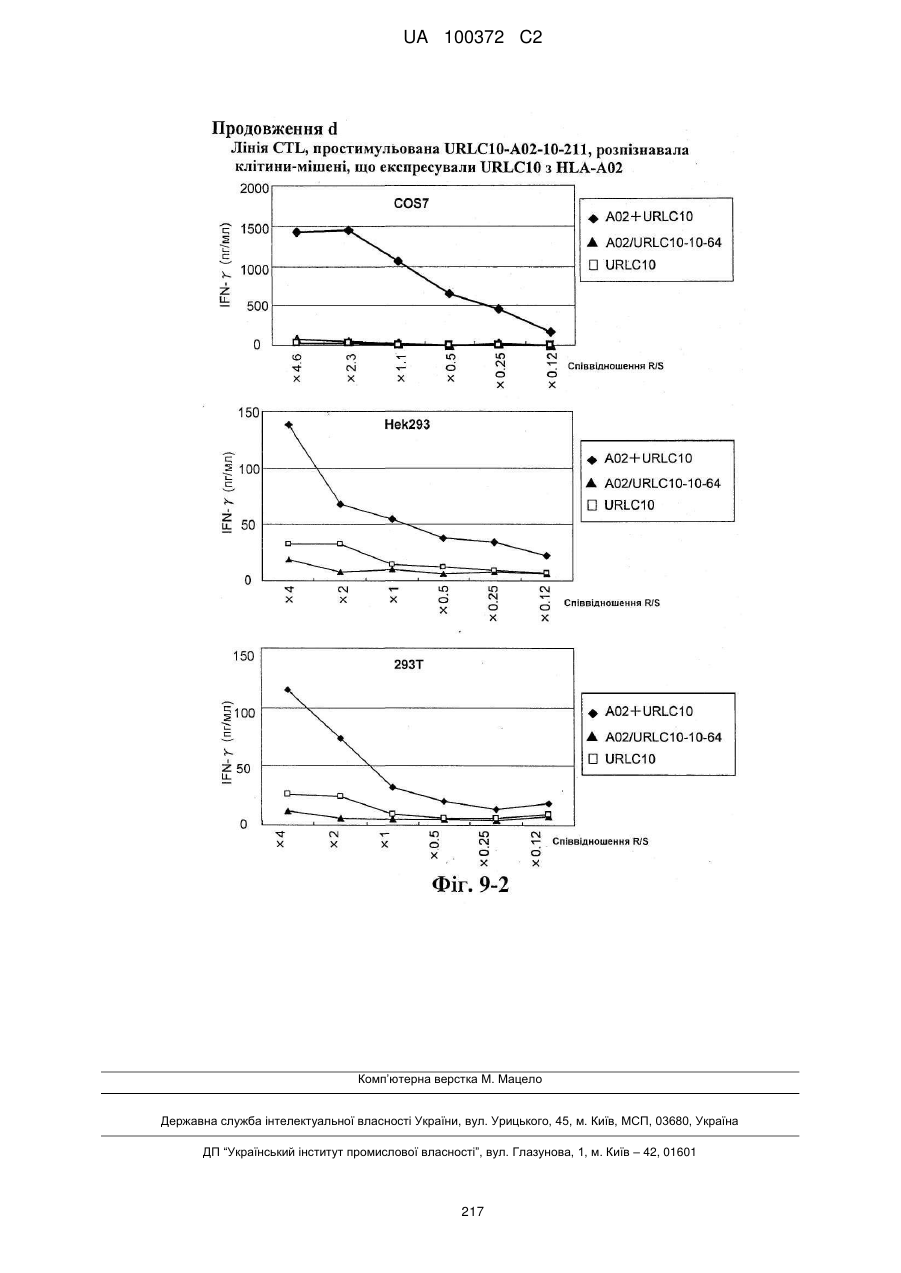
Виділений пептид, здатний індукувати цитотоксичні т-клітини, та його застосування як вакцини
Формула / Реферат
1. Виділений пептид, здатний індукувати цитотоксичні Т-клітини, де пептид складається з менше ніж приблизно 15 амінокислот та містить амінокислотну послідовність SEQ ID NO: 194.
2. Пептид, який складається з менше ніж приблизно 15 амінокислот та здатний індукувати цитотоксичні Т-клітини, де згаданий пептид містить амінокислотну послідовність SEQ ID NO: 194, де 1 або 2 амінокислоти заміщені, видалені або додані.
3. Пептид за п. 1, де згаданий пептид складається з амінокислотної послідовності SEQ ID NO: 194.
4. Пептид за п. 2, де згаданий пептид складається з амінокислотної послідовності SEQ ID NO: 194, де 1 або 2 амінокислоти заміщені, видалені або додані.
5. Пептид за п. 2 або 4, де друга амінокислота від N-закінчення - це фенілаланін, тирозин, метіонін або триптофан.
6. Пептид за будь-яким з пп. 2, 4 та 5, де С-кінцева амінокислота - це фенілаланін, лейцин, ізолейцин, триптофан або метіонін.
7. Фармацевтична композиція для лікування або профілактики хвороби, пов’язаної з надмірною експресією гена за SEQ ID NO: 11, при цьому згадана композиція містить принаймні один пептид у відповідності з будь-яким з пп. 1-6 або полінуклеотид, що кодує цей пептид.
8. Фармацевтична композиція за п. 7, де хвороба, що пов’язана з надмірною експресією гена за SEQ ID NO: 11, являє собою рак.
9. Фармацевтична композиція за п. 8, де рак вибраний з групи, що складається з раку сечового міхура, раку молочної залози, раку шийки матки, холангіокарциноми, хронічного мієлоїдного лейкозу (CML), колоректального раку, ендометріозу, раку стравоходу, раку шлунка, раку шлунка дифузного типу, раку печінки, недрібноклітинного раку легенів (NSCLC), лімфоми, остеосаркоми, раку яєчника, раку підшлункової залози, раку простати, раку нирки, дрібноклітинного раку легенів (SCLC), пухлини м’якої тканини та раку яєчка.
10. Екзосома, яка презентує на своїй поверхні комплекс, що включає пептид у відповідності з будь-яким з пп. 1-6 та антиген HLA.
11. Екзосома за п. 10, де антиген HLA - це HLA-A24.
12. Екзосома за п. 11, де антиген HLA - це HLA-A2402.
13. Спосіб індукування антигенпрезентуючої клітини, що має високу здатність індукувати цитотоксичні Т-клітини, який включає етап контактування антигенпрезентуючої клітини з пептидом у відповідності з будь-яким з пп. 1-6.
14. Спосіб індукування цитотоксичних Т-клітин шляхом контактування Т-клітини з пептидом у відповідності з будь-яким з пп. 1-6.
15. Спосіб індукування антигенпрезентуючої клітини, що має високу здатність індукувати цитотоксичні Т-клітини, при цьому згаданий спосіб включає етап перенесення гена, який включає полінуклеотид, що кодує пептид у відповідності з будь-яким з пп. 1-6, до антигенпрезентуючої клітини.
16. Спосіб індукування цитотоксичних Т-клітин, який включає етапи:
(і) контактування антигенпрезентуючих клітин з пептидом у відповідності з будь яким з пп. 1-6, та
(іі) змішування антигенпрезентуючої клітини етапу (і) з Т-клітиною CD8+ та їх сумісне культивування.
17. Виділена цитотоксична Т-клітина, яка індукована за способом у відповідності з п. 14 або 16 або яка перетворена нуклеїновими кислотами, що кодують поліпептиди субодиниці TCR, які мають здатність зв’язуватися з пептидом у відповідності з будь-яким з пп. 1-6 у контексті HLA-A24.
18. Антигенпрезентуюча клітина, яка містить комплекс, утворений між антигеном HLA та пептидом у відповідності з будь-яким з пп. 1-6.
19. Антигенпрезентуюча клітина, індукована за способом у відповідності з п. 13 або п. 15.
20. Вакцина для інгібування проліферації клітини, що експресує ген за SEQ ID NO: 11, де вакцина містить принаймні один пептид у відповідності з будь-яким з пп. 1-6 як активний інгредієнт.
21. Вакцина за п. 20, де клітина, що експресує ген за SEQ ID NO: 11, являє собою ракову клітину.
22. Вакцина за п. 21, де рак вибраний з групи, що складається з раку сечового міхура, раку молочної залози, раку шийки матки, холангіокарциноми, хронічного мієлоїдного лейкозу (CML), колоректального раку, ендометріозу, раку стравоходу, раку шлунка, раку шлунка дифузного типу, раку печінки, недрібноклітинного раку легенів (NSCLC), лімфоми, остеосаркоми, раку яєчника, раку підшлункової залози, раку простати, раку нирки, дрібноклітинного раку легенів (SCLC), пухлини м’якої тканини та раку яєчка.
23. Вакцина за п. 22, яку виготовлено за рецептурою для введення суб’єктові, антиген HLA якого - це HLA-A24.
24. Спосіб лікування або профілактики хвороби, пов’язаної з надмірною експресією гена за SEQ ID NO: 11, у суб’єкта, який включає введення згаданому суб’єктові вакцини, яка містить пептид у відповідності з будь-яким з пп. 1-6, його імунологічно активний фрагмент або полінуклеотид, що кодує згаданий пептид або імунологічно активний фрагмент.
25. Спосіб за п. 24, де хвороба, що пов’язана з надмірною експресією гена за SEQ ID NO: 11, являє собою рак.
26. Спосіб за п. 25, де рак вибраний з групи, що складається з раку сечового міхура, раку молочної залози, раку шийки матки, холангіокарциноми, хронічного мієлоїдного лейкозу (CML), колоректального раку, ендометріозу, раку стравоходу, раку шлунка, раку шлунка дифузного типу, раку печінки, недрібноклітинного раку легенів (NSCLC), лімфоми, остеосаркоми, раку яєчника, раку підшлункової залози, раку простати, раку нирки, дрібноклітинного раку легенів (SCLC), пухлини м’якої тканини та раку яєчка.
27. Спосіб скринінгу пептиду, у якому 1, 2 або декілька амінокислот заміщені, де згаданий пептид включає амінокислотну послідовність за SEQ ID NO: 194, при цьому згаданий спосіб включає етапи:
(а) підтвердження того, що не існує жодної суттєвої гомології послідовностей з усією послідовністю з 1, 2 або більше амінокислотними заміщеннями;
(b) вимірювання здатності пептиду-кандидата, що містить заміщення, індукувати CTL, та
(с) вибір пептиду, здатність якого індукувати CTL є такою ж самою або вищою порівняно з оригінальним пептидом.
Текст
Реферат: Винахід належить до виділеного пептиду, здатного індукувати цитотоксичні Т-клітини, фармацевтичної композиції, що його містить, ексзосоми, яка експресує на своїй поверхні комплекс, що включає даний пептид, способу індукування антигенпрезентуючої клітини. Винахід також належить до способу індукування цитотоксичних Т-клітин, вакцини для інгібування проліферації клітин, способу скринінгу пептиду тощо. UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Для цієї заявки заявлено пріоритет попередньої заявки США за № 60/902,949, поданої 21 лютого 2007 року, опис якої у повному обсязі включено в даний опис винаходу шляхом посилання для усіх цілей. Цей винахід стосується галузі біологічної науки, більш специфічно - галузі лікування раку. Зокрема, цей винахід стосується новітніх імуногенних пептидів, що є надзвичайно ефективними як протиракові вакцини, та ліків для лікування та профілактики пухлин, які містять такі пептиди. Попередній рівень техніки + Було продемонстровано, що CD8 цитотоксичні Т-лімфоцити (CTL) розпізнають епітопні пептиди, що походять від пухлина-пов'язаних антигенів (ТАА), присутніх на молекулах класу І головного комплексу гістосумісності (МНС), що в подальшому лізують пухлинні клітини. З моменту відкриття родини MAGE як першого прикладу ТАА багато інших ТАА відкрили, застосовуючи імунологічні підходи (Boon T. (1993) Int J Cancer 54: 177-80.; Boon T. et al., (1996) J Exp Med 183: 725-9.; van der Bruggen P et al., (1991) Science 254: 1643-7.; Brichard V et al., (1993) J Exp Med 178: 489-95.; Kawakami Y et al., (1994) J Exp Med 180: 347-52.). Деякі з них зараз знаходяться у клінічній розробці як мішені імунотерапії. ТАА, відкриті на цей час, включають MAGE (van der Bruggen P et al., (1991) Science 254: 1643-7.), gp100 (Kawakami Y et al., (1994) J Exp Med 180: 347-52.), SART (Shichijo S et al., (1998) J Exp Med 187:277-88.) та NY-ESO-1 (Chen Y.T. et al., (1997) Proc. Natl. Acd. Sci. USA, 94: 1914-8.). З іншого боку, було продемонстровано, що певні генні продукти, які демонстрували деяку специфічну надмірну експресію у пухлинних клітинах, розпізнаються як мішені для індукування клітинних імунних реакцій. Такі генні продукти включають p53 (Umano Y et al., (2001) Br J Cancer, 84:1052-7.), HER2/neu (Tanaka H et al., (2001) Br J Cancer, 84: 94-9.), CEA (Nukaya I et al., (1999) Int. J. Cancer 80, 92-7.) та їм подібні. Незважаючи на суттєвий прогрес у базових та клінічних дослідженнях стосовно TAA (Rosenberg SA et al., (1998) Nature Med, 4: 321-7.; Mukherji B. et al., (1995) Proc Natl Acad Sci USA, 92: 8078-82.: Hu X et al., (1996) Cancer Res, 56: 2479-83.), лише дуже обмежена кількість ТАА-кандидатів, придатних для лікування раку, є доступною у цей час. ТАА, які надмірно експресуються у ракових клітинах та експресія яких обмежується раковими клітинами, будуть перспективними кандидатами як імунотерапевтичні мішені. Як HLA-A24, так і HLA-A0201 є звичайними алелями HLA серед японського та європейського населення (Date Y et al., (1996) Tissue Antigens 47: 93-101.; Kondo A et al., (1995) J Immunol 155: 4307-12.; Kubo RT et al., (1994) J Immunol 152: 3913-24.; Imanishi et al., Proceeding of the eleventh International Histocompatibility Workshop and Conference Oxford University Press, Oxford, 1065 (1992); Williams F et al., (1997) Tissue Antigen 49: 129-33.). Отже, антигенні пептиди раку, представлені цими алелями HLA, можуть стати особливо корисними при лікуванні раку серед пацієнтів японського та європейського походження. Крім того, відомо, що індукція CTL низької спорідненості in vitro зазвичай є наслідком впливу високих концентрацій пептидів, що генерують високий рівень специфічних комплексів пептид/МНС на клітинах, що презентують антиген (АРС), які будуть ефективно активувати ці CTL (Alexander-Miller et al., (1996) Proc Natl Acad Sci USA 93: 4102-7.). Нещодавно повідомлялося, що застосовуючи алгоритми (Journal of Immunological Methods, (1995), Vol.185, pp.181-190, J. Immunol., (1994), Vol.152, pp.163-175, protein science, (2000), Vol.9, pp.1838-1846), можна було очікувати одержання пептидної послідовності, що зв'язується з молекулами HLA класу І. Проте, важко стверджувати, що очікуваний епітопний пептид можна порізати до певного розміру та експресувати на поверхні клітини-мішені за допомогою молекули HLA, та що він буде розпізнаватися CTL. Крім того, алгоритм, наприклад, BIMAS (http://bimas.dcrt.nih.gov/cgi-bin/molbio/ken_parker_comboform) (Parker KC, et al., (1994) J Immunol.;152(1):163-75.; Kuzushima K, et al., (2001) Blood.;98(6):1872-81.)) може запропонувати пептид, що зв'язується з молекулою HLA, проте запропонований пептид не є настільки жорстким (Bachinsky MM, et. al., Cancer Immun. 2005 Mar 22;5:6.). Отже, скринінг ТАА все ще залишає багато проблем та труднощів. Нещодавні розробки у технологіях кДНК-мікроматриць дозволили побудувати повні профілі генної експресії у ракових клітинах порівняно з нормальними клітинами (Okabe, H. et al., (2001) Cancer Res., 61, 2129-37.; Lin YM. et al., (2002) Oncogene, 21;4120-8.; Hasegawa S. et al., (2002) Cancer Res 62:7012-7.). Цей підхід дозволяє більш досконало зрозуміти складну природу ракових клітин та механізми канцерогенезу та спрощує ідентифікацію генів, експресія яких дерегульована у пухлинах (Bienz M. et al., (2000) Cell 103, 311-20.). Серед транскриптів, які визначаються як регульовані у раку на підвищення їх вмісту, нещодавно були відкриті CDH3 (GenBank Accession No. NM_001793; SEQ ID Nos.1, 2), EPHA4 (GenBank Accession No. L36645; SEQ ID Nos.3, 4), ECT2 (GenBank Accession No. AY376439; SEQ ID Nos.5, 6), HIG2 (GenBank 1 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Accession No. NM_013332; SEQ ID Nos.7, 8) INHBB (GenBank Accession No. NM_002193; SEQ ID Nos.9, 10), KIF20A (GenBank Accession No. NM_005733; SEQ ID Nos.11, 12), KNTC2 (GenBank Accession No. AF017790; SEQ ID Nos.13, 14), TTK (GenBank Accession No. NM_003318; SEQ ID Nos.15, 16) та URLC10 (GenBank Accession No. NM_017527; SEQ ID Nos.17, 18). Загальний вміст цих посилань включено шляхом посилання у цей опис винаходу. Ці гени представляють особливий інтерес для авторів цього винаходу, тому що вони специфічно регулюються на підвищення їх вмісту у пухлинних клітинах різних ракових тканин проаналізованих випадків (дивись далі). Отже, імуногенні пептиди, що походять від CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10, можна застосовувати для селективного вбивства пухлинних клітин, що експресують такі антигени. Цей винахід спрямовано на ці та інші потреби. Оскільки цитотоксичні ліки, такі як M-VAC, часто стають причиною серйозних побічних реакцій, зрозуміло, що обміркований вибір новітніх молекул-мішеней на основі добре охарактеризованих механізмів дії буде дуже корисним для розробки ефективних протиракових ліків, що мають мінімізований ризик побічних ефектів. З цією метою аналізи профілю експресії попередньо здійснили на різних видах раку та здоровій тканині людини. Внаслідок таких досліджень відкрили численні гени, які специфічно надмірно експресуються у раку (Lin YM, et al., Oncogene. 2002 Jun 13;21:4120-8.; Kitahara O, et al., Cancer Res. 2001 May 1;61:3544-9.; Suzuki C, et al., Cancer Res. 2003 Nov 1;63:7038-41.; Ashida S, Cancer Res. 2004 Sep 1;64:596372.; Ochi K, et al., Int J Oncol. 2004 Mar;24(3):647-55.; Kaneta Y, et al., Int J Oncol. 2003 Sep;23:681-91.; Obama K, Hepatology. 2005 Jun;41:1339-48.; Kato T, et al., Cancer Res. 2005 Jul 1;65:5638-46.; Kitahara O, et al., Neoplasia. 2002 Jul-Aug;4:295-303.; Saito-Hisaminato A et al., DNA Res 2002, 9: 35-45.). Приклади таких генів, які, як визначається, надмірно експресуються у різних видах раку, включають, проте не обмежуються тільки ними, CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10. Попередньо було визначено, що CDH3 надмірно експресується у раку сечового міхура, раку шийки матки, холангіокарциномі, колоректальному раку, ендометріозі, раку шлунка, раку шлунка дифузного типу, недрібноклітинному раку легенів (NSCLC), раку підшлункової залози, пухлині м'якої тканини та пухлині яєчка. ЕРНА4 ідентифікували у раку сечового міхура, раку шийки матки, холангіокарциномі, ендометріозі, раку шлунка дифузного типу, раку яєчника, раку підшлункової залози, раку простати та у пухлині м'якої тканини. ЕСТ2 ідентифікували у раку сечового міхура, раку молочної залози, раку шийки матки, холангіокарциномі, хронічному мієлоїдному лейкозі (CML), колоректальному раку, раку стравоходу, недрібноклітинному раку легенів (NSCLC), лімфомі, раку простати, раку нирки та дрібноклітинному раку легенів (SCLC). HIG2 ідентифікували у раку нирки та дрібноклітинному раку легенів (SCLC). INHBB ідентифікували у холангіокарциномі, раку стравоходу, NSCLC, раку нирки, дрібноклітинному раку легенів (SCLC) та пухлині м'якої тканини. KIF20A ідентифікували у раку сечового міхура, раку молочної залози, холангіокарциномі, раку стравоходу, недрібноклітинному раку легенів (NSCLC), раку підшлункової залози, раку простати, раку нирки та дрібноклітинному раку легенів (SCLC). KNTC2 ідентифікували у раку сечового міхура, раку молочної залози, раку шийки матки, холангіокарциномі, хронічному мієлоїдному лейкозі (CML), колоректальному раку, раку стравоходу, недрібноклітинному раку легенів (NSCLC), лімфомі, остеосаркомі, раку яєчника, раку підшлункової залози, раку простати, раку нирки, дрібноклітинному раку легенів (SCLC) та пухлині м'якої тканини. ТТК ідентифікували у раку сечового міхура, раку молочної залози, раку шийки матки, холангіокарциномі, хронічному мієлоїдному лейкозі (CML), колоректальному раку, раку стравоходу, раку печінки, недрібноклітинному раку легенів (NSCLC), лімфомі, остеосаркомі, раку простати, дрібноклітинному раку легенів (SCLC) та пухлині м'якої тканини. URLC10 ідентифікували у раку сечового міхура, раку шийки матки, холангіокарциномі, раку стравоходу, раку шлунка, недрібноклітинному раку легенів (NSCLC), остеосаркомі, раку підшлункової залози та дрібноклітинному раку легенів (SCLC). Суть винаходу Цей винахід частково базується на відкритті мішеней імунотерапії, які можна застосовувати. Оскільки ТАА часто не мають імуногенності, відкриття відповідних мішеней є надзвичайно важливим. Як вказано вище, визначили, що CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10 регулюються на підвищення їх вмісту при різних видах раку. Більш детально, ці гени ідентифікували, застосовуючи спосіб визначення профілю генної експресії за допомогою мікроматриці кДНК широкого геному. Як вказано вище, було продемонстровано, що експресія CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10 специфічно регулюється на підвищення їх вмісту у різних пухлинних клітинах: від клітин раку підшлункової залози до клітин раку нирки. Як показано у Таблиці 1, експресія CDH3 є вагомо підвищеною у 26 з 34 випадків раку сечового міхура, у 17 з 19 випадків раку шийки матки, в усіх 19 випадках 2 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 холангіокарциноми, у 30 з 34 випадків колоректального раку, у 20 з 21 випадку ендометріозу, у 13 з 20 випадків раку шлунку, у 7 з 8 випадків раку шлунка дифузного типу, у 36 з 37 випадків NSCLC, в усіх 16 випадках раку підшлункової залози, в усіх з 21 випадку пухлини м'якої тканини та в усіх з 10 випадків пухлини яєчка. Таблиця 1 крім того демонструє, що: експресія ЕРН4 є вагомо підвищеною у 14 з 34 випадків раку сечового міхура, у 8 з 14 випадків раку шийки матки, у 10 з 25 випадків холангіокарциноми, у 5 з 15 випадків ендометріозу, у 5 з 8 випадків раку шлунка дифузного типу, в усіх 5 випадках раку яєчника, в усіх 14 випадках раку підшлункової залози, у 20 з 51 випадку раку простати та у 14 з 23 випадків пухлини м'якої тканини; експресія ЕСТ2 є вагомо підвищеною у 17 з 19 випадків раку сечового міхура, у 5 з 12 випадків раку молочної залози, в усіх 14 випадках раку шийки матки, в усіх 13 випадках холангіокарциноми, в усіх 5 випадках хронічного мієлоїдного лейкозу, у 7 з 8 випадків колоректального раку, у 12 з 16 випадків раку стравоходу, у 6 з 16 випадків NSCLC, у 8 з 10 випадків лімфоми, в 1 з 1 випадку раку підшлункової залози, у 10 з 13 випадків раку простати, у 3 з 16 випадків раку нирки та у 12 з 13 випадків SCLC; експресія HIG2 є вагомо підвищеною у 19 з 20 випадків раку нирки та у 7 з 9 випадків пухлини м'якої тканини; експресія INHBB є вагомо підвищеною у 10 з 21 випадку холангіокарциноми, в усіх 12 випадках раку стравоходу, у 10 з 13 випадків NSCLC, у 22 з 24 випадків раку нирки, у 8 з 14 випадків SCLC та у 45 з 49 випадків пухлини м'якої тканини; експресія KIF20A є вагомо підвищеною в усіх з 31 випадку раку сечового міхура, у 38 з 61 випадку раку молочної залози, у 10 з 11 випадків холангіокарциноми, у 7 з 19 випадків раку стравоходу, у 21 з 22 випадків NSCLC, в усіх 6 випадках раку яєчника, у 17 з 36 випадків раку простати, у 6 з 11 випадків раку нирки та в усіх 15 випадках SCLC; експресія KNTC2 є вагомо підвищеною у 30 з 32 випадків раку сечового міхура, у 47 з 56 випадків раку молочної залози, в усіх 10 випадках раку шийки матки, у 16 з 22 випадків холангіокарциноми, у 17 з 37 випадків хронічного мієлоїдного лейкозу, у 3 з 10 випадків колоректального раку, в 11 з 46 випадків раку стравоходу, у 15 з 19 випадків NSCLC, у 7 з 8 випадків лімфоми, у 20 з 24 випадків остеосаркоми, у 3 з 5 випадків раку яєчника, в усіх 2 випадках раку підшлункової залози, у 15 з 37 випадків раку простати, у 14 з 19 випадків раку нирки, в усіх 15 випадках SCLC та у 40 з 59 випадків пухлини м'якої тканини; експресія ТТК є вагомо підвищеною в усіх 27 випадках раку сечового міхура, у 25 з 30 випадків раку молочної залози, у 15 з 16 випадків раку шийки матки, в усіх 10 випадках холангіокарциноми, у 5 з 7 випадків хронічного мієлоїдного лейкозу, у 6 з 10 випадків колоректального раку, у 24 з 44 випадків раку стравоходу, у 8 з 15 випадків раку печінки, в усіх 12 випадках NSCLC, в усіх 6 випадках лімфоми, у 13 з 16 випадків остеобластоми, у 12 з 17 випадків раку простати, в усіх 15 випадках SCLC та у 16 з 33 випадків пухлини м'якої тканини; експресія URLC10 є вагомо підвищеною в усіх 29 випадках раку сечового міхура, у 15 з 16 випадків раку шийки матки, в усіх 7 випадках холангіокарциноми, у 7 з 19 випадків раку стравоходу, в усіх 3 випадках раку шлунка, у 24 з 27 випадків NSCLC, у 15 з 19 випадків остеосаркоми, у 4 з 5 випадків раку підшлункової залози, у 33 з 43 випадків пухлини м'якої тканини. Цей винахід базується, принаймні частково, на ідентифікації специфічних епітопних пептидів генних продуктів цих генів (CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10), яким притаманна спроможність індукувати цитотоксичні Т-лімфоцити (CTL), специфічні до відповідних молекул. Як докладно обговорюється далі, мононуклеари периферійної крові (РВМС) здорового донора стимулювали, застосовуючи пептиди-кандидати, які зв'язуються з HLA-A*2402 або HLA-A*0201 та які походять від CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK або URLC10. Клонам та/або лініям CTL потім надали специфічної цитотоксичності проти HLA-A24 або HLA-A2-позитивних клітин-мішеней, імпульсно мічених кожним пептидомкандидатом. Ці результати демонструють, що ці пептиди - це HLA-A24 або HLA-A2-обмежені епітопні пептиди, що можуть індукувати сильні та специфічні імунні реакції проти клітин, що експресують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK або URLC10. Отже, цим винаходом пропонуються способи лікування або профілактики хвороби, пов'язаної з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK або URLC10, наприклад, раку. Такі способи передбачають етап введення суб'єктові, якому це потрібно, поліпептидів CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10 винаходу. Внаслідок введення такого (таких) пептиду (пептидів) відбувається індукція протипухлинного імунітету, що індукується введенням цих поліпептидів. Отже, цим винаходом 3 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 пропонуються способи індукування протипухлинного імунітету у суб'єкта, при цьому такі способи передбачають етап введення суб'єктові поліпептидів CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, а також фармацевтичні композиції для лікування або профілактики хвороби, пов'язаної з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку, при цьому фармацевтичні композиції містять поліпептиди CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10. Приклади таких видів раку включають, проте не обмежуються тільки ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунка, рак шлунка дифузного типу, рак печінки, NSCLC, лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, SCLC, пухлину м'якої тканини та рак яєчка. Цим винаходом, крім того, пропонуються способи профілактики пост-хірургічного рецидиву хвороби, згаданої вище. Стосовно специфічних цілей та завдань, згаданих вище, фахівці у галузі зрозуміють, що один або більше аспектів цього винаходу можуть виконати певні завдання, проте один або більше інших аспектів можуть виконати інші завдання. Кожне завдання може не застосовувати у рівній мірі, в усіх його відношеннях, кожен аспект цього винаходу. Таким чином, завдання, згадані у цьому описі, можна розглядати альтернативним чином відповідно до будь-якого одного аспекту цього винаходу. Додаткові завдання та ознаки винаходу стануть більш повно зрозумілими після прочитання наступного докладного опису у зв'язку з фігурами та прикладами, що його супроводжують. Проте, слід розуміти, що вищезгадана суть винаходу та наступний докладний опис є переважними варіантами здійснення винаходу, та вони не є обмежувальними для винаходу або інших альтернативних варіантів здійснення цього винаходу. Зокрема, незважаючи на те, що винахід описано у цьому описі з посиланням на ряд специфічних варіантів здійснення, слід відзначити, що опис ілюструє винахід, а не обмежує його. Різні модифікації та варіанти застосування можуть виникнути у фахівців у галузі, при цьому вони не відхиляються від духу та обсягу винаходу, описаного у формулі винаходу, що додається. Подібним чином інші задачі, ознаки, користь та переваги цього винаходу будуть очевидними з суті цього винаходу та певних варіантів здійснення, описаних далі, та вони будуть легко зрозумілими для фахівців у галузі. Такі задачі, ознаки, користь та переваги стануть очевидними з опису у зв'язку з супроводжувальними прикладами, даними, фігурами та усіма розумними підсумками, що виходять з нього, самостійно або з урахуванням посилань, включених до цього опису. Стислий опис ілюстративного матеріалу Різні аспекти та варіанти застосування цього винаходу стануть зрозумілими для фахівців у галузі після розгляду стислого опису фігур та докладного опису цього винаходу та його переважних варіантів здійснення, які слідують. Фіг. 1-1. Фігура 1 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, показують, що CDH3-A24-10-332 (SEQ ID NO: 34), CDH3-A24-10-470 (SEQ ID NO: 358), CDH3A24-9-513 (SEQ ID NO: 19), CDH3-A24-9-406 (SEQ ID NO: 22), CDH3-A24-10-807 (SEQ ID NO: 30) та CDH3-A24-10-655 (SEQ ID NO: 344) демонструють сильне виробництво IFN-гама. "a" демонструє приклад негативних пептидів, у яких не можна виявити CTL-індукуючу спроможність, незважаючи на можливу зв'язувальну активність з HLA-A*2402. "b" демонструє CTL-індукуючу спроможність CDH3-A24-10-332 (SEQ ID NO: 34). CDH3-A24-10-332 (SEQ ID NO: 34) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама (ELISPOTA), а лінія CTL, яку було отримано з позитивної комірки #4, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "с" демонструє CTL-індукуючу спроможність CDH3A24-10-470 (SEQ ID NO: 358). CDH3-A24-10-470 (SEQ ID NO: 358) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а лінія CTL, яку було отримано з позитивної комірки #4, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "d" демонструє CTL-індукуючу спроможність CDH3-A24-9-513 (SEQ ID NO: 19). CDH3A24-9-513 (SEQ ID NO: 19) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама. Комірка #6, зображена як комірки у рамці на панелі зліва, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Крім того, лінія CTL, яку було отримано з позитивної комірки #5, зображеної як комірки у рамці на середній панелі, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "е" демонструє CTL-індукуючу спроможність CDH3-A24-9-406 (SEQ ID NO: 22). CDH3-A24-9-406 (SEQ ID NO: 22) демонстрував 4 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFNгама, а лінія CTL, яку було отримано з позитивної комірки #2, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Фіг. 1-2. Фігура 1 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що CDH3-A24-10-332 (SEQ ID NO: 34), CDH3-A24-10-470 (SEQ ID NO: 358), CDH3-A24-9-513 (SEQ ID NO: 19), CDH3-A24-9-406 (SEQ ID NO: 22), CDH3-A24-10-807 (SEQ ID NO: 30) та CDH3-A24-10-655 (SEQ ID NO: 344) демонструють сильне виробництво IFN-гама. "f" демонструє CTL-індукуючу спроможність CDH3-A24-10-807 (SEQ ID NO: 30). CDH3-A24-10-807 (SEQ ID NO: 30) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а лінію та клон CTL отримали з позитивної комірки #5, зображеної як комірки у рамці. Отриманий клон CTL, створений проти цього пептиду, демонстрував специфічну CTL-активність проти COS7, трансфектованих як геном CDH3 повної довжини, так і молекулою HLA-A24 (нижній правий графік). З іншого боку, як негативні контрольні приготували COS7, трансфектовані CDH3 повної довжини, проте не трансфектовані HLA-A24, та COS7, трансфектовані HLA-A24, проте не трансфектовані CDH3 повної довжини. Клон CTL демонстрував високу специфічну CTL-активність проти COS7, трансфектованих як CDH3, так і HLA-A24. "g" демонструє CTL-індукуючу спроможність CDH3-A24-10-655 (SEQ ID NO: 344). CDH3-A24-10-655 (SEQ ID NO: 344) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а лінію та клон CTL отримали з позитивної комірки #1, зображеної як комірки у рамці. Отриманий клон CTL, створений проти цього пептиду, демонстрував специфічну CTL-активність проти COS7, трансфектованих як геном CDH3 повної довжини, так і молекулою HLA-A24 (нижній правий графік). З іншого боку, як негативні контрольні приготували COS7, трансфектовані CDH3 повної довжини, проте не трансфектовані HLA-A24, та COS7, трансфектовані HLA-A24, проте не трансфектовані CDH3 повної довжини. Клон CTL демонстрував високу специфічну CTLактивність проти COS7, трансфектованих як CDH3, так і HLA-A24. Фіг. 2. Фігура 2 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що Epha4-A24-9-453 (SEQ ID NO: 41), Epha4-A24-9-5 (SEQ ID NO: 44), Epha4A24-9-420 (SEQ ID NO: 48), Epha4-A24-9-869 (SEQ ID NO: 46), Epha4-A24-10-24 (SEQ ID NO: 78), Epha4-A02-9-501 (SEQ ID NO: 376) та Epha4-A02-9-165 (SEQ ID NO: 379) демонструють сильне виробництво IFN-гама. "a" демонструє приклад негативних пептидів, у яких не можна виявити CTL-індукуючу спроможність, незважаючи на можливу зв'язувальну активність з HLA. "b" демонструє CTL-індукуючу спроможність Epha4-A24-9-453 (SEQ ID NO: 41). Epha4-A24-9-453 (SEQ ID NO: 41) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а лінія CTL, яку було отримано з позитивної комірки #3, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "с" демонструє CTL-індукуючу спроможність Epha4A24-9-5 (SEQ ID NO: 44). Epha4-A24-9-5 (SEQ ID NO: 44) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а лінія CTL, яку було отримано з позитивної комірки #2, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "d" демонструє CTL-індукуючу спроможність Epha4-A24-9-420 (SEQ ID NO: 48). Epha4-A24-9-420 (SEQ ID NO: 48) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама. Комірка #6, зображена як комірки у рамці на верхній панелі, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Крім того, лінія CTL, яку було отримано з позитивної комірки #6, зображеної як комірки у рамці на середній панелі, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "е" демонструє CTL-індукуючу спроможність Epha4-A24-9-869(SEQ ID NO: 46). Epha4-A24-9-869 (SEQ ID NO: 46) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а лінія CTL, яку було отримано з позитивної комірки #5, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "f" демонструє CTL-індукуючу спроможність Epha4-A24-10-24 (SEQ ID NO: 78). Epha4-A24-10-24 (SEQ ID NO: 78) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а лінія CTL, яку було отримано з позитивної комірки #4, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "g" демонструє CTLіндукуючу спроможність Epha4-A02-9-501 (SEQ ID NO: 376). Epha4-A02-9-501 (SEQ ID NO: 376) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним 5 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 спот-аналізом IFN-гама, а лінію CTL та клон отримали з позитивної комірки #8, зображеної як комірки у рамці. Цитотоксичну активність отриманої CTL-лінії проти клітин-мішеней, імпульсно мічених цим пептидом, вимірювали за допомогою аналізу вивільнення хрому (CRA) (нижній графік), та CTL-лінія мала дуже сильну специфічну цитотоксичну активність проти клітинмішеней, імпульсно мічених цими пептидами. "h" демонструє CTL-індукуючу спроможність Epha4-A02-9-165 (SEQ ID NO: 379). Epha4-A02-9-165 (SEQ ID NO: 379) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а лінію CTL отримали з позитивної комірки #3, зображеної як комірки у рамці. Цитотоксичну активність отриманої CTL-лінії проти клітин-мішеней, імпульсно мічених пептидом, вимірювали за допомогою аналізу вивільнення хрому (CRA) (правий графік), та CTL-лінія мала дуже сильну специфічну цитотоксичну активність проти клітин-мішеней, імпульсно мічених цими пептидами. Фіг. 3. Фігура 3 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що ECT2-A24-9-515 (SEQ ID NO: 80), ECT2-A24-10-40 (SEQ ID NO: 100) та ECT2A24-10-101 (SEQ ID NO: 101) демонструють сильне виробництво IFN-гама. "a" демонструє приклад негативних пептидів, у яких не можна виявити CTL-індукуючу спроможність, незважаючи на можливу зв'язувальну активність з HLA. "b" демонструє CTL-індукуючу спроможність ECT2-A24-9-515 (SEQ ID NO: 80). ECT2-A24-9-515 (SEQ ID NO: 80) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFNгама. Комірки #5 та #7, зображені як комірки у рамці на лівій панелі, демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Крім того, CTL-лінія, яку отримали з позитивної комірки #7, зображеної як комірки у рамці на другій панелі, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Цитотоксичну активність CTL-лінії проти ракової клітинної лінії, ТЕ6, що ендогенно експресує ЕСТ2 та HLA-A24, вимірювали шляхом аналізу вивільнення хрому (CRA), та CTL-клон мав дуже сильну цитотоксичну активність проти ТЕ6. З іншого боку, ефекторні клітини не демонстрували цитотоксичну активність CTL-лінії проти ракової клітинної лінії, ТЕ5, що експресує лише ЕСТ2, не виявили. "c" демонструє CTL-індукуючу спроможність ECT2-A24-10-40 (SEQ ID NO: 100). ECT2-A24-10-40 (SEQ ID NO: 100) демонстрував сильне виробництво IFNгама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінію та клон отримали з позитивної комірки #2, зображеної як комірки у рамці. Отриманий CTL-клон, створений проти цього пептиду, демонстрував специфічну CTL-активність проти COS7, трансфектованих як геном ЕСТ2 повної довжини, так і молекулою HLA-A24. З іншого боку, як негативні контрольні приготували COS7, трансфектовані ЕСТ2 повної довжини, проте не трансфектовані HLA-A24, COS7, трансфектовані HLA-A24 та геном URLC10, як замісником ЕСТ2 повної довжини, та COS7, трансфектовані HLA-A24 та імпульсно мічені ECT2-10-101. CTL-клон демонстрував високу специфічну CTL-активність проти COS7, трансфектованих як ЕСТ2, так і HLA-A24. "d" демонструє CTL-індукуючу спроможність ECT2-A24-10-101 (SEQ ID NO: 101). ECT2-A24-10-101 (SEQ ID NO: 101) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінію отримали з позитивної комірки #1, зображеної як комірки у рамці. Отримана CTL-лінія, створена проти цього пептиду, демонструвала специфічну CTL-активність проти COS7, трансфектованих як геном ЕСТ2 повної довжини, так і молекулою HLA-A24. З іншого боку, як негативні контрольні приготували COS7, трансфектовані ЕСТ2 повної довжини, проте не трансфектовані HLA-A24, COS7, трансфектовані HLA-A24 та геном URLC10, як замісником ЕСТ2 повної довжини, та COS7, трансфектовані HLA-A24 та імпульсно мічені ECT2-10-40. CTL-клон демонстрував високу специфічну CTL-активність проти COS7, трансфектованих як ЕСТ2, так і HLA-A24. Фіг. 4-1. Фігура 4 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що HIG2-A24-9-19 (SEQ ID NO: 110), HIG2-A24-9-22 (SEQ ID NO: 111), HIG2-A249-8 (SEQ ID NO: 387), HIG2-A24-10-7 (SEQ ID NO: 112), HIG2-A24-10-18 (SEQ ID NO: 394), HIG2A02-9-15 (SEQ ID NO: 116), HIG2-A02-9-4 (SEQ ID NO: 117) та HIG2-A02-10-8 (SEQ ID NO: 121) демонструють сильне виробництво IFN-гама. "a" демонструє приклад негативних пептидів, у яких неможливо виявити CTL-індукуючу спроможність, незважаючи на можливу зв'язувальну активність з HLA. "b" демонструє CTL-індукуючу спроможність HIG2-A24-9-19 (SEQ ID NO: 110). HIG2-A24-9-19 (SEQ ID NO: 110) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія, яку отримали з позитивної комірки #6, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "c" демонструє CTL-індукуючу спроможність HIG2-A24-9-22 (SEQ ID NO: 111). HIG2-A24-9-22 (SEQ ID NO: 111) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFNгама, а CTL-лінія та клон, що отримали з позитивної комірки #7, зображеної як комірки у рамці, 6 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "d" демонструє CTL-індукуючу спроможність HIG2-A24-9-8 (SEQ ID NO: 387). HIG2A24-9-8 (SEQ ID NO: 387) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія та клон, що отримали з позитивної комірки #5, зображеної як комірки у рамці, демонстрували специфічну реакцію проти клітинмішеней, імпульсно мічених цим епітопним пептидом. "e" демонструє CTL-індукуючу спроможність HIG2-A02-9-8 (SEQ ID NO: 114). HIG2-A02-9-8 (SEQ ID NO: 114) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFNгама, а CTL-лінію отримали з позитивної комірки #10, зображеної як комірки у рамці. Отримана CTL-лінія, створена проти цього пептиду, демонструє специфічну CTL-активність проти 293Т, трансфектованих як геном HIG2 повної довжини, так і молекулою HLA-A02. Як негативні контрольні приготували 293Т, трансфектовані HIG2 повної довжини, проте не трансфектовані HLA-A02, 293Т, трансфектовані HLA-A02 та геном FoxP3, як замісником HIG2 повної довжини, та 293Т, трансфектовані HLA-A02 та імпульсно мічені HIG2-9-15. CTL-лінія демонструвала високу специфічну CTL-активність проти 293Т, трансфектованих як HIG2, так і HLA-A02. Фіг. 4-2. Фігура 4 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що HIG2-A24-9-19 (SEQ ID NO: 110), HIG2-A24-9-22 (SEQ ID NO: 111), HIG2-A249-8 (SEQ ID NO: 387), HIG2-A24-10-7 (SEQ ID NO: 112), HIG2-A24-10-18 (SEQ ID NO: 394), HIG2A02-9-15 (SEQ ID NO: 116), HIG2-A02-9-4 (SEQ ID NO: 117) та HIG2-A02-10-8 (SEQ ID NO: 121) демонструють сильне виробництво IFN-гама. "f" демонструє CTL-індукуючу спроможність HIG2A24-10-7 (SEQ ID NO: 112). HIG2-A24-10-7 (SEQ ID NO: 112) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінії або клон, які отримали з позитивних комірок #1 та #7, зображених як комірки у рамці, демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "g" демонструє CTL-індукуючу спроможність HIG2-A24-10-18 (SEQ ID NO: 394). HIG2A24-10-18 (SEQ ID NO: 394) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія та клон, які отримали з позитивної комірки #7, зображеної як комірки у рамці, демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "h" демонструє CTL-індукуючу спроможність HIG2-A02-9-15 (SEQ ID NO: 116). HIG2-A02-9-15 (SEQ ID NO: 116) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFNгама, а CTL-лінію отримали з позитивної комірки #10, зображеної як комірки у рамці. Отримана CTL-лінія, створена проти цього пептиду, демонструє специфічну CTL-активність проти COS7, трансфектованих як геном HIG2 повної довжини, так і молекулою HLA-A02. Як негативні контрольні приготували COS7, трансфектовані HIG2 повної довжини, проте не трансфектовані HLA-A02, та COS7, трансфектовані HLA-A02 та імпульсно мічені пептидом HIG2-9-8. CTL-лінія демонструвала високу специфічну CTL-активність проти COS7, трансфектованих як HIG2, так і HLA-A02. Фіг. 4-3. Фігура 4 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що HIG2-A24-9-19 (SEQ ID NO: 110), HIG2-A24-9-22 (SEQ ID NO: 111), HIG2-A249-8 (SEQ ID NO: 387), HIG2-A24-10-7 (SEQ ID NO: 112), HIG2-A24-10-18 (SEQ ID NO: 394), HIG2A02-9-15 (SEQ ID NO: 116), HIG2-A02-9-4 (SEQ ID NO: 117) та HIG2-A02-10-8 (SEQ ID NO: 121) демонструють сильне виробництво IFN-гама. "i" демонструє CTL-індукуючу спроможність HIG2A02-9-4 (SEQ ID NO: 117). HIG2-A02-9-4 (SEQ ID NO: 117) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінію та клон отримали з позитивної комірки #10, зображеної як комірки у рамці. Отримана CTL-лінія, створена проти цього пептиду, демонструє специфічну CTL-активність проти COS7, трансфектованих як геном HIG2 повної довжини, так і молекулою HLA-A02 (середній графік). Крім того, як негативні контрольні приготували COS7, трансфектовані HIG2 повної довжини, проте не трансфектовані HLA-A02, COS7, трансфектовані HLA-A02 та геном ТТК як замісником HIG2 повної довжини, та COS7, трансфектовані HLA-A02 та імпульсно мічені HIG2-9-8. Цитотоксичну активність CTL-клону проти 293Т, трансфектованих як геном HIG2 повної довжини, так і молекулою HLA-A02, та ракової клітинної лінії Caki-1, що ендогенно експресує HIG2 та HLA-A02, вимірювали за допомогою аналізу вивільнення хрому (CRA) (нижні графіки), та CTL-клон мав дуже сильну цитотоксичну активність як проти трансфектанту від гена HIG2 та HLA-A02, так і проти Caki-1. З іншого боку, ефекторні клітини не демонстрували цитотоксичну активність CTL-лінії проти 293Т, трансфектованих лише HIG2 або лише HLA-A02, та ракову клітинну лінію А498, що експресує лише HIG2, не виявили. "j" демонструє CTL-індукуючу спроможність HIG2-A02-10-8 (SEQ ID NO: 121). HIG2-A02-10-8 (SEQ ID NO: 121) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN 7 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 гама, а CTL-лінія, яку отримали з позитивної комірки #9, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Фіг. 5-1. Фігура 5 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що INHBB-A24-9-180 (SEQ ID NO: 395), INHBB-A24-10-180 (SEQ ID NO: 133), INHBB-A24-10-305 (SEQ ID NO: 135), INHBB-A24-10-7 (SEQ ID NO: 137) та INHBB-A24-10-212 (SEQ ID NO: 426) демонструють сильне виробництво IFN-гама. "a" демонструє приклад негативних пептидів, у яких неможливо виявити CTL-індукуючу спроможність, незважаючи на можливу зв'язувальну активність з HLA. "b" демонструє CTL-індукуючу спроможність INHBBA24-9-180 (SEQ ID NO: 395). INHBB-A24-9-180 (SEQ ID NO: 395) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінію та клон отримали з позитивної комірки #7, зображеної як комірки у рамці. Цитотоксичну активність отриманого CTL-клону проти пухлинних клітин, Miapaca2, що експресують як INHBB, так і HLA-A02, вимірювали шляхом аналізу вивільнення хрому (CRA), та ефекторні клітини демонстрували високу специфічну цитотоксичну активність проти Міараса2. З іншого боку, він не продемонстрував суттєву специфічну цитотоксичну активність проти Caki-1, що експресують INHBB, проте не експресують HLA-A02. "c" демонструє CTL-індукуючу спроможність INHBB-A24-10-180 (SEQ ID NO: 133). INHBB-A24-10-180 (SEQ ID NO: 133) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінію отримали з позитивної комірки #3, зображеної як комірки у рамці. Отримана CTL-лінія, створена проти цього пептиду, демонструвала високу специфічну CTL-активність проти 293Т, трансфектованих як геном INHBB повної довжини, так і молекулою HLA-A24. Крім того, як негативні контрольні приготували 293Т, трансфектовані INHBB повної довжини, проте не трансфектовані HLA-A24, та 293Т, трансфектовані HLA-A24 та імпульсно мічені пептидом INHBB-10-305. Фіг. 5-2. Фігура 5 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що INHBB-A24-9-180 (SEQ ID NO: 395), INHBB-A24-10-180 (SEQ ID NO: 133), INHBB-A24-10-305 (SEQ ID NO: 135), INHBB-A24-10-7 (SEQ ID NO: 137) та INHBB-A24-10-212 (SEQ ID NO: 426) демонструють сильне виробництво IFN-гама. "d" демонструє CTL-індукуючу спроможність INHBB-A24-10-305 (SEQ ID NO: 135). INHBB-A24-10-305 (SEQ ID NO: 135) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінію та клон отримали з позитивної комірки #2, зображеної як комірки у рамці. Отриманий CTL-клон, створений проти цього пептиду, демонстрував високу специфічну CTL-активність проти 293Т, що трансфектували як геном INHBB повної довжини, так і молекулою HLA-A24. Крім того, як негативні контрольні приготували 293Т, трансфектовані INHBB повної довжини, проте не трансфектовані HLA-A24, 293Т, трансфектовані HLA-A24 та імпульсно мічені пептидом INHBB-10-180. "e" демонструє CTL-індукуючу спроможність INHBBA24-10-7 (SEQ ID NO: 137). INHBB-A24-10-7 (SEQ ID NO: 137) демонструє сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінії отримали з позитивної комірки #8, зображеної як комірки у рамці на верхній панелі, та позитивної комірки #2, зображеної як комірки у рамці на нижній панелі. CTL-лінія з комірки #8 демонструвала специфічну CNL-активність проти 293Т, трансфектованих як геном INHBB повної довжини, так і молекулою HLA-A24. Крім того, як негативні контрольні приготували 293Т, трансфектовані INHBB повної довжини, проте не трансфектовані HLA-A24, та 293Т, трансфектовані HLA-A24 та імпульсно мічені пептидом INHBB-10-40. "f" демонструє CTLіндукуючу спроможність INHBB-A24-10-212 (SEQ ID NO: 426). INHBB-A24-10-212 (SEQ ID NO: 426) демонструє сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія, яку отримали з позитивної комірки #1, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Фіг. 6-1. Фігура 6 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що KIF20A-A24-10-304 (SEQ ID NO: 186), KIF20A-A24-9-383 (SEQ ID NO: 178), KIF20A-A24-10-66 (SEQ ID NO: 194) та KIF20A-A24-9-305 (SEQ ID NO: 174) демонструють сильне виробництво IFN-гама. "a" демонструє приклад негативних пептидів, у яких неможливо виявити CTL-індукуючу спроможність, незважаючи на можливу зв'язувальну активність з HLA. "b" демонструє CTL-індукуючу спроможність KIF20A-A24-10-304 (SEQ ID NO: 186). KIF20A-A2410-304 (SEQ ID NO: 186) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама. Комірка #5, зображена як комірки у рамці на нижній правій панелі, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Крім того, CTL-лінія та клон, які отримали з позитивної комірки 8 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 #5, зображеної як комірки у рамці на верхній лівій панелі, також демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Отриманий CTLклон, розроблений проти пептиду, демонстрував специфічну CTL-активність проти 24-LCL, трансфектованих геном KIF20А повної довжини. Крім того, A24-LCL, трансфектовані mockвектором, приготували як негативні контрольні. Цитотоксичну активність CTL-клону проти пухлинних клітин, Міараса2, що експресують як KIF20A, так і HLA-A24, вимірювали шляхом аналізу вивільнення хрому (CRA), та CTL-клон мав дуже сильну специфічну цитотоксичну активність проти Міараса2 (нижній правий графік). З іншого боку, він не демонстрував суттєвої специфічної цитотоксичної активності проти РК59, що експресує KIF20A, проте не експресує HLA-A24. "c" демонструє CTL-індукуючу спроможність KIF20A-A24-9-383 (SEQ ID NO: 178). KIF20A-A24-9-383 (SEQ ID NO: 178) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама. Комірки #3 та #4, зображені як комірки у рамці на правій панелі, демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Крім того, CTL-лінія, яку отримали з позитивної комірки #3, зображеної як комірки у рамці на лівій панелі, також демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Отримана CTL-лінія демонструвала високу специфічну CTL-активність проти COS7, трансфектованих як геном KIF20 повної довжини, так і молекулою HLA-A24. Крім того, як негативні контрольні приготували COS7, трансфектовані KIF20 повної довжини, проте не трансфектовані HLA-A24, та COS7, трансфектовані HLA-A24 та імпульсно мічені пептидом KIF20A-9-621. Фіг. 6-2. Фігура 6 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що KIF20A-A24-10-304 (SEQ ID NO: 186), KIF20A-A24-9-383 (SEQ ID NO: 178), KIF20A-A24-10-66 (SEQ ID NO: 194) та KIF20A-A24-9-305 (SEQ ID NO: 174) демонструють сильне виробництво IFN-гама. "d" демонструє CTL-індукуючу спроможність KIF20A-A24-10-66 (SEQ ID NO: 194). KIF20A-A24-10-66 (SEQ ID NO: 194) демонстрував сильне виробництво IFNгама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінії, які отримали з позитивної комірки #6, зображеної як комірки у рамці на верхній лівій панелі, та комірки #3, зображеної як комірки у рамці на нижній середній панелі, демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Крім того, CTL-клон, вибраний з CTL-лінії з комірки #6 шляхом обмежувального розведення, демонстрував специфічну CTL-активність проти клітин-мішеней. Отриманий CTL-клон демонстрував специфічну CTL-активність проти COS7, трансфектованих як геном KIF20 повної довжини, так і молекулою HLA-A24. Крім того, як негативні контрольні приготували COS7, трансфектовані KIF20 повної довжини, проте не трансфектовані HLA-A24, COS7, трансфектовані HLA-A24 та геном URLC10 як замісником KIF20А повної довжини, та COS7, що трансфектовані HLA-A24 та імпульсно мічені пептидом KIF20A-10-308. "e" демонструє CTL-індукуючу спроможність KIF20AA24-9-305 (SEQ ID NO: 174). KIF20A-A24-9-305 (SEQ ID NO: 174) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінії, які отримали з позитивної комірки #2, зображеної як комірки у рамці на верхній лівій панелі, та комірки #6, зображеної як комірки у рамці на нижній середній панелі, демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Крім того, CTL-клон, вибраний з CTL-лінії з комірки #2 шляхом обмежувального розведення, демонстрував специфічну CTL-активність проти клітин-мішеней. Цитотоксичну активність CTLклону проти пухлинних клітин PK45P, що експресують як KIF20F, так і HLA-A24, вимірювали шляхом аналізу вивільнення хрому (CRA), та цей CTL-клон мав дуже сильну цитотоксичну активність проти PK45P. З іншого боку, він не показав суттєвої специфічної цитотоксичної активності проти РК59, що експресує KIF20A, проте не експресує HLA-A24. Фіг. 7-1. Фігура 7 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що KNTC2-A24-9-309 (SEQ ID NO: 196), KNTC2-A24-9-124 (SEQ ID NO: 202), KNTC2-A24-9-154 (SEQ ID NO: 210), KNTC2-A24-9-150 (SEQ ID NO: 213), KNTC2-A24-10-452 (SEQ ID NO: 214), KNTC2-A24-10-227 (SEQ ID NO: 217) та KNTC2-A24-10-273 (SEQ ID NO: 223) демонструють сильне виробництво IFN-гама. "a" демонструє приклад негативних пептидів, у яких неможливо виявити CTL-індукуючу спроможність, незважаючи на можливу зв'язувальну активність з HLA. "b" демонструє CTL-індукуючу спроможність KNTC2-A24-9-309 (SEQ ID NO: 196). KNTC2-A24-9-309 (SEQ ID NO: 196) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія, яку отримали з позитивної комірки #8, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "c" демонструє CTL-індукуючу спроможність KNTC2-A24-9-124 (SEQ ID NO: 202). KNTC2-A24-9-124 (SEQ ID NO: 202) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним 9 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 спот-аналізом IFN-гама, а CTL-лінія, яку отримали з позитивної комірки #5, зображеної як комірки у рамці демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "d" демонструє CTL-індукуючу спроможність KNTC2-A24-9-154 (SEQ ID NO: 210). KNTC2-A24-9-154 (SEQ ID NO: 210) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія та клон, які отримали з позитивної комірки #5, зображеної як комірки у рамці, демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "e" демонструє CTLіндукуючу спроможність KNTC2-A24-9-150 (SEQ ID NO: 213). KNTC2-A24-9-150 (SEQ ID NO: 213) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія, яку отримали з позитивної комірки #7, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Фіг. 7-2. Фігура 7 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що KNTC2-A24-9-309 (SEQ ID NO: 196), KNTC2-A24-9-124 (SEQ ID NO: 202), KNTC2-A24-9-154 (SEQ ID NO: 210), KNTC2-A24-9-150 (SEQ ID NO: 213), KNTC2-A24-10-452 (SEQ ID NO: 214), KNTC2-A24-10-227 (SEQ ID NO: 217) та KNTC2-A24-10-273 (SEQ ID NO: 223) демонструють сильне виробництво IFN-гама. "f" демонструє CTL-індукуючу спроможність KNTC2-A24-10-452 (SEQ ID NO: 214). KNTC2-A24-10-452 (SEQ ID NO: 214) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFNгама, а CTL-лінії та клон, які отримали з позитивної комірки #4, зображеної як комірки у рамці на верхній лівій панелі, та комірки #5, зображеної як комірки у рамці на середній панелі, демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Крім того, CTL-клон, вибраний з CTL-лінії з комірки #5 шляхом обмежувального розведення, демонстрував специфічну CTL-активність проти клітин-мішеней. Отримана CTLлінія з комірки #4 демонструвала специфічну CTL-активність проти НЕК293, трансфектованих як геном KNTC2 повної довжини, так і молекулою HLA-A24. Крім того, як негативні контрольні приготували НЕК293, трансфектовані KNTC2 повної довжини, проте не трансфектовані HLAA24, НЕК293, трансфектовані HLA-A24, проте не трансфектовані KNTC2 повної довжини, та НЕК293, трансфектовані HLA-A24, імпульсно мічені пептидом KNTC-9-309. "g" демонструє CTLіндукуючу спроможність KNTC2-A24-10-227 (SEQ ID NO: 217). KNTC2-A24-10-227 (SEQ ID NO: 217) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія, яку отримали з позитивної комірки #1, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "h" демонструє CTL-індукуючу спроможність KNTC2-A24-10-273 (SEQ ID NO: 223). KNTC2-A24-10-273 (SEQ ID NO: 223) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія, яку отримали з позитивної комірки #8, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Фіг. 8-1. Фігура 8 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що TTK-A02-9-462 (SEQ ID NO: 227), TTK-A02-9-719 (SEQ ID NO: 233), TTK-A029-547 (SEQ ID NO: 228) та TTK-A02-10-462 (SEQ ID NO: 254) демонструють сильне виробництво IFN-гама. "a" демонструє приклад негативних пептидів, у яких неможливо виявити CTLіндукуючу спроможність, незважаючи на можливу зв'язувальну активність з HLA. "b" демонструє CTL-індукуючу спроможність TTK-A02-9-462 (SEQ ID NO: 227). TTK-A02-9-462 (SEQ ID NO: 227) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія та два клони, які отримали з позитивної комірки #4, зображеної як комірки у рамці, демонстрували специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. Отриманий CTL-клон демонстрував високу специфічну CTL-активність проти COS7, трансфектованих як геном ТТК повної довжини, так і молекулою HLA-A02. Крім того, як негативні контрольні приготували COS7, трансфектовані ТТК повної довжини, проте не трансфектовані HLA-A02, COS7, трансфектовані HLA-A02, проте не трансфектовані ТТК повної довжини, та COS7, трансфектовані HLA-A02 та імпульсно мічені пептидом TTK-9-547. "c" демонструє CTL-індукуючу спроможність TTK-A02-9-719 (SEQ ID NO: 233). TTK-A02-9-719 (SEQ ID NO: 233) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінію та клони отримали з позитивної комірки #1, зображеної як комірки у рамці. Отримана CTL-лінія демонструвала високу специфічну CTL-активність проти COS7, трансфектованих як геном ТТК повної довжини, так і молекулою HLA-A02. Крім того, як негативні контрольні приготували COS7, трансфектовані ТТК повної довжини, проте не трансфектовані HLA-A02, та COS7, трансфектовані HLA-A02 та геном HIG2 як замісником ТТК повної довжини. 10 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 8-2. Фігура 8 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що TTK-A02-9-462 (SEQ ID NO: 227), TTK-A02-9-719 (SEQ ID NO: 233), TTK-A029-547 (SEQ ID NO: 228) та TTK-A02-10-462 (SEQ ID NO: 254) демонструють сильне виробництво IFN-гама. "d" демонструє CTL-індукуючу спроможність TTK-A02-9-547 (SEQ ID NO: 228). TTKA02-9-547 (SEQ ID NO: 228) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінію та клони отримали з позитивної комірки #2, зображеної як комірки у рамці. Отримана CTL-лінія демонструвала високу специфічну CTL-активність проти COS7, трансфектованих як геном ТТК повної довжини, так і молекулою HLA-A02. Крім того, як негативні контрольні приготували COS7, трансфектовані ТТК повної довжини, проте не трансфектовані HLA-A02, COS7, трансфектовані HLA-A02, проте не трансфектовані ТТК повної довжини, та COS7, трансфектовані HLA-A02 та імпульсно мітчені TTK-10-462. Фіг. 8-3. Фігура 8 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що TTK-A02-9-462 (SEQ ID NO: 227), TTK-A02-9-719 (SEQ ID NO: 233), TTK-A029-547 (SEQ ID NO: 228) та TTK-A02-10-462 (SEQ ID NO: 254) демонструють сильне виробництво IFN-гама. "e" демонструє CTL-індукуючу спроможність TTK-A02-10-462 (SEQ ID NO: 254). TTKA02-10-462 (SEQ ID NO: 254) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінію та три клони отримали з позитивної комірки #8, зображеної як комірки у рамці. Отриманий CTL-клон демонстрував високу специфічну CTL-активність проти COS7, трансфектованих як геном ТТК повної довжини, так і молекулою HLA-A02. Крім того, як негативні контрольні приготували COS7, трансфектовані ТТК повної довжини, проте не трансфектовані HLA-A02, COS7, трансфектовані HLA-A02, проте не трансфектовані ТТК повної довжини, та COS7, трансфектовані HLA-A02 та імпульсно мічені пептидом TTK-9-547. Фіг. 9-1. Фігура 9 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що URLC10-A02-9-206 (SEQ ID NO: 271), URLC10-A02-9-212 (SEQ ID NO: 272) та URLC10-A02-10-211 (SEQ ID NO: 288) демонструють сильне виробництво IFN-гама. "a" демонструє приклад негативних пептидів, у яких неможливо виявити CTL-індукуючу спроможність, незважаючи на можливу зв'язувальну активність з HLA. "b" демонструє CTLіндукуючу спроможність URLC10-A02-9-206 (SEQ ID NO: 271). URLC10-A02-9-206 (SEQ ID NO: 271) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія, яку отримали з позитивної комірки #7, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "c" демонструє CTL-індукуючу спроможність URLC10-A02-9-212 (SEQ ID NO: 272). URLC10-A02-9-212 (SEQ ID NO: 272) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінія, яку отримали з позитивної комірки #3, зображеної як комірки у рамці, демонструвала специфічну реакцію проти клітин-мішеней, імпульсно мічених цим епітопним пептидом. "d" демонструє CTLіндукуючу спроможність URLC10-A02-10-211 (SEQ ID NO: 288). URLC10-A02-10-211 (SEQ ID NO: 288) демонстрував сильне виробництво IFN-гама порівняно з контрольним за імуноферментним спот-аналізом IFN-гама, а CTL-лінію отримали з позитивної комірки #5, зображеної як комірки у рамці. Фіг. 9-2. Фігура 9 демонструє результати скринінгу епітопних пептидів, які, у свою чергу, демонструють, що URLC10-A02-9-206 (SEQ ID NO: 271), URLC10-A02-9-212 (SEQ ID NO: 272) та URLC10-A02-10-211 (SEQ ID NO: 288) демонструють сильне виробництво IFN-гама. "Продовження d" показує, що oтриманий CTL-клон демонстрував високу специфічну CTLактивність проти COS7, НЕК293 та 293Т, трансфектованих як геном URLC10 повної довжини, так і молекулою HLA-A02. Крім того, як негативні контрольні приготували COS7, HEK293 або 293T, трансфектовані URLC10 повної довжини, проте не трансфектовані HLA-A02, та COS7, HEK93 або 293T, трансфектовані HLA-A02 та імпульсно мічені URLC10-10-64. На цих фігурах "+" позначає мішень, імпульсно мічену пептидом, "-" позначає, що мішень імпульсно не мічена пептидом, "R" означає респондер, "S" означає стимулятор, "E" означає ефектор та "T" означає мішень. Докладний опис винаходу Слова "a", "an" та "the", що застосовуються у цьому описі, означають "принаймні один", якщо інше особливо не вказано. Якщо інше не визначено, усі технічні та наукові терміни, що застосовуються у цьому описі, мають такі ж значення, які зазвичай розуміють звичайні фахівці у галузі, до якої належить цей винахід. Цей винахід частково базується на відкритті мішеней імунотерапії, які можна застосовувати. 11 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Визначення нових ТАА, особливо тих, які індукують сильні та специфічні протипухлинні імунні реакції, гарантує подальший розвиток клінічного застосування стратегії вакцинації пептидами при різних типах раку (Boon T et al., (1996) J Exp Med 183: 725-9.; van der Bruggen P et al., (1991) Science 254: 1643-7.; Brichard V et al., (1993) J Exp Med 178: 489-95.; Kawakami Y et al., (1994) J Exp Med 180: 347-52.; Shichijo S et al., (1998) J Exp Med 187:277-88.; Chen YT et al., (1997) Proc.Natl.Acd. Sci.USA, 94: 1914-8.; Harris CC, (1996) J Natl Cancer Inst 88:1442-55.; Butterfield LH et al., (1999) Cancer Res 59:3134-42.; Vissers JL et al., (1999) Cancer Res 59: 5554-9.; van der Burg SH et al., (1996) J. Immunol 156:3308-14.; Tanaka F et al., (1997) Cancer Res 57:4465-8.; Fujie T et al., (1999) Int J Cancer 80:169-72.; Kikuchi M et al., (1999) Int J Cancer 81: 459-66.; Oiso M et al., (1999) Int J Cancer 81:387-94.). Оскільки ТАА часто не мають імуногенності, відкриття придатних мішеней є надзвичайно важливою проблемою. Як зазначено вище, попередньо визначили, що CDH3 (GenBank Accession No. NM_001793; SEQ ID Nos.1, 2), EPHA4 (GenBank Accession No. L36645; SEQ ID Nos.3, 4), ECT2 (GenBank Accession No. AY376439; SEQ ID Nos.5, 6), HIG2 (GenBank Accession No. NM_013332; SEQ ID Nos.7, 8), INHBB (GenBank Accession No. NM_002193; SEQ ID Nos.9, 10), KIF20A (GenBank Accession No. NM_005733; SEQ ID Nos.11, 12), KNTC2 (GenBank Accession No. AF017790; SEQ ID Nos.13, 14), TTK (GenBank Accession No. NM_003318; SEQ ID Nos.15, 16) та URLC10 (GenBank Accession No. NM_017527; SEQ ID Nos.17, 18) надмірно експресуються при різних видах раку при застосуванні технології кДНКмікроматриці. У цьому винаході показано, що пептиди, які походять від CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK або URLC10, є епітопами ТАА, обмеженими HLA-A24 та HLA-A2, при цьому цей алель HLA зазвичай зустрічається серед представників японського та європейського населення. Специфічно, застосовуючи їхню зв'язувальну спорідненість до HLA-A24 або HLA-A2, ідентифікували пептидіи-кандидатів, що зв'язуються з HLA-A24 або HLA-A2 та що походять від CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK або URLC10. Після стимуляції in vitro Тклітин дендритними клітинами (DC), завантаженими цими пептидами, успішно отримали CTL, застосовуючи наступні пептиди: CDH3-A24-9-513 (SEQ ID NO: 19), CDH3-A24-9-406 (SEQ ID NO: 22), CDH3-A24-10-807 (SEQ ID NO: 30), CDH3-A24-10-332 (SEQ ID NO: 34), CDH3-A24-10-655 (SEQ ID NO: 344), CDH3-A24-10-470 (SEQ ID NO: 358), EphA4-A24-9-453 (SEQ ID NO: 41), EphA4-A24-9-5 (SEQ ID NO: 44), EphA4-A24-9-869 (SEQ ID NO: 46), EphA4-A24-9-420 (SEQ ID NO: 48), EphA4-A24-10-24 (SEQ ID NO: 78), EphA4-A02-9-501 (SEQ ID NO: 376), EphA4-A02-9-165 (SEQ ID NO: 379), ECT2-A24-9-515 (SEQ ID NO: 80), ECT2-A24-10-40 (SEQ ID NO: 100), ECT2-A24-10-101 (SEQ ID NO: 101), HIG2-A24-9-19 (SEQ ID NO: 110), HIG2-A24-9-22 (SEQ ID NO: 111), HIG2-A24-9-8 (SEQ ID NO: 387), HIG2-A24-10-7 (SEQ ID NO: 112), HIG2-A24-10-18 (SEQ ID NO: 394), HIG2-A02-9-8 (SEQ ID NO: 114), HIG2-A02-9-15 (SEQ ID NO: 116), HIG2-A02-9-4 (SEQ ID NO: 117), HIG2-A02-10-8 (SEQ ID NO: 121), INHBB-A24-9-180 (SEQ ID NO: 395), INHBB-A24-10-180 (SEQ ID NO: 133), INHBB-A24-10-305 (SEQ ID NO: 135), INHBB-A24-10-7 (SEQ ID NO: 137), 12 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 INHBB-A24-10-212 (SEQ ID NO: 426), KIF20A-A24-9-305 (SEQ ID NO: 174), KIF20A-A24-9-383 (SEQ ID NO: 178), KIF20A-A24-10-304 (SEQ ID NO: 186), KIF20A-A24-10-66 (SEQ ID NO: 194), KNTC2-A24-9-309 (SEQ ID NO: 196), KNTC2-A24-9-124 (SEQ ID NO: 202), KNTC2-A24-9-154 (SEQ ID NO: 210), KNTC2-A24-9-150 (SEQ ID NO: 213), KNTC2-A24-10-452 (SEQ ID NO: 214), KNTC2-A24-10-227 (SEQ ID NO: 217), KNTC2-A24-10-273 (SEQ ID NO: 223), TTK-A02-9-462 (SEQ ID NO: 227), TTK-A02-9-547 (SEQ ID NO: 228), TTK-A02-9-719 (SEQ ID NO: 233), TTK-A02-10-462 (SEQ ID NO: 254), URLC-A02-9-206 (SEQ ID NO: 271), URLC-A02-9-212 (SEQ ID NO: 272) та URLC-A02-10-211 (SEQ ID NO: 288) Ці пептиди є епітопними пептидами кожного ТАА, обмеженого HLA-A24 або HLA-A2. Оскільки ці антигени надмірно експресуються при більшості видів раку та пов'язані з проліферацією клітин пухлини, то вони знаходять застосування як імунотерапевтичні мішені проти раку. Приклади раку включають, проте не обмежуються лише ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. Відповідно, цим винаходом далі пропонуються способи лікування або профілактики хвороби, пов'язаної з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку у суб'єкта, при цьому такі способи включають етапи введення суб'єктові імуногенного пептиду, який складається з менш, ніж приблизно 40 амінокислот, часто менш, ніж приблизно 20 амінокислот, зазвичай менш, ніж приблизно 15 амінокислот та має амінокислотну послідовність SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 376, 379, 80, 100, 101, 110, 111, 387, 112, 394, 114, 116, 117, 121, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217, 223, 227, 228, 233, 254, 271, 272 або 288. Альтернативно, імуногенний пептид може мати наступну амінокислотну послідовність SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 376, 379, 80, 100, 101, 110, 111, 387, 112, 394, 114, 116, 117, 121, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217, 223, 227, 228, 233, 254, 271, 272 або 288, у якій 1, 2 або декілька (наприклад, до 5) амінокислот заміщені, видалені або додані, за умови, що отриманий варіант пептиду зберігає імуногенну активність (тобто, спроможність індукувати CTL, що є специфічними до клітин, що експресують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, до клітин різних видів раку). Кількість залишків, які слід замістити, видалити або додати, зазвичай становить 5 амінокислот або менше, переважно 4 амінокислоти або менше, більш переважно 3 амінокислоти або менше, навіть більш переважно одну або дві амінокислоти. Види раку, що передбачаються, включають, проте не обмежуються лише ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. Крім того, цим винаходом пропонуються способи профілактики пост-хірургічного рецидиву цих хвороб, згаданих вище. Відомо, що варіанти пептидів (тобто, пептидів, що мають амінокислотну послідовність, модифіковану шляхом заміщення, делеції або додавання одного, двох або декількох амінокислотних залишків до первинної амінокислотної послідовності), зберігають первинну біологічну активність (Mark DF et al., (1984) Proc Natl Acad Sci USA 81: 5662-6.; Zoller MJ and Smith M, (1982) Nucleic Acids Res 10:6487-500.; Dalbadie-McFarland G et al., (1982) Proc Natl Acad Sci USA 79: 6409-13.). У контексті цього винаходу переважно, щоб внаслідок амінокислотних 13 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 модифікацій зберігалися властивості бічного ланцюга первинної амінокислоти (процес, відомий як консервативне амінокислотне заміщення). Приклади властивостей амінокислотних бічних ланцюгів включають гідрофобні амінокислоти (A, I, L, M, F, P, W, Y, V), гідрофільні амінокислоти (R, D, N, C, E, Q, G, H, K, S, T) та бічні ланцюги, що мають наступні функціональні групи або характеристики взагалі: аліфатичний бічний ланцюг (G, A, V, L, I, P); гідроксильну групу, що містить бічний ланцюг (S, T, Y); атом сірки, що містить бічний ланцюг (C, M); карбонову кислоту та амід, що містить бічний ланцюг (D, N, E, Q); основу, що містить бічний ланцюг (R, K, H); та ароматичний компонент, що містить бічний ланцюг (H, F, Y, W). Слід відзначити, що літери у дужках вказують на однолітерні коди амінокислот. У переважних варіантах здійснення імуногенний пептид - це нонапептид (9-mer) або декапептид (10-mer). Цим винаходом далі пропонується спосіб індукування протипухлинного імунітету до хвороб, пов'язаних з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку, у суб'єкта, при цьому такий спосіб включає етапи введення суб'єктові, якому це потрібно, імуногенного пептиду цього винаходу, а саме, пептиду, що має амінокислотну послідовність SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 376, 379, 80, 100, 101, 110, 111, 387, 112, 394, 114, 116, 117, 121, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217, 223, 227, 228, 233, 254, 271, 272 або 288 або її варіант (тобто, включає 1, 2 або декілька (наприклад, до 5) амінокислотних заміщень, делецій або додавань). Види раку, що передбачаються, включають, проте не обмежуються лише ними, рак сечового міхура, рак молочної залози, рак шийки матки,холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. У контексті цього винаходу суб'єкт - це переважно ссавець. Приклади ссавців включають, проте не обмежуються тільки ними, наприклад, людину, примата, що не є людиною, мишу, щура, собаку, кішку, коня або корову. У цьому винаході пептид можна вводити суб'єкту, дотримуючись протоколу in vivo або ex vivo. Крім того, цим винаходом також пропонується застосування нонапептиду або декапептиду, що вибрані з пептидів, які мають амінокислотну послідовність SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 376, 379, 80, 100, 101, 110, 111, 387, 112, 394, 114, 116, 117, 121, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217, 223, 227, 228, 233, 254, 271, 272 або 288 (або її варіант), для виробництва імуногенної композиції для лікування або профілактики хвороби, пов'язаної з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку. Види раку, що передбачаються, включають, проте не обмежуються лише ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. Аналізи гомології вказаних далі пептидів демонструють, що вони не мають суттєвої гомології з пептидами, що походять від будь-яких відомих генних продуктів людини. CDH3-A24-9-513 (SEQ ID NO: 19), CDH3-A24-9-406 (SEQ ID NO: 22), CDH3-A24-10-807 (SEQ ID NO: 30), CDH3-A24-10-332 (SEQ ID NO: 34), CDH3-A24-10-655 (SEQ ID NO: 344), CDH3-A24-10-470 (SEQ ID NO: 358), EphA4-A24-9-453 (SEQ ID NO: 41), EphA4-A24-9-5 (SEQ ID NO: 44), EphA4-A24-9-869 (SEQ ID NO: 46), EphA4-A24-9-420 (SEQ ID NO: 48), EphA4-A24-10-24 (SEQ ID NO: 78), EphA4-A02-9-501 (SEQ ID NO: 376), EphA4-A02-9-165 (SEQ ID NO: 379), ECT2-A24-9-515 (SEQ ID NO: 80), ECT2-A24-10-40 (SEQ ID NO: 100), ECT2-A24-10-101 (SEQ ID NO: 101), HIG2-A24-9-19 (SEQ ID NO: 110), 14 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 HIG2-A24-9-22 (SEQ ID NO: 111), HIG2-A24-9-8 (SEQ ID NO: 387), HIG2-A24-10-7 (SEQ ID NO: 112), HIG2-A24-10-18 (SEQ ID NO: 394), HIG2-A02-9-8 (SEQ ID NO: 114), HIG2-A02-9-15 (SEQ ID NO: 116), HIG2-A02-9-4 (SEQ ID NO: 117), HIG2-A02-10-8 (SEQ ID NO: 121), INHBB-A24-9-180 (SEQ ID NO: 395), INHBB-A24-10-180 (SEQ ID NO: 133), INHBB-A24-10-305 (SEQ ID NO: 135), INHBB-A24-10-7 (SEQ ID NO: 137), INHBB-A24-10-212 (SEQ ID NO: 426), KIF20A-A24-9-305 (SEQ ID NO: 174), KIF20A-A24-9-383 (SEQ ID NO: 178), KIF20A-A24-10-304 (SEQ ID NO: 186), KIF20A-A24-10-66 (SEQ ID NO: 194), KNTC2-A24-9-309 (SEQ ID NO: 196), KNTC2-A24-9-124 (SEQ ID NO: 202), KNTC2-A24-9-154 (SEQ ID NO: 210), KNTC2-A24-9-150 (SEQ ID NO: 213), KNTC2-A24-10-452 (SEQ ID NO: 214), KNTC2-A24-10-227 (SEQ ID NO: 217), KNTC2-A24-10-273 (SEQ ID NO: 223), TTK-A02-9-462 (SEQ ID NO: 227), TTK-A02-9-547 (SEQ ID NO: 228), TTK-A02-9-719 (SEQ ID NO: 233), TTK-A02-10-462 (SEQ ID NO: 254), URLC-A02-9-206 (SEQ ID NO: 271), URLC-A02-9-212 (SEQ ID NO: 272) та URLC-A02-10-211 (SEQ ID NO: 288) Отже, можливість невідомих або небажаних імунних реакцій при імунотерапії проти цих молекул суттєво скорочується. Стосовно антигенів HLA, дані, наведені у цьому описі, демонструють, що застосування антигенів типу А-24 або типу А-2 (про які говорять, що вони надзвичайно експресуються серед представників японського населення) є переважним для отримання ефективних результатів. Застосування підтипів, таких як А-2402 та А-0201, є навіть більш переважним. Зазвичай, у клінічних умовах, тип антигену HLA пацієнта, який потребує лікування, досліджується заздалегідь, що, у свою чергу, дозволяє вибрати відповідні пептиди, що мають високий рівень афінітету зв'язування з антигеном пацієнта або мають здатність індукувати цитотоксичні Тклітини (CTL) внаслідок презентації антигену. Крім того, для того, щоб отримати пептиди, що мають високий афінітет зв'язування та здатність індукувати CTL, можна виконати заміщення, делецію або додавання 1, 2 або декількох (наприклад, до 5) амінокислот на основі амінокислотної послідовності часткових пептидів CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10, які виникають природно. У цьому описі термін "декілька" означає до 5 або менше, більш переважно до 3 або менше. Далі, окрім пептидів, що природно виникають, та, оскільки регулярність послідовностей пептидів, що виникають внаслідок зв'язування з антигенами HLA є вже відомою (Kubo RT, et al., (1994) J. Immunol., 152, 3913-24.; Rammensee HG, et al., (1995) Immunogenetics. 41:178-228.; Kondo A, et al., (1995) J. Immunol. 155:4307-12.), модифікації на основі такої правильності можна виконати на імуногенних пептидах винаходу. Наприклад, з перевагою можна застосовувати пептиди, що мають високий афінітет зв'язування з HLA-24, при якій друга амінокислота від N-закінчення заміщена фенілаланіном, тирозином, метіоніном або триптофаном. Подібно до цього, з перевагою можна також застосовувати пептиди, амінокислота яких на С-закінченні заміщена фенілаланіном, лейцином, ізолейцином, триптофаном або метіоніном. З іншого боку, можна з перевагою застосовувати пептиди, що мають високий афінітет зв'язування з HLA-A2, при якій друга амінокислота від N-закінчення заміщена лейцином або метіоніном, та пептиди, амінокислота яких на С-закінченні заміщена валіном або лейцином. Заміщення виконується не лише на кінцевих амінокислотах, але також на позиції потенційного TCR-розпізнавання пептидів. Декілька досліджень продемонстрували, що амінокислотні заміщення у пептиді можуть бути еквівалентними або навіть кращими 15 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 порівняно з оригінальним пептидом, наприклад, CAP1, p53 (264-272), Her-2/neu (369-377) або gp100 (209-217) (Zaremba et al. Cancer Res. 57, 4570-4577, 1997, T. K. Hoffmann et al. J Immunol. (2002) Feb 1;168(3):1338-47., S. O. Dionne et al. Cancer Immunol immunother. (2003) 52: 199-206 та S. O. Dionne et al. Cancer Immunology, Immunotherapy (2004) 53, 307-314). Крім того, 1-2 амінокислоти можна додати до N-закінчення та/або С-закінчення пептиду. Проте, коли пептидна послідовність є ідентичною до частини амінокислотної послідовності ендогенного або екзогенного білка, що має відмінну функцію, можуть трапитися побічні ефекти, такі як автоімунні розлади або алергічні симптоми стосовно специфічних речовин. Отже, переважно запобігати ситуації, при якій імуногенна послідовність відповідає амінокислотній послідовності відомого білка. Такій ситуації можна запобігти внаслідок виконання пошуку гомології, застосовуючи доступні бази даних. Якщо пошук гомології підтверджує, що пептиди, у яких 1, 2 або декілька відмінних амінокислот не існують у природі, тоді можна запобігти небезпеці того, що модифікації вищезгаданої амінокислотної послідовності, наприклад, підвищать афінітет зв'язування з антигенами HLA та/або підвищать спроможність індукувати CTL. Незважаючи на те, що очікують, що пептиди, які мають високий афінітет зв'язування з антигенами HLA, як описано вище, будуть надзвичайно ефективними як протиракові вакцини, пептиди-кандидати, які вибираються згідно з наявністю високого афінітету зв'язування як індикатора, слід дослідити на дійсну присутність спроможності індукувати CTL. Спроможність індукувати CTL можна звичайним шляхом підтвердити шляхом індукування клітин, які презентують антиген та які є носіями антигенів МНС людини (наприклад, В-лімфоцитів, макрофагів та дендритних клітин), або більш специфічно дендритних клітин, що походять від лейкоцитів мононуклеарів периферійної крові людини, та після стимуляції пептидом, що представляє інтерес, змішування з CD8-позитивними клітинами та вимірювання цитотоксичної активності проти клітин-мішеней. Як реакційну систему можна застосовувати трансгенних тварин, отриманих з метою експресувати антиген HLA людини (наприклад, тварин, описаних у BenMohamed L, et al., (2000) Hum. Immunol.; 61(8):764-79 Related Articles, Books, Linkout.). 51 Наприклад, клітини-мішені можна мітити радіоізотопом Cr та йому подібним, а цитотоксичну активність можна підрахувати за радіоактивністю, що вивільнилася з клітин-мішеней. Альтернативно, це можна дослідити шляхом вимірювання IFN-гама, що виробляється та вивільняється CTL у присутності клітин, що презентують антиген, які є носіями іммобілізованих пептидів, та спостереження зони інгібування на середовищі, застосовуючи моноклональні антитіла проти IFN-гама. Внаслідок дослідження спроможності пептидів індукувати CTL, як описано вище, визначили, що ті пептиди, які мають високий афінітет зв'язування з антигеном HLA, необов'язково мають високу індукувальну спроможність. Проте, нонапептиди або декапептиди, які вибрані з групи пептидів, що мають амінокислотні послідовності, визначені наступними пептидами, демонстрували особливо високу спроможність індукувати CTL: CDH3-A24-9-513 (SEQ ID NO: 19), CDH3-A24-9-406 (SEQ ID NO: 22), CDH3-A24-10-807 (SEQ ID NO: 30), CDH3-A24-10-332 (SEQ ID NO: 34), CDH3-A24-10-655 (SEQ ID NO: 344), CDH3-A24-10-470 (SEQ ID NO: 358), EphA4-A24-9-453 (SEQ ID NO: 41), EphA4-A24-9-5 (SEQ ID NO: 44), EphA4-A24-9-869 (SEQ ID NO: 46), EphA4-A24-9-420 (SEQ ID NO: 48), EphA4-A24-10-24 (SEQ ID NO: 78), EphA4-A02-9-501 (SEQ ID NO: 376), EphA4-A02-9-165 (SEQ ID NO: 379), ECT2-A24-9-515 (SEQ ID NO: 80), ECT2-A24-10-40 (SEQ ID NO: 100), ECT2-A24-10-101 (SEQ ID NO: 101), HIG2-A24-9-19 (SEQ ID NO: 110), HIG2-A24-9-22 (SEQ ID NO: 111), HIG2-A24-9-8 (SEQ ID NO: 387), HIG2-A24-10-7 (SEQ ID NO: 112), HIG2-A24-10-18 (SEQ ID NO: 394), HIG2-A02-9-8 (SEQ ID NO: 114), 16 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 HIG2-A02-9-15 (SEQ ID NO: 116), HIG2-A02-9-4 (SEQ ID NO: 117), HIG2-A02-10-8 (SEQ ID NO: 121), INHBB-A24-9-180 (SEQ ID NO: 395), INHBB-A24-10-180 (SEQ ID NO: 133), INHBB-A24-10-305 (SEQ ID NO: 135), INHBB-A24-10-7 (SEQ ID NO: 137), INHBB-A24-10-212 (SEQ ID NO: 426), KIF20A-A24-9-305 (SEQ ID NO: 174), KIF20A-A24-9-383 (SEQ ID NO: 178), KIF20A-A24-10-304 (SEQ ID NO: 186), KIF20A-A24-10-66 (SEQ ID NO: 194), KNTC2-A24-9-309 (SEQ ID NO: 196), KNTC2-A24-9-124 (SEQ ID NO: 202), KNTC2-A24-9-154 (SEQ ID NO: 210), KNTC2-A24-9-150 (SEQ ID NO: 213), KNTC2-A24-10-452 (SEQ ID NO: 214), KNTC2-A24-10-227 (SEQ ID NO: 217), KNTC2-A24-10-273 (SEQ ID NO: 223), TTK-A02-9-462 (SEQ ID NO: 227), TTK-A02-9-547 (SEQ ID NO: 228), TTK-A02-9-719 (SEQ ID NO: 233), TTK-A02-10-462 (SEQ ID NO: 254), URLC-A02-9-206 (SEQ ID NO: 271), URLC-A02-9-212 (SEQ ID NO: 272) та URLC-A02-10-211 (SEQ ID NO: 288). Як відзначалося вище, цим винаходом пропонуються пептиди, що мають спроможність індукувати цитотоксичні Т-клітини, а саме ті пептиди, що мають амінокислотну послідовність SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 376, 379, 80, 100, 101, 110, 111, 387, 112, 394, 114, 116, 117, 121, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217, 223, 227, 228, 233, 254, 271, 272 або 288 або її варіант (тобто, ті, у яких 1, 2 або декілька амінокислот заміщені, видалені або додані). Переважно, щоб амінокислотні послідовності, що складаються з 9 або 10 амінокислот, вказаних у SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 376, 379, 80, 100, 101, 110, 111, 387, 112, 394, 114, 116, 117, 121, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217, 223, 227, 228, 233, 254, 271, 272 або 288, або їх варіантах, не збігалися з амінокислотною послідовністю, пов'язаною з іншим ендогенним білком. Зокрема, прикладами переважних варіантів є амінокислотне заміщення на лейцин або метіонін на другій амінокислоті від N-закінчення, амінокислотне заміщення на валін або лейцин амінокислоти С-закінчення та амінокислотне додавання від 1 до 2 амінокислот на N-закінченні та/або С-закінченні. Фахівець у галузі зрозуміє, що окрім амінокислотних заміщень та додавань у способах цього винаходу можна також застосовувати імунологічно активні фрагменти пептидів. Способи визначення активних фрагментів є добре відомими у галузі. CTL-клони, отримані шляхом стимуляції цими модифікованими пептидами, можуть розпізнавати оригінальні пептиди та спричиняти руйнування клітин, що експресують оригінальні пептиди. Пептиди цього винаходу можна приготувати, застосовуючи добре відомі способи. Наприклад, пептиди можна приготувати штучно, застосовуючи або технологію рекомбінантної ДНК, або хімічний синтез. Пептиди цього винаходу можна синтезувати або поокремо, або як більш довгі пептиди, що складаються з двох або більше пептидів. Пептиди цього винаходу є переважно ізольованими, тобто суттєво вільними від інших природно виникаючих білків клітинхазяїнів та їх фрагментів. Пептиди цього винаходу можуть містити модифікації, такі як глікозилування, окиснення бічного ланцюга або фосфорилування, доки модифікації не руйнують біологічну активність пептидів, яку описано у цьому описі, а саме їх спроможність зв'язуватися з антигеном HLA та індукувати CTL. Інші модифікації включають включення D-амінокислот або інших амінокислотних міметиків, які можна застосовувати, наприклад, для збільшення тривалості напіврозпаду пептидів у сироватці. Крім того, цей винахід може містити спосіб скринінгу пептиду, у якому 1, 2 або більше амінокислот заміщено, де згаданий пептид включає амінокислотну послідовність, що вибрана з 17 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 групи, яка складається з SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 80, 100, 101, 110, 111, 387, 112, 394, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217 та 223, при цьому згаданий спосіб включає етапи: (a) узгодження того, що не існує жодної суттєвої гомології послідовностей з усією послідовністю із 1, 2 або більше амінокислотними заміщеннями; (b) вимірювання спроможності пептиду-кандидата, що має заміщення, індукувати CTL; та (с) вибір пептиду, спроможність якого індукувати CTL є такою ж самою або вищою порівняно з оригінальним пептидом. Наприклад, у переважних варіантах здійснення цим винаходом пропонується спосіб ідентифікації пептиду, що має спроможність індукувати CTL проти клітин, що експресують принаймні один пов'язаний з пухлиною антиген, де пов'язаний з пухлиною антиген є антигеном, вибраним з групи, що складається з CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10, при цьому згаданий спосіб включає етапи: (і) отримання або генерування принаймні однієї послідовності-кандидата, яка складається з амінокислотної послідовності, модифікованої шляхом заміщення, делеції або додавання одного, двох або декількох амінокислотних залишків до оригінальної амінокислотної послідовності, де оригінальна амінокислотна послідовність вибрана з групи, що складається з SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 80, 100, 101, 110, 111, 387, 112, 394, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217 та 223; (іі) вибору послідовності-кандидата, що не має суттєвої значної гомології з пептидами, що походять від будь-яких відомих генних продуктів людини, відмінних від згаданих пов'язаних з пухлиною антигенів; (ііі) контактування пептиду, що складається з послідовності-кандидата, яка вибрана на етапі (іі), з антиген-презентуючими клітинами; (iv) контактування антиген-презентуючих клітин етапу (с) з Т-клітинами для оцінювання спроможності пептиду стимулювати Т-клітини; та (v) ідентифікації пептиду, у якого спроможність індукувати CTL є такою ж самою абовищою порівняно з пептидом, що складається з оригінальної амінокислотної послідовності. Переважно, амінокислота заміщується іншою амінокислотою, у якій зберігаються властивості бічного ланцюга амінокислоти (процес, відомий як консервативне амінокислотне заміщення). Приклади властивостей амінокислотних бічних ланцюгів - це гідрофобні амінокислоти (A, I, L, M, F, P, W, Y, V), гідрофільні амінокислоти (R, D, N, C, E, Q, G, H, K, S, T) та бічні ланцюги, що мають наступні функціональні групи або характеристики взагалі: аліфатичний бічний ланцюг (G, A, V, L, I, P); гідроксильну групу, що містить бічний ланцюг (S, T, Y); атом сірки, що містить бічний ланцюг (C, M); карбонову кислоту та амід, що містить бічний ланцюг (D, N, E, Q); основу, що містить бічний ланцюг (R, K, H); та ароматичний компонент, що містить бічний ланцюг (H, F, Y, W). Слід відзначити, що літери у дужках вказують на однолітерні коди амінокислот. У цьому винаході суттєва значна гомологія - це, наприклад, ідентичність більш ніж на 90 %, переважно на 95 %, більш переважно на 99 % або 100 % з відомим генним продуктом людини, з яким слід порівнювати. Пептиди цього винаходу можна приготувати як комбінацію, яка включає два або більше пептидів винаходу, для застосування як вакцини проти хвороби, пов'язаної з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку, при цьому така вакцина індукує CTL in vivo. Види раку, що передбачаються, включають, проте не обмежуються тільки ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. Пептиди можуть бути у вигляді суміші або можуть бути кон'югованими один з одним за допомогою стандартних способів. Наприклад, пептиди можна експресувати як єдину поліпептидну послідовність. Пептиди у комбінації можуть бути однаковими або різними. При введенні пептидів цього винаходу пептиди представлено з високою щільністю на антигенах HLA антиген-презентуючих клітин, які, у свою чергу, індукують CTL, що специфічно реагують у напрямку комплексу, утвореного між пептидом, що демонструється, та антигеном HLA. Альтернативно, антиген-презентуючі клітини, що мають іммобілізовані пептиди цього винаходу на їх клітинній поверхні, отримані шляхом взяття дендритних клітин у суб'єктів, можна стимулювати пептидами цього винаходу. Повторне введення цих клітин відповідним суб'єктам індукує CTL, та внаслідок цього може підвищитися агресивність до клітин-мішеней. Більш специфічно, цим винаходом пропонуються ліки для лікування та/або профілактики 18 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 проліферації, метастазу та їм подібної хвороби, пов'язаної з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад раку, які включають один або більше пептидів цього винаходу або полінуклеотид, що кодує ці пептиди. Пептиди або полінуклеотиди цього винаходу знаходять особливе застосування при лікуванні хвороби, пов'язаної з CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку. Види раку, які передбачаються, включають, проте не обмежуються тільки ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. Пептиди цього винаходу можна вводити суб'єктові безпосередньо, як фармацевтичну композицію, виготовлену згідно з традиційними способами виробництва. У таких випадках окрім пептидів цього винаходу можна включити як відповідні, без особливих обмежень, носії, ексципієнти та їм подібне, що зазвичай застосовується для ліків. Імуногенні композиції цього винаходу можна застосовувати для лікування або профілактики хвороби, пов'язаної з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку. Види раку, які передбачаються, включають, проте не обмежуються тільки ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. Імуногенні композиції для лікування та/або профілактики хвороби, пов'язаної з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку, які включають як активний інгредієнт один або більше пептидів цього винаходу, можуть далі включати допоміжний агент, так щоб клітинний імунітет був ефективним. Альтернативно, їх можна вводити з іншими активними інгредієнтами, такими як протиракові агенти. Види раку, які передбачаються, включають, проте не обмежуються тільки ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. Придатні форми виготовлення включають гранули. Придатні допоміжні агенти описано у літературі (Johnson AG. (1994) C1in. Microbio1. Rev., 7:277-89.). Приклади допоміжних речовин включають, проте не обмежуються тільки ними, фосфат алюмінію, гідроксид алюмінію та галун. Крім того, можна зручно застосовувати ліпосомні форми, гранулярні форми, у яких ліки зв'язані з гранулами з діаметром до декількох мкм (mc m), та форми, у яких ліпід зв'язаний з пептидом. Метод введення може бути пероральним, інтрадермальним, підшкірним, внутрівенною ін'єкцією або їм подібним та може включати системне введення або місцеве введення поблизу пухлини-мішені. Дозу пептиду (пептидів) цього винаходу можна привести у відповідність до хвороби, яку слід лікувати, віку пацієнта, маси, способу введення та їм подібного. Хоча доза зазвичай становить від 0,001 мг до 1000 мг, переважно від 0,01 мг до 100 мг, більш переважно від 0,1 мг до 10 мг та переважно вводиться один раз протягом від декількох днів до декількох місяців, фахівець у галузі зможе легко вибрати відповідну дозу та спосіб введення, оскільки вибір та оптимізація цих параметрів відповідає повсякденній практиці. Цим винаходом далі пропонуються внутрішньоклітинні везикули, що називаються екзосомами, які презентують на своїй поверхні комплекси, створені між пептидами цього винаходу та антигенами HLA. Екзосоми можна приготувати, наприклад, застосовуючи способи, докладно описані у Published Japanese Translation of International Publication Nos. Hei 11-510507 та 2000-512161, та їх переважно виготовляють, застосовуючи антиген-презентуючі клітини, отримані від суб'єктів, які є цільовими об'єктами лікування та/або профілактики. Екзосоми цього винаходу можна прищеплювати як протиракові вакцини, подібно до пептидів цього винаходу. Тип антигенів HLA, що застосовуються, повинен відповідати антигенам суб'єкта, який потребує лікування та/або профілактики. Наприклад, серед японського населення HLA-A24 або HLA-A2, особливо HLA-A2402 або HLA-A0201, є часто відповідним. У деяких варіантах здійснення композиції вакцин цього винаходу включають компонент, який здійснює первинний вплив на цитотоксичні Т-лімфоцити. Ліпіди було ідентифіковано як 19 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 агенти, спроможні здійснювати первинний вплив на CTL in vivo проти вірусних антигенів. Наприклад, залишки пальмітинової кислоти можна приєднати до епсилон- та альфа-аміногруп залишку лізину, а потім з'єднати з імуногенним пептидом цього винаходу. Ліпідований пептид можна потім вводити або безпосередньо, у міцелі або частинці, включеній у ліпосому, або емульгувати у допоміжному агенті. Як інший приклад ліпіду, що активізує CTL-реакції, можна для активізації CTL застосовувати ліпопротеїни E. Coli, такі як трипальмітоїл-Sгліцерилцистеїнлізерил-серин (P3CSS), коли він ковалентно приєднаний до відповідного пептиду (дивись, наприклад, Deres K, et al., (1989) Nature 342:561-4.). Імуногенні композиції цього винаходу можуть також включати нуклеїнові кислоти, що кодують один або більше імуногенних пептидів, описаних у цьому описі. Дивись, наприклад, Wolff JA et al., (1990) Science 247:1465-8; Патенти США №№ 5580859; 5589466; 5804566; 5739118; 5736524; 5679647 та WO 98/04720. Приклади технології доставки на основі ДНК включають депротеїнізовану ДНК, доставку за сприянням (бупівікаїн, полімери, опосередковану пептидами), катіонні ліпідні комплекси та опосередковану частинками доставку ("генна пушка") або опосередковану тиском доставку (дивись, наприклад, патент США № 5922687). Імуногенні пептиди винаходу можна також експресувати за допомогою вірусних або бактеріальних векторів. Приклади придатних векторів експресії включають ослаблених вірусних хазяїнів, таких як віруси коров'ячої віспи або пташиної віспи. Цей підхід залучає застосування вірусу коров'ячої віспи, наприклад, як вектора для експресії нуклеотидних послідовностей, що кодують пептид. Після введення хазяїну рекомбінантний вірус коров'ячої віспи експресує імуногенний пептид, та, таким чином, викликає імунну реакцію. Вектори коров'ячої віспи та способи, що є корисними у протоколах імунізації, описано, наприклад, у патенті США № 4722848. Інший придатний вектор - це BCG (Bacille Calmette Guerin). Вектори BCG описано у Stover CK, et al., (1991) Nature 351:456-60. У галузі відомим є широке різноманіття інших векторів, що є корисними для терапевтичного введення або імунізації, наприклад, вектори аденовірусів та адено-пов'язаних вірусів, ретровірусні вектори, вектори типу Salmonella, вектори детоксифікованого токсину сибірської виразки та їм подібні. Дивись, наприклад, Shata MT, et al., (2000) Mol. Med. Today 6:66-71; Shedlock DJ and Weiner DB., et al., (2000) J. Leukoc. Biol. 68:793806; та Hipp JD, et al., (2000) In Vivo 14:571-85. Цим винаходом також пропонуються способи індукування антиген-презентуючих клітин, застосовуючи один або більше пептидів цього винаходу. Антиген-презентуючі клітини можна індукувати шляхом індукування дендритних клітин з мононуклеарів периферійної крові з наступним контактуванням (стимуляцією) їх з одним або більше пептидами цього винаходу in vitro, ex vivo та in vivo. Коли пептиди цього винаходу вводять суб'єктам, тоді антигенпрезентуючі клітини, що мають пептиди цього винаходу, іммобілізовані на них, індукуються у тілі суб'єкта. Альтернативно, після іммобілізування пептидів цього винаходу на антигенпрезентуючих клітинах, ці клітини можна вводити суб'єктові як вакцину. Наприклад, введення ex vivo може включати етапи: а: узяття антиген-презентуючих клітин у суб'єкта та b: контактування антиген-презентуючих клітин етапу "а" з пептидом цього винаходу. Альтернативно, згідно з цим винаходом пропонується застосування пептидів цього винаходу для виробництва фармацевтичної композиції, що індукує антиген-презентуючі клітини. Крім того, цим винаходом також пропонується пептид цього винаходу для індукування антигенпрезентуючих клітин. Антиген-презентуючі клітини, отримані на етапі "b", можна вводити суб'єктові як вакцину. Цим винаходом також пропонується спосіб індукування антиген-презентуючих клітин, що мають високий рівень спроможності індукувати цитотоксичні Т-клітини, при цьому цей спосіб включає етап перенесення генів, що складаються з полінуклеотиду (-ів), який кодує один або більше пептидів цього винаходу, до антиген-презентуючих клітин in vitro. Введені гени можуть бути у формі ДНК або РНК. Щодо способів введення, можна придатним чином застосовувати, без особливих обмежень, різні способи, що традиційно здійснюються у цій галузі, такі як спосіб ліпофекції, електропорації та спосіб із застосуванням фосфату кальцію. Більш специфічно, трансфекцію можна виконувати, як описано у Reeves ME, et al., (1996) Cancer Res., 56:5672-7.; Butterfield LH, et al., (1998) J. Immunol., 161:5607-13.; Boczkowski D, et al., (1996) J. Exp. Med., 184:465-72.; Published Japanese Translation of International Publication No. 2000-509281. Під час перенесення гена до антиген-презентуючих клітин ген зазнає транскрипції, трансляції та їм подібного у клітині, а потім отриманий білок зазнає процесингу МНС Класу І або Класу ІІ та проходить через шлях презентації для презентації часткових пептидів. Цим винаходом далі пропонуються способи індукування CTL, застосовуючи один або більше пептидів цього винаходу. Коли пептиди цього винаходу вводяться суб'єктові, CTL індукуються у 20 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 тілі суб'єкта, та завдяки цьому підвищується сила імунної системи, що уражає клітини, які експресують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, ракові клітини у пухлинних тканинах. Види раку, які передбачаються, включають, проте не обмежуються тільки ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. Альтернативно, пептиди цього винаходу можна застосовувати у контексті терапевтичного способу ex vivo, при якому антигенпрезентуючі клітини та CD8-позитивні клітини або лейкоцити мононуклеарів периферійної крові, що походять від суб'єкта, контактують з (стимулюються) одним або більше пептидами цього винаходу in vitro, та після індукування CTL ці клітини повертають суб'єктові. Наприклад, спосіб може включати етапи: a: узяття антиген-презентуючих клітин у суб'єкта; b: контактування антиген-презентуючих клітин етапу "а" з пептидом цього винаходу, + c: змішування антиген-презентуючих клітин етапу "b" з Т-клітинами CD8 та сумісне культивування, так щоб індукувати цитотоксичні Т-клітини; та + d: збирання Т-клітин CD8 зі співкультури етапу "с". Альтернативно, згідно з цим винаходом пропонується застосування пептидів цього винаходу для виробництва фармацевтичної композиції, що індукує CTL. Крім того, цим винаходом також + пропонуються пептиди цього винаходу для індукування CTL. Т-клітини CD8 , що мають цитотоксичну активність, отриману на етапі "d", можна вводити суб'єктові як вакцину. Цим винаходом далі пропонуються виділені цитотоксичні Т-клітини, індуковані із застосуванням пептидів цього винаходу. Цитотоксичні Т-клітини, індуковані шляхом стимуляції антиген-презентуючою клітиною, що презентує один або більше пептидів цього винаходу, переважно походять від суб'єктів, які є цільовими об'єктами лікування та/або профілактики, та їх можна вводити самостійно або у комбінації з іншими ліками, включаючи один або більше пептидів цього винаходу або екзосоми, що мають протипухлинну активність. Отримані цитотоксичні Т-клітини діють специфічно проти клітин-мішеней, що презентують пептиди цього винаходу або переважно такий самий пептид (пептиди), що застосовується для індукування. Клітини-мішені можуть бути клітинами, що експресують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10 ендогенно, або клітинами, що трансфектовані генами CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10. Клітини, що презентують пептиди цього винаходу на клітинній поверхні завдяки стимуляції цими пептидами, можуть також стати мішенями атаки. Цим винаходом також пропонуються антиген-презентуючі клітини, які презентують комплекси, утворені між антигенами HLA та одним або більше пептидами цього винаходу. Антиген-презентуючі клітини, отримані внаслідок контактування з пептидами цього винаходу або нуклеотидами, що кодують такі пептиди, переважно походять від суб'єктів, які є цільовими об'єктами лікування та/або профілактики, та їх можна вводити як вакцини, самостійно або у комбінації з іншими ліками, включаючи пептиди, екзосоми або цитотоксичні Т-клітини цього винаходу. Цим винаходом також пропонуються композиція, що складається з нуклеїнових кислот, які кодують поліпептиди, спроможні утворювати субодиницю рецептора Т-клітин (TCR), та способи її застосування. Субодиниці TCR мають спроможність утворювати TCR, які надають специфічності Т-клітинам щодо пухлинних клітин, що презентують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK або URLC10. Застосовуючи відомі у галузі способи, можна ідентифікувати нуклеїнові кислоти альфа- та бета-ланцюга як субодиниці TCR CTL, індукованих одним або більше пептидами цього винаходу (WO2007/032255 та Morgan et al., J Immunol, 171, 3288 (2003)). Похідні TCR переважно зв'язують клітини-мішені, що демонструють пептиди CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK або URLC10, з високим ступенем енергійності та довільно опосередковують ефективне вбивство клітин-мішеней, що презентують пептид CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK або URLC10 in vivo та in vitro. Нуклеїнові кислоти, що кодують субодиниці TCR, можна включити у придатні вектори, наприклад, ретровірусні вектори. Ці вектори є добре відомими у галузі. Нуклеїнові кислоти або вектори, що містять їх, можна з користю перенести до Т-клітини, при цьому Т-клітина переважно береться від пацієнта. Переважно, винаходом пропонується готова композиція, яка дозволяє швидко модифікувати власні Т-клітини пацієнта (або клітини іншого ссавця), щоб швидко та легко отримати модифіковані Т-клітини, які мають відмінні властивості вбивати ракові клітини. 21 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, цим винаходом пропонуються CTL, які приготували шляхом трансдукції нуклеїновими кислотами, які кодують поліпептиди субодиниць TCR, що зв'язуються з пептидом CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK або URLC10, наприклад, SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 376, 379, 80, 100, 101, 110, 111, 387, 112, 394, 114, 116, 117, 121, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217, 223, 227, 228, 233, 254, 271, 272 або 288 у контексті HLA-A24 або HLA-A2. Трансдуковані CTL є спроможними повертатися до ракових клітин in vivo та розповсюджуватися внаслідок добре відомого способу культивування in vitro (наприклад, Kawakami et al., J Immunol., 142, 3452-3461 (1989)). Т-клітини цього винаходу можна застосовувати для створення імуногенної композиції, корисної під час лікування або профілактики раку у пацієнтів, які потребують терапію або захист (WO2006/031221). У контексті цього винаходу термін "вакцина" (також називається імуногенною композицією) означає речовину, яка індукує протипухлинний імунітет або пригнічує різні види раку після щеплення тварин. Згідно з цим винаходом припустили, що поліпептиди, які мають амінокислотну послідовність SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 80, 100, 101, 110, 111, 387, 112, 394, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217 або 223, є епітопними пептидами, обмеженими HLA-A24, та ті поліпептиди, що мають SEQ ID NO: 376, 379, 114, 116, 117, 121, 227, 228, 233, 254, 271, 272 або 288, є епітопними пептидами, обмеженими HLA-A2, які можуть індукувати сильну та специфічну імунну реакцію проти клітин, що експресують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, ракових клітин, що експресують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10. Види раку, які передбачаються, включають, проте не обмежуються тільки ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. Отже, цей винахід також охоплює спосіб індукування протипухлинного імунітету за допомогою поліпептидів, що мають амінокислотну послідовність SEQ ID NO: 19, 22, 30, 34, 344, 358, 41, 44, 46, 48, 78, 376, 379, 80, 100, 101, 110, 111, 387, 112, 394, 114, 116, 117, 121, 395, 133, 135, 137, 426, 174, 178, 186, 194, 196, 202, 210, 213, 214, 217, 223, 227, 228, 233, 254, 271, 272 або 288 або її варіант (тобто, включаючи 1, 2 або декілька (наприклад, до 5) амінокислотних заміщень, делецій або додавань). Взагалі, протипухлинний імунітет включає імунні реакції, такі як наступні: - індукція цитотоксичних лімфоцитів проти пухлин, що містять клітини, які експресують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, - індукція антитіл, що розпізнають пухлини, які мають клітини, що експресують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, та - індукція виробництва протипухлинних цитокінів. Отже, коли певний пептид індукує будь-яку одну з цих імунних реакцій після щеплення тварини, вважають, що цей пептид має дію, яка індукує протипухлинний імунітет. Індукцію протипухлинного імунітету пептидом можна виявити шляхом спостереження in vivo та in vitro реакцій імунної системи у хазяїна проти пептиду. Наприклад, добре відомим є спосіб виявлення індукції цитотоксичних Т-лімфоцитів. Сторонню речовину, що поступає у живий організм, представляють Т-клітинам та В-клітинам за допомогою дії антиген-презентуючих клітин (АРС). Т-клітини, що відповідають на антиген, представлений АРС специфічним до антигену способом, диференціюються у цитотоксичні Тклітини (також позначаються як цитотоксичні Т-лімфоцити або CTL) завдяки стимуляції антигеном, а потім вони проліферуються; цей процес позначається у цьому описі як "активація" Т-клітин. Отже, індукцію CTL певним пептидом можна оцінити, представивши пептид Т-клітині за допомогою АРС, та виявленням індукції CTL. Крім того, АРС мають ефект активації Т-клітин + + + CD4 , Т-клітин CD8 , макрофагів, еозинофілів та NK-клітин. Оскільки Т-клітини CD4 є також важливими для протипухлинного імунітету, то дію пептиду, що індукує протипухлинний імунітет, можна оцінити, застосовуючи ефект активації цих клітин як індикатор. Спосіб оцінки індукуючої дії CTL із застосуванням дендритних клітин (DC) як АРС є добре відомим у галузі. DC є представником АРС, що серед АРС має найсильнішу індукуючу дію на CTL. У цьому способі поліпептид тесту спочатку контактує з DC, а потім ця DC контактує з Тклітинами. Виявлення Т-клітин, які мають цитотоксичні ефекти проти клітин, що нас цікавлять, після контактування з DC, демонструє, що поліпептид тесту має активність індукувати цитотоксичні Т-клітини. Активність CTL проти пухлин можна визначити, наприклад, 22 UA 100372 C2 51 5 10 15 20 25 30 35 40 45 50 55 60 застосовуючи лізис Cr-мічених пухлинних клітин як індикатор. Альтернативно, добре відомим є спосіб оцінки ступеню пошкодження пухлинної клітини, при якому застосовується активність поглинання 3Н-тимідину або вивільнення LDH (лактат-дегідрогенази) як індикаторів. Крім того, його можна також візуально досліджувати шляхом вимірювання IFN-гама, що виробляється та вивільнюється CTL у присутності антиген-презентуючих клітин, які є носіями іммобілізованих пептидів, застосовуючи антитіла проти IFN-гама, так як в імуноферментному спот-аналізі. Окрім DC можна також застосовувати мононуклеари периферійної крові (РВМС) як АРС. Повідомляється, що індукція CTL підвищується внаслідок культивування РВМС у присутності GM-CSF та IL-4. Подібно до цього, було продемонстровано, що CTL індукується внаслідок культивування РВМС у присутності гемоціаніну лімфи равлика (KLH) та IL-7. Протестовані поліпептиди, які підтвердили за допомогою цих способів, що вони мають CTLіндукуючу активність, - це поліпептиди, що мають ефект активації DC та, як наслідок, CTLіндукуючу активність. Отже, поліпептиди, що індукують CTL проти клітин, які експресують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, є корисними як вакцини проти хвороб, пов'язаних з CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку. Крім того, АРС, що мають бажану спроможність індукувати CTL проти хвороб, пов'язаних з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку, внаслідок контактування з поліпептидами, є корисними як вакцини проти цих хвороб. Крім того, CTL, що придбали бажану цитотоксичність внаслідок презентації поліпептидних антигенів за допомогою АРС, можна також застосовувати як вакцини проти хвороб, пов'язаних з CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку. Такі терапевтичні способи для хвороб, пов'язаних з CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку, які застосовують протипухлинний імунітет завдяки АРС та CTL, називаються клітинною імунотерапією. Види раку, які передбачаються, включають, проте не обмежуються тільки ними, рак сечового міхура, рак молочної залози, рак шийки матки, холангіокарциному, хронічний мієлоїдний лейкоз (CML), колоректальний рак, ендометріоз, рак стравоходу, рак шлунку, рак шлунку дифузного типу, рак печінки, недрібноклітинний рак легенів (NSCLC), лімфому, остеосаркому, рак яєчника, рак підшлункової залози, рак простати, рак нирки, дрібноклітинний рак легенів (SCLC), пухлину м'якої тканини та пухлину яєчка. Взагалі, коли поліпептид застосовується для клітинної імунотерапії, ефективність CTLіндукції можна підвищити шляхом комбінування численних поліпептидів, які мають різні структури, та шляхом контактування їх з DC. Отже, коли DC стимулюються фрагментами білка, переважно застосовувати суміш численних типів фрагментів. Індукцію протипухлинного імунітету поліпептидом можна далі підтвердити шляхом спостереження індукції виробництва антитіла проти пухлин. Наприклад, коли антитіла проти поліпептиду індукуються у лабораторній тварині, імунізованій поліпептидом, та коли ріст, проліферація та/або метастаз пухлинних клітин пригнічуються такими антитілами, визначається, що цей поліпептид індукує протипухлинний імунітет. Протипухлинний імунітет можна індукувати шляхом введення вакцини цього винаходу, та індукція протипухлинного імунітету дозволяє лікувати та попереджати хворобу, пов'язану з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, рак. Терапія проти раку або профілактика початку хвороби, пов'язаної з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку, може включати інгібування росту клітин, що експресують CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, ракових клітин, інволюцію цих клітин та пригнічення виникнення цих клітин, наприклад, ракових клітин. Скорочення смертності людей, що мають хворобу, пов'язану з CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, рак, зменшення маркерів хвороби у крові, ослаблення помітних симптомів, що супроводжують хворобу, та їм подібне також включаються у терапію або профілактику хвороби, наприклад, раку. Такі терапевтичні та профілактичні ефекти є переважно статистично суттєвими, наприклад, можуть спостерігатися при рівні значущості 5 % або менше, де терапевтичний або профілактичний ефект вакцини проти хвороби, пов'язаної з CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, раку, порівнюється з контрольним без введення вакцини. Наприклад, для визначення статистичної значущості можна застосовувати перевірку за критерієм Стьюдента, U-тест Мана-Уітні або ANOVA. Тим самим цим винаходом пропонується спосіб лікування або профілактики хвороби, пов'язаної з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/абоURLC10, наприклад, раку, при цьому терапевтичні сполуки або композиції можна вводити профілактично або терапевтично суб'єктам, які страждають на рак або мають ризик розвитку 23 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 хвороби (або сприйнятливість до неї). Таких суб'єктів можна ідентифікувати, застосовуючи стандартні клінічні способи. У контексті цього винаходу профілактичне введення відбувається до проявлення явних клінічних симптомів хвороби, так що хвороба або розлад попереджаються або альтернативно відкладаються у своєму розвитку. У контексті галузі медицини термін "профілактика" ("попередження") охоплює будь-яку активність, яка зменшує смертність або ускладнення від хвороби. Профілактику можна здійснювати на первинному, вторинному та третинному рівнях профілактики. Тоді як первинна профілактика дозволяє запобігти розвитку хвороби, вторинний та третинний рівні профілактики охоплюють діяльність, спрямовану на попередження розвитку хвороби та виникнення симптомів, а також на зменшення негативного впливу вже діагностованої хвороби внаслідок відновлення функції та зменшення пов'язаних з хворобою ускладнень. У контексті лікування раку термін "ефективний" означає лікування, наслідком якого є зменшення розміру, розповсюдженості або метастатичного потенціалу раку у суб'єкта. Коли лікування здійснюється "профілактично", тоді термін "ефективний" означає, що лікування уповільнює або попереджає виникнення раку або зменшує клінічний симптом раку. Оцінити ступінь розвитку раку можна із застосуванням стандартних клінічних протоколів. Крім того, ефективність лікування можна визначити за допомогою будь-якого відомого способу діагностики або лікування раку. Наприклад, рак можна діагностувати, застосовуючи гістопатологію, або шляхом ідентифікації симптоматичних аномалій. Вищезгаданий пептид, що має імунологічну активність, або полінуклеотид або вектор, що кодує такий пептид, можна поєднати з допоміжним агентом. Допоміжний агент означає сполуку, яка підвищує імунну реакцію проти пептиду, коли її вводять разом (або послідовно) з пептидом, що має імунологічну активність. Приклади придатних допоміжних агентів включають токсин холери, токсин сальмонели, галун та їм подібні, проте приклади не обмежуються лише ними. Крім того, вакцину цього винаходу можна комбінувати відповідним чином з фармацевтично прийнятним носієм. Приклади таких носіїв - це стерилізована вода, фізіологічний сольовий розчин, фосфатний буфер, культуральна рідина та їм подібні. Крім того, вакцина може містити, якщо необхідно, стабілізатори, суспензії, консерванти, поверхнево-активні речовини та їм подібне. Вакцину вводять системно або місцево. Введення вакцини можна виконувати шляхом єдиного введення або ревакцинації шляхом багаторазового введення. Коли АРС або CTL застосовують як вакцину цього винаходу, тоді хворобу, пов'язану з надмірною експресією CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та/або URLC10, наприклад, рак, можна лікувати або попереджати, наприклад, за допомогою способу ex vivo. Більш специфічно, РВМС суб'єкта, який отримує лікування або профілактику, збирають, та їх піддають контакту ex vivo з пептидом цього винаходу. Після індукції АРС або CTL ці клітини можна вводити суб'єктові. АРС можна також індукувати шляхом введення вектора, що кодує пептид, у РВМС ex vivo. АРС або CTL, індуковані in vitro, можна клонувати до початку введення. Завдяки клонуванню та культивуванню клітин, що мають високу активність щодо руйнування клітин-мішеней, можна більш ефективно здійснювати клітинну імунотерапію. Крім того, АРС та CTL, виділені таким способом, можна застосовувати для клітинної імунотерапії не тільки стосовно індивідуумів, від яких походять клітини, але також стосовно подібних типів хвороб у інших індивідуумів. Аспекти цього винаходу описано у наступних прикладах, які наведено тільки з метою проілюструвати цей винахід та допомогти звичайному фахівцю у галузі здійснити та використати його. Приклади у жодному разі не призначені для обмеження обсягу цього винаходу. Придатні способи та матеріали описано далі, хоча способи та матеріали, подібні або еквівалентні до способів та матеріалів, описаних у цьому описі винаходу, можна застосовувати на практиці або для тестування цього винаходу. ПРИКЛАДИ Далі цей винахід описано, проте не обмежено, наступними прикладами. Проте, матеріали, способи та їм подібне, описані у цьому описі, тільки ілюструють аспекти винаходу та в жодному разі не призначенні для обмеження обсягу цього винаходу. Як такі, матеріали, способи та їм подібне або еквіваленти того, що описано у цьому описі винаходу, можна застосовувати на практиці або для тестування цього винаходу. МАТЕРІАЛИ ТА СПОСОБИ Клітинні лінії Клітини A24-LCL (HLA-A24), В-лімфобластоїдну клітинну лінію людини, отримали шляхом трансформації вірусом Епстайна-Барра. Клітини Т2, COS7, A498, Caki-2 та HEK 293 купували у АТСС. Caki-1 та MIAPaca-2 купували у JCRB. PK-45P, PK-59, TE-5 та TE-6 купували у TKG. 293 24 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 T купували у GenHunter. Вибірпептиду-кандидата, що походить від CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10 Нонапептиди (9-mer) та декапептиди (10-mer), що походять від CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK або URLC10, які зв'язуються з молекулою HLA-A*2402 або HLAA*0201, передбачили, застосовуючи прогнозне програмне забезпечення для зв'язування "BIMAS" (http://bimas.dcrt.nih.gov/cgi-bin/molbio/ken_parker_comboform) (Parker KC, et al., (1994) J Immunol.;152(1):163-75.; Kuzushima K, et al., (2001) Blood.;98(6):1872-81.). Ці пептиди синтезували за допомогою Sigma (Саппоро, Японія) згідно зі стандартним способом твердофазного синтезу та очистили шляхом рідинної хроматографії високого розділення (HPLC) зі зворотною фазою. Чистоту (більше 90 %) та ідентичність цих пептидів визначили шляхом аналітичної рідинної хроматографії високого розділення (HPLC) та шляхом масспектрометричного аналізу, відповідно. Пептиди розчинили у диметилсульфоксиді (DMSO) при концентрації 20 мг/мл та зберігали при -80 °C. Індукція CTL in vitro Дендритні клітини (DC), що походять від моноцитів, застосовували як антиген-презентуючі клітини (АРС), щоб індукувати реакції CTL проти пептидів, представлених на HLA. DC генерували in vitro, як описано у роботах (Nukaya I et al., (1999) Int. J. Cancer 80, 92-7., Tsai V et al., (1997) J. Immunol 158:1796-802.). Стисло кажучи, мононуклеари периферійної крові (РВМС), узяті у здорового волонтера (HLA-A*2402 та/або HLA-A*0201) за допомогою розчину FicollPaque (Pharmacia), відокремили за допомогою налипання на пластикову колбу з тканинною культурою (Becton Dickinson), так щоб збагатити їх фракцією моноцитів. Збагачену моноцитами популяцію культивували у присутності 1000 одиниць/мл GM-CSF (Genzyme) та 1000 одиниць/мл IL-4 (Genzyme) у AIM-V (Invitrogen), що містило 2 % інактивовану теплом аутогенну сироватку (AS). Після 7 днів перебування у культурі генеровані цитокінами DC імпульсно мітили 20 мкг/мл синтезованих пептидів у присутності 3 мкг/мл бета 2-мікроглобуліну протягом 4 годин при 20 °C у AIM-V. Ці імпульсно мічені пептидом DC потім інактивували за допомогою ММС (30 мкг/мл + протягом 30 хвилин) та змішали у відношенні 1:20 з аутогенними Т-клітинами CD8 , отриманими TM шляхом позитивної селекції за допомогою Dynabeads M-450 CD8 (Dynal) та DETACHa BEAD (Dynal). Ці культури помістили у планшети з 48 комірками (Corning); при цьому кожна комірка 4 5 + містила 1,5 × 10 імпульсно мічених пептидом DC, 3 × 10 T клітин CD8 та 10 нг/мл IL-7 (Genzyme) у 0,5 мл AIM-V/2 % AS. Через три дні до цих культур додали IL-2 (CHIRON), так щоб кінцева концентрація становила 20 міжнародних одиниць/мл. На 7 та 14 дні Т-клітини знов стимулювали аутогенними імпульсно міченими пептидом DC. DC готували кожного разу однаковим способом, який описано вище. CTL протестували стосовно імпульсно мічених пептидом клітин A24-LCL або Т2-клітин після 3 раундів стимуляції пептидом на 21 день. Процедура розмноження CTL CTL розмножували у культурі, застосовуючи спосіб, подібний до способу, описаного співавторами Riddell SR, et al., (Walter EA et al., (1995) N Engl J Med 333:1038-44.; Riddel SR, et 4 al., (1996) Nature Med. 2:216-23.). Всього 5 × 10 CTL повторно суспендували у 25 мл AIM-V/5 % AS з 2 типами В-лімфобластоїдних клітинний ліній людини, інактивованих за допомогою ММС, у присутності 40 нг/мл моноклонального антитіла проти CD3 (Pharmingen). Через один день після початку культивування 120 міжнародних одиниць/мл IL-2 додали до культур. Культури підпитували свіжою AIM-V/5 % AS, що містила 30 міжнародних одиниць/мл IL-2, у 5, 8 та 11 день. Отримання клонів CTL Виконували розведення, щоб отримати 0,3, 1 та 3 CTL/комірку у титраційному мікропланшеті з 96 комірками з круглим дном (Nalge Nunc International). CTL культивували з 2 типами В4 лімфобластоїхдних клітинних ліній людини при 7 × 10 клітин/комірку, 20 нг/мл антитіла проти CD3 та 124 міжнародними одиницями/мл IL-2 в загальній кількості 150 мкл/комірку AIM-V, що містило 5 % AS. 50 мкл/комірку IL-2 додали до середовища через 10 днів, так що IL-2 набув кінцевої концентрації 125 одиниць/мл. CTL-активність CTL протестували на 14 день, та клони CTL розмножили, застосовуючи такий самий спосіб, як описано вище. Специфічна CTL-активність Для дослідження специфічної CTL-активності виконували імуноферментний спот-аналіз IFNгама та ЕЛАЙЗА IFN-гама. Стисло кажучи, як клітини-стимулятори приготували імпульсно мічені пептидом A24-LCL або 4 Т2-клітини (1 × 10 /комірку). Як клітини-респондери застосовували культивовані клітини у 48 комірках або клони CTL після обмежувального розведення. Імуноферментний спот-аналіз IFNгама та ЕЛАЙЗА IFN-гама виконували згідно з інструкцією виробника. 25 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Отримання клітин, що примусово експресують або поокремо ген-мішень або HLA-A02 або HLA-A24, або разом ген-мішень та HLA-A02 або HLA-A24 кДНК, що кодує відкриту рамку зчитування генів-мішеней або HLA-A02 або HLA-A24, ампліфікували за допомогою ПЛР. Ампліфікований ПЛР продукт клонували у вектор рсDNA3.1 myc-His (Invitrogen). Плазмідами трансфектували клітки-мішені, клітинні лінії здорової людини COS7 або 293T HLA-A02 та HLA-A24-нуль, застосовуючи ліпофектамін (Invitrogen) згідно з процедурами, рекомендованими виробником. Альтернативно, плазмідами, що містили цільові гени, трансфектували A24-LCL за допомогою електропорації, застосовуючи GenePulserII 6 (Biorad). Стисло, 2,5 × 10 клітин A24-LCL імпульсно мітили 10 мкг плазмід при 140 В та 1000 мікрофарад. Через два дні після трансфекції трансфектовані клітини обробили розчином клітинного розпаду та застосовували як клітини-мішені для аналізу CTL-активності. Аналіз цитотоксичності 51 Цитотоксичну активність визначали за допомогою аналізу вивільнення Cr протягом 4 годин. Клітини-мішені імпульсно мітили пептидом, концентрація якого становила 20 мкг/мл, 51 протягом ночі. Клітини-мішені мітили 100 мкКі Na2 CrO4 при 37 °C протягом 1 години, а потім 4 тричі промили RPMI1640. Клітини-мішені (1 × 10 /100 мкл) та 100 мкл ефекторних клітин при різній кількості у загальному об'ємі 200 мкл розташували у титраційному мікропланшеті з 96 комірками з круглим дном (Corning) та культивували при 37 °C в інкубаторі СО2 протягом 4 годин. Після культивування узяли 100 мкл надосадової рідини з кожної комірки та вимірили радіоактивність, застосовуючи лічильник гама-частинок. Спонтанне вивільнення було радіоактивністю від клітин-мішеней з середовищем у відсутності ефекторних клітин, та максимальне вивільнення було радіоактивністю від клітин-мішеней з 1 M HCl. Відсоткове співвідношення специфічної цитотоксичності визначили за допомогою наступної формули: % специфічний лізис = [(експериментальне вивільнення спонтанне вивільнення)/(максимальне вивільнення - спонтанне вивільнення)]х100. РЕЗУЛЬТАТИ Підвищена експресія CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10 при різних видах раку Глобальні дані щодо профілю генної експресії, отримані від різних видів раку, для визначення яких застосовувалася кДНК-мікроматриця, дозволили виявити, що експресія наступних генів є підвищеною: CDH3 (GenBank Accession No. NM_001793; SEQ ID Nos.1, 2), EPHA4 (GenBank Accession No. L36645; SEQ ID Nos.3, 4), ECT2 (GenBank Accession No. AY376439; SEQ ID Nos.5, 6), HIG2 (GenBank Accession No. NM_013332; SEQ ID Nos.7, 8), INHBB (GenBank Accession No. NM_002193; SEQ ID Nos.9, 10), KIF20A (GenBank Accession No. NM_005733; SEQ ID Nos.11, 12), KNTC2 (GenBank Accession No. AF017790; SEQ ID Nos.13, 14), TTK (GenBank Accession No. NM_003318; SEQ ID Nos.15, 16) та URLC10 (GenBank Accession No. NM_017527; SEQ ID Nos.17, 18). Експресія CDH3 була значно підвищеною при наступних видах раку порівняно з відповідною здоровою тканиною: у 26 з 34 випадків раку сечового міхура, у 17 з 19 випадків раку шийки матки, у 19 з 19 випадків холангіокарциноми, у 30 з 34 випадків колоректального раку, у 20 з 21 випадку ендометріозу, у 13 з 20 випадків раку шлунку, у 7 з 8 випадків раку шлунка дифузного типу, у 36 з 37 випадків NSCLC, у 16 з 16 випадків раку підшлункової залози, у 21з 21 випадку пухлини м'якої тканини та у 10 з 10 випадків пухлини яєчка. Експресія ЕРНА4 була значно підвищеною при наступних видах раку порівняно з відповідною здоровою тканиною: у 14 з 34 випадків раку сечового міхура, у 8 з 14 випадків раку шийки матки, у 10 з 25 випадків холангіокарциноми, у 5 з 15 випадків ендометріозу, у 5 з 8 випадків раку шлунка дифузного типу, 26 UA 100372 C2 5 10 15 20 25 30 35 40 45 50 55 60 у 5 з 5 випадків раку яєчника, у 14 з 14 випадків раку підшлункової залози, у 20 з 51 випадку раку простати та у 14 з 23 випадків пухлини м'якої тканини. Експресія ЕСТ2 була значно підвищеною при наступних видах раку порівняно з відповідною здоровою тканиною: у 17 з 19 випадків раку сечового міхура, у 5 з 12 випадків раку молочної залози, у 14 з 14 випадків раку шийки матки, у 13 з 13 випадків холангіокарциноми, у 5 з 5 випадків хронічного мієлоїдного лейкозу, у 7 з 8 випадків колоректального раку, у 12 з 16 випадків раку стравоходу, у 6 з 16 випадків NSCLC, у 8 з 10 випадків лімфоми, у 1 з 1 випадку раку підшлункової залози, у 10 з 13 випадків раку простати, у 3 з 16 випадків раку нирки та у 12 з 13 випадків SCLC. Експресія HIG2 була значно підвищеною у 19 з 20 випадків раку нирки та у 7 з 9 випадків пухлини м'якої тканини порівняно з відповідною здоровою тканиною. Експресія INHBB була значно підвищеною при наступних видах раку порівняно з відповідною здоровою тканиною: у 10 з 21 випадку холангіокарциноми, у 12 з 12 випадків раку стравоходу, у 10 з 13 випадків NSCLC, у 22 з 24 випадків раку нирки, у 8 з 14 випадків SCLC та у 45 з 49 випадків пухлини м'якої тканини. Експресія KIF20A була значно підвищеною при наступних видах раку порівняно з відповідною здоровою тканиною: у 31 з 31 випадку раку сечового міхура, у 38 з 61 випадку раку молочної залози, у 10 з 11 випадків холангіокарциноми, у 7 з 19 випадків раку стравоходу, у 21 з 22 випадків NSCLC, у 6 з 6 випадків раку яєчника, у 17 з 36 випадків раку простати, у 6 з 11 випадків раку нирки та у 15 з 15 випадків SCLC. Експресія KNTC2 була значно підвищеною при наступних видах раку порівняно з відповідною здоровою тканиною: у 30 з 32 випадків раку сечового міхура, у 47 з 56 випадків раку молочної залози, у 10 з 10 випадків раку шийки матки, у 16 з 22 випадків холангіокарциноми, у 17 з 37 випадків хронічного мієлоїдного лейкозу, у 3 з 10 випадків колоректального раку, у 11 з 46 випадків раку стравоходу, у 15 з 19 випадків NSCLC, у 7 з 8 випадків лімфоми, у 20 з 24 випадків остеосаркоми, у 3 з 5 випадків раку яєчника, у 2 з 2 випадків раку підшлункової залози, у 15 з 37 випадків раку простати, у 14 з 19 випадків раку нирки, у 15 з 15 випадків SCLC та у 40 з 59 випадків пухлини м'якої тканини. Експресія ТТК була значно підвищеною при наступних видах раку порівняно з відповідною здоровою тканиною: 27 UA 100372 C2 5 10 15 20 25 у 27 з 27 випадків раку сечового міхура, у 25 з 30 випадків раку молочної залози, у 15 з 16 випадків раку шийки матки, у 10 з 10 випадків холангіокарциноми, у 5 з 7 випадків хронічного мієлоїдного лейкозу, у 6 з 10 випадків колоректального раку, у 24 з 44 випадків раку стравоходу, у 8 з 15 випадків раку печінки, у 12 з 12 випадків NSCLC, у 6 з 6 випадків лімфоми, у 13 з 16 випадків остеобластоми, у 12 з 17 випадків раку простати, у 15 з 15 випадків SCLC та у 16 з 33 випадків пухлини м'якої тканини. Експресія URLC10 була значно підвищеною при наступних видах раку порівняно з відповідною здоровою тканиною: у 29 з 29 випадків раку сечового міхура, у 15 з 16 випадків раку шийки матки, у 7 з 7 випадків холангіокарциноми, у 7 з 19 випадків раку стравоходу, у 3 з 3 випадків раку шлунка, у 24 з 27 випадків NSCLC, у 15 з 19 випадків остеосаркоми, у 4 з 5 випадків раку підшлункової залози, у 33 з 43 випадків пухлини м'якої тканини. Таблиця 1. Співвідношення випадків спостереження регулювання на підвищення вмісту CDH3, EPHA4, ECT2, HIG2, INHBB, KIF20A, KNTC2, TTK та URLC10 у раковій тканині порівняно з відповідною здоровою тканиною Рак сечового міхура Рак молочної залози Рак шийки матки Холангіокарцинома Хронічний мієлолейкоз Колоректальний рак Ендометріоз Рак стравоходу Рак шлунку Рак шлунку дифузного типу Рак печінки Недрібноклітинний рак легенів Лімфома Остеосаркома Рак яєчника Рак підшлункової залози Рак простати Рак нирки Дрібноклітинний рак легенів Пухлина м'якої тканини Пухлина яєчка CDH3 26/34 17/19 19/19 30/34 20/21 13/20 7/8 36/37 16/16 21/21 10/10 28 EPHA4 14/34 8/14 10/25 5/15 5/8 5/5 14/14 20/51 14/23 ECT2 17/19 5/12 14/14 13/13 5/5 7/8 12/16 6/16 8/10 1/1 10/13 3/6 12/13 HIG2 19/20 7/9 INHBB 10/21 12/12 10/13 22/24 8/14 45/49
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated peptide able to induce cytotoxic t cells and use thereof as vaccine
Автори англійськоюTsunoda, Takuya, Ohsawa, Ryuji
Назва патенту російськоюВыделенный пептид, способный индуцировать цитотоксические т-клетки, и его применение в качестве вакцины
Автори російськоюЦунода Такуя, Охсава Рюдзи
МПК / Мітки
МПК: A61P 35/00, C12N 5/10, G01N 33/68, A61K 38/04, C07K 7/00
Мітки: цитотоксичні, індукувати, т-клітини, здатний, застосування, вакцини, виділений, пептид
Код посилання
<a href="https://ua.patents.su/219-100372-vidilenijj-peptid-zdatnijj-indukuvati-citotoksichni-t-klitini-ta-jjogo-zastosuvannya-yak-vakcini.html" target="_blank" rel="follow" title="База патентів України">Виділений пептид, здатний індукувати цитотоксичні т-клітини, та його застосування як вакцини</a>
Попередній патент: Спосіб одержання біогазу при виготовленні цінного продукту, зокрема крохмалю, з борошна із зерна злакових культур
Наступний патент: Лікарський засіб у формі таблетки з протизапальною, аналгетичною та хондропротекторною дією
Випадковий патент: Система автоматичного відключення електромережі при сильному вітрі