Солі похідних тетрагідроімідазо[1,5-а]піразину, спосіб одержання (варіанти) і їх медичне застосування
Номер патенту: 106225
Опубліковано: 11.08.2014
Автори: Янг Фанглонг, Сун Піаоянг, Ліанг Джіндонг, Шен Гуангюан, Ванг Янг, Танг Пенг Чо, Фан Джянг
Формула / Реферат
1. Фармацевтично прийнятна сіль (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти,
де сіллю є кислотно-адитивна сіль, утворена органічною або неорганічною кислотою і (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбоновою кислотою, або основно-адитивна сіль, утворена органічною або неорганічною основою і (R)-7-[3-aмiно-4-(2,4,5-трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбоновою кислотою,
де кислотно-адитивну сіль вибирають з групи, що містить фосфат, малат і тартрат,
де основно-адитивну сіль вибирають з групи, що містить натрієву, літієву, калієву, кальцієву, магнієву, тетраметиламонієву, тетраетиламонієву, етаноламонієву сіль, холінову сіль, лізинову сіль, аргінінову сіль, метиламонієву, диметиламонієву сіль, триметиламонієву, триетиламонієву і етиламонієву сіль.
2. Сіль за пунктом 1, де кислотно-адитивною сіллю є фосфат.
3. Сіль за пунктом 2, де основно-адитивною сіллю є етаноламонієва сіль або холінова сіль.
4. Сіль за будь-яким з пп. 1-3, де сіль вибирають з:
 ,
,
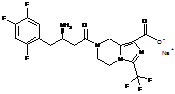 ,
,
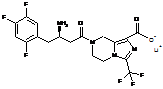 ,
,
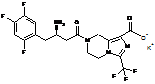 ,
,
 ,
,
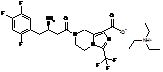 ,
,
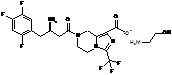 ,
,
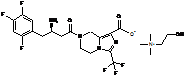 ,
,
 або
або
 .
.
5. Застосування солі за будь-яким з пп. 1-4 при одержанні медикаменту для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну.
6. Застосування солі за будь-яким з пп. 1-4 при одержанні медикаменту, що є інгібітором дипептидилпептидази (DPP-IV).
7. Спосіб лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну, де спосіб включає введення суб'єкту, що цього потребує, терапевтично ефективної дози солі за будь-яким з пп. 1-4.
8. Спосіб інгібування активності дипептидилпептидази, в якому здійснюють контактування дипептидилпептидази з сіллю за будь-яким з пп. 1-4.
9. Лікарський засіб для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну, який містить сіль за будь-яким з пп. 1-4.
10. Лікарський засіб, який містить сіль за будь-яким з пп. 1-4, як інгібітор дипептидилпептидази (DPP-IV).
11. Спосіб одержання солі за будь-яким з пп. 1-4, в якому (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти гідрохлорид піддають взаємодії з органічною або неорганічною кислотою, де органічну або неорганічну кислоту вибирають з групи, що містить фосфорну кислоту, малонову кислоту, винну кислоту.
12. Спосіб одержання солі за будь-яким з пп. 1-4, в якому (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти гідрохлорид піддають взаємодії з гідроксидом лужного металу, аміном або четвертинним амонієм, де гідроксид лужного металу вибирають з групи, що містить гідроксид натрію, гідроксид літію, гідроксид калію, гідроксид кальцію, гідроксид магнію, і амін або четвертинний амоній вибирають з групи, що містить тетраметиламоній, тетраетиламоній, етаноламін, холін, лізин, аргінін, метанамін, диметиламін, триметиламін, триетиламін і етиламін.
13. Фармацевтична композиція, що містить терапевтично ефективну кількість солі за будь-яким з пп. 1-4 або фармацевтично прийнятний носій.
14. Застосування композиції за пунктом 13 при виготовленні медикаменту для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну.
15. Спосіб лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну, де спосіб включає введення суб'єктові, що цього потребує, терапевтично ефективної дози фармацевтичної композиції за пунктом 13.
16. Лікарський засіб для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну, який містить композицію за п. 13.
Текст
Реферат: Описуються фармацевтичні солі (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)-бутаноїл]-3трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти, способи їх одержання, композиції, що містять згадані фармацевтичні солі, і їх застосування як медикаментів, особливо як інгібіторів дипептидилпептидази IV (DPP-IV). UA 106225 C2 (12) UA 106225 C2 UA 106225 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь винаходу Представлений винахід стосується фармацевтично прийнятних солей (R)-7-[3-аміно-4(2,4,5-трифторфеніл)-бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1карбонової кислоти, способів їх одержання, фармацевтичних композицій, що їх містять, і їх застосування як терапевтичного агента, зокрема, їх застосування як інгібітора дипептидилпептидази IV (DPP-IV). Передумови створення винаходу Діабет був описаний досить давно. Він є метаболічним захворюванням, що характеризується хронічною гіперглікемією внаслідок абсолютної або відносної нестачі інсуліну в тілі людини, що призводить до збільшення концентрацій глюкози в крові і драматичного вивільнення глюкози в сечу, що поєднується з розладом метаболізму цукру, ліпіду і протеїну, а у психологічному вираженні, у збільшенні вживання рідини, збільшення сечопускань, збільшенні вживання їжі, втраті ваги, запамороченні, слабкості і інших симптомах. Стійку або неконтрольовану гіперглікемію пов'язують із збільшенням захворюваності і смертністю. Часто ненормальний гомеостаз глюкози пов'язують безпосередньо або не безпосередньо із зміною метаболізму ліпіду, ліпопротеїну і аполіпротеїну і іншими метаболічними і гемодинамічними захворюваннями. Пацієнти з цукровим діабетом типу 2 мають підвищений ризик до макроваскулярних і мікроваскулярних ускладнень, таких як коронарна хвороба серця, інсульт, периферійне васкулярне захворювання, гіпертензія, нефропатія, нейропатія і ретинопатія і т.і.. Крім того, терапевтичний контроль гомеостазу глюкози, метаболізму ліпіду, гіпертензії і т.і. є дуже важливим для клінічного лікування цукрового діабету. Існують дві загально визнані форми діабету. При діабеті типу 1, тобто, інсулін-залежному цукровому діабеті (IDDM), пацієнти продукують досить мало або не продукують зовсім інсулін, що є гормоном, який регулює утилізацію глюкози. При діабеті типу 2, тобто, неінсулінзалежному цукровому діабеті (NIDDM), пацієнти часто мають в плазмі рівні інсуліну, що є такими ж самими або часто підвищеними порівняно із суб'єктами, що не страждають на діабет. Однак, ці пацієнти мають розвинуту резистентність до інсуліну, який має стимулювальну дію на метаболізм глюкози і ліпіду в основних інсулінчутдивих тканинах, таких як м'язи, печінка і 25 адипозних тканин і рівні інсуліну в плазмі, навіть, якщо підвищені, недостатні для подолання значної резистентності до інсуліну. Резистентність до інсуліну, головним чином, не обумовлена зменшенням кількості рецепторів інсуліну, але також дефектом зв'язування постінсулінового рецептора, що є досі незрозумілим. Ця резистентність до чутливості інсуліну призводить до недостатньої інсулінзалежної активації повторного поглинання, окислення і накопичення глюкози в м'язах і неадекватного пригнічення ліполізу в адипозній тканині і регулювання продукування глюкози і секретування в печінці. Дипептидилпептидаза-IV (DPP-IV) є серинпротеазою, що відщеплює N-термінальні дипептиди з поліпептиду, що містить залишок проліну в передостанньому положенні. Хоча біологічна роль DPP-IV у системах ссавців повністю не встановлена, припускають, що вона відіграє важливу роль в метаболізмі нейропептиду, активації Т-клітин, адгезії і інвазії ракових клітин до ендотелію і потрапляння ВІЛ у лімфоїдні клітини (WO98/19998). Нещодавно було відкрито, що DPP-IV відповідає за попередження секретування глюкагонподібного пептиду-1 (GLP-1). Більш особливо, DPP-IV відщеплює N-термінальний His-Ala дипептид в GLP-1, таким чином, перетворюючи активний GLP-1(7-36)NH2 на неактивний GLP1(9-36)NH2 (Endocrinology, 1999, 140: 5356-5363). За фізіологічних умов, час напіврозкладу цілого GLP-1 в циркулюючій крові є коротким. Неактивований метаболіт GLP-1 після деградації DPP-IV може зв'язуватись з GLP-1 рецепторами, таким чином, антагонізуючи дію GLP-1, і скорочуючи фізіологічні відповіді на GLP-1. Однак, інгібітори DPP-IV можуть захистити ендогенний або навіть екзогенний GLP-1 від інактивації і, таким чином, значно збільшити біоактивність GLP-1 (5-10-разів). Оскільки GLP-1 є основним стимулятором секретування панкреатичного інсуліну і має безпосередню сприятливу дію на видалення глюкози, інгібування DPP-IV являє собою привабливий підхід до лікування не-інсулін-залежного цукрового діабету (NIDDM) (US6110949). Хоча були описані деякі інгібітори DPP-IV, на сьогоднішній день відсутній ефективний лікарський засіб. Все ще необхідними є поліпшені інгібітори DPP-IV. Ціллю представленого винаходу є одержання ряду сполук, які є інгібіторами DPP-IV і можуть бути використані для лікування діабету або подібного захворювання або використані як паліативні лікарські засоби. 1 UA 106225 C2 5 10 15 20 25 30 35 Заявка PCT/CN2008/001936 подана заявником представленого винаходу 4 січня 2009 описує нові похідні тетрагідроімідазо[1,5-а]піразину і їх застосування як інгібітора DPP-IV. Прикладом 10, описаним в ній, був (/3)-7-[3-аміно-4-(2,4,5-трифтор- феніл)-бутаноїл]-3трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1 -карбонової кислоти гідрохлорид, для якого згідно з тестами була підтверджена відмінна інгібувальна активність щодо DPP-IV. Крім того, ця заявка була повністю включена сюди як посилання. Іншою ціллю представленого винаходу є одержання фармацевтично прийнятних солей сполук представлених формулою (І) і їх композицій для поліпшення їх розчинності, біодоступності, гіпоглікемічної активності і фармакокінетики. Короткий опис суті винаходу Представлений винахід стосується одержання нових фармацевтично прийнятних солей (R)7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5а]піразин-1-карбонової кислоти, способів їх одержання, фармацевтичних композицій, що їх містять і їх застосування, як терапевтичного агента, зокрема, їх застосування як інгібітора дипептидилпептидази IV. Солі сполук представлених формулою (І) мають відмінну активність при лікуванні діабету, поліпшену розчинність, добру активність і біодоступінсть in vivo, також як і нижчу токсичність і є добрими кандидатами при одержанні медикаменту для лікування діабету. Представлений винахід забезпечує фармацевтично прийнятні солі сполук формули (І). Термін "фармацевтично прийнятні солі" стосується фармацевтично нетоксичних кислотноадитивних солей або основноадитивних солей. Кислотноадитивними солями є солі утворені з сполук формули (І) і органічної або неорганічної кислоти, включаючи гідрохлорид, фосфат, гідрофосфат, сульфат, бісульфат, сульфіт, ацетат, оксалат, малонат, пентаноат, глутамат, олеат, пальмітат, стеарат, лаурат, борат, п-толуолсульфонат, метансульфонат, малат, тартрат, бензоат, памоат, саліцилат, ванілат, манделат, сукцинат, глюконат, лактобіонат і лаурилсульфонат, переважно фосфат. Основноадитивними солями є солі утворені з сполук формули (І) і органічної або неорганічної основи, включаючи солі утворені лужними металами, аміном або четвертинним амонієм, такі як натрієва сіль, літієва сіль, калієва сіль, кальцієва сіль, магнієва сіль, сіль за аміном, сіль з тетраметиламонієм, сіль з тетраетиламонієм, сіль з холіном, переважно, сіль з холіном. Аміносолями є солі сформовані з сполук формули (І) і аміну, включаючи амоній, первинний амін, вторинний амін і третинний амін, такі як метанамінова сіль, диметиламінова сіль, триметиламінова сіль, триетиламінова сіль, етиламінова сіль, етаноламінова сіль, лізинова сіль і аргінінова сіль, переважно етаноламінова сіль. Прикладами фармацевтично прийнятних солей сполуки формула (І) представленого винаходу є, але не обмежується ними: 2 UA 106225 C2 3 UA 106225 C2 4 UA 106225 C2 5 10 15 20 25 30 35 Реакції одержання згаданих вище солей зазвичай проводять при охолодженні, кімнатній температурі або нагріванні. Однак, слід відзначити, що температура реакції має деякий вплив на реакції одержання різних солей, які добре відомі середньому фахівцю в цій галузі. Температури реакцій утворення солей представленого винаходу знаходяться в інтервалі від кімнатної температури до температури кипіння реакційного розчинника, переважно 0~40°С. Фахівець в цій галузі може легко визначити найбільш придатну температуру реакції утворення солі використовуючи звичайні методики. Представлений винахід стосується способу одержання фармацевтично прийнятних солей сполуки формули (І), де спосіб включає утворення кислотноадитивних і основноадитивних солей. Спосіб одержання кислотноадитивних солей включає наступні стадії (R)-7-[3-аміно-4(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1карбонової кислоти гідрохлорид реагує з розчином лугу і потім одержана (R)-7-[3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонова кислота реагує з органічною або неорганічною кислотою, де органічну або неорганічну кислоту вибирають з групи, що містить хлорводневу кислоту, фосфорну кислоту, сірчану кислоту, сірчисту кислоту, оцтову кислоту, щавлеву кислоту, малонову кислоту, валеріанову кислоту, глутамінову кислоту, олеїнову кислоту, пальмітинову кислоту, стеаринову кислоту, лаурилову кислоту, борну кислоту, п-толуолсульфонову кислоту, метансульфонову кислоту, яблучну кислоту, винну кислоту, бензойну кислоту, памоїнову кислоту, саліцилову кислоту, ванілінову кислоту, манделову кислоту, бурштинову кислоту, глюконову кислоту, лактобіонову кислоту і лаурилсульфонову кислоту. Спосіб одержання основноадитивних солей включає взаємодію (R)7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5а]піразин-1-карбонової кислоти з гідроксидом лужного металу, заміщеним аміном або четвертинним амонієм, де гідроксид лужного металу вибирають з гідроксиду натрію, гідроксиду літію, гідроксиду калію, гідроксиду кальцію, гідроксиду магнію і амін або четвертинний амоній вибирають з групи, що містить тетраметиламоній, тетраетил амоній, етаноламін, холін, лізин, аргінін, метанамін, диметиламін, триметиламін, триетиламін і етиламін. Представлений винахід стосується застосування фармацевтично прийнятних солей сполуки формули (І) при одержанні медикаменту для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну. Представлений винахід стосується застосування фармацевтично прийнятних солей сполуки формули (І) при одержанні інгібітора дипептидилпептидази (DPP-IV). Представлений винахід стосується способу лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну, де спосіб включає введення суб'єктові терапевтично ефективної кількості фармацевтично прийнятних солей сполуки формули (I). 5 UA 106225 C2 5 10 15 20 25 30 35 40 45 50 55 60 Представлений винахід стосується способу інгібування каталітичної активності дипептидилпептидази IV, де спосіб включає контактування дипептидилпептидази IV з фармацевтично прийнятними солями сполуки формули (І). Представлений винахід стосується застосування фармацевтично прийнятних солей сполуки формули (І), як лікарського засобу при лікуванні діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну. Представлений винахід стосується застосування фармацевтично прийнятних солей сполуки формули (І), як лікарського засобу для інгібування дипептидилпептидази IV (DPP-IV). Представлений винахід стосується фармацевтичної композиції, яка містить терапевтично ефективну кількість фармацевтично прийнятної солі сполуки формули (І) і фармацевтично прийнятний носій. Представлений винахід також стосується застосування композиції при одержанні медикаменту для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну. Представлений винахід стосується способу лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну, де спосіб включає введення суб'єктові терапевтично ефективної кількості фармацевтичної композиції, що містить фармацевтично прийнятну сіль сполуки формули (І). Представлений винахід стосується застосування фармацевтичної композиції, що містить фармацевтичну сіль сполуки формули (І), як лікарського засобу при лікуванні діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну. Якщо не вказано інше, наступні терміни використовувані в описі і пунктах формули мають значення описані нижче. Термін "фармацевтична композиція" стосується суміші однієї або більше фармацевтично прийнятних солей сполуки описаної тут або їх проліків з іншими хімічними компонентами, такими як фізіологічно/фармацевтично прийнятні носії. Ціллю фармацевтичної композиції є полегшення введення сполуки в організм. Для того щоб досягти цілей винаходу, винахід використовую наступні технічні рішення: Спосіб синтезу сполуки формули (І) стосується способу одержання описаного в прикладі 10 заявки PCT/CN2008/001936, що подана заявником 27 листопада 2008. Таким чином, опис був повністю включений сюди як посилання. Спосіб одержання кислотно або основноадитивної солі (R)-7-[3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонової кислоти включає: Спосіб одержання кислотноадитивної солі включає взаємодію (R)-7-[3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонової кислоти гідрохлориду з лужним розчином і взаємодію одержаної (R)-7-[3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти з органічною або неорганічною кислотою; Спосіб одержання основноадитивної солі включає взаємодію (R)-7-[3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонової кислоти з органічною або неорганічною основою, такою як гідроксид лужного металу, заміщеним аміном або четвертинним амонієм в органічному розчиннику, що змішується з водою. Детальний опис винаходу Наступні приклади надалі ілюструють винахід, але не повинні розглядатись як обмеження винаходу. Структура сполук підтверджували за допомогою спектрів ядерного магнітного резонансу 1 1 1 ( НЯМР) або масспектроскопії (MC). H ЯМР зсув () приведений в м.ч.. H ЯМР знімали на пристрої Bruker AVANCE-400. Розчинниками були дейтерований метанол (CD3OD). Хімічні зсуви -6 приведені в 10 (м.ч.). MC визначали використовуючи масспектрометр FINNIGAN LCQAd (ECI) (виробник: Thermo, тип: Finnigan LCQ advantage MAX). Використовували пластинки з силікагелем для тонкошарової хроматографії Yantai Huanghai HSGF254 або Qingdao GF254. Пластинками використовуваними в ТШХ були 0,15 мм~0,2 мм і пластинками використовуваними при очищенні продуктів були 0,4 мм~0,5 мм. Для колонкової хроматографії зазвичай використовували силікагель Yantai Huanghai 200300 меш, як носій. Вихідні матеріали представленого винаходу відомі і одержували від ABCR GmbH & Co. KG, Acros Organics, Aldrich Chemical Company, Accela ChemBio lnc, Darui Finechemical Co., Ltd і т.і., або вони можуть бути одержані використовуючи загальноприйняті в цій галузі способи синтезу. 6 UA 106225 C2 Якщо не вказано інше, наступні реакції проводили в атмосфері азоту. "Атмосфера азоту" означає, що реакційна колба устаткована кулькою з азотом приблизно 1 л. "Атмосфера водню" означає, що реакційна колба устаткована кулькою з воднем приблизно 5 10 15 20 1 л. Якщо не вказано інше, розчин використовуваний в наступних реакціях стосується водного розчину. Якщо не вказано інше, температурою реакції була кімнатна температура. Прийнятною кімнатною температурою була 20°C ~ 30°С. Реакції прикладів контролювали використовуючи тонкошарову хроматографію (ТШХ). Система розчинників для розділення включає систему дихлорметан і метанол, систему гексан і етилацетат, систему петролейний ефір і етилацетат і ацетон. Співвідношення об'ємів розчинників коригували згідно з полярністю сполук. Система елюювання при колонковій хроматографії містила: А: дихлорметан і метанол, В: гексан і етилацетат. Співвідношення об'ємів розчинників коригували згідно з полярністю сполук і іноді також додавали аміак або оцтову кислоту. ВЕРХ стосується високоефективної рідинної хроматографії. ВЕРХ проводили використовуючи пристрій для високоефективної рідинної хроматографії Agilent 2695-2996 (колонка Gimini C18 150x4,6 мм). Умови ВЕРХ: час прогону: 30 хвилин; температура колонки: 30°C; PDA: 230 нм; Рухома фаза: метанол:вода (0,1% водний аміак) = 25:75; швидкість потоку: 1,0 мл/хв. Приклад 1 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти гідрохлорид 25 30 35 Стадія 1 2,2-Диметил-5-[2-(2,4,5-трифторфеніл)-ацетил]-[1,3]діоксані-4,6-діон 2,2-Диметил-[1,3]діоксані-4,6-діон (5,69 г, 39,5 ммоль) розчиняли в 400 мл дихлорметану при перемішуванні, після чого додавали 2,4,5-трифторфеніл оцтову кислоту 1а (7,15 г, 37,6 ммоль) і 4-диметиламінопіридин (7,35 г, 60,2 ммоль) на бані лід-вода. Потім краплями повільно додавали суспензію 1-(3-диметиламінопропіл)-3-етилкарбодііміду гідрохлориду (8,28 г, 43,2 ммоль) в 250 мл дихлорметану. Після перемішування при кімнатній температурі протягом 36 годин, реакційну суміш промивали 5% розчином бісульфату калію (250 мл7) і насиченим розсолом (250 мл2), сушили над безводним сульфатом магнію, фільтрували і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, 2,2-диметил-5-[2-(2,4,5трифторфеніл)-ацетил]-[1,3]діоксані-4,6-діон, 1b (11,4 г, вихід 96%) як білу тверду речовину. MC m/z (ECI): 315,5 [М-1]. 7 UA 106225 C2 5 10 15 20 25 30 35 40 45 50 55 Стадія 2 Етил 3-оксо-4-(2,4,5-трифтор-феніл)-бутират 2,2-Диметил-5-[2-(2,4,5-трифтор-феніл)-ацетил]-[1,3]діоксані-4,6-діон 1b (15,72 г, 49,6 ммоль) розчиняли в 280 мл етанолу при перемішуванні, потім реакційну суміш нагрівали при 70°C на масляній бані 12 годин. Після охолодження до кімнатної температури, суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі використовуючи систему В, як елюент, одержуючи вказану в заголовку сполуку, етил 3-оксо-4-(2,4,5-трифтор-феніл)-бутират, 1с (12 г, вихід 88%) як жовте масло. MC m/z (ECI): 259 [М-1]. Стадія 3 Етил 3-аміно-4-(2,4,5-трифторфеніл)-бут-2-еноат Етил 3-оксо-4-(2,4,5-трифтор-феніл)-бутират 1с (24,6 г, 94,5 ммоль) розчиняли в 240 мл метанолу і до розчину додавали амонію ацетат (36,4 г, 473 ммоль). Реакційну суміш нагрівали із зворотнім холодильником протягом 3 годин. Реакційну суміш концентрували при пониженому тиску і потім до залишку додавали 100 мл води. Суміш екстрагували етилацетатом (200 мл3) і об'єднану органічну фазу промивали 200 мл насиченого розсолу, сушили над безводним сульфатом магнію, фільтрували і концентрували при пониженому тиску одержуючи світло-жовту тверду речовину. Одержану тверду речовину розчиняли в 50 мл етилацетату при 80°C і потім до розчину додавали 50 мл н-гексану і кристал затравку. Суміш охолоджували до кімнатної температури і через пів години додавали 100 мл н-гексану. Суміш зберігали в холодильнику 12 годин і потім фільтрували одержуючи вказану в заголовку сполуку, етил 3-аміно-4-(2,4,5трифтор-феніл)-бут-2-еноат, 1d (19,5 г, вихід 80%) як білу тверду речовину. MC m/z (ECI): 260,1 [М+1]. Стадія 4 Етил 3-трет-бутоксикарбоніламіно-4-(2,4,5-трифтор-феніл)-бутират Етил 3-аміно-4-(2,4,5-трифтор-феніл)-бут-2-еноат 1d (4,1 г, 15,8 ммоль) додавали в автоклав, після чого додавали 70 мл метанолу, ді-трет-бутилдикарбонат (3,8 г, 17,4 ммоль), димер хлор(1,5-циклооктадієн)родію (І) (32 мг, 0,0632 ммоль) і (R)-1-[(S)-2(дифенілфосфіно)фероценіл]-етил-трет-бутилфосфін (68 мг, 0,13 ммоль). Реакційна суміш реагувала в атмосфері водню 24 години при тиску 6,67 атмосфери при 30°С. Суміш фільтрували і фільтрат концентрували при пониженому тиску. Потім до залишку при 50°C додавали 34 мл метанолу, після чого додавали 12 мл води після повного розчинення. Після охолодження до кімнатної температури, суміш зберігали в холодильнику 12 годин і потім фільтрували. Твердий продукт промивали сумішшю метанол/вода (о:о = 1:1), сушили у вакуумі одержуючи вказану в заголовку сполуку, етил 3-трет-бутоксикарбоніл-аміно-4-(2,4,5-трифторфеніл)-бутират, 1е (4 г, вихід 70%) як світло-жовту тверду речовину. MC m/z (ECI): 362,4 [М+1]. Стадія 5 (R)-3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифтор-феніл)-масляна кислота З посиланням на загальновідомий спосіб з Tetrahedron Asymmetry, 2006, 17(2), 205-209. 3трет-Бутоксикарбоніламіно-4-(2,4,5-трифтор-феніл)-масляної кислоти етиловий естер 1е (10 г, 27,7 ммоль) і гідроксид натрію (3,32 г, 83,1 ммоль) розчиняли в 150 мл суміші метанолу і води (о:о = 1:1). Реакційну суміш перемішували при 40-45°C 1-1,5 години, потім частину розчину упарювали при пониженому тиску. До залишку додавали малу кількість води, потім рН доводили до 2-3 1M хлорводневою кислотою на бані лід-вода. Суміш екстрагували етилацетатом (200 мл3) і об'єднану органічну фазу промивали 200 мл насиченого розсолу, сушили над безводним сульфатом натрію, фільтрували і концентрували при пониженому тиску і потім залишок перекристалізували з етилацетат/н-гексан одержуючи вказану в заголовку сполуку, (R)-3-трет-бутоксикарбоніламіно-4-(2,4,5-трифтор-феніл)-масляна кислота, 1f (9,2 г) як білу тверду речовину, яку безпосередньо використовували в наступній стадії. MC m/z (ECI): 332,3 [М-1]. Стадія 6 С-Піразин-2-іл-метиламін Піразин-2-карбонітрил 1g (10,5 г, 100 ммоль) розчиняли в 150 мл 1,4-діоксану, потім додавали нікель Ренея (1,0 г) в 250 мл автоклаві. Реакційна суміш реагувала в атмосфері водню 8 годин при тиску 40 атмосфер при 60°С, фільтрували і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, С-піразин-2-іл-метиламін, 1h (10,7 г, вихід 98%) як коричневе масло. MC m/z (ECI): 110 [М+1]. Стадія 7 2,2,2-Трифтор-N-піразин-2-ілметил-ацетамід 8 UA 106225 C2 5 10 15 20 25 30 35 40 45 50 55 С-Піразин-2-іл-метиламін 1h (10,9 г, 100 ммоль) додавали в реакційну колбу, потім краплями повільно протягом години при 0°C на бані лід-вода додавали 20 мл трифтороцтового ангідриду. Реакційна суміш реагувала при кімнатній температурі протягом 2 годин. Потім суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі використовуючи систему А, як елюент, одержуючи вказану в заголовку сполуку, 2,2,2-трифтор-N-піразин-2-ілметил-ацетамід, 1і (21,0 г) як коричневе масло. MC m/z (ECI): 206,1 [М+1]. Стадія 8 3-Трифторметил-імідазо[1,5-а]піразин 2,2,2-Трифтор-N-піразин-2-ілметил-ацетамід 1і (21,0 г, 100 ммоль) додавали в реакційну колбу, після чого додавали 100 мл оксихлориду фосфору. Після перемішування 30 хвилин, до розчину додавали пентаоксид фосфору (17,8 г, 125 ммоль). Реакційну суміш нагрівали із зворотнім холодильником протягом 5 годин. Суміш концентрували при пониженому тиску і реакційну систему гасили деіонізованою водою. Суміш доводили до рН 5-6 20% розчином гідроксиду натрію на бані лід-вода і потім екстрагували етилацетатом (250 мл4). Об'єднану органічну фазу сушили над безводним сульфатом магнію, фільтрували і концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі використовуючи систему А, як елюент, одержуючи вказану в заголовку сполуку, 3трифторметил-імідазо[1,5-а]піразин, 1j (12,0 г, вихід 65%) як жовту тверду речовину. MC m/z 1 (ECl): 188,0 [М+1]. H ЯМР (400 МГц, CDCI3, м.ч.): 9,15 (с, 1Н), 8,06 (д, 1Н), 7,92 (с, 1Н), 7,81 (д, 1Н). Стадія 9 3-Трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин 3-Трифторметил-імідазо[1,5-а]піразин 1j (12,0 г, 64,2 ммоль) розчиняли в 150 мл безводного етанолу, потім до розчину додавали 10% Pd/C (500 мг). Реакційну суміш перемішували при кімнатній температурі в атмосфері водню 12 годин. Реакційний розчин фільтрували через шар великозернистого силікагелю і фільтрат концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, 3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин, 1k (12,2 г, вихід 99%) як коричневу тверду речовину. 1 H ЯМР (400 МГц, CDCI3, м.ч.): 6,84 (с, 1Н), 4,10 (м, 4Н), 3,26 (м, 2Н), 1,81 (с, 1Н). Стадія 10 трет-Бутил (R)-[3-оксо-1-(2,4,5-трифтор-бензил)-3-(3-трифторметил-5,6-дигідро-8Hімідазо[1,5-а]піразин-7-іл)-пропіл]-карбамат (R)-3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифтор-феніл)-масляну кислоту 1f (8,6 г, 45 ммоль) і 9,4 мл триетиламіну розчиняли в 300 мл дихлорметану. Після перемішування протягом 5 хвилин, до розчину послідовно додавали 3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5а]піразин 1k (15,0 г, 45 ммоль) і біс(2-оксо-3-оксазолідиніл)фосфонікхлорид (17,1 г, 67,3 ммоль). Реакційна суміш реагувала 2 години і потім концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі використовуючи систему В, як елюент, одержуючи вказану в заголовку сполуку, трет-Бутил (R)-[3-оксо-1-(2,4,5-трифторбензил)-3-(3-трифторметил-5,6-дигідро-8Н-імідазо[1,5-а]піразин-7-іл)-пропіл]-карбамат, 1m (20,0 1 г, вихід 88%) як білу тверду речовину. H ЯМР (400 МГц, CD3OD, м.ч.): 7,25 (м, 1Н), 7,11 (м, 1Н), 7,032 (с, 1Н), 4,93 (м, 2Н), 4,35 (м, 3H), 4,05 (м, 2Н), 2,99 (м, 2Н), 2,73 (м, 2H), 1,34 (с, 9H). Стадія 11 трет-Бутил(R)-[3-оксо-1-(2,4,5-трифтор-бензил)-3-(1-бром-3-трифторметил-5,6-дигідро-8Німідазо[1,5-а]піразин-7-іл)-пропіл]-карбамат трет-Бутил(R)-[3-оксо-1-(2,4,5-трифтор-бензил)-3-(3-трифторметил-5,6-дигідро-8Hімідазо[1,5-а]піразин-7-іл)-пропіл]-карбамат 1m (20,0 г, 39,6 ммоль) розчиняли в 300 мл безводного етанолу і потім додавали до розчин N-бромсукцинімід (14,1 г, 79,2 ммоль). Після перемішування протягом години, додавали до суміші карбонат калію (10,9 г, 79,2 ммоль) і дітрет-бутилдикарбонат (8,6 г, 39,6 ммоль) і суміш перемішували протягом ще години. Реакційну суміш фільтрували через шар крупнозернистого силікагелю і потім фільтрат концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі використовуючи систему В, як елюент, одержуючи вказану в заголовку сполуку, трет-бутил (R)[3-оксо-1-(2,4,5-трифтор-бензил)-3-(1-бром-3-трифторметил-5,6-дигідро-8Н-імідазо[1,5а]піразин-7-іл)-пропіл]-карбамат, 1n (20,0 г, вихід 86%) як білу тверду речовину. 1 H ЯМР (400 МГц, CDCI3, м.ч.): 7,063 (м, 1Н), 6,88 (м, 1Н), 4,72 (с, 1Н), 4,56 (с, 1Н), 4,13 (м, 3H), 3,88 (м, 2Н), 2,94 (м, 2Н), 2,62 (м, 2H), 1,36 (с, 9H). Стадія 12 9 UA 106225 C2 5 10 15 20 25 30 35 40 Метил (R)-7-[3-трет-бутоксикарбоніламіно-4-(2,4,5-трифтор-феніл)-бутирил]-3трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-форміат З посиланням на Journal of Organometallic Chemistry, 1985, 285(1-3), 293-303. Октакарбонілдикобальт (4,02 г, 11,76 ммоль), етилхлорацетат (0,71 г, 5,88 ммоль), карбонат калію (1,62 г, 11,76 ммоль) і 50 мл метанолу додавали в реакційну колбу. Після перемішування протягом 5 хвилин, додавали трет-бутил (R)-[3-оксо-1-(2,4,5-трифтор-бензил)-3-(1-бром-3трифторметил-5,6-дигідро-8H-імідазо[1,5-а]піразин-7-іл)-пропіл]-карбамат 1n (2,3 г, 3,92 ммоль). Реакційну суміш перемішували при 60°C 2 години і потім концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі використовуючи систему В, як елюент, одержуючи вказану в заголовку сполуку, метил (R)-7-[3-третбутоксикарбоніламіно-4-(2,4,5-трифтор-феніл)-бутирил]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-форміат, 1q (1,1 г, вихід 50%) як білу тверду речовину. MC m/z (ECI): 565,0 [М+1]. Стадія 13 (R)-7-[3-трет-Бутоксикарбоніл-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-а]піразин-1-карбонова кислота Метил (R)-7-[3-трет-бутоксикарбоніламіно-4-(2,4,5-трифтор-феніл)-бутирил]-3трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-форміат 1р (1,8 г, 3,2 ммоль) розчиняли в 50 мл метанолу, після чого додавали 10 мл водного гідроксиду натрію (4 M). Реакційну суміш перемішували протягом 1 години. Реакційну суміш доводили до рН = 3-5 2 M хлорводневою кислотою на бані з льодом. Суміш екстрагували етилацетатом (100 мл3). Об'єднану органічну фазу сушили над безводним сульфатом магнію, фільтрували і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, (R)-7-[3-трет-бутоксикарбоніл-4-(2,4,5трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонова кислота, 1q (1,76 г, вихід 100%) як світло-жовту тверду речовину. MC m/z (ECI): 550,9 [М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,29-7,23 (м, 1Н), 7,121-7,08 (м, 1Н), 5,15-5,03 (м, 2Н), 4,414,06 (м, 5Н), 2,98-2,77 (м, 4Н), 1,42-1,26 (м, 9Н). Стадія 14 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти гідрохлорид (R)-7-[3-трет-Бутоксикарбоніл-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8тетрагідроімідазо[1,5-а]піразин-1-карбонову кислоту 1q (1,76 г, 3,2 ммоль) додавали до реакційної колби після чого додавали 10 мл етилацетатного хлороводню. Реакційну суміш перемішували протягом 1 години і потім концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, (R)-7-[3-аміно-4-(2,4,5-трифтор-феніл)-бутаноїл]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонової кислоти гідрохлорид, 1 (1,56 г, вихід 100%) як білу тверду речовину. MC m/z (ECI): 451,2 [М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,42-7,37 (м, 1Н), 7,28-7,23 (м, 1Н), 5,19-5,05 (м, 2Н), 4,364,29 (м, 1Н), 4,15-4,00(м, 2Н), 3,94-3,93(м, 2Н), 3,21-2,88 (м, 2Н), 2,86-2,81(м, 2Н). Приклад 2 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти фосфат 45 50 (R)-7-[3-Аміно-4-(2,4,5-трифтор-феніл)-бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти гідрохлорид 1 (1,45 г, 2,97 ммоль) розчиняли в 14 мл дихлорметану. Потім суміш промивали 6 мл водного бікарбонату натрію і водний шар екстрагували 5,6 мл дихлорметану. Об'єднану органічну фазу промивали 6 мл насиченого розсолу, сушили над безводним сульфатом натрію, фільтрували і концентрували при пониженому тиску одержуючи маслянистий залишок (1,38 г). Залишок розчиняли в 40 мл ізопропілового спирту після чого додавали розчин 85% фосфорної кислоти (342,8 мг, 2,97 10 UA 106225 C2 5 10 15 20 25 30 35 40 ммоль) в 2 мл ізопропілового спирту при перемішуванні до утворення твердої речовини. Після перемішування протягом 2 годин суміш фільтрували і фільтрувальний залишок промивали ізопропіловим спиртом і сушили при пониженому тиску при 40°C одержуючи неочищену сполуку (1,44 г, 88,6%). Неочищену сполуку (1,44 г, 2,63 ммоль) розчиняли в 26 мл ізопропілового спирту і перемішували 1 годину. Суміш фільтрували і фільтрувальний залишок промивали ізопропіловим спиртом. Тверду речовину розчиняли в деіонізованій воді. Суміш концентрували при пониженому тиску при 40°C і сушили у вакуумі при 40°C одержуючи вказану в заголовку сполуку, (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти фосфат, 2 (1,33 г, 92,6%) як білий порошок. MC m/z (ECI): 451,2 [М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,36-7,42 (м, 1Н), 7,19-7,25 (м, 1Н), 5,01-5,15 (м, 2Н), 4,244,34 (м, 2Н), 4,06-4,11 (м, 1Н), 3,91-3,98 (м, 1Н), 3,07-3,12 (м, 2Н), 2,8-3,09 (м, 2Н). Приклад 3 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонова кислота (R)-7-[3-Аміно-4-(2,4,5-трифтор-феніл)-бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти гідрохлорид 1 (1,02 г, 2,1 ммоль) розчиняли в 30 мл метанолу після чого додавали водний гідроксид натрію (2,1 мл, 2,1 ммоль). Реакцію перемішували протягом 15 хвилин. Реакційну суміш концентрували при пониженому тиску і одержану тверду речовину розчиняли в 15 мл суміші дихлорметан/метанол (о:о = 1:3). Суміш фільтрували і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, (R)-7-[3-аміно-4-(2,4,5-трифторфеніл) бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5а]піразин-1-карбонова кислота, 3 (943 мг, 100%) як білу тверду речовину. ВЕРХ: 99,89%. MC m/z (ECI): 451,2 [М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,32-7,41 (м, 1Н), 7,11-7,21 (м, 1Н), 5,00-5,07 (м, 2Н), 4,164,24 (м, 2Н), 4,05-4,08 (м, 1Н), 3,85-3,97 (м, 2Н), 3,05-3,17 (м, 2Н), 2,91-2,93 (м, 2Н). Приклад 4 Натрію (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбоксилат (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонову кислоту 3 (100 мг, 0,22 ммоль) розчиняли в 5 мл метанолу після чого додавали водний гідроксид натрію (0,44 мл, 0,22 ммоль). Реакцію перемішували протягом 15 хвилин. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, натрію (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбоксилат, 4 (104 мг, 99,7%) як білу тверду речовину. ВЕРХ: 99,65%. MC m/z (ECI): 451,2 [М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,26-7,30 (м, 1H), 7,08-7,13 (м, 1H), 5,00-5,20 (м, 2H), 4,264,27 (M, 2H), 4,00-4,11 (м, 2H), 3,44-3,48 (м, 1H), 2,72-2,83 (м, 2H), 2,59-2,60 (м, 2H). Приклад 5 Літію (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбоксилат 11 UA 106225 C2 5 10 15 20 25 30 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонову кислоту 3 (100 мг, 0,22 ммоль) розчиняли в 5 мл метанолу після чого додавали водний розчин гідроксиду літію (0,44 мл, 0,22 ммоль). Реакцію перемішували протягом 15 хвилин. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, літію (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбоксилат, 5 (48 мг, 98,6%) як білу тверду речовину. ВЕРХ: 99,66%. MC m/z (ECI): 451,2 [М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,31-7,38 (м, 1Н), 7,13-7,22 (м, 1Н), 5,07-5,27 (м, 2Н), 4,264,36 (м, 2Н), 4,01-4,15 (м, 2Н), 3,53-3,60 (м, 1Н), 2,80-2,91 (м, 2Н), 2,59-2,72 (м, 2Н). Приклад 6 Калію (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбоксилат (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонову кислоту 3 (100 мг, 0,22 ммоль) розчиняли в 5 мл метанолу після чого додавали водний гідроксид калію (0,44 мл, 0,22 ммоль). Реакцію перемішували протягом 15 хвилин. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, калію (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбоксилат, 6 (108 мг, 100%) як білу тверду речовину. ВЕРХ: 92,78%. MC m/z (ECI): 451,2[М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,31-7,38 (м, 1Н), 7,14-7,23 (м, 1Н), 5,07-5,27 (м, 2Н), 4,264,36 (м, 2Н), 4,01-4,15 (м, 2Н), 3,52-3,60 (м, 1Н), 2,80-2,92 (м, 2Н), 2,59-2,74 (м, 2Н). Приклад 7 Кальцію (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбоксилат (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонову кислоту 3 (100 мг, 0,22 ммоль) розчиняли в 10 мл метанолу після чого додавали водний розчин гідроксиду кальцію (8,1 мг, 0,11 ммоль). Суміш перемішували протягом 20 годин. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, кальцію (R)-7-[3-аміно-4-(2,4,5 12 UA 106225 C2 5 трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбоксилат, 7 (103 мг, 100%) як білу тверду речовину. ВЕРХ: 99,60%. MC m/z (ECI): 451,2 [М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,28-7,34 (м, 1Н), 7,11-7,21 (м, 1Н), 5,10-5,21 (м, 2Н), 4,224,36 (м, 2Н), 4,03-4,09 (м, 2Н), 3,55-3,59 (м, 1Н), 2,76-2,85 (м, 2Н), 2,60-2,71 (м, 2Н). Приклад 8 Триетиламонію (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8тетрагідро-імідазо[1,5-а]піразин-1-карбоксилат 10 15 20 25 30 35 40 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонову кислоту 3 (100 мг, 0,22 ммоль) розчиняли в 5 мл метанолу після чого додавали розчин триетиламіну в метанолі (0,767 мл, 0,22 ммоль, розчин одержували додаванням 1 мл триетиламіну до метанолу з утворенням 25 мл розчину триетиламіну в метанолі). Суміш перемішували протягом 40 годин. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, триетиламонію (R)-7-[3-аміно-4(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1карбоксилат, 8 (112 мг, 99,8%) як білу тверду речовину. ВЕРХ: 99,8%. MC m/z (ECI): 451,2 [М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,28-7,35 (м, 1Н), 7,10-7,19 (м, 1Н), 5,03-5,13 (м, 2Н), 4,174,25 (м, 2Н), 3,88-4,08 (м, 2Н), 3,70-3,73 (м, 1Н), 3,12-3,17 (м, 6Н), 2,93-2,95 (м, 2Н), 2,71-2,80 (м, 2Н), 1,27-1,30 (м, 9Н). Приклад 9 2-Гідроксиетиламонію (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбоксилат (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонову кислоту 3 (100 мг, 0,22 ммоль) розчиняли в 5 мл метанолу після чого додавали розчин етаноламіну в метанолі (0,33 мл, 0,22 ммоль, розчин одержували додаючи 1 мл етаноламіну до метанолу з утворенням 25 мл розчину етаноламіну в метанолі). Суміш перемішували протягом 40 годин. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, 2-гідроксиетиламонію (R)-7-[3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбоксилат, 9 (114 мг, 99,62%) як білу тверду речовину. ВЕРХ: 99,62%. MC m/z (ECI): 451,2[М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,27-7,32 (м, 1Н), 7,07-7,16 (м, 1Н), 4,96-5,17 (м, 2Н), 4,124,26 (м, 2Н), 3,91-4,09 (м, 2Н), 3,70-3,72 (т, 2Н), 3,56-3,57 (м, 1Н), 2,95-2,98 (т, 2Н), 2,80-2,89 (м, 2Н), 2,58-2,70 (м, 2Н). Приклад 10 2-Гідроксиетил(триметил)амонію (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбоксилат 13 UA 106225 C2 5 10 15 20 25 30 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонову кислоту 3 (100 мг, 0,22 ммоль) розчиняли в 5 мл метанолу після чого додавали розчин холіну в метанолі (1,55 мл, 0,22 ммоль, розчин одержували додаючи 1 мл холіну в метанол з утворенням 25 мл розчину холіну в метанолі). Суміш перемішували протягом 3 годин. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, 2-гідроксиетил(триметил)амонію (R)-7-[3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбоксилат, 10 (120 мг, 98,5%) як білу тверду речовину. ВЕРХ: 99,41%. MC m/z (ECI): 451,2 [М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,23-7,30 (м, 1Н), 7,06-7,15 (м, 1Н), 4,99-5,19 (м, 2Н), 4,194,26 (м, 2Н), 3,89-4,07 (м, 4Н), 3,60-3,71 (м, 1Н), 3,50-3,55 (м, 2Н), 3,21 (с, 9Н), 2,72-2,84 (м, 2Н), 2,55-2,66 (м, 2Н). Приклад 11 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти (25)-2-гідроксибутандіоат L-Яблучну кислоту (368 мг, 2,74 ммоль) розчиняли в 25 мл суміші метанол/вода (о:о = 4:1) з утворенням 0,11 M розчину використовуваного на наступних стадіях. (R)-7-[3-Аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонову кислоту 3 (100 мг, 0,22 ммоль) розчиняли в 10 мл метанолу після чого додавали 2 мл згаданого вище розчину. Суміш перемішували протягом 30 хвилин. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, (R)-7-[3-Аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонової кислоти (2S)-2-гідроксибутандіоат, 11 (129 мг, 98,92%) як білу тверду речовину. ВЕРХ: 98,92%. MC m/z (ECI): 451,1 [M+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,32-7,41 (м, 1H), 7,16-7,23 (м, 1H), 4,96-5,13 (м, 2H), 4,354,39 (м, 1H), 4,20-4,30 (м, 2H), 4,04-4,13 (м, 1H), 3,90-4,00 (м, 2H), 3,07-3,13 (м, 2H), 2,77-2,97 (м, 3H), 2,56-2,62 (м, 1H). Приклад 12 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти (2S,3S)-2,3-дипдроксибутандіоат 14 UA 106225 C2 5 10 15 20 25 30 35 D-винну кислоту (413 мг, 2,75 ммоль) розчиняли в 25 мл суміші метанол/вода (о:о = 4:1) з утворенням 0,11 M розчину використовуваного на наступних стадіях. (R)-7-[3-Аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонову кислоту 3 (100 мг, 0,22 ммоль) розчиняли в 10 мл метанолу після чого додавали 2 мл згаданий вище розчин. Суміш перемішували протягом 30 хвилин. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, (R)-7-[3-Аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонової кислоти (2S,3S)-2,3-дигідрокси-бутандіоат 12 (131 мг, 99%) як білу тверду речовину. ВЕРХ: 99,35%. MC m/z (ECI): 451,1 [М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,32-7,41 (м, 1Н), 7,17-7,26 (м, 1Н), 5,01-5,14 (м, 2Н), 4,51 (с, 1Н), 4,20-4,35 (м, 2Н), 4,00-4,13 (м, 1Н), 3,89-3,96 (м, 2Н), 3,04-3,13 (м, 2Н), 2,90-3,00 (м, 1Н), 2,77-2,87 (м, 1Н). Приклад 13 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти (2S)-2-аміно-5-гуанідинопентаноат L-Аргінін (239 мг, 1,37 ммоль) розчиняли в 25 мл суміші метанол/вода (о:о = 4:1) з утворенням 0,055 M розчину використовуваного на наступних стадіях. (R)-7-[3-Аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонову кислоту 3 (100 мг, 0,22 ммоль) розчиняли в 15 мл метанолу після чого додавали 4 мл згаданого вище розчину. Суміш перемішували протягом 4 годин. Реакційна суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, (R)-7-[3-Аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-а]піразин-1-карбонової кислоти (2S)-2-аміно-5-гуанідино-пентаноат, 13 (139 мг, 100%) як білу тверду речовину. ВЕРХ:98,89%. MC m/z (ECI): 451,1[М+1]. 1 H ЯМР (400 МГц, CD3OD, м.ч.): 7,24-7,32 (м, 1Н), 7,09-7,14 (м, 1Н), 4,98-5,18 (м, 2Н), 4,254,28 (м, 1Н), 4,18-4,19 (м, 1Н), 3,93-4,04 (м, 2Н), 3,50-3,54 (м, 2Н), 3,18-3,23 (м, 2Н), 2,76-2,87 (м, 2Н), 2,58-2,69 (м, 2Н), 1,77-1,90 (м, 2Н), 1,67-1,75 (м, 2Н). Приклади тестування: Визначення розчинності Згідно із звичайною методикою вимірювання розчинності, визначали розчинність тестованих сполук в чотирьох різних системах: салін забуферений фосфатом (PBS, рН = 7,4), метанол, 0,1% хлорводнева кислота і води. Результати показані в Таблиці 1: Таблиця 1 Приклад Приклад 1 Приклад 2 Приклад 3 Приклад 4 Приклад 5 Приклад 8 Приклад 9 Приклад 10 Приклад 11 Приклад 12 PBS (рН 7,4) 18,6 20,2 7,0 57,4 60,5 0,2 0,3 1,2 19,5 12,3 Значення розчинності (мг/мл) метанол 0,1%НСІ 31,3 17,2 37,5 32,5 32,7 20,5 46,7 94,8 50,3 100,6 20,1 8,3 35,2 12,6 40,3 15,2 5,4 32,6 0,5 33,8 15 вода 20,9 26,1 9,2 43,5 40,2 0,5 1,0 1,5 22,2 19,5 UA 106225 C2 5 10 15 20 25 30 35 Висновок: розчинність прикладу 2, прикладу 4 і прикладу 5 значно поліпшилась. Фармакологічні дослідження Тестували сполуки представленого винаходу для визначення їх DPP-IV, DPP-VIII, DPP-IX інгібувальної активності згідно з наступними методиками. Визначали концентрацію половинного інгібування IC50 (концентрація тестованої сполуки, що проявляє 50% інгібування активності ферменту) кожної сполуки використовуючи реакційний тест і розраховані фіксовані кількості ферменту і субстрату з декількома різними концентраціями тестованих сполук. Тестували сполуки представленого винаходу для визначення DPP-IV, DPP-VIII, DPP-IX інгібувальної активності в наступних тестах використовуючи Promega DPPIV-Glo™ Protease Assay (Кат № G8350/G8351) Kit, де: a. DPP-IV фермент одержували від Calbiochem, Каталожний №317630; b. DPP-VIII фермент одержували від Bioscience, Каталожний №80080; с. DPP-IX фермент одержували від Bioscience, Каталожний №80090. Методику одержання звичайного реагенту, такого як DPPIV-GIo буфер, реагентів люциферину необхідних в тесті і деталі проведення тесту можна одержати з опису набору. Дослідження проводили з наступною методикою: Тестовану сполуку розчиняли в ДМСО одержуючи ряд розчинів з різною концентрацією тестованої сполуки. DPPIV-GIo буфер і заморожений люцифериновий детектувальний реагент врівноважували до кімнатної температури. Люцифериновий детектувальний реагент розчиняли в середньому буфері в коричневій колбі з утворенням розчину. Потім DPP-IV-GIo розчиняли в надчистій воді одержуючи прийнятну концентрація. Субстратний розчин і розчин люциферинового детектувального реагенту добре змішували із прийнятним співвідношенням (співвідношення винаходу 1:49) і суміш залишали при кімнатній температурі на 30-60 хвилин. Змішували Tris буфер (2 мМ, рН 8,0), тестовані сполуки і DPP-IV (DPP-VIII або DPP-IX) і потім переносили до 96-лункового планшету. Кожен тест містив дві лунки з три лункового контролю. Однаковий об'єм ДМСО додавали до негативного контролю і бланкового контролю. Потім до 96лункового планшету додавали змішаний розчин люциферинового детектувального реагента і субстрату для початку реакції. 96-лунукові планшети інкубували при кімнатній температурі на шейкері планшетів 40 хвилин після висівання. Визначали силу флуоресцентного сигналу в кожній лунці використовуючи мікропланшетний зчитувач і розраховували коефіцієнт інгібування ферменту сполукою в цій концентрації за приведеною далі формулою: коефіцієнт інгібування: Kl= [1-(S-B)/(N-B)]*100% S: значення зразка В: значення бланкового контролю N: значення негативного контролю IC50 тестованих сполук можна розрахувати з коефіцієнтів інгібування при різних концентраціях. Таблиця 2 Приклад 1 2 3 4 5 8 9 10 11 12 40 45 IC50 (мкМ) DPP8 87,9 399,7 235,7 77,3 80,5 152,5 113,7 210,1 279,7 243,8 DPPIV 0,021 0,015 0,013 0,022 0,025 0,021 0,012 0,023 0,009 0,012 DPP9 63,6 185,0 125,4 42,3 50,6 135,6 128,3 165,6 180,1 135,5 Висновок: вільна форма або солі кожної із сполук проявляють відмінне інгібування активності DPP-IV. Сполука прикладу 2 проявляє більш переважну селективність. Фармакокінетичне дослідження Приклад тестування 1: Фармакокінетичне дослідження сполук представленого винаходу. 1. Ціль дослідження Сполуку Прикладу 3 вводили щурам у шлунок або ін'єкцією у хвостову вену, а сполуки Прикладів 1-4, Прикладу 9 і Прикладів 11-12 вводили у шлунок для визначення концентрації 16 UA 106225 C2 5 10 15 20 25 30 35 40 45 лікарського засобу в плазмі в різні моменти часу використовуючи РХ/МС/МС вимірювання. Досліджували і оцінювали фармокінетику сполук представленого винаходу у щурів. Також досліджували абсолютну оральну біодоступність. 2. Протокол 2.1 Зразки Сполуки Прикладів 1-4, Прикладу 9 і Прикладів 11-12. 2.2 Експериментальні тварини 28 здорових SD щурів, порівну самців і самиць, одержували від SINO-BRITSH SIPPR/BK LAB.ANIMAL LTD., CO, Ліцензійний номер: SCXK (Shanghai) 2008-0016. 2.3 Інструменти Масспектрометр АРІ 4000 Q-trap Linear Ion Mass Spectrometer, Applied Biosystems Corp., USA; Високоефективна рідинна хроматографія Agilent 1200, Agilent Corp., USA; 2.4 Одержання тестованих сполук Група введення у вену: необхідну кількість тестованої сполуки розчиняли в 0,5 мл ДМСО використовуючи ультразвук і потім розводили нормальним саліном до 15 мл з одержанням 0,3 мг/мл розчину. Група введення у шлунок: необхідну кількість тестованої сполуки розчиняли в 0,5% CMC-Na використовуючи ультразвук з одержанням 0,3 мг/мл суспензії. 2.5 Введення 32 здорових SD щурів, порівну самців і самиць, розділяли на 8 груп, так що кожна група містила 4 щури. Після ночі без їжі, щурам у вену ін'єктували сполуку Прикладу 3 і вводили у шлунок сполуку Прикладу 3 і її сіль, в дозі 3,0 мг/кг (розраховано для вільної форми) і об'ємі 10 мл/кг. 2.6 Відбір зразку Відбирали зразки крові (0,2 мл) у щурів в групі, якій вводили у вену, із зіниці перед введенням і після 2, 15, 30 хвилин і 1,0, 2,0, 4,0, 6,0, 8,0, 12,0, 24,0 годин після введення, які зберігали в гепаринізованих пробірках і центрифугували 10 хвилин при 3500 об/хв. Зразки плазми зберігали при -20°C до аналізу. Щурів годували через 2 години після введення. Відбирали зразки крові у щурів в групі, якій вводили у шлунок, перед введенням і через 0,5, 1,0, 2,0, 3,0, 4,0, 6,0, 8,0, 12,0, 24,0 годин після введення. Зразки обробляли таким же самим способом, як згадано вище. 2.7 Аналітичні способи 50 мкл внутрішнього стандартного розчину і 150 мкл метанолу додавали до 50 мкл плазми щурів одержаної в різні моменти часу після введення. Потім суміш перемішували З хвилини використовуючи змішувач і центрифугували 10 хвилин при 13500 об/хв. 10 мкл надосадкової рідини аналізували за допомогою РХ/МС/МС. 2.8 Розрахунок фармакокінетичних параметрів Для тестованих сполук була побудована окрема модель фармакокінетичних властивостей і були розраховані основні фармакокінетичні параметри використовуючи програмне забезпечення DAS 2.0, в якому були факточно виміряні значення Сmax і tmax. Розраховували абсолютну біодоступність використовуючи AUC0-t узятий після введення і ін'єкції у вену. 2. Результати фармакокінетичних параметрів Фармакокінетичні параметри сполук представленого винаходу показані в таблиці 3. Висновок: порівняно з іншими сполуками, фармакокінетичні властивості і біодоступність сполуки Прикладу 2 значно поліпшилась і сполука мала видатні фармакокінетичні властивості. Таблиця 3 Приклад F (%) (нг/мл) AUC0-t (нгг/мл) t1/2 (г) Tmax (г) MRT (г) CL/F (л/г/кг) Vz/F (л/кг) 1 2,90 18,0±7,5 66,6±19,5 1,74±0,16 2,50±1,00 3,17±0,36 45,6±11,5 114±27 2 8,63 66,6±36,4 198,1±57,4 1,69±1,24 0,92±0,58 4,05±3,66 16,2±4,55 41±29,7 13,4±5,6 58,3±17,3 2,73±0,73 1,00±0,00 4,45±1,01 51,7±16,0 193±38 вена 4 9 11 12 2,90 14,2±2,0 4,06 25,1±13,9 3,03 13,5±3,9 3,25 17,0±6,9 2295±353 2,35±1,90 0,22±0,06 1,33±0,20 6,05±6,53 66,6±10,6 93,2±36,4 69,5±25,2 74,6±21,7 2,65±0,94 3,18±0,71 2,21±0,69 2,54±0,86 1,75±0,96 1,25±0,50 1,63±1,11 1,75±0,50 4,30±0,60 4,34±0,66 4,50±1,32 4,23±0,84 43,7±7,1 32,9±10,0 46,6±17,7 40,3±9,9 164±56 155±63 140±39 154±77 17 UA 106225 C2 5 10 15 20 Попередня оцінка гіпоглікемічної дії сполук представленого винаходу 1. Ціль дослідження Для визначення дії на толерантність до оральної глюкози сполук Прикладу 1-4 і Прикладу 812 у нормальних ICR мишей (SINO-BRITSH SIPPR/BK LAB.ANIMAL LTD., CO), визначали гіпоглікемічну дію in vivo використовуючи вимірювач рівня глюкози в крові для вимірювання і аналізу вмісту цукру в зразках в різні моменти часу протягом 2 годин. Зразки відбирали з хвоста мишей. 2. Спосіб 2.1 Доза Доза, що вводилась, складала 10 мг/кг і як бланк вводили воду. Обидві групи містили 5% ДМСО. 2.2 Спосіб ведення Мишам вводили через рот під час годування. Вводили 4 г/кг 10% розчину глюкози (0,8 мл кожній миші) через 15 хвилин після введення. 2.3 Рівень цукру в крові Мишам вводили згадану вище дозу (бланковій групі вводили водний розчин 5% ДМСО) і вимірювали значення цукру в крові (-15 хвилин). Через 15 хвилин після введення, мишам вводили 4 г/кг 20% розчину глюкози і визначали значення цукру в крові використовуючи Roche ACCU-CHEK на 0, 15, 30, 45, 60, 120 хвилині. 2.4 Результати показані в таблиці 4: Таблиця 4 Приклад № 1 2 3 4 8 9 10 11 12 Гіпоглікемічний рівень цукру в крові на 30 хвилині після введення % (10 мг/кг) 16,06 29,96 25,60 9,49 19,82 27,56 20,92 20,18 24,11 Висновок: порівняно з іншими сполуками, сполука Прикладу 2 мала значну гіпоглікемічну дію. 25 ФОРМУЛА ВИНАХОДУ 30 35 40 1. Фармацевтично прийнятна сіль (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти, де сіллю є кислотно-адитивна сіль, утворена органічною або неорганічною кислотою і (R)-7-[3-аміно-4(2,4,5-трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1карбоновою кислотою, або основно-адитивна сіль, утворена органічною або неорганічною основою і (R)-7-[3-aмiно-4-(2,4,5-трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8тетрагідроімідазо[1,5-а]піразин-1-карбоновою кислотою, де кислотно-адитивну сіль вибирають з групи, що містить фосфат, малат і тартрат, де основно-адитивну сіль вибирають з групи, що містить натрієву, літієву, калієву, кальцієву, магнієву, тетраметиламонієву, тетраетиламонієву, етаноламонієву сіль, холінову сіль, лізинову сіль, аргінінову сіль, метиламонієву, диметиламонієву сіль, триметиламонієву, триетиламонієву і етиламонієву сіль. 2. Сіль за пунктом 1, де кислотно-адитивною сіллю є фосфат. 3. Сіль за пунктом 2, де основно-адитивною сіллю є етаноламонієва сіль або холінова сіль. 4. Сіль за будь-яким з пп. 1-3, де сіль вибирають з: 18 UA 106225 C2 F H2PO4 F NH3 + F F O O NH2 OH N F F F F O O NH2 O N F N N NH2 NH2 O N F F F F 2 , NH2 F N N OH O N H3N+ F F O O F , F OH N N N+ F F , F F NH2 F F O O NH2 OH N F F HO OH O F F F OH O N N NH O F OH N F O HO O O OH N N OH OH NH2 O O N N N O 30 Ca2+ F F 25 F F O , F N , N F F N NH+ F 20 F O O N N O N + F F O O F 15 N K O O F F 10 N F F 5 O F , F NH2 N + F F , F F O O Li + F F NH2 Na F F , F N N F F F O N N N O O F F або OH N H HO NH2 NH2 F F F . 5. Застосування солі за будь-яким з пп. 1-4 при одержанні медикаменту для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну. 6. Застосування солі за будь-яким з пп. 1-4 при одержанні медикаменту, що є інгібітором дипептидилпептидази (DPP-IV). 7. Спосіб лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну, де спосіб включає введення суб'єкту, що цього потребує, терапевтично ефективної дози солі за будь-яким з пп. 1-4. 8. Спосіб інгібування активності дипептидилпептидази, в якому здійснюють контактування дипептидилпептидази з сіллю за будь-яким з пп. 1-4. 9. Лікарський засіб для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну, який містить сіль за будь-яким з пп. 1-4. 10. Лікарський засіб, який містить сіль за будь-яким з пп. 1-4, як інгібітор дипептидилпептидази (DPP-IV). 11. Спосіб одержання солі за будь-яким з пп. 1-4, в якому (R)-7-[3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти гідрохлорид піддають взаємодії з органічною або неорганічною кислотою, де органічну або неорганічну кислоту вибирають з групи, що містить фосфорну кислоту, малонову кислоту, винну кислоту. 12. Спосіб одержання солі за будь-яким з пп. 1-4, в якому (R)-7-[3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-а]піразин-1-карбонової кислоти гідрохлорид піддають взаємодії з гідроксидом лужного металу, аміном або четвертинним амонієм, де гідроксид лужного металу вибирають з групи, що містить гідроксид натрію, гідроксид літію, гідроксид калію, гідроксид кальцію, гідроксид магнію, і амін або четвертинний амоній вибирають з групи, що містить тетраметиламоній, тетраетиламоній, етаноламін, холін, лізин, аргінін, метанамін, диметиламін, триметиламін, триетиламін і етиламін. 13. Фармацевтична композиція, що містить терапевтично ефективну кількість солі за будь-яким з пп. 1-4 або фармацевтично прийнятний носій. 14. Застосування композиції за пунктом 13 при виготовленні медикаменту для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну. 19 UA 106225 C2 5 15. Спосіб лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну, де спосіб включає введення суб'єктові, що цього потребує, терапевтично ефективної дози фармацевтичної композиції за пунктом 13. 16. Лікарський засіб для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну, який містить композицію за п. 13. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюSalts of tetrahydroimidazo[1,5-a]pyrazine derivatives, preparation methods and pharmaceutical use thereof
Автори англійськоюTang, Peng Cho, Sun, Piaoyang, Yang, Fanlong, Liang, Jindong, Shen, Guangyuan, Wang, Yang, Fan, Jiang
Автори російськоюТанг Пенг Чо, Сун Пиаоянг, Янг Фанглонг, Лианг Джиндонг, Шен Гуангюан, Ванг Янг, Фан Джянг
МПК / Мітки
МПК: A61P 3/04, C07D 487/04, A61K 31/4985, A61P 3/10
Мітки: спосіб, застосування, варіанти, медичне, солі, тетрагідроімідазо[1,5-а]піразину, одержання, похідних
Код посилання
<a href="https://ua.patents.su/22-106225-soli-pokhidnikh-tetragidroimidazo15-apirazinu-sposib-oderzhannya-varianti-i-kh-medichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Солі похідних тетрагідроімідазо[1,5-а]піразину, спосіб одержання (варіанти) і їх медичне застосування</a>
Попередній патент: Кристалічні інсулін-кон’югати
Наступний патент: Композиція внутрішньовим’яного ущільнювача соска та спосіб його застосування для зменшення або усунення візуальних дефектів у витриманих сирах
Випадковий патент: Спосіб охолодження оточуючим повітрям води системи оборотного водозабезпечення












