Рекомбінантна мікобактерія як вакцина для застосування на людях
Формула / Реферат
1. Вакцина проти туберкульозу для застосування на людях, що містить як активний інгредієнт рекомбінантну клітину бактерій Mycobacterium, яка є уреаза-дефіцитною і яка містить молекулу рекомбінантної нуклеїнової кислоти, що кодує гібридний поліпептид, який містить (а) антиген бактерій Mycobacterium, який містить пептидну послідовність, яка кодується нуклеотидами 121-153 послідовності SEQ ID NO: 1, причому цим антигеном бактерій Mycobacterium є Ag85B, або його імуногенний фрагмент, і (b) домен виходу з фаголізосоми, який містить пептидну послідовність, яка кодується нуклеотидами 211-1722 послідовності SEQ ID NO: 1, причому рекомбінантна клітина бактерій Mycobacterium являє собою рекомбінантну клітину бактерій Mycobacterium bovis датського штаму підтипу Prague, яка не несе гена стійкості до антибіотиків.
2. Вакцина за п. 1, призначена для введення суб′єкту, якому не вводили штам бактерій Mycobacterium.
3. Вакцина за п. 2, призначена для введення новонародженому.
4. Вакцина за п. 1, призначена для введення суб′єкту, якому попередньо вводили штам бактерій Mycobacterium.
5. Вакцина за будь-яким з пп. 1-4, що являє собою ліофілізат, факультативно разом з відновлювальною рідиною.
6. Вакцина за будь-яким з пп. 1-5, яка містить дозу приблизно
103-104 КУО, приблизно 104-105 КУО або приблизно 105-106 КУО.
7. Вакцина за будь-яким з пп. 1-6 для внутрішньошкірного введення.
8. Вакцина за будь-яким з пп. 1-7 для введення разовою дозою.
9. Вакцина за будь-яким з пп. 1-7 для введення двома або більше дозами.
10. Вакцина за будь-яким з пп. 1-9 для активації поліфункціональних CD4+Т-клітин.
11. Спосіб вакцинації людини проти туберкульозу, який включає введення фармацевтично ефективної дози рекомбінантної клітини бактерій Mycobacterium, яка є уреаза-дефіцитною та не несе гена стійкості до антибіотиків, і яка містить молекулу рекомбінантної нуклеїнової кислоти, що кодує гібридний поліпептид, який містить (а) антиген бактерій Mycobacterium, який містить пептидну послідовність, яка кодується нуклеотидами 121-153 послідовності SEQ ID NO: 1, причому цим антигеном бактерій Mycobacterium є Ag85B, або його імуногенний фрагмент, і (b) домен виходу з фаголізосоми, який містить пептидну послідовність, яка кодується нуклеотидами 211-1722 послідовності SEQ ID NO: 1, причому рекомбінантна клітина бактерій Mycobacterium являє собою рекомбінантну клітину бактерій Mycobacterium bovis датського штаму підтипу Prague.
Текст
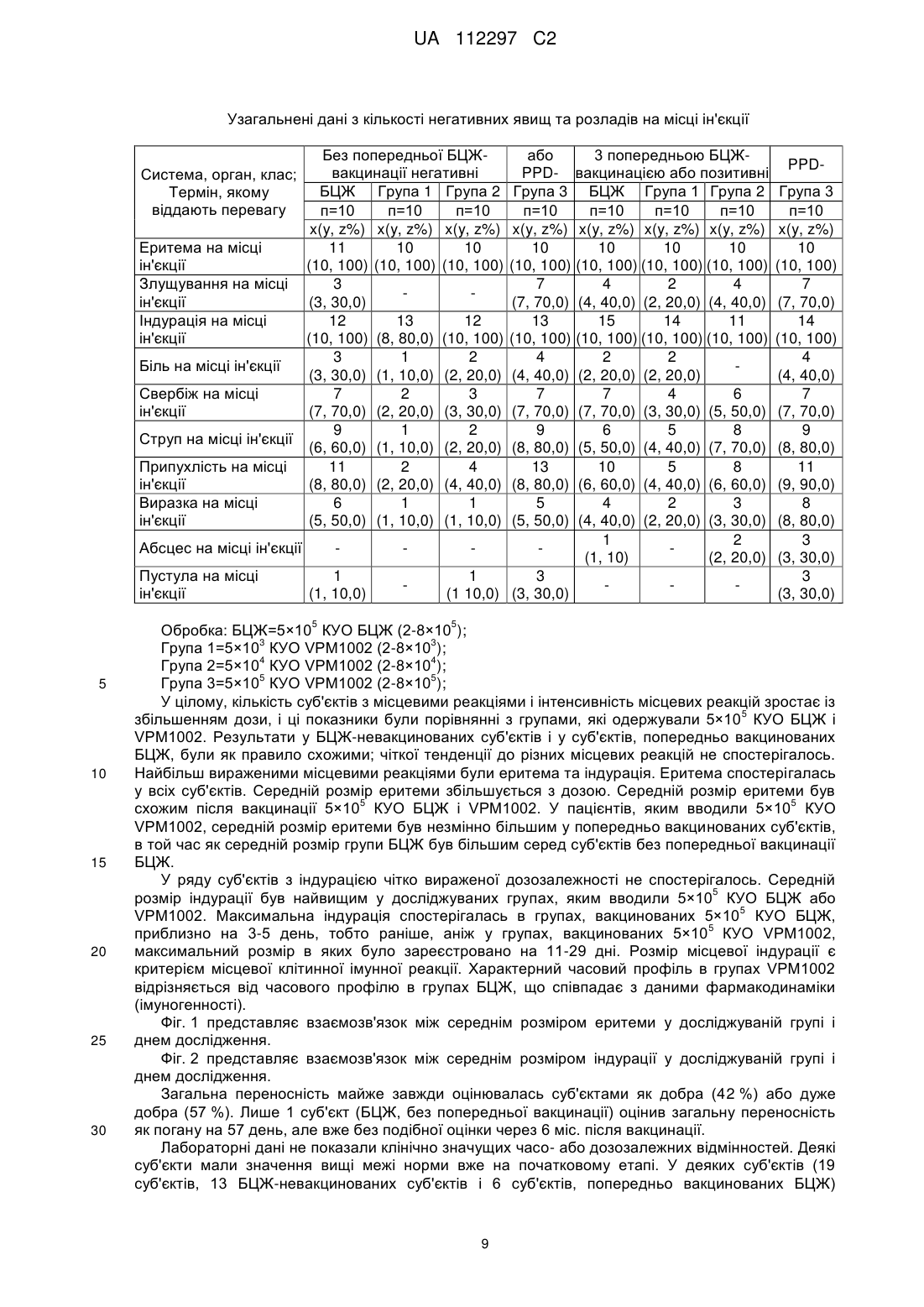
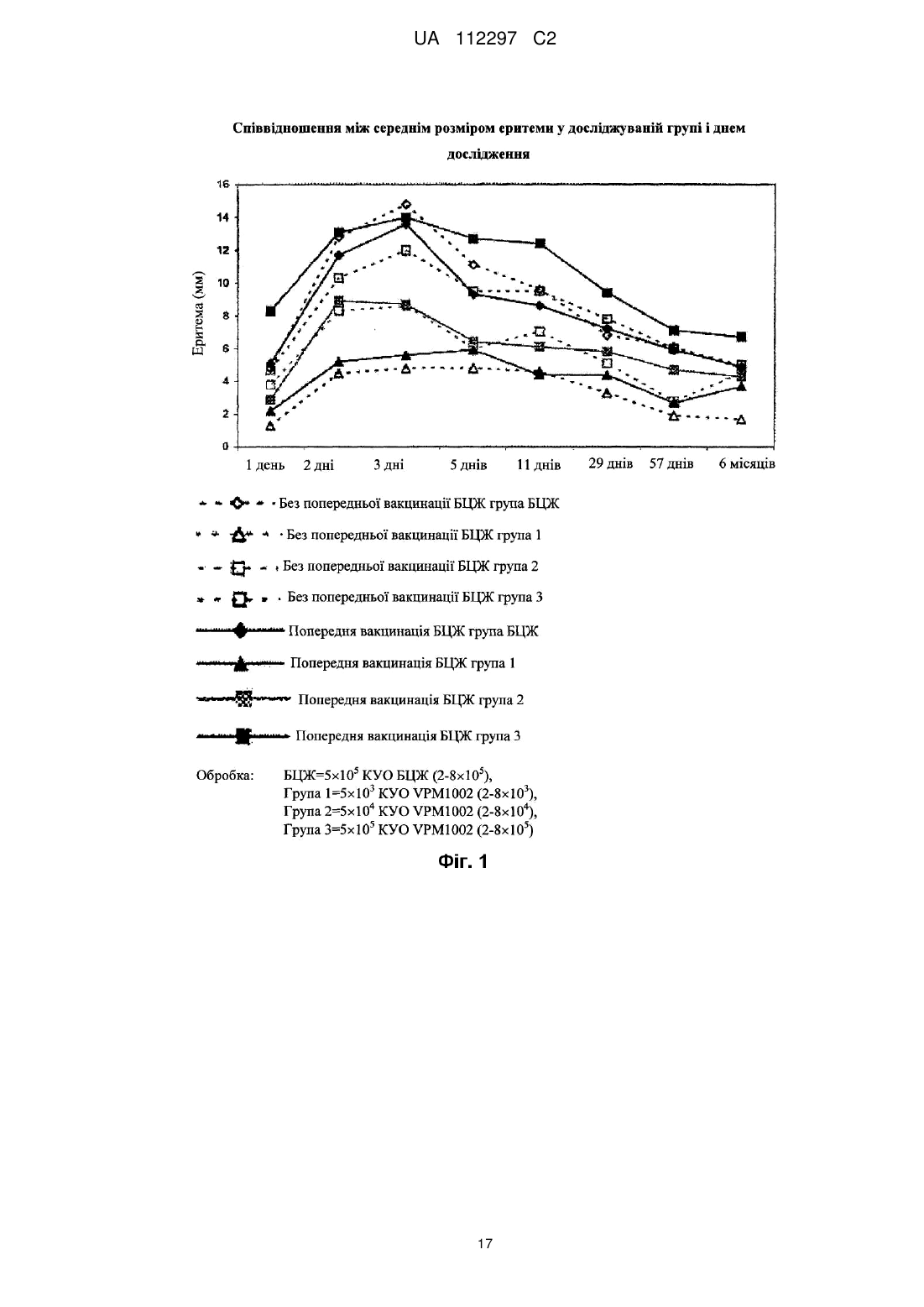
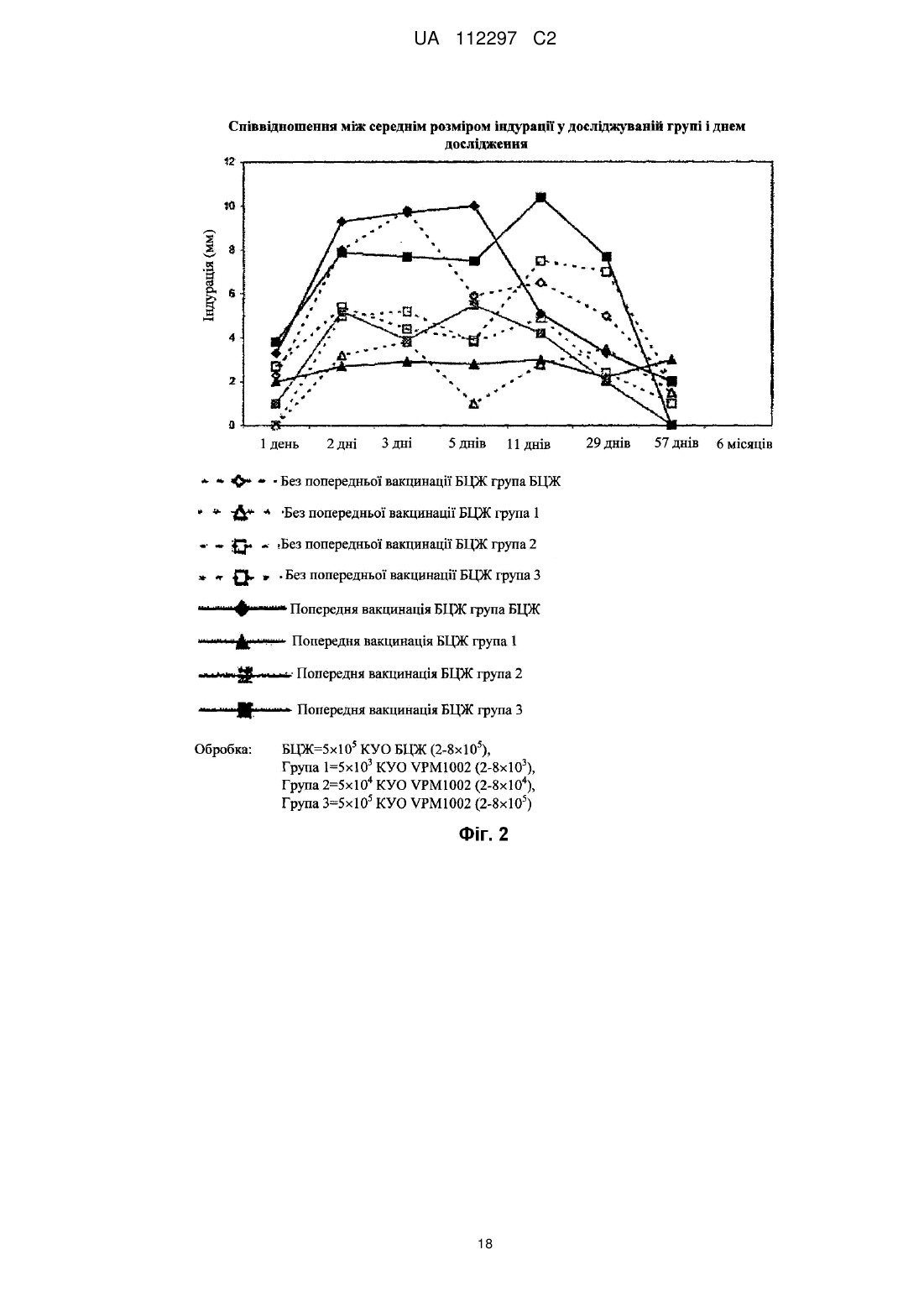
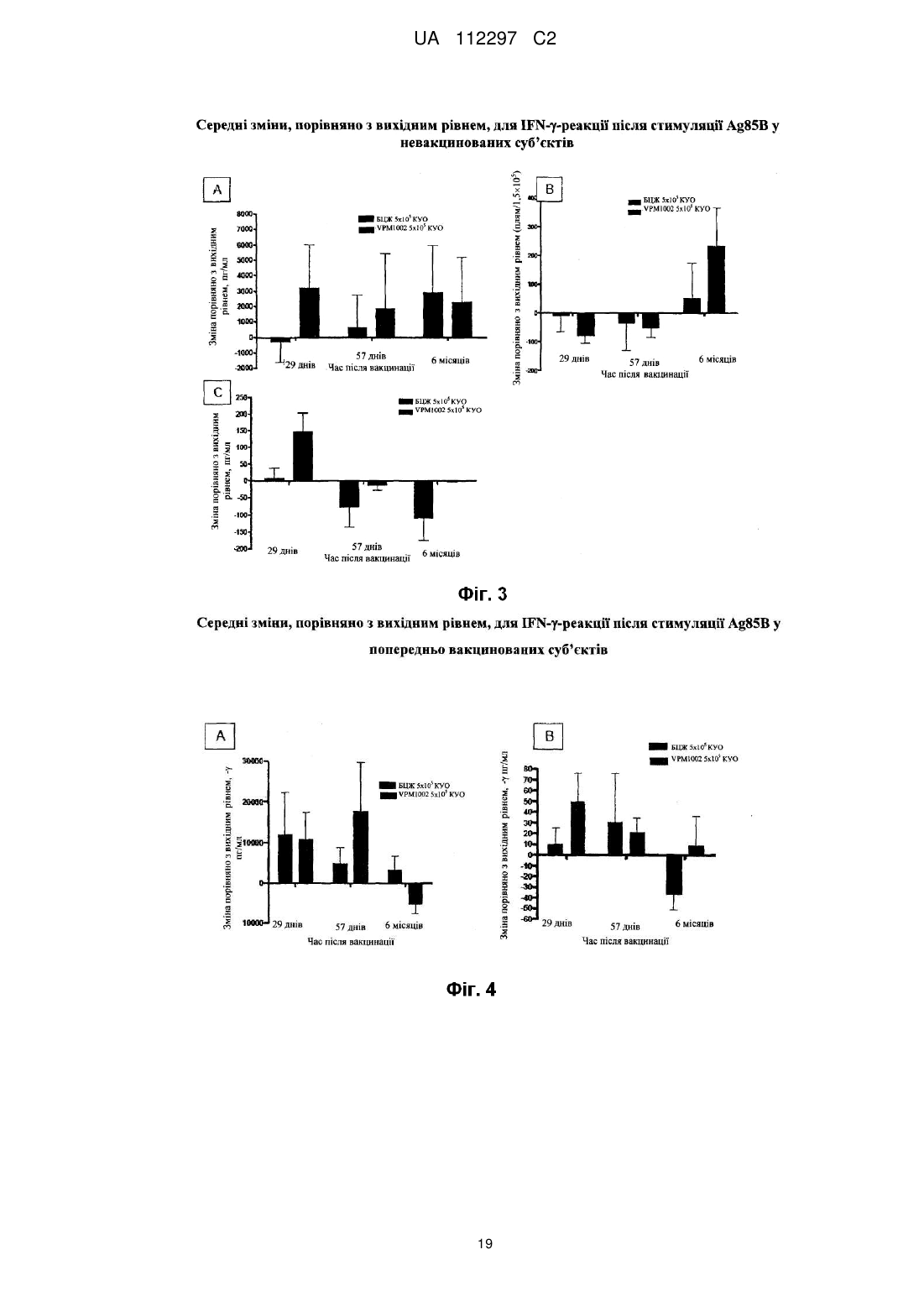
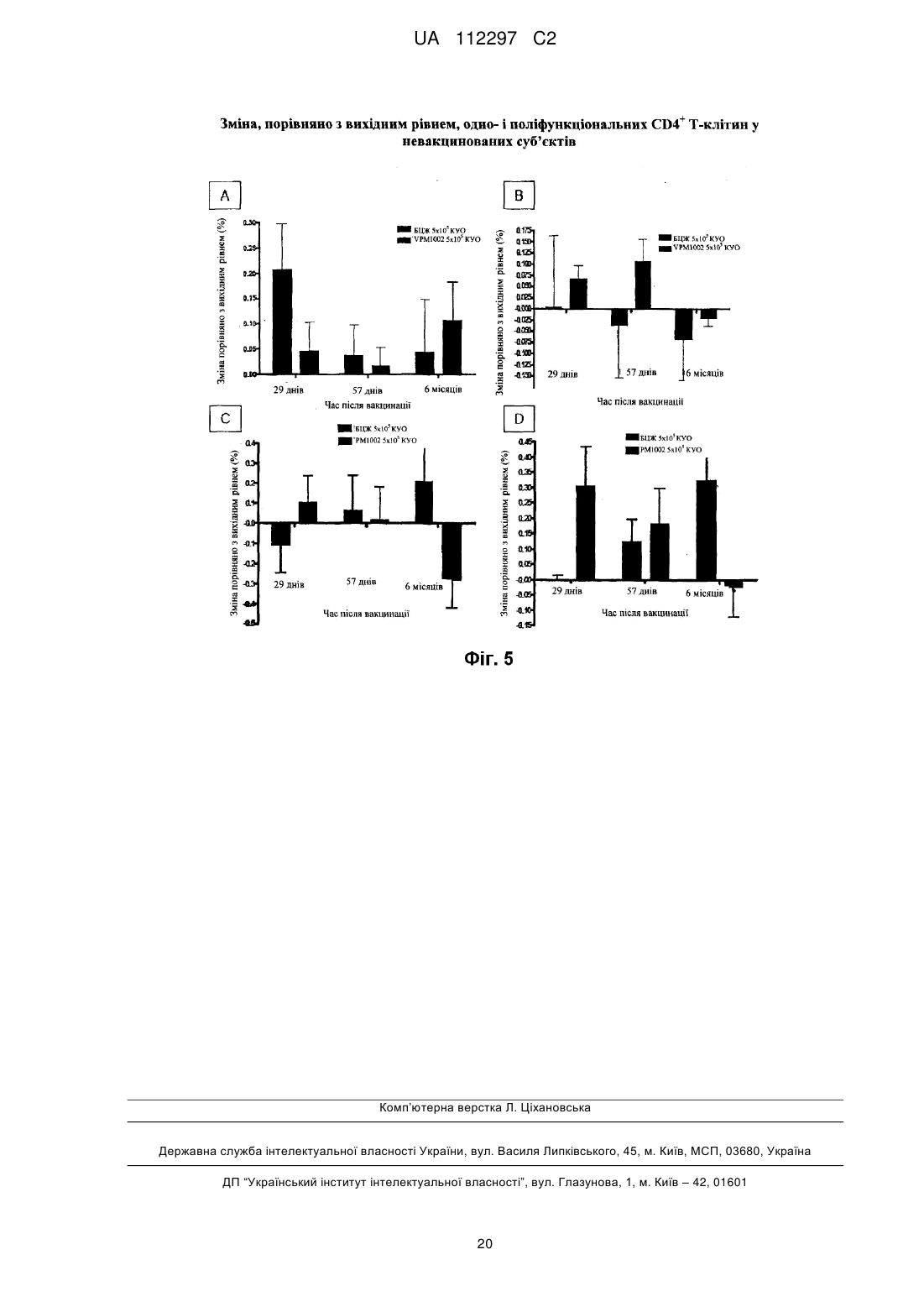
Реферат: UA 112297 C2 (12) UA 112297 C2 Винахід стосується вакцини проти туберкульозу для застосування на людях, що містить як активний інгредієнт рекомбінантну клітину бактерій Mycobacterium, яка є уреаза-дефіцитною і яка містить молекулу рекомбінантної нуклеїнової кислоти, що кодує гібридний поліпептид, який містить (а) антиген бактерій Mycobacterium, який містить пептидну послідовність, яка кодується нуклеотидами 121-153 послідовності SEQ ID NO: 1, причому цим антигеном бактерій Mycobacterium є Ag85B, або його імуногенний фрагмент, і (b) домен виходу з фаголізосоми, який містить пептидну послідовність, яка кодується нуклеотидами 211-1722 послідовності SEQ ID NO: 1, причому рекомбінантна клітина бактерій Mycobacterium являє собою рекомбінантну клітину бактерій Mycobacterium bovis датського штаму підтипу Prague, яка не несе гена стійкості до антибіотиків. UA 112297 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід стосується нової рекомбінантної вакцини, що забезпечує захисний імунітет, зокрема, проти туберкульозу, у людей. У 1993 році Всесвітня організація охорони здоров'я (ВООЗ) оголосила стан із захворюванням на туберкульоз (ТБ) глобальною надзвичайною ситуацією. У світі приблизно 2 мільярди людей інфіковані Mycobacterium tuberculosis, патогенним мікроорганізмом, що спричинює туберкульоз [1, 2]. Для усіх існує підвищений ризик розвитку клінічних симптомів захворювання. У більшості людей зараження Mycobacterium tuberculosis спочатку стримується захисними силами організму, і згадане зараження залишається прихованим. Тим не менш, приховане зараження туберкульозом здатне до перетворення на активну форму туберкульозу в будь-який час, і особи з активною формою туберкульозу стають джерелами нових інфекцій. В доповіді ВООЗ (2009) повідомлялось про 9,3 мільйона нових випадків захворювання у 2007 році, і цей показник постійно зростає [1]. Щороку від цієї хвороби вмирає близько 1,8 мільйона людей. Таким чином, туберкульоз продовжує залишатися провідною причиною смерті від інфекційних захворювань по всьому світу. BCG (БЦЖ, бацила Кальметта-Герена), атенуйований штам Mycobacterium bovis, застосовується як протитуберкульозна вакцина з 1921 року. На сьогоднішній день було введено близько 4 мільярдів доз [3]. Тим не менш, вакцинація БЦЖ є недостатньо ефективною щоб зупинити поширення туберкульозу. БЦЖ може захистити проти (або принаймні зменшити інтенсивність симптомів) важких форм системного туберкульозу у дітей, зокрема менінгіту. БЦЖ не захищає від легеневих та інфекційних форм вказаної хвороби [4]. Це, однак, було б необхідним для припинення передачі хвороби. Доступними є лише декілька методів антибіотичної терапії. Вони все частіше виявляються неефективними, оскільки все більше і більше пацієнтів інфікуються штамами туберкульозної палички, що мають стійкість до багатьох лікарських засобів [1, 5]. Ситуацію ще більше погіршує розповсюдження нових високопатогенних штамів, наприклад, пекінського штаму Mycobacterium tuberculosis (Beijing/W) [6]. Метою цього винаходу є створення безпечної, добре переносної і ефективної вакцини проти туберкульозу, особливо для мешканців ендемічних районів та осіб, що належать до групи підвищеного ризику в неендемічних районах. Ця вакцина повинна замінити застосовувану на цей час вакцину БЦЖ. Нова вакцина повинна бути щонайменше такою ж сильнодіючою, як і існуючий штам, і повинна бути безпечнішою ніж БЦЖ [5, 7]. Mycobacterium tuberculosis і БЦЖ фагоцитуються макрофагами хазяїна. Спрямована міграція антигену бактерій, завдяки його внутрішньофагосомальному знаходженню, здійснюється через шлях головного комплексу гістосумісності (МНС) II. Це призводить до + переважної стимуляції CD4 Т-клітин. Тим не менш було показано, що МНС І-рестриктовані + CD8 цитотоксичні Т-клітини відіграють ключову роль в імунітеті проти Mycobacterium tuberculosis [8, 9]. На відміну від Mycobacterium tuberculosis, БЦЖ індукує лише слабку + стимуляцію CD8 цитотоксичних Т-клітин [2, 3, 10]. У зв'язку з цим для спрямування антигенів бактерій Mycobacterium шляхом МНС І було створено рекомбінатний штам БЦЖ, що експресує домен виходу з фаголізосоми [2, 7]. Вказаний штам секретує лістеріолізин (Hly) L. monocytogenes [7, 11]. Це надає можливість згаданому штаму ухилятися від фагосом інфікованих клітин-хазяїв шляхом перфорації мембрани фагосоми. Інактивація гена уреази С була необхідною для забезпечення кислого фагосомального значення рН для оптимальної активності Hly. Перфорація сприяє переміщенню антигена у цитоплазму і полегшує перехресне приміювання через підвищений апоптоз [7, 9]. Цей процес дуже ефективно імітує індукцію імунітету Mycobacterium tuberculosis. Згаданий механізм дії, як очікується, уможливить створення ефективної і добре переносної вакцини проти туберкульозу. Ця ідея була описана в WO99/101496 та в WO 2004/094469, вміст яких включено до цього опису шляхом посилання. У цьому дослідженні рекомбінантна уреаза-дефіцитна вакцина БЦЖ була вперше застосована на людях. Це дослідження проводили з метою оцінки безпечності, місцевої та системної переносності, а також імуногенності вакцини. Вказане дослідження проводили за планом послідовного підвищення доз у порівнянні з наявною у продажу БЦЖ. Вісімдесят (80) суб'єктів в Німеччині були довільним чином розподілені на 4 групи, кожна з яких складається з 20 людей, з розшаруванням відповідно до анамнезу БЦЖ-вакцинації. На додаток до стандартного моніторингу безпечності, здійснювали інтенсивний моніторинг безпечності, що включав лабораторні показники, оцінку фізичної безпечності і докладний аналіз ЕКГ. Предметом цього винаходу є вакцина для застосування на людях, що містить як активний інгредієнт рекомбінантну бактерію Mycobacterium, яка є уреаза-дефіцитною і яка містить 1 UA 112297 C2 5 10 15 20 25 30 35 40 45 50 55 60 молекулу рекомбінантної нуклеїнової кислоти, що кодує гібридний поліпептид, який містить (а) антиген бактерій Mycobacterium або його імуногенний фрагмент, і (b) домен виходу з фаголізосоми. Ще одним предметом цього винаходу є спосіб вакцинації людини, який включає введення фармацевтично ефективної дози рекомбінантної бактерії Mycobacterium, яка є уреазадефіцитною і яка містить молекулу рекомбінантної нуклеїнової кислоти, що кодує гібридний поліпептид, який містить (а) антиген бактерій Mycobacterium або його імуногенний фрагмент, і (b) домен виходу з фаголізосоми. За варіантом здійснення, якому віддають особливу перевагу, послідовність ureC є інактивованою (ΔUrec), наприклад, шляхом конструювання вектора-самогубця, що містить зруйнований геном селекційного маркеру ген ureC, трансформації клітини-мішені вказаним вектором, і проведення скринінгу для вибору клітин, позитивних на селекційний маркер, що мають негативний з уреази фенотип [12]. Вказаною клітиною, за варіантом, якому віддають перевагу, є клітина M. bovis, клітина M. tuberculosis, зокрема, атенуйована клітина M. tuberculosis або клітина іншої бактерії Mycobacterium, наприклад, M. microti, M. smegmatis, M. canettii, M. marinum або M. fortuitum. За варіантом, якому віддають більшу перевагу, вказана клітина являє собою рекомбінантну клітину бактерій M. bovis (БЦЖ), зокрема, рекомбінантну клітину бактерій M. bovis датського штаму підтипу Prague [13]. За варіантом, якому віддають найбільшу перевагу, вказана клітина являє собою рекомбінантний датський штам БЦЖ підтипу Prague, що характеризується як rBCG + + AUrec: Hly : Hyg (VPM1002). Клітина бактерій Mycobacterium за цим винаходом містить молекулу рекомбінантної нуклеїнової кислоти, наприклад, молекулу нуклеїнової кислоти, представлену послідовністю SEQ ID NO: 1. Ця молекула нуклеїнової кислоти містить послідовність, що кодує сигнальний пептид (нуклеотиди 1-120), послідовність, що кодує імуногенний домен (нуклеотиди 121-153), послідовність, що кодує пептидний лінкер (нуклеотиди 154-210), послідовність, що кодує фаголізосомальний домен (нуклеотиди 211-1722), додаткову послідовність, що кодує пептидний лінкер (нуклеотиди 1723-1800) і послідовність, що кодує довільний пептид (нуклеотиди 18011870). Відповідна амінокислотна послідовність представлена послідовністю SEQ ID NO: 2. Домен, здатний викликати імунну відповідь, вибирають з-посеред імуногенних пептидів або поліпептидів M. bovis чи M. tuberculosis або з-посеред їхніх імуногенних фрагментів, що мають у довжину щонайменше 6 амінокислот, за варіантом, якому віддають перевагу, щонайменше 8 амінокислот. Конкретними прикладами відповідних антигенів є Ag85B (р30) M. tuberculosis (Harth et al., 1996), Ag85B (α-антиген) M. bovis БЦЖ (Matsuo et al., 1988), Ag85A M. tuberculosis (Huygen et al., 1996) та ESAT-6 M. tuberculosis (Sorensen et al., 1996, Harboe et al., 1996 і Andersen et al., 1995). За варіантом, якому віддають більшу перевагу, імуногенний домен є похідним антигену Ag85B. За варіантом, якому віддають найбільшу перевагу, імуногенний домен містить послідовність від аа.41 до аа.51 з послідовності SEQ ID NO: 2. Молекула рекомбінантної нуклеїнової кислоти також містить домен виходу з фаголізосоми, тобто поліпептидний домен, який забезпечує вихід гібридного поліпептиду з фаголізосоми в цитозоль клітин ссавців. За варіантом, якому віддають перевагу, домен виходу з фаголізосоми являє собою домен виходу з фаголізосоми Listeria, опис якого наведено у патенті США № 5,733,151, який включено до цього опису шляхом посилання. За варіантом, якому віддають більшу перевагу, домен виходу з фаголізосоми є похідним гена лістеріолізину (Hly) L.monocytogenes. За варіантом, якому віддають найбільшу перевагу, домен виходу з фаголізосоми кодується молекулою нуклеїнової кислоти, яку вибирають з-посеред: (а) нуклеотидної послідовності, що містить нуклеотиди 211-1722, як показано в послідовності SEQ ID NO: 1, (b) нуклеотидної послідовності, що кодує ту саму амінокислотну послідовність, що і послідовність з (а), і (с) нуклеотидної послідовності, що гібридизується у жорстких умовах з послідовністю (а) або (b). Окрім нуклеотидної послідовності, представленої послідовністю SEQ ID NO: 1, цей винахід також охоплює послідовності нуклеїнових кислот, що гібридизуються з нею. Термін "гібридизація" у цьому винаході вжитий як визначено у Sambrook et al. (Molecular Cloning. A laboratory manual, Cold Spring Harbor Laboratory Press (1989), 1.101-1.104). 3a цим винаходом термін "гібридизація" вжитий, якщо позитивний сигнал гібридизації все ще можна спостерігати після промивання протягом однієї години 1×SSC (розчин цитрату і хлориду натрію) і 0,1 % SDS (додецилсульфат натрію) при температурі 55 °C, за варіантом, якому віддають перевагу, при температурі 62 °C, і за варіантом, якому віддають більшу перевагу, при температурі 68 °C, зокрема, протягом 1 години 0,2×SSC і 0,1 % SDS при температурі 55 °C, за варіантом, якому віддають перевагу, при температурі 62 °C, і за варіантом, якому віддають більшу перевагу, при 2 UA 112297 C2 5 10 15 20 25 30 35 40 45 50 55 температурі 68 °C. Послідовність, що гібридизується з нуклеотидною послідовністю, представленою послідовністю SEQ ID NO: 1, за таких умов промивання, являє собою нуклеотидну послідовність, що кодує домен виходу з фаголізосоми, якій віддають перевагу за цим винаходом. Нуклеотидну послідовність, що кодує домен виходу з фаголізосоми, як описано вище, можна одержати безпосередньо з мікроорганізму роду Listeria або з будь-якого рекомбінантного джерела, наприклад, з рекомбінантної клітини Е. соlі, що містить відповідну молекулу нуклеїнової кислоти Listeria або її варіант, як описано вище. За варіантом, якому віддають перевагу, молекула рекомбінантної нуклеїнової кислоти, що кодує гібридний поліпептид, містить послідовність, що кодує сигнальний пептид. За варіантом, якому віддають більшу перевагу, вказаною сигнальною послідовністю є сигнальна послідовність, активна в бактеріях Mycobacteria, за варіантом, якому віддають перевагу, в M. bovis, наприклад, нативна сигнальна послідовність M. bovis. Прикладом відповідної сигнальної послідовності, якій віддають перевагу, є нуклеотидна послідовність, що кодує сигнальний пептид Ag85B, яку в послідовності SEQ ID NO: I представляють нуклеотиди 1-120. Крім того, бажано, щоб між імуногенним доменом і доменом виходу з фаголізосоми знаходився пептидний лінкер. За варіантом, якому віддають перевагу, вказаний пептидний лінкер має у довжину від 5 амінокислот до 50 амінокислот. За варіантом, якому віддають більшу перевагу, послідовність, що кодує лінкер, представлена у послідовності SEQ ID NO: 1 нуклеотидами 154-210 або відповідною їй послідовністю, з урахуванням виродженості генетичного коду. Нуклеїнова кислота може бути розміщена на рекомбінантному векторі. За варіантом, якому віддають перевагу, вказаним рекомбінантним вектором є прокаріотний вектор, тобто вектор, що містить елементи для реплікації та/або геномної інтеграції в прокаріотних клітинах. За варіантом, якому віддають перевагу, вказаний рекомбінантний вектор несе молекулу нуклеїнової кислоти за цим винаходом, функціонально пов'язану з послідовністю контролю експресії. Вказаною послідовністю контролю експресії за варіантом, якому віддають перевагу, є послідовність контролю експресії, активна в бактеріях Mycobacteria, зокрема, в M. bovis. Вказаний вектор може бути екстрахромосомним вектором або вектором, прийнятним для інтеграції до хромосоми. Приклади таких векторів відомі фахівцям в цій галузі і наводяться, наприклад, у Sambrook et al., дивись вище. В певних варіантах здійснення цього винаходу рекомбінантна клітина бактерій Mycobacterium може нести ген стійкості до антибіотиків, наприклад, ген стійкості до гігроміцину (Hyg). В інших варіантах здійснення винаходу рекомбінантна клітина бактерій Mycobacterium не несе гена стійкості до антибіотиків. За варіантом, якому віддають перевагу, вакцина являє собою живу вакцину для застосування на людях, наприклад, для застосування на мешканцях районів, ендемічних з інфекцій бактерій Mycobacterium, наприклад, туберкульозу, або для застосування на особах, що належать до групи підвищеного ризику в неендемічних районах. Вакцина може бути призначеною для введення суб'єкту, якому не вводили штаму бактерій Mycobacterium, наприклад, штаму БЦЖ, наприклад, людині, якій раніше не вводили імуногенного штаму бактерій Mycobacterium, або людині, яку раніше не вакцинували БЦЖ. Прикладами таких суб'єктів є, наприклад, новонароджені або діти, наприклад, віком до 8 років, наприклад, у районах, ендемічних з інфекцій бактерій Mycobacterium, наприклад, туберкульозу, або особи, що належать до групи підвищеного ризику в неендемічних районах. Вакцина є особливо придатною для введення суб'єктам з ВІЛ-позитивними батьками, наприклад, матерями. Вакцину можна вводити суб'єктам, яким не вводили штаму бактерій Mycobacterium, наприклад, штаму БЦЖ, у групі населення ендемічній з ВІЛ-інфекції. За іншими варіантами здійснення вакцина може бути призначеною для введення суб'єкту, якому попередньо вводили штам бактерій Mycobacterium, наприклад, штам БЦЖ, наприклад, дітям віком від 9 років або дорослим, що проживають, наприклад, у районах, ендемічних з туберкульозу, або суб'єктам, попередньо вакцинованим БЦЖ. У таких суб'єктів вакцина за цим винаходом діє як ревакцинація на вже існуючий імунний статус, індукований БЦЖ. У ще одному варіанті здійснення, якому віддають перевагу, результатом введення вакцини є підвищена гамма-інтерферонова (IFN-γ-) реакція у невакцинованих або попередньо + + вакцинованих суб'єктів та активація CD4 Т-клітин, зокрема, поліфункціональних CD4 Т-клітин. За варіантом, якому віддають перевагу, вакцина являє собою ліофілізат, що містить клітину бактерій Mycobacterium і факультативно агенти, наприклад, глюкозу та/або декстран. Факультативно вакцина додатково містить відновлювальну рідину - воду для ін'єкцій або 3 UA 112297 C2 3 5 10 15 20 25 30 35 40 45 50 55 60 фізіологічний розчин. За деякими прикладами здійснення, вакцина містить дозу приблизно 10 4 4 5 5 6 10 КУО (колонієутворювальних одиниць), приблизно 10 -10 КУО або приблизно 10 -10 КУО. Може бути вибраним введення на поверхню слизової оболонки (наприклад, очної, інтраназальної, ротової порожнини, шлунка, кишечника, прямої кишки, вагінальної або сечовивідних шляхів) або парентеральним шляхом (наприклад, підшкірно, внутрішньошкірно, внутрішньом'язово, внутрішньовенно або внутрішньоочеревинно). Особливо переважним є внутрішньошкірне введення. В певних варіантах здійснення цього винаходу вакцина призначена для введення однією дозою, в тому числі для імунізації суб'єктів, яким не вводили штаму бактерій Mycobacterium, або ревакцинацію суб'єктів, яким попередньо вводили штам бактерій Mycobacterium, наприклад, суб'єктів, які були попередньо вакциновані вакциною на основі штаму бактерій Mycobacterium, наприклад, нативною вакциною БЦЖ для суб'єктів, які контактували з бактерією Mycobacterium, наприклад, патогенною бактерією Mycobacterium перед введенням вакцини за цим винаходом. Альтернативно вакцина за цим винаходом може вводитись двома або декількома дозами. Відповідні дози можуть вводитись з інтервалами від приблизно 1 тижня до 6 місяців або довше. Вакцина за цим винаходом призначена для застосування проти інфекцій бактерій Mycobacterium, конкретніше, для застосування проти туберкульозу. Далі винахід буде додатково проілюстрований наведеними фігурами, лістингами послідовностей та прикладами. Фіг. 1: Співвідношення між середнім розміром еритеми у досліджуваній групі і днем дослідження. Фіг. 2: Співвідношення між середнім розміром індурації у досліджуваній групі і днем дослідження. Фіг. 3: Середні зміни, порівняно з вихідним рівнем, для IFN-γ-peaKnii після стимуляції Ag85B у невакцинованих суб'єктів. A. РВМС ELISA для IFN-γ, B. ELISpot, C. Аналіз цільної крові (ELISA) на IFN-γ. 5 Всі аналізи були стимульовані Ag85B, 2 мкг/мл. Група VPM1002 (5×10 ) - стовпчики червоного кольору, група БЦЖ - стовпчики синього кольору. Стимуляція: Ag 85В, 2 мкг/мл. VPM1002 посилює IFN-γ-реакцію. Фігура 4: Середні зміни, порівняно з вихідним рівнем, для IFN-γ-реакції після стимуляції Ag85B у попередньо вакцинованих суб'єктів. A. PBMC ELISA для IFN-γ, B. Аналіз цільної крові (ELISA) на IFN-γ. 5 Всі аналізи були стимульовані Ag85B, 2мкг/мл. Група VPM1002 (5×10 ) - стовпчики червоного кольору, група БЦЖ - стовпчики синього кольору. Стимуляція: Ag 85В, 2 мкг/мл. VPM1002 посилює IFN-γ-реакцію. + Фігура 5: Зміна, порівняно з вихідним рівнем, одно- і поліфункціональних CD4 T-клітин у невакцинованих суб'єктів. + A. Частота однофункціональних позитивних CD4 Т-клітин (експресія IFN-γ), повторно стимульованих PPD. + B. Частота поліфункціональних CD4 Т-клітин (експресія IFN-γ та IL-2), повторно стимульованих Ag85B. + C. Частота поліфункціональних CD4 Т-клітин (експресія IFN-γ, IL-2 та TNF-a), повторно стимульованих PPD. D. Повторно стимульовані Ag85B визначали засобами FACS ICS РВМС від дорослих, вакцинованих VPM1002 (червоний колір) або БЦЖ (синій колір). Послідовність SEQ ID NO: 1: показує нуклеотидну послідовність молекули нуклеїнової кислоти, що кодує антиген бактерій Mycobacterium 85B і лістеріозний домен виходу з фаголізосоми. Послідовність SEQ ID NO: 2: показує відповідну амінокислотну послідовність молекули нуклеїнової кислоти, представленої послідовністю SEQ ID NO: 1. Приклад І фаза клінічних випробувань для оцінки безпечності та імуногенності вакцини за цим винаходом (VPM1002) у порівнянні з БЦЖ на здорових чоловіках-волонтерах, поділених на групи у залежності від анамнезу БЦЖ-вакцинації. 1. Характеристика вакцини VPM 1002 VPM1002 являє собою генетично модифіковану вакцину БЦЖ, що є похідною датського штаму БЦЖ Mycobacterium bovis підтипу Prague, що характеризується таким чином: rBCG 4 UA 112297 C2 + 5 10 15 20 25 30 35 40 + ΔureC: Hly : Hyg . VPM 1002 є доступною у вигляді ліофілізованого осаду живої Mycobacterium + + 6 6 bovis BCG ΔureC: Hly : Hyg . Один флакон містить 5×10 КУО (в діапазоні 2-8×10 КУО) VPM1002. Ген лістеріолізину (Нly) був включеним до гена уреази С (ureC), що призвело до ліквідації активності уреази С і появи активності лістеріолізину. VPM1002 є стійкою до гігроміціну (Hyg). Стійкість до гігроміціну відігравала роль селекційного маркеру під час генно-інженерного конструювання штаму, і буде відігравати роль специфічного маркеру під час моніторингу генетично модифікованого організму (ГМО) та у процесі виявлення ГМО. VPM1002 є чутливою до антибіотиків, що традиційно використовуються при лікуванні інфекцій бактерій Mycobacterium, тобто до ізоніазиду, рифампіцину та етамбутолу. VPM1002 постачається у вигляді сублімованого (ліофілізованого) осаду, який відновлюється 6 1 мл Н2О (вода для ін'єкцій). Концентрація після відновлення становить приблизно 5×10 КУО. 3 4 Для введення доз 5×10 КУО і 5×10 КУО, відновлену суспензію VPM1002 розбавляють 1:100 або 1:10, відповідно, із застосуванням стерильного готового до застосування 0,9 % розчину хлориду натрію. 2. Цілі Основною метою цього дослідження було визначення безпечності разових доз VPM1002. Другорядною метою цього дослідження було визначення імуногенності разових доз VPM1002 для вакцинації проти туберкульозу. 3. Методологія (план дослідження): Це було перше застосування VPM1002 на людях. Дослідження проводили за відкритим, рандомізованим, керованим планом з підвищенням дози для оцінки безпечності та імуногенності разової дози VPM1002. Одноразовій вакцинації VPM1002 внутрішньошкірним шляхом піддавали суб'єктів, яким або раніше не вводили вакцину БЦЖ, або які були раніше вакциновані (задокументована вакцинація вакциною БЦЖ або наявність рубця після введення БЦЖ і, у обох випадках, слабопозитивна шкірна проба з очищеним білковим деріватом (PPD)). Були досліджені три зростаючі дози VPM1002. Контрольній групі суб'єктів вводили разову дозу вакцини БЦЖ. Поствакцинальні параметри безпечності уважно відслідковували до 4 год після введення вакцини. Після цього суб'єктів відпускали з клініки, за винятком перших 3-х суб'єктів в кожній групі, що одержувала певну дозу, які залишались у клініці протягом 24 год після вакцинації. Оцінку параметрів безпечності та фармакодинамічні дослідження проводили до 57 дня і повторили через 6 міс. після вакцинації. Проміжний аналіз параметрів безпечності провели після одержання результатів 57 дня від перших 3 суб'єктів кожної групи. На підставі цих даних дійшли висновку, що введення VPM1002 5 у дозах до 5×10 КУО є безпечним і добре переносним. На основі вторинних кінцевих точок дослідження імуногенності була здійснена статистична переоцінка розміру вибірки. Результати цього аналізу (p1 = 0,0119) показали, що запланований обсяг вибірки з 80 суб'єктів, включених у дослідження, був достатнім. У розширенні обсягу вибірки необхідності не було. 4. Кількість суб'єктів До цього дослідження планували включити сорок (40) суб'єктів, не вакцинованих БЦЖ, і 40 суб'єктів, попередньо вакцинованих БЦЖ (або PPD-позитивних). Всі 80 суб'єктів, за винятком 1 суб'єкту, який був виключений з групи пацієнтів, яка підлягала подальшому лікарському нагляду, завершили дослідження, як планувалося. 45 Оброблювана група Експериментальні групи Без попередньої БЦЖ3 попередньою БЦЖ-вакцинацією вакцинації або PPD-негативні або PPD-позитивні БЦЖ Група 1 Група 2 Група 3 БЦЖ Група 1 Група 2 Група 3 Разом n(%) n(%) n(%) n(%) n(%) n(%) n(%) n(%) n(%) Кількість включених 10 суб'єктів Кількість суб'єктів, що 10 завершили (100) дослідження Кількість виключених 0 суб'єктів Причина Інші причини 10 10 10 10 10 10 10 80 10 (100) 10 (100) 10 (100) 10 (100) 10 (100) 10 (100) 9 (90) 79 (98,8) 0 0 0 0 0 0 1 (10) 1 (1,3) 1(10) 1 (1,3) 5 UA 112297 C2 5 5 10 15 20 25 30 35 40 45 50 55 60 5 Обробка: БЦЖ=5×10 КУО БЦЖ (2-8×110 ), 3 3 Група 1=5×10 КУО VPM1002 (2-8×10 ), 4 4 Група 2=5×10 КУО VPM1002 (2-8×10 ), 5 5 Група 3=5×10 КУО VPM1002 (2-8×10 ) 5. Діагноз та основні критерії для включення суб'єктів: Здорові чоловіки у віці 18-55 років (з включенням крайніх значень), без будь-яких симптомів, фізичних ознак або лабораторних показників, що вказували б на системні порушення або поточне захворювання, і без жодних ознак активної або латентної туберкульозної інфекції (LTBI). Папула при постановці туберкулінової (PPD) проби на вихідному рівні повинна бути
ДивитисяДодаткова інформація
Назва патенту англійськоюRecombinant mycobacterium as vaccine for use in humans
Автори англійськоюGrode, Leander
Автори російськоюГроде Леандер
МПК / Мітки
МПК: A61K 39/04, C12N 1/21, A61P 43/00, C12R 1/32
Мітки: вакцина, застосування, мікобактерія, людях, рекомбінантна
Код посилання
<a href="https://ua.patents.su/22-112297-rekombinantna-mikobakteriya-yak-vakcina-dlya-zastosuvannya-na-lyudyakh.html" target="_blank" rel="follow" title="База патентів України">Рекомбінантна мікобактерія як вакцина для застосування на людях</a>
Попередній патент: Сухий порошковий препарат, який містить інгібітор фосфодіестерази
Наступний патент: Бензімідазолові інгібітори респіраторно-синцитіального вірусу
Випадковий патент: Лікувальний засіб "пелобішофіт" і спосіб його одержання