Бензімідазолові інгібітори респіраторно-синцитіального вірусу
Номер патенту: 112298
Опубліковано: 25.08.2016
Автори: Ху Лілі, Ребойсон П'єр Жан-Марія Бернард, Тахрі Абделах, Койманс Людвіг Поль, Демін Самюєль Домінік, Ведевіль Садрін Марі Хелен, Джонкерс Тім Хьюго Марія
Формула / Реферат
1. Сполука, представлена формулою І
 ,
,
де
кожен X являє собою С або N;
R1 являє собою Н;
R2 вибраний з групи, що складається з Вr і Сl;
R3 являє собою -(CR6R7)n-R8;
R4 вибраний з групи, що складається з С3-С7циклоалкілу, С2-С10алкенілу, CH2CF3 або -SO2CH3;
R5 присутній у тому випадку, коли X являє собою С, де кожен R5 вибраний незалежно з групи, що складається з Н і галогену;
R5 відсутній, якщо X являє собою N;
R6 і R7 кожен незалежно вибраний з Н і С1-С10алкілу, С3-С7циклоалкілу; або R6 і R7 узяті разом утворюють морфолініл;
R8 вибраний з групи, що складається з Н, ОН, CF3, CHF2, F, Сl, SO2CH3, SО2С3-С7циклоалкілу, NR6SO2R6, SO2NR6R7, NR6SО2С3-С7циклоалкілу, CN, NR6R7, COOH, COOR6, CONR6R7, ОСОС1-С6алкілу, CONR6SO2R7, CONH-R6-SO2R7, CONH-R6-SO2NR6R7, CONR6SO2NR6R7, фталіміду, фенілу, імідазолілу або піримідинілу;
n являє собою ціле число із значенням від 1 до 6.
2. Сполука за п. 1, де R2 являє собою Вr.
3. Сполука за п. 1, де R2 являє собою Сl.
4. Сполука за будь-яким з попередніх пунктів, де R6 і R7 являють собою Н.
5. Сполука за будь-яким з попередніх пунктів, де n складає 2-4.
6. Сполука за будь-яким з попередніх пунктів, де R8 вибраний з групи, що складається з F, CN, OH, CF3 і SO2CH3.
7. Сполука за будь-яким з попередніх пунктів, де R8 вибраний з групи, що складається з F, CN, ОН і SO2CH3.
8. Сполука за будь-яким з попередніх пунктів, де R4 являє собою С3-С7циклоалкіл або CH2CF3.
9. Сполука за будь-яким з попередніх пунктів, де R4 являє собою циклопропіл або CH2CF3.
10. Сполука за будь-яким з попередніх пунктів, де один X являє собою N, а інші X являють собою С.
11. Сполука за п. 1, де сполука являє собою
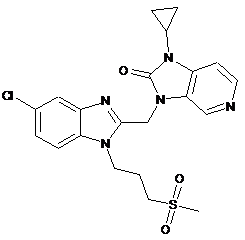 .
.
12. Сполука за п. 11, де сполука являє собою
 .
.
13. Сполука за будь-яким з пп. 1-12 для застосування як лікарського засобу.
14. Фармацевтична композиція, що містить фармацевтично прийнятний носій і терапевтично ефективну кількість сполуки за будь-яким з пп. 1-12 як активну сполуку.
15. Спосіб отримання фармацевтичної композиції за п. 14, де вказаний спосіб включає безпосереднє змішування фармацевтично прийнятного носія з терапевтично ефективною кількістю сполуки за будь-яким з пп. 1-12.
16. Сполука за будь-яким з пп. 1-12 для застосування як лікарського засобу для інгібування реплікації RSV.
17. Застосування сполуки за будь-яким з пп. 1-12 для одержання лікарського засобу для інгібування реплікації RSV.
Текст
Реферат: Бензімідазоли, що мають інгібіторну активність відносно реплікації RSV, що характеризуються формулою (І), їх пролікарські похідні, N-оксиди, солі приєднання, четвертинні аміни, металокомплекси і стереохімічні ізомери, композиції, що містять ці сполуки як активний інгредієнт, і способи отримання цих сполук і композицій. UA 112298 C2 (12) UA 112298 C2 UA 112298 C2 5 10 15 20 25 30 35 40 45 50 ОПИС Область техніки, до якої відноситься винаходи Винахід відноситься до бензімідазолу, що має противірусну активність, зокрема, що має інгібіторну дією, на реплікацію респіраторно-синцитіального вірусу (RSV). Винахід також описує отримання цих бензімідазолів, композиції, що містять ці сполуки, і композиції для застосування в лікуванні респіраторно-синцитіальної інфекції. Рівень техніки RSV людини, або респіраторно-синцитіальний вірус, є крупним РНК-вірусом, який відноситься до сімейства Paramyxoviridae і підродині Pneumoviridae разом з бичачим вірусом RSV. RSV людини викликає ряд захворювань дихальних шляхів у людей різного віку по всьому світу. Він є основною причиною захворювань нижніх дихальних шляхів у немовляцтві і дитинстві. Більше половини всіх немовлят заражається RSV на першому році життя, і майже всі впродовж перших двох років життя. У маленьких дітей інфекція може викликати пошкодження легенів, які зберігаються протягом багатьох років і можуть пізніше призводити до хронічних захворювань легенів (хронічні хрипи, астма). Діти старшого віку і дорослі часто страждають від (важкої) вірусної інфекції верхніх дихальних шляхів, викликаної зараженням RSV. У літньому віці сприйнятливість до вірусу знову зростає, і RSV буває залучений у ряд спалахів пневмонії у літніх людей, які вносять істотний вклад до смертності. Інфікування вірусом певної підгрупи не захищає від подальшого інфікування RSV-ізолятом тієї ж підгрупи в наступний зимовий сезон. Повторне інфікування RSV, таким чином, є поширеним, не дивлячись на існування всього двох підтипів, A і B. На сьогоднішній день для застосування проти інфекції RSV схвалено лише три лікарські засоби. Перше є рибавірином, нуклеозидним аналогом, який передбачає аерозольне лікування важкої інфекції RSV у госпіталізованих дітей. Аерозольний спосіб введення, токсичність (ризик тератогенності), висока вартість і сильно варіююча ефективність обмежують його застосування. ® ® Два інших лікарських засоби, RespiGam (RSV-IG) і Synagis (палівізумаб), імуностимулятори поліклональних і моноклональних антитіл призначені для застосування як профілактичні засоби. Обидва лікарські засоби є дуже дорогими і вимагають парентерального введення. Інші спроби розробити безпечну і ефективну вакцину проти RSV до теперішнього часу закінчувалися невдачею. Інактивовані вакцини не захищали від захворювання, і в деяких випадках навіть підсилювали захворювання під час подальшої інфекції. Випробування живих аттенуйованих вакцин не мали помітного успіху. Вочевидь, що існує необхідність в ефективному, нетоксичному і легкому для введення лікарському засобі проти реплікації RSV. Особливо бажаним є надання лікарських засобів проти реплікації RSV, які можна вводити перорально. Посиланням на бензімідазолові противірусні засобами є WO 01/95910. У цьому документі представлені сполуки з противірусною активністю із значеннями EC 50 у діапазоні від 0,001 мкМ до 50 мкМ (зазвичай такі сполуки не демонструють бажаної біологічної активності). Іншим посиланням, в якому представлені заміщені 2-метил-бензімідазолові засоби проти RSV з тим же діапазоном активності, є WO 03/053344. Іншим пов'язаним посиланням на сполуки з тим же діапазоном активності є WO 02/26228 і надає бензімідазолoві противірусні засоби. Посиланням на взаємовідносини структури і активності відносно інгібування RSV 5-заміщеними бензімідазоловими сполуками є X.A. Wang et al, Bioorganic and Medicinal Chemistry Letters 17 (2007) 4592-4598. Необхідно надати лікарські засоби з противірусною активністю. Зокрема, необхідно надати нові лікарські засоби, що мають інгібіторну активність відносно реплікації RSV. Крім того, необхідно розкрити структуру сполук, які дозволять отримати вищі рівні біологічної активності, ніж відомі в даній області, і особливо рівні активності, представлені значеннями EC50 нижче 0,001 мкМ. Крім того, необхідно розкрити сполуки з пероральною противірусною активністю. Суть винаходу Для досягнення однієї або декількох з наведених вище цілей винахід в одному з аспектів надає противірусні бензімідазолові сполуки, представлені формулою I, пролікарський засіб, Nоксид, сіль приєднання, четвертинний амін, комплексну сполуку металу або їх стереохімічні ізомери; 1 UA 112298 C2 5 10 15 20 25 30 35 40 45 50 , де кожен X є C або N; R1 є H; R2 вибраний з групи, що складається з Br і Cl; R3 є -(CR6R7)n-R8; R4 вибраний з групи, що складається з H, C 3-C7циклоалкіла, C2-C10алкеніла, -(CR6R7)n-R8; CH2-п-фторфеніла, CH2CF3 і -SО2CH3; R5 присутній у тому випадку, коли X є C, тоді як кожен R 5 незалежно вибраний з групи, що складається з H, C1-C6алкіла, C1-C6алкокси, галогена і CN; R5 відсутній у тому випадку, коли X є N; R6 і R7 незалежно вибрані з H і C1-C10алкіла, C3-C7циклоалкіла; або R6 і R7, узяті разом утворюють 5-6-членне аліфатичне або ароматичне кільце, яке необов'язково містить один або декілька гетероатомів, вибраних з групи N, S, O. R8 вибраний з групи, що складається з H, ОН, CF 3, CHF2, F, Cl, SO2CH3, SO2C3C7циклоалкіла, NR6SO2R6, SO2NR6R7, NR6SO2C3-C7циклоалкіла, CN, NR6R7, COOH, COOR6, CONR6R7, OCOC1-C6алкіла, CONR6SO2R7, CONHR6SO2R7, CONHR6SO2NR6R7CONR6SO2NR6R7, фталіміда або 5-6-членного аліфатичного або ароматичного кільця, що необов'язково містить один або декілька гетероатомів, вибраних з групи N, S, O; n є цілим числом із значенням від 1 до 6; У іншому варіанті здійснення кожен X є C або N; R1 є H; R2 вибраний з групи, що складається з Br і Cl; R3 є -(CR6R7)n-R8; R4 вибраний з групи, що складається з H, C3-C7циклоалкіла, C2-C10алкеніла і -SO2CH3; R5 присутній у тому випадку, коли X є C, тоді як кожен R 5 незалежно вибраний з групи, що складається з H, C1-C6алкіла, C1-C6алкокси, галогена і CN; R5 відсутній у тому випадку, коли X є N; R6 і R7 незалежно вибрані з H і C1-C10алкіла; або R6 і R7, узяті разом утворюють 5-6-членне аліфатичне кільце, яке необов'язково містить один або декілька гетероатомів, вибраних з групи N, S, O. R8 вибраний з групи, що складається з H, ОН, CF 3, CHF2, F, SO2CH3, SO2C3-C7циклоалкіла, NR6SO2R6, SO2NR6R7, NR6SO2C3-C7циклоалкіла, CN, NR6R7, COOH, COOR6, CONR6R7, OCOC1C6алкіла; n є цілим числом із значенням від 2 до 6; У іншому аспекті винахід відноситься до наведених вище сполук для застосування в лікуванні інфекцій RSV у теплокровних тварин, бажано людини. В іншому аспекті винахід надає спосіб лікування вірусних інфекцій RSV у суб'єкта, що потребує цього, що включає введення вказаному суб'єктові ефективної кількості наведеної вище сполуки. В іншому аспекті винахід відноситься до застосування наведеної вище сполуки для отримання лікарського засобу для лікування інфекцій RSV. У додатковому аспекті, винахід відноситься до фармацевтичної композиції, що містить наведену вище сполуку і фармацевтично прийнятний ексципієнт. Ще в одному додатковому аспекті винахід відноситься до способів отримання представлених вище сполук. Детальний опис винаходу Винахід заснований на несподіваному виявленні того, що в певних 5-заміщених бензімідазолових сполуках специфічний замісник R 2, що є хлором або бромом, надає сполуки з несподівано високою біологічною активністю проти RSV. Навіть у науковому викладі активності 2 UA 112298 C2 5 10 15 20 25 30 35 40 45 50 55 60 структур (посилання на Wang, наведене вище) комбінації за даним винаходом не представлені. Жоден з результатів, представлених Wang, не передбачає біологічної активності, що перевищує вказаний вище діапазон 0,001-50 мкм. У даному винаході далі представлені конкретні варіанти здійснення із посиланнями на конкретні приклади, проте винахід не обмежений ними і обмежений лише формулою винаходу. Термін "що містить", що застосовується у даному описі і формулі винаходу не виключає інших елементів або етапів. Застосування іменників у формі однини включає також форми множини, якщо не вказане інше. Термін "пролікарський засіб", як застосовується впродовж усього документа, означає фармакологічно прийнятні похідні, наприклад, складні ефіри і аміди, продукт біотрансформації яких є активним лікарським засобом, як визначено для сполук формули (I). Документ Goodman і Gilman (The Pharmacological Basis of Therapeutics, 8th ed., McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", р. 13-15), що описує пролікарські засоби, включений у цей документ. Пролікарські засоби характеризуються гарною розчинністю у воді і біодоступністю і легко метаболізуются in vivo в активні інгібітори. Як застосовують у цьому документі, R1-C6алкіл як група або частина групи є насиченим вуглеводневим радикалом з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю, такий як метил, етил, пропіл, 1-метилетил, бутил, пентил, гексил, 2-метилбутил і тому подібне. С1-С10алкіл як група або частина групи є насиченим вуглеводневим радикалом з прямим або розгалуженим ланцюгом, що містить від 1 до 10 атомів вуглецю, такий як групи, вказані для C 1C6алкіла і гептила, октила, ноніла, 2-метилгексила, 2-метилгептила, децила, 2-метилноніла і т.п.; Термін "C2-C10алкеніл", що застосовується в цьому документі по відношенню до групи або частини групи, включає ненасичені вуглеводневі радикали з прямим або розгалуженим ланцюгом, що містять, щонайменше, один подвійний зв'язок і що бажано містять один подвійний зв'язок, і від 2 до 10 атомів вуглецю, такі як етеніл, пропеніл, бутен-1-іл, бутен-2-іл, пентен-1-іл, пентен-2-іл, гексен-1-іл, гексен-2-іл, гексен-3-іл, 2-метилбутен-1-іл, гептен-1-іл, гептен-2-іл, гептен-3-іл, гептен-4-іл, 2-метилгексен-1-іл, октен-1-іл, октен-2-іл, октен-3-іл, октен-4-іл, 2метилгептен-1-іл, нонен-1-іл, нонен-2-іл, нонен-3-іл, нонен-4-ил, нонен-5-іл, 2-метилоктен-1-іл, децен-1-іл, децен-2-іл, децен-3-іл, децен-4-іл, децен-5-іл, 2-метилнонен-1-іл і т.п.; Термін -(CR6R7)n, що застосовується в цьому документі, означає n-кратне повторення підгрупи CR6R7, де кожна з цих підгруп визначена незалежно. Якщо група C2-C10алкеніл зв'язана з гетероатомом, то вона бажано зв'язана через насичений атом вуглецю. С1-C6алкокси як група або частина групи є O-С1-C6алкільним радикалом, де С1-C6-алкіл є сполукою, описаною вище. C3-C7циклоалкіл є узагальненою назвою для циклопропіла, циклобутила, циклопентила, циклогексила або циклогептила. Термін "галоген" є узагальненою назвою для фтору, хлору, брому і йоду. Слід зазначити, що позиції радикалів у будь-якій молекулярній групі, що застосовуються у визначеннях, можуть бути замінені на будь-яку позицію в такій молекулярній групі за умови, що сполука є хімічно стабільною. Радикали, що застосовуються у визначеннях груп, включають усі можливі ізомери, якщо не вказане інше. Наприклад, пентил включає 1-пентил, 2-пентил і 3-пентил. Якщо група зустрічається в складній сполуці більше одного разу, то кожне її визначення є незалежним. Далі в цьому документі термін "сполуки формули (I)» або "дані сполуки", або схожі терміни включають сполуки загальної формули (I), їх пролікарські похідні, N-оксиди, солі приєднання, четвертинні аміни, комплексні сполуки з металами і стереохімічні ізомери. Слід розуміти, що деякі сполуки формули (I) можуть мати один або декілька хіральних центрів і існувати як стереохімічні ізомери. Як застосовують у цьому документі, термін "стереохімічні ізомери" означає всі можливі сполуки, побудовані з тих самих атомів, зв'язаних у тій самій послідовності, але що мають тривимірні структури, які не є взаємозамінними, які можуть мати сполуки формули (I). Якщо не вказане інше, хімічне позначення сполуки описує суміш усіх можливих стереохімічних ізомерів, які може мати вказана сполука. Вказана суміш може містити все діастереомери та∕або енантіомери основної молекулярної структури вказаної сполуки. Всі стереохімічні ізомери сполук за даним винаходом як у чистій формі, так і у вигляді суміші один з одним включені в обсяг даного винаходу. 3 UA 112298 C2 5 10 15 20 25 30 35 40 45 50 55 Чисті стереохімічні форми сполук і проміжних сполук, як застосовується в даному документі, є ізомерами, по суті вільними від інших енантіомерних або діастереомерних форм основної молекулярної структури вказаних сполук або проміжних сполук. Зокрема, термін "стереохімічно чистий" позначає сполуки або проміжні сполуки, які характеризуються стереоізометричним надлишком, що складає від не менше 80 % (тобто мінімум 90 % одного ізомеру і максимум 10 % інших можливих ізомерів) до 100 % (тобто 100 % одного ізомеру і відсутність інших), конкретніше, сполуки або проміжні сполуки, які характеризуються стереоізометричним надлишком, що складає від 90 % до 100 %, конкретніше стереоізометричним надлишком від 94 % до 100 % і найконкретніше стереоізометричним надлишком від 97 % до 100 %. Терміни "енантіомерно чистий" і "діастереомерно чистий" слід розуміти так само, проте відносно енантіомерного надлишку і діастереомерного надлишку суміші, що представляє інтерес, відповідно. Чисті стереоізомерні форми сполук і проміжних сполук за даним винаходом можна отримувати за допомогою відомих у даній області способів. Наприклад, енантіомери можна відділяти один від одного за допомогою селективної кристалізації їх діастереомерних солей з оптично активними кислотами або основами. Приклади включають винну кислоту, дибензоїлвинну кислоту, дитолуолвинну кислоту і камфорсульфонову кислоту. Альтернативно, енантіомери можна розділяти за допомогою способів хроматографії із застосуванням хіральних нерухомих фаз. Вказані чисті стереохімічні ізомери можна також отримувати з відповідних чистих стереохімічних ізомерів прийнятних первинних речовин за умови, що реакція є стереоспецифічною. Бажано при необхідності отримання певного стереоізомера вказану сполуку отримують стереоспецифічними способами. У цих способах бажано застосовують енантіомерно чисті первинні речовини. Діастереомерні рацемати формули (I) можна отримувати окремо із застосуванням традиційних способів. Прийнятні способи фізичного розділення, застосування яких є бажаним, включають, наприклад, селективну кристалізацію і хроматографію, наприклад колонкову хроматографію. Для деяких сполук формули (I), їх пролікарських похідних, N-оксидів, солей, сольватів, четвертинних амінів або комплексних сполук з металами і проміжних сполук, що застосовуються для їх отримання, точна стереохімічна конфігурація не визначена. Фахівець у даній області може визначити точну конфігурацію таких сполук із застосуванням способів, відомих у даній області, таких як, наприклад, рентгенодифракція. Даній винахід також включає всі ізотопи атомів, що містяться в представлених сполуках. Ізотопи включають атоми з тим же атомним числом, але з різними масовими числами. Як загальний приклад, що не має на увазі обмеження, ізотопи водню включають тритій і дейтерій. Ізотопи вуглецю включають C-13 і C-14. Для терапевтичного застосування солі сполуки формули (I) включають ті, які містять фармацевтично прийнятний протилежно заряджений іон. Проте солі кислот і основ, які не є фармацевтично прийнятними, також можна застосовувати, наприклад, при отриманні або очищенні фармацевтично прийнятної сполуки. Всі солі, як фармацевтично прийнятні, так і фармацевтично неприйнятні, включені в обсяг даного винаходу. Фармацевтично прийнятні солі приєднання кислот і основ, як вказано вище, містять терапевтично активні нетоксичні форми солей приєднання кислот і основ, які можуть утворити сполуки формули (I). Фармацевтично прийнятні солі приєднання кислот можна легко отримувати за допомогою обробки основної форми прийнятною кислотою. Прийнятні кислоти включають, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад, хлористоводнева кислота або бромистоводнева кислота, сірчана, азотна, фосфорна і інші кислоти; або органічні кислоти, такі як, наприклад, оцтова, пропіонова, гідроксіоцтова, молочна, піровиноградна, щавлева (тобто етандикислота), малонова, бурштинова (тобто бутандикислота), малеїнова, фумарова, яблучна (тобто гідроксибутандикислота), винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламова, саліцилова, п-аміносаліцилова, памова і інші кислоти. І навпроти, вказані форми солей можна переводити у форму вільної основи за допомогою обробки прийнятною основою. Сполуки формули (I), що містять кислотний протон, також можна переводити у форму нетоксичних солей приєднання металу або аміну за допомогою обробки прийнятними органічними і неорганічними основами. Прийнятні форми основних солей включають, наприклад, аммонійні солі, солі лужних і лужно-земельних металів, наприклад, літію, натрію, калія, магнію, кальцію і тому подібне, солі органічних основ, наприклад, бензатина, N-метил-D 4 UA 112298 C2 5 10 15 20 25 30 35 40 45 глюкаміна, гідрабамінові солі і солі амінокислот, таких як, наприклад, аргінін, лізин і тому подібне. Як застосовують у цьому документі, термін "сіль приєднання" також включає сольвати, які сполуки формули (I) і їх солі можуть утворити. Такі сольвати включають, наприклад, гідрати, алкоголяти і тому подібне. Як застосовують у цьому документі, термін "четвертинний амін" позначає четвертинні солі аммонію, які сполуки формули (I) можуть утворити за допомогою реакції між азотистою основою сполуки формули (I) і прийнятним кватернізуючим агентом, таким як, наприклад, необов'язково заміщений алкілгалід, арилгалід або арилалкілгалід, наприклад, метиліодид або бензиліодид. Можна застосовувати також інші реактиви з прийнятними групами, що відходять, такі як алкілтрифторметансульфонати, алкіл-метансульфонати і алкіл-п-толуолсульфонати. Четвертинний амін містить позитивно заряджений азот. Фармацевтично прийнятні протиіони включають хлор, бром, йод, трифторацетат і ацетат. Вибраний протиіон можна вводити в реакцію із застосуванням іонообмінних смол. Форми N-оксида представлених сполук включають сполуки формули (I), де один або декілька атомів азоту окислені до так званого N-оксида. Слід розуміти, що сполуки формули (I) можуть мати властивості зв'язування з металом, утворення хелатних і комплексних сполук і, таким чином, можуть існувати у вигляді комплексних сполук з металами або метало-хелатів. Такі металатні похідні сполук формули (I) включені в обсяг даного винаходу. Деякі сполуки формули (I) можуть також існувати в таутомерній формі. Такі форми, хоча і не вказані ясно в наведеній вище формулі, включені в обсяг даного винаходу. Визначені варіанти здійснення, що не обмежують обсяг винаходу, детальніше розглянуті нижче. У деяких варіантах здійснення R2 є Br. У інших варіантах здійснення R2 є Cl. У найбільш бажаних варіантах здійснення R2 є Br. З урахуванням того, що R3 є -(CR6R7)n-R8, як визначено вище, у бажаному варіанті здійснення R6 і R7 є H. Далі, n є 2-4, і найбажаніше n є 3 або 4. R8 бажано вибраний з групи, що складається з H, ОН, F, CF 3, CN і SO2CH3. R4 бажано вибраний з групи, що складається з C3-C7циклоалкіла, C2-C10алкеніла, CH2CF3 і SO2CH3, бажаніше C3-C7циклоалкіла, C2-С10алкеніла і -SO2CH3. Бажаніше, R4 є C3C7циклоалкілом або CH2CF3. Найбажаніше, R4 є циклопропілом або CH2CF3. У бажаному варіанті здійснення і бажаніше у поєднанні з іншими бажаними варіантами здійснення один X є N, а інші X є C. У найбільш бажаному варіанті здійснення той X, що є N, знаходиться в пара-положенні по відношенню до N-R4. Як, правило, бажано один R5 вибраний з групи, що складається з С1-C6алкіла, С1-C6алкокси, галогена і CN. Найбажаніше всі R5 є H. У іншому бажаному варіанті здійснення, R2 є Cl; один X є N, а інші X є C, де N знаходиться в пара-положенні по відношенню до N-R4; і R4 є циклопропілом або CH2CF3. Бажані сполуки є сполуками, наведеними в таблиці 1 і 2 нижче. Найбажанішими є сполуки P1, P2, P3, P4, P5, P6, P7, P8, P9, P10, P11, P12, P13, P14, P15, P16, P17, P22, P23, P24, P25, P26 і P27. Бажаніше сполуки є P1, P2, P3, P4, P6 і P24. Найбільш бажані сполуки є P1, P2, P3 і P4. Сполуки формули (I) можна отримувати, наприклад, за допомогою способів, показаних на схемі 1. Як правило, фрагмент A або B при об'єднанні з фрагментом C призводить до отримання похідних формули (I). 5 UA 112298 C2 5 10 15 20 Схема 1. Загальний спосіб отримання сполук формули (I) Для способу 1 приклад прийнятних умов реакції для взаємодії фрагменту A з фрагментом C із отриманням сполук формули (I) є реакцією Міцунобу. Прийнятним розчинником для такого типу реакції є TFTF (тетрагідрофуран). Альтернативно (але не обмежуючись цим) сполуки типу фрагменту B, де Z=Cl, Br, OTos або OMs можуть взаємодіяти із сполуками типу фрагменту C у ході реакції зв'язування із застосуванням основи (Спосіб 2). Можливі основи для застосування в цій реакції (але не обмежуючись цим) включають K2CO3, Cs2CO3, триетиламін і гідрид натрію. Прийнятним розчинником (але не обмежуючись цим) для такого типу реакцій зв'язування із застосуванням основи є DMF (диметилформамід). Сполуки типу фрагменту A можна, як правило, отримувати способом, представленим на схемі 2. Схема 2. Загальний спосіб отримання сполук типу фрагменту A Як правило, сполуки типу фрагменту B можна отримувати із сполук типу фрагменту A за допомогою реакції з такими речовинами (але не обмежуючись цим), як SOCl 2, PBr3, p-TsCl, MsCl. Схема 3. Загальний спосіб отримання сполук типу фрагменту B Сполуки типа фрагмента C можна отримувати способом, представленим на схемі 4. 25 6 UA 112298 C2 5 10 15 20 25 30 35 40 45 50 55 60 Схема 4. Загальний спосіб отримання сполук типу фрагменту B Сполуки формули (I) можна переводити у відповідні форми N-оксида за допомогою відомих у даній області способів перетворення тривалентного азоту у форму N-оксиду. Вказана реакція N-окислення, як правило, включає взаємодію первинної речовини формули (I) з прийнятним органічним або неорганічним пероксидом. Прийнятні неорганічні пероксиди включають, наприклад, пероксид водню, пероксиди лужних або лужно-земельних металів, наприклад, пероксид натрію, пероксид калію; прийнятні органічні пероксиди можуть включати надкислоти, такі як, наприклад, бензолкарбопероксикислота або галогензаміщена бензолкарбопероксикислота, наприклад, 3-хлорбензолкарбопероксикислота, пероксоалканові кислоти, наприклад, пероксооцтова кислота, алкілгідропероксиди, наприклад, третбутила гідропероксид. Прийнятні розчинники включають, наприклад, воду, нижчі спирти, наприклад, етанол і тому подібне, вуглеводні, наприклад, толуол, кетон, наприклад, 2-бутанон, галогеновані вуглеводні, наприклад, дихлорметан і суміші таких розчинників. Чисті стереохімічні ізомери сполук формули (I) можна отримувати за допомогою застосування відомих у даній області способів. Діастереомери можна розділяти фізичними способами, такими як селективна кристалізація і способи хроматографії, наприклад, протиточна хроматографія, рідинна хроматографія і тому подібне. Сполуки формулами (I), отримані наведеними вище способами, як правило, є рацемічними сумішами енантіомерів, які можна розділяти за допомогою інших відомих у даній області способів. Рацемічні сполуки формули (I), які проявляють значні основні або кислотні властивості, можна переводити у форму відповідних діастереомерних солей за допомогою реакції з прийнятною хіральною кислотою або прийнятною хіральною основою. Вказані форми діастереомерих солей потім розділяють, наприклад, за допомогою селективної або фракційної кристалізації, і енантіомери виділяють із застосуванням луги або кислоти. Альтернативний спосіб розділення енантіомерних форм сполук формули (I) включає рідинну хроматографію, зокрема, рідинну хроматографію із застосуванням хіральних нерухомих фаз. Указані чисті стереохімічні ізомери можна також отримувати з відповідних чистих стереохімічних ізомерів прийнятних первинних речовин, за умови, що реакція протікає стереоспецифічно. Бажано, для отримання певного стереоізомера вказану сполуку отримують стереоспецифічними способами. Ці способи включають застосування енантіомерно чистих первинних речовин. У додатковому аспекті даній винахід відноситься до фармацевтичної композиції, що містить терапевтично ефективну кількість сполуки формули (I), як визначено в даному документі, або сполуки, побудованої з будь-яких підгруп сполуки формули (I), як визначено в даному документі, і фармацевтично прийнятний носій. Терапевтично ефективна кількість у даному контексті є кількістю, достатньою для профілактики, стабілізації або скорочення вірусної інфекції, зокрема, інфекції вірусу RSV, в інфікованих індивідуумів або індивідуумів, які характеризуються ризиком зараження. В іншому аспекті даній винахід відноситься до способу отримання фармацевтичної композиції, як визначено в даному документі, який включає безпосереднє змішування фармацевтично прийнятного носія з терапевтично ефективною кількістю сполуки формули (I), як визначено в даному документі, або сполуки, побудованої з будь-яких підгруп сполуки формули (I), як визначено в даному документі. Таким чином, із сполук за даним винаходом або будь-якого варіанту його здійснення можна складати різні фармацевтичні форми для введення всередину. Як прийнятні композиції можна наводити всі композиції, які, як правило, застосовують для систематичного введення лікарських засобів. Для отримання фармацевтичних композицій за даним винаходом ефективну кількість визначеної сполуки, необов'язково у формі солі приєднання або комплексу з металом, що застосовується як активний інгредієнт, безпосередньо змішують з фармацевтично прийнятним носієм, де носій може бути представлений у вигляді широкого діапазону форм залежно від форми композиції, що застосовується для введення. Ці фармацевтичні композиції бажано представлені лікарськими формами для однократного застосування, які є прийнятними, зокрема, для перорального, ректального, черезшкірного або парентерального введення. Наприклад, при отриманні композицій у лікарській формі для перорального введення можна застосовувати будь-який із звичайних фармацевтичних носіїв, такий як, наприклад, вода, гліколі, олії, спирти і тому подібне, у разі рідких препаратів для перорального введення, таких як суспензії, сиропи, еліксири, емульсії і розчини; або тверді носії, такі як крохмалі, цукри, каолін, змащувальні засоби, зв'язуючі засоби, дезинтегруючі засоби і тому подібне в разі порошків, пілюль, капсул і пігулок. Завдяки легкості введення пігулки і капсули є найбільш бажаними пероральними стандартними лікарськими формами, в яких застосовують тверді фармацевтичні носії. В разі композицій для парентерального введення носій, як правило, містить стерильну 7 UA 112298 C2 5 10 15 20 25 30 35 40 45 50 55 60 воду, яка складає, щонайменше, значну частину композиції, хоча може включати інші інгредієнти, наприклад, що збільшують розчинність. Можна отримувати, наприклад, розчини для ін'єкцій, в яких носій містить фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину і розчину глюкози. Можна отримувати також суспензії для ін'єкцій, в яких застосовують прийнятні рідкі носії, суспендуючі засоби і тому подібне. Також застосовують препарати в твердій формі, які призначені для переводу їх у препарати в рідкій формі безпосередньо перед застосуванням. У композиціях, прийнятних для черезшкірного введення, носій необов'язково містить агент, що полегшує введення, та/або прийнятний зволожувач, необов'язково у поєднанні з прийнятними добавками будь-якого складу в незначній кількості, де добавки не спричиняють істотної шкідливої дії на шкіру. Сполуки за даним винаходом також можна вводити за допомогою пероральної інгаляції або вдування із застосуванням способів і складів, що застосовуються в даній області для введення у такий спосіб. Таким чином, як правило, сполуки за даним винаходом можна вводити влегені у формі розчину, суспензії або сухого порошку, причому розчин є бажаним. Будь-які системи, розроблені для доставки розчинів, суспензій або сухих порошків за допомогою пероральної інгаляції або вдування, є прийнятними для введення представлених сполук. Таким чином, даній винахід також відноситься до фармацевтичної композиції, розробленої для введення за допомогою інгаляції або вдування через ротову порожнину і що містить сполуку формули (I) і фармацевтично прийнятний носій. Переважно сполуки за даним винаходом доставляють за допомогою інгаляції розчину в розпорошеній або аерозольній формі. Особливо переважно формулювати вказані вище фармацевтичні композиції в стандартній лікарській формі для полегшення введення і однорідності одиниць дозування. Стандартна лікарська форма, як застосовують у даному документі, відноситься до фізично дискретних одиниць, прийнятних як однократні дози, де кожна одиниця містить визначену кількість активного інгредієнта, обчислену так, щоб забезпечувати бажаний терапевтичний ефект у поєднанні з необхідним фармацевтичним носієм. Приклади таких стандартних лікарських форм включають пігулки (включаючи ділимі пігулки або вкриті оболонкою пігулки), капсули, пілюлі, супозиторії, порошки, пластинки, розчини або суспензії для ін'єкцій і тому подібне, і їх кратно збільшені дози. Сполуки формули (I) демонструють противірусні властивості. Вірусні інфекції, на які можна впливати і застосуванням сполук і способів за даним винаходом, включають інфекції, викликані орто- і параміксовірусами і, зокрема, респіраторно-синцитіальним вірусом (RSV) людини і копитних. Ряд сполук за даним винаходом, крім того, проявляють активність проти мутованих штамів RSV. Крім того, багато сполук за даним винаходом мають прийнятний фармакокінетичний профіль і мають привабливі властивості відносно біодоступності, включаючи прийнятний період напіввиведення, значення AUC і пікового значення і відсутність несприятливих властивостей, таких як недостатньо швидка дія і затримка в тканинах. Противірусну активність представлених сполук по відношенню до RSV in vitro оцінювали в тесті, описаному в експериментальній частині опису винаходу, і її також можна демонструвати за допомогою аналізу урожаю вірусу. Противірусну активність представлених сполук по відношенню до RSV in vivo можна демонструвати на експериментальній моделі із застосуванням бавовняних хом'яків, як описано в Wyde et al. (Antiviral Research (1998), 38, 3142). Завдяки противірусним властивостям, і особливо направленою проти RSV активності сполуки формули (I) або будь-яких варіантів їх здійснення, їх пролікарські похідні, N-оксиди, солі приєднання, четвертинні аміни, комплексні сполуки з металами і стереохімічні ізомери можна застосовувати в лікуванні індивідуумів, страждаючих на вірусну інфекцію, особливо інфекцію RSV, і для профілактики цих інфекцій. Як правило, сполуки за даним винаходом можна застосовувати в лікуванні теплокровних тварин, заражених вірусами, зокрема, респіраторносинцитіальним вірусом. Таким чином, сполуки за даним винаходом або будь-який варіант їх здійснення можна застосовувати як лікарські засоби. Вказане застосування як лікарського засобу або спосіб лікування включає системне введення зараженим вірусом суб'єктам або суб'єктам, чутливим до вірусних інфекцій, кількості, ефективної для боротьби із станом, що асоціюється з вірусною інфекцією, зокрема, інфекцією RSV. Даний винахід також відноситься до застосування представлених сполук або будь-яких варіантів їх здійснення в отриманні лікарського засобу для лікування або профілактики вірусних інфекцій, особливо інфекції RSV. Даний винахід, крім того, відноситься до способу лікування теплокровних тварин, заражених вірусом або зараження вірусом, що характеризується ризиком, зокрема, вірусом RSV, де 8 UA 112298 C2 5 10 15 20 25 30 35 40 вказаний спосіб включає введення ефективної проти вірусу кількості сполуки формули (I), як визначено в даному документі, або сполуки, побудованої з будь-яких підгруп сполуки формули (I), як визначено в даному документі. Як правило, передбачають, що ефективна проти вірусу добова кількість складає від 0,01 мг/кг маси тіла до 500 мг/кг маси тіла, бажаніше від 0,1 мг/кг маси тіла до 50 мг/кг маси тіла. Часто бажано доставляти необхідну дозу у вигляді двох, трьох, чотирьох або більше частин дози через прийнятні інтервали часу протягом доби. Вказані частини дози можна формулювати у вигляді стандартних лікарських форм, наприклад, таких, що містять від 1 до 1000 мг, зокрема, від 5 до 200 мг активного інгредієнта на стандартну лікарську форму. Точне дозування і частота введення залежать від конкретного сполуки формули (I), що застосовується, конкретного стану, що підлягає лікуванню, важкості стану, що підлягає лікуванню, віку, маси тіла, статі, міри порушення і загального фізичного стану конкретного пацієнта, а також від інших лікарських засобів, які може приймати пацієнт, як відомо фахівцям у даній області. Крім того, вочевидь, що вказану ефективну добову кількість можна зменшувати або збільшувати залежно від сприйнятливості індивідуума, який підлягає лікуванню, та/або залежно від оцінки лікаря, що виписує композиції за даним винаходом. Діапазони ефективної добової кількості, наведені вище, таким чином, мають рекомендаційний характер. Крім того, як лікарський засіб також можна застосовувати комбінації інших противірусних речовин і сполуки формули (I). Таким чином, даній винахід також відноситься до композиції, що містить (a) сполуку формули (I) і (b) іншу противірусну сполуку, яку застосовують як комбінований препарат для одночасного, роздільного або послідовного використання в противірусному лікуванні. В одному препараті можна комбінувати різні лікарські засоби з фармацевтично прийнятними носіями. Наприклад, сполуки за даним винаходом можна комбінувати з бета-інтерфероном або фактором некрозу пухлини альфа для лікування або запобігання інфекціям RSV. Далі в цьому документі винахід проілюстрований наступними необмежуючими прикладами. Приклад 1 Детальний опис отримання 3-({5-бром-1-[3-(метилсульфоніл)пропіл]-1Н-бензімідазол-2іл}метил)-1-циклопропіл-1,3-дигідро-2H-імідазо[4,5-з]піридин-2-она (P2), типовий приклад за винаходом представлений на схемі 5. Схема 5 У 100 мл сухій колбі фрагмент A2 (750 мг, 2,14 ммоль), трифенілфосфін (645 мг, 2,46 ммоль, 1,15 екв.) і фрагмент С1 (393 мг, 2,25 ммоль, 1,05 екв.) розчиняли в тетрагідрофурані (THF) (60 мл). Розчин поміщали в атмосферу N2 і за допомогою шприца додавали діізопропілaзодикарбоксилат (DIAD) (0,484 мл, 2,46 ммоль, 1,15 екв.). Реакційну суміш перемішували при кімнатній температурі в атмосфері азоту протягом ночі. Суміш випарювали насухо і заздалегідь очищали за допомогою ВЕРХ на колонці RP Vydac Denali C18 (10 мкм, 250 г, 5 см) із застосуванням 0,25 % NH4HCO3 в розчині вода-CH3CN, що застосовувався як елюент. Після випарювання і висушування у вакуумі отримували 620 мг (1,23 ммоль, 57,5 %) білої твердої речовини. Отримання {5-бромо-1-[3-(метилсульфоніл)пропіл]-1H-бензімідазол-2-іл}-метанола (фрагмент A2) проводили способом, представленим на схемі 6. 9 UA 112298 C2 5 10 15 20 25 30 35 40 Схема 6 Сполуку 1 (7,6 г, 35 ммоль), 3-(метилсульфоніл)пропан-1-амін гідрохлорид (6 г, 35 ммоль) і діізопропілетиламін (DIEA) (13,5 г, 105 ммоль) розчиняли в етанолі (70 мл) і нагрівали із зворотним холодильником протягом 14 год. Суміш охолоджували до 20 °C. Осад фільтрували і промивали етанолом. Отримували 11 г (94 %) сполуки 2 у вигляді помаранчевого порошку. Сполуку 2 (10 г, 29,7 ммоль) у метанолі (200 мл), EtOAc (200 мл) і THF (200 мл) гідрогенізували із застосуванням Ni Ренея (10 г) як каталізатора при 20 °C (1 атм.) протягом 3 год. Після поглинання H2 (3 екв.) фільтрували каталізатор і випарювали фільтрат. Отримували 10 г (90 %) сполуки 3 у вигляді чорної твердої речовини. Сполуку 3 (10 г, 29,7 ммоль) і метил диметоксіацетат (9,2 г, 68,31 ммоль) у 24 мас. % KOEt в етанолі (13,5 г, 38,5 ммоль) перемішували і нагрівали із зворотним холодильником протягом ночі. Суміш випарювали у вакуумі. Додавали воду (200 мл). Додавали оцтову кислоту для нейтралізації суміші. Суміш екстрагували етилацетатом (2 × 100 мл). Об'єднані органічні шари промивали насиченим NaHCO3, насиченим сольовим розчином і висушували над Na2SО4. Розчинник видаляли у вакуумі із отриманням 12,3 г (90 %) сполуки 4 у вигляді темного масла. Сполуку 4 (12,3 г, 29,3 ммоль) у THF (100 мл) перемішували протягом 0,5 год. при 20 °C до розчинення. Додавали концентровані HCl (21 мл) і H2О (42 мл). Суміш кип'ятили із зворотним холодильником протягом 6 год. і потім охолоджували до 10 °C. Додавали CH3OH (50 мл) з подальшим акуратним додаванням NaBH4 (24 г, 629 ммоль). Суміш перемішували протягом 0,5 год. при 10 °C і концентрували у вакуумі. Додавали воду (200 мл). Суміш екстрагували етилацетатом (2 × 100 мл). Об'єднані органічні шари промивали насиченим сольовим розчином і висушували над Na2SО4. Розчинник видаляли у вакуумі. Отриману тверду речовину промивали етилацетатом (2 × 5 мл) і висушували у вакуумі. Отримували 6,8 г (60 %) фрагменту A2 у вигляді білястої твердої речовини, маса/заряд = 347 & 1 349 (M+H)+Br. H ЯМР (400 Мгц, DMSО-d6) δ м.д. 2,20 (дкв, J=7,8, 7,5 Гц, 2H), 2,98 (с, 3H), 3,163,24 (м, 2H), 4,42 (т, J=7,4 Гц, 2H), 4,73 (д, J=6,0 Гц, 2H), 5,73 (т, J=5,8 Гц, 1H), 7,42 (дд, J=8,7, 1,9 Гц, 1H), 7,63 (д, J=8,5 Гц, 1H), 7,79-7,83 (м, 1H). Отримання 1-(циклопропіл)-1,3-дигідро-2H-імідазо[4,5-з]піридин-2-она (фрагмент С1) проводили способом, представленим на схемі 7. Схема 7 У круглодонну колбу поміщали 3-нітро-4-хлорпіридин (600 г, 3,8 моль), абсолютний EtOH (3 л), діізопропілетиламін (DIPEA) (1320 мл, 7,6 міль) і циклопропіл амін (432 г, 7,6 моль). Отриманий розчин кип'ятили із зворотним холодильником протягом 10 год. Реакційну суміш охолоджували до 0 °C, і отриману тверду речовину збирали фільтрацією. Відфільтрований осад промивали холодним етанолом (2 × 500 мл) із отриманням сполуки 6. Залишкову рідину концентрували і розділяли між водою (1000 мл) і етилацетатом (1000 мл). Водний шар екстрагували етилацетатом (2 × 500 мл), висушували над MgSО 4, фільтрували і концентрували із отриманням другої партії продукту (всього: 650 г, 96 %). Суспензію сполуки 6 (650 г, 3,65 10 UA 112298 C2 2 5 10 15 моль) і 10 % Pd/C (50 % води; 163 г) в ETOH (7 л) гідрогенізували при 50 фунт/дюйм H2 протягом 16 год. при кімнатній температурі. Суспензію фільтрували через целіт і концентрували. Залишок сушили у вакуумі із отриманням сполуки 7 (490 г, 90,6 %). У розчин сполуки 7 (490 г, 3,29 моль) у CH3CN (4 л) при 0 °C додавали карбонілдіімідазол (CDI) (559 г, 3,45 моль, 1,05 екв.), і отриману суміш нагрівали до кімнатної температури і струшували протягом 16 год. при кімнатній температурі. Осад збирали фільтрацією, і тверду речовину промивали холодними CH3CN (2 × 1000 мл). Тверду речовину сушили у вакуумі із отриманням 1 фрагмента С1 (450 г, 78,2 %). Маса/заряд = 176 (M+H). H ЯМР (400 Мгц, DMSO-d6) δ м.д. 0,840,91 (м, 2H), 0,98-1,06 (м, 2H), 2,89 (тт, J=7,0, 3,5 Гц, 1H), 7,18 (д, J=5,5 Гц, 1H), 8,16 (с, 1H), 8,19 (д, J=5,5 Гц, 1H), 10,98 (ушир. с, 1H). Приклади 2-27 Похідні P1 і P3-P27 отримували способами, описаними вище для отримання P2. Сполуки P1-P27 тестували на інгібіторную активність по відношенню до RSV (табл. 1). Приклад 28 Отримання 3-((5-хлор-1-(4-фторбутил)-1H-бензо[d]імідазол-2-іл)метил)-1-(метилсульфоніл)1H-імідазо[4,5-з]піридин-2(3H)-она (P34). Етап 1 20 25 30 35 До розчину спирту 8 (363 мг, 1,414 ммоль) у 30 мл дихлорметану додавали по краплях розчин тіонілхлориду (336 мг, 2 екв.) у 10 мл дихлорметану. Реакційну суміш перемішували протягом однієї години при 45 °C. Потім її концентрували у вакуумі з отриманням бажаної проміжної сполуки 9 (440 мг, 99 %) у вигляді солі HCl, яку використовували на наступному етапі. Етап 2 До розчину 1-(метилсульфоніл)-1H-імідазо[4,5-з]піридин-2(3H)-он гідрохлорида 10 (720 мг, 2,626 ммоль) у 10 мл додаткового сухого DMF додавали гідрид натрію (210 мг, 5,253 ммоль, 60 % колоїдний розчин у маслі) порційно при кімнатній температурі. Через 20 хвилин по краплях додавали розчин 5-хлор-2-(хлорметил)-1-(4-фторбутил)-1Н-бензо[d]імідазол гідрохлорида 9 (440 мг, 1,313 ммоль) у 5 мл DMF. Протягом ночі при кімнатній температурі проводили струшування. Потім реакційну суміш розводили водою (50 мл) і екстрагували із застосуванням EtOAc (2 × 50 мл). Органічні шари об'єднували, промивали насиченим сольовим розчином, висушували над MgSO4, фільтрували і концентрували у вакуумі. Отримане блідо-помаранчеве масло розтирали в DCM, і осад фільтрували. Далі його промивали DCM і простим ефіром ізопропіла і висушували в умовах сильного розрідження з отриманням титульного продукту 3((5-хлор-1-(4-фторбутил)-1Н-бензо[d]імідазол-2-іл)метил)-1-(метилсульфоніл)-1H-імідазо[4,5 11 UA 112298 C2 5 10 15 20 25 30 35 с]піридин-2(3H)-она P34 у вигляді білої твердої речовини з виходом 40 %; маса/заряд = 452 + (M+H) . Приклад 29 Отримання 4-(5-хлор-2-((1-циклопропіл-2-оксо-1H-імідазо[4,5-з]піридин-3(2H) -іл)метил)-1Hбензо[d]імідазол-1-іл)бутанової кислоти (P45) До сполуки P52 (2,8 г, 5,8 ммоль), розчиненої в THF (100 мл), додавали гідроксид літію (556 мг, 23 ммоль), розчинений у воді (25 мл). Отриману суміш перемішували при кімнатній температурі протягом ночі. Потім реакційну суміш вливали у воду, підкислену до pH4 за допомогою 1M водного розчину соляної кислоти. Отриману суміш екстрагували дихлорметаном. Органічний шар сушили над MgSО4 і концентрували. Залишок очищали за допомогою колонкової хроматографії з застосуванням дихлорметану і метанолу з отриманням вказаної в + заголовку сполуки P45 у вигляді білого порошку (2,37 г, 84 %); маса/заряд = 426 (M+H) . Приклад 30 Отримання 3-((5-бром-1-(4-морфоліно-4-оксобутил)-1H-бензо[d]імідазол-2-іл)метил)-1циклопропіл-1H-імідазо[4,5-з]піридин-2(3H)-она (P48) До карбонової кислоти P84 (500 мг, 1 ммоль), розчиненої в ацетонітрилі (50 мл), однократно додавали карбоніл діімідазол (207 мг, 2,3 ммоль). Суміш перемішували при 50 °C протягом ночі. Потім суміші дозволяли остигнути до кімнатної температури і додавали морфолін (278 мг, 3,2 ммоль). Отриману суміш перемішували при кімнатній температурі протягом 4 годин, потім вливали у воду (50 мл) і екстрагували дихлорметаном (30 мл). Органічний шар сушили над MgSО4 і потім концентрували. Залишок очищали за допомогою колонкової хроматографії із застосуванням дихлорметану і метанолу. Продукт P48 виділяли у вигляді білого порошку (200 + мг, 34 %); маса/заряд = 540 (M+H) . Приклад 31 Отримання 4-(5-хлор-2-((1-циклопропіл-2-оксо-1H-імідазо[4,5-з]піридин-3(2H)-іл)метил)-1Hбензо[d]імідазол-1-іл)-N-(циклопропілсульфоніл)бутанаміда (P49) До розчину P45 (500 мг, 1,17 ммоль) в ацетонітрилі (50 мл) додавали карбоніл діімідазол (210 мг, 1,3 ммоль). Отриману суміш перемішували при 50 °C протягом 2 годин. Потім суміші дозволяли остигнути до кімнатної температури і додавали послідовно циклопропан сульфонамід (157 мг, 1,29 ммоль) і DBU (268 мг, 1,76 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Отриману суміш вливали у воду (50 мл) і потім додавали дихлорметан (50 мл). Суміш підкислювали 1M розчином соляної кислоти до pH4 і 12 UA 112298 C2 5 потім екстрагували дихлорметаном. Органічний шар сушили над MgSO 4 і потім концентрували. Залишок очищали за допомогою колонкової хроматографії з отриманням P49 (487 мг, 78 %) у + вигляді білого порошку; маса/заряд = 544 (M+H) . Приклад 32 Отримання 3-({5-хлор-1-[3-(1Н-імідазол-1-іл)пропіл]-1H-бензімідазол-2-іл}метил)-1циклопропіл-l, 3-дигідро-2H-імідазо[4,5-с]піридин-2-она (P51) Стадія 1 10 15 4-хлор-N-[3-(1H-імідазол-1-іл)пропіл]-2-нітроанілін (11, 5 г, 17,8 ммоль) розчиняли в 100 мл метанолу (MEOH) і додавали палладій на активованому вугіллі (10 %, 120 мг, 0,1 екв.) в атмосфері азоту. Розчин гідрогенізували при 1 бар протягом 16 годин. Реакційну суміш фільтрували через целіт, і фільтрат концентрували у вакуумі і очищали за допомогою флеш1 хроматографії (від 0 до 10 % метанолу в CH2Cl2) з отриманням 4-хлор-N -[3-(1Н-імідазол-1іл)пропіл]бензол-1,2-діаміна (12, 2,18 г, 49 %) у вигляді твердої речовини; LCMS маса/заряд = + 251 (M+H) . Стадія 2 1 20 25 30 Гліколеву кислоту (1,98 г, 26 ммоль, 3 екв.) додавали в розчин 4-хлор-N -[3-(1Н-імідазол-1іл)пропіл]бензол-1,2-діаміна (12, 2,18 г, 8,7 ммоль) у HCl (6н, 20 мл) при кімнатній температурі. Реакційну суміш нагрівали до 90 °C протягом 16 годин. Після охолоджування до температури довкілля реакційну суміш розбавляли 100 мл води з подальшим додаванням NaHCO 3 до досягнення pH, що становить приблизно 7. Додавали CH2Cl2 (30 мл), відділяли органічний шар і екстрагували водний шар додатковим CH2Cl2 (20 мл). Об'єднані органічні шари сушили (MgSO4), фільтрували і концентрували у вакуумі і очищали за допомогою флеш-хроматографії (від 0 до 10 % MeOH у CH2Cl2) з отриманням {5-хлор-1-[3-(1Н-імідазол-1-іл)пропіл]-1Н-бензімідазол-2+ іл}метанолу (13, 740 мг, 30 %) у вигляді білої твердої речовини; LCMS маса/заряд = 291 (M+H) . Етап 3 У 100 мл колбі {5-хлор-l-[3-(1Н-імідазол-1-іл)пропіл]-1Н-бензімідазол-2-іл} метанол (13) (740 мг, 2,54 ммоль), трифенілфосфін (667,5 мг, 2,54 ммоль, 1 екв.) і 1-циклопропіл-1,3-дигідро-2Hімідазо[4,5-з]піридин-2-он (фрагмент С1) (443,3 мг, 2,54 ммоль, 1 екв.) розчиняли в 13 UA 112298 C2 5 10 15 20 25 30 35 тетрагідрофурані (THF) (60 мл). Розчин поміщали в атмосферу N 2 і за допомогою шприца додавали діізопропілaзодикарбоксилат (DIAD) (0,752 мл, 3,8 ммоль, 1,5 екв.). Реакційну суміш перемішували при кімнатній температурі в атмосфері азоту протягом 16 годин. Суміш випарювали насухо і заздалегідь очищали за допомогою ВЕРХ на колонці RP SunFire Prep С18 (OBD-10 мкм, 30 × 150 мм) із застосуванням 0,25 % NH4HCO3 у розчині вода-CFBCN, що застосовувався як елюент. Після випарювання і висушування у вакуумі отримували 3-({5-хлор-l[3-(1Н-імідазол-1-іл) пропіл]-1Н-бензімідазол-2-іл}метил)-1-циклопропіл-1,3-дигідро-2Hімідазо[4,5-с]піридин-2-он (P51, 635 мг, 58 %) у вигляді білої твердої речовини; LCMS + маса/заряд = 448 (M+H) . Приклад 33 Отримання 4-(5-хлор-2-((1-циклопропіл-2-оксо-1Н-імідазо[4,5-с]піридин-3(2H)-іл)метил)-1Нбензо[d]імідазол-1-іл)-N-(циклопропілсульфоніл)-N-метилбутанаміда До розчину P49 (500 мг, 0,94 ммоль) у DMF (50 мл) додавали карбонат цезію (616 мг, 1,9 ммоль). Отриману суміш перемішували при кімнатній температурі протягом 1 години і потім додавали метиліодид (0,059 мл, 1,9 ммоль). Отриману суміш перемішували при кімнатній температурі протягом ночі. Потім суміш вливали у воду і екстрагували дихлорметаном, висушували над MgSО4 і концентрували. Залишок очищали за допомогою колонкової хроматографії із застосуванням дихлорметану і метанолу із отриманням P59 (120 мг, 21 %) у + вигляді білого порошку; маса/заряд = 544 (M+H) . Приклад 34 Отримання (3-{[5-хлор-l-(4-фторбутил)-1Н-бензімідазол-2-іл]метил}-2-оксо-2,3-дигідро-1Німідазо[4,5-с]піридин-1-іл)оцтової кислоти У 100 мл сухій колбі трет-бутил(3-{[5-хлор-1-(4-фторбутил)-1Н-бензімідазол-2-іл]метил}-2оксо-2,3-дигідро-1Н-імідазо[4,5-з]піридин-1-іл)ацетат (P33) (1,74 г, 3,49 ммоль) розчиняли в 50 мл суміші тетрагідрофуран/вода (3/1). У розчин додавали гідроксид літію (167,3 мг, 6,98 ммоль, 2 екв.), і суміш перемішували протягом 16 годин при кімнатній температурі. Реакційну суміш розбавляли водою (20 мл) з подальшим додаванням водної HCl (1M) до досягнення pH, що становить приблизно 6. У реакційну суміш додавали дихлорметан (40 мл) і відділяли органічний шар. Водний шар випарювали насухо і висушували в печі протягом 16 годин із отриманням (3{[5-хлор-1-(4-фторбутил)-1Н-бензімідазол-2-іл]метил}-2-оксо-2,3-дигідро-1Н-імідазо[4,5с]піридин-1-іл)оцтової кислоти (P67, 1,6 г, 100 %) у вигляді білої твердої речовини; LCMS + маса/заряд = 432 (M+H) . Приклад 35 Отримання 2-(3-{[5-хлор-l-(4-фторбутил)-1Н-бензімідазол-2-іл]метил}-2-оксо-2,3-дигідро-1Німідазо[4,5-с]піридин-1-іл)-N-циклопропілацетаміда (P68) 14 UA 112298 C2 5 10 15 20 25 30 35 40 У 100 мл сухій колбі (3-{[5-хлор-1-(4-фторбутил)-1Н-бензімідазол-2-іл]метил}-2-оксо-2,3дигідро-1Н-імідазо[4,5-з]піридин-1-іл)оцтову кислоту (P67, 300 мг, 0,69 ммоль), діізопропілетиламін (0,29 мл, 2,08 ммоль, 3 екв.), циклопропіламін (60 мкл, 0,83 ммоль, 1,2 екв.) і 2-(1Н-7-азaбензотриазол-1-іл)-1,1,3,3-тетраметилуроніум гексафторфосфат метанамініум (HATU, 316,9 мг, 0,83 ммоль, 1,2 екв.) розчиняли в DMF (50 мл). Розчин поміщали в атмосферу N2 і струшували при кімнатній температурі протягом 1 години. Реакційну суміш розбавляли водою (20 мл) і екстрагували дихлорметаном (50 мл). Органічний шар сушили над MgSО 4 і випарювали. Залишок далі кристалізували в діізопропіловому ефірі/ацетонітрилі. Тверду речовину фільтрували і висушували в печі протягом 16 годин із отриманням 2-(3-{[5-хлор-1-(4фторбутил)-1Н-бензімідазол-2-іл]метил}-2-оксо-2,3-дигідро-1H-імідазо[4,5-з]піридин-1-іл) -Nциклопропілацетаміда (P68, 86 мг, 26 %) у вигляді білої твердої речовини; LCMS маса/заряд = + 471 (M+H) . Приклад 36 Отримання 4-(5-бром-2-((l-циклопропіл-2-оксо-1Н-імідазо[4,5-с]піридин-3(2H)-іл)метил)-1Нбензо[d]імідазол-1-іл)-N-сульфамоїлбутанаміда (P76) Сполуку P36 (4,5 г, 9,57 ммоль), DCC (2,0 г, 9,57 ммоль) і SuOH (1,4 г, 12,4 ммоль) у DMF (50 мл) перемішували протягом 14 год. при 20 °C. Потім суміш виливали в крижану воду (100 мл). Суміш екстрагували за допомогою CH2Cl2 (2*100 мл). Органічні шари промивали насиченим сольовим розчином, висушували над MgSO4, фільтрували і випарювали у вакуумі з отриманням 4,5 г проміжної сполуки, яку використовували на наступному етапі без подальшого очищення. Попередню проміжну сполуку (1,0 г, 1,76 ммоль), сульфонамід (0,51 г, 5,3 ммоль) і DMAP (0,65 г, 5,3 ммоль) у CH2Cl2 (10 мл) перемішували і нагрівали із зворотним холодильником протягом 14 год. Потім суміш випарювали у вакуумі. Залишок очищали за допомогою високоефективної рідинної хроматографії (C18, елюент: CH 3CN/H2О від 15/85 до 35/65 з 10 ммоль/л HCl як буфер). Збирали чисті фракції і випарювали органічний розчинник. Додавали 10 % NaHCО3 до pH=8. Суміш фільтрували, і тверду речовину промивали H 2О (2*10 мл). Продукт отримували за допомогою ліофілізації (80 мг, вихід 10 %). 1 H ЯМР (400 Мгц, ДМСО-d) d м.д. 0,88-0,94 (м, 2H) 1,03-1,10 (м, 2H) 1,82-1,92 (м, 2H) 2,202,28 (м, 2H) 2,97 (кв, J=3,47 Гц, 1H) 4,34 (т, J=7,98 Гц, 2H) 5,42 (с, 2H) 7,29 (д, J=5,10 Гц, 1H) 7,40 (дд, J1=8,68 Гц, J2=1,74 Гц, 1H) 7,63 (д, J=8,68, 1H) 7,80 (д, J=1,74 Гц, 1H) 8,26 (д, J=5,20 Гц, 1H) 8,38 (с, 1H) Приклади 37-85 Похідні P28-33, P35-44, P46,47,50, P52-58, P60-66, P69-75 і P77-P85 отримували за допомогою способів, описаних вище. Всі сполуки P28-83 тестували на інгібіторну активність відносно RSV (таблиця 2). Приклади 86-89 Похідні P86-P89 отримували за допомогою способів, описаних вище та/або відомими в даній області способами (таблиця 3). Загальні експериментальні характеристики Аналіз ВЕРХ-МС проводили одним з наступних способів: Спосіб 1: 15 UA 112298 C2 5 10 15 20 25 30 35 40 45 50 55 60 Виміри по ВЕРХ проводили із застосуванням модуля Agilent 1100, який включає насос, детектор на діодній матриці (DAD) (застосована довжина хвилі 220 нм), нагрівач колонки і колонку, як визначено нижче. Потік у колонці розділяли для спрямування в Agilent MSD Series G1946C і G1956A. Детектор MS був забезпечений API-ES (пристрій для іонізації електророзпилюванням таким при атмосферному тиску). Мас-спектри отримували за допомогою сканування від 100 до 1000. Напруга капілярної голки складала 2500 В для режиму позитивної іонізації і 3000 В для режиму негативної іонізації. Напруга фрагментації складала 50 В. Температуру осушення газу підтримували на рівні 350 °C при потоці 10 л/хв. Зворотнофазову ВЕРХ проводили на колонці YMC-Pack ODS-AQ, 50 × 2,0 мм 5 мм із швидкістю потоку 0,8 мл/хв. Застосовували дві рухомі фази (рухома фаза A: вода з 0,1 % TFA; рухома фаза B: ацетонітрил з 0,05 % TFA). Спочатку 100 % A утримували протягом 1 хв. Потім застосовували градієнт до 40 % A і 60 % B за 4 хв і утримували протягом 2,5 хв. Застосовували типовий об'єм проби, що вводилася, що становить 2 мл. Температура печі складала 50 °C. (Полярність МС: позитивна.) Спосіб 2: Виміри по ВЕРХ проводили із застосуванням модуля Agilent 1100, який включає насос, детектор на діодній матриці (DAD) (застосована довжина хвилі 220 нм), нагрівач колонки і колонку, як визначено нижче. Потік у колонці розділяли для спрямування в Agilent MSD Series G1946C і G1956A. Детектор MS був забезпечений API-ES (пристрій для іонізації електророзпилюванням при атмосферному тиску). Мас-спектри отримували за допомогою сканування від 100 до 1000. Напруга капілярної голки складала 2500 В для режиму позитивної іонізації і 3000 В для режиму негативної іонізації. Напруга фрагментації складала 50 В. Температуру осушення газу підтримували на рівні 350 °C при потоці 10 л/хв. Зворотно-фазову ВЕРХ проводили на колонці YMC-Pack ODS-AQ, 50 × 2,0 мм 5 мм із швидкістю потоку 0,8 мл/хв. Застосовували дві рухомі фази (рухома фаза A: вода з 0,1 % TFA; рухома фаза B: ацетонітрил з 0,05 % TFA). Спочатку 90 % A і 10 % B утримували протягом 0,8 хвилин. Потім застосовували градієнт до 20 % A і 80 % B за 3,7 хвилин і утримували протягом 3 хвилин. Застосовували типовий об'єм проби, що вводилась, що становить 2 мл Температура печі складала 50 °C. (Полярність МС: позитивна.) Спосіб 3: Колонка: XTerra MS С18 2,5μ, 4,6 × 50 мм, рухома фаза A: 10 ммоль NH 4OOCH+0,1 % HCOOH у H2O, рухома фаза B: MeOH при температурі колонки 50 °C із застосуванням швидкості потоку 1,5 мл/хв. Умови градієнта: t=0 хв: 65 % A, 35 % B; t=3,5 хв: 5 % A, 95 % B; t=5,5 хв: 5 % A, 95 % B; t=5,6 хв: 65 % A, 35 % B; t=7 хв: 65 % A, 35 % B. Спосіб 4: Колонка: SunFire C18 3,5μ 4,6 × 100 мм, рухома фаза A: 10 ммоль NH 4OOCH+0,1 % HCOOH у H2O, рухома фаза B: MeOH при температурі колонки 50 °C із застосуванням швидкості потоку 1,5 мл/хв. Умови градієнта: t=0 хв: 65 % A, 35 % B; t=7 хв: 5 % A, 95 % B; t=9,6 хв: 5 % A, 95 % B; t=9,8 хв: 65 % A, 35 % B; t=12 хв: 65 % A, 35 % B. Спектри ЯМР записували на спектрометрі Bruker 400 при 400 Мгц протягом 1 години. Хімічні зрушення наведені в м.д, а значення J у Гц. Мультиплетності представлені наступними скороченнями: d - дублет, t - триплет, m - мультиплет і так далі. Тонкошарову хроматографію (TLC) проводили на 5 × 10 см алюмінієвих пластинах, покритих Silicagel 60 F254 (Merck KGaA). Противірусна активність Чорні 96-лункові планшети з прозорим дном для мікротитрування (Corning, Amsterdam, The Netherlands) заповнювали в двох дослідах із застосуванням спеціальної налагодженої автоматичної системи серійними 4-кратними розведеннями сполуки в кінцевому об'ємі 50 мкл середовища для культивування [середовище RPMI без фенолового червоного, 10 % FBS, 0,04 % гентаміцина (50 мг/мл) і 0,5 % DMSO]. Потім у кожну лунку додавали 100 мкл клітинної 4 суспензії HeLa (5 × 10 клітин/мл) у середовищі для культивування з подальшим додаванням 50 мкл rgRSV224 (MOI=0,02) вірусу в середовищі для культивування із застосуванням багатоканальної піпетки (Thermo Scientific, Erembodegem, Belgium). Вірус rgRSV224 є отриманим способами генної інженерії вірус, який містить додатковий ген GFP (Hallak et al, 2000) і придбаний з ліцензією в NIH (Bethesda, MD, USA). Середовище, заражені вірусом контролі і ложнозаражені контролі включали в кожен тест. Клітини інкубували при 37 °C у атмосфері 5 % CO2. Через три доби після інфікування вірусну реплікацію оцінювали за допомогою виміру експресії GFP у клітинах із застосуванням лазерного мікроскопа MSM (Tibotec, Beerse, Belgium). EC50 визначали як 50 % інгібіторну концентрацію по відношенню до експресії GFP. Паралельно сполуки інкубували протягом трьох діб у білих 96-лункових планшетах для мікротитрування (Corning) і визначали цитотоксичність сполук у клітинах HeLa за 16 UA 112298 C2 5 10 15 20 допомогою виміру вмісту АТФ у клітинах із застосуванням набору ATPlite (PerkinElmer, Zaventem, Belgium) згідно інструкціям виробника. CC50 визначали як 50 % цитотоксичну концентрацію. Посилання Hallak LK, Spillmann D, Collins PL, Peeples ME. Glycosaminoglycan sulfation requirements for respiratory syncytial virus infection. J. Virol. 740, 10508-10513 (2000). Оцінка серцево-судинної безпеки Дія сполук, описаних у даному винаході, і пов'язаних сполук BMS-433771 на кардіогемодинамічні і кардіо-електрофізіологічні характеристики оцінювали у анестезованих морських свинок. Для цієї мети вимірювали параметри електрокардіограми з поверхні тіла (ECG), частоту серцевих скорочень і середній артеріальний тиск у двох експериментальних групах. У першій групі (n=7) зростаючі дози сполуки, що підлягала оцінці (0,32, 0,64, 1,25, 2,5, 5 і 10 мг/кг) вводили внутрішньовенно протягом 5 хв із 15-хвилинними інтервалами. У другій групі (n=7) вводили відповідні об'єми носія за тією ж схемою. Відомо, що дана експериментальна модель дозволяє легко виявляти ефект, який спричиняють на ECG сполуки, що викликають електрофізіологічні зміни серця, включаючи подовження інтервалу QTc, аналогічні очікуваним змінам у людини (De Clerck, F, Fundam. Clin. Pharm.; 2002; 16: 125-139; Testai J. Appl. Toxicol; 2004; 24: 217-222). Концентрації, що призводили до значного подовження QTcB (p
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzimidazole respiratory syncytial virus inhibitors
Автори англійськоюCooymans, Ludwig Paul, Demin, Samuel Dominique, Hu, Lili, Jonckers, Tim Hugo Maria, Raboisson, Peirre Jean-Marie Bernard, Tahri, Abdellah, Vendeville, Sandrine Marie Helene
Автори російськоюКойманс Людвиг Пол, Демин Самюель Доминик, Ху Лили, Джонкерс Тим Хьюго Мария, Рэбойсон Пьер Жан-Мария Бернард, Тахри Абделах, Ведевиль Садрин Мари Хелен
МПК / Мітки
МПК: A61K 31/4188, C07D 235/26, C07D 471/04, A61P 11/00
Мітки: вірусу, респіраторно-синцитіального, інгібітори, бензімідазолові
Код посилання
<a href="https://ua.patents.su/42-112298-benzimidazolovi-ingibitori-respiratorno-sincitialnogo-virusu.html" target="_blank" rel="follow" title="База патентів України">Бензімідазолові інгібітори респіраторно-синцитіального вірусу</a>
Попередній патент: Рекомбінантна мікобактерія як вакцина для застосування на людях
Наступний патент: Пристрій та спосіб встановлення вітрового скла
Випадковий патент: Спосіб оцінки якості проведення випробувань вогнестійкості будівельних конструкцій