Гетероцикліл-3-сульфоніліндазоли як ліганди 5-гідрокситриптаміну-6
Номер патенту: 80184
Опубліковано: 27.08.2007
Автори: Робічод Альберт Джін, Бернотас Рональд Чарльз, Янь Іньфа, Лю Гуанчен
Формула / Реферат
1. Сполука формули І

де
А являє собою С, CR8 або N;
R1 являє собою Н, галоген, CN, COR9, OCО2R10, CO2R11, CONR12R13, SOXR14, NR15R16, OR17 або С1-С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена;
R2 являє собою необов'язково заміщену С1-С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну групу або необов'язково заміщену 8-13-членну біциклічну або трициклічну систему, що містить N атом у головній частині з місточковим зв'язком і необов'язково містить 1, 2 або 3 додаткових гетероатоми, вибраних з атомів N, О або S;
R3 являє собою Н або С1-С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена;
R4 являє собою Н або С1-С6алкільну або С3-С7циклоалкільну групу, кожна з яких необов'язково заміщена;
R5, R6 і R7 кожен незалежно являє собою Н або С1-С6алкільну або С3-С7циклоалкільну групу, кожна з яких необов'язково заміщена;
m і р кожен незалежно є цілим числом, що дорівнює 1, 2 або 3;
n є цілим числом, що дорівнює 1 або 2;
R8 являє собою Н, ОН або необов'язково заміщену С1-С6алкоксигрупу;
R9, R10, R11 і R17 кожен незалежно являє собою Н або С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3-С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена;
R12, R13, R15 і R16 кожен незалежно являє собою Н або необов'язково заміщену С1-С4алкільну групу, або R12 і R13, або R15 і R16, взяті разом з атомом, до якого приєднані, можуть утворювати 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний із О, NR18 або SOX;
R14 являє собою С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3-С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена;
R18 являє собою Н або С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3-С7циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена;
х дорівнює 0 або є цілим числом, що дорівнює 1 або 2; і
![]() являє собою одинарний або подвійний зв'язок, або її стереоізомер, або їх фармацевтично прийнятні солі.
являє собою одинарний або подвійний зв'язок, або її стереоізомер, або їх фармацевтично прийнятні солі.
2. Сполука за п.1, де n дорівнює 1.
3. Сполука за п.1 або п. 2, де R4 являє собою Н або необов'язково заміщену С1-С4алкільну групу.
4. Сполука за будь-яким з пп.1-3, де R2 являє собою необов'язково заміщену фенільну, нафтильну або гетероарильну групу.
5. Сполука за будь-яким з пп.1-4, де 6- або 7-членне азакільце приєднане до індазолу в положенні 5 або 7.
6. Сполука за будь-яким з пп. 1-5, де А являє собою N.
7. Сполука за будь-яким з пп.1-6, де R3 вибраний з водню, фенілу і С1-С4алкілу, який може бути необов'язково заміщений необов'язково заміщеним фенілом.
8. Сполука за будь-яким з пп.1-7, де m дорівнює 1 і R1 являє собою водень або галоген.
9. Сполука за п.1, яка являє собою одну з наступних сполук:
5-(4-метилпіперазин-1-іл)-3-(1-нафтилсульфоніл)-1Н-індазол;
3-(1-нафтилсульфоніл)-5-піперазин-1-іл-1Н-індазол;
1-(3-хлорбензил)-5-(4-метилпіперазин-1-іл)-3-(1-нафтилсульфоніл)-1Н-індазол;
7-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)-1Н-індазол;
3-(фенілсульфоніл)-7-(4-пропілпіперазин-1-іл)-1Н-індазол;
3-(фенілсульфоніл)-7-піперазин-1-іл-1Н-індазол;
5-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)-1Н-індазол;
3-(фенілсульфоніл)-5-(4-пропілпіперазин-1-іл)-1Н-індазол;
3-(фенілсульфоніл)-5-піперазин-1-іл-1Н-індазол;
5-піперазин-1-іл-3-[(3-ціанофеніл)сульфоніл]-1Н-індазол;
7-(4-метилпіперазин-1-іл)-3-[(2-фенетил)сульфоніл]-1Н-індазол;
3-(1-нафтилсульфоніл)-7-(4-пропілпіперазин-1-іл)-1Н-індазол;
5-(4-фенетилпіперазин-1-іл)-3-(1-нафтилсульфоніл)-1Н-індазол;
5-(4-метилпіперазин-1-іл)-3-(2-нафтилсульфоніл)-1Н-індазол;
3-[(2-хлор-4-фторфеніл)сульфоніл]-5-піперазин-1-іл-1Н-індазол;
1-метил-3-(фенілсульфоніл)-5-піперазин-1-іл-1Н-індазол;
1-феніл-3-(фенілсульфоніл)-5-піперазин-1-іл-1Н-індазол;
1-метил-3-(фенілсульфоніл)-7-піперазин-1-іл-1Н-індазол;
1-феніл-3-(фенілсульфоніл)-7-(піперазин-1-іл)-1Н-індазол;
7-піперазин-1-іл-3-[(3-фторфеніл)сульфоніл]-1Н-індазол;
3-[(4-фторфеніл)сульфоніл]-7-(4-метилпіперазин-1-іл)-1Н-індазол;
3-[(2-хлорфеніл)сульфоніл]-7-піперазин-1-іл-1Н-індазол;
3-[(4-амінофеніл)сульфоніл]-7-(піперазин-1-іл)-1Н-індазол;
5-піперазин-1-іл-3-[(3-фторфеніл)сульфоніл]-1Н-індазол;
3-[(4-фторфеніл)сульфоніл]-5-(4-метилпіперазин-1-іл)-1Н-індазол;
3-[(2-хлорфеніл)сульфоніл]-5-(пропілпіперазин-1-іл)-1Н-індазол;
3-[(4-амінофеніл)сульфоніл]-5-піперазин-1-іл-1Н-індазол;
3-[(5-хлортієн-2-іл)сульфоніл]-5-піперазин-1-іл-1Н-індазол;
3-[(5-хлортієн-2-іл)сульфоніл]-7-піперазин-1-іл-1Н-індазол;
4-хлор-3-(фенілсульфоніл)-7-піперазин-1-іл-1Н-індазол;
5-фтор-3-(фенілсульфоніл)-7-піперазин-1-іл-1Н-індазол;
6-фтор-3-(фенілсульфоніл)-7-піперазин-1-іл-1Н-індазол;
4-хлор-3-(фенілсульфоніл)-5-піперазин-1-іл-1Н-індазол;
7-фтор-3-(фенілсульфоніл)-5-піперазин-1-іл-1Н-індазол;
6-фтор-3-(фенілсульфоніл)-5-піперазин-1-іл-1Н-індазол;
6-(4-фенетилпіперазин-1-іл)-3-(фенілсульфоніл)-1Н-індазол;
6-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)-1Н-індазол;
6-(4-пропілпіперазин-1-іл)-3-(фенілсульфоніл)-1Н-індазол;
3-(фенілсульфоніл)-6-піперазин-1-іл-1Н-індазол;
4-піперазин-1-іл-3-(фенілсульфоніл)-1Н-індазол;
4-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)-1Н-індазол;
4-(4-пропілпіперазин-1-іл)-3-(фенілсульфоніл)-1Н-індазол;
3-(фенілсульфоніл)-4-піперазин-1-іл-1Н-індазол;
3-[(5-хлортієн-2-іл)сульфоніл]-5-піперидин-1-іл-1Н-індазол;
3-[(5-хлортієн-2-іл)сульфоніл]-7-піперидин-1-іл-1Н-індазол;
1-метил-3-(фенілсульфоніл)-5-піперидин-1-іл-1Н-індазол;
3-[(3-фторфеніл)сульфоніл]-5-піперидин-1-іл-1Н-індазол;
1-метил-3-(фенілсульфоніл)-7-(4-метилпіперидин-1-іл)-1Н-індазол;
3-[(3-фторфеніл)сульфоніл]-7-піперидин-1-іл-1Н-індазол;
3-[(3-фторфеніл)сульфоніл]-5-піперидин-1-іл-1Н-індазол;
3-(фенілсульфоніл)-5-піперидин-1-іл-1Н-індазол;
1-метил-3-[(3-фторфеніл)сульфоніл]-7-піперидин-1-іл-1Н-індазол;
3-(фенілсульфоніл)-7-піперидин-1-іл-1Н-індазол;
або їх стереоізомери, або їх фармацевтично прийнятні солі.
10. Спосіб лікування розладу центральної нервової системи, пов'язаного з 5-НТ6 рецептором або опосередковуваного 5-НТ6 рецептором, у пацієнта, що потребує такого лікування, який включає введення зазначеному пацієнту терапевтично ефективної кількості сполуки формули І за будь-яким з пп.1-9 або її стереоізомера, або їх фармацевтично прийнятної солі.
11. Спосіб за п.10, де зазначений розлад являє собою руховий розлад, розлад, пов'язаний зі станом страху, або розлад пізнавальної здатності.
12. Спосіб за п. 10, де зазначений розлад являє собою нейродегенеративний розлад.
13. Спосіб за п. 11, де зазначений розлад вибраний із групи, що включає дефіцит уваги, абсесивно-компульсивний розлад, синдром відміни прийому лікарського засобу, алкогольну або нікотинову залежність, шизофренію, депресію, хворобу Альцгеймера.
14. Спосіб за п.12, де зазначений розлад вибраний із групи, що включає удар, травму голови і невропатичний біль.
15. Фармацевтична композиція, яка містить фармацевтично прийнятний носій і сполуку формули І за будь-яким з пп.1-9 або її стереоізомер, або їх фармацевтично прийнятну сіль.
16. Спосіб одержання сполуки формули (І) за п.1, який включає одне з наступного:
(а) діазотування і циклізацію сполуки формули (VІIA):
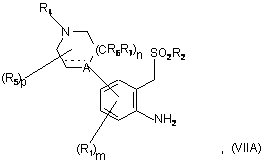
де пунктирна лінія, m, n, p, A, R1, R2, R4, R5, R6 і R7 мають значення, визначені в п.1, наприклад, при використанні суміші NaNO2/кислота, з одержанням сполуки формули (І), де R3 являє собою водень,
або
(b) алкілування або арилування захищеної сполуки формули (ІА)

де пунктирна лінія, m, n, p, A, R1, R2, R5, R6 і R7 мають значення, визначені в п. 1, і Р являє собою захисну групу або R4, де R4 має значення, визначені вище, за винятком водню, при використанні алкілуючого або арилуючого агента формули R3-LG, де LG являє собою відхідну групу, і R3 являє собою С1-С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; і, якщо необхідно, видалення захисної групи з одержанням відповідної сполуки формули (І), де R3 являє собою С1-С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена;
(с) алкілування сполуки формули (ІB)
або

де пунктирна лінія, m, n, p, A, R1, R2, R3, R5, R6 і R7 мають значення, визначені в п.1, при використанні алкілуючого агента формули R4-LG, де LG являє собою відхідну групу, і R4 являє собою С1-С6алкільну або С3-С7циклоалкільну групу, кожна з яких необов'язково заміщена, з одержанням відповідної сполуки формули (І), де R4 являє собою С1-С6алкільну або С3-С7циклоалкільну групу, кожна з яких необов'язково заміщена;
або
(d) взаємодію сполуки формули (XII):

де m, R1, R2 і R3 мають значення, визначені в п.1, і LG' являє собою відхідну групу, таку як Сl, Вr, І, або активовану гідроксильну групу, таку як трифлат, зі сполукою формули (V):

де n, р, R4, R5, R6 і R7 мають значення, визначені в п.1, у присутності каталізатора, наприклад, паладієвого або нікелевого каталізатора, з одержанням відповідної сполуки формули (І), де А являє собою N;
або
(e) відновлення сполуки формули (XVI):

де m, n, p, R1, R2, R5, R6 і R7 мають значення, визначені в п.1, Р являє собою захисну групу або R4, значення якого визначені в п.1, і Р' являє собою захисну групу або R3, значення якого визначені в п.1, якщо необхідно, з видаленням будь-якої захисної групи і одержанням відповідної сполуки формули (І), де А являє собою СН;
або
(f) підкислення сполуки формули (XV):

де m, n, p, R1, R2, R5, R6 і R7 мають значення, визначені в п.1, Р являє собою захисну групу або R4, значення якого визначені в п.1, і Р' являє собою захисну групу або R3, значення якого визначені в п.1, якщо необхідно, з видаленням будь-якої захисної групи і одержанням відповідної сполуки формули (І), де А являє собою С, і ![]() являє собою подвійний зв'язок;
являє собою подвійний зв'язок;
або
(g) перетворення основної сполуки формули (І) за п. 1 у її кислотно-адитивну сіль або навпаки;
або
(h) виділення стереоізомера сполуки формули (І) з суміші.
Текст
1. Сполука формули І C2 2 (19) 1 3 4. Сполука за будь-яким з пп.1-3, де R2 я вляє собою необо в'язково замі щен у фенільну, нафтильну або гетероарильну групу. 5. Сполука за будь-яким з пп.1-4, де 6- або 7членне азакільце при єднан е до індазолу в положенні 5 або 7. 6. Сполука за будь-яким з пп. 1-5, де А являє собою N. 7. Сполука за будь-яким з пп.1-6, де R3 вибраний з водню, фенілу і С1-С4алкілу, який може бути необов'язково заміщений необов'язково заміщеним фенілом. 8. Сполука за будь-яким з пп.1-7, де m дорівнює 1 і R1 являє собою водень або галоген. 9. Сполука за п.1, яка являє собою одну з наступних сполук: 5-(4-метилпіперазин-1-іл)-3-(1-нафтилсульфоніл)-1Ніндазол; 3-(1-нафтилсульфоніл)-5-піперазин-1-іл-1Ніндазол; 1-(3-хлорбензил)-5-(4-метилпіперазин-1-іл)-3-(1нафтилсуль фоніл)-1Н-індазол; 7-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)-1Ніндазол; 3-(фенілсульфоніл)-7-(4-пропілпіперазин-1-іл)-1Ніндазол; 3-(фенілсульфоніл)-7-піперазин-1-іл-1Н-індазол; 5-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)-1Ніндазол; 3-(фенілсульфоніл)-5-(4-пропілпіперазин-1-іл)-1Ніндазол; 3-(фенілсульфоніл)-5-піперазин-1-іл-1Н-індазол; 5-піперазин-1-іл-3-[(3-ціанофеніл)сульфоніл]-1Ніндазол; 7-(4-метилпіперазин-1-іл)-3-[(2фенетил)сульфоніл]-1Н-індазол; 3-(1-нафтилсульфоніл)-7-(4-пропілпіперазин-1-іл)-1Ніндазол; 5-(4-фенетилпіперазин-1-іл)-3-(1-нафтилсульфоніл)1Н-індазол; 5-(4-метилпіперазин-1-іл)-3-(2-нафтилсульфоніл)1Н-індазол; 3-[(2-хлор-4-фторфеніл)сульфоніл]-5-піперазин-1іл-1Н-індазол; 1-метил-3-(фенілсульфоніл)-5-піперазин-1-іл-1Ніндазол; 1-феніл-3-(фенілсульфоніл)-5-піперазин-1-іл-1Ніндазол; 1-метил-3-(фенілсульфоніл)-7-піперазин-1-іл-1Ніндазол; 1-феніл-3-(фенілсульфоніл)-7-(піперазин-1-іл)-1Ніндазол; 7-піперазин-1-іл-3-[(3-фторфеніл)сульфоніл]-1Ніндазол; 3-[(4-фторфеніл)сульфоніл]-7-(4-метилпіперазин-1іл)-1Н-індазол; 3-[(2-хлорфеніл)сульфоніл]-7-піперазин-1-іл-1Ніндазол; 3-[(4-амінофеніл)сульфоніл]-7-(піперазин-1-іл)-1Ніндазол; 5-піперазин-1-іл-3-[(3-фторфеніл)сульфоніл]-1Ніндазол; 3-[(4-фторфеніл)сульфоніл]-5-(4-метилпіперазин-1іл)-1Н-індазол; 80184 4 3-[(2-хлорфеніл)сульфоніл]-5-(пропілпіперазин-1іл)-1Н-індазол; 3-[(4-амінофеніл)сульфоніл]-5-піперазин-1-іл-1Ніндазол; 3-[(5-хлортієн-2-іл)сульфоніл]-5-піперазин-1-іл-1Ніндазол; 3-[(5-хлортієн-2-іл)сульфоніл]-7-піперазин-1-іл-1Ніндазол; 4-хлор-3-(фенілсульфоніл)-7-піперазин-1-іл-1Ніндазол; 5-фтор-3-(фенілсульфоніл)-7-піперазин-1-іл-1Ніндазол; 6-фтор-3-(фенілсульфоніл)-7-піперазин-1-іл-1Ніндазол; 4-хлор-3-(фенілсульфоніл)-5-піперазин-1-іл-1Ніндазол; 7-фтор-3-(фенілсульфоніл)-5-піперазин-1-іл-1Ніндазол; 6-фтор-3-(фенілсульфоніл)-5-піперазин-1-іл-1Ніндазол; 6-(4-фенетилпіперазин-1-іл)-3-(фенілсульфоніл)-1Ніндазол; 6-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)-1Ніндазол; 6-(4-пропілпіперазин-1-іл)-3-(фенілсульфоніл)-1Ніндазол; 3-(фенілсульфоніл)-6-піперазин-1-іл-1Н-індазол; 4-піперазин-1-іл-3-(фенілсульфоніл)-1Н-індазол; 4-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)-1Ніндазол; 4-(4-пропілпіперазин-1-іл)-3-(фенілсульфоніл)-1Ніндазол; 3-(фенілсульфоніл)-4-піперазин-1-іл-1Н-індазол; 3-[(5-хлортієн-2-іл)сульфоніл]-5-піперидин-1-іл-1Ніндазол; 3-[(5-хлортієн-2-іл)сульфоніл]-7-піперидин-1-іл-1Ніндазол; 1-метил-3-(фенілсульфоніл)-5-піперидин-1-іл-1Ніндазол; 3-[(3-фторфеніл)сульфоніл]-5-піперидин-1-іл-1Ніндазол; 1-метил-3-(фенілсульфоніл)-7-(4-метилпіперидин1-іл)-1Н-індазол; 3-[(3-фторфеніл)сульфоніл]-7-піперидин-1-іл-1Ніндазол; 3-[(3-фторфеніл)сульфоніл]-5-піперидин-1-іл-1Ніндазол; 3-(фенілсульфоніл)-5-піперидин-1-іл-1Н-індазол; 1-метил-3-[(3-фторфеніл)сульфоніл]-7-піперидин1-іл-1Н-індазол; 3-(фенілсульфоніл)-7-піперидин-1-іл-1Н-індазол; або їх стереоізомери, або їх фармацевтично прийнятні солі. 10. Спосіб лікування розладу центральної нервової системи, пов'язаного з 5-НТ6 рецептором або опосередковуваного 5-Н Т6 рецептором, у пацієнта, що потребує такого лікування, який включає введення зазначеному пацієнту терапе втично ефек тивно ї кількості сполуки форм ули І за будь-яким з пп.1-9 або її стереоізомера, або їх фармацевтично прийнятної солі. 11. Спосіб за п.10, де зазначений розлад являє собою рухо вий розлад, розлад, пов'язаний зі станом страху, або розлад пізнавальної здатності. 5 80184 12. Спосіб за п. 10, де зазначений розлад я вляє собою нейроде генерати вний розлад. 13 . Спосіб за п . 11 , де зазна чен ий роз ла д вибраний із гр уп и, що включає дефіцит уваги, абсесивно-компульсивний розлад, синдром відміни прийому лікарського засобу, алкогольну або нікотинову залежність, шизофренію, депресію, хворобу Альцгеймера. 14. Спосіб за п.12, де зазначений розлад вибраний із групи, що включає удар, травму голови і невропатичний біль. 15. Фармаце вти чна композиція, яка місти ть фармацевти чно прийня тний н о сі й і сп олук у фо р м ули І з а будь -як им з пп .1 -9 або її сте р е оі зом ер , а бо їх фармацевтично прийнятну сіль. 1 6 . Сп о сі б одерж ан ня сп о лук и фо рм ули (І) з а п .1 , як ий вк люча є одне з наступного: (а) діазотування і циклізацію сполуки формули (VІIA): R4 H N A (R5 ) p A , (IB) де пунктирна лінія, m, n, p, A, R1, R2, R3, R5, R6 і R7 мають значення, визначені в п.1, при використанні алкілуючого агента формули R4-LG, де LG являє собою відхідн у гр уп у, і R4 являє собою С1С6алкільну або С 3-С7циклоалкільну груп у, кожна з яких необов'язково заміщена, з одержанням відповідної сполуки формули (І), де R4 являє собою С1-С6алкільну або С3-С7циклоалкільну групу, кожна з яких необов'язково заміщена; або (d) взаємодію сполуки формули (XII): SO2R2 N N R3 (R 1) m , (VIIA) (R 1) m де пунктирна лінія, m, n, p, A, R1, R2, R4, R5, R6 і R7 мають значення, визначені в п.1, наприклад, при використанні суміші NaNO2/кислота, з одержанням сполуки формули (І), де R3 являє собою водень, або (b) алкілування або арилування захищеної сполуки формули (ІА) R4 N (R5) p N N (CR6R7)n H (CR 6R7)n SO2R2 N N H (R 1) m , (XII) де m, R1, R2 і R3 мають значення, визначені в п.1, і LG' являє собою відхідну груп у, таку як Сl, Вr, І, або активовану гідроксильну гр упу, таку як трифлат, зі сполукою формули (V): P (R 5) p SO2 R2 (R1 ) m (CR 6R7 )n SO R 2 2 NH2 A (CR6 R7 )n N N R3 LG' N (R5 ) p 6 , (IA) де пунктирна лінія, m, n, p, A, R1, R2, R5, R6 і R7 мають значення, визначені в п. 1, і Р являє собою захисну групу або R4, де R4 має значення, визначені вище, за винятком водню, при використанні алкілуючого або арилуючого агента формули R3-LG, де LG являє собою відхідну групу, і R3 являє собою С 1С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; і, якщо необхідно, видалення захисної групи з одержанням відповідної сполуки формули (І), де R3 являє собою С1-С6алкільну, С3С7циклоалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; або (с) алкілування сполуки формули (ІB) , (V) де n, р, R4 , R5 , R6 і R7 мають значення, визначені в п.1 , у присутності каталізатора, наприклад, паладієвого або нікелевого каталізатора, з одержанням відповідної сполуки формули (І), де А являє собою N; або (e) відновлення сполуки формули (XVI): P N (R5 ) p A (C R6 R7 )n SO2R 2 N N (R 1) m P' , (XVI) де m, n, p, R 1, R2, R5, R6 і R7 мають значення, визначені в п.1, Р являє собою захисну груп у або R 4, значення якого визначені в п.1, і Р' являє собою захисну гр упу або R3, значення якого визначені в п.1, якщо необхідно, з видаленням будь-якої захисної групи і одержанням відповідної сполуки формули (І), де А являє собою СН; або (f) підкислення сполуки формули (XV): 7 80184 п.1, якщо необхідно, з видаленням будь-якої захисної групи і одержанням відповідної сполуки формули (І), де А являє собою С, і - - - являє собою P N (CR6 R7 )n (R5 ) p SO 2 R2 HO N N (R1 ) m P' 8 , (XV) де m, n, p, R 1, R2, R5, R6 і R7 мають значення, визначені в п.1, Р являє собою захисну груп у або R 4, значення якого визначені в п.1, і Р' являє собою захисну гр упу або R3, значення якого визначені в Серотонінові (5-гідрокситриптамінові або 5-НТ) рецептори відіграють важливу роль у багатьох фізіологічних і поведінкових функціях людей і тварин. Дані функції опосередковані різними 5-НТ рецепторами, розподіленими по всьому організму. До нашого часу клоновані приблизно п'ятнадцять різних підтипів 5-НТ рецепторів людини, і ролі багатьох з них в організмі людини добре відомі. Одним з підтипів 5-НТ рецептора, ідентифікованих останнім часом, є 5-НТ6 рецептор, що був вперше клонований у 1993 році з тканини щура [Monsma, F.J.; Shen, Y.; Ward, R.P.; Hamblin, M.W. Molecular Pharmacology, 1993, 43, 320-327], а пізніше з тканини людини [Kohen, R.; Metcalf, M.A.; Khan, N.; Druck, Т.; Huebner, K.; Sibley, D.R. Journal of Neurochemlstry 1996, 66, 47-56]. Даний рецептор являє собою з'єднаний з G-білком рецептор (GPCR) і позитивно зв'язаний з аденілатциклазою [Ruat, M.; Traiffort, Ε.; Arrang, J-M.; TardivelLacombe, L.; Diaz, L.; Leurs, R.; Schawartz, J-C. Biochemical Biophysical Research Communications, 1993, 193, 268-276]. Цей рецептор виявлений майже винятково в ділянках центральної нервової системи (ЦНС) як в організмі щура, так і в організмі людини. Дослідження гібридизації 5-НТ6 рецептора безпосередньо в мозку щура з використанням мітохондріальної ДНК показують основну локалізацію в зонах 5-НТ проекції, включаючи смугасте тіло, оточення ядер (nucleus accumbens), нюховий горбик і утворення гіпокампу [Ward, R.P.; Hamblin, M.W.; Lachowicz, J.E.; Hoffman, B.J.; Sibley, D.R.; Dorsa, D.M. Neuroscience 1995, 64, 1105-1111]. Існує велика кількість можливих терапевтичних застосувань 5-НТ6 лігандів в організмі, основаних на прямих ефектах і на показаннях одержаних в результаті наукових досліджень. Такі дослідження включають визначення місцезнаходження рецептора, визначення зв'язку лігандів з відомою in vivo активністю і різні дослідження, проведені на тваринах. Одним з таких можливих терапевтичних застосувань модуляторів функції 5-НТ6 рецептора є поліпшення пізнавальної функції і пам'яті у людей при таких захворюваннях, як хвороба Альцгеймера. Високі рівні поширення рецептора виявлені у важливих структурах передньої частки головного подвійний зв'язок; або (g) перетворення основної сполуки формули (І) за п. 1 у її кислотно-адитивну сіль або навпаки; або (h) виділення стереоізомера сполуки формули (І) з суміші. мозку, включаючи хвостате ядро/шкарлупу, гіпокамп, оточення ядер і кору головного мозку, що свідчить про те, яку роль грає рецептор у пам'яті і пізнанні, оскільки ці ділянки, як відомо, грають життєво важливу роль у пам'яті [Gerard С; Martres, M.-P.; Lefe vre, К.; Miquel, М.С.; Verge, D.; Lanfumey, R.; Doucet, E.; Hamon, M.; El Mestikawy, S. Brain Research, 1997, 746, 207-219[). Здатність відомих лігандів 5-НТ6 рецептора підвищува ти холінергічну трансмісію також свідчить про можливість їх застосування для поліпшення пізнавальної функції [Bentley, J.C.; Boursson, Α.; Boess, F.G.; Копі, F.C.; Marsden, C.A.; Petit, Ν.; Sleight, A.J. British Journal of Pharmacology, 1999, 126(7), 1537-1542]. Дослідження показали, що відомий 5-НТ6 селективний антагоніст значно підвищує рівні вмісту глютамату і аспартату в передній частині кори головного мозку без підвищення рівнів вмісту норадреналіну, дофаміну або 5-НТ. Відомо, що таке селективне підвищення нейрохімічних речовин, залучених у пам'ять і пізнавальну функцію, однозначно свідчить про те, яку роль грають 5-НТ6 ліганди в мисленні [Dawson, L.A.; Nguen, Н.О.; Li, P. British Journal of Pharmacology, 2000, 130(1), 23-26]. Дослідження пам'яті тварин і їх здатності до навчання з використанням відомих селективних 5-НТ6 антагоністів показало деякі позитивні ефекти [Rogers, D.C.; Hatcher, P.D.; Hagan, J. J. Society of Neuroscience, Abstracts, 2000, 26, 680]. Додаткове підтвердження ролі, що грає селективний 5-НТ6 ліганд у пізнавальній здатності, можна знайти в [публікації Woolley, M.L.; Marsden, C.A.; Sleight, A.J.; Fone, K.C.F., Psychopharmacology, 2003, 170(4), 358-367]. До потенційного терапевтичного застосування 5-НТ6 лігандів відноситься лікування розладу дефіциту уваги (ADD, відомого також як розлад дефіциту уваги з гіперактивністю або ADHD) як у дітей, так і у дорослих. Оскільки вважається, що 5НТ6 антагоністи підвищують активність дофамінового шляху, що має відношення до ефективного зв'язку чорної речовини зі смугастим тілом, і оскільки ADHD зв'язаний з патологіями в хвостатому ядрі [Ernst, M.; Zametkin, A.J.; Matochik, J.H.; Jons, P.A.; Cohen, R.M. Journal of Neurosciene, 1998, 18(15), 5901-5907], 5-HT6 антагоністи можуть полегшувати розлади, пов'язані з дефіцитом уваги. 9 80184 Проведені раніше дослідження, пов'язані з вивченням зв'язку різних ЦНС-лігандів з відомою терапевтичною активністю або значної структурної подібності з відомими лікарськими засобами, вказують на роль 5-НТ6 лігандів при лікуванні шизофренії і депресії. Наприклад, клозапін (ефективний антипсихотичний лікарський засіб) має високу спорідненість до 5-НТ6 рецепторного підтипу. Крім того, деякі клінічні антидепресанти мають високу спорідненість до 5-НТ6 рецепторного підтипу, а також виступають як антагоністи на цьому сайті [Branchek, T.A.; Blackburn, Т. Р. Annual Reviews in Pharmacology and Toxicology 2000,40,319-334]. Крім того, дослідження in vivo на щура х показують, що 5-НТ6 модулятори можуть використовуватись при лікуванні рухови х розладів, у тому числі епілепсії [Stean, Τ.; Routledge, С; Upton, N. British Journal of Pharmacology 1999, 127, Proc. Supplement 13 IP; Routledge, C; Bromidge, S.M.; Moss, S.F.; Price, G.W.; Hirst, W.; Newman, H.; Riley, G.; Gager, Т.; Stean, Т.; Upton, N.; Clarke, S.E.; Brown, A.M. British Journal of Pharmacology 2000, 137(7), 1606-1612]. В цілому, описані вище дослідження однозначно говорять про те, що сполуки, які є модуляторами 5-НТ6 рецептора, тобто лігандами, можуть використовува тись для наступних терапевтичних показань: лікування захворювань, пов'язаних з недостатністю пам'яті, пізнавальної здатності і здатності до навчання, таких як хвороба Альцгеймера і дефіцит уваги; лікування особистісних розладів, таких як шизофренія; лікування поведінкових розладів, наприклад, тривоги, депресії і обсесивно-компульсивних розладів; лікування емоційних або моторних розладів, таких як хвороба Паркінсона та епілепсія; лікування захворювань, пов'язаних з нейродегенерацією, таких як удар і травма голови; усунення адикцій до деяких хімічних сполук, включаючи нікотин, алкоголь та інші речовини, якими зловживають. Таким чином, предметом даного винаходу є надання сполук, що можуть використовуватись як терапевтичні лікарські засоби для лікування різних розладів центральної нервової системи, пов'язаних з 5-НТ6 рецептором або опосередковуваних ним. Іншим предметом даного винаходу є надання способів терапевтичного лікування і фармацевтичних композицій, застосовних для лікування розладів центральної нервової системи, зв'язаних з 5НТ6 рецептором або опосередковуваних ним. Відмітною ознакою даного винаходу є те, що надані сполуки можуть такожвикористовуватись для подальшого вивчення і дослідження властивостей 5-НТ6 рецептора. Даний винахід надає сполуку формули І 10 дe А являє собою С, CR8 або N; R1 являє собою Н, галоген, CN, COR9, OCO2R10 , CO2R11, CONR12R13, SOXR 14, NR15R 16, OR17 або С1-С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну груп у, кожна з яких необов'язково заміщена; R2 являє собою необов'язково заміщену С 1С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну або групу необов'язково заміщену 8-13членну біциклічну або трициклічну систему, що містить N атом у головній частині з місточковим зв'язком і необов'язково містить 1, 2 або 3 додаткових гетероатоми, вибраних з атомів Ν, Ο або S; R3 являє собою Η або С 1-С6алкільну, С3С7циклоалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; R4 являє собою Η або С 1-С6алкільну або С 3С7циклоалкільну групу, кожна з яких необов'язково заміщена; R5, R6 і R7 кожен незалежно являє собою Η або С1-С6алкільну або С 3-С7циклоалкільну гр упу, кожна з яких необов'язково заміщена; m і р кожен незалежно є цілим числом, що дорівнює 1, 2 або 3; n є цілим числом, що дорівнює 1 або 2; R8 являє собою Н, ОН або необов'язково заміщену С 1-С6алкоксигрупу; R9, R10, R11 і R17 кожен незалежно являє собою Η або С1-С6алкільну, С2-С6алкенільну, С2С6алкінільну, С3-С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; R12, R13, R15 і R16 кожен незалежно являє собою Η або необов'язково заміщену С 1-С4алкільну груп у або R12 і R13 або R15 і R16, взяті разом з атомом, до якого приєднані, можуть утворювати 5-7членне кільце, що необов'язково містить інший гетероатом, вибраний із О, NR18 або SOX ; R14 являє собою С1-С6алкільну, С2С6алкенільну, С2-С6алкінільну, С3С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; R18 являє собою Η або С 1-С6алкільну, С2С6алкенільну, С2-С6алкінільну, С3С7циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; x дорівнює 0 або є цілим числом, що дорівнює 1 або 2; і --- являє собою одинарний або подвійний зв'язок, або 11 80184 її стереоізомери, або їх фармацевтично прийнятні солі. Даний винахід надає також способи і композиції, корисні для лікування розладів центральної нервової системи. 5-гідрокситриптаміновий-6 рецептор є одним з рецепторів, відкритих останнім часом і призначених для ідентифікації молекулярним клонуванням. Його здатність з'єднуватись із самими різними терапевтичними хімічними сполуками, використовуваними в психіатрії, у поєднанні з маловивченим розподілом у мозку стимулює значний інтерес до нових сполук, що здатні взаємодіяти з даним рецептором або робити на нього несприятливий вплив. Були зроблені значні зусилля для пояснення можливої ролі 5-НТ6 рецептора в психіатрії, розладі мислення, рухової функції і у контролі, пам'яті, регулюванні настрою і т.п. Тому сполуки, що демонструють здатність зв'язуватись з 5-НТ6 рецептором, дійсно є бажаними як допоміжні засоби для дослідження 5-НТ6 рецептора, так і як потенційні терапевтичні лікарські засоби для лікування розладів центральної нервової системи, наприклад, див. [С Reavill, D.C. Rogers, Current Opinion in Investigational Drugs, 2001, 2 (1): 104109, Pharma Press Ltd.]. Несподівано було встановлено, що гетероцикліл-3-сульфоніліндазоли формули І показують спорідненість до 5-НТ6 рецептора в поєднанні з високою селективністю до даного підтипу. Переважно, зазначені індазоли формули І є терапевтичними лікарськими засобами для лікування розладів центральної нервової системи (ЦНС), пов'язаних з 5-НТ6 рецептором або опосередковуваних ним. Відповідно, даний винахід надає 1тетероцикліл-3-сульфоніліндазоли формули І , де А являє собою С, CR8 або N; R1 являє собою Н, галоген, CN, COR9, OCO2R10 , CO2R11, CONR12R13, SOXR 14, NR15R 16, OR17 або С1-С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну груп у, кожна з яких необов'язково заміщена; R2 являє собою необов'язково заміщену С 1С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну груп у або необов'язково заміщену 8-13членну біциклічну або трициклічну систему, що містить N атом у головній частині з місточковим зв'язком і необов'язково містить 1, 2 або 3 додаткових гетероатоми, вибраних з атомів Ν, Ο або S; 12 R3 являє собою Η або С 1-С6алкільну, С3С7циклоалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; R4 являє собою Η або С 1-С6алкільну або С 3С7циклоалкільну групу, кожна з яких необов'язково заміщена; R5, R6 і R7 кожен незалежно являє собою Η або С1-С6алкільну або С 3-С7циклоалкільну гр упу, кожна з яких необов'язково заміщена; m і р кожен незалежно є цілим числом, що дорівнює 1, 2 або 3; n є цілим числом, що дорівнює 1 або 2; R8 являє собою Н, ОН або необов'язково заміщену С 1-С6алкоксигрупу; R9, R10, R11 і R17 кожен незалежно являє собою Η або С1-С6алкільну, С2-С6алкенільну, С2С6алкінільну, С3-Сб циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; R12, R13, R15 і R16 кожен незалежно являє собою Η або необов'язково заміщену С 1-С4алкільну груп у або R12 і R13 або R15 і R16, взяті разом з атомом, до якого приєднані, можуть утворювати 5-7членне кільце, що необов'язково містить інший гетероатом, вибраний із О, NR18 або SOX ; R14 являє собою С1-С6алкільну, С2С6алкенільну, С2-С6алкінільну, С3Сб циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; R18 являє собою Η або С 1-С6алкільну, С2С6алкенільну, С2-С6алкінільну, С3С7циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких необов'язково заміщена; x дорівнює 0 або є цілим числом, що дорівнює 1 або 2; і --- являє собою одинарний або подвійний зв'язок, або їх стереоізомери, або їх фармацевтично прийнятні солі. Термін «галоген», використовуваний у даному описі і формулі винаходу, відноситься до F, СІ, Вr або І, термін «циклогетероалкіл» відноситься до п'яти-семи-членної циклоалкільної системи, що містить від 1 до 2 гетероатомів, які можуть бути однаковими або різними і вибрані з атомів Ν, Ο або S, і необов'язково містить один подвійний зв'язок Типовими прикладами циклогетероалкільних циклічних систем, включених у термін, що визначений вище, є представлені нижче цикли, де X являє собою NR, О або S; і R являє собою Η або необов'язковий замісник, що визначений нижче: Аналогічно, термін «гетероарил», використовуваний у даному описі і формулі винаходу, відноситься до п'яти-десяти-членної ароматичної циклі 13 80184 чної системи, що містить 1, 2 або 3 гетероатоми, які можуть бути однаковими або різними і вибрані з атомів Ν, Ο або S. Такі гетероарильні циклічні системи включають піроліл, азоліл, оксазоліл, тіазоліл, імідазоліл, фурил, тієніл, хінолініл, ізохінолініл, індоліл, бензотієніл, бензофураніл, бензізоксазоліл і т.п. Термін «арил» відноситься до карбоциклічної ароматичної системи, такої як феніл, нафтил, антраценіл і т.п. Термін «галогеналкіл», використовуваний у даному описі, відноситься до СnН2n+1 групі, що містить від одного до 2n+1 атомів галогену, які можуть бути однаковими або різними, і термін «галогеналкокси», використовуваний у даному описі, відноситься до групи О СnН2n+1, що містить від одного до 2n+1 атомів галогену, які можуть бути однаковими або різними. Типовими прикладами 8-13-членних біциклічних або трициклічних систем, що містять N атом при місточковому зв'язку і необов'язково містять 1, 2 або 3 додаткових гетероатоми, вибраних з атомів Ν, Ο або S, і включених у термін, визначений вище, є наступні циклічні системи, де W2 являє собою NR, О або S; і R являє собою Η або необов'язковий замісник, що визначений нижче: Коли в даному описі і формулі винаходу групи «С1-С6алкіл», «С2-Сб алкеніл», «С2-С6алкініл», «С3С7циклоалкіл», «циклогетероалкіл», «арил» або «гетероарил» визначені як «необов'язково заміщені», групи замісників, що необов'язково присутні, можуть складати від однієї до декількох з числа використовуваних при одержанні фармацевтично активних сполук або при модифікуванні таких сполук для впливу на їх стр уктуру/активність, накопичення, абсорбцію, стабільність або іншу корисну властивість. Конкретні приклади таких замісників включають атоми галогену, нітро, ціано, тіоціанато, ціанато, гідроксил, алкіл, галогеналкіл, алкокси, галогеналкокси, аміно, алкіламіно, діалкіламіно, форміл, алкоксикарбоніл, карбоксил, алканоїл, алкілтіо, алкілсульфініл, алкілсульфоніл, карбамоїл, алкіламінокарбоніл, феніл і заміщений феніл (де замісниками є групи, перераховані в даному визначенні), фенокси, бензил, бензилокси, гетероарил, індоліл, гетероцикліл (наприклад, гетероарил, циклогетероалкіл) або циклоалкіл, переважно атоми галогену або нижчі алкільні або нижчі 14 алкоксигрупи. Звичайно можуть бути присутніми 03 замісники. Коли кожний з перерахованих вище замісників являє собою або містить групу алкільного замісника, він може бути прямим або розгалуженим і може містити до 12, переважно до 6, більш переважно до 4 атомів вуглецю. Фармацевтично прийнятні солі можуть являти собою будь-яку кислотно-адитивну сіль, утворену сполукою формули І і фармацевтично прийнятною кислотою, такою як фосфорна, сірчана, хлористоводнева, бромистоводнева, лимонна, малеїнова, малонова, мигдальна, янтарна, фумарова, оцтова, молочна, азотна, сульфонова, птолуолсульфонова, метансульфонова кислота і т.п. Сполуки даного винаходу включають складні ефіри, карбамати або інші традиційні пролікарські форми, які звичайно є функціональними похідними сполук даного винаходу і легко перетворюються in vi vo в активний фрагмент відповідно до винаходу. Відповідно, спосіб даного винаходу включає лікування різних станів, описаних вище, сполукою формули І або сполукою, що конкретно не описана вище, але яка при введенні перетворюється у сполуку формули І in vivo. Винахід включає також метаболіти сполук даного винаходу, визначені як активні частинки, одержані при введенні цих сполук у біологічну систему. Сполуки даного винаходу можуть існувати у вигляді одного або декількох стереоізомерів. Різні стереоізомери включають енантіомери, діастереомери, атропізомери і геометричні ізомери. Фахівцю в даній галузі буде очевидно, що один стереоізомер може бути більш активним або може виявляти корисні дії, коли є присутнім у надлишку щодо іншого(их) стереоізомера(ів) або коли відділений від іншого(их) стереоізомера(ів). Крім того, кваліфікованому фа хівцю відомо, як розділити, збагатити або селективно одержати зазначені стереоізомери. Відповідно, даний винахід включає сполуки формули І, їх стереоізомери і їх фармацевтично прийнятні солі. Сполуки даного винаходу можуть бути представлені у вигляді суміші стереоізомерів, окремих стереоізомерів або в оптично активній або енантіомерно чистій формі. Прикладами R3 є водень, феніл і С1-С4алкіл, що може бути заміщений необов'язково заміщеним фенілом, наприклад, R3 являє собою метил, феніл або 3-хлорбензил. Прикладом А є N. Прикладами R2 є феніл, 1-нафтил, 2-нафтил, ціанофеніл, 2-, 3- або 4-галогенфеніл, 2-фенетил, 2хлор-4-фтор феніл, амінофеніл і тієніл. Прикладами R4 є Н, метил, етил, пропіл і фенетил. Переважними сполуками даного винаходу є сполуки формули І, де n дорівнює 1. Іншу гр упу переважних сполук складають сполуки формули І, де R4 являє собою Η або необов'язково заміщену С1-С4алкільну груп у. Додаткову груп у переважних сполук складають сполуки формули І, де R2 являє собою необов'язково заміщену фенільну, нафтильну або гетероарильну гр упу. Переважними також є сполуки формули І, в яких R5, R6 і R7 являють собою Н. Більш переважними сполуками даного винаходу є сполуки формули І, в яких А являє собою N 15 і R4 являє собою Η або необов'язково заміщену С1-С4алкільну груп у. Іншу гр упу більш переважних сполук складають сполуки формули І, в яких А являє собою Ν; n дорівнює 1 і R2 являє собою необов'язково заміщену фенільну, нафтильну або гетероарильну груп у. Ще більш переважними сполуками даного винаходу є сполуки формули І, в яких 6- або 7-членне азакільце приєднане до індазолу в положенні 5 або 7. Переважними сполуками даного винаходу є також наступні сполуки: 5-(4-метилпіперазин-1-іл)-3-(1нафтилсуль фоніл)-1Н-індазол; 3-(1-нафтилсульфоніл)-5-піперазин-1-іл-1Ніндазол; 1-(3-хлорбензил)-5-(4-метилпіперазин-1-іл)-3(1-нафтилсульфоніл)-1Н-індазол; 7-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)1Н-індазол; 3-(фенілсульфоніл)-7-(4-пропілпіперазин-1-іл)1Н-індазол; 3-(фенілсульфоніл)-7-піперазин-1-іл-1Ніндазол; 5-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)1Н-індазол; 3-(фенілсульфоніл)-5-(4-пропілпіперазин-1-іл)1Н-індазол; 3-(фенілсульфоніл)-5-піперазин-1-іл-1Ніндазол; 5-піперазин-1-іл-3-[(3-ціанофеніл)сульфоніл]1Н-індазол; 7-(4-метилпіперазин-1-іл)-3-[(2фенетил)сульфоніл]-1Н-індазол; 3-(1-нафтилсульфоніл)-7-(4-пропілпіперазин-1іл)-1Н-індазол; 5-(4-фенетилпіперазин-1-іл)-3-(1нафтилсуль фоніл)-1Н-індазол; 5-(4-метилпіперазин-1-іл)-3-(2нафтилсуль фоніл)-1Н-індазол; 3-[(2-хлор-4-фторфеніл)сульфоніл]-5піперазин-1-іл-1Н-індазол; 1-метил-3-(фенілсульфоніл)-5-піперазин-1-іліН-індазол; 1-феніл-3-(фенілсульфоніл)-5-піперазин-1-іл1Н-індазол; 1-метил-3-(фенілсульфоніл)-7-піперазин-1-іл1Н-індазол; 1-феніл-3-(фенілсульфоніл)-7-(піперазин-1-іл)1Н-індазол; 7-піперазин-1-іл-3-[(3-фторфеніл)сульфоніл]1Н-індазол; 3-[(4-фторфеніл)сульфоніл]-7-(4метилпіперазин-1-іл)-1H-індазол; 3-[(2-хлорфеніл)сульфоніл]-7-піперазин-1-іл1Н-індазол; 3-[(4-амінофеніл)сульфоніл]-7-(піперазин-1-іл)1Н-індазол; 5-піперазин-1-іл-3-[(3-фторфеніл)сульфоніл]1Н-індазол; 3-[(4-фторфеніл)сульфоніл]-5-(4метилпіперазин-1-іл)-1Н-індазол; 3-[(2-хлорфеніл)сульфоніл]-5(пропілпіперазин-1-іл)-1Н-індазол; 80184 16 3-[(4-амінофеніл)сульфоніл]-5-піперазин-1-іл1Н-індазол; 3-[(5-хлортієн-2-іл)сульфоніл]-5-піперазин-1-іл1Н-індазол; 3-[(5-хлортієн-2-іл)сульфоніл]-7-піперазин-1-іл1Н-індазол; 4-хлор-3-(фенілсульфоніл)-7-піперазин-1-іл1Н-індазол; 5-фтор-3-(фенілсульфоніл)-7-піперазин-1-іл1Н-індазол; 6-фтор-3-(фенілсульфоніл)-7-піперазин-1-іл1H-індазол; 4-хлор-3-(фенілсульфоніл)-5-піперазин-1-іл1Н-індазол; 7-фтор-3-(фенілсульфоніл)-5-піперазин-1-іл1Н-індазол; 6-фтор-3-(фенілсульфоніл)-5-піперазин-1-іл1Н-індазол; 6-(4-фенетилпіперазин-1-іл)-3(фенілсульфоніл)-1Н-індазол; 6-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)1Н-індазол; 6-(4-пропілпіперазин-1-іл)-3-(фенілсульфоніл)1Н-індазол; 3-(фенілсульфоніл)-6-піперазин-1-іл-1Ніндазол; 4-піперазин-1-іл-3-(фенілсульфоніл)-1Ніндазол; 4-(4-метилпіперазин-1-іл)-3-(фенілсульфоніл)1Н-індазол; 4-(4-пропілпіперазин-1-іл)-3-(фенілсульфоніл)1Н-індазол; 3-(фенілсульфоніл)-4-піперазин-1-іл-1Ніндазол; 3-[(5-хлортієн-2-іл)сульфоніл]-5-піперидин-1іл-1Н-індазол; 3-[(5-хлортієн-2-іл)сульфоніл]-7-піперидин-1іл-1Н-індазол; 1-метил-3-(фенілсульфоніл)-5-піперидин-1-іл1Н-індазол; 3-[(3-фторфеніл)сульфоніл]-5-піперидин-1-іл1Н-індазол; 1-метил-3-(фенілсульфоніл)-1-(4метилпіперидин-1-іл)-1Н-індазол; 3-[(3-фторфеніл)сульфоніл]-7-піперидин-1-іл1Н-індазол; 3-[(3-фторфеніл)сульфоніл]-5-піперидин-1-іл1Н-індазол; 3-(фенілсульфоніл)-5-піперидин-1-іл-1Ніндазол; 1-метил-3-[(3-фторфеніл)сульфоніл]-7піперидин-1-іл-1Н-індазол; 3-(фенілсульфоніл)-7-піперидин-1-іл-1Ніндазол; їх стереоізомери або їх фармацевтично прийнятні солі. Даний винахід надає також способи одержання сполук формули (І) або їх солей, де зазначені способи включають одне з наступного: (a) діазотування і циклізацію сполуки формули (VIIA): 17 80184 18 , , де пунктирна лінія, m, n, p, A, R1, R2, R4, R5 , R6 і R7 мають значення, визначені вище, наприклад, з використанням суміші NaNO2/кислота з одержанням сполуки формули (І), де R3 являє собою водень, або (b) алкілування або арилування захищеної сполуки формули (ІА) де m, R1, R2 і R3 мають значення, визначені вище, і LG' являє собою відхідну груп у, таку як СІ, Вr, І або активовану гідроксильну груп у, таку як трифлат, зі сполукою формули (V): , , де пунктирна лінія, m, n, p, A, R1б R2, R5, R6 i R7 мають значення, визначені вище, і Ρ являє собою захисну груп у або R4, де R4 має значення, визначені вище, за винятком водню, з використанням алкілуючого або арилуючого агента формули R3-LG, де LG являє собою відхідну груп у і R3 представляє собою С 1-С6алкільну, С3-С7циклоалкільну, арильну або гетероарильну груп у, кожна з яких необов'язково заміщена; і, якщо необхідно, видалення захисної групи з одержанням відповідної сполуки формули (І), де R3 являє собою С1С6алкільну, С3-7циклоалкільну, арильну або гетероарильну груп у, кожна з яких необов'язково заміщена; або (c) алкілування сполуки формули (IB) де n, р, R4, R5 , R6 і R7 мають значення, визначені вище, у присутності каталізатора, наприклад, паладієвого або нікелевого каталізатора, з одержанням відповідної сполуки формули (І); або (e) відновлення сполуки формули (XVI): , де m, n, р, R1, R2, R5, R 6 і R7 мають значення, визначені вище, Ρ являє собою захисн у гр уп у або R4, що має значення, визначені в пункті 1, і Р' являє собою захисну груп у або R3, значення якого визначені вище, якщо необхідно, з видаленням будь-якої захисної групи і одержанням відповідної сполуки формули (І), де А являє собою СН; або (f) підкислення сполуки формули (XV): , де пунктирна лінія, m, n, p, A, R1, R2, R3, R5 , R6 і R7 мають значення, визначені вище, з використанням алкілуючого агента формули R4-LG, де LG являє собою відхідну груп у і R4 являє собою С1С6алкільну або С 3-С7циклоалкільну групу, кожна з яких необов'язково заміщена, з одержанням відповідної сполуки формули (І), де R4 являє собою С1-С6алкільну або С3-С7циклоалкільну групу, кожна з яких необов'язково заміщена; або (d) взаємодію сполуки формули (XII): , де m, n, р, R1, R2, R5, R 6 і R7 мають значення, визначені вище, Ρ являє собою захисн у гр уп у або R4, значення якого визначені вище, і Р' являє собою захисну гр уп у або R3, значення якого визначені вище, якщо необхідно, з видаленням будьякої захисної групи і одержанням відповідної сполуки формули (І), де А являє собою С, і --- являє собою подвійний зв'язок; або 19 80184 (g) перетворення основної сполуки формули (І), як визначено в даному описі, у її кислотноадитивну або сіль навпаки; або (h) виділення стереоізомера сполуки формули (І) з суміші. Зокрема, сполуки даного винаходу можуть бути відповідним чином одержані з використанням традиційних методів синтезу і, якщо необхідно, стандартними методами розділення або виділення. Наприклад, сполуки формули (І), де А являє собою N; R3 являє собою Н; і --- являє собою одинарний зв'язок (Sa), можуть бути одержані взаємодією галогеннітробензолу формули II з хлорметилсульфоном формули III у присутності сильної основи, такої як KO-t-Bu або KОН, з одержанням бензилсульфонільної сполуки формули IV; взаємодією зазначеної сполуки формули IV з піперазином або гомопіперазином формули V у присутності основи, такої як K2СО3, з одержанням сполуки формули VI; взаємодією зазначеної сполуки формули VI з відновником, таким як Sn, Fe або Zn, у присутності кислоти з одержанням відповідного аміну формули VII; і взаємодією зазначеного аміну з NaNO2 у присутності кислоти з одержанням цільової сполуки формули Іа. Реакції представлені на наведеній нижче схемі синтезу І, де Hal являє собою СІ або F. Сполуки формули Іа, де R3 не є Н, можуть бути одержані з використанням традиційних методик алкілування/видалення захисту. Наприклад, сполуки формули І, де А являє собою N; R3 не є Н; --являє собою одинарний зв'язок (Іb), можуть бути одержані взаємодією захищеної сполуки формули VIII з алкілуючим агентом формули IX у присутності основи і розчинника, необов'язково у присутності агента фазового переносу з одержанням алкілованої захищеної сполуки формули X і видаленням захисної групи із зазначеної сполуки формули X з одержанням цільової сполуки формули І, де R4 20 являє собою Н. Альтернативно, для сполук, в яких R3 являє собою арильну або гетероарильну групи, агент формули IX може являти собою арил- або гетероарилборонову кислоту і може бути підданий реакції з'єднання з індазолом формули VIII у присутності каталізатора, наприклад, Сu(ОСОСН3)2, з одержанням відповідної захищеної сполуки формули X, де R3 являє собою арильну або гетероарильну групу. Необов'язково, сполука формули Іb може бути піддана взаємодії з алкілуючим агентом формули XI у стандартних умовах реакції алкілування з одержанням сполуки формули Іb, де R 3 не є Η. Якщо необхідно, послідовність реакцій може обертатись видаленням захисту зі сполуки формули VIII з одержанням сполуки формули Іа, де R3 і R4 являють собою Η (Іс), і алкілуванням сполуки формули Іс алкілуючим агентом формули XI з одержанням сполуки формули Id. Необов'язково, сполука формули Id може бути піддана взаємодії з алкілуючим агентом формули IX, як описано вище, з одержанням сполуки формули Іb. Дана послідовність реакцій представлена на схемі II, де Ρ являє собою захисну гр упу і LG являє собою відхідну груп у, таку як СІ, Вr, І, ОН, В(ОН)2, тозил, мезил і т.п. Альтернативно, сполуки формули Ib можуть бути одержані безпосередньо з похідного індазолу формули XII реакцією з'єднання зазначеної сполуки формули XII із придатним піперазином або гомопіперазином формули V у присутності каталізатора, такого як паладієвий або нікелевий каталізатор. Зазначена реакція представлена на схемі III, де LG' являє собою відхідну груп у, таку як СІ, Вr, І, або активовану гідроксильну груп у, таку як CF3SO3 (трифла т). 21 80184 22 Сполуки формули VIII також можуть бути одержані взаємодією захищеного 3-йодіндазолу формули XIII із сульфінатом натрію формули XIV у присутності йодиду міді і диметилформаміду (ДМФА) з одержанням цільової сполуки формули VIII або взаємодією сполуки формули XIII з тіолом формули XV у присутності йодиду міді і основи, такої як K2СО3, з одержанням простого тіоефіру формули XVI і окислюванням зазначеної сполуки формули XVI з одержанням цільової сполуки формули VIII. Описані реакції представлені на схемі IV, де Ρ являє собою захисну гр упу. Сполуки формули XIII, де n дорівнює 1 і R 5, R6 і R7 являють собою Η (Хlllb), можуть бути одержані взаємодією індазоламіну формули XX з гідрохлоридом ді(2-хлоретил)аміном з одержанням відповідного піперазиниліндазолу формули XXI, введенням захисної групи в зазначену сполуку формули XXI і взаємодією захищеної сполуки формули XXI з йодом у присутності основи, такої як KОН, з одержанням цільової сполуки формули ХIIb. Дані реакції представлені на схемі VI, де Ρ являє собою захисну груп у. Сполуки формули XIII, де R1 являє собою Η (ХІIIа), можуть бути одержані взаємодією дигалогенбензальдегіду формули XVII з похідним піперазину або гомопіперазину формули V, де R4 являє собою захисну гр упу (Va), з одержанням ортогалогенбензальдегіду формули XVIII, взаємодією сполуки формули XVIII з гідразингідратом з одержанням індазолу формули XIX і взаємодією індазолу формули XIX з йодом у присутності основи, такої як KОН, з одержанням цільових сполук формули ХІIIа. Зазначені реакції представлені на схемі V, де Ρ являє собою захисну гр упу і Hal являє собою F, СІ, Вr або І, переважно F. Сполуки формул ХІllа і Хlllb можуть бути піддані перетворенню у сполуки формули la, Ib або Іс, як показано вище на схемах II і III. Відповідні сполуки даного винаходу, де А являє собою CR8, можуть бути одержані, наприклад, взаємодією захищеного броміндазолу формули XXII з літійвмісною сполукою і взаємодією одержаного в такий спосіб літійвмісного похідного без виділення з N-захищеним азациклічним кетоном формули XXIII з одержанням захищеного гідроксипохідного формули XXIV, одержане гідроксипохідне може бути потім піддане дегідратації з одер 23 80184 жанням захищеної сполуки формули XXV. Каталітичне гідрування зазначеної сполуки формули XXV з наступним видаленням захисних груп приводить до одержання цільових сполук формули І, де А являє собою CR8; R3 і R4 являють собою Н; і -- являє собою одинарний зв'язок (Id). Дана послідовність реакцій представлена на схемі VII, де Ρ і Р' кожен незалежно являє собою захисну груп у. Відповідно до методик, представлених на схемі II вище, сполуки формул XXIV, XXV і Id можуть бути легко піддані перетворенню у сполуки формули І, де А являє собою CR8 і R3 або R4 не є Н. Альтернативно, сполуки формули І, де А являє собою С або CR8 і R3 являє собою Η (Іе), можуть бути одержані взаємодією хлорметилсульфонільного похідного формули III з нітробензолпохідним формули XXVI у присутності сильної основи, такої як KO-t-Bu або KОН, з одержанням сполуки формули XXVII; відновленням зазначеної сполуки формули XVII відновником, таким як Sn, Fe або Zn, у присутності кислоти з одержанням відповідного аміну формули XXVIII; і взаємодією зазначеного аміну з NaNO2 у присутності кислоти з одержанням цільового індазол-похідного формули Іе. Описані реакції представлені на схемі VIII. 24 Сполуки формули Іе можуть бути піддані перетворенню у відповідні сполуки формули І, де А являє собою С або CR8 і R3 не є Н, взаємодією зазначеної сполуки формули Іе з алкілуючим агентом, як показано вище на схемі II. Захисні групи, що придатні для застосування в реакціях, представлених ви ще, включають третбутилоксикарбоніл, бензил, ацетил, бензилоксикарбоніл або будь-яку стандартну гр упу, використовувану для захисту основного азоту у стандартних методиках синтезу. Переважно, сполуки формули І даного винаходу корисні для лікування ЦНС-розладів, пов'язаних з 5-НТ6 рецептором або опосередковуваних ним, включаючи розлад рухової функції, емоційний, особистісний, поведінковий, психічний розлади, розлад пізнавальної функції, нейродегенеративний і т.п. розлади, наприклад, хвороба Альцгеймера, хвороба Паркінсона, дефіцит уваги, стани занепокоєння, епілепсія, депресія, обсесивно-компульсивний розлад, порушення сну, нейродегенеративні розлади (такі як травма голови або удар), харчові розлади (такі як анорексія або булімія), шизофренія, втрата пам'яті, розлади, пов'язані зі відміною ліків або зловживанням нікотином і т.п., або деяких шлунково-кишкових розладів, таких як синдром подразненої товстої кишки. Відповідно, даний винахід надає спосіб лікування розладу центральної нервової системи, пов'язаного з 5-НТ6 рецептором або опосередковуваного ним, у пацієнта, що потребує такого лікування, який включає введення зазначеному пацієнту терапевтично ефективної кількості сполуки формули І, описаної вище. Сполуки можуть бути введені перорально або парентерально або будь-яким традиційним способом, що відомий як ефективний спосіб введення терапевтичного лікарського засобу пацієнту, що потребує такого засобу. Термін «введення», використовуваний в даному описі у відношенні введення сполуки або речовини даного винаходу, означає або безпосереднє введення такої сполуки або речовини, або введення проліків, похідного або аналога, який утворює еквівалентну кількість сполуки або речовини в організмі. Терапевтично ефективна кількість, що вводиться при лікуванні конкретного ЦНС-розладу, може змінюватись згідно зі специфічним станом(ами), що підлягає(ють) лікуванню, масою тіла, віком і характером сприйняття його пацієнтом, тяжкості розладу, думки лікуючого лікаря і т.п. Звичайно ефективні кількості для добового перорального введення можуть складати приблизно від 0,01 до 1000мг/кг, переважно приблизно від 0,5 до 500мг/мг, і ефективні кількості для парентерального введення можуть складати приблизно від 0,1 до 100мг/мг, переважно приблизно від 0,5 до 50мг/кг. 25 80184 На практиці сполуки даного винаходу вводять у вигляді самої сполуки або її попередника у твердій або рідкій формі в чистому вигляді або у поєднанні з одним або декількома звичайними фармацевтичними носіями або ексципієнтами. Відповідно, даний винахід надає фармацевтичну композицію, що включає фармацевтично прийнятний носія і ефективну кількість сполуки формули І, описану вище . Тверді носії, що придатні для застосування в композиції даного винаходу, включають одну або кілька речовин, які можуть також виступати як смакові домішки, змащувальні речовини, солюбілізатори, суспендуючі агенти, наповнювачі, агенти, що поліпшують ковзання, речовини, що полегшують пресування, зв'язувальні речовини, домішки, що дезінтегрують таблетки або інкапсулюють речовини. У порошках носій може бути тонкоподрібненою твердою речовиною, що змішується з тонкоподрібненою сполукою формули І. У таблетках сполука формули І може змішува тись з носієм, що володіє необхідними властивостями стиснення у придатних співвідношеннях і пресуватись в бажану форму бажаного розміру. Зазначені порошки і таблетки можуть містити до 99% (мас.) сполуки формули І. Тверді носії, що придатні для застосування в композиції даного винаходу, включають фосфа т кальцію, стеарат магнію, тальк, цукри, лактозу, декстрин, крохмаль, желатин, целюлозу, метилцелюлозу, натрійкарбоксиметилцелюлозу, полівінілпіролідин, низькоплавкі воски та іонообмінні смоли. У композиції даного винаходу може застосовуватись будь-який фармацевтично прийнятний рідкий носій, що підходить з одержанням розчинів, суспензій, емульсій, сиропів і еліксирів. Сполуки формули І можуть бути розчинені або суспендовані у фармацевтично прийнятному рідкому носії, такому як вода, органічний або розчинник фармацевтично прийнятна олія або жир або їх суміш. Зазначена рідка композиція може містити інші придатні фармацевтичні домішки, такі як солюбілізатори, емульгатори, буферні домішки, консерванти, підсолоджувачі, смакові домішки, суспендуючі агенти, загусники, барвники, регулятори в'язкості, стабілізатори, регулятори осмотичного тиску і т.п. Приклади рідких носіїв, що придатні для перорального і парентерального введення, включають воду (що особливо містять домішки, перераховані вище, наприклад, похідні целюлози, переважно розчин натрійкарбоксиметилцелюлози), спирти (включаючи одноатомні і багатоатомні спирти, наприклад, гліколі) або їх похідні або олії (наприклад, фракціонована кокосова олія і арахісова олія). Носієм для парентерального введення може бути складний маслянистий ефір, такий як етилолеат або ізопропілміристат. Композиції даного винаходу, що являють собою стерильні розчини або суспензії, придатні для внутрішньом'язової, інтраперитонеальної або підшкірної ін'єкції. Стерильні розчини можуть також вводитись внутрішньовенно. Композиції даного винаходу, що придатні для перорального введення, можуть бути у твердій або рідкій формі. 26 Для більш чіткого розуміння і для більш чіткого представлення даного винаходу нижче наведені конкретні приклади його здійснення. Наведені приклади є ілюстративними і жодним чином не повинні розглядатись як такі, що обмежують об'єм даного винаходу і його основні принципи. За винятком випадків, обговорених особливо, всі частини є масовими. Абревіатура «ЯМР» означає протонний ядерний магнітний резонанс. Абревіатури «ТГФ», «ДМФА» і «ДМСО» означають тетрагідрофуран, диметилформамід і диметилсульфоксид, відповідно. У структурних формулах Ph представляє фенільну груп у. Приклад 1 Одержання 1-бензил-4-(4нітрофеніл)піперазину Розчин 1-бензилпіперазину (8,81м, 50,0ммоль), 4-фторнітробензолу (5,31мл, 50ммоль) і K2СО3 (6,90м, 50,0ммоль) в етанолі при перемішуванні кип'я тять зі зворотним холодильником в атмосфері азоту протягом 18 годин, потім охолоджують, розбавляють водою і екстрагують СН2СI2. Об'єднані екстракти сушать над MgO4 і концентрують у вакуумі з одержанням твердого залишку. Одержаний твердий залишок розтирають з сумішшю етилацетат:гексани (20:80) і фільтрують. Залишок на фільтрі сушать на повітрі, одержуючи зазначену в заголовку сполуку у вигляді оранжевих кристалів (8,45м, вихід 57%, т.пл. 218219°С), яку ідентифікують методами ЯМР і масспектрометрії. Приклад 2 Одержання 1-бензил-4-{4-нітро-3[(фенілсульфоніл)метил]феніл}піперазину Розчин 1-бензил-4-(4-нітрофеніл)піперазину (5,95м, 20,0ммоль) і хлорметилфенілсульфону (3,82м, 20,0ммоль) у безводному ТГФ при перемішуванні в атмосфері азоту при температурі -60°С обробляють 1,0М KO-t-Bu у ТГФ (44,0мл, 44,0ммоль), нагрівають до -20°С протягом 1 години, реакційну суміш гасять оцтовою кислотою і обробляють послідовно водою, насиченим водним розчином NaHCO3 і ефіром. Фази розділяють і водну фазу екстрагують ефіром. Об'єднані ефірні фази промивають водою і насиченим розчином солі, сушать над MgSO4 і концентрують у вакуумі. Одержаний залишок хроматографують (силікагель, елюент: етилацетатхексани 1:1 і 1:0), одержуючи зазначену в заголовку сполуку у вигляді твердої жовтої речовини (7,52м, вихід 83%, т.пл. 145-146°С), що ідентифікують методами ЯМР і мас-спектрометрії. Приклад 3 27 80184 28 Одержання 4-(4-бензилпіперазин-1-іл)-2[(фенілсульфоніл)метил]анілін Суміш 1-бензил-4-{4-нітро-3[(фенілсульфоніл)метил]феніл}піперазину (6,77м, 15,0ммоль), гранульованого олова (7,48м, 63,0ммоль) у метанолі і концентрованій хлористоводневій кислоті нагрівають до 45°С і витримують при цій температурі протягом 4 годин, перемішують при кімнатній температурі протягом 18 годин, обережно виливають у насичений водний розчин NaHCO3, обробляють ефіром і перемішують протягом 0,5 години. Фази розділяють і водну фазу екстрагують послідовно ефіром і СН 2СI2. Екстракти і органічну фазу поєднують, сушать над MgO4 і концентрують у вакуумі. Одержаний залишок розчиняють у СН2СI2 і фільтрують через целіт. Фільтрат концентрують у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді твердої блідо-жовтої речовини (6,11м, 97% вихід, т.пл. 141-143°С), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 4 Одержання гідрохлориду 5-(4бензилпіперазин-1-іл)-3-(фенілсульфоніл)-1Ніндазолу Розчин 4-(4-бензилпіперазин-1-іл)-2[(фенілсульфоніл)метил]аніліну (0,371м, 0,88ммоль) у 4,0М водному розчині хлористоводневої кислоти при перемішуванні охолоджують на крижаній лазні, обробляють розчином NaO2 (91мг, 1,32ммоль) у воді, додаючи його краплями, перемішують протягом 40 хвилин, обробляють водним 2,5М розчином NaOH, доводячи значення рН до ~14, і фільтрують. Осад на фільтрі розчиняють у СН2СI2 і хроматографують (силікагель, елюент:етилацетат), одержуючи вільну імідазольну основу зазначеного в заголовку продукту у вигляді твердої жовтої речовини (276мг, 64%). Одержану тверду речовину розчиняють у суміші етанолу і СН2СI2, обробляють 4,0М НСl у діоксані і концентрують у вакуумі, одержуючи твердий залишок. Залишок розтирають з етилацетатом, одержуючи зазначений у заголовку продукт у вигляді твердої, не зовсім білої речовини (278мг, вихід 57%, т.пл. 177-180°С), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 5 Одержання гідрохлориду 5-(4бензилпіперазин-1-іл)-3-[(3-фторфеніл)сульфоніл]-1Н-індазолу Відповідно до методик прикладів 2-4 при використанні хлорметил(3-фторфеніл)сульфону, зазначену в заголовку сполуку одержують у вигляді твердої, не зовсім білої речовини (т.пл. 157160°С), яку ідентифікують методами ЯМР і масспектрометрії. Приклад 6 Одержання 1-бензил-4-(3-метокси-4нітрофеніл)піперазину Розчин 1-бензилпіперазину (3,53м, 20,0ммоль), 4-хлор-3-метоксинітробензолу (3,75м, 20,0ммоль) і K2СО3 (2,76м, 20,0ммоль) у ДМФА при перемішуванні нагрівають до температури в інтервалі від 85 до 100°С в атмосфері азоту і витримують при даній температурі протягом 23 годин, потім охолоджують до кімнатної температури, обробляють 2М водним розчином хлористоводневої кислоти, розбавляють водою і екстрагують ефіром. Об'єднані екстракти промивають насиченим розчином солі, сушать над MgSO 4 і концентрують у вакуумі. Одержаний залишок хроматографують (силікагель, елюент:етилацетат:гексани (30:70 і 50:50), одержуючи зазначену в заголовку сполуку у ви гляді жовтува то-оранжевої олії (2,64м, вихід 57%), яку ідентифікують методом ЯМР. Приклад 7 Одержання гідрохлориду 5-(4бензилпіперазин-1-іл)-6-метокси-3(фенілсульфоніл)-1Н-індазолу Відповідно до методик прикладів 2-4, описаних вище, при використанні 1-бензил-4-(2-метокси-4нітрофеніл)піперазину як вихідної речовини, зазначену в заголовку сполуку одержують у вигляді твердої жовтувато-коричневої речовини (т.пл. 185187°С), яку ідентифікують методами ЯМР і масспектрометрії. Приклад 8 Одержання гідрохлориду 5-(4бензилпіперазин-1-іл)-6-метокси-1-феніл-3(фенілсульфоніл)-1Н-індазолу 29 80184 Суміш 5-(4-бензилпіперазин-1-іл)-6-метокси-3(фенілсульфоніл)-1Н-індазолу (448мл, 0,97ммоль), фенілборонової кислоти (242мг, 1,94ммоль), ацетату міді (II) (271мг, 1,50ммоль), піридину (160мг, 2,00ммоль) і молекулярних сит (4Å, 1,0г) у метиленхлориді перемішують при кімнатній температурі протягом 48 годин і фільтрують. Осад на фільтрі промивають ТГФ. Фільтрати поєднують і концентрують у вакуумі. Одержаний залишок піддають хроматографії (силікагель, елюент:етилацетат:гексани 60:40 і 80:20) з одержанням вільного аміну зазначеної в заголовку сполуки у вигляді білої твердої речовини, 130мг (вихід 25%). Одержаний амін розчиняють у етанолі, розтирають з 4,0N HCI у діоксані і концентрують у вакуумі до твердого залишку. Одержаний залишок розтирають етилацетатом, одержуючи в результаті зазначену в заголовку сполуку у вигляді твердої білої речовини (т.пл. 210-212°С), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 9 Одержання гідрохлориду 6-метокси-1-феніл-3(фенілсульфоніл)-5-піперазин-1-іл-1Н-індазолу Суміш 5-(4-бензилпіперазин-1-іл)-6-метокси-1феніл-3-(фенілсульфоніл)-1Н-індазолу (190мг, 0,353ммоль) і 1-хлоретилхлорформіату (250мг, 1,77ммоль) у 1,2-дихлоретані кип'ятять зі зворотним холодильником протягом 4 годин, охолоджують до кімнатної температури і концентрують досуха. Одержаний залишок розчиняють в етанолі, розчин кип'ятять зі зворотним холодильником протягом 16 годин і концентрують у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді твердої білої речовини (130мг, ви хід 82%). Продукт очищають перекристалізацією з суміші етанол/ефір, одержуючи тверду білу речовину (т.пл. 167-170°С), яку ідентифікують методами ЯМР і масспектрометрії. Приклад 10 Одержання гідрохлориду 6-метокси-3(фенілсульфоніл)-5-(піперазин-1-іл)-1-[4(трифторметил)феніл]-1Н-індазолу 30 Відповідно до методик прикладів 2-4, описаних вище, при використанні 4(трифторметил)фенілборонової кислоти, зазначену в заголовку сполуку одержують у вигляді твердої жовтувато-коричневої речовини (т.пл. 175177°С), яку ідентифікують методами ЯМР і масспектрометрії. Приклад 11 Одержання 5-(4-бензилпіперазин-1-іл)-1метил-3-(фенілсульфоніл)-1Н-індазолу Розчин 5-(4-бензилпіперазин-1-іл)-3(фенілсульфоніл)-1Н-індазолу (433мг, 1,00ммоль) у ТГФ при кімнатній температурі обробляють NaH (80мг, 60% у мінеральному маслі, 2,00ммоль), реакційну суміш перемішують протягом 0,5 години, обробляють метилйодидом (142мг, 1,00ммоль), перемішують протягом 16 годин і розбавляють водою і EtOAc. Органічну фазу відокремлюють, сушать над MgO4 і концентрують у вакуумі. Одержаний залишок хроматографують (SiO2, елюент; EtOАс/гексани 90:10), одержуючи зазначену в заголовку сполуку у вигляді твердої білої речовини (190мг, вихід 43%, т.пл. 195-197°С), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 12 Одержання дигідрохлориду 5-(4бензилпіперазин-1-іл)-1-етил-3-(фенілсульфоніл)1Н-індазолу Суміш 5-(4-бензилпіперазин-1-іл)-3(фенілсульфоніл)-1Н-індазолу (400мг, 0,92ммоль), брометану (108мг, 1,00ммоль) і K2СО3 (276мг, 2,00ммоль) у ДМФА перемішують протягом 16 годин при кімнатній температурі, потім розбавляють водою і EtOAc. Органічну фаз у відокремлюють, сушать над MgO4 і концентрують у вакуумі. Одержаний залишок хроматографують (SiO2, елюент: EtOAc/гексани 80:20, потім 90:10), одержуючи вільний амін зазначеної в заголовку сполуки у вигляді твердої білої речовини (230мг). Частину одержаного продукту (115мг, 0,25ммоль) розчиняють у етанолі, обробляють 4М НСl у діоксані і концентрують у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді твердої білої речовини (т.пл. >250°С), яку ідентифікують за допомогою масспектрометрії і ЯМР спектра. Приклади 13-93 Одержання похідних 3-арилсульфоніл-5піперазиниліндазолу 31 80184 32 Відповідно до методик прикладів 2-12, описаних вище, при використанні придатного 4нітрофенілпіперазину як вихідної речовини і придатного хлорметиларилсульфону як реагенту, одержують сполуки, представлені в таблиці І, які ідентифікують методами Н-ЯМР і масспектрометрії. Приклад 94 Одержання метилпіперазину 1-(5-хлор-2-нітрофеніл)-4 Суміш 4-хлор-2-фторнітробензолу (28,5ммоль), 1-метилпіперазин (28,5ммоль) і K2СО3 (37,0ммоль) у ДМФА перемішують при 100°С протягом 16 годин і розбавляють водою і EtOAc. Фази розділяють і водну фазу екстрагують EtOAc. Органічну фазу і екстракти поєднують, промивають послідовно водою і насиченим розчином солі, сушать над Na2SO4 і сушать у вакуумі. Одержаний залишок хроматографують (SiO2, елюент: 10% метанол у EtOAc), одержуючи зазначений у заголовку продукт. Приклад 95 Одержання 1-{5-хлор-2-нітро--3-{[(4фтор феніл)сульфоніл]метил}феніл}-4метилпіперазину Суміш 1-(5-хлор-2-нітрофеніл)-4метилпіперазину (1,0ммоль) і 4фторбензилсульфонілхлориду (1,0ммоль) у ТГФ при перемішуванні обробляють 2,2мл 1М розчину KO-t-Bu (2,2ммоль) у ТГФ при -78°С, нагрівають до кімнатної температури і витримують при даній температурі протягом 2 годин, гасять оцтовою кислотою і концентрують у вакуумі. Одержаний залишок розподіляють між ЕtOАс і водним розчином Na2CO3. Фази розділяють і водну фазу екстрагують EtOAc. Ор ганічну фазу поєднують з екстрактами, сушать над Na2SO4 і концентрують у вакуумі 33 80184 досуха, одержуючи зазначений у заголовку продукт. Приклад 96 Одержання 4-хлор-2-{[(4фтор феніл)сульфоніл]метил}-6-(4-метилпіперазин1-іл)аніліну Розчин 4-хлор-2-{[(4фтор феніл)сульфоніл]метил}-6-(4-метилпіперазин1-іл)аніліну (1,0ммоль) у метанолі обробляють Sn у вигляді фольги (593,3мг), потім 5,8мл 12М НСI, витримують при 60°С протягом 4 годин (до завершення реакції згідно з даними тонкошарової хроматографії), охолоджують до 0°С, обробляють твердим NaOH, доводячи значення рН до >10, і екстрагують СН 2СI2. Екстракти поєднують, промивають водою і концентрують досуха у вакуумі, одержуючи зазначену в заголовку сполуку. Приклад 97 Одержання 5-хлор-3-[(4фтор феніл)сульфоніл]-7-(4-метилпіперазин-1-іл)1Н-індазолу До розчину NaNO2 (2,0мг) у воді при 0°С краплями додають розчин 4-хлор-2-{[(4фтор фенілсульфоніл]метил}-6-(4-метилпіперазин1-іл)аніліну (102,2мг, 0,25ммоль) у 1М НСI, дають суміші нагрітись до кімнатної температури протягом 2 годин, потім обробляють насиченим розчином Na2CO3, доводячи значення рН до >10, і фільтрують. Осад на фільтрі промивають водою і сушать у вакуумі, одержуючи зазначену в заголовку сполуку, яку ідентифікують методами ЯМР і мас-спектрометрії. Приклади 98-101 Одержання похідних 3-(арилсульфоніл)-7-(4метилпіперазин-1-іл)-1Н-індазолу Відповідно до методик прикладів 95-97, описаних вище, при використанні придатного арилсульфонілхлориду одержують сполуки, представлені 34 в таблиці II, які ідентифікують методами ЯМР і мас-спектрометрії. Приклад 102 Одержання 1-фтор-3-[4-(третбутоксикаронил)піперазин-1-іл]бензальдегіду Розчин 2,6-дифторбензальдегіду 5 (10,0м, 70ммоль) у Ν,Ν-диметилформаміді обробляють трет-бутилпіперазин-1-карбоксилатом (Воc) 6 (14,4м, 77,0ммоль) і карбонатом калію (11,7м, 85,0ммоль), перемішують при 80°С протягом 16 годин, охолоджують до температури навколишнього середовища, розбавляють водою і екстрагують метиленхлоридом. Екстракти поєднують, промивають послідовно водою і насиченим розчином солі, сушать над суль фатом натрію і концентрують у вакуумі, одержуючи неочищену олію. Одержану олію очищають колонковою хроматографією (силікагель, етилацетат/гексани 15:85), одержуючи зазначену в заголовку сполуку у вигляді твердої жовтої речовини (15,5м, вихід 71%), яку ідентифікують методами ЯМР і масспектрометрії. Приклад 103 Одержання 4-[4-(третбутоксикарбоніл)піперазин-1-іл]-1Н-індазолу Розчин 7 (20,0м, 64,9ммоль) і гідразинмоногідрату (30мл) у метил сульфоксиді перемішують при 95°С протягом 96 годин, охолоджують до кімнатної температури, розподіляють між насиченим розчином гідрокарбонату натрію і ефіром. Фази розділяють і водну фазу екстрагують ефіром. Екстракти поєднують з органічною фазою, промивають по 35 80184 слідовно водою і насиченим розчином солі, сушать над сульфатом натрію і концентрують у вакуумі з одержанням неочищеного залишку. Одержаний залишок очищають колонковою хроматографією (силікагель, елюент із градієнтом: етилацетат/гексани від 10:90 до 30:70), одержуючи зазначену в заголовку сполуку у вигляді твердої сві тложовтої речовини (12,3м, вихід 57%), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 104 Одержання 4-[4-(третбутоксикарбоніл)піперазин-1-іл]-3-йод-1Н-індазолу Розчин 4-[4-(трет-бутоксикарбоніл)піперазин1-іл]-1Н-індазолу (5,00м, 16,5ммоль) у Ν,Νдиметилформаміді обробляють порошкоподібним гідроксидом калію (1,85м, 33,07ммоль) і йоду (4,61м, 18,2ммоль), одержану суміш перемішують при кімнатній температурі протягом 16 годин, розбавляють етилацетатом і гасять 15% водним розчином метабисульфіту натрію. Фази розділяють і водну фазу екстрагують етилацетатом. Екстракти і органічну фазу поєднують, промивають насиченим розчином солі, сушать над сульфатом натрію і концентрують у вакуумі з одержанням неочищеного твердого продукту. Одержану тверду речовину очищають колонковою хроматографією (силікагель, етилацетат/гексани від 10:90 до 15:85 і потім до 20:80), одержуючи зазначену в заголовку сполуку у вигляді твердої жовтої речовини (2,40м, вихід 35%), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 105 Одержання 4-[4-(третбутоксикарбоніл)піперазин-1-іл]-3(фенілсульфоніл)-1Н-індазолу Суміш 4-[4-(трет-бутоксикарбоніл)піперазин-1іл]-3-йод-1Н-індазолу (0,110м, 0,257ммоль), бензолсульфінату натрію (0,068м, 0,411ммоль), йодиду міді (І) (0,073м, 0,386ммоль) і Ν,Νдиметилформаміду завантажують у пробірку з гвинтовою пробкою і мембраною, покритою тефлоном. З пробірки відкачують повітря і заповнюють її аргоном. Цю процедуру повторюють двічі, потім пробірку нагрівають до 125°С і витримують при цій температурі протягом 4 годин. Реакційну суміш 36 охолоджують, розподіляють між етилацетатом і водою і фільтрують через шар діатомової землі. Фільтрат поділяють на фази. Органічну фазу промивають насиченим розчином солі, сушать над сульфатом натрію і концентрують у вакуумі. Одержаний неочищений продукт очищають колонковою хроматографією (силікагель, етилацетат/гексани 40:60), одержуючи зазначену в заголовку сполуку у вигляді блідо-жовтої піни (0,022м, вихід 18%), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 106 Одержання гідрохлориду 3-(фенілсульфоніл)4-піперазин-1-іл-1Н-індазолу Розчин 4-[4-(трет-бутоксикарбоніл)піперазин1-іл]-3-(фенілсульфоніл)-1Н-індазолу (0,022м, 0,050ммоль) у метанолі обробляють 2М розчином НСl в ефірі (0,4мл), одержану суміш кип'ятять зі зворотним холодильником протягом 1 години, охолоджують до кімнатної температури і концентрують досуха. Залишок знову розчиняють у метанолі і концентрують. Цю процедуру повторюють ще три рази, в результаті одержують зазначену в заголовку сполуку у вигляді твердої білої речовини (0,009м, вихід 40%), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 107 Одержання 4-[4-третбутоксикарбоніл)піперазин-1-іл)-3-(1-нафтилтіо)1Н-індазолу Суміш 4-[4-(трет-бутоксикарбоніл)піперазин-1іл]-3-йод-1Н-індазолу (0,068м, 0,159ммоль), йодиду міді(І) (0,005м, 0,024ммоль) і карбонату калію (0,044м, 0,318ммоль) додають у пробірку з гвинтовою пробкою з мембраною, покритою тефлоном. З пробірки відкачують повітря і заповнюють її аргоном і цю процедуру повторюють ще два рази. Реакційну суміш обробляють послідовно 2пропанолом (1,5мл), етиленгліколем (19мкл, 0,318ммоль) і 1-нафталінтіолом (0,051м, 0,318ммоль), нагрівають до 130-140°С і витримують при цій температурі протягом 8 годин, потім охолоджують до кімнатної температури, розбавляють етилацетатом і фільтрують через діатомову землю. Фільтрат концентрують при зниженому 37 80184 тиску. Одержаний неочищений продукт очищають флеш-хроматографією (силікагель, етилацетат/гексани 40:60), одержуючи зазначену в заголовку сполуку у ви гляді безбарвної олії (0,033м, вихід 45%), яку ідентифікують методами ЯМР і масспектрометрії. Приклад 108 Одержання 4-[4-(третбутоксикарбоніл)піперазин-1-іл]-3-(1нафтилсуль фоніл)-1Н-індазолу Розчин 4-[4-трет-бутоксикарбоніл)піперазин-1іл)-3-(1-нафтилтіо)-1Н-індазолу (0,030м, 0,065ммоль) у крижаній оцтовій кислоті при перемішуванні обробляють 35% водним розчином пероксиду водню (0,127м, 1,30ммоль), одержану суміш перемішують протягом 24 годин, потім реакцію гасять 10% водним розчином метабісульфіту натрію (1мл) і концентрують у вакуумі. Одержану тверду речовину відразу додають до суспензії 10% паладію на вугіллі (3мл) у метанолі (10мл) і гідрують в апараті Пара в атмосфері водню при тиску 40 фунтів на кв. дюйм протягом 2 годин зі струшуванням, потім фільтрують через діатомову землю. Фільтрат концентрують у вакуумі. Одержаний неочищений продукт очищають флешхроматографією (силікагель, етилацетат/гексани 30:70), одержуючи зазначену в заголовку сполуку у вигляді безбарвної олії (0,011м, вихід 35%), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 109 Одержання гідрохлориду 3-(1нафтилсуль фоніл)-4-піперазин-1-іл-1Н-індазолу Відповідно до методики прикладу 106, приведеної вище, при використанні 4-[4-(третбутоксикарбоніл)піперазин-1-іл]-3-(1нафтилсуль фоніл)-1Н-індазолу як вихідної речовини, зазначену в заголовку сполуку одержують у вигляді твердої речовини світло-жовтого кольору (вихід 74%, т.пл. 220°С розкл.), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклади 110-114 Одержання похідних гідрохлориду 3(арилсульфоніл)-4-піперазин-1-іл-1Н-індазолу 38 Відповідно до методик прикладів 102-109, описаних вище, при використанні придатного арилтіолу або арилсульфінату одержують сполуки, представлені в таблиці III, які ідентифікують методами ЯМР і мас-спектрометрії. Приклад 115 Одержання 6-[4-третбутоксикарбоніл)піперазин-1-іл]-1Н-індазолу Розчин 6-аміноіндазолу (13,3м, 100ммоль) у нбутанолі при перемішуванні обробляють гідрохлоридом біс(2-хлоретил)аміну (28,6м, 160ммоль) і карбонатом калію (34,6м, 250ммоль), одержану суміш кип'ятять зі зворотним холодильником протягом 72 годин, охолоджують до кімнатної температури і концентрують у вакуумі. Одержаний неочищений продукт розчиняють у 1,4-діоксані, розчин охолоджують до 0°С і при перемішуванні обробляють IN розчином гідроксиду натрію (200мл) і ди-трет-бутилдикарбонату (34,9м, 160ммоль), суміш перемішують при температурі навколишнього середовища протягом 24 годин і концентрують у вакуумі з одержанням неочищеної олії. Одержану олію розподіляють між етилацетатом і водою. Органічний шар відокремлюють, промивають насиченим розчином солі, сушать над сульфатом натрію і концентрують у вакуумі. Одержаний залишок очищають флеш-хроматографією (силікагель, етилацетат/гексани 40:60), одержуючи зазначену в заголовку сполуку у вигляді безбарвної олії (11,5м, вихід 38%), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 116 39 80184 Одержання 6-[4-третбутоксикарбоніл)піперазин-1-іл]-3-йод-1Н-індазолу Розчин 6-[4-трет-бутоксикарбоніл)піперазин-1іл]-1Н-індазолу (7,20м, 23,8ммоль) у Ν,Νдиметилформаміді при 0°С при перемішуванні обробляють порошкоподібним гідроксидом калію (5,40м, 95,4ммоль) з наступним додаванням краплями розчину йоду (10,9м, 42,9ммоль) у Ν,Νдиметилформаміді, суміш перемішують при температурі навколишнього середовища протягом 16 годин, розбавляють етилацетатом і реакцію гасять 10% водним розчином метабісульфіту натрію. Фази розділяють. Водну фазу екстрагують етилацетатом. Екстракти поєднують з органічною фазою, промивають насиченим розчином солі, сушать над сульфатом натрію і концентрують у вакуумі. Одержаний неочищений продукт очищають флешхроматографією (силікагель, етилацетат/гексани 30:70), одержуючи зазначену в заголовку сполуку у вигляді твердої жовтої речовини (11,5м, вихід 38%), яку ідентифікують методами ЯМР і масспектрометрії. Приклад 117 Одержання 6-[4-(третбутоксикарбоніл)піперазин-1-іл]-3(фенілсульфоніл)-1Н-індазолу Відповідно до методики прикладу 105, описаної вище, при використанні 6-[4-(третбутоксикарбоніл)піперазин-1-іл]-3-йод-1Н-індазолу і бензолсульфінату натрію, зазначену в заголовку сполуку одержують у ви гляді безбарвної піни (вихід 80%), яку ідентифікують методами ЯМР і масспектроскопії. Приклад 118 Одержання гідрохлориду 3-(фенілсульфоніл)6-піперазин-1-іл-1Н-індазолу Відповідно до методики прикладу 106, описаної вище, при використанні 6-[4-(третбутоксикарбоніл)піперазин-1-іл]-3(фенілсульфоніл)-1Н-індазолу як вихідної речовини, зазначену в заголовку сполуку одержують у вигляді твердої, не зовсім білої речовини (вихід 81 %), яку ідентифікують методами ЯМР і масспектроскопії. 40 Приклади 119-124 Одержання похідних гідрохлориду (арилсульфоніл)-6-піперазин-1-іл-1Н-індазолу 3 Відповідно до методик прикладів 117 і 118, описаних вище, при використанні придатного арилсульфінату, одержують сполуки, представлені в таблиці IV, які ідентифікують методами ЯМР і масспектроскопії. Приклад 125 Одержання 6-[4-(третбутоксикарбоніл)піперазин-1-іл)-3-(1-нафтилтіо)1Н-індазолу Відповідно до методики прикладу 107, описаної вище, при використанні 6-[4-(третбутоксикарбоніл)піперазин-1-іл]-3-йод-1Н-індазолу як вихідної речовини, зазначену в заголовку сполуку одержують у вигляді безбарвної олії (вихід 78%), яку ідентифікують методами ЯМР і масспектроскопії. Приклад 126 Одержання 6-[4-(третбутоксикарбоніл)піперазин-1-іл)-3-(1-нафтилсульфоніл)-1Н-індазолу Розчин 6-[4-(трет-бутоксикарбоніл)піперазин1-іл)-3-(1-нафтилтіо)-1Н-індазолу (0,240м, 0,521ммоль) у метиленхлориді при перемішуванні обробляють метахлорнадбензойною кислотою (mcpba) (77% чистоти, 0,350м, 1,56ммоль) і гідрокарбонатом натрію (0,219м, 2,61ммоль), суміш 41 80184 перемішують при температурі навколишнього середовища протягом 16 годин і розподіляють між етилацетатом і водою. Фази розділяють і водну фазу екстрагують метиленхлоридом. Екстракти і органічну фазу поєднують, промивають послідовно 10% водним розчином гідрокарбонату натрію і насиченим розчином солі, сушать над сульфатом натрію і концентрують у вакуумі з одержання неочищеної олії. Одержану олію додають до суспензії 10% паладію на вуглеці (40мг) у метанолі і гідрують зі струшуванням в апараті Пара воднем при тиску 40 фунтів на кв. дюйм протягом 2 годин, потім фільтрують через діатомову землю. Фільтрат концентрують у вакуумі. Одержаний неочищений продукт очищають флеш-хроматографією (силікагель, етилацетат/гексани 50:50), одержуючи зазначену в заголовку сполуку у вигляді безбарвної олії (0,106м, вихід 41%), яку ідентифікують методами ЯМР і мас-спектрометрії. Приклад 127 Одержання гідрохлориду 3-(1нафтилсуль фоніл)-6-піперидин-1-іл-1Н-індазолу Відповідно до методики прикладу 106, описаної вище, при використанні 6-[4-(третбутоксикарбоніл)піперазин-1-іл]-3-(1нафтилсуль фоніл)-1Н-індазолу як вихідної речовини, зазначену в заголовку сполуку одержують у вигляді твердої білої речовини (вихід 98%, 205210°С), яку ідентифікують методами ЯМР і масспектроскопії. Приклад 128 Порівняльна оцінка спорідненості зв'язування з 5-НТ6 досліджуваних сполук Спорідненість досліджуваних сполук до серотонінового 5-НТ6 рецептора оцінюють у такий спосіб. Культивовані клітини Гела, які експресують клонування 5-НТ6 рецептори людини, збирають і центрифугують з низькою швидкістю (1000xg) протягом 10,0 хвилин для видалення культурального середовища. Зібрані клітини суспендують у половинному об'ємі свіжого забуференого фосфатного фізіологічного розчину і знову центрифугують з такою ж швидкістю. Цю операцію повторюють. Зібрані клітини потім гомогенізують у десятьох об'ємах 50мМ Tris HCl (ρΗ 7,4) і 0,5мМ EDTA. Гомогенат центрифугують при 40000xg протягом 30,0 хвилин і осад збирають. Одержаний пелет знову суспендують у 10 об'ємах Tris-HCl буфера і знову центрифугують з такою ж швидкістю. Кінцевий пелет суспендують у невеликому обсязі TrisHCl буфера і визначають вміст тканинного білка в аліквотах об'ємами 10-25мкл. Сироватковий альбумін великої рогатої худоби використовують як стандарт при визначенні вмісту білка відповідно до методу, описаного у [публікації Lowry et al., J. Biol. Chem., 193:265 (1951)]. Об'єм суспендованих клітинних мембран доводять до обсягу, при якому 42 концентрація тканинного білка складає 1,0мг/мл суспензії. Одержану мембранну суспензію (10кратно концентровану) відбирають в аліквоти обсягом 1,0 мл і зберігають при -70°С до використання в наступних дослідах визначення зв'язування. Досліди з визначення зв'язування проводять у 96-ямкових планшетах із загальним обсягом 200мкл. У кожну ямку додають наступну суміш: 80,0мкл інкубаційного буфера, одержаного з 50мМ Tris-HCl буфера (рН 7,4), що містить 10,0мМ MgCl2 і 0,05мМ EDTA, і 20мкл [3H]-LSD (S.A., 86,0Кі/ммоль, доступного від Amersham Life Science), 3,0нМ. Константа дисоціації [3H]LSD, KD, на серотоніновому 5-НТ6 рецепторі людини дорівнює 2,9нМ, як визначено за насиченням зв'язування при підвищенні концентрацій [3H]LSD. Реакцію ініціюють кінцевим додаванням 100,0мкл тканинної суспензії. Кількісне визначення неспецифічного зв'язування проводять у присутності 10,0мкМ метіотепіну. Випробувані сполуки додають в обсязі 20,0мкл. Реакцію проводять у темряві при кімнатній температурі протягом 120 хвилин, у процесі чого зв'язаний комплекс «ліганд-рецептор» відфільтровують на 96-ямковому уніфільтрі (unifilter) з харвестером Packard FiltermateÒ 196. Зв'язаному комплексу на фільтрувальному диску дають висо хнути на повітрі і радіоактивність вимірюють за допомогою лічильника Packard TopCountÒ, оснащеного шістьма фотомультиплетними детекторами, після додавання 40,0мкл сцинтиляційного люмінофора MicroscintÒ у кожну поверхневу ямку. Чашу уні фільтру теплоізолюють і радіоактивність зчитують на Packard TopCountÒ з ефективністю тритію 31,0%. Специфічне зв'язування з 5-НТ6 рецептором визначають як загальну радіоактивність за винятком кількості зв'язування у присутності 10,0мкМ неміченого метіотепіну. Зв'язування у присутності тестованої сполуки у змінюваних концентраціях виражають як відсоток від специфічного зв'язування у відсутності тестованої сполуки. Результати представляють у вигляді графіка залежності log % зв'язування від log концентрації тестованої сполуки. За допомогою нелінійного регресійного аналізу одержаних даних з використанням комп'ютерної програми PrismÒ для досліджуваних сполук одержують значення ІС50 і Ki з довірчими інтервалами 95%. Кількість заміщення, одержана за допомогою тестованої сполуки, виражають у відсотку (%) інгібування і обчислюють з наступного рівняння: æ B - NSB ö % інгібування = ç 1 - 0 ÷100 è TB - NSB ø де В0 являє собою кількість СРМ-зв'язування у присутності тестованого засобу; NSB являє собою СРМ зв'язування у присутності концентрації насичення замінника; ТВ являє собою загальну кількість СРМ- зв'язування при нульовій (0) концентрації тестованої сполуки. Альтернативно, з графіка лінійної регресії одержаних точок визначають значення ІС 50, і зна 43 чення Ki обчислюють за допомогою наступного рівняння: Ki=IC50/(1+L/KD), де L являє собою концентрацію використовуваного радіоактивного ліганду, KD являє собою константу дисоціації ліганду для рецептора, обидві концентрації виражають у нМ. Комп’ютерна в ерстка О. Гапоненко 80184 44 Використовуючи описану методику аналізу, визначають значення % інгібування і Ki і порівнюють зі значеннями, одержаними з використанням контрольних сполук, які, як відомо, виявляють зв'язування з 5-НТ6 рецептором. Одержані дані представлені в таблиці V нижче. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюHeterocyclyl-3-sulfonylindazoles as 5-hydroxytryptamine-6 ligands
Автори англійськоюBernotas Ronald Charles
Назва патенту російськоюГетероциклил-3-сульфонилиндазолы как лиганды гидрокситриптамина-6
Автори російськоюБернотас Рональд Чарльз
МПК / Мітки
МПК: C07D 409/04, A61P 25/00, C07D 403/04, C07D 231/56, C07D 409/12
Мітки: 5-гідрокситриптаміну-6, ліганди, гетероцикліл-3-сульфоніліндазоли
Код посилання
<a href="https://ua.patents.su/22-80184-geterociklil-3-sulfonilindazoli-yak-ligandi-5-gidroksitriptaminu-6.html" target="_blank" rel="follow" title="База патентів України">Гетероцикліл-3-сульфоніліндазоли як ліганди 5-гідрокситриптаміну-6</a>
Попередній патент: Машина для видалення шарів дорожнього покриття
Наступний патент: Пристрій електропостачання для живлення транспортного засобу
Випадковий патент: Проміжний детонатор для свердловинних зарядів












