1-(аміноалкіл)-3-сульфонілазаіндоли як ліганди 5-гідрокситриптамінів-6
Номер патенту: 78999
Опубліковано: 10.05.2007
Автори: Бернотас Рональд Чарльз, Антане Шуйлер А., Ленісек Стівен Едвард
Формула / Реферат
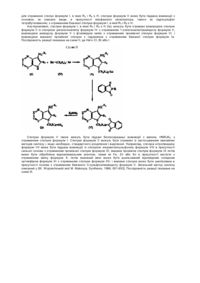
1. Сполука формули (І)
 , (I)
, (I)
де
W є N або CR7;
Х є N або CR8;
Y є N або CR9;
Z є N або CR10, за умови, що принаймні один, і не більше двох, з W, X, Y і Z повинен бути N;
n є цілим числом 2, 3, 4 або 5;
R1 є необов'язково заміщеним С1-С6-алкілом, С3-С7-циклоалкілом, арилом або гетероарилом, або необов'язково заміщеним 8-13-членною біциклічною або трициклічною системою кілець, що має атом N в основі місточкового зв'язку і необов'язково містить 1, 2 або 3 додаткових гетероатоми, вибраних з N, О або S;
R2 є Н, галогеном або С1-С6-алкілом, С1-С6-алкокси, С3-С7-циклоалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений;
R3 і R4 кожний незалежно є Н або необов'язково заміщеним С1-С6-алкілом;
R5 і R6 кожний незалежно є Н або С1-С6-алкілом, С2-С6-алкенілом, С2-С6-алкінілом, С3-С7-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений, або R5 і R6 разом з атомом, до якого вони приєднані, утворюють необов'язково заміщене 5-8-членне кільце, що необов'язково містить додатковий гетероатом, вибраний з О, NR11 або SOm;
R7, R8, R9 і R10 незалежно є Н, галогеном, CN, OCO2R12, СО2R13, CONR14R15, SOpR16, NR17R18, OR19, COR20 або С1-С6-алкілом, С2-С6-алкенілом, С2-С6-алкінілом, С3-С7-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений;
R11, R12, R13, R16, R19 і R20 кожний незалежно є Н або С1-С6-алкілом, С2-С6-алкенілом, С2-С6-алкінілом, С3-С7-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений;
R14 і R15 кожний незалежно є Н або необов'язково заміщеним С1-С6-алкілом, або R14 і R15 разом з атомом, до якого вони приєднані, можуть утворювати 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний з О, NR22 або S;
R17 і R18 кожний незалежно є Н або необов'язково заміщеним С1-С4-алкілом, або R17 і R18 разом з атомом, до якого вони приєднані, можуть утворювати 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний з О, NR21 або SOx;
R21 і R22 кожний незалежно є Н або С1-С6-алкілом, С2-С6-алкенілом, С3-С7-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений; і
m, р і х кожний незалежно дорівнює 0 або цілому числу 1 або 2; або
її стереоізомер або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, в якій W або Z є N.
3. Сполука за п. 1 або 2, в якій n дорівнює 2.
4. Сполука за будь-яким з пп. 1-3, в якій R1 є необов'язково заміщеним фенілом, нафтилом або імідазотіазолілом.
5. Сполука за п. 4, в якій R1 є фенілом, необов'язково заміщеним галогеном або 1-нафтилом або 6-хлорімідазо[1,2-b][1,3]тіазол-5-ілом.
6. Сполука за будь-яким з пп.1-5, в якій W є CR7; Х є CR8; і Y є CR9.
7. Сполука за будь-яким з пп. 1-6, в якій Х є CR8; Y є CR9; і Z є CR10.
8. Сполука за будь-яким з пп. 1-7, в якій R5 і R6 кожний незалежно є Н або С1-С3-алкілом.
9. Сполука за будь-яким з пп. 1-8, в якій R3 і R4 є Н.
10. Сполука за будь-яким з пп. 1-9, в якій R2 є Н.
11. Сполука за п. 1, вибрана з групи, що включає:
2-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етиламін;
2-[3-(фенілсульфоніл)-1Н-піроло[2,3-с]піридин-1-іл]етиламін;
2-[3-(фенілсульфоніл)-1Н-піроло[3,2-с]піридин-1-іл]етилаімін;
2-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}етиламін;
2-{3-[(4-метилфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етиламін;
2-{3-[(нафт-1-ил)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етиламін;
2-{3-[(6-хлорімідазо[2,1-b][1,3]тіазол-5-іл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл} етиламін;
2-{3-[(3-хлорфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етиламін;
2-{3-[(2-хлорфеніл)сульфоніл]-1Н-піроло[2,3-с]піридин-1-іл}етиламін;
2-{3-[(3-метоксифеніл)сульфоніл]-1Н-піроло[3,2-с]піридин-1-іл}етиламін;
2-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}етиламін;
N,N-диметил-N-(2-{3-[(3-фторфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)амін;
N,N-диметил-N-{2-[3-(нафт-1-илсульфоніл)-1Н-піроло [2,3-b]піридин-1-іл]етил}амін,
N,N-диметил-N-(2-{3-[(6-хлорімідазо[1,2-b][1,3]тіазол-5-іл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)амін;
N,N-димeтил-N-(2-{3-[(3-xлopфeнiл)cyльфoнiл]-1H-пipoлo[2,3-b]пipидин-1-іл}етил)амін;
3-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]пропан-1-амін;
3-[3-(фенілсульфоніл)-1Н-піроло[2,3-с]піридин-1-іл]пропан-1-амін;
3-[3-(фенілсульфоніл)-1Н-піроло[3,2-с]піридин-1-іл]пропан-1-амін;
3-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}пропан-1-амін;
2-{6-хлор-3-[(3-хлорфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}
етиламін;
2-{7-хлор-3-[(2-хлорфеніл)сульфоніл]-1Н-піроло[2,3-с]піридин-1-іл}
етиламін;
4-{3-[(3-метоксифеніл)сульфоніл]-1Н-піроло [3,2-c]піридин-1-іл}бутан-1-
амін;
4-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}бутан-1-амін;
N,N-диметил-N-{2-[3-(фенілсульфоніл)-1Н-піроло[2,3-с]піридин-1-іл]етил}амін;
N,N-диметил-N-{2-[3-(фенілсульфоніл)-1Н-піроло[3,2-с]піридин-1-іл]етил}амін;
N,N-диметил-N-{2-[3-(тіан-2-іл)-1Н-піроло[2,3-b]піридин-1-іл]етил}амін;
N,N-диметил-N-{2-[3-(нафт-1-ил)-1Н-піроло[2,3-b]піридин-1-іл]етил}амін;
N,N-диметил-N-(2-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}етил)амін;
N-метил-N-(2-{3-[(3-хлорфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)амін;
N-метил-N-(2-{3-[(3-фторфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)амін;
N-метил-N-{2-[3-(нафт-1-илсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етил}амін;
N-метил-N-(2-{3-[(6-хлорімідазо[1,2-b][1,3]тіазол-5-іл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)амін;
N-метил-N-(2-{3-[(2-хлорфеніл)сульфоніл]-1Н-піроло[3,2-с]піридин-1-іл}етил)амін;
N-метил-N-(2-{3-[(3-метоксифеніл)сульфоніл]-1Н-піроло[2,3-с]піридин-1-іл}етил)амін;
N-бензил-N-(2-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}етил)амін;
N,N-дибензил-3-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]пропан-1-амін;
3-[3-(фенілсульфоніл)-1Н-піроло[2,3-с]піридин-1-іл]пропан-1-амін;
3-[3-(фенілсульфоніл)-1Н-піроло[3,2-с]піридин-1-іл]пропан-1-амін;
їх стереоізомери і фармацевтично прийнятні солі.
12. Спосіб лікування розладу центральної нервової системи, пов'язаного з або що знаходиться під впливом рецептора 5-ГТ6, у пацієнта, потребуючого цього, який включає введення вказаному пацієнту терапевтично ефективної кількості сполуки формули І, такої, як визначено в будь-якому з пп. 1-11, або її стереоізомера, або її фармацевтично прийнятної солі.
13. Спосіб за п. 12, в якому вказаним розладом є розлад моторики, тривога або когнітивний розлад.
14. Спосіб за п. 12, в якому вказаним розладом є нейродегенеративний розлад.
15. Спосіб за п. 13, в якому вказаним розладом є дефіцит уваги або обсесивно-компульсивний розлад;
16. Спосіб за п. 14, в якому вказаним розладом є удар або травма голови.
17. Фармацевтична композиція, яка містить фармацевтично прийнятний носій і сполуку формули І, таку, як визначено в будь-якому з пп. 1-11, або її стереоізомер, або її фармацевтично прийнятну сіль.
18. Спосіб отримання сполуки формули І, такої, як описано в п. 1, або її стереоізомерів або її фармацевтично прийнятних солей, в якому піддають взаємодії сполуку формули II
 , ІІ
, ІІ
де W, X, Y, Z, R1 і R2 такі, як указано вище, з галогеналкіламіном формули III
![]() , (III)
, (III)
де Hal є Сl, Вr або І і R3, R4, R5, R6 і n такі, як указано вище, в присутності основи з отриманням сполуки формули І.
Текст
Даний винахід відноситься до 1-(аміноалкіл)-3-сульфонілазаіндолів, що застосовуються як ліганди 5гідрокситриптаміну-6, до способів їх отримання, до способів лікування з їх застосуванням і до фармацевтичних композицій, що містять їх. Рецептори серотоніну (5-гідрокситриптаміну) (5-ГТ) грають критичну роль в багатьох фізіологічних і поведінкових функціях у людини і тварин. Такі функції опосередковуються через різні рецептори 5-ГТ, розподілені в організмі. У цей час існує приблизно п'ятнадцять різних підтипів рецепторів 5-ГТ людини, які клоновані, багато які з них грають добре визначену роль у людини. Одним з недавно ідентифікованих підтипів рецепторів 5-ГТ є рецептор 5-ГТ6, уперше клонований з тканини щура в 1993 році [Monsma, F.J.; Shen, Y.; Ward, R.P.; Hamblin, M.W. Molecular Pharmacology 1993, 43, 320-327] і потім з тканини людини [Kohen, R.; Metcalf, Μ, Α.; Khan, Ν.; Druck, Т.; Huebner, К.; Sibley, D.R. Journal of Neurochemistry 1996,. 66, 4756]. Рецептор являє собою зв'язаний з G-білком рецептор (GPCR), позитивно зв'язаний з аденілатциклазою [Ruat, Μ.; Traiffort, E.; Arrang, J-M.; Tardivel-Lacombe, L.; Diaz, L.; Leurs, R.; Schwartz, J-C. Biochemical Biophysical Research Communications 1993, 193, 268-276]. Рецептор знайдений практично виключно в центральній нервовій системі (ЦНС), як у щурів, так і у людини. Дослідження гібридизації in situ рецептору 5-ГТ6 в мозку щура із застосуванням мРНК показали основну локалізацію в ділянках проекції 5-ГТ, включаючи стриатум, necleus accumbens, нюхові горбики і гіпокампальні утворення [Ward, R.P.; Harablin, M.W.; Lachowicz, J.E.; Hoffman, B.J.; Sibley, D.P ; Dorsa, D.M. Neuroscience 1995, 64, 1105-1111]. Існує безліч потенційних галузей застосування для лігандів 5-ГТ6 у людини, основаних на прямій дії і на свідченнях з відомих наукових досліджень. Ці дослідження включають локалізацію рецептора, афінність лігандів з відомою in vivo активністю і різні дослідження на тваринах, що проводяться аж до цього часу. Однією з потенційних галузей застосування модуляторів функції рецептора 5-ГТ6 є поліпшення пізнавальної здатності і пам'яті у людини при таких захворюваннях, як хвороба Альцгеймера. Високі рівні рецептора, знайдені у важливих структурах в передньому мозку, включаючи каудат/шкарлупу, гіпокамп, necleus accumbens і кору головного мозку, передбачають залучення рецептора в функції пам'яті і пізнавальній здатності, оскільки відомо, що ці ділянки грають життєво важливу роль для пам'яті [Garard, С; Martres, Μ.-P.; Lefevre, К.; Miquel, Μ.С; Verge, D.; Lanfumey, R.; Doucet, E.; Hamon, M.; El Mestikawy, S. Brain Research, 1997, 746, 207-219]. Здатність відомих лігандів рецептора 5-ГТ6 поліпшувати холінергічну трансмісію також підтверджує можливість застосування для поліпшення пізнавальної здатності [Bentley, J.C.; Boursson, Α.; Boess, F.G.; Копе, F.C.; Marsden, C.A.; Petit, Ν.; Sleight, A.J. British Journal of Pharmacology, 1999, 126(7), 1537-1542]. У процесі досліджень було виявлено, що відомий селективний антагоніст 5-ГТ6 значно підвищує рівні глутамату і аспартату в лобовій корі головного мозку, не збільшуючи рівні норадреналіну, допаміну або 5-ГТ. Таке селективне збільшення нейрохімічних речовин, яке, як відомо, залучене в функції пам'яті і пізнавальній здатності, чітко вказує на роль лігандів 5-ГТ6 в пізнавальній здатності [Dawson, L.A.; Nguyen, H.Q.; Li, P. British Journal of Pharmacology, 2000, 120(7), 23-26]. Дослідження пам'яті тварин і вивчення відомого селективного антагоніста 5-ГТ6 показали деякий позитивний ефект [Rogers, D.C.; Hatcher, P.O.; Hagan, J.J. Society of Neuroscience, Abstracts 2000, 26, 680]. Подібним потенційним терапевтичним застосуванням лігандів 5-ГТ6 є лікування розладів дефіциту уваги (РДУ, також відомих, як захворювання гіперактивності дефіциту уваги або ЗГДУ) у дітей і у дорослих. Оскільки, схоже, що антагоністи 5-ГТ6 поліпшують активність нігростріарного допамінового шляху, і оскільки ЗГДУ пов'язане з аномаліями в каудаті [Ernst, M.; Zametkin, A.J.I Matochik, J.H.; Jons, P.A.; Cohen, R.M. Journal of Neuroscience 1998, 18(15), 5901-5907], антагоністи 5-ГТ6 можуть послабляти розлади дефіциту уваги. У ранніх дослідженнях, в яких вивчали афінність різних лігандів ЦНС при відомому терапевтичному застосуванні або велику структурну схожість з відомими лікарськими засобами, була запропонована роль лігандів 5-ГТ6 в лікуванні шизофренії і депресії. Наприклад, клозапін (ефективний клінічний антипсихотичний засіб) має високу афінність до 5-ГТ6 підтипу рецептора. Також деякі клінічні антидепресанти мають високу афінність до рецептору і діють як антагоністи на цій ділянці [Branchek, Τ.Α.; Blackburn, T.P. Annual Reviews in Pharmacology and Toxicology 2000, 40, 319-334]. Далі, недавні in vivo дослідження на щурах показали, що модулятори 5-ГТ6 можуть бути корисні при лікуванні розладів руху, включаючи епілепсію [Stean, T.; Routledge, C; Upton, N. British Journal of Pharmacology, 1999, 127 Proc. Supplement 131P і Rouledge, C; Bromidge, S.M.; Moss, S.F.; Price, G.W.; Hirst, W.; Newman, H.; Riley, G.; Gager, Т.; Stean, Т.; Upton, N.; Clarke, S.F.; Brown, A.M. British Journal of Pharmacology, 2000, 130(7), 1606-1612]. Взяті разом, вказані дослідження твердо підтверджують, що сполуки, які є лігандами 5-ГТ6, можуть застосовуватися при терапевтичних показаннях, включаючи: лікування захворювань, пов'язаних з дефіцитом пам'яті, пізнавальної здатності і здатності до навчання, таких як хвороба Альцгеймера і розлад дефіциту уваги; лікування розладів особистості, таких як шизофренія; лікування розладів поведінки, наприклад, тривоги, депресії і обсесивно-компульсивних розладів; лікування розладів руху або моторики, таких як хвороба Паркінсона і епілепсія; лікування захворювань, пов'язаних з нейродегенерацією, таких як удар і травма голови; або зняття залежності від лікарських засобів, включаючи залежність від нікотину, алкоголю і інших речовин, що спричиняють звикання. Тому об'єктом даного винаходу є сполуки, які корисні як терапевтичні агенти при лікуванні різних розладів центральної нервової системи, пов'язані з або що знаходяться під впливом рецептора 5-ГТ6. Іншим об'єктом даного винаходу є терапевтичні способи і фармацевтичні композиції, що застосовуються при лікуванні розладів центральної нервової системи, пов'язаних з або що знаходяться під впливом рецептора 5-ГТ6. Характерною особливістю даного винаходу є те, що сполуки відповідно до даного винаходу також можуть застосовуватися для подальших досліджень і оцінки рецептора 5-ГТ6. Ці і інші об'єкти і характеристики даного винаходу стануть більш зрозумілими з докладного опису, представленого нижче. Даний винахід відноситься до похідного 1-(аміноалкіл)-3-сульфонілазаіндолу формули І де W є N або CR7; X є N або CR8; Υ є N або CR9; Ζ є N або CR10 за умови, що, принаймні, один, і не більш двох з W, Χ, Υ і Ζ повинні бути Ν; n є цілим числом 2, 3, 4 або 5; R1 є необов'язково заміщеним С1-С6-алкілом, С3-С7-циклоалкілом, арилом або гетероарилом, або необов'язково заміщеною 8-13-членною біциклічною або трициклічною системою кілець, що має атом N в основі місточкового зв'язку і необов'язково містить 1, 2 або 3 додаткових гетероатоми, вибраних з Ν, Ο або S; R2 є Н, галогеном або С1-С6-алкілом, С1-С6-алкокси, С3-С7-циклоалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений; R3 і R4 кожний незалежно є Η або необов'язково заміщеним С1-С6-алкілом; R5 і R6 кожний незалежно є Η або С1-С6-алкілом, С2-С6-алкенілом, С2-С6-алкінілом, С3-С7-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений, або R5 і R6 разом з атомом, до якого вони приєднані, утворюють необов'язково заміщене 5-8-членне кільце, що необов'язково містить додатковий гетероатом, вибраний з О, NR11 або SOm; R7, R8, R9 і R10 незалежно є Н, галогеном, CN, OCO2R12, CO2R13, CONR14R15, SOpR16, NR17R18, OR19, COR20 або С1-С6-алкілом, С2-С6-алкенілом, С2-С6-алкінілом, С3-С7-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений; R11, R12, R13, R16, R19 i R20 кожний незалежно є Η або С1-С6-алкілом, С2-С6-алкенілом, С2-С6-алкінілом, С3-С6-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений; R14 і R15 кожний незалежно є Η або необов'язково заміщеним С 1-С6-алкілом, або R14 і R15 разом з атомом, до якого вони приєднані, можуть утворювати 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний з О, NR22 або S; R17 і R18 кожний незалежно є Η або необов'язково заміщеним С 1-С4-алкілом, або R17 і R18 разом з атомом, до якого вони приєднані, можуть утворювати 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний з О, NR21 або SOx; R21 і R22 кожний незалежно є Η або С1-С6-алкілом, С2-С6-алкеншом, С3-С7-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений; і m, p і x кожний незалежно дорівнює 0 або цілому числу 1 або 2; або її стереоізомеру або її фармацевтично прийнятної солі. Даний винахід також представляє способи і композиції, що застосовуються для терапевтичного лікування розладів центральної нервової системи, пов'язаних з або що знаходяться під впливом рецептора 5-ГТ6. Рецептор 5-гідрокситриптамін-6 (5-ГТ6) є одним з рецепторів, недавно ідентифікованих молекулярним клонуванням. Його здатність зв'язувати широкий спектр терапевтичних сполук, що застосовуються в психіатрії, в поєднанні з його цікавим розподілом в мозку, обумовлює значний інтерес до нових сполук, які здатні взаємодіяти з або впливати на даний рецептор. Були зроблені значні зусилля для того, щоб зрозуміти можливу роль рецептора 5-ГТ6 в психіатрії, дисфункції пізнавальної здатності, моторних функціях і контролі, пам'яті, настрої і подібних. До теперішнього часу сполуки, які демонструють афінність зв'язування з рецептором 5-ГТ6, вважаються корисними як допоміжний засіб для вивчення рецептора 5ГТ6, так і як потенційні терапевтичні агенти при лікуванні розладів центральної нервової системи, наприклад, [див. С. Reavill and D.C. Rogers, Current Opinion in Investigational Drugs; 2001, 2(1): 104-109, Pharma Press Ltd.]. Несподівано було виявлено, що похідні 1-(аміноалкіл)-3-сульфонілазаіндолу формули І демонструють афінність до 5-ГТ6. Переважно такі похідні азаіндолу можуть застосовуватися як ефективні терапевтичні агенти для лікування розладів центральної нервової системи (ЦНС), пов'язані з або що знаходяться під впливом рецептора 5-ГТ6. Отже, даний винахід відноситься до похідних 1-(аміноалкіл)-3-сульфонілазаіндолу формули І дe W є N або CR7; X є N або CR8; Υ є N або CR9; Ζ є N або CR10 за умови, що, принаймні, один, і не більш двох з W, Χ, Υ і Ζ повинні бути Ν; n є цілим числом 2, 3, 4 або 5; R1 є необов'язково заміщеним С1-С6-алкілом, С3-С7-циклоалкілом, арилом або гетероарилом, або необов'язково заміщеним 8-13-членною біциклічною або трициклічною системою кілець, що має атом N в основі місточкового зв'язку і необов'язково містить 1, 2 або 3 додаткових гетероатоми, вибраних з Ν, Ο або S; R2 є Н, галогеном або С1-С6-алкілом, С1-С6-алкокси, С3-С7-циклоалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений; R3 і R4 кожний незалежно є Η або необов'язково заміщеним СгС6-алкілом; R5 і R6 кожний незалежно є Η або С1-С6-алкілом, С2-С6-алкенілом, С2-С6-алкінілом, С3-С7-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений, або R5 і R6 разом з атомом, до якого вони приєднані, утворюють необов'язково заміщене 5-8-членне кільце, що необов'язково містить додатковий гетероатом, вибраний з О, NR11 або SOm; R7, R8, R9 і R10 незалежно є Η, галогеном, CN, OCO2R12, CO2R13, CONR14R15, SOpR16, NR17R18, OR19, COR20 або С1-С6-алкілом, С2-С6-алкенілом, С2-С6-алкінілом, С3-С7-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений; R11, R12, R13, R16, R19 і R20 кожний незалежно є Н або С1-С6-алкілом, С2-Сб-алкенілом, С2-С6-алкінілом, С3-Сб-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений; R14 і R15 кожний незалежно є Η або необов'язково заміщеним С 1-С6-алкілом, або R14 і R15 разом з атомом, до якого вони приєднані, можуть утворювати 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний з О, NR22 або S; R17 і R18 кожний незалежно є Η або необов'язково заміщеним С 1-С4-алкілом, або R17 і R18 разом з атомом, до якого вони приєднані, можуть утворювати 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний з О, NR21 або SOX; R21 і R22 кожний незалежно є Η або С1-С6-алкілом, С2-С6-алкенілом, С3-С7-циклоалкілом, циклогетероалкілом, арилом або гетероарилом, кожний з яких необов'язково заміщений; і m, p і x кожний незалежно дорівнює 0 або цілому числу 1 або 2; або їх стереоізомерів або їх фармацевтично прийнятних солей. У даному описі і формулі винаходу термін галоген означає F, СІ, Вr або І, і термін циклогетероалкіл означає 5-7-членну систему кілець, що містить 1 або 2 гетероатоми, які можуть бути однаковими або різними, вибраних з азоту, кисню і сірки, і необов'язково містить один подвійний зв'язок. Приклади циклогетероалкільної системи кілець, що входить в представлений тут термін, включають такі кільця, в яких Х1 є NR, О або S; і R є Η або необов'язковим замісником, таким як описано нижче: Термін гетероарил, що застосовується в описі і в формулі винаходу, означає 5-10-членну ароматичну систему кілець, що містить 1, 2 або 3 гетероатоми, які можуть бути однаковими або різними, вибраних з Ν, Ο або S. Такі гетероарильні системи кілець включають піроліл, азоліл, оксазоліл, тіазоліл, імідазоліл, фурил, тієніл, хінолініл, ізохінолініл, індолініл, бензотієніл, бензофураніл, бензізоксазоліл або подібні. Термін арил означає карбоциклічну ароматичну систему кілець, наприклад таку, що має 6-14 атомів вуглецю, таку як феніл, нафтил, антраценіл і подібні. Термін галогеналкіл в даному описі означає групу СnН2n+1, що має від одного до 2п+1 атомів галогену, які можуть бути однаковими або різними, і термін галогеналкокси в даному описі означає групу ОСnН2n+1, що має від одного до 2n+1 атомів галогену, які можуть бути однаковими або різними. Приклади 8-13-членних біциклічних або трициклічних систем кілець, що мають атом N в основі місточкового зв'язку і необов'язково містять 1, 2 або 3 додаткових гетероатоми, вибраних з Ν, Ο або S, охоплені терміном, що застосовується в даному описі, включають представлені нижче кільцеві системи, в яких W 2 є NR, О або S; і R є Η або необов'язковим замісником, таким як показано нижче: В описі і формулі винаходу, де терміни, такі як С1-С6-алкіл, С2-С6-алкеніл, С2-С3-алкініл, С3-С6циклоалкіл, циклогетероалкїл, арил або гетероарил, вказані як необов'язково заміщені, групи замісників, які необов'язково присутні, можуть бути в кількості однієї або більше, наприклад, 2 або 3, і являють собою групи, що звичайно застосовуються в фармацевтичних сполуках або модифікаціях таких сполук для того, щоб вплинути на їх структуру/активність, стійкість, абсорбцію, стабільність або інші корисні властивості. Певні приклади таких замісників включають атоми галогену, нітро, ціано, гідроксил, алкіл, галогеналкіл, алкокси, галогеналкокси, аміно, алкіламіно, діалкіламіно, форміл, алкоксикарбоніл, карбоксил, алканоїл, алкілтіо, алкілсульфініл, алкіл сульфоніл, карбамоїл, алкіламідо, феніл, фенокси, бензил, бензилокси, гетероцикліл (такий як гетероарил або циклогетероалкїл) або циклоалкіл, переважно, атоми галогену або нижчі алкільні групи. Звичайно присутні від 0 до 3 замісників. Якщо будь-який з вказаних вище замісників являє собою або містить алкільний замісник у вигляді групи або частини групи, він може бути лінійним або розгалуженим і може містити аж до 12, переважно аж до 6, більш переважно аж до 4 атомів вуглецю. Фармацевтично прийнятною сіллю може бути будь-яка кислотно-адитивна сіль, утворена із сполуки формули І і фармацевтично прийнятної кислоти, такої як фосфорна, сірчана, хлористоводнева, бромистоводнева, лимонна, малеїнова, малонова, мигдалева, янтарна, фумарова, оцтова, молочна, азотна, сульфонова, п-толуолсульфонова, метансульфонова кислота або подібні. Сполуки відповідно до даного винаходу включають складні ефіри, карбамати або інші звичайні форми проліків, які, загалом, є функціональними похідними сполук відповідно до даного винаходу і які легко перетворюються в активну групу даного винаходу in vivo. Відповідно, спосіб відповідно до даного винаходу включає лікування різних станів, описаних вище, сполукою формули І або сполукою, яка не описана конкретно, але яка, при введенні, перетворюється в сполуку формули І in vivo. Також в об'єм включені метаболіти сполук відповідно до даного винаходу, визначені як активні сполуки, отримані при введенні вказаних сполук в біологічну систему. Сполуки відповідно до даного винаходу можуть існувати у виглйді одного або більше стереоізомерів. Різні стереоізомери включають енантіомери, діастереомери, атропізомери і геометричні ізомери. Фахівцеві в даній галузі буде зрозуміло, що один стереоізомер може бути більш активним або може володіти сприятливою дією, будучи збагаченим по відношенню до іншого(их) стереоізомеру(ів) або при відділенні від іншого(их) стереоізомеру(ів). Крім того, фахівцеві в даній галузі відомо, як відділяти, збагачувати або селективно отримувати вказані стереоізомери. Отже, даний винахід включає сполуки формули І, їх стереоізомери і їх фармацевтично прийнятні солі. Сполуки відповідно до даного винаходу можуть бути у вигляді суміші стереоізомерів, окремих стереоізомерів або у вигляді оптично активної або енантіомерно чистої форми. Переважними сполуками відповідно до даного винаходу є сполуки формули І, в яких W або Ζ є N. Також переважними є сполуки формули І, в яких n дорівнює 2. Інша група переважних сполук формули І включає сполуки, в яких R1 є необов'язково заміщеним фенілом, нафтилом або імідазотіазолілом. Більш переважними сполуками відповідно до даного винаходу є сполуки формули І, в яких W є CR7; X є CR8; Υ є CR9; і Ζ є N. Інша група більш переважних сполук включає сполуки формули І, в яких W є Ν; X є CR8; Υ є CR9; і Ζ є CR10. Більш переважні сполуки формули І також включають сполуки, в яких η дорівнює 2 і R3 і R4 є Н. Також більш переважними сполуками є ті сполуки формули І, в яких W або Ζ є Ν; n дорівнює 2; R1 є необов'язково заміщеним фенілом, нафтилом або імідазотіазолілом; R2, R3 і R, є Н; і R5 і R6 кожний незалежно є Η або С1-С3-алкілом. Приклади переважних сполук відповідно до даного винаходу включають: 2-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етиламін; 2-[3-(фенілсульфоніл)-1Н-піроло[2,3-с]піридин-1-іл]етиламін; 2-[3-(фенілсульфоніл)-1Н-піроло[3,2-с]піридин-1-іл]етиламін; 2-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}етиламін; 2-{3-[(4-метилфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етиламін; 2-[3-(нафт-1-ил)сульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етиламін; 2-{3-[(6-хлорімідазо[2,1-b][1,3]тіазол-5-іл)сульфоніл]-1Н-піроло[2,3-]піридин-1-іл}етиламін; 2-{3-[(3-хлорфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етиламін; 2-{3-[(2-хлорфеніл)сульфоніл]-1Н-піроло[2,3-с]піридин-1-іл}етиламін; 2-{3-[(3-метоксифеніл)сульфоніл]-1Н-піроло[3,2-с]піридин-1-іл}етиламін; 2-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}етиламін; N,N-диметил-N-(2-{3-[(3-фторфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)амін; N,N-диметил-N-{2-[3-(нафт-1-илсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етил}амін; N,N-диметил-N-(2-{3-[(6-хлорімідазо[1,2-b][1,3]тіазол-5-іл)сульфоніл]-1Н-піроло[2,3-b]піридин-1іл}етил)амін; N,N-диметил-N-(2-{3-[(3-хлорфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)амін; 3-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]пропан-1-амін; 3-[3-(фенілсульфоніл)-1Н-піроло[2,3-с]піридин-1-іл]пропан-1-амін; 3-[3-(фенілсульфоніл)-1Н-піроло[3,2-с]піридин-1-іл]пропан-1-амін; 3-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}пропан-1-амін; 2-{6-хлор-3-[(3-хлорфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етиламін; 2-{7-хлор-3-[(2-хлорфеніл)сульфоніл]-1Н-піроло[2,3-с]піридин-1-іл}етиламін; 4-{3-[(3-метоксифеніл)сульфоніл]-1Н-піроло[3,2-с]піридин-1-іл}бутан-1-амін; 4-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}бутан-1-амін; N,N-диметил-N-{2-[3-(фенілсульфоніл)-1Н-піроло[2,3-с]піридин-1-іл]етил}амін; N,N-диметил-N-{2-[3-(фенілсульфоніл)-1Н-піроло[3,2-с]піридин-1-іл]етил}амін; N,N-диметил-N-{2-[3-(тіан-2-іл)-1Н-піроло[2,3-b]піридин-1-іл]етил}амін; N,N-диметил-N-{2-[3-(нафт-1-ил)-1Н-піроло[2,3-b]піридин-1-іл]етил}амін; N,N-диметил-N-(2-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}етил)амін; N-метил-N-(2-{3-[(3-хлорфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)амін; N-метил-N-(2-{3-[(3-фторфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)амін; N-метил-N-{2-[3-(нафт-1-илсульфоіїіл)-1Н-піроло[2,3-b]піридин-1-іл]етил}амін; N-метил-N-(2-{3-[(6-хлорімідазо[1,2-b][1,3]тіазол-5-іл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)амін; N-метил-N-(2-{3-[(2-хлорфеніл)сульфоніл]-1Н-піроло[3,2-с]піридин-1-іл}етил)амін; N-метил-N-(2-{3-[(3-метоксифеніл)сульфоніл]-1Н-піроло[2,3-с]піридин-1-іл}етил)амін; N-бензил-N-(2-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}етил)амін; N,N-дибензил-3-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]пропан-1-амін; 3-[3-(фенілсульфоніл)-1Н-піроло[2,3-с]піридин-1-іл]пропан-1-амін; 3-[3-(фенілсульфоніл)-1Н-піроло[3,2-с]піридин-1-іл]пропан-1-амін; їх стереоізомери і фармацевтично прийнятні солі. Даний винахід також представляє способи отримання сполук формули І, таких як визначені вище, або їх стереоізомерів або їх фармацевтично прийнятних солей, де способи включають один з наступних: a) взаємодію сполуки формули II де W, Χ, Υ, Ζ, R1 і R2 такі, як описані вище, з галогеналкіламіном формули III де Hal є СІ, Вr або І і R3, R4, R5, R6 і n такі, як описано вище, в присутності основи з отриманням сполуки формули І; або b) взаємодію сполуки формули (V) де W, X, Υ, Ζ, R1, R3, R4 і n такі, як описані вище, і Hal є галогеном, із сполукою формули HNR5R6, де R5 і R6 такі, як описано вище, з отриманням сполуки формули І; або c) сульфонілювання сполуки формули XVI: де W, X, Y, Z, R3, R4, R5, R6 і n такі, як описані вище, із сполукою формули: CISO2R1 де R1 такий, як визначено вище, з отриманням сполуки формули І; або d) відновлення сполуки формули XX: де W, X, Y, Z, R1, R3, R4 і n такі, як описані вище, з отриманням відповідної сполуки формули І, в якій R5 і R6, обидва є воднем; або e) взаємодію сполуки формули де W, X, У, Ζ, R1, R2, R3, R4, n і m є такими, як описані вище, з гідразином з отриманням відповідної сполуки формули І, в якій R5 і R6, обидва є воднем; або f) перетворення основної сполуки формули І в фармацевтично прийнятну сіль або навпаки. Сполуки відповідно до даного винаходу звичайно отримують способами, ілюстрованими на представлених нижче схемах, в яких Hal є СІ, Вr або І. Основи, придатні для застосування в способі відповідно до даного винаходу, включають сильні основи, такі як NaH, KOt-Bu, NaOH або будь-які прийнятні основи, здатні видаляти протон від основного атома азоту азаіндолу. Розчинники, придатні для застосування в способі відповідно до даного винаходу, включають полярні розчинники, такі як диметилформамід, диметилсульфоксид, ацетонітрил, тетрагідрофуран або подібні. Якщо застосовують два незмішувані розчинники, може бути присутнім міжфазний каталізатор. Переважно, для отримання сполук формули І, в яких R5 і R6 є Н, сполука формули II може бути піддана взаємодії з основою, як описано вище, в присутності міжфазного каталізатора, такого як гідросульфат тетрабутиламонію, з отриманням бажаної сполуки формули І, в якій R5 і R6 є Н. Альтернативно, сполуки формули І, в яких R5 і R6 є Η (Іа), можуть бути отримані взаємодією сполуки формули II із сполукою дигалогеналкілу формули IV з отриманням 1-(галогеналкіл)азаіндолу формули V; взаємодією азаіндолу формули V з фталімідом калію з отриманням проміжної сполуки формули VI, і взаємодією вказаної проміжної сполуки з гідразином з отриманням бажаної сполуки формули Іа. Послідовність реакції показана на схемі II, де Hal є СІ, Вr або І. Сполуки формули V також можуть бути піддані безпосередньо взаємодії з аміном, HNR5R6, з отриманням сполуки формули І. Сполуки формули II можуть бути отримані із застосуванням звичайних методів синтезу і, якщо необхідно, стандартного розділення і виділення. Наприклад, сполука нітропіридину формули VII може бути піддана взаємодії із сполукою хлорметилсульфонілу формули VIII в присутності сильної основи з отриманням проміжної сполуки формули IX; вказана проміжна сполука формули IX потім може бути оброблена відновлювальним агентом, таким як Fe, Zn або Sn в присутності кислоти з отриманням аміну формули X; потім вказаний амін може бути ацильований відповідним складним ортоефіром формули XI з отриманням сполуки формули XII; і вказана сполука може бути циклізована в присутності основи з отриманням бажаного 3-сульфонілазаіндолу формули II. Загальний метод синтезу описаний у [W. Wojciechowski and M. Makosza, Synthesis, 1986, 651-653]. Послідовність реакції показана на схемі III. Сполуки формули II також можуть бути отримані безпосередньо із сполуки азаіндолу, наприклад, азаіндол формули XIII може бути підданий взаємодії з йодом, необов'язково в присутності КІ, з отриманням відповідного 3-йодазаіндолу формули XIV, і вказаний 3-йодазаіндол може бути поєднаний з відповідним тіолом формули XV з отриманням 3-тіоазаінцолу формули XVI. Вказана сполука формули XVI потім може бути окислена із застосуванням звичайних окислювальних реагентів, таких як Н2О2, м-хлорпербензойна кислота або подібні з отриманням проміжної сполуки формули II. Реакція показана на схемі IV. Альтернативно, проміжна сполука 3-тіоазаіндолу формули XVI може бути отримана в одну стадію з азаіндолу формули XIII взаємодією вказаної сполуки формули XIII з тіолом формули XV в присутності йоду, переважно в полярному розчиннику, такому як водний спирт. Отримані таким чином сполуки формули II потім можуть бути перетворені в бажані сполуки формули І алкілуванням атома азоту основного азаіндолу, як показано на схемах І і II вище. Сполуки формули XIII також можуть бути перетворені в бажані сполуки формули І, в яких R5 і R6 відмінні від Η (Іа), взаємодією азаіндолу формули XIII з аміном формули lllа, в якому R5 і R6 відмінні від Н, з отриманням N-алкілованої сполуки формули XVII; взаємодією сполуки формули XVII з сульфонілхлоридом формули XVIII, необов'язково в присутності реагенту, такого як Ag(OSO2CF3) або Bi(OSO2CF3)3, з отриманням бажаної сполуки формули Іа. Також сполуки І, в яких R5 і R6 є Η (Ib), можуть бути отримані безпосередньо з проміжної сполуки формули XIII взаємодією вказаної проміжної сполуки формули XIII з нітрилом формули XIX з отриманням відповідної алкілованої сполуки формули XX; сульфонуванням вказаної сполуки формули XX з отриманням сполуки формули XXI; і відновленням сполуки формули XXI із застосуванням звичайних відновлювальних агентів, таких як боран, в тетрагідрофурані (ТГФ) з отриманням бажаних сполук формули Іb. Реакції показані на схемі V, де Hal є СІ, Вr або І. Переважно, сполуки формули І відповідно до даного винаходу застосовують для лікування розладів ЦНС, пов'язаних або що знаходяться під впливом рецептора 5-ГТ6, включаючи розлади моторики, настрою, особистості, поведінки, психіатричні, когнітивні, нейродегенеративні або подібні, наприклад, хвороба Альцгеймера, хвороба Паркінсона, розлад дефіциту уваги, тривогу, епілепсію, депресію, обсесивнокомпульсивний розлад, порушення сну, нейродегенеративні розлади (такі як травма або удар), розлади харчування (такі як анорексія або булімія), шизофренію, втрату пам'яті, розлади, пов'язані з відміною лікарських засобів або нікотинової залежності, або подібних, або деяких шлунково-кишкових розладів, таких як синдром подразненого кишечнику. Отже, даний винахід представляє спосіб лікування розладу центральної нервової системи, пов'язаного або такого, що знаходиться під впливом рецептора 5-ГТ6 у пацієнта, потребуючого такого лікування, який включає введення вказаному пацієнту терапевтично ефективної кількості сполуки формули І, такої як описано вище. Сполуки можуть вводитися пероральним або парентеральним шляхом або будь-яким звичайним шляхом, який забезпечує ефективне введення терапевтичного агента пацієнту, потребуючому цього. Термін «введення» в даному контексті, в значенні введення сполуки або речовини відповідно до даного винаходу, означає або введення безпосередньо такої сполуки або речовини, або введення проліків, похідного або аналога, який дає еквівалентну кількість сполуки або речовини в організмі. Терапевтично ефективна кількість, що застосовується для лікування певного розладу ЦНС, може варіюватися в залежності від певних умов стану, що лікується,розміру, віку і реакції пацієнта, тяжкості розладу, свідчення лікуючого терапевта і подібних. Загалом, ефективні кількості для щоденного перорального введення складають від близько 0,01 до 1000мг/кг, переважно від близько 0,5 до 500мг/кг, і ефективна кількість для парентерального введення складає від близько 0,1 до 100мг/кг, переважно від 0,5 до 50мг/кг. На практиці, сполуки відповідно до даного винаходу дають шляхом введення сполуки або її попередника в твердій або рідкій формі, або в чистому вигляді, або в комбінації з одним або більше звичайними фармацевтичними носіями або наповнювачами. Отже, даний винахід представляє фармацевтичну композицію, яка містить фармацевтично прийнятний носій і ефективну кількість сполуки формули І, такої як описано вище. Тверді носії, придатні для застосування в композиціях відповідно до даного винаходу, включають одну або більше речовин, які також можуть діяти як смакові агенти, лубриканти, солюбілізатори, суспендуючі агенти, наповнювачі, гліданти, допоміжні для пресування агенти, зв'язуючі агенти, агенти для дезінтеграції таблеток або інкапсулюючі матеріали. У порошках носій може являти собою тонкоподрібнену тверду речовину в суміші з тонкоподрібненою сполукою формули І. В таблетках сполука формули І може бути змішана з носієм, що має необхідні властивості для пресування, у відповідних пропорціях і мати бажану форму і розмір. Вказані порошки і таблетки можуть містити аж до 99мас.% сполуки формули І. Тверді носії, придатні для застосування в композиціях відповідно до даного винаходу, включають фосфат кальцію, стеарат магнію, тальк, цукор, лактозу, декстрин, крохмаль, желатин, целюлозу, метилцелюлозу, натрійкарбоксиметилцелюлозу, полівінілпіролідон, віск з низькою температурою плавлення і іонообмінні смоли. У композиціях відповідно до даного винаходу можуть застосовуватися будь-які фармацевтично прийнятні рідкі носії, придатні для отримання розчинів, суспензій, емульсій, сиропів і еліксирів. Сполуки формули І можуть бути розчинені або суспендовані в фармацевтично прийнятному рідкому носії, такому як вода, органічний розчинник або фармацевтично прийнятна олія або жир, або їх суміші. Вказані рідкі композиції можуть містити інші фармацевтично прийнятні домішки, такі як солюбілізатори, емульгатори, буфери, консерванти, підсолоджувачі, смакові агенти, суспендуючі агенти, загусники, барвники, регулятори в'язкості, стабілізатори, осмотичні регулятори або подібні. Приклади рідких носіїв, придатних для перорального і парентерального введення, включають воду (таку, що особливо містить домішки, такі як вказані вище, наприклад, похідні целюлози, переважно, розчин натрійкарбоксиметилцелюлози), спирти (включаючи одноатомні спирти і багатоатомні спирти, наприклад, гліколі) або їх похідні, або олії (наприклад, фракціоновану кокосову олію і арахісову олію). Для парентерального введення носій також може бути складним ефіром жирних кислот, таким як етилолеат або ізопропілміристат. Композиції відповідно до даного винаходу, які являють собою стерильні розчини або суспензії, застосовують для внутрішньом'язового, внутрішньочеревинного або підшкірного ведення. Стерильні розчини також можуть вводитися внутрішньовенно. Композиції відповідно до даного винаходу, придатні для перорального застосування, можуть бути як в рідкій, так і в твердій формі. Для більш ясного розуміння і для ілюстрації даного винаходу нижче представлені конкретні приклади. Представлені нижче приклади є тільки ілюстративними і не повинні розумітися як такі, що обмежують об'єм і основоположні принципи даного винаходу жодним чином. Термін Н-ЯМР означає протонний ядерний магнітний резонанс. Терміни СН2Сl2 і ДМФ означають метиленхлорид і диметилформамід, відповідно. Хроматографію проводять із застосуванням SiO2 як підкладки. Приклад 1 Отримання 3-(фенілтіо)-1Н-піроло[2,3-b]піридину Розчин метилфенілсульфоксиду (8,33г, 59,4ммоль) в СН2Сl2 охолоджують до температури -78°С і по краплях обробляють трифтороцтовим ангідридом (4,1мл, 5,3ммоль). Після перемішування протягом 30 хвилин при температурі -78°С додають розчин 7-азаіндолу (5,2г, 44,0ммоль) в СН2Сl2. Через 30 хвилин при температурі -78°С додають триетиламін (74мл, 534ммоль), і реакційну суміш нагрівають до температури навколишнього середовища. Після перемішування протягом 3,5 днів реакційну суміш концентрують у вакуумі, обробляють насиченим водним NaHCO3 і екстрагують СН2Сl2. Органічні екстракти об'єднують і концентрують у вакуумі. Отриманий залишок кристалізують з метанолу/Н2О і перекристалізовують з СН2Сl2/гексану з отриманням вказаної в заголовку сполуки у вигляді білуватої твердої речовини, 1,26г, т.пл. 188-189°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 2 Отримання 3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридину Розчин 3-(фенілтіо)-1Н-піроло[2,3-b]піридин (100мг, 0,44ммоль) в трет-бутиловому спирті обробляють MnSO4·H2O (4мг, 0,020ммоль) і охолоджують до температури 0°С. Суміш 30% водного перекису водню (500мг, 4,41ммоль) і 0,2н. водного NaHCO3 (7,5мл) додають по краплях. Реакційну суміш перемішують протягом 23 годин при температурі 20°С, розбавляють насиченим водним NaHCO3 і екстрагують етилацетатом. Об'єднані екстракти сушать над MgSO4 і концентрують у вакуумі. Хроматографія (1:50 метанол/СН2Сl2) отриманого залишку, дає твердий продукт, який перекристалізовують з СН2Сl2/гексану з отриманням вказаної в заголовку сполуки у вигляді рожево-білої твердої речовини, 50мг, т.пл. >250°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 3 Отримання 1-(2-хлоретил)-3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридину Розчин 3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридину (4,30г, 16,6ммоль) в 1,2-дихлоретані (33мл, 420ммоль) обробляють AliquatÒ (хлорид трикаприлметиламонію, виробляється в Aldrich, Milwaukee, WI) (6,9г) і 50% водним NaOH (1,6г, 20ммоль). Реакційну суміш перемішують протягом 6 годин при температурі 45°С. Охолоджений розчин розбавляють Н2О (200мл) і екстрагують СН2Сl2 (3´250мл). Об'єднані екстракти СН2Сl2 сушать над MgSO4 і концентрують у вакуумі до коричневої смоли. Цю смолу піддають хроматографії (1:4 етилацетат/гексан) і потім кристалізують з етилацетату/гексану з отриманням вказаної в заголовку сполуки у вигляді білої твердої речовини, 3,84г, т.пл. 117-119°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 4 Отримання 2-{2-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етил}-1Н-ізоіндол-1,3(2Н)-діону Розчин 1-(2-хлоретил)-3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридину (3,84г, 12,0ммоль) в ДМФ обробляють фталатом калію (2,78г, 15,0ммоль), нагрівають при температурі 115°С протягом 16 годин, охолоджують до кімнатної температури, розбавляють водою і екстрагують етилацетатом. Об'єднані екстракти промивають насиченим розчином солі, сушать над MgSO4 і концентрують у вакуумі. Отриманий залишок кристалізують з СН2Сl2/гексану з отриманням вказаної в заголовку сполуки у вигляді білої твердої речовини, 4,54г, охарактеризованої аналізом Н-ЯМР. Приклад 5 Отримання дигідрохлориду 2-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етиламіну Розчин 2-{2-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етил}-1Н-ізоіндол-1,3(2Н)-діону (4,54г, 10,5ммоль) в діоксані обробляють безводним гідразином (8,3мл, 265ммоль), нагрівають при температурі 50°С протягом 3 годин, концентрують у вакуумі, розбавляють водою і екстрагують СН2Сl2. Об'єднані екстракти сушать над MgSO4 і концентрують у вакуумі з отриманням прозорого смолистого залишку. Хроматографія (1:9 метанол/СН2Сl2) залишку дає вільний амін вказаної в заголовку сполуки у вигляді прозорої смоли. Вільний амін розчиняють в етанолі, підкисляють 2н. водною НСl і концентрують у вакуумі. Кристалізація отриманого залишку з етанолу/простого ефіру дає вказану в заголовку сполуку у вигляді білої твердої речовини, 3,20г, т.пл. 195-197°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 6 Отримання гідрохлориду N,N-диметил-N-{2-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етил}аміну Розчин 3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридину (400мг, 1,55ммоль) в сухому ДМФ охолоджують до температури 0°С, обробляють гідридом натрію (60% в олії, 97мг, 2,43ммоль), перемішують протягом 3 годин при температурі 20°С, охолоджують до температури -20°С, обробляють гідрохлоридом 2(диметиламіно)етилхлориду (336мг, 2,33ммоль), перемішують при температурі 60°С протягом 16 годин, охолоджують до кімнатної температури, гасять водою і екстрагують етилацетатом. Органічні екстракти об'єднують, промивають насиченим розчином солі, сушать над MgSO4 і концентрують у вакуумі з отриманням вільного аміну вказаної в заголовку сполуки у вигляді жовтуватої смоли. Смолу розчиняють в етанолі, обробляють 1н. водної НСl і концентрують у вакуумі. Кристалізація отриманого залишку з етанолу/простого ефіру дає вказану в заголовку сполуку у вигляді світлої рудувато-коричневої твердої речовини, 111мг, т.пл. 214-217°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 7 Отримання дигідрохлориду 2-{3-[(4-метилфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етиламіну По методиці прикладів 1-6, і застосовуючи 7-азаіндол і метил п-толілсульфоксид як вихідні матеріали, отримують вказану в заголовку сполуку у вигляді білої твердої речовини, т.пл. 215-217°С, охарактеризованої масспектральним аналізом і аналізом Н-ЯМР. Приклад 8 Отримання 3-йод-1Н-піроло[2,3-b]піридину Розчин 7-азаіндолу (20,0г, 169ммоль) в етанолі обробляють йодом (57,9г, 228ммоль), йодидом калію (37,8г, 228ммоль) і 1н. водним NaOH (204мл, 204ммоль). Після перемішування протягом 4 годин при температурі 20°С реакційну суміш розбавляють водою і екстрагують етилацетатом. Органічні екстракти об'єднують і концентрують у вакуумі. Отриманий залишок кристалізують з метанолу/води з отриманням вказаної в заголовку сполуки у вигляді рожево-білої твердої речовини, 35,4г, т.пл. 201-204°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 9 Отримання 3-[(4-фторфеніл)тіо]-1Н-піроло[2,3-b]піридину Розчин 3-йод-1Н-піроло[2,3-b]піридину (4,0г, 16,4ммоль) в ДМФ обробляють 4-фторбензолтіолом (2,09мл, 19,7ммоль), карбонатом калію (3,40г, 24,6ммоль) і йодидом міді (4,21г, 22,1ммоль). Реакційну суміш нагрівають при температурі 65°С протягом 4 годин, охолоджують, розбавляють конц. водним NH4OH і екстрагують етилацетатом. Екстракти об'єднують, промивають насиченим розчином солі, сушать над MgSO4 і концентрують у вакуумі. Хроматографія (1:50 метанол/СН2Сl2) залишку з подальшою кристалізацією з метанолу/Н2О дає вказану в заголовку сполуку у вигляді білуватої твердої речовини, 3,56г, т.пл. 183-184°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 10 Отримання 3-[(4-фторфеніл)сульфонал]-1Н-піроло[2,3-b]піридину Розчин 3-[(4-фторфеніл)тіо]-1Н-піроло[2,3-b]піридину (3,36г, 13,8ммоль) в ацетоні обробляють розчином NaHCO3 (2,90г, 35,4ммоль) у воді. Реакційну суміш обробляють OxoneÒ (2KHSO5xKHSO4xK2SO4, виробництва DuPont, Wilmington, DE.) (25,5г, 41,4ммоль), перемішують протягом 3 годин при температурі 20°С, розбавляють водою, охолоджують на бані лід-вода і фільтрують. Фільтрувальний коржик промивають водою і сушать у вакуумі з отриманням вказаної в заголовку сполуки у вигляді білої твердої речовини, 1,73г, т.пл. 212-213°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 11 Отримання гідрохлориду 2-{3-[(4-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1-іл}етиламіну По методиці прикладів 3-5, застосовуючи 3-[(4-фторфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин як субстрат, отримують вказану в заголовку сполуку у вигляді білої твердої речовини, т.пл. 193-197°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 12 Отримання дигідрохлориду 2-(3-[(3-хлорфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етиламіну По вказаних вище методиках і із застосуванням 3-йод-1Н-піроло[2,3-b]піридин і 3-хлорбензолтіолу як вихідних матеріалів отримують вказану в заголовку сполуку у вигляді білої твердої речовини, т.пл. 203206°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклади 13-30 Отримання гідрохлориду N,N-диметил-N-(2-{3-[(заміщений феніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1іл}етил)аміну По методиках, вказаних в прикладах 4, 5 або 6, або застосовуючи метод, описаний в [J. Alvarez-Builla, et al., Synthetic Communications, (1991) 21(4) 535-544], і застосовуючи відповідний 3-(заміщений сульфоніл)1Н-піроло[2,3-b]піридин і бажаний галогеналкіламін, отримують продукти, показані в таблиці І і ідентифікують їх мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 31 Отримання N,N-диметил-N-[2-(1H-піроло[2,3-b]піридин-1-іл)етил]аміну Розчин 1Н-піроло[2,3-b]піридину (5,00г, 42,3ммоль), що перемішується, в ДМФ при температурі навколишнього середовища обробляють 95% гідридом натрію в олії (3,78г, 150ммоль). Після закінчення виділення газу реакційну суміш обробляють гідрохлоридом 2-(диметиламіно)етилхлориду (6,40г, 44,4ммоль), перемішують протягом 16 годин і концентрують у вакуумі. Отриманий залишок розподіляють між EtOAc і водою. Органічну фазу відділяють, сушать над MgSO4 і концентрують у вакуумі з отриманням вказаної в заголовку сполуки у вигляді олії, 6,50г (вихід 81%), що ідентифікується мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 32 Отримання дигідрохлориду N,N-диметил-N-(2-{3-[(3-фторфеніл)сульфонілі-1Н-піроло[2,3-b]піридин-1іл}етил)аміну Розчин, N,N-диметил-N-[2-(1Н-піроло[2,3-b]піридин-1-іл)етил]аміну (1,66г, 8,8ммоль), що перемішується, в нітробензолі обробляють 3-фторфенілсульфонілхлоридом (1,88г, 9,7ммоль) в атмосфері азоту з подальшою обробкою трифторметшісульфонатом срібла (2,94г, 11,4ммоль), нагрівають до температури 100°С протягом 22 годин, охолоджують і фільтрують через бавовняний фільтр. Фільтрат обробляють водою і насиченим водним NaHCO3 і екстрагують СН2Сl2. Екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі. Отриманий залишок піддають хроматографії, елююючи 2:98 концентрованим NH4ОН/етанолом, з отриманням вільного аміну вказаної в заголовку сполуки у вигляді в'язкої олії, яка твердіє (1,25г, 41%). Вільний амін розчиняють в теплому етанолі, обробляють 4Μ НСI в діоксані і фільтрують. Фільтрат сушать з отриманням вказаної в заголовку сполуки у вигляді блідо-жовтої твердої речовини, 1,07г (29% вихід), т.пл. 191-192°С, охарактеризованої масспектральним аналізом і аналізом Н-ЯМР. Приклади 33-56 Отримання похідних Ν-{[2-(3-арилсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етил}аміну По методиках, вказаних вище, і застосовуючи відповідний N1-заміщений 1Н-піроло[2,3-b]піридин і бажаний арилсульфонілхлорид, отримують продукти, показані в таблиці II, і ідентифікують їх масспектральним аналізом і аналізом Н-ЯМР. Приклад 57 Отримання метиламіну гідрохлориду N-(2-{3-[(3-хлорфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)-N Розчин N-(2-{3-[(3-хлорфеніл)сульфоніл]-1Н-піроло[2,3-b]піридин-1-іл}етил)-Ν,Ν-диметиламіну (0,540г, 1,49ммоль), що перемішується в атмосфері азоту, в 1,2-дихлоретані обробляють 1хлоретилхлорформіатом (0,40мл, 3,7ммоль), нагрівають до температури кипіння із зворотним холодильником протягом 2 годин, охолоджують і концентрують у вакуумі. Отриманий залишок обробляють етанолом, нагрівають при температурі кипіння із зворотним холодильником протягом 2 годин і концентрують у вакуумі. Отриманий залишок піддають хроматографії із застосуванням 2:98 концентрованого NH4OH/етанолу як елюенту, з отриманням вільного аміну вказаної в заголовку сполуки у вигляді напівтвердої речовини (311мг, 60%). Вільний амін розчиняють в етанолі, обробляють 4Μ НСl в діоксані і фільтрують. Фільтрат сушать з отриманням вказаної в заголовку сполуки у вигляді блідо-жовтої твердої речовини, 274мг (48% вихід), т.пл. 263-265°С (розкл.), охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклади 58-62 Отримання похідних N-{[2-(3-арилсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етил}аміну По методиках, вказаних вище, і застосовуючи відповідний Ν-(Ν,Ν-дизаміщений аміноалкіл)-1Нпіроло[2,3-b]піридин отримують продукти, показані в таблиці III, і ідентифікують їх мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 63 Отримання 1-(1Н-піроло[2,3-b]піридин-1-іл)ацетонітрилу Розчин 1Н-піроло [2,3-b] піридин (5,06г, 42,8ммоль), що перемішується, в ДМФ при температурі навколишнього середовища порціями обробляють 95% гідридом натрію (1,10г, 43,5ммоль). Після завершення виділення газу реакційну суміш обробляють бромацетонітрилом (3,00мл, 43,1ммоль), перемішують протягом 16 годин і концентрують у вакуумі. Отриманий залишок розподіляють між ЕtOАс і водою. Органічну фазу відділяють, сушать над MgSO4 і концентрують у вакуумі. Залишок піддають хроматографії, елююючи 1:3 ЕtOАс/гексаном з отриманням вказаної в заголовку сполуки у вигляді воскової твердої речовини, т.пл. 77-79°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 64 Отримання 1-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]ацетонітрилу Розчин 1-(1Н-піроло[2,3-b]піридин-1-іл)ацетонітрилу (0,68г, 4,33ммоль), що перемішується, в нітробензолі обробляють бензолсульфонілхлоридом (0,57мл, 4,4ммоль) і трифторметансульфонатом срібла (1,50г, 5,8ммоль), нагрівають при температурі 125°С протягом 16 годин, охолоджують і розділяють між насиченим водним NaHCO3 і СН2Сl2. Органічну фазу сушать над MgSO4 і концентрують у вакуумі. Отриманий залишок піддають хроматографії, елююючи спочатку 1:4 EtOAc/гексаном, потім 1:2 EtOАс/гексаном з отриманням вказаної в заголовку сполуки у вигляді рудувато-коричневої твердої речовини, 0,70г (54% вихід), т.пл. 140-142°С, охарактеризованої мас-спектральним аналізом і аналізом НЯМР. Приклад 65 Отримання 2-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]етиламіну Частину 1-[3-(фенілсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл] ацетонітрилу (0,30г, 1,00ммоль) обробляють 1,0Μ бораном в тетрагідрофурані (ТГФ) (4,0мл, 4,0ммоль) порціями по 0,5мл при температурі навколишнього середовища, перемішують протягом 16 годин, обробляють 2,0Μ НСl (15мл), нагрівають при температурі 100°С протягом 2 годин, охолоджують на крижаній бані, обробляють 2,5Μ водним NaOH і екстрагують простим ефіром. Екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі з отриманням вказаної в заголовку сполуки у вигляді олії, 0,180г (60°/о вихід), охарактеризованої масспектральним, аналізом і аналізом Н-ЯМР. Приклади 66-68 Отримання похідних [3-(арилсульфоніл)-1Н-піроло[2,3-b]піридин-1-іл]алкіл аміну По методиках, описаних в прикладах 64 і 65, і застосовуючи відповідний 3-арилсульфоніл-1Нпіроло[2,3-b]піридин-1-ацетонітрил, отримують сполуки, показані в таблиці IV, і ідентифікують їх масспектральним аналізом і аналізом Н-ЯМР. Приклад 69 Отримання 4-нітро-3-[(фенілсульфоніл)метил]піридин-N-оксиду Із застосуванням адаптованої методики [Makosza, et al., Liebigs Ann. Chem., 1984, 8-14], суміш 4нітропіридин-N-оксиду (1,40г, 10,0ммоль), що перемішується, і хлорметилфенілсульфону (1,92г, 10,0ммоль) в ДМСО (25мл) на холодній водяній бані обробляють розчином КОН (4,0г, 71ммоль) в ДМСО, перемішують протягом 45 хвилин, виливають в 1,0Μ хлористоводневу кислоту і воду і екстрагують СН2Сl2. Водну фазу фільтрують і фільтрувальний коржик сушать у вакуумі з отриманням вказаної в заголовку сполуки, 1,20г (вихід 41%). Органічні екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі. Отриману вологу тверду речовину нагрівають в киплячому етанолі/воді (4:1) і фільтрують. Фільтрат охолоджують, концентрують і фільтрують. Отриманий фільтрувальний коржик сушать у вакуумі з отриманням додаткової порції вказаної в заголовку сполуки, 0,967г (загальний вихід 74%), т.пл. 219-220°С, охарактеризованої масспектральним аналізом і аналізом Н-ЯМР. Приклад 70 Отримання 3-фенілсульфоніл-1Н-піроло[3,2-с]піридину Суміш 4-нітро-3-[(фенілсульфоніл)метил]піридин-N-оксиду (1,43г, 4,90ммоль) в метанолі нагрівають з форміатом амонію (1,54г, 24,5ммоль) і 10% паладієм на вугіллі (0,50г) при температурі 50°С протягом 24 годин, обробляють додатковою кількістю форміату амонію (0,63г, 10ммоль), нагрівають при температурі кипіння із зворотним холодильником протягом 30 годин, охолоджують і фільтрують. Фільтрат концентрують у вакуумі. Отриманий залишок суспендують в етанолі/воді і фільтрують для видалення залишкового каталізатора. Фільтрат концентрують, охолоджують і фільтрують. Фільтрувальний коржик сушать з отриманням рудувато-коричневої твердої речовини (0,60г). Цю тверду речовину (0,55г) змішують з триетилортоформіатом (1,84мл, 11,1ммоль), моногідратом пара-толуолсульфокислоти (рТsОН) (42мг, 0,22ммоль) і 1,2-дихлоретаном, нагрівають при температурі, кипіння із зворотним холодильником протягом 7 годин і концентрують у вакуумі. Отриманий залишок диспергують в тетрагідрофурані, обробляють 1,0Μ KO-t-Bu в тетрагідрофурані (3,1мл, 3,1ммоль), перемішують протягом 2 годин, обробляють насиченим водним NH4Cl і водою і екстрагують СН2Сl2. Екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі. Отриману оранжеву тверду речовину піддають хроматографії, елююючи спочатку ЕtOАс, потім 10:90 етанолом/EtOAc з отриманням вказаної в заголовку сполуки у вигляді білуватої твердої речовини, 330мг (58% вихід), т.пл. 261-263°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 71 Отримання дигідрохлориду N,N-диметил-N-{2-[3-(фенілсульфоніл)-1H-піроло[3,2-с]піридин-1іл]етил}аміну По методиці прикладу 6, застосовуючи 3-фенілсульфоніл-1Н-піроло[3,2-с]піридин, температуру навколишнього середовища як температуру реакції і час реакції 24 години, отримують вказану в заголовку сполуку у вигляді білуватої твердої речовини, т.пл. 255-257°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 72 Отримання 6-метокси-3-нітро-2-[(фенілсульфоніл)метил]-піридину 1Μ KOt-Bu розчин в тетрагідрофурані (50мл, 50ммоль) охолоджують до температури -40°С, порціями обробляють розчином хлорметилфенілсульфону (4,39г, 23,0ммоль) і потім розчином 2-метокси-5нітропіридину (3,55г, 23,0ммоль) в тетрагідрофурані, перемішують протягом 45 хвилин при температурі 40°С, обробляють крижаною оцтовою кислотою (3,0г, 50ммоль) і фільтрують. Фільтрувальний коржик сушать на повітрі з отриманням вказаної в заголовку сполуки у вигляді рудувато-коричневої твердої речовини, 5,70г (80% вихід), т.пл. 147-149°С, охарактеризованої мас-спектральним аналізом і аналізом НЯМР. Приклад 73 Отримання 3-аміно-6-метокси-2-[(фенілсульфоніл)метил]піридину До суміші 6-метокси-3-нітро-2-[(фенілсульфоніл)метил]піридин (6,17г, 20,0ммоль), що перемішується, в метанолі і конц. НСl (50мл) додають тонкі смужки олов'яної фольги (10,0г, 84,2ммоль), нагрівають при температурі 60°С протягом 20 годин і фільтрують гарячої. Фільтрат виливають на лід і 2,5н. водний NaOH, перемішують протягом 0,5 години і фільтрують. Фільтрувальний коржик сушать на повітрі з отриманням вказаної в заголовку сполуки у вигляді білої твердої речовини, вихід 5,26г (94%), охарактеризованої масспектральним аналізом і аналізом Н-ЯМР. Приклад 74 Складний етиловий ефір N-{6-метокси-[2-(фенілсульфоніл)метил]піридин-3-іл}формімідної кислоти Суміш 3-аміно-6-метокси-2-[(фенілсульфоніл)метил] піридину (2,40г, 8,62ммоль), що перемішується, в триетилортоформіаті (20мл) і моногідраті п-толуолсульфокяслоти (pTsOH) (0,15г, 0,788ммоль) нагрівають при температурі 155°С протягом 48 годин і концентрують у вакуумі. Отриманий залишок розбавляють гексаном і фільтрують з отриманням вказаної в заголовку сполуки у вигляді рудувато-коричневої речовини, 2,54г (88% вихід), охарактеризованої масспектральним аналізом і аналізом Н-ЯМР. Приклад 75 Отримання 5-метокси-3-фенілсульфоніл-1Н-піроло[3,2-b]піридину Розчин складного етилового ефіру, N-{6-метокси-[2-(фенілсульфоніл)метил]піридин-3-іл}формімідної кислоти (2,54г, 7,60ммоль), що перемішується, в ДМСО обробляють порошкоподібним KOt-Bu (4,59г, 38,0ммоль), перемішують при температурі навколишнього середовища протягом 4 годин, обробляють 10% водним NH4CI і екстрагують ЕtOАс. Екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі. Отриманий залишок перекристалізовують з ЕtOАс з отриманням вказаної в заголовку сполуки у вигляді рудувато-коричневої речовини, 0,42г (19% вихід), т.пл. 223-225°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 76 Отримання дигідрохлориду N,N-диметил-N-{2-[3-(фенілсульфоніл)-1H-піроло[3,2-b]піридин-1іл]етил}аміну Розчин 5-метокси-3-фенілсульфоніл-1Н-піроло[3,2-b] піридину (0,288г, 1,00ммоль), що перемішується, в сухому диметилформаміді обробляють 95% NaH (0,075г, 2,97ммоль), перемішують при температурі навколишнього середовища до припинення виділення газу, обробляють гідрохлоридом 2(диметиламіно)етилхлориду (0,200г, 1,39ммоль), перемішують протягом 16 годин при температурі 80°С, концентрують у вакуумі і розподіляють між водою і EtOAc. Органічну фазу сушать над MgSO4 і концентрують у вакуумі. Отриманий залишок піддають хроматографії, елююючи EtOAc, потім 1:9 CH3OH/EtOAc з отриманням напівтвердої речовини (0,216г, 60% вихід вільного аміну). Напівтверду речовину розчиняють в етанолі і обробляють 4н. НСl в діоксані і фільтрують. Фільтрувальний коржик сушать і розтирають з простим ефіром з отриманням вказаної в заголовку сполуки у вигляді білої твердої речовини, 0,19г, т.пл. 212-214°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклад 77 Отримання дигідрохлориду N,N-диметил-N-(2-(3-[(3-фторфеніл)сульфоніл]-1Н-піроло[3,2-b]піридин-1іл}етил)аміну По методиці прикладів 6, 8, 9 і 10, застосовуючи 1Н-піроло[3,2-b]піридин як вихідний матеріал, отримують вказану в заголовку сполуку у вигляді білої твердої речовини, т.пл. 163-165°С, охарактеризованої мас-спектральним аналізом і аналізом Н-ЯМР. Приклади 78-81 Отримання похідних N-{2-[3-(арилсульфоніл)-1Н-піроло[3,2-b]піридин-1-іл]етил}аміну По методиці прикладів 72-76, застосовуючи відповідні заміщені нітробензоли як вихідний матеріал і арилсульфонілхлорид і хлоретиламін, отримують сполуки, показані в таблиці V, охарактеризовані масспектральним аналізом і аналізом Н-ЯМР. Приклад 82 Порівняльна оцінка афінності зв'язування сполук, що тестуються, до 5-ГТ6 Афінність сполук, що тестуються, до рецептору серотоніну 5-ГТ6 оцінюють таким чином. Культивовані клітини Неlа, які експресують людські клоновані рецептори 5-ГТ6, збирають і центрифугують при низькій швидкості (1000´g) протягом 10 хвилин для видалення культурного середовища. Зібрані клітини суспендують в половині об'єму свіжого фізіологічного розчину з фосфатним буфером і повторно центрифугують при тій же швидкості. Операцію повторюють. Зібрані клітини потім гомогенізують в десяти об'ємах 50мМ Тріс·НСl (рН 7,4) і 0,5мМ ЕДТК. Гомогенат центрифугують при 40000´g протягом 30 хвилин і осад збирають. Отриманий осад після центрифугування повторно суспендують в 10 об'ємах Тріс·НСl буфера і повторно центрифугують при тій же швидкості. Кінцевий осад після центрифугування суспендують в невеликому об'ємі Тріс·НСІ буфера і вміст білка в тканині визначають в аліквотах об'ємом 10-25мкл. Альбумін бичачої сироватки застосовують як стандарт при визначенні білка по методу, описаному у [Lowry et al, J. Biol. Chem., 193:265 (1951)]. Об'єм суспендованих мембран клітин доводять до отримання концентрації білка в тканині 1,0мг/мл суспензії. Отриману суспензію мембран (концентровану в 10 раз) аліквотують в об'ємах 1,0мл і зберігають при температурі -70°С до застосування в подальших експериментах на зв'язування. Експерименти на зв'язування проводять в 96-ямкових титрувальних мікропланшетах загальним об'ємом 200мкл. У кожну ямку додають наступну суміш: 80,0мкл інкубаційного буфера, отриманого в 50мМ Тріс·НСl буфері (рН 7,4), що містить 10,0мМ MgCl2 і 0,5мМ ЕДТК і 20мкл [3Н]-ЛСД (S.A., 86,0Кі/ммоль, від Amersham Life Science), 3,0нМ. Константа дисоціації, Kd [3Н]-ЛСД для людського рецептора серотоніну 5-ГТ6 становить 2,9нМ, що визначається насиченням зв'язування при концентраціях [3 Н]-ЛСД, що збільшуються. Реакцію починають доданням 100,0мкл суспензії тканини. Неспецифічне зв'язування вимірюють в присутності 10,0мкМ метіотепіну. Сполуки, що тестуються, додають в об'ємі 20,0мкл. Реакцію проводять в темряві протягом 120 хвилин при кімнатній температурі, протягом чого пов'язаний комплекс ліганда-рецептора відфільтровують в 96-ямковий уніфільтр з харвестеромPackard FiltermateÒ 196. Пов'язаний комплекс, уловлений на фільтрувальному диску, сушать на повітрі і його радіоактивність вимірюють на Packard TopCountÒ, обладнаному шістьма датчиками фотопомножовуча, після додання 40,0мкл сцинтилянту MicroscintÒ-20 в кожний плоский осередок. Планшет з уніфільтром герметизують при нагріванні і зчитують на Packard TopCountÒ з ефективністю тритію 31,0%. Специфічне зв'язування з рецепторами 5-ГТ6 визначають як загальну зв'язану радіоактивність за мінусом зв'язування в присутності 10,0мкМ неміченого метіотепіну. Зв'язування в присутності різних концентрацій сполук, що тестуються, виражають в процентах специфічного зв'язування в порівнянні з відсутністю сполуки, що тестується. Результати наносять у вигляді логарифма % зв'язування по відношенню до логарифма концентрації сполуки, що тестується. Нелінійний регресійний аналіз даних проводять за допомогою програмного забезпечення PrismÒ з отриманням значень ІС50 і Ki сполук, що тестуються, з 95% достовірністю. Будують графік лінійної регресії даних, з якого визначають значення ІС50 і значення Ki визначають за допомогою наступного рівняння: Ki=IC50/(1+L/KD), де L є концентрацією радіоактивного ліганду, що застосовується, і KD є константою дисоціації ліганду для рецептора, виражені в нМ. У даному дослідженні визначають значення Ki і порівнюють їх зі значеннями, отриманими для порівняльних сполук, відомих зв'язуванням з рецептором 5-ГТ6. Дані показані в таблиці VI нижче. Таблиця VI Сполука, що тестується (приклад №) 5 6 7 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 65 66 67 68 76 77 78 79 Ki зв'язування 5-ГТ6 (нМ) 6 23 9 22 20 50 2 1 2 6 5 5 11 2 2 9 3 15 4 45 88 158 403 5 4 2 20 102 9 12 212 10 41 39 27 63 10 10 7 2 14 1 3 3 11 94 4 2 0,3 1 1 3 9 1 6 2 24 14 56 200 4 11 80 81 Порівняльні приклади Клозапін Локсапін Бромокріптин Метіотепін Міансерин Оланзепін 2 214 Ki зв'язування 5-ГТ6 (нМ) 6,0 41,4 23,0 8,3 44,2 19,5 Як можна бачити з показаних вище результатів, сполуки відповідно до даного винаходу демонструють значну афінність до рецептору 5-ГТ6.
ДивитисяДодаткова інформація
Назва патенту англійською1-(aminoalkyl)-3-sulfonylazaindoles as ligands of 5-hydroxytryptamine-6
Назва патенту російською1-(аминоалкил)-3-сульфонилазаиндолы в качестве лигандов 5-гидрокситриптамина-6
МПК / Мітки
МПК: A61P 25/28, C07D 471/04, A61K 31/437, C07D 519/00, A61P 25/00
Мітки: ліганди, 5-гідрокситриптамінів-6, 1-(аміноалкіл)-3-сульфонілазаіндоли
Код посилання
<a href="https://ua.patents.su/23-78999-1-aminoalkil-3-sulfonilazaindoli-yak-ligandi-5-gidroksitriptaminiv-6.html" target="_blank" rel="follow" title="База патентів України">1-(аміноалкіл)-3-сульфонілазаіндоли як ліганди 5-гідрокситриптамінів-6</a>
Попередній патент: Сенсорний пристрій
Наступний патент: Магнітний сепаратор
Випадковий патент: Спосіб вирощування бройлерів в селянських сімейних господарствах і кліткові ярусні батареї