Похідні індолілалкіламіну як ліганди 5-гідрокситриптаміну-6, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі
Номер патенту: 78536
Опубліковано: 10.04.2007
Автори: Коул Дерек Сесіл, Сток Джозеф Реймонд, Зоу Пінг, Леннокс Уільям Джозеф
Формула / Реферат
1. Сполука формули І
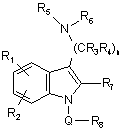 , (I)
, (I)
де
Q являє собою SO2, CO, CONR9 або CSNR10;
n являє собою ціле число, що дорівнює 2 або 3;
кожний r1 і r2 незалежно являє собою Н, галоген, CN, OCO2R12, CO2R13,
CONR14R15, CNR16NR17R18, SOmR19, NR20R21, OR22, COR23 або С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3-С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких є необов'язково заміщеною;
кожний R3 і R4 незалежно являє собою Н або необов'язково заміщену С1-С6алкільну групу;
кожний R5 і R6 незалежно являє собою Н або С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3-С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких є необов'язково заміщеною, або R5 і R6 можуть разом з атомом, до якого вони прикріплені, утворювати необов'язково заміщене 5-7-членне кільце, що необов'язково містить додатковий гетероатом, вибраний з О, N або S;
R7 являє собою Н, галоген або С1-С6алкільну, С1-С6алкокси, арильну або гетероарильну групу, кожна з яких є необов'язково заміщеною;
R8 являє собою необов'язково заміщену 8-13-членну біциклічну або трициклічну кільцеву систему, що має атом N в головній частині місточкового зв'язку і, необов'язково, містить 1, 2 або 3 додаткових гетероатоми, вибраних з N, O aбo S;
m дорівнює 0 або цілому числу, що дорівнює 1 або 2;
кожний R9 і R10 незалежно являє собою Н або С1-С6алкільну, арильну або гетероарильну групу, кожна з яких є необов'язково заміщеною;
кожний R12, R13, R19 і R23 незалежно являє собою Н або С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3-С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожна з яких є необов'язково заміщеною;
кожний R14, R15 і R22 незалежно являє собою Н або необов'язково заміщену C1-C6алкільну групу; і
кожний R16, R17, R18, R20 і R21 незалежно являє собою Н або необов'язково заміщену С1-С4алкільну групу; або R20 і R21 можуть разом з атомом, до якого вони прикріплені, утворювати 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний з О, N або S; або
її стереоізомери або її фармацевтично прийнятні солі.
2. Сполука за п. 1, де Q являє собою SO2.
3. Сполука за п. 1 або п. 2, де n дорівнює 2.
4. Сполука за будь-яким з пп.1-3, де R8 являє собою необов'язково заміщену імідазо[2,1-b][1,3]тіазолільну кільцеву систему.
5. Сполука за п. 4, де R8 являє собою 6-хлорімідазо[2,1-b][1,3]тіазол-5-іл.
6. Сполука за будь-яким з пп. 1-5, де R7 являє собою Н.
7. Сполука за будь-яким з пп. 1-6, де R3 і R4 являють собою Н.
8. Сполука за будь-яким з пп. 1-7, де R1 і R2 незалежно вибирають з водню, галогену, С1-С6алкілу, гідрокси, С1-С6алкілу, заміщеного фенілом, і С1-С6алкокси.
9. Сполука за будь-яким з пп. 1-8, де кожний R5 і R6 незалежно вибирають з водню, С1-С6алкілу і С1-С6алкілу, заміщеного фенілом, або R5 і R6 разом з атомом азоту являють собою кільце піролідинілу, піперазинілу або піперидинілу, необов'язково заміщене С1-С6алкілом або СООН.
10. Сполука за п.1, вибрана з групи, що складається з:
2-{1-[(6-хлорімідазо[2,1-b][1,3]тіазол-5-іл)сульфоніл]-1Н-індол-3-іл}етиламіну;
2-{1-[(імідазо[2,1-b][1,3]тіазол-5-іл)сульфоніл]-1Н-індол-3-іл}етиламіну;
{2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}метиламіну;
{2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}диметиламіну;
бензил-{2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил)аміну;
1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-3-(2-піролідин-1-ілетил)-1Н-індолу;
1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-3-[2-(4-метилпіперазин-1-іл)етил]-1Н-індолу;
1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-3-(2-піперидин-1-ілетил)-1Н-індолу;
бензил-{2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}метиламіну;
{2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}фенетиламіну;
1-{2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}піролідин-2-карбонової кислоти;
2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]-1-метилетиламіну;
(R)-2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]-1-метилетиламіну;
(S)-2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]-1-метилетиламіну;
2-[1-(2-хлорімідазо[1,2-а]піридин-3-сульфоніл)-1Н-індол-3-іл]етиламіну;
2-[1-(2,6-дихлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етиламіну;
2-[1-(2-хлорбензо[d]імідазо[2,1-b][1,3]тіазол-3-сульфоніл)-1Н-індол-3-іл]етиламіну;
{2-[1-(2-хлорімідазо[1,2-а]піридин-3-сульфоніл)-1Н-індол-3-іл]етил}метиламіну;
{2-[1-(2,6-дихлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}метиламіну;
{2-[1-(2-хлорбензо[b]імідазо[2,1-b][1,3]тіазол-3-сульфоніл)-1Н-індол-3-іл]етил}метиламіну;
{2-[1-(2-хлорімідазо[1,2-а]піридин-3-сульфоніл)-1Н-індол-3-іл]етил}диметиламіну;
{2-[1-(2,6-дихлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}диметиламіну;
{2-[1-(2-хлорбензо[b]імідазо[2,1-b][1,3]тіазол-3-сульфоніл)-1Н-індол-3-іл]етил}диметиламіну;
2-[5-хлор-1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етиламіну;
2-[5-хлор-1-(2-хлорімідазо[1,2-а]піридин-3-сульфоніл)-1Н-індол-3-іл]етиламіну;
2-[5-хлор-1-(2,6-дихлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етиламіну;
2-[5-хлор-1-(2-хлорбензо[b]імідазо[2,1-b][1,3]тіазол-3-сульфоніл)-1Н-індол-3-іл]етиламіну;
2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-5-метокси-1Н-індол-3-іл]етиламіну;
2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-6-метокси-1Н-індол-3-іл]етиламіну;
2-[5-бром-1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етиламіну;
2-[5-бензилокси-1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етиламіну;
2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-5-метил-1Н-індол-3-іл]етиламіну;
2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-6-метил-1Н-індол-3-іл]етиламіну;
2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-7-метил-1Н-індол-3-іл]етиламіну;
3-(2-аміноетил)-1-(6-хлор-імідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-5-олу;
2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-5-фтор-1Н-індол-3-іл]етиламіну;
2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-6-фтор-1Н-індол-3-іл]етиламіну;
їх стереоізомеров або їх фармацевтично прийнятних солей.
11. Спосіб лікування розладу центральної нервової системи, пов'язаного з рецептором 5-НТ6, або такого, що знаходиться під його впливом, у потребуючого лікування пацієнта, що включає введення вказаному пацієнту терапевтично ефективної кількості сполуки формули І за будь-яким з пп. 1-10 або її стереоізомерів, або її фармацевтично прийнятних солей.
12. Спосіб за п. 11, де вказаний розлад являє собою руховий розлад, розлад, пов'язаний з почуттям тривоги, або розлад пізнавальної функції.
13. Спосіб за п. 11, де вказаний розлад являє собою шизофренію або депресію.
14. Спосіб за п. 12, де вказаний розлад являє собою хворобу Альцгеймера або хворобу Паркінсона.
15. Спосіб за п. 12, де вказаний розлад являє собою розлад з дефіцитом уваги або нав'язливий компульсивний розлад.
16. Фармацевтична композиція, яка містить фармацевтично прийнятний носій і сполуку формули (І) за будь-яким з пп. 1-10 або її стереоізомери, або її фармацевтично прийнятні солі.
17. Спосіб отримання сполуки формули (І) за п. 1, який включає взаємодію сполуки формули В
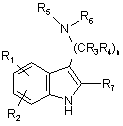 , (B)
, (B)
де n, R1, R2, R3, R4, R5, R6 і R7 визначені в п. 1, з відповідним сульфонілуючим, ацилуючим, карбамоїлуючим або тіокарбамоїлуючим агентом, що містить групу:
R8-Q-,
де R8 визначений в п. 1, a Q являє собою SO2, CO, CONR9 або CSNR10; причому вказані реагуючі сполуки, якщо потрібно, захищені на реактивних ділянках і/або на реактивних замісних групах, і видалення будь-яких захисних груп з отриманням відповідної сполуки формули (І); і, якщо необхідно, перетворення одержаної сполуки формули (І) в її кислотно-адитивну або лужно-адитивну сіль; і, якщо необхідно, виділення ізомеру сполуки формули (І) з суміші ізомерів.
18. Спосіб отримання сполуки формули Id
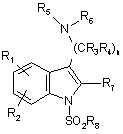 , (Id)
, (Id)
де Q являє собою SO2;
n являє собою ціле число, що дорівнює 2 або 3;
кожний R1 і R2 незалежно являє собою Н, галоген, CN, OCO2R12, CO2R13, CONR14R15, CNR16NR17R18, SOmR19, NR20R21, OR22, СОR23 або C1-C6алкільну, C2-C6алкенільну, C2-C6алкінільну, C3-C6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожну необов'язково заміщену;
кожний R3 і R4 незалежно являє собою Н або необов'язково заміщену C1-C6алкільну групу;
кожний R5 і R6 незалежно являє собою C1-C6алкільну, C2-C6алкенільну, C2-C6алкінільну, C3-C6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожну необов'язково заміщену, або R5 і R6 можуть разом з атомом, з яким вони сполучені, утворювати необов'язково заміщене 5-7-членне кільце, що необов'язково містить додатковий гетероатом, вибраний з О, N або S;
R7 являє собою Н, галоген або C1-C6алкільну, C1-C6алкокси, арильну або гетероарильну групу, кожну необов'язково заміщену;
r8 являє собою необов'язково заміщену 8-13-членну біциклічну або трициклічну кільцеву систему, що має атом N в головній частині місточкового зв'язку, і, необов'язково, містить 1, 2 або 3 додаткових гетероатоми, вибраних з N, O або S;
m дорівнює 0 або цілому числу, що дорівнює 1 або 2;
кожний r9 і r10 незалежно являє собою Н або C1-C6алкільну, арильну або гетероарильну групу, кожну необов'язково заміщену;
кожний R12, R13 і R19 незалежно являє собою Н або C1-C6алкільну, C2-C6алкенільну, C2-C6алкінільну, C3-C6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожну необов'язково заміщену;
кожний r14, R15 і R22 незалежно являє собою Н або необов'язково заміщену С1-
C6алкільну групу; і
кожний r16, r17, r18, r20 і r21 незалежно являє собою Н або необов'язково заміщену С1-С4алкільну групу; або r20 і r21 можуть разом з атомом, з яким вони сполучені, утворювати 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний з О, N або S,
причому спосіб включає взаємодію сполуки формули XVIII
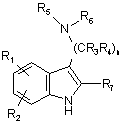 , (XVIII)
, (XVIII)
де n, r1, r2, r3, r4, r5, r6 і r7 визначені вище для формули Id, з хлоридом сульфонілу R8SO2Cl в присутності основи, необов'язково в присутності розчинника.
Текст
Даний винахід відноситься до похідних індолілалкіламіну як лігандів 5-гідрокситриптаміну-6, способів їх отримання, фармацевтичних композицій, що містять їх, і до способів лікування з їх застосуванням. Вважають, що різні розлади нервової системи, такі як тривога, депресія, рухо ві розлади і т.д., пов'язані з порушенням нейромедіатору 5-гідрокситриптаміну (5-НТ) або серотоніну. Серотонін локалізується в центральній і периферичній нервових системах, і відомо, що він впливає на багато які типи станів, включаючи, нарівні з іншими, психіатричні розлади, рухо ву активність, поведінку, пов'язану з споживанням їжі, статеву активність і нейроендокринну регуляцію. Ефекти серотоніну регулюються різними підтипами рецепторів 5-НТ. Відомі рецептори 5-НТ включають сімейство 5-НТ1 (наприклад, 5-НТ1А), сімейство 5-НТ2 (наприклад, 5НТ2А), підтипи 5-НТЗ, 5-НТ4, 5-НТ5, 5-НТ6 i 5-НТ7. Був клонований нещодавно ідентифікований підтип рецепторів 5-гідрокситриптаміну-6 (5-НТ6) людини, і повідомлялося про широкий розподіл його мРНК. Найвищі рівні мРНК рецепторів 5-НТ6 спостерігалися в нюховому горбику, смугастому тілі, навколоядерній ділянці, зубчатій частці і ділянках СА1, СА2 і САЗ гіпокампу. Більш низькі рівні мРНК рецепторів 5-НТ6 спостерігаються в зернистому шарі мозочка, декількох діенцефальних ядрах, мигдалинах і в корі. Норзерн-блотинги виявили, що мРНК рецепторів 5-НТ6, як виявляється, присутня виключно в головному мозку при невеликій кількості даних про її присутність в периферичних тканинах. Висока спорідненість ряду антипсихотичних засобів до рецептору 5-НТ6, в доповнення до локалізації його мРНК в смугастому тілі, нюховому горбику і навколоядерній ділянці, свідчить про те, що деякі з клінічних дій даних сполук можуть бути опосередковані через вказаний рецептор. Тому вважають, що ліганди рецепторів 5-НТ6 потенційно можна застосовувати при лікуванні певних розладів ЦНС, таких як тривога, депресія, епілепсія, нав'язливий компульсивний розлад, розлад з дефіцитом уваги, мігрень, для посилення пізнавальної пам'яті (наприклад, для лікування хвороби Альцгеймера), для лікування розладів сну, розладів споживання їжі (наприклад, анорексії або булімії), нейродегенеративних розладів (наприклад, інсульту або травми голови), панічних атак, синдрому відміни наркотичних засобів і інших речовин після їх зловживання (наприклад, кокаїну, етанолу, нікотину або бензодіазепінів), шизофренії або подібних до них станів; або при лікуванні певних шлунково-кишкових розладів, таких як синдром подразненого кишечнику. Тому, задачею даного винаходу є надання сполук, які можна застосовувати як терапевтичні засоби при лікуванні різних розладів центральної нервової системи, пов'язаних з рецептором 5-НТ6 або його впливом. Ще однією задачею даного винаходу є розробка способів лікування і фармацевтичних композицій, які можна застосовувати для лікування розладів центральної нервової системи, пов'язаних з рецептором 5-НТ6 або його впливом. Сполуки даного винаходу можна також застосовувати для подальшого дослідження і з'ясування ролі рецептора 5-НТ6. Вказані і інші задачі і ознаки винаходу стануть більш очевидні у викладеному тут нижче докладному описі. Даний винахід відноситься до похідного індолілалкіламіну формули І де Q являє собою SO2, CO, CONR 9 або CSNR10; n являє собою ціле число, що дорівнює 2 або 3; кожний R1, і R2 незалежно являє собою Н, галоген, CN, OCO2R12 , CO2R13, CONR14R 15, CNR16NR17R18, SOmR19, NR20R21 OR22, COR23 або С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3-С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну груп у, кожну необов'язково заміщену; кожний R3 і R4 незалежно являє собою Н або необов'язково заміщену С1-С6алкільну груп у; кожний R5 і R6 незалежно являє собою Н або С 1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну гр упу, кожну необов'язково заміщену, або R5 і R6 можуть бути взяті разом з атомом, з яким вони сполучені, утворюючи необов'язково заміщене 5-7членне кільце, що необов'язково містить додатковий гетероатом, вибраний з О, N або S; R7 являє собою Н, галоген, або С1-С6алкільну, С1-С6алкокси, арильну або гетероарильну груп у, кожну необов'язково заміщену; R8 являє собою необов'язково заміщену 8-13-членну біциклічну або трициклічну кільцеву систему, що має атом N в головній частині місточкового зв'язку і, необов'язково, що містить 1, 2 або 3 додаткових гетероатоми, вибраних з N, О або S; m дорівнює 0 або цілому числу, що дорівнює 1 або 2; кожний R9 і R10 незалежно являє собою Н або С 1-С6алкільну, арильну або гетероарильну гр упу, кожну необов'язково заміщену; кожний R12, R13, R19 і R23 незалежно являє собою Н або С 1-С6балкільну, С2-С6алкенільну, С2-С6алкінільну, С3-с6циклоалкільну, циклогетероалкільну, арильну або гетероарильну груп у, кожну необов'язково заміщену; кожний R14, R15 і R 22 незалежно являє собою Н або необов'язково заміщену С1-С6алкільну гр упу; і кожний R16, R17, R18, R20 і R21 незалежно являє собою Н або необов'язково заміщену С 1-С4алкільну гр упу; або R20 і R21 можуть бути взяті разом з атомом, з яким вони сполучені, утворюючи 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний з О, N або S; або його стереоізомерів або його фармацевтично прийнятних солей. Даний винахід також відноситься до способів і композицій, які можна використати для терапевтичного лікування розладів центральної нервової системи, пов'язаних з рецептором 5-НТ6 або його впливом. Рецептор 5-гідрокситриптаміну-6 (5-НТ6) є одним з найважливіших рецепторів, нещодавно ідентифікованих молекулярним клонуванням. Його здатність зв'язувати широкий діапазон терапевтичних сполук, що застосовуються в психіатрії, в поєднанні з його інтригуючим розподілом в головному мозку, стимулювали значний інтерес до нових сполук, які здатні взаємодіяти з вказаним рецептором або впливати на нього. Робляться значні зусилля для розуміння можливої ролі рецептора 5-НТ6 в психіатрії, пізнавальній дисфункції, руховій функції і регуляції, пам'яті, настрої і подібних сферах. Для цього проводили методичний пошук сполук, які демонструють спорідненість зв'язування до рецептора 5-НТ6, як допоміжний засіб у вивченні рецептора 5-НТ6, так і як потенційні терапевтичні засоби при лікуванні розладів центральної нервової системи [див., наприклад, С. Reavill and B.C. Rogers, Current Opinion in Investigational Drugs, 2001, 2(1): 104-109, Pharma Press Ltd]. У цей час виявлено, що похідні індолілалкіламіну формули І демонструють спорідненість до 5-НТ6. Похідні вказаного аміну можна застосовувати як ефективні терапевтичні засоби для лікування розладів центральної нервової системи (ЦНС), пов'язані з рецептором 5-НТ6 або його впливом. Відповідно, даний винахід відноситься до похідного індолілалкіламіну формули І де Q являє собою SO2, CO, CONR 9 або CSNR10; n являє собою ціле число, що дорівнює 2 або 3; кожний R1 і R2 незалежно являє собою Н, галоген, CN, OCO2R12, CO 2R13 , CONR14R15, CNR16NR17R18, SOmR19, NR20R21 OR22, COR23 або С1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3-С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну груп у, кожну необов'язково заміщену; кожний R3 і R4 незалежно являє собою Н або необов'язково заміщену С1-С6алкільну груп у; кожний R5 і R6 незалежно являє собою Н або С 1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну гр упу, кожну необов'язково заміщену, або R5 і R6 можуть бути взяті разом з атомом, з яким вони сполучені, утворюючи необов'язково заміщене 5-7членне кільце, що необов'язково містить додатковий гетероатом, вибраний з О, N або S; R7 являє собою Н, галоген або С 1-С6алкільну, С1-С6алкокси, арильну або гетероарильну групу, кожну необов'язково заміщену; R8 являє собою необов'язково заміщену 8-13-членну біциклічну або трициклічну кільцеву систему, що має атом N в головній частині містечкового зв'язку і, необов'язково містить 1, 2 або 3 додаткових гетероатоми, вибраних з N, О або S; m дорівнює 0 або цілому числу, що дорівнює 1 або 2; кожний R9 і R10 незалежно являє собою Н або, арильну або гетероарильну груп у, кожну необов'язково заміщену; С1-С6алкільну кожний R12, R13, R19 і R23 незалежно являє собою Н або С 1-С6алкільну, С2-С6алкенільну, С2-С6алкінільну, С3-С6циклоалкільну, циклогетероалкільну, арильну або гетероарильну групу, кожну необов'язково заміщену; кожний R14, R15 і R 22 незалежно являє собою Н або необов'язково заміщену С1-С6алкільну гр упу; і кожний R16, R17, R18, R 20 і R21 незалежно являє собою Н або необов'язково заміщену С 1-С4алкільну гр упу; або R20 і R21 можуть бути взяті разом з атомом, з яким вони сполучені, утворюючи 5-7-членне кільце, що необов'язково містить інший гетероатом, вибраний з О, N або S; або його стереоізомерів або його фармацевтично прийнятних солей. Термін «галоген», що використовується в описі і формулі винаходу, означає Вr, СІ, І або F, а термін «циклогетероалкіл» означає 5-7-членну циклоалкільну кільцеву систему, що містить 1 або 2 гетероатоми, які можуть бути однаковими або різними, вибраними з N, О або S, і необов'язково містять один подвійний зв'язок. Прикладами циклогетероалкільних кільцевих систем, включених у вказаний тут термін, є наступні кільця, в яких W являє собою NR, О або S; і R являє собою Н або необов'язковий замісник, як описано тут нижче: Аналогічним чином термін «гетероарил», що використовується в описі і формулі винаходу, означає 5-10членну ароматичну кільцеву систему, що містить 1, 2 або 3 ге тероатоми, які можуть бути однаковими або різними, вибраними з N, О або S. Такі гетероарильні кільцеві системи включають піроліл, азоліл, оксазоліл, тіазоліл, імідазоліл, фурил, тієніл, хінолініл, ізохінолініл, індолініл, бензотієніл, бензофураніл, бензізоксазоліл або подібні сполуки. Термін «арил» означає карбоциклічну ароматичну кільцеву систему, наприклад, що містить 6-10 атомів вуглецю, таку як феніл, нафтил або подібні сполуки. Термін «галогеналкіл», що використовується тут, означає групу СnH2n+1 , що має від одного до 2n+1 атомів галогену, які можуть бути однаковими або різними, і термін «галогеналкокси», що використовується тут, означає групу ОС nН2+1, що має від одного до 2n+1 атомів галогену, які можуть бути однаковими або різними. Прикладами 8-13-членних біциклічних або трициклічних кільцевих систем, що мають атом N в головній частині місточкового зв'язку, і необов'язково містять 1, 2 або 3 додаткових гетероатоми, вибраних з N, О або S, включених в позначений тут термін, є наступні кільцеві системи, де W являє собою NR, О або S; a R являє собою Н або необов'язковий замісник, як описано тут нижче: В описі і формулі винаходу, коли такі терміни як «С1-С6алкіл, С2-С6алкеніл, С2-С5алкініл, С3-С7циклоалкіл, циклогетероалкіл, арил, гетероарил або 8-13-членна біциклічна або трициклічна кільцева система, що має атом N в головній частині місточкового зв'язку», позначені як такі, що є необов'язково заміщеними, замісні групи, які можуть необов'язково бути присутніми, можуть бути однією або більше, наприклад, двома або трьома, однаковими або відмінними від груп, що звичайно використовуються в розробці фармацевтичних сполук або модифікаціях таких сполук, впливаючи на їх стр уктур у/активність, тривалість дії, всмоктування, стійкість або іншу сприятливу властивість. Конкретні приклади таких замісників включають атоми галогенів, нітро, ціано, тіоціанато, ціанато, гідроксильну, алкільну, галоалкільну, алкокси, галоалкокси, аміно, алкіламіно, діалкіламіно, формільну, алкоксикарбонільну, карбоксильну, алканоїльну, алкілтіо, алкілсульфінільну, алкілсульфонільну, карбамоїльну, алкіламідо, фенільну, фенокси, бензильну, бензилокси, гетероарильну, циклогетероарильну або циклоалкільну групи, переважно, атоми галогену або групи нижчих алкілів. Звичайно можуть бути присутніми 0-3 замісники. Коли будь-який з вказаних вище замісників являє собою або містить алкільну груп у як замісник, вона може бути лінійною або розгалуженою і може містити до 12, переважно, до 6, переважніше, до 4 атомів вуглецю. Прикладами R1 і R2 є незалежно водень, галоген (такий як фтор, хлор, бром), С1-С6алкіл (наприклад, метил), гідрокси, С1-С6алкіл, заміщений фенілом (наприклад, бензил), і С1-С6алкокси (наприклад, метокси); наприклад, де заміщення знаходиться в 5- і/або 6- і/або 7 положенні. Q може являти собою, наприклад, SO2. Прикладом n є 2. Прикладами R8 є необов'язково заміщені імідазо[ 1,2-а]піридинова, імідазо[2,1 -b][ 1,3]тіазолільна або бензо[с1]імідазо[2,1-b][1,3]тіазольна кільцева система, наприклад, R8 являє собою 6-хлорімідазо[2,1b][1,3]тіазол-5-іл. Прикладом R7 є Н. R3 і R4 можуть незалежно являти собою, наприклад, Н або С1-С6алкіл, такий як метил. Значення кожного присутнього R3 і R4 може бути однаковим або різним, наприклад, один R3 може являти собою Н, а інший - СН3. Прикладами R5 і R6 є незалежно водень, С1-С6алкіл і С1-С6алкіл, заміщений фенілом. Прикладами R5 і R6, коли вони разом з атомом азоту являють собою 5-або 6-членне кільце, є кільця, такі як піролідиніл, піперазиніл або піперидиніл, кожний необов'язково заміщений С1-С6алкілом або СООН. Фармацевтично прийнятні солі можуть являти собою будь-яку кислотно-адитивну сіль, утворену сполукою формули І і фармацевтично прийнятною кислотою, такої як фосфорна, сірчана, хлористоводнева, бромистоводнева, лимонна, малеїнова, малонова, мигдалева, янтарна, фумарова, оцтова, молочна, азотна, сульфонова, паратолуолсульфонова, метансульфонова кислота або ним подібні кислоти. Сполуки даного винаходу включають складні ефіри, карбамати або інші звичайні пролікові форми, які загалом являють собою функціональні похідні сполук даного винаходу і які легко перетворюються в активну частину молекули даного винаходу in vi vo. Відповідно, спосіб відповідно до даного винаходу охоплює лікування різних станів, описаних ви ще, сполукою формули І або сполукою, яка спеціально не розкрита, але яка, після введення, перетворюється в сполуку формули l in vivo. Включені також метаболіти сполук даного винаходу, визначені як активні види, що продукуються після введення вказаних сполук в біологічну систему. Сполуки даного винаходу можуть існувати у ви гляді одного або більше стереоізомерів. Різні стереоізомери включають енантіомери, діастереомери, атропізомери і геометричні ізомери. Фахівцеві в даній галузі буде зрозуміло, що один стереоізомер може бути більш активним або може виявляти сприятливі ефекти при збагаченні ним суміші стереоізомерів відносно іншого стереоізомера(ів), або при відділенні від іншого стереоізомера(ів). Крім того, фахівець в даній галузі знає як відділити, збагатити або селективно отримати вказані стереоізомери. Відповідно, даний винахід включає сполуки формули І, їх стереоізомери і їх фармацевтично прийнятні солі. Сполуки даного винаходу можуть бути присутніми у вигляді суміші стереоізомерів, окремих стереоізомерів або у вигляді оптично активної форми. Переважними сполуками даного винаходу є сполуки формули І, де Q являє собою SO2. Також переважними є ті сполуки формули І, де n дорівнює 2. Іншою групою переважних сполук формули І є ті сполуки, де R8 являє собою 6-хлорімідазо[2,1-b] [ 1,3]тіазол-5-іл. Більш переважними сполуками даного винаходу є ті сполуки формули І, де Q являє собою SO 2, a R 7 являє собою Н. Іншою гр упою більш переважних сполук є ті сполуки формули І, де Q являє собою SO 2, n дорівнює 2, a R7 являє собою Н. Подальшими більш переважними сполуками є сполуки формули І, де Q являє собою SO2, n дорівнює 2, R7 являє собою Н, a R8 являє собою 6-хлорімідазо[2,1-b][1,3]тіазол-5-іл. Серед переважних сполук винаходу представлені: 2-{1[(6-хлорімідазо[2,1-b][1,3]тіазол-5-іл)сульфоніл]-1Н-індол-3-іл}етиламін; 2-{1-[(імідазо[2,1 -b][1,3]тіазол-5-іл)сульфоніл]-1Н-індол-3-іл}етиламін; {2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}метиламін; {2-[1-(6-хлорімідазо[2,1-b][1;3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}диметиламін; бензил-{2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}амін; 1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-3-(2-піролідин-1-ілетил)-ІН-індол; 1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-3-[2-(4-метилпіперазин-1-іл)етил]-1Н-індол; 1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-3-(2-піперидин-1-ілетил)-1Н-індол; бензил-{2-[1-(6-хлорімідазо[2,1-b][тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}метиламін; {2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}фенетиламін; 1-{2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}піролідин-2-карбонова кислота; 2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]-1-метилетиламін; (S)-2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]-1-метилетиламін; (S)-2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]-1-метилетиламін; 2-[1 -(2-хлорімідазо[1,2-а]піридин-3-сульфоніл)-1Н-індол-3-іл]етиламін; 2-[1-(2,6-дихлорімідазо[2,1-b[1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етиламін; 2-[1-(2-хлорбензо[d]імідазо[2,1 -b][1,3]тіазол-3-сульфоніл)-1 Н-індол-3-іл] етиламін; {2-[1-(2-хлорімідазо[1,2-а]піридин-3-сульфоніл)-1Н-індол-3-іл]етил}метиламін; {2-[1-(2,6-дихлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}метиламін; {2-[1-(2-хлорбензо[d]імідазо[2,1-b][1,3]тіазол-3-сульфоніл)-1Н-індол-3-іл]етил}метиламін; {2-[1-(2-хлорімідазо[1,2-а]піридин-3-сульфоніл)-1Н-індол-3-іл]етил}диметиламін; {2-[1-(2,6-дихлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етил}диметиламін; {2-[1-(2-хлорбензо[d]імідазо[2,1-b][1,3]тіазол-3-сульфоніл)-1H-індол-3-іл]етил}диметиламін; 2-[5-хлор-1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етиламін; 2-[5-хлор-1-(2-хлорімідазо[1,2-а]піридин-3-сульфоніл)-1Н-індол-3-іл]етиламін; 2-[5-хлор-1-(2,6-дихлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етиламін; 2-[5-хлор-1-(2-хлорбензо[d]імідазо[2,1-Ь][1,3]тіазол-3-сульфоніл)-1Н-індол-3-іл]етиламін; 2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-5-метокси-1Н-індол-3-їл]етиламін; 2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-6-метокси-1Н-індол-3-іл]етиламін; 2-[5-бром-1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етиламін; 2-[5-бензилокси-1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-3-іл]етиламін; 2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-5-метил-1Н-індол-3-іл]етиламін; 2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-6-метил-1Н-індол-3-іл]етиламін; 2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-7-метил-1Н-індол-3-іл]етиламін; 3-(2-аміноетил)-1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-1Н-індол-5-ол; 2-[ 1 -(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-5-фтор-1Н-індол-3-іл]етиламін; 2-[1-(6-хлорімідазо[2,1-b][1,3]тіазол-5-сульфоніл)-6-фтор-1Н-індол-3-іл]етиламін; їх стереоізомери; або їх фармацевтично прийнятні солі. Даний винахід також відноситься до способів отримання сполук формули (І), причому способи включають один з наступних: а) взаємодія сполуки формули В де n,R1,R2,R3,R4 ,R5, R6 і R7 визначені вище, з відповідним сульфонілуючим, ацилюючим, карбамоїлуючим або тіокарбамоїлуючим агентом, що містить груп у: -R8Q-, де R8 визначений вище, a Q являє собою SO2, CO, CONR 9 або CSNR10; причому вказані реагуючі сполуки за необхідності захищені на реактивних ділянках і/або на реактивних замісникових групах, і видалення будьяких захисних груп для отримання відповідної сполуки формули (І); або b) видалення захисної групи із сполуки формули І, де R5 заміщений захисною групою, з отриманням відповідної сполуки формули (І), де NR5R6 являє собою-NHR6 або с) взаємодія сполуки формули (С): де n, R1 R2, R3, R4, R 7, R8 і Q визначені вище, a L являє собою відхідну груп у, таку як галоген, наприклад, Вг, з аміном формули NHR5R6, з отриманням відповідної сполуки формули (І); d) перетворення сполуки формули (І), що має реакційно-здатну замісникову груп у, в іншу сполуку формули І; або e) перетворення основної сполуки формули (І) в кислотно-адитивну сіль або навпаки; або f) виділення ізомеру сполуки формули (І) з суміші ізомерів; або g) перетворення азиду формули (D) де n, R1 R2, R3, R4, R7, R8 і Q визначені вище, у відповідну сполуку формули (І), де обидва R5 і R6 являють собою Н. Способи проведення описаних вище реакцій добре відомі фахівцям в даній галузі і/або проілюстровані в даному описі. У будь-якій з описаних тут реакцій групи реакційно-здатних замісників або ділянки в молекулі можуть бути за хищені перед реакцією використанням відповідних захисних гр уп, інертних до умов реакції, і видалені після реакції. Сполуки винаходу можна відповідним чином отримати з використанням звичайних синтетичних способів і, якщо потрібно, стандартних методик розділення і виділення. Наприклад, сполуки формули І, де Q являє собою SO2, n дорівнює 2 і R3 і R4 являють собою Н (Іа), можна отримати послідовною реакцією індольного похідного формули І з оксалілхлоридом і аміном, HNR5R6, отримуючи проміжну сполуку формули III; відновленням карбонільних груп формули III гідридом літійалюмінію, отримуючи відповідне 3-етиламінове похідне сполуки формули IV; і реакцією вказаного похідного сполуки формули IV з основою, такою як трет-бутилат калію або гідрид натрію, а потім сульфонілхлоридом, R8SO2Cl, отримуючи бажаний продукт формули Ia. Послідовність реакції показана на схемі послідовності операцій І. Схема послідовності операцій І Для проміжних сполук формули IV, де R5 або R6 являють собою Н, амін формули IV може бути захищений звичайним захисним реагентом, таким як карбонат ди-трет-бутилу, перед кінцевими етапами сульфонілування. Потім можна зняти захист отриманої N-захищеної сполуки формули І в присутності кислоти. Альтернативно, сполуки формули Іа можна отримати реакцією похідного 3-(2-брометилу) формули V послідовно з основою і сульфонілхлоридом, R8SO2C1, отримуючи проміжну сполуку формули VI, і реакцією проміжної сполуки формули VI з аміном, HNR5R6, отримуючи бажаний продукт формули Іа. Етапи реакції показані на схемі послідовності операцій II. Схема послідовності операцій II Сполуки формули І, де R3 або R4 являють собою не Н, a Q являє собою SO2 (Ib), можна отримати послідовною реакцією проміжної сполуки формули II з реактивом Грін'яра, таким як етилмагнійбромід, і хлоридом амінокислоти формули VII, отримуючи 3-ацильовану сполуку формули VIII; відновленням вказаної сполуки формули VIII відновлювальним агентом, таким як гідрид літійалюмінію, отримуючи відповідну 3алкіламіносполуку формули IX, і сульфуванням сполуки формули IX, як описано вище в схемах послідовності операцій І і II, отримуючи бажаний продукт формули Іb. Послідовність реакції показана на схемі послідовності операцій III. Схема послідовності операцій III У випадку, коли R5 або R6 являють собою Н, атом азоту хлориду амінокислоти формули VII захи щений, і захист відповідного отриманого продукту можна зняти, використовуючи звичайні засоби, отримуючи бажану сполуку формули Іb, де R5 або R6 являють собою Н. Сполуки формули І, де Q являє собою SO2; n дорівнює 3; і R3, R4, R5, R6 і R7 являють собою Н (Іс), можна отримати послідовною реакцією гідрохлориду арилгідразину формули X з 3,4-дигідро-2Н-піраном, отримуючи індол-3-ілпропанол-1-ол формули XI; заміною гідроксигрупи на бром, отримуючи відповідну бромсполуку формули XII; реакцією сполуки формули XII з азидом натрію, отримуючи азид формули XIII; сульфонілюванням азиду формули XIII, отримуючи сполук у формули XIV, і перетворенням сполуки формули XIV в бажаний амін формули Іс за допомогою реакції з трифенілфосфіном. Послідовність реакції показана на схемі послідовності операцій IV. Схема послідовності операцій IV Аналогічно, сполуки формули І, де Q являє собою CO, CONR9 або CSR10, можна отримати, використовуючи вказані вище методики, проілюстровані в схемах послідовності операцій І, II, III і IV, і застосовуючи відповідним чином заміщений хлорангідрид, ізоціанат або ізотіоціанат, замість R8SO2Cl. Захисні групи, які можна використати в описаних вище реакціях, включають карбоксилат трет-бутилу, бензил, ацетил, бензилоксикарбоніл або будь-яку звичайну гр упу, яка, як відомо, захищає основний азот при стандартних методиках синтезу. Сульфонілхлориди, R8SCО2Cl, можна купити або отримати звичайними методиками. Наприклад, сульфонілхлориди 6-заміщеного-імідазо[2,1-b][1,3]тіазол-5-ілу формул XVa і XVb можна отримати реакцією 2амінотіазолу з хлороцтовою кислотою або відповідним хлорметилкетоном, отримуючи відповідно 2-іміно-4тіазолін-3-ілоцтову кислоту (XVIa) або 2-іміно-4-тіазолін-3-ілкетон (XVIb); реакцією або XVIa, або XVIb з РОСl3, отримуючи, у випадку XVIa, 6-хлорімідазо[2,1-b]тіазол (XVIIa), або, у випадку XVIb, 6-заміщений-імідазо[2,1b]тіазол (XVIIb); і послідовною реакцією відповідних сполук XVIIa і XVIIb з хлорсульфоновою кислотою і РОСІ3, отримуючи бажані сульфонілхлориди формул XVa і XVb. Реакції проілюстровані в схемі послідовності операцій V, де R являє собою необов'язковий замісник, як описано вище, за винятком галогену. Схема послідовності операцій V Переважно даний винахід відноситься до способу отримання сполуки формули І, де Q являє собою SO2, a R5 і R6 являють собою не Н (Id), який включає реакцію сполуки формули XVIII з сульфонілхлоридом, R8SO2Cl, в присутності основи, необов'язково, в присутності розчинника. Процес показаний в схемі послідовності операцій VI. Схема послідовності операцій VI Основи, придатні для використання в способі винаходу, являють собою сильні основи, такі як NaH, КОтретBu, або будь-яку звичайну основу, здатн у видалити протон з основного індолу або атом азоту бензазолу. Переважно сполуку формули І винаходу можна успішно використати при лікуванні розладів центральної нервової системи, пов'язаних з рецептором 5-НТ6 або таких, що знаходяться під його впливом, таких як розлади рухови х функцій, настрою, психіатричні розлади, розлади пізнавальної функції, нейродегенеративні розлади або подібні розлади, наприклад, хвороба Альцгеймера, хвороба Паркінсона, розлад з дефіцитом уваги, тривога, епілепсія, депресія, нав'язливий компульсивний розлад, мігрень, розлади сну, нейродегенеративні розлади (такі як травма голови або інсульт), розлади споживання їжі (такі як анорексія або булімія), шизофренія, втрата пам'яті, розлади, пов'язані з наркотичною абстиненцією або припиненням зловживання нікотином або подібні розлади, або певні шлунково-кишкові розлади, такі як синдром подразненого кишечнику. Відповідно, даний винахід відноситься до способу лікування розладу центральної нервової системи (ЦНС), пов'язаного з рецептором 5-НТ6, або такого, що знаходиться під його впливом, у потребуючого його пацієнта, який включає введення вказаному пацієнту терапевтично ефективної кількості сполуки формули І, описаної вище. Сполуку можна вводити пероральним або парентеральним шляхом або будь-яким звичайним шляхом, який відомий як ефективний шлях введення терапевтичного засобу потребуючому його пацієнту. Терапевтично ефективна кількість, що надається при лікуванні конкретного розладу ЦНС, може варіювати відповідно до конкретного стану(ів), який піддається лікуванню, маси, росту, віку і типу реакції пацієнта, тяжкості розладу, оцінкою лікуючого лікаря і подібними чинниками. Загалом, ефективні кількості для добового перорального введення можуть складати приблизно від 0,01 до 1000мг/кг, переважно, приблизно від 0,5 до 500мг/кг, а ефективні кількості для парентерального введення можуть складати приблизно від 0,1 до 100мг/кг, переважно, приблизно від 0,5 до 50мг/кг. У реальній практиці сполуки винаходу надають введенням сполуки або її попередника в твердій або рідкій формі, або окремо, або в комбінації з одним або більше звичайних фармацевтичних носіїв або ексципієнтів. Відповідно, даний винахід відноситься до фармацевтичної композиції, яка включає фармацевтично прийнятний носій і ефективну кількість сполуки формули І, описаної вище. Тверді носії, придатні для використання в композиції винаходу, включають одну або більше речовин, які можуть також діяти як ароматизуючі агенти, мастильні агенти, солюбілізуючі агенти, суспендуючі агенти, наповнювачі, глянцювачі , допоміжні агенти для пресування, зв'язувальні речовини, агенти, що розпушують таблетки, або інкапсулюючі речовини. У порошках носій може являти собою тонко подрібнену тверду речовину, яка представлена в суміші з тонко подрібненою сполукою формули І. В таблетках сполука формули І може бути змішана з носієм, що має необхідні властивості стиснення у відповідних пропорціях, і спресованим в бажану форму і розмір. Вказані порошки і таблетки можуть містити до 99% мас, сполуки формули І. Тверді носії, відповідні для використання в композиції винаходу, включають фосфат кальцію, стеарат магнію, тальк, цукор, лактозу, декстрин, крохмаль, желатин, целюлозу, метилцелюлозу, натрійкарбоксиметилцелюлозу, полівінІлпіролідон, віск з низькою точкою плавлення і іонообмінні смоли. Будь-який фармацевтично прийнятний рідкий носій, придатний для отримання розчинів, суспензій, емульсій, сиропів і еліксирів, можна використати в композиції винаходу. Сполуки формули І можна розчинити або суспендувати в фармацевтично прийнятному рідкому носії, такому як вода, органічний розчинник або фармацевтично прийнятна олія або жир, або в їх суміші. Вказана рідка композиція може містити інші відповідні фармацевтичні домішки, такі як солюбілізатори, емульгатори, буфери, консерванти, підсолоджувальні агенти, ароматизуючі агенти, суспендуючі агенти, загусники, фарбувальні агенти, регулятори в'язкості, стабілізатори, регулятори осмотичного тиску або подібні речовини. Приклади рідких носіїв, придатних для перорального і парентерального введення, включають воду (зокрема, що містить вказані вище домішки, наприклад, похідні целюлози, переважно, розчин натрійкарбоксиметилцелюлози), спирти (включаючи одноатомні спирти і багатоатомні спирти, наприклад гліколі) або їх похідні, або олії (наприклад, фракціоновану кокосову олію і арахісову олію). Для парентерального введення носій може також являти собою маслянистий складний ефір, такий як олеат або ізопропілміристат. Композиції даного винаходу, які являють собою стерильні розчини або суспензії, придатні для внутрішньом'язової, внутрішньочеревинної або підшкірної ін'єкції. Стерильні розчини можна також вводити внутрішньовенно. Композиції винаходу, придатні для перорального введення, можуть бути як в рідкій формі, так і у формі твердої композиції. Для більш ясного розуміння і для більш ясної ілюстрації винаходу нижче викладені його конкретні приклади. Наступні приклади є лише ілюстративними, і їх жодним чином не треба розуміти як такі, що обмежують діапазон і принципи, що лежать в основі винаходу. При відсутності інших вказівок, всі частини являють собою частини по масі. Терміни «ЯМР» і «ВЕРХ» означають відповідно ядерний магнітний резонанс і високоефективну рідинну хроматографію. Терміни «ТГФ» і «ЕЮАс» означають відповідно тетрагідрофуран і етилацетат. Приклад 1 Отримання гідрохлориду 2-і {1-[(6-хлорімідазо[2,1 -b] [1,3тіазол-5-іл)сульфоніл]-1Н-індол-3-іл}етиламіну Розчин триптаміну (4,2г, 26,2ммоль) в суміші 1:1 ацетону: води обробляють карбонатом ди-трет-бутилу (6,5г, 27,8ммоль) і К2СО3 (7,5г, 54,4ммоль), перемішують при кімнатній температурі протягом 16год., концентрують у вакуумі у водну суміш і екстрагують ЕtOАс. Екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі. Суміш отриманого залишку (5,6г, 21ммоль) і хлориду 6-хлорімідазо[2,1-b]тіазол-5сульфонілу (5,01г, 19,5ммоль) в ТГФ порціями обробляють трет-бутилатом калію (4,3г, 39ммоль (2 еквіваленти)) при кімнатній температурі, перемішують протягом 16год., виливають в насичений розчин NaHCO3 і екстрагують ЕtOАс. Екстракти об'єднують, суша ть над MgSO4 і концентрують у вакуумі. Вказаний отриманий залишок хроматографують (силікагель, 10%-60% ЕtOАс в гексанах як градієнтний елюент), отримуючи захищену 5-сульфонілтриптамінову проміжну сполуку у вигляді твердої речовини рудуватокоричневого кольору, 5,6г (вихід 60%). Розчин вказаної проміжної сполуки (6,8г, 14,2ммоль) в ізопропанолі обробляють 4N НСl в діоксані (40мл, 11 еквівалентів), перемішують протягом 4год. і фільтрують. Фільтрувальний коржик промивають простим ефіром і сушать повітрям, отримуючи вказаний в заголовку продукт у вигляді не зовсім білої твердої речовини, 3,2 г (вихід 55%) з температурою плавлення 239-241°С, що ідентифікується ЯМР і мас-спектральним аналізами. Приклад 2 Отримання 3-(2-брометил)-1-(6-хлорімідазо[2,1-b]тіазол-5-сульфоніл)індолу Суміш 3-(2-брометил)індолу (1,0г, 4,46ммоль) і хлориду 6-хлорімідазо[2,1-b]тіазол-5-сульфонілу (0,96г, 1,1 еквіваленти) в ТГФ обробляють трет-бутилатом (трет-бутоксидом) калію (0,48г, 1,1 еквіваленту) при кімнатній температурі, перемішують протягом 16год., гасять насиченим NaHCO3 і екстрагують EtOAc. Екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі, отримуючи вказаний в заголовку продукт у вигляді коричневої олії, 1,2г (вихід 58%), що ідентифікується ВЕРХ і мас-спектральним аналізами. Приклад 3 Отримання {2-[1-(6-хлорімідазо[2,1-b]тіазол-5-сульфоніл)-1H-індол-3-іл]етил}метиламіну Розчин 3-(2-брометил)-1 -(6-хлорімідазо[2,1 -b]тіазол-5-сульфоніл)індолу (92мг, 0,20ммоль) в ТГФ обробляють метиламіном (2М в метанолі, 0,4мл, 2 еквіваленти), нагрівають при 50°С протягом 24год., охолоджують і концентрують у вакуумі. Отриманий залишок очищають ВЕРХ1 , отримуючи вказаний в заголовку продукт у вигляді білої твердої речовини, 18,5мг, що ідентифікується ВЕРХ2 і масспектральним аналізами. ПРИКЛАДИ 4-11 Отримання похідних N-заміщеного-2-{1-[(6-хлорімідазо[2,1-b][1,3]тіазол-5-іл)сульфоніл]-1H-індол-3іл}етиламіну Використовуючи по суті ті ж описані вище методики і застосовуючи відповідний амін, отримують сполуки, показані в таблиці І, і ідентифікують ВЕРХ і мас-спектральним аналізами. 1 Умови ВЕРХ (препаративної): Система препаративної ВЕРХ Джілсона; колонка YMC Pro С18, 20мм х 50мм внутрішній діаметр, 5мкМ; введення проби 2мл; Розчинник А: 0,02% ТФА/вода; Розчинник В: 0,02% ТФА/ацетонітрил/Градієнт: Час 0: 95% А; 2хв: 95% А; 14хв: 10% А, 15хв.: 10% А, 16хв.: 95% А; Швидкість потоку 22,5мл/хв.; Де текція: 254нм DAD. 2 Умови ВЕРХ (аналітичної): Система ВЕРХ Hewlett Packard 1100; колонка Waters Xterra C18, 2мм х 30мм внутрішній діаметр, 3мкМ; введення проби 5мкл; Розчинник А: 0,02% ТФА/вода; Розчинник В: 0,02% ТФА/ацетонітрил; Градієнт: Час 0: 95% А; 0,2хв.: 95% А; 3хв.: 5% А; Швидкість потоку 1,2мл/хв.; Детекція: 254нм DAD. Таблиця 1 1 Умови ВЕРХ (аналітичної): Система ВЕРХ Hewlett Packard 1100; колонка Waters Xterra С18, 2мм x 30мм внутрішній діаметр, 3мкМ; введення проби 5мкл; Розчинник А: 0,02% ТФА/вода; Розчинник В: 0,02% ТФА/ацетонітрил; Градієнт: Час 0: 95% А; 0,2хв.: 95% А; 3хв.: 5% А; Швидкість потоку 1,2мл/хв.; Детекція: 254нм DAD. Приклад 12 Отримання гідрохлориду 2-[1-(6-хлорімідазо[2,1-b]тіазол-5-сульфоніл)-1H-індол-3-іл]-1-метилетиламіну Розчин сульфонату a-метилтриптамінметану (5,0г, 18,5ммоль) в суміші 1:1 ацетону: води обробляють дикарбонатом ди-трет-бутилу (7,7г, 55,5ммоль, 3 еквіваленти), перемішують при кімнатній температурі протягом 16год., концентрують у вакуумі у водн у суміш і екстрагують EtOAc. Екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі. Суміш частини отриманого залишку (2,0г, 7,3ммоль, 1,1 еквіваленту) і хлориду 6-хлорімідазо[2,1-b]тіазол-5-сульфонілу (1/7г, 6,6ммоль, 1,0 еквівалент) в ТГФ порціями обробляють трет-бутилатом калію (820мг, 7,3ммоль, 1,1 еквіваленту) при кімнатній температурі, перемішують протягом 1 год., завантажують в насичений розчин NaHCO3 і екстрагують EtOAc. Екстракти об'єднують, сушать над Na2SO4 і концентрують у вакуумі. Вказаний отриманий залишок хроматографують (силікагель, 20%-50% EtOAc в гексанах як градієнтний елюент), отримуючи вільну основу вказаного в заголовку продукту у вигляді коричневої олії, 1,7г (вихід 50%). Обробка 4N НСl в діоксані і ТГФ з подальшою фільтрацією і перекристалізацією фільтрувального коржика з етанолу дає вказаний в заголовку продукт у вигляді яснокоричневої твердої речовини, 1,0г (вихід 40%), що ідентифікується ЯМР і мас-спектральним аналізами. Приклад 13 Отримання (S)-2-аміно-1-(1Н-шдол-3-іл)-пропан-1-ону Розчин індолу (1,1г 9,3ммоль, 1,0 еквівалент) в метиленхлориді в атмосфері N 2 при 0°С обробляють по краплях бромідом етилмагнію (9мл, 3,0М в простому ефірі, 27ммоль, 3 еквіваленти), дають зігрітися до кімнатної температури протягом 1год., охолоджують до 0°С, обробляють по краплях розчином хлорангідриду Fmoc-L-аланіну (14,0ммоль, 1,5 еквіваленти) в метиленхлориді, дають зігрітися до кімнатної температури протягом 1год., завантажують на 50мл водної IN HCl, охолоджують до 0°С і перемішують при 0°С протягом 15хв. Фази розділяють. Органічну фазу сушать над Na2SO4 і концентрують у вакуумі, отримуючи залишок. Залишок розводять насиченим NaHCO3 і екстрагують EtOAc. Екстракти об'єднують і концентрують у вакуумі, отримуючи залишок, який розчиняють в 10% піперидині в диметилформаміді і перемішують протягом 1год. при кімнатній температурі. Отриманий розчин розводять насиченим NaHCO3 і екстрагують EtOAc. Екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі, отримуючи вказаний в заголовку продукт у вигляді коричневої олії, 0,8г (вихід 47%), що ідентифікується ВЕРХ і мас-спектральним аналізами. Приклад 14 Отримання (S)-2-( 1Н-індол-3-іл)-1-метилетиламіну Розчин (8)-2-Аміно-1-(1Н-індол-3-іл)-пропан-1-ону (0,47г, 2,5ммоль, 1,0 еквівалент) в ацетонітрилі і ізопропанолі обробляють порціями NaBH4 (285мг, 7,49ммоль, 3,0 еквіваленти), нагрівають при температурі дефлегмації протягом 24год., перемішують при кімнатній температурі в атмосфері N 2 протягом 36год., гасять метанолом, концентрують і розподіляють між водою і EtOAc. Фазу EtOAc сушать над MgSO4 і концентрують у вакуумі, отримуючи вказаний в заголовку продукт у вигляді коричневої олії, що ідентифікується ВЕРХ і масспектральним аналізами. Приклад 15 Отримання гідрохлориду (S)-2-[1-(6-хлорімідазо[2,1-b]тіазол-5-сульфоніл)1Н-індол-3-іл]-1-метилетиламіну Суміш (S)-2-(1Н-індол-3-іл)-1-метилетиламіну (0,43г, 2,5ммоль) і дикарбонату ди-трет-бутилу (0,60г, 2,75ммоль) в ацетоні обробляють по краплях водним К2СО3 (3,5г, 25ммоль) при 0°С, дають зігрітися до кімнатної температури протягом 16год., концентрують у водний залишок і екстрагують EtOAc. Екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі до сухості. Даний залишок хроматографують (силікагель, 10%-50% EtOAc в гексанах як градієнтний елюент), отримуючи захищений (ІІ)-2-метилтриптамін. Суміш захищеного триптаміну (0,17г, 0,62ммоль) і хлориду 6-хлорімідазо[2,1-b]тіазол-5-сульфонілу (0,16г, 0,62ммоль) в ТГФ обробляють трет-бутилатом калію (77мг, 0,68ммоль) при кімнатній температурі, перемішують протягом 1год., завантажують в насичений NaHCO3 і екстрагують EtOAc. Екстракти об'єднують, сушать над Na2SO4 і концентрують у вакуумі. Отриманий залишок диспергують в ТГФ і 4N НС1 в діоксані, перемішують протягом 16 год., концентрують у вакуумі і очищають ВЕРХ, отримуючи вказаний в заголовку продукт у вигляді бежевої твердої речовини, 0,62мг (вихід 35%), що ідентифікується ЯМР і мас-спектральним аналізами. Приклад 16 Отримання гідрохлориду (R)-2-[1-(6-хлорімідазо[2,1-b]тіазол-5-сульфоніл)-1Н-індол-3-іл]-1-метилетиламіну Використовуючи по суті такі ж методики, як описано вище, і застосовуючи F-moc-D-аланін як вихідну речовину, отримують вказаний в заголовку продукт і ідентифікують ВЕРХ і мас-спектральним аналізами. 1 Умови ВЕРХ: Система ВЕРХ Hewlett Packard 1100; колонка Waters Xterra CIS, 2мм x 30мм внутрішній діаметр, 3мкМ; введення проби 5мкл; Розчинник А: 0,02% ТФА/вода; Розчинник В: 0,02% ТФА/ацетонітрил; Градієнт: Час 0: 95% А; 0,2 хв.: 95% А; 3 хв.: 5% А; Швидкість потоку 1,2мл/хв.; Детекція: 254нм DAD. Приклади 17-40 Отримання похідних індолілалкіламіну Використовуючи по суті такі ж методики, як описано вище, і застосовуючи відповідний індольний субстрат і галід сульфонілу, отримують сполуки, показані в таблиці II, і ідентифікують ВЕРХ і мас-спектральним аналізами. Таблиця II 1 Умови ВЕРХ: Система ВЕРХ Hewlett Packard 1100; колонка Waters Xterra CIS, 2мм x 30мм внутрішній діаметр, 3мкМ; введення проби 5мкл; Розчинник А: 0,02% ТФА/вода; Розчинник В: 0,02% ТФА/ацетонітрил; Градієнт: Час 0: 95% А; 0,2 хв.: 95% А; 3 хв.: 5% А; Швидкість потоку 1,2мл/хв.; Детекція: 254нм DAD. Приклад 41 Отримання 3-(фтор-1H-індол-3-іл)пропан-1-олу Перемішену суспензію гідрохлориду 4-фторфенілгідразину (8,13г, 50ммоль) в суміші води і діоксану обробляють розчином 3,4-дигідро-2Н-пірану (4,6мл, 50ммоль) протягом періоду 5хв., нагрівають при 100°С протягом 18год., охолоджують, розводять простим ефіром і фільтрують. Фільтрат сушать над Na 2SO4 і концентрують у вакуумі. Отриманий залишок очищають флеш-хроматографією (силікагель, 1:1 EtOАс/гексан), отримуючи вказаний в заголовку продукт у вигляді олії, 8,31г (вихід 86%), що ідентифікується ЯМР і масспектральним аналізами. Приклад 42 Отримання 3-(3-бромпропіл)-5-фтор-1Н-індолу Суміш 3-(5-фтор-1Н-індол-3-іл)-пропан-1-олу (2,15г, 11,2ммоль), тетраброміду вуглецю (4,80г, 14,5ммоль) і трифенілфосфіну (4,40г, 16,7ммоль) в метиленхлориді перемішують протягом 1год. і концентрують у вакуумі. Отриманий залишок очищають флеш-хроматографією (силікагель, EtOАс /гексан 3/7), отримуючи вказаний в заголовку продукт у вигляді олії, 1,97 г (ви хід 69%), що ідентифікується ЯМР і мас-спектральним аналізами. Приклад 43 Отримання 3-(3-азидопропіл)-5-фтор-1Н-індолу Розчин 3-(3-бромпропіл)-5-фтор-1Н-індолу (0,95г, 3ммоль) і азиду натрію (0,59г, 9ммоль) в безводному диметилформаміді перемішують при 60°С протягом 18год., виливають у воду і екстрагують метиленхлоридом. Екстракти об'єднують, промивають водою, сушать над Na2SO4 і концентрують у вакуумі. Отриманий залишок очищають флеш-хроматографією (силікагель, EtOАс/гексан 3/7), отримуючи вказаний в заголовку продукт у вигляді прозорої олії, 0,98г (ви хід 91%), що ідентифікується ЯМР і мас-спектральним аналізами. Приклад 44 Отримання 3-(3-азидопропіл)-1-[(6-хлорімїдазо[2,1-b][1.3]тіазол-5-іл)сульфоніл]-5-фтор-1Н-індолу Перемішений розчин 3-(3-азидопропіл)-5-фтор-1Н-індолу (150мг, 0,53ммоль) в ТГФ обробляють KOt-Bu (0,55мл, 0,55ммоль, 1М в розчині ТГФ) в атмосфері азоту при кімнатній температурі, перемішують протягом 30хв., обробляють 6-хлорімідазо[2,1-b]тіазол-5-сульфонілхлоридом (141мг, 0,55ммоль), перемішують протягом 18год. при кімнатній температурі, гасять 1N HCl і водою і розводять EtOAc. Дві фази розділяють і водну фазу екстрагують EtOAc. Екстракти об'єднують з органічною фазою і сушать над MgSO4 і концентрують у вакуумі. Отриманий залишок очищають флеш-хроматографією (силікагель, EtOАс /гексан 3/7), отримуючи вказаний в заголовку продукт у вигляді жовтої твердої речовини, 203мг (вихід 88%), точка плавлення 84-86°С, що ідентифікується ЯМР і мас-спектральним аналізами. Приклад 45 Отримання 3-[(1-[(6-хлорімідазо[2,1-b][1.3]тіазол-5-іл)сульфоніл]-5-фтор-1Н-індол -3-іл}Іпропан-1-аміну Суміш 3-(3-азидопропіл)-1-[(6-хлорімідазо[2,1-b][1,3]тіазол-5-іл)сульфоніл]-5-фтор-1Н-індолу (180мг, 0,41ммоль) і трифенілфосфіну (161мг, 0,62ммоль) в ТГФ і воді перемішують в атмосфері азоту протягом 24год. при кімнатній температурі і концентрують у вакуумі. Отриманий залишок очищають флешхроматографією (силікагель, EtOAc/2M NH3 в МеОН: 98/2), отримуючи вказаний в заголовку продукт у вигляді не зовсім білої твердої речовини, 132мг (вихід 78%), точка плавлення 139-141°С, що ідентифікується ЯМР і мас-спектральним аналізами. Приклад 46 Порівняльна оцінка спорідненості зв'язування випробуваних сполук з рецептором 5-НТ6 Спорідненість випробуваних сполук до рецептору 5-НТ6 серотоніну оцінюють таким чином. Культивовані клітини HeLa, що експресують людські клоновані рецептори 5-НТ6, збирають і центрифугують при низькій швидкості 1000 х g) протягом 10,0хв. для видалення культуральних середовищ. Зібрані клітини суспендують в половині об'єму свіжого фізіологічного сольового розчину з фосфатним буфером і повторно центрифугують при тій же швидкості. Дану операцію повторюють. Зібрані клітини потім гомогенізують в десяти об'ємах 50мМ Tris.HCl (pH 7,4) і 0,5мМ ЕДТА. Гомогенат центрифугують при 40000 х g протягом 30,0хв. і осад збирають. Отриманий осад в пробірці після центрифугування повторно суспендують в 10 об'ємах буфера Tris.HCl і повторно центрифугують при тій же швидкості. Остаточний осад в пробірці після центрифугування суспендують в невеликому об'ємі буфера Tris.HCl, і вміст білка в тканині визначають в аліквотних об'ємах по 10-25мкл. Альбумін бичачої сироватки використовується як стандарт при визначенні вмісту білка у відповідності до методу, описаного Lowry et al., J. Biol. Chem., 193:265 (1951). Об'єм суспендованих клітинних мембран доводять, отримуючи концентрацію тканинного білка 1,0мг/мл суспензії. Отриману суспензію мембран (концентровану в 10 разів) ділять на алкіквотні об'єми по 1,0мл і зберігають при -70°С до використання в подальших експериментах зв'язування. Експерименти зв'язування проводять в 96-ямкових титрувальних мікропланшетах в загальному об'ємі 200мкл. У кожну ямку додають наступну суміш: 80,0 мкл інкубаційного буфера, виготовленого в буфері 50мМ Tris.HCl (pH 7,4), що містить 10,0мМ MgCl2 і 0,5мМ ЕДТА і 20мкл [3H]-LSD (S.A., 86,0 Ки/ммоль, що продається компанією Amersham Life Science), 3,0нМ. Константа дисоціації, KD [3H]-LSD на людському рецепторі 5-НТ6 серотоніну, становить 2,9нМ, за даними визначення насичення зв'язування при зростаючих концентраціях [3H]LSD. Реакцію запускають остаточним доданням 100,0мкл тканинної суспензії. Неспецифічне зв'язування вимірюють в присутності 10,0мкМ метіотепіну. Випробувані сполуки додають в об'ємі 20,0мкл. Реакції проводять в темряві протягом 120хв. при кімнатній температурі, і в цей час комплекс зв'язаного лїганду-рецептора відфільтровують на 96-ямковому монофільтрі збирачем клітин Packard Filtermate® 196 Harvester. Зв'язаному комплексу, захопленому на диску фільтра, дають висохти на повітрі, і радіоактивність вимірюють лічильником Packard TopCount®, обладнаним шістьма фотопомножувальними детекторами після додання 40,0 мкл сцинтиляційної речовини Microscint®-20 в кожну неглибоку ямку. Чашку монофільтра герметизують термозапаюванням і проводять підрахунок в Packard TopCount®, при ефективності тритію 31,0%. Специфічне зв'язування з рецептором 5-НТ6 визначають як загальну пов'язану радіоактивність мінус кількість, пов'язану в присутності 10,0мкМ неміченого метіотепіну. Зв'язування в присутності змінюваних концентрацій випробуваної сполуки виражене у вигляді процентної частки специфічного зв'язування за відсутності випробуваної сполуки. Результати наносять на графік залежності логарифма % зв'язування від логарифма концентрації випробуваної сполуки. Нелінійний регресійний аналіз точок даних комп'ютерною програмою Prism ® дає значення як ІС50> так і КI випробуваних сполук з 95% довірчими межами. Лінію лінійної регресії точок даних наносять на графік, по якому визначають величину ІС 50 , a величину К I визначають на основі наступного рівняння: КI=IC50/(1+L/KD), де L являє собою концентрацію використаного радіоактивного ліганду, a KD являє собою константу дисоціації ліганду для рецептора, обидві величини, виражені в нМ. Використовуючи даний аналіз, визначають наступні величини Кг і порівнюють з величинами, отриманими репрезентативними сполуками, які, як відомо, демонструють зв'язування з рецептором 5-НТ6. Дані показані нижче в таблиці III. Таблиця III Випробувана сполука (№ експерименту) 1 3 4 5 6 7 8 9 10 11 12 15 16 17 18 20 21 22 23 24 25 30 31 32 33 34 35 36 37 38 39 40 45 Порівняльні приклади Клозапін Локсапін Бромкріптин Зв'язування з 5-НТ6 КI (нМ) 2 19 1 4 5 7 51 5 41 30 2 6 2 14 8 11 12 51 10 10 37 11 13 74 169 31 6 348 4 9 5 1,2 48 Зв'язування з 5-НТ6 КI (нМ) 6,0 41,4 23,0 Метіотепін Міансерин Олазепін 8,3 44,2 19,5 Як видно з викладених вище результатів, сполуки даного винаходу демонструють значну спорідненість до рецептору 5-НТ6.
ДивитисяДодаткова інформація
Назва патенту англійськоюIndolylalkylamine derivatives as ligands of 5-hydroxytryptamine-6, method of production (variants), pharmaceutical composition
Автори англійськоюCOLE DEREK CECIL, STOCK JOSEPH RAYMOND
Назва патенту російськоюПроизводные индолилалкиламина в качестве лиганды 5-гидрокситриптамина-6, способ их получения (варианты), фармацевтическая композиция на их основе
Автори російськоюКоул Дерек Сесил, Сток Джозеф Реймонд
МПК / Мітки
МПК: A61P 25/24, A61K 31/437, A61P 25/16, A61P 25/18, C07D 471/04, A61P 25/28, C07D 513/04, A61P 43/00, A61K 31/429, A61P 25/22, A61K 31/496, A61P 25/00, A61K 31/5377
Мітки: індолілалкіламіну, композиція, основі, фармацевтична, похідні, ліганди, варіанти, 5-гідрокситриптаміну-6, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/15-78536-pokhidni-indolilalkilaminu-yak-ligandi-5-gidroksitriptaminu-6-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні індолілалкіламіну як ліганди 5-гідрокситриптаміну-6, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі</a>
Наступний патент: Каталітичний реактор для переробки синтез-газу
Випадковий патент: Мала вітроенергетична установка












