Інгібітори вірусу гепатиту с
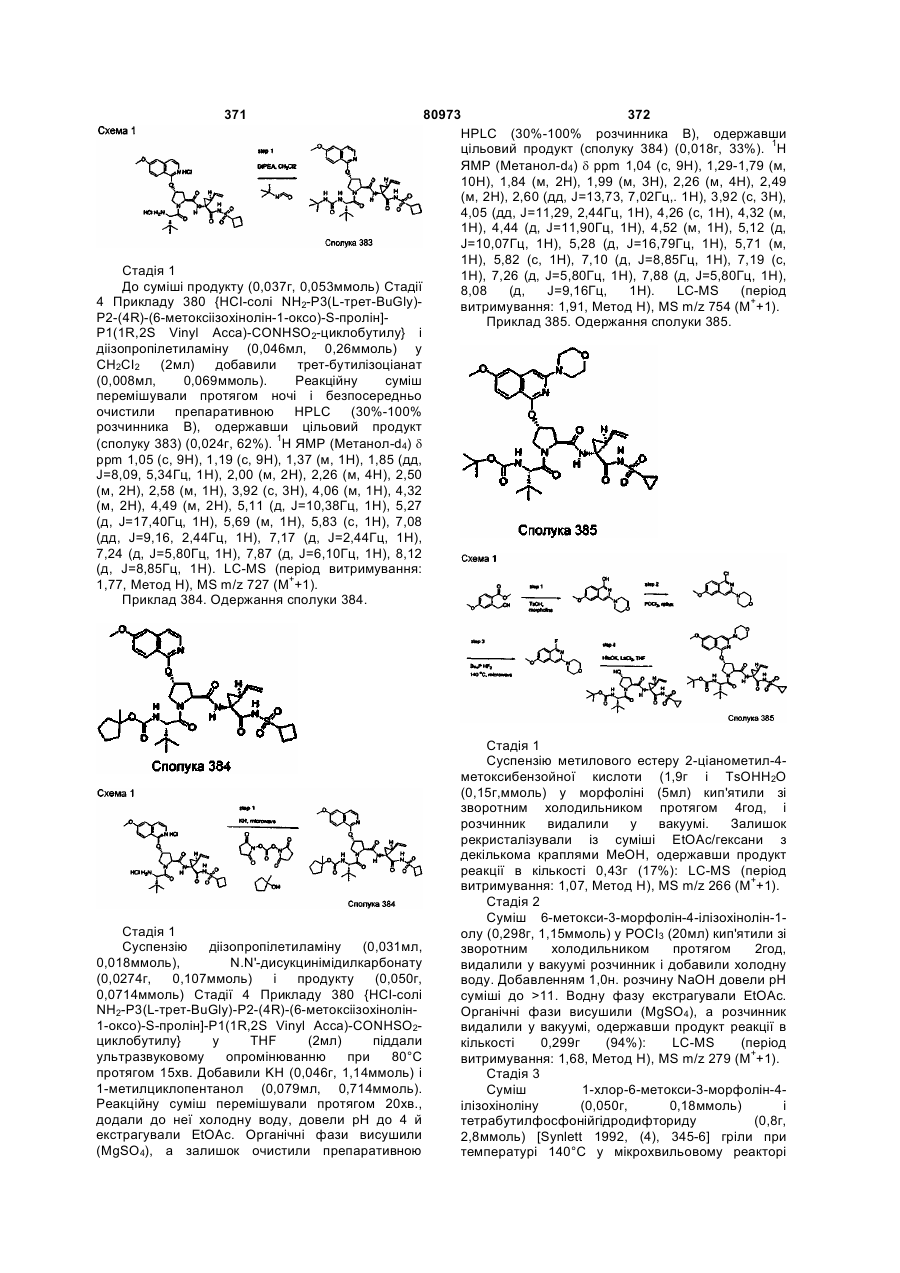
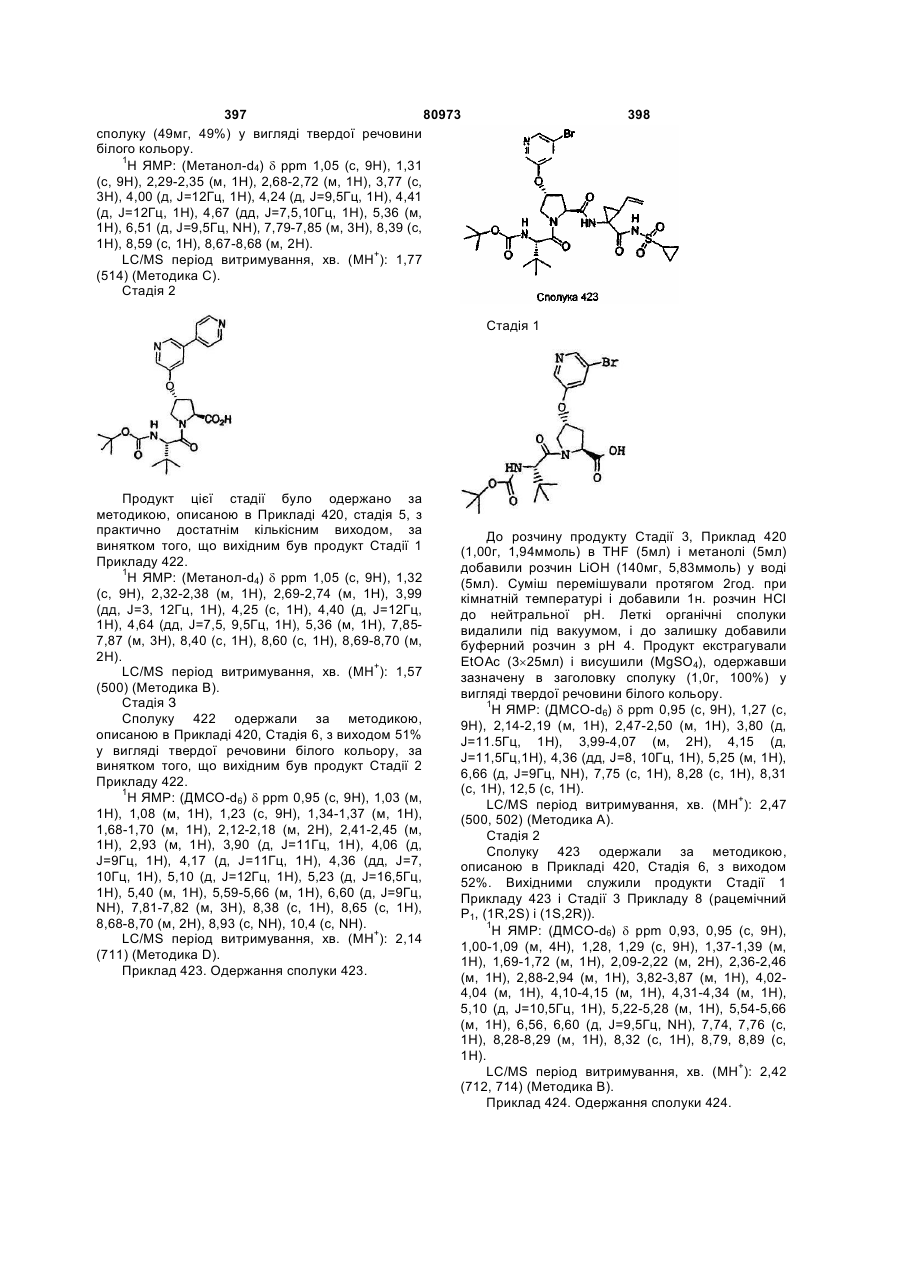
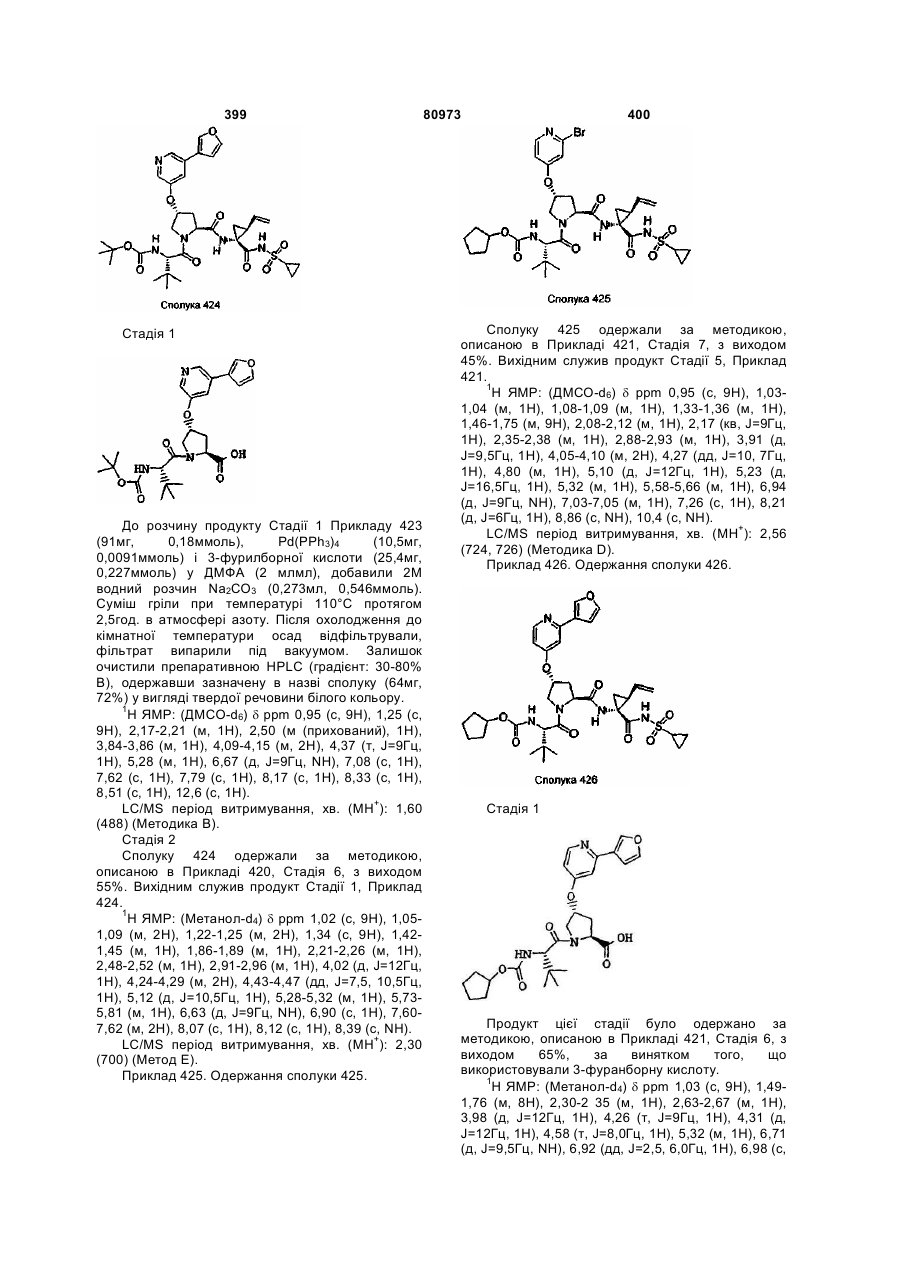
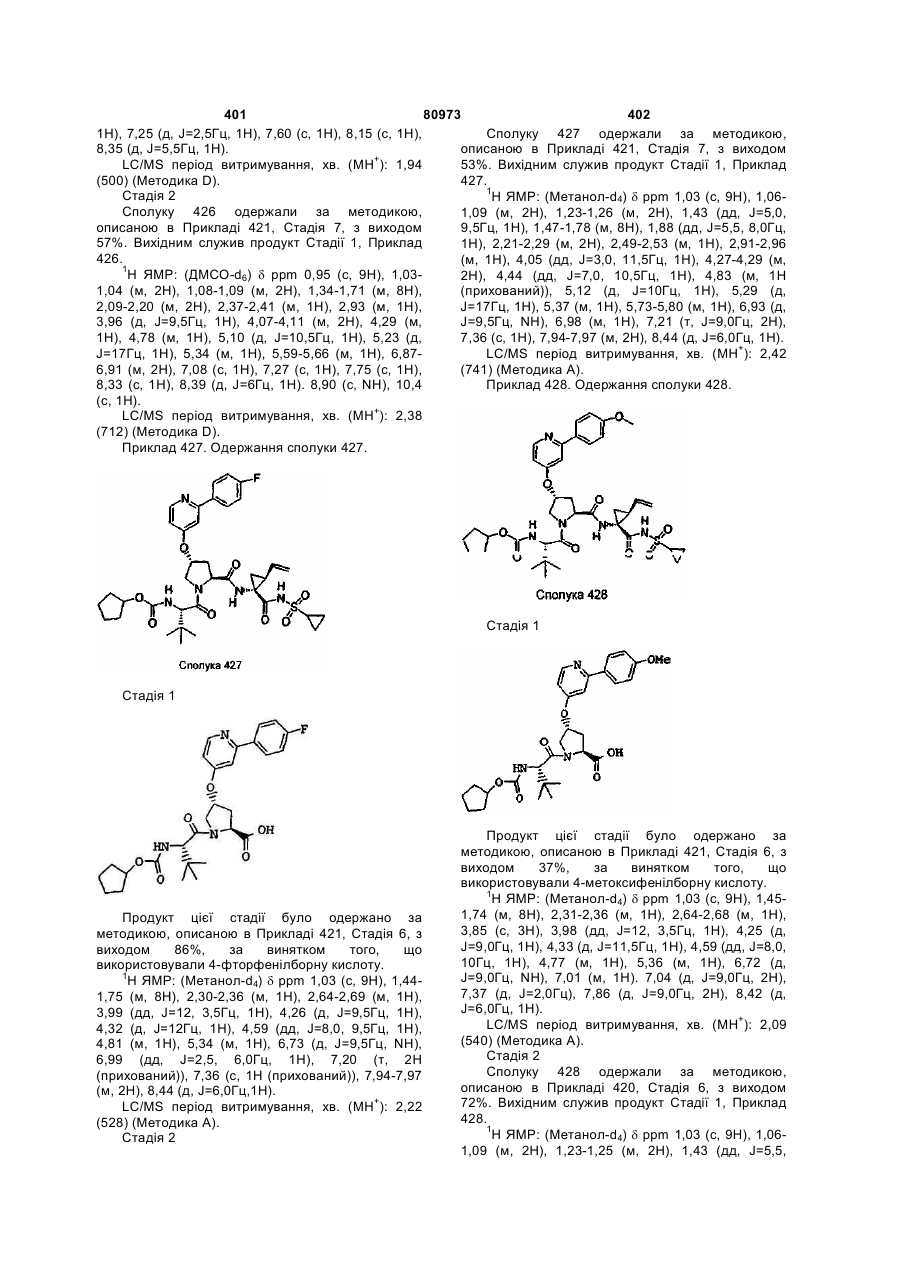
Номер патенту: 80973
Опубліковано: 26.11.2007
Автори: Ванг Ксіанг-Донг Алан, Сун Лі-Кванг, Кампбелл Джеффрі Аллен, Гоод Ендрю Чарльз, Хевавасам Піясена, Чен Ян, Сіт Сінг-Юен, Скола Поль Міхаель, Сін Ни
Формула / Реферат
1. Сполука, яка має формулу
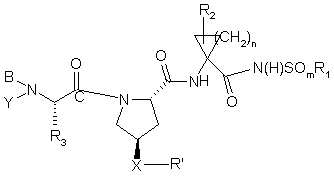 , (І)
, (І)
де:
(a) R1 означає С1-8алкіл, С3-7циклоалкіл або С4-10алкілциклоалкіл;
(b) m приймає значення 1 або 2;
(c) n приймає значення 1 або 2;
(d) R2 означає Н, С1-6алкіл, С2-6алкеніл або С3-7циклоалкіл, кожний з яких є необов'язково заміщеним галоїдом;
(e) R3 означає С1-8алкіл, необов'язково заміщений на галоїд, групи ціано, аміно, С1-6діалкіламіно, С6-10арил, С7-14алкіларил, С1-6алкокси, карбокси, гідрокси, арилокси, С7-14алкіларилокси, С2-6алкіловий естер, С8-15алкілариловий естер; С3-12алкеніл, С3-7циклоалкіл або С4-10алкілциклоалкіл, де циклоалкіл або алкілциклоалкіл є необов'язково заміщеними на групи гідрокси, С1-6алкіл, С2-6алкеніл або С1-6алкокси; або R3 разом з атомом вуглецю, до якого він приєднаний, утворює С3-7циклоалкільну групу, необов'язково заміщену С2-6алкенілом;
(f) Y означає Н, феніл, заміщений нітрогрупою, піридил, заміщений нітрогрупою або С1-6алкіл, який необов'язково має як замісники ціаногрупу, ОН або С3-7циклоалкіл;
за умови, що коли R4 або R5 означає Н, тоді Y означає Н;
(g) В означає Н, С1-6алкіл, R4-(C=О)-, R4О(C=О)-, R4-N(R5)-C(=О)-, R4-N(R5)-C(=S)-, R4SО2- або R4-N(R5)-SO2-;
(h) R4 означає (і) С1-10алкіл, необов'язково заміщений на феніл, карбоксил, С1-6 алканоїл, 1-3 галоїди, гідрокси, -ОС(О)С1-6алкіл, С1-6алкокси, аміно, необов'язково заміщений С1-6алкілом, амідогрупою або (нижчий алкіл)амідогрупою; (іі) С3-7циклоалкіл, С3-7циклоалкокси або С4-10алкілциклоалкіл, кожний з яких є необов'язково заміщеним групою гідрокси, карбоксилом, (С1-6алкокси)карбонілом, аміно, необов'язково заміщеним С1-6алкілом, амідогрупою або (нижчий алкіл)амідогрупою; (ііі) С6-10арил або С7-16арилалкіл, кожний з яких є необов'язково заміщеним С1-6алкілом, галоїдом, групами нітро, гідрокси, амідо, (нижчий алкіл)амідо або аміногрупою, необов'язково заміщеною С1-6алкілом; (iv) Het; (v) біцикло(1,1,1)пентан; або (vi) -С(О)ОС1-6алкіл, С2-6алкеніл або С2-6алкініл;
(і) R5 означає Н; С1-6алкіл, необов'язково заміщений 1-3 галоїдами; або С1-6 алкокси, за умови, що R4 означає С1-10алкіл;
(j) Х означає О, S, - SO, SО2, OCH2, CH2O або NH;
(k) R' означає Het; або С6-10арил або С7-14алкіларил, необов'язково заміщений на Rа; і
(l) Rа означає С1-6алкіл, С3-7циклоалкіл, С1-6алкокси, С3-7циклоалкокси, галоїд-С1-6алкіл, СF3, моно- або дигалоїд-С1-6 алкокси, ціано, галоїд, тіоалкіл, гідрокси, алканоїл, NO2, SH, аміно, С1-6алкіламіно, ді-(С1-6)алкіламіно, ді-(С1-6)алкіламід, карбоксил, (С1-6)карбоксіестер, С1-6алкілсульфон, С1-6алкілсульфонамід, ди-(С1-6)алкіл(алкоксі)амін, С6-10арил, С7-14алкіларил або 5-7-членний моноциклічний гетероцикл;
за умови, що X-R' не означає сполуку
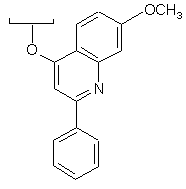 ;
;
або її фармацевтично прийнятні сіль, сольват чи проліки.
2. Сполука за п. 1, яка відрізняється тим, що R1 означає С3-7циклоалкіл.
3. Сполука за п. 1, яка відрізняється тим, що R2 означає С1-6алкіл, С2-6алкеніл або С3-7циклоалкіл.
4. Сполука за п. 3, яка відрізняється тим, що R2 означає С2-6алкеніл.
5. Сполука за п. 1, яка відрізняється тим, що R3 означає С1-8алкіл, необов'язково заміщений на С6арил, С1-6алкокси, карбокси, гідрокси, арилокси, С7-14алкіларилокси, С2-6алкіловий естер, С8-15алкілариловий естер; С3-12алкеніл, С3-7циклоалкіл або С4-10алкілциклоалкіл.
6. Сполука за п. 5, яка відрізняється тим, що R3 означає С1-8алкіл, необов'язково заміщений на С1-6алкокси або С3-7циклоалкіл.
7. Сполука за п. 1, яка відрізняється тим, що Y означає Н.
8. Сполука за п. 1, яка відрізняється тим, що В означає Н, С1-6алкіл, R4-(C=O)-, R4O-(С=O)-, R4-N(R5)-C(=O)-, R4-N(R5)-C(=S)-, R4SO2- або R4-N(R5)-SO2-.
9. Сполука за п. 8, яка відрізняється тим, що В означає R4-(C=O)-, R4O-(C=O)- або R4-N(R5)-C(=O)-.
10. Сполука за п. 9, яка відрізняється тим, що В означає R4O-(C=O)-, a R4 означає С1-6алкіл.
11. Сполука за п. 1, яка відрізняється тим, що R4 означає: (і) С1-10алкіл, необов'язково заміщений на феніл, карбоксил, С1-6алканоїл, 1-3 галоїди, гідрокси, С1-6алкокси; (іі) С3-7циклоалкіл, С3-7циклоалкокси або С4-10алкілциклоалкіл; або (ііі) С6-10арил або С7-16арилалкіл, кожний з яких є необов'язково заміщеним С1-6 алкілом або галоїдом.
12. Сполука за п. 11, яка відрізняється тим, що R4 означає: (і) С1-10алкіл, необов'язково заміщений на 1-3 галоїди або на С1-6алкокси; або (іі) С3-7циклоалкіл чи С4-10алкілциклоалкіл.
13. Сполука за п. 1, яка відрізняється тим, що R5 означає Н або С1-6алкіл, необов'язково заміщений 1-3 галоїдами.
14. Сполука за п. 13, яка відрізняється тим, що R5 означає Н.
15. Сполука за п. 1, яка відрізняється тим, що Х означає О або NH.
16. Сполука за п. 1, яка відрізняється тим, що R' означає Het або С6-10арил, необов'язково заміщений на Ra.
17. Сполука за п. 16, яка відрізняється тим, що R' означає Het.
18. Сполука за п. 1, яка відрізняється тим, що гетероцикл містить в кільці 1 або 2 атоми азоту і, необов'язково, атом сірки або кисню.
19. Сполука за п. 18, яка відрізняється тим, що гетероцикл є заміщеним, принаймні, одним із таких замісників: С1-6алкілом, С1-6алкокси, галоїдом, С6-10арилом, С7-14алкіларилом або 5-7 членним моноциклічним гетероциклом.
20. Сполука за п. 1, яка відрізняється тим, що R3 означає С1-6алкіл, С3-7циклоалкіл, С1-6алкокси, галоїд-С1-6алкіл, галоїд, аміно, С6арил або 5-7-членний моноциклічний гетероцикл.
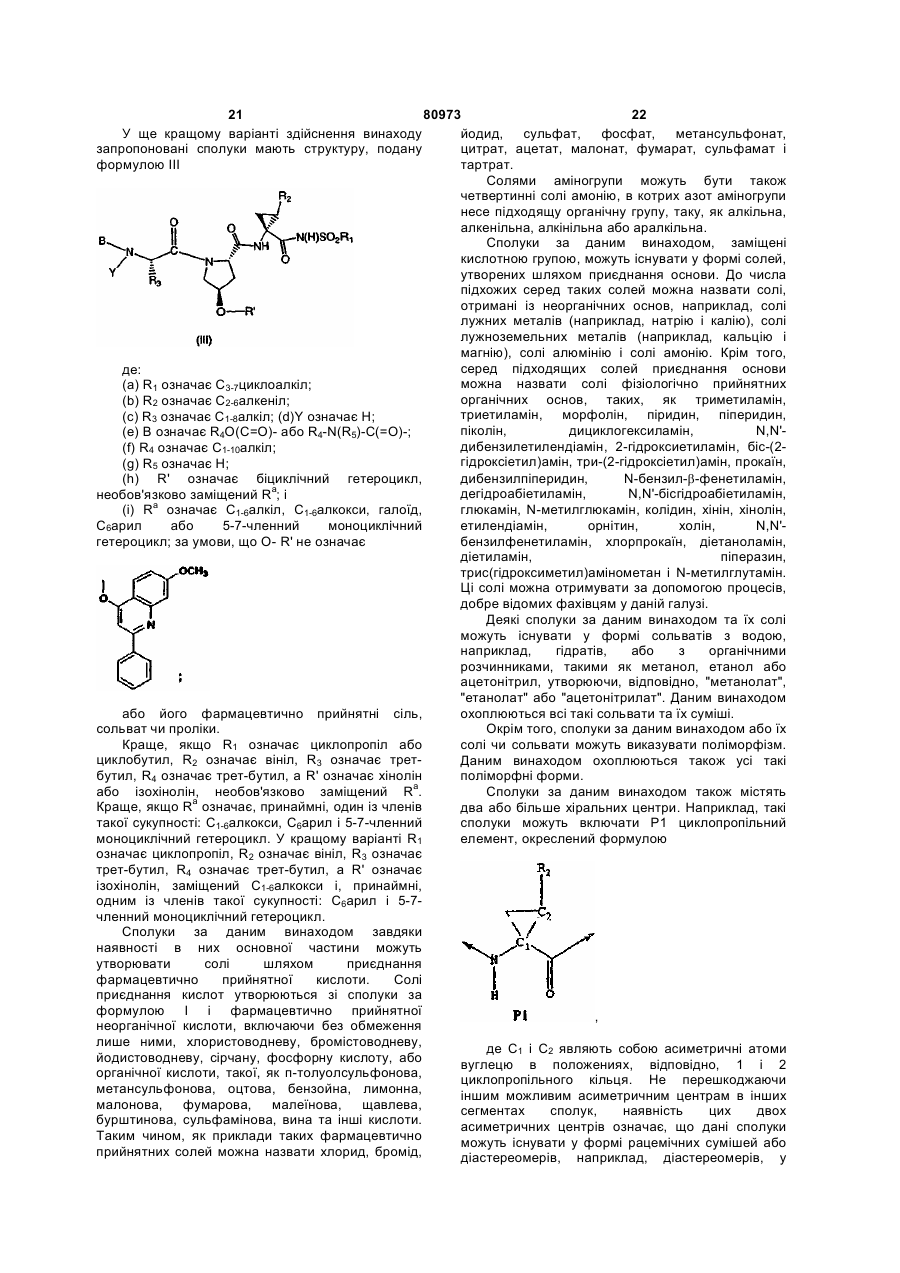
21. Сполука, яка має формулу
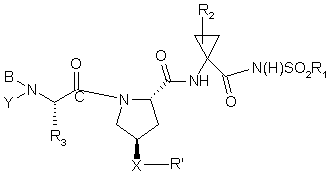 , (II)
, (II)
де
(a) R1 означає С3-7циклоалкіл;
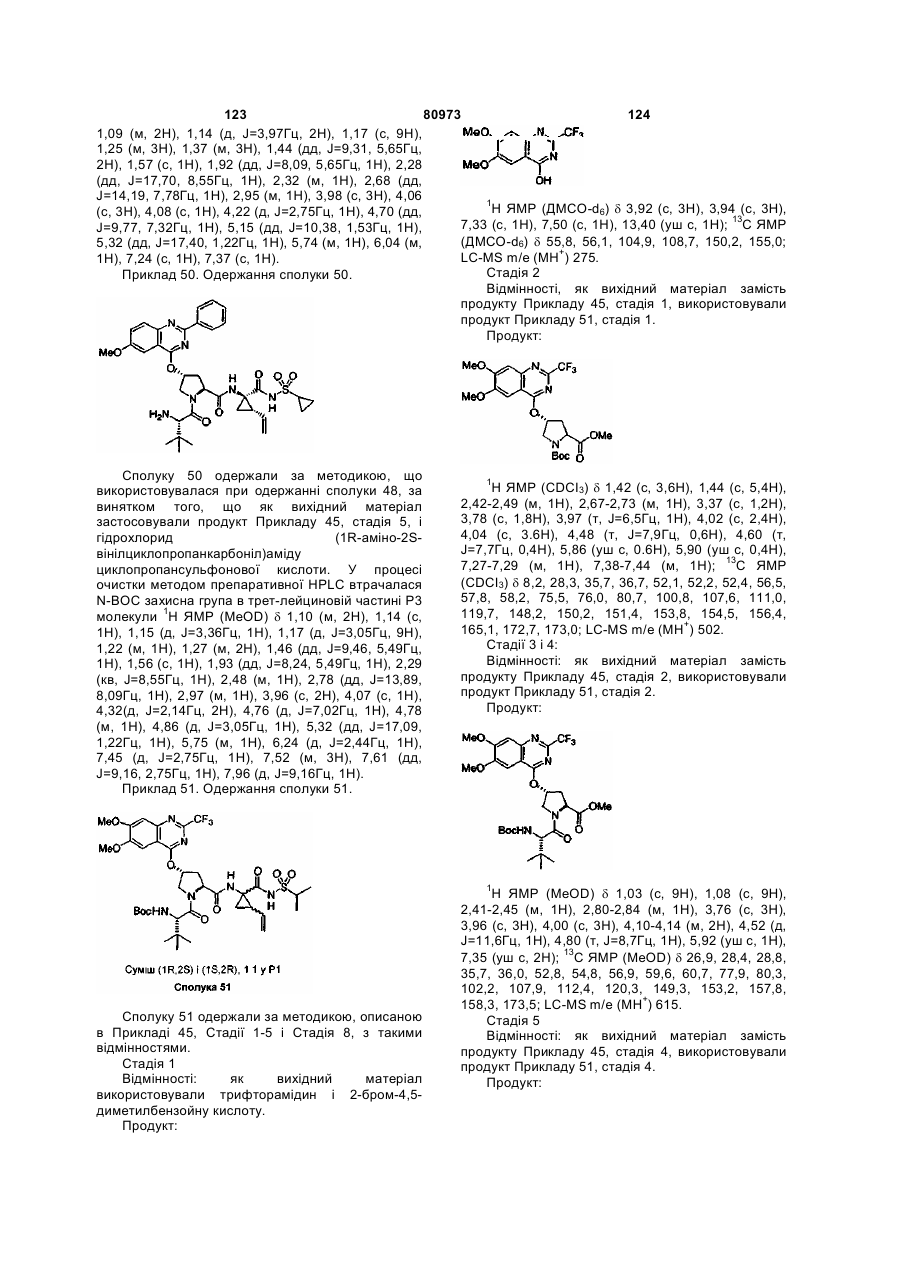
(b) R2 означає С1-6алкіл, С2-6алкеніл або С3-7циклоалкіл;
(c) R3 означає С1-6алкіл, необов'язково заміщений на С6арил, С1-6алкокси, групи карбокси, гідрокси, арилокси, С7-14алкіларилокси, С2-6алкіловий естер, C8-15алкілариловий естер; С3-12алкеніл, С3-7циклоалкіл або С4-10алкілциклоалкіл;
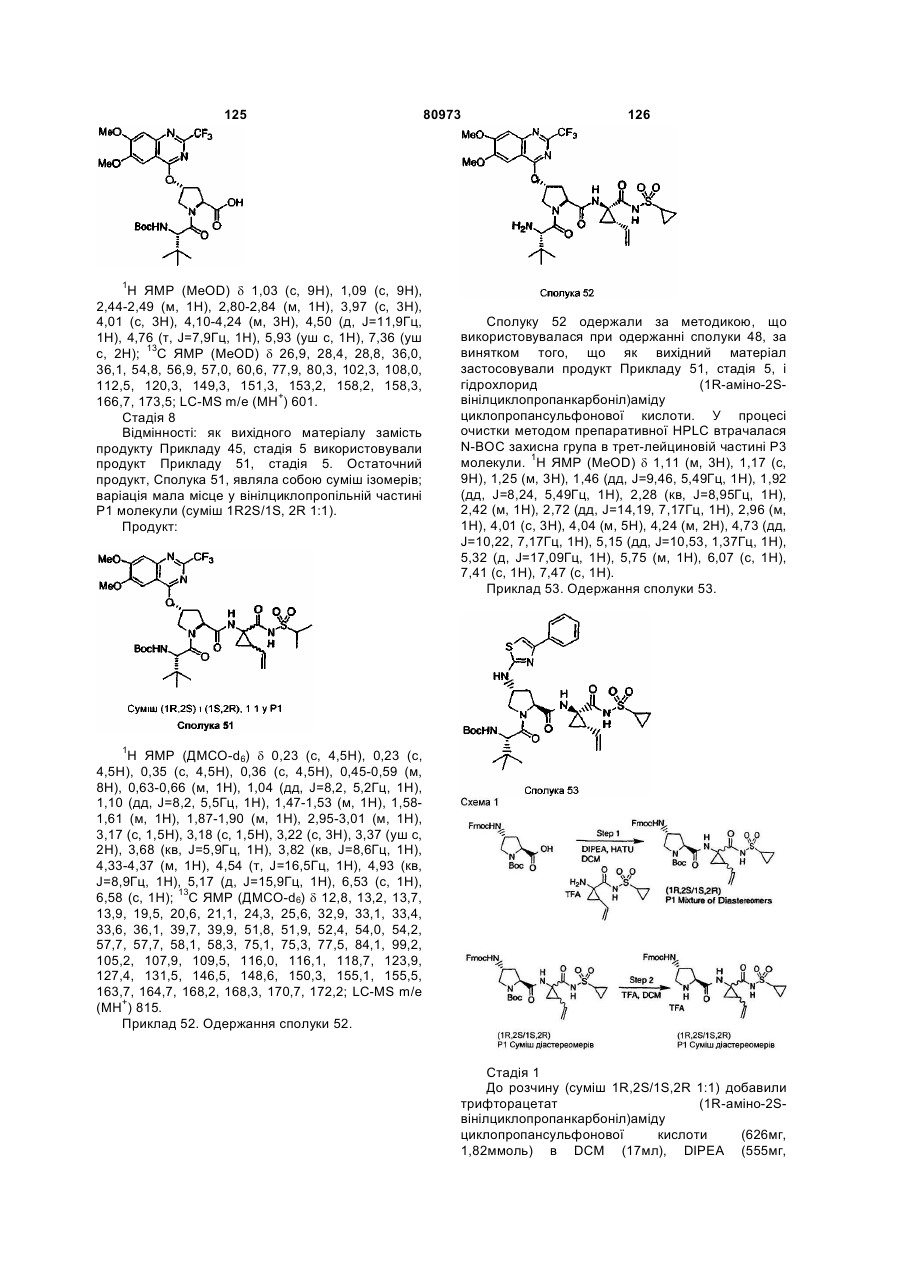
(d) Y означає Н;
(e) В означає Н, С1-6алкіл, R4-(C=O)-, R4O(C=O)-, R4-N(R5)-C(=O)-, R4-N(R5)-C(=S)-, R4SO2- або R4-N(R5)-SO2-;
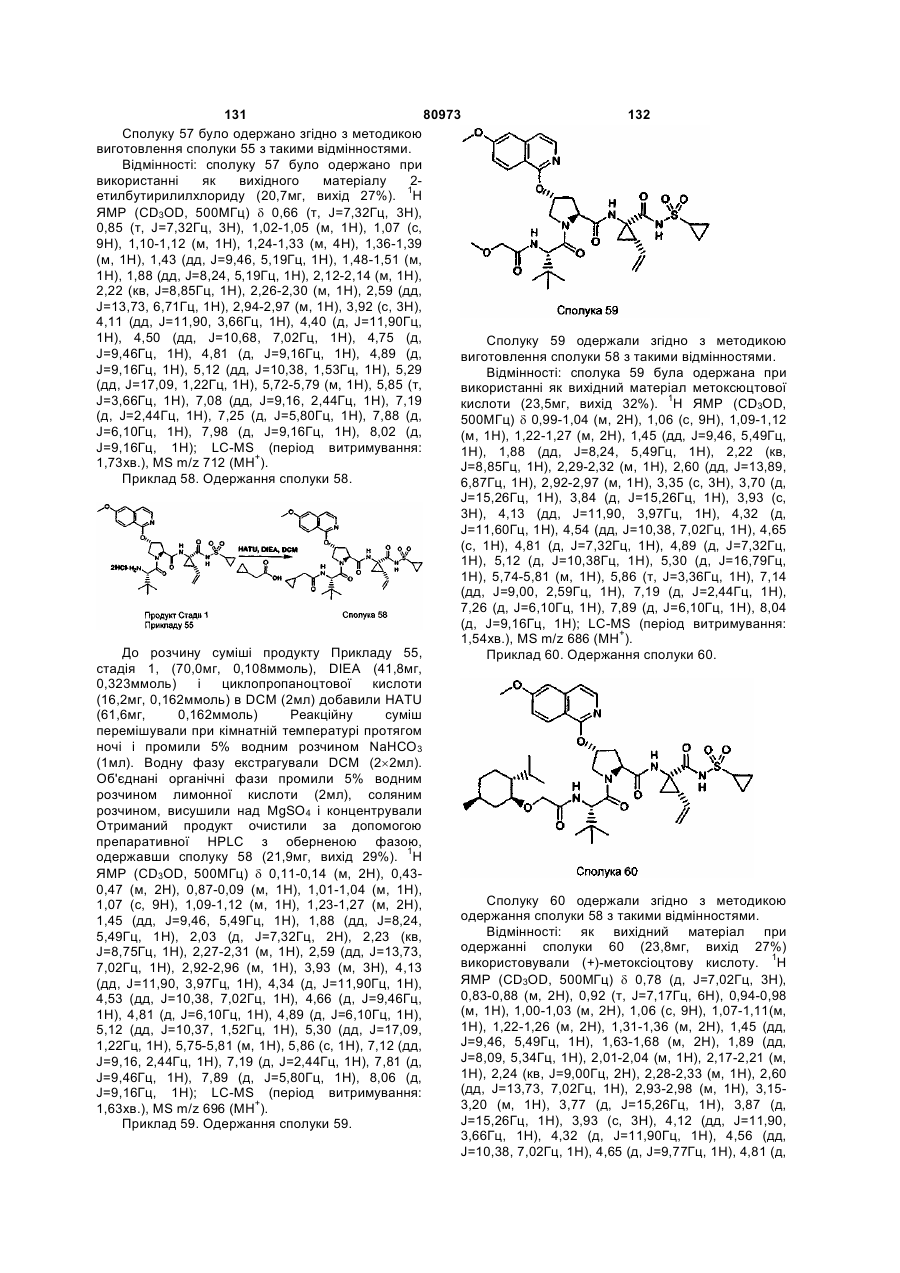
(f) R4 означає (і) С1-10алкіл, необов'язково заміщений на феніл, карбоксил, С1-6алканоїл, 1-3 галоїди, групи гідрокси, С1-6алкокси; (іі) С3-7циклоалкіл, С3-7циклоалкокси або С4-10алкілциклоалкіл; або (ііі) С6-10арил чи С7-16арилалкіл, кожний з яких є необов'язково заміщеним на С1-6алкіл або галоїд;
(g) R5 означає Н; С1-6алкіл, необов'язково заміщений 1-3 галоїдами;
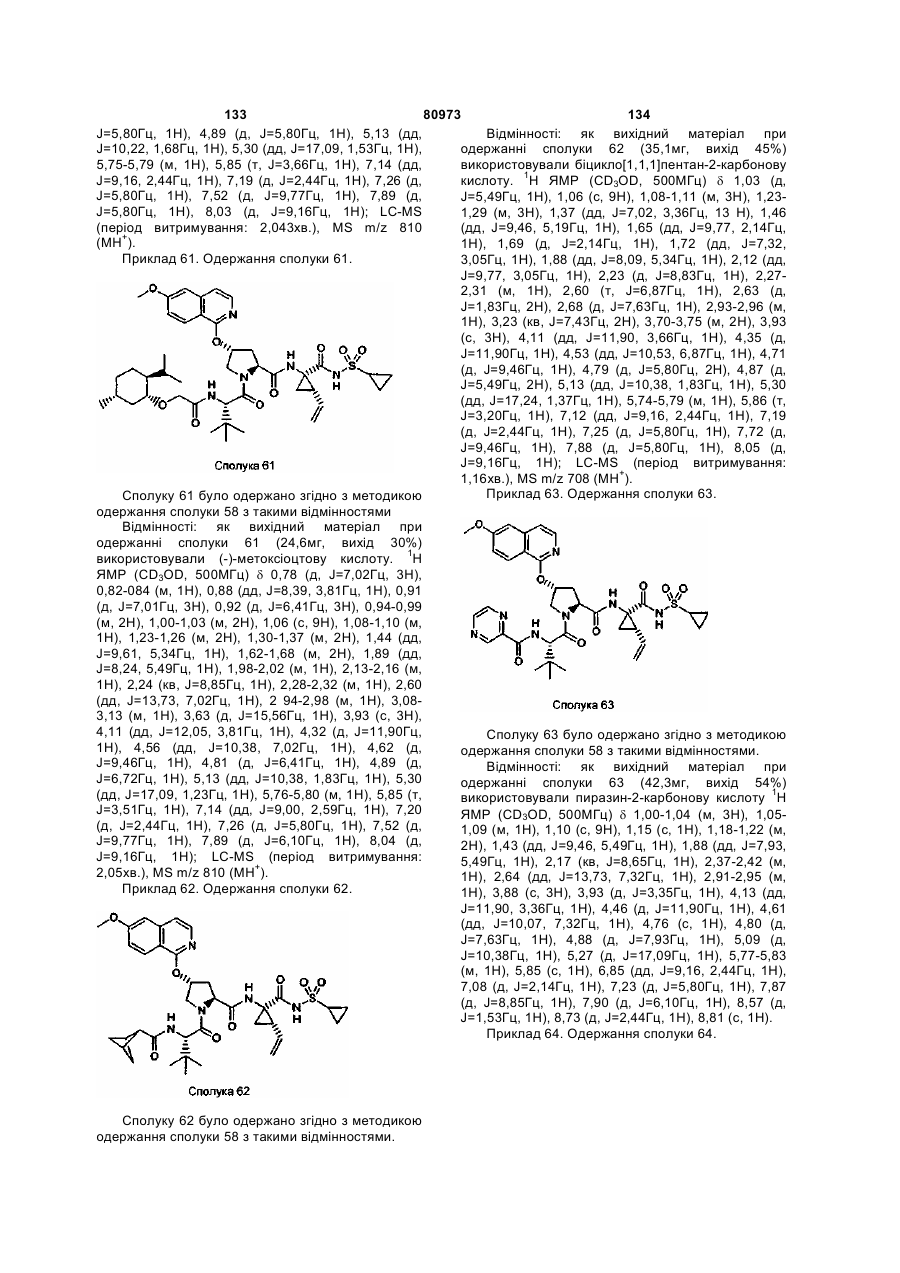
(h) X означає О або NH;
(і) R' означає Het або С6-10 арил, необов'язково заміщений на R3; і
(j) Ra означає С1-6алкіл, С3-7циклоалкіл, С1-6алкокси, галоїд-С1-6алкіл, галоїд, аміно, С6арил або 5-7-членний моноциклічний гетероцикл;
за умови, що Xa-R' не є
 ;
;
або її фармацевтично прийнятні сіль, сольват чи проліки.
22. Сполука за п. 21, яка відрізняється тим, що R' означає біциклічний гетероцикл.
23. Сполука за п. 22, яка відрізняється тим, що гетероцикл містить в кільці 1 або 2 атоми азоту і, необов'язково, атом сірки або кисню.
24. Сполука за п. 22, яка відрізняється тим, що гетероцикл заміщений, принаймні, одним із таких замісників: С1-6алкілом, С1-6алкокси, галоїдом, С6арилом і 5-7-членним моноциклічним гетероциклом.
25. Сполука за п. 21, яка відрізняється тим, що R' означає біциклічний гетероцикл, що містить 1 атом азоту, і є заміщеним метоксигрупою і, принаймні, одним із таких замісників: С6арилом і 5-7-членним моноциклічним гетероциклом.
26. Сполука за п. 21, яка відрізняється тим, що R' означає моноциклічний гетероцикл.
27. Сполука за п. 26, яка відрізняється тим, що гетероцикл містить в кільці 1 або 2 атоми азоту і, необов'язково, атом сірки або атом кисню.
28. Сполука за п. 26, яка відрізняється тим, що гетероцикл заміщений, принаймні, одним із таких замісників: С1-6алкілом, С1-6алкокси, галоїдом, С6-10арилом, С7-14алкіларилом або 5-7-членним моноциклічним гетероциклом.
29. Сполука за п. 21, яка відрізняється тим, що R' означає моноциклічний гетероцикл, що містить 1 або 2 атоми азоту, і є заміщеним метоксигрупою і, принаймні, одним із таких замісників: С6арилом і 5-7-членним моноцикпічним гетероциклом.
30. Сполука, яка має формулу
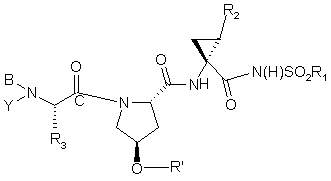 , (III)
, (III)
де
(a) R1 означає С3-7циклоалкіл;
(b) R2 означає С2-6алкеніл;
(c) R3 означає С1-6алкіл;
(d) Y означає Н;
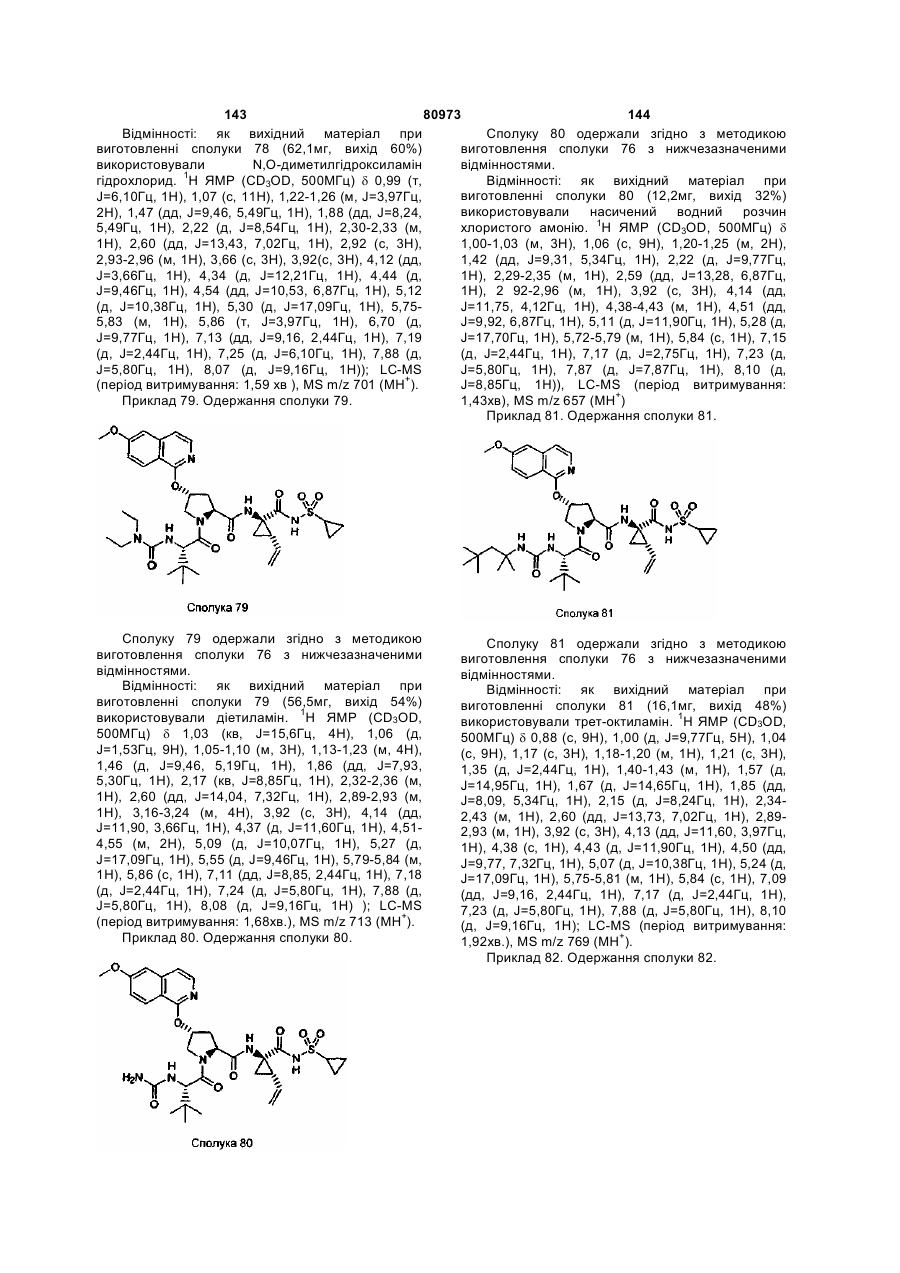
(e) В означає R4O(C=O)- або R4-N(R5)-C(=O)-;
(f) R4 означає С1-10алкіл;
(g) R5 означає Н;
(h) R' означає біциклічний гетероцикл, необов'язково заміщений Ra; і
(і) Ra означає С1-6алкіл, С1-6алкокси, галоїд, С6арил або 5-7-членний моноциклічний гетероцикл; за умови, що O-R' не є
 ;
;
або її фармацевтично прийнятні сіль, сольват або проліки.
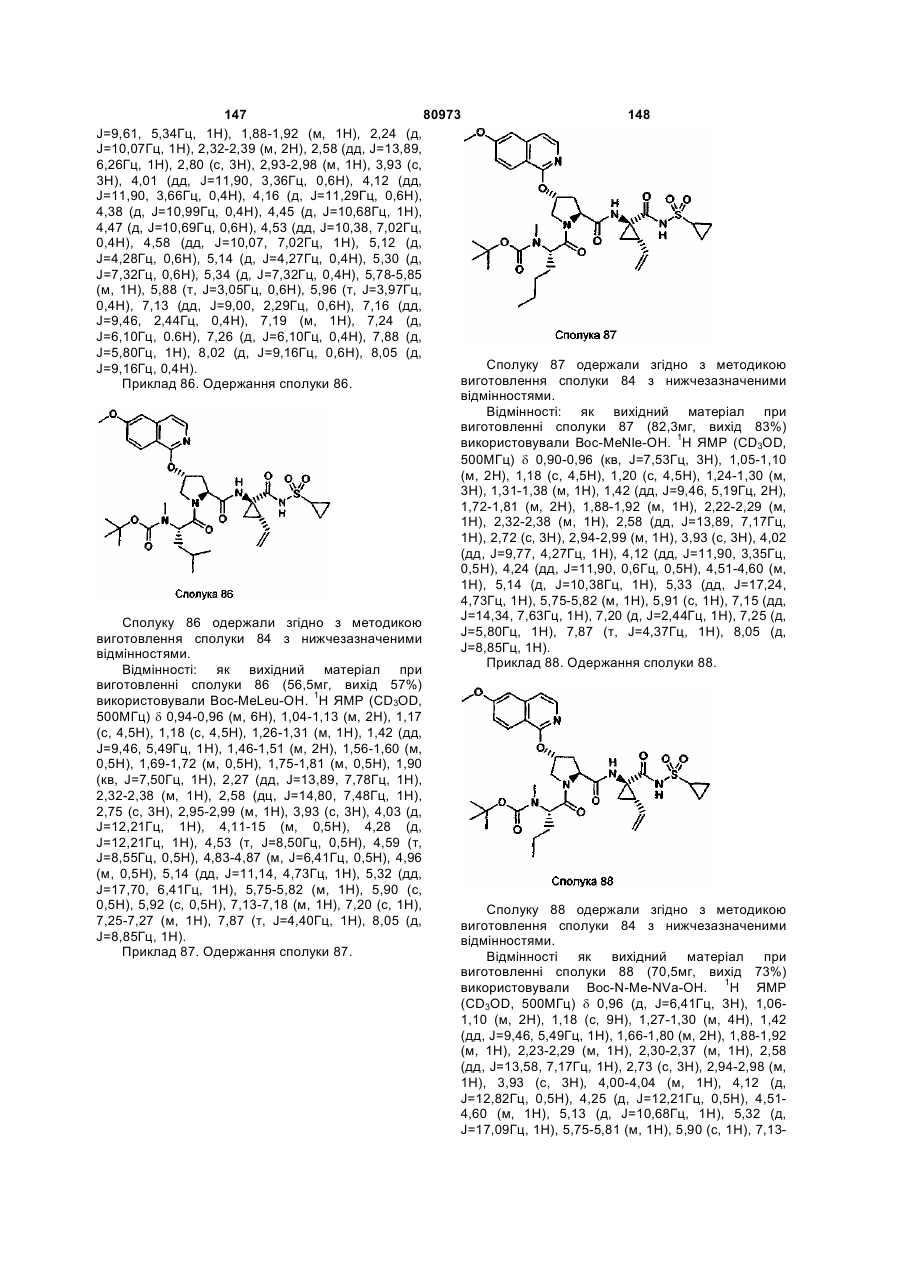
31. Сполука за п. 30, яка відрізняється тим, що R1 означає циклопропіл або циклобутил.
32. Сполука за п. 30, яка відрізняється тим, що R2 означає вініл.
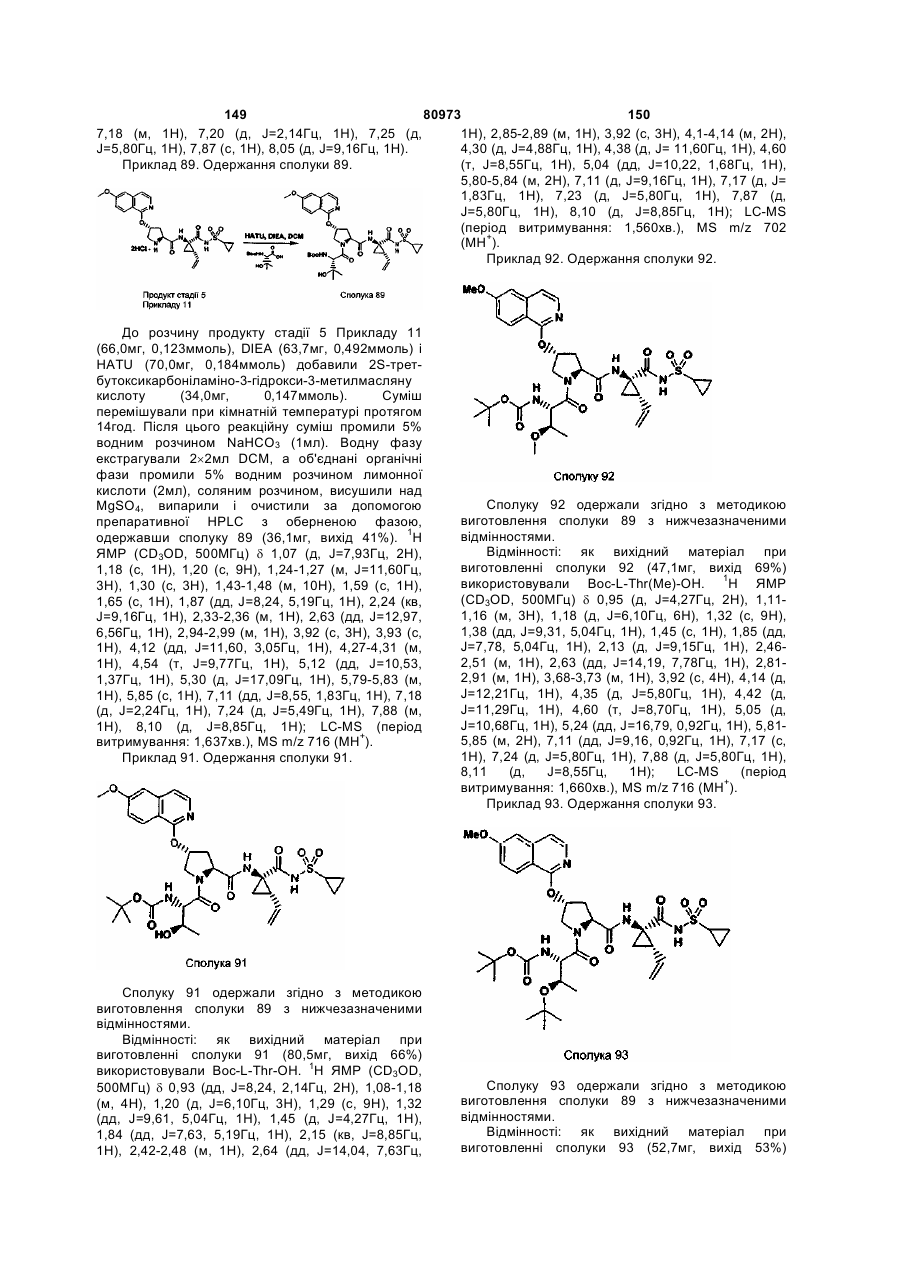
33. Сполука за п. 30, яка відрізняється тим, що R3 означає трет-бутил.
34. Сполука за п. 30, яка відрізняється тим, що R4 означає трет-бутил.
35. Сполука за п. 30, яка відрізняється тим, що R' означає хінолін або ізохінолін, необов'язково заміщений на Ra.
36. Сполука за п. 30, яка відрізняється тим, що R1 означає циклопропіл, R2 означає вініл, R3 означає трет-бутил, R4 означає трет-бутил і R' означає ізохінолін, заміщений на Ra.
37. Сполука за п. 36, яка відрізняється тим, що Ra означає С1-6алкокси.
38. Сполука за п. 37, яка відрізняється тим, що до значень Ra, крім того, входять, принаймні, С6арил і/або 5-7-членний моноциклічний гетероцикл.
39. Спосіб лікування HCV-інфікованого пацієнта, який включає у себе введення пацієнту терапевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятних солі, сольвату чи проліків.
40. Спосіб інгібування NS3-протеази HCV-вірусу, який включає у себе введення пацієнту, що потребує цього, терапевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятних солі, сольвату чи проліків.
41. Композиція, яка містить сполуку за п. 1 або її фармацевтично прийнятні сіль, сольват чи проліки і фармацевтично прийнятний носій.
42. Композиція за п. 41, яка містить, крім того, додатковий імуномодуляторний засіб.
43. Композиція за п. 42, яка відрізняється тим, що додатковий імуномодуляторний засіб вибирають із групи, що складається із ![]() ,
, ![]() і
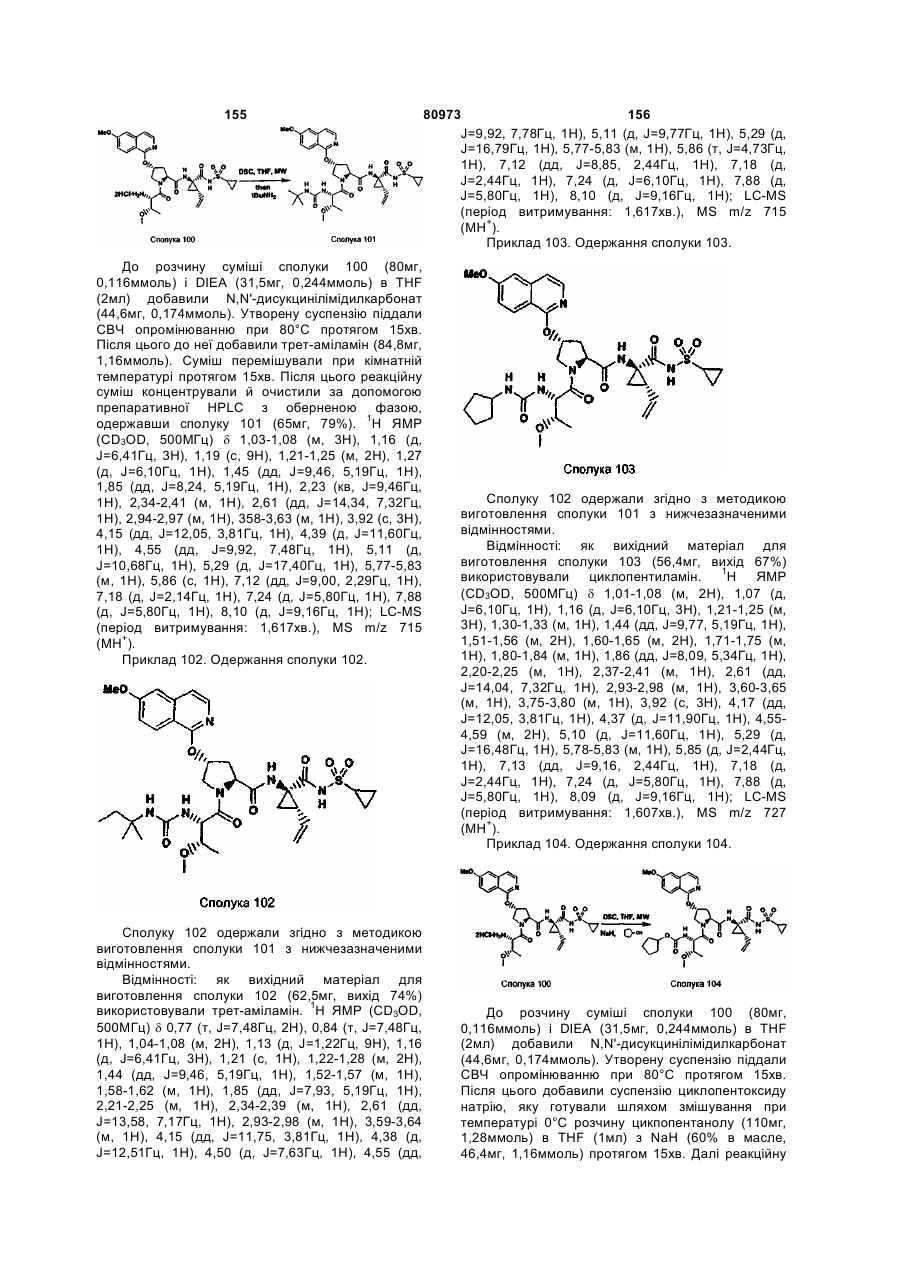
і ![]() .
.
44. Композиція за п. 41, яка, крім того, містить антивірусний агент.
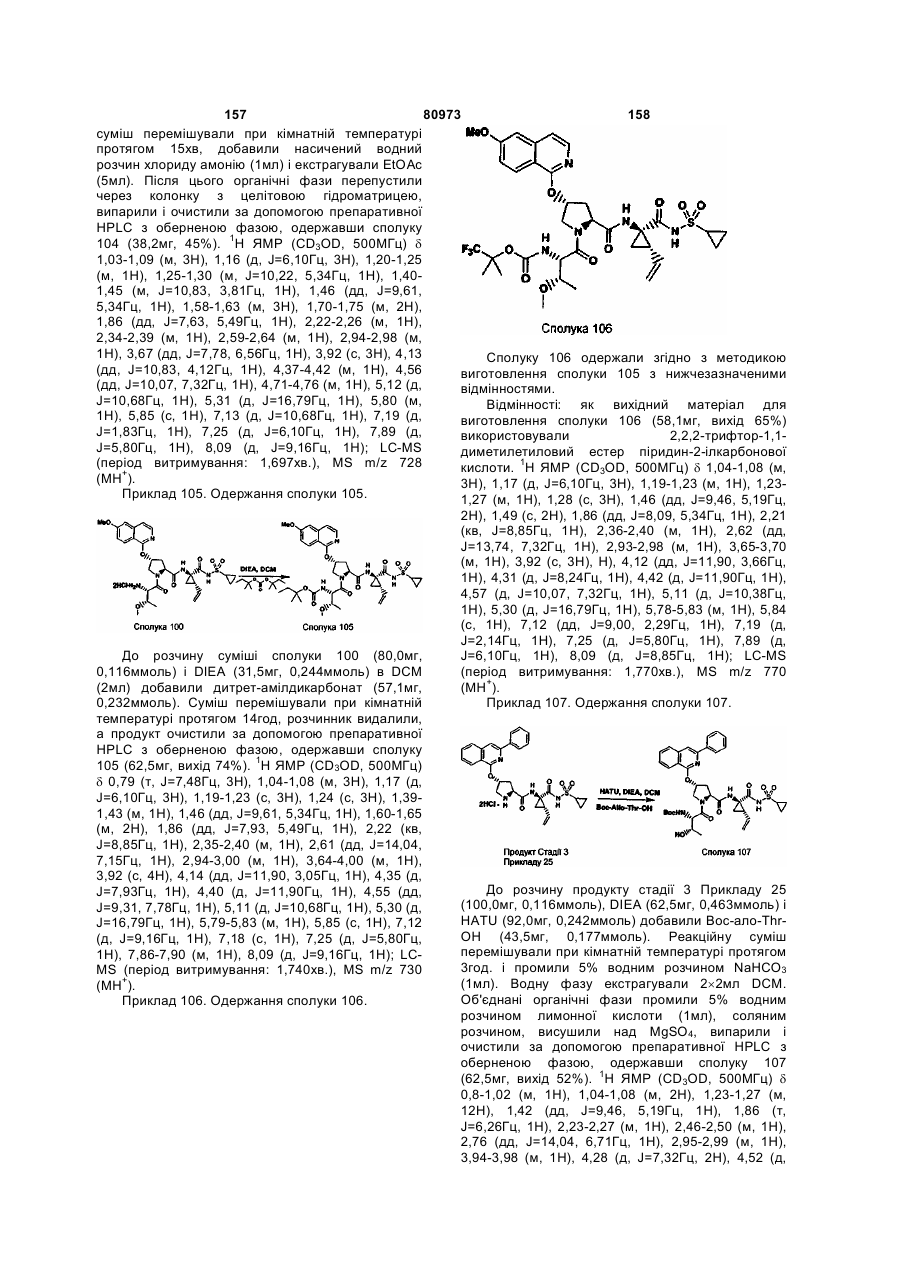
45. Композиція за п. 44, яка відрізняється тим, що антивірусний агент вибирають із групи, що складається із рибавірину й амантадину.
46. Композиція за п. 41, яка, крім того, містить інгібітор HCV-протеази, відмінний від сполуки за п. 1.
47. Композиція за п. 46, яка, крім того, містить інгібітор мішені в життєвому циклі HCV, відмінний від NS3-протеази HCV-вірусу.
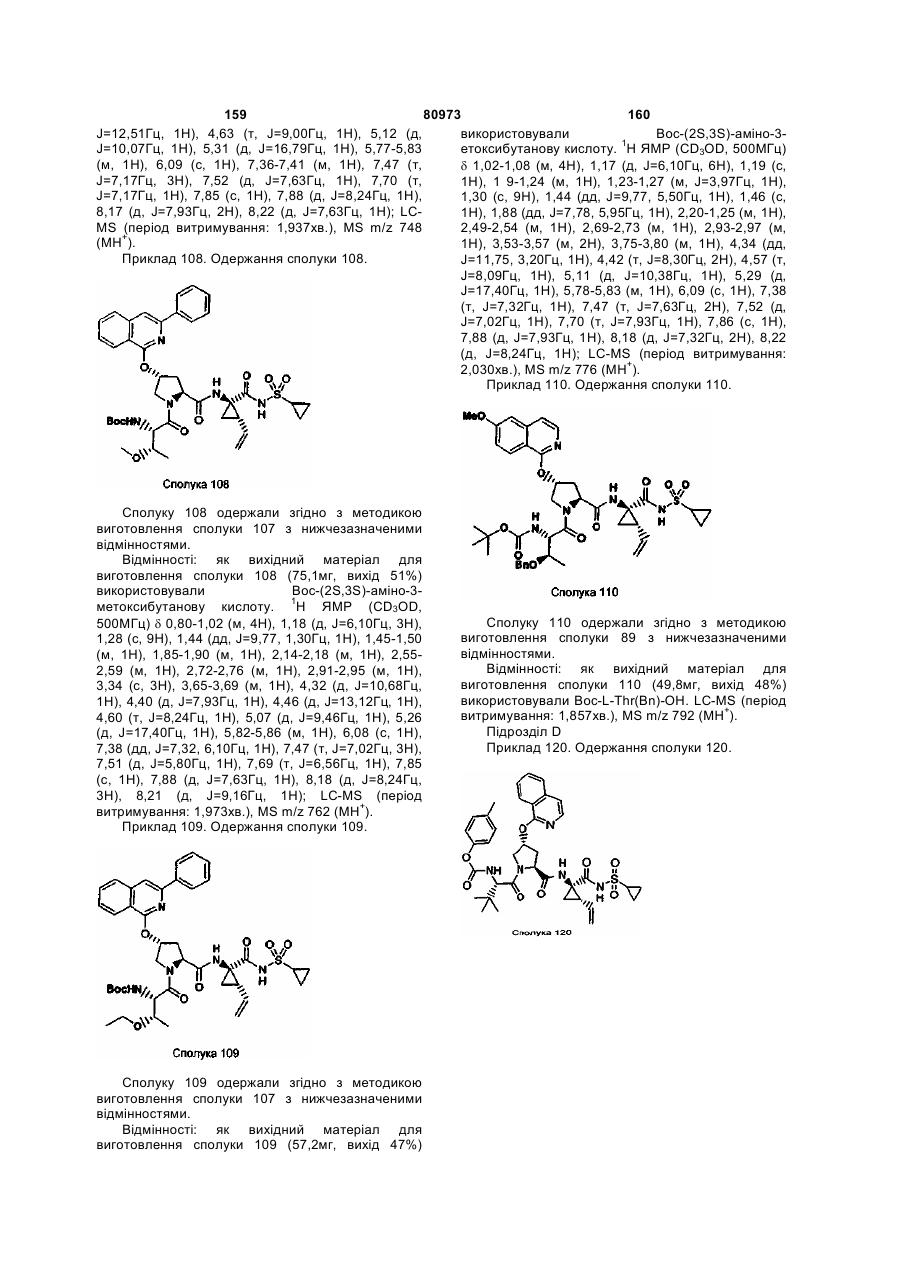
48. Композиція за п. 47, яка відрізняється тим, що іншу мішень вибирають із групи, що складається із гелікази, полімерази, металопротеази та їх сумішей.
49. Композиція за п. 41, яка відрізняється тим, що її застосовують у виготовленні препарату для лікування пацієнта, інфікованого вірусом гепатиту С.
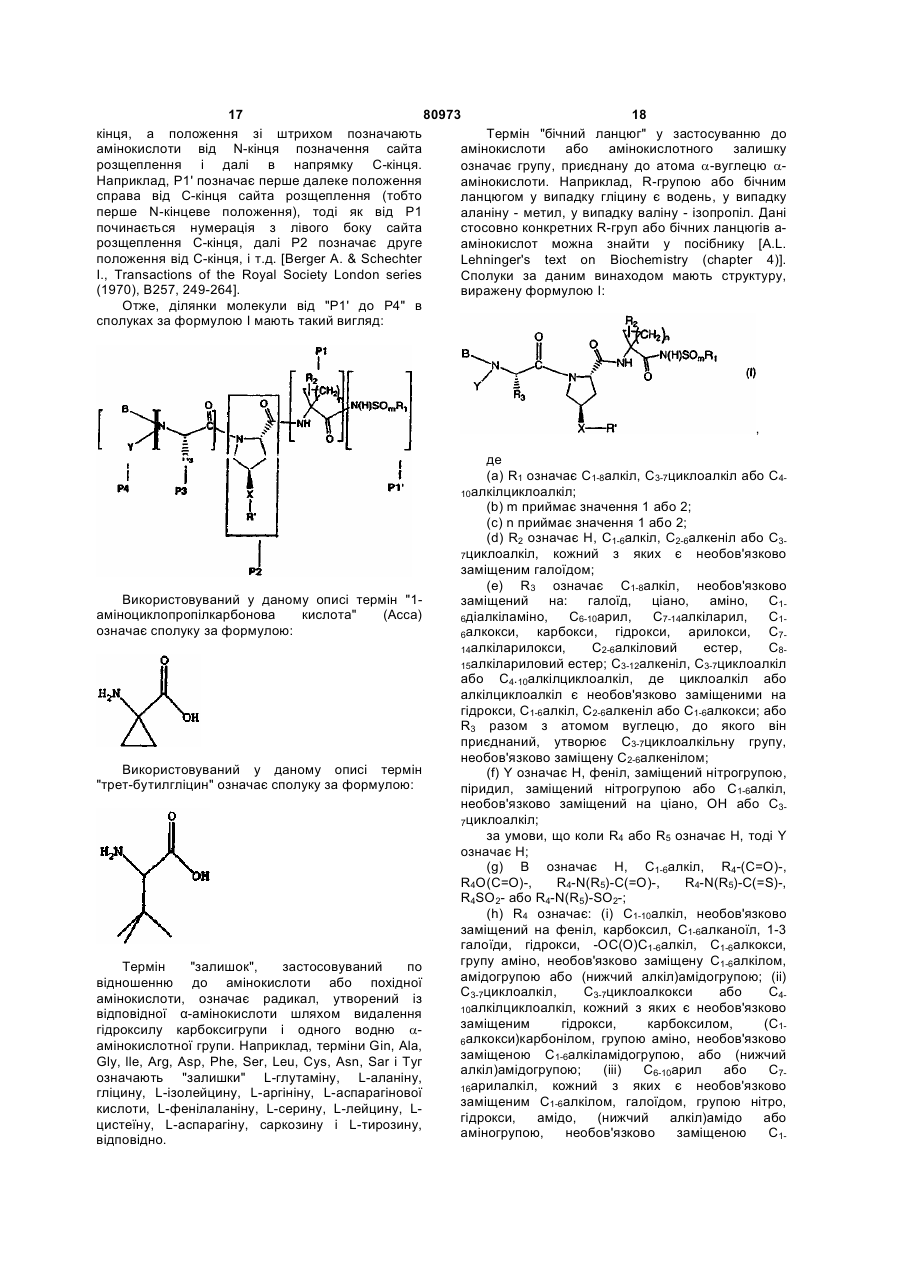
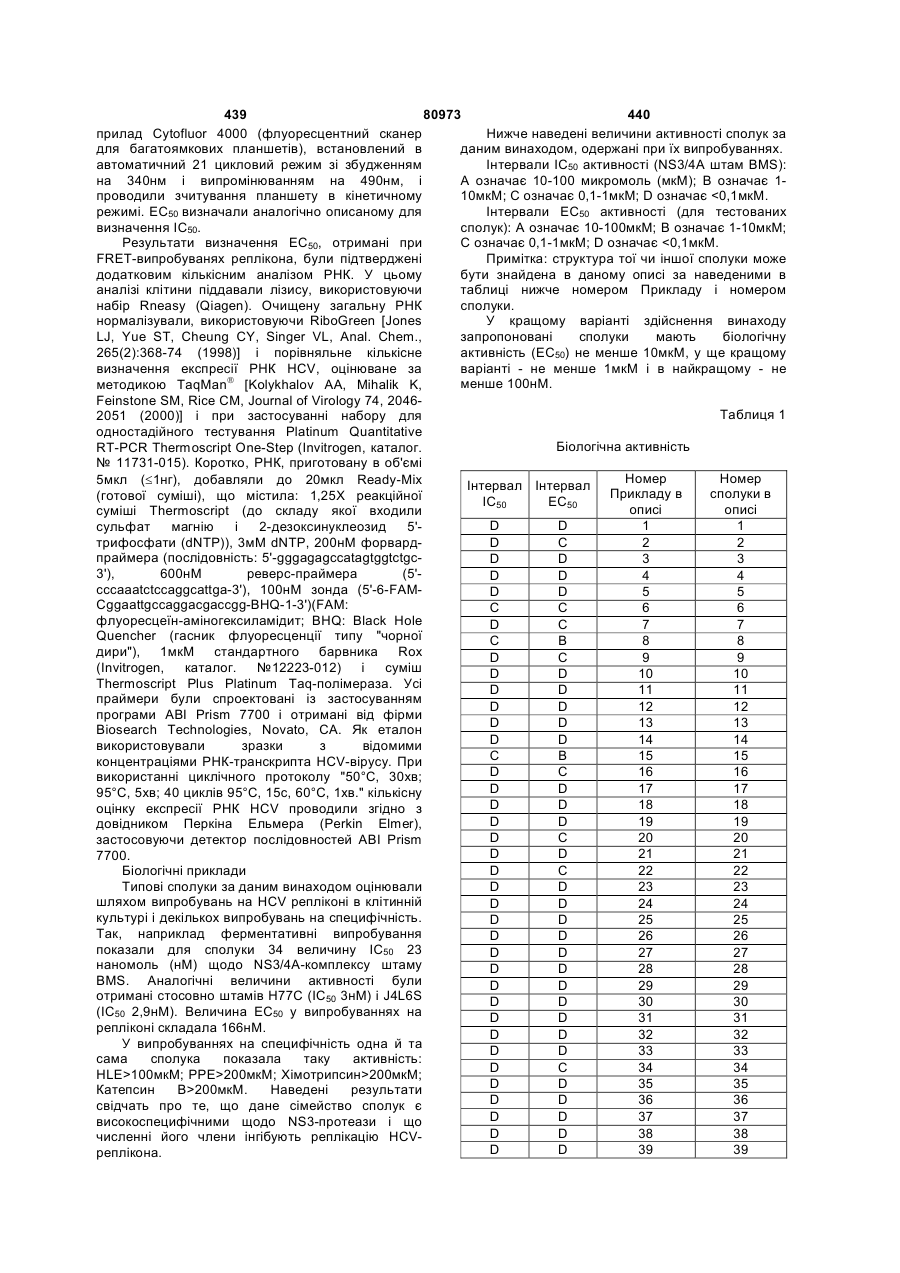
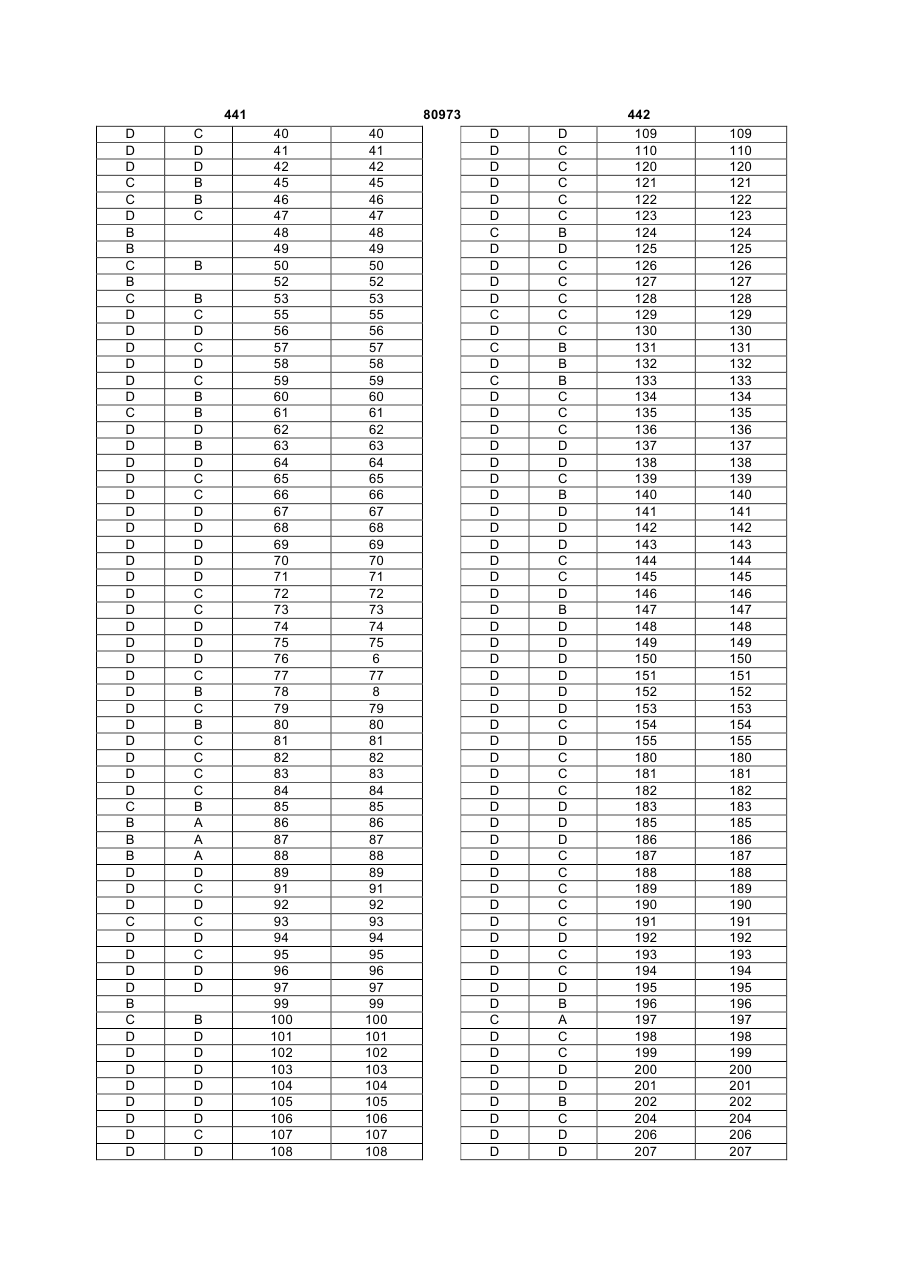
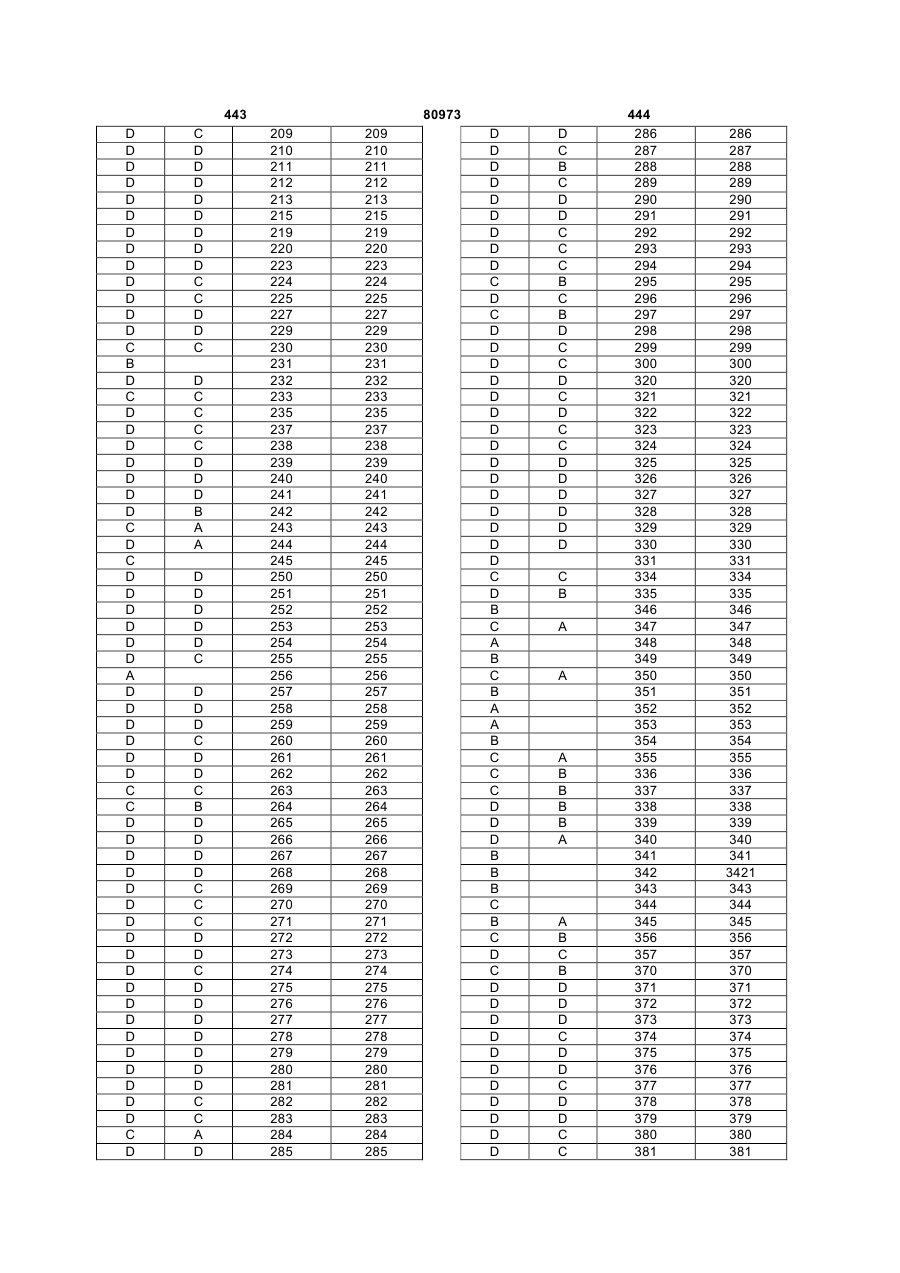
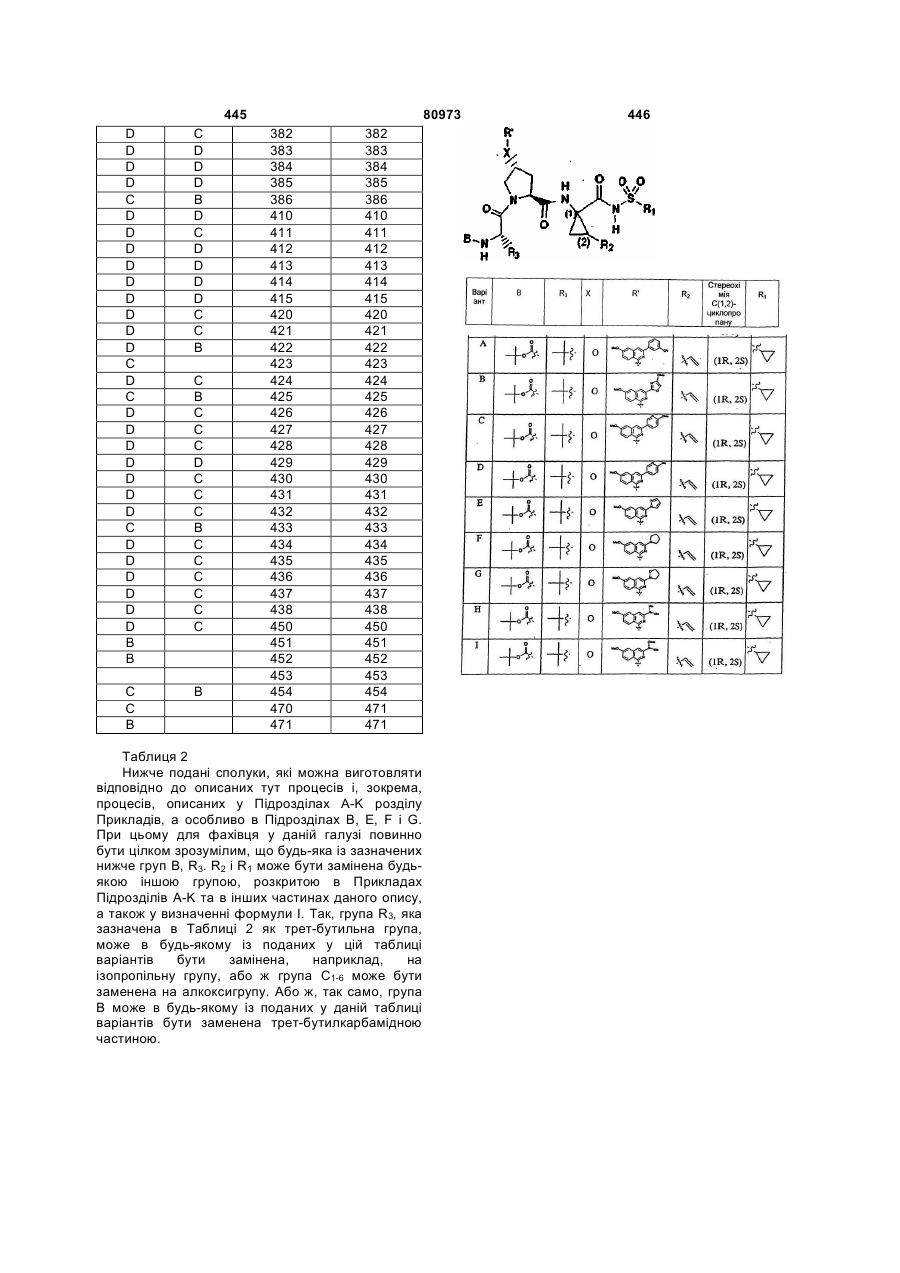
Текст
1. Сполука, яка має формулу R2 UA 2 (19) 1 C2 (54) ІНГІБІТОРИ ВІРУСУ ГЕПАТИТУ С 3 80973 4 означає Н, С1-6алкіл, R4-(C=O)-, R4O-(С=O)-, R4R4-N(R5)-C(=О)-, R4-N(R5)-C(=S)-, R4SО2- або R4N(R5)-C(=O)-, R4-N(R5)-C(=S)-, R4SO2- або R4N(R5)-SO2-; N(R5)-SO2-. (h) R4 означає (і) С1-10алкіл, необов'язково 9. Сполука за п. 8, яка відрізняється тим, що В заміщений на феніл, карбоксил, С1-6 алканоїл, 1-3 означає R4-(C=O)-, R4O-(C=O)- або R4-N(R5)-C(=O)галоїди, гідрокси, -ОС(О)С1-6алкіл, С1-6алкокси, . аміно, необов'язково заміщений С1-6алкілом, 10. Сполука за п. 9, яка відрізняється тим, що В амідогрупою або (нижчий алкіл)амідогрупою; (іі) означає R4O-(C=O)-, a R4 означає С1-6алкіл. С3-7циклоалкіл, С3-7циклоалкокси або С411. Сполука за п. 1, яка відрізняється тим, що R4 10алкілциклоалкіл, кожний з яких є необов'язково означає: (і) С1-10алкіл, необов'язково заміщений на заміщеним групою гідрокси, карбоксилом, (С1феніл, карбоксил, С1-6алканоїл, 1-3 галоїди, аміно, необов'язково 6алкокси)карбонілом, гідрокси, С1-6алкокси; (іі) С3-7циклоалкіл, С3заміщеним С1-6алкілом, амідогрупою або (нижчий алкіл)амідогрупою; (ііі) С6-10арил або С77циклоалкокси або С4-10алкілциклоалкіл; або (ііі) С6кожний з яких є необов'язково 10арил або С7-16арилалкіл, кожний з яких є 16арилалкіл, необов'язково заміщеним С1-6 алкілом або заміщеним С1-6алкілом, галоїдом, групами нітро, галоїдом. гідрокси, амідо, (нижчий алкіл)амідо або 12. Сполука за п. 11, яка відрізняється тим, що R4 аміногрупою, необов'язково заміщеною С1означає: (і) С1-10алкіл, необов'язково заміщений на 6алкілом; (iv) Het; (v) біцикло(1,1,1)пентан; або (vi) 1-3 галоїди або на С1-6алкокси; або (іі) С3С(О)ОС1-6алкіл, С2-6алкеніл або С2-6алкініл; (і) R5 означає Н; С1-6алкіл, необов'язково 7циклоалкіл чи С4-10алкілциклоалкіл. 13. Сполука за п. 1, яка відрізняється тим, що R5 заміщений 1-3 галоїдами; або С1-6 алкокси, за означає Н або С1-6алкіл, необов'язково заміщений умови, що R4 означає С1-10алкіл; 1-3 галоїдами. (j) Х означає О, S, - SO, SО2, OCH2, CH2O або NH; 14. Сполука за п. 13, яка відрізняється тим, що R5 (k) R' означає Het; або С6-10арил або С7а означає Н. 14алкіларил, необов'язково заміщений на R ; і 15. Сполука за п. 1, яка відрізняється тим, що Х (l) Rа означає С1-6алкіл, С3-7циклоалкіл, С1означає О або NH. 6алкокси, С3-7циклоалкокси, галоїд-С1-6алкіл, СF3, 16. Сполука за п. 1, яка відрізняється тим, що R' моно- або дигалоїд-С1-6 алкокси, ціано, галоїд, означає Het або С6-10арил, необов'язково тіоалкіл, гідрокси, алканоїл, NO2, SH, аміно, С1заміщений на Ra. 6алкіламіно, ді-(С1-6)алкіламіно, ді-(С1-6)алкіламід, 17. Сполука за п. 16, яка відрізняється тим, що R' карбоксил, (С1-6)карбоксіестер, С1-6алкілсульфон, означає Het. С1-6алкілсульфонамід, ди-(С1-6)алкіл(алкоксі)амін, 18. Сполука за п. 1, яка відрізняється тим, що С6-10арил, С7-14алкіларил або 5-7-членний гетероцикл містить в кільці 1 або 2 атоми азоту і, моноциклічний гетероцикл; необов'язково, атом сірки або кисню. за умови, що X-R' не означає сполуку 19. Сполука за п. 18, яка відрізняється тим, що OCH3 гетероцикл є заміщеним, принаймні, одним із таких замісників: С1-6алкілом, С1-6алкокси, O галоїдом, С6-10арилом, С7-14алкіларилом або 5-7 членним моноциклічним гетероциклом. N 20. Сполука за п. 1, яка відрізняється тим, що R3 означає С1-6алкіл, С3-7циклоалкіл, С1-6алкокси, галоїд-С1-6алкіл, галоїд, аміно, С6арил або 5-7членний моноциклічний гетероцикл. 21. Сполука, яка має формулу R2 ; або її фармацевтично прийнятні сіль, сольват чи проліки. O 2. Сполука за п. 1, яка відрізняється тим, що R1 O N(H)SO2R1 B означає С3-7циклоалкіл. NH N C 3. Сполука за п. 1, яка відрізняється тим, що R2 N O Y означає С1-6алкіл, С2-6алкеніл або С3-7циклоалкіл. 4. Сполука за п. 3, яка відрізняється тим, що R2 R3 означає С2-6алкеніл. R' X 5. Сполука за п. 1, яка відрізняється тим, що R3 , означає С1-8алкіл, необов'язково заміщений на (II) С6арил, С1-6алкокси, карбокси, гідрокси, арилокси, де С7-14алкіларилокси, С2-6алкіловий естер, С8(a) R1 означає С3-7циклоалкіл; 15алкілариловий естер; С3-12алкеніл, С3-7циклоалкіл (b) R2 означає С1-6алкіл, С2-6алкеніл або С3або С4-10алкілциклоалкіл. 7циклоалкіл; 6. Сполука за п. 5, яка відрізняється тим, що R3 (c) R3 означає С1-6алкіл, необов'язково заміщений означає С1-8алкіл, необов'язково заміщений на С1на С6арил, С1-6алкокси, групи карбокси, гідрокси, 6алкокси або С3-7циклоалкіл. арилокси, С7-14алкіларилокси, С2-6алкіловий естер, 7. Сполука за п. 1, яка відрізняється тим, що Y C8-15алкілариловий естер; С3-12алкеніл, С3означає Н. 7циклоалкіл або С4-10алкілциклоалкіл; 8. Сполука за п. 1, яка відрізняється тим, що В (d) Y означає Н; 5 80973 6 R2 (e) В означає Н, С1-6алкіл, R4-(C=O)-, R4O(C=O)-, R4-N(R5)-C(=O)-, R4-N(R5)-C(=S)-, R4SO2- або R4N(R5)-SO2-; O (f) R4 означає (і) С1-10алкіл, необов'язково O N(H)SO2R1 заміщений на феніл, карбоксил, С1-6алканоїл, 1-3 B NH N галоїди, групи гідрокси, С1-6алкокси; (іі) С3C N O Y С3-7циклоалкокси або С47циклоалкіл, алкілциклоалкіл; або (ііі) С6-10арил чи С710 R3 кожний з яких є необов'язково 16арилалкіл, заміщеним на С1-6алкіл або галоїд; R' O , (g) R5 означає Н; С1-6алкіл, необов'язково (III) заміщений 1-3 галоїдами; де (h) X означає О або NH; (a) R1 означає С3-7циклоалкіл; (і) R' означає Het або С6-10 арил, необов'язково 3 (b) R2 означає С2-6алкеніл; заміщений на R ; і (c) R3 означає С1-6алкіл; (j) Ra означає С1-6алкіл, С3-7циклоалкіл, С1(d) Y означає Н; 6алкокси, галоїд-С1-6алкіл, галоїд, аміно, С6арил (e) В означає R4O(C=O)- або R4-N(R5)-C(=O)-; або 5-7-членний моноциклічний гетероцикл; (f) R4 означає С1-10алкіл; за умови, що Xa-R' не є (g) R5 означає Н; OCH3 (h) R' означає біциклічний гетероцикл, необов'язково заміщений Ra; і O (і) Ra означає С1-6алкіл, С1-6алкокси, галоїд, С6арил або 5-7-членний моноциклічний гетероцикл; за N умови, що O-R' не є OCH3 O ; або її фармацевтично прийнятні сіль, сольват чи проліки. 22. Сполука за п. 21, яка відрізняється тим, що R' означає біциклічний гетероцикл. 23. Сполука за п. 22, яка відрізняється тим, що гетероцикл містить в кільці 1 або 2 атоми азоту і, необов'язково, атом сірки або кисню. 24. Сполука за п. 22, яка відрізняється тим, що гетероцикл заміщений, принаймні, одним із таких замісників: С1-6алкілом, С1-6алкокси, галоїдом, С6арилом і 5-7-членним моноциклічним гетероциклом. 25. Сполука за п. 21, яка відрізняється тим, що R' означає біциклічний гетероцикл, що містить 1 атом азоту, і є заміщеним метоксигрупою і, принаймні, одним із таких замісників: С6арилом і 5-7-членним моноциклічним гетероциклом. 26. Сполука за п. 21, яка відрізняється тим, що R' означає моноциклічний гетероцикл. 27. Сполука за п. 26, яка відрізняється тим, що гетероцикл містить в кільці 1 або 2 атоми азоту і, необов'язково, атом сірки або атом кисню. 28. Сполука за п. 26, яка відрізняється тим, що гетероцикл заміщений, принаймні, одним із таких замісників: С1-6алкілом, С1-6алкокси, галоїдом, С6С7-14алкіларилом або 5-7-членним 10арилом, моноциклічним гетероциклом. 29. Сполука за п. 21, яка відрізняється тим, що R' означає моноциклічний гетероцикл, що містить 1 або 2 атоми азоту, і є заміщеним метоксигрупою і, принаймні, одним із таких замісників: С6арилом і 57-членним моноцикпічним гетероциклом. 30. Сполука, яка має формулу N ; або її фармацевтично прийнятні сіль, сольват або проліки. 31. Сполука за п. 30, яка відрізняється тим, що R1 означає циклопропіл або циклобутил. 32. Сполука за п. 30, яка відрізняється тим, що R2 означає вініл. 33. Сполука за п. 30, яка відрізняється тим, що R3 означає трет-бутил. 34. Сполука за п. 30, яка відрізняється тим, що R4 означає трет-бутил. 35. Сполука за п. 30, яка відрізняється тим, що R' означає хінолін або ізохінолін, необов'язково заміщений на Ra. 36. Сполука за п. 30, яка відрізняється тим, що R1 означає циклопропіл, R2 означає вініл, R3 означає трет-бутил, R4 означає трет-бутил і R' означає ізохінолін, заміщений на Ra. 37. Сполука за п. 36, яка відрізняється тим, що Ra означає С1-6алкокси. 38. Сполука за п. 37, яка відрізняється тим, що до значень Ra, крім того, входять, принаймні, С6арил і/або 5-7-членний моноциклічний гетероцикл. 39. Спосіб лікування HCV-інфікованого пацієнта, який включає у себе введення пацієнту терапевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятних солі, сольвату чи проліків. 40. Спосіб інгібування NS3-протеази HCV-вірусу, який включає у себе введення пацієнту, що 7 80973 8 потребує цього, терапевтично ефективної кількості складається із рибавірину й амантадину. сполуки за п. 1 або її фармацевтично прийнятних 46. Композиція за п. 41, яка, крім того, містить солі, сольвату чи проліків. інгібітор HCV-протеази, відмінний від сполуки за п. 41. Композиція, яка містить сполуку за п. 1 або її 1. фармацевтично прийнятні сіль, сольват чи проліки 47. Композиція за п. 46, яка, крім того, містить і фармацевтично прийнятний носій. інгібітор мішені в життєвому циклі HCV, відмінний 42. Композиція за п. 41, яка містить, крім того, від NS3-протеази HCV-вірусу. додатковий імуномодуляторний засіб. 48. Композиція за п. 47, яка відрізняється тим, що 43. Композиція за п. 42, яка відрізняється тим, що іншу мішень вибирають із групи, що складається із додатковий імуномодуляторний засіб вибирають із гелікази, полімерази, металопротеази та їх сумішей. групи, що складається із і a-, b49. Композиція за п. 41, яка відрізняється тим, що d - інтерферон ів . її застосовують у виготовленні препарату для 44. Композиція за п. 41, яка, крім того, містить лікування пацієнта, інфікованого вірусом гепатиту антивірусний агент. С. 45. Композиція за п. 44, яка відрізняється тим, що антивірусний агент вибирають із групи, що Даний винахід у цілому стосується антивірусних сполук і, зокрема, сполук, що інгібують активність NS3-протеази, яку кодує вірус гепатиту С. Крім того, винахід стосується композицій, що містять ці сполуки, і процесів інгібування NS3-протеазної активності. Вірус гепатиту С (HCV: Hepatitis C Virus) є основним людським патогеном, котрий за оціночними даними вражає 170 мільйонів людей, що приблизно в п'ятеро перевищує число людей, інфікованих вірусом імунодефіциту 1-го типу. У значної частини цих HCV-інфікованих осіб розвиваються серйозні прогресуючі хвороби печінки, включаючи цироз і гепатоцелюлярний рак [Lauer, G.M.; Walker, B.D. N. Engl. J. Med. (2001), 345, 41- 52]. Сьогодні найбільш ефективна терапія HCV здійснюється за рахунок використання комбінації альфа-інтерферону з рибавірином і дозволяє досягати тривалого ефекту приблизно у 40% хворих [Poynard, Т. et al., Lancet (1998), 352, 14261432]. Нещодавні результати клінічних досліджень показують, що пегильований альфа-інтерферон перевершує в монотерапії немодифікований альфа-інтерферон [Zeuzem, S. et al., N. Engl. J. Med. (2000), 343, 1666-1672]. Проте, навіть в умовах експериментальних терапевтичних схем із залученням комбінації пегильованого альфаінтерферону з рибавірином у значної частини пацієнтів не спостерігається тривалого зниження вірусного навантаження. Таким чином, є очевидною та давно назріла необхідність у розробці ефективних лікарських засобів для лікування HCV-інфекції. HCV є РНК-вірусом з позитивно звитою РНК. На основі порівняння виведеної амінокислотної послідовності і широкої подібності на нетрансльованій 5'-ділянці HCV-вірус був класифікований як окремий рід родини Flaviviridae. Всі члени родини Flaviviridae мають покриті оболонкою віриони, которі містять РНК-геном з позитивним ланцюгом РНК, що кодує всі відомі вірус-специфічні білки шляхом трансляції єдиної, неперерваної, відкритої рамки зчитування. У нуклеотидній і кодованій амінокислотній послідовності по всьому HCV-геному виявлена наявність значної гетерогенності. Було охарактеризовано, принаймні, шість основних генотипів і описано більше 50 підтипів. Основні генотипи HCV розрізняються між собою розповсюдженістю у світі, так що клінічне значення генетичної гетерогенності HCV залишається неясним, незважаючи на численні дослідження можливого впливу генотипів на патогенез і терапію. Однонитковий РНК-геном HCV-вірусу складається, приблизно, із 9500 нуклеотидів і має одну відкриту рамку зчитування (ORF: open reading frame), що кодує один великий поліпротеїн, який складається, приблизно, із 3000 амінокислот. В інфікованих клітинах цей поліпротеїн розщеплюється в багатьох місцях клітинними і вірусними протеазами, утворюючи структурні і неструктурні (NS) білки. У випадку HCV-вірусу продукування зрілих неструктурних білків (NS2, NS3, NS4A, NS4B, NS5A і NS5B) відбувається під дією двох вірусних протеаз. Перша з них, яка все ще залишається погано охарактеризованою, чиніть розщеплення на ділянці з'єднання NS2-NS3; друга являє собою серинову протеазу, що міститься на N-кінцевій ділянці NS3 (звідки її назва: "NS3-протеазa"), і опосередковує всі подальші розщеплення нижче від від NS3, як у цис-, у сайті розщеплення NS3-NS4A, так і транс-, у решти сайтів розщеплення NS4A-NS4B, NS4BNS5A, NS5A-NS5B. Білок NS4A, очевидно, виконує численні функції, діючи як кофактор для NS3протеази і, можливо, сприяючи локалізації NS3 та інших компонентів вірусної реплікази в мембрані. Утворення комплексу NS3-білка з NS4A, очевидно, є необхідним для процесінгу подій і підсилення протеолітичної ефективності в усіх сайтах. NS3бідок також виказує нуклеозидтрифосфатазну і РНК-геліказну активності. NS5B являє собою РНКзалежну РНК-полімеразу, котра бере участь у реплікації HCV. Серед сполук, що продемонстрували свою ефективність щодо інігбування реплікації HCV, діючи як селективні інгібітори серинової протеази 9 80973 10 HCV-вірусу, є пептиди, описані в [Патенті США (І) Ra означає С1-6 алкіл, С3-7 циклоалкіл, С1№6323180]. 6алкокси, С3-7циклоалкокси, галоїд-С1-6алкіл, CF3, Даним винаходом пропонується сполука за моно- або дигалоїд-С1-6алкокси, ціано, галоїд, формулою І, включаючи її фармацевтично тіоалкіл, гідрокси, алканоїл, NO2, SH, аміно, С1прийнятні солі, сольвати та проліки, 6алкіламіно, ди-(С1-6)алкіламіно, ди-(С1-6)алкіламід, карбоксил, (С1-6)карбоксіестер, С1-6алкілсульфон, С1-6алкілсульфонамід, ди-(С1-6)алкіл(алкоксі)амін, С6-10арил, С7-14алкіларил або 5-7-членний моноциклічний гетероцикл; за умови, що X- R' не означає сполуку , де: (a) Rt означає С1-8алкіл, С3-7циклоалкіл або С410алкілциклоалкіл; (b) m приймає значення 1 або 2; (c) n приймає значення 1 або 2; (d) R2 означає Η, С1-6алкіл, С2-6алкеніл або С3кожний з яких є необов'язково 7циклоалкіл, заміщеним галоїдом; (e) R3 означає С1-8алкіл, необов'язково заміщений на галоїд, групу ціано, аміно, С16діалкіламіно, арил, С7-14алкіларил, С1-6алкокси, карбокси, гідрокси, арилокси, С7-14алкіларилокси, С2-6алкільний естер, С8-15алкіларильний естер, С312алкеніл, С3-7циклоалкіл або С4-10алкілциклоалкіл, де циклоалкіл або алкілциклоалкіл є необов'язково заміщеними на гідрокси, С1-6алкіл, С2-6алкеніл або С1-6алкокси; або R3 разом з атомом вуглецю, до якого він приєднаний, утворює циклоалкільну С37групу, необов'язково заміщену С2-6алкенілом; (f) Υ означає Η, феніл, заміщений нітрогрупою, піридил, заміщений нітрогрупою, або С1-6алкіл, необов'язково заміщений на групу ціано, ОН або С3-7циклоалкіл; за умови, що коли R4 або R5 означає Н, тоді Υ означає Н; (д) В означає Н, С1-6алкіл, R4-(C=O)-, R4O(C=O)-, R4-N(R5)-C(=O)-, R4-N(R5)- C(=S)-, R4SO2- або R4-N(R5)-SO2-; (h) R4 означає (і) С1-10алкіл, необов'язково заміщений на феніл, карбоксил, С1-6алканоїл, 1-3 галоїди, гідрокси, -ОС(О)С1-6алкіл, С1-6алкокси, групу аміно, необов'язково заміщену С1-6алкілом, амідогрупою або групою (нижчий алкіл)амідо; (іі) С3-7циклоалкіл, С3-7циклоалкокси або С410алкілциклоалкіл, кожний з яких є необов'язково заміщеним гідрокси, карбоксилом, (С16алкокси)карбонілом, групою аміно, необов'язково заміщеною С1-6алкілілом, амідогрупою або групою (нижчий алкіл)амідо; (ііі) С6-10арил або С7кожний з яких є необов'язково 16арилалкіл, заміщеним С1-6алкілом, галоїдом, нітро, гідрокси, амідогрупою, групою (нижчий алкіл)амідо або аміногрупою, необов'язково заміщеною С16алкілом; (iv) Het; (v) біцикло(1.1.1)пентан; або (vi) С(О)OС1-6алкіл, С2-6алкеніл або C2-6алкініл; (і) R5 означає Н; С1-6алкіл, необов'язково заміщений 1-3 галоїдами; або С1-6алкокси, за умови, що R4 означає С1-10алкіл; (j) X означає О, S, SO, SO2, ОСН2, СН2О або NH; (k) R' означає Het; або С6-10арил або С7a 10алкіларил, необов'язково заміщений R ; і або її фармацевтично прийнятні сіль, сольват чи проліки. Винаходом також пропонуються композиції, що містять сполуки за даним винаходом або їхні фармацевтично прийнятні солі, сольвати чи проліки і фармацевтично прийнятний носій. Зокрема, винаходом пропонуються фармацевтичні композиції, що є придатними для інгібування NS3 HCV-вірусу і містять терапевтично ефективну кількість сполуки за даним винаходом або її фармацевтично прийнятних солі, сольвату, проліків і фармацевтично прийнятний носій. Крім того, даним винаходом пропонуються процеси лікування хворих, інфікованих HCVвірусом, які включають у себе введення хворому терапевтично ефективної кількості сполуки за даним винаходом або її фармацевтично прийнятних солі, сольвату чи проліків. Винаходом передбачені також процеси інгібування NS3протеази HCV-вірусу шляхом уведення хворому ефективної кількості сполуки за даним винаходом. Таким чином, даний винахід робить можливим створювати поліпшені лікарські препарати, що містять запропоновані сполуки і можуть бути ефективними при лікуванні хворих, інфікованих HCV-вірусом. Зокрема, винаходом передбачені пептидні сполуки, здатні інгібувати функціонування NS3-протеази, наприклад, у комбінації з NS4Aпротеазою. Стереохімічні визначення та умовні позначення, використовувані в даному описі, як правило, відповідають довідникам [McGraw-Hill Dictionary of Chemical Terms, S.P. Parker, Ed., McGraw-Hill Book Company, New York (1984); Stereochemistry of Organic Compounds, Eliel, E. and Wilien, S., John Wiley & Sons, Inc., New York (1994)]. Численні органічні сполуки існують в оптично активних формах, тобто вони володіють здатністю обертати площину плоскополяризованого світла. В описі оптичноактивних сполук префіксні символи D і L або R і S вживаються для позначення абсолютної конфігурації молекули стосовно її хірального центра (або центрів). Префіксними символами d і І або (+) і (-) позначається знак обертання плоскополяризованого світла сполукою; при цьому 11 80973 12 знаки (-) і І відповідають лівообертальним кожного активного компонента, яка є достатньою сполукам, а знаки (+) і d - правообертальним для того, щоб принести відчутну користь хворому, сполукам. Через таку хімічну структуру ці сполуки, наприклад, тривале зниження вірусного що звуться стереоізомерами, є між собою навантаження. У випадку лікування із ідентичними, за винятком того, що вони є застосуванням лише одного активного інгредієнта, дзеркальним відображенням одна одної. Окремо цей термін стосується тільки цього інгредієнта. взятий стереоізомер із тієї чи іншої пари При застосуванню цього терміну до комбінації дзеркальних відображень зветься також активних інгредієнтів він стосується об'єднаної енантіомером, а суміш таких ізомерів часто кількості активних інгредієнтів, котра викликає називають енантіомерною сумішшю. терапевтичний ефект унаслідок їх сукупного Номенклатура, що застосовується для опису уведення послідовно або одночасно. органічних радикалів, наприклад, вуглеводнів і Виразами "сполуки за даним винаходом", заміщених вуглеводнів, звичайно, якщо не "запропоновані сполуки" і т.п. охоплюються зазначено іншого, відповідає відомій у даній галузі сполуки за формулою І та їх фармацевтично стандартній номенклатурі. Комбінації груп, прийнятні солі і сольвати, наприклад, гідрати. наприклад, алкілалкоксіамін, якщо не зазначено Подібним чином, під проміжними продуктами і іншого, охоплюють усі можливі стійкі конфігурації. сполуками слід розуміти також їх солі і сольвати, Нижче з метою ілюстрації дані визначення деяких залежно від контексту. Посилання на сполуку за радикалів і комбінацій. даним винаходом припускають також кращі Термінами "рацемічна суміш" і "рацемат" сполуки за формулами II і III. визначається еквімолярна суміш двох Термін "похідна" означає хімічно енантіомерів, позбавлена оптичної активності. модифіковану сполуку, причому мається на увазі, Термін "хіральний" використовується для що дана модифікація є добре відомою для визначення молекул, дзеркальні відображення фахівця-хіміка середнього рівня і являє собою, яких не збігаються при їх накладанні на дзеркальні наприклад, естер або амід кислоти, захисну групу, відображення їхніх антиподів, тоді як терміном таку, як бензильна група у випадку спирту або "ахіральний" визначаються молекули, дзеркальні тіолу, і трет-бутоксикарбонільна група у випадку відображення яких збігаються при їх накладанні на аміну. дзеркальні відображення їхніх антиподів. Термін "сольват" означає фізичний зв'язок Терміном "діастереомер" визначається сполуки за даним винаходом з однією чи більше стереоізомер, який не є енантіомером. Це може молекулами розчинника, органічного або бути, наприклад, стереоізомер з двома або більше неорганічного. Таким фізичним зв'язком може бути центрами хіральності, молекули якого не є також водневий зв'язок. У деяких випадках дзеркальними відображеннями одна одної. сольват може бути таким, що піддається Діастереоізомери мають різні фізичні властивості, відокремленню, наприклад, коли одна або більше наприклад, температури плавлення, спектральні молекул убудовані в кристалічну решітку твердої властивості і реакційну здатність. Суміші кристалічної речовини. Терміном "сольват" діастереоізомерів можна розділяти за допомогою охоплюються як сольвати в розчинах, так і аналітичних методів високої розрізнювальної відокремлювані сольвати. Сольватами можуть спроможності, такими, як електрофорез і бути, наприклад, гідрати, етанолати, метанолати і хроматографія. т.п. Під терміном "енантіомери" маються на увазі Використовуваний у даному описі термін два стереоізомери даної сполуки, дзеркальні "проліки" означає похідні сполук за даним відображення яких при їх суміщенні не збігаються винаходом, котрі містять групи, здатні одне з одним. розщеплюватися шляхом хімічних або Терміном "фармацевтично прийнятна сіль" метаболічних перетворень в умовах сольволізу охоплюються нетоксичні солі, синтезовані зі або у фізіологічних умовах і, таким чином, ставати сполуки, що містить основну або кислотну частину, фармацевтично активними in vivo сполуками за за допомогою звичайних хімічних методів. Як даним винаходом. Проліки тієї чи іншої сполуки правило, такі солі можна отримувати за можуть утворюватися звичайним шляхом з допомогою реакції вільної кислотної або основної функціональною групою цієї сполуки, наприклад, форми цих сполук зі стехіометричною кількістю аміно, гідрокси або карбокси. Пролікарська похідна підходящої основи або кислоти у воді чи форма сполуки часто має кращу розчинність, органічному розчиннику або в їх суміші; звичайно тканинну сумісність і пролонговане звільнення в кращими є неводні середовища, такі, як етер, організмі ссавця [Bungard, Η., Design of Prodrugs, етилацетат, етанол, ізопропанол або ацетонітрил. pp. 7- 9, 21- 24, Elsevier, Amsterdam 1985]. Перелік підходящих солей можна знайти в Проліками, поряд з іншим, можуть бути добре [Remington's Pharmaceutical Sciences, 18th ed., відомі фахівцям у даній галузі похідні кислот, такі, Mack Publishing Company, Easton, PA, 1990, як естери, отримувані шляхом реакції вихідної p.1445]. Сполука за даним винаходом може кислотної сполуки з підходящим спиртом, або застосовуватися у формі вільної основи чи вільної аміди, отримувані шляхом реакції вихідної кислоти кислоти або у формі її фармацевтично прийнятної з підходящим аміном. солі. Усі її форми охоплюються об'ємом даного Під використовуваним тут терміном "пацієнт" винаходу. мається на увазі як людина, так і інша особина Під виразом "терапевтично ефективна класу ссавців. кількість" мається на увазі загальна кількість 13 80973 14 Термін "фармацевтична композиція" означає Використовуваний у даному описі термін композицію, що містить сполуку за даним "алкеніл" означає алкільний радикал, що містить, винаходом у комбінації, принаймні, з одним принаймні, один подвійний зв'язок, наприклад, додатковим фармацевтичним інгредієнтом, тобто етеніл (вініл) і алкіл. ад'ювантом, ексципієнтом або носієм, як-от Використовуваний у даному описі термін розріджувачі, консерванти, наповнювачі, "алкокси" означає алкільну групу із зазначеним регулятори звільнення, дезінтегратори, числом атомів вуглецю, приєднаних до атома змочувальні речовини, емульгатори, кисню. Термін "алкокси" включає у себе, суспендувальні речовини, підсолоджувачі, наприклад, метокси, етокси, пропокси, 1коригенти смаку і запаху, антибактеріальні метилетокси, бутокси і 1,1-диметилетокси. речовини, протигрибкові речовини, мастила і Останній з цих радикалів має назву трет-бутокси. диспергатори, залежно від природи, способу Термін "алкоксикарбоніл" означає алкільну групу, вживання і лікарських форм. Можна, наприклад, яка додатково містить карбонільну групу. використовувати інгредієнти, перелічені в Використовуваний у даному описі термін [Remington's Pharmaceutical Sciences, 18th ed., "циклоалкіл" означає циклоалкільний замісник, що Mack Publishing Company, Easton, PA (1999)]. містить зазначену кількість атомів вуглецю, і Вираз "фармацевтично прийнятний" включає у дане поняття, наприклад, циклопропіл, використовується в даному описі як визначення циклобутил, циклопентил, циклогексил, для тих сполук, матеріалів, композицій і/або циклогептил і спіроциклічні групи, такі, як лікарських форм, котрі, виходячи з медичних спіроциклопропіл і спіроциклобутил. Термін міркувань, є підходящими до застосування в "циклоалкокси" означає зв'язану з атомом кисню контакті с тканинами організму пацієнта і не несуть циклоалкільну групу, наприклад, циклобутилокси небезпеки спричинення надмірної токсичності, або циклопропілокси Термін "алкілциклоалкіл" подразнення, алергічної реакції або інших означає циклоалкільну групу, зв'язану з алкільною проблем чи ускладнень, зрівняних з прийнятним групою. Якщо не зазначено іншого, то вказаний співвідношенням між ризиком і користю від їх при цьому інтервал кількості атомів вуглецю застосування. охоплює загальне число атомів вуглецю в Термін "лікування" означає: (і) запобігання радикалі. Так, С4-10алкілциклоалкіл може містити захворюванню, розладу або стану у пацієнта, 1-7 атомів вуглецю в алкільній групі і 3-9 атомів котрий може бути схильним до цього вуглецю в кільці, наприклад, циклопропілметил захворювання, розладу або стану, але у котрого або циклогексилетил. діагнозом вони ще не встановлені; (іі) інгібування Використовуваний у даному описі термін захворювання, розладу або стану, тобто "арил" означає ароматичну частину, що містить припинення їх розвитку; і (ііі) послаблення зазначене число атомів вуглецю, наприклад, захворювання, розладу або стану, тобто феніл, інданіл або нафтил. Наприклад, запис "С6повернення плину захворювання, розладу або 10арил" означає ароматичну групу, що містить 6-10 стану у зворотному напрямку. атомів вуглецю, які можуть бути у формі Використовуваний у даному описі термін моноциклічної або біциклічної структури. "заміщений" означає наявність заміщень у сайтах Використовуваний тут термін "галоїдарил" означає зв'язування в кількості від одного до максимально арил, заміщений одним чи більше атомами можливого числа таких сайтів на центральному, галоїду. Терміни "алкіларил", "арилалкіл" і наприклад, органічному радикалі, з котрим "аралкіл" означають арильну групу, заміщену зв'язаний замісник, наприклад, моно-, ди-, три- і однією або більше алкільними групами. Так, С7тетразаміщений, якщо не зазначено іншого. група може мати 1-8 атомів 14алкіларильна Використовуваний у даному описі термін вуглецю в алкільній групі у випадку "галоїд" означає галоїдний замісник, вибраний моноциклічного ароматичного радикала і 1-4 серед брому, хлору, фтору або йоду. Термін атоми вуглецю в алкільній групі у випадку "галоїдалкіл" означає алкільну групу, котра містить сконденсованого ароматичного радикала. До один або більше галоїдних замісників. числа арильних при цьому належать радикали, Використовуваний у даному описі термін заміщені типовими замісниками, добре відомими "алкіл" означає ациклічні прямолінійні або фахівцям у даній галузі, наприклад, такими, як розгалужені алкільні замісники і включає в це галоїд, гідрокси, карбокси, карбоніл, нітро, сульфо, поняття, наприклад, метил, етил, пропіл, бутил, аміно, ціано, діалкіламіно, галоїдалкіл, CF3, трет-бутил, гексил, 1-метилетил, 1-метилпропіл, 2галоїдалкокси, тіоалкіл, алканоїл, SH, алкіламіно, метилпропіл, 1,1-диметилетил. Так, запис С1алкіламід, діалкіламід, карбоксіестер, алкілсульфонамід і алкіл(алкоксі)амін. Як 6алкіл означає алкільну групу, що містить від одного до шести атомів вуглецю. Термін "нижчий приклади алкіларильних груп можна назвати алкіл" означає алкільну групу, що містить від бензил, бутилфеніл і 1-нафтилметил. Терміни одного до шести, переважно, від одного до "алкіларилокси" і "алкіларилестер" означають чотирьох атомів вуглецю. Термін "алкілестер" алкіларильні групи, що містять, відповідно, атом означає алкільну групу, яка додатково містить кисню й естерну групу. естерну групу. Звичайно, зазначений діапазон Використовуваний у даному описі термін кількості атомів вуглецю, наприклад, у запису „С2"карбоксіалкіл" означає карбоксильну групу включає всі атоми вуглецю в (СООН), зв'язану через алкільну групу згідно з 6алкілестер" радикалі. визначеним вище, і включає, наприклад, масляну кислоту. 15 80973 16 Як приклади біциклічних гетероциклів можна Використовуваний у даному описі термін навести, не обмежуючись лише ними, такі циклічні "алканоїл" означає прямолінійні або розгалужені 1системи: оксоалкільні радикали, що містять зазначене число атомів вуглецю, й охоплює своїм значенням, наприклад, форміл, ацетил, 1-оксопропіл (пропіоніл), 2-метил-1-оксопропіл, 1-оксогексил і т.д. Використовуваний у даному описі термін "аміноаралкіл" означає аміногрупу, заміщену алкільною групою, тобто такий, як показано нижче аміноаралкіл: Кращими моноциклічними гетероциклами є 57-членні насичені, частково насичені або повністю ненасичені циклічні системи (системи останньої з цих підмножин звуться тут ненасиченими ароматичними гетероциклами), що містять в циклі від одного до чотирьох гетероатомів, вибраних . серед азоту, кисню і сірки, причому гетероатоми сірки та азоту можуть бути необов'язково Використовуваний у даному описі термін окисленими. Моноциклічний гетероцикл може "алкіламід" означає амід, монозаміщений алкілом, також містити замісники, наприклад, від 1 до 3 на тобто такий, як: будь-якому з атомів циклу. Як приклади підходящих для цього замісників можна назвати С1-6алкіл, С3-7циклоалкіл, С1-6алкокси, С37циклоалкокси, галоїд-С1-6алкіл, CF3, моно- або дигалоїд-С1-6алкокси, ціано, галоїд, тіоалкіл, гідрокси, алканоїл, NO2, SH, аміно, С1-6алкіламіно, . ді(С1-6)алкіламіно, ді(С1-6)алкіламід, карбоксил, (С1С1-6алкілсульфон, С1Використовуваний у даному описі термін 6)карбоксіестер, С1-6алкілсульфонамід, ді(С1"карбоксіалкіл" означає карбоксильну групу 6алкілсульфоксид, (СООН), зв'язану через алкільну групу згідно з 6)алкіл(алкоксі)амін, С6-10арил, С7-14алкіларил і 5-7членний моноциклічний гетероцикл. визначеним вище, і включає у своє значення, Моноциклічний гетероцикл може бути приєднаний наприклад, масляну кислоту. до бічної групи, наприклад, X у Формулі І, на будьВикористовуваний у даному описі термін якому атомі циклу. "гетероцикл", який позначається також "Het", Як приклади моноциклічних гетероциклів означає 7-12-членні біциклічні гетероцикли і 5-7можна навести, не обмежуючись лише ними, такі членні моноциклічні гетероцикли. циклічні системи: Кращими біциклічними гетероциклами є 7-12членні сконденсовані біциклічні системи (обидва кільця мають спільну пару атомів), що містять 1-4 гетероатоми, вибрані серед азоту, кисню і сірки, причому обидва кільця гетероциклу є повністю ненасиченими. Гетероатоми азоту і сірки можуть бути необов'язково окисленими. Біциклічний гетероцикл може містити гетероатоми в одному або обох циклах. Біциклічний гетероцикл може також містити замісники на будь-якому атомі вуглецю в циклі, наприклад, 1-3 замісники. Як приклади підходящих замісників можна назвати С1Для фахівця в даній галузі цілком зрозуміло, С3-7циклоалкіл, С1-6алкокси, С36алкіл, що гетероцикли, які використовуються у сполуках 7циклоалкокси, галоїд-С1-6алкіл, CF3, моно- або за даним винаходом, повинні бути стабільними. дигалоїд-С1-6алкокси, ціано, галоїд, тіоалкіл, Стабільною сполукою в загальному випадку є гідрокси, алканоїл, NO2, SH, аміно, С1-6алкіламіно, така, котру можна синтезувати, відокремлювати і ди(С1-6)алкіламіно, ди(С1-6)алкіламід, карбоксил, використовувати у фармацевтичних препаратах за (С1-6)карбоксіестер, С1-6алкілсульфон, С1допомогою добре відомих фахівцям у даній галузі С1-6алкілсульфоксид, ди(С16алкілсульфонамід, процесів без небезпеки її руйнування. 6)алкіл(алкоксі)амін, С6-10арил, С7-14алкіларил і 5-7Використовувані в назвах сполук за даним членний моноциклічний гетероцикл. Коли два винаходом символи Р1', Р1, Р2, Р3 і Р4 замісники приєднані до сусідніх атомів вуглецю позначають відносні положення амінокислотних біциклічного гетероциклу, вони можуть залишків зв'язування інгібітору протеази, відносно з'єднуватися з утворенням циклу, наприклад, зв'язування природного пептидного субстрату, що п'яти-, шести- або семичленної циклічної системи, розщеплюється. Розщеплення відбувається у що містить до двох гетероатомів, вибраних серед природному субстраті між положеннями Р1 і Р1', кисню й азоту. Біциклічний гетероцикл може бути де положення без штриха позначають приєднаний до бічної групи, наприклад, X у амінокислоти, починаючи від С-кінця природного Формулі І, на будь-якому атомі в циклі, переважно, сайта розщеплення пептиду і далі в напрямку Nна атомі вуглецю. 17 80973 18 кінця, а положення зі штрихом позначають Термін "бічний ланцюг" у застосуванню до амінокислоти від N-кінця позначення сайта амінокислоти або амінокислотного залишку розщеплення і далі в напрямку С-кінця. означає групу, приєднану до атома a-вуглецю aНаприклад, Р1' позначає перше далеке положення амінокислоти. Наприклад, R-групою або бічним справа від С-кінця сайта розщеплення (тобто ланцюгом у випадку гліцину є водень, у випадку перше N-кінцеве положення), тоді як від Р1 аланіну - метил, у випадку валіну - ізопропіл. Дані починається нумерація з лівого боку сайта стосовно конкретних R-груп або бічних ланцюгів арозщеплення С-кінця, далі Р2 позначає друге амінокислот можна знайти у посібнику [A.L. положення від С-кінця, і т.д. [Berger A. & Schechter Lehninger's text on Biochemistry (chapter 4)]. I., Transactions of the Royal Society London series Сполуки за даним винаходом мають структуру, (1970), B257, 249-264]. виражену формулою І: Отже, ділянки молекули від "Р1' до Р4" в сполуках за формулою І мають такий вигляд: , Використовуваний у даному описі термін "1аміноциклопропілкарбонова кислота" (Асса) означає сполуку за формулою: Використовуваний у даному описі термін "трет-бутилгліцин" означає сполуку за формулою: Термін "залишок", застосовуваний по відношенню до амінокислоти або похідної амінокислоти, означає радикал, утворений із відповідної α-амінокислоти шляхом видалення гідроксилу карбоксигрупи і одного водню aамінокислотної групи. Наприклад, терміни Gin, Ala, Gly, lle, Arg, Asp, Phe, Ser, Leu, Cys, Asn, Sar і Туг означають "залишки" L-глутаміну, L-аланіну, гліцину, L-ізолейцину, L-аргініну, L-аспарагінової кислоти, L-фенілаланіну, L-серину, L-лейцину, Lцистеїну, L-аспарагіну, саркозину і L-тирозину, відповідно. де (a) R1 означає С1-8алкіл, С3-7циклоалкіл або С410алкілциклоалкіл; (b) m приймає значення 1 або 2; (c) n приймає значення 1 або 2; (d) R2 означає Η, С1-6алкіл, С2-6алкеніл або С3кожний з яких є необов'язково 7циклоалкіл, заміщеним галоїдом; (e) R3 означає С1-8алкіл, необов'язково заміщений на: галоїд, ціано, аміно, С1С6-10арил, С7-14алкіларил, С16діалкіламіно, карбокси, гідрокси, арилокси, С76алкокси, С2-6алкіловий естер, С814алкіларилокси, 15алкілариловий естер; С3-12алкеніл, С3-7циклоалкіл або С4.10алкілциклоалкіл, де циклоалкіл або алкілциклоалкіл є необов'язково заміщеними на гідрокси, С1-6алкіл, С2-6алкеніл або С1-6алкокси; або R3 разом з атомом вуглецю, до якого він приєднаний, утворює С3-7циклоалкільну групу, необов'язково заміщену С2-6алкенілом; (f) Υ означає Η, феніл, заміщений нітрогрупою, піридил, заміщений нітрогрупою або С1-6алкіл, необов'язково заміщений на ціано, ОН або С37циклоалкіл; за умови, що коли R4 або R5 означає Н, тоді Υ означає Н; (g) В означає Н, С1-6алкіл, R4-(C=O)-, R4O(C=O)-, R4-N(R5)-C(=O)-, R4-N(R5)-C(=S)-, R4SO2- або R4-N(R5)-SO2-; (h) R4 означає: (і) С1-10алкіл, необов'язково заміщений на феніл, карбоксил, С1-6алканоїл, 1-3 галоїди, гідрокси, -ОС(О)С1-6алкіл, С1-6алкокси, групу аміно, необов'язково заміщену С1-6алкілом, амідогрупою або (нижчий алкіл)амідогрупою; (іі) С3-7циклоалкіл, С3-7циклоалкокси або С410алкілциклоалкіл, кожний з яких є необов'язково заміщеним гідрокси, карбоксилом, (С16алкокси)карбонілом, групою аміно, необов'язково заміщеною С1-6алкіламідогрупою, або (нижчий алкіл)амідогрупою; (ііі) С6-10арил або С7кожний з яких є необов'язково 16арилалкіл, заміщеним С1-6алкілом, галоїдом, групою нітро, гідрокси, амідо, (нижчий алкіл)амідо або аміногрупою, необов'язково заміщеною С1 19 80973 20 алкілом; (iv) Het; (ν) біцикло(1.1.1)пентан; або (vi) (b) R2 означає С1-6алкіл, С2-6алкеніл або С36 C(O)OC1-6 алкіл, С2-6алкеніл або С2-6алкініл; 7циклоалкіл; (і) R5 означає Η; С1-6алкіл, необов'язково (c) R3 означає С1-8алкіл, необов'язково заміщений 1-3 галоїдами; або С1-6алкокси, за заміщений на: С6арил, С1-6алкокси, карбокси, умови, що R4 означає С1-10алкіл; гідрокси, арилокси, С7-14алкіларилокси, С2(j) X означає О, S, SO, SO2, ОСН2, СН2О або 6алкіловий естер, С8-15алкілариловий естер; С3NH; 12алкеніл, С3-7циклоалкіл або С4-10алкілциклоалкіл; (k) R' означає Het; або С6-10арил чи С7(d)Υ означає Η; a (e) В означає Н, С1-6алкіл, R4-(C=O)-, 10алкіларил, необов'язково заміщений R ; і (І) Ra означає С1-6алкіл, С3-7циклоалкіл, С1R4O(C=O)-, R4-N(R5)-C(=O)-, R4-N(R5)-C(=S)-, R4SO2- або R4-N(R5)-SO2-; 6алкокси, С3-7циклоалкокси, галоїд-С1-6алкіл, CF3, моно- або дигалоїд-С1-6алкокси, ціано, галоїд, (f) R4 означає (і) С1-10алкіл, необов'язково тіоалкіл, гідрокси, алканоїл, NO2, SH, аміно, С1заміщений на феніл, карбоксил, С1-6алканоїл, 1-3 галоїди, гідрокси, С1-6алкокси; (іі) С3-7циклоалкіл, 6алкіламіно, ди-(С1-6)алкіламіно, ди-(С1-6)алкіламід, карбоксил, (С1-6)карбоксіестер, С1-6алкілсульфон, С3-7циклоалкокси або С4.10алкілциклоалкіл; або (ііі) С1-6алкілсульфонамід, ди-(С1-6)алкіл(алкоксі)амін, С6-10арил чи С7-16арилалкіл, кожний з яких є С6-10арил, С7-14алкіларил або 5-7-членний необов'язково заміщеним С1-6алкілом або моноциклічний гетероцикл; галоїдом; за умови, що X- R1 не означає (g) R5 означає Н; С1-6алкіл, необов'язково заміщений 1-3 галоїдами; (h) X означає О або NH; (і) R' означає Het; або С6-10арил, необов'язково заміщений на Ra; і (j) Ra означає С1-6алкіл, С3-7циклоалкіл, С1алкокси, галоїд-С1-6алкіл, галоїд, аміно, С6арил 6 або 5-7-членний моноциклічний гетероцикл; за умови, що Ха-R' не означає або його фармацевтично прийнятні сіль, сольват чи проліки. У кращому варіанті здійснення винаходу: R2 означає С2-6алкеніл; R3 означає С1-8алкіл, необов'язково заміщений С1-6алкокси, або С37циклоалкіл; Υ означає Н; В означає R4-(C=O)-, R4O(C=O)- або R4-N(R5)-C(=O)-; R4 означає С110алкіл, необов'язково заміщений 1-3 галоїдами або С1-6алкокси; або С3-7циклоалкіл чи С410алкілциклоалкіл; R5 означає Η; Χ означає О або NH; і R' означає Het. Замісники із кожної поданої тут групи можна вибирати індивідуально або об'єднувати у будьякій комбінації, котра дає стабільну сполуку за даним винаходом. Крім того, більш ніж один замісник із кожної групи може бути заміщений у серцевинній групі за умови наявності достатньої кількості доступних сайтів зв'язування. Наприклад, такі Ra-замісники, як С1-6алкокси, С6арил і 5-7членний моноциклічний гетероцикл можуть бути заміщені у біциклічному гетероциклі R'. У кращому варіанті здійснення даного винаходу запропоновані сполуки мають структуру за формулою II: , де: (a) R1 означає С3-7циклоалкіл, або його фармацевтично прийнятні сіль, сольват чи проліки. В одному з кращих варіантів здійснення винаходу R' означає біциклічний гетероцикл. Біциклічний гетероцикл містить переважно 1 або 2 атоми азоту і, необов'язково, атом сірки або кисню в кільці. Краще, якщо гетероцикл є заміщений, принаймні, одним із таких замісників: С1-6алкілом, С1-6алкокси, галоїдом, С6арилом і 5-7-членним моноциклічним гетероциклом. У ще кращому варіанті R' означає біциклічний гетероцикл, що містить 1 атом азоту і заміщений метоксигрупою і, принаймні, одним із таких замісників: С6арилом і 57-членним моноциклічним гетероциклом. В іншому кращому варіанті здійснення винаходу R' означає моноциклічний гетероцикл. Цей гетероцикл містить переважно 1 або 2 атоми азоту і, необов'язково, атом сірки або атом кисню в кільці. Краще, якщо гетероцикл заміщений, принаймні, одним із таких замісників: С1-6алкілом, С1-6алкокси, галоїдом, С6-10арилом, С714алкіларилом або 5-7-членним моноциклічним гетероциклом. У ще кращому варіанті R' означає моноциклічний гетероцикл, що містить 1 або 2 атоми азоту і заміщений метоксигрупою і, принаймні, одним із таких замісників: С6арилом і 57-членним моноциклічним гетероциклом. 21 80973 22 йодид, сульфат, фосфат, метансульфонат, У ще кращому варіанті здійснення винаходу цитрат, ацетат, малонат, фумарат, сульфамат і запропоновані сполуки мають структуру, подану тартрат. формулою III Солями аміногрупи можуть бути також четвертинні солі амонію, в котрих азот аміногрупи несе підходящу органічну групу, таку, як алкільна, алкенільна, алкінільна або аралкільна. Сполуки за даним винаходом, заміщені кислотною групою, можуть існувати у формі солей, утворених шляхом приєднання основи. До числа підхожих серед таких солей можна назвати солі, отримані із неорганічних основ, наприклад, солі лужних металів (наприклад, натрію і калію), солі лужноземельних металів (наприклад, кальцію і магнію), солі алюмінію і солі амонію. Крім того, серед підходящих солей приєднання основи де: можна назвати солі фізіологічно прийнятних (a) R1 означає С3-7циклоалкіл; органічних основ, таких, як триметиламін, (b) R2 означає С2-6алкеніл; триетиламін, морфолін, піридин, піперидин, (c) R3 означає С1-8алкіл; (d)Υ означає Η; піколін, дициклогексиламін, Ν,Ν'(e) В означає R4O(C=O)- або R4-N(R5)-C(=O)-; дибензилетилендіамін, 2-гідроксиетиламін, біс-(2(f) R4 означає С1-10алкіл; гідроксіетил)амін, три-(2-гідроксіетил)амін, прокаїн, (g) R5 означає Η; дибензилпіперидин, N-бензил-b-фенетиламін, (h) R' означає біциклічний гетероцикл, дегідроабіетиламін, Ν,Ν'-бісгідроабіетиламін, необов'язково заміщений Ra; і глюкамін, N-метилглюкамін, колідин, хінін, хінолін, (і) Ra означає С1-6алкіл, С1-6алкокси, галоїд, етилендіамін, орнітин, холін, Ν,Ν'С6арил або 5-7-членний моноциклічний бензилфенетиламін, хлорпрокаїн, діетаноламін, гетероцикл; за умови, що О- R' не означає діетиламін, піперазин, трис(гідроксиметил)амінометан і N-метилглутамін. Ці солі можна отримувати за допомогою процесів, добре відомих фахівцям у даній галузі. Деякі сполуки за даним винаходом та їх солі можуть існувати у формі сольватів з водою, наприклад, гідратів, або з органічними розчинниками, такими як метанол, етанол або ацетонітрил, утворюючи, відповідно, "метанолат", "етанолат" або "ацетонітрилат". Даним винаходом охоплюються всі такі сольвати та їх суміші. або його фармацевтично прийнятні сіль, Окрім того, сполуки за даним винаходом або їх сольват чи проліки. солі чи сольвати можуть виказувати поліморфізм. Краще, якщо R1 означає циклопропіл або циклобутил, R2 означає вініл, R3 означає третДаним винаходом охоплюються також усі такі бутил, R4 означає трет-бутил, a R' означає хінолін поліморфні форми. або ізохінолін, необов'язково заміщений Ra. Сполуки за даним винаходом також містять Краще, якщо Ra означає, принаймні, один із членів два або більше хіральних центри. Наприклад, такі сполуки можуть включати Р1 циклопропільний такої сукупності: С1-6алкокси, С6арил і 5-7-членний елемент, окреслений формулою моноциклічний гетероцикл. У кращому варіанті R1 означає циклопропіл, R2 означає вініл, R3 означає трет-бутил, R4 означає трет-бутил, a R' означає ізохінолін, заміщений С1-6алкокси і, принаймні, одним із членів такої сукупності: С6арил і 5-7членний моноциклічний гетероцикл. Сполуки за даним винаходом завдяки наявності в них основної частини можуть утворювати солі шляхом приєднання фармацевтично прийнятної кислоти. Солі приєднання кислот утворюються зі сполуки за формулою І і фармацевтично прийнятної , неорганічної кислоти, включаючи без обмеження лише ними, хлористоводневу, бромістоводневу, де С1 і С2 являють собою асиметричні атоми йодистоводневу, сірчану, фосфорну кислоту, або вуглецю в положениях, відповідно, 1 і 2 органічної кислоти, такої, як п-толуолсульфонова, циклопропільного кільця. Не перешкоджаючи метансульфонова, оцтова, бензойна, лимонна, іншим можливим асиметричним центрам в інших малонова, фумарова, малеїнова, щавлева, сегментах сполук, наявність цих двох бурштинова, сульфамінова, вина та інші кислоти. асиметричних центрів означає, що дані сполуки Таким чином, як приклади таких фармацевтично можуть існувати у формі рацемічних сумішей або прийнятних солей можна назвати хлорид, бромід, діастереомерів, наприклад, діастереомерів, у 23 80973 24 Вихідні матеріали, які можуть застосовуватися котрих конфігурація R2 є або син-конфігурацією до в синтезі сполук за даним винаходом, добре відомі аміду, або син-конфігурацією до карбонілу, як фахівцям у даній галузі, їх можна легко виготовити показано нижче: або ж придбати комерційним шляхом. Сполуки за даним винаходом можна виготовляти за допомогою процесів, добре відомих фахівцям у даній галузі, [див., наприклад, патент США №6323180 і заявку на патент США №200020111313 А1]. Нижче описано декілька процесів виготовлення сполук згідно з даним винаходом. Ці процеси подані з метою ілюстрації і жодним чином не обмежують об'єму заявленого винаходу. Слід нагадати, що в разі необхідності сполука за даним винаходом може бути приготована таким чином, що її функціональна група буде захищена за допомогою звичайної захисної групи, яку для отримання запропонованої сполуки в чистому вигляді можна буде видаляти. Техніка використання захисних груп в цілях здійснення даного винаходу є звичайною і добре відома фахівцям у даній галузі. Сполуки за даним винаходом можна синтезувати, наприклад, за допомогою загального процесу, ілюстрованого на Схемі І (де CPG є захисна група для карбоксильного кінця, a APG є захисна група для амінокінця). Енантіомери можна розділяти за допомогою процесів, добре відомих фахівцям у даній галузі, наприклад, шляхом утворення діастереомерних солей, котрі можна розділяти за допомогою кристалізації, газо-рідинної або рідинної хроматографії, селективної реакції одного з енантіомерів з енантіомер-специфічним реагентом. Цілком зрозуміло, що коли потрібний енантіомер внаслідок застосованого процесу розділяння перетворювали на іншу хімічну субстанцію, тоді потребується додаткова стадія процесу для утворення бажаної енантіомерної форми. Альтернативним чином потрібні енантіомери можна одержувати шляхом асиметричного синтезу, використовуючи оптично активні реагенти, субстрати, каталізатори або розчинники, або ж шляхом асиметричного перетворення одного енантіомеру в інший. Сполуки за даним винаходом можуть мати форму проліків. Кращими проліками при цьому є P1, P2 і Р3 можуть зв'язуватися за допомогою прості аліфатичні або ароматичні естери, утворені добре відоміх методів сполучення пептидів. Групи із кислотних груп, за наявності останніх, на кінцях Р1, Р2 і Р3 можуть об'єднуватися між собою у сполук за даним винаходом. У деяких випадках будь-якому порядку за умови, що утворювана в бажано створювати проліки типу подвійних результаті сполука буде відповідати пептидам за естерів, таких, як (ацилоксі)алкілові або даним винаходом. Наприклад, Р3 може (алкоксикарбоніл)оксі)алкілові естери. зв'язуватися з Р2-Р1, або Р1 - з Р3-Р2. Деякі сполуки згідно з даним винаходом У загальному випадку пептиди подовжують можуть також існувати в різних стійких шляхом зняття захисту з a-аміногрупи N-кінцевого конформаційних формах, котрі можна розділяти. залишку і приєднання до нього незахищеної Асиметрія обертання внаслідок обмеженого карбоксильної групи наступної, відповідним чином обертання навколо асиметричного одинарного N-захищеної амінокислоти шляхом пептидного зв'язку, наприклад, через просторові перешкоди зв'язування описаними методами. Ці процедури або деформації кільця, може дозволяти на зняття захисту і приєднання повторюють доти, розділяння різних конформаційних варіантів поки не отримають потрібну послідовність. Таке структури. Даним винаходом охоплюються всі зв'язування можна здійснювати зі складовими конформаційні ізомери таких сполук та їх суміші. амінокислотими постадійно, як показано на Схемі Деякі сполуки за даним винаходом можуть І. існувати у цвітеріонній формі. Отже винаходом Зв'язування двох амінокислот, амінокислоти і охоплюються всі цвітеріонні форми таких сполук пептиду або двох пептидних фрагментов можна та їх суміші. виконувати за допомогою стандартних методів 25 80973 26 зв'язування, таких, як азидний метод, метод толуолсульфонільна; 2) ароматичні карбаматні змішаного ангидриду вугільної і карбонової кислот групи, такі, як бензилоксикарбоніл (Cbz або Z) і (ізобутилхлорформіатний метод), карбодіімідний (з заміщені бензилоксикарбоніл и, а також 9дициклогексилкарбодіімідом, флуоренілметилоксикарбоніл (Fmoc); 3) діізопропілкарбодіімідом або водорозчинним аліфатичні карбаматні групи, такі, як треткарбодіімідом) метод, Методика Активного естеру бутоксикарбоніл (Вос), етоксикарбоніл, діізопропілметоксикарбоніл і алілоксикарбоніл; 4) (з r-нітрофеніловим естером, імідоестером Nциклоалкілкарбаматні групи, такі, як оксибурштинової кислоти), K-метод з реагентом циклопентилоксикарбоніл і Вудворда, карбонілдіімідазольний метод, метод адамантилоксикарбоніл; 5) алкільні групи, такі, як фосфорних реагентів або окисно-відновні методи. трифенілметил і бензил; 6) триалкілсиліл, такий, Деякі із цих методів (особливо карбодіімідний як триметилсиліл; і 7) тіолвмісні групи, такі, як метод) можна підсилювати додаванням 1фенілтіокарбоніл і дитіасукциноїл. гідроксибензотриазолу або 4-DMAP. Ці реакції Кращою захисною групою для a-аміногрупи є зв'язування можна здійснювати як в розчині (рідкій фазі), так і в твердій фазі. Вос або Fmoc. Промисловістю виробляється Більш детально, стадія зв'язування включає багато похідних амінокислот, відповідним чином реакцію сполучення з дегідратацією вільної захищених для пептидного синтезу. Захисну групу карбоксильної групи одного із реагентів з вільною для a-аміногрупи знов добавленого аміногрупою іншого реагенту при наявності амінокислотного залишку розщеплюють перед зв'язуючої речовини з утворенням поперечного зв'язуванням з наступною амінокислотою. У разі амідного зв'язку. Опис таких зв'язуючих речовин застосування групи Вос для цього використовують можна знайти в загальних посібниках з хімії трифтороцтову кислоту, чисту або в хлористому пептидів, наприклад, [М. Bodansky, "Peptide метилені, або ж НСІ в діоксані чи в етилацетаті. Chemistry", 2nd rev. ed., Springer-Verlag, Berlin, Після цього утворювану амонійну сіль, перед Germany, (1993)]. Серед підходящих зв'язуючих сполученням або підгод. нього, нейтралізують речовин можна назвати, наприклад, Ν,Ν'основними розчинами, наприклад, водними дициклогексилкарбодіімід, 1-гідроксибензотриазол буферами або третинними амінамі у дихлорметані при наявності Ν,Ν'-дициклогексилкарбодііміду або чи ацетонітрилі, чи диметилформаміді. Якщо ж N-етил-N'-[(3-диметиламіно)пропіл]карбодііміду. застосовують групу Fmoc, то як реагент Практично вигідною зв'язуючою речовиною є використовують піперидин або заміщений продажний (бензотриазол-1-ілокси)триспіперидин у диметилформаміді. Але, поряд з цим, (диметиламіно)фосфонійгексафторфосфат як сам можна використовувати будь-який вторинний амін. по собі, так і в присутності 1Знімати захист можна при температурі від 0°С до гідроксибензотриазолу або 4-DMAP. Іншою кімнатної (rt або RT), звичайно при 20-22°С. практично прийнятною зв'язуючою речовиною є При синтезі пептиду із застосуванням будьпродажний 2-(1Н-бензотриазол-1-іл)-N,N,N',N'якої вищезазначеної групи будь-яку амінокислоту, тетраметилуронійтетрафторборат. Крім того, що має функціональні групи у бічному ланцюзі, використовуватися як зв'язуючий агент може слід захищати. Фахівцям у даній галузі техніки продажний О-(7-азабензотриазол-1-іл)-Ν,Ν,Ν',Ν'відомо, що вибір і застосування відповідних тетраметилуронійгексафторфосфат. Реакцію захисних груп для таких бічноланцюгових сполучення проводили в інертному розчиннику, функціональних груп залежить від амінокислоти і наприклад, у хлористому метилені, ацетонітрилі наявності інших захисних груп у пептиді. Вибір або диметилформаміді. Для підтримання такої захисної групи є фактором важливим тому, величини рН реакційнної суміші на рівні близько 8 що її не можна видаляти в процесі зняття захисту і додають надлишок третинного аміну, наприклад, сполучення a-аміногрупи. діізопропілетиламіну, Ν-метилморфоліну, NОтже якщо, наприклад, як a-амінозахисну метилпіролідину або 4-DMAP. Температура реакції групу застосовують Вос, то підходящими для звичайно лежить у межах 0-50°С, а тривалість бічного ланцюга є такі захисні групи: рреакції становить від 15хв. до 24год. толуолсульфонільні (тозильні) частини, які можна Підгод. протікання реакцій сполучення застосовувати для захисту амінних бічних функціональні групи складових амінокислот, як ланцюгів таких амінокислот, як Lys і Arg; правило, повинні бути захищені для уникнення ацетамідометильні, бензильні (Вn) або третутворення небажаних зв'язків. Захисні групи, котрі бутилсульфонільні частини, які можна можна для цього використовувати, перелічені, застосовувати для захисту сульфідвмісного наприклад, в [Greene, "Protective Groups in Organic бічного ланцюга цистеїну; бензилові (Вn) етери Chemistry", John Wiley & Sons, New York (1981)] і в можна застосовувати для захисту бічних ланцюгів ["Peptides: Analysis, Synthesis, Biology", Vol. 3, з гідроксильними групами серину, треоніну та Academic Press, New York (1981)], вміст яких гідроксипроліну; бензилові естери можна включений у даний опис шляхом посилання. застосовувати для захисту бічних ланцюгів з a-Аміногрупа кожної амінокислоти, котра карбоксигрупами аспарагінової і глутамінової повинна зв'язуватися пептидним ланцюгом, що кислот. росте, повинна бути захищена (APG). Для цього Якщо для захисту a-аміну вибирають Fmoc, то можна використовувати будь-яку захисну групу, звичайно прийнятними є трет-бутильні захисні відому в даній галузі техніки. Як приклади таких групи. Наприклад, Вос можна застосовувати для груп можна назвати: 1) ацильні групи, такі, як лізину й аргініну, трет-бутиловий етер - для формільна, трифторацетильна, фталільна і rсерину, треоніну і гідроксипроліну, а трет 27 80973 28 котрі можна розщеплювати шляхом обробки бутиловий естер - для аспарагінової кислоти і слабкою основою або м'якими відновними глутамінової кислоти. Трифенілметильну засобами, такими, як трихлоретиловий і (тритильну) частину можна використовувати для фенациловий естери. захисту сульфідвмісного бічного ланцюга цистеїну. По завершенню росту пептидного ланцюга все Утворювана a-карбонова кислота (продукт захисні групи видаляють. При застосуванні розщеплення внаслідок обробки слабкою синтезу в рідкій фазі захисні групи можна кислотою, слабкою основою або м'яким відновним видаляти за допомогою будь-якого процесу, що засобом) сполучається з R1SO2NH2 (приготованим відповідає вибраній захисній групі. Ці процеси шляхом обробки R1SO2CI в насиченому розчині повинні бути добре відомими фахівцям у даній аміаку в тетрагідрофурані) при наявності пептидгалузі. зв'язуючого агента, такого, як CDI або EDAC, при Далі, у синтезі сполук за даним винаходом наявності основи, такої, як 4-диметиламінопіридин можна дотримуватися таких рекомендацій. (4-DMAP) і/або 1,8-діазабіцикло[5.4.0]ундец-7-ен Наприклад, для приготування сполуки, що містить (DBU), з убудовуванням Р'-частини й ефективним R4-C(O)-, R4-S(O)2, захищений Р3, цілий пептид, збиранням трипептиду P1'-P1-P2-P3-APG. У цьому або пептидний сегмент сполучають з підходящим процесі, як правило, використовується 1-5 ацилхлоридом або сульфонілхлоридом, еквівалентів Р'-зв'язуючих речовин. відповідно, які можна придбати комерційним Крім того, якщо захисна група APG для Р3 шляхом або синтезувати за допомогою добре видаляється і замінюється на В-частиною за відомих процесів. Для приготування сполуки, що допомогою описаних вище процесів, а утворювана містить R4-C(O)-, захищений Р3, цілий пептид або внаслідок розщеплення а-карбонова кислота пептидний сегмент сполучають з відповідним (розщеплення проводили шляхом обробки хлорформіатом, який можна придбати слабкою кислотою, слабкою основою або м'якими комерційним шляхом або синтезувати за відновними засобами) сполучається з R1SO2NH2 допомогою добре відомих процесів. Як Вос-похідні (отриманим шляхом обробки R1SO2CI у використовують (Вос)2О. насиченому розчині аміаку в тетрагідрофурані або Наприклад, за допомогою описаних тут альтернативних процесів) при наявності пептид-зв'язуючої речовини, наприклад CDI або EDAC, й основи, такої, як 4-диметиламінопіридин (4-DMAP) і/або 1,8-діазабіцикло[5.4.0]ундец-7-ен (DBU), з вбудовуванням Р'-частини й ефективним збиранням трипептиду Р1'-Р1-Р2-Р3-В. У цьому процесі, як правило, використовується 1-5 еквівалентів Р'-зв'язуючих речовин. Сполуки за даним винаходом можна отримувати за допомогою найрізноманітніших процесів, включаючи процеси, описані нижче в прикладах, і процеси, описані в [Патенті США Циклопентанол піддають обробці фосгеном, №6323180 і Патентній заявці США №10/001850, отримуючи відповідний хлорформіат. поданій 20 листопада 2001р.]. Зміст Патенту США Хлорформіат приводять у взаємодію 6323180 і Патентної заявки США 10/001850, вміст потрібним ІМН2-трипептидом при наявності яких включений тут в усій їхній повноті шляхом основи, наприклад триетиламіну, отримуючи в посилання. результаті циклопентилкарбамат. Нижче на Схемі II відображено загальний При синтезі сполуки, що містить R4-N(R5)процес, дотримуючись якого сполуки за формулою C(O)- або R4-NH-(S)-, захищений Р3, цілий пептид І конструюють шляхом сполучення проміжної або пептидний сегмент піддають обробці трипептидкарбонової кислоти (1) із фосгеном і за цим приводять у взаємодію з сульфонамідом Р'. (Слід зауважити, що групи R6, аміном, як описано в [SynLett. Feb 1995; (2); 142R7, R8, R9, R10, R11, як показано нижче, є 144], або проводять реакцію з промисловим замісниками в гетероциклічній системі). Зазначена ізоціанатом і підходящою основою, наприклад, реакція сполучення потребує обробки карбонової триетиламіном. кислоти (1) зв'язуючим реагентом, таким, як При синтезі сполуки, що містить R4-N(R5)карбонілдіімідазол, в розчиннику, наприклад THF, S(O2)-, захищений Р3, цілий пептид або пептидний котрий можна кип'ятити зі зворотним сегмент піддають обробці свіжоприготованим або холодильником з додаванням після цього промисловим сульфамілхлоридом з наступною за отриманої похідної сполуки (1) до Р1'цим взаємодією з аміном, як описано в [Ger. Offen. сульфонаміду в розчиннику, наприклад, THF або (1998), 84 pp.19802350] або в [WO 98/32748]. хлористому метилені при наявності основи, Групу a-карбоксилу С-кінцевого залишку наприклад DBU. звичайно захищають як естер (CPG), котрий можна розщепити з утворенням карбонової кислоти. Для цього можна застосовувати, наприклад, такі захисні групи: 1) алкілові естери, такі, як метиловий, триметилсиліловий і третбутиловий; 2) арилалкілові естери, такі, як бензиловий і заміщений бензиловий; 3) естери, 29 80973 30 наприклад РуВОР, при наявності основи, наприклад діізопропіламіну, і в розчиннику, наприклад хлористому метилені. Отримуваний у результаті цього проміжний продукт Р2-Р1-Р1' можна перетворювати на сполуки за формулою І шляхом двостадійного синтезу, де на першій стадії відбувається зняття захисту на амінокінці Р2 у присутності кислоти, такої, як TFA, в розчиннику, наприклад хлористому метилені. Отримана сіль трифтороцтової кислоти може сполучатися з карбоксильним кінцем елемента Р4-Р3 за допомогою звичайних зв'язуючих речовин, наприклад РуВор, при наявності основи, такої, як 2. Основа діізопропіламін, і використовуючи розчинники, Альтернативний процес конструювання сполук наприклад дихлорметан, з утворенням сполук (4) за формулою І показано на Схемі III. Тут за формулою І. сульфонамідний елемент PV сполучається з елементом Р1 за допомогою процесу, відображеного на Схемі І. З отриманої в результаті цього процесу Р1-Р1'-частини можна по закінченню його зняти захисну групу на амінокінці. У цьому загальному прикладі використовується захисна група Вос, але для фахівця в даній галузі цілком зрозуміло, що в даному процесі можна застосовувати й інші захисні групи. Зазначену захисну Вос-групу можна видалити за допомогою, наприклад, трифтороцтової кислоти в розчиннику, такому, як дихлоретан. При цьому одержують позбавлений захисту амін у формі солі TFAкислоти. Зазначена TFA-амінна сіль може безпосередньо застосовуватися в наступній реакції сполучення, або в альтернативному варіанті TFA-амінну сіль можна спочатку перетворити на НСІ-амінну сіль, і останню використовувати в зазначеній реакції сполучення, відображеній на Схемі III. Сполучення НСІ-амінної солі (3) з карбоксильним кінцем при наявності зв'язуючих реагентів, наприклад HATU, в розчинниках, таких, як дихлорметан, можна одержати сполуки (4) за формулою І. де: Base coupling agent: Основа як зв'язуюча речовина Deprotection: Зняття захисту Проміжний продукт Р4-Р3-Р2, використовуваний у процесах згідно з вищенаведеними схемами, може бути сконструйований так, як описано вище, з подальшим розвитком цього процесу відповідно до загальної Схеми V. Тут вільний карбоксильний кінець проміжного продукту Р4-Р3 (1) може сполучатися з амінокінцем елемента Р2 з утворенням дипептиду Р4-Р3-Р2 (2). Захисну групу з карбонільного кінця проміжного продукту Р4-Р3Р2 можна видалити шляхом омилення естерної групи з одержанням Р4-Р3-Р2 у формі вільної карбонової кислоти (3). Проміжні продукти, подібні (3), можна перетворити на сполуки за формулою І де: за допомогою процесів, розглянутих у даному 1. Base coupling agent: Основа як зв'язуюча описі. речовина 2. Acid: Кислота Альтернативний процес конструювання сполук за формулою І показаний на Схемі IV. Тут гідрохлорид Р1-Р1'-кінцевого аміну (1) сполучається з вільною карбоксильною групою елемента Р2 за допомогою зв'язуючих речовин, 31 Сполуки за формулою І можна також перетворювати на інші сполуки за формулою І за допомогою описаних тут процесів. Один з прикладів таких процесів поданий на Схемі VI. Тут сполуку за формулою І (1), що містить групу Вос у положенні Р4, перетворювали на сполуку (3) за формулою І, котра містить карбамідну групу в положенні Р4. Перетворення (1) на (3) можна здійснювати у дві стадії, на першій з котрих сполуку (1) перетворювали на амін (2) шляхом обробки (1) кислотою, наприклад, TFA в розчиннику, наприклад, хлористому метилені. Утворену TFA-амінну сіль обробляють ізоціанатом при наявності одного еквівалента основи. При цьому одержують сполуку (3) за формулою І, в котрій Р3-частина завершується сечовиною. Як зазначалося вище, для фахівця цілком зрозуміло, що проміжний продукт (2) можна застосовувати як вихідний матеріал для одержання сполук за формулою І, в котрих група РЗ завершується амідною або сульфонамідною, або тіокарбамідною, або сульфамідною групою. Конструювання зазначених сполук за формулою І можна здійснювати в стандартних умовах утворення зазначених функціональних груп Р4 із амінів. де: Р4 removal: Видалення Р4 80973 32 Coupling: Сполучення При конструюванні сполук за формулою І Р1'кінець вбудовують у молекули за допомогою одного із загальних процесів, коротко окреслених вище і більш докладно описаних нижче. У деяких прикладах елементи Р1', тобто циклоалкіл- або алкілсульфонаміди, можна одержати як комерційним шляхом, так і з відповідного алкіл-або циклоалкілсульфонілхлориду шляхом обробки останнього аміаком. Інакше ці сульфонаміди можна синтезувати згідно із загальним процесом, відображеним на Схемі VII. У цьому процесі продажний 3-хлорпропілсульфонілхлорид (1) перетворювали на відповідний захищений сульфонамід, наприклад, шляхом обробки третбутиламіном. Після цього сульфонамід (2) перетворювали на відповідний циклоалкілсульфонамід шляхом обробки двома еквівалентами основи, наприклад бутиллітiю, в розчиннику, такому, як THF, при низькій температурі. Захисну групу в отриманому циклогексилсульфонаміді можна зняти шляхом обробки його кислотою, і таким чином одержати цільовий незахищений циклоалкілсульфонамід. Елементи Р1, що використовуються для одержання сполук за формулою І, у деяких випадках отримуються комерційним шляхом, а в інших - синтезуються за допомогою описаних тут процесів. Вбудовування їх у сполуки за формулою І здійснюють у відповідності з процесами, запропонованими даним винаходом. Заміщені циклопропіламінокислоти Р1 можна синтезувати, використовуючи загальний процес, відображений на Схемі VIII. Імін (1), придбаний комерційним шляхом або легко синтезований, піддають обробці 1,4дигалоїдбутеном (2) при наявності основи, отримуючи імін (3). Після цього, імін (3) піддають кислотному гідролізу і одержують продукт (4), котрий містить алільний замісник, що є син-форми до карбоксильної групи як основний продукт. Амінну частину сполуки (4) захищають за допомогою Вос-групи, одержуючи повністю захищену амінокислоту (5). Цей проміжний продукт є рацематом, котрий можна розкласти за допомогою ферментативного процесу, при якому естерну частину сполуки (5) розщеплюють за допомогою протеази, отримуючи відповідну карбонову кислоту. Не вдаючись до будь-якої конкретної теорії, можна вважати, що ця реакція є селективною, оскільки один із енантіомерів при цьому реагує зі значно вищою швидкістю, ніж його 33 80973 дзеркальне відображення, що в результаті приводить до кінетичного розділення проміжного рацемату. У наведених тут прикладах більш кращим стереоізомером для інтегрування у сполуки за формулою І є стереоізомер 5а, який уміщає стереохімію (1R, 2S). За наявності ферменту естерна група цього енантіомеру не зазнає розщеплення, і тому енантіомер (5а) регенерується із реакційної суміші. Проте, естерна група менш кращого енантіомеру (5b), що вміщає стереохімію (1S, 2R), розщеплюється, тобто піддається гідролізу, в результаті чого утворюється вільна кислота (6). По завершенню цієї реакції естер (5а) можна відокремити від кислоти (6) за допомогою звичайних методів, наприклад, водної екстракції або хроматографії. На схемах, наведених нижче, показані процеси одержання проміжних продуктів Р2 і сполук за формулою І. Слід зауважити, що в багатьох випадках реакції показані лише для одного положення проміжного продукту. Але цілком зрозуміло, що такі реакції можна використовувати для проведення модификацій з іншими положеннями цього проміжного продукту. Крім того, зазначені проміжні продукти, умови реакції і процеси, розглянуті в конкретних прикладах, можуть широко застосовуватися до сполук з іншими замісниками. Після поданих нижче загальних схем наведені приклади, як загальні, так і специфічні, які не є такими, що обмежують. Так, наприклад, ізохінолінове ядро показане тут як частина загальної Схеми IX. Проте, цей підхід є таким, що може бути втілений у процес конструювання сполук з іншими гетероциклічними замісниками, що не є ізохінолінами, наприклад, хінолінами або піридинами. 34 На Схемі IX відображений процес сполучення N-захищеної С4-оксипролінової частини з гетероциклом з утворенням проміжного продукту (4) і подальшими перетвореннями зазначеного проміжного продукту на сполуку за формулою І шляхом подовження поліпептидного ланцюга згідно з даним описом. Слід зауважити, що на першій стадії, котра являє собою сполучення С4гідроксипролінової частини з гетероарильним елементом, використовується основа. Фахівцям у даній галузі добре відомо, що подібного роду сполучення можна здійснювати, використовуючи такі основи, як трет-бутоксид калію або гідрид натрію, в розчиннику, наприклад, ДМФА, ДМСО або THF. Це приєднування до циклічної системи ізохіноліну відбувається в положенні С1 (нумерація для циклічної системи ізохіноліну показана на проміжному продукті 2 Схеми IX) і спрямовується хлорвмісною групою, котра у цьому процесі заміщується. Слід зауважити, що в цьому положенні можна використовувати інші побічні групи, що відходять, наприклад, фторвмісна група, як це показано на схемі. Такі фторвмісні проміжні продукти (3) можна отримувати із відповідних хлорвмісних сполук згідно з відомими із літератури процесами, розглянутими в даному опису. Слід зауважити також, що положення побічної групи (хлору або фтору) в даній циклічній системі може мінятися, як показано на Схемі X, де побічна група (у даному прикладі - фтору) є в положенні С6 кільцевої системи ізохіноліну проміжного продукту (2). Далі, варто нагадати, що положення кільцевих гетероатомів в проміжних продуктах, подібних продуктам (2) на Схемах IX і X, також змінюється, 35 80973 як це визначається самим поняттям описуваного тут гетероциклу. Проміжний продукт (2) на Схемі X може приєднуватися до похідної С4 оксипроліну, утворюючи Р2-елемент (3). Цю С6-заміщену похідну ізохіноліну можна перетворювати на сполуки за формулою І за допомогою описаних тут процесів. Альтернативою вищеописаному процесу сполучення С4-гідроксипроліну з ароматичними і гетероароматичними сполуками є реакція Міцунобу, відображена на стадії 1 Схеми XI. На цій загальній схемі процесу проведення реакцій похідна С4гідроксипроліну сполучається з кільцевою системою хіназоліну. У цій реакції використовуються такі реагенти, як трифенілфосфин і DEAD (діетилазодикарбоксилат), в апротонних розчинниках, таких, як THF або діоксан. Цю реакцію можна застосовувати для одержання арилових або гетероарилових етерів. Слід зауважити, що у ході цієї реакції сполучення стереохімія С4 хірального центра в похідній С4гідроксипроліну змінюється на протилежну, у зв'язку з чим необхідно як вихідний матеріал використовувати похідну С4-гідроксипроліну зі стереохімією (S) у положенні С4 (як показано на Схемі XI). Слід додати, що в літературі описані численні модификації і вдосконалені варіанти реакції Міцунобу, включені в даний опис. У багатьох розглянутих тут прикладах здійснення даного винаходу ізохіноліни вбудовуються в остаточні сполуки і, зокрема, в ділянку Р2 зазначених сполук. Для фахівця в даній галузі цілком зрозуміло, для синтезу ізохінолінов придатними є численні загальні процеси. Крім того, зазначені ізохіноліни, отримані за допомогою цих процесів, можна легко вбудовувати в остаточні сполуки за формулою І за допомогою процесів, поданих у даному опису. Один із загальних процесів синтезу ізохінолінов відображений на Схемі XII. Тут похідні коричної кислоти, показані у загальному вигляді структурою (2), перетворювалися на 1-хлорізохіноліни за чотири стадії. Зазначені хлорізохіноліни після 36 цього можна використовувати в реакції сполучення з утворенням похідних С4гідроксипроліну. Перетворення коричних кислот на хлорхіноліни починають з обробки коричної кислоти алкілхлорформіатом при наявності основи. Утворений внаслідок цього ангідрид піддають обробці азидом натрію, що приводить до утворення ацилазиду (3), як показано на Схемі. Існують інші методи одержання ацилазидів із карбонових кислот. Так, наприклад, карбонову кислоту можна обробляти дифенілфосфорилазидом (DPPA) в апротонному розчиннику, такому, як дихлорметан, при наявності основи. На наступній стадії реакції ацилазид (3) перетворювали на відповідний ізохінолон (4), як показано на схемі, що розглядається. Для цього ацилазид нагрівають до температури приблизно 190°С у висококиплячому розчиннику, такому, як дифенілметан. Ця реакція є загальною і дає заміщений ізохінолон, що утворюється із відповідних похідних коричної кислоти з виходами від помірного до доброго. Слід зауважити, що зазначені похідні коричної кислоти можна придбати комерційним шляхом або ж приготувати із відповідного бензальдегиду (1) шляхом прямого сполучення з малоновою кислотою або її похідною, а також за допомогою реакції Вітіга. Проміжні ізохінолони (4) на Схемі XII можна перетворити на відповідний 1-хлорізохінолін шляхом обробки оксихлоридом фосфору. Ця реакція є загальною, і її можна застосовувати для будь-яких ізохінолонів, хінолонів та інших гетероциклів згідно з даним описом з метою перетворення гідрокси-замісника на відповідну хлорвмісну сполуку, якщо існує спряження поміж зазначеною гідроксигрупою і атомом азоту в даних гетероциклічних системах. Іншим шляхом синтезу кільцевої системи ізохіноліну є застосування методу ПомеранцаФритша. Цей загальний метод ілюстрований на Схемі XIII. Згідно з ним спочатку здійснюють перетворення бензальдегіду (1) на функціоналізований імін (2). Після цього зазначений імін перетворювали на кільцеву систему ізохіноліну шляхом обробки кислотою при 37 підвищеній температурі. Цей процес синтезу ізохіноліну, який відображено на Схемі XIII, є загальним і особливо ефективним у приготуванні ізохінолінових проміжних продуктів, заміщених в положенні С8 (примітка: у проміжному продукті (3) на Схемі XIII замісником у положенні С8 ізохіноліну є R11). Проміжні ізохіноліни (3) можна перетворити на відповідні 1-хлорізохіноліни (5) у дві стадії, як показано на даній схемі. На першій стадії при обробці ізохіноліну (3) метахлорбензойною кислотою в апротонному розчиннику, такому, як дихлорметан, відбувається утворення N-оксиду ізохіноліну (4). Проміжний продукт (4) можна перетворити на відповідний 1хлорізохінолін шляхом обробки його оксихлоридом фосфору у киплячому хлороформі. Слід зауважити, що цей двостадійний процес є загальним і може застосовуватися для одержання хлорізохінолінов і хлорхінолінов із підходящих ізохінолінов і хінолінов, відповідно. На Схемі XIV ілюстрований ще один процес синтезу кільцевої системи ізохіноліну. У цьому процесі орто-алкілбензамідну сполуку (1) піддають обробці сильною основою, якою може бути, наприклад, трет-бутиллітій, в розчиннику, такому, як THF, при низькій температурі. Після цього до реакційної суміші добавляють нітрил, котрий вступає в реакцію приєднання з аніоном, що утворюється при депротонуванні (1), внаслідок якого утворюється сполука (2). Ця реакція є загальною і може застосовуватися для одержання заміщених ізохінолінов. Проміжний продукт (2) на Схемі XIV можна перетворити на відповідний 1хлорізохінолін за допомогою процесів, розглянутих у даному описі. Інший процес синтезу ізохінолінів показаний на Схемі XV. Депротонування проміжного продукту (1) із застосуванням трет-бутиллітію описано вище. Проте, в даному процесі зазначений проміжний аніон захоплюється естером, внаслідок чого утворюється проміжний продукт (2), як показано нижче. У наступній реакції кетон (2) сполучається з ацетатом амонію при підвищеній 80973 38 температурі, утворюючи хінолон (3). Ця реакція є загальною і може застосовуватися для конструювання заміщених ізохінолонів, котрі можна перетворювати на відповідні 1хлорізохіноліни згідно з даним описом. На Схемі XVI ілюстрований ще один процес конструювання ізохінолінів. На першій стадії цього процесу проводилиь депротонування ортоалкілариліміну (1) (втор-бутиллітій, THF), і до отриманого в результаті аніону добавляють активну карбокислотну сполуку, наприклад, амід Вейнреба. Утворений кетоімін (2) можна перетворити на відповідний ізохінолін шляхом сполучення його з ацетатом амонію при підвищених температурах. Цей процес є загальним і може застосовуватися для синтезу заміщених ізохінолінов. Зазначені ізохіноліни можна перетворювати на відповідні 1хлорізохіноліни за допомогою процесів, розглянутих у даному описі. Описані тут гетероцикли, що вбудовуються в сполуки за формулою І, можна додатково функціоналізувати. Цілком зрозуміло, що додаткову функціоналізацію зазначених гетероциклів можна здійснювати до або після вбудування цих функціональних груп (гетероциклів) у сполуки за формулою І. Цей процес ілюстрований на схемах нижче. Наприклад, на Схемі XVII показано перетворення 1-хлор-6-фторізохіноліну на відповідні 39 1-хлор-6-алкоксиізохіноліни шляхом обробки сполуки (1) (рівняння 1) алкоксидом натрію або калію у спиртовому розчиннику, в котрому алкоксид утворюється при кімнатній температурі. У деяких випадках необхідно нагрівати реакційну суміш, щоб довести реакцію до кінця. Зазначений хлорхінолін можна вбудовувати в сполуку за формулою І, дотримуючись описаних тут процесів. Модифікації гетероциклічного елемента Р2 можна також здійснювати після його вбудовування в сполуки за формулою І, як показано в (рівн. 2) Схеми XVII. Зокрема, сполуки, наприклад, (1) в (рівн. 2), котрі містять побічну групу в кільцевій системі фталазину, можна замінити на нуклеофил, наприклад алкоксид, у розчиннику, наприклад, відповідному спирті, із якого утворений даний алкоксид. Ці реакції можна проводити при кімнатній температурі, але в деяких випадках для завершення реакції може потребуватися нагрів реакційної суміші. На Схемі XVIII показаний загальний процес модифікації гетероциклів у відповідності з даним тут визначенням із застосуванням реакцій сполучення, опосередкованих паладієм. Зазначене сполучення можна застосовувати для функціоналізації гетероциклу в будь-якому положенні кільцевої системи за умови, що це кільце є відповідним чином активоване або функціоналізоване, наприклад, за допомогою хлориду, як показано на схемі. При цьому спочатку проводили реакцію 1-хлорізохіноліну (1) з метахлорпербензойною кислотою, отримуючи відповідний N-оксид (2). Далі проміжний продукт (2) можна перетворити на відповідний 1,3дихлорізохінолін (3) шляхом обробки оксихлоридом фосфору в киплячому хлороформі. Проміжний продукт (3) може сполучатися з N-Boc4-гідроксипроліном за допомогою процесів, поданих у даному описі, даючи проміжний продукт (5), як показано на схемі. Проміжний продукт (5) може сполучатися за реакцією Судзукі з арилборною кислотою при наявності паладієвого реагенту й основи в розчиннику, такому, як THF, толуол чи ДМФА. При цьому утворюється С3арилізохіноліновий проміжний продукт (6). В цій Pd-опосередкованій реакції сполучення можна також застосовувати гетероарилборні кислоти і отримувати проміжний С3-гетероарилізохінолін (6). Проміжний продукт (6) далі перетворювали на 80973 40 остаточні сполуки за формулою І за допомогою процесів, поданих у даному описі. Опосередковане паладієм сполучення гетероарильних систем з арильними або гетероарильними елементами можна також використовувати на останніх стадіях синтезу при конструюванні сполук за формулою І, як показано на Схемі ІХХ. Згідно з цією схемою проміжний трипептидацилсульфонамід (1) сполучається з 1хлор-3-бромізохіноліном (2) у відповідності з описаним вище процесом заміщення гетероарильної частини на алкоксид з утворенням проміжного продукту (3). Сполучення (1) і (2) найбільш ефективно відбувається при наявності каталізатора, такого, як хлорид лантану, згідно з даним описом. Кільцеву систему проміжного ізохіноліну (3) можна додатково функціоналізувати шляхом сполучення за Судзукі (Процес 1: продукт (3) приводять у взаємодію з гетероарил- або арилборною кислотою при наявності паладієвого каталізатора, такого, як тетра(трифенілфосфін)паладій, і основи, такої, як карбонат цезію, в розчиннику, наприклад ДМФА), або шляхом сполучення за реакцією Штиле (Stille) (Процес 2: продукт (3) приводять у взаємодію з гетероарильними або арильними сполуками олова при наявності паладієвого каталізатора, такого, як тетра(трифенілфосфін)паладій, в розчиннику, наприклад толуолі). Для сполучення С4-амінопролінових елементів з функціоналізованими гетероциклами можна також використовувати реакції з паладієвим каталізатором. На Схемі XX показано сполучення проміжного продукту (1) з функціоналізованим ізохіноліном при наявності паладієвого 41 80973 42 каталізатора і основи в розчиннику, такому, як підоболонкових і інтралезіональних ін'єкцій та толуол. Проміжні продукти, подібні сполуці (3), інфузій. можна перетворити на сполуки за формулою І за Фармацевтичні композиції можуть мати форму допомогою процесів, поданих у даному описі. стерильних препаратів для ін'єкцій, наприклад, водних або масляних суспензій. Такі суспензії можна готувати добре відомими методами із використанням диспергаторів або поверхневоактивних і суспендувальних речовин. Процеси одержання таких сполук добре відомі фахівцям у даній галузі. При пероральному застосуванні фармацевтичні композиції за даним винаходом можуть вводитися у будь-якій перорально прийнятній лікарській формі, включаючи, наприклад, капсули, таблетки, водні суспензії і розчини. Серед носіїв, що звичайно Для конструювання кільцевої системи використовуються в пероральних таблетках, функціоналізованого ізохіноліну можна також можна назвати лактозу і маїсовий крохмаль. Як використовувати реакції [4+2] циклоприєднання. правило, добавляють також мастила, наприклад, Наприклад, (Схема XXI) застосування стеарат магнію. Серед розріджувачів для вінілізоціанатів (1) у реакціях циклоприєднання з перорального застосування препаратів у формі бензольними попередниками (2) дозволяє капсул можна назвати лактозу і сухий маїсовий отримати функціоналізовані ізохінолони (3). крохмаль. У разі перорального вживання Зазначені ізохіноліни можна вбудовувати в препаратів у формі водних суспензій активний сполуки за формулою І, за допомогою процесів, інгредієнт об'єднують з емульгатором і розкритих у даному описі. суспендувальним агентом. Якщо потрібно, то до складу препарату можна добавляти певні підсолоджувачі і/або коригенти смаку і запаху, а також барвники. Стосовно інших варіантів підходящих носіїв для вищезазначених композицій інформацію можна знайти в стандартних фармацевтичних посібниках, наприклад, в ["Remington's Pharmaceutical Sciences", 19th ed., Mack Publishing Company, Easton, Penn., 1995]. Решта деталей стосовно розробки і приготування підходящих Даним винаходом також передбачені форм постачання фармацевтичних композицій за композиції, що містять запропоновану сполуку або даним винаходом добре відома фахівцям у даній її фармацевтично прийнятні сіль, сольват або галузі. проліки і фармацевтично прийнятний носій. При монотерапії з метою профілактики і Фармацевтичні композиції згідно з даним лікування HCV-опосередкованого захворювання винаходом містять терапевтично ефективну типовими є рівні доз сполук за даним винаходом у кількість запропонованої сполуки, або її межах 0,01-1000 міліграмів на кілограм (мг/кг) фармацевтично прийнятную сіль, фармацевтично маси тіла за день, переважно в межах 0,5-250мг/кг прийнятний сольват або фармацевтично маси тіла за день. Як правило, фармацевтичні прийнятні проліки, і фармацевтично прийнятний композиції за даним винаходом уводять 1-5 разів носій, причому фармацевтично прийнятний носій за день або ж шляхом безперервного вливання. являє собою, наприклад, ексципієнт або носійТаке введення можна застосовувати для лікування розріджувач. хронічних або гострих станів. Кількість активного Вміст активного інгредієнта, тобто активної інгредієнта, котру можна об'єднувати з носійними сполуки, в таких композиціях, як правило, складає речовинами для приготування однієї дози 0,1-99,9%(мас.) від маси композиції і часто лежить лікарської форми, залежить від реципієнта, що у межах 5-95%(мас). піддається лікуванню, і конкретного способу Фармацевтичні композиції за даним застосування. винаходом можна вводити перорально, Для фахівця у даній галузі цілком зрозуміло, парентерально або за допомогою імплантованого що на практиці можуть потребуватися як нижчі, так резервуара. Кращими є пероральне вживання та і вищі дози за ті, що були зазначені у ін'єкції. У деяких випадках рН препарата можна попередньому абзаці. Конкретне дозування і корегувати за допомогою фармацевтично режим лікування для даного пацієнта залежать від прийнятних кислот, основ або буферів для низки чинників, включаючи активність підвищення стабільності сполуки в препараті або її застосовуваної сполуки, віку, маси тіла, загального форми постачання. Використовуваний тут термін стану здоров'я, статі, раціону харчування, часу "парентеральний" охоплює цим поняттям способи застосування ліків, швидкості звільнення підшкірних, внутрішньошкірних, внутрішньовенних, активного інгредієнта, конкретної комбінації внутрішньом'язових, внутрішньосуглобових, лікарських речовин, тяжкості і перебігу інтрасиновіальних, внутрішньогрудинних, інфекційного захворювання, схильності пацієнта 43 80973 44 до інфікування і рішення лікаря. Як правило, дослідженнях. Ці сполуки можуть служити лікування починають з малих доз, суттєво нижчих ефективним засобом у створенні дослідницького оптимальної дози пептиду. Після цього дозу інструментарію для розробки процесів аналізу потроху підвищують доти, поки не буде досягнуто вірусної реплікації, оцінки систем аналізу тварин і оптимальний ефект у даних умовах. У загальному структурних біологічних досліджень з метою випадку найбільш бажано вводити сполуку при поглиблення знань щодо механізму HCV-хвороб. рівні концентрації, котрий звичайно дає ефективні Сполуки за даним винаходом можна також результати проти вірусу, не викликаючи ніяких використовувати в лікуванні та профілактиці шкідливих або руйнівних побічних ефектів. вірусного забруднення матеріалів і, отже, для Якщо композиції за даним винаходом містять зниження ризику вірусного інфікування комбінацію запропонованої сполуки з одним чи лабораторного і медичного персоналу або більше додаткових терапевтичних або пацієнтів, що вступають у контакт з такими профілактичних засобів, то як сполука, так і матеріалами як, наприклад, кров'ю, тканинами, додатковий засіб звичайно є наявними в них в хірургічними інструментами й одягом, дозах приблизно 10-100%, а в кращому варіанті - в лабораторними інструментами й одягом, а також з дозах приблизно 10-80% від дози, котра звичайно апаратурою і матеріалами для збирання або застосовується в режимі монотерапії. переливання крові. Якщо ці сполуки або їх фармацевтично Приклади прийнятні солі, сольвати чи проліки готують у Наведені нижче конкретні приклади, що формі препарату з терапевтично прийнятним ілюструють процеси синтезу сполук за даним носієм, то приготовану композицію можна вводити винаходом, жодним чином не обмежують об'єму in vivo ссавцям, у тому числі людині з метою винаходу. Ці процеси можуть бути певним чином інгібування NS3-протеази HCV-вірусу або з метою пристосовані до одержання сполук, які лікування або профілактики HCV-вірусної інфекції. охоплюються об'ємом винаходу, але в даному Таке лікування можна також здійснювати, описі окремо не згадуються. Крім того, для використовуючи сполуки за даним винаходом в фахівця у даній галузі очевидною повинна бути комбінації з такими засобами, як: також можливість одержання однакових сполук за імуномодулятори, наприклад, інтерферони; інші даним винаходом за допомогою різноманітних антивірусні засоби, такі, як рибавірин, амантадин; варіантів даних процесів, що незначною мірою інші інгібітори NSS-протеази HCV; інгібітори інших різняться між собою. мішеней життєвого циклу HCV, таких, як геліказа, Якщо спеціально не зазначено іншого, то вміст полімераза, металопротеаза або внутрішній сайт компонентів у розчинах виражається тут прикріплення рибосом; та інші, або їх комбінації. відношенням масових і об'ємних відсотків, а Додаткові засоби можна об'єднувати зі сполуками співвідношення розчинів виражається в об'ємних за даним винаходом для приготування відсотках. Спектри ядерного магнітного резонансу однократної дози лікарської форми. В іншому (ЯМР) були записані на спектрометрі Bruker 300, варіанті додаткові засоби можна вводити ссавцю 400 і 500МГц; хімічні зсуви (d) виражені в відокремлено як частину багатократної дози. мільйонних частинах (ррm). Флеш-хроматографію Таким чином, згідно з ще одним аспектом проводили на силікагелі (SiO2) за методом Стила даного винаходу пропонується процес інгібування [W.C. Still et al., J. Org. Chem., (1978), 43, 2923]. HCV NS3-протеазної активності у пацієнта шляхом Усі дані рідинної хроматографії (LC) були введення пацієнту сполуки за даним винаходом записані на рідинному хроматографі Shimadzu LCабо її фармацевтично прийнятної солі чи 10AS з детектором SPB-10AV-VIS. Macфармацевтично прийнятного сольвату, замісники спектрометричні (MS) дані були отримані на котрих є такими, як визначено вище. установці Micromass Platform для LC у режимі У кращому варіанті здійснення винаходу цей електророзпорошування (ES+). Якщо не зазначено процес застосовується для зниження HCV NS3іншого, то в наведених нижче прикладах кожну протеазної активності в організмі пацієнта. Якщо сполуку піддавали аналізу методами рідинної фармацевтична композиція містить як активний хроматографії і мас-спектрометрії (LC/MS) з компонент тільки сполуку за даним винаходом, то різними методиками в таких умовах: такий процес може додатково включати стадію Колонки (Методика A)-YMC ODS введення пацієнту засобу, вибраного із групи, що S7 С18 3,0´50мм складається із імуномодулятора, антивірусного (Методика B)-YMC ODSзасобу, інгібітору протеази HCV-вірусу або A S7 С18 3,0´50мм інгібітору інших мішеней у життєвому циклі HCV(Методика C)-YMC S7 вірусу, наприклад, гелікази, полімерази або С18 3,0´50мм металопротеази. Такий додатковий засіб можна (Методика D)-YMC вводити пацієнту до, водночас або після введення Xterra ODS S7 3,0´50мм сполук за даним винаходом. (Методика E)-YMC Xterra В іншому кращому варіанті здійснення ODS S7 3,0´50мм винаходу цей процес застосовують для інгібування (Методика F)-YMC ODSвірусної реплікації у пацієнта. Такий процес може A S7 C18 3,0´50мм застосовуватися для лікування або профілактики Градієнт Від 100% розчинника HCV-захворювання. А/0% розчинника В до Запропоновані сполуки можна також 0% розчинника А/100% використовувати як реагенти в лабораторних розчинника В 45 80973 46 І Елементи Р1 Тривалість градієнта 2хв. (А, В, D, F, G); 8хв. 1. Одержання рацемічного етилового естеру (С, Е) (1R,2S)/(1S,2R)-1-аміно-2Період витримування 1хв. (А, В, D, F, G);2хв. вінілциклопропанкарбонової кислоти (C, E) Витрата елюенту 5мл/хв. Довжина хвилі 220нм детектора Розчинник А 10% МеОН/90% Н2О/0,1% TFA Розчинник В 10% Н2О/90% МеОН/0,1% TFA Скорочення, що використовуються в даному описі і, зокрема, скорочення в наведених нижче ілюстративних прикладах добре відомі фахівцям у даній галузі. Деякі із застосованих скорочень мають такі значення: Гідрохлорид гліцинетилового естеру (303,8г, Rt кімнатна температура 2,16моль) суспендували в трет-бутилметиловому Вое трет-бутилоксикарбоніл етері (1,6л), добавили бензальдегід (231г, DMSO, Диметилсульфоксид 2,16моль) і безводний сульфат натрію (154,6г, ДМСО 1,09моль), і суміш охолодили до 0°С на водяній EtOAc Етилацетат бані з льодом. По краплях протягом 30хв. t-BuOK трет-бутоксид калію добавили триетиламін (455мл, 3,26моль), і суміш Et2O діетиловий етер перемішували протягом 48год. при кімнатній TBME трет-бутилметиловий етер температурі. Реакцію припиняли додаванням THF Тетрагідрофуран льодяної води (1л), і органічний шар CDI Карбонілдіімідазол відокремлювали. Водну фазу екстрагували третDBU 1,8-діазабіцикло[5.4.0]ундец-7-ен бутилметиловим етером (0,5л) і об'єднані органічні TFA трифтороцтова кислота фази промивали сумішшю насиченого водного NMM N-метилморфолін розчину NaHCO3 (1л) і соляним розчином (1л.). HATU О-7-азабензотриазол-1-іл Розчин сушили над MgSO4, концентрували у HBTU О-(1Н-бензотриазол-1-1л)-N,N,N',N'вакуумі, одержуючи в результаті 392,4г продукту, тетраметиламон1йгексафторфосфат HOBT N-гідроксибензотриазол похідної N-бензиліміну у вигляді в'язкого жовтого PyBrop бром-біс-піролідинфосфоній масла, яке використовували безпосередньо на ДМФА Диметилформамід наступній стадії. 1Н ЯМР (CDCI3, 300МГц) d 1,32 (т, (DMF) J=7,1Гц, 3Н), 4,24 (кв, J=7,1Гц, 2Н), 4,41 (д, MeOH Метанол J=1,1Гц, 2Н), 7,39-7,47 (м, 3Н), 7,78-7,81 (м, 2Н), EDTA етилендіамінтетраоцтова кислота 8,31 (с, 1Н). високої HRMS мас-спектрометрія розрізнювальної спроможності DMAP 4-диметиламінопіридин DIPEA Діізопропілетиламін DCM дихлорметан DCE Дихлоретан Сполуки і проміжні хімічні продукти за даним винаходом, описані в наведених нижче прикладах, були одержані за допомогою описаних нижче процесів. Слід зауважити, що розділ "Приклади" поділений на Підрозділи від А до К. Номера прикладів і номера сполук не йдуть безперервно один за одним упродовж усього розділу До суспензії трет-бутоксиду літію (84,06г, "Приклади" даного опису, у зв'язку з чим у кожному 1,05моль) у сухому толуолі (1,2л) по краплях підрозділі зазначається перерив у нумерації. протягом 60хв. добавили суміш N-бензиліміну Нумерація усередині кожного підрозділу, як гліцинетилового естеру (100,4г, 0,526 моль) і правило, є безперервною. У Підрозділі Л описана транс-1,4-дибром-2-бутену (107,0г, 0,500моль) у біологічна активність сполук. У Підрозділі Μ сухому толуолі (0,6л). Після цього темно-червону описана група додаткових сполук, котрі можна суміш різко охолодили добавленням у неї води отримувати за допомогою процесів згідно з даним (1л) і трет-бутилметилового етеру (ТВМЕ, 1л). винаходом. Водну фазу відокремили і вдруге екстрагували Підрозділ А ТВМЕ-етером (1л). Органічні фази об'єднали, Одержання проміжних продуктів добавили 1н. розчин НСІ (1л), і суміш Одержання проміжних продуктів Р1 перемішували при кімнатній температурі протягом Описані в цьому підрозділі проміжні продукти 2год. Органічну фазу відокремили й екстрагували Р1 можна застосовувати для приготування сполук водою (0,8л). Після цього водні фази об'єднали, за формулою і, дотримуючись процесів згідно з наситили сіллю (700г), добавили ТВМЕ (1л), і даним винаходом. суміш охолодили до 0°С. Після цього суміш при 47 80973 48 перемішуванні підлужили до рН 14 добавленням естеру (25,0г, 93,53ммоль) промислового до неї по краплях 10н. розчин NaOH, органічний походження в THF (112мл). Реакційну суміш шар відокремили, а водну фазу екстрагували відігріли до 0°С, перемішали протягом 40хв. і потім знов охолодили до -78°С. До цього розчину ТВМЕ (2´500мл). Об'єднані органічні фази добавили транс-1,4-дибром-2-бутен (20,0г, висушили (MgSO4) і концентрували до об'єму 1л. 93,50ммоль), суміш перемішали протягом 1год. До цього розчину вільного аміну добавляли при 0°С і знов охолодили до -78°С. Добавили третВОС2О або ди-трет-бутилдикарбонат (131,0г, бутоксид калію (11,55г, 102,9ммоль), суміш швидко 0,6моль), і суміш перемішували протягом 4 днів відігріли до 0°С і перемішували ще протягом однієї при кімнатній температурі. Після цього до години, після чого концентрували у вакуумі. Сирий реакційної суміші добавили додаткову кількість дипродукт розчинили в Et2O (530мл), добавили 1н. трет-бутилдикарбонату (50г, 0,23моль), суміш розчин НСІ (106мл, 106ммолей), і утворену кип'ятили зі зворотним холодильником протягом двофазну суміш перемішували протягом 3,5год. 3год. і залишили на ніч охолоджуватися до при кімнатній температурі. Шари розділили, кімнатної температури. Далі реакційну суміш водяний шар промили Et2O (двічі) і підлужили висушили над MgSO4 і концентрували у вакуумі, насиченим розчином Na2HCO3. Цільовий амін одержавши в результаті 80г сирого продукту- Цей екстрагували Et2O (тричі), і об'єднані органічні залишок очистили за допомогою флешфази промили соляним розчином, висушили хроматографії (2,5кг SiO2, елюент 1-2% (MgSO4) і концентрували у вакуумі, одержавши в МеОН/СН2СІ2), одержавши 57г (53%) рацемічного результаті вільний амін. Цей продукт піддали етилового естеру N-Вос-(1R,2S)/(1S,2R)-1-аміно-2обробці 4н. розчином НСІ у діоксані (100мл, вінілциклопропанкарбонової кислоти у вигляді 400ммоль) і концентрували, одержавши жовтого масла, що тверділо при стоянні в гідрохлорид етилового естеру (1R,2S)/(1S,2R)-1холодильнику: 1Н ЯМР (CDCI3, 300МГц) d 1,26 (т, аміно-2-вінілциклопропанкарбонової кислоти у J=7,1Гц, 3Н), 1,46 (с, 9Н), 1,43-1,49 (м, 1Н), 1,76вигляді коричневої напіврідкої речовини (вихід 1,82 (уш м, 1Н), 2,14 (кв, J=8,6Гц, 1Н), 4,18 (кв, 5,3г, 34%), ідентичної речовині, отриманій за J=7,2Гц, 2Н), 5,12 (дд, J=10,3, 1,7Гц, 1Н), 5,25 (уш Методикою А, за винятком наявності в ній с, 1Н), 5,29 (дд, J=17,6, 1,7Гц, 1Н), 5,77 (ддд, невеликої кількості домішки неідентифікованої J=17,6, 10,3, 8,9Гц, 1Н); MS m/z 254,16 (М-1). ароматичної речовини (8%). Стадія 3. Розділяння етилового естеру N-BocГотування гідрохлориду рацемічного (1R,2S)/(1S,2R)-1-аміно-2етилового естеру (1R,2S)/(1S,2R) 1-аміно-2вінілциклопропанкарбонової кислоти вінілциклопропанкарбонової кислоти Етиловий естер N-Вос-(1R,2S)/(1S,2R)-1аміно-2-вінілциклопропанкарбонової кислоти (9,39г, 36,8ммоль) розчинили в 4н. НСІ/діоксані (90мл, 360ммоль) і перемішували протягом 2год. при кімнатній температурі. Реакційну суміш концентрували, одержавши гідрохлорид етилового естеру (1R,2S)/(1S,2R)-1-аміно-2вінілциклопропан-карбонової кислоти з кількісним виходом 7г, 100%. 1Н ЯМР (метанол-d4) d 1,32 (т, J=7,1, 3Н), 1,72 (дд, J=10,2, 6,6Гц, 1Н), 1,81 (дд, J=8,3, 6,6Гц, 1Н), 2,38 (кв, J=8,3Гц, 1Н), 4,26-4,34 (м, 2Н). 5,24 (дд, 10,3, 1,3Гц, 1Н), 5,40 (д, J=17,2, 1Н), 5,69-5,81 (м, 1Н). Альтернативний процес одержання гідрохлориду рацемічного етилового естеру N-Вос(1R,2S)/(1S,2R)-1-аміно-2-вініл циклопропанкарбонової кислоти До розчину трет-бутоксиду калію (11,55г, 102,9ммоль) в THF (450мл) при температурі -78°С добавили N,N-дибензилімін гліцинетилового Розділяння А До водного розчину натрійфосфатного буферу (0,1М, 4,25л, рН 8), поміщеного у 12л реактор із сорочкою і підтримуваного при температурі 39°С і перемішуванні зі швидкістю 300об/хв., добавили 511г акалази (Acalase) 2,4л (приблизно 425мл) (Novozymes North America Inc.). Коли температура суміші досягла 39°С, її рН довели до 8,0 додаванням 50% NaOH у воді. Після цього протягом 40хв. добавили розчин рацемічного етилового естеру N-Вос-(1R,2S)/(1S,2R)-1-аміно-2вінілциклопропан-карбонової кислоти (85мг) у 850мл ДМСО. Температуру реакційної суміші підтримували на рівні 40°С протягом 24,5год. За цей час рН суміші двічі, через 1,5год. і 19,5год, доводили до 8,0 добавленням 50% NaOH у воді. Через 24,5год. було визначено, що енантіомерний надлишок в естері складає 97,2%. Реакційну суміш охолодили до кімнатної температури (26°С) і 49 80973 50 перемішували протягом ночі (16год.), після чого перемішували з 1мл етанолу; після енантіомерний надлишок в естері складав 100%. центрифугування 10мкл супернатант аналізували Далі рН реакційної суміші довели до 8,5 за допомогою хіральної HPLC (рідинної добавленням NaOH, і утворену суміш хроматографії високої розрізнювальної спроможності). До решти реакційної суміші екстрагували МТВЕ (2´2л). Об'єднані МТВЕ фази добавили 0,1мл ДМСО, і планшет витримали в промили 5% NaHCO3 (3´100мл), водою (3´100мл) і термостаті ще протягом 3 днів при 250об/хв. і концентрували у вакуумі, одержавши в результаті 40°С, після чого в ямку добавили чотири мілілітри енантіомерно чистий етиловий естер N-Bocетанолу. Після центрифугування 0мкл (1S,2R)-1-аміно-2-вінілциклопропанкарбонової супернатанту аналізували методом хіральної кислоти у вигляді твердої речовини світло-жовтого HPLC. Результати аналізу показали, що кольору (42,55г; чистота 97% при 210нм, не енантіомерний надлишок складав 100%. містить кислоти; 100% енантіомерний надлишок Розділяння С (ее: enantiomeric excess). До 0,5мл 100мМ HepseNa-буферу (рН 8,5) в Далі водяний шар після екстракції підкислили ямці 24-ямкового планшета (ємність: 10мл/ямку) до рН 2 додаванням 50% H2SO4 і екстрагували добавили 0,1мл есперази (Esperase) 8,0л МТВЕ (2´2л). МТВЕ-екстракт промили водою (протеаза із Bacillus halodurans) (Novozymes North (3´100мл) і випарили, одержавши кислоту у America Inc.) і розчин рацемічного етилового вигляді твердої речовини жовтого кольору (42,74г; естеру N-Boc-(1R,2S)/(1S,2R)-1-аміно-2чистота: 99% при 210нм, не містила естеру). вінілциклопропанкарбонової кислоти (10мг) в 0,1мл ДМСО. Планшет герметизували і витримували в термостаті при 250об/хв. і 40°С. Через 18год. енантіомерний надлишок естеру складав 39,6%. Його було визначено таким чином: відбирали 0,1мл реакційної суміші і ретельно перемішували з 1мл етанолу; після центрифугування 10мкл супернатанту аналізували за допомогою хіральної HPLC. До решти реакційної суміші добавили 0,1мл ДМСО, і планшет витримали в термостаті ще протягом 3 днів при 250об/хв. і 40°С, після чого в ямку добавили чотири мілілітри етанолу. Після центрифугування 10мкл супернатанту аналізували методом хіральної HPLC. Результати аналізу показали, що енантіомерний надлишок складав 100%. Аналіз зразків проводили таким чином. 1) Приготування зразка. Приблизно 0,5мл реакційної суміші ретельно перемішували з 10 об'ємами EtOH. Після центрифугування 10мкл супернатанту упорскували в HPLC-колонку. 2) Визначення конверсії Колонка: YMC ODS А 4,6´50мм, S-5мкм Розчинник: А - 1мМ НСІ у воді; В - MeCN Градієнт: 30% В за 1мин; 30-45% В за 0,5хв; 45% В за 1,5хв; 45-30% В за 0,5хв. Витрата: 2мл/хв. УФ детектування: 210нм Період витримування: кислота -1,2хв.; естер 2,8хв. 3) Визначення енантіомерного надлишку для естеру Розділяння В Колонка: CHIRACEL OD-RH 4,6´150мм, SДо 0,5мл 100мМ Heps·Na-буферу (рН 8,5) в 5мкм ямці 24-ямкового планшета (ємність: 10мл/ямку) Рухома фаза: MeCN/50мМ НСl у воді (67/33) добавили 0,1 (савінази) Savinase 16,0л (протеаза Витрата: 0,75мл/хв. із Bacillus clausii) (Novozymes North America Inc.) і УФ детектування: 210нм розчин рацемічного етилового естеру N-BocПеріод витримування: (1R,2S)/(1S,2R)-1-аміно-2(1S, 2R) ізомер у формі кислоти: 5,2хв.; вінілциклопропанкарбонової кислоти (10мг) в Рацемат: 18,5хв. і 20,0хв; 0,1мл ДМСО. Планшет герметизували і (1R, 2S) ізомер у формі естеру: 18,5хв. витримували в термостаті в режимі обертання зі 2. Одержання етилового естеру N-Вос-(1R,2S)швидкістю 250об/хв. при температурі 40°С. Через 1-аміно-2-циклопропіл-циклопропанкарбонової 18год. енантіомерний надлишок естеру складав кислоти 44,3%. Його було визначено таким чином: відбирали 0,1мл реакційної суміші і ретельно 51 Розчин етилового естеру N-Вос-(1R,2S)-1аміно-2-вінілциклопропанкарбонової кислоти (255мг, 1,0ммоль) в етері (10мл) піддали обробці ацетатом паладію (5мг, 0,022ммоль). До оранжево-червоного розчину в атмосфері N2 по краплях протягом 1год. Добавили надлишок діазометану в етері. Утворений розчин перемішували при кімнатній температурі протягом 18год. Надлишок діазометану видалили потоком азоту. Після цього розчин концентрували шляхом роторного випаровування. Утворений у результаті цього сирий продукт піддали флеш-хроматографії (10% EtOAc/гексан), одержавши 210мг (78%) етилового естеру N-Вос-(1R,2S)-1-аміно-2циклопропілциклопропанкарбонової кислоти у вигляді безколірного масла. LC-MS (період витримування: 2,13хв., подібно Методиці А, за винятком того, що тривалість градієнта становила 3хв, колонка Xterra MS C18 S7 3,0´50мм), MS m/e 270 (M++1). 3. 1-третБутоксикарбоніламіноциклопропанкарбонова кислота промислового виготовлення: 80973 52 Стадія 1. Одержання ди-трет-бутилового естеру 2-етилциклопропан-1,1-дикарбонової кислоти, показаного нижче. До суспензії бензилтриетиламонийхлориду (21,0г, 92,2ммоль) у 50% водному розчині NaOH (92,4г у 185мл Н2О) добавили 1,2-дибромбутан (30,0г, 138,9ммоль) і ди-трет-бутилмалонат (20,0г, 92,5ммоль). Реакційну суміш інтенсивно перемішували протягом 18год при кімнатній температурі, після чого добавили водно-льодяну суміш. Сирий продукт екстрагували СН2СІ2 (тричі) ι послідовно промили водою (тричі), соляним розчином Органічні фази об'єднали. Органічний шар висушили (MgSO4), профільтрували і концентрували у вакуумі. Отриманий залишок піддали флеш-хроматографії (100г SiO2, 3% Et2O в гексані), одержавши продукт, зазначений у заголовку (18,3г, 67,8ммоль, вихід 73%), котрий використовували безпосередньо на наступній стадії. Стадія 2. Одержання рацемічного третбутилового естеру 2-етилциклопропан-1,1дикарбонової кислоти, показаного нижче. 4. Приготування гідрохлориду метилового естеру 1-аміноциклобутан-карбонової кислоти 1-Аміноциклобутанкарбонову кислоту (100мг, 0,869ммоль) (Tocris) розчинили в 10мл МеОН і барботували газом НСІ протягом 2год. Реакційну суміш перемішували протягом 18год. Після цього суміш концентрували у вакуумі, одержавши в результаті 144мг жовтого масла. Масло розтерли з 10мл етеру, одержавши 100мг зазначеного в заголовку продукту у вигляді білої твердої речовини. 1Н ЯМР (CDCI3) d 2,10-2,25 (м, 1Н), 2,282,42 (м, 1Н), 2,64-2,82 (м, 4Н), 3,87 (с, 3Н), 9,21 (уш. с, 3Н). 5. Одержання рацемічного трет-бутилового естеру (1R,2R)/(1S,2S)-1-аміно-2етилциклопропанкарбонової кислоти: Продукт стадії 1 (18,3г, 67,8ммоль) добавили до суспензії трет-бутоксиду калію (33,55г, 299,0ммоль) у сухому етері (500мл) при 0°С, а після цього Н2О (1,35мл, 75,0ммоль), і створену суміш інтенсивно перемішували протягом ночі при кімнатній температурі. Реакційну суміш вилили в суміш води з льодом і промили етером (тричі). Водяний шар підкислили 10% водним розчином лимонної кислоти при 0°С і екстрагували EtOAc (тричі). Об'єднані органічні фази промили водою (двічі), соляним розчином, висушили (MgSO4) і концентрували у вакуумі, одержавши в результаті продукт, зазначений у заголовку, у вигляді блідожовтого масла (10г, 46,8ммоль, вихід 69%). Стадія 3. Одержання трет-бутилового естеру (1R,2R)/(1S,2S)-2-етил-1-(2триметилсилілетоксикарбоніламіно)циклопропанка рбонової кислоти, показаного нижче. До суспензії продукту Стадії 2 (10г, 46,8ммоль) і 3 свіжоактивoваних 4 молекулярних сит у сухому бензолі (160мл) добавили Et3N (7,50мл, 53 80973 54 53,8ммоль) і DPPA (11мл, 10,21ммоль). Реакційну (1,0л), водою (1,0л), соляним розчином (1,0л) і суміш кип'ятили зі зворотним холодильником висушили над Na2SO4. Розчин профільтрували і протягом 3,5год, після цього добавили 2концентрували у вакуумі, одержавши в результаті триметилсилілетанол (13,5мл, 94,2ммоль) і світло-жовту тверду речовину, яку кристалізували реакційну суміш кип'ятили зі зворотним із гексану, одержавши продукт у вигляді білої холодильником ще протягом ночі. Після цього твердої речовини (316,0г, 99%). 1 суміш профільтрували, розбавили Et2O, промили Н ЯМР (CDCI3) d 1,38 (с, 9Н), 2,30-2,27 (м, 10% водним розчином лимонної кислоти, водою, 2Н), 3,22 (т, J=7,35Гц, 2Н), 3,68 (т, J=6,2Гц, 2Н), насиченим водним розчином NaHCO3, водою 4,35 (уш, 1Н). (двічі), соляним розчином (двічі), висушили Стадія 2. Одержання трет-бутиламіду (MgSO4) і концентрували у вакуумі. Залишок циклопропансульфонової кислоти суспендували з 10г поліізоціанатної поглинальної смоли фірми Aldrich у 120мл СН2СІ2, перемішували при кімнатній температурі протягом ночі і в результаті одержали продукт, зазначений у заголовку (8г, 24,3ммоль; 52%), у вигляді світложовтого масла: 1Н ЯМР (CDCI3) d 0,03 (с, 9Н), 0,97 До розчину N-трет-бутил-(3(м, 5Н), 1,20 (уш м, 1Н), 1,45 (с, 9Н), 1,40-1,70 (м, хлор)пропілсульфонаміду (2,14г, 10,0ммоль) в 4Н), 4,16 (м, 2Н), 5,30 (уш с, 1Н). THF (100мл) при температурі -78°С добавили нСтадія 4. Одержання рацемічного третBuLi (2,5Μ у гексані, 8,0мл, 20,0ммоль). Реакційну бутилового естеру (1R,2R)/(1S,2S) 1-аміно-2суміш довели до кімнатної температури протягом етилциклопропанкарбонової кислоти, показаного 1год. Леткі продукти видалили у вакуумі. Залишок нижче. розподілили між EtOAc і водою (200мл, 200мл). До продуктуСтадії 3 (3г, 9ммоль) добавили 1,0Μ розчин TBAF в THF (9,3мл, 9,3ммоль), і суміш кип'ятили зі зворотним холодильником протягом 1,5год, охолодили до кімнатної температури і розбавили добавленням 500мл EtOAc. Після цього розчин послідовно промили водою (2´100мл), соляним розчином (2´100мл), висушили (MgSO4) і концентрували у вакуумі, одержавши в результаті проміжний продукт, зазначений у заголовку. Елементи II Р1' Елементи Р', отримувані так, як описано нижче, можна застосовувати для одержання сполук за формулою І за допомогою процесів, поданих у даному описі. 1. Одержання циклопропілсульфонаміду Стадія 1. Одержання хлор)пропілсульфонаміду -N-трет-бутил-(3 трет-Бутиламін (3,0моль, 315,3мл) розчинили в THF (2,5л). Розчин охолодили до -20°С. Повільно добавили 3-хлорпропансульфонілхлорид (1,5моль, 182,4мл.). Реакційну суміш довели до кімнатної температури і перемішували протягом 24год. Суміш профільтрували, і фільтрат концентрували у вакуумі. Залишок розчинили в СН2СІ2 (2,0л). Отриманий розчин промили 1н. НСІ Відокремлений органічний шар промили соляним розчином, висушили над Na2SO4, профільтрували і концентрували у вакуумі. Залишок рекристалізували із гексану, одержавши цільовий продукт у вигляді твердої речовини білого кольору (1,0г, 56%). 1 Н ЯМР (CDCI3): d 0,98-1,00 (м, 2Н), 1,18-1,19 (м, 2Н), 1,39 (с, 9Н), 2,48-2,51 (м, 1Н), 4,19 (уш, 1Н). Стадія 3. Одержання циклопропілсульфонаміду Розчин трет-бутиламіду циклопропансульфонової кислоти (110,0г, 0,62моль) у TFA (500мл) перемішували при кімнатній температурі протягом 16год. Леткі речовини видалили у вакуумі. Залишок рекристалізували із суміші EtOAc/гексан (60мл/240мл), одержавши цільовий продукт у вигляді твердої речовини білого кольору (68,5г, 91%). 1 Н ЯМР (ДMCO-d6): d 0,84-0,88 (м, 2Н), 0,950,98 (м, 2Н), 2,41-2,58 (м, 1Н), 6,56 (уш, 2Н). 2. Альтернативний процес одержання циклопропілсульфонаміду Розчин THF 100мл, охолоджений до 0°С, барботували газоподібним аміаком до насичення. До цього розчину добавили розчин 5г (28,45ммоль) циклопропілсульфонілхлориду (фірми Array Biopharma) у 50мл THF. Після цього розчин залишили на ніч відігріватися до кімнатної температури і перемішували ще протягом одного дня. Далі суміш концентрували доти, поки не залишилося 1-2мл розчинника, перенесли на шар 55 80973 56 SiO2 (30г, елюент 30-60% EtOAc/гексани), речовини білого кольору. 1Н ЯМР (CDCI3): d 1,58одержавши 3,45г (100%) 1,72 (м, 2Н), 1,74-1,88 (м, 2Н), 1,94-2,14 (м, 4Н), циклопропілсульфонаміду у вигляді твердої 3,48-3,59 (м, 1Н), 4,80 (уш с, 2Н); 13С ЯМР (CDCI3): речовини білого кольору. 1Н ЯМР (метанол-d4): d d 25,90, 28,33, 63,54; MS m/e 148 (M-H)-. 13 0,94-1,07 (м, 4Н), 2,52-2,60 (м, 1Н). С ЯМР 5. Одержання циклогексилсульфонаміду (Метанол-d4): d 5,92, 33,01. 3. Одержання циклобутилсульфонаміду До розчину 5,0г (37,0ммоль) циклобутилброміду в 30мл безводного діетилового етеру (Et2O), охолодженого до -78°С, добавили 44мл (74,8ммоль) 1,7Μ розчину трет-бутиллітію в пентанах і температуру розчину повільно, протягом 1,5год, довели до -35°С. Цю суміш повільно канюлювали в розчин 5,0г (37,0ммоль) свіжодистильованого сульфурилхлориду в 100мл гексанів, охолоджений до -40°С, протягом 1 години довели до 0°С й обережно концентрували у вакуумі. Далі суміш знов розчинили в Et2O, промили один раз льодяною водою, висушили (MgSO4) і обережно концентрували. Після цього суміш знов розчинили в 20мл THF, по краплях добавили до 500мл насиченого розчину NH3 в THF і залишили на ніч при перемішуванні. Далі суміш концентрували у вакуумі, сирий продукт у вигляді твердої речовини жовтого кольору рекристалізували із мінімальної кількості СН2СІ2 в гексанах з 1-2 краплями МеОН, одержавши 1,90г (38%) циклобутилсульфонаміду у вигляді твердої речовини білого кольору. 1Н ЯМР (CDCI3): d 1,952,06 (м, 2Н), 2,30-2,54 (м, 4Н), 3,86 (с(р?), J=8Гц, 1Н), 4,75 (уш с, 2Н); 13С ЯМР (CDCI3): d 16,43, 23,93, 56,29. HRMS m/z (M-H)- розрахунок для C4H8NSO2: 134,0276; вимірювання: 134,0282. 4. Одержання циклопентилсульфонаміду Розчин 18,5мл (37,0ммоль) 2М циклопентилмагнійхлориду в етері по краплях добавили до розчину 3,0мл (37,0ммоль) свіжодистильованого сульфурилхлориду (Aldrich) в 100мл гексанів, охолодженого до -78° С. Температуру суміші протягом 1 години довели до 0°С, а після цього обережно концентрували у вакуумі. Далі суміш знов розчинили в Et2O (200мл), промили один раз льодяною водою (200мл), висушили (MgSO4) і обережно концентрували. Потім суміш знов розчинили в 35мл THF, по краплях добавили до 500мл насиченого розчину NH3 в THF і залишили на ніч при перемішуванні. Суміш концентрували у вакуумі, одержавши в результаті сирий продукт у вигляді твердої речовини жовтого кольору. Залишок профільтрували через 50г силікагелю, використовуючи як елюент 70% EtOAc-гексани, після чого розчин концентрували. Залишок рекристалізували із мінімальної кількості СН2СІ2 в гексанах з 1-2 краплями МеОН, одержавши 2,49г (41%) циклопентилсульфонаміду у вигляді твердої Розчин 18,5мл (37,0ммоль) 2М циклогексилмагнійхлориду (TCI Americas) в етері по краплях добавили до розчину 3,0мл (37,0ммоль) свіжодистильованого сульфурилхлориду в 100мл гексанів, охолодженого до -78°С. Температуру суміші протягом 1 години довели до 0°С, після чого суміш обережно концентрували у вакуумі. Далі суміш знову розчинили в Et2O (200мл), промили один раз льодяною водою (200мл), висушили (MgSO4) і обережно концентрували. Після цього суміш знову розчинили в 35мл THF, по краплях добавили до 500мл насиченого розчину NH3 в THF і залишили на ніч при перемішуванні. Нарешті суміш концентрували у вакуумі, одержавши в результаті сирий продукт у вигляді твердої речовини жовтого кольору. Отриманий залишок профільтрували через 50г силікагелю, використовуючи як елюент 70% EtOAc-гексани, і після цього розчин концентрували. Залишок рекристалізували із мінімальної кількості СН2СІ2 у гексанах з 1-2 краплями МеОН, одержавши 1,66г (30%) циклогексилсульфонаміду, що являв собою тверду речовину білого кольору. 1Н ЯМР (CDCI3): d 1,111,37 (м, 3Н), 1,43-1,56 (м, 2Н), 1,67-1.76 (м, 1Н), 1,86-1,96 (м, 2Н), 2,18-2,28 (м, 2Н), 2,91 (тт, J=12, 3,5Гц, 1Н), 4,70 (уш с, 2Н); 13С ЯМР (CDCI3): d 25,04, 26,56, 62,74; MS m/e 162 (M-1)-. 6. Одержання неопентилсульфонаміду За методикою, описаною для випадку готування циклогексилсульфонаміду, 49мл (37ммоль) 0,75Μ неопентилмагнійхлориду (Alfa) в етері було перетворено на 1,52г (27%) неопентилсульфонаміду, що мав вигляд білої твердої речовини. 1Н ЯМР (CDCI3): d 1,17 (с, 9Н), 3,12 (с, 2Н), 4,74 (уш с, 2Н); 13С ЯМР (CDCI3): d 29,46, 31,51, 67,38; MS m/e 150 (M-1)-. 7. Одержання циклобутилкарбінілсульфонаміду Розчин 12,3г (83ммоль) циклобутилкарбінілброміду (Aldrich) і 13,7г (91ммоль) йодида натрію в 150мл ацетону кип'ятили зі зворотним холодильником протягом ночі і після цього охолодили до кімнатної температури. Неорганічну тверду речовину 57 80973 58 відфільтрували, а ацетон і циклобутилкарбінілйодид (8,41г, 46%) видалили при температурі 80°С перший під нормальним тиском, а другий під тиском 150 Торр (133,3Па). Розчин 4,0г (21,98ммоль) циклобутилкарбінілйодиду в 30мл сухого діетилового етеру (Et2O), охолоджений до -78°С, канюлювали в розчин 17мл (21,98ммоль) 1,3Μ розчину втор-бутиллітію в гексанах, і розчин перемішували протягом 5хв. У приготовану таким чином суміш канюлювали розчин 3,0г (21,98ммоль) свіжодистильованого сульфурилхлориду в 110мл гексанів, охолоджений до -78°С. Суміш протягом 1 години довели до кімнатної температури, а після цього обережно концентрували у вакуумі. Далі суміш знову розчинили в Et2O, промили один раз льодяною водою, висушили (MgSO4) і обережно концентрували. Після цього суміш знову розчинили в 30мл THF, по краплях добавили до Ізохінолін (1) та його заміщені аналоги можна 500мл насиченого розчину NH3 в THF і залишили вбудовувати в елементи Р2 за допомогою двох на ніч при перемішуванні. Далі суміш методик, коротко окреслених вище і докладно концентрували у вакуумі, і сирий залишок у вигляді розглянутих у даному опису. Зазначені елементи твердої речовини жовтого кольору Р2 (3) можна перетворювати на сполуки за рекристалізували із мінімальної кількості СН2СІ2 в формулою І, дотримуючись методик, аналогичних гексанах з 1-2 краплями МеОН, одержавши 1,39г описаним тут стосовно одержання подібних (42%) циклобутилкарбінілсульфонаміду у вигляді аналогів ізохіноліну. твердої речовини білого кольору. 1Н ЯМР (CDCI3): 2. Ізоксазолпіридин і оксазолпіридин (1) d 1,81-2,03 (м, 4Н), 2,14-2,28 (м, 2Н), 2,81-2,92 (м, 1Н), 3,22 (д, J=7Гц, 2Н), 4,74 (уш с, 2Н); 13С ЯМР (CDCI3): d 19,10, 28,21, 30,64, 60,93; MS m/e 148 (M-1)". Період витримування: 1,73хв, Методика В, 818 (М++Н). 8. Одержання циклопропілкарбінілсульфонаміду Цільовий циклопропілкарбінілсульфонамід одержали із циклопропілкарбінілброміду (Aldrich) згідно з методикою, застосованою у готуванні циклобутилкарбінілсульфонаміду, див. також [JACS 1981, р,442-445]. 1Н ЯМР (CDCI3): d 0,390,44 (м, 2Н), 0,67-0,76 (м, 2Н), 1,13-1,27 (м, 1Н), 3,03 (д, J=7,3Гц, 2Н), 4,74 (уш. с, 2Н); 13С ЯМР (CDCI3): d 4,33, 5,61, 59,93; MS m/e 134 (M-1). Ill Гетероцикли, що використовуються як вихідні матеріали при конструюванні елементів Р2 з метою подальшого введення останніх у сполуки за формулою І. 1. Ізохіноліни Ізоксазольний та оксазольний гетероцикл (1) і його аналоги можна отримувати за допомогою добре відоміх хімічних реакцій і вбудовувати у сполуки за формулою І за допомогою процесів, поданих у даному опису стосовно аналогічних ізоксазолпіридинових проміжних продуктів, як показано в підрозділі В. Підрозділ В У Підрозділі В при проведенні LC/MS аналізу використовували такі умови Колонки (Методика A): YMC ODS-A C18 S7 (4,6´33мм) (Методика В): YMC Xterra ODS S7 (3,0´50мм) (Методика С): Xterra ms C18 (4,6´33мм) (Методика D): YMC ODS-A C18 S3 (4,6´33мм) Градієнт: від 100% розчинника А/0% 59 80973 60 розчинника В до 0% розчинника LC-MS (період витримування: 1,19хв, Методика В), MS m/z 227 (М++Н). А/100% розчинника В Стадія 2 Розчин 3-метил-5-фенілізоксазол[4,5Тривалість b]піридин-4-оксиду (1,00г, 4,40ммоль) і РОСІ3 градієнта: 3хв. (2,71г, 17,7ммоль) у хлороформі (10мл) кип'ятили Період зі зворотним холодильником протягом 1год. По витримування: 1хв. охолодженню до кімнатної температури до Витрата розчину добавили хлороформ (50мл) і промили елюенту: 5мл/хв. водним розчином NaHCO3 (дві порції по 50мл) і Довжина хвилі соляним розчином, висушили над MgSO4, детектора: 220нм профільтрували і випарили. Залишок очистили за Розчинник А: 10% МеОН/90% Н2О/0,1% TFA. допомогою флеш-хроматографії (4:1 гексанРозчинник В: 90% EtOAc), одержавши 790мг (73%) цільового МеОН/10%H2O/0,1%TFA продукту у вигляді твердої речовини білого При розділянні методом препаративної HPLC кольору. використовували такі умови 1 Колонки: Phenomenex-luna 30X100мм, S5 Н ЯМР (CDCI3): d 2,72 (с, 3Н), 7,46-7,54 (м, Градієнт: від 60% розчинника А/40% 3Н), 7,91 (с, 1Н), 8,00-8,03 (м, 2Н); LC-MS (період розчинника В до 0% розчинника витримування: 1,76хв, Методика В), MS m/z 245, А/100% розчинника В 247 (М++Н). Тривалість градієнта: 15хв. Час припинення:20хв. Витрата елюенту: 30мл/хв. Довжина хвилі детектора: 220нм Розчинники: Розчинник А: 10% МеОН/90% Н2О/0,1% TFA Розчинник В: 90% МеОН/10% Н2О/0,1% TFA Приклад 1. Одержання сполуки 1. Стадія 1 Суміш 3,5-диметил-4-нітроізоксазолу (1,42г, 10,0ммоль), фенілацетальдегіду (1,32г, 11,0ммоль) у піперидині (1мл) й етанолі (10мл) кип'ятили зі зворотним холодильником протягом 16год. Після охолодження до кімнатної температури продукт випав в осад, і його зібрали шляхом фільтрування. Осад на фільтрі ретельно промили холодним етанолом, одержавши 1,20г (53%) цільового продукту у вигляді твердої речовини білого кольору. 1Н ЯМР (CDCI3): d 2,87 (с, 3Н), 7,46-7,50 (м, 3Н), 7,56 (д, J=8,5Гц, 1Н), 7,77,80 (м, 2Н). Стадія 3 До суміші метилового естеру 4гідроксипіролідин-2-карбонової кислоти (Н-НурОМе НСІ) (1,81г, 10,0ммоль), HATU (5,70г, 15,0 моль) і N-ВОС-трет-бутил-L-гліцину (2,42г, 105ммоль) в СН2СІ2 (100мл ) при температурі 0°С добавили DIPEA (3,47г, 31,0ммоль). Після перемішували при кімнатній температурі протягом 12год. розчин розрідили СН2СІ2 (100мл) і промили льодяним 5% водним розчином лимонної кислоти. Органічний шар промили льодяним 5% водним розчином лимонної кислоти, 1М NaOH, соляним розчином, висушили над MgSO4 і профільтрували. Фільтрат концентрували у вакуумі, одержавши в результаті 3,55г (99%) цільового продукту у вигляді жовтувато-білої піни. Цей продукт використовували на наступній стадії без додаткової очистки. 1 Н ЯМР (CD3OD): d 1,04 (с, 9Н), 1,43 (с, 9Н), 1,99-2,03 (м, 1Н), 2,20-2,30 (м, 1Н), 3,69 (с, 3Н), 3,70-3,79 (м, 2Н), 4,28 (уш, 1Н), 4,46 (уш, 1Н), 4,744,80 (м, 1Н); LC-MS (період витримування: 1,28хв., Методика В), MS m/z 359 (М++Н). Стадія 4 Суміш продукту Стадії 3 (3,55г, 9,9ммоль) в THF (50мл ), МеОН (50мл ) ι моногідрату LiOH (0,83г, 19,9ммоль в 50мл Н2О) перемішували при кімнатній температурі протягом ночі. Після видалення летких речовин у вакуумі залишок
ДивитисяДодаткова інформація
Назва патенту англійськоюHepatitis c virus inhibitors
Автори англійськоюWang Xiang-Dong Alan, Sun Li-Quang, Sit Sing-Yuen, Sin Ny, Scola Paul Michael, Hewawasam Piyasena, Good Andrew Charles, Chen Yan, Campbell Jeffrey Allen
Назва патенту російськоюИнгибиторы вируса гепатита с
Автори російськоюВанг Ксианг-Донг Алан, Сун Ли-Кванг, Сит Синг-Юен, Син Ни, Скола Поль Михаэль, Хевавасам Пиясена, Гоод Эндрю Чарльз, Чен Ян, Кампбелл Джеффри Аллен
МПК / Мітки
МПК: C07D 413/14, C07D 401/14, C07D 417/14, A61K 45/00, A61P 37/04, C07K 5/08, C07D 491/04, A61P 31/14, A61P 1/16, C07D 401/12, C07D 403/12, A61K 31/13, A61P 43/00, C07K 5/083, A61K 31/7052, A61K 31/40, C07D 498/04, A61P 37/02, A61K 38/55, A61K 38/21, C07K 5/087, C07D 207/16
Мітки: гепатиту, вірусу, інгібітори
Код посилання
<a href="https://ua.patents.su/224-80973-ingibitori-virusu-gepatitu-s.html" target="_blank" rel="follow" title="База патентів України">Інгібітори вірусу гепатиту с</a>
Попередній патент: Чашоподібна посудина (варіанти) та кришка для неї (варіанти)
Наступний патент: Комбінований процес художнього підбору та укладання паркету
Випадковий патент: Спосіб захисту від кореневих гнилей та підвищення продуктивності озимої пшениці