Пептидоміметики, що виявляють глюкагонову антагоністичну та glp-1 агоністичну активність
Номер патенту: 99493
Опубліковано: 27.08.2012
Автори: Джеін Мукул Р., Бахекар Раджеш Х., Пател Панкадж Раманбхай
Формула / Реферат
1. Ізольовані пептидоміметики, що мають послідовність формули (І), включаючи її таутомери, сольвати
A-Z1-Z2-Z3-Z4-Z5-Z6-Z7-Z8-Z9-Z10-Z11-В, (І)
у якій
А позначає групи -NH-R1, R3-CO-, R3-O-CO- або R3-SO2-, де R1 позначає водень або необов'язково заміщений лінійний чи розгалужений (С1-С10) алкільний ланцюг; R3 вибирають з лінійних чи розгалужених (С1-С10) алкільних, (С3-С6) циклоалкільних, арильних, гетероарильних або арилалкільних груп; В позначає -COOR2, -CONHR2 або CH2OR2, де R2 позначає Н, необов'язково заміщені групи, вибрані з лінійних чи розгалужених (С1-С10) алкільних, арильних або аралкільних груп; Z1-Z11 позначають природні або неприродні амінокислоти, з'єднані одна з одною амідним зв'язком, де Z1 позначає L-гістидин (Н), D-гістидин (dH) або уроканінову кислоту (UA)
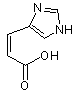 ,
,
уроканінова кислота (UA)
Z2 позначає природні чи неприродні амінокислоти, вибрані з групи, що складається з L-серину (S), D-серину (dS), L-аланіну (А), D-аланіну (dA), α-метилпроліну (α-Ме-Pro), α-аміноізомасляної кислоти (Aib), 1-аміноциклопропанкарбонової кислоти (АСР), 1-аміноциклопентанкарбонової кислоти (АРР)
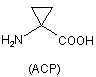 ,
, 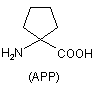 ,
,
Z3 позначає L-глутамін (Gln; Q), D-глутамін (dQ) або сполуки формули II (CNB або Hfl)
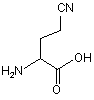 ,
,
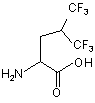 ,
,
2-аміно-4-ціаномасляна кислота (CNB)
гексафторлейцин (Hfl)
Формула II
Z4 позначає гліцин (G) або неприродні амінокислоти 1-аміноциклопропанкарбонову кислоту (АСР) чи 1-аміноциклопентанкарбонову кислоту (АРР);
Z5 позначає природну чи неприродну амінокислоту, яка має гідроксил у бічному ланцюзі; краще, Z5 позначає L-треонін (Т), D-треонін (dТ), L-ало-треонін (allo-Thr; allo-T), D-ало-треонін (d-allo-Thr; d-allo-T);
Z6 позначає природну чи неприродну амінокислоту, що має дизаміщений альфа-атом вуглецю з двома бічними ланцюгами, причому кожний з них може незалежно бути необов'язково заміщеною алкільною або арильною чи аралкільною групою, де замісники можуть бути вибрані з однієї чи кількох алкільних груп або з однієї чи більше галоїдних груп;
Z7 та Z8 незалежно позначають природну чи неприродну амінокислоту, що має гідроксил у бічному ланцюзі;
Z9 незалежно позначають природну чи неприродну амінокислоту, що має амінокислотний бічний ланцюг, який включає кислотну групу;
Z10 позначає L- або D-неприродну амінокислоту формули III (а-с)
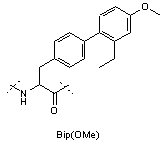 ,
,
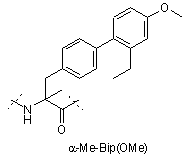 ,
,
 ,
,
IIIa
IIIb
IIIc
Z11 позначає L- або D-неприродну амінокислоту формули IV (а-l)
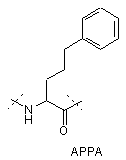 ,
,
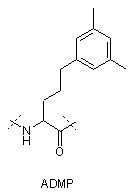 ,
,
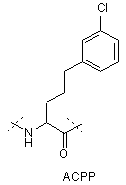 ,
,
 ,
,
IVa
IVb
IVc
IVd
 ,
,
 ,
,
 ,
,
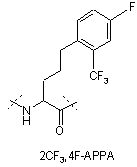 ,
,
IVe
IVf
IVg
IVh
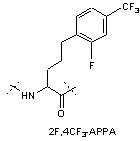 ,
,
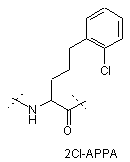 ,
,
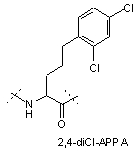 ,
,
 .
.
IVi
IVj
IVk
IVl
2. Сполука формули (І) за п. 1, у якій Z6 позначає групи Phe (F), альфа-метилфенілаланін (-α-Me-Phe-), альфа-метил-2-фторфенілаланін (-α-Me-2F-Phe-) або альфа-метил-2,6-дифторфенілаланін (-α-Me-2,6-F-Phe-) або 2-фторфенілаланін (-2F-Phe-).
3. Сполука формули (І) за п. 1, у якій кожен з Z7 та Z8 вибирають з треоніну, серину, 1-аміноциклопропанкарбонової кислоти.
4. Сполука формули (І) за п. 1, у якій Z9 вибирають з L-аспарагінової кислоти (D), D-аспарагінової кислоти (dD) або сполуки формули II.
5. Сполука формули (І) за п. 1, у якій арильну групу вибирають з фенільної, нафтильної, інданільної, флуоренільної або біфенільної груп; гетероарильну групу вибирають з піридильної, тієнільної, фурильної, імідазолільної, бензофуранільної груп.
6. Сполука формули (І) за п. 1, у якій амідний зв'язок між Z9 та Z10 або Z10 та Z11, або Z9-Z11 є додатково N-метильованим, що позначається як '(NMe)'.
7. Сполука формули (І) за п. 1, у якій амідний зв'язок між Z9 та Z10 або Z10 та Z11, або Z9-Z11 додатково є тіоамідним зв'язком.
8. Сполука формули (І) за п. 7, у якій додатково тіоамідний зв'язок між Z9 та Z10 або Z10 та Z11, або Z9-Z11 є відновленим до '-СН2-' зв'язку.
9. Сполука формули (І)
A-Z1-Z2-Z3-Z4-Z5-Z6-Z7-Z8-Z9-Z10-Z11-В, (І)
у якій
'А' позначає групи -NH-R1, R3-CO-, R3-O-CO- або R3-SO2-, де R1 позначає водень або необов'язково заміщений лінійний чи розгалужений (С1-С10) алкільний ланцюг; R3 вибирають з лінійних чи розгалужених (С1-С10) алкільних, (Сз-С6) циклоалкільних, арильних, гетероарильних або арилалкільних груп; В позначає -COOR2, -CONHR2 або CH2OR2, де R2 позначає Н, необов'язково заміщені групи, вибрані з лінійної чи розгалуженої (С1-С10) алкільної групи, арильних або аралкільних груп; Z1 позначає L-гістидин (Н), D-гістидин (dR) або уроканінову кислоту (UA); Z2 вибирають з L-серину, D-серину, L-аланіну, D-аланіну, α-аміноізомасляної кислоти, 1-аміноциклопропанкарбонової кислоти
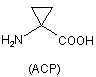 ,
, 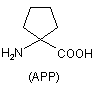 ,
,
Z3 позначає L-глутамін (Gln; Q), D-глутамін (dQ) або сполуки формули II (CNB або Hfl).
 ,
,
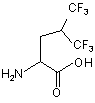 ,
,
2-аміно-4-ціаномасляна кислота (CNB)
гексафторлейцин (Hfl)
Формула II
Z4 позначає гліцин (G) або неприродні амінокислоти 1-аміноциклопропанкарбонову кислоту (АСР) чи 1-аміноциклопентанкарбонову кислоту (АРР); Z5 позначає L-треонін (Т), D-треонін (dТ), L-ало-треонін (allo-Thr; allo-T), D-ало-треонін (d-allo-Thr; d-allo-T); Z6 позначає фенілаланін (Phe; F), альфа-метилфенілаланін (-α-Me-Phe-), альфа-метил-2-фторфенілаланін (-α-Ме-2F-Phe-), альфа-метил-2,6-дифторфенілаланін (-α-Me-2,6-F-Phe-) або 2-фторфенілаланін (-2F-Phe-)
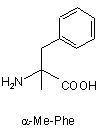 ,
,
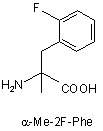 ,
,
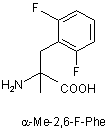 ,
,
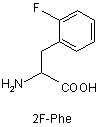 ,
,
Z7 та Z8 незалежно вибирають з треоніну, серину, 1-аміноциклопропанкарбонової кислоти (АСР); Z9 вибирають з L-аспарагінової кислоти (D), D-аспарагінової кислоти (dD) або сполуки формули II; Z10 позначає L- або D-неприродну амінокислоту формули III (а-с)
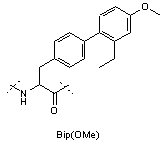 ,
,
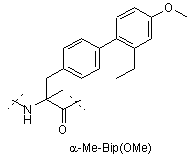 ,
,
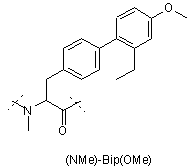 ,
,
IIIa
IIIb
IIIc
Z11 позначає L- або D-неприродну амінокислоту формули IV (а-l)
 ,
,
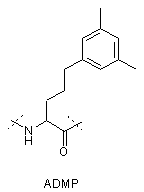 ,
,
 ,
,
 ,
,
IVa
IVb
IVc
IVd
 ,
,
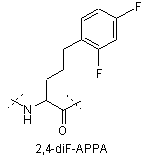 ,
,
 ,
,
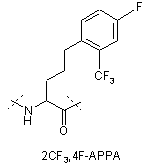 ,
,
IVe
IVf
IVg
IVh
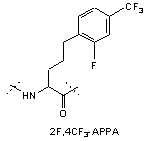 ,
,
 ,
,
 ,
,
 .
.
IVi
IVj
IVk
IVl
10. Сполука формули 1, вибрана з
HSQGTFTSD-Bip(OMe)-(APPA);
HSQGTFTSD-Bip(OMe)-(ADMP);
HSQGTFTSD-Bip(OMe)-(ACPP);
HSQGTFTSD-Bip(OMe)-(AMCB);
H-(α-Me-Pro)-QGTFTSD-Bip(OMe)-(APPA);
H-(α-Me-Pro)-QGTFTSD-Bip(OMe)-(ADMP);
H-(α-Me-Pro)-QGTFTSD-Bip(OMe)-(ACPP);
H-(α-Me-Pro)-QGTFTSD-Bip(OMe)-(AMCB);
HAQGTFTSD-Bip(OMe)-(APPA);
HAQGTFTSD-Bip(OMe)-(ADMP);
HAQGTFTSD-Bip(OMe)-(ACPP);
HAQGTFTSD-Bip(OMe)-(AMCB);
H-Aib-QGTFTSD-Bip(OMe)-(APPA);
H-Aib-QGTFTSD-Bip(OMe)-(ADMP);
H-Aib-QGTFTSD-Bip(OMe)-(ACPP);
H-Aib-QGTFTSD-Bip(OMe)-(AMCB);
H-(ACP)-QGTFTSD-Bip(OMe)-(APPA);
H-(ACP)-QGTFTSD-Bip(OMe)-(ADMP);
H-(ACP)-QGTFTSD-Bip(OMe)-(ACPP);
H-(ACP)-QGTFTSD-Bip(OMe)-(AMCB);
H-(APP)-QGTFTSD-Bip(OMe)-(APPA);
H-(APP)-QGTFTSD-Bip(OMe)-(ADMP);
H-(APP)-QGTFTSD-Bip(OMe)-(ACPP);
H-(APP)-QGTFTSD-Bip(OMe)-(AMCB);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(APPA);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(ADMP);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(ACPP);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(AMCB);
H-Aib-QGT-(α-Me-Phe)-TSD-Bip(OMe)-(APPA);
H-Aib-QGT-(α-Me-Phe)-TSD-Bip(OMe)-(ADMP);
H-Aib-QGT-(α-Me-Phe)-TSD-Bip(OMe)-(ACPP);
H-Aib-QGT-(α-Me-Phe)-TSD-Bip(OMe)-(AMCB);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(ADMP);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(ACPP);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(AMCB);
H-Aib-QGT-(2F-Phe)-TSD-Bip(OMe)-(APPA);
H-Aib-QGT-(2F-Phe)-TSD-Bip(OMe)-(ADMP);
H-Aib-QGT-(2F-Phe)-TSD-Bip(OMe)-(ACPP);
H-Aib-QGT-(2F-Phe)-TSD-Bip(OMe)-(AMCB);
HSQGTFTSD-Bip(OMe)-(2F-APPA);
HSQGTFTSD-Bip(OMe)-(2,4-diF-APPA);
HSQGTFTSD-Bip(OMe)-(2CF3-APPA);
HSQGTFTSD-Bip(OMe)-(2CF3,4F-APPA);
HSQGTFTSD-Bip(OMe)-(2F,4CF3-APPA);
HSQGTFTSD-Bip(OMe)-(2Cl-APPA);
HSQGTFTSD-Bip(OMe)-(2,4-diCl-APPA);
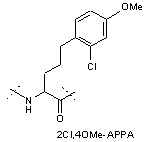
HSQGTFTSD-Bip(OMe)-(2Cl,4OMe-APPA);
HAQGTFTSD-Bip(OMe)-(2F-APPA);
HAQGTFTSD-Bip(OMe)-(2,4-diF-APPA);
HAQGTFTSD-Bip(OMe)-(2CF3-APPA);
HAQGTFTSD-Bip(OMe)-(2CF3,4F-APPA);
HAQGTFTSD-Bip(OMe)-(2F,4CF3-APPA);
HAQGTFTSD-Bip(OMe)-(2Cl-APPA);
HAQGTFTSD-Bip(OMe)-(2,4-diCl-APPA);
HAQGTFTSD-Bip(OMe)-(2Cl,4OMe-APPA);
H-Aib-QGTFTSD-Bip(OMe)-(2F-APPA);
H-Aib-QGTFTSD-Bip(OMe)-(2,4-diF-APPA);
H-Aib-QGTFTSD-Bip(OMe)-(2CF3-APPA);
H-Aib-QGTFTSD-Bip(OMe)-(2CF3,4F-APPA);
H-Aib-QGTFTSD-Bip(OMe)-(2F,4CF3-APPA);
H-Aib-QGTFTSD-Bip(OMe)-(2Cl-APPA);
H-Aib-QGTFTSD-Bip(OMe)-(2,4-diCl-APPA);
H-Aib-QGTFTSD-Bip(OMe)-(2Cl,4OMe-APPA);
H-(ACP)-QGTFTSD-Bip(OMe)-(2F-APPA);
H-(ACP)-QGTFTSD-Bip(OMe)-(2,4-diF-APPA);
H-(ACP)-QGTFTSD-Bip(OMe)-(2CF3-APPA);
H-(ACP)-QGTFTSD-Bip(OMe)-(2CF3,4F-APPA);
H-(ACP)-QGTFTSD-Bip(OMe)-(2F,4CF3-APPA);
H-(ACP)-QGTFTSD-Bip(OMe)-(2Cl-APPA);
H-(ACP)-QGTFTSD-Bip(OMe)-(2,4-diCl-APPA);
H-(ACP)-QGTFTSD-Bip(OMe)-(2Cl,4OMe-APPA);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2F-APPA);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2,4-diF-APPA);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2CFrAPPA);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2CF3,4F-APPA);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2F,4CF3-APPA);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2Cl-APPA);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2,4-diCl-APPA);
H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2Cl,4OMe-APPA);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2,4-diF-APPA);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2CF3-APPA);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2CF3,4F-APPA);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F,4CF3-APPA);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2Cl-APPA);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2,4-diCl-APPA);
H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2Cl,4OMe-APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA);
H-Aib-QGT-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA);
H-Aib-(CNB)-GT-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA);
H-Aib-QGT-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA);
H-Aib-(CNB)-GT-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-((NMe)(APPA));
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-((NMe)(APPA));
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-((NMe)(2F-APPA));
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-((NMe)(2F-APPA));
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(APPA));
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(APPA));
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(NMe)(2F-APPA));
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(2F-APPA));
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(APPA));
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(APPA));
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(2F-APPA));
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(2F-APPA));
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-((NMe)Bip(OMe))-((NMe)(APPA));
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-((NMe)Bip(OMe))-((NMe)(APPA));
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-((NMe)Bip(OMe))-((NMe)(2F-APPA));
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-((NMe)Bip(OMe))-((NMe)(2F-APPA));
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(APPA));
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(APPA));
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(2F-APPA));
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(2F-APPA));
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(APPA));
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(APPA));
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(2F-APPA));
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(2F-APPA));
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TS-(NMe)D-((NMe)Bip(OMe))-((NMe)(APPA));
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TS-(NMe)D-((NMe)Bip(OMe))-((NMe)(APPA));
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TS-(NMe)D-((NMe)Bip(OMe))-((NMe)(2F-APPA));
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TS-(NMe)D-((NMe)Bip(OMe))-((NMe)(2F-APPA));
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(APPA));
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(APPA));
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(2F-APPA));
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(2F-APPA));
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(APPA));
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(APPA));
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(2F-APPA));
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(2F-APPA));
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(C=S)-(APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(C=S)-(APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(C=S)-(2F-APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(C=S)-(2F-APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(2F-APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(2F-APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(2F-APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(2F-APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-(C=S)-Bip(OMe)-(C=S)-(APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-(C=S)-Bip(OMe)-(C=S)-(APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(CH2)-(APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(CH2)-(APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(CH2)-(2F-APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(CH2)-(2F-APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(2F-APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(2F-APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(2F-APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(2F-APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-(CH2)-Bip(OMe))-(CH2)-(APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-(CH2)-Bip(OMe)-(CH2)-(APPA);
CH3CO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-(CH2)-Bip(OMe)-(CH2)-(2F-APPA);
CH3OCO-H-Aib-QGT-(α-Me-2F-Phe)-TSD-(CH2)-Bip(OMe)-(CH2)-(2F-APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(APPA);
CH3OCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(APPA);
CH3CO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(2F-APPA);
CH3ОCO-H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(2F-APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMeHCH2)-(APPA);
H-Aib-QG-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(2F-APPA);
H-Aib-(CNB)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(2F-APPA);
CH3CO-H-Aib-(CNB)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
CH3OCO-H-Aib-(CNB)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
CH3CO-H-Aib-(CNB)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
CH3OCO-H-Aib-(CNB)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(APPA);
CH3CO-H-Aib-(Hfl)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
CH3OCO-H-Aib-(Hfl)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
CH3CO-H-Aib-(Hfl)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
CH3OCO-H-Aib-(Hfl)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMeHCH2)-(2F-APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(2F-APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(APPA));
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(2F-APPA));
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(NMe)(APPA));
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(2F-APPA));
H-Aib-(Hfl)-GT-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA);
H-Aib-(Hfl)-GT-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA);
H-Aib-(Hfl)-G-T(allo)-(α-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA);
H-Aib-(Hfl)-GT-(α-Me-Phe)-TSD-Bip(OMe)-(APPA);
H-Aib-(Hfl)-GT-(α-Me-Phe)-TSD-Bip(OMe)-(ADMP);
H-Aib-(Hfl)-GT-(α-Me-Phe)-TSD-Bip(OMe)-(ACPP);
H-Aib-(Hfl)-GT-(α-Me-Phe)-TSD-Bip(OMe)-(AMCB);
H-Aib-(Hfl)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(APPA);
H-Aib-(Hfl)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(ADMP);
H-Aib-(Hfl)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(ACPP);
H-Aib-(Hfl)-GT-(α-Me-2F-Phe)-TSD-Bip(OMe)-(AMCB).
11. Фармацевтична композиція, що включає сполуки формули (І) за будь-яким з попередніх пунктів формули та придатний фармацевтично прийнятний носій (носії).
12. Застосування сполуки формули (І) за будь-яким з пунктів формули 1-10 як антагоніста глюкагонового рецептора.
13. Застосування сполуки формули (І) за будь-яким з пунктів формули 1-10 як агоніста рецептора GLP-1.
14. Застосування сполуки формули (І) за будь-яким з пунктів формули 1-10 як агента для лікування чи профілактики хвороб, спричинених гіперліпідемією, гіперхолестеринемією, гіперглікемією, гіперінсулінемією, підвищеними рівнями вільних жирних кислот або гліцерину крові, гіпертригліцеридемією, загоєнням ран, порушеною толерантністю до глюкози, лептинорезистентністю, інсулінорезистентністю або іншими діабетичними ускладненнями.
15. Спосіб профілактики чи лікування хвороби, спричиненої гіперліпідемією, гіперхолестеринемією, гіперглікемією, гіперінсулінемією, підвищеними рівнями вільних жирних кислот або гліцерину крові, гіпертригліцеридемією, загоєнням ран, порушеною толерантністю до глюкози, лептинорезистентністю, інсулінорезистентністю або іншими діабетичними ускладненнями, який включає введення ефективної нетоксичної кількості сполуки формули (І) за будь-яким з попередніх пунктів формули пацієнту, що потребує цього.
16. Спосіб за п. 15, у якому хвороба є діабетом типу 2, порушеною толерантністю до глюкози, дисліпідемією, гіпертензією, атеросклерозом, гіперліпідемією, хворобою коронарної артерії, серцево-судинними розладами та іншими хворобами, причинним патофізіологічним механізмом яких є інсулінорезистентність.
17. Лікарський засіб для лікування/полегшення будь-якого з хворобливих станів, описаних в будь-якому з попередніх пунктів формули, що включає введення сполуки формули (І) за будь-яким з попередніх пунктів формули та фармацевтично прийнятного носія, розріджувача, ексципієнтів або сольвату пацієнту, що потребує цього.
18. Застосування фармацевтичної композиції, що містить сполуку формули (І) за будь-яким з пунктів формули 1-10, як лікарського засобу, придатного для лікування хвороб, згаданих в будь-якому з пунктів формули 14-16.
Текст
Реферат: Даний винахід пропонує нові пептидоміметики, які діють як глюкозозалежні стимулятори секреції інсуліну. Крім того, було знайдено, що ці пептидоміметики виявляють активність антагоніста глюкагонового рецептора разом з активністю агоніста рецептора GLP-1. UA 99493 C2 (12) UA 99493 C2 UA 99493 C2 Даний винахід належить до нових сполук загальної формули (І), їх таутомерних форм, їх фармацевтично прийнятних солей та фармацевтичних композицій, що їх містять. A-Z1-Z2-Z3-Z4-Z5-Z6-Z7-Z8-Z9-Z10-Z11-B 5 10 15 20 25 30 35 40 45 50 55 (І) Даний винахід також стосується способу одержання сполук загальної формули (І), їх таутомерних форм, їх фармацевтично прийнятних солей та фармацевтичних композицій, що їх містять. Діабет характеризується порушеною секрецією інсуліну панкреатичними Р-клітинами, інсулінорезистентністю чи обома цими факторами (Cavaghan, M.K., et al., J. Clin. Invest. 2000, 106, 329). Більшість пацієнтів з діабетом типу 2 можна лікувати агентами, які знижують продукування глюкози печінкою (глюкагонові антагоністи), зменшують всмоктування глюкози з ЖКТ, стимулюють функцію Р-клітин (стимулятори секреції інсуліну), або агентами, які посилюють тканинну чутливість пацієнтів по відношенню до інсуліну (сенсибілізатори інсуліну). Лікарські засоби, що використовуються зараз для лікування діабету типу 2, включають інгібітори -глюкозидази, сенсибілізатори інсуліну, стимулятори секреції інсуліну та блокатор каналів KАТР (Chehade, J. M., et al., Drugs, 2000, 60, 95). Однак, майже половина суб'єктів з діабетом типу 2 з часом втрачають свою відповідь на ці агенти і тому потребують інсулінотерапії. Лікування інсуліном має декілька недоліків, воно є ін'єкційним, спричинює гіпоглікемію та призводить до збільшення ваги (Burge, M.R., Diabetes Obes. Metab., 1999, 1, 199). Проблеми із сучасними способами лікування створюють потребу в нових терапіях для лікування діабету типу 2. В цьому відношенні, було знайдено, що агоніст глюкагоноподібного пептиду-1 (GLP-1), який промотує глюкоза-залежну секрецію інсуліну у підшлунковій залозі, та антагоніст глюкагонового рецептора, який інгібує продукування глюкози печінкою шляхом інгібування глікогенолізу та глюконеогенезу, виявляють терапевтичний потенціал. Таким чином, було знайдено, що агоніст GLP-1 та глюкагоновий антагоніст разом знижують рівні глюкози у кровотоці та є корисними терапевтичними агентами для лікування і профілактики типу 2 (Perry, ТА, et al., Trends Pharmacol. Sci., 2003, 24, 377). Глюкагон та GLP-1 є членами сімейства структурно споріднених пептидних гормонів (сімейство секретину). Глюкагон та GLP-1 утворюють високогомологічний набір пептидів, тому що ці два гормони походять від спільного прекурсора, препроглюкагону, який при тканинаспецифічному процесингу приводить до продукування GLP-1 переважно у кишечнику і глюкагону в підшлунковій залозі (Jiang, G., et al., Am. J. Physiol. Endocrinol. Metab., 2003, 284, E671-678). Рецептори цих двох пептидів є гомологічними (58 % ідентичності) та належать до класу В сімейства G-білок-спряжених рецепторів (GPCR). Клас-В GPCR також називається сімейством секретинових рецепторів, яке складається з 15 пептид-зв'язуючих рецепторів у людини. GPCR рецептори включають позаклітиннй N-термінальний домен з 100-160 залишків, з'єднаний з навколомембранним доменом (J-домен) із семи трансмембранних -спіралей з проміжними петлями та С-термінальний хвіст (Brubaker, P.L, et al., Receptors Channels, 2002, 8, 179). Клас В GPCR активується ендогенними пептидними лігандами проміжного розміру, типово, 30-40 амінокислот (Hoare, S.R.J., Drug. Discovery Today, 2005, ±0,423; Gether, U., Endocrine Reviews, 2000, 21, 90). Глюкагон є пептидним гормоном з 29-амінокислот, що утворюється шляхом процесингу проглюкагону у панкреатичних -клітинах за допомогою РС2. Глюкагон діє за допомогою семи трансмембранних GPCR (G-білок спряжених рецепторів), що складаються з 485 амінокислот. Глюкагон вивільняється у кровотік, коли рівень глюкози у кровотоці є низьким. Головною фізіологічною роллю глюкагону є стимуляція виробляння глюкози печінкою, що приводить до посилення глікемії (Tan, K., et al., Diabetologia, 1985, 28, 435). Глюкагон забезпечує основний контррегуляторний механізм для інсуліну у підтриманні гомеостазу глюкози in vivo. Глюкагон та його рецептор є потенційними цілями для лікування діабету. Антагоністична глюкагонова дія шляхом блокування дії секретованого глюкагону на глюкагоновий рецептор (глюкагоновий антагоніст) або шляхом інгібування (пригнічення) продукування самого глюкагону є новим напрямком втручання при діабетичних та метаболічних розладах (Unson, C.G., et al., Peptides, 1989, 10, 1171; Parker, J. C, Diabetes, 2000, 49, 2079; Johnson, D. G., Science, 1982, 215, 1115; Ahn, J. M., JMC, 2001, 44(9), 1372-1379). Амід GLP-1 (7-36) є продуктом препроглюкагонового гена, який секретується кишковими Lклітинами у відповідь на приймання їжі. Фізіологічна дія GLP-1 викликає значний інтерес. GLP-1 виявляє складну дію шляхом стимулювання секреції інсуліну панкреатичними Р-клітинами у глюкоза-залежний спосіб (інсулінотропна дія). GLP-1 знижує концентрацію глюкагону у циркулюючій плазмі, шляхом інгібування його секреції (продукування -клітинами (Drucker D. J., 1 UA 99493 C2 5 10 15 20 25 30 35 40 45 50 55 60 Endocrinology, 2001, 142, 521-527). GLP-1 також виявляє такі властивості, як стимуляція росту Рклітин, пригнічення апетиту, уповільнене спороження шлунку та стимуляція чутливості до інсуліну (Nauck, M.A., Horm. Metab. Res., 2004, 36, 852). Зараз, різні аналоги GLP-1 та ЕХ-4, такі як Liraglutide / NN2211 (Novo Nordisk; Phase-Ill; WO 1998 008871), BIM 51077 (Ipsen; Phase-ll; WO 2000 034331), CJC-1131 (ConjuChem; Phase-ll; WO 2000 069911) та ZP-10 (Zealand та Aventis; Phase-ll; WO 2001 004156) перебувають на різних стадіях клінічних досліджень (Nauck М.А., ® Regulatory Peptides, 2004, 115, 13). Нещодавно, на ринок США був випущений BYETTA (ексендин-4, АС 2933; US 5424286) (Amylin та Lilly). Однак, усі існуючі агоністи GLP-1 вводяться парентеральним шляхом, так що недотримання пацієнтом режиму лікування є великою проблемою існуючої терапії на основі застосування GLP-1. Ефекторною системою глюкагонових та GLP-1 рецепторів є фермент аденілілциклаза (АС). Взаємодія агоніста глюкагону або GLP-1 із рецепторами глюкагону або GLP-1 (GLP-1 R), відповідно, спричинює активацію АС, яка перетворює АТР на сАМР. Підвищення рівня внутрішньоклітинного сАМР збільшує співвідношення ADP/ATP, тим самим ініціюючи деполяризацію клітин (внаслідок закриття каналів KATR). Зростання рівня внутрішньоклітинного сАМР також активує протеїнкіназу (РK-А та РK-С), яка підвищує клітинну (cystolic) концентрацію 2+ Са, шляхом відкривання Са-каналів L-типу. Зростання внутрішньоклітинного Са приводить до екзоцитозу інсуліну панкреатичними -клітинами та глюкагон-пептиду -клітинами (Fehmann, Н.С., Endocr. Rev., 1995, 16, 390). Наведені нижче результати аналізу послідовностей GLP-1 та глюкагону показують первинні структурні співвідношення: 1 9 29 Глюкагон: NH2- HSQGTFTSD YSKYLDSRRAQDFVQWLMNT -CONH2: (Seq. ID No: 1) 1 9 30 GLP-1 (7-36): NH2- HAEGTFTSD VSSYLEGQAAKEFIAWLVKGR -CONH2 (Seq. ID No: 2) (+) 1 (Перші N-термінальні залишки 1-9 пептиду GLP-1, з С-термінальним амідом: NH3 - HAE ) 9(-) GTFTSD -CONH2 (Seq. ID No: 3): Сумарний заряд негативний. (+) Перші N-термінальні залишки 1-9 глюкагон-пептиду, з С-термінальним амідом: NH3 1 9(-) HSQGTFTSD -CONH2 (Seq. ID No: 4): Сумарний заряд нейтральний. nd Однобуквенні скорочення для амінокислот можна знайти у Zubay, G., Biochemistry 2 ed., 1988, MacMillan Publishing, New York, p. 33. Нативні або синтетичні GLP-1 пептиди швидко метаболізуються протеолітичними ферментами, такими як дипептидилпептидаза-IV (DPP-IV), до неактивного метаболіту, що обмежує застосування GLP-1 як лікарського засобу (Deacon, C.F., Regulatory Peptides, 2005, 128, 117). Аналогічно, останніми роками було описано декілька непептидильних та пептидильних антагоністів глюкагонового рецептора різних структур, але жоден з них зараз активно не досліджується або не проходить клінічних випробувань (Kurukulasuriya, R., Expert Opinion Therapeutic Patents, 2005, 15, 1739; Lau, J., J. Med. Chem., 2007, 50, 113; Petersen, K.F. Diabetologia, 2001, 44, 2018; Cascieri, M.A., JBC, 1999, 274, 8694). Вважається, що ідентифікація непептидних лігандів (особливо, агоністів) для класу В GPCR є головним вузьким місцем у відкритті нових лікарських засобів. HTS (високопродуктивний скринінг), мабуть, дав декілька результативних влучень (US 2005/6927214; WO 2000/042026; US 2007/0043093), однак, скринінг цих влучень по відповідних рецепторах, особливо, в умовах in vivo (тваринні моделі), має схильність до несправжніх помилок (Murphy, K.G., PNAS, 2007, 104, 689). Глюкагон та GLP-1 обидва відіграють важливу роль у загальному гомеостазі глюкози (Drucker, D.J., J. Clin. Invest., 2007, 117, 24; Bollyky, J., J. Clin. Endocrinol. Metab., 2007, 92, 2879). Глюкагон збільшує концентрації глюкози плазми шляхом стимулювання глюконеогенезу та глікогенолізу у печінці, у той час як GLP-1 знижує концентрації глюкози плазми, медійовані глюкоза-залежною секрецією інсуліну (Mojsov, S., et al., JBC, 1990, 265, 8001). Знаючи важливість як глюкагон-пептиду, так і GLP-1 для підтримання нормальних концентрацій глюкози крові, останніми роками спостерігався значний інтерес до ідентифікації окремого ліганду, що діяв би як антагоніст глюкагонових рецепторів та агоніст GLP-1 рецепторів (Claus, Т. Н., J. Endocrinology, 2007, 192, 371; Pan C.Q., JBC, 2006, 281, 12506). Хоча ідентифікація сильнодіючого непептидного агоніста GLP-1 може бути складною (Chen, D., PNAS, 2007, 104, 943; Knudsen, L.В., PNAS, 2007, 104, 937), конструювання гібридного пептидоміметика, що діяв би як глюкагоновий антагоніст та агоніст GLP-1 рецептора, імовірно, забезпечило б новий підхід до лікування діабету типу 2 (Claus, T.H., J. Endocrinology, 2007, 192, 371). Нещодавно було описано ряд хімерних пептидів, що діють як агоніст GLP-1 рецептора та антагоніст глюкагонового рецептора, сконструйованих переважно шляхом поєднання Nтермінальних залишків глюкагон-пептиду (залишки 1-26) з останніми 4 С-термінальними залишками GLP-1 пептиду (VKGR) (Pan C.Q., et al., US 6864069 В2; Pan C.Q., JBC, 2006, 281, 12506). 2 UA 99493 C2 5 10 15 20 25 30 35 40 45 50 55 В літературі були описані дослідження співвідношення структура-активність (SAR) для визначення ролі індивідуальних амінокислот у глюкагоновій та GLP-1 послідовностях (Runge, S., JBC, 2003, 278, 28005; Mann, R., Biochem. Soc. Trans., 2007, 35, 713). Глюкагон та GLP-1 не мають чітко визначеної структури у водному розчині, але в присутності міцел або у середовищі, що імітує мембрану, вони набувають альфа-спіральної структури у середній частині, з гнучкими N- та С-термінальними ділянками (Thornton, K., Biochemistry, 1994, 33, 3532; Neidigh, J. W., Biochemistry, 2001, 40, 13188). Це дозволяє припустити, що спіральна структура є потрібною для зв'язування пептидних лігандів з їх відповідними рецепторами. Мутації або делеція амінокислот у N-термінальній ділянці обох пептидів приводить до утворення антагоністів рецептора або неактивних сполук, дозволяючи припустити важливість N-кінця для активації рецептора как глюкагоном, так і GLP-1 пептидами (Hjorth, S.A., JBC, 1994, 269, 30121; Green, В. D., J. Моl. Endocrinology, 2003, 31, 529). In vivo, GLP-1 швидко деградує під дією дипептидилпептидази IV (DPP IV), протеази, відповідальної за розщеплення пептидів, що містять пролінові або аланінові залишки у передостанньому N-термінальному положенні, приводячи до утворення неактивних метаболітів. Заміщення сприйнятливих до DPP-IV сайтів, такі як заміщення Ala у 2-му положенні GLP-1 пептиду на D-Ala, Aib чи Hfl (гексафторлейцин), сильно підвищує стабільність у плазмі (Deacon, C.F., Diabetes, 1998, 47, 764; Meng, H., J. Med. Chem., 2008, 51, 7303-7307). В даних дослідженнях ми знайшли, що зчеплення N-термінальної послідовності глюкагонпептиду (перші 1-9 залишки, Seq. ID. No. 4) з дипептидом двох неприродних амінокислот дозволило ідентифікувати новий клас пептидоміметиків, які виявляють глюкагонову антагоністичну та GLP-1 агоністичну активності, з різними ступенями селективності. Для збільшення тривалості дії та стабільністі до фермента DPP-IV, ми здійснили сайт-специфічну модифікацію гібридних пептидоміметиків селективно у положенні Z 2 неприродними амінокислотами, такими як D-Ala, Aib, -метилпролін (-Ме-Рrо), 1-аміноциклопентанкарбонова кислота (АРР) та 1-аміноциклопропанкарбонова кислота (АСР), і успішно ідентифікували короткі пептидоміметики. Деякі пептидоміметики виявили ефективність навіть при пероральному шляху введення, зберігаючи при цьому як глюкагонову антагоністичну, так і GLP-1 агоністичну активності. Відомий рівень техніки та стратегія розробки Був описаний ряд N-термінально модифікованих модуляторів GLP-1 із загальною формулою Хаа1-Хаа11, у якій Хаа1-Хаа9 позначають перші 1-9 залишків пептиду GLP-1 (HAEGTFTSD; Seq. ID No. 3), з де-якими аналогами, у яких Хаа2 або позначає Ala або є необов'язково заміщеним на Aib, Хаа3 позначає амінокислоти з карбоновою кислотою у бічному ланцюзі, такі як глутамінова кислота та аспарагінова кислота, але не Gln (Q), який є консервативним у Nтермінальній послідовності глюкагон-пептиду (HSQGTFTSD, Seq. ID No. 4). Хаа6 позначає Phe або необов'язково заміщений на --Me-2F-Phe-, Xaa9 позначає амінокислоти з карбоновою кислотою або амідом у бічних ланцюгах, такі як аспарагінова кислота, глутамінова кислота, аспарагін і т.д., Хаа10 позначає заміщені чи незаміщені похідні біфенілаланіну (Вір), і Хаа11 позначають заміщені чи незаміщені похідні біфенілаланіну (Вір) або заміщені чи незаміщені похідні 2-аміно-5-фенілпентаноєвої кислоти (APPA) (WO 2003/033671 А2; US 2004/0127423 А1; WO 2004/094461 А2; US 2006/0004222 А1; WO 2006/014287 A1; WO 2006/127948 A2; WO 2007/082264 A2; US 2007/0021346 A1; US 2007/0099835; US 2007/0238669 A1; WO 2007/140284 A2; US 2006/7145040 B2; US 2007/7238671 B2; US 2007/7238670 B2; US 2007/0287670 A1; US 2008/0045461 A1). Раніше, був описаний ряд нових пептидоміметиків з 11 амінокислот, які переважно складаються з N-термінальної послідовності глюкагон-пептиду (перші 1-9 залишків, Seq. ID. No. 4) як активуючого компонента, ковалентно з'єднаної з дипептидом двох неприродних амінокислот (заміщені чи незаміщені похідні біфенілаланіну (Вір)), як зв'язуючого компонента, що виявляють головним чином глюкоза-залежну секрецію інсуліну. Крім того, ці пептидоміметики виявляють активність антагоніста глюкагонового рецептора, разом з активністю агоніста GLP-1 рецептора (WO 2008/ 062457 А2). В даному винаході описані нові пептидоміметики формули (І) (які тут та надалі називаються пептидоміметиками). В даному винаході, замість зв'язуючого компонента на основі біфенілаланінового (Вір) дипептиду, ми використовували як зв'язуючі компоненти заміщені чи незаміщені дипептидні похідні на основі Вір(ОМе)-АРРА. Несподівано, коли ми приєднали цей 9 дипептид до перших 9 залишків N-термінальної послідовності глюкагон-пептиду ('HSQGTFTSD ; Seq. ID No: 4) замість перших 9 залишків N-термінальної послідовності пептиду GLP-1 + (HAEGTFTSD; Seq. ID No. 3), ми знайшли, що цей пептидоміметик (NH 3 -HSQGTFTSD 3 UA 99493 C2 5 10 15 20 25 30 35 40 45 50 55 60 Bip(OMe)-(APPA)-CONH2; Seq. ID No. 5) виявляє головним чином активність антагоніста глюкагонового рецептора, разом з активністю агоніста GLP-1 рецептора, Фігура 1. Нові пептидоміметики формули (І) діють переважно як антагоністи глюкагонового рецептора, а також виявляють GLP-1R агоністичні ефекти. Різні пептидоміметики, описані в даному винаході, виявляють значну глюкоза-залежну секрецію інсуліну (in vitro) та знижують рівні глюкози у кровотоці (in vivo), з різними рівнями спорідненості/селективності до глюкагонових та GLP-1 рецепторів. Крім того, у порівнянні з раніше описаними пептидоміметиками (наприклад, як у WO 2008/062457 А2), ці пептидоміметики, із заміщеними чи незаміщеними дипептидними похідними на основі Вір(ОМе)-АРРА як зв'язуючими компонентами, виявляють підвищену стабільність до протеолітичного розщеплення, особливо, DPP-IV, шлунковими та кишковими ферментами. Таким чином, були знайдені декілька пептидоміметиків, стабільних до ферментів ЖКТ та кислотного рН шлунку, з поліпшеною оральною біодоступністю, що робить їх придатними кандидатами для лікування / полегшення / профілактики діабету як типу 1, так і типу 2, метаболічних розладів та споріднених розладів. Даний винахід описує групу нових пептидоміметиків, що функціонують як антагоністи глюкагонового рецептора та агоністи рецептора GLP-1, які мають різний ступінь спорідненості/селективності до обох рецепторів та є придатними для зниження рівнів глюкози у кровотоці і для лікування діабету. Ці пептидоміметики описуються загальною формулою (І), наведеною нижче. Пептидоміметики за даним винаходом є придатними для лікування організму людини чи тварини шляхом регулювання дії інсуліну та глюкагону. Завдяки введенню нового та метаболічно стабільного зв'язуючого компонента, пептидоміметики за даним винаходом виявляють поліпшену оральну біодоступність і тому були знайдені придатними для лікування / полегшення / регуляції або профілактики діабету типу 1 та типу 2 і асоційованих метаболічних розладів. Кращі варіанти втілення Кращий варіант втілення даного винаходу передбачає нові пептидоміметики загальної формули (І), їх таутомерні форми, нові проміжні сполуки, використовувані в їх синтезі, їх фармацевтично прийнятні солі, їх фармацевтично прийнятні сольвати та фармацевтичні композиції, що містять їх чи їх суміші, придатні для лікування / полегшення / регуляції діабету. В іншому кращому варіанті втілення передбачається спосіб одержання нових пептидоміметиків загальної формули (І), їх таутомерних форм, їх фармацевтично прийнятних солей, фармацевтично прийнятних сольватов та фармацевтичних композицій, що їх містять. У ще одному кращому варіанті втілення передбачаються фармацевтичні композиції, що містять пептидоміметики загальної формули (І), їх таутомерні форми, їх фармацевтично прийнятні солі, сольвати та їх суміші, які мають фармацевтично прийнятні носії, розчинники, розріджувачі, ексципієнти та інші середовища, нормально застосовувані при їх виробництві. У ще одному кращому варіанті втілення передбачається використання нових пептидоміметиків за даним винаходом як протидіабетичних агентів шляхом введення терапевтично ефективної та нетоксичної кількості пептидоміметиків формули (І) або їх фармацевтично прийнятних композицій ссавцям, що потребують такого лікування. Використовувані скорочення У прикладах та в усьому цьому тексті використовуються такі скорочення: Aib = -аміноізомасляна кислота, ACN = ацетонітрил, АРРА = 2-аміно-5-фенілпентаноєва кислота, ACPP = 2-аміно-5-(3-хлорфеніл)пентаноєва кислота, ADMP = 2-аміно-5-(3,5-диметилфеніл)пентаноєва кислота, АМСВ = 2-аміно-5-(4-хлор-2-метилфеніл)пентаноєва кислота, 2F-APPA = 2-аміно-5-(2-фторфеніл)пентаноєва кислота, 2,4-diF-APPA = 2-аміно-5-(2,4-дифторфеніл)пентаноєва кислота, 2CF3-APPA = 2-аміно-5-(2-(трифторметил)феніл)пентаноєва кислота, 2CF3,4F-APPA=2-аміно-5-(4-фтор-2-(трифторметил)феніл)пентаноєва кислота, 2F, 4CF3-APPA = 2-аміно-5-(2-фтор-4-(трифторметил)феніл)пентаноєва кислота, 2СІ-АРРА = 2-аміно-5-(2-хлорфеніл)пентаноєва кислота, 2СІ, 4ОМе-АРРА = 2-аміно-5-(2-хлор-4-метоксифеніл)пентаноєва кислота, Вір = біфенілаланін, Вір(ОМе) = 2'-етил-4'-метоксибіфенілаланін, -Ме-Вір(ОМе) = -метильований Вір(ОМе), N(Me)-Bip(OMe) = N-метильований Вір(ОМе), Вn = бензил, 4 UA 99493 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вос = трет-бутоксикарбоніл, t Вu = О-трет-бутильна група, сАМР = аденозин-3',5'-циклічний монофосфат, DCM = дихлорметан, DMF (ДМФ) = N,N-диметилформамід, DIPCDI = діізопропілкарбодіімід, DIPEA = діізопропілетиламін, Et = етил, Et2O = діетиловий ефір, Fmoc = флуоренілметоксикарбоніл, g (г) = грам(ів), GLP-1R = рецептор глюкагон-подібного пептиду-1, Glucagon R = глюкагоновий рецептор, h (год.) = година (години), Hfl = 5,5,5,5',5',5'-2S-гексафторлейцин, HOBt = гідроксибензотриазол, HOAt = 7-аза-гідроксибензотриазол, HBTU = 2-(1Н-бензотриазол-1-іл)-1,1,3,3-тетраметиламіній гексафторфосфат, HPLC (ВЕРХ) = високоефективна рідинна хроматографія, і.р. = інтраперитонеально, L (л) = літр, LC/MS = рідинна хроматографія / мас-спектрометрія, Me = метил, Міn (хв) = хвилина (хвилини), mL (мл) = мілілітр, l (мкл) = мікролітр, mg (мг) = міліграм(ів), mmol (ммоль) = мілімоль (мілімолей), MS = мас-спектрометрія, РуВОР = бензотриазол-1-ілокси-трис-піролідинофосфоній гексафторфосфат, SPPS = твердофазовий пептидний синтез, sc = підшкірний, TMS = триметилсиліл, TIPS = триізопропілсилан, TFA = трифтороцтова кислота, TBTU=2-(1Н-бензотриазол-1-іл)-1,1,3,3-тетраметиламіній тетрафторборат, Trt = трифенілметильна група. Короткий опис креслень Фігура 1 ілюструє in vitro активність антагоніста глюкагонового рецептора та активність агоніста рецептора GLP-1 людини із Seq. ID. 5. Фігура 2 ілюструє приклади ортогонально захищенх амінокислот, використовуваних у твердофазовому пептиднному синтезі (SPPS) пептидоміметиків з використанням Fmoc. Фігура 3 ілюструє in vitro визначення DRC та ЕС50 ексендину (Фігура А) та Seq. ID No. 38 (Фігура В), за результатами аналізу Н GLP-1R. Фігура 4 ілюструє in vivo зниження глюкози у С57 мишей за допомогою Seq. ID No. 38, після інтраперитонеального (і.р) введення. Фігура 5 ілюструє in vivo зниження глюкози у С57 мишей за допомогою Seq. ID No. 38, після перорального (p.о) введення. Фігура 6 ілюструє in vivo зниження глюкози у db/db мишей за допомогою Seq. ID No. 38, після перорального (p.о) введення. Фігура 7 ілюструє рівні інсуліну сироватки після однократного перорального введення носіїв / досліджуваних пептидоміметиків (Seq. ID. No. 10, 20 та 25) у мишей C57BL/6J (in vivo). Детальний опис винаходу Відповідно до даного винаходу, синтетичні пептидоміметики, що мають структурну формулу (І), виявляють глюкоза-залежну секрецію інсуліну. Крім того, було знайдено, що ці пептидоміметики виявляють активність антагоніста глюкагонового рецептора, разом з активністю агоніста GLP-1 рецептора. Ці пептидоміметики подвійної дії виявляють підвищену стабільність до протеолітичного розщеплення, особливо, ферментом DPP-IV (дипептидилпептидаза-IV). Було знайдено, що більшість пептидоміметиків є стабільними у плазмі пацюків до 24 годин (in vitro), виявляючи підвищену стабільність до дії ферментів ЖКТ, 5 UA 99493 C2 таких як пепсин, та кислотного рН шлунка, а також до мікросом печинки (in vitro). Завдяки підвищеній метаболічній стабільності, деякі з цих пептидоміметиків можуть також бути доставлені пероральними шляхами введення для лікування чи профілактики діабету та споріднених метаболічних розладів. 5 A-Z1-Z2-Z3-Z4-Z5-Z6-Z7-Z8-Z9-Z10-Z11-B 10 15 20 25 (І) у якій А позначає групи -NH-R1, R3-CO-, R3-O-CO- або R3-SO2-, де R1 позначає водень або необов'язково заміщений лінійний чи розгалужений (С1-С10) алкільний ланцюг; R3 вибирають з лінійних чи розгалужених (С1-С10) алкільних, (С3-С6) циклоалкільних, арильних, гетероарильних або арилалкільних груп. У кращому варіанті втілення, арильну групу вибирають з фенільних, дифенільних, нафтильних, інданільних, флуоренільних або біфенільних груп; гетероарильну групу вибирають з піридильних, тієнільних, фурильних, імідазолільних, бензофуранільних груп; В позначає -COOR2, -CONHR2 або CH2OR2, де R2 позначає Н, необов'язково заміщені групи, вибрані з лінійної чи розгалуженої (С1-С10) алкільної групи, арильних чи аралкільних груп, які було визначено вище; Z1-Z11 позначають природні чи неприродні амінокислоти, з'єднані одна з одною амідним зв'язком, якщо не вказано інше. Z1 позначає L-гістидин (Н), D-гістидин (с/Н) або уроканінову кислоту (UA); уроканінова кислота (UA) Z2 позначає природну чи неприродну амінокислоту, вибрану з групи, що складається з Lсерину (S), D-серину (dS), L-аланіну (А), D-аланіну (dA), диметилпроліну (-Ме-Pro), аміноізомасляної кислоти (Aib), 1-аміноциклопропанкарбонової кислоти (АСР), 1аміноциклопентанкарбонової кислоти (АРР); Z3 позначає L-глутамін (Gin; Q), D-глутамін (dQ) або сполуки формули II (CNB або Hfl). 30 2-Аміно-4-ціаномасляна кислота (CNB) Формула II 35 Гексафторлейцин (Hfl) Z4 позначає гліцин (G) або неприродні амінокислоти 1-аміноциклопропанкарбонову кислоту (АСР) чи 1-аміноциклопентанкарбонову кислоту (АРР); Z5 позначає природну чи неприродну амінокислоту, яка має гідроксил у бічному ланцюзі; кращими Z5 є L-треонін (Т), D-треонін (dT), L-ало-треонін (allo-Thr; allo-T), D-ало-треонін (d-alloThr; d-allo-T); 6 UA 99493 C2 5 Z6 позначає природну чи неприродну амінокислоту з дизаміщеним альфа-атомом вуглецю, що має два бічних ланцюги, причому кожний з них може незалежно бути необов'язково заміщеним алкільною або арильною чи аралкільною групою, у яких замісники можуть бути вибрані з однієї чи кількох алкільних груп або однієї чи кількох галоїдних груп. Кращими Z 6 є фенілаланін (Phe; F), альфа-метилфенілаланін (--Ме-Phe-), альфа-метил-2-фторфенілаланін (--Me-2F-Phe-) або альфа-метил-2,6-дифторфенілаланін (--Me-2,6-F-Phe-) чи 2фторфенілаланін (-2F-Phe-). 10 15 Z7 та Z8 незалежно позначають природну чи неприродну амінокислоту, що має гідроксил у бічному ланцюзі, краще, Z7 та Z8 незалежно вибирають з треоніну, серину, 1аміноциклопропанкарбонової кислоти (АСР), як було визначено вище; Z9 незалежно позначають природну чи неприродну амінокислоту, яка має амінокислотний бічний ланцюг, що включає кислотну групу. Кращі Z 9 вибирають з L-аспарагінової кислоти (D), D-аспарагінової кислоти (dD) або сполук формули II, як було визначено вище. Z10 позначає L- або D-неприродну амінокислоту формули ІІІ(а-с); вибрану із заміщеного чи незаміщеного 2'-етил-4'-метоксибіфенілаланіну (Вір(ОМе)) та його похідних. 20 25 30 Z11 позначає L- або D-неприродну амінокислоту формули IV(a-l); вибрану із заміщеної чи незаміщеної 2-аміно-5-фенілпентаноєвої кислоти (АРРА) та її похідних. В наступному варіанті втілення амідний зв'язок між Z 9 та Z10 або Z10 та Z11 або Z9-Z11 може бути N-метильованим, що позначається скорочено як '(NMe)', таким як D-(NMe)-(Bip(OMe)); (Bip(OMe))-(NMe)-APPA; D-(NMe)-(Bip(OMe))-(NMe)-АРРА; може бути тіоамідним зв'язком, що позначається скорочено як 'C=S', таким як D-(C=S)-(Bip(OMe)); Bip(OMe)-(C=S)-(APPA); D-(C=S)(Bip(OMe))-(C=S)-(APPA), або тіоамідний зв'язок між Z9 та Z10 або Z10 та Z11 або Z9-Z11 може бути відновленим до '-СН2-' групи (дезоксопептид), таким як D-(CH2)-(Bip(OMe)); Bip(OMe)-(CH2)(APPA); D-(CH2)-(Bip(OMe))-(CH2)-(APPA). 7 UA 99493 C2 5 10 15 20 25 Визначення: Термін 'природні амінокислоти' позначає усі ті двадцять амінокислот, що зустрічаються у природі. Термін 'неприродні амінокислоти' позначає або заміщення L-амінокислот на відповідні Dамінокислоти, такі як заміщення L-Ala на D-Ala і т.п., або придатні модифікації L- чи Dамінокислот, аміноалкілкислот, будь то шляхом - -алкілування, такого як заміщення Ala на -метил-АІа (Aib), заміщення Phe на альфаметилфенілаланін (--Me-Phe-), альфа-метил-2-фторфенілаланін (--Me-2F-Phe-) або альфаметил-2,6-дифторфенілаланін (--Me-2,6-F-Phe-); - заміщення у бічному ланцюзі амінокислот, такого як заміщення бічного ланцюга ароматичної амінокислоти галогеном, (С1-С3)-алкілом, арильними групами, більш конкретно, заміщення Phe на альфа-метил-2-фторфенілаланін (--Me-2F-Phe-) або альфа-метил-2,6дифторфенілаланін (--Me-2,6-F-Phe-); - N-метилування амінокислот, що позначається скорочено як '(NMe)', такого як (NMe)Bip(OMe) або (NMe)-APPA; - заміщення амідного зв'язку на тіоамідний зв'язок, що позначається скорочено як 'C=S', хімічно, модифікація аміду дипептиду до тіоаміду може бути здійснена шляхом обробки захищеного дипептиду, будь то у фазі розчину чи на твердій підкладці, з використанням реагента Лоуссона (Lawssen). Крім цього, тіоамідний зв'язок між дипептидами може бути перетворений на '-СН2-' групу (дезоксопептид) шляхом відновлення боридом нікелю (Jr. Guziec, F.S., Tetrahedron Letters, 1990, 31(1), 23-26). 8 UA 99493 C2 5 10 15 20 25 30 35 40 45 50 55 60 Різні групи, радикали та замісники, використовувані будь-де в даному описі, описані далі. Термін "алкіл", що використовується тут, сам або в комбінації з іншими радикалами, позначає лінійний чи розгалужений радикал, що містить від одного до десяти атомів водню, такий як метил, етил, н-пропіл, ізо-пропіл, н-бутил, втор-бутил, трет-бутил, аміл, т-аміл, нпентил, н-гексил, ізо-гексил, гептил, октил, децил і т.п. Термін "циклоалкіл", що використовується тут, сам або в комбінації з іншими радикалами, позначає радикал, що містить від трьох до семі атомів вуглецю, такий як циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і т.п. Термін "арил" або "ароматичний", що використовується тут, сам або в комбінації з іншими радикалами, позначає ароматичну систему, яка включає одно, два чи три кільця, де такі кільця можуть бути з'єднані одне з одним через місточкові групи або можуть бути сконденсованими, таку як феніл, нафтил, тетрагідронафтил, індан, біфеніл і т.п. Термін 'арилалкіл' позначає алкільну групу, визначену вище, приєднану до арилу, такі як бензил, фенілетил, нафтилметил і т.п. Термін "арилокси" позначає арильний радикал, визначений вище, приєднаний до алкоксигрупи, такий як фенокси, нафтилокси і т.п., що може бути заміщеним. Термін "аралкокси" позначає арилалкільний фрагмент, визначений вище, такий як бензилокси, фенетилокси, нафтилметилокси, фенілпропілокси і т.п., що може бути заміщеним. Термін "гетероарил" або "гетероароматичний", що використовується тут, сам або в комбінації з іншими радикалами, позначає ароматичну систему, яка містить одне, два чи три кільця, де такі кільця можуть бути з'єднані одне з одним через місточкові групи або можуть бути сконденсованими, і яка містить один чи більше гетероатомів, вибраних з О, N або S. Термін "гетероаралкіл", що використовується тут, сам або в комбінації з іншими радикалами, позначає гетероарильну груп, визначену вище, приєднану до лінійного або розгалуженого насиченого вуглецевого ланцюга, що містить 1-6 атомів вуглецю. Терміни "гетероарилокси", "гетероаралкокси", "гетероциклокси" позначають гетероарильні, гетероарилалкільні групи, відповідно, визначені вище, приєднані до атома кисню. Термін "ацил", що використовується тут, сам або в комбінації з іншими радикалами, позначає радикал, що містить від одного до восьми атомів вуглецю, такий як форміл, ацетил, пропаноїл, бутаноїл, ізо-бутаноїл, пентаноїл, гексаноїл, гептаноїл, бензоїл і т.п., що може бути заміщеним. Термін "карбонова кислота", що використовується тут, сам або в комбінації з іншими радикалами, позначає -СООН групу та включає похідні карбонової кислоти, такі як складні ефіри та аміди. Термін "складний ефір", що використовується тут, сам або в комбінації з іншими радикалами, позначає -СОО-групу та включає похідні карбонової кислоти, де складноефірні фрагменти є алкоксикарбонілом, таким як метоксикарбоніл, етоксикарбоніл і т.п., що може бути заміщеним. Якщо не вказано інше, термін 'амінокислота', що використовується тут, сам або як частина іншої групи, включає, без обмежень, аміногрупу та карбоксильну групу, приєднані до одного атома вуглецю, який позначається як ''-атом вуглецю. Абсолютна 'S' конфігурація ''-атома вуглецю звичайно позначається як 'L' або природна конфігурація. 'R' конфігурація ''-атома вуглецю звичайно позначається як 'D'-амінокислота. У випадку, коли обидва '-замісники' є рівними, такими як водень або метил, амінокислоти є Gly або Aib та є нехіральними. Рядкова 'd' позначає хіральність D-амінокислот. В описі, при зазначенні будь-якої амінокислоти, вона включає обидві L- та D-форми, якщо не вказано інше. Таким чином, у Таблиці 2 наведений перелік одержаних в даному винаході пептидоміметиків, у якому кожна з амінокислот може бути 'L' або 'D'. Термін 'антагоніст рецептора' стосується сполук, що інгібують активацію рецептора та генерування вторинного месенджера, такого як циклічний AMP, будь то шляхом конкурентного чи неконкурентного зв'язування. Термін 'антагоніст глюкагонового рецептора' стосується сполук, що інгібують активацію глюкагонового рецептора. Термін 'модулятор або агоніст GLP-1 рецептора' стосується сполуки, що діє на рецептор GLP-1, змінюючи його здатність регулювати подальші сигнальні події, такі як продукування сАМР та вивільнення інсуліну. Приклади модуляторів рецептора включають агоніст, частковий агоніст, зворотний агоніст та алостеричні потенціатори. Відповідно до даного винаходу, синтетичні ізольовані пептидоміметики, описані тут, діють головним чином як антагоніст глюкагонового рецептора. Крім того, було знайдено, що ці пептидоміметики також діють як агоністи GLP-1 рецепторів. Ці синтетичні пептидоміметики виявляють бажані in vitro властивості антагоніста глюкагонового рецептора, а також активність 9 UA 99493 C2 5 10 15 20 25 30 35 40 45 50 55 агоніста GLP-1 рецептора у клітинах СНО, трансфекованих глюкагоном людини або рецептором GLP-1 (H глюкагон R або HGLP-1R), в інтервалі значень концентрації 1-100 нМ. Активність агоніста Н GLP-1R оцінюють шляхом визначення кількості вивільненого сАМР, у той час як глюкагонову активність антагоніста оцінюють шляхом вимірювання величини інгібування продукування сАМР досліджуваними пептидоміметиками в присутності глюкагон-пептиду. Нові пептидоміметики виявляють бажану in vitro активність антагоніста глюкагонового рецептора у клітинах СНО, трансфекованих глюкагоновим рецептором людини, в інтервалі значень концентрації 1-100 нМ. Деякі з одержаних досліджуваних пептидоміметиків виявляють глюкозазалежне вивільнення інсуліну та зменшують гіперглікемію натще, без спричинення гіпоглікемії, при проведенні випробувань in vivo на різних діабетичних тваринних моделях, таких як гіперглікемічні миші С57, миші ob/ob та db/db, що робить їх ідеальними терапевтичними кандидатами для лікування та профілактики діабету типу 2. Ці нові класи пептидоміметиків можуть бути введені пероральним або парентеральним шляхами введення. Даний винахід пропонує пептидоміметики формули (І), фармацевтичні композиції, що використовують такі пептидоміметики самі або в комбінації, способи використання таких пептидоміметиків. Зокрема, даний винахід передбачає фармацевтичну композицію, яка включає терапевтично ефективні кількості пептидоміметиків формули (І), самих або в комбінації (комбінаціях) з фармацевтично прийнятним носієм. Далі, передбачається спосіб лікування або уповільнення розвитку чи початку діабету, особливо, діабету типу 2, включаючи ускладнення діабету, включаючи ретинопатію, невропатію, нефропатію та уповільнене загоєння ран і споріднені хвороби, такі як інсулінорезистентність (порушений гомеостаз глюкози), гіперглікемія, гіперінсулінемія, підвищені рівні жирних кислот або гліцерину крові, гіперліпідемія, включаючи гіпертригліцеридемію, синдром X, атеросклероз та гіпертензія, де терапевтично ефективні кількості пептидоміметиків формули (І) або їх комбінацію (комбінації) вводять ссавцю, наприклад, людині, пацієнту, що потребує лікування. Одержання пептидоміметиків: Кілька шляхів синтезу, що можуть бути використані для одержання пептидоміметиків за даним винаходом, є добре відомими кваліфікованому фахівцю в області пептидного синтезу. Пептидоміметики формули (І), у якій усі символи були визначені вище, можуть бути синтезовані з використанням способів, описаних нижче, разом із звичайними методиками, відомими кваліфікованим фахівцям в області пептидого синтезу, або їх варіантів, передбачуваних кваліфікованими фахівцями. Зазначені способи включають, без обмежень, описані нижче. Описані тут пептидоміметики можуть бути одержані шляхом хімічного синтезу з використанням придатних варіантів різних твердофазових методик, що є загальновідомими, таких як описані у G. Barany and R.B. Merrifield, "Peptides: Analysis, Synthesis, Biology"; Volume 2 "Special methods in peptide synthesis, Part A", pp. 3-284, E. Gross and J. Meienhofer, Eds., Academic Press, New York, 1980; та у J.M. Stewart and J.D. Young, "Solid-phase peptide synthesis" 2nd Ed., Pierce Chemical Co., Rockford, II, 1984. Краща стратегія одержання пептидоміметиків за даним винаходом основана на використанні SPPS-підходу з використанням Fmoc, де група Fmoc (9флуоренілметилметилоксикарбоніл) використовується для тимчасовго захисту -аміногрупи, в комбінації з кислотно-лабільними захиснимі групами, такими як т-бутилоксикарбонільні (Вос), t трет-бутильні (Вu ), трифенілметильні (тритильні) (Trt) групи (Фігура 2), для тимчасового захисту бічних ланцюгів амінокислоти (див., наприклад, Е. Atherton and R.C. Sheppard, "The Fluorenylmethoxycarbonyl amino protecting group", у "Peptides: Analysis, Synthesis, Biology"; Volume 9 - "Special methods in peptide synthesis, Part C", pp. 1-38, S. Undenfriend and J. Meienhofer, Eds., Academic Press, San Diego, 1987). Пептидоміметики можуть бути синтезовані ступінчасто на нерозчинній полімерній підкладці (смолі), починаючи з С-кінця пептиду. У варіанті втілення, синтез ініціюють шляхом приєднання С-термінальної амінокислоти пептиду до смоли шляхом утворення амідного, складноефірного чи простого ефірного зв'язку. Це дозволяє згодом вивільнити одержаний пептид у вигляді Стермінального аміду, карбонової кислоти або спирту, відповідно. В SPPS з використанням Fmoc, С-термінальна амінокислота та усі інші використовувані у синтезі амінокислоти повинні мати свої -аміногрупи та функціональності бічних ланцюгів (якщо вони є) захищеними в різний спосіб (ортогональний захист), так щоб захисна група -аміногрупи могла бути селективно видалена під час синтезу з використанням придатної основи, такої як 20 % розчин піперидину, без будь-якого передчасного відщеплення пептиду від смоли або видалення захисних груп бічних ланцюгів, звичайно захищених кислотно-лабільними захисними групами. 10 UA 99493 C2 5 10 15 20 25 30 35 40 45 Приєднання амінокислоти здійснюється шляхом активації її карбоксильної групи у вигляді активного складного ефіру та проведення її реакції з разблокованою -аміногрупою Nтермінальної амінокислоти, приєднаної до смоли. Після кожного приєднання та зняття захисту, пептидил-смолу промивають надлишком розчинників, таких як ДМФ, DCM та діетиловий ефір. Послідовність зняття захисту -аміногрупи та приєднання повторюють до завершення складання бажаної пептидної послідовності (Схема 1). Пептид потім відщеплюють від смоли із супутним зняттям захисту функціональностей бічних ланцюгів за допомогою відповідної суміші для відщеплення, звичайно в присутності відповідних сполук-акцепторів для обмеження побічних реакцій. Одержаний пептид зрештою очищують оберненофазовою ВЕРХ. Синтез пептидил-смол, потрібних для використання як прекурсори для кінцевих пептидів, використовує комерційно доступні зшиті полістирольні полімерні смоли (Novabiochem, San Diego, CA). Кращими для використання в даному винаході є смола Fmoc-PAL-PEG-PS, 4-(2',4'диметоксифеніл-Рmос-амінометил)феноксиацетил-п-метилбензгідриламінова смола (Fmoc-Rink амідна МВНА смола), 2-хлортрифенілметилхлоридна смола або смола на основі пбензилоксибензилового спирту (НМР смола), до яких може бути заздалегідь приєднана чи ні Стермінальна амінокислота. Якщо С-термінальна амінокислота не приєднана, її приєднання може бути здійснене за допомогою HOBt активного складного ефіру Fmoc-захищеної амінокислоти, утвореного за реакцією з DIPCDI. У випадку 2-хлортрифенілметильної смоли, приєднання першої Fmoc-захищеної амінокислоти здійснюють з використанням DIPEA. Для приєднання наступної амінокислоти, N-термінальний захист пептидильної смоли селективно видаляють, використовуючи 10-20 % розчин піперидину. Після кожного приєднання та зняття захисту, надлишок амінокислот та реагентів зв'язування видаляють шляхом промивання ДМФ, DCM та простим ефіром. Зв'язування наступних амінокислот може бути здійснене з використанням HOBt або НОАТ активних складних ефірів, одержаних з DIPCDI/HOBt або DIPCDI/HOAT, відповідно. У випадку деяких складних реакцій зв'язування, особливо, зв'язування амінокислот, що є гідрофобними, або амінокислот з об'ємними захисними групами бічних ланцюгів, повне зв'язування може бути досягнуте при використанні комбінації високоефективних агентів зв'язування, таких як HBTU, РуВОР чи TBTU, з такими домішками, як DIPEA. Синтез пептидоміметиків, описаний тут, може бути з здійснений використанням апарата для проведення періодичного або у безперервному потоці синтезу пептиду, такого як синтезатор пептидів CS-Bio або ААРРТЕС, з використанням стратегії захисту Fmoc/т-бутил. Неприродні некомерційні амінокислоти, присутні в різних положеннях, включають в пептидний ланцюг з використанням одного чи декількох способів, відомих фахівцям. В одному підході, готують Fmoc-захищену неприродну амінокислоту у розчині, використовуючи відповідні описані в літературі процедури. Наприклад, Fmoc-захищені -метильовані амінокислоти, такі як Fmoc-AibOH, Fmoc-(-Me-2F-Phe)-OH, Fmoc-(-Me-2,6-F-Phe)-OH, були одержані з використанням модифікованої описаної в літературі процедури (Boesten, W.H.J., et аl., Org. Lett., 2001, 3(8), 1121; Kapadia, S.R., et al., JOC, 2001, 66, 1903-1905). Синтез N-Fmoc-2-аміно-5фенілпентаноєвої кислоти (Fmoc-АРРА) та її похідних, зазначених у Формулі IV(a-l), проводився з використанням модифікованого відомого з літератури способу (Betshrugge, J.V., Tetrahedron, 1998, 54, 1753-1762; WO 2003/087036). Fmoc-Вір(ОМе)-ОН-(2'-етил-4'-метоксибіфенілаланін; 2аміно-3-(2'-етил-4'-метоксибіфеніл-4-іл)пропіонова кислота) був одержаний описаним в літературі способом (Kotha, S., et al., Tetrahedron 2002, 58, 9633; US 2006/0004222 A1), і Fmoc5,5,5,5',5',5'-2S-гексафторлейцин (Fmoc-(Hfl)-OH) був одержаний за описаною процедурою (Chiu, Н.Р., Cheng, R.P., Org. Lett., 2007, 9(26), 5517-5520). Одержане похідне було потім використане у ступінчастому синтезі пептиду. Альтернативно, потрібні неприродні амінокислоти споруджували безпосередньо на смолі з використанням процедур органічного синтезу, з утворенням лінійного пептидного ланцюга. 50 11 UA 99493 C2 Схема 1: Загальна схема SPPS з використанням Fmoc 5 10 15 Прекурсори пептид-смола для відповідних пептидоміметиків можуть бути відщеплені, і захисні групи видалені, з використанням придатних варіантів будь-яких стандартних процедур відщеплення, описаних в літературі (King, D.S., et al., Int. J. Peptide Protein Res., 1990, 36, 255). Кращим способом для використання в даному винаході є застосування суміші для відщеплення на основі TFA, в присутності води та TIPS як сполук-акцепторів. Типово, пептидил-смолу інкубують у TFA/воді/TIPS (94:3:3; об.:об.:об.; 10 мл/100 мг пептидил-смоли) протягом 1,5-2 год. при кімнатній температурі. Вивільнену смолу потім відокремлюють на фільтрі, розчин у TFA концентрують або висушують при зниженому тиску. Одержаний сировой пептид осаджують чи промивають Et2O або повторно розчиняють безпосередньо в ДМФ або 50 % водній оцтовій кислоті для очищення препаративною ВЕРХ. Пептидоміметики із бажаною чистотою можуть бути одержані очищенням з використанням препаративної ВЕРХ. Розчин сирового пептиду вводять в напівпрепаративну колонки (Luna 10 мкм; С18; 100 Å), розмір 250×50 мм, та елююють з лінійним градієнтом ACN у воді, обидва забуферені 0,1 % TFA, при об'ємній витраті 15-50 мл/хв., з контролем ефлюента за допомогою PDA детектора на 220 нм. Структури очищених пептидоміметиків можуть бути підтверджені шляхом аналізу методом мас-спектроскопії з елетророзпиленням (ES-MS). Усі одержані пептиди були ізольовані у вигляді трифторацетатної солі, з TFA як протиіоном, після очищення препаративною ВЕРХ. Однак, деякі пептиди були піддані знесолюванню 12 UA 99493 C2 5 10 15 20 25 30 35 40 45 шляхом пропускання через шар придатної іонообмінної смоли, краще, через аніонообмінну смолу Dowex SBR Р(С1) або еквівалентну основну аніонообмінну смолу. У деяких випадках, протиіони TFA заміщували на ацетатні іони шляхом пропускання через придатну іонообмінну смолу, з елююванням розведеним розчином оцтової кислоти. Для одержання хлористоводневої солі пептидів, на останній стадії виробництва вибрані пептиди, у вигляді ацетатної солі, обробляють 4М НСІ. Одержаний розчин фільтрують через мембранний фільтр (0,2 мкм) і потім ліофілізують, одержуючи НСІ-сіль, що має колір бід білого до білуватого. За допомогою подібних методик та/або таких їх придатних модифікацій, що можуть бути легко здійснені кваліфікованими фахівцями, були одержані інші придатні фармацевтично прийнятні солі пептидоміметиків за винаходом. Загальний спосіб одержання пептидоміметиків з використанням SPPS підходу: Складання пептидоміметиків на смолі: Проводять набухання достатньої кількості (50-100 мг) смоли Fmoc-PAL-PEG-PS або FmocRink амідної МВНА смоли, зі ступенем заміщення: 0,5-0,6 ммоль/г, у ДМФ (10-20 мл/100 мг смоли) протягом 2-10 хвилини. Fmoc-групу смоли потім видаляють шляхом інкубування смоли з 10-20 % піперидину в ДМФ (10-30 мл/100 мг смоли) протягом 10-30 хвилин. Смолу зі знятим захистом фільтрують та промивають надлишком ДМФ, DCM та простого ефіру (50 мл ×4). Промиту смолу інкубують у свіжодистильованому ДМФ (1 мл/100 мг смоли) під атмосферою азоту протягом 5 хвилин. Додають до смоли 0,5М розчин першої Fmoc-захищеної амінокислоти (1-3 екв.), попередньо активованої HOBt (1-3 екв.) та DIPCDI (1-2 екв.) у ДМФ, і смолу потім струшують протягом 1-3 год. під атмосферою азоту. Завершення зв'язування контролюють за допомогою кількісного нінгідринового тесту. Після зв'язування першої амінокислоти, смолу промивають ДМФ, DCM та діетиловим ефіром (50 мл ×4). Для зв'язування наступної амінокислоти, по-перше, видаляють Fmoc-захист першої амінокислоти, зв'язаної зі смолою, за допомогою 20 % розчину піперидину, після чого проводять зв'язування Fmoc-захищеної другої амінокислоти, використовуючи придатні агенти зв'язування, як описано вище. Виконують повторні цикли зняття захисту, промивання, зв'язування та промивання до складання на смолі бажаного пептидного ланцюга, відповідно до загальної Схеми 1 вище. Зрештою, видаляють захист Fmoc-захищеної пептидил-смоли, одержаної вище, шляхом обробки 20 % піперидином, як описано вище, і пептидил-смолу промивають ДМФ, DCM та діетиловим ефіром (50 мл ×4). Смолу, що містить бажаний пептид, висушують під тиском азоту протягом 10-15 хвилин та піддають обробці з метою відщеплення/зняття захисту. Типовий приклад автоматизованого твердофазового синтезу пептидної послідовності ID. No. 37 (H2N-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA)-CONH2). Лінійний пептидний ланцюг H2N-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA)-PAL-PEGPS складають в автоматичному синтезаторі CS-Bio 536 PepSynthesiser™ з використанням методики Fmoc твердофазового пептидного синтезу (SPPS) (Схема 2). Fmoc-амінокислоти та 2(1Н-бензотриазол-1-іл)-1,1,3,3-тетраметилуронійтетрафторборат (TBTU) завантажують разом у флакони та встановлюють в амінокислотному модулі синтезатора. Маточний розчин діізопропілетиламіну (DIPEA; 0,9М) та ДМФ зберігають у флаконах для реактивів під атмосферою сухого азоту. Смолу, Fmoc-PAL-PEG-PS (0,38 ммоль/г; 1 г) висушують над Р2О5 in vacuo (1 год.) та проводять набухання у свіжодистильованому ДМФ (5 мл). Суспензією набухлої смоли набивають скляну колонку та встановлюють у синтезатор. Усі цикли синтезу проводять -1 при об'ємній витраті 5 мл хв. , Таблиця 1. Смолу промивають свіжодистильованим ДМФ протягом 10 хвилин. Зняття захисної Fmoc-групи здійснюють за допомогою 20 % піперидину в ДМФ протягом 10 хвилин і зняття захисту контролюють УФ-детектуванням ефлюента колонки при 304 нм. 13 UA 99493 C2 Схема 2: SPPS для Seq. ID. No. 37 5 10 15 Надлишок піперидину видаляють за допомогою трьох допоміжних циклів промивання та циклу промивання дистильованим ДМФ, при тривалості кожного циклу 15 хвилин. Аміногрупу обробляють Fmoc-амінокислотою (4 еквіваленти), попередньо активованою TBTU (3,9 еквівалентів) в присутності DIPEA (8 еквівалентів), і рециркулюють протягом 120 хвилин. Надлишок амінокислоти та розчинні побічні продукти видаляють з колонки та петлі за допомогою чотирьох допоміжних циклів промивання та циклів промивання дистильованим ДМФ, при тривалості кожного циклу 10 хвилин. Після цього, цикли синтезу (зняття захисту, промивання, ацилювання та промивання) повторюють для завершення складання лінійного пептиду. Кінцевий цикл зняття захисту проводять з використанням 20 % піперидину в ДМФ протягом 15 хвилин для видалення термінальної Fmoc-групи, з наступним циклом промивання (10×4 хвилини). Готову систему пептид-смола фільтрують через фільтр з пористого скла, промивають послідовно три рази ДМФ, DCM, метанолом, ДМФ та діетиловим ефіром (100 мл кожного). Пептид-смолу висушують in vacuo над Р2О5 (2 год.) та зберігають при -20 °C. Проводять нінгідриновий тест смоли для перевірки N-термінальної вільної аміногрупи зв'язаного зі смолою пептиду. Поява синьо-пурпурного забарвлення розчину та бусин смоли свідчить про присутність вільної аміногрупи у зв'язаному зі смолою пептиді та вважається позитивним результатом тесту. 14 UA 99493 C2 Таблиця 1 Цикли автоматизованого твердофазового пептидного синтезу Стадія 1 2 3 4 10 15 20 25 30 35 40 45 Ацилювання 5 5 Функція Промивання Зняття захисту Промивання Промивання Реагент/ Розчинник Диметилформамід (ДМФ) 20 % піперидину в ДМФ ДМФ Амінокислота; TBTU та діізопропілетиламін (в ДМФ) Диметилформамід Число циклів 1 2 3 Час (хвилин) 10 15 15 Рециркуляція 120 4 10 Було проведене дрібномасштабне відщеплення для оцінки чистоти зв'язаного зі смолою пептиду. Висушену систему пептид-смола (біля 10 мг) обробляють сумішшю (1 мл) TFA, води, триізопропілсилану (95:2,5:2,5 об./об.) протягом 90 хвилин при кімнатній температурі, час від часу обережно перемішуючи обертанням. Смолу фільтрують, ретельно промивають нерозведеною TFA (1 мл) і весь фільтрат випарюють при зниженому тиску. Залишкову TFA виділяють азеотропною перегонкою з діетиловим ефіром (2 мл). Одержаний залишок суспендують в дистильованій воді (2 мл) і водний шар екстрагують три рази діетиловим ефіром (3 мл). Водний шар відокремлюють та ліофілізують, одержуючи сировий пептид H 2N-H-Aib-QGT(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA)-CONH2. Ліофілізований пептид H2N-H-Aib-QGT-(-Me-2FPhe)-TSD-Bip(OMe)-(APPA)-CONH2 розчиняють в 0,1 % водній TFA (біля 1 мг/1 мл) і його чистоту аналізують методом аналітичної оберненофазової ВЕРХ та характеризують масспектрометрією з іонізацією електророзпилюванням (ESI-MS). Процент чистоти: 90 % (сировий пептид). ESI-MS; Розраховано для H2N-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA)-CONH2: + + + + + 1465 (М ), 1487 (M+Na ) та 1503 (М+K ); Знайдено (m/z): 1465 (М ), 1487 (M+Na ) та 1503 + (М+K ). Використовуючи наведений вище протокол та його придатні варіанти, що можуть бути здійснені кваліфікованим фахівцем, були одержані сконструйовані за даним винаходом пептидоміметики з використанням підходу Fmoc-SPPS. Після цього зв'язані зі смолою пептидоміметики відщеплювали та видаляли захист, очищали та характеризували з використанням такого протокола. Відщеплення та зняття захисту: Бажані пептидоміметики одержували шляхом відщеплення та зняття захисту з їх відповідних пептидил-смол шляхом обробки суміші для відщеплення на основі TFA у такий спосіб. Розчин TFA/вода/триізопропілсилан (95:2,5:2,5) (10 мл/100 мг пептидил-смоли) додають до пептидилсмоли і суміш витримують при кімнатній температурі, час від часу перемішуючи. Смолу фільтрують, промивають сумішшю для відщеплення і об'єднаний фільтрат випарюють до сухого залишку. Одержаний залишок розчиняють у 10 мл води та водний шар екстрагують 3 рази простим ефіром (20 мл кожного разу) і, зрештою, водний шар ліофілізують. Сировий пептид, одержаний після ліофілізації, очищають препаративною ВЕРХ у такий спосіб: Очищення сирових пептидоміметиків препаративною ВЕРХ: Препаративну ВЕРХ проводять на рідинному хроматографі Shimadzu LC-8A. Розчин сирового пептиду в ДМФ або воді вводять в напівпрепаративну колонку (Luna 10 мкм; С 18; 100 Å) розміром 250×50 мм та елююють лінійним градієнтом ACN у воді, обидва забуферені 0,1 % TFA, з використанням об'ємної витрати 15-50 мл/хв, з контролем ефлюента PDA детектором при 220 мкм. Типово використовують градієнт від 20 % до 70 % суміші вода-ACN, забуференої 0,1 % TFA, протягом періоду 50 хвилин, при зміні градієнта на 1 % за хвилину. Бажаний елюйований продукт збирають у вигляді однієї фракції об'ємом 10-20 мл і чисті пептидоміметики одержують у виглядіі аморфних білих порошків шляхом ліофілізації відповідних фракцій ВЕРХ. Аналіз очищених пептидоміметиків методом ВЕРХ Після очищення препаративною ВЕРХ, як описано вище, кожний пептид аналізують методом аналітичної оберненофазової ВЕРХ в аналітичній ВЕРХ системі Shimadzu LC-10AD. Для аналізу пептидоміметиків методом аналітичної ВЕРХ використовують колонку Luna 5 мкм; С18; 100 Å, розміром 250×4,6 мм, з лінійним градієнтом 0,1 % TFA та ACN буфера, і реєстрацію хроматограми проводять при 220 мкм за допомогою PDA-детектора. 15 UA 99493 C2 5 10 15 Характеризація методом мас-спектрометри Кожний пептид характеризували методом мас-спектрометрії з іонізацією електророзпилюванням (ESI-MS), в протоково-ін'єкційному або LC/MS режимі. Потрійно квадрупольні мас-спектрометри (АРІ-3000 (MDS-SCIES, Canada) використовувалися для усіх аналізів позитивних та негативних іонів у режимі електророзпилювання. Дані повного сканування реєстрували в діапазоні масових чисел квадруполя, при роботі з розділенням приладу. В усіх випадках, експериментально виміряна молекулярна вага співпадала до 0,5 Дальтон із розрахунковою моноізотопною молекулярною вагою. Кількісний аналіз масхроматограми проводили з використанням прикладної комп'ютерної програми Analyst 1.4.1. Використовуючи способи синтезу, описані тут, разом з іншими загальновідомими методиками та їх придатними варіантами, одержали такі нові пептидоміметики. Цей перелік визначає різні групи пептидоміметиків, які можуть бути одержані відповідно до даного винаходу і, як очікується, включає щонайменше очевидні варіанти цих пептидоміметиків. Однак, це розкриття не повинно тлумачитися як таке, що будь-яким чином обмежує обсяг винаходу. У Таблиці 2(i-v) перелічені нові пептидоміметики за даним винаходом разом з їх відповідними номерами Seq. ID. Таблиця 2 (і): Перелік одержаних пептидоміметиків Seq. ID. No. 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 Послідовність пептидоміметиків HSQGTFTSD-Bip(OMe)-(APPA) HSQGTFTSD-Bip(OMe)-(ADMP) HSQGTFTSD-Bip(OMe)-(ACPP) HSQGTFTSD-Bip(OMe)-(AMCB) H-(-Me-Pro)-QGTFTSD-Bip(OMe)-(APPA) H-(-Me-Pro)-QGTFTSD-Bip(OMe)-(ADMP) H-(-Me-Pro)-QGTFTSD-Bip(OMe)-(ACPP) H-(-Me-Pro)-QGTFTSD-Bip(OMe)-(AMCB) HAQGTFTSD-Bip(OMe)-(APPA) HAQGTFTSD-Bip(OMe)-(ADMP) HAQGTFTSD-Bip(OMe)-(ACPP) HAQGTFTSD-Bip(OMe)-(AMCB) H-Aib-QGTFTSD-Bip(OMe)-(APPA) H-Aib-QGTFTSD-Bip(OMe)-(ADMP) H-Aib-QGTFTSD-Bip(OMe)-(ACPP) H-Aib-QGTFTSD-Bip(OMe)-(AMCB) H-(ACP)-QGTFTSD-Bip(OMe)-(APPA) H-(ACP)-QGTFTSD-Bip(OMe)-(ADMP) H-(ACP)-QGTFTSD-Bip(OMe)-(ACPP) H-(ACP)-QGTFTSD-Bip(OMe)-(AMCB) H-(APP)-QGTFTSD-Bip(OMe)-(APPA) H-(APP)-QGTFTSD-Bip(OMe)-(ADMP) H-(APP)-QGTFTSD-Bip(OMe)-(ACPP) H-(APP)-QGTFTSD-Bip(OMe)-(AMCB) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(APPA) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(ADMP) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(ACPP) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(AMCB) H-Aib-QGT-(-Me-Phe)-TSD-Bip(OMe)-(APPA) H-Aib-QGT-(-Me-Phe)-TSD-Bip(OMe)-(ADMP) H-Aib-QGT-(-Me-Phe)-TSD-Bip(OMe)-(ACPP) H-Aib-QGT-(-Me-Phe)-TSD-Bip(OMe)-(AMCB) H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(ADMP) H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(ACPP) 16 UA 99493 C2 40 41 42 43 44 H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(AMCB) H-Aib-QGT-(2F-Phe)-TSD-Bip(OMe)-(APPA) H-Aib-QGT-(2F-Phe)-TSD-Bip(OMe)-(ADMP) H-Aib-QGT-(2F-Phe)-TSD-Bip(OMe)-(ACPP) H-Aib-QGT-(2F-Phe)-TSD-Bip(OMe)-(AMCB) Таблиця 2 (іі): Перелік одержаних пептидоміметиків Seq. ID. No. 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 Послідовність пептидоміметиків HSQGTFTSD-Bip(OMe)-(2F-APPA) HSQGTFTSD-Bip(OMe)-(2,4-diF-APPA) HSQGTFTSD-Bip(OMe)-(2CF3-APPA) HSQGTFTSD-Bip(OMe)-(2CF3,4F-APPA) HSQGTFTSD-Bip(OMe)-(2F, 4CF3-APPA) HSQGTFTSD-Bip(OMe)-(2CI-APPA) HSQGTFTSD-Bip(OMe)-(2,4-diCI-APPA) HSQGTFTSD-Bip(OMe)-(2CI, 4OMe-APPA) HAQGTFTSD-Bip(OMe)-(2F-APPA) HAQGTFTSD-Bip(OMe)-(2,4-diF-APPA) HAQGTFTSD-Bip(OMe)-(2CF3-APPA) HAQGTFTSD-Bip(OMe)-(2CF3, 4F-APPA) HAQGTFTSD-Bip(OMe)-(2F, 4CF3-APPA) HAQGTFTSD-Bip(OMe)-(2CI-APPA) HAQGTFTSD-Bip(OMe)-(2,4-diCI-APPA) HAQGTFTSD-Bip(OMe)-(2CI, 4OMe-APPA) H-Aib-QGTFTSD-Bip(OMe)-(2F-APPA) H-Aib-QGTFTSD-Bip(OMe)-(2,4-diF-APPA) H-Aib-QGTFTSD-Bip(OMe)-(2CF3-APPA) H-Aib-QGTFTSD-Bip(OMe)-(2CF3, 4F-APPA) H-Aib-QGTFTSD-Bip(OMe)-(2F, 4CF3-APPA) H-Aib-QGTFTSD-Bip(OMe)-(2CI-APPA) H-Aib-QGTFTSD-Bip(OMe)-(2,4-diCI-APPA) H-Aib-QGTFTSD-Bip(OMe)-(2CI, 4OMe-APPA) H-(ACP)-QGTFTSD-Bip(OMe)-(2F-APPA) H-(ACP)-QGTFTSD-Bip(OMe)-(2,4-diF-APPA) H-(ACP)-QGTFTSD-Bip(OMe)-(2CF3-APPA) H-(ACP)-QGTFTSD-Bip(OMe)-(2CF3,4F-APPA) H-(ACP)-QGTFTSD-Bip(OMe)-(2F, 4CF3-APPA) H-(ACP)-QGTFTSD-Bip(OMe)-(2CI-APPA) H-(ACP)-QGTFTSD-Bip(OMe)-(2,4-diCI-APPA) H-(ACP)-QGTFTSD-Bip(OMe)-(2CI, 4OMe-APPA) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2F-APPA) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2,4-diF-APPA) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2CF3-APPA) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2CF3,4F-APPA) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2F, 4CF3-APPA) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2CI-APPA) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2,4-diCI-APPA) H-Aib-(CNB)-GTFTSD-Bip(OMe)-(2CI, 4OMe-APPA) H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2,4-diF-APPA) H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2CF3-APPA) H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2CF3, 4F-APPA) H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F, 4CF3-APPA) H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2CI-APPA) 17 UA 99493 C2 91 92 H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2,4-diCI-APPA) H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2CI, 4OMe-APPA) Таблиця 2 (ііі): Перелік одержаних пептидоміметиків Seq. ID. No. 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 Послідовність пептидоміметиків CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(ailo)-SD-Bip(OMe)-(APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA) H-Aib-QGT-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA) H-Aib-(CNB)-GT-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA) H-Aib-QGT-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA) H-Aib-(CNB)-GT-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-((NMe)(APPA)) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-((NMe)(APPA)) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-((NMe)(2F-APPA)) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-((NMe)(2F-APPA)) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(APPA)) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(APPA)) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(2F-APPA)) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(2F-APPA)) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(APPA)) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(APPA)) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(2F-APPA)) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMeH(NMe)(2F-APPA)) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-((NMe)Bip(OMe))-((NMe)(APPA)) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-((NMe)Bip(OMe))-((NMe)(APPA)) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-((NMe)Bip(OMe))-((NMe)(2F-APPA)) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-((NMe)Bip(OMe))-((NMe)(2F-APPA)) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))((NMe)(APPA)) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe)) 18 UA 99493 C2 139 140 141 142 143 144 145 146 147 148 149 150 ((NMe)(APPA)) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(2FAPPA)) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(2FAPPA)) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(APPA)) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(APPA)) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(2F-APPA)) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-((NMe)Bip(OMe))-((NMe)(2FAPPA)) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TS-(NMe)D-((NMe)Bip(OMe))-((NMe)(APPA)) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TS-(NMe)D-((NMe)Bip(OMe))-((NMe)(APPA)) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TS-(NMe)D-((NMe)Bip(OMe))-((NMe)(2F-APPA)) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TS-(NMe)D-((NMe)Bip(OMe))-((NMe)(2FAPPA)) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))((NMe)(APPA)) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))((NMe)(APPA)) Таблиця 2 (iv): Перелік одержаних пептидоміметиків Seq. ID. No. 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 Послідовність пептидоміметиків CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))((NMe)(2F-APPA)) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))((NMe)(2F-APPA)) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(APPA)) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))((NMe)(APPA)) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(2FAPPA)) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))((NMe)(2F-APPA)) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(C=S)-(APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(C=S)-(APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(C=S)-(2F-APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(C=S)-(2F-APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(2F-APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(2F-APPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(APPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(2F-APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(2F-APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-(C=S)-Bip(OMe)-(C=S)-(APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-(C=S)-Bip(OMe)-(C=S)-(APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)(APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(2F 19 UA 99493 C2 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(2FAPPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(APPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(CH2)-(APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMeHCH2)-(APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(CH2H2F-APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMeHCH2)-(2F-APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(2F-APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(2F-APPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(APPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(2F-APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(2F-APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-(CH2)-Bip(OMe))-(CH2)-(APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-(CH2)-Bip(OMe)-(CH2)-(APPA) CH3CO-H-Aib-QGT-(-Me-2F-Phe)-TSD-(CH2)-Bip(OMe)-(CH2)-(2F-APPA) CH3OCO-H-Aib-QGT-(-Me-2F-Phe)-TSD-(CH2)-Bip(OMe)-(CH2)-(2F-APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(APPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)(APPA) CH3CO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(2FAPPA) CH3OCO-H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(2FAPPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(APPA) H-Aib-QG-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(2F-APPA) H-Aib-(CNB)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(2F-APPA) CH3CO-H-Aib-(CNB)-GT-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) CH3OCO-H-Aib-(CNB)-GT-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) CH3CO-H-Aib-(CNB)-GT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) CH3OCO-H-Aib-(CNB)-GT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) Таблиця 2 (v): Перелік одержаних пептидоміметиків Seq. ID. No. 209 210 211 212 213 214 215 216 217 218 219 Послідовність пептидоміметиків H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(CH2)-Bip(OMe)-(CH2)-(APPA) CH3CO-H-Aib-(Hfl)-GT-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) CH3OCO-H-Aib-(Hfl)-GT-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) CH3CO-H-Aib-(Hfl)-GT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) CH3OCO-H-Aib-(Hfl)-GT-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(2F-APPA) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(CH2)-(APPA) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(2F-APPA) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-(C=S)-Bip(OMe)-(C=S)-(APPA) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(2F-APPA) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(C=S)-(APPA) 20 UA 99493 C2 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 5 10 15 20 25 30 H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))((NMe)(APPA)) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-S-(NMe)D-((NMe)Bip(OMe))-((NMe)(2FAPPA)) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(APPA)) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-((NMe)(2F-APPA)) H-Aib-(Hfl)-GT-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA) H-Aib-(Hfl)-GT-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-TSD-Bip(OMe)-(APPA) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-TSD-Bip(OMe)-(2F-APPA) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(APPA) H-Aib-(Hfl)-G-T(allo)-(-Me-2F-Phe)-T(allo)-SD-Bip(OMe)-(2F-APPA) H-Aib-(Hfl)-GT-(-Me-Phe)-TSD-Bip(OMe)-(APPA) H-Aib-(Hfl)-GT-(-Me-Phe)-TSD-Bip(OMe)-(ADMP) H-Aib-(Hfl)-GT-(-Me-Phe)-TSD-Bip(OMe)-(ACPP) H-Aib-(Hfl)-GT-(-Me-Phe)-TSD-Bip(OMe)-(AMCB) H-Aib-(Hfl)-GT-(-Me-2F-Phe)-TSD-Bip(ОMe)-(APPA) H-Aib-(Hfl)-GT-(-Me-2F-Phe)-TSD-Bip(OMe)-(ADMP) H-Aib-(Hfl)-GT-(-Me-2F-Phe)-TSD-Bip(ОMe)-(ACPP) H-Aib-(Hfl)-GT-(-Me-2F-Phe)-TSD-Bip(OMe)-(AMCB) In vitro та in vivo дослідження нових пептидоміметиків: Проводили тестування пептидоміметиків, одержаних, як описано вище, на a) In vitro глюкоза-залежну секрецію інсуліну (протокол аналітичного скринінгу клітин RIN5F); b) In vitro агоністичну активність до GLP-1R людини (визначення циклічного AMP); c) In vitro антагоністичну активність до глюкагону людини (визначення циклічного AMP); d) Стабільність пептидоміметиків під дією ферменту DPP IV, плазми людини, штучної шлункової рідини, кишкової рідини та мікросом печинки; і e) Демонстрацію in vivo ефективності дослідних сполук (пептидоміметиків) у мишей C57BL/6J (in vivo), з використанням різних in vitro та in vivo аналізів, як описано нижче. In vitro дослідження: In vitro глюкоза-залежна секреція інсуліну (протокол аналітичного скринінгу клітин RIN5F) Клітини RIN5F (інсуліноми пацюка) культивують у середовищі RPMI 1640 з домішками пірувату натрію (1 мМ) HEPES та глюкози (4,5 г/л) у зволожуваному інкубаторі (5 % СО2) при 6 37 °C. Після трипсинізації клітини RIN5F висівають з концентрацією 0,2 × 10 клітин на лунку в 12-лункові планшети. Клітини вирощують протягом ночі до ступеню злиття 80 % і проводять експерименти із секреції інсуліну у такий спосіб (Montrose-Rafizadeh C., et al., Моl. Cell. Endo. 1997, 130, 109.; Wang, X., et al., Endocrinology 2001, 5, 1820). Клітини промивають один раз розчином PBS, після чого 40 хв. інкубують у свіжому збалансованому буфері Krebs-Ringer, що містить NaCI (115 ммоль/л), KСІ (4,7 ммоль/л), СаСІ2 (1,28 ммоль/л), MgSO47H2O (1,2 ммоль/л), KН2РО4 (1,2 ммоль/л), NaHCO3 (10 ммоль/л) та HEPES (25 ммоль/л), який містить глюкозу (1,1 мМ) та B.S.A (0,5 %), рН 7,4. Буфер заміняють через 40 хв. і клітини інкубують (37 °C) з досліджуваними пептидоміметиками, в різних концентраціях, протягом 30 хв., як у присутності (16,7 мМ), так і без (0 мМ) глюкозного навантаження. Супернатант збирають і кількість інсуліну вимірюють за допомогою ультрачутливого набору для визначення інсуліну пацюка Rat insulin ELISA kit (Crystal Chem, IL). Білок у супернатанті оцінюють за допомогою набору для визначення біцинхонінової кислоти (Bicinchoninic acid kit), відповідно до протоколу виробника (Sigma Aldrich, MO). Загальний вміст інсуліну, виміряний у пікограмах (пг), ділять на загальний білок (мкг) для нормалізації розбіжностей у щільності клітин між лунками. In vitro активність типових пептидоміметиків із глюкоза-залежної секреції інсуліну наведена у Таблиці 3. 21 UA 99493 C2 Таблиця 3 In vitro активність типових пептидоміметиків із глюкоза-залежної секреції інсуліну Seq. ID. No. Контроль 1 (0 мМ глюкози) Контроль 2 (16,7 мМ глюкози) Ексендин-4 25 26 27 29 30 31 32 39 40 45 46 47 48 49 50 77 78 79 80 81 82 83 84 85 86 101 103 109 110 111 112 113 114 116 120 130 132 142 154 166 175 192 200 202 206 210 218 225 Конц. досліджуваної сполуки (нМ) 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 0,1/1/10 22 Секреція інсуліну (пг/мкг/год.)* 5,9±0,61 10,2±0,51 16,2±0,10/22,1±0,12/36,2±0,12 15,6±0,30/21,8±0,11/35,6±0,20 16,6±0,41/22,9±0,32/36,6±0,19 16,4±0,12/22,7±0,17/36,6±0,05 16,3±0,15/22,4±0,21/36,2±0,11 17,1±0,11/23,1±0,16/37,0±0,29 16,8±0,20/22,7±0,29/36,6±0,31 12,1±0,52/14,1±0,16/28,0±0,36 11,1±0,12/13,1±0,13/19,0±0,16 12,6±0,20/15,9±0,31/28,4±0,11 11,8±0,50/14,9±0,11/27,9±0,31 12,7±0,21/15,8±0,33/29,3±0,19 13,1±0,11/14,9±0,17/28,8±0,44 12,9±0,14/15,8±0,13/29,9±0,15 16,1±0,22/22,1±0,26/36,0±0,36 15,4±0,14/21,2±0,18/35,6±0,17 15,6±0,33/21,8±0,16/35,6±0,26 16,6±0,41/22,9±0,32/36,7±0,11 16,5±0,12/22,7±0,17/36,5±0,05 16,2±0,13/22,4±0,19/36,2±0,09 17,1±0,15/23,1±0,12/37,0±0,19 16,9±0,22/22,8±0,31/36,7±0,34 12,3±0,33/14,1±0,36/28,0±0,16 12,1±0,42/14,6±0,41/27,8±0,46 11,9±0,17/14,2±0,13/27,6±0,16 12,3±0,33/14,8±0,16/28,1±0,22 12,4±0,22/15,2±0,32/29,6±0,50 12,1±0,51/14,1±0,19/28,1±0,29 12,6±0,25/15,3±0,31/29,7±0,48 12,0±0,14/14,3±0,12/27,8±0,32 16,2±0,20/22,2±0,20/36,1±0,31 15,3±0,19/21,2±0,11/35,5±0,19 15,6±0,31/21,8±0,16/35,6±0,28 16,6±0,41/22,9±0,32/36,6±0,19 16,4±0,12/22,7±0,17/36,6±0,05 16,3±0,15/22,4±0,21/36,2±0,11 17,1±0,11/23,1±0,16/37,0±0,29 13,1±0,11/14,9±0,17/28,8±0,44 12,9±0,14/15,8±0,13/29,9±0,15 16,1±0,22/22,1±0,26/36,0±0,36 15,4±0,14/21,2±0,18/35,6±0,17 15,6±0,33/21,8±0,16/35,6±0,26 16,6±0,41/22,9±0,32/36,7±0,11 16,5±0,12/22,7±0,17/36,5±0,05 16,8±0,20/22,7±0,29/36,6±0,31 12,1±0,42/14,6±0,41/27,8±0,46 11,9±0,17/14,2±0,13/27,6±0,16 12,3±0,33/14,8±0,16/28,1±0,22 12,4±0,22/15,2±0,32/29,6±0,50 UA 99493 C2 230 235 237 0,1/1/10 0,1/1/10 0,1/1/10 12,1±0,51/14,1±0,19/28,1±0,29 12,6±0,25/15,3±0,31/29,7±0,48 12,0±0,14/14,3±0,12/27,8±0,32 *ln vitro глюкоза-залежну (глюкозне навантаження 16,7 нМ) секрецію інсуліну при різних концентраціях пептидоміметиків вимірюють з використанням клітин інсуліноми пацюка (RIN5F). Загальний вміст інсуліну (пг) ділять на загальний білок (мкг) для нормалізації розбіжностей у щільності клітин між лунками. n=3, значення позначають середнє ± S.D. (стандартний відхил). Базальна секреція інсуліну для усіх сполук спостерігалася при концентрації глюкози 0 нМ. 5 10 15 20 25 30 35 40 In vitro агоністична активність GLP-1R людини (визначення циклічного AMP). Нові пептидоміметики піддавали скринінгу на активність агоніста до GLP-1 рецептора людини (HGLP-1R) (in vitro) з використанням клітинного аналізу сАМР, у стабільно трансфекованих клітинах CHO/GLP1R людини. Клітини СНО-K1 (CRL 9618) були одержані від American Type Culture Collection (Rockville, MD). Клітини CHO вирощували у середовищі Ham F12, що містить L-глутамін (2 мМ), HEPES (25 мМ), МаНСО3 (1,1 г/л), та з домішками сироватки новонароджених телят (NBCS; 10 %), пеніциліну (50 од./мл (об./об.)) та стрептоміцину (50 мкг/мл (об./об.)). Клітини розбавляють через кожні 3 дні у співвідношенні 1:8. Продукування стабільних клітинних ліній СНО, що експресують рецептор GLP-1 людини. кДНК, що кодує рецептор GLP-1 людини, була ізольована методом RT-PCR відповідно до стандартного протоколу. Повну кДНК клонували в pcDNA3.1(+). Для продукування клітинних ліній СНО, що експресують рецептор GLP-1, клітини СНО трансфекували 10 мкг експресійної плазміди pcDNA/hGLP-1R з використанням СаРО4 відповідно до стандартного протоколу (Wheeler, M.B., et al., Endocrinology 1993, 133, 57). Клони, що експресують рецептор, були генеровані шляхом селекції G418 (800 мкг/мл активної речовини, Sigma). Стабільні клони потім утримували при 500 мкг/мл (G418). Селектований клон використовувався між пасажами 9-25 для проведення аналізів сАМР. Визначення генерування сАМР. Клітини СНО, стабільно трансфековані GLP-1R людини, утримували у Ham's F12+10 % NBCS+500 мкг/мл G418 до ступеня злиття 70-75 %. Клітини трипсинізували за допомогою 2 мл TPVG (0,25 % трипсину, 0,53 мМ EDTA, 1,38 мМ глюкози). Трипсин інактивують за допомогою середовища Ham's F12, що містить 10 % NBCS, і клітини 5 суспендують у 2 мл повного середовища. Потім висівають 2×10 клітин/лунку на 12-лункові планшети і планшети інкубують у зволоженій атмосфері при 37 °C протягом 16-18 год. (Fehmann, Н.С., et al., Peptides 1994, 15, 453). Наступного дня проводять аналіз, коли ступінь злиття клітин досягне 90-95 %. Середовище відсмоктують з 12-лункового планшета і клітини промивають один раз з використанням Ham's F12 (без домішок). Клітини інкубують при 37 °C з 500 мкл Ham's F12+1 % BSA+0,125 мМ RO-20 протягом 30 хв. Після інкубування, середовище відсмоктують і додають свіже середовище (просте Ham's F12+1 % BSA+0,25 мМ RO-20) з 5 мкл досліджуваних сполук (пептидоміметиків), розчинених у воді (MilliQ). Клітини інкубують з досліджуваними сполуками протягом 30 хв. у зволоженій атмосфері при 37 °C. Після інкубування, середовище видаляють і клітини промивають один раз простим Ham's F12. Після цього, клітини лізують шляхом додавання до кожної лунки 500 мкл охолодженої на льоді 0,1 N НСІ і струшують протягом 30 хвилин при 200 об./хв. Клітини потім зіскрібають, лізат збирають в мікроцентрифужні пробірки та центрифугують при 12000 об./хв. протягом 10 хв. для видалення уламків. Потім відбирають 300 мкл супернатанта з кожної мікроцентрифужної пробірки в скляну пробірку та висушують під N2 протягом 30 хв. для визначення сАМР. Загальний сАМР визначають у зразку відповідно до протоколу виробника з використанням набору для імунологічного аналізу циклічного AMP (R&D Systems, Minneapolis. MN). Решта супернатанта використовується для визначення концентрації білка з використанням мікро-ВСА (Sigma). Дані обчислюють як процент від контролю (носій: вода) та виражають як середнє ± SD (стандартний відхил). Агоністичні активності типових пептидоміметиків по відношенню до рецепторів GLP-1 людини in vitro наведені у Таблиці 4. 45 23 UA 99493 C2 Таблиця 4: Активність in vitro GLP-1 R людини (вивільнення сАМР) досліджуваних сполук (пептидоміметиків), в % активності по відношенню до контролю Seq. ID. No. Ексендин-4 11 16 19 22 29 30 32 39 40 42 45 47 50 62 68 72 77 79 80 81 82 84 101 110 112 114 116 120 130 140 144 154 156 166 168 178 180 185 190 194 196 198 200 202 203 204 205 206 207 1 нМ 88±0,11 99±0,03 99±0,11 99±0,12 99±0,02 96±0,09 38±0,12 39±0,11 40±0,09 38±0,11 39±0,10 51±0,03 55±0,16 60±0,12 38±0,12 39±0,11 45±0,022 40±0,09 62±0,11 66±0,022 69±0,09 78±0,12 38±0,11 41±0,09 38±0,11 39±0,10 82±0,22 55±0,16 99±0,12 39±0,10 51±0,03 55±0,16 60±0,12 86±0,11 96±0,02 96±0,09 39±0,12 40±0,11 46±0,022 41±0,09 38±0,11 39±0,10 82±0,22 55±0,16 99±0,12 86±0,11 96±0,02 96±0,09 39±0,12 40±0,11 Концентрація досліджуваних сполук 10 нМ 100 нМ 1 мкМ 95±0,10 99±0,04 99±0,08 99±0,01 99±0,06 99±0,09 99±0,13 99±0,16 99±0,06 99±0,08 99±0,11 99±0,12 99±0,26 99±0,31 99±0,60 99±0,07 99±0,04 99±0,01 78±0,15 86±0,18 95±0,03 80±0,09 88±0,06 96±0,14 81±0,07 87±0,04 95±0,01 77±0,16 85±0,11 94±0,08 81±0,08 89±0,09 96±0,11 86±0,40 91±0,21 99±0,32 89±0,05 93±0,09 99±0,02 92±0,15 98±0,18 99±0,03 78±0,15 86±0,18 95±0,03 80±0,09 88±0,06 96±0,14 84±0,46 90±0,41 99±0,66 81±0,07 87±0,04 95±0,01 94±0,09 99±0,06 99±0,14 97±0,46 99±0,41 99±0,66 98±0,07 99±0,04 99±0,01 99±0,15 99±0,18 99±0,03 77±0,16 85±0,11 94±0,08 82±0,07 87±0,04 95±0,01 77±0,16 85±0,11 94±0,08 81±0,08 89±0,09 96±0,11 87±0,12 92±0,14 99±0,22 88±0,13 92±0,11 99±0,07 99±0,15 99±0,18 99±0,03 81±0,08 89±0,09 96±0,11 86±0,40 91±0,21 99±0,32 89±0,05 93±0,09 99±0,02 92±0,15 98±0,18 99±0,03 99±0,09 99±0,06 99±0,14 99±0,46 99±0,41 99±0,66 99±0,07 99±0,04 99±0,01 80±0,15 86±0,18 95±0,03 81±0,09 89±0,06 96±0,14 85±0,46 90±0,41 99±0,66 82±0,07 87±0,04 95±0,01 77±0,16 85±0,11 94±0,08 81±0,08 89±0,09 96±0,11 87±0,12 92±0,14 99±0,22 88±0,13 92±0,11 99±0,07 99±0,15 99±0,18 99±0,03 99±0,09 99±0,06 99±0,14 99±0,46 99±0,41 99±0,66 99±0,07 99±0,04 99±0,01 80±0,15 86±0,18 95±0,03 81±0,09 89±0,06 96±0,14 24 10 мкМ 99±0,07 99±0,11 99±0,10 99±0,16 99±0,08 99±0,08 98±0,09 99±0,19 98±0,08 97±0,05 99±0,16 99±0,21 99+0,04 99±0,09 98±0,09 99±0,19 99±0,03 98±0,08 99±0,19 99±0,03 99±0,08 99±0,09 97±0,05 98±0,08 97±0,05 99±0,16 99±0,26 99±0,09 99±0,09 99±0,16 99±0,21 99±0,04 99±0,09 99±0,19 99±0,03 99±0,08 98±0,09 99±0,19 99±0,03 98±0,08 97±0,05 99±0,16 99±0,26 99±0,09 99±0,09 99±0,19 99±0,03 99±0,08 98±0,09 99±0,19 UA 99493 C2 210 216 220 224 228 230 235 237 5 10 15 20 25 30 35 40 45 50 46±0,022 93±0,11 93±0,10 99±0,06 99±0,11 99±0,12 99±0,02 96±0,09 85±0,46 99±0,09 99±0,46 99±0,06 99±0,13 99±0,08 99±0,26 99±0,07 90±0,41 99±0,06 99±0,41 99±0,08 99±0,16 99±0,11 99±0,31 99±0,04 99±0,66 99±0,14 99±0,66 99±0,10 99±0,06 99±0,12 99±0,60 99±0,01 99±0,03 99±0,19 99±0,03 99±0,12 99±0,10 99±0,16 99±0,08 99±0,08 На основі in vitro активності агоніста GLP-1 рецептора людини були визначені значення ЕС50 для нових пептидоміметиків, і порівняльні криві доза-відповідь (DRC) для ексендину (ЕС50 = 0,56 нМ) та Seq. ID. No. 38: H-Aib-QGT-(-Me-2F-Phe)-TSD-Bip(OMe)-(ADMP) (EC50 = 0,34 нМ) наведені на Фігурі 3 як типовий приклад. Антагоністична активність in vitro глюкагону людини (вимірювання інгібування величини продукування циклічного AMP досліджуваними пептидоміметиками). Нові пептидоміметики піддають скринінгу на активність антагоніста глюкагонового рецептора людини (Н-глюкагон-R) (in vitro) з використанням клітинного аналізу сАМР у клітинах СНО, стабільно трансфекованих глюкагоновим рецептором людини. Клітини СНО-K1 (CRL 9618) були одержані від American Type Culture Collection (Rockville, MD). Клітини СНО вирощують у середовищі Ham's F12, що містить L-глутамін (2 мМ), HEPES (25 мМ), NaHCO3 (1,1 г/л) з домішками сироватки новонароджених телят (NBCS; 10 %), пеніциліну (50 од./мл (об./об.)) та стрептоміцину (50 мкг/мл (об./об.)). Клітини ділять через кожні 3 дні у співвідношенні 1:8. Продукування стабільних клітинних ліній СНО, що експресують глюкагоновий рецептор людини. Ізолюють кДНК, що кодує глюкагоновий рецептор людини, методом RT-PCR відповідно до стандартного протоколу. Повну кДНК клонують в pcDNA3.1 (Invitrogen). Для продукування клітинних ліній СНО, що експресують глюкагоновий рецептор, клітини СНО трансфекують 10 мкг експресійної плазміди pcDNA/H-глюкагон-R з використанням СаРО4 відповідно до стандартного протоколу. Клони, що експресують рецептор, були генеровані селекцією G418 (800 мкг/мл активної речовини, Sigma). Стабільні клони після цього утримують при 500 мкг/мл (G418). Селектований клон використовували між пасажами 9-25 для аналізів сАМР. Визначення глюкагонової антагоністичної активності шляхом вимірювання величини продукування сАМР, інгібованої після додавання досліджуваних пептидоміметиків разом з глюкагон-пептидом. Клітини СНО, стабільно трансфековані глюкагоновим рецептором людини, утримують в Ham's F12+10 % NBCS+500 мкг/мл G418 до ступеня злиття 70-75 %. Клітини трипсинізують за допомогою 2 мл TPVG (0,25 % трипсину, 0,53 мМ EDTA, 1,38 мМ глюкози). Трипсин інактивують за допомогою середовища Ham's F12, що містить 10 % NBCS, і клітини суспендують в 2 мл 5 повного середовища. Потім висівають 2×10 клітин/лунку в 12-лункові планшети і планшети інкубують у зволоженій атмосфері при 37 °C протягом 16-18 год. Наступного дня аналіз проводять, коли ступінь злиття клітин становить 90-95 %. Середовище відсмоктують з 12лункового планшета і клітини промивають один раз Ham's F12 (простий). Клітини інкубують при 37 °C з 500 мкл Ham's F12+1 % BSA+0,125 мМ RO-20 протягом 30 хв. Після інкубування, середовище відсмоктують і додають свіже середовище (просте Ham's F12+1 % BSA+0,25 мМ RO-20) з 5 мкл досліджуваних сполук (пептидоміметиків), розчинених у воді (MilliQ), після чого додають глюкагон-пептид (як агоніст). Клітини інкубують з пептидоміметиками та глюкагонпептидом протягом 30 хв. у зволоженій атмосфері при 37 °C. Після інкубування, середовище видаляють і клітини промивають один раз простим Ham's F12. Після цього, клітини лізують шляхом додавання 500 мкл охолодженої на льоді 0,1N HCI до кожної лунки і струшують протягом 30 хвилини при 200 об./хв. Клітини потім зіскрібають, лізат збирають в мікроцентрифужні пробірки та центрифугують при 12000 об./хв. протягом 10 хв. для видалення уламків. З кожної мікроцентрифужної пробірки потім відбирають 300 мкл супернатанта в скляну пробірку та висушують під N2 протягом 30 хв., для вимірювання сАМР. Оцінюють загальний сАМР у зразку відповідно до протоколу виробника з використанням імунологічного аналізу на циклічний AMP (R&D Systems, Minneapolis. MN). Решта супернатанта використовується для визначення концентрації білка з використанням мікро-ВСА (Sigma). Дані обчислюють як процент від контролю (носій: вода) та виражають як середнє + SD (стандартний відхил). Антагоністична активність in vitro глюкагонового рецептора людини типових пептидоміметиків наведена у Таблиці 5. 25 UA 99493 C2 Таблиця 5: In vitro антагоністична активність досліджуваних сполук (пептидоміметиків) по відношенню до глюкагонового рецептора людини, виміряна як інгібування продукування сАМР (пмоль/мл/мкг prt) глюкагон-пептидом, досліджуваними сполуками, інкубованими в різних концентраціях, разом з насиченою концентрацією глюкагон-пептиду. Seq. ID. No. Глюкагон 5 9 11 19 22 26 28 29 30 31 40 45 49 51 65 72 77 78 79 84 110 112 114 116 120 130 132 142 144 150 154 156 166 168 170 172 177 178 188 189 191 192 194 195 197 199 200 202 1 нМ 23±0,01 6±0,02 5±0,02 3±0,04 0 17±0,12 15±0,11 14±0,02 20±0,06 22±0,03 6±0,02 18±0,07 15±0,11 10±0,03 5±0,09 10±0,12 9±0,11 20±0,06 22±0,03 6±0,02 4±0,01 18±0,07 6±0,01 4±0,02 2±0,03 0 5±0,04 15±0,11 10±0,03 5±0,09 10±0,12 9±0,11 5±0,01 19±0,03 21±0,11 6±0,05 4±0,16 0 0 5±0,04 3±0,12 4±0,05 4±0,09 18±0,12 15±0,11 14±0,02 4±0,06 10±0,16 9±0,14 Концентрація досліджуваних сполук 10 нМ 100 нМ 1 мкМ 36±0,09 36,1±0,08 37,2±0,11 5±0,04 3±0,14 0 3±0,15 0 0 0 0 0 0 0 0 15±0,13 12±0,13 8±0,16 12±0,13 8±0,09 4±0,01 11±0,03 7±0,22 3±0,12 18±0,09 16±0,01 14±0,03 21±0,05 20±0,07 18±0,04 5±0,03 2±0,61 0 16±0,01 12±0,03 8±0,02 12±0,13 8±0,09 4±0,01 8±0,03 6±0,22 2±0,13 3±0,11 0 0 8±0,02 6±0,04 4±0,05 6±0,12 5±0,14 3±0,22 18±0,09 16±0,01 14±0,03 21±0,05 20±0,07 18±0,04 5±0,03 2±0,61 0 2±0,17 0 0 16±0,01 12±0,03 8±0,02 5±0,02 2±0,13 0 2±0,15 0 0 0 0 0 0 0 0 3±0,02 1±0,11 0 12±0,13 8±0,09 4±0,01 8±0,03 6±0,22 2±0,13 3±0,11 0 0 8±0,02 6±0,04 4±0,05 6±0,12 5±0,14 3±0,22 2±0,17 0 0 17±0,08 15±0,01 14±0,02 19±0,02 18±0,07 18±0,03 5±0,04 2±0,16 0 2±0,11 0 0 0 0 0 0 0 0 3±0,15 1±0,15 0 1±0,12 0 0 2±0,13 2±0,12 0 2±0,12 0 0 16±0,11 12±0,13 8±0,12 12±0,13 8±0,09 4±0,01 11±0,03 7±0,22 3±0,12 3±0,11 0 0 8±0,12 6±0,14 4±0,15 6±0,14 5±0,13 3±0,24 26 10 мкМ 36,9±0,02 0 0 0 0 6±0,12 2±0,08 0 12±0,01 18±0,03 0 6±0,08 2±0,08 0 0 1±0,02 0 12±0,01 18±0,03 0 0 6±0,08 0 0 0 0 0 2±0,08 0 0 1±0,02 0 0 12±0,11 16±0,02 0 0 0 0 0 0 0 0 6±0,18 2±0,08 0 0 1±0,12 0 UA 99493 C2 204 205 206 207 208 212 218 225 228 237 5 10 15 20 6±0,05 4±0,16 0 0 5±0,04 10±0,12 9±0,11 5±0,01 19±0,03 21±0,11 5±0,04 2±0,11 0 0 3±0,15 8±0,02 6±0,12 2±0,17 17±0,08 19±0,02 2±0,16 0 0 0 1±0,15 6±0,04 5±0,14 0 15±0,01 18±0,07 0 0 0 0 0 4±0,05 3±0,22 0 14±0,02 18±0,03 0 0 0 0 0 1±0,02 0 0 12±0,11 16±0,02 Стабільність пептидоміметиків до дії ферменту DPP IV, плазми людини, штучної шлункової рідини, кишкової рідини та мікросом печинки. Різні пептидоміметики (кінцева концентрація 2 мкМ) інкубують або з DPP IV (1:25 міліодиниць (mU)) або зі змішаною плазмою людини (7,5 мкл) або штучною шлунковою рідиною (рН 1,5; склад НСІ, NaCI та пепсин) або штучною кишковою рідиною (рН 7,5) або мікросомами печинки людини, протягом 0, 2, 4, 6, 12 та 24 год. (37 °C; буфер 50 мМ триетаноламін-НСІ; рН 7,8). Концентрації ферменту DPP IV / плазми людини / штучної шлункової рідини / штучної кишкової рідини / мікросом печинки людини вибирають шляхом попередніх експериментів для забезпечення деградації приблизно 50 % ексендину протягом 2-4 год., що дозволяє спостерігати час-залежну деградацію протягом 24 год. Реакції зупиняють шляхом додавання TFA/H2O (15 мл, 10 % (об./об.)). Продукти реакції потім вводять в аналітичну колонку Vydac C 18 (4,6×250 мм) і великий фрагмент деградації відокремлюють від інтактного пептидоміметика. Колонку врівноважують за допомогою TFA/H2O при об'ємній витраті 1 мл/хв. Використовуючи 0,1 % (об./об.) TFA в 70 % ацетонітрилі/Н2О, концентрацію ацетонітрилу в елююючому розчиннику збільшують з 0 % до 28 % протягом 10 хв. і з 28 % до 42 % протягом 30 хв. Контролюють оптичне поглинання при 206 нм за допомогою УФ-детектора і піки збирають вручну перед проведенням аналізу методом ESI-MS. Вимірюють площу під кривою для досліджуваних пептидоміметиків та їх метаболітів і процент деградації обчислюють для кожного моменту часу протягом періоду 24 год. Результати досліджень стабільності вибраних пептидоміметиків до дії ферменту DPP IV, плазми людини, штучної шлункової рідини, кишкової рідини та мікросом печинки (in vitro) наведені у Таблиці 6. Таблиця 6: Результати досліджень стабільності вибраних пептидоміметиків до дії ферменту DPP IV, плазми людини, штучної шлункової рідини, кишкової рідини та мікросом печинки (in vitro) Seq. ID. No. Пр. 4 7 8 12 14 16 19 27 29 30 31 32 45 47 49 50 65 68 70 Фермент а DPP IV 88 (6,1) 71 (8) 00 (>24) 76 (9) 74 (9) 70 (9) 86 (9) 00 (>24) 00 (>24) 00 (>24) 76 (10) 75 (10) 77 (10) 76 (9) 75 (9) 77 (9) 76 (9) 74 (9) 70 (9) Плазма b людини 87 (6,1) 69 (8) 00 (>24) 78 (8) 75 (8) 71 (8) 70 (8) 00 (>24) 00 (>24) 00 (>24) 78 (9) 77 (9) 80 (9) 78 (8) 77 (8) 80 (8) 78 (8) 75 (8) 71 (8) Штучна шлункова c рідина 100 (0,4) 11 (7) 00 (>24) 14 (8) 12 (8) 14 (8) 15 (8) 00 (>24) 00 (>24) 00 (>24) 100 (0,5) 100 (0,5) 100 (0,5) 12 (8) 14 (8) 13 (8) 14 (8) 12 (8) 14 (8) 27 Штучна кишкова d рідина 100 (0,2) 43 (6) 00 (>24) 43 (6) 46 (6) 40 (6) 41 (6) 00 (>24) 00 (>24) 00 (>24) 100 (0,5) 100 (0,5) 100 (0,5) 55 (6) 45 (6) 50 (6) 43 (6) 46 (6) 40 (6) Мікросоми e печинки 100 (0,2) 77 (2) 35 (5) 80 (1) 83 (1) 78 (1) 77 (1) 31 (5) 32 (5) 33 (5) 100 (0,5) 100 (0,5) 100 (0,5) 79 (1) 81 (1) 82 (1) 80 (1) 83 (1) 78 (1) UA 99493 C2 72 74 77 78 79 80 81 82 84 110 112 114 116 120 130 132 142 144 154 156 166 168 178 180 185 190 194 198 200 201 202 203 204 205 206 207 208 210 212 214 215 219 221 224 226 229 230 234 236 86 (9) 76 (10) 74 (10) 70 (10) 86 (10) 72 (10) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 76 (9) 75 (9) 77 (9) 76 (9) 74 (9) 70 (9) 86 (9) 72 (9) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 76 (10) 75 (10) 77 (10) 76 (10) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 74 (10) 70 (10) 86 (10) 72 (10) 00 (>24) 70 (8) 78 (9) 75 (9) 71 (9) 70 (9) 70 (9) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 78 (8) 77 (8) 80 (8) 78 (8) 75 (8) 71 (8) 70 (8) 70 (8) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 78 (9) 77 (9) 80 (9) 78 (9) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 75 (9) 71 (9) 70 (9) 70 (9) 00 (>24) 15 (8) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 50 (4) 55 (4) 45 (4) 43 (4) 49 (4) 52 (4) 43 (4) 41 (4) 12 (8) 14 (8) 13 (8) 14 (8) 12 (8) 14 (8) 15 (8) 12 (8) 00 (>24) 50 (4) 55 (4) 45 (4) 43 (4) 49 (4) 52 (4) 43 (4) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 00 (>24) 41 (6) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 55 (6) 45 (6) 50 (6) 43 (6) 46 (6) 40 (6) 41 (6) 42 (6) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 00 (>24) 00 (>24) 00 (>24) 00 (>24) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 00 (>24) 77 (1) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 86 (2) 84 (2) 85 (2) 84 (2) 82 (2) 81 (2) 84 (2) 80 (2) 79 (1) 81 (1) 82 (1) 80 (1) 83 (1) 78 (1) 77 (1) 78 (1) 35 (5) 86 (2) 84 (2) 85 (2) 84 (2) 82 (2) 81 (2) 84 (2) 33 (5) 31 (5) 32 (5) 33 (5) 32 (5) 26 (5) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 32 (5) 33 (5) 32 (5) 26 (5) 100 (0,5) 100 (0,5) 100 (0,5) 100 (0,5) 35 (5) a: % деградації пептидоміметиків за 24 год. при інкубації з ферментом DPP-IV, значення у дужках позначають період напіввиведення (t1/2), в год.; b: % деградаціі пептидоміметиків за 24 год. при інкубації з плазмою людини, значення у дужках позначають період напіввиведення (t1/2), в год.; с: % деградаціі пептидоміметиків за 24 год. при інкубації зі штучною шлунковою рідиною, значення у дужках позначають період напіввиведення (t1/2), в год.; d: % деградаціі пептидоміметиків за 24 год. при інкубації зі штучною кишковою рідиною, значення у дужках позначають період напіввиведення (t1/2), в год.; 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPeptidomimetics with glucagon antagonistic and glp-1 agonistic activities
Автори англійськоюBahekar, Rajesh, H., Jain, Mukul, R., Patel, Pankaj, Ramanbhai
Назва патенту російськоюПептидомиметики, проявляющие глюкагоновую антагонистическую и glp-1 агонистическую активность
Автори російськоюБахекар Раджеш Х., Джеин Мукул Р., Пател Панкадж Раманбхай
МПК / Мітки
МПК: C07K 14/605, A61P 3/10, A61K 38/26
Мітки: агоністичну, виявляють, антагоністичну, глюкагонову, glp-1, пептидоміметики, активність
Код посилання
<a href="https://ua.patents.su/229-99493-peptidomimetiki-shho-viyavlyayut-glyukagonovu-antagonistichnu-ta-glp-1-agonistichnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Пептидоміметики, що виявляють глюкагонову антагоністичну та glp-1 агоністичну активність</a>
Попередній патент: Похідні 1,3-дигідро-5-ізобензофуранкарбонітрилу і його фармацевтична композиція для лікування передчасної еякуляції
Наступний патент: Похідні піридазинону, гербіцидні композиції та спосіб контролювання росту небажаної рослинності
Випадковий патент: Пристрій для очищення дроту, наприклад електродного












