Трициклічна індазольна сполука, спосіб одержання та фармацевтична композиція, яка її містить
Номер патенту: 108747
Опубліковано: 10.06.2015
Автори: Магаро' Габріель, Мангано Джорджина, Алісі Марія Алессандра, Гарроне Беатріче, Каццолла Нікола, Фурлотті Гвідо
Формула / Реферат
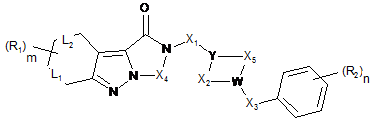
1. Трициклічна індазольна сполука загальної формули (І):
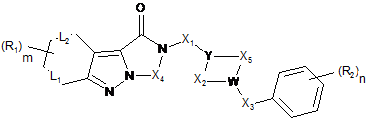 (I)
(I)
у якій
Υ являє собою СН або Ν;
W являє собою СН або Ν;
за умови, що принаймні один з Υ та W являє собою атом азоту;
Х1 та Х3 можуть незалежно являти собою σ-зв'язок, двовалентний алкільний ланцюг, що містить від 1 до 5 атомів вуглецю, карбонільну групу, двовалентний алканоїльний ланцюг типу -СO-(СН2)1-4- або -(СН2)1-4-СО-, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості атомів галогену, однієї або більшої кількості С1-3алкільних груп, однієї або більшої кількості С1-3алкоксигруп;
Х4 може являти собою двовалентний алкільний ланцюг, що містить від 1 до 5 атомів вуглецю, карбонільну групу, двовалентний алканоїльний ланцюг типу -СО-(СН2)1-4- або -(СН2)1-4-СО-, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості атомів галогену, однієї або більшої кількості С1-3алкільних груп, однієї або більшої кількості С1-3алкоксигруп;
Х2 та Х5 можуть незалежно являти собою σ-зв'язок або двовалентний алкільний ланцюг, що містить від 1 до 4 атомів вуглецю, де атоми водню зазначеного алкільного ланцюга можуть бути необов'язково заміщені за допомогою одного або більшої кількості атомів галогену, однієї або більшої кількості С1-3алкільних груп, однієї або більшої кількості С1-3алкоксигруп, та щонайменше один з Х2 та Х5 відрізняється від σ-зв'язку;
L1 та L2 можуть незалежно являти собою s-зв'язок або π-зв'язок;
R1 може незалежно являти собою Н, ОН, галоген, CN, С1-3алкіл, С1-3алкокси, NRiRii, NO2, CF3, CONRiiiRiv, SO2Rv, OCF3, N(Rvi)SO2Rvii, C(NRviii)N(RixRx), N(Rxi)C(O)Rxii;
R2 може незалежно являти собою Н, ОН, галоген, CN, С1-3алкіл, С1-3алкокси, С1-3гідроксіалкіл, С1-3аміноалкіл, NRiRii, NO2, CF3, CONRiiiRiv, SO2Rv, OCF3, N(Rvi)SO2Rvii, C(NRviii)N(RixRx), N(Rxi)C(O)Rxii;
m та n можуть незалежно являти собою від 1 до 3;
Ri, Rii, Riii, Riv, Rv, Rvi, Rvii, Rviii, Rix, Rx, Rxi, Rxii можуть незалежно являти собою Н або С1-3алкіл;
та її солі приєднання з фармацевтично прийнятними органічними та неорганічними кислотами.
2. Сполука за п. 1, де Х1 може являти собою карбонільну групу, двовалентний алкільний ланцюг, що містить від 1 до 3 атомів вуглецю, двовалентний алканоїльний ланцюг типу -СО-(СН2)1-3- або -(СН2)1-3-CO-, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості атомів галогену, однієї або більшої кількості С1-3алкільних груп.
3. Сполука за п. 1 або 2, де Х3 може являти собою σ-зв'язок, двовалентний алкільний ланцюг, що містить від 1 до 3 атомів вуглецю, двовалентний алканоїльний ланцюг типу -СО-(СН2)1-2-, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості атомів галогену, однієї або більшої кількості С1-3алкільних груп.
4. Сполука за будь-яким з попередніх пунктів, де Х4 може являти собою двовалентний алкільний ланцюг, що містить від 1 до 3 атомів вуглецю, двовалентний алканоїльний ланцюг типу -СО-(СН2)1-2- або -(СН2)1-2-СО-, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості атомів галогену, однієї або більшої кількості С1-3алкільних груп.
5. Сполука за будь-яким з попередніх пунктів, де Х2 та Х5 може являти собою двовалентний алкільний ланцюг, що містить від 1 до 3 атомів вуглецю, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості атомів галогену, однієї або більшої кількості С1-3алкільних груп.
6. Сполука за будь-яким з попередніх пунктів, де L1 та L2 обидва можуть являти собою σ-зв'язок або обидва можуть являти собою π-зв'язок.
7. Сполука за будь-яким з попередніх пунктів, де R1 може незалежно являти собою Η, ОН, F, Сl, CN, С1-3алкільну групу, С1-3алкоксигрупу, NRiRii групу, NO2, CF3, CONRiiiRiv групу, SO2Rv та OCF3.
8. Сполука за будь-яким з попередніх пунктів, де R2 може незалежно являти собою Н, ОН, F, Сl, CN, С1-3алкіл, С1-3алкокси, С1-3гідроксіалкіл, С1-3аміноалкіл, NRiRii, NO2, CF3, CONRiiiRiv, SO2Rv, OCF3.
9. Сполука за будь-яким з попередніх пунктів, де фармацевтично прийнятну органічну або неорганічну кислоту вибирають з групи, що включає щавлеву, малеїнову, метансульфонову, паратолуолсульфонову, бурштинову, лимонну, винну, молочну, соляну, фосфорну та сірчану кислоту.
10. Спосіб одержання трициклічної індазольної сполуки формули (І), як визначено у будь-якому з попередніх пунктів 1-9, у якому виконують
(1b) конденсацію амідної похідної формули (IV):
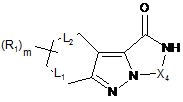 , (IV)
, (IV)
у якій
R1, L1, L2, X4 та m приймають значення, визначені у будь-якому з попередніх пунктів 1-8,
з похідною формули (V)
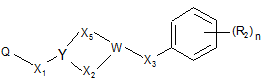 , (V)
, (V)
у якій
R2, Χ1, Х2, Х3, Х5, W, Υ та n приймають значення, визначені у будь-якому з попередніх пунктів 1-8, та
Q являє собою відхідну групу, вибрану з групи, яка включає атом галогену, мезилатну групу (CH3SO3-) та тозилатну групу (p-MePhSO3-),
з одержанням трициклічної індазольної сполуки загальної формули (І).
11. Спосіб одержання трициклічної індазольної сполуки формули (І), як визначено у будь-якому з попередніх пунктів 1-9, у якому виконують
(1а) конденсацію аміну формули (II)
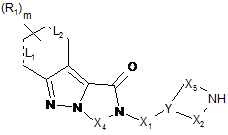 , (II)
, (II)
у якій
Х1, Х2, Х4, Х5, Y, L1, L2, R1 та m приймають значення, визначені у будь-якому з попередніх пунктів 1-8,
з похідною формули (III)
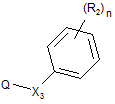 , (III)
, (III)
у якій
Х3, R2 та n приймають значення, визначені у будь-якому з попередніх пунктів 1-8, та
Q являє собою відхідну групу, вибрану з групи, яка включає атом галогену, мезилатну групу (CH3SO3-) та тозилатну групу (p-MePhSO3-),
з одержанням трициклічної індазольної похідної загальної формули (І).
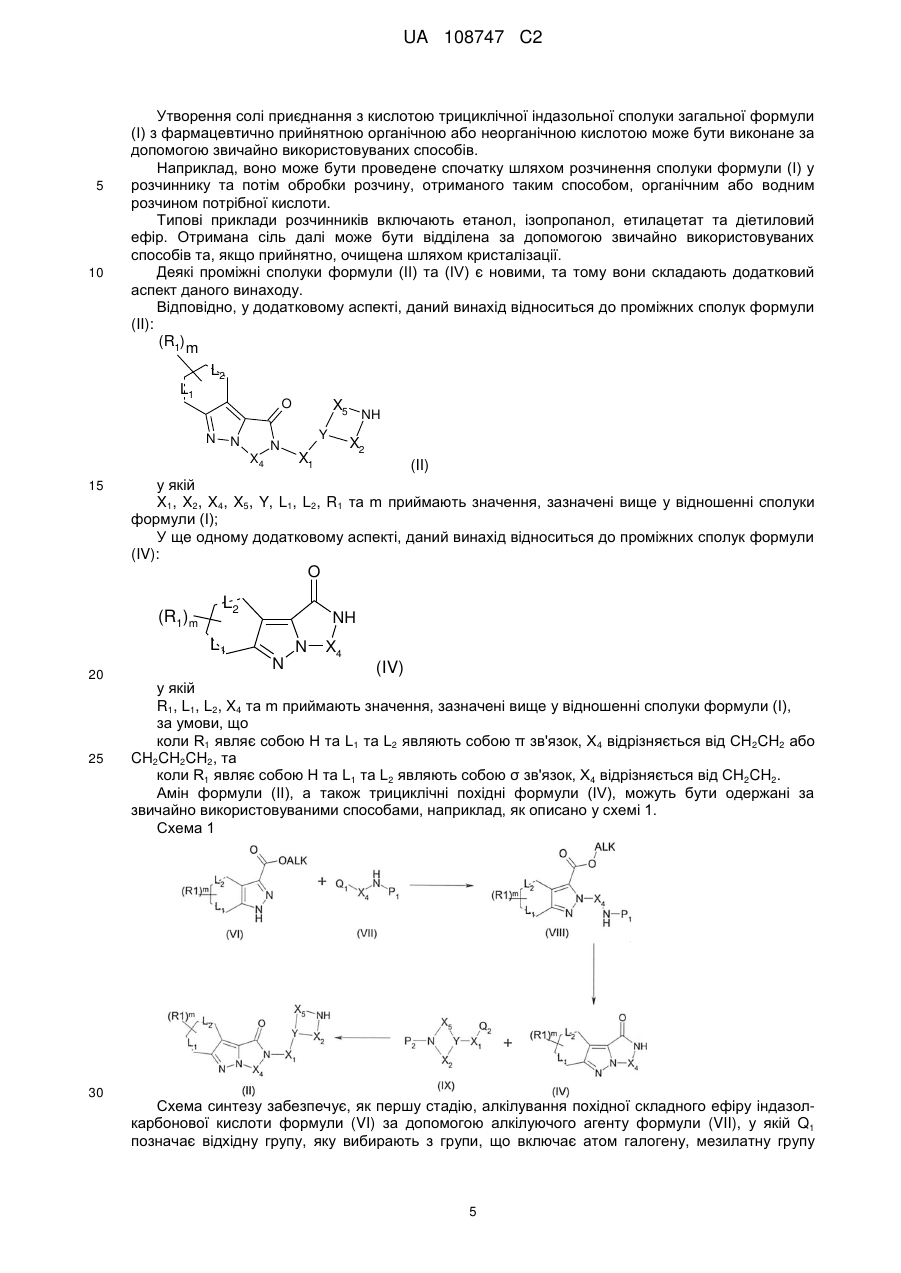
12. Проміжна сполука формули (II):
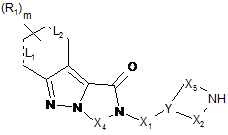 , (II)
, (II)
у якій
Χ1, Χ2, Χ4, X5, Υ, L1, L2, R1 та m приймають значення, визначені у будь-якому з попередніх пунктів 1-8.
13. Проміжна сполука формули (IV):
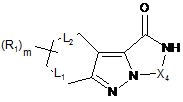 , (IV)
, (IV)
у якій
R1, X4 та m приймають значення, визначені у будь-якому з попередніх пунктів 1-8,
L1 та L2 являють собою σ-зв'язок, за умови, що, коли R1 являє собою Н, Х4 відрізняється від СН2СН2.
14. Фармацевтична композиція, яка містить ефективну кількість щонайменше однієї трициклічної індазольної сполуки формули (І)
 , (I)
, (I)
у якій Y, W, Х1, Х2, Х3, X4, X5, L1, L2, R1, R2, m та n приймають значення, визначені у будь-якому з попередніх пунктів 1-8, або її солі з фармацевтично прийнятною органічною або неорганічною кислотою та щонайменше один фармацевтично прийнятний наповнювач.
15. Застосування трициклічної індазольної сполуки загальної формули (І):
 , (I)
, (I)
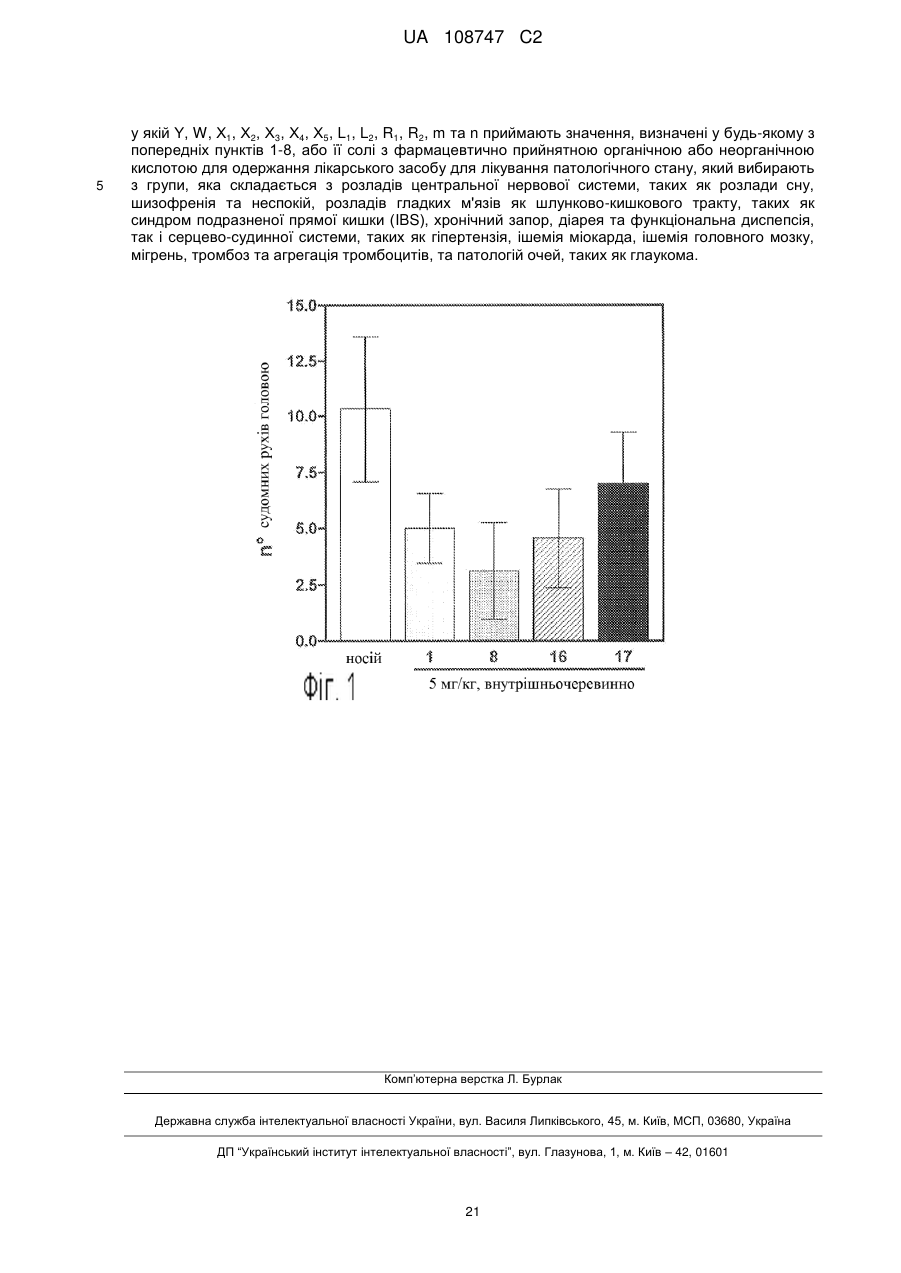
у якій Υ, W, Χ1, Х2, Х3, Х4, Х5, L1, L2, R1, R2, m та n приймають значення, визначені у будь-якому з попередніх пунктів 1-8, або її солі з фармацевтично прийнятною органічною або неорганічною кислотою для одержання лікарського засобу для лікування патологічного стану, який вибирають з групи, яка складається з розладів центральної нервової системи, таких як розлади сну, шизофренія та неспокій, розладів гладких м'язів як шлунково-кишкового тракту, таких як синдром подразненої прямої кишки (IBS), хронічний запор, діарея та функціональна диспепсія, так і серцево-судинної системи, таких як гіпертензія, ішемія міокарда, ішемія головного мозку, мігрень, тромбоз та агрегація тромбоцитів, та патологій очей, таких як глаукома.
Текст
Реферат: Трициклічна індазольна сполука та її фармацевтично прийнятні солі приєднання кислоти, її застосування, спосіб та проміжні сполуки для їх одержання та фармацевтична композиція, що їх містить. Трициклічна індазольна сполука має наступну загальну формулу (І): UA 108747 C2 (12) UA 108747 C2 O (R1) m L1 N L2 N N X4 X1 Y X2 X5 W (R2) n X3 , (I) у якій R1, R2, L1, L2, Χ1, Х2, Х3, Χ4, Χ5, Y, W, m та n приймають значення, представлені в описі. O L 2 ( R ) 1 m X 1 N L Y X 15 N X 4 N R ) 2 n W X ( 2 X ( I ) 3 UA 108747 C2 5 10 15 20 25 30 35 40 45 50 55 ГАЛУЗЬ ВИНАХОДУ Даний винахід відноситься до нових трициклічних індазольних сполук, до способу та проміжних сполук для їх одержання, до фармацевтичної композиції, яка містить її, та до її застосування. Зокрема, даний винахід відноситься до нових трициклічних індазольних сполук, що мають селективну афінність до 5-HT2A рецепторів, корисних у лікуванні деяких патологій, які залучають 5-HT2A рецептори, наприклад, деяких розладів центральної нервової системи, а також розладів гладких м'язів або шлунково-кишкового тракту або серцево-судинної системи. Вплив на зазначені рецептори є також корисним у регулюванні внутрішньоочного тиску та, як наслідок, у лікуванні глаукоми. РІВЕНЬ ТЕХНІКИ 2A серотоніновий рецептор (5-HT2A) являє собою рецептор, сполучений з білком G, який присутній у багатьох видах та широко розповсюджений у організмі людини. Процес передачі сигналу, що є результатом активації рецептору, не повністю зрозумілий. Відомо, що активація цього рецептору, за допомогою білку G, сполученого з ним, приводить до активації різних ферментів, таких як фосфоліпаза C (з наступним гідролізом фосфатидилінозитол дифосфату та виробленням інозитол трифосфату) або фосфоліпаза A2 (яка веде до вивільнення арахідонової 2+ кислоти). Крім того, відповідь рецептору веде до потоку іонів кальцію (Ca ) у клітину та до активації функціональних білків, таких як протеїнкіназа C. Цей рецептор присутній у центральній нервовій системі, у клітинах гладких м'язів судин та шлунково-кишкового тракту та у тромбоцитах. Міжнародна патентна публікація WO2008061688 описує 2-алкіл-індазольні сполуки, що мають селективний вплив на 5-HT2 рецептори та, по відношенню до різних підтипів рецепторів, сполуки мають селективну афінність до 5-HT2A рецепторів у порівнянні з 5-HT2C рецепторами. Відомі і інші сполуки, що мають селективну афінність до 5-HT2A рецептору, такі як, наприклад, пімавансерін (ACP-103), що знаходиться у III фазі клінічних випробувань, для лікування хвороби Паркінсона, психозу, та еплівансерін (SR46349) та волінансерін (M100907), обидва з яких знаходяться у III фазі клінічних випробувань для лікування безсоння. 5-HT2A рецептор залучається у деякі розлади центральної нервової системи, такі як, наприклад, розлади сну (Popa D. et al., J Neurosci. 2005; 25(49): 11231-11238), шизофренія (Kapur S et al., Am J Psychiatry. 1996; 153: 466-476) та неспокій (Van Oekelen D et al., Life Sci. 2003; 72(22): 2429-2449), а також розлади гладких м'язів або шлунково-кишкового тракту (Briejer MR et al., Neurogastroenterol Motil. 1997; 9(4): 231-237) або серцево-судинної системи (Nagatomo T et al., Pharmacol Ther. 2004; 104(1): 59-81). Більше того, сполуки, що мають селективну афінність до 5-HT2A рецептору, селективна афінність може бути ефективною у регулюванні внутрішньоочного тиску та, як наслідок, у лікуванні патологій, таких як глаукома (Jesse A. May et al., J Pharmacol Exp Ther. 2003; 306(1): 301-309). Міжнародна патентна публікація WO2006050803 розкриває бі- або три-циклічні індазольні сполуки та їх солі, для селективної боротьби із шкідливими рослинами при вирощуванні корисних рослин або для регулювання росту рослин. КОРОТКИЙ ОПИС ДАНОГО ВИНАХОДУ Наразі, Заявник неочікувано виявив нові трициклічні індазоламідні сполуки, що мають селективну афінність до 5-HT2A рецептору. Крім того, Заявник визначив, що нові трициклічні індазоламідні сполуки мають значно нижчу селективну афінність до 5-HT2С рецепторів у порівнянні з 5-HT2A рецепторами. Біологічна активність помітно відрізняється від біологічної активності відомих трициклічних індазольних сполук, наприклад, тих, що описані у зазначеній вище міжнародній патентній публікації WO 2006050803. Більше того, сполуки даного винаходу мають структуру, яка помітно відрізняється від відомих сполук, що мають селективну афінність до 5-HT2A рецептору. Нові трициклічні індазольні сполуки даного винаходу можуть бути корисними у лікуванні деяких патологій, які залучають 5-HT2A рецептор, наприклад, деяких розладів центральної нервової системи, таких як розлади сну, шизофренія та неспокій, а також розладів гладких м'язів або шлунково-кишкового тракту, таких як синдром подразненої прямої кишки (IBS), хронічний запор, діарея та функціональна диспепсія, або серцево-судинної системи, таких як гіпертензія, ішемія міокарда, ішемія головного мозку, мігрень, тромбоз та агрегація тромбоцитів. Вплив на зазначений рецептор є також корисним у регулюванні внутрішньоочного тиску та, як наслідок, у лікуванні глаукоми. 1 UA 108747 C2 Відповідно, перший аспект даного винаходу відноситься до трициклічної індазольної сполуки загальної формули (I): O L2 (R1)m N X1 L1 Y X5 N X4 N (R2)n X2 W (I) 5 10 15 20 25 30 35 40 45 50 X3 у якій Y являє собою CH або N; W являє собою CH або N; за умови, що один з Y та W являє собою атом азоту; X1 та X3 можуть незалежно являти собою σ зв'язок, двовалентний алкільний ланцюг, що містить від 1 до 5 атомів вуглецю, карбонільну групу, двовалентний алканоїльний ланцюг типу CO-(CH2)1-4- або -(CH2)1-4-CO-, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості атомів галогену, однієї або більшої кількості C1-3алкільних груп, однієї або більшої кількості C1-3алкокси груп; X4 може являти собою двовалентний алкільний ланцюг, що містить від 1 до 5 атомів вуглецю, карбонільну групу, двовалентний алканоїльний ланцюг типу -CO-(CH2)1-4- або -(CH2)1-4CO-, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості атомів галогену, однієї або більшої кількості C1-3алкільних груп, однієї або більшої кількості C1-3алкокси груп; X2 та X5 можуть незалежно являти собою σ зв'язок або двовалентний алкільний ланцюг, що містить від 1 до 4 атомів вуглецю, де атоми водню зазначеного алкільного ланцюгу можуть бути необов'язково заміщені за допомогою одного або більшої кількості атомів галогену, однієї або більшої кількості C1-3алкільних груп, однієї або більшої кількості C1-3алкокси груп; L1 та L2 можуть незалежно являти собою σ зв'язок або зв'язок; i ii R1 можуть незалежно являти собою H, OH, галоген, CN, C1-3алкіл, C1-3алкокси, NR R , NO2, iii iv v vi vii viii ix x xi xii CF3, CONR R , SO2R , OCF3, N(R )SO2R , C(NR )N(R R ), N(R )C(O)R ; R2 можуть незалежно являти собою H, OH, галоген, CN, C 1-3алкіл, C1-3алкокси, C1i ii iii iv v vi vii гідроксиалкіл, C1-3аміноалкіл, NR R , NO2, CF3, CONR R , SO2R , OCF3, N(R )SO2R , 3 viii ix x xi xii C(NR )N(R R ), N(R )C(O)R ; m та n можуть незалежно являти собою від 1 до 3; i ii iii iv v vi vii viii ix x xi xii R , R , R , R , R , R , R , R , R , R , R , R можуть незалежно являти собою H або C1-3алкіл; та її солей приєднання з фармацевтично прийнятними органічними та неорганічними кислотами. Типові приклади фармацевтично прийнятних кислот включають: щавлеву, малеїнову, метансульфонову, паратолуолсульфонову, бурштинову, лимонну, винну, молочну, соляну, фосфорну та сірчану кислоту. Відповідно до кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, X1 може являти собою карбонільну групу, двовалентний алкільний ланцюг, що містить від 1 до 3 атомів вуглецю, двовалентний алканоїльний ланцюг типу -CO-(CH2)1-3- або -(CH2)1-3-CO-, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості галогенових атомів, або однієї або більшої кількості C1-3алкільних груп. Відповідно до навіть ще кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, X1 може являти собою –CO-, -CH2-, або -(CH2)3-. Відповідно до кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, X3 може являти собою σ зв'язок, двовалентний алкільний ланцюг, що містить від 1 до 3 атомів вуглецю, двовалентний алканоїльний ланцюг типу -CO-(CH2)1-2-, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості галогенових атомів, або однієї або більшої кількості C1-3алкільних груп. Відповідно до навіть ще кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, X3 може являти собою σ зв'язок, -(CH2)2-, -CO-CH2-, або -CH2CF2-. Відповідно до кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, X4 може являти собою двовалентний алкільний ланцюг, що містить від 1 до 3 атомів вуглецю, двовалентний алканоїльний ланцюг типу -CO-(CH2)1-2- або -(CH2)1-2-CO, де 2 UA 108747 C2 5 10 15 20 25 30 атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості галогенових атомів, або однієї або більшої кількості C1-3алкільних груп. Відповідно до навіть ще кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, X4 може являти собою –(CH2)2-, -(CH2)3-; -CH2-CO-, або -CO-CH2-. Відповідно до кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, X2 та X5 може являти собою двовалентний алкільний ланцюг, що містить від 1 до 3 атомів вуглецю, де атоми водню зазначених алкільного та алканоїльного ланцюгів можуть бути необов'язково заміщені за допомогою одного або більшої кількості галогенових атомів, або однієї або більшої кількості C1-3алкільних груп. Відповідно до навіть ще кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, X2 може являти собою –(CH2)2-, або -(CH2)3- та X5 може являти собою – CH2-, або -(CH2)2-. Відповідно до кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, L1 та L2 обидва можуть являти собою σ зв'язок або обидва можуть являти собою π зв'язок. Відповідно до кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, R1 може незалежно являти собою H, OH, F, Cl, CN, C1-3алкільну групу, C1i ii iii iv v 3алкокси групу, NR R групу, NO2, CF3, CONR R групу, SO2R , та OCF3. Відповідно до навіть ще кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, R1 може незалежно являти собою H, OH, F, CN, CF3, та CONH2. Відповідно до кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, R2 може незалежно являти собою H, OH, F, Cl, CN, C1-3алкіл, C1-3алкокси, i ii iii iv v C1-3гідроксиалкіл, C1-3аміноалкіл, NR R , NO2, CF3, CONR R , SO2R , OCF3. Відповідно до навіть ще кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, R2 може незалежно являти собою H, OH, F, CH2OH, CH2NH2, CONH2; Відповідно до кращого варіанту втілення даного винаходу, у загальній формулі (I), представленій вище, m являє собою 1 та n може являти собою 1 або 2. Другий аспект даного винаходу відноситься до способу одержання (i) трициклічної індазольної сполуки загальної формули (I) та, необов'язково (ii) її солі приєднання кислоти з фармацевтично прийнятними неорганічними та органічними кислотами. Відповідно, спосіб даного винаходу, у його першому варіанті втілення, характеризується тим, що він включає (1b) конденсування амідної похідної формули (IV): O L2 (R1)m NH L1 N N 35 X4 (IV) у якій R1, L1, L2, X4, та m приймають значення, зазначені вище у відношенні сполуки формули (I), з похідною формули (V) X5 Q X1 40 45 (R2)n W Y X2 X3 (V) у якій R2, X1, X2, X3, X5, W, Y, та n приймають значення, зазначені вище у відношенні сполуки формули (I), та Q являє собою відхідну групу, вибрану з групи, яка включає атом галогену, мезилатну групу (CH3SO3 ) та тозилатну групу (p-MePhSO3 ), що забезпечує одержання трициклічної індазольної сполуки загальної формули (I). Переважно, Q являє собою атом хлору, атом брому або мезилатну групу. Крім того, спосіб даного винаходу, коли W являє собою атом азоту, характеризується тим, що він включає (1a) конденсацію аміну формули (II) 3 UA 108747 C2 (R1) m L2 L1 O N N X4 5 N X5 Y X1 NH X2 (II) у якій X1, X2, X4, X5, Y, L1, L2, R1 та m приймають значення, зазначені вище у відношенні сполуки формули (I), з похідною формули (III) (R2)n Q X 3 10 15 20 25 30 35 40 45 (III) у якій X3, R2 та n приймають значення, зазначені вище у відношенні сполуки формули (I), та Q являє собою відхідну групу, вибрану з групи, яка включає атом галогену, мезилатну групу (CH3SO3 ) та тозилатну групу (p-MePhSO3 ), що забезпечує одержання трициклічної індазольної похідної загальної формули (I). Переважно, Q являє собою атом брому або мезилатну групу. При бажанні, трициклічну індазольну похідну загальної формули (I) вводять у реакцію з фармацевтично прийнятною органічною або неорганічною кислотою, що забезпечує одержання її солі приєднання з кислотою. Стадія конденсації (1b) може бути проведена за допомогою звичайно використовуваних технологій, у присутності основи. Наприклад, амідну похідну формули (IV) вводять у реакцію зі сполукою формули (V), у якій Q являє собою, переважно, атом хлору, атом брому або мезилатну групу, у присутності основи. Типовим прикладом основи є гідрид натрію. Переважно, стадію конденсації (1b) проводять у присутності розріджувача при температурі, що становить від -20 °C до температури кипіння розчиннику, та впродовж часу, що становить від 0,5 до 48 годин. Переважно, температура варіюється від 0 °C до температури кипіння розчиннику. Переважно, час реакції становить від 1 до 24 годин. Як правило, використовуваний розріджувач являє собою полярний апротонний розчинник. Приклади прийнятних полярних апротонних розчинників включають N, N-диметилформамід або тетрагідрофуран. Стадія конденсації (1a) також може бути проведена за допомогою звичайно використовуваних способів, переважно у присутності основи. Наприклад, амін формули (II) може бути введений у реакцію зі сполукою формули (III), у якій Q являє собою, переважно, атом брому або мезилатну групу, переважно у присутності основи. Типові приклади основ включають карбонат або бікарбонат калію, натрію або цезію. Переважно, стадію конденсації (1a) проводять у присутності розріджувача при температурі від кімнатної температури (20 °C) до 160 °C та впродовж часу від 1 до 72 годин. Переважно, температура реакції змінюється від кімнатної температури (20 °C) до 100 °C. Переважно, час реакції становить від 12 до 48 годин. Як правило, використовуваний розріджувач являє собою протонний або апротонний полярний розчинник. Прийнятні приклади протонних полярних розчинників включають спирти, такі як етанол. Прийнятні приклади полярних апротонних розчинників включають ацетон або N, N-диметилформамід. Сполука, яку отримують у будь-якій стадії конденсації (1b) або (1a), може бути очищена за допомогою звичайно використовуваних способів, таких як флеш хроматографія та кристалізація. Трициклічна індазольна похідна загальної формули (I), яку одержують за будь-якою стадією конденсації (1b) або (1a), може бути введена у реакцію з фармацевтично прийнятною органічною або неорганічною кислотою з утворенням її солі приєднання з кислотою. 4 UA 108747 C2 5 10 Утворення солі приєднання з кислотою трициклічної індазольної сполуки загальної формули (I) з фармацевтично прийнятною органічною або неорганічною кислотою може бути виконане за допомогою звичайно використовуваних способів. Наприклад, воно може бути проведене спочатку шляхом розчинення сполуки формули (I) у розчиннику та потім обробки розчину, отриманого таким способом, органічним або водним розчином потрібної кислоти. Типові приклади розчинників включають етанол, ізопропанол, етилацетат та діетиловий ефір. Отримана сіль далі може бути відділена за допомогою звичайно використовуваних способів та, якщо прийнятно, очищена шляхом кристалізації. Деякі проміжні сполуки формули (II) та (IV) є новими, та тому вони складають додатковий аспект даного винаходу. Відповідно, у додатковому аспекті, даний винахід відноситься до проміжних сполук формули (II): (R1) m L2 L1 O N N X4 15 N X5 Y NH X2 X1 (II) у якій X1, X2, X4, X5, Y, L1, L2, R1 та m приймають значення, зазначені вище у відношенні сполуки формули (I); У ще одному додатковому аспекті, даний винахід відноситься до проміжних сполук формули (IV): O (R1)m L2 NH L1 20 25 30 N N X4 (IV) у якій R1, L1, L2, X4 та m приймають значення, зазначені вище у відношенні сполуки формули (I), за умови, що коли R1 являє собою H та L1 та L2 являють собою π зв'язок, X4 відрізняється від CH2CH2 або CH2CH2CH2, та коли R1 являє собою H та L1 та L2 являють собою σ зв'язок, X4 відрізняється від CH2CH2. Амін формули (II), а також трициклічні похідні формули (IV), можуть бути одержані за звичайно використовуваними способами, наприклад, як описано у схемі 1. Схема 1 Схема синтезу забезпечує, як першу стадію, алкілування похідної складного ефіру індазолкарбонової кислоти формули (VI) за допомогою алкілуючого агенту формули (VII), у якій Q1 позначає відхідну групу, яку вибирають з групи, що включає атом галогену, мезилатну групу 5 UA 108747 C2 5 10 (CH3SO3 ) та тозилатну групу (p-MePhSO3 ), та P1 позначає захисну групу кінцевих амінів, яку вибирають з групи, що включає 9-флуоренілметил-карбамат (Fmoc), трет-бутил-карбамат (Boc) та N-бензиліденамін. Переважно, Q1 являє собою атом хлору, атом брому або мезилатну групу. Послідовно, захисну групу P1 видаляють та отриманий первинний амін внутрішньомолекулярно вводять у реакцію із складноефірною групою, що забезпечує одержання циклічного аміну формули (IV). Останній алкілують шляхом реакції з алкілуючим агентом формули (IX), у якій Q 2 позначає відхідну групу, вибрану з групи, що включає атом галогену, мезилатну групу (CH 3SO3 ) та тозилатну групу (p-MePhSO3 ) та P2 позначає захисну групу кінцевих амінів, вибрану з групи, що включає 9-флуоренілметил-карбамат (Fmoc) та трет-бутил-карбамат (Boc). Переважно, Q2 являє собою атом хлору, атом брому або мезилатну групу. Послідовно, захисну групу P2 видаляють з утворенням амінних похідних формули (II). Сполуки, представлені для прикладу у наступній Таблиці 1, можуть бути одержані за схемою синтезу, описаною вище. 15 ТАБЛИЦЯ 1 № 1 2 3 4 5 6 7 8 9 10 11 L1 L2 12 14 15 H 16 17 18 σ σ σ σ H H H 19 σ σ H 20 H 21 22 23 24 25 26 27 28 29 30 31 32 33 34 H H H H H H H H H H 9-CF3 8-OH H 13 20 R1 H H 7-F 7-CN H 7-CONH2 H H H H H H H H H R2 p-F H o-F o-F o-F o-F o-F o-F o-F p-F o-F p-OH o-F p-CH2OH o-F o-F p-CH2NH2 o-F m’-CONH2 p-F p-F o-F o-F p-OH H o-F m-CONH2 H o-F p-F H H p-F H H H H o-F o-F o-F X1 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 X2 (CH2)2 (CH2)3 (CH2)2 (CH2)2 (CH2)3 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)3 X3 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 X4 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH2CO (CH2)2 COCH2 (CH2)3 X5 (CH2)2 CH2 (CH2)2 (CH2)2 CH2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH2 Y CH CH CH CH CH CH CH CH CH CH W N N N N N N N N N N m 1 1 1 1 1 1 1 1 1 1 n 1 1 1 1 1 1 1 1 1 1 CH2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH N 1 2 CH2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH N 1 2 CH2 (CH2)3 (CH2)2 (CH2)3 CH2 CH N 1 1 CH2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH N 1 2 CH2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH N 1 2 CH2 CH2 CH2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 COCH2 (CH2)3 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH CH CH N N N 1 1 1 1 1 1 CH2 (CH2)2 COCH2 (CH2)2 (CH2)2 CH N 1 2 CH2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH N 1 1 CH2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH N 1 2 CH2 CH2 CH2 CH2 CH2 CH2 (CH2)3 CH2 CH2 (CH2)3 CH2 CH2 CO (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH2CF2 COCH2 COCH2 CH2CF2 σ CH2CF2 CH2CF2 σ (CH2)2 (CH2)2 (CH2)2 (CH2)3 (CH2)3 (CH2)2 (CH2)2 (CH2)3 (CH2)3 (CH2)2 (CH2)2 (CH2)3 (CH2)3 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 (CH2)2 CH CH CH CH CH CH N CH CH N CH CH CH N N N N N N CH N N CH N N N 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 Типові приклади патологічних станів, які могли б мати користь з лікування новою трициклічною індазольною сполукою формули (I), що має селективну афінність до 5-HT2A рецептору, включають деякі розлади центральної нервової системи, такі як, наприклад, розлади сну (Popa D. et al., J Neurosci. 2005; 25(49): 11231-11238), шизофренія (Kapur S et al., Am J Psychiatry. 1996; 153: 466-476) та неспокій (Van Oekelen D et al., Life Sci. 2003; 72(22): 24292449) а також розлади гладких м'язів або шлунково-кишкового тракту (Briejer MR et al., Neurogastroenterol Motil. 1997; 9(4): 231-237) або серцево-судинної системи (Nagatomo T et al., 6 UA 108747 C2 5 10 15 20 25 30 35 40 45 50 55 Pharmacol Ther. 2004; 104(1): 59-81). Більше того, зазначена фармацевтична композиція може бути ефективною у регулюванні внутрішньоочного тиску та, як наслідок, у лікуванні патологій, таких як глаукома (May JA et al., J Pharmacol Exp Ther. 2003; 306(1): 301-309). Інший аспект даного винаходу відноситься до застосування описаної вище трициклічної індазольної сполуки загальної формули (I) або її солі з фармацевтично прийнятною органічною або неорганічною кислотою, для одержання лікарського засобу для лікування патологічного стану, який вибирають з групи, яка складається з розладів центральної нервової системи, розладів гладких м'язів або шлунково-кишкового тракту або серцево-судинної системи, та патологій очей. Більш особливо, даний винахід відноситься до застосування описаної вище трициклічної індазольної сполуки загальної формули (I) або її солі з фармацевтично прийнятною органічною або неорганічною кислотою, для одержання лікарського засобу для лікування розладу центральної нервової системи, який вибирають з групи, що включає такі як: розлади сну, шизофренія, та неспокій. Даний винахід також відноситься до застосування описаної вище трициклічної індазольної сполуки загальної формули (I) або її солі з фармацевтично прийнятною органічною або неорганічною кислотою, для одержання лікарського засобу для лікування розладу гладких м'язів шлунково-кишкового тракту, який вибирають з групи, що включає такі як: синдром подразненої прямої кишки (IBS), хронічний запор, діарея та функціональна диспепсія. Даний винахід також відноситься до застосування описаної вище трициклічної індазольної сполуки загальної формули (I) або її солі з фармацевтично прийнятною органічною або неорганічною кислотою, для одержання лікарського засобу для лікування розладу гладких м'язів серцево-судинної системи, який вибирають з групи, що включає такі як: гіпертензія, ішемія міокарда, ішемія головного мозку, мігрень, тромбоз та агрегація тромбоцитів. Даний винахід також відноситься до застосування описаної вище трициклічної індазольної сполуки загальної формули (I) або її солі з фармацевтично прийнятною органічною або неорганічною кислотою, для одержання лікарського засобу для лікування глаукоми. Даний винахід додатково відноситься до способу лікування патологічного стану, який вибирають з групи, що включає розлади центральної нервової системи, розлади гладких м'язів або шлунково-кишкового тракту або серцево-судинної системи, та патології очей, який включає введення пацієнту, якому це необхідно, терапевтично ефективної кількості щонайменше однієї трициклічної індазольної сполуки формули (I), як описано вище, або її солі з фармацевтично прийнятною органічною або неорганічною кислотою. Зокрема, розлади центральної нервової системи, які можуть лікуватися за допомогою способів даного винаходу, включають розлади сну, шизофренію та неспокій. Розлади гладких м'язів шлунково-кишкового тракту, які можуть лікуватися за допомогою способів даного винаходу, включають синдром подразненої прямої кишки (IBS), хронічний запор, діарею та функціональну диспепсію. Розлади гладких м'язів серцево-судинної системи, які можуть лікуватися за допомогою способів даного винаходу, включають гіпертензію, ішемію міокарда, ішемію головного мозку, мігрень, тромбоз та агрегацію тромбоцитів. Патології очей, які можуть лікуватися за допомогою способів даного винаходу, включають глаукому. Додатковий аспект даного винаходу відноситься до фармацевтичної композиції, яка включає ефективну кількість щонайменше однієї трициклічної індазольної сполуки формули (I), як описано вище, або її солі з фармацевтично прийнятною органічною або неорганічною кислотою та щонайменше один інертний фармацевтично прийнятний наповнювач. Переважно, фармацевтичну композицію даного винаходу одержують у підходящих лікарських формах, які включають ефективну кількість щонайменше однієї трициклічної індазольної сполуки формули (I), як описано вище, або її солі з фармацевтично прийнятною органічною або неорганічною кислотою та щонайменше один інертний фармацевтично прийнятний наповнювач. Тому, додатковий аспект даного винаходу відноситься до застосування зазначеної вище фармацевтичної композиції для лікування патологічного стану, який вибирають з групи, що включає розлади центральної нервової системи, такі як розлади сну, шизофренія та неспокій, розлади гладких м'язів або шлунково-кишкового тракту, такі як синдром подразненої прямої кишки (IBS), хронічний запор, діарея та функціональна диспепсія, або серцево-судинної системи, такі як гіпертензія, ішемія міокарда, ішемія головного мозку, мігрень, тромбоз та агрегація тромбоцитів, та патології очей, такі як глаукома. 7 UA 108747 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади підходящих лікарських форм включають таблетки, капсули, покриті таблетки, гранули, розчини та сиропи для перорального введення; розчини, помаду та мазь для місцевого введення; просочені лікарським засобом пластири для крізьшкірного введення; суппозиторії для ректального введення та ін'єкційні стерильні розчини. Інші підходящі лікарські форми включають форми з уповільненим вивільненням та форми на основі ліпосом для перорального, ін'єкційного або крізьшкірного введення. Лікарські форми також можуть містити інші традиційні інгредієнти, такі як: консерванти, стабілізатори, поверхнево-активні речовини, буфери, солі для регулювання осмотичного тиску, емульгатори, підсолоджувачі, барвники, ароматизатори та подібні. Якщо вимагається спеціальними терапевтичними вимогами, фармацевтична композиція даного винаходу може містити інші фармакологічно активні інгредієнти, одночасне введення яких є корисним. Кількість трициклічної індазольної сполуки формули (I) або її фармацевтично прийнятної солі приєднання з кислотою у фармацевтичній композиції даного винаходу може змінюватися у широких межах в залежності від відомих факторів, наприклад, таких як: тип патології, серйозність хвороби, маса тіла пацієнта, лікарська форма, вибраний шлях введення, кількість введень на добу та ефективність вибраної трициклічної індазольної сполуки формули (I). Однак, спеціаліст, кваліфікований у даній галузі техніки, може визначати оптимальну кількість легким та рутинним способом. Як правило, кількість трициклічної індазольної сполуки формули (I) або її фармацевтично прийнятної солі приєднання з кислотою у фармацевтичній композиції даного винаходу буде такою, щоб забезпечити рівень введення від 0,0001 до 100 мг/кг/добу. Переважно, рівень введення становить від 0,001 до 50 мг/кг/добу, та навіть більш краще від 0,01 до 10 мг/кг/добу. Лікарські форми фармацевтичної композиції даного винаходу можуть бути одержані за способами, які відомі хіміку-фармацевту, та включають змішування, гранулювання, пресування, розчинення, стерилізацію та подібні. Наступний опис призначений для додаткової ілюстрації даного винаходу, не обмежуючи його. КОРОТКИЙ ОПИС ФІГУРИ Фіг. 1 являє собою графічне представлення ефекту досліджуваних сполук після внутрішньочеревинного введення у дослідженні судомних рухів головою миші відповідно до процедури Дослідження C, представленої у цьому описі нижче. На вісі Y представлено кількість судомних рухів головою після внутрішньочеревинного введення сполук, показаних на вісі X. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА 1 H-ЯМР спектроскопія: a) Varian Gemini 200 (200MГц) b) Brucker 300 Avance (300 MГц); внутрішній стандарт = триметилсилан. [(s) = синглет; (d) = дублет; (t) = триплет; (q) = квартет; (qn) = квінтет; (sxt) = секстет; (spt) = септет; (bs) = широкий синглет; (bd) = широкий дублет; (dd) = дублет дублетів; (dt) = дублет триплетів; (tt) = триплет триплетів; (m) = мультиплет; J = константа взаємодії; δ = хімічний зсув (у част./млн.)]. Приклад 1 2-({1-[2-(4-фторфеніл)етил]піперидин-4-іл}метил)-3,4-дигідропіразино[1,2-b]індазол-1(2H)ону гідрохлорид 1a) Метил 2-(2-хлоретил)-2H-індазол-3-карбоксилат 1-бром-2-хлоретан (70 мл; 0,84 моль) повільно додають до суспензії метилового складного ефіру 1H(2H)-індазол-3-карбонової кислоти (20 г; 0,084 моль), карбонату цезію (24,4 г; 0,177 моль) у ацетонітрилі (600 мл), що продовжують перемішувати при кімнатній температурі. Реакційну суміш тримають при перемішуванні при цій же температурі впродовж 3 днів, потім тверду речовину видаляють фільтруванням. Розчинник видаляють шляхом випарювання при зниженому тиску. Отриману таким чином сиру сполуку очищують за допомогою флеш хроматографії на силікагелі, використовуючи як елюент суміш гексан:етилацетат у співвідношенні 8:2. Приблизно 10 г метил 2-(2-хлоретил)-2H-індазол-3-карбоксилату отримують таким чином. 1 H-ЯМР (300 MГц, CDCl3) δ: 3,9 – 4,1 (m, 5H); 5,24 (t, J=6,0 Гц; 2H); 7,2-7,4 (m, 2H); 7,79 (d; J=9,0 Гц; 1H); 8,02 (d; J=9,0 Гц; 1H). 1b) Метил 2-(2-азидоетил)-2H-індазол-3-карбоксилат Азид натрію (8,8 г; 0,135 моль) додають до розчину метил 2-(2-азидоетил)-2H-індазол-3карбоксилату (9 г, 0,038 моль) у диметилсульфоксиді (ДМСО) (100 мл) при енергійному перемішуванні при кімнатній температурі. Реакційну суміш потім обробляють шляхом її охолодження до кімнатної температури, розводячи її водою (100 мл) та екстрагуючи її кілька разів етилацетатом (3 × 100 мл). Органічні 8 UA 108747 C2 5 10 15 20 25 30 35 40 45 50 55 60 фази, зібрані разом, промивають водою (3 × 25 мл), потім насиченим розчином NaCl (30 мл) та, наприкінці, сушать за допомогою безводного Na2SO4. Розчинник видаляють шляхом випарювання при зниженому тиску, отримуючи таким чином приблизно 6 г метил 2-(2азидоетил)-2H-індазол-3-карбоксилату, який використовують для наступних реакцій без додаткових стадій очищення. 1 H-ЯМР (300 MГц, CDCl3) δ: 3,87 (t, J=6,0 Гц; 2H); 4,04 (s, 3H); 5,11 (t, J=6,0 Гц; 2H); 7,2 – 7,4 (m, 2H); 7,80 (t, J=9,0 Гц; 1H); 8,01 (d; J=9,0 Гц; 1H). 1c) 3,4-дигідропіразино[1,2-b]індазол-1(2H)-он Суспензію, що містить метил 2-(2-азидоетил)-2H-індазол-3-карбоксилат (6 г; 0,024 моль), 10 % паладію на вугіллі (0,5 г; 0,5 ммоль) у 5н. гідрохлоридному розчині етанолу (100 мл) поміщають у систему Пара для гідрогенізації у атмосфері водню при кімнатній температурі на 24 години. Після закінчення реакції, суспензію відфільтровують через целіт та розчинник видаляють шляхом випарювання при зниженому тиску. Отриманий таким чином сирий продукт розчиняють у абсолютному етанолі (250 мл), додають триетиламін (12 мл; 0,12 моль) та перемішують при зрошенні впродовж 48 годин. Потім реакцію зупиняють шляхом видалення розчиннику шляхом випарювання при зниженому тиску. Залишок переносять у воду (100 мл) та екстрагують дихлорoметаном (ДХМ) (3 × 150 мл). Органічну фазу, зібрану разом, потім промивають насиченим розчином NaCl (50 мл) та сушать за допомогою безводного Na2SO4. Отримують приблизно 3 г сирого продукту. Його очищують за допомогою флеш хроматографії на силікагелі, використовуючи як елюент суміш гексан:етилацетат у співвідношенні 8:2. Таким чином, отримують 1,5 г 3,4-дигідропіразино[1,2b]індазол-1(2H)-ону. 1 H-ЯМР (300 MГц, CDCl3) δ: 3,6-3,8 (m, 2H); 4,64 (t, J=6,0 Гц; 2H); 7,26 (t, J=9,0 Гц; 1H); 7,36 (t, J=9,0 Гц; 1H); 7,75 (d, J=9,0 Гц; 1H); 7,98 (d; J=9,0 Гц; 1H). 1d) Трет-бутил 4-[(1-оксо-3,4-дигідропіразино[1,2-b]індазол-2(1H)-іл) метил]піперидин-1карбоксилат 60 % NaH (0,72 г; 0,018 моль) додають до розчину 3,4-дигідропіразино[1,2-b]індазол-1(2H)ону (2,7 г; 0,015 моль) у диметилформаміді (ДМФА) (50 мл), що продовжують перемішувати при кімнатній температурі. Реакційну суміш продовжують перемішувати при цій же температурі у атмосфері азоту впродовж 2 годин 30 хвилин, потім повільно додають розчин трет-бутил 4{[(метилсульфоніл)окси]метил}піперидин-1-карбоксилату (4,4 г; 0,015 моль) у ДМФА (25 мл). Після закінчення додавання, суміш нагрівають при 150 °C впродовж 6 годин. Потім реакцію зупиняють шляхом охолодження суміші при кімнатній температурі та шляхом видалення розчиннику шляхом випарювання при зниженому тиску. Залишок переносять у дихлорoметан та потім фільтрують через силікагелевий фільтр. Розчинник видаляють шляхом випарювання при зниженому тиску, таким чином отримуючи 3,5 г трет-бутил 4-[(1-оксо-3,4-дигідропіразино[1,2b]індазол-2(1H)-іл)метил]піперидин-1-карбоксилату, що використовують у наступних реакціях без додаткових стадій очищення. 1 H-ЯМР (300 MГц, CDCl3) δ: 1,1 – 1,4 (m, 2H); 1,45 (s, 9H); 1,6 – 1,8 (m, 2H); 1,9 – 2,1 (m, 1H); 2,71 (bt, J=13,2 Гц; 2H); 3,4 – 3,6 (m, 2H), 3,89 (t, J=6,6 Гц, 2H); 4,0 – 4,3 (m, 2H); 4,69 (t, J=6,6 Гц; 2H); 7,2 – 7,4 (m, 2H); 7,75 (d, J=8,7 Гц; 1H); 8,16 (d, J=8,7 Гц; 1H). 1e) 2-(піперидин-4-ілметил)-3,4-дигідропіразино[1,2-b]індазол-1(2H)-ону гідрохлорид Розчин, що містить трет-бутил 4-[(1-оксо-3,4-дигідропіразино[1,2-b]індазол-2(1H)іл)метил]піперидин-1-карбоксилат (3,5 г; 0,009 моль), етилацетат (20 мл) та 3M гідрохлоридний розчин етанолу (10 мл), продовжують перемішувати при кімнатній температурі впродовж 2 годин. Потім реакцію зупиняють шляхом фільтрування твердої речовини, яка утворилася, та промивання її етилацетатом. Таким чином, отримують 1,5 г 2-(піперидин-4-ілметил)-3,4дигідропіразино[1,2-b]індазол-1(2H)-ону гідрохлориду, який використовують для наступної реакції без додаткових стадій очищення. 1 H-ЯМР (300 MГц, ДМСО-d6+D2O) δ: 1,38 (bq, J=9,0 Гц; 2H); 1,81 (bd, J=12,0 Гц; 2H); 1,9 – 2,1 (m, 1H); 2,80 (bt, J=9,0 Гц; 2H); 3,25 (bd, J=12,0 Гц; 2H); 3,42 (d, J=6,0 Гц; 2H); 3,81 (t, J=6,0 Гц; 2H); 4,74 (t, J=6 Гц; 2H); 7,27 (t, J=9,0 Гц; 1H); 7,36 (t, J=9,0 Гц; 1H); 7,75 (d, J=9,0 Гц; 1H); 8,00 (d, J=9,0 Гц; 1H). 1f) 2-({1-[2-(4-фторфеніл)етил]піперидин-4-іл}метил)-3,4-дигідропіразино[1,2-b]індазол-1(2H)ону гідрохлорид Розчин, що містить 2-(піперидин-4-іл-метил)-3,4-дигідропіразино[1,2-b]індазол-1(2H)-ону гідрохлорид (528 мг; 1,64 ммоль), карбонат калію (610 мг; 4,4 ммоль), 4-фторфенетил бромід (450 мг; 2,2 ммоль) у етанолі (10 мл), продовжують перемішувати при зрошенні протягом 24 9 UA 108747 C2 5 10 15 20 25 30 35 40 45 50 55 годин. Потім реакцію зупиняють шляхом охолодження суміші при кімнатній температурі та концентрування розчиннику при зниженому тиску. Залишок переносять у ДХМ (30 мл) та промивають у зазначеному порядку насиченим розчином NaHCO3 (2 × 20 мл), водою (2 × 15 мл) та насиченим розчином NaCl (10 мл). Органічну фазу потім сушать за допомогою Na 2SO4 та розчинник видаляють шляхом випарювання при зниженому тиску. Твердий сирий продукт потім очищують за допомогою флеш хроматографії на силікагелі, використовуючи як елюент суміш хлорoформ:метанол у співвідношенні 9:1. Очищений таким чином продукт розчиняють у суміші діетиловий ефір:етанол у співвідношенні 10:1 (10 мл) та обробляють при кімнатній температурі 3M гідрохлоридним розчином етанолу (0,33 мл). Утворену таким чином тверду речовину фільтрують та кристалізують за допомогою суміші ізопропанол:діізопропіловий ефір у співвідношенні 3:7. Таким чином, отримують 250 мг 2-({1-[2-(4-фторфеніл)-етил]піперидин-4іл}метил)-3,4-дигідропіразино[1,2-b]-індазол-1(2H)-ону гідрохлориду. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 1,49 – 1,78 (m, 2H); 1,81 – 2,10 (m, 3H); 2,76 – 2,99 (m, 2H); 3,00 – 3,12 (m, 2H); 3,17 – 3,40 (m, 2H); 3,47 (d, J=6,61 Гц; 2H); 3,51 – 3,67 (m, 2H); 3,93 (t, J=6,11 Гц; 2H); 4,75 (t, J=6,11 Гц; 2H); 7,11 – 7,42 (m, 6H); 7,76 (dt, J=8,59 Гц; J=0,99 Гц; 1H); 8,01 (dt, J=8,26 Гц; J=1,16 Гц; 1 H), 10,51 (bs, 1H). Приклад 2 2-({1-[2-(4-фторфеніл)етил]піперидин-3-іл}метил)-3,4-дигідропіразино[1,2-b]індазол-1(2H)-он 2a) Трет-бутил-2-брометилкарбамат Триетиламін (2,02 г; 0,020 моль) додають краплинним способом до розчину 2брометанаміну (2,04 г; 0,010 моль) та трет-бутоксикарбонільного ангідриду (1,74 г; 0,010 моль) у дихлорoметані (50 мл), що тримають при перемішуванні при 0 °C. Реакцію продовжують перемішувати протягом 15 хвилин при 0 °C, потім протягом 8 годин при кімнатній температурі. Цю суміш промивають водою (2 × 50 мл) та органічну фазу сушать на Na 2SO4. Після видалення розчиннику шляхом випарювання при зниженому тиску, залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи як елюент суміш гексан:етилацетат у співвідношенні 8:2. Таким чином, отримують 1,79 г трет-бутил-2-брометил-карбамату. Цю тверду речовину використовують для наступної реакції без додаткових стадій очищення. 1 H-ЯМР (200 MГц, CDCl3) δ: 1,41 (s, 9H); 3,24-3,59 (m, 4H); 4,95 (bs, 1H). 2b) Метил 2-[2-(трет-бутоксикарбоніламіно)етил]-2H-індазол-3-карбоксилат Карбонат цезію (19,5 г; 0,06 моль) додають до розчину метил 1H-індазол-3-карбоксилату (3,5 г; 0,02моль) та трет-бутил-2-брометилкарбамату (8,9 г; 0,04 моль) у ДМФА (30 мл), що тримають при перемішуванні при кімнатній температурі. Цю суміш тримають при енергійному перемішуванні при кімнатній температурі впродовж 48 годин, потім обробляють шляхом додавання води (50 мл) та, послідовно, 1M HCl до одержання pH 6. Водну фазу екстрагують етилацетатом (3 × 50 мл) та органічні фази, зібрані разом, промивають насиченим розчином NaCl (10 мл), потім сушать на Na 2SO4. Після видалення розчиннику шляхом випарювання при зниженому тиску, залишок очищують за допомогою флеш хроматографії на силікагелі; використовуючи як елюент суміш гексан:етилацетат у співвідношенні 6:4. Таким чином, отримують 2,87 г метил 2-[2-(трет-бутоксикарбоніламіно)етил]2H-індазол-3-карбоксилату, що використовують для наступної реакції без додаткових стадій очищення. 1 H-ЯМР (200 MГц, CDCl3) δ: 1,36 (s, 9H); 3,74 (q, 2H, J=5,5 Гц); 4,03 (s, 3H); 4,89-5,07 (bs, 1H); 5,03 (t, 2H, J=5,5 Гц); 7,23-7,42 (m, 2H); 7,79 (dt, 1H, J=7,5 Гц; J=1,6 Гц); 8,02 (dt, 1H, J=7,5 Гц; J=1,6 Гц). 2c) 3,4-дигідропіразино[1,2-b]індазол-1(2H)-он Розчин 1,25M HCl у етанолі (48 мл; 0,06 моль) повільно додають до розчину метил 2-[2(трет-бутоксикарбоніламін)етил]-2H-індазол-3-карбоксилату (6,38 г; 0,02 моль) у етилацетаті (50 мл), що продовжують перемішувати при кімнатній температурі. Отриману таким чином суміш тримають при перемішуванні при кімнатній температурі впродовж 2 годин. Розчинник потім видаляють шляхом випарювання при зниженому тиску та залишок обробляють етилацетатом (20 мл) при кімнатній температурі та фільтрують. Отриману таким чином тверду речовину розчиняють у метанолі (10 мл) та карбонат цезію (13,0 г; 0,04 моль) додають до отриманого розчину, що продовжують перемішувати при кімнатній температурі. Цю суміш тримають при перемішуванні впродовж 16 годин при кімнатній температурі, потім розчинник видаляють шляхом випарювання при зниженому тиску. Залишок переносять у воду (50 мл) та водну фазу екстрагують кілька разів етилацетатом (5 × 50 мл). Органічні фази, зібрані разом, сушать на Na2SO4 та приблизно 4 г сирого продукту отримують після видалення розчиннику шляхом випарювання при зниженому тиску. Сирий продукт потім очищують за допомогою флеш 10 UA 108747 C2 5 10 15 20 25 30 35 40 45 50 55 хроматографії на силікагелі, використовуючи суміш гексан:етилацетат у співвідношенні 8:2 як елюент. Таким чином, отримують 3,4 г 3,4-дигідропіразино[1,2-b]індазол-1(2H)-ону. 1 H-ЯМР (200 MГц, CDCl3) δ: 3,93 (dt, 2H, J=6,7 Гц; J=1,7 Гц); 4,72 (t, 2H, J=6,7 Гц); 6,35 (bs, 1H); 7,27-7,46 (m, 2H); 7,78 (dt, 1H, J=8,4 Гц; J=1,4 Гц); 8,16 (dt, 1H, J=8,4 Гц; J=1,4 Гц). 2d) Трет-бутил 3-[(1-оксо-3,4-дигідропіразино[1,2-b]індазол-2(1H)-іл)-метил]-піперидин-1карбоксилат Продукт одержують слідуючи способу, описаному у прикладі 1d), але використовуючи третбутил 3-{[(метилсульфоніл)окси]метил}-піперидин-1-карбоксилат як реагент. Таким чином, отримують 3,8 г трет-бутил 3-[(1-оксо-3,4-дигідропіразино[1,2-b]індазол-2(1H)-іл)метил]піперидин-1-карбоксилату. 1 H-ЯМР (200 MГц, CDCl3) δ: 1,20 – 1,45 (m, 1H); 1,43 (s, 3H); 1,55 – 2,10 (m, 4H); 2,65 – 3,05 (m, 2H); 3,30 – 3,75 (m, 2H); 3,75 – 4,05 (m, 2H); 3,90 (t, 2H, J=6,1 Гц); 4,72 (t, 2H, J=6,1 Гц); 7,25 – 7,45 (m, 2H); 7,76 (dt, 1H, J=8,4 Гц; J=1,1 Гц); 8,15 (dt, 1H, J=8,0 Гц; J=1,3 Гц). 2e) 2-({1-[2-(4-фторфеніл)етил]піперидин-3-іл}метил)-3,4-дигідро-піразино[1,2-b]індазол1(2H)-он Розчин 1,25M HCl у етанолі (4,8 мл; 0,006 моль) додають до розчину, що містить трет-бутил 3-[(1-оксо-3,4-дигідропіразино[1,2-b]індазол-2(1H)-іл)метил]піперидин-1-карбоксилат (0,77 г; 0,002 моль) у етилацетаті (7 мл), що продовжують перемішувати при кімнатній температурі. Отриману таким чином суміш тримають при перемішуванні при кімнатній температурі впродовж 2 годин, потім розчинник видаляють шляхом випарювання при зниженому тиску. Отриманий таким чином залишок переносять у етилацетат (5 мл) та фільтрують. Твердий продукт розчиняють за допомогою 1-(2-брометил)-4-фторбензолу (0,81 г; 0,004 моль) у безводному ДМФА (10 мл). Карбонат цезію (1,95 г; 0,006 моль) додають до отриманого розчину, що продовжують перемішувати при кімнатній температурі. Потім цю суміш тримають при енергійному перемішуванні при кімнатній температурі впродовж 48 годин та потім обробляють шляхом додавання води (20 мл) та етилацетату (25 мл). Водну фазу екстрагують кілька разів етилацетатом (3 × 20 мл) та органічні фази, зібрані разом, сушать на Na 2SO4. Розчинник потім видаляють шляхом випарювання при зниженому тиску та залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш гексан:етилацетат у співвідношенні 7:3 як елюент. Таким чином, отримують 170 мг 2-({1-[2-(4-фторфеніл)етил]піперидин-3-іл}метил)-3,4дигідропіразино[1,2-b]індазол-1(2H)-ону. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 8,00 (d, J=8,48 Гц; 1H), 7,75 (d, J=8,77 Гц; 1H); 7,31 – 7,41 (m, 1H); 7,18 – 7,30 (m, 3H); 6,99 – 7,11 (m, 2H); 4,70 (t, J=6,14 Гц; 2H), 3,88 (t, J=6,14 Гц; 2H), 3,32 – 3,56 (m, 2H); 2,63 – 2,86 (m, 4H); 2,39 – 2,47 (m, 2H); 1,79 – 2,11 (m, 3H); 1,67 (d, J=10,23 Гц; 2H); 1,35 – 1,53 (m, 1H);1,03 (d, J=9,35 Гц; 1H). Приклад 5 2-({1-[2-(2-фторфеніл)етил]піперидин-3-іл}метил)-3,4-дигідропіразино[1,2-b]індазол-1(2H)ону гідрохлорид Продукт одержують слідуючи способу, описаному у прикладі 2e), але використовуючи 1-(2брометил)-2-фторбензол як реагент. Бажаний продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлорoформ:метанол у співвідношенні 9:1 як елюент. Таким чином, отримують 350 мг 2-({1-[2-(2-фторфеніл)етил]піперидин-3-іл}метил)-3,4дигідропіразино[1,2-b]індазол-1(2H)-ону гідрохлориду. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 10,81 (bs, 1H); 8,00 (dt, J=1,16; 8,26 Гц; 1H); 7,76 (d, J=8,59 Гц; 1H); 7,09 – 7,42 (m, 6H); 4,71 – 4,81 (m, 2H); 3,93 (t, J=6,28 Гц; 2H); 3,48 – 3,70 (m, 3H); 3,06 – 3,46 (m, 5H); 2,67 – 3,00 (m, 2H); 2,36 – 2,47 (m, 1H); 1,66 – 2,05 (m, 3H); 1,05 – 1,39 (m, 1H). Приклад 8 2-({1-[2-(2-фторфеніл)етил]піперидин-4-іл}метил)-3,4-дигідропіразино[1,2-b]індазол-1(2H)-он Продукт одержують слідуючи способу, описаному у прикладі 2e), але використовуючи третбутил 4-[(1-оксо-3,4-дигідропіразино[1,2-b]індазол-2(1H)-іл)метил]піперидин-1-карбоксилат (отриманий у прикладі 1d) та 1-(2-брометил)-2-фторбензол як реагенти. Бажаний продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлорoформ:метанол у співвідношенні 95:5 як елюент. Таким чином, отримують 160 мг 2-({1-[2-(2-фторфеніл)етил]піперидин-4-іл}метил)-3,4дигідропіразино[1,2-b]індазол-1(2H)-ону. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 8,00 (d, J=8,18 Гц; 1H); 7,74 (d, J=8,48 Гц; 1H); 7,17 – 7,41 (m, 4H); 7,05 – 7,16 (m, 2H); 4,70 (t, J=6,30 Гц, 2H); 3,90 (t, J=6,30 Гц; 2H); 3,41 (d, J=7,02 Гц; 2H); 2,91 11 UA 108747 C2 5 10 15 20 25 30 35 40 45 50 55 (d, J=10,52 Гц; 2H); 2,76 (t, J=7,50 Гц; 2H), 1,86 – 2,06 (m, 2H); 1,55 – 1,83 (m, 3H); 1,12 – 1,37 (m, 2H). Приклад 10 2-({1-[2-(4-фторфеніл)етил]піперидин-3-іл}метил)-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2b]індазол-1-ону дигідрохлорид 10a) трет-бутил-3-бромпропілкарбамат Продукт отримують, використовуючи спосіб, описаний у прикладі 2a), використовуючи 3бромпропан-1-амін як реагент. Цей продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш гексан:етилацетат у співвідношенні 95:5 як елюент. Таким чином, отримують 1,77 г трет-бутил-3-бромпропілкарбамату. 1 H-ЯМР (200 MГц, CDCl3) δ: 1,41 (s, 9H); 2,02 (qn, 2H, J=6,5 Гц); 3,24 (t, 2H, J=6,5 Гц); 3,41 (t, 2H, J=6,5); 4,7 (bs, 1H). 10b) Метил 2-[3-(трет-бутоксикарбоніламін)пропіл]-2H-індазол-3-карбоксилат Продукт отримують, використовуючи спосіб, описаний у прикладі 2b), використовуючи третбутил-3-бромпропілкарбамат як реагент. Цей продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш гексан:етилацетат у співвідношенні 7:3 як елюент. Таким чином, отримують 3,13 г метил 2-[3-(трет-бутоксикарбоніламін)пропіл]-2H-індазол-3карбоксилату. 1 H-ЯМР (200 MГц, CDCl3) δ: 1,43 (s, 9H); 2,16 (qn, 2H, J=6,5 Гц); 3,10 (q, 2H, J=6,5 Гц); 4,03 (s, 3H); 4,97 (t, 2H, J=6,5 Гц); 4,90-5,10 (bs, 1H); 7,20-7,40 (m, 2H); 7,76 (dt, 1H, J=8,3 Гц; J=1,1 Гц); 8,01 (dt, 1H, J=7,3 Гц; J=1,3 Гц). 10c) 2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-он Продукт отримують, використовуючи спосіб, описаний у прикладі 2c), використовуючи метил 2-[3-(трет-бутоксикарбоніламін)пропіл]-2H-індазол-3-карбоксилат як реагент. Цей продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш пентан:діетиловий ефір у співвідношенні 95:5 як елюент. Таким чином, отримують 3,5 г 2,3,4,5тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-ону. 1 H-ЯМР (200 MГц, CDCl3) δ: 2,42 (qn, 2H, J=6,6 Гц); 3,43 (q, 2H, J=6,6 Гц); 4,82 (t, 2H, J=6,6 Гц); 6,38 (bs, 1H); 7,20-7,45 (m, 2H); 7,74 (dt, 1H, J=8,4 Гц; J=1,2 Гц); 8,06 (dt, 1H, J=8,4 Гц; J=1,4 Гц). 10d) Трет-бутил 3-[(1-оксо-4,5-дигідро-1H-[1,4]діазепіно[1,2-b]індазол-2(3H)іл)метил]піперидин-1-карбоксилат Продукт отримують, використовуючи спосіб, описаний у прикладі 1d), використовуючи 2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-он та трет-бутил 3{[(метилсульфоніл)окси]метил}піперидин-1-карбоксилат як реагенти. Таким чином, отримують 3,6 г трет-бутил 3-[(1-оксо-4,5-дигідро-1H-[1,4]діазепіно[1,2-b]індазол-2(3H)-іл)метил]піперидин1-карбоксилату. 1 H-ЯМР (200 MГц, CDCl3) δ: 1,15 – 1,40 (m, 1H); 1,44 (s, 3H); 1,50 – 2,10 (m, 4H); 2,45 (qn, 2H, J=6,7 Гц); 2,55 – 2,95 (m, 2H); 3,40 – 3,70 (m, 1H); 3,45 (t, 2H, J=6,7 Гц); 3,80 – 4,15 (m, 3H); 4,77 (t, 2H, J=6,7 Гц); 7,15 – 7,40 (m, 2H); 7,72 (dt, 1H, J=8,6 Гц; J=1,0 Гц); 7,94 (dt, 1H, J=8,3 Гц; J=1,2 Гц). 10e) 2-({1-[2-(4-фторфеніл)етил]піперидин-3-іл}метил)-2,3,4,5-тетрагідро-1H[1,4]діазепіно[1,2-b]індазол-1-ону дигідрохлорид Продукт отримують, використовуючи спосіб, описаний у прикладі 2e), використовуючи третбутил 3-[(1-оксо-4,5-дигідро-1H-[1,4]діазепіно[1,2-b]індазол-2(3H)-іл)метил]піперидин-1карбоксилат як реагент. Амінний продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлорoформ:метанол у співвідношенні 9:1 як елюент. Очищений продукт розчиняють у суміші діетиловий ефір:етанол у співвідношенні 10:1 (10 мл) та обробляють при кімнатній температурі за допомогою 3M HCl у етанолі (0,33 мл). Утворену таким чином тверду речовину фільтрують та кристалізують з суміші ізопропанол:діізопропіловий ефір у співвідношенні 8:2. Таким чином, отримують 188 мг 2-({1-[2-(4фторфеніл)етил]піперидин-3-іл}метил)-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-ону дигідрохлориду. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 11,24 (bs, 1H); 10,96 (bs, 1H); 7,79 – 7,86 (m, 1H); 7,70 (d, J=8,59 Гц; 1H); 7,25 – 7,41 (m, 3H); 7,01 – 7,25 (m, 3H); 4,64 – 4,88 (m, 2H); 3,00 – 3,85 (m, 10H); 2,67 – 2,97 (m, 2H); 2,53 – 2,65 (m, 1H); 2,24 – 2,43 (m, 1H); 1,80 – 2,04 (m, 3H); 1,14 – 1,39 (m, 1H). Приклад 13 12 UA 108747 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-({1-[2-(2-фторфеніл)етил]піперидин-3-іл}метил)-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2b]індазол-1-ону дигідрохлорид Продукт отримують, використовуючи спосіб, описаний у прикладі 10e), використовуючи 1-(2брометил)-2-фторбензол як реагент. Амінний продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлороформ:метанол у співвідношенні 9:1 як елюент. Кінцевий продукт натомість очищують шляхом кристалізації з суміші ізопропанол:діізопропіловий ефір у співвідношенні 8:2. Таким чином, отримують 163 мг 2-({1-[2(2-фторфеніл)етил]піперидин-3-іл}метил)-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1ону дигідрохлориду. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 11,19 (bs, 1H); 10,40 (bs, 1H); 7,83 (d, J=8,26 Гц; 1H); 7,70 (d, J=8,92 Гц; 1H); 7,25 – 7,45 (m, 3H); 7,11 – 7,24 (m, 3H); 4,59 – 4,91 (m, 2H); 3,04 – 3,86 (m, 10H); 2,68 – 3,04 (m, 2H); 2,54 – 2,63 (m, 1H); 2,21 – 2,44 (m, 1H); 1,79 – 2;05 (m, 3H); 1,15 – 1,37 (m, 1H). Приклад 16 2-({1-[2-(4-фторфеніл)етил]піперидин-4-іл}метил)-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2b]індазол-1-ону гідрохлорид 16a) Трет-бутил 4-((1-оксо-4,5-дигідро-1H-[1,4]діазепіно[1,2-b]індазол-2(3H)іл)метил)піперидин-1-карбоксилат Продукт отримують, використовуючи спосіб, описаний у прикладі 1d), використовуючи 2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-он як реагент. Цей продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш пентан:діетиловий ефір у співвідношенні 95:5 як елюент. Таким чином, отримують 3,40 г трет-бутил 4-((1-оксо-4,5-дигідро1H-[1,4]діазепіно[1,2-b]індазол-2(3H)-іл)метил)-піперидин-1-карбоксилату. 1 H-ЯМР (200 MГц, CDCl3) δ: 2,41 (s, 3H); 7,26 (d, 2H, J=8,1 Гц); 7,45 (d, 2H, J=8,1 Гц); 7,57 (d, 1H, J=13,6 Гц); 7,99 (d, 1H, J=13,6 Гц). 16b) 2-({1-[2-(4-фторфеніл)етил]піперидин-4-іл}метил)-2,3,4,5-тетрагідро-1H[1,4]діазепіно[1,2-b]індазол-1-ону гідрохлорид Продукт отримують, використовуючи спосіб, описаний у прикладі 10e), використовуючи третбутил 4-[(1-оксо-4,5-дигідро-1H-[1,4]діазепіно[1,2-b]індазол-2(3H)-іл)метил]піперидин-1карбоксилат як реагент. Амінний продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлорoформ:метанол у співвідношенні 95:5 як елюент. Кінцевий продукт натомість очищують з суміші ізопропанол:діізопропіловий ефір у співвідношенні 4:6. Таким чином, отримують 167 мг 2-({1-[2-(4-фторфеніл)етил]піперидин-4іл}метил)-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-ону гідрохлориду. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 10,63 (bs, 1H); 7,82 (d, J=8,59 Гц; 1H), 7,70 (d, J=8,92 Гц; 1H); 7,25 – 7,40 (m, 3H); 7,10 – 7,25 (m, 3H); 4,72 (t, J=6,94 Гц; 2H); 3,45 – 3,70 (m, 4H); 3,43 (t, J=6,44 Гц; 2H); 2,75 – 3,35 (m, 7H); 2,37 (q, J=6,69 Гц; 2H); 1,85 – 2,10 (m, 3H); 1,50 – 1,85 (m, 2H). Приклад 17 2-({1-[2-(4-фторфеніл)етил]піперидин-4-іл}метил)-3,4,7,8,9,10-езагідропіразино[1,2-b]індазол1(2H)-ону гідрохлорид 17a) Трет-бутил 4-[(1-оксо-3,4,7,8,9,10-езагідропіразино[1,2-b]індазол-2(1H)іл)метил]піперидин-1-карбоксилат Продукт отримують, використовуючи спосіб, описаний у прикладі 1d), використовуючи 3,4,7,8,9,10-езагідропіразино[1,2-b]індазол-1(2H)-он як реагент. Сирий продукт використовують для наступної реакції без додаткових стадій очищення. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 4,17 – 4,28 (m, 2H); 3,92 (d, J=12,86 Гц; 2H); 3,66 – 3,77 (m, 2H); 3,26 – 3,35 (m, 2H); 2,59 – 2,72 (m, 4H); 2,55 (t, J=5,85 Гц, 2H); 1,77 – 1,93 (m, 1H); 1,53 – 1,76 (m, 6H); 1,39 (s, 9H); 1,02 (dd, 2H). 17b) 2-({1-[2-(4-фторфеніл)етил]піперидин-4-іл}метил)-3,4,7,8,9,10-езагідро-піразино[1,2b]індазол-1(2H)-ону гідрохлорид Продукт отримують, використовуючи спосіб, описаний у прикладі 2e), використовуючи третбутил 4-[(1-оксо-3,4,7,8,9,10-езагідропіразино[1,2-b]індазол-2(1H)-іл)метил]піперидин-1карбоксилат як реагент. Цей продукт очищують шляхом кристалізації з суміші ізопропанол:діізопропіловий ефір. Таким чином, отримують 0,2 г 2-({1-[2-(4фторфеніл)етил]піперидин-4-іл}метил)-3,4,7,8,9,10-езагідропіразино[1,2-b]індазол-1(2H)-ону гідрохлориду. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 10,47 (bs, 1H); 7,26 – 7,40 (m, 2H); 7,10 – 7,23 (m, 2H); 4,19 – 4,32 (m, 2H); 3,73 (t, J=5,95 Гц, 2H); 3,46 – 3,59 (m, 2H); 3,35 (d, J=6,61 Гц; 2H); 3,12 – 3,27 (m, 2H); 2,98 – 3,11 (m, 2H); 2,77 – 2,96 (m, 2H); 2,65 (t, J=5,78 Гц; 2H); 2,56 (t, J=5,78 Гц; 2H); 1,44 – 2,05 (m, 9H). 13 UA 108747 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 20 2-[(1-фенетилпіперидин-4-іл)метил]-3,4-дигідропіразино[1,2-b]індазол-1(2H)-ону гідрохлорид Продукт отримують, використовуючи спосіб, описаний у прикладі 10e), використовуючи третбутил 4-[(1-оксо-3,4-дигідропіразино[1,2-b]індазол-2(1H)-іл)метил]піперидин-1-карбоксилат (приклад 1d) та фенетил-бромід як реагенти. Амінний продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлороформ:метанол у співвідношенні 85:15 як елюент. Кінцевий продукт натомість очищують шляхом кристалізації з суміші ізопропанол:діізопропіловий ефір у співвідношенні 3:7. Таким чином, отримують 121 мг 2-[(1фенетилпіперидин-4-іл)метил]-3,4-дигідропіразино[1,2-b]індазол-1(2H)-ону гідрохлориду. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 10,84 (bs, 1H); 8,01 (d, J=8,26 Гц; 1H); 7,76 (d, J=8,59 Гц; 1H); 7,13 – 7,44 (m, 7H); 4,75 (t, J=6,11 Гц; 2H); 3,94 (t, J=6,11 Гц; 2H), 3,51 – 3,67 (m, 2H); 3,47 (d, J=6,94 Гц; 2H); 3,01 – 3,39 (m, 6H); 2,78 – 3,02 (m, 2H); 1,81 – 2,28 (m, 3H); 1,53 – 1,79 (m, 2H). Приклад 22 2-[(1-фенетилпіперидин-4-іл)метил]-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-он Продукт отримують, використовуючи спосіб, описаний у прикладі 2e), використовуючи третбутил 4-[(1-оксо-4,5-дигідро-1H-[1,4]діазепіно[1,2-b]індазол-2(3H)-іл)метил]піперидин-1карбоксилат (приклад 16a) та фенетил-бромід як реагенти. Цей продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлороформ:метанол у співвідношенні 95:5 як елюент. Таким чином, отримують 223 мг 2-[(1-фенетилпіперидин-4іл)метил]-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-ону. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 7,82 (d, J=8,18 Гц; 1H); 7,69 (d, J=8,48 Гц; 1H); 7,07 – 7,40 (m, 7H); 4,68 (t, J=7,02 Гц; 2H); 3,34 – 3,55 (m, 4H); 2,94 (d, J=11,40 Гц; 2H); 2,65 – 2,79 (m, 2H); 2,33 (qn, J=6,65 Гц; 2H); 1,97 (t, J=10,82 Гц; 2H); 1,59 – 1,83 (m, 3H); 1,15 – 1,37 (m, 2H). Приклад 25 2-{[1-(фенілацетил)піперидин-4-іл]метил}-3,4-дигідропіразино[1,2-b]індазол-1(2H)-он Продукт отримують, використовуючи спосіб, описаний у прикладі 2e), використовуючи третбутил 4-[(1-оксо-3,4-дигідропіразино[1,2-b]індазол-2(1H)-іл)метил]піперидин-1-карбоксилат (приклад 1d) та бензол ацетил-хлорид як реагенти. Цей продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлорoформ:метанол у співвідношенні 9:1 як елюент. Таким чином, отримують 104 мг 2-{[1-(фенілацетил)піперидин-4-іл]метил}-3,4дигідропіразино[1,2-b]індазол-1(2H)-ону. 1 H-ЯМР (200 MГц, CDCl3) δ: 0,85 – 1,15 (m, 1H); 1,15 – 1,35 (m, 1H); 1,85 – 2,15 (m, 1H); 2,61 (td, 1H, J=13,2 Гц; J=2,8 Гц); 2,95 (td, 1H, J=13,2 Гц; J=2,8 Гц); 3,39 (dd, 1H, J=13,7 Гц; J=6,9 Гц); 3,54 (dd, 1H, J=13,7 Гц; J=7,5 Гц); 3,73 (s, 2H); 3,75-4,05 (m, 2H); 3,84 (t, 2H, J=6,3 Гц); 3,86 (d, 2H, J=6,3 Гц); 4,67 (t, 2H, J=6,3 Гц); 7,10 – 7,45 (m, 7H); 7,76 (dt, 1H, J=8,3 Гц; J=1,1Гц); 8,14 (dt, 1H, J=8,2 Гц; J=1,1 Гц). Приклад 26 2-{[1-(фенілацетил)піперидин-4-іл]метил}-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол1-он Продукт отримують, використовуючи спосіб, описаний у прикладі 2e), використовуючи третбутил 4-[(1-оксо-4,5-дигідро-1H-[1,4]діазепіно[1,2-b]індазол-2(3H)-іл)метил]піперидин-1карбоксилат (приклад 16a) та бензолацетил-хлорид як реагенти. Цей продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлорoформ:метанол у співвідношенні 9:1 як елюент. Таким чином, отримують 141 мг 2-{[1-(фенілацетил)піперидин-4іл]метил}-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-ону. 1 H-ЯМР (200 MГц, CDCl3) δ: 0,85 – 1,45 (m, 2H); 1,85 – 2,15 (m, 1H); 2,39 (qn, 2H, J=6,7 Гц); 2,64 (td, 1H, J=12,5 Гц; J=2,2 Гц); 2,98 (td, 1H, J=12,5 Гц; J=2,2 Гц); 3,25 – 3,45 (m, 4H); 3,50 – 3,70 (m, 1H); 3,75 (s, 2H); 3,89 (bd, 2H, J=14,2 Гц); 4,50 – 4,80 (m, 2H); 4,67 (t, 2H, J=7,1 Гц); 7,10 – 7,45 (m, 7H); 7,72 (dt, 1H, J=8,6 Гц; J=1,1 Гц); 7,93 (dt, 1H, J=8,2 Гц; J=1,1 Гц). Приклад 28 2-[3-(4-фенілпіперидин-1-іл)пропіл]-3,4-дигідропіразино[1,2-b]індазол-1(2H)-он гідрохлорид 28a) 1-(3-хлорoпропіл)-4-фенілпіперидин Твердий карбонат цезію (195 г; 0,6mмоль) додають до розчину 4-фенілпіперидину (32 г; 0,2 моль), 1-бром-3-хлорoпропану (40 мл; 0,4 ммоль) у безводному ДМФА (300 мл), що продовжують перемішувати при кімнатній температурі. Цю суміш тримають при перемішуванні при цій же температурі впродовж 12 годин. Воду (1000 мл) та етилацетат (500 мл) додають для припинення реакції. Після розділення фаз, водну фазу екстрагують кілька разів етилацетатом (3 × 500 мл). Органічні фази, зібрані разом, промивають відповідно водою (100 мл) та насиченим розчином NaCl (100 мл), та потім сушать на безводному Na 2SO4. Розчинник видаляють шляхом випарювання при зниженому тиску та залишок очищують за допомогою флеш хроматографії на 14 UA 108747 C2 5 10 15 20 25 30 35 40 45 50 55 60 силікагелі, використовуючи суміш гексан:етилацетат у співвідношенні 1:1 як елюент. Таким чином, 29,5 г 1-(3-хлорoпропіл)-4-фенілпіперидину отримують у вигляді безбарвного масла. 1 H-ЯМР (200 MГц, CDCl3) δ: 1,75 – 1,90 (m, 2H); 1,90 – 2,15 (m, 6H); 2,35 – 2,65 (m, 3H); 3,02 (bd, 2H, J=6,4 Гц); 3,64 (t, 2H, J=6,4 Гц); 7,05 – 7,45 (m, 5H). 28b) 2-[3-(4-фенілпіперидин-1-іл)пропіл]-3,4-дигідропіразино[1,2-b]індазол-1(2H)-ону гідрохлорид Розчин 3,4-дигідропіразино[1,2-b]індазол-1(2H)-ону (375 мг; 2,0 ммоль) у суміші тетрагідрофуран:диметилформамід (ДМФА) у співвідношенні 1:1 (4 мл) додають краплинним способом до суспензії NaH 55 % у мінеральному маслі (104 мг; 2,4 ммоль) у безводному тетрагідрофурані (ТГФ), що продовжують перемішувати при кімнатній температурі у атмосфері аргону. Цю суміш тримають при перемішуванні при цій же температурі у інертній атмосфері впродовж 1 години; потім, повільно додають розчин 1-(3-хлорoпропіл)-4-фенілпіперидину (4,4 г; 0,015 моль) у ДМФА (25 мл). Після закінчення додавання, суміш нагрівають при температурі зрошення впродовж 6 годин. Потім реакцію зупиняють шляхом охолодження суміші до кімнатної температури та шляхом додавання етилацетату (10 мл). Потім цю суміш фільтрують через силікагелевий фільтр, далі розчинник видаляють шляхом випарювання при зниженому тиску. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлороформ:метанол у співвідношенні 9:1 як елюент. Очищений таким чином продукт розчиняють у суміші діетиловий ефір:етанол у співвідношенні 10:1 (10 мл) та обробляють при кімнатній температурі за допомогою 3M HCl у етанолі (0,33 мл). Утворену таким чином тверду речовину фільтрують та кристалізують з суміші ізопропанол:діізопропіловий ефір у співвідношенні 1:1. Таким чином, отримують 197 мг 2-[3-(4-фенілпіперидин-1-іл)пропіл]-3,4дигідропіразино[1,2-b]індазол-1(2H)-ону гідрохлориду. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 10,88 (bs, 1H); 8,02 (dt, J=1,16 Гц; J=8,26 Гц; 1H); 7,77 (dt, J=0,93 Гц; J=8,55 Гц; 1H); 7,18 – 7,42 (m, 7H); 4,74 – 4,81 (m, 2H); 3,89 – 4,03 (m, 2H); 3,65 (t, J=6,44 Гц; 2H); 3,57 (d, J=11,72 Гц; 2H); 2,92 – 3,18 (m, 4H); 2,70 – 2,87 (m, 1H); 2,01 – 2,26 (m, 4H); 1,94 (d, J=12,55 Гц; 2H). Приклад 31 2-[3-(4-фенілпіперидин-1-іл)пропіл]-2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-ону гідрохлорид Продукт отримують, використовуючи спосіб, описаний у прикладі 28b), використовуючи 2,3,4,5-тетрагідро-1H-[1,4]діазепіно[1,2-b]індазол-1-он (приклад 10c) як реагент. Амінний продукт очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш хлороформ:етанол у співвідношенні 85:15 як елюент. Кінцевий продукт натомість очищують шляхом кристалізації з суміші ізопропанол:діізопропіловий ефір у співвідношенні 1:1. Таким чином, отримують 317 мг 2-[3-(4-фенілпіперидин-1-іл)пропіл]-2,3,4,5-тетрагідро-1H[1,4]діазепіно[1,2-b]індазол-1-ону гідрохлориду. 1 H-ЯМР (300 MГц, ДМСО-d6) δ: 10,94 (bs, 1H); 7,84 (dt, J=1,11 Гц; J=8,34 Гц; 1H); 7,71 (dt, J=0,97 Гц; J=8,63 Гц; 1H); 7,29 – 7,40 (m, 3H); 7,16 – 7,29 (m, 4H); 4,73 (t, J=7,02 Гц; 2H); 3,55 – 3,73 (m, 5H); 3,44 (t, J=6,36 Гц; 2H); 2,97 – 3,21 (m, 4H); 2,83 (tt, J=3,63 Гц; J=12,14 Гц; 1H); 2,42 (qn, J=6,65 Гц; 2H); 2,04 – 2,26 (m, 4H); 1,96 (d, J=13,87 Гц; 2H). Фармакологія Фармакологічні властивості сполук формули (I) відповідно до даного винаходу оцінюють за допомогою способів, описаних у наступних розділах Дослідження A, B та C. Дослідження A (in vitro) Афінність сполук формули (I) відповідно до даного винаходу до людського рекомбінантного 5-HT2A серотонінового рецептору продемонстрована за допомогою стандартного способу Bonhaus DW, Bach C, DeSouza A, Rich Salazar FH, Matsuoka BD, Zuppan P, Chan HW та Eglen RM (1995) у "The pharmacology and distribution of human 5-hydroxytryptamine 2B (5-HT2B) receptor gene products: comparison with 5-HT2A and 5-HT2C receptors". Br. J. Pharmacol. 115: 622 – 628. Зокрема, зв'язування з людським 5-HT2A серотоніновим рецептором проводять, використовуючи, як вихідний матеріал, препарат мембран зі стійкої рекомбінантної CHO-K1 клітинної лінії, що експресує людський 5-HT2A рецептор. 3 Дослідження заміщення проводять, використовуючи 0,5 нM [ H]-кетансерін як радіоліганд. Цю концентрацію вибирають на основі досліджень насичення, що дає можливість отримати Bmax 0,51 пмоль/мг білку та Kd 0,2 нM. Неспецифічне зв'язування вимірюють у присутності 1 мкM міансеріну. Це тестування проводять у Tris-HCl 50 мM буфері (pH 7,4 при 37 °C), з інкубуванням впродовж 1 години при 25 °C. Дослідні сполуки розчиняють у ДМСО, потім розводять у буфері (кінцева ДМСО концентрація 0,01 %) та поміщають на 96-лункові планшети. Ці сполуки досліджують у двох 15 UA 108747 C2 5 10 повторах на 8-точковій кривій залежності концентрація - відповідь (у логарифмічній шкалі, що -12 -5 змінюється у інтервалі від 10 до 10 M). Кетансерін використовують як еталонну сполуку. Після інкубування, мембрани фільтрують на скляних фільтрах (GF/B) (Unifilter, Packard), оброблених за допомогою 0,5 % поліетиленіміну. Потім ці фільтри промивають буферним розчином та сушать у печі впродовж 30 хвилин при 45 °C. Сцинтиляційну рідину додають до кожної лунки та щонайменше через 16 годин радіоактивність вимірюють впродовж 1 хвилини, використовуючи TopCount (Packard). IC50 значення для кожної сполуки розраховують, використовуючи нелінійне регресивне дослідження (GraphPad PRISM програмне забезпечення) та константи інгібування Ki визначають, використовуючи рівняння, описане Cheng Y. та Prussof W.H. (1973) "Relationship between the inhibition constant (Ki) and the concentration of inhibitor which causes 50 percent inhibition (I50) of an enzyme reaction." Biochem. Pharmacol. 22: 3099-3108. Значення афінності типових сполук формули (I) відповідно до даного винаходу до 5-HT2A рецептору показані у Таблиці 2, у якій афінність є більшою для вищого значення пKi. 15 ТАБЛИЦЯ 2 Сполука (№) 1 2 5 8 10 13 16 17 20 22 28 31 Кетансерін 20 25 30 35 5-HT2A (пKi) 7,71 5,94 6,16 8,74 6,56 6,59 8,14 7,53 7,78 7,68 7,13 7,34 9,65 Дослідження B (in vitro) Афінність сполук формули (I) відповідно до даного винаходу до 5-HT2С серотонінового рецептору продемонстрована за допомогою стандартного способу, описаного Wolf W.A. та Schutz J.S. (1997) у "The serotonin 5-HT2C receptor is a prominent serotonin receptor in basal ganglia: evidence from functional studies on serotonin-mediated phosphoinositide hydrolysis." J. Neurochem. 69: 1449-1458. Зокрема, зв'язування з людським серотоніновим 5-HT2C рецептором проводять, використовуючи, як вихідний матеріал, препарат мембран зі стійкої рекомбінантної CHO-K1 клітинної лінії, що експресує людський 5-HT2С рецептор. 3 Дослідження заміщення проводять, використовуючи 1 нM [ H]-мезулергін як радіоліганд. Цю концентрацію вибирають на основі досліджень насичення, що дає можливість отримати Bmax 4,9 пмоль/мг білку та Kd 1,1 нM. Неспецифічне зв'язування вимірюють у присутності 1 мкM міансеріну. Це тестування проводять у Tris-HCl 50 мM буфері (pH 7,4 при 37 °C), 0,1 % аскорбінової кислоти, 10 мкM паргіліну, з інкубуванням впродовж 1 години при 25 °C. Дослідні сполуки розчиняють у ДМСО, потім розводять у буфері (кінцева ДМСО концентрація 0,01 %) та поміщають на 96-лункові планшети. Ці сполуки досліджують у двох повторах на 8-точковій кривій залежності -12 -5 концентрація - відповідь (у логарифмічній шкалі, що змінюється у інтервалі від 10 до 10 M). SB 242084 використовують як еталонну сполуку. SB 242084 являє собою селективний антагоніст 5-HT2c серотонінового рецептору, вироблений та проданий фірмою Sigma-Aldrich, що має наступну структурну формулу: 16 UA 108747 C2 5 10 Після інкубування, мембрани фільтрують на скляних фільтрах (GF/B) (Unifilter, Packard), оброблених за допомогою 0,5 % поліетиленіміну. Потім ці фільтри промивають буферним розчином та сушать у печі впродовж 30 хвилин при 45 °C. Сцинтиляційну рідину додають до кожної лунки та щонайменше через 16 годин радіоактивність вимірюють впродовж 1 хвилини, використовуючи TopCount (Packard). IC50 значення для кожної сполуки розраховують, використовуючи нелінійне регресивне дослідження (GraphPad PRISM програмне забезпечення) та константи інгібування Ki визначають, використовуючи рівняння, описане Cheng Y. та Prussof W.H. (1973) "Relationship between the inhibition constant (Ki) and the concentration of inhibitor which causes 50 percent inhibition (I50) of an enzyme reaction." Biochem. Pharmacol. 22: 3099-3108. Значення афінності типових сполук формули (I) відповідно до даного винаходу до 5-HT2С рецепторів людських рекомбінантних клітин показані у Таблиці 3, у якій афінність є більшою для вищого значення пKi. ТАБЛИЦЯ 3 Сполука (№) 1 16 17 28 31 SB 242084 (л)5-HT2c (пKi) 5,77
ДивитисяДодаткова інформація
Назва патенту англійськоюTricyclic indazole compound, method of preparation and pharmaceutical composition containing it
Автори англійськоюAlisi, Maria Alessandra, Cazzolla, Nicola, Furlotti, Guido, Garrone, Beatrice, Magaro', Gabriele, Mangano, Giorgina
Автори російськоюАлиси Мария Алессандра, Каццолла Никола, Фурлотти Гвидо, Гарроне Беатриче, Магаро' Габриель, Мангано Джорджина
МПК / Мітки
МПК: A61P 25/22, A61P 1/00, A61P 9/12, A61P 25/18, A61P 25/06, C07D 487/04, A61K 31/4985, A61K 31/5517, A61P 7/02
Мітки: одержання, містить, фармацевтична, спосіб, індазольна, композиція, сполука, трициклічна, яка
Код посилання
<a href="https://ua.patents.su/23-108747-triciklichna-indazolna-spoluka-sposib-oderzhannya-ta-farmacevtichna-kompoziciya-yaka-mistit.html" target="_blank" rel="follow" title="База патентів України">Трициклічна індазольна сполука, спосіб одержання та фармацевтична композиція, яка її містить</a>
Попередній патент: Заміщені ізохінолінони та хіназолінони
Наступний патент: Кулачково-важільний механізм
Випадковий патент: Спосіб визначення впливу цинку на метаболічні процеси у постінфарктних хворих з цукровим діабетом 2 типу