Екзополісахарид бактерії shigella sonnei, спосіб його одержання та вакцина і фармацевтична композиція, що його містять
Номер патенту: 111845
Опубліковано: 24.06.2016
Автори: Апарін Пьотр Гєннадьєвіч, Шміголь Владімір Ігорєвіч, Йолкіна Станіслава Івановна, Головіна Маріна Едуардовна, Львов Вячєслав Лєонідовіч
Формула / Реферат
1. Полісахарид бактерії Shigella sonnei, фаза І, який включає від 1 до 100 повторюваних дисахаридних ланок O-[4-аміно-2-(N-ацетил)аміно-2,4-дидезокси-β-D-галактопіранозил]-(1—>4)-O-[2-(N-aцeтил)aмiнo-2-дeзoкcи-α-L-альтрпірануронової кислоти], сполучених у полісахаридний ланцюг (1—>3) зв'язками, і негідроксильовані жирні кислоти.
2. Полісахарид за п. 1, отриманий з використанням бактерій S. sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання.
3. Полісахарид за п. 2, отриманий з використанням бактерій S. sonnei способом, який включає: (а) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (с) виділення полісахариду з рідкої фази.
4. Полісахарид за п. 3, отриманий з використанням бактерій S. sonnei способом, в якому відділення рідкої фази від бактеріальних клітин здійснюють при збереженні нативності бактеріальних клітин.
5. Полісахарид за п. 1, який являє собою екзополісахарид, що продукується бактеріями S. sonnei, фаза І, в зовнішнє середовище.
6. Полісахарид за п. 5, який являє собою бактеріальний капсульний полісахарид.
7. Полісахарид за п. 1, в якому негідроксильовані жирні кислоти являють собою його нетоксичний ліпідний компонент.
8. Полісахарид за п. 1 або п. 7, в якому негідроксильовані жирні кислоти містять 16-18 вуглецевих атомів у молекулі.
9. Полісахарид за п. 1 або п. 7, або п. 8, в якому вміст негідроксильованих жирних кислот становить не менше 0,01 мас. %.
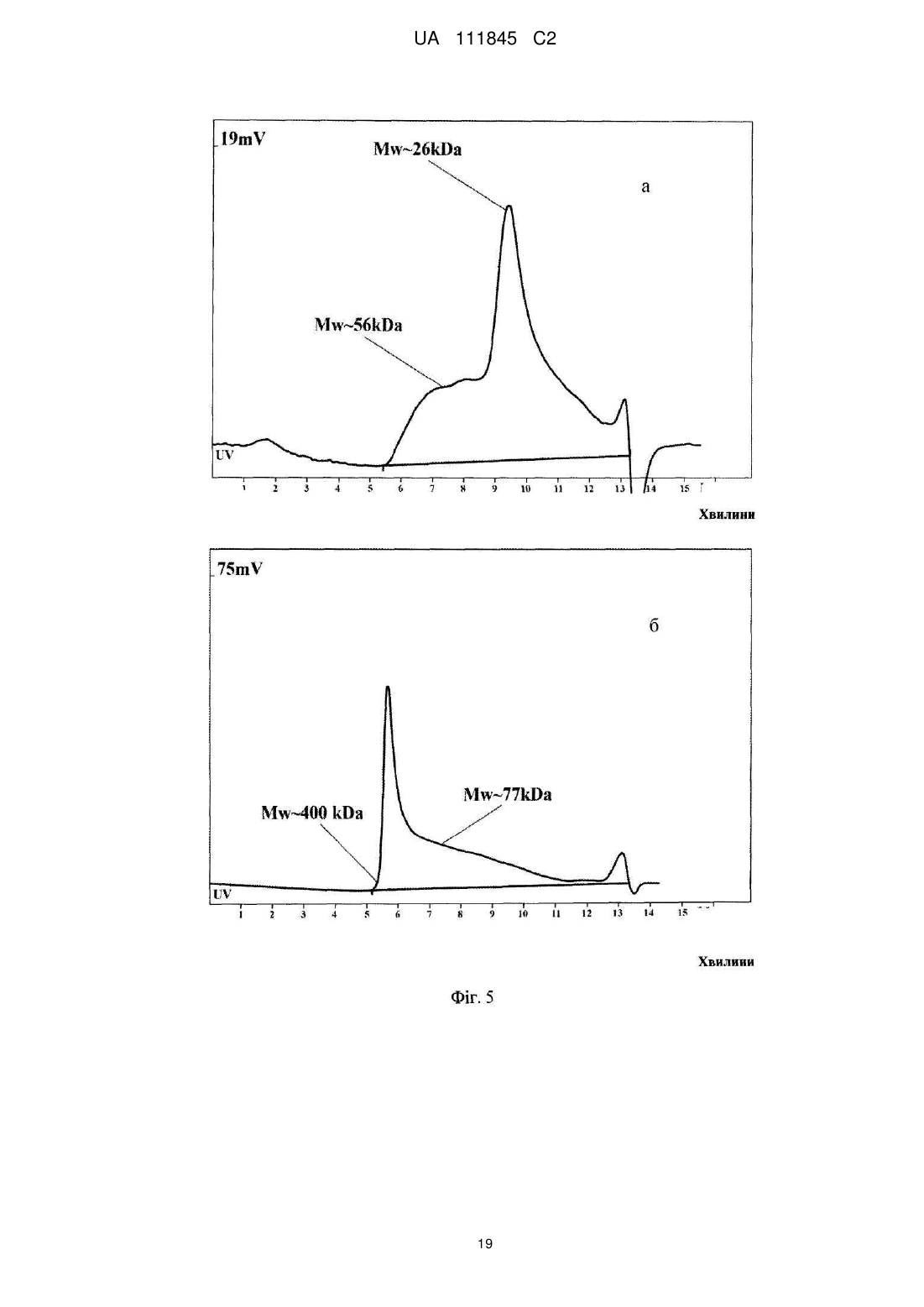
10. Полісахарид за будь-яким із пп. 1-9, молекулярна маса якого, виміряна методом гель-фільтрації, становить від 0,4 до 400 кДа.
11. Полісахарид за будь-яким із пп. 1-10, який містить не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот.
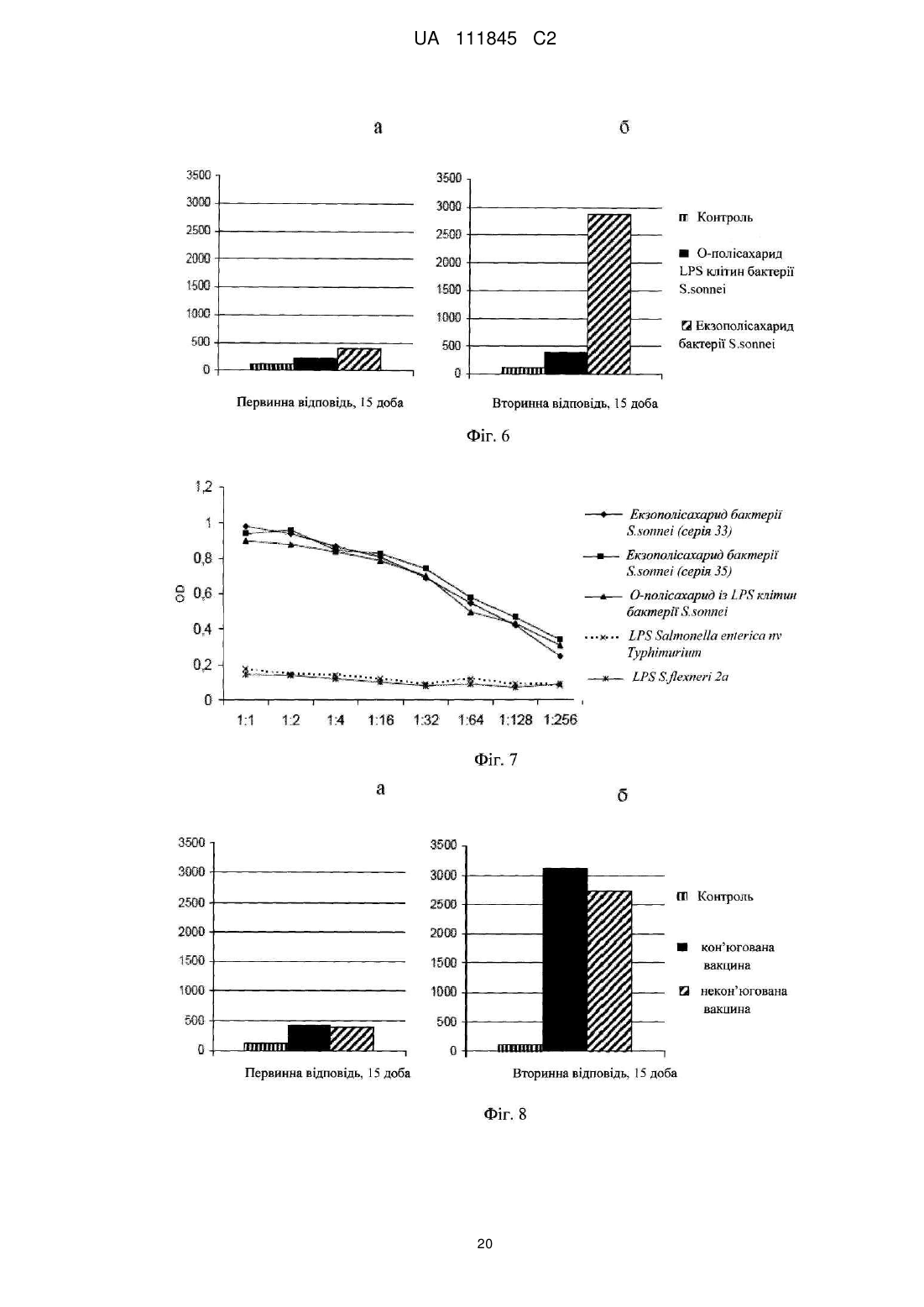
12. Полісахарид за будь-яким із пп. 1-11, який викликає мукозальний захист від шигельозу Зонне шляхом індукції синтезу специфічних антитіл проти бактерії S. sonnei, фаза І в організмі ссавців, включаючи людину.
13. Спосіб отримання полісахариду за п. 1, який включає використання бактерій S. sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання.
14. Спосіб за п. 13, який включає: (а) отримання культури бактерій S. sonnei в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (с) виділення полісахариду з рідкої фази.
15. Спосіб за п. 14, в якому відділення рідкої фази від бактеріальних клітин здійснюють при збереженні нативності бактеріальних клітин.
16. Спосіб за п. 14, в якому виділення полісахариду з рідкої фази включає: (і) видалення з рідкої фази білків і нуклеїнових кислот; (іі) ультрафільтрацію та (ііі) діаліз отриманого розчину.
17. Вакцина, яка включає ефективну кількість полісахариду за п. 1.
18. Вакцина за п. 17, в якій полісахарид отриманий з використанням бактерій S. sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання.
19. Вакцина за п. 18, в якій полісахарид отриманий з використанням бактерій S. sonnei способом, що включає: (а) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (с) виділення полісахариду з рідкої фази.
20. Вакцина за п. 19, в якій полісахарид отриманий з використанням бактерій S. sonnei способом, що включає відділення рідкої фази від бактеріальних клітин при збереженні нативності бактеріальних клітин.
21. Вакцина за п. 17, в якій полісахарид являє собою екзополісахарид, що продукується бактеріями S. sonnei, фаза І, у зовнішнє середовище.
22. Вакцина за п. 21, в якій полісахарид являє собою бактеріальний капсульний полісахарид.
23. Вакцина за п. 17, в якій негідроксильовані жирні кислоти полісахариду являють собою його нетоксичний ліпідний компонент.
24. Вакцина за п. 17 або п. 23, в якій негідроксильовані жирні кислоти полісахариду містять 16-18 вуглецевих атомів у молекулі.
25. Вакцина за п. 17 або п. 23, або п. 24, в якій вміст негідроксильованих жирних кислот у полісахариді становить не менше 0,01 мас. %.
26. Вакцина за будь-яким із пп. 17-25, в якій полісахарид має молекулярну масу, виміряну методом гель-фільтрації, від 0,4 до 400 кДа.
27. Вакцина за будь-яким із пп. 17-26, в якій полісахарид містить не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот.
28. Вакцина за будь-яким із пп. 17-27, в якій полісахарид викликає мукозальний захист від шигельозу Зонне шляхом індукції синтезу специфічних антитіл проти бактерії S. sonnei, фаза І в організмі ссавців, включаючи людину.
29. Вакцина за будь-яким із пп. 17-28, в якій полісахарид є апірогенним для кроля в дозі не більше 0,050 мкг/кг в тесті пірогенності на кролях.
30. Вакцина за будь-яким із пп. 17-29, яка включає фармацевтично допустимі добавки.
31. Вакцина за п. 30, в якій фармацевтично допустимі добавки вибрані з групи, що включає стабілізатори рН, консерванти, ад'юванти, ізотонізуючі агенти та їх комбінації.
32. Вакцина за будь-яким із пп. 17-31, в якій полісахарид міститься в некон'югованій формі.
33. Вакцина за п. 30, яка включає білковий носій як фармацевтично допустиму добавку.
34. Вакцина за п. 33, в якій білковий носій вибраний з групи, що включає дифтерійний анатоксин, правцевий анатоксин і екзопротеїн А Pseudomonas aeruginosa.
35. Вакцина за п. 33 або п. 34, в якій полісахарид міститься в кон'югованій формі.
36. Фармацевтична композиція, яка включає ефективну кількість полісахариду за п. 1.
37. Фармацевтична композиція за п. 36, в якій полісахарид отриманий з використанням бактерій S. sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання.
38. Фармацевтична композиція за п. 37, в якій полісахарид отриманий з використанням бактерій S. sonnei способом, що включає: (а) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (с) виділення полісахариду з рідкої фази.
39. Фармацевтична композиція за п. 38, в якій полісахарид отриманий з використанням бактерій S. sonnei способом, що включає відділення рідкої фази від бактеріальних клітин при збереженні нативності бактеріальних клітин.
40. Фармацевтична композиція за п. 36, в якій полісахарид являє собою екзополісахарид, що продукується бактеріями S. sonnei, фаза І, у зовнішнє середовище.
41. Фармацевтична композиція за п. 40, в якій полісахарид являє собою бактеріальний капсульний полісахарид.
42. Фармацевтична композиція за п. 36, в якій негідроксильовані жирні кислоти полісахариду являють собою його нетоксичний ліпідний компонент.
43. Фармацевтична композиція за п. 36 або п. 42, в якій негідроксильовані жирні кислоти полісахариду містять 16-18 вуглецевих атомів у молекулі.
44. Фармацевтична композиція за п. 36 або п. 42, або п. 43, в якій вміст негідроксильованих жирних кислот у полісахариді становить не менше 0,01 мас. %.
45. Фармацевтична композиція за будь-яким із пп. 36-44, в якій полісахарид має молекулярну масу, виміряну методом гель-фільтрації, від 0,4 до 400 кДа.
46. Фармацевтична композиція за будь-яким із пп. 36-45, в якій полісахарид містить не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот.
47. Фармацевтична композиція за будь-яким із пп. 36-46, в якій полісахарид є модулятором реакцій імунної системи ссавців, включаючи людину.
48. Фармацевтична композиція за будь-яким із пп. 36 -47, в якій полісахарид є апірогенним для кроля в дозі не більше 0,050 мкг/кг в тесті пірогенності на кролях.
49. Фармацевтична композиція за будь-яким із пп. 36-48, яка включає фармацевтично допустимі цільові добавки.
50. Фармацевтична композиція за п. 49, в якій цільові добавки вибрані з групи, що включає консерванти, стабілізатори, розчинники та їх комбінації.
51. Застосування полісахариду за п. 1 для виробництва фармацевтичного засобу.
52. Застосування за п. 51, в якому полісахарид отриманий з використанням бактерій S. sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання.
53. Застосування за п. 52, в якому полісахарид отриманий з використанням бактерій S. sonnei способом, що включає: (а) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (с) виділення полісахариду з рідкої фази.
54. Застосування за п. 53, в якому полісахарид отриманий з використанням бактерій S. sonnei способом, що включає відділення рідкої фази від бактеріальних клітин при збереженні нативності бактеріальних клітин.
55. Застосування за п. 51, в якому полісахарид являє собою екзополісахарид, що продукується бактеріями S. sonnei, фаза І, у зовнішнє середовище.
56. Застосування за п. 55, в якому полісахарид являє собою бактеріальний капсульний полісахарид.
57. Застосування за п. 51, в якому негідроксильовані жирні кислоти полісахариду являють собою його нетоксичний ліпідний компонент.
58. Застосування за п. 51 або п. 57, в якому негідроксильовані жирні кислоти полісахариду містять 16-18 вуглецевих атомів у молекулі.
59. Застосування за п. 51 або п. 57, або п. 58, в якому вміст негідроксильованих жирних кислот у полісахариді становить не менше 0,01 мас. %.
60. Застосування за будь-яким із пп. 51-59, в якому полісахарид має молекулярну масу, виміряну методом гель-фільтрації, від 0,4 до 400 кДа.
61. Застосування за будь-яким із пп. 51-60, в якому полісахарид містить не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот.
62. Застосування за будь-яким із пп. 51-61, в якому полісахарид викликає мукозальний захист від шигельозу Зонне шляхом індукції синтезу специфічних антитіл проти бактерії S. sonnei, фаза І в організмі ссавців, включаючи людину.
63. Застосування за будь-яким із пп. 51-61, в якому полісахарид є модулятором реакцій імунної системи ссавців, включаючи людину.
64. Застосування за будь-яким із пп. 51-63, в якому полісахарид є апірогенним для кроля в дозі не більше 0,050 мкг/кг в тесті пірогенності на кролях.
65. Застосування за п. 51, в якому фармацевтичний засіб призначений для парентерального, перорального, ректального, інтравагінального, нашкірного, сублінгвального й аерозольного введення ссавцям, включаючи людину.
Текст
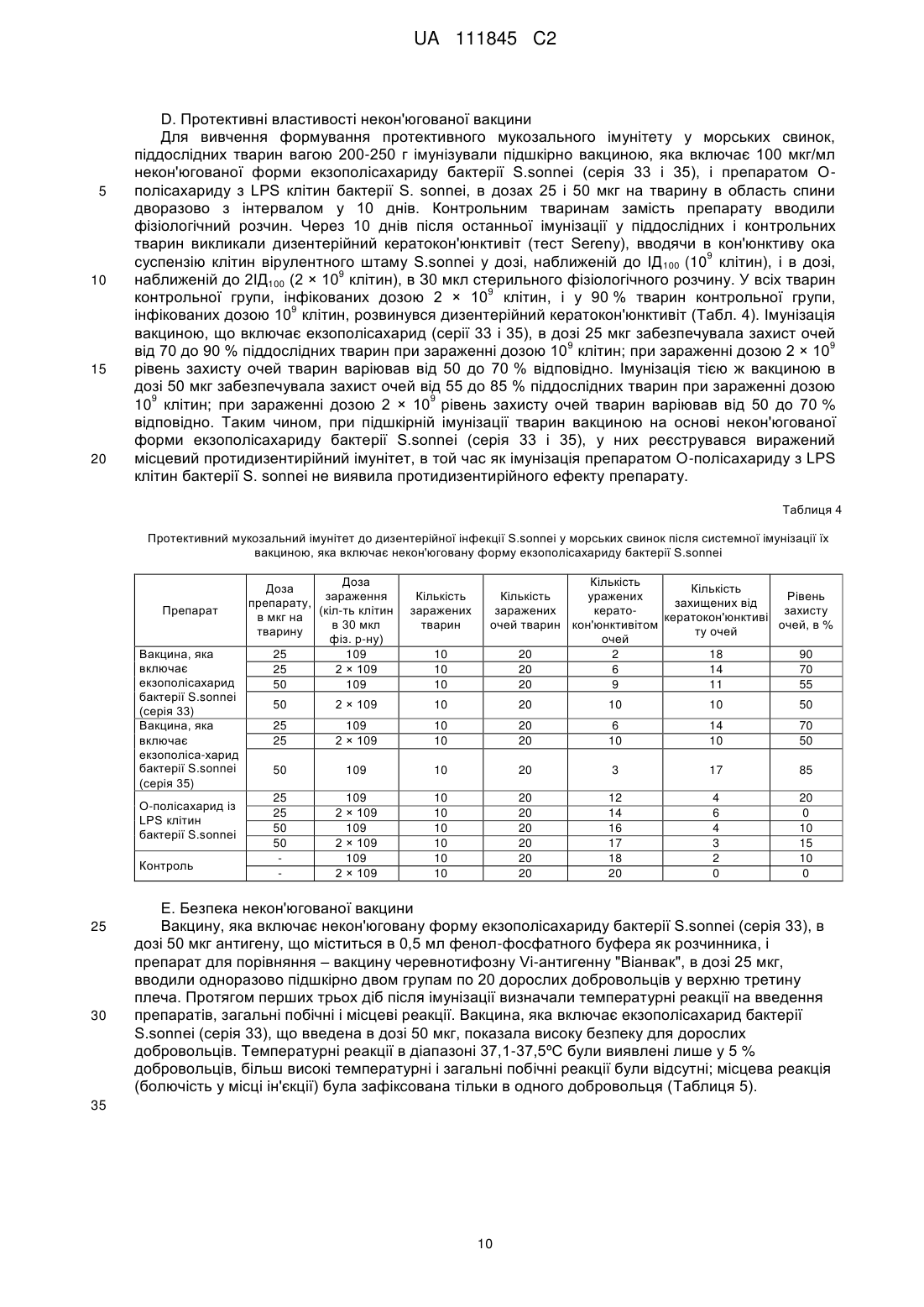
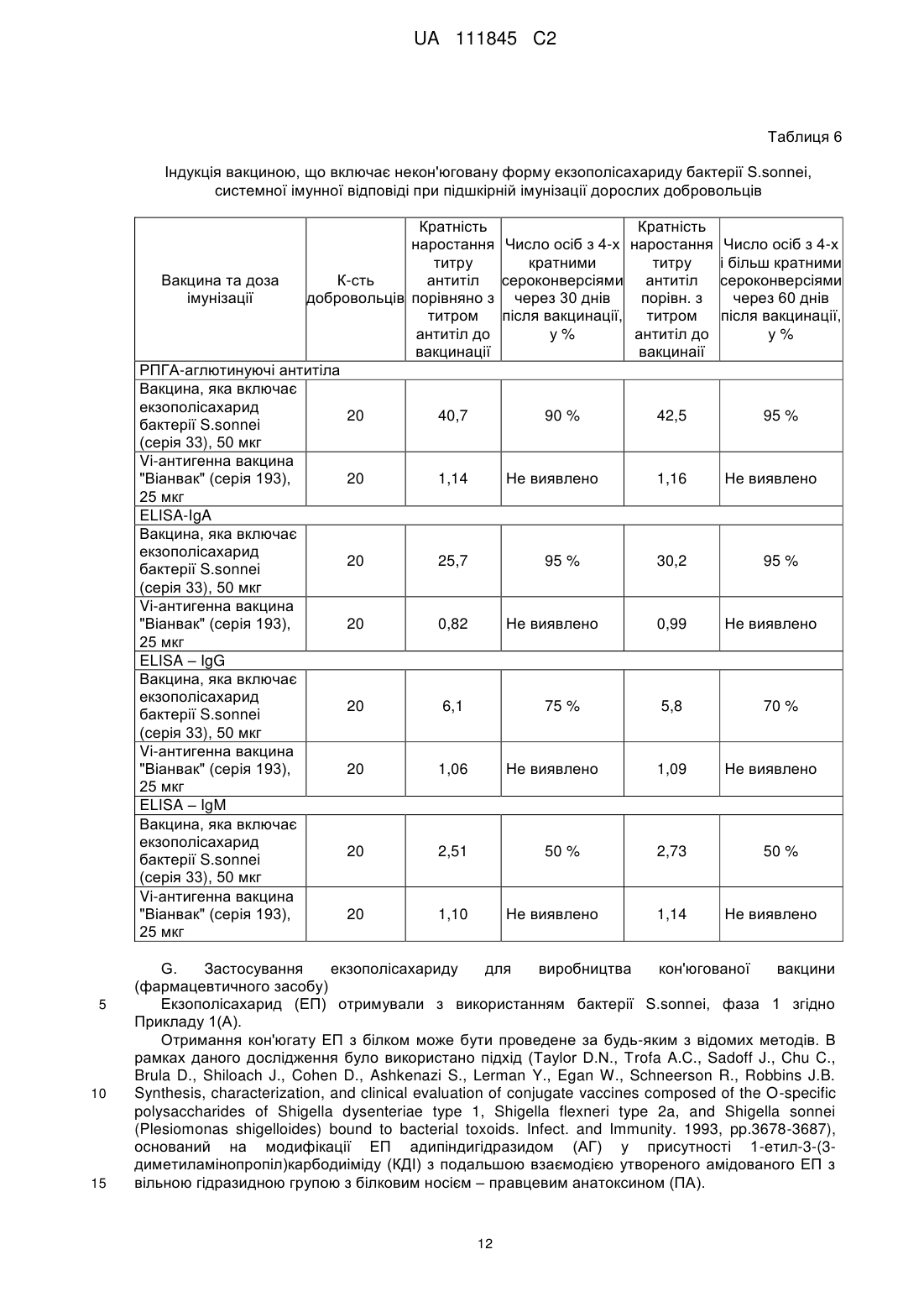
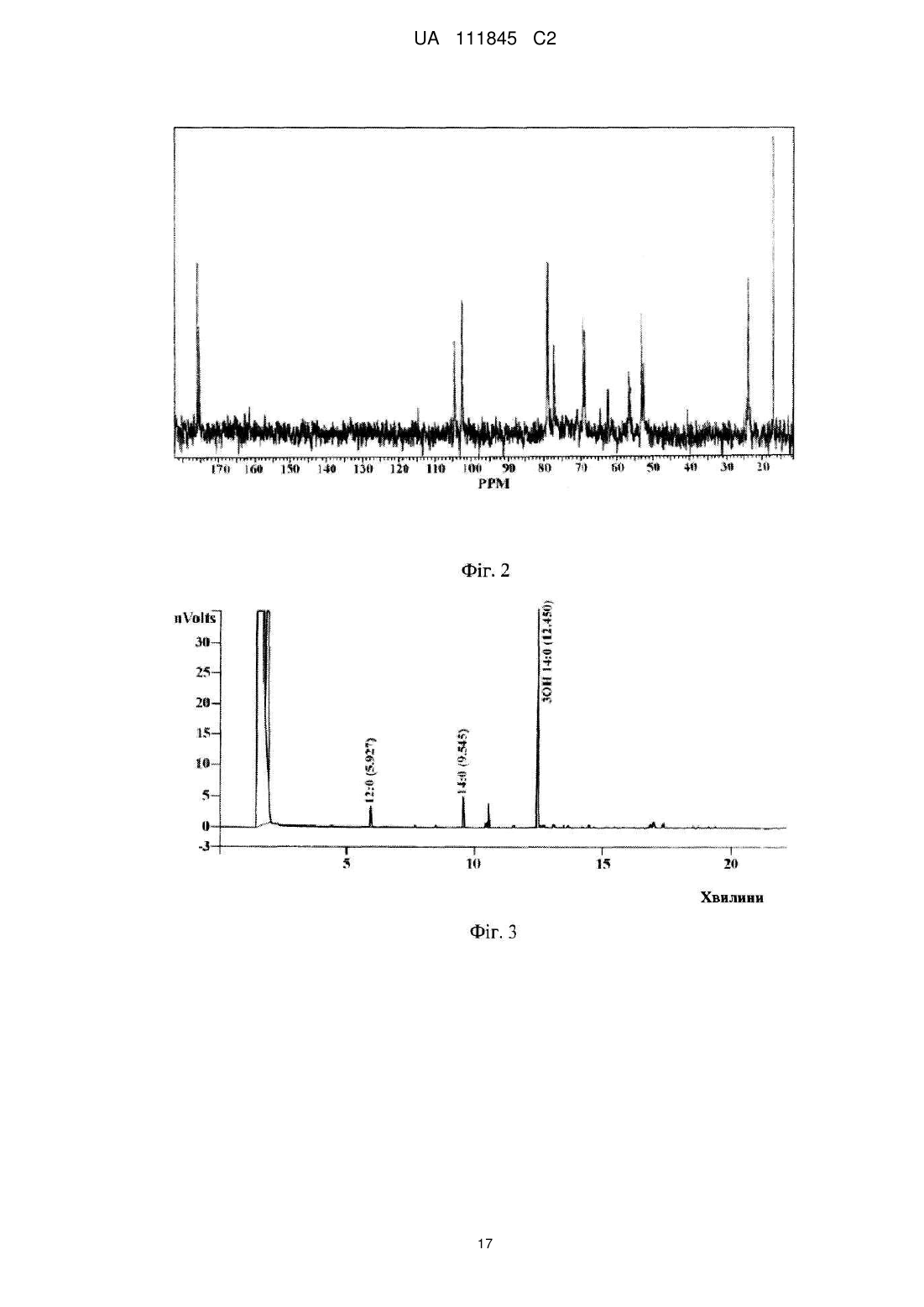
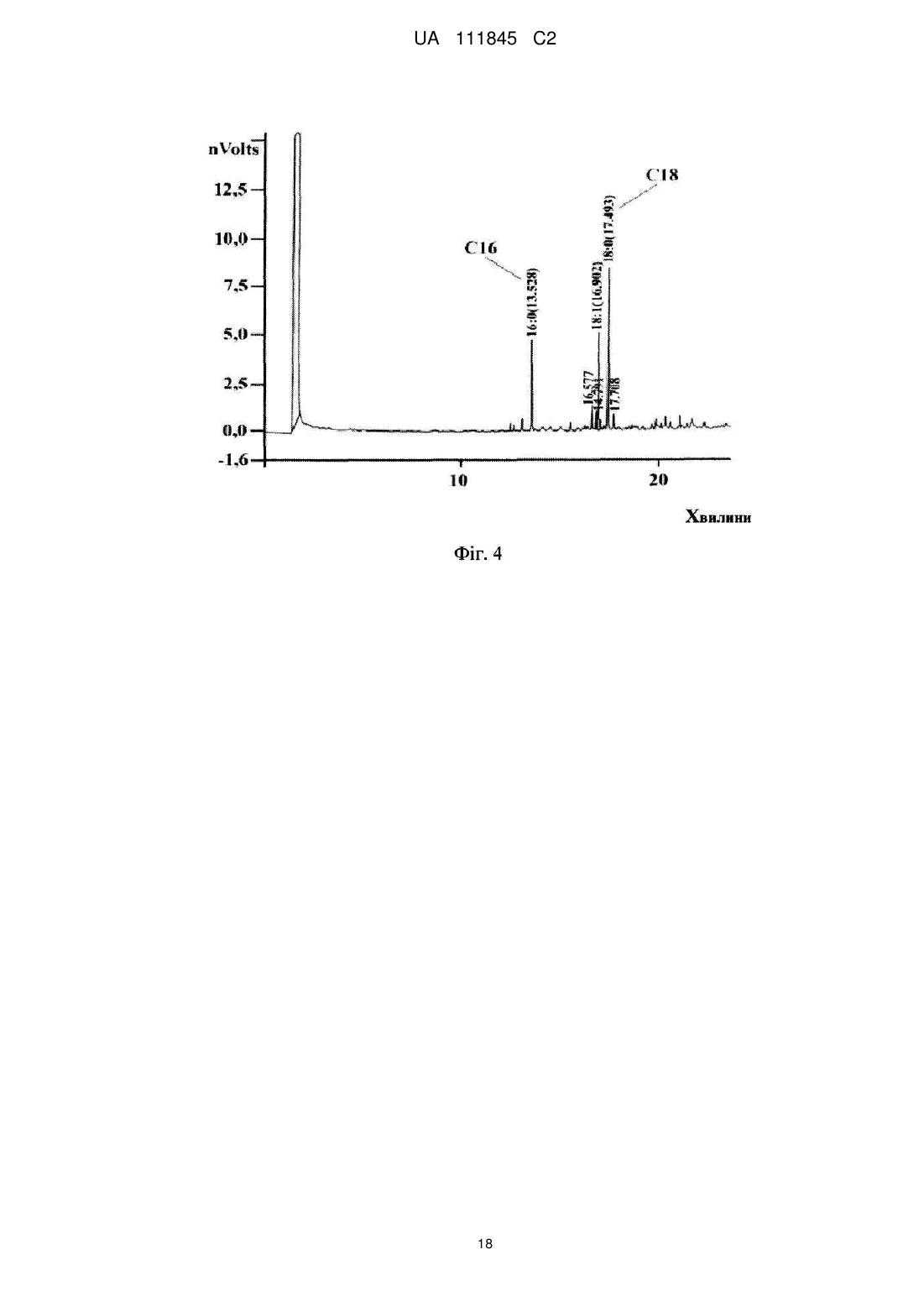
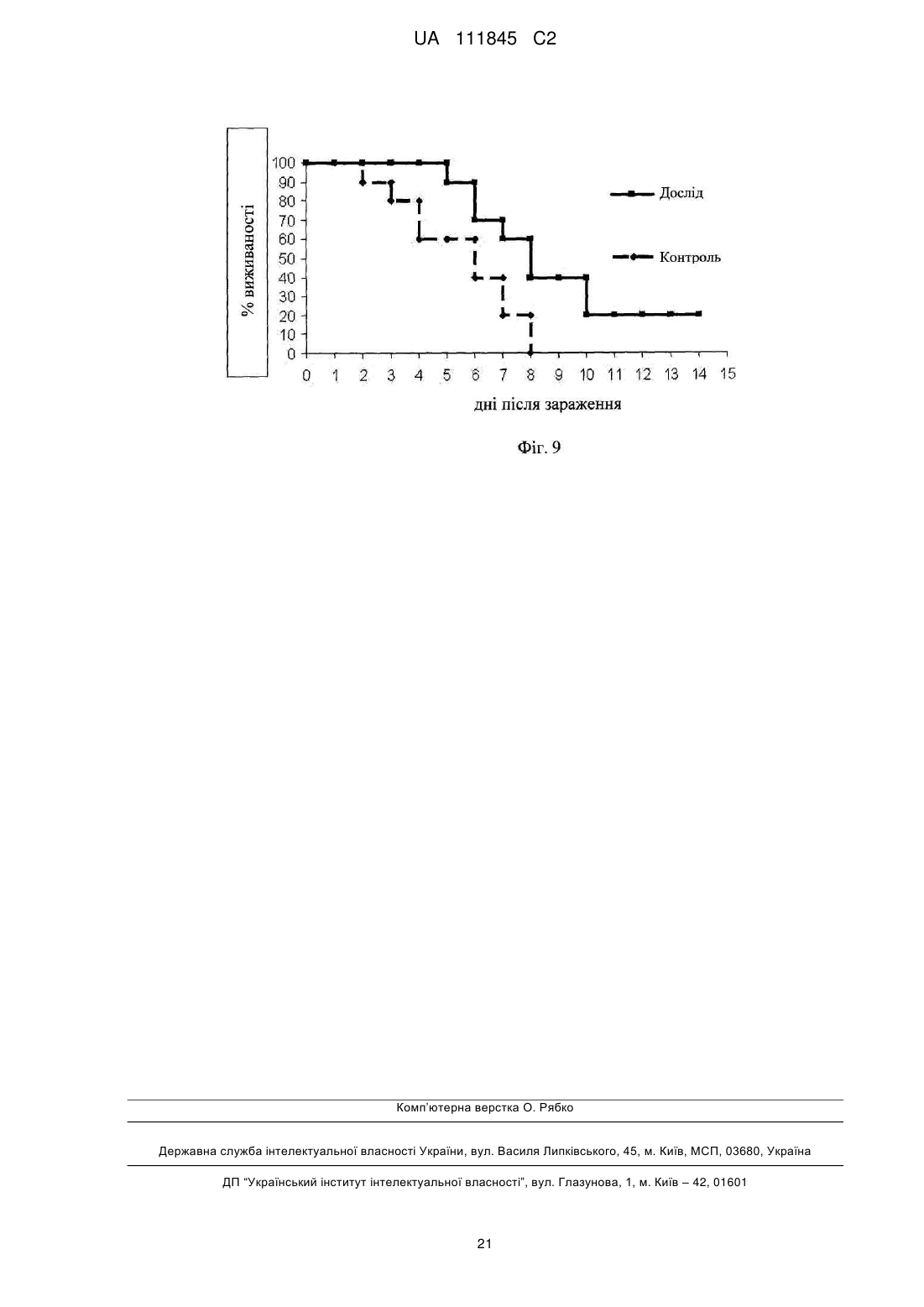
Реферат: Винахід стосується О-специфічного полісахаридного антигену – екзополісахариду бактерії Shigella sonnei, фаза І, який являє собою автентичну природну сполуку - бактеріальний капсульний полісахарид, що складається з 1-100 повторюваних дисахаридних ланок О-[4-аміно2-(N-ацетил)аміно-2,4-дидезокси--D-галактопіранозил]—(1→4)-O-[2-(N-ацетил)аміно-2дезокси--L-альтрпірануронової кислоти], сполучених в полісахардний ланцюг (1→3) зв'язками, і негідроксильованих жирних кислот. Екзополісахарид викликає мукозальний захист від шигельозу Зонне шляхом індукції синтезу специфічних антитіл проти бактерії S. sonnei в організмі ссавців, включаючи людину. UA 111845 C2 (12) UA 111845 C2 UA 111845 C2 5 10 15 20 25 30 35 40 45 50 55 60 Область техніки Винаходи відносяться до клінічної імунології та фармакології, зокрема, до полісахаридного антигену бактерії Shigella sonnei, фаза I – О-специфічного екзополісахариду, способу його одержання, а також до вакцин і фармацевтичних композицій, що його містять. Попередній рівень техніки Вже майже сторіччя після відкриття в Японії бацили Шига, відомої як Shigella dysenteriae, тип 1, шигельози є однією з головних проблем охорони здоров'я практично всіх країн світу. Так, щорічно від дизентерії, яку викликають мікроорганізми роду Shigella, в країнах, що розвиваються, гине кілька сотень тисяч дітей до п'яти років. У розвинених країнах Північної півкулі також періодично виникають потужні спалахи шигельозу, викликані бактерією Shigella sonnei, єдиним представником групи D роду Shigella. У зв'язку з вищевикладеним ВООЗ рекомендує як пріоритет розробку "глобальної" протишигельозної вакцини, яка містить протективні компоненти патогенних представників роду Shigella, зокрема, Shigella sonnei, фаза I (Kotloff K.L., Winickoff J.P., Ivanoff B., Clemens J.D., Swerdlow D.L., Sansonetti P.J., Adak G.K., Levine M.M. Global burden of Shigella infections: implications for vaccine development and implementation of control strategies. Bull.WHO, 1999, v.77, p.651-665). Створення ж моновакцини проти шигельозу Зонне є як попереднім етапом вирішення цієї проблеми, так і самостійним, надзвичайно актуальним завданням для багатьох регіонів. Специфічність імунітету до дизентерійної інфекції детермінована структурою головного протективного антигену шигел-полісахаридного О-антигену. Первинна структура Оспецифічного полісахариду молекули ліпополісахариду (LPS) клітинної стінки бактерії S. sonnei, фаза 1 визначена Kenne у співавт. (Kenne L., Lindberg B., Petersson K., Katzenellenbogen E., Romanowska E. Structural studies of the O-specific side-chains of the Shigella sonnei phase I lipopolysaccharide. Сarbohydrаte Res., 1980, 78:119-126). О-антигенний компонент LPS являє собою полісахарид, що складається з повторюваних дисахаридних ланок О-[4-аміно-2-(N-ацетил)аміно-2,4-дидезокси-β-D-галактопіранозил]—(1→4)О-[2-(N-ацетил)аміно-2-дезокси-α-L-альтрпірануронової кислоти], сполучених в полісахаридний ланцюг (1→3) зв'язками. Цей О-полісахаридний компонент S. sonnei, фаза 1, ковалентно приєднаний до домену кора E.coli R2 типу, який, у свою чергу, ковалентно зв'язаний з ліпідом А, і утворює лінійну молекулу LPS. Виділення О-полісахариду з LPS клітинної стінки не представляє значних технічних складностей. Так, метод виділення, спочатку запропонований Freeman, включає такі основні стадії – отримання культури бактерій S. sonnei, фаза I в рідкому середовищі; відділення культуральної рідини від бактеріальних клітин; екстракцію LPS з бактеріальних клітин водним фенолом (Westphal O., Jann K. Bacterial lipopolysaccharide extraction with phenol: water and further application of the procedure. Methods Carbohydr. Chem., 1965, v.5, p.83-91); деградацію LPS з подальшим виділенням з нього О-полісахариду (Morrison D.C., Leive L. Fractions of lipopolysaccharide from Escherichia coli O111: B4 prepared by two extraction procedures. J. Biol. Chem. 250 (1975) 2911-2919). Відомий також спосіб отримання О-специфічного антигену Shigella sp. високого ступеня чистоти, що включає: отримання культури бактерій у рідкому середовищі; обробку культури бактерій гексадеацилтриметиламоній бромідом з подальшою екстракцією LPS з бактеріальних клітин; відділення екстракту LPS від бактеріальних клітин; деградацію LPS з подальшим виділенням з нього О-полісахариду (KR 20010054032 А). Таким чином, в основі всіх відомих способів виділення О-специфічного антигену з LPS Shigella sp. лежить стадія екстракції, тобто виділення LPS з клітинних стінок бактерій, яка обумовлює неминучу втрату нативності бактеріальних клітин. Крім того, генезис О-специфічного антигену з LPS Shigella sp. детермінує і структуру антигенів, виділених відомими способами. Так, практично всі отримані з LPS Shigella sp. О-антигени містять елементи структури домену кора. М'який гідроліз 1 %-вою оцтовою кислотою, який використовується для видалення ліпіду А з молекули LPS, призводить до отримання полісахаридного деривативу, що являє собою О-специфічний полісахарид, приєднаний до олігосахариду "кора". (Fensom A.H., Meadow P.M. Evidence for two regions in the polysaccharide moiety of the lipopolysaccharide of Pseudomonas aeruginosa 8602. FEBS Lett. 9(2), 1970, 81-84; Morrison DC, Leive L. Fractions of lipopolysaccharide from Escherichia coli O111:B4 prepared by two extraction procedures. J Biol Chem. 250(8), (1975), 2911-19; Oertelt C, Lindner B, Skurnik M, Holst O.Isolation and structural characterization of an R-form lipopolysaccharide from Yersinia enterocolitica serotype O:8. Eur. J. Biochem. 2001 Feb; 268 (3), 554-64; Osborn M.J. Studies on the gram-negative cell wall. I. Evidence for the role of 2-keto-3-deoxyoctonate in the lipopolysaccharide of Salmonella typhimurium. Proc. Natl. Acad. Sci. USA, 50, (1963), 499-506). 1 UA 111845 C2 5 10 15 20 25 30 35 40 45 50 55 Запропоновано використання О-полісахариду з LPS клітинної стінки бактерії S. sonnei, фаза I у складі виключно кон'югованих вакцин проти шигельозу Зонне, при його ковалентному зв'язуванні з білковими носіями – білком D Haemophilis influenzae, рекомбінантним екзопротеіном А Pseudomonas aeruginosa (rEPA), рекомбінантним дифтерійним токсином (rDT), рекомбінантним токсином B C. difficile (rBRU) (US Pat. Appl. 2005/ 0031646; WO/2010/019890). Проведені дослідження імуногенних і протективних властивостей О-полісахариду з LPS клітинної стінки бактерії Plesiomonas shigelloides О7, ідентичного за структурою з Ополісахаридом з LPS бактерії S. sonnei, фаза I, кон'югованого з білком – екзопротеіном А Pseudomonas aeruginosa (rEPA) або дифтерійним анатоксином CRM9 з мутантного штаму Corynobacterium diphtheriae (Cohen D., Ashkenazi S., Green M.S., Gdalevich M., Robin G., Slepon R., Yavzori M., Orr N., Block C., Ashkenazi I., Shemer J., Taylor D.N., Hale T.L., Sadoff J.C., Pavliakova D., Schneerson R., Robbins R. Double-blind vaccine controlled randomized efficacy trial of an investigational Shigella sonnei conjugate vaccine in young adults. Lancet, 1997, v.349, pp.155159). Виявилося, що кон'югат О-полісахариду з rEPA є імуногенним для експериментальних тварин і людини при парентеральному введенні, викликаючи у добровольців продукцію Оспецифічних антитіл і середній рівень захисту від інфекції з коефіцієнтом ефективності 74 %. Проте надзвичайно коротка тривалість контрольованого епіддосліду (2,5 – 7 місяців) викликає сумнів у достовірності оцінки протективного потенціалу вакцини. Недавні випробування імуногенності О-полісахаридної кон'югованої вакцини проти інфекції S. sonnei на основі rEPA-носія на дітях виявили слабку імуногенність препарату для дітей від 1 до 4-х років (коефіцієнт ефективності склав 27,5 %), а також раннє згасання імунної відповіді після імунізації (Passwell J.H., Ashkenzi S., Banet-Levi Y., Ramon-Saraf R., Farzam N., Lerner-Geva L., Even-Nir H., Yerushalmi B., Chu C., Shiloach J., Robbins J.B., Schneerson R; Israeli Shigella Study Group. Age-related efficacy of Shigella O-specific polysaccharide conjugates in 1-4-year-old Israeli children. Vaccine. 2010, Mar., 2; 28 (10), pp.2231-2235). Таким чином, кон'юговані білково-полісахаридні вакцини проти шигельозу Зонне виявляють недостатню імуногенність в клінічних випробуваннях як на дорослих, так і на дитячих контингентах. Слід зазначити, що імуногенні властивості вільного, некон'югованого О-полісахариду з LPS бактерії S. sonnei, фаза I, як вакцинного імуногена не відомі. Експериментальні дані Taylor зі співавт. демонструють практично повну відсутність імуногенної активності відносно мишей некон'югованого О-полісахариду з LPS клітин бактерії Plesiomonas shigelloides, структура якого ідентична структурі О-антигену S. sonnei, фаза 1 (Taylor DN., Trofa A.C., Sadoff J., Chu C., Bryla D., Shiloach J., Cohen D., Ashkenazi S., Lerman Y., Egan W. Synthesis, characterization and clinical evaluation of conjugate vaccines composed of the O-specific polysaccharides of Shigella dysenteriae type 1, Shigella flexneri type 2a, and Shigella sonnei (Plesiomonas shigelloides) bound to bacterial toxoids. Infect. Immun., 1993, Sep, 61 (9): 3678-3687). Виходячи з вищевикладеного, актуальність розробки інших підходів до створення Оантигенних вакцин проти інфекції S. sonnei є очевидною. Як альтернативний і найбільш перспективний напрямок розробки може розглядатися створення некон'югованої вакцини на основі О-антигенного екзополісахариду, продукованого бактерією S. sonnei, фаза I, у зовнішнє середовище. Відомо, що багато грампозитивних і грамнегативних бактерій продукують не тільки полісахаридні компоненти клітинної стінки, а й позаклітинні екзополісахариди, які виділяються клітиною у зовнішнє середовище і виконують захисну функцію. При цьому продуковані екзополісахариди можуть знаходитися як у вільному стані, так і утворювати позаклітинну капсулу або мікрокапсулу. Іноді екзополісахариди, які продуковані клітиною у зовнішнє середовище, являють собою специфічні високоімуногенні антигени, що здатні індукувати синтез протективних антитіл. Так, цілий ряд таких полісахаридних антигенів використовується у складі вакцин для профілактики інфекцій, що викликає менінгокок груп А і С, збудник черевного тифу (Lindberg A.A. Polyosides (encapsulated bacteria). C.R. Acad.Sci. Paris, 1999, v.322, p.925-932). Імуногенність полісахаридних вакцин залежить від первинної структури полісахаридного антигену, його молекулярної маси, здатності до утворення агрегатних структур (The vaccine book. Edited by B.R.Bloom, P.-H. Lambert Academic Press, San Diego 2003, pp. 436). При цьому первинна структура бактеріального екзополісахариду може бути як ідентичною структурі Ополісахариду з LPS клітинної стінки, так і відрізнятися від неї (Goldman R.C., White D., Orskov F., Orskov I., Rick P.D., Lewis M.S., Bhattacharjee A.K., Leive L. A sulface polysaccharide of Esherichia coli O111 contains O-antigen and inhibits agglutination of cells by anti-O antiserum. J. Bacteriol., 1982, v.151, p. 1210-1221). 2 UA 111845 C2 5 10 15 20 25 30 35 40 45 50 55 60 Проте ні первинна структура екзополісахариду бактерії S. sonnei, фаза I, ні його фізикохімічні, імунобіологічні та протективні властивості, ні спосіб його виділення, ні, нарешті, сам факт його існування, в літературі не описані. У літературі також не описані фармацевтичні композиції на основі полісахаридів S. sonnei, фаза I, розробка яких може дати істотний внесок у клінічну фармакологію. Відоме лише використання фрагментів О-полісахариду з LPS клітин S. sonnei, фаза I, які включають від 1 до 5 дисахаридних ланок, як харчової добавки для орального введення, що стимулює розвиток імунної системи у немовлят від 1 до 6-місячного віку, детермінований зростанням співвідношення кількості T-хелперів 1 типу (Тh 1 відповідь) у порівнянні з Т- хелперами 2 типу (Th 2 відповідь) (US Pat. Appl. 2009/0317427 А1). Розкриття винаходів Завданням заявлених винаходів є отримання високотехнологічним способом екзополісахариду бактерії S. sonnei, фаза I та розробка на його основі полісахаридних вакцин і фармацевтичних композицій. Технічними результатами, що забезпечуються заявленими винаходами, є: (a) отримання нативного екзополісахариду з бактерії S. sonnei, фаза I, високого ступеня чистоти з високим виходом у промисловому масштабі; (b) підвищення специфічності, імуногенності, протективної активності та безпеки розроблених вакцин; (с) висока ефективність і широкий спектр дії запропонованих фармацевтичних композицій. Вперше отримано новий полісахаридний антиген – екзополісахарид, або капсульний полісахарид, що продукується бактерією S. sonnei, фаза I у зовнішнє середовище. На відміну від О-специфічного полісахариду з LPS клітинної стінки бактерії, виділеного штучно фрагмента молекули, екзополісахарид являє собою автентичну природну сполуку, отриману з використанням бактерій Shigella sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання. Первинна структура екзополісахариду виявилася ідентичною як такій структурі О-полісахариду з LPS клітин бактерії S. sonnei, фаза I, тобто екзополісахарид складається з 1–100 повторюваних дисахаридних ланок О-[4-аміно-2-(N-ацетил)аміно-2,4дидезокси-β-D-галактопіранозил]—(1→4)-О-[2-(N-ацетил)аміно-2-дезокси-α-Lальтрпірануронової кислоти], сполучених в полісахаридний ланцюг (1→3) зв'язками (Фіг. 1 і Фіг. 2). На відміну від О-полісахариду з LPS клітин бактерії, нативний екзополісахарид включає нетоксичний ліпідний компонент, до складу якого входять негідроксильовані жирні кислоти з 16тьма –18-тьма вуглецевими атомами в молекулі (Фіг. 3, Фіг. 4). Вміст жирних кислот у ньому становить не менше 0,01 мас. %. Крім того, отриманий будь-яким способом з бактерії S. sonnei екзополісахарид не включає елементів структури домену кора LPS (Фіг. 4). Екзополісахарид можна отримувати будь-яким способом, включаючи генно-інженерний, з використанням геному бактерії Shigella sonnei. Переважно екзополісахарид отримують з використанням бактерій Shigella sonnei способом, що включає: (a) отримання культури бактерій у рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (c) виділення полісахариду з рідкої фази. При цьому, щоб уникнути руйнування клітинних стінок і потрапляння LPS в рідку фазу, відділення її від бактеріальних клітин доцільно здійснювати при збереженні нативності бактеріальних клітин. Виділення полісахариду з рідкої фази може бути здійснено способом, що включає: (i) видалення з рідкої фази білків і нуклеїнових кислот; (ii) ультрафільтрацію і (iii) діаліз отриманого розчину. Отриманий вищевказаним способом екзополісахарид може містити не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот. Молекулярна маса екзополісахариду, виміряна методом гель-фільтрації, становить від 0,4 до 400 kDa. Основна фракція екзополісахариду являє собою біополімер з молекулярною масою більше 80 kDa (Фіг. 5В), в той час як основна фракція Ополісахариду має молекулярну масу не більше 26 kDa (Фіг. 5А). Екзополісахарид є імуногенним і викликає мукозальний захист від шигельозу Зонне шляхом індукції синтезу специфічних антитіл проти бактерії Shigella sonnei, фаза I в організмі ссавців, включаючи людину (Приклад 1С, Фіг. 6; Приклади 2D, 2F). Як вже зазначалося вище, імуногенність полісахаридного антигену детермінована його молекулярною масою, здатністю до утворення агрегатних структур, тому найбільшу імуногенність виявляє фракція екзополісахариду з молекулярною масою від 80 до 400 kD. Імуногенність високомолекулярної фракції екзополісахариду перевищує більше ніж у 7 разів імуногенність О-полісахариду з LPS клітин бактерії (Приклад 1С, Фіг. 6), що обумовлено, мабуть, в тому числі наявністю в його молекулі нетоксичного ліпідного компонента – негідроксильованих жирних кислот, що сприяють утворенню надмолекулярних агрегатних структур. Крім того, екзополісахарид є апірогенним для кроля в дозі не більше 0,050 мкг/кг у тесті пірогенності на кролях при внутрішньовенному введенні (Приклад 1D). За параметром 3 UA 111845 C2 5 10 15 20 25 30 35 40 45 50 55 пірогенності вакцинний препарат екзополісахариду відповідає вимогам Комітету експертів ВООЗ для полісахаридних вакцин (WHO TR-WHO Technical report No.840, 1994). Заявлений спосіб отримання екзополісахариду бактерії S. sonnei, фаза I, включає: (a) отримання культури бактерій Shigella sonnei в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (c) виділення полісахариду з рідкої фази. При цьому рідка фаза, що забезпечує життєдіяльність клітин культури, може являти собою живильне середовище різного складу і з різними властивостями. Відділення рідкої фази від бактеріальних клітин переважно здійснюють при збереженні нативності бактеріальних клітин. Таким чином, в заявленому способі отримання полісахариду, що виключає використання LPS як джерела його отримання, відсутня стадія вилучення LPS із клітинних стінок бактерій, що обумовлює неминучу втрату нативності бактеріальних клітин. Виділення полісахариду з рідкої фази може бути здійснено способом, що включає: (i) видалення з рідкої фази білків і нуклеїнових кислот; (ii) ультрафільтрацію і (iii) діаліз отриманого розчину. Заявлена вакцина для профілактики та/або лікування шигельозу Зонне включає профілактично і/або терапевтично ефективну кількість полісахариду бактерії Shigella sonnei, фаза I, що складається з 1–100 повторюваних дисахаридних ланок О-[4-аміно-2-(Nацетил)аміно-2,4-дидезокси-β-D-галактопіранозил]—(1→4)-О-[2-(N-ацетил)аміно-2-дезокси-α-Lальтрпірануронової кислоти], сполучених в полісахаридному ланцюзі (1 → 3) зв'язками, і отриманого з використанням бактерій Shigella sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання. Даний полісахарид є екзополісахаридом або капсульним полісахаридом продукованим бактерією S. sonnei, фаза I у зовнішнє середовище. Нативний екзополісахарид включає нетоксичний ліпідний компонент, до складу якого входять негідроксильовані жирні кислоти з 16тьма – 18-тьма вуглецевими атомами в молекулі (Фіг. 4). Вміст жирних кислот у ньому становить не менше 0,01 мас. %. Крім того, отриманий будь-яким способом з використанням бактерії S. sonnei екзополісахарид не включає елементів структури домену кора LPS (Фіг. 4). Екзополісахарид можна отримувати будь-яким способом, включаючи генно-інженерний, з використанням геному бактерії Shigella sonnei. Переважно екзополісахарид отримують з використанням бактерій Shigella sonnei способом, що включає: (a) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (c) виділення полісахариду з рідкої фази. При цьому, для уникнення руйнування клітинних стінок і потрапляння LPS в рідку фазу, відділення її від бактеріальних клітин доцільно здійснювати при збереженні нативності бактеріальних клітин. Виділення полісахариду з рідкої фази може бути здійснено способом, що включає: (i) видалення з рідкої фази білків і нуклеїнових кислот; (ii) ультрафільтрацію і (iii) діаліз отриманого розчину. Отриманий вищевказаним способом екзополісахарид може містити не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот. Молекулярна маса екзополісахариду, виміряна методом гель-фільтрації, становить від 0,4 до 400 kDa. Основна фракція екзополісахариду являє собою біополімер з молекулярною масою більше 80 kDa (Фіг. 5В). Екзополісахарид є імуногенним і викликає мукозальний захист від шигельозу Зонне шляхом індукції синтезу специфічних антитіл проти бактерії Shigella sonnei, фаза I в організмі ссавців, включаючи людину (Приклад 1С, Фіг. 6; Приклади 2D, 2F). Максимальну імуногенність виявляє фракція екзополісахариду з молекулярною масою від 80 до 400 kDa. Імуногенність екзополісахариду перевищує більше ніж у 7 разів імуногенність Ополісахариду з LPS клітин бактерії (Приклад 1С, Фіг. 6). Екзополісахарид є апірогенним для кроля в дозі не більше 0,050 мкг/кг в тесті пірогенності на кролях при внутрішньовенному введенні (Приклад 1D). Заявлена вакцина може включати фармацевтично допустимі добавки, якими можуть бути використані стабілізатори pH, консерванти, ад'юванти, ізотонізуючі агенти або їх комбінації. Крім того, вакцина може включати екзополісахарид як у некон'югованій, так і в кон'югованій формі. При цьому вакцина, що включає кон'юговану форму екзополісахариду, додатково містить білковий носій, а саме дифтерійний анатоксин або правцевий анатоксин, або екзопротеін А Pseudomonas aeruginosa, або інші білки. Заявлена фармацевтична композиція включає ефективну кількість полісахариду бактерії Shigella sonnei, фаза I, що складається з 1-100 повторюваних дисахаридних ланок О-[4-аміно-2(N-ацетил)аміно-2,4-дидезокси-β-D-галактопіранозил]—(1→4)-О-[2-(N-ацетил)аміно-2-дезокси-αL-альтрпірануронової кислоти], сполучених в полісахаридний ланцюг (1 →3) зв'язками, і отриманого з використанням бактерій Shigella sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання. 4 UA 111845 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний полісахарид є екзополісахаридом, або капсульним полісахаридом, що продукує бактерія S. sonnei, фаза I у зовнішнє середовище. Нативний екзополісахарид включає нетоксичний ліпідний компонент, представлений негідроксильованими жирними кислотами з 16тьма – 18-тьма вуглецевими атомами в молекулі (Фіг. 4). Вміст жирних кислот у ньому становить не менше 0,01 мас. %. Крім того, отриманий будь-яким способом з використанням бактерії S. sonnei екзополісахарид не включає елементів структури домену кора LPS (Фіг. 4). Екзополісахарид можна отримувати будь-яким способом, включаючи генно-інженерний, з використанням геному бактерії Shigella sonnei. Переважно екзополісахарид отримують з використанням бактерій Shigella sonnei способом, що включає: (a) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (c) виділення полісахариду з рідкої фази. При цьому, для уникнення руйнування клітинних стінок і потрапляння LPS в рідку фазу, відділення її від бактеріальних клітин доцільно здійснювати при збереженні нативності бактеріальних клітин. Виділення полісахариду з рідкої фази може бути здійснено способом, що включає: (i) видалення з рідкої фази білків і нуклеїнових кислот; (ii) ультрафільтрацію і (iii) діаліз отриманого розчину. Отриманий вищевказаним способом екзополісахарид може містити не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот. Молекулярна маса екзополісахариду, виміряна методом гель-фільтрації, становить від 0,4 до 400 kDa. Основна фракція екзополісахариду являє собою біополімер з молекулярною масою більше 80 kDa (Фіг.5В). Екзополісахарид є модулятором реакцій імунної системи ссавців, включаючи людину (Приклад 3B). Екзополісахарид є апірогенним для кроля в дозі не більше 0,050 мкг/кг в тесті пірогенності на кролях при внутрішньовенному введенні (Приклад 1D). Заявлена фармацевтична композиція може включати фармацевтично допустимі цільові добавки, якими можуть бути використані консерванти, стабілізатори, розчинники або їх комбінації. Заявлена фармацевтична композиція може мати широкий спектр фармакологічної активності і виявляє, зокрема, ефективну лікувальну противірусну дію при інфекції, яку викликає вірус грипу A H1N1 (Приклад 3В, Фіг. 9). Заявлено також застосування полісахариду бактерії Shigella sonnei, фаза I, для виробництва фармацевтичного засобу. Зазначений полісахарид складається з 1–100 повторюваних дисахаридних ланок О-[4-аміно-2-(N-ацетил)аміно-2,4-дидезокси-β-D-галактопіранозил]—(1→4)О-[2-(N-ацетил)аміно-2-дезокси-α-L-альтрпірануронової кислоти], сполучених в полісахаридний ланцюг (1→3) зв'язками, і отриманий з використанням бактерій Shigella sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання. Даний полісахарид є екзополісахаридом, або капсульним полісахаридом, що продукує бактерія S. sonnei, фаза I у зовнішнє середовище. Нативний екзополісахарид включає нетоксичний ліпідний компонент, до складу якого входять негідроксильовані жирні кислоти з 16-тьма – 18-тьма вуглецевими атомами в молекулі (Фіг. 4). Вміст жирних кислот у ньому становить не менше 0,01 мас. %. Крім того, отриманий будь-яким способом з використанням бактерії S. sonnei екзополісахарид не включає елементів структури домену кора LPS (Фіг. 4). Екзополісахарид можна отримувати будь-яким способом, включаючи генно-інженерний, з використанням геному бактерії Shigella sonnei. Переважно екзополісахарид отримують з використанням бактерій Shigella sonnei способом, що включає: (a) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (c) виділення полісахариду з рідкої фази. При цьому, для уникнення руйнування клітинних стінок і потрапляння LPS в рідку фазу, відділення її від бактеріальних клітин доцільно здійснювати при збереженнінативності бактеріальних клітин. Виділення полісахариду з рідкої фази може бути здійснено способом, що включає: (i) видалення з рідкої фази білків і нуклеїнових кислот; (ii) ультрафільтрацію і (iii) діаліз отриманого розчину. Отриманий вищевказаним способом екзополісахарид може містити не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот. Молекулярна маса екзополісахариду, виміряна методом гель-фільтрації, становить від 0,4 до 400 kDa. Основна фракція екзополісахариду являє собою біополімер з молекулярною масою більше 80 kDa (Фіг.5В). Екзополісахарид є імуногенним і викликає мукозальний захист від шигельозу Зонне шляхом індукції синтезу специфічних антитіл проти бактерії Shigella sonnei, фаза I в організмі ссавців, включаючи людину (Приклад 1С, Фіг. 6; Приклади 2D, 2F). Крім того, екзополісахарид є також модулятором реакцій імунної системи у ссавців, включаючи людину (Приклад 3B). Екзополісахарид є апірогенним для кроля в дозі не більше 0,050 мкг/кг в тесті пірогенності на кролях при внутрішньовенному введенні (Приклад 1D). Фармацевтичний засіб призначений для парентерального, перорального, ректального, інтравагінального, нашкірного, сублінгвального і аерозольного введення ссавцям, включаючи людину. Короткий опис креслень 5 UA 111845 C2 5 10 15 20 25 30 35 40 45 50 55 Винаходи ілюструються наступними фігурами. На Фіг. 1 представлена структурна формула мономерної ланки екзополісахариду бактерії Shigella sonnei, фаза I. 13 На Фіг. 2 представлений С ЯМР-спектр екзополісахариду бактерії Shigella sonnei, фаза I, (серія 33). На Фіг. 3 представлені результати ГРХ мас-спектрометрії LPS бактерії Shigella sonnei, фаза I. На Фіг. 4 представлені результати ГРХ мас-спектрометрії екзополісахариду бактерії Shigella sonnei, фаза I; стрілками позначені сигнали негідроксильованих жирних кислот. На Фіг. 5 представлені графіки молекулярно-масового розподілу О-специфічного полісахариду, виділеного з LPS бактерії Shigella sonnei, фаза I (а) і екзополісахариду бактерії Shigella sonnei, фаза I (б). При цьому на осі ординат представлені значення ультрафіолетового поглинання, при довжині хвилі 225 нм; на осі абсцис вказано час, у хв. На Фіг. 6 представлені діаграми продукції антитіл (15 доба) після первинної (а) і вторинної (б) імунізації мишей препаратами екзополісахариду бактерії S. sonnei, фаза I (cерія 33) і Ополісахариду з LPS клітин бактерії S. sonnei, фаза I, в дозі 25 мкг на мишу. На осі ординат вказані значення титру розведення сироватки. На Фіг. 7 представлені графіки зв'язування антитіл з монорецепторної кролячої сироватки до О-антигену Shigella sonnei, фаза 1, із зразками екзополісахариду бактерії Shigella sonnei (серії 33 і 35); О-полісахариду з LPS клітин бактерії Shigella sonnei; LPS Salmonella enterica sv typhimurium; LPS Shigella flexneri 2a в ELISA тесті. При цьому на осі абсцис представлені значення титру розведення сироватки, а на осі ординат – значення оптичної густини кольорового субстрату реакції (орто-фенілендіаміну) при довжині хвилі 495/650 нм. На Фіг. 8 представлені діаграми продукції антитіл (15 доба) після первинної (а) і вторинної (б) імунізації мишей вакциною, що включає некон'юговану форму екзополісахариду бактерії S. sonnei, фаза I, і вакциною, що включає кон'югований з САТ екзополісахарид бактерії S.sonnei, фаза I (серія 33), в дозі 25 мкг полісахариду на мишу. На осі ординат вказані значення титру розведення сироватки. На Фіг. 9 представлені графіки виживаності двох груп мишей, інфікованих дозою LD 100 вірулентного штаму грипу А Н1N1. При цьому перша група (дослід) отримувала щоденні ін'єкції фармкомпозіціі, в дозі 100 мкг екзополісахариду на мишу, друга ж група (контроль) - ін'єкції фізіологічного розчину відповідно. Кращі варіанти здійснення винаходів Приклад 1 Отримання та характеристика екзополісахариду бактерії Shigella sonnei, фаза I А. Отримання екзополісахариду Екзополісахарид отримували з використанням бактерії S.sonnei, фаза I. Культуру бактерій отримували в рідкій фазі, шляхом глибинного культивування S.sonnei в живильному середовищі. Відділення рідкої фази від бактеріальних клітин здійснювали за допомогою проточної центрифуги (Westphalia) з охолодженням, при дотриманні режимів, що забезпечують м'яке осадження клітин із збереженням їх нативності. Екзополісахарид виділяли з рідкої фази шляхом видалення з неї білків і нуклеїнових кислот, подальшої ультрафільтрації та діалізу отриманого розчину. З цією метою рідку фазу концентрували і піддавали діалізу з використанням установки для ультрафільтрації (Владісарт; межа проходження мембрани 50 kDa). Діалізат ліофілізували, знову розчиняли в 0,05 М трисбуфері, pH=7,2, що містить 0,01 % CaCl2 і MgCl2, додавали RNA-азу і DNA-азу в кількостях 100 мкг/мл і 10 мкг/мл відповідно і через 16 годин перемішування при 37ºС реакційну суміш обробляли протеїназою К (20 мкг/мл) протягом 2-х годин при температурі 55ºС. Отриманий прозорий розчин піддавали ультрафільтрації та діалізу з використанням установки для ультрафільтрації (Владісарт; межа проходження мембрани 50 kDa). За необхідності отриманий розчин ліофілізували і отримували очищений екзополісахарид з виходом 60-80 %. Отриманий вищевказаним способом екзополісахарид містить не більше 1 мас. % білків, що визначаються методом Бредфорда (Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 1976, v. 72, p. 248254), і не більше 2 мас. % нуклеїнових кислот, що визначаються методом Спіріна (Спирин А.С. Спектрофотометрическое определение суммарного количества нуклеиновых кислот. Биохимия, 1958, т. 23, № 4, с. 656). В. Структура, склад і фізико-хімічні властивості екзополісахариду 6 UA 111845 C2 13 5 10 15 20 25 30 35 40 45 50 55 Структуру екзополісахариду S. sonnei, фаза I вивчали за допомогою С ЯМР-спектроскопії. ЯМР-спектроскопія виконана на спектрометрі Bruker, модель DRX-500, з програмним забезпеченням XWINNMR та імпульсними послідовностями від виробника. Зйомка спектрів 13 проводилася в D20 (99: 95 %) з ацетоном як стандарт (31,5 ppm для С ). Мас-спектроскопія високогої розрішення з іонізацією електророзпиленням і реєстрацією іонів за допомогою іонциклотронного резонансу виконана на спектрометрі Bruker Daltonics, модель Apex II, з магнітом 7 Тесла. 13 Порівняльний аналіз С ЯМР-спектру екзополісахариду (Фіг.2) показав його повну 13 ідентичність відомим С ЯМР-спектрами О-специфічного полісахариду, виділеного з LPS S.sonnei, фаза 1, що однозначно вказує на тотожність будови мономерних ланок обох біополімерів (Фіг. 1). Дослідження ліпідного компонента екзополісахариду проводили на підставі аналізу жирних кислот за допомогою газо-рідинної хроматографії і ГРХ/мас-спектрометрії на хроматографі Hewlett Packard, модель 5890, з'єднаному з мас-спектрометром NERMAG, модель R10-10L. Проведено порівняльне дослідження жирнокислотного складу і будови екзополісахариду і LPS S.sonnei, фаза I. Екзополісахарид і LPS були піддані метанолізу дією 2M HCl/CH 3OH при 85ºС протягом 16 годин. У метанолізаті LPS були виявлені лауринова (12:0), міристинова (14:0) і β-гідроксіміристинова (30H14:0) кислоти (Фіг. 3), тоді як метанолізат екзополісахариду містив як основні продукти метилові ефіри вищих жирних кислот 16:0, 18:1 та 18:0 (Фіг. 4). Результати ГРХ/мас-спектрометрії дозволили встановити, що екзополісахарид містить нетоксичний ліпідний компонент, який містить негідроксильовані жирні кислоти з 16-тьма – 18тьма вуглецевими атомами в молекулі, характерні для дигліцеридів, у кількості не менше 0,01 мас. %. У екзополісахариді, на відміну від LPS, не виявлені компоненти олігосахариду кора (гептоза, Кdо) і ліпіду А (гідроксильовані жирні кислоти; жирні кислоти з коротшим ланцюгом, ніж у пальмітинової кислоти) (Фіг. 4). При м'якій кислотній деградації екзополісахариду відщеплення ліпідної частини не відбувається. М'який гідроліз LPS 1 %-ною оцтовою кислотою призводить до видалення ліпіду А з молекули LPS. При цьому полісахаридний компонент, що залишився, являє собою Оспецифічний полісахарид, приєднаний до олігосахариду "кора" (Fensom and Meadow, 1970; Morrison and Leive, 1975; Oertelt et al., 2001; Osborn, 1963). Таким чином, екзополісахарид не являється ні LPS, необхідними компоненти якого є кора і ліпід А, ні О-специфічним полісахаридом, що включає олігосахаридний фрагмент "кора", а являє собою глікокон'югат іншого складу і структури, але з тією ж будовою повторюваної мономерної ланки, що і О-антиген S.sonnei. Дослідження молекулярно-масового розподілу екзополісахариду S.sonnei і О- специфічного полісахариду, виділеного з LPS S.sonnei, проведено за допомогою ВЕРХ на колонці TSK 3000 SW за допомогою проточного УФ-детектора (довжина хвилі 225 нм) у буфері, що містить 0,02 М NaOAc, 0,2 М NaCl (pH 5,0). Порівняльний аналіз хроматограм О-специфічного полісахариду і екзополісахариду показав, що основна фракція О- полісахариду має молекулярну массу 26kDa (Фіг. 5А), тоді як екзополісахарид являє собою біополімер з молекулярною масою більше 80 kDa (Фіг. 5В). С. Імуногенність екзополісахариду Дві групи мишей лінії (СВАХС57Вl/6) FI внутрішньочеревно імунізували препаратом екзополісахариду бактерії S.sonnei, серія 33, і препаратом О-полісахариду з LPS клітин бактерії Shigella sonnei, в дозі 25 мкг на мишу. Препарат екзополісахариду індукував гуморальну імунну відповідь після одноразового введення, і на 15 добу в сироватках периферичної крові тварин визначали 3,4-кратне збільшення кількості IgG антитіл; а препарат О-полісахариду з LPS клітин бактерії індукував слабку первинну імунну відповідь – 1,9-кратне збільшення кількості IgG антитіл на 15 добу відповідно (Фіг. 6А). Для вивчення вторинної імунної відповіді ті ж групи мишей імунізували антигенами повторно в дозі 25 мкг на мишу через місяць після первинного введення. На 15 добу вторинної відповіді після повторної імунізації препаратом екзополісахариду, серія 33, у мишей зареєстровано 25кратне збільшення кількості IgG анти-О антитіл, тобто спостерігалася анамнестична вторинна імунна відповідь. Після повторної імунізації мишей препаратом О-полісахариду з LPS клітин бактерії зареєстровано слабке 3,4-кратне підвищення кількості IgG анти-О антитіл (Фіг. 6В). Таким чином, екзополісахарид бактерії має істотно більш високу імуногенність, індукуючи синтез О-специфічних IgG антитіл, рівень яких у 7 разів перевищує той, що індукований Ополісахаридом з LPS клітин бактерії. D. Пірогенність екзополісахариду 7 UA 111845 C2 5 Пірогенність препаратів екзополісахариду бактерії S.sonnei (серія 33 і 35) і О- полісахариду з LPS клітин бактерії S.sonnei визначали у порівнянні з пірогенністю зразків LPS, отриманих з клітин того ж штаму за методом Westphal (Westphal O., Jann K. Bacterial lipopolysaccharide extraction with phenol: water and further application of the procedure. Methods Carbohydr. Chem., 1965, v.5, pp.83-91), та комерційною Vi-антигенною вакциною. Тест проводився на кролях породи Шиншила масою 2,80-3,05 кг відповідно до вимог Технічного регламенту ВООЗ для Viполісхаридної вакцини (WHO Technical report No.840, 1994). Після введення препарату тричі вимірювали ректальну температуру кролів з інтервалом в 1 годину. Апірогенним вважали той препарат, для якого сумарне підвищення температури не перевищувало 1,15 °C. 10 Таблиця 1 Пірогенність препаратів полісахаридів і LPS бактерії S.sonnei та комерційної Vi- антигенної вакцини Препарат Значення підвищення температури, в ºС Vi-антигенна черевнотифозна (0,1; 0,2; 0,3) ∑: 0,6 вакцина "Віанвак", серія 152 Екзополісахарид бактерії S.sonnei, (0,2; 0,2; 0,1) ∑: 0,5 серія 33 Екзополісахарид бактерії S.sonnei, (0,2; 0,2; 0,3) ∑: 0,7 серія 35 О-полісахарид із LPS клітин (0,2; 0,1; 0,2) ∑: 0,5 бактерії S.sonnei LPS із клітин (1,1; 0,8; 1,0) ∑: 2,9 бактерії S. sonnei 15 20 25 30 35 Пірогенність апірогенний апірогенний апірогенний апірогенний високопірогенний Внутрішньовенне введення препарату екзополісахариду бактерії S.sonnei та препарату Ополісахариду з LPS клітин бактерії S.sonnei у дозі 0,050 мкг на кг маси тіла не викликало пірогенного ефекту у кролів. Препарат LPS, отриманий з клітин того ж штаму, являючись класичним ендотоксином, виявив високу пірогенність. Приклад 2 Вакцини, що включають екзополісахарид бактерії S. sonnei, фаза I А. Застосування екзополісахариду для виробництва некон'югованої вакцини (фармацевтичного засобу) Приготування некон'югованої вакцини включає отримання екзополісахариду з використанням бактерії S.sonnei, фаза 1 згідно з Прикладом 1 (А) і подальший стерильний розлив в ампули або шприци розчину, що містить активну субстанцію і фармацевтично допустимі цільові добавки, якими можуть бути стабілізатори pH, консерванти, ад'юванти, ізотонізуючі агенти або їх комбінації. Прищеплюваньна доза вакцини містить: некон'юговану форму екзополісахариду, в кількості від 0,010 мг до 0,100 мг; фенол (консервант), не більше 0,75 мг (Sigma, USP Grade 108-95-2), з додаванням натрію хлориду (Sigma, USP Grade 7647-145), натрію фосфату двозаміщеного (Sigma, USP Grade 7782-85-6) і натрію фосфату однозаміщеного (Sigma, USP Grade 13472-35-0); воду апірогенну стерильну для ін'єкцій, 0,5 мл (ФС 42-2620-97, EP IV 2002). В. Серологічна активність некон'югованої вакцини Серологічну активність і імуноспецифічність вакцини, що включає екзополісахарид у некон'югованій формі, в концентрації 100 мкг/мл (серії 33 і 35), визначали в реакції гальмування пасивної гемаглютинації (РГПГА) у порівнянні з іншими О-антигенами в концентрації 100 мкг/мл – О-полісахаридом з LPS клітин бактерії S.sonnei, а також LPS бактерій S. sonnei, S.flexneri 2a та Salmonella enterica sv typhimurium, отриманих методом Westphal (Westphal O., Jann K. Bacterial lipopolysaccharide extraction with phenol: water and further application of the procedure. Methods Carbohydr. Chem., 1965, v.5, p.83-91). Використовували комерційний діагностикум еритроцитарний Зонне (Мікроген, Росія) і монорецепторні кролячі сироватки до О-антигену S.sonnei. 8 UA 111845 C2 5 Концентрація гальмування РПГА вакцинами, що включають екзополісахарид (серія 33 і 35), О-полісахарид з LPS, а також препарат LPS бактерії S.sonnei, не перевищувала 1,56 мкг/мл (Табл. 2). Гетерологічні LPS бактерій S.flexneri 2a і Salmonella enterica sv typhimurium мали слабку серологічну активність ув реакції з монорецепторною сироваткою Зонне (концентрації гальмування ≥ 25 мкг/мл) (Табл. 2). Таблиця 2 Гальмування РПГА некон'югованою вакциною, що включає екзополісахарид бактерії S.sonnei, і препаратами О-полісахариду з LPS клітин бактерії S.sonnei і LPS бактерій S. sonnei, S.flexneri 2a, Salmonella enterica sv typhimurium Концентрація гальмування, в мкг/мл Препарат Вакцина, що включає некон'юговану форму екзополісахариду бактерії S.sonnei, (серія 33-1) Вакцина, що включає некон'юговану форму екзополісахариду бактерії S.sonnei, (серія 35-1) О-полісахарид з LPS клітин бактерії S.sonnei LPS бактерії S.sonnei LPS бактерії S.flexneri 2а LPS бактерії Salmonella enterica sv typhimurium 10 15 20 1,56 0,78 1,56 0,78 25,00 25,0 У тесті ELISA визначали взаємодію in vitro серій вакцин, які включають некон'юговану форму екзополісахариду бактерії S.sonnei в концентрації 100 мкг/мл (серія 33-1 і 35-1), та інші Оантигени в концентрації 100 мкг/мл – О-полісахарид з LPS клітин бактерії S.sonnei, препарати LPS бактерій S.flexneri 2a і Salmonella enterica sv typhimurium, з антитілами монорецепторної кролячої сироватки до О-антигену S. sonnei. При адсорбції на твердій фазі вакцини, що включає екзополісахарид бактерії S.sonnei і О-полісахарид з LPS клітин бактерії S.sonnei, також ефективно взаємодіяли з сироваткою до О-антигену S. sonnei (Фіг. 7). С. Пірогенність некон'югованої вакцини Пірогенність вакцини, яка містить 100 мкг/мл некон'югованої форми екзополісахариду бактерії S.sonnei (серія 33 і 35), визначали у порівнянні з пірогенністю комерційної Vi-антигенної вакцини, О-полісахариду з LPS клітин бактерії S.sonnei і LPS, отриманих з надклітинної рідини (НР) і клітин того ж штаму методом Westphal за методикою, описаною в прикладі 1 С. Результати тесту представлені в таблиці 3. Таблиця 3 Пірогенність вакцини, що включає некон'юговану форму екзополісахариду бактерії S.sonnei, комерційної Vi-антигенної вакцини, препаратів О-полісахариду з LPS клітин бактерії S.sonnei і LPS бактерії S. sonnei Препарат Vi-антигенна черевнотифозна вакцина "Віанвак", серія 152 Вакцина, яка включає екзополісахарид бактерії S.sonnei, (серія 33-1) Вакцина, яка включає екзополісахарид бактерії S.sonnei, (серія 35-1) О-полісахарид із LPS клітин бактерії S.sonnei LPS із НР бактерії S.sonnei LPS із клітин бактерії S.sonnei 25 Значення підвищення Пірогенність температури, в ºС (0,3; 0,2; 0,0) ∑: 0,5 апірогенний (0,2; 0,2; 0,2) ∑: 0,6 апірогенний (0,2; 0,1; 0,3) ∑: 0,6 апірогенний (0,1; 0,1; 0,3) ∑: 0,5 апірогенний (1,2; 1,2; 1,1) ∑: 3,5 (1,1; 0,9; 1,1) ∑: 3,1 високопірогенний високопірогенний Внутрішньовенне введення вакцини, яка включає екзополісахарид бактерії S.sonnei, у дозі 0,050 мкг на кг маси тіла не викликало пірогенного ефекту у кролів. Препарат LPS з клітин бактерії S.sonneі того ж штаму мав високу пірогенність і, таким чином, представляв собою класичний ендотоксин. 9 UA 111845 C2 5 10 15 20 D. Протективні властивості некон'югованої вакцини Для вивчення формування протективного мукозального імунітету у морських свинок, піддослідних тварин вагою 200-250 г імунізували підшкірно вакциною, яка включає 100 мкг/мл некон'югованої форми екзополісахариду бактерії S.sonnei (серія 33 і 35), і препаратом Ополісахариду з LPS клітин бактерії S. sonnei, в дозах 25 і 50 мкг на тварину в область спини дворазово з інтервалом у 10 днів. Контрольним тваринам замість препарату вводили фізіологічний розчин. Через 10 днів після останньої імунізації у піддослідних і контрольних тварин викликали дизентерійний кератокон'юнктивіт (тест Sereny), вводячи в кон'юнктиву ока 9 суспензію клітин вірулентного штаму S.sonnei у дозі, наближеній до ІД 100 (10 клітин), і в дозі, 9 наближеній до 2ІД100 (2 × 10 клітин), в З0 мкл стерильного фізіологічного розчину. У всіх тварин 9 контрольної групи, інфікованих дозою 2 × 10 клітин, і у 90 % тварин контрольної групи, 9 інфікованих дозою 10 клітин, розвинувся дизентерійний кератокон'юнктивіт (Табл. 4). Імунізація вакциною, що включає екзополісахарид (серії 33 і 35), в дозі 25 мкг забезпечувала захист очей 9 9 від 70 до 90 % піддослідних тварин при зараженні дозою 10 клітин; при зараженні дозою 2 × 10 рівень захисту очей тварин варіював від 50 до 70 % відповідно. Імунізація тією ж вакциною в дозі 50 мкг забезпечувала захист очей від 55 до 85 % піддослідних тварин при зараженні дозою 9 9 10 клітин; при зараженні дозою 2 × 10 рівень захисту очей тварин варіював від 50 до 70 % відповідно. Таким чином, при підшкірній імунізації тварин вакциною на основі некон'югованої форми екзополісахариду бактерії S.sonnei (серія 33 і 35), у них реєструвався виражений місцевий протидизентирійний імунітет, в той час як імунізація препаратом О-полісахариду з LPS клітин бактерії S. sonnei не виявила протидизентирійного ефекту препарату. Таблиця 4 Протективний мукозальний імунітет до дизентерійної інфекції S.sonnei у морських свинок після системної імунізації їх вакциною, яка включає некон'юговану форму екзополісахариду бактерії S.sonnei Препарат Вакцина, яка включає екзополісахарид бактерії S.sonnei (серія 33) Вакцина, яка включає екзополіса-харид бактерії S.sonnei (серія 35) О-полісахарид із LPS клітин бактерії S.sonnei Контроль 25 30 Доза Доза зараження препарату, (кіл-ть клітин в мкг на в 30 мкл тварину фіз. р-ну) 25 109 25 2 × 109 50 109 Кількість заражених тварин 10 10 10 Кількість Кількість Кількість уражених Рівень захищених від заражених кератозахисту кератокон'юнктиві очей тварин кон'юнктивітом очей, в % ту очей очей 20 2 18 90 20 6 14 70 20 9 11 55 50 2 × 109 10 20 10 10 50 25 25 109 2 × 109 10 10 20 20 6 10 14 10 70 50 50 109 10 20 3 17 85 25 25 50 50 109 2 × 109 109 2 × 109 109 2 × 109 10 10 10 10 10 10 20 20 20 20 20 20 12 14 16 17 18 20 4 6 4 3 2 0 20 0 10 15 10 0 E. Безпека некон'югованої вакцини Вакцину, яка включає некон'юговану форму екзополісахариду бактерії S.sonnei (серія 33), в дозі 50 мкг антигену, що міститься в 0,5 мл фенол-фосфатного буфера як розчинника, і препарат для порівняння – вакцину черевнотифозну Vi-антигенну "Віанвак", в дозі 25 мкг, вводили одноразово підшкірно двом групам по 20 дорослих добровольців у верхню третину плеча. Протягом перших трьох діб після імунізації визначали температурні реакції на введення препаратів, загальні побічні і місцеві реакції. Вакцина, яка включає екзополісахарид бактерії S.sonnei (серія 33), що введена в дозі 50 мкг, показала високу безпеку для дорослих добровольців. Температурні реакції в діапазоні 37,1-37,5ºС були виявлені лише у 5 % добровольців, більш високі температурні і загальні побічні реакції були відсутні; місцева реакція (болючість у місці ін'єкції) була зафіксована тільки в одного добровольця (Таблиця 5). 35 10 UA 111845 C2 Таблиця 5. Безпека вакцини, що включає некон'юговану форму екзополісахариду бактерії S.sonnei, при імунізації дорослих добровольців Реакції на введення вакцини Температурні реакції (37,1 – 37,5º С) Температурні реакції (37,6 – 38,5º С) Температурні реакції (38,5ºС і вище) Загальні побічні реакції Місцеві реакції (болючість) 5 10 15 20 25 30 35 Вакцина, яка включає екзополісахарид бактерії S.sonnei (серія 33), в дозі 50 мкг у 5 % добровольців відсутні відсутні відсутні 1 випадок Vi-антигенна вакцина "Віанвак" (серія 193), в дозі 25 мкг у 5 % добровольців відсутні відсутні відсутні 1 випадок F. Імуногенність некон'югованої вакцини Імуногенність вакцини, яка включає некон'юговану форму екзополісахариду бактерії S.sonnei (серія 33), для дорослих добровольців визначали в серологічних дослідженнях, використовуючи тести імуноферментного аналізу (ELISA) і реакції пасивної гемаглютинації (РПГА). Вакцину, що включає екзополісахарид бактерії S.sonnei (серія 33), в дозі 50 мкг антигену, який міститься в 0,5 мл фенол-фосфатного буфера як розчинника, і препарат для порівняння – вакцину черевнотифозну Vi-антигенну "Віанвак", в дозі 25 мкг, вводили одноразово підшкірно двом групам піддослідних, по 20 дорослих добровольців, у верхню третину плеча. Сироватки крові для досліджень брали у піддослідних до вакцинації і через 30 і 60 днів після вакцинації відповідно. Для проведення ELISA аналізу використовували планшети, сенсибілізовані ліпополісахаридом бактерії S.sonneі, кролячі антитіла проти IgG, IgM, IgA людини, кон'юговані з пероксидазою хрону (Sigma, USA). Оптичну густину вимірювали на ELISA-рідері фірми Bio-Rad iMark при двохвильовому зчитуванні (490/630 нм). Тест РПГА проводили згідно інструкції виробника, використовуючи еритроцитарний комерційний діагностикум (Мікроген, Росія). Імуногенність вакцини оцінювали за такими показниками: 4-х кратним сероконверсіям порівняно з фоновою сироваткою, рівню антигенної відповіді до і після вакцинації; при цьому визначали середні геометричні титри антитіл (СГТА), кратність наростання титрів у групі щеплених випробовуваних у порівнянні з фоновою сироваткою. Наростання титрів анти-О антитіл спостерігали у всіх добровольців, щеплених вакциною, яка включає екзополісахарид бактерії S.sonnei (серія 33). При цьому кратність наростання х х титрів аглютинуючих антитіл до і після вакцинації була високою і склала 40,7 та 42,5 рази на 30-й і 60-й день після вакцинації відповідно. У вакцинованих випробовуваних зареєстровані високі рівні сероконверсії антитіл до О-антигену S.sonnei, які складають ≥90 %. У випробовуваних, імунізованих вакциною "Віанвак", не було відзначено підвищень специфічних антитіл і 4-х кратних сероконверсій (Табл. 6). Вивчення у піддослідних кратності наростання і сероконверсії IgA, IgG, IgM класів антитіл до О-антигену S.sonnei в ELISA-тесті в порівнянні з фоновим рівнем при імунізації їх вакциною, що включає екзополісахарид бактерії S.sonnei (серія 33), виявило високі підвищення титрів антитіл, переважно IgA класу. Так, кратність наростання титру IgA антитіл склала на 30-й і 60-й день х х х х після імунізації 25,7 і 30,2 разів; IgG антитіл – 6,1 і 5,8 разів відповідно. Рівень сероконверсії О-специфічних антитіл IgA, IgG класів був високим і склав для IgA-96 і 94 %; для IgG-73 і 72 % на 30-й і 60-й день після вакцинації відповідно. Таким чином, заявлена вакцина, яка включає некон'юговану форму екзополісахариду бактерії S.sonnei, при одноразовій підшкірній імунізації дорослих добровольців індукує системну адаптивну імунну відповідь з домінуванням антитіл IgA класу. 40 11 UA 111845 C2 Таблиця 6 Індукція вакциною, що включає некон'юговану форму екзополісахариду бактерії S.sonnei, системної імунної відповіді при підшкірній імунізації дорослих добровольців Кратність наростання Число осіб з 4-х титру кратними Вакцина та доза К-сть антитіл сероконверсіями імунізації добровольців порівняно з через 30 днів титром після вакцинації, антитіл до у% вакцинації РПГА-аглютинуючі антитіла Вакцина, яка включає екзополісахарид 20 40,7 90 % бактерії S.sonnei (серія 33), 50 мкг Vi-антигенна вакцина "Віанвак" (серія 193), 20 1,14 Не виявлено 25 мкг ELISA-IgA Вакцина, яка включає екзополісахарид 20 25,7 95 % бактерії S.sonnei (серія 33), 50 мкг Vi-антигенна вакцина "Віанвак" (серія 193), 20 0,82 Не виявлено 25 мкг ELISA – IgG Вакцина, яка включає екзополісахарид 20 6,1 75 % бактерії S.sonnei (серія 33), 50 мкг Vi-антигенна вакцина "Віанвак" (серія 193), 20 1,06 Не виявлено 25 мкг ELISA – IgM Вакцина, яка включає екзополісахарид 20 2,51 50 % бактерії S.sonnei (серія 33), 50 мкг Vi-антигенна вакцина "Віанвак" (серія 193), 20 1,10 Не виявлено 25 мкг 5 10 15 Кратність наростання титру антитіл порівн. з титром антитіл до вакцинаії Число осіб з 4-х і більш кратними сероконверсіями через 60 днів після вакцинації, у% 42,5 95 % 1,16 30,2 0,99 5,8 1,09 2,73 1,14 Не виявлено 95 % Не виявлено 70 % Не виявлено 50 % Не виявлено G. Застосування екзополісахариду для виробництва кон'югованої вакцини (фармацевтичного засобу) Екзополісахарид (ЕП) отримували з використанням бактерії S.sonnei, фаза 1 згідно Прикладу 1(А). Отримання кон'югату ЕП з білком може бути проведене за будь-яким з відомих методів. В рамках даного дослідження було використано підхід (Taylor D.N., Trofa A.C., Sadoff J., Chu C., Brula D., Shiloach J., Cohen D., Ashkenazi S., Lerman Y., Egan W., Schneerson R., Robbins J.B. Synthesis, characterization, and clinical evaluation of conjugate vaccines composed of the O-specific polysaccharides of Shigella dysenteriae type 1, Shigella flexneri type 2a, and Shigella sonnei (Plesiomonas shigelloides) bound to bacterial toxoids. Infect. and Immunity. 1993, pp.3678-3687), оснований на модифікації ЕП адипіндигідразидом (АГ) у присутності 1-етил-3-(3диметиламінопропіл)карбодиіміду (КДІ) з подальшою взаємодією утвореного амідованого ЕП з вільною гідразидною групою з білковим носієм – правцевим анатоксином (ПА). 12 UA 111845 C2 5 10 15 20 25 30 35 40 45 50 55 Модифікацію ЕП з АГ в присутності КДІ проводили у воді протягом 2-16 годин, підтримуючи значення рН 4,8-5,2 додаванням конц. НСl за допомогою рН-стата. Модифікований ЕП виділяли на колонці з Сефадексом G-50 у воді. Контроль ступеню амідування здійснювався за допомогою 13С-ЯМР-спектроскопії. Кон'югацію модифікованого ЕП з ПА проводили в 0,2М розчині хлористого натрію в присутності КДІ протягом 4-18 годин, підтримуючи значення рН 5,6 за допомогою рН-стата. Кон'югат очищували на колонці з Сефарозою CL-6B від незначної кількості некон'югованих вихідних біополімерів і низькомолекулярних домішок, використовуючи 0,2М розчин хлористого натрію як елюент. Фракції, що містять кон'югат ЕП з білком і елюють поблизу холостого об'єму колонки, об'єднували і додавали до них фенол до концентрації 0,05-0,15 % для подальшого стерильного розливу в ампули з додаванням фармацевтично допустимих цільових добавок, якими були стабілізатори pH або консерванти, або ад'юванти, або ізотонізуючі агенти чи їх комбінації. Вакцинний кон'югат містив 40 мас. % білка, визначеного методом Бредфорд (Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 1976, v. 72, pp.248-254). Одна прищеплювальна доза кон'югованої вакцини містить: кон'югат екзополісахариду від 0,010 до 0,200 мг; фенол (консервант), не більше 0,75 мг (Sigma, USP Grade 108-95-2), з додаванням натрію хлориду (Sigma, USP Grade 7647-14-5), натрію фосфату двозаміщеного (Sigma, USP Grade 7782-85-6) і натрію фосфату однозаміщеного (Sigma, 13472-35-0); воду апірогенну, стерильну для ін'єкцій 0,5 мл (ФС 42-2620-97, EP IV 2002). H. Імуногенність кон'югованої вакцини Дві групи мишей лінії (СВАХС57Вl/6) FI внутрішньочеревно імунізували вакциною, яка включає некон'юговану форму екзополісахариду бактерії S.sonnei, серія 33 і вакциною, яка включає кон'югат екзополісахариду бактерії S.sonnei, серія 33 з білковим носієм САТ, у дозі 25 мкг полісахариду на мишу. Некон'югована вакцина індукує гуморальну імунну відповідь після одноразового введення і на 15 добу в сироватках периферичної крові тварин визначали 3,4кратне збільшення кількості IgG антитіл. Кон'югована вакцина також індукує гуморальну імунну відповідь після одноразового введення і на 15 добу в сироватках периферичної крові тварин визначали 3,7-кратне збільшення кількості IgG антитіл (Фіг. 8А). Для вивчення вторинної імунної відповіді ті ж групи мишей імунізували вакцинами повторно в дозі 25 мкг полісахариду на мишу через місяць після первинного введення. На 15 добу вторинної відповіді після повторної імунізації кон'югованою вакциною зареєстровано 27-кратне збільшення кількості IgG анти-О антитіл, а після повторної імунізації некон'югованою вакциною – 23,6-кратне збільшення кількості IgG анти-О антитіл відповідно. При цьому рівні О-специфічних антитіл істотно перевищували показники первинної імунної відповіді у імунізованих мишей (Фіг. 8В). Приклад 3 Фармацевтична композиція, яка включає екзополісахарид бактерії S. sonnei, фаза I А. Застосування екзополісахариду для виробництва фармацевтичної композиції (фармацевтичного засобу) Приготування фармацевтичної композиції включає отримання екзополісахариду з використанням бактерії S.sonnei, фаза1 згідно Прикладу 1 (А) і подальший стерильний розлив в ампули або шприци розчину, що містить активну субстанцію і фармацевтично допустимі цільові добавки, якими можуть бути консерванти, стабілізатори, розчинники або їх комбінації. Лікувальна доза фармацевтичної композиції містить: екзополісахарид, від 0,010 до 5,000 мг, з додаванням натрію хлориду (Sigma, USP Grade 7647-14-5), натрію фосфату двозаміщеного (Sigma, USP Grade 7782-85-6) і натрію фосфату однозаміщеного (Sigma, USP Grade 13472-350), воду апірогенну стерильну для ін'єкцій 0,5 мл (ФС 42-2620-97, EP IV 2002). В. Противірусна дія фармацевтичної композиції Дві групи мишей лінії (СВАХС57Вl/6)FI, по 10 тварин кожна, інфікували дозою LD100 вірулентного штаму грипу А H1N1, після чого здійснювали лікування дослідної групи шляхом щоденного внутрішньочеревного введення фармацевтичної композиції тваринам, в дозі 100 мкг екзополісахариду на тварину; контрольній же групі тварин аналогічно вводили фізіологічний розчин. Виживаність тварин визначали протягом двох тижнів після інфікування. У контрольній групі виживаність склала 0 %, у дослідній - 20 % (Фіг. 9). При цьому середні показники тривалості життя дослідної групи мишей статистично достовірно (р>0,001) були вище контрольної. Таким чином, отримані експериментальні дані свідчать про те, що заявлена фармацевтична композиція має дію, що модулює реакції імунної системи. 13 UA 111845 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 1. Полісахарид бактерії Shigella sonnei, фаза І, який включає від 1 до 100 повторюваних дисахаридних ланок O-[4-аміно-2-(N-ацетил)аміно-2,4-дидезокси-β-D-галактопіранозил]-(1—>4)O-[2-(N-aцeтил)aмiнo-2-дeзoкcи-α-L-альтрпірануронової кислоти], сполучених у полісахаридний ланцюг (1—>3) зв'язками, і негідроксильовані жирні кислоти. 2. Полісахарид за п. 1, отриманий з використанням бактерій S. sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання. 3. Полісахарид за п. 2, отриманий з використанням бактерій S. sonnei способом, який включає: (а) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (с) виділення полісахариду з рідкої фази. 4. Полісахарид за п. 3, отриманий з використанням бактерій S. sonnei способом, в якому відділення рідкої фази від бактеріальних клітин здійснюють при збереженні нативності бактеріальних клітин. 5. Полісахарид за п. 1, який являє собою екзополісахарид, що продукується бактеріями S. sonnei, фаза І, в зовнішнє середовище. 6. Полісахарид за п. 5, який являє собою бактеріальний капсульний полісахарид. 7. Полісахарид за п. 1, в якому негідроксильовані жирні кислоти являють собою його нетоксичний ліпідний компонент. 8. Полісахарид за п. 1 або п. 7, в якому негідроксильовані жирні кислоти містять 16-18 вуглецевих атомів у молекулі. 9. Полісахарид за п. 1 або п. 7, або п. 8, в якому вміст негідроксильованих жирних кислот становить не менше 0,01 мас. %. 10. Полісахарид за будь-яким із пп. 1-9, молекулярна маса якого, виміряна методом гельфільтрації, становить від 0,4 до 400 кДа. 11. Полісахарид за будь-яким із пп. 1-10, який містить не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот. 12. Полісахарид за будь-яким із пп. 1-11, який викликає мукозальний захист від шигельозу Зонне шляхом індукції синтезу специфічних антитіл проти бактерії S. sonnei, фаза І в організмі ссавців, включаючи людину. 13. Спосіб отримання полісахариду за п. 1, який включає використання бактерій S. sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання. 14. Спосіб за п. 13, який включає: (а) отримання культури бактерій S. sonnei в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (с) виділення полісахариду з рідкої фази. 15. Спосіб за п. 14, в якому відділення рідкої фази від бактеріальних клітин здійснюють при збереженні нативності бактеріальних клітин. 16. Спосіб за п. 14, в якому виділення полісахариду з рідкої фази включає: (і) видалення з рідкої фази білків і нуклеїнових кислот; (іі) ультрафільтрацію та (ііі) діаліз отриманого розчину. 17. Вакцина, яка включає ефективну кількість полісахариду за п. 1. 18. Вакцина за п. 17, в якій полісахарид отриманий з використанням бактерій S. sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання. 19. Вакцина за п. 18, в якій полісахарид отриманий з використанням бактерій S. sonnei способом, що включає: (а) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (с) виділення полісахариду з рідкої фази. 20. Вакцина за п. 19, в якій полісахарид отриманий з використанням бактерій S. sonnei способом, що включає відділення рідкої фази від бактеріальних клітин при збереженні нативності бактеріальних клітин. 21. Вакцина за п. 17, в якій полісахарид являє собою екзополісахарид, що продукується бактеріями S. sonnei, фаза І, у зовнішнє середовище. 22. Вакцина за п. 21, в якій полісахарид являє собою бактеріальний капсульний полісахарид. 23. Вакцина за п. 17, в якій негідроксильовані жирні кислоти полісахариду являють собою його нетоксичний ліпідний компонент. 24. Вакцина за п. 17 або п. 23, в якій негідроксильовані жирні кислоти полісахариду містять 1618 вуглецевих атомів у молекулі. 25. Вакцина за п. 17 або п. 23, або п. 24, в якій вміст негідроксильованих жирних кислот у полісахариді становить не менше 0,01 мас. %. 26. Вакцина за будь-яким із пп. 17-25, в якій полісахарид має молекулярну масу, виміряну методом гель-фільтрації, від 0,4 до 400 кДа. UA 111845 C2 5 10 15 20 25 30 35 40 45 50 55 27. Вакцина за будь-яким із пп. 17-26, в якій полісахарид містить не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот. 28. Вакцина за будь-яким із пп. 17-27, в якій полісахарид викликає мукозальний захист від шигельозу Зонне шляхом індукції синтезу специфічних антитіл проти бактерії S. sonnei, фаза І в організмі ссавців, включаючи людину. 29. Вакцина за будь-яким із пп. 17-28, в якій полісахарид є апірогенним для кроля в дозі не більше 0,050 мкг/кг в тесті пірогенності на кролях. 30. Вакцина за будь-яким із пп. 17-29, яка включає фармацевтично допустимі добавки. 31. Вакцина за п. 30, в якій фармацевтично допустимі добавки вибрані з групи, що включає стабілізатори рН, консерванти, ад'юванти, ізотонізуючі агенти та їх комбінації. 32. Вакцина за будь-яким із пп. 17-31, в якій полісахарид міститься в некон'югованій формі. 33. Вакцина за п. 30, яка включає білковий носій як фармацевтично допустиму добавку. 34. Вакцина за п. 33, в якій білковий носій вибраний з групи, що включає дифтерійний анатоксин, правцевий анатоксин і екзопротеїн А Pseudomonas aeruginosa. 35. Вакцина за п. 33 або п. 34, в якій полісахарид міститься в кон'югованій формі. 36. Фармацевтична композиція, яка включає ефективну кількість полісахариду за п. 1. 37. Фармацевтична композиція за п. 36, в якій полісахарид отриманий з використанням бактерій S. sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання. 38. Фармацевтична композиція за п. 37, в якій полісахарид отриманий з використанням бактерій S. sonnei способом, що включає: (а) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (с) виділення полісахариду з рідкої фази. 39. Фармацевтична композиція за п. 38, в якій полісахарид отриманий з використанням бактерій S. sonnei способом, що включає відділення рідкої фази від бактеріальних клітин при збереженні нативності бактеріальних клітин. 40. Фармацевтична композиція за п. 36, в якій полісахарид являє собою екзополісахарид, що продукується бактеріями S. sonnei, фаза І, у зовнішнє середовище. 41. Фармацевтична композиція за п. 40, в якій полісахарид являє собою бактеріальний капсульний полісахарид. 42. Фармацевтична композиція за п. 36, в якій негідроксильовані жирні кислоти полісахариду являють собою його нетоксичний ліпідний компонент. 43. Фармацевтична композиція за п. 36 або п. 42, в якій негідроксильовані жирні кислоти полісахариду містять 16-18 вуглецевих атомів у молекулі. 44. Фармацевтична композиція за п. 36 або п. 42, або п. 43, в якій вміст негідроксильованих жирних кислот у полісахариді становить не менше 0,01 мас. %. 45. Фармацевтична композиція за будь-яким із пп. 36-44, в якій полісахарид має молекулярну масу, виміряну методом гель-фільтрації, від 0,4 до 400 кДа. 46. Фармацевтична композиція за будь-яким із пп. 36-45, в якій полісахарид містить не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот. 47. Фармацевтична композиція за будь-яким із пп. 36-46, в якій полісахарид є модулятором реакцій імунної системи ссавців, включаючи людину. 48. Фармацевтична композиція за будь-яким із пп. 36 -47, в якій полісахарид є апірогенним для кроля в дозі не більше 0,050 мкг/кг в тесті пірогенності на кролях. 49. Фармацевтична композиція за будь-яким із пп. 36-48, яка включає фармацевтично допустимі цільові добавки. 50. Фармацевтична композиція за п. 49, в якій цільові добавки вибрані з групи, що включає консерванти, стабілізатори, розчинники та їх комбінації. 51. Застосування полісахариду за п. 1 для виробництва фармацевтичного засобу. 52. Застосування за п. 51, в якому полісахарид отриманий з використанням бактерій S. sonnei, але при цьому без використання ліпополісахаридів як джерела його отримання. 53. Застосування за п. 52, в якому полісахарид отриманий з використанням бактерій S. sonnei способом, що включає: (а) отримання культури бактерій в рідкій фазі; (b) відділення рідкої фази від бактеріальних клітин; (с) виділення полісахариду з рідкої фази. 54. Застосування за п. 53, в якому полісахарид отриманий з використанням бактерій S. sonnei способом, що включає відділення рідкої фази від бактеріальних клітин при збереженні нативності бактеріальних клітин. 55. Застосування за п. 51, в якому полісахарид являє собою екзополісахарид, що продукується бактеріями S. sonnei, фаза І, у зовнішнє середовище. 56. Застосування за п. 55, в якому полісахарид являє собою бактеріальний капсульний полісахарид. 15 UA 111845 C2 5 10 15 20 57. Застосування за п. 51, в якому негідроксильовані жирні кислоти полісахариду являють собою його нетоксичний ліпідний компонент. 58. Застосування за п. 51 або п. 57, в якому негідроксильовані жирні кислоти полісахариду містять 16-18 вуглецевих атомів у молекулі. 59. Застосування за п. 51 або п. 57, або п. 58, в якому вміст негідроксильованих жирних кислот у полісахариді становить не менше 0,01 мас. %. 60. Застосування за будь-яким із пп. 51-59, в якому полісахарид має молекулярну масу, виміряну методом гель-фільтрації, від 0,4 до 400 кДа. 61. Застосування за будь-яким із пп. 51-60, в якому полісахарид містить не більше 1 мас. % білків і 2 мас. % нуклеїнових кислот. 62. Застосування за будь-яким із пп. 51-61, в якому полісахарид викликає мукозальний захист від шигельозу Зонне шляхом індукції синтезу специфічних антитіл проти бактерії S. sonnei, фаза І в організмі ссавців, включаючи людину. 63. Застосування за будь-яким із пп. 51-61, в якому полісахарид є модулятором реакцій імунної системи ссавців, включаючи людину. 64. Застосування за будь-яким із пп. 51-63, в якому полісахарид є апірогенним для кроля в дозі не більше 0,050 мкг/кг в тесті пірогенності на кролях. 65. Застосування за п. 51, в якому фармацевтичний засіб призначений для парентерального, перорального, ректального, інтравагінального, нашкірного, сублінгвального й аерозольного введення ссавцям, включаючи людину. 16 UA 111845 C2 17 UA 111845 C2 18 UA 111845 C2 19 UA 111845 C2 20 UA 111845 C2 Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Назва патенту англійськоюExopolysaccharide of shigella sonnei bacteria, method for producing same, vaccine and pharmaceutical composition containing same
Автори англійськоюAparin, Petr Gennadievich, Lvov, Vyacheslav Leonidovich, Elkina, Stanislava Ivanovna, Golovina, Marina Eduardovna, Shmigol, Vladimir Igorevich
Назва патенту російськоюЭкзополисахарид бактерии shigella sonnei, способ его получения и включающие его вакцина и фармацевтическая композиция
Автори російськоюАпарин Петр Геннадьевич, Львов Вячеслав Леонидович, Ёлкина Станислава Ивановна, Головина Марина Эдуардовна, Шмиголь Владимир Игоревич
МПК / Мітки
МПК: A61K 39/112, A61P 37/02, C12N 1/00
Мітки: sonnei, вакцина, одержання, спосіб, бактерії, екзополісахарид, композиція, shigella, фармацевтична, містять
Код посилання
<a href="https://ua.patents.su/23-111845-ekzopolisakharid-bakteri-shigella-sonnei-sposib-jjogo-oderzhannya-ta-vakcina-i-farmacevtichna-kompoziciya-shho-jjogo-mistyat.html" target="_blank" rel="follow" title="База патентів України">Екзополісахарид бактерії shigella sonnei, спосіб його одержання та вакцина і фармацевтична композиція, що його містять</a>
Попередній патент: Фармацевтично прийнятні співкристали n-[2-(7-метокси-1-нафтил)етил]ацетаміду і способи їх одержання
Наступний патент: Теплоізольований пристрій для нагрівання курильного матеріалу
Випадковий патент: Кулірний еластичний трикотаж