Конденсовані біциклічні похідні сульфамоїлу та їх застосування як лікарських препаратів для лікування гепатиту b
Номер патенту: 115069
Опубліковано: 11.09.2017
Автори: Версхюерен Вім Гастон, Вандік Коен, Рабуассон П'єр Жан-Марі Бернар
Формула / Реферат
1. Сполука формули (І)
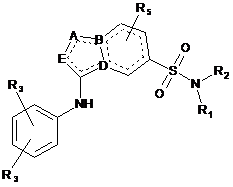 (І)
(І)
або її стереоізомер або таутомерна форма, де
А являє собою N, С або О;
В являє собою С;
D являє собою С або N;
Е являє собою С або N;
де, якщо А і Е є або N, або С, вони необов'язково заміщені R4;
R1 являє собою водень;
R2 являє собою С1-С6алкіл, С5-циклоалкіл або С6-циклоалкіл, які є необов'язково заміщені одним або декількома замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, С1-С4алкілу;
кожен R3 незалежно вибраний з водню, галогену, С1-С4алкілу, CFH2, CF2H або CF3;
R4 являє собою С1-С4алкіл, С3-С5циклоалкіл, -(С=О)С1-С4-алкіл;
R5 являє собою водень;
або її фармацевтично прийнятна сіль або сольват.
2. Сполука за п. 1, де щонайменше один R3 незалежно вибраний з водню, галогену або С1-С4алкілу.
3. Сполука за будь-яким з попередніх пунктів, яка представлена формулою (І-І) або (І-ІІ):
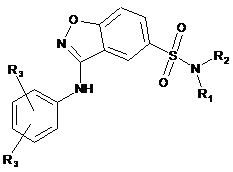 , (I-I)
, (I-I) 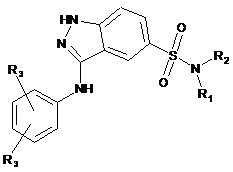 , (I-II)
, (I-II)
де R1, R2 і R3 визначені у будь-якому з попередніх пунктів.
4. Сполука за будь-яким з попередніх пунктів, де щонайменше один R3 незалежно вибраний з фтору або С1-С3алкілу.
5. Сполука за будь-яким з попередніх пунктів, де R1 являє собою водень або метил.
6. Сполука за будь-яким з пп. 1-5 для застосування в попередженні або лікуванні у ссавців інфекції, викликуваної HBV.
7. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-5 і фармацевтично прийнятний носій.
8. Фармацевтична композиція за п. 7 для застосування у попередженні або лікуванні у ссавців інфекції, викликуваної HBV.
9. Продукт, який містить (а) сполуку формули (І) за будь-яким з пп. 1-5 і (b) другий інгібітор HBV, у вигляді комбінованого препарату для одночасного, роздільного або послідовного застосування у лікуванні інфекцій, викликуваних HBV.
Текст
Реферат: Інгібітори реплікації HBV формули (І) R5 A E O D R3 NH R3 B S O N R2 R1 , (І) UA 115069 C2 (12) UA 115069 C2 у тому числі їхні стереохімічні ізомерні форми, а також їхні солі, гідрати, сольвати, де А-Е, R1, R2, R3 та R5 мають значення, визначені в даному документі. Даний винахід також стосується способів одержання вказаних сполук, фармацевтичних композицій, які містять їх, а також до їхнього застосування окремо або в комбінації з іншими інгібіторами HBV в терапії, активній щодо HBV. R5 A E O D R3 NH R3 B S O N R1 R2 UA 115069 C2 5 10 15 20 25 30 Рівень техніки Вірус гепатиту B (HBV) являє собою оболонковий вірус з родини гепаднавірусів (Hepadnaviridae) з частково дволанцюговою ДНК (длДНК). Його геном містить 4 рамки зчитування, які перекриваються: передкоровий/коровий ген; ген полімерази; гени L, M та S, які кодують 3 оболонкових білка; та ген X. При інфікуванні геном з частково дволанцюговою ДНК (релаксована кільцева ДНК; rcDNA) перетворюється у ковалентно замкнуту кільцеву ДНК (cccDNA) в ядрі клітини-хазяїна та вірусні мРНК транскрибуються. Відразу після заключення в капсид передгеномна РНК (pgRNA), яка також кодує коровий білок і Pol, слугує в якості матриці для зворотної транскрипції, яка відновлює геном з частково длДНК (rcDNA) в нуклеокапсиді. HBV викликав спалахи епідемії у ряді регіонів Азії та Африки та він є ендемічним в Китаї. HBV інфіковано приблизно 2 мільярди людей в усьому світі, серед яких у приблизно 350 мільйонів людей розвинулись хронічні інфекції. Вірус викликає захворювання гепатиту B, при цьому хронічна інфекція пов'язана із значно зростаючим ризиком розвитку цирозу та гепатоцелюлярної карциноми. Передача вірусу гепатиту B відбувається при контакті з інфікованою кров'ю або біологічними рідинами, при цьому вірусну ДНК було виявлено в слині, сльозах та сечі хронічних носіїв з високим титром ДНК в сироватці. Існує ефективна та з хорошою переносимістю вакцина, але варіанти направленого лікування в наш час обмежені застосуванням інтерферону та наступних противірусних засобів: тенофовіру, ламівудину, адефовіру, ентекавіру та телбівудину. Гетероарилдигідропіримідини (HAP) було ідентифіковано як клас інгібіторів HBV в культурі тканин та в моделях на тваринах (Weber et al., Antiviral Res. 54: 69–78). Крім того, WO 2013/006394, опублікована 10 січня 2013 р., і WO 2013/096744, опублікована 27 червня 2013 р., відносяться до підкласів сульфамоїл-ариламідів, 35 активних проти HBV. Серед проблем, з якими можна зіткнутися при використанні противірусних препаратів направленої щодо HBV дії, виділяють токсичність, мутагенність, недостатню селективність, слабку ефективність, слабку біодоступність та складність синтезу. Існує потреба у додаткових інгібіторах HBV, які можуть долати щонайменше один з цих недоліків. Опис винаходу В одному аспекті даний винахід пропонує сполуки, які можуть бути представлені формулою (I): R5 A E B O D S R3 O NH N R2 R1 R3 (I), 35 40 45 або їхні стереоізомер або таутомерну форму, де A являє собою N, C або O; B являє собою C або N; D являє собою C або N; E являє собою C або N; де якщо A і E являють собою або N, або C, вони необов'язково заміщені R4; R1 являє собою водень або C1-C3алкіл; R2 являє собою C1-C6алкіл, C1-C3алкіл-R6, бензил або 3-7-членне насичене кільце, що необов'язково містить один або декілька гетероатомів, кожен з яких незалежно вибраний з групи, що складається з O, S та N, при цьому такі C1C6алкіл або 3-7-членне насичене кільце є необов'язково заміщеними одним або декількома замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, C 1C3алкілоксі, C1-C4алкілу, OH, CN, CFH2, CF2H або CF3; або R1 R2 разом з азотом, до якого вони приєднані, утворюють 5-7-членне насичене кільце, необов'язково заміщене одним або декількома замісниками, кожен з яких незалежно вибраний з 1 UA 115069 C2 5 10 15 20 25 30 35 40 45 50 групи, що складається з водню, галогену, C1-C4алкілоксі, C1-C3алкілу, OH, CN, CFH2, CF2H та CF3; кожен R3 незалежно вибраний з водню, галогену, C1-C4алкілоксі, C1-C4алкілу, 5 OH, CN, CFH2, CF2H, CF3 або 3-5-членного насиченого кільця, що необов'язково містить один або декілька гетероатомів, кожен з яких незалежно вибраний з групи, що складається з O і N; R4 являє собою водень, C1-C4алкіл, C3-C5циклоалкіл, -(C=O)C1-C4-алкіл, -(C=O)-C1C3алкілоксі або у випадку, якщо A або E відповідає C, R4 додатково може являти собою галоген; R5 являє собою водень або галоген; R6 являє собою 3-7-членне насичене кільце, що необов'язково містить один або декілька гетероатомів, кожен з яких незалежно вибраний з групи, що складається з O, S та N, при цьому таке 3-7-членне насичене кільце є необов'язково заміщеним одним або декількома замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, C 1-C3алкілоксі, C1C4алкілу, OH, CN, CFH2, CF2H або CF3; або їхні фармацевтично прийнятну сіль або сольват. Крім того, даний винахід відноситься до фармацевтичної композиції, що містить сполуку формули (I) та фармацевтично прийнятний носій. Даний винахід також відноситься до сполук формули (I) для застосування у якості лікарського препарату, переважно для застосування у попередженні або лікуванні у ссавця інфекції, викликаної HBV. У додатковому аспекті даний винахід відноситься до комбінації сполуки формули (I) та іншого інгібітора HBV. Визначення Термін "C1-3алкіл" або "C1-C3алкіл" як група або частина групи відноситься до гідрокарбільного радикала формули C nH2n+1, де n являє собою число в діапазоні від 1 до 3. У випадку, якщо C1-3алкіл приєднаний до ще одного радикала, він відноситься до формули C nH2n. C1-C3алкільні групи містять від 1 до 3 атомів вуглецю, більш переважно від 1 до 2 атомів вуглецю. C1-3алкіл включає всі лінійні або розгалужені алкільні групи з 1-3 атомами вуглецю і, таким чином, включає такі групи, як, наприклад, метил, етил, н-пропіл та ізо-пропіл. C1-4алкіл як група або частина групи означає насичені вуглеводневі радикали з прямим або розгалуженим ланцюгом, які містять від 1 до 4 атомів вуглецю, такі як групи, що визначені для C1-3алкілу та бутилу тощо. C1-6алкіл як група або частина групи означає насичені вуглеводневі радикали з прямим або розгалуженим ланцюгом, які містять від 1 до 6 атомів вуглецю, такі як групи, що визначені для C1-4алкілу та пентилу, гексилу, 2-метилбутилу тощо. Термін "C1-3алкілоксі" як група або частина групи відноситься до радикала з формулою -ORс, де Rс являє собою C1-3алкіл. Необмежувальні приклади придатного C1-3алкілоксі включають метилоксі (також метоксі), етилоксі (також етоксі), пропілоксі та ізопропілоксі. Використовуваний в даному документі термін "3-7-членне насичене кільце" означає насичений циклічний вуглеводень з 3, 4, 5, 6 або 7 атомами вуглецю та є загальним для циклопропілу, циклобутилу, циклопентилу, циклогексилу та циклогептилу. Таке насичене кільце необов'язково містить один або декілька гетероатомів так, що щонайменше один атом вуглецю заміщується гетероатомом, вибраним з N, O та S, зокрема, з N і O. Приклади включають оксетан, тетрагідро-2H-піраніл, піперидиніл, тетрагідрофураніл, морфолініл та піролідиніл. Використовувана в даному документі означає конденсовану біциклічну групу, що необов'язково містить один або декілька гетероатомів так, що щонайменше B, D або E заміщуються азотом або A заміщується N або O ((гетеро-)арил). Вказаній (гетеро-)арильній групі необхідно мати лише деякий ступінь ароматичного характеру. Ілюстративні приклади (гетеро-)арильних груп включають без обмеження бензофуран, індол, ізоіндол, індазол, імідазопіридин та бензизоксазол. Переважними є бензизоксазол та індазол. 2 UA 115069 C2 5 10 15 20 25 30 35 40 45 50 55 60 Необхідно відзначити, що в рамках визначень, використовуваних в усьому описі, можуть існувати різні ізомери різноманітних гетероциклів. Наприклад, піроліл може являти собою 1Hпіроліл або 2H-піроліл. Термін "галоген" є загальним для фтору, хлору, брому або йоду. Також необхідно відзначити, що положення радикалів на будь-якому молекулярному фрагменті, використовуваному у визначеннях, можуть знаходитися в будь-якому місці на такому фрагменті за умов, що він є хімічно стабільним. Наприклад, піридил включає 2-піридил, 3піридил та 4-піридил; пентил включає 1-пентил, 2-пентил та 3-пентил. Якщо будь-яка змінна (наприклад, галоген або C1-4алкіл) зустрічається більше одного разу у будь-якому компоненті, то кожне визначення є незалежним. Для терапевтичного застосування солі сполук формули (I) є такими, в яких протиіон є фармацевтично або фізіологічно прийнятним. Однак солі, які мають фармацевтично неприйнятний протиіон, можуть також знаходити застосування, наприклад, при одержанні або очищенні фармацевтично прийнятної сполуки формули (I). Всі солі, незалежно від того, чи є вони фармацевтично прийнятними, чи ні, включені в об’єм даного винаходу. Фармацевтично прийнятні або фізіологічно переносимі форми солей приєднання, які можуть утворювати сполуки згідно з даним винаходом, можна без перешкод одержувати за допомогою відповідних кислот, таких як, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад, хлористоводнева або бромистоводнева кислота; сірчана; сірчана з утворенням гемісульфатів, азотна; фосфорна і подібні кислоти; або органічні кислоти, такі як, наприклад, оцтова, аспарагінова, додецилcірчана, енантова, капронова, нікотинова, пропіонова, гідроксіоцтова, молочна, піровиноградна, щавелева, малонова, бурштинова, малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламова, саліцилова, п-аміносаліцилова, памоєва і подібні кислоти. І навпаки, вказані форми солей приєднання кислот можна перетворити шляхом обробки відповідною основою у вільну основну форму. Термін "солі" також включає гідрати і форми приєднання розчинника, які можуть утворювати сполуки згідно з даним винаходом. Прикладами таких форм є, наприклад, гідрати, алкоголяти тощо. Сполуки згідно з даним винаходом також можуть існувати у своїх таутомерних формах. Наприклад, таутомерними формами амідних (-C(=O)-NH-) груп є іміноспирти (-C(OH)=N-). Мається на увазі, що таутомерні форми, хоча вони явно і не вказані в представлених в даному документі структурних формулах, включені в об’єм даного винаходу. Термін "стереохімічно ізомерні форми" сполук згідно з даним винаходом, використовуваний у даному документі вище, визначає всі можливі сполуки, складені з одних і тих же атомів, зв'язаних за допомогою такої ж послідовності зв'язків, але які мають різні просторові структури, що не є взаємозамінними, якими можуть володіти сполуки згідно з даним винаходом. Якщо не згадано або не вказано інше, хімічне позначення сполуки охоплює суміш усіх можливих стереохімічно ізомерних форм, якими може володіти вказана сполука. Вказана суміш може містити усі діастереомери та/або енантіомери з основною молекулярною структурою вказаної сполуки. Мається на увазі, що всі стереохімічно ізомерні форми сполук згідно з даним винаходом як у чистому вигляді, так і в суміші одна з однією включені в об’єм даного винаходу. Чисті стереоізомерні форми сполук і проміжних продуктів, згадуваних в даному документі, визначаються як ізомери, які, по суті, не містять інших енантіомерних або діастереомерних форм однієї і тієї ж основної молекулярної структури вказаних сполук або проміжних продуктів. Зокрема, термін "стереоізомерно чистий" відноситься до сполук або проміжних продуктів, які характеризуються стереоізомерним надлишком щонайменше 80% (тобто мінімум 90% одного ізомеру і максимум 10% інших можливих ізомерів) аж до стереоізомерного надлишку 100% (тобто 100% одного ізомеру та відсутність іншого), більш конкретно, до сполук або проміжних продуктів, які характеризуються стереоізомерним надлишком від 90% до 100% включно, ще більш конкретно, які характеризуються стереоізомерним надлишком від 94% до 100% включно, і найбільш конкретно, які характеризуються стереоізомерним надлишком від 97% до 100% включно. Терміни "енантіомерно чистий" та "діастереомерно чистий" необхідно розуміти подібним чином, але у такому випадку відносно, відповідно, енантіомерного надлишку та діастереомерного надлишку суміші, яка являє собою інтерес. Чисті стереоізомерні форми сполук і проміжних продуктів згідно з даним винаходом можна одержувати шляхом застосування методик, відомих з рівня техніки. Наприклад, енантіомери можна відділяти один від одного шляхом селективної кристалізації їхніх діастереомерних солей з оптично активними кислотами або основами. Їхніми прикладами є винна кислота, 3 UA 115069 C2 5 10 15 дибензоїлвинна кислота, дитолуїлвинна кислота та камфорсульфонова кислота. Як альтернатива, енантіомери можна розділяти за допомогою хроматографічних методик з використанням хіральних нерухомих фаз. Вказані чисті стереохімічні ізомерні форми також можна одержати з відповідних чистих стереохімічно ізомерних форм придатних вихідних матеріалів за умов, що реакція проходить стереоспецифічно. Переважно, якщо необхідним є конкретний стереоізомер, то вказану сполуку можна синтезувати стереоспецифічними способами одержання. В цих способах переважно будуть використовуватися енантіомерно чисті вихідні матеріали. Діастереомерні рацемати формули (I) можна одержувати окремо традиційними способами. Відповідними способами фізичного розділення, які можна переважно використовувати, є, наприклад, селективна кристалізація та хроматографія, наприклад, колонкова хроматографія. Мається на увазі, що даний винахід також включає всі ізотопи атомів, які зустрічаються у сполуках за даним винаходам. Ізотопи включають ті атоми, які мають однакове атомне число, але різні масові числа. Як загальний приклад і без обмеження, ізотопи водню включають тритій та дейтерій. Ізотопи вуглецю включають C-13 і C-14. Детальний опис винаходу Далі в усіх випадках використання у даному документі термін "сполуки формули (I)", R5 A E B O D S R3 O NH N R2 R1 R3 (I), 20 25 30 35 40 45 або "сполуки за даним винаходом", або подібний термін, як мається на увазі, включають сполуки загальної формули (I), (Ia), (Ib), (I-I), (I-II), солі, стереоізомерні форми та рацемічні суміші або будь-які їхні підгрупи. Згідно з даним винаходом в формулі (I): A являє собою N, C або O; B являє собою C або N; D являє собою C або N; E являє собою C або N; де якщо A і E являють собою або N, або C, вони необов'язково заміщені R4; R1 являє собою водень або C1-C3алкіл; R2 являє собою C1-C6алкіл, C1-C3алкіл-R6, бензил або 3-7-членне насичене кільце, що необов'язково містить один або декілька гетероатомів, кожен з яких незалежно вибраний з групи, що складається з O, S та N, при цьому такі C 1-C6алкіл або 3-7-членне насичене кільце є необов'язково заміщеними одним або декількома замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, C 1-C3алкілоксі, C1-C4алкілу, OH, CN, CFH2, CF2H або CF3; або R1 R2 разом з азотом, до якого вони приєднані, утворюють 5-7-членне насичене кільце, необов'язково заміщене одним або декількома замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, C1-C4алкілоксі, C1-C3алкілу, OH, CN, CFH2, CF2H та CF3; кожен R3 незалежно вибраний з водню, галогену, C 1-C4алкілоксі, C1-C4алкілу, OH, CN, CFH2, CF2H, CF3 або 3-5-членного насиченого кільця, що необов'язково містить один або декілька гетероатомів, кожен з яких незалежно вибраний з групи, що складається з O і N; R4 являє собою водень, C1-C4алкіл, C3-C5циклоалкіл, -(C=O)C1-C4-алкіл, -(C=O)-C1C3алкілоксі або у випадку, якщо A або E відповідає C, R4 додатково може являти собою галоген; R5 являє собою водень або галоген та R6 являє собою 3-7-членне насичене кільце, що необов'язково містить один або декілька гетероатомів, кожен з яких незалежно вибраний з групи, що складається з O, S та N, при цьому таке 3-7-членне насичене кільце є необов'язково заміщеним одним або декількома замісниками, 4 UA 115069 C2 5 10 15 20 кожен з яких незалежно вибраний з групи, що складається з водню, галогену, C 1-C3алкілоксі, C1C4алкілу, OH, CN, CFH2, CF2H або CF3. У першому варіанті здійснення даного винаходу R 4 являє собою водень, C3C5циклоалкіл, (C=O)C1-C4-алкіл, -(C=O)-C1-C3алкілоксі або у випадку, якщо A або E відповідає C, R 4 додатково може являти собою галоген. В одному варіанті здійснення даного винаходу R 1 являє собою водень або метил. У другому варіанті здійснення даного винаходу R2 являє собою C1-C3алкіл-R6 або C4-C7циклоалкіл, необов'язково заміщений одним або декількома замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, C1-C3алкілоксі, C1-C4алкілу, OH, CN, CFH2, CF2H та CF3; та де R6 являє собою C4-C7циклоалкіл, необов'язково заміщений одним або декількома замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, C 1C3алкілоксі, C1-C4алкілу, OH, CN, CFH2, CF2H, CF3. У третьому варіанті здійснення даного винаходу R2 являє собою C4-C7циклоалкіл, необов'язково заміщений одним або декількома замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, C1-C3алкілоксі, C1-C4алкілу, OH, CN, CFH2, CF2H, CF3. В ще одному варіанті здійснення даного винаходу R2 являє собою C5-циклоалкіл або C6циклоалкіл, необов'язково заміщений одним або декількома замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену та C1-C4алкілу. В іншому варіанті здійснення R3 являє собою фтор, C1-C3алкіл або циклопропіл. Переважно щонайменше один R3 являє собою метил, iзопропіл або циклопропіл. В іншому варіанті здійснення один R3 являє собою метил, ізо-пропіл або циклопропіл, а інший R3 являє собою фтор або водень. Переважно R4 являє собою водень. В переважному варіанті здійснення сполуки представлені формулою (I-I) або (I-II), 25 O N S R3 NH R3 30 35 40 45 50 HN O O N O N R2 S R3 NH R1 R3 , (I-I) O N R2 R1 , (I-II) де R1, R2, R3 визначені вище. Наступні комбінації будь-яких додаткових або переважних варіантів здійснення також охоплено об’ємом даного винаходу. Найбільш переважними є сполуки, показані в таблиці 1. В наступному аспекті даний винахід відноситься до фармацевтичної композиції, що містить терапевтично або профілактично ефективну кількість сполуки формули (I), як визначено у даному документі, та фармацевтично прийнятний носій. Профілактично ефективна кількість у даному контексті являє собою кількість, достатню для запобігання інфекції, викликаної HBV, у суб'єктів, які зазнають ризику інфікування. Терапевтично ефективна кількість у даному контексті являє собою кількість, достатню для стабілізації інфекції, викликаної HBV, для ослаблення інфекції, викликаної HBV, або для ерадикації інфекції, викликаної HBV, у інфікованих суб'єктів. В ще наступному аспекті даний винахід відноситься до способу одержання фармацевтичної композиції, як визначено у даному документі, який включає ретельне перемішування фармацевтично прийнятного носія з терапевтично або профілактично ефективною кількістю сполуки формули (I), як визначено у даному документі. Таким чином, сполуки за даним винаходом або будь-яка їхня підгрупа можуть бути складені у різні фармацевтичні форми з метою введення. Як відповідні композиції можна згадати усі композиції, що зазвичай використовуються для системного введення лікарських засобів. Для одержання фармацевтичних композицій за даним винаходом ефективну кількість конкретної сполуки, необов'язково в формі солі приєднання, як активний інгредієнт об'єднують в однорідну суміш з фармацевтично прийнятним носієм, при цьому носій може набувати широкого різноманіття форм в залежності від форми препарату, необхідного для введення. Дані фармацевтичні композиції є бажаними в одиничній лікарській формі, придатній, зокрема, для 5 UA 115069 C2 5 10 15 20 25 30 35 40 45 50 55 60 перорального, ректального, черезшкірного введення або шляхом парентеральної ін'єкції. Наприклад, при одержанні композицій у вигляді лікарської форми для перорального застосування можна використовувати будь-яке загальноприйняте фармацевтичне середовище, таке як, наприклад, вода, гліколі, олії, спирти тощо, у випадку рідких препаратів для перорального застосування, таких як суспензії, сиропи, еліксири, емульсії та розчини; або тверді носії, такі як крохмалі, цукри, каолін, змащувальні речовини, зв'язувальні речовини, розрихлювачі тощо, у випадку порошків, пігулок, капсул і таблеток. Завдяки своїй простоті введення таблетки і капсули являють собою найбільш переважні форми одиниці дозування для перорального застосування, у випадку яких застосовують тверді фармацевтичні носії. У випадку композицій для парентерального застосування носій буде, як правило, щонайменше у значному ступені включати стерильну воду, хоча може включати й інші інгредієнти, наприклад, для покращення розчинності. Наприклад, можуть бути одержані розчини для ін'єкцій, в яких носій включає фізіологічний розчин, розчин глюкози або суміш фізіологічного розчина і розчина глюкози. Також можуть бути одержані суспензії для ін'єкцій, у випадку яких можна використовувати відповідні рідкі носії, суспендуючі засоби тощо. Також включені препарати у твердій формі, які призначені для перетворення безпосередньо перед застосуванням в препарати в рідкій формі. В композиціях, які придатні для черезшкірного введення, носій необов'язково включає засіб, що сприяє проникненню, та/або придатний змочувальний засіб, необов'язково в комбінації з придатними добавками будь-якої природи в мінімальних пропорціях, при цьому добавки не спричиняють значного шкідливого впливу на шкіру. Сполуки за даним винаходом також можуть бути введені шляхом пероральної інгаляції або інсуфляції у формі розчину, суспензії або сухого порошку з використанням будь-якої системи доставки, відомої з рівня техніки. Особливо переважним є складання вищевказаних фармацевтичних композицій в одиничній лікарській формі для простоти введення і рівномірності дозування. Одинична лікарська форма, застосовувана в даному винаході, відноситься до фізично окремих одиниць, які є придатними як одиничні дози, при цьому кожна одиниця містить попередньо встановлену кількість активного інгредієнта, розраховану для одержання необхідного терапевтичного ефекту, у поєднанні з необхідним фармацевтичним носієм. Прикладами таких одиничних лікарських форм є таблетки (у тому числі подільні таблетки або покриті таблетки), капсули, пігулки, супозиторії, пакетики з порошком, облатки, розчини або суспензії тощо, а також їхні окремі численності. Сполуки формули (I) є активними як інгібітори циклу реплікації HBV та їх можна застосовувати у лікуванні та профілактиці інфекції, викликаної HBV, або захворювань, асоційованих з HBV. Останні включають прогресуючий фіброз печінки, запалення і некроз, що приводить до цирозу, кінцевої стадії захворювання печінки та гепатоклітинної карциноми. Завдяки їхнім противірусним властивостям, зокрема, їхнім властивостям, направленим проти HBV, сполуки формули (I) або будь-яка їхня підгрупа є застосовуваними в інгібуванні циклу реплікації HBV, та їх можна застосовувати, зокрема, в лікуванні теплокровних тварин, зокрема, людей, інфікованих HBV, і в профілактиці інфекцій, викликаних HBV. Крім того, даний винахід відноситься до способу лікування теплокровної тварини, зокрема, людини, інфікованої HBV, або яка зазнає ризику інфекції HBV, при цьому вказаний спосіб передбачає введення терапевтично ефективної кількості сполуки формули (I). Отже, сполуки формули (I), визначені у даному документі, можуть бути використані як ліки, зокрема, як ліки для лікування або попередження інфекції, викликаної HBV. Вказане застосування як ліків або способу лікування включає систематичне введення суб'єктам, інфікованим HBV, або суб'єктам, сприйнятливим до інфекції, викликаної HBV, кількості, ефективної для боротьби із станами, асоційованими з інфекцією, викликаною HBV, або кількості, ефективної для попередження інфекції, викликаної HBV. Даний винахід також відноситься до застосування сполук за даним винаходом у виготовленні лікарського препарату для лікування або попередження інфекції, викликаної HBV. Загалом передбачається, що противірусна ефективна добова кількість повинна складати від приблизно 0,01 до приблизно 50 мг/кг або від приблизно 0,01 до приблизно 30 мг/кг ваги тіла. Може бути доцільним введення необхідної дози у вигляді двох, трьох, чотирьох або більше частин дози з відповідними інтервалами протягом дня. Вказані частини дози можуть бути складені у вигляді одиничних лікарських форм, наприклад, які містять від приблизно 1 до приблизно 500 мг, або від приблизно 1 до приблизно 300 мг, або від приблизно 1 до приблизно 100 мг, або від приблизно 2 до приблизно 50 мг активного інгредієнта на одиничну лікарську форму. Даний винахід також відноситься до комбінацій сполуки формули (I) або будь-якої її підгрупи, як визначено у даному документі, з іншими засобами проти HBV. Термін "комбінація" 6 UA 115069 C2 5 10 15 20 25 30 може відноситися до продукту або набору, який містить (a) сполуку формули (I), визначену вище, і (b) щонайменше одну іншу сполуку, здатну лікувати інфекцію, викликану HBV (у даному документі позначено як засіб проти HBV), у вигляді комбінованого препарату для одночасного, роздільного або послідовного застосування у лікуванні інфекцій, викликаних HBV. У варіанті здійснення даний винахід відноситься до комбінації сполуки формули (I) або будь-якої її підгрупи щонайменше з одним засобом проти HBV. В конкретному варіанті здійснення даний винахід відноситься до комбінації сполуки формули (I) або будь-якої її підгрупи щонайменше з двома засобами проти HBV. В конкретному варіанті здійснення даний винахід відноситься до комбінації сполуки формули (I) або будь-якої її підгрупи щонайменше з трьома засобами проти HBV. В конкретному варіанті здійснення даний винахід відноситься до комбінації сполуки формули (I) або будь-якої її підгрупи щонайменше з чотирма засобами проти HBV. Комбінацію відомих раніше засобів проти HBV, таких як інтерферон-α (IFN-α), пегільований інтерферон-α, 3TC, адефовір або їхня комбінація, а також сполуки формули (I) або їхню будьяку підгрупу можна використовувати як ліки у комбінованій терапії. Загальні способи синтезу Загальний синтез Сполуки загальної формули (Ia) (сполука I, де E відповідає азоту та B і D відповідають вуглецю, а також A відповідає азоту або кисню, схема 1) можуть бути синтезовані, як показано на схемі 1. Похідна II 5-(хлорсульфоніл)-2фторбензойної кислоти приєднується до аміну із структурою III з одержанням сульфонаміду IV. Сполуку VI одержують шляхом утворення аміду при взаємодії карбонової кислоти IV та аніліну V, наприклад, із застосуванням HATU за присутності органічної основи, наприклад, N,N-діізопропілетиламіну (DIPEA) в DMF. Тіоамід VII може бути одержано шляхом реакції сполуки VI із засобом для тіонування, наприклад, реагентом Лавесона (2,4-біс(4-метоксифеніл)-1,3,2,4-дитіадифосфетан-2,4-дисульфід). Нарешті здійснюють реакцію сполуки VII з NH2OH, у випадку якщо A відповідає кисню або NH2NH2, у випадку якщо A відповідає азоту, при підвищеній температурі (наприклад, 120 °C -150 °C, в DMSO) з одержанням сполуки Ia. Схема 1 7 UA 115069 C2 Схема 2 5 Як альтернатива, для синтезу сполук загальної формули (Ia) може застосовуватися шлях, описаний на схемі 2. Сполуку VIII можна піддати реакції з аміном формули (III) з одержанням сполуки IX, яка циклізована із сполукою формули X, наприклад, шляхом застосування гідразину в iPrOH при 110 °C, якщо A відповідає NH в сполуці X. Потім сполука X може бути перетворена в сполуку загальної формули (Ia), наприклад, за допомогою каталізованого міддю зв'язування із застосуванням боронової кислоти XI. 10 Схема 3 15 На схемі 3 описаний загальний синтез сполук загальної формули (Ib). В результаті реакції сполуки XII з тіoізоціанатом XIII та циклізації утвореної проміжної сполуки утворюється сполука загальної формули (Ib), наприклад, під впливом N,N'-дициклогексилметандііміну або 2-хлор-1метилпіридинію йодиду. Сполуки загальної формули XIIa і XIIb можуть бути одержані, як показано на схемі 4 та як показано на прикладі синтезу сполук 17, 18 та 19. 20 Схема 4 8 UA 115069 C2 5 10 15 20 25 30 Експериментальні дані: Умови LCMS: Спосіб A. Загальні умови: рухома фаза A: H2O (0,1% TFA); B: CH3CN (0,05% TFA). Час зупинки: 2 хв.; час градієнтного елюювання (хв.) [%A/%B] 0,01 [90/10] - 0,9 [20/80] - 1,5 [20/80] 1,51 [90/10]; потік: 1,2 мл/хв.; температура колонки: 50 °C, Xtimate C18 2,1×30 мм, 3 мкм. Спосіб В. Загальні умови: рухома фаза A: H2O (0,1% TFA); B: CH3CN (0,05% TFA). Час зупинки: 10 хв.; час градієнтного елюювання (хв.) [%A/%B] 0,0 [90/10] - 0,8 [90/10] - 4,5 [20/80] 7,5 [20/80] - 8,0 [90/10]; потік: 0,8 мл/хв.; температура колонки: 50 °C, YMC-PACK ODS-AQ, 50×2,0 мм, 5 мкм. Спосіб С. Загальні умови: рухома фаза A: H2O (0,1% TFA); B: CH3CN (0,05% TFA). Час зупинки: 10 хв.; час градієнтного елюювання (хв.) [%A/%B] 0,0 [70/30] - 0,8 [70/30] - 4 [10/90] - 7,5 [10/90] - 8,0 [70/30]; потік: 0,8 мл/хв.; температура колонки: 50 °C YMC-PACK ODS-AQ, 50×2,0 мм, 5 мкм. Спосіб D. Загальні умови: рухома фаза A: H2O (0,1% TFA); B: CH3CN (0,05% TFA). Час зупинки: 10 хв.; час градієнтного елюювання (хв.) [%A/%B] 0,0 [100/0] - 1 [100/0] - 5 [40/60] - 7,5 [40/60] - 8,0 [100/0]; потік: 0,8 мл/хв.; температура колонки: 50 °C, YMC-PACK ODS-AQ, 50×2,0 мм, 5 мкм. Спосіб E. Загальні умови: рухома фаза A: H2O (0,1% TFA); B: CH3CN (0,05% TFA). Час зупинки: 10 хв.; час градієнтного елюювання (хв.) [%A/%B] 0,0 [90/10] - 0,8 [90/10] - 4,5 [20/80] 7,5 [20/80] - 9,5 [90/10]; потік: 0,8 мл/хв.; температура колонки: 50 °C, Agilent TC-C18, 50×2,1 мм, 5 мкм. Спосіб F. Вимірювання протягом LC проводили з використанням Acquity UPLC (Waters), з нагрівачем колонки (встановленим на 55 °C). Зворотно-фазову UPLC (надефективну рідинну хроматографію) здійснювали на колонці Acquity UPLC HSS T3 (1,8 мкм, 2,1×100 мм; Waters Acquity) при швидкості потоку 0,8 мл/хв. Дві рухомі фази (A: 10 мМ ацетат амонію у суміші H2O/ацетонітрил 95/5; рухома фаза B: ацетонітрил) використовували для виконання умов градієнта від 100% A і 0% B до 5% A і 95% B за 2,1 хвилини і після цього до 0% A і 100% B за 0,9 хвилини, до 5% A і 95% B за 0,5 хв. Використовували об'єм проби для введення 1 мкл. Напруга на конусі складала 30 В для режиму позитивної іонізації та 30 В для режиму негативної іонізації. Синтез сполук 35 40 45 До 5-(хлорсульфоніл)-2-фторбензойної кислоти (5,5 г, 23,05 ммоля) в EtOAc (75 мл) додавали циклогексанамін (6,86 г, 69,15 ммоля) при кімнатній температурі. Реакційну суміш перемішували при кімнатній температурі протягом 10 хвилин і далі промивали за допомогою 1 н HCl (50 мл). Органічну фазу висушували над MgSO 4 і концентрували у вакуумі з одержанням 5(N-циклогексилсульфамоїл)-2-фторбензойної кислоти у вигляді білої твердої речовини (6 г), яку використовували на наступній стадії без додаткового очищення. До частини вищевказаної одержаної твердої речовини (1,5 г) додавали 4-фторанілін (553 мг, 4,98 ммоля) та DIPEA (1,287 г, 9,96 ммоля) в DMF (30 мл), HATU (2,27 г, 5,97 ммоля) при кімнатній температурі. Суміш перемішували при кімнатній температурі протягом 15 годин. Додавали EtOAc (300 мл) і воду (200 мл), та суміш промивали сольовим розчином (2×200 мл), висушували над MgSO 4, фільтрували і концентрували з одержанням сполуки 1. Спосіб A; Rt: 1,12 хв., маса/заряд: 395,1 + (M+H) . Точна маса: 394,1. 9 UA 115069 C2 5 Суміш сполуки 1 (1,5 г, 3,8 ммоля) та 2,4-біс(4-метоксифеніл)-1,3,2,4дитіадифосфетан-2,4дисульфіду (реагент Лавесона 923 мг, 2,28 ммоля) в толуолі (40 мл) перемішували при 110 °C протягом 15 годин. Суміш концентрували в вакуумі з одержанням жовтої твердої речовини (2,2 г). Цю тверду речовину, яка містила сполуку 2, використовували як таку на наступній стадії реакції. 10 15 Частину вищевказаної одержаної твердої речовини, яка містила сполуку 2 (700 мг) і N2H4.H2O (546 мг, 17 ммоль) в DMSO (15 мл), перемішували при 150 °C протягом 5 годин. Додавали воду і суміш екстрагували за допомогою EtOAc (150 мл). Органічні шари промивали сольовим розчином, висушували і концентрували у вакуумі з одержанням залишку. Одержаний залишок перекристалізовували з MeOH-вода з одержанням сполуки 3 у вигляді світложовтої твердої речовини (280 мг) після фільтрації і висушування у вакуумі. Спосіб B; Rt: 4,52 хв., + 1 маса/заряд: 389,2 (M+H) . Точна маса: 388,1; H ЯМР (400 МГц, DMSO-d6) δ ppm 12,41 (1 H, s), 9,26 (1 H, s), 8,60 (1 H, d, J=1,0 Гц), 7,66-7,82 (3 H, m), 7,41-7,62 (2 H, m), 7,02-7,21 (2 H, m), 2,783,04 (1 H, m), 1,461,69 (4 H, m), 1,32-1,46 (1 H, m), 0,89-1,30 (5 H, m). 20 25 30 Частину вищевказаної одержаної твердої речовини, яка містила сполуку 2 (1 г), Na 2CO3 (2,58 г, 24,3 ммоля) та NH2OH.HCl (1,69 г, 24,3 ммоля) в DMSO (20 мл) та воду (4 мл), перемішували при 120 °C протягом 5 годин. Додавали воду і суміш екстрагували за допомогою EtOAc (150 мл), органічний шар промивали сольовим розчином, висушували і концентрували у вакуумі з одержанням залишку. Цей залишок очищали препаративною HPLC (Phenomenex Synergi maxRP 150x30 мм; рухома фаза A: очищена вода (0,075% TFA, об'єм/об'єм); рухома фаза B: ацетонітрил; швидкість потоку: 30 мл/хв.; градієнт: 53-83% більше 8 хвилин з одержанням сполуки 4 у вигляді білої твердої речовини (120 мг). Спосіб C; Rt: 3,79 хв., маса/заряд: 390,3 + 1 (M+H) . Точна маса: 389,1; H ЯМР (400 МГц, DMSOd6) δ ppm 9,90 (1 H, s), 8,75 (1 H, d, J=1,5 Гц), 8,04 (1 H, dd, J=9,0, 1,5 Гц), 7,83 (1 H, d, J= 9,0 Гц), 7,75 (1 H, d, J=7,5 Гц), 7,67-7,73 (2 H, m), 7,16-7,30 (2 H, m), 2,903,02 (1 H, m), 1,48-1,65 (4 H, m), 1,37-1,49 (1 H, m), 0,95-1,21 (5 H, m). 35 10 UA 115069 C2 Сполука 5 5 10 15 20 25 30 Циклопентанамін (17,85 г, 210 ммоль) і NaOH (16,8 г, 420 ммоль) розчиняли в THF (300 мл) і H2O (300 мл). 5-(Хлорсульфоніл)-2-фторбензойну кислоту (50 г, 210 ммоль) додавали при 0 °C. Суміш перемішували при 20 °C протягом 12 годин. Суміш промивали за допомогою етилацетату (3×50 мл). Водний шар відділяли і доводили до pH=3 за допомогою 1 н HCl. Утворений осад фільтрували і висушували у вакуумі з одержанням 5-(N-циклопентилсульфамоїл)-2фторoбензойної кислоти (40 г). 5-(Nциклопентилсульфамоїл)-2-фторoбензойна кислота (40 г, 139,4 ммоля), 4-фторанілін (19,3 г, 167,2 ммоля) та триетиламін (28,2 г, 278,8 ммоля) розчиняли в DMF (400 мл). HATU (63 г, 167,2 ммоля) додавали при 0 °C і далі суміш перемішували при 20 °C протягом 6 годин. Розчинник видаляли у вакуумі і одержаний залишок очищали колонковою хроматографією на силікагелі (елюент: петролейний ефір:етилацетат = 5:1) з одержанням 5-(N-циклопентилсульфамоїл)-2фтор-N-(4-фторфеніл)бензаміду (38 г). 5-(N-циклопентилсульфамоїл)-2-фтор-N-(4фторфеніл)бензамідамід (38 г, 100 ммоль) і реагент Лавесона (40,4 г, 100 ммоль) розчиняли в толуолі (1000 мл). Суміш перемішували при 120 °C протягом 16 годин. Леткі компоненти видаляли у вакуумі і одержаний залишок та N2H4-H2O (80 мл) розчиняли в 1,4-діоксані (500 мл). Суміш перемішували протягом 12 годин при 160 °C. Розчинник видаляли у вакуумі і одержаний залишок очищали високоефективною рідинною хроматографією (колонка: Phenomenex Synergi Diamonsil 150×20 мм×5 мкм. Спосіб: 25%-55% B в A; A: H2O+0,1% TFA B: CH3CN. Швидкість потоку (мл/хв.): 40). Чисті фракції збирали і підлуговували до pH=7 за допомогою насиченого водного NaHCO3. Органічні леткі компоненти видаляли у вакуумі і водний шар екстрагували за допомогою етилацетату (3×20 мл). Об'єднані органічні шари промивали сольовим розчином і висушували над Na2SO4. Розчинник видаляли у вакуумі, одержаний залишок суспендували у воді (5 мл) і водний шар ліофілізували досуха з одержанням сполуки 5 (15 г). Спосіб B; Rt: 4,14 + 1 хв., маса/заряд: 375,2 (M+H) . Точна маса: 374,1; H ЯМР (600 МГц, DMSO-d6) δ ppm 1,26-1,33 (m, 2 H), 1,33-1,40 (m, 2 H), 1,49-1,56 (m, 2 H), 1,56-1,61 (m, 2 H), 3,40 (quin, J=6,6 Гц, 1 H), 7,14 (t, J=8,1 Гц, 2 H), 7,47 (br. s., 1 H), 7,55 (d, J=8,8 Гц, 1 H), 7,73 (dd, J=8,8, 1,8 Гц, 1 H), 7,76 (dd, J=9,1, 4,8 Гц, 2 H), 8,64 (d, J=1,6 Гц, 1 H), 9,28 (s, 1 H), 12,37 (br. s., 1 H). Сполука 6 35 40 Сполуку 5 (400 мг, 1 ммоль) розчиняли в DMF (50 мл). CH3I (0,71 г, 5 ммоль) та K2CO3 (0,69 г, 5 ммоль) додавали в суміш. Суміш перемішували при 110 °C протягом 12 годин. Розчинник видаляли у вакуумі. Залишок очищали за допомогою високоефективної рідинної хроматографії (колонка: Phenomenex Synergi Diamonsil 150×20 мм×5 мкм. Спосіб: 25-55% B в A; A: H2O+0,1% TFA B: CH3CN. Швидкість потоку (мл/хв.) 40). Чисті фракції збирали і підлуговували до pH=7 насиченим водним NaHCO3. Органічний розчинник видаляли у вакуумі і водний шар екстрагували за допомогою етилацетату (3×20 мл). Об'єднані органічні шари промивали сольовим розчином і висушували над Na2SO4. Розчинник видаляли у вакуумі. Залишок очищали із застосуванням тонкошарової хроматографії (елюент: петролейний ефір:етилацетат = 1:1). 11 UA 115069 C2 5 Одержаний продукт суспендували у воді (5 мл) і CH 3CN (2 мл) та суміш ліофілізували досуха з одержанням сполуки 6 (53 мг). + 1 Спосіб D; Rt: 5,87 хв., маса/заряд: 389,2 (M+H) . Точна маса: 388,1; H ЯМР (400 МГц, DMSO-d6) δ ppm 9,32 (1 H, s), 8,58 (1 H, s), 7,67-7,81 (3 H, m), 7,58-7,67 (1 H, m), 7,46 (1 H, d, J=6,5 Гц), 7,12 (2 H, t, J=8,8 Гц), 3,93 (3 H, s), 3,33-3,40 (1 H, m), 1,42-1,66 (4 H, m), 1,16-1,42 (4 H, 1 m). H ЯМР (400 МГц, хлороформ-d) δ ppm 8,26 (1 H, d, J=1,0 Гц), 7,80 (1 H, dd, J=8,9, 1,6 Гц), 7,46-7,55 (2 H, m), 7,34 (1 H, d, J=8,8 Гц), 7,03 (2 H, t, J=8,7 Гц), 6,48 (1 H, s), 4,46 (1 H, d, J=7,0 Гц), 3,98 (3 H, s), 3,52-3,66 (1 H, m), 1,69-1,83 (2 H, m), 1,57-1,66 (2 H, m), 1,45-1,54 (2 H, m), 1,261,45 (2 H, m). 10 Сполука 7 15 20 25 30 35 40 Сполуку 5 (600 мг, 1,6 ммоля) розчиняли в DMF (50 мл). В суміш додавали 2бромпропан (0,98 г, 8 ммоль) і K2CO3 (0,45 г, 5 ммоль) при 0 °C. Суміш перемішували при 0 °C протягом 1 години. Розчинник видаляли у вакуумі і одержаний залишок очищали високоефективною рідинною хроматографією на силікагелі (колонка: Phenomenex Synergi Diamonsil 150×20 мм×5 мкм. Спосіб: 2555% B в A, A: H2O+0,1% TFA B: CH3CN. Швидкість потоку (мл/хв.): 40). Чисті фракції збирали і підлуговували до pH=7 насиченим водним NaHCO3. Леткі компоненти видаляли у вакуумі і водний шар екстрагували за допомогою етилацетату (3×20 мл). Об'єднані органічні шари промивали сольовим розчином і висушували над Na2SO 4. Розчинник видаляли у вакуумі, одержаний продукт суспендували у воді (5 мл) і CH 3CN (2 мл), та суміш ліофілізували + досуха з одержанням сполуки 7 (420 мг). Спосіб E; Rt: 4,90 хв., маса/заряд: 417,1 (M+H) . 1 Точна маса: 416,2. H ЯМР (600 МГц, DMSO-d6) δ ppm 1,27-1,41 (m, 4 H), 1,48 (d, J=6,6 Гц, 6 H), 1,51-1,63 (m, 4 H), 3,38 (quin, J=6,6 Гц, 1 H), 4,91 (spt, J=6,5 Гц, 1 H), 7,15 (t, J=8,9 Гц, 2 H), 7,48 (br. s., 1 H), 7,71 (d, J=9,0 Гц, 1 H), 7,74 (dd, J=9,0, 1,6 Гц, 1 H), 7,76 (dd, J=9,0, 4,8 Гц, 2 H), 8,61 (dd, J=1,5, 0,7 Гц, 1 H), 9,34 (s, 1 H). Сполука 8 Сполуку 5 (600 мг, 1,6 ммоля) розчиняли в 1,4-діоксані (50 мл), додавали циклопропілборонову кислоту (690 мг, 8 ммоль), Cu (OAc) 2 (181 мг, 8 ммоль), Cs2CO3 (0,45 г, 5 ммоль) та DMAP (200 мг, 1,634 ммоля). Суміш перемішували при 50 °C протягом ночі. Розчинник видаляли у вакуумі і одержаний залишок очищали високоефективною рідинною хроматографією на силікагелі (колонка: Phenomenex Synergi Diamonsil 150×20 мм×5 мкм. Спосіб: 25-55% B в A. A: H2O+0,1% TFA B: CH3CN. Швидкість потоку (мл/хв.): 40). Чисті фракції збирали і підлуговували до pH=7 за допомогою насиченого водного NaHCO3. Леткі компоненти видаляли у вакуумі. Водний шар екстрагували за допомогою етилацетату (3×20 мл). Об'єднані органічні шари промивали сольовим розчином і висушували над Na2SO4. Розчинник видаляли у вакуумі і одержаний залишок суспендували у воді (5 мл) і CH 3CN (2 мл). Суміш ліофілізували досуха з одержанням сполуки 8 (380 мг). + 1 Спосіб E; Rt: 4,74 хв., маса/заряд: 415,1 (M+H) . Точна маса: 414,2. H ЯМР (600 МГц, DMSO-d6) δ ppm 1,11-1,15 (m, 4 H), 1,21-1,41 (m, 4 H), 1,45-1,66 (m, 4 H), 3,39 (sxt, J=6,7 Гц, 1 H), 12 UA 115069 C2 3,61-3,68 (m, 1 H), 7,15 (t, J=8,9 Гц, 2 H), 7,51 (d, J=6,9 Гц, 1 H), 7,69 (dd, J=8,9, 0,5 Гц, 1 H), 7,75 (dd, J=9,0, 4,8 Гц, 1 H), 7,79 (dd, J=8,9, 1,7 Гц, 2 H), 8,62 (dd, J=1,8, 0,6 Гц, 1 H), 9,34 (s, 1 H). 5 Сполука 9 10 15 Сполуку 5 (1,5 г, 4 ммоль) розчиняли в Ac 2O (50 мл). Суміш перемішували при 110 °C протягом 12 годин. Розчинник видаляли у вакуумі, одержаний залишок промивали за допомогою H2O (5 мл) і дихлорметану (5 мл) та висушували у вакуумі з одержанням сполуки 9 + (1,35 мг). Спосіб B; Rt: 4,70 хв., маса/заряд: 417,2 (M+H) . Точна маса: 416,1. 1 H ЯМР (600 МГц, DMSO-d6) δ ppm 9,81 (1 H, s), 8,80 (1 H, dd, J=1,8, 0,5 Гц), 8,43 (1 H, dd, J=8,8, 0,5 Гц), 8,03 (1 H, dd, J=8,8, 1,8 Гц), 7,79-7,87 (2 H, m), 7,71 (1 H, d, J=7,0 Гц), 7,18 (2 H, t, J=9,0 Гц), 3,45 (1 H, sxt, J=7,0 Гц), 2,66 (3 H, s), 1,55-1,63 (2 H, m), 1,45-1,56 (2 H, m), 1,32-1,39 (2 H, m), 1,24-1,32 (2 H, m). Сполука 10 20 25 Сполуку 5 (1,5 г, 4 ммоль) розчиняли в DMF (20 мл). NaH (0,48 г, 20 ммоль) додавали в суміш при 0 °C. Метилкарбонохлоридат (1,89 г, 20 ммоль) додавали краплями при 0 °C. Суміш перемішували при 25 °C протягом 12 годин. H2O (5 мл) 5 додавали краплями при 0 °C. Розчинник видаляли у вакуумі. Залишок промивали за допомогою H2O (5 мл), дихлорметану (10 мл) та N,N-диметилформаміду (5 мл) і висушували у вакуумі з одержанням сполуки 10 (1,33 + 1 г). Спосіб B; Rt: 4,54 хв., маса/заряд: 433,1 (M+H) . Точна маса: 432,1. H ЯМР (600 МГц, DMSOd6) δ ppm 9,97 (1 H, s), 8,92 (1 H, dd, J=1,8, 0,6 Гц), 8,28 (1 H, d, J=8,8 Гц), 8,07 (1 H, dd, J=8,8, 1,8 Гц), 7,88-7,95 (2 H, m), 7,79 (1 H, d, J=7,0 Гц), 7,18-7,28 (2 H, m), 4,05 (3 H, s), 3,45-3,55 (1 H, m), 1,58-1,66 (2 H, m), 1,49-1,58 (2 H, m), 1,23-1,42 (4 H, m). 30 Сполука 11 13 UA 115069 C2 Одержували подібно до того, як описано для сполуки 5, із застосуванням (3S)тетрагідрофуран-3-аміну гідрохлориду замість циклопентиламіну та 3,4дифтораніліну + замість 4-фтораніліну. Спосіб D; Rt: 5,5 хв., маса/заряд: 395,2 (M+H) . Точна маса: 394,1. 5 10 Сполука 12 Одержували подібно до того, як описано для сполуки 11, із застосуванням 4фтор-3-метил+ аніліну замість 3,4-дифтораніліну. Спосіб B; Rt: 4,15 хв., маса/заряд: 391,2 (M+H) . Точна маса: 390,1. Сполука 13 15 20 25 30 35 У розчин 3-ціано-4-фторбензолсульфонілхлориду (3 г, 13,7 ммоля) та ізопропіламіну (1,211 г, 20,49 ммоля) в CH2Cl2 (30 мл) додавали N,N-діізопропілетиламін (3,53 г, 27,3 ммоля). Одержувану суміш перемішували при 18 °C протягом 2 годин. Реакційну суміш промивали за допомогою 1 н HCl (25 мл) і насиченого водного NaHCO 3 (25 мл), висушували над Na 2SO4 і концентрували у вакуумі з одержанням неочищеного 3-ціано-4-фтор-Nізопропілбензолсульфонаміду (3,4 г). У розчин неочищеного 3-ціано-4-фтор-Nізопропілбензолсульфонаміду (2,9 г) в 2-пропанолі (30 мл) додавали гідразин (0,77 г, 23,9 ммоля). Одержану суміш нагрівали із зворотним холодильником при 110 °C протягом 1 години. Суміш концентрували при пониженому тиску із одержанням неочищеного 3-аміно-N-ізопропіл1H-індазол-5-сульфонаміду (4,1 г). Розчин ацетату міді(II) (714 мг, 3,93 ммоля) в CH 2Cl2 (15 мл) перемішували протягом 5 хвилин. Додавали неочищений 3-аміно-N-ізопропіл-1H-індазол-5-сульфонамід (1 г), 3,4дифторфенілборонову кислоту (620,9 мг, 3,9 ммоля) та N,N-діізопропілетиламін (508 мг, 3,9 ммоля). Одержану суміш перемішували і нагрівали із зворотним холодильником при 50 °C під O2 протягом ночі. Органічний шар відділяли і водний шар екстрагували дихлорметаном (20 мл). Об'єднані органічні шари висушували над Na2SO4 та концентрували при пониженому тиску з одержанням неочищеної сполуки 13. Неочищений продукт очищали за допомогою препаративної високоефективної рідинної хроматографії на зворотній фазі (елюент: CH3CN в H2O (0,05% NH3.H2O) 38-68%, об'єм/об'єм). Чисті фракції, які містили сполуку 13, збирали і органічні речовини видаляли у вакуумі. Водний шар ліофілізували досуха з одержанням сполуки 13 (114 мг). Спосіб B; Rt: 4,23 хв., маса/заряд: + 367 (M+H) . Точна маса: 366,1. 14 UA 115069 C2 Сполука 14 5 Одержували подібно до того, як описано для сполуки 12, із застосуванням метилгідразину + замість гідрату гідразину. Спосіб D; Rt: 5,88 хв., маса/заряд: 405,3 (M+H) . Точна маса: 404,1. Сполука 15 10 15 Одержували подібно до того, як описано для сполуки 5, із застосуванням ізопропіламіну замість циклопентиламіну, 3-(дифторметил)-4-фтор-аніліну замість 4-фтораніліну та + метилгідразину замість гідрату гідразину. Спосіб B; Rt: 4,71 хв., маса/заряд: 413,3 (M+H) . Точна 1 маса: 412,1. H ЯМР (400 МГц, DMSOd6) δ ppm 0,93 (d, J=6,5 Гц, 6 H) 3,08-3,28 (m, 1 H) 3,97 (s, 3 H) 7,23 (t, J=54,2 Гц, 1 H) 7,28-7,42 (m, 1 H) 7,46 (br. s, 1 H) 7,63-7,72 (m, 1 H) 7,72-7,84 (m, 1 H) 7,91-8,04 (m, 2 H) 8,62 (s, 1 H) 9,59 (s, 1 H). Сполука 16 20 Одержували подібно до того, як описано для сполуки 15, із застосуванням (3S)тетрагідрофуран-3-аміну гідрохлориду замість ізопропіламіну. Спосіб D; Rt: 5,84 хв., + маса/заряд: 441,2 (M+H) . Точна маса: 440,1. 25 Сполука 17 15 UA 115069 C2 5 10 15 20 25 30 35 3-(Дифторoметил)-4-фтор-анілін (1000 мг, 6,2 ммоля), 1,1'-тіoкарбонілід-2(1 h)-піридон (1,72 г, 7,4 ммоля) та CH2Cl2 послідовно додавали у 20 мл флакон при 25 °C. Суміш нагрівали за допомогою мікрохвильового випромінення при 70 °C протягом 1 години. Суміш гасили водою, екстрагували дихлорметаном (20 мл). Органічний шар відділяли та концентрували у вакуумі. Одержаний залишок (1,8 г), який містив 2-(дифторметил)-1-фтор-4-ізотіoціанато-бензол, застосовували без очищення. 6-Хлор-Nізопропіл-піридин-3-сульфонамід (4 г, 17,0 ммоля), ціанід цинку (4,0 г, 34 ммоля), ацетат паладію (II) (381 мг, 1,7 ммоля), 1,1'-біс(дифенілфосфіно)фероцен (942 мг, 1,7 ммоль) та N, Nдиметилацетамід (50 мл) послідовно додавали при 25 °C у колбу об'ємом 250 мл. Суміш підігрівали до 60 °C і перемішували протягом 2 годин в атмосфері азоту. Суміш гасили водою, екстрагували дихлорметаном (50 мл). Органічний шар відділяли та концентрували у вакуумі. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі (елюент: петролейний ефір та етилацетат 3:1) з одержанням 6-ціано-N-ізопропіл-піридин-3-сульфонаміду (3,4 г), 6-ціано-N-ізопропіл-піридин-3-сульфонаміду. 6-Ціано-N-ізопропілпіридин-3-сульфонамід (2 г) та нікель (скелетний, промотований молібденом, 280 мг) розчиняли у метанолі (2 мл). Суміш перемішували в автоклаві (дегазували тричі за допомогою газоподібного водню). Суміш перемішували при 50 °C протягом 12 годин в атмосфері водню (50 фунтів на квадратний дюйм). Суміш відфільтровували і леткі компоненти видаляли у вакуумі. Неочищений 6(амінометил)N-ізопропіл-піридин-3-сульфонамід (1,5 г) застосовували на наступній стадії без очищення. Неочищений 6-(амінометил)-N-ізопропілпіридин-3-сульфонамід (1,5 г) і 2-(дифторметил)-1фтор-4-ізотіоціанато-бензол (1,3 г) розчиняли у толуолі (20 мл). Суміш перемішували при 120 °C протягом 12 годин. Розчинник видаляли у вакуумі. Одержаний залишок очищали колонковою хроматографією на силікагелі (елюент: петролейний ефір:етилацетат = 3:1) з одержанням 1-[3(дифторметил)-4-фтор-феніл]-3-[[5-(ізопропілсульфамоїл)-2піридил]метил]тіосечовини (0,9 г). 1[3-(Дифторметил)-4-фтор-феніл]-3-[[5(ізопропілсульфамоїл)-2-піридил]метил]тіосечовину (0,9 г) і DCC (0,9 г, 4,2 ммоля) розчиняли у толуолі. Суміш перемішували при 120 °C протягом 12 годин. Розчинник видаляли у вакуумі і одержаний залишок очищали високоефективною рідинною хроматографією на зворотній фазі (рухома фаза: CH3CN у воді (0,1 % TFA) 0-30 %). Чисті фракції збирали і нейтралізували за допомогою твердого NaHCO3. Органічний розчинник видаляли у вакуумі. Утворений осад фільтрували, промивали за допомогою H2O (5 мл) і висушували під вакуумом з високим ступенем розрідження. Залишок суспендували у воді (5 мл) і водний шар ліофілізували досуха з одержанням сполуки 17 (290 мг). Спосіб B; Rt: 3,87 хв., + 1 маса/заряд: 399,3 (M+H) . Точна маса: 398,1. H ЯМР (400 МГц, DMSO-d6) δ ppm 0,99 (d, J=6,3 Гц, 6 H) 3,20-3,33 (m, 1 H) 6,72 (d, J=9,5 Гц, 1 H) 7,20 (t, J=53,5 Гц, 1 H) 7,23-7,37 (m, 2 H) 7,56 (d, J=9,5 Гц, 1 H) 7,66-7,85 (m, 2 H) 7,93 (d, J=3,3 Гц, 1 H) 8,75 (s, 1 H) 9,56 (br. s., 1 H). Сполука 18 40 45 2-Хлорпіридин-5-сульфонілхлорид (10 г, 47,1 ммоля) і (S)-3-амінотетрагідрофурантозилат (3,3 г, 38 ммоль) послідовно і повільно додавали при 0 °C до CH2Cl2 (200 мл) триетиламіну. Суміш підігрівали до 25 °C і перемішували протягом 2 годин. Суміш гасили водою, екстрагували дихлорметаном (100 мл). Органічний шар відділяли і концентрували у вакуумі. Неочищений продукт очищали колонковою хроматографією з елююванням петролейним ефіром та етилацетатом (3:1) з одержанням 6-хлор-N-[(3S)тетрагідрофуран-3-іл]піридин-3-сульфонаміду. Сполуку 18 одержували подібно до того, як описано для сполуки 17, із застосуванням 6-хлор-N[(3S)тетрагідрофуран-3-іл]піридин-3-сульфонаміду замість 6-хлор-N-ізопропілпіридин-3сульфонаміду та 4-фтор-3-метилфенілізотіоoціанату замість 2- (дифторметил)-1-фтор-4 16 UA 115069 C2 + ізотіоціанато-бензолу. Спосіб B, Rt: 3,35 хв., маса/заряд: 391,3 (M+H) . Точна маса: 390,1. 5 10 15 20 25 30 35 40 45 Сполука 19 6-Хлор-N-ізопропіл-піридин-3-сульфонамід (1,03 г, 4,38 ммоля) і гідразин (1,54 г, 48,2 ммоля) в EtOH (5 мл) нагрівали при 85 °C протягом 2 годин. Реакційну суміш охолоджували на льодяній бані протягом 1 години. Утворені білі кристали відфільтровували, промивали за допомогою холодного етанолу (5 мл) і висушували у вакуумі при 50 °C протягом 2 годин з одержанням 6гідразино-Nізопропіл-піридин-3-сульфонаміду (694 мг). Розчин 4-фтор-3метилфенілізотіоціанату (477 мг, 2,86 ммоля) в THF (10 мл) додавали порціями протягом 3 хвилин до розчину 6-гідразино-N-ізопропіл-піридин-3-сульфонаміду (679 мг, 2,86 ммоля) в THF і перемішували 90 хвилин. Реакційну суміш концентрували і одержаний білий порошок кристалізували із ацетонітрилу/води. Білі кристали (844 мг) відфільтровували і висушували у вакуумі при 50 °C. До розчину з частиною білих кристалів (738 мг) в THF (50 мл) додавали NEt3 (0,62 мл, 4,45 ммоля) з наступним додаванням 2-хлор-1-метилпіридинію йодиду (569 мг, 2,23 ммоля) і перемішували. Реакційну суміш залишали на ніч і потім концентрували у вакуумі. Одержаний залишок перемішували з CH2Cl2/1 M HCl, 100 мл/100 мл. Жовтий осад відфільтровували, розчиняли в мінімальній кількості метанолу і завантажували в картридж Waters Porapak CX 5 г (елюювали двічі метанолом та елюювали продукт 2 об'ємами NH 3 7M/CH3OH). Після концентрування фракції продукту у вакуумі одержаний залишок піддавали колонковій хроматографії на силікагелі (2-10 % CH3OH в дихлорметані) з одержанням сполуки + 1 19 (75 мг). Спосіб F, Rt: 1,59 хв., маса/заряд: 364,1 (M+H) . Точна маса: 363,1. H ЯМР (400 МГц, DMSO-d6) δ ppm 1,01 (d, J=6,6 Гц, 6 H), 2,26 (d, J=1,5 Гц, 3 H), 3,25-3,40 (1H, сигнал протона під H2O-піком відповідно до 2D-кореляційної спектроскопії), 7,12 (t, J=9,1 Гц, 1 H), 7,36 (dd, J=9,7, 1,5 Гц, 1 H), 7,52-7,59 (m, 1 H), 7,65 (dd, J=6,8, 2,6 Гц, 1 H), 7,76 (dd, J=9,7, 0,9 Гц, 1 H), 8,04 (br. s, 1 H), 9,07 (d, J=1,1 Гц, 1 H), 9,65 (br. s, 1 H). Біологічні приклади – активність проти HBV сполук формули (I) Активність проти HBV вимірювали з використанням стабільно трансфікованої клітинної лінії HepG2.2.15. Описано, що дана клітинна лінія секретує відносно постійні високі рівні віріонних частинок HBV, які, як було показано, викликають як гостру, так і хронічну інфекцію і захворювання у шимпанзе. Для аналізу щодо противірусної активності клітини оброблювали двічі протягом трьох днів за допомогою серійно розведеної сполуки в 96-лункових планшетах в двох повторностях. Після 6 днів обробки противірусну активність визначали шляхом кількісного підрахунку очищеної ДНК HBV від секретованих віріонів з використанням ПЛР в реальному часі і HBV-специфічного набору праймерів та зонду. Активність проти HBV також вимірювали з використанням клітинної лінії HepG2.117, клітинної лінії, яка стабільно індуцибельно продукує HBV, яка реплікує HBV за відсутності доксицикліну (система Tet-off). Для аналізу щодо противірусної активності індукували реплікацію HBV з наступною обробкою за допомогою серійно розведеної сполуки в 96-лункових планшетах в двох повторностях. Після 3 днів обробки противірусну активність визначали шляхом кількісного підрахунку внутрішньоклітинної ДНК HBV з використанням ПЛР в реальному часі і HBV-специфічного набору праймерів та зонду. Цитотоксичність сполук також тестували з використанням клітин HepG2, які інкубували протягом 4 днів за присутності сполук. Життєздатність клітин оцінювали з використанням аналізу з резазурином. Результати представлені в таблиці 1. 17 UA 115069 C2 Таблиця 1 Структура № сполуки HBVHepG2.15; EC50 (мкМ) HepG2 117 EC50 (мкМ) HepG2 4 дні CC50 (мкМ) 3 1,0 4,6 >25 4 0,74 1,2 >25 5 1,0 1,8 >25 6 0,49 0,82 >25 7 >50 >25 >25 8 0,21 0,62 >25 18 UA 115069 C2 Таблиця 1 Структура № сполуки HBVHepG2.15; EC50 (мкМ) HepG2 117 EC50 (мкМ) HepG2 4 дні CC50 (мкМ) 9 >50 18,4 >25 10 46,5 >25 >25 11 3,3 12,4 >25 12 5,2 >25 >25 13 8,9 >25 >25 14 1,1 8,5 >25 19 UA 115069 C2 Таблиця 1 Структура № сполуки HBVHepG2.15; EC50 (мкМ) HepG2 117 EC50 (мкМ) HepG2 4 дні CC50 (мкМ) 15 0,44 2,8 >25 16 1,3 4,5 >25 17 0,56 14,2 >25 18 1,7 >25 >25 19 1,2 3,4 >25 20 UA 115069 C2 ФОРМУЛА ВИНАХОДУ 1. Сполука формули (І) R5 A B E O D R3 NH S R2 N O R1 R3 5 10 15 20 (І) або її стереоізомер або таутомерна форма, де А являє собою N, С або О; В являє собою С; D являє собою С або N; Е являє собою С або N; де, якщо А і Е є або N, або С, вони необов'язково заміщені R4; R1 являє собою водень; R2 являє собою С1-С6алкіл, С5-циклоалкіл або С6-циклоалкіл, які є необов'язково заміщені одним або декількома замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, С1-С4алкілу; кожен R3 незалежно вибраний з водню, галогену, С1-С4алкілу, CFH2, CF2H або CF3; R4 являє собою С1-С4алкіл, С3-С5циклоалкіл, -(С=О)С1-С4-алкіл; R5 являє собою водень; або її фармацевтично прийнятна сіль або сольват. 2. Сполука за п. 1, де щонайменше один R3 незалежно вибраний з водню, галогену або С1С4алкілу. 3. Сполука за будь-яким з попередніх пунктів, яка представлена формулою (І-І) або (І-ІІ): O N S R3 NH R3 25 30 35 HN O O N R2 O N S R3 NH R1 O N R2 R1 R , (I-I) 3 , (I-II) де R1, R2 і R3 визначені у будь-якому з попередніх пунктів. 4. Сполука за будь-яким з попередніх пунктів, де щонайменше один R3 незалежно вибраний з фтору або С1-С3алкілу. 5. Сполука за будь-яким з попередніх пунктів, де R1 являє собою водень або метил. 6. Сполука за будь-яким з пп. 1-5 для застосування в попередженні або лікуванні у ссавців інфекції, викликуваної HBV. 7. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-5 і фармацевтично прийнятний носій. 8. Фармацевтична композиція за п. 7 для застосування у попередженні або лікуванні у ссавців інфекції, викликуваної HBV. 9. Продукт, який містить (а) сполуку формули (І) за будь-яким з пп. 1-5 і (b) другий інгібітор HBV, у вигляді комбінованого препарату для одночасного, роздільного або послідовного застосування у лікуванні інфекцій, викликуваних HBV. Комп’ютерна верстка Л. Ціхановська Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Назва патенту англійськоюFused bicyclic sulfamoyl derivatives and the use thereof as medicaments for the treatment of hepatitis b
Автори англійськоюVandyck, Koen, Verschueren, Wim, Gaston, Raboisson, Pierre, Jean-Marie, Bernard
Автори російськоюВандик Коен, Версхюерен Вим Гастон, Рабуассон Пьер Жан-Мари Бернар
МПК / Мітки
МПК: C07D 261/20, A61K 31/416, A61K 31/42, C07D 231/56
Мітки: біциклічні, препаратів, лікарських, похідні, гепатиту, сульфамоїлу, застосування, лікування, конденсовані
Код посилання
<a href="https://ua.patents.su/23-115069-kondensovani-biciklichni-pokhidni-sulfamolu-ta-kh-zastosuvannya-yak-likarskikh-preparativ-dlya-likuvannya-gepatitu-b.html" target="_blank" rel="follow" title="База патентів України">Конденсовані біциклічні похідні сульфамоїлу та їх застосування як лікарських препаратів для лікування гепатиту b</a>
Попередній патент: Капсула для застосування в пристрої для приготування харчового продукту
Наступний патент: Закупорювальний пристрій, вузол закупорювання та засіб індикації розтинання пляшки з рідиною
Випадковий патент: Фланцевий прокатний профіль












