Похідні діазепіноіндолу (варіанти), фармацевтична композиція з інгібуючою фосфодіестеразу iv активністю
Номер патенту: 42793
Опубліковано: 15.11.2001
Автори: Паскаль Ів, Кальве Алан, Даль Свеін Г., Жюньєн Жан-Луі, Мудлі Індрес
Формула / Реферат
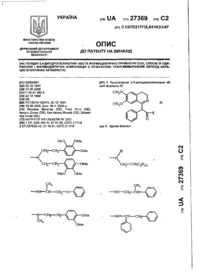
1. Производные диазепиноиндола общей формулы (I)
в которой:
R - водород, низший алкил или низший алкоксил;
А - арил, азотсодержащий гетероарил, серосодержащий гетероарил, незамещенные или замещенные 1-3 независимыми группами, выбранными из галогена, низшего алкила, галогеналкила, низшего алкоксила, гидроксила, ацетокси-, амино-, трет.-бутоксикарбониламино-, циклоалкилкарбониламино- и ацетамидогруппы;
при условии, что, когда R означает водород, то:
I) А не означает 2-индолильный радикал;
II) для рацемических форм А не означает фенильный радикал, замещенный галогеном; галогеном и аминогруппой;
галогеналкильной группой; или 1-3 алкоксильными группами, их рацемические формы, их изомерные конфигурации, определяемые углеродом в положении 3 диазепиноиндол-4-онового ядра и их фармакологически приемлемые соли.
2. Производные диазепиноиндола формулы (I) по п. 1, у которых абсолютной конфигурацией атома углерода в a-положении к карбонилу, диазепинового цикла является (R)-конфигурация.
3. Производные диазепиноиндола формулы (I) по п. 1 или 2, у которых А означает фенил, нафтил; пиридил, тиенил, пиразинил, пиримидил, индолил, хинолил, изохинолил, пиразоло-триазинил, имидазо-пиридил и имидазо-пиримидил, незамещенные или замещенные 1-3 независимыми группами, выбранными из числа галогена, низшего алкила, галогеналкила, низшего алкоксила, гидроксила, ацетокси-, амино-, трет.-бутоксикарбониламино-, циклоалкилкарбониламино- или ацетамидогруппы.
4. Производные диазепиноиндола формулы (I) по любому из пп. 1-3, у которых R означает низший алкил или низший алкоксил.
5. Производные диазепиноиндола формулы (I) по любому из пп. 1-4, у которых R означает метил или метоксигруппу.
6. Производные диазепиноиндола формулы (I) по п. 1, представляющие собой соединения, выбранные из группы, включающей
а) (3R)-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино-[6,7,1-hi]индол-3-ил)изоникотинамид;
б) (4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)-изохинолин-3-карбоновой кислоты;
в) (4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)-4,7-диметил-пиразол[5,1-с][1,2,4]-триазин-3-карбоновой кислоты;
г) (9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)-изохинолин-3-карбоновой кислоты;
д) (3R)-4-хлор-N-(9-метокси-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамид;
е) (9-метокси-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)-хинолин-3-карбоновой кислоты;
ж) (9-метокси-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид(3R)-хинолин-6-карбоновой кислоты;
3) (3R)-3-хлор-4-метокси-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид;
и) (3R)-4-амино-3,5-дихлор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид;
к) (3R)-5,6-дихлор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)никотинамид;
л) (3R)-2-метокси-N-(9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид;
м) (3R)-N-(9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]-диазепино[6,7,1-hі]индол-3-ил)изоникотинамид;
н) (9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)-4,7-диметил-пиразол-[5,1-с][1,2,4]триазин-3-карбоновой кислоты.
7. Производные диазепиноиндола общей формулы (II)
в которой R означает метил или метоксигруппу, представляющие собой промежуточные соединения для получения производных диазепиноиндола по п. 1, у которых R означает метил или метокси.
8. Фармацевтическая композиция с ингибирующей фосфодиэстеразу IV активностью, содержащая активное вещество на основе азотсодержащего гетероциклического соединения и фармацевтически приемлемый наполнитель, отличающаяся тем, что в качестве азотсодержащего гетероциклического соединения она содержит по крайней мере одно производное диазепиноиндола общей формулы (Ia)
в которой:
R1 - водород, низший алкил или низший алкоксил;
А1 - арил, азотсодержащий гетероарил, серосодержащий гетероарил, незамещенные или замещенные 1-3 независимыми группами, выбранными из галогена, низшего алкила, галогеналкила, низшего алкоксила, гидроксила, ацетоксигруппы, аминогруппы, трет-бутоксикарбониламино-, циклоалкилкарбонил-амино- или ацетамидогруппы;
его рацемическую форму или изомерную конфигурацию, определяемую углеродом в положении 3 диазепиноиндол-4-онового ядра, или фармакологически приемлемую соль.
9. Фармацевтическая композиция по п. 8, отличающаяся тем, что она содержит производное диазепиноиндола, у которого абсолютной конфигурацией атома углерода в a-положении к карбонилу диазепинового цикла диазепиноиндола является (R)-конфигурация.
10. Фармацевтическая композиция по п. 8 или 9, отличающаяся тем, что она содержит производное диазепиноиндола, у которого R1 означает метил или метоксигруппу.
11. Фармацевтическая композиция по любому из пп. 8-10, отличающаяся тем, что она содержит производное диазепиноиндола, выбранное из группы, включающей
а) (3R)-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамид;
б) (4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид(3R)изохинолин-3-карбоновой кислоты;
в) (4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид (3R)-4,7-диметил-пиразол[5,1-с][1,2,4]триазин-3-карбоновой кислоты;
г) (9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)-изохинолин-3-карбоновой кислоты;
д) (3R)-4-хлор-N-(9-метокси-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамид;
е) (9-метокси-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)-хинолин-3-карбоновой кислоты;
ж) (9-метокси-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид(3R)-хинолин-6-карбоновой кислоты;
з) (3R)-3-хлор-4-метокси-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид;
и) (3R)-4-амино-3,5-дихлор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид;
к) (3R)-5,6-дихлор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)никотинамид;
л) (3R)-2-метокси-N-(9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид;
м) (3R)-N-(9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]-диазепино[6,7,1-hі]индол-3-ил)изоникотинамид; или
н) (9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)-4,7-диметилпиразол-[5,1-с][1,2,4]триазин-3-карбоновой кислоты.
Текст
1. Производные диазепиноиндола общей формулы (I) C2 (54) ПОХІДНІ ДІАЗЕПІНОІНДОЛУ (ВАРІАНТИ), ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ З ІНГІБУЮЧОЮ ФОСФОДІЕСТЕРАЗУ IV АКТИВНІСТЮ 42793 диазепиноиндол-4-онового ядра, или фармакологически приемлемую соль. 9. Фармацевтическая композиция по п. 8, отличающаяся тем, что она содержит производное диазепиноиндола, у которого абсолютной конфигурацией атома углерода в a-положении к карбонилу диазепинового цикла диазепиноиндола является (R)-конфигурация. 10. Фармацевтическая композиция по п. 8 или 9, отличающаяся тем, что она содержит производное диазепиноиндола, у которого RI означает метил или метоксигруппу. 11. Фармацевтическая композиция по любому из пп. 8-10, отличающаяся тем, что она содержит производное диазепиноиндола, выбранное из группы, включающей а) (3R)-N-(4-oкco-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамид; б) (4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)изохинолин-3-карбоновой кислоты; в) (4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид(3R)-4,7-диметил-пиразол[5,1-с][1,2,4]триазин-3-карбоновой кислоты; г) (9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)-изохинолин-3-карбоновой кислоты; д) (3R)-4-хлор-N-(9-метокси-4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол3-ил)бензамид; е) (9-метокси-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид(3R)хинолин-3-карбоновой кислоты; ж) (9-метокси-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид(3R)хинолин-6-карбоновой кислоты; з) (3R)-3-хлор-4-метокси-N-(4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол3-ил)бензамид; и) (3R)-4-амино-3,5-дихлор-N-(4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]дизепино[6,7,1-hі]индол3-ил)бензамид; к) (3R)-5,6-диxлop-N-(4-oкco-1-фeнил-3,4,6,7тeтpaгидpo-[1,4]диазепино[6,7,1-hі]индол-3ил)никотинамид; л) (3R)-2-метокси-N-(9-метил-4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол3-ил)бензамид; м) (3R)-N-(9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]-диазепино[6,7,1-hi]индол-3-ил)изоникотинамид; или н) (9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hі]индол-3-ил)амид(3R)-4,7диметилпиразол-[5,1-с][1,2,4]триазин-3-карбоновой кислоты. к) (3R)-5,6-дихлор-N-(4-оксо-1-фенил-3,4,6,7тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)никотинамид; л) (3R)-2-метокси-N-(9-метил-4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол3-ил)бензамид; м) (3R)-N-(9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]-диазепино[6,7,1-hi]индол-3-ил)изоникотинамид; н) (9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)амид(3R)-4,7диметил-пиразол-[5,1-с][1,2,4]триазин-3-карбоновой кислоты. 7. Производные диазепиноиндола общей формулы (II) (II) в которой R означает метил или метоксигруппу, представляющие собой промежуточные соединения для получения производных диазепиноиндола по п. 1, у которых R означает метил или метокси. 8. Фармацевтическая композиция с ингибирующей фосфодиэстеразу IV активностью, содержащая активное вещество на основе азотсодержащего гетероциклического соединения и фармацевтически приемлемый наполнитель, отличающаяся тем, что в качестве азотсодержащего гетероциклического соединения она содержит по крайней мере одно производное диазепиноиндола общей формулы (Iа) (Ia) в которой: RІ - водород, низший алкил или низший алкоксил; АІ - арил, азотсодержащий гетероарил, серосодержащий гетероарил, незамещенные или замещенные 1-3 независимыми группами, выбранными из галогена, низшего алкила, галогеналкила, низшего алкоксила, гидроксила, ацетоксигруппы, аминогруппы, трет-бутоксикарбониламино-, циклоалкилкарбониламино- или ацетамидогруппы; его рацемическую форму или изомерную конфигурацию, определяемую углеродом в положении 3 Настоящее изобретение относится к использованию [1,4]диазепино[6,7,1-hi]индолов, некоторые из которых являются новыми для получения лекарственных средств, позволяющих лечить заболевания, терапию которых можно проводить с помощью ингибитора фосфодиэстераз-IV. Эти ле карственные средства особенно пригодны в качестве противовоспалительных, антиаллергических, бронхорасширяющих или антиастматических препаратов, и они лишены вторичных эффектов на систему пищеварения или на сердце. 2 42793 В отличие от свойств, обнаруженных в настоящем изобретении, известный уровень техники описывает [1,4]диазепино-[6,7,1-hi]индолы, обладающие антагонистическими свойствами по отношению к холецистокинину (ССК) и/или гастрину, причем эти соединения предлагаются для лечения заболеваний пищеварительного тракта: желудок, кишечник, поджелудочная железа и желчный пузырь, и особенно расстройств, связанных с нарушением чувства сытости. Так, в европейской заявке на патент №340064 описываются соединения формулы: рые катализируют его гидролиз до неактивного аденозин-5'-монофосфата. У млекопитающих различают по крайней мере пять больших групп фосфодиэстераз циклических нуклеотидов (ФДЭ), пронумерованных как I, II, III, IV и V, в зависимости от их структуры, их кинетического поведения, их специфичности к субстрату или их чувствительности к эффекторам (Beavo J.A., Trends Pharmacol. Sci., 11, 150-155 (1990)). ФДЭ-IV специфичны к сАМР. Известны неспецифические ингибиторы фосфодиэстераз, которые ингибируют несколько групп ферментов. К таким ингибиторам относятся некоторые метилксантины, например, теофиллин. Эти соединения имеют низкий терапевтический индекс, в частности, из-за того, что они воздействуют на типы ФДЭ, присутствующие в других клетках, отличных от клеток-мишеней. Наоборот, некоторые типы ФДЭ могут быть селективно ингибированы с помощью различных фармакологических агентов: они замедляют гидролиз циклических нуклеотидов и, следовательно, их концентрация повышается в тех клетках, где находится тип ФДЭ, чувствительный к ингибитору. Особый интерес представляют собой фосфодиэстеразы-IV (ФДЭ-IV), которые идентифицированы в многочисленных тканях, включая центральную нервную систему, сердце, сосудистый эндотелий, гладкую мышцу сосудов и мышцу воздушных путей, миелоидные и лимфоидные линии. Повышение концентрации сАМР в клетках, принимающих участие в воспалении, ингибирует их активацию: т.е. ингибируется синтез и высвобождение медиаторов на уровне мастоцитов, моноцитов, полинуклеарных эозинофилов и базофилов, ингибируется хемотаксис и дегрануляция полинуклеарных нейтрофилов и эозинофилов, ингибируется деление и дифференциация лимфоцитов. Цитокины, в частности, фактор некроза опухоли и интерлейкины, продуцируемые различными типами лейкоцитов, такими как Т-лимфоциты и полинуклеарные эозинофилы, играют важную роль в возникновении воспалительных симптомов, в особенности в ответ на стимуляцию аллергеном на уровне дыхательных путей. С другой стороны, сАМР снижает тонус гладкомышечных волокон воздушных путей; ингибиторы ФДЭ-IV вызывают бронхорелаксацию. Следовательно, можно предполагать, что селективные ингибиторы ФДЭ-IV обладают терапевтической активностью, и позволяют их использовать как противовоспалительные, антиаллергические, бронхорасширяющие лекарственные средства, а также при лечении астмы, где наблюдают инфильтрацию воздушных путей за счет воспалительных клеток и сужения бронхов. Теофиллин давно и очень широко используется для лечения астмы, и, хотя механизм его действия является сложным, ингибирование ФДЭ благоприятствует его действию, однако его действие сопровождается некоторыми нежелательными эффектами, как тошнота и резкие головные боли. До настоящего времени разработка эффективных ингибиторов ФДЭ-IV оказывалась затруднительной вследствие того, что множество потен в которой R1 и R2 означают водород или галоген, Аr означает индолил или фенил и "n" означает 2 или 3. Эти соединения являются периферическими антагонистами холецистокинина (ССКA). В европейской заявке на патент № 360079 описываются периферические и/или центральные антагонисты ССК формулы: в которой R1 означает возможно замещенный арил; Х означает кислород или метилен, возможно замещенный низшим алкильным радикалом; А означает связь или низший алкилен, который может содержать одну или несколько низших алкильных групп; R2 означает водород или ацил в очень широком смысле. Оказалось, что предпочтительными продуктами этой европейской заявки на патент 360079 являются такие, в которых: - R1 означает 2-фторфенил; и/или - R2 означает арилпропеноильную или гетероарилпропеноильную группу; и/или - конфигурация углерода диазепина в a-положении к его карбонилу является (S)- или (R,S)конфигурацией. В том, что касается ингибирования фосфодиэстераз, то следует напомнить, что циклический аденозин-3',5'-монофосфат (сАМР) представляет собой второй убиквитарный внутриклеточный переносчик информации, промежуточный между первым переносчиком (гормоны, нейротрансмиттеры или аутакоиды) и функциональными клеточными ответами: первый переносчик информации стимулирует фермент, ответственный за синтез сАМР; сАМР затем, в зависимости от затрагиваемой клетки, принимает участие в очень многих функциях: метаболических, контрактильных или секреторных. Воздействия сАМР прекращаются, когда он разрушается фосфодиэстеразами циклических нуклеотидов, внутриклеточных ферментов, кото 3 42793 циальных ингибиторов ФДЭ-IV не лишены активности в отношении фосфодиэстераз других групп. Отсутствие селективности у ингибиторов ФДЭIV создает, таким образом, проблему, учитывая широкий спектр регулируемых с помощью сАМР функций. Следовательно, существует необходимость в эффективных и селективных ингибиторах ФДЭ-IV, то есть не проявляющих активности по отношению к ФДЭ, принадлежащим к другим группам. Ролипрам (DCI), производное пирролидона, синтезируемое с 1975 г., рассматривают как типичный представитель специфических ингибиторов ФДЭ-IV. Синтезированы многочисленные соединения, родственные ролипраму, для их использования в качестве ингибиторов ФДЭ-IV. Ин витро, ролипрам ингибирует активность воспалительных клеток у грызунов: ингибирует синтез медиаторов мастоцитами, полинуклеарными эозинофилами и базофилами, и также моноцитами; ингибирует хемотаксис и дегрануляцию полинуклеаров. Ролипрам предлагается в качестве антидепрессора; однако, его использование сопровождается нежелательными эффектами типа тошноты и рвоты. Однако, вопреки известному уровню техники, в настоящее время найдено, что производные [1,4]диазепино[6,7,1-hi]индолов, некоторые из которых являются новыми, неожиданно являются эффективными ингибиторами ФДЭ-IV в концентрациях, в которых они мало или вовсе не воздействуют на другие виды ФДЭ. Изобретение по существу относится к применению диазепиноиндолов, некоторые из которых являются новыми, формулы (I): (I) в которой: - R означает водород, низший алкил или низший алкоксил; - А означает арил, азотсодержащий гетероарил, или серосодержащий гетероарил, причем каждый может быть замещен 1-3 группами, независимо друг от друга выбираемыми из галогена, низшего алкила, галогеналкила, низшего алкоксила, гидроксила, ацетокси-, амино-, трет.-бутоксикарбониламино-, циклоалкилкарбониламино- или ацетамидогруппы; их рацемических форм, их изомерных конфигураций, определяемых углеродом в положении 3 диазепиноиндол-4-онового ядра, и их фармацевтически приемлемых солей. Во втором аспекте, изобретение относится к диазепиноиндолам формулы (I'): (I') в которой: - R означает водород, низший алкил или низший алкоксил; - А означает арил, азотсодержащий гетероарил или серосодержащий гетероарил, причем каждый может быть замещен 1-3 группами, независимо друг от друга выбираемыми из галогена, низшего алкила, галогеналкила, низшего алкоксила, гидроксила, ацетокси-, амино-, трет.-бутоксикарбониламино-, циклоалкилкарбониламино- или ацетамидогруппы; их рацемическим формам и их изомерам конфигурации, определяемой углеродом в положении 3 диазепиноиндол-4-онового ядра, так же, как их фармацевтически приемлемым солям, при условии, что, когда R означает водород, то: I) А не означает ни индол-2-ильный радикал, ни фенильный радикал, замещенный 1-3алкоксильными группами; II) для рацемических форм или форм конфигурации (S), А не означает фенил, замещенный галогеном; галогеном и аминогруппой; или галогеналкильной группой. В вышеприведенном тексте, так же, как в приводимом ниже тексте: - под арилом понимают фенильную или нафтильную группу; - под азотсодержащим гетероарилом понимают моноциклическую или полициклическую ненасыщенную группу, содержащую по крайней мере один атом азота, и предпочтительно эти азотсодержащие гетероциклы могут представлять собой 4-7 членные гетеромоноциклические группы, содержащие 1-4 атома азота, или нена (I) в которой: - R означает водород, низший алкил или низший алкоксил; - А означает арил, азотсодержащий гетероарил, или серосодержащий гетероарил, причем каждый может быть замещен 1-3 группами, независимо выбираемыми из галогена, низшего алкила, галогеналкила, низшего алкоксила, гидроксила, ацетокси-, амино-, трет.-бутоксикарбониламино-, циклоалкилкарбониламино- или ацетамидогруппы. В первом аспекте, изобретение относится к применению, для получения лекарственных средств, позволяющих лечить заболевания, терапию которых можно проводить с помощью ингибитора фосфодиэстераз-IV, диазепиноиндолов формулы (I): 4 42793 сыщенные конденсированные гетероциклические группы с 1-4 атомами азота; причем азотсодержащая гетероарильная группа может быть метилированной или этилированной по положительно заряженному азоту; - под галогеном понимают фтор, хлор, бром или иод; - под низшим алкилом понимают линейные или разветвленные алкильные группы с 1-4 атомами углерода; - под циклоалкилом понимают циклопропильные, циклобутильные и циклопентильные группы; - под низшим алкоксилом понимают Оалкильную группу, в которой алкильной группой является низший алкил, такой, как указанный выше; - под галогеналкилом понимают моно-, ди- или тригалогеналкил, содержащий 1-4 атома углерода. Перечень фармацевтически приемлемых солей можно найти в J. Pharm. Sci., 66, 1-19 (1977). Однако, под фармакологически приемлемой солью соединения формулы (I), содержащую функцию основного характера, понимают соли присоединения соединений формулы (I), которые получают исходя из неорганических или органических нетоксичных кислот, как, например, соли бромоводородной, соляной, серной, сульфаминовой, фосфорной, азотной, уксусной, пропионовой, янтарной, гликолевой, стеариновой, молочной, яблочной, винной, лимонной, слизевой, аскорбиновой, памоиновой, малеиновой, гидроксималеиновой, фенилуксусной, глутаминовой, бензойной, салициловой, сульфаниловой, ацетоксибензойной, фумаровой, толуолсульфоновой, этандисульфоновой, щавелевой, изетионовой и других кислот. В эту категорию соединений изобретения также входят различные соли четвертичного аммония производных формулы (I). И под фармакологически приемлемой солью соединения формулы (I), содержащего функцию кислого характера, понимают обычные соли соединений формулы (I), которые получают исходя из неорганических или органических нетоксичных оснований, как, например, гидроксиды щелочных и щелочноземельных металлов (лития, натрия, калия, магния и кальция), амины (дибензилэтилендиамин, триметиламин, пиперидин, пирролидин, бензиламин и другие) или гидроксиды четвертичного аммония, как тетраметиламмонийгидроксид. Из диазепиноиндолов формулы (I) и формулы (I') предпочтительны те, в которых R означает низший алкил или низший алкоксил и предпочтительно метил или метоксигруппу. Вообще предпочтительны диазепиноиндолы формулы (I) и формулы (I'), где асимметрический атом углерода в a-положении по отношению к карбонилу диазепинового цикла имеет абсолютную конфигурацию (R) (согласно номенклатуре Кана, Ингольда и Прелога), то есть противоположную таковой, указываемой как благоприятная (S) для сродства антагонистического типа к рецепторам ССК. Изобретение также относится к способу получения диазепиноиндолов формулы (I), который состоит во введении во взаимодействие рацеми ческого или оптически активного амина формулы (II): (II) с производным карбоновой кислоты формулы (III): (III) в которой А имеет вышеуказанное значение и Z означает галоген, азидогруппу, имидазол-1ильную группу, группу -O-CO-Z1, где Z1 может быть, помимо А, пространственно затрудненным алкильным радикалом с 3-6 атомами углерода; наконец, Z1 может означать группу O-Z2, где Z2 означает ароматическую группу, включающую один или два цикла и замещенную одной или несколькими нитрогруппами или атомами галогена, для получения рацемического или оптически активного соединения формулы (I). В частности можно описать получение диазепиноиндолов формулы (I) согласно трем способам А, Б и В, в которых соединение формулы (III) означает продукты формул (IIIA), (IIIБ) и (IIIB), соответственно: согласно реакции: В частности, можно поступать следующим образом. Способ А Соединение формулы (II) растворяют в 550 объемах безводного органического растворителя, например, в хлорированном углеводороде, 5 42793 таком как дихлорметан или хлороформ; в линейном или циклическом простом эфире, таком как 1,2-диметоксиэтан, тетрагидрофуран или диоксан; в полярном апротонном растворителе, таком как пиридин, диметилсульфоксид или диметилформамид, или в любом другом растворителе, пригодном для осуществления реакции конденсации, или же в соответствующей смеси двух или нескольких этих растворителей, и в полученный раствор добавляют 1-2 эквивалента галоидангидрида кислоты формулы А-СО-Х, в которой Х означает галоген, предпочтительно хлор, а А имеет вышеуказанное значение. Затем добавляют такое же эквимолярное количество неорганического или органического основания, предпочтительно триэтиламина, и перемешивают при температуре от -20°С до температуры кипения реакционной среды в течение времени от тридцати минут до 24-х часов. Реакционную смесь, возможно разбавленную одним из вышеуказанных растворителей, затем обрабатывают последовательно разбавленным раствором неорганической кислоты, насыщенным раствором гидрокарбоната натрия, а потом водой. После выпаривания растворителя продукт обычно очищают путем флэш-хроматографии на колонке с диоксидом кремния по методу, разработанному Still и др. J. Org. Chem., 43, 2923 (1978). Способ Б Стадия 1 Соединение формулы А-СООН, в котором А имеет вышеуказанное значение, растворяют в 550 объемах органического растворителя, такого, как растворители, описанные для способа А. В полученный раствор добавляют три эквивалента соединения формулы Z2-OH, в которой Z2 имеет вышеуказанное значение, причем предпочтительными группами Z2 являются п-нитрофенил, 2,4динитрофенил и в частности, пентафторфенил, в присутствии дегидратирующего агента, такого как карбодиимид, и возможно соли пиридиния. Реакционные условия подобны таковым способа А. После выпаривания растворителя, продукт, в зависимости от его степени чистоты, определяемой с помощью тонкослойной хроматографии, очищают путем флэш-хроматографии или используют таким, какой есть, в реакции стадии 2. Стадия 2 Полученный на предыдущей стадии сложный эфир добавляют к одному эквиваленту соединения формулы (II), растворенному в безводном этилацетате. Реакционные условия подобны таковым способа А. После выпаривания растворителя продукт очищают путем флэш-хроматографии. Способ В К соединению формулы (II), растворенному в 5-50 объемах одного из указанных в способе А растворителей, добавляют в небольшом избытке кислоту формулы А-СООН, в которой А имеет вышеуказанное значение, в присутствии одного эквивалента агента конденсации, такого как N,N'дизамещенный карбодиимид, N,N'-карбонилдиимидазол, или как предпочтительный O-[(этоксикарбонил)цианометиламино]-N,N,N',N'-тетраметилуроний-тетрафторборат или бром-трис(пирролидинофосфоний)гексафторфосфат, и двух эквивалентов третичного амина. Реакционные условия подобны таковым способа А. Смесь экстрагируют последовательно разбавленным раствором неорганической кислоты, насыщенным раствором гидрокарбоната натрия и водой. После выпаривания растворителя продукт очищают путем флэш-хроматографии. Общий способ получения промежуточных аминов формулы (II) в их рацемической и/или энантиомерной формах подробно описывается в уровне техники. Например, амин формулы (II) можно получать путем аминирования находящегося в a-положении карбонила диазепиноиндола формулы (V): (V) с помощью производного гидроксиламина или хлорамина; или же, в две стадии, путем введения во взаимодействие соединения формулы (V) с оксимирующим реагентом для получения оксима формулы (IV): (VI) причем вторая стадия заключается в каталитическом восстановлении оксима водородом в присутствии катализатора восстановления или путем реакции с цинком в присутствии уксусной кислоты или с хлоридом олова-(II) в присутствии соляной кислоты, для получения аминопроизводного формулы (II). Нижеприводимая схема иллюстрирует способ синтеза соединения формулы (II): 6 42793 конденсированного с аминокислотой. Путем разложения по Эдману снова получают два энантиомера амина формулы (II); или же: - растворяют рацемическое соединение формулы (II) в растворе оптически активной кислоты, как, например, в энантиомере миндальной, дибензоилвинной, ди-п-толуилвинной, камфорсульфоновой, п-нитробензоилглутаминовой или винной кислот, с целью получения двух диастереоизомерных солей, затем, вследствие различия в растворимости, кристаллизуют селективно одну из них из соответствующего растворителя. Промежуточные продукты формулы (IV) и продукты формулы (II) представляют собой промежуточные соединения, пригодные для получения активных продуктов согласно изобретению. Изобретение также относится к лекарственному средству для борьбы против воспалительных, аллергических заболеваний, против сужения бронхов, или для лечения астмы, отличающемуся тем, что оно включает диазепиноиндол согласно изобретению в фармацевтической форме, приемлемой для излечиваемого заболевания. Индол формулы (IX) восстанавливают до соответствующего индолина формулы (VIII), который конденсируют с бензонитрилом формулы (VII) в присутствии кислоты Льюиса для получения, после гидролиза, бензофенона формулы (VI). Получение продукта формулы (V) из продукта формулы (VI) в присутствии этилглицината в пиридине осуществляют по методу, описанному (метод N) Hester J.B. и др., J. Med. Chem., 13, 827-835 (1970). Для получения оптически активного соединения формулы (II) можно действовать следующим образом: - конденсировать рацемическое соединение формулы (II) с производным a-аминокислоты, принадлежащей к ряду D или к ряду L, и в котором амино-функция защищена легко удаляемой группой, предпочтительно трет.-бутилоксикарбонильной группой. В полученном соединении удаляют защитную группу путем гидролиза, предпочтительно в кислой среде в присутствии трифторуксусной кислоты, и полученный продукт разделяют на его диастереоизомеры с помощью хроматографии; получают два изомера амина, 7 42793 Экспериментальная часть Химическая часть Нижеследующие примеры иллюстрируют осуществление способов и получение продуктов согласно изобретению, не ограничивая этим объема охраны изобретения. Чистоту, идентичность и физико-химические характеристики полученных продуктов и основных полученных промежуточных продуктов определяют следующим образом: - чистоту контролируют путем тонкослойной хроматографии на силикагеле (Мерк 60-F254) и наблюдаемый Rf соотносят к используемому растворителю для элюирования, который, чаще всего, идентичен таковому, используемому для препаративной хроматографической очистки соединений. Эти растворители идентифицируют с помощью следующих аббревиатур: S.A: метиленхлорид S.A1: смесь дихлорметана с ацетоном в соотношении 97:3 по объему; S.A2: смесь дихлорметана с ацетоном в соотношении 96:4 по объему; S.A3: смесь дихлорметана с ацетоном в соотношении 95:5 по объему; S.A4: смесь дихлорметана с ацетоном в соотношении 90:10 по объему; S.A5: смесь дихлорметана с ацетоном в соотношении 88:12 по объему; S.A6: смесь дихлорметана с ацетоном в соотношении 85:15 по объему; S.A7: смесь дихлорметана с этилацетатом в соотношении 98:2 по объему; S.A8: смесь дихлорметана с метанолом в соотношении 98:2 по объему; S.A9: смесь дихлорметана с метанолом в соотношении 97:3 по объему; S.A10: смесь дихлорметана с метанолом в соотношении 95:5 по объему; S.B: этилацетат; S.B1: смесь этилацетата с циклогексаном в соотношении 70:30 по объему; S.B2: смесь этилацетата с циклогексаном в соотношении 60:40 по объему; S.B3: смесь этилацетата с метанолом в соотношении 97:3 по объему; S.B4: смесь этилацетата с метанолом в соотношении 95:5 по объему; - идентичность элементной формулы полученных соединений с элементной формулой целевых структур подтверждают путем анализа основных элементов. Результаты указаны в соответствии с предлагаемой структурой, учитывая возможные сольваты или гидраты; - идентичность полученных продуктов с предлагаемыми структурами подтверждают их спектром протонного ядерного магнитного резонанса и путем их инфракрасных спектров. Спектры 1Н-ЯМР снимают при 400 мгц на приборе марки Брюкер, причем соединения растворяют в дейтерохлороформе с триметилсиланом в качестве внутреннего стандарта. Указывают природу сигналов, их хим. сдвиги в м.д. (миллионные доли), число протонов, к которому их относят, и их ионообменную способность с D2О. Инфракрасные спектры регистрируют при использовании таблетки из бромида калия на спектрометре Шимадзу IR-435; - определяемыми физико-химическими характеристиками являются температура плавления соединений, определяемая по методу в капилляре и соответствующие значения которой приводятся без поправки; вращательная способность соединений, определяемая при комнатной температуре, близкой к 20°С, на приборе Polartronic в кювете длиной 10 см, и результаты определения которой в некоторых случаях позволяют оценить оптическую чистоту путем расчета избытка одного из энантиомеров (е.е.). С целью стандартизации, химическая номенклатура приводимых в примерах продуктов представляет собой таковую, определяемую с помощью программного обеспечения "Autonom", версия 1.0 (Beilstein Institut - изд. Springier), которое создает систематические номенклатуры соединений согласно правилам IUPAC. Также для простоты природу заместителя R приводимых в примерах продуктов уточняют только тогда, когда он отличен от водорода. Промежуточные соединения формулы (II) Промежуточное соединение (I.a): (3RS)-3Aмино-1-фенил-6,7-дигидро-3Н-[1,4]диазепино [6,7,1-hі]индол-4-он (П-R,S) Соединение получают по методике, описанной в примере 1, стадии а) и b), европейской заявки на патент 0340064. Промежуточное соединение (I.б): (3R)-3Aмино-1-фенил-6,7-дигидро-3Н-[1,4]диазепино [6,7,1-hi]индол-4-он (П-R) Получение соединения описывается в примере 5 стадии а), b), с), d), h), экспериментальной части европейской заявки на патент 0340064 А1. Однако, предпочтителен альтернативный способ, который состоит в разделении путем фракционной кристаллизации промежуточного рацемического соединения (1.а) за счет образования и разделения диастереоизомеров с N-ацетил-L-фенилаланином: - 74,0 г (267 ммоль) (3R,S)-3-Амино-1-фенил6,7-дигидро-3Н-[1,4]диазепино[6,7,1-hі]индол-4-она (промежуточное соединение (1.а)) растворяют в 210 мл кипящего н-пропанола. В то же время 44,1 г (267 ммоль) N-ацетил-L-фенил-аланина растворяют в 140 мл кипящего н-пропанола. Оба раствора смешивают, оставляют охлаждаться, вносят затравку в виде нескольких кристаллов. После выдерживания в течение трех дней кристаллы отфильтровывают и высушивают. Масса их составляет 50,0 г (e.e.=77%). Продукт перекристаллизовывают последовательно два раза из кипящего этилацетата. Получают 39,0 г (е.е.=97%). Маточные растворы от первой кристаллизации выпаривают, остаток обрабатывают кипящим этилацетатом. После кристаллизации, фильтрации и высушивания получают 35,0 г кристаллов (е.е.=50%), которые, после двух последовательных кристаллизаций из кипящего этилацетата, позволяют получить 17,0 г (е.е.=97%) продукта. Объединенные две партии кристаллов дают 56,0 г (выход=95%) соли (3R)-энантиомера амина с Nацетил-L-фенил-аланином. Т.пл.=171°С. [a]D= =+132° (с=1, метанол). - 42,4 г (96 ммоль) соли (3R)-амина интенсивно перемешивают в присутствии 500 мл этилацетата и 500 мл 1 н. раствора гидроксида натрия. После 8 42793 - Стадия 3: 9-Метил-1-фенил-6,7-дигидро-3Н[1,4]диазепино[6,7,1-hі]индол-4-он В 140 мл пиридина вводят 21,0 г (88 ммоль) 7бензоил-5-метил-индолина, затем 43,2 г (31 ммоль) этилглицинат-хлоргидрата. Нагревают при перемешивании при температуре 110-115°С, постоянно отгоняя образующиеся легкие фракции. Спустя 12 часов охлаждают и добавляют 150 мл 2,5%-ного раствора карбоната натрия в воде и в 150 мл дихлорметана. Водную фазу отделяют, экстрагируют с помощью 150 мл дихлорметана. Органические фазы объединяют и промывают водой. Растворитель выпаривают, затем остаток очищают путем флэш-хроматографии на колонке с диоксидом кремния, причем используемым элюирующим средством является этилацетат. Получают 22,0 г очищенного продукта в виде твердого вещества бежево-каштанового цвета. Выход = 80%. Т.пл.=132°С. ТСХ: S.B; 0,70. 1 Н-ЯМР, d (м.д.): 2,3 (с, 3Н); 3,15 (т, 2Н); 4,25 (т, 2Н); 4,3 (т, 2Н); 7,0 (с, 1Н); 7,25 (с, 1Н); 7,45 (м, 3Н); 7,55 (м, 2Н). - Стадия 4: 3-Гидроксиимино-9-метил-1фенил-6,7-дигидро-3Н-[1,4]диазепино[6,7,1-hі]индол-4-он 21,0 г (76 ммоль) вышеполученного продукта растворяют в смеси из 84 мл тетрагидрофурана и 168 мл толуола. Охлаждают и при температуре ниже 0°С добавляют 21,3 г (190 ммоль) трет.бутилата калия. При добавлении возникает экзотермическая реакция, и раствор окрашивается в черный цвет. После перемешивания в течение 20 минут, в течение 10 минут добавляют около 9,35 г (80 ммоль) изоамилнитрита. Перемешивают в течение 10 минут при температуре ниже 0°С, затем добавляют 31,2 мл ледяной уксусной кислоты и 300 мл воды. Нерастворимую часть отфильтровывают и добавляют 200 мл дихлорметана. Декантируют и водную фазу промывают с помощью 200 мл дихлорметана. Органические фазы объединяют и промывают с помощью 200 мл воды. После выпаривания растворителя остаток обрабатывают 40 мл метанола. Выкристаллизовавшийся продукт отфильтровывают, промывают с помощью 20 мл охлажденного метанола, затем высушивают. Получают 15,06 г твердого вещества желтого цвета. Выход = 65%. Т.пл.=247°С. ТСХ: S.B2; 0,38. 1 Н-ЯМР, d (м.д.): 2,3 (с, 3Н); 3,2 (т, 2Н); 4,4 (т, 2Н); 7,3 (м, 3Н); 7,4-7,6 (м, 3Н); 7,9 (уш.с, 1Н). - Стадия 5: (3R,S)-3-Амино-9-метил-1-фенил6,7,-дигидро-3Н-[1,4]диазепино[6,7,1-hі]индол-4-он 1,32 г 5%-ного рутения-на-угле добавляют к раствору 4,4 г (14,4 ммоль) полученного на предыдущей стадии продукта в 150 мл метанола. Гидрируют при давлении 8 бар при 80°С в течение 6 часов, затем отфильтровывают, и катализатор промывают. После выпаривания остаток очищают путем флэш-хроматографии на колонке с диоксидом кремния, причем используемым элюирующим средством является смесь из этилацетата, постепенно обогащаемого метанолом. Получают 2,87 г очищенного амина в виде твердого вещества желто-бежевого цвета. Выход = 68%, Т.пл.=116°С. ТСХ: S.B4; 0,14. растворения этилацетатную фазу отделяют, промывают насыщенной хлоридом натрия водой, затем дегидратируют и выпаривают. Получают 25,4 г промежуточного амина (1.б). Выход = 95%. Т.пл.=79°С. [a]D=+172° (с=1, дихлорметан). 1 Н-ЯМР, d (м.д.): 3,05-3,5 (м, 2Н); 3,3 (уш.с, 2Н, обмениваемые); 3,9-4,0 (м, 1Н); 4,6-4,7 (м, 1Н); 7,05-7,6 (м, 9Н). ИК-спектр: 3350, 1670, 1600, 1560, 1420, 1380, 1340, 1290, 1240, 760, 730, 690 см-1. Промежуточное соединение (2.a): (3R,S)-3Амино-9-метил-1-фенил-6,7-дигидро-3Н-[1,4]диазепино[6,7,1-hі]индол-4-он (П-R,S; R=СН3) - Стадия 1: 5-Метил-индолин К раствору 20,0 г (152 ммоль) 5-метил-индола в 300 мл ледяной уксусной кислоты при температуре ниже 20°С маленькими порциями добавляют 28,74 г (457 ммоль) цианоборгидрида натрия. Добавление при слегка экзотермической реакции осуществляют в течение трех часов, и оно сопровождается незначительным выделением водорода. Перемешивают в течение 12 часов при температуре ниже 20°С, затем добавляют 300 мл воды и рН-значение реакционной среды доводят до 1012 путем добавления 500 мл 30%-ного раствора гидроксида натрия. Смесь экстрагируют два раза дихлорметаном, затем органическую фазу промывают с помощью 100 мл воды. Выпаривают, остаток очищают путем флэш-хроматографии на колонке с диоксидом кремния, причем используемым элюирующим средством является смесь возрастающей полярности метанола в дихлорметане. Получают 15,3 г (выход = 75%) бесцветного масла, которое при хранении окрашивается в каштановый цвет (атмосфера азота и отсутствие света). ТСХ (тонкослойная хроматография): S.A8; 0,39. 1 Н-ЯМР, d (м.д.): 2,2 (с, 3Н); 2,95 (т, 2Н); 3,4 (м, 3Н, из которых 1 обмениваемый); 6,5 (д, 1Н); 6,8 (д, 1Н); 6,95 (с, 1Н). - Стадия 2: 7-Бензоил-5-метил-индолин 13,70 г (103 ммоль) 5-Метил-индолина растворяют в 360 мл 1,2-дихлорэтана. При температуре ниже 5°С прикалывают 13,24 г (113 ммоль) трихлорида бора в виде 1М раствора в дихлорметане, 20,36 г (197 ммоль) бензонитрила, затем 13,73 г (103 ммоль) безводного трихлорида алюминия. Смесь кипятят в течение 16 часов с обратным холодильником (температура массы составляет 82-84°С). После охлаждения осуществляют гидролиз путем добавления 103 мл 4 н. соляной кислоты и нагревания в течение 20 минут при 80°С. Оставляют охлаждаться до 20°С и проводят экстракцию дихлорметаном. Водную фазу повторно экстрагируют с помощью 100 мл дихлорметана. Объединенные органические фазы промывают раствором гидроксида натрия, затем концентрированным раствором хлорида натрия и сушат над сульфатом натрия. После отфильтровывания и выпаривания получают 22,10 г твердого вещества желтого цвета. Выход = 91%. Т.пл.=84°С. Соответствующий анализ для C16H15NO. ТСХ: S.A; 0,46 1 Н-ЯМР, d (м.д.): 2,2 (с, 3Н); 3,05 (т, 2Н); 3,75 (т, 2Н); 6,9 (уш.с, 1Н обмениваемый); 7,05 (уш.с, 2Н); 7,5 (м, 3Н); 7,65 (м, 2Н). 9 42793 1 Н-ЯМР, d (м.д.): 2,3 (с, 3Н); 2,4 (уш.с, 2Н обмениваемые); 3,1 (м, 1Н); 3,3 (м, 1Н); 3,95 (м, 1Н); 4,65 (м, 1Н); 7-7,6 (м, 8Н). Промежуточное соединение (2.б): (3R)-3Амино-9-метил-1-фенил-6,7-дигидро-3Н-[1,4]диазапино[6,7,1-hі]индол-4-он (П-R; R=СН3) 19,95 г (68 ммоль) (R,S)-амина формулы (2.а) растворяют в 200 мл ацетонитрила при кипячении с обратным холодильником. В то же время 26,45 г (68 ммоль) ди-п-толуоил-винной кислоты растворяют в 260 мл ацетонитрила при кипячении с обратным холодильником. Горячие растворы смешивают, затем выдерживают в течение 24-х часов при комнатной температуре. Кристаллы белого цвета отфильтровывают и промывают их 100 мл охлажденного ацетонитрила, затем высушивают. Оптическую чистоту определяют путем введения во взаимодействие 5 мг амина с фенил-3метилизоцианатом и исследования полученного продукта на хроматографической колонке типа Pirckle при элюировании смесью изопропанола с циклогексаном в соотношении 50:50 по объему. Отфильтрованные кристаллы массой 20,6 г (е.е.=45%) перекристаллизовывают три раза последовательно из ацетонитрила для получения очищенного продукта (е.е.=98%). Получают 12,0 г продукта. Т.пл.=233°С. [a]D=+177° (с=1, метанол). Вышеполученную соль суспендируют в 100 мл этилацетата. При интенсивном перемешивании добавляют насыщенный раствор гидрокарбоната натрия. Спустя несколько минут водную фазу удаляют. Органическую фазу промывают водой, сушат, затем растворитель выпаривают на холоду в атмосфере азота. Получают очищенное основание. Т.пл.=68°С. [a]D=+207° (с=1, дихлорметан). Промежуточное соединение (3.а): (3R,S)-3Амино-9-метокси-1-фенил-6,7-дигидро-3Н-[1,4]диазепино[6,7,1-hі]индол-4-oн (П-R,S; R=СН3О) Соединение получают из 5-метокси-индола в 5 стадий согласно методике, описанной для получения промежуточного соединения (2.а): - Стадия 1: 5-Метокси-индолин Выход = 83%. Светло-желтая жидкость, которая окрашивается на свету. ТСХ: S.B2; 0,38. 1 Н-ЯМР, d (м.д.): 3,0 (т, 2Н); 3,41 (с, 1Н обмениваемый); 3,5 (т, 2Н); 3,7 (с, 3Н); 6,6 (с, 2Н); 6,8 (с, 1Н). - Стадия 2: 7-Бензоил-5-метокси-индолин Выход = 38%. Твердое вещество оранжевого цвета. Т.пл.=123°С. ТСХ: S.A7; 0,81. 1 Н-ЯМР, d (м.д.): 3,05 (т, 2Н); 3,65 (с, 3Н); 3,75 (т, 2Н); 6,75 (уш.с, 2Н, из которых 1Н обмениваемый); 6,95 (уш.с, 1Н); 7,4-7,55 (м, 3Н); 7,65 (м, 2Н). - Стадия 3: 9-Метокси-1-фенил-6,7-дигидро3Н-[1,4]диазепино[6,7,1-hі]индол-4-он Выход = 82%; Смола коричневого цвета. ТСХ: S.A6; 0,73. 1 Н-ЯМР, d (м.д.): 3,1 (т, 2Н); 3,7 (с, 3Н); 4,3 (т, 2H); 3,9 (с, 2Н); 6,6 (с, 1Н); 7,0 (с, 1Н); 7,3-7,5 (м, 3Н); 7,6 (д, 2Н). - Стадия 4: 3-гидроксиимино-9-метокси-1фенил-6,7-дигидро-3Н-[1,4]диазепино[6,7,1-hі]индол-4-он Выход = 53%. Твердое вещество желтооранжевого цвета. Т.пл.=205°С. ТСХ: S.A5; 0,17. 1 Н-ЯМР, d (м.д.): 3,2 (т, 2Н); 3,7 (с, 3Н); 4,4 (т, 2Н); 6,7 (т, 2Н); 7,1 (с, 1Н); 7,4-7,6 (м, 3Н); 7,8 (д, 2Н); 8,6 (с, 1Н). - Стадия 5: (3R,S)-3-Амино-9-метокси-1фенил-6,7-дигидро-3Н-[1,4]диазепино[6,7,1-hі]индол-4-он Выход = 67%. Твердое вещество желтобежевого цвета. Т.пл.=84°С. ТСХ: S.B3; 0,24 1 Н-ЯМР, d (м.д.): 3,2 (т, 2Н); 3,7 (с, 3Н); 4,4 (т, 2Н); 5,3 (с, 1Н); 6,7 (с, 1Н); 7,1 (с, 1Н); 7,4-7,8 (м, 5Н); 2,1 и 8,5 (уш.с, 2Н обмениваемые). Промежуточное соединение (3.б): (3R)-3Амино-9-метокси-1-фенил-6,7-дигидро-3Н-[1,4]диазепино[6,7,1-hi]индол-4-он (П-R; R=СН3О) 10,0 г (32,3 ммоль) (R,S)-амина формулы (3.а) растворяют в 100 мл ацетонитрила при кипячении с обратным холодильником. В то же самое время 12,47 г (32,3 ммоль) ди-п-толуоил-винной кислоты растворяют в 100 мл ацетонитрила при кипячении с обратным холодильником. Горячие растворы смешивают, затем оставляют для кристаллизации путем охлаждения до комнатной температуры. После выдерживания в течение ночи, кристаллы белого цвета отфильтровывают и промывают их с помощью 100 мл охлажденного ацетонитрила, затем высушивают. Эти кристаллы (е.е.=37%) перекристаллизовывают 2 раза последовательно из ацетонитрила для получения очищенного продукта (е.е.=99,5%). После этой очистки осуществляют хроматографию при использовании колонки с оптически активной неподвижной фазой С18 типа Pirckle, элюируя смесью изопропанола с нгексаном в соотношении 50:50. Получают 9,9 г продукта. Выход = 44%. Т.пл.=168°С. 9,9 г вышеполученной соли суспендируют в 100 мл этилацетата. При интенсивном перемешивании добавляют насыщенный раствор гидрокарбоната натрия, спустя несколько минут удаляют водную фазу. Органическую фазу промывают с помощью 50 мл воды, сушат, затем растворитель выпаривают на холоду в атмосфере азота. Получают 4,1 г очищенного основания. Выход = 95%. Т.пл.=84°С. [a]D=+23° (с=1,1; дихлорметан). Примеры получения соединений формулы (I) согласно изобретению Так, как описано выше, соединения формулы (I) согласно изобретению получают путем взаимодействия 3-амино-1-фенил-6,7-дигидро-3Н[1,4]диазепино[6,7,1-hі]индол-4-онов, промежуточных соединений формулы (II), с галоидангидридом формулы (IIIA) согласно способу А, со сложными, в частности пентафторфениловыми, эфирами формулы (IIIБ) согласно способу Б или с карбоновыми кислотами формулы (IIIB) согласно способу В. Ниже приводятся общие методики осуществления этих способов. Способ А В защищенном от влаги реакторе, при перемешивании, 10,0 ммоль промежуточного амина формулы (II) растворяют в 60 мл безводного дихлорметана. При температуре около 20°С затем добавляют 10,0 ммоль галоидангидрида кислоты формулы (IIIА), после чего прикапывают 10,0 ммоль триэтиламина. Реакция протекает при перемешивании и при комнатной температуре от 10 42793 15 до 20°С и за ее ходом следят с помощью тонкослойной хроматографии. Когда реакция считается законченной, добавляют 120 мл дихлорметана к реакционной смеси, смесь экстрагируют последовательно с помощью 60 мл 1 н. раствора соляной кислоты, 60 мл насыщенного раствора гидрокарбоната натрия и, наконец, 60 мл воды. После высушивания дихлорметан выпаривают при пониженном давлении, остаток очищают путем флэш-хроматографии при использовании колонки с диоксидом кремния, причем элюирующим средством является смесь возрастающей полярности, образуемая, например, ацетоном в дихлорметане. Фракции после элюирования, содержащие, как определено, чистое соединение, объединяют, затем выпаривают при пониженном давлении. Для очищенного остаточного продукта определяют структуру и чистоту, как описано выше. Способ Б Стадия 1: 10,0 ммоль Промежуточной кислоты (IIIB) формулы А-СООН и 3,55 г (19,3 ммоль) пентафторфенола растворяют в 25 мл дихлорметана. Затем добавляют 0,81 г (2,6 ммоль) пдиметиламинопиридиний-п-толуолсульфоната и: - либо 22,4 ммоль дициклогексилкарбодиимида в способе "Б.а", - либо 22,4 ммоль N-(3-диметиламинопропил)N'-этил-карбодиимида в способе "Б.б". Смесь перемешивают в течение 16 часов при комнатной температуре около 20°С, затем нерастворимую часть отфильтровывают. Растворитель отгоняют, остаток очищают путем флэш-хроматографии на колонке с диоксидом кремния, используя в качестве наиболее часто применяемого элюирующего средства градиент ацетона в дихлорметане. Фракции, содержащие чистое соединение согласно ТСХ, объединяют, растворитель выпаривают, и после анализа остаточный промежуточный сложный эфир (IIIБ)в виде аморфной пены используют таким, какой есть в последующей стадии. Стадия 2: 10,0 ммоль Полученного в предыдущей стадии сложного пентафторфенилового эфира (IIIБ) добавляют к 10,0 ммоль промежуточного амина формулы (II), растворенного в безводном этилацетате. После перемешивания в течение 16 часов при комнатной температуре около 20°С нерастворимую часть отфильтровывают, этилацетат выпаривают в вакууме, затем остаток очищают по методу флэш-хроматографии на колонке с диоксидом кремния, используя наиболее часто применяемый в качестве элюирующего средства градиент метанола в дихлорметане. Фракции, содержащие чистое соединение согласно ТСХ, объединяют, растворитель выпаривают, и очищенный остаток идентифицируют и анализируют. Способ В В защищенном от влаги реакторе, при перемешивании, 10,0 ммоль промежуточного амина формулы (II) растворяют в 50,0 мл безводного дихлорметана. Затем при комнатной температуре около 20°С добавляют 11,0 ммоль промежуточной кислоты (IIIВ) формулы А-СООН, затем 10,0 ммоль (3,28 г) "TOTU" (сокращенное название O-[(этоксикарбонил)цианометиламино]-N,N,N'N'-тетраметилуроний-тетрафторбората - изготовитель фирма Fluka, стандартное обозначение 02580). Смесь охлаждают до 0°С, после чего добавляют 20,0 ммоль (2,55 г) N,N-диизопропилэтиламина, и смесь перемешивают в течение 12 часов при комнатной температуре, затем экстрагируют последовательно с помощью 50 мл 1 н. раствора соляной кислоты, 50 мл насыщенного раствора гидрокарбоната натрия и, наконец, 50 мл воды. Растворитель удаляют в вакууме, и остаток очищают по методу флэш-хроматографии на колонке с диоксидом кремния, используя наиболее часто применяемый в качестве элюирующего средства градиент метанола в дихлорметане. Фракции, содержащие чистое соединение согласно ТСХ, объединяют, растворитель испаряют, и очищенный остаток идентифицируют и анализируют. Пример 1.А: (4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)-амид (3R,S)-2-хлор-4-трифторметил-пиримидин-5карбоновой кислоты [формула (I); А = 5-(2-хлор-4-трифторметилпиримидил)]. Соединение получают согласно способу А, исходя из промежуточного соединения (1.а) и хлорангидрида 5-(2-хлор-4-трифторметил)-пиримидилкарбоновой кислоты. Выход = 72%. Твердое вещество белого цвета. Т.пл.=282°С (разложение). Анализ согласуется с C23H15ClF3N5O2. ТСХ: S.A4; 0,70. 1 Н-ЯМР (диметилсульфоксид), d (м.д.): 2,9-3,6 (м, 2Н); 3,7-4,2 (м, 1Н); 4,4-4,75 (м, 1Н); 5,45 (д, 1Н, становится синглетом за счет обмена); 7,1-7,8 (м, 8Н); 9,25 (с, 1Н); 10,2 (д, 1Н обмениваемый); ИК-спектр: 3200, 1670, 1560, 1540, 1520, 1430, 1345, 1210, 1140, 800, 735, 700 см-1. Пример 1.Б: N-(4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)-амид (3R,S)-имидазо[1,2-а]пиридин-2-карбоновой кислоты [формула (I); A = 2-имидазо[1,2-а]пиридинил]. Соединение получают из промежуточного продукта (1.а) и имидазо[1,2-а]пиридин-2-карбоновой кислоты согласно методике, основанной на способе В, которая состоит в осуществлении конденсации в тетрагидрофуране (ТГФ) в присутствии бромтрис(пирролидинофосфоний)гексафторфосфата ("РуВrор") и триэтиламина. 4,50 г (16,23 ммоль) промежуточного амина (1.а) растворяют в 150 мл безводного ТГФ. Добавляют 3,20 г (16,3 ммоль) имидазо[1,2-а]пиридин-2-карбоновой кислоты и 4,95 г (6,82 мл, 49 ммоль) триэтиламина. Смесь охлаждают на бане со льдом и добавляют 9,13 г (18,6 ммоль) "РуВrор" в 50 мл ТГФ. После перемешивания в течение 16 часов при комнатной температуре отфильтровывают нерастворимую часть, и растворители удаляют путем отгонки в вакууме. Остаток (12,2 г) очищают путем хроматографии на колонке с диоксидом кремния, элюируя этилацетатом, содержащим 5% ацетона. Фракции, содержащие очищенный продукт согласно ТСХ, объединяют, и растворитель выпаривают. Получают 5,1 г чистого продукта в виде аморфного вещества. Выход = 71%. Т.пл.=260°С. Анализ согласуется с C25H19FN5O2×H2O. ТСХ: S.A6; 0,27. 11 42793 1 Н-ЯМР, d (м.д.): 2,80-3,55 (м, 2Н); 3,70-4,10 (м, 1Н); 4,30-4,75 (м, 1Н); 5,50-5,68 (д, 1Н, после обмена становится синглетом); 6,65-7,70 (м, 11Н); 8,00-8,15 (м, 2Н); 8,85-8,95 (д, 1Н обмениваемый). ИК-спектр: 3100, 1725, 1640, 1520, 1390, 1275, 1020, 820, 800, 750 см-1. Пример 2.А: (3R)-2-Фор-N-(4-Оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)бензамид [формула (1); A = 2-фторфенил] Соединение получают согласно способу А из промежуточного соединения (1.б) и 2-фторбензоилхлорида. Выход = 50,5%. Аморфное твердое вещество. Т.пл.=192°С. [a]D=+51° (с=1, дихлорметан). Анализ согласуется с C24H18FN3O2. ТСХ: S.A3; 0,43. 1 Н-ЯМР, d (м.д.): 3,10-3,20 (м, 1Н); 3,30-3,45 (м, 1Н); 3,95-4,05 (м, 1Н); 4,65-4,75 (м, 1Н); 5,65 (д, 1Н); 7,10-7,60 (м, 11Н, из которых 1Н обмениваемый); 8,15 (м, 1Н); 8,50-8,65 (м, 1Н). ИК-спектр: 3300, 1640, 1490, 1430, 1380, 1340, 1230, 1160, 725, 690 см-1. Пример 2.Б: (3R)-3-Фтор-(4-Оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)бензамид [формула (І); А = 3-фторфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 3-фторбензоилхлорида. Выход = 78%. Аморфное твердое вещество. Т.пл.=244°С. [a]D=+48° (с=1, дихлорметан). Анализ согласуется с C24H18FN3O2×0,5H2O. ТСХ: S.A3; 0,43. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 4,00 (м, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н); 7,10-7,60 (м, 10Н); 7,65-7,80 (м, 2Н); 8,00 (д, 1Н обмениваемый). ИК-спектр: 3250, 1670, 1620, 1580, 1520, 1430, 1380, 1340, 1280, 1240, 1220, 1140, 790, 670 см-1. Пример 2.В: (3R)-4-Фтор-N-(4-оксо-1-фенил3,4,6,7-тедрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)бензамид [формула (І); А = 4-фторфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 4-фторбензоилхлорида. Выход = 50,4%. Аморфное твердое вещество. Т.пл.=228°С. [a]D=+48° (с=1, дихлорметан). Анализ согласуется с С24Н18FN3О2×0,25Н2O. ТСХ: S.A3; 0,52. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 3,95 (м, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н); 7,10-7,60 (м, 10Н, из которых 1Н обмениваемый); 8,00 (м, 1Н). ИК-спектр: 3400, 1640, 1590, 1490, 1440, 1420, 1380, 1340, 1230, 1160, 1050, 800, 760, 690, 660 см-1. Пример 2.Г: (3R)-2-Хлор-(4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)бензамид [формула (І); А = 2-хлорфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 2-хлорбензоилхлорида. Выход = 66%. Аморфное твердое вещество. Т.пл.=121°С. [a]D=+82° (с=1, дихлорметан). Анализ согласуется с С24Н18FN3О2×0,1CH2Cl2. ТСХ: S.A3; 0,57. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 4,00 (м, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н); 7,10 (м, 1Н); 7,20 7,60 (м, 10Н); 7,80 (м, 1Н); 8,00 (д, 1Н обмениваемый). ИК-спектр: 3300, 1650, 1590, 1490, 1430, 1380, 1220, 1160, 1040, 750, 730, 690 см-1. Пример 2.Д: (3R)-3-Хлор-N-(4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3ил)бензамид [формула (I); А = 3-хлорфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 3-хлорбензоилхлорида. Выход = 85%. Твердое вещество белого цвета. Т.пл.=230°С (разложение). [a]D=+34° (с=1, дихлорметан). Анализ согласуется с C24H18ClN3O2. ТСХ: S.A3; 0,49. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 4,00 (м, 1Н); 4,67 (м, 1Н); 5,65 (д, 1Н, который становится синглетом за счет обмена); 7,15 (м, 1Н); 7,25 (м, 1Н); 7,3-7,6 (м, 8Н); 7,85 (м, 1Н); 8,0 (м, 1Н); 8,15 (д, 1Н обмениваемый). ИК-спектр: 3250 (уширенная), 3050, 1680, 1650, 1505, 1440, 1275, 1240, 725, 690 см-1. Пример 2.Е: (3R)-2-Иод-N-(4-оксо-1-фенил3,4,6,7-тедрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)бензамид [формула (І); А=2-иодфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 2-иодбензоилхлорида. Выход = 69%. Аморфное твердое вещество. Т.пл.=123°С. [a]D=+81° (с=1, дихлорэтан). Анализ согласуется с C24H18IN3O2. ТСХ: S.A3; 0,55. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,40 (м, 1Н); 4,0 (м, 1Н); 4,67 (м, 1Н); 5,65 (д, 1Н, который становится синглетом за счет обмена); 7,12 (м, 2Н); 7,25 (м, 1Н); 7,3-7,5 (м, 5Н); 7,58 (м, 2Н); 7,70 (м, 2Н, из которых 1Н обмениваемый); 7,92 (Д, 1Н). ИК-спектр: 3400, 3260, 1650, 1490, 1440, 1385, 1160, 725, 690 см-1. Пример 2.Ж: (3R)-3-Хлор-4-фтор-N-(4-оксо-1фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hi]индол-3-ил)бензамид [формула (I); A = 3-хлор-4-фторфенил] Соединение получают согласно способу В из промежуточного продукта (1.б) и 3-хлор-4-фторбензойной кислоты. Выход = 97%. Аморфное твердое вещество. Т.пл.=148°С. [a]D=+43° (с=1, дихлорметан). Анализ согласуется с C24H17ClFN3O2. ТСХ: S.A3; 0,70. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 4,00 (м, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н); 7,10-7,60 (м, 9Н, из которых 1Н обмениваемый); 7,85 (м, 1Н); 8,05 (м, 2Н). ИК-спектр: 3300, 3050, 1650, 1480, 1380, 1250, 1170, 1050, 750, 730, 690 см-1. Пример 2.З: (3R)-3,4-Дихлор-N-(4-оксо-1фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hi]индол-3-ил)бензамид [формула (І); А = 3,4-дихлорфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 3,4-дихлорбензоил-хлорида. Выход = 85,4%. Аморфное твердое вещество. Т.пл.=163°С. [a]D=+42° (с=1, дихлорметан). Анализ согласуется с С24Н17СІ2N3О2. ТСХ: S.A3; 0,76. 12 42793 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 4,00 (м, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н); 7,10-7,60 (м, 9Н, из которых 1Н обмениваемый); 7,85 (м, 1Н); 8,05 (м, 2Н). ИК-спектр: 3300, 3050, 1640, 1500, 1440, 1380, 1280, 1230, 1130, 1020, 750, 730, 690 см-1. Пример 2.И: (3R)-2-Метил-N-(4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)бензамид [формула (І); А = 2-метилфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 2-метилбензоилхлорида. Выход = 33%. Твердое вещество белого цвета. Т.пл.=154°С. [a]D=+78° (с=1, дихлорметан). Анализ согласуется с C25H21N3O3. TCX: S.A3; 0,34. 1 Н-ЯМР, d (м.д.): 2,6 (с, 3Н); 3,15 (м, 1Н); 3,38 (м, 1Н); 3,48 (м, 1Н); 4,68 (м, 1Н); 5,66 (д, 1Н, становится синглетом за счет обмена); 7,12 (м, 1Н); 7,25 (м, 3Н); 7,3-7,5 (м, 5Н); 7,56 (м, 2Н); 7,68 (м, 2Н, из которых 1Н обмениваемый). ИК-спектр: 3300, 3000, 1650, 1470, 1440, 1380, 1250, 1160, 725, 690 см-1. Пример 2.К: (3R)-2-Метокси-N-(4-оксо-1фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hі]индол-3-ил)бензамид [формула (І); А = 2-метоксифенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 2-метоксибензоилхлорида. Выход = 72%. Твердое вещество белого цвета. Т.пл.=228°С. [a]D=+34° (с=1, дихлорметан). Анализ согласуется с C25H21N3O3 (0,25H2O). TCX: S.A3; 0,53. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,37 (м, 1Н); 4,0 (м, 1Н); 4,08 (с, 3Н); 4,67 (м, 1Н); 5,70 (д, 1Н, который становится синглетом за счет обмена); 7,07,15 (м, 3Н); 7,25 (м, 1Н); 7,38 (м, 2Н); 7,45 (м, 3Н); 7,55 (м, 2Н); 8,25 (м, 1Н); 9,85 (м, 1Н обмениваемый). ИК-спектр: 3350, 2900, 1670, 1640, 1590, 1500, 1470, 1380, 1280, 1240, 1170, 1010, 750, 730, 690 см-1. Пример 2.Л: (3R)-3-Метокси-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамид [формула (І); А = 3-метоксифенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 3-метоксибензоилхлорида. Выход = 74%. Твердое вещество белого цвета. Т.пл.=181°С. [a]D=+48° (с=1, дихлорметан). Анализ согласуется с С25Н21N3О3. ТСХ: S.A3; 0,51. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 3,85 (с, 3Н); 4,0 (м, 1Н); 4,65 (м, 1Н); 5,65 (д, 1Н, становится синглетом за счет обмена); 7,10 (м, 2Н); 7,25 (м, 1Н); 7,35-7,6 (м, 9Н); 7,97 (м, 1Н обмениваемый). ИК-спектр: 3400, 2900, 1650, 1600, 1480, 1500, 1475, 1440, 1380, 1275, 1240, 1030, 790, 750, 720, 695 см-1. Пример 2.М: (3R)-4-Метокси-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид [формула (І); А = 4-метоксифенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 4-метоксибензоилхлорида. Выход = 67%. Твердое вещество бело го цвета. Т.пл.=221°С (разложение), [a]D=+51° (с=1, дихлорметан). Анализ согласуется с С25Н21N3О3. ТСХ: S.A3; 0,49. 1 Н-ЯМР, d (м.д.): 3,13 (м, 1Н); 3,35 (м, 1Н); 3,85 (с, 3Н); 4,0 (м, 1Н); 4,65 (м, 1Н); 5,65 (д, 1Н, становится синглетом за счет обмена); 6,95 (д, 2Н); 7,10 (т, 1Н); 7,25 (т, 1Н); 7,38 (м, 2Н); 7,45 (м, 2Н); 7,55 (м, 2Н); 7,95 (м, 3Н, из которых 1Н обмениваемый). ИК-спектр: 3350, 1680, 1650, 1600, 1480, 1390, 1250, 1200, 1030, 840, 760, 725, 695 см-1. Пример 2.Н: (3R)-3,4,5-Триметокси-N-(4-оксо1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hі]индол-3-ил)бензамид [формула (І); A = 3,4,5-триметоксифенил] Соединение получают согласно способу В из промежуточного продукта (1.б) и 3,4,5-триметоксибензойной кислоты. Выход = 81,4%. Аморфное твердое вещество. Т.пл.=221°С (разложение). [a]D=+54° (с=1, дихлорметан). Анализ согласуется с С27Н25N3O5. ТСХ: S.A4; 0,76. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 3,90 (д, 9Н); 4,00 (м, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н); 7,10 (м, 1Н); 7,15-7,30 (м, 3Н); 7,30-7,60 (м, 6Н); 7,90 (д, 1Н). ИК-спектр: 3300, 2900, 1640, 1520, 1470, 1300, 1230, 1170, 1120, 1000, 750, 730, 690 см-1. Пример 2.O: (3R)-2-Метокси-5-хлор-N-(4-оксо1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hі]индол-3-ил)бензамид [формула (I); А = 2-метокси-5-хлорфенил] Соединение получают согласно способу В из промежуточного продукта (1.б) и 2-метокси-5хлорбензойной кислоты. Выход = 90,1%. Аморфное твердое вещество. Т.пл.=234°С. [a]D= ноль (с=1, дихлорметан). Анализ согласуется с С25Н17СІN3О3. ТСХ: S.A3; 0,64. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 4,00 (м, 1Н); 4,10 (с, 3Н); 4,70 (м, 1Н); 5,6 (д, 1Н); 7,00 (д, 1Н); 7,10 (т, 1Н); 7,20-7,50 (м, 6Н); 7,55 (д, 2Н); 8,2 (м, 1Н); 9, 75 (д, 1Н обмениваемый). ИК-спектр: 3350, 1650, 1590, 1470, 1380, 1260, 1240, 1180, 1010, 730, 690, 640 см-1. Пример 2.П: (3R)-4-Ацетамидо-N-(4-оксо-1фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hі]индол-3-ил)бензамид [формула (І); А = ацетамидофенил] Соединение получают согласно способу Б.а иэ промежуточного продукта (1.б) и промежуточного пентафторфенилового эфира 4-ацетамидобензойной кислоты. Выход = 32%. Аморфный продукт. Т.пл.=266°С. [a]D=+43° (с=1, дихлорметан). Анализ согласуется с C16H22N4O3. ТСХ: S.B; 0,20. 1 Н-ЯМР, d (м.д.): 2,10 (с, 3Н); 3,15 (м, 1Н); 3,35 (м, 1Н); 4,00 (м, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н); 7,107,60 (м, 8Н); 7,65 (д, 2Н); 7,85 (д, 2Н); 7,95 (д, 1Н обмениваемый); 8,35 (уш.с, 1Н обмениваемый). ИК-спектр: 3300, 1690, 1740, 1600, 1510, 1440, 1390, 1310, 1260, 1180, 1120, 1020, 860, 760, 730, 700 см-1. Пример 2.Р: (4-Oксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)пиридин-2-карбоновой кислоты 13 42793 Пример 2.Ф: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)хинолин-6-карбоновой кислоты [формула (1); А = 6-хинолил] Соединение получают согласно способу А из промежуточного продукта (1.б) и хлорангидрида хинолин-6-карбоновой кислоты. Выход = 57%. Твердое вещество белого цвета. Т.пл.=182°С. [a]D=+59° (с=1, дихлорметан). Анализ согласуется с C27H20N4O2×0,75H2O. TCX: S.A4; 0,40. 1 Н-ЯМР, d (м.д.): 2,80-3,60 (м, 2Н); 3,70-4,30 (м, 1Н); 4,50-4,90 (м, 1Н); 5,75 (д, 1Н, становится синглетом за счет обмена); 6,90-7,70 (м, 10Н); 8,00-8,40 (м, 4Н, из которых 1Н обмениваемый); 8,55 (м, 1Н); 9,00 (м, 1Н). ИК-спектр: 3300, 1680, 1650, 1510, 1490, 1440, 1280, 780, 730, 695 см-1. Пример 2.Х: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-2метил-хинолин-4-карбоковой кислоты [формула (1); А = 4-(2-метилхинолил)] Соединение получают согласно способу Б.а из промежуточного продукта (1.б) и промежуточного пентафторфенилового эфира 2-метил-хинолин-4карбоновой кислоты. Выход = 94%. Аморфный продукт. Т.пл.=280°С (разложение). Анализ согласуется с C28H22N4О2×0,1CH2Cl2. TCX: S.A3; 0,58. 1 Н-ЯМР, d (м.д.): 2,70 (с, 3Н); 3,20 (м, 1Н); 3,45 (м, 1Н); 4,00 (м, 1Н); 4,70 (м, 1Н); 5,80 (д, 1Н); 7,107,75 (м, 11Н); 8,15 (д, 1Н); 8,20 (д, 1Н обмениваемый); 8,85 (с, 1Н). ИК-спектр: 3300, 1650, 1600, 1520, 1450, 1390, 1340, 1240, 1160, 760, 700 см-1. Пример 2.Ц: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)изохинолин-3-карбоновой кислоты [формула (1); А = 3-изохинолил] Соединение получают согласно способу Б.б из промежуточного продукта (1.б) и промежуточного пентафторфенилового эфира 3-метил-хинолин-4карбоновой кислоты в присутствии N-(3-диметиламинопропил)-N'-этилкарбодиимида. Выход = 84%. Аморфный продукт. Т.пл.=250°С [a]D=+10° (с=1, дихлорметан). Анализ согласуется с C27H20N4O2×0,3H2O×0,15CH2Cl2. TCX: S.A1; 0,25. 1 Н-ЯМР, d (м.д.): 3,12 (м, 1Н); 3,38 (м, 1Н); 3,75 (с, 3Н); 4,0 (м, 1Н); 4,63 (м, 1Н); 5,72 (д, 1Н, становится синглетом за счет обмена); 7,12 (м, 1Н); 7,28 (м, 1Н); 7,35 (м, 2Н); 7,47 (м, 2Н); 7,59 (м, 2Н); 7,72 (м, 2Н); 8,0 (д, 1Н); 8,1 (д, 1Н); 8,65 (с, 1Н); 9,28 (с, 1Н); 9,86 (д, 1Н обмениваемый). ИК-спектр: 3400, 1670, 1600, 1485, 1450, 1260, 900, 790, 785, 755, 730, 700, 670 см-1. Хлоргидрат получают из основания в солянокислом пропаноле. Полученные кристаллы промывают эфиром и сушат в вакууме. Т.пл.=225°С [a]D=-416° (с=1, дихлорметан). ТСХ: S.A3; 0,35. Пример 2.Ч: Фторсульфонат (4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)амида (3R)-N-метил-изохинолиний-3-карбоновой кислоты [формулы (I); А = N-метил-3-изохинолиний] [формула (І); A = 2-пиридил] Соединение получают согласно способу В из промежуточного продукта (1.б) и пиридин-2карбоновой кислоты. Выход = 86,0%. Аморфное твердое вещество. Т.пл.=208°С. [a]D=+57° (с=1, дихлорметан). Анализ согласуется с C23H18N4O2×0,2CH2CI2×0,1H2O. TCX: S.A3; 0,67. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 4,00 (м, 1Н); 4,65 (м, 1Н); 5,65 (д, 1Н); 7,10 (м, 1Н); 7,207,60 (м, 8Н); 7,85 (м, 1Н); 8,20 (д, 1Н); 8,65 (д, 1Н); 9,70 (д, 1Н обмениваемый). ИК-спектр: 3300, 1660, 1490, 1440, 1380, 1240, 1160, 750, 690 см-1. Пример 2.С: (3R)-(4-Оксо-1-фенил-3,4,6,7тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)изоникотинамид [формула (1); А = 4-пиридил] Соединение получают согласно способу Б.а из промежуточного продукта (1.б) и промежуточного пентафторфенилового эфира изоникотиновой кислоты. Выход = 83%. Аморфный продукт. Т.пл.=234°С. [a]D=+23° (с=1, дихлорметан). Анализ согласуется с С25Н20СlN3О3. TCX: S.A10; 0,60. 1 Н-ЯМР, d (м.д.): 3,10 (м, 1Н); 3,30 (м, 1Н); 3,90 (м, 1Н); 4,60 (м, 1Н); 5,60 (д, 1Н); 7,05-7,50 (м, 8Н, из которых 1Н обмениваемый); 7,75 (м, 2Н); 8,50 (м, 1Н); 8,70 (м, 2Н). ИК-спектр: 3300, 1640, 1470, 1430, 1380, 1270, 1160, 1110, 1040, 750, 720, 690 см-1. Пример 2.Т: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-1Н-индол-2-карбоновой кислоты [формула (1); А = 2-1Н-индолил] Соединение получают согласно способу А из промежуточного продукта (1.б) и хлорангидрида 1Н-индол-2-карбоновой кислоты. Выход = 81%. Твердое вещество белого цвета. Т.пл.=196°С. [a]D=+74° (с=1, дихлорметан). Анализ согласуется с С26Н19N4O2×0,5C4H8O2. TCX: S.A3; 0,62. 1 Н-ЯМР, d (м.д.): 2,8-3,6 (м, 2Н); 3,7-4,25 (м, 1Н); 4,4-4,7 (1Н); 5,55-5,65 (д, 1Н, становится синглетом за счет обмена); 6,9-7,7 (м, 13Н); 7,9-8,1 (д, 1Н обмениваемый); 10,05 (с, 1Н обмениваемый). ИК-спектр: 3250, 1685, 1630, 1530, 1440, 1385, 1340, 1235, 740, 690 см-1. Пример 2.У: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-хинолин-3-карбоновой кислоты [формула (1); А = 3-хинолил] Соединение получают согласно способу А из промежуточного продукта (1.б) и хлорангидрида хинолин-3-карбоновой кислоты. Выход = 65%. Твердое вещество белого цвета. Т.пл.=150°С. [a]D=+152° (с=1, дихлорметан). Анализ согласуется с С27Н20N4O2×0,4H2O. TCX: S.A4; 0,22. 1 Н-ЯМР, d (м.д.): 2,70-3,6 (м, 2Н); 3,6-4,15 (м, 1Н); 4,3-4,8 (1Н); 5,5-5,7 (д, 1Н становится синглетом за счет обмена); 6,8-8,3 (м, 13Н); 8,60-8,8 (м, 1Н); 9,2-9,4 (м, 1Н). ИК-спектр: 3300, 1680, 1660, 1510, 1445, 1285, 840, 785, 695 см-1. 14 42793 Соединение получают согласно способу А из промежуточного продукта (2.а) - (3R,S)-3-амино-9метил-1-фенил-6,7-дигидро-[1,4]диазепино[6,7,1hі]индол-4-она - и хлорангидрида хинолин-3-карбоновой кислоты. Выход = 56%. Твердое вещество белого цвета. Т.пл.=238°С. Анализ согласуется с C28H22N4O2×0,2H2O. TCX: S.A4; 0,18. 1 Н-ЯМР, d (м.д.): 2,45 (с, 3Н); 3,1 (м, 1Н); 3,45 (м, 1Н); 3,95 (м, 1Н); 4,65 (м, 1Н); 5,71 (д, 1Н, становится синглетом за счет обмена); 7,25-7,65 (м, 8Н); 7,85 (м, 1Н); 7,95 (д, 1Н); 8,2 (д, 1Н обмениваемый); 8,25 (д, 1Н); 8,8 (с, 1Н); 9,45 (с, 1Н). ИК-спектр: 3450 (уширенная); 3200, 3005, 1690, 1660, 1530, 1430, 1375, 1290, 1245, 1160, 920, 780, 695 см-1. Пример 4: (9-Метил-4-оксо-1-фенил-3,4,6,7тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3ил)амид (3R)-изохинолин-3-карбоновой кислоты [формула (1); А = 3-изохинолил; R = СН3] Соединение получают согласно способу Б.б) по методике, идентичной таковой примера 2.Ц, при использовании промежуточного продукта (2.б): (3R)-3-амино-9-метил-1-фенил-6,7-дигидро[1,4]диазепино[6,7,1-hі]индол-4-она. Выход = 93%. Твердое вещество белого цвета. Т.пл.=130°С. [a]D=+8° (с=1, дихлорметан). Анализ согласуется с C27H20N4O2×0,4Н2O×0,15CH2Cl2. TCX: S.A4; 0,17. 1 Н-ЯМР, d (м.д.): 2,35 (с, 3Н); 3,1 (м, 1Н); 3,35 (м, 1Н); 4,0 (м, 1Н); 4,65 (м, 1Н); 5,7 (д, 1Н, становится синглетом за счет обмена); 7,25-7,5 (м, 5Н); 7,6 (м, 2Н); 7,75 (м, 2Н); 8 (д, 1Н); 8,1 (д, 1Н); 8,65 (с, 1Н); 8,8 (с, 1Н); 9,9 (д, 1Н обмениваемый). ИК-спектр: 3380, 1660, 1490, 1350, 1235, 1160, 740, 695 см-1. Пример 5: (9-Метокси-4-оксо-1-фенил-3,4,6,7тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)амид (3R,S)-изохинолин-3-карбоновой кислоты [формула (1); А = 3-изохинолил; R = СН3О] Соединение получают согласно способу А из промежуточного продукта (3.а) - (3R,S)-3-амино-9метокси-1-фенил-6,7-дигидро-[1,4]диазепино[6,7,1hі]индол-4-она - и хлорангидрида хинолин-3карбоновой кислоты. Выход = 40%. Твердое вещество белого цвета. Т.пл.=204°С. Анализ согласуется с С28Н22N4О3×0,33H2O×0,33СН2СІ2. ТСХ: S.B1; 0,25. 1 Н-ЯМР, d (м.д.): 3,1 (м, 1Н); 3,35 (м, 1Н); 3,75 (с, 3Н); 4,0 (м, 1Н); 4,7 (м, 1Н); 5,7 (д, 1Н, становится синглетом за счет обмена); 6,7 (уш.с, 1Н); 7,1 (уш.с, 1Н); 7,25-7,85 (м, 7Н); 7,95 (д, 1Н); 8,2 (д, 1Н); 8,25 (д, 1Н обмен.); 8,75 (м, 1Н); 9,75 (м, 1Н). ИК-спектр: 3300 (уширенная), 1660, 1520, 1480, 1390, 1290, 1230, 1120, 780, 700 см-1. Примар 6.А: (3R)-3-Хлор-N-(9-метокси-4-оксо1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hi]индол-3-ил)бензамид [формула (1); А = 3-хлорфенил; R = СН3О] Соединение получают согласно способу В из промежуточного продукта (3.б) - (3R)-3-амино-9метокси-1-фенил-6,7-дигидро-[1,4]диазепино[6,7,1hі]индол-4-она - и 3-хлорбензойной кислоты. Выход = 75,9%. Аморфное твердое вещество. Т.пл.=119°С. [a]D=+29° (с=1, дихлорметан). Анализ согласуется с С25Н20СlN3О3. ТСХ: S.A2; 0,59. 1,0 г (2,31 ммоль) Продукта примера 2.Ц растворяют в 12 мл дихлорметана, раствор охлаждают до 0°С и добавляют в него 0,184 г (2,31 ммоль) метилфторсульфоната. После выдерживания в течение 1 часа при 0°С оставляют температуру повышаться до комнатной и затем выпаривают при пониженном давлении. Остаток очищают путем флэш-хроматографии на колонке с диоксидом кремния, причем элюирующим средством является смесь возрастающей полярности ацетона в дихлорметане. Получают 1,1 г соединения в виде твердого вещества белого цвета. Т.пл.=228°С. Выход = 87%. [a]D=-408° (с=1, дихлорметан). Анализ согласуется с С28Н23FN4O5S×0,5H2O. ТСХ: S.A10; 0,10. 1 Н-ЯМР, d (м.д.): 3,35 (м, 1Н); 3,45 (м, 1Н); 3,52 (с, 3Н); 4,5 (м, 1Н); 4,78 (м, 1Н); 5,75 (д, 1Н, становится синглетом за счет обмена); 7,0 (м, 1Н); 7,25 (м, 1Н); 7,45 (м, 1Н); 7,65 (м, 2Н); 7,7-7,9 (м, 5Н); 8,02 (м, 1Н); 8,12 (с, 1Н); 8,65 (с, 1Н); 9,25 (с, 1Н); 10,5 (д, 1Н обмениваемый). ИК-спектр: 3450, 3350, 1680, 1600, 1560, 1480, 1430, 1270, 1070, 770, 700, 580 см-1. Пример 2.Ш: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид имидазо[1,2-а]пиримидин-2-карбоновой кислоты [формула (I); A = имидазо[1,2-а]пиримидинил] Соединение получают согласно способу В.а) из промежуточного продукта (1.б) и промежуточного пентафторфенилового эфира имидазо[1,2а]пиримидин-2-карбоновой кислоты. Выход = 57%. Аморфный продукт. Т.пл.=270°С (разложение). [a]D=-21° (с=1, дихлорметан). Анализ согласуется с C24H18N6O2×0,5C3H6O×0,2CH2Cl2. TCX: S.A9; 0,13. 1 Н-ЯMР (диметилсульфоксид), d (м.д.): 2,903,5 (м, 2Н); 3,5-4,20 (м, 1Н); 4,2-4,7 (м, 1Н); 5,40-5,6 (д, 1Н, становится синглетом за счет обмена); 7,07,7 (м, 9Н); 7,6-7,8 (м, 1Н); 8,0 (с, 1Н); 8,6-8,75 (м, 1Н); 8,75-8,95 (д, 1Н обмениваемый). ИК-спектр: 3400 (уширенная), 1685, 1645, 1530, 1440, 1280, 1220, 1155, 730, 700 см-1. Пример 2.Щ: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4,7-диметил-пиразол-[5,1-с][1,2,4]триазин-3карбоновой кислоты [формула (I); А = 3-(4,7-диметил-пиразол[5,1с][1,2,4]триазинил] Соединение получают согласно способу Б.а) из промежуточного продукта (1.б) и промежуточного пентафторфенилового эфира 4,7-диметилпиразол[5,1-с][1,2,4]триазин-3-карбоновой кислозы. Выход = 46%. Порошок белого цвета. Т.пл.=260°С. [a]D=+21° (с=1, дихлорметан). Анализ согласуемся с C25H21N7O2×0,75H2O. TCX: S.A3; 0,20. 1 Н-ЯМР, d (м.д.): 2,65 (с, 3Н); 3,15 (м, 1Н); 3,30 (с, 3Н); 3,40 (м, 1Н); 4,00 (м, 1Н); 4,70 (м, 1Н); 5,70 (д, 1Н); 7,10-7,60 (м, 9Н); 9,90 (д, 1Н обмениваемый). ИК-спектр: 3350, 1660, 1600, 1560, 1470, 1390, 1370, 1300, 1230, 1170, 800, 730, 690, 640 см-1. Пример 3: (9-Метил-4-оксо-1-фенил-3,4,6,7тетрагидро-[1,4]диазепино[6,7,1-h1]индол-3ил)амид (3R,S)-хинолин-3-карбоновой кислоты [формула (1); А = 3-хинолил; R = СН3] 15 42793 1 Н-ЯМР, d (м.д.): 3,10 (м, 1Н); 3,35 (м, 1Н); 3,70 (с, 3Н); 4,00 (м, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н); 6,70 (с, 1Н); 7,10 (с, 1Н); 7,35-7,65 (м, 7Н); 7,85 (д, 1Н); 8,00 (с, 1Н); 8,05 (д, 1Н обмен.). ИК-спектр: 3300, 1660, 1570, 1510, 1460, 1370, 1340, 1260, 1230, 1170, 1140, 1040, 760, 740, 700 см-1. Пример 6.Б: (3R)-4-Хлор-N-(9-метокси-4-оксо1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hі]индол-3-ил)бензамид [формула (1); A = 4-хлорфенил; R = СН3О] Соединение получают согласно способу А из промежуточного продукта (3.б) и 4-хлорбензоилхлорида. Выход = 83%. Твердое вещество белого цвета. Т.пл.=175°С. [a]D=+3,26° (с=1, дихлорметан). Анализ согласуется с С25Н20СІN3О3×0,25Н2O. ТСХ: S.A3; 0,49. 1 Н-ЯМР, d (м.д.): 3,1 (м, 1Н); 3,35 (м, 1Н); 3,75 (с, 3Н); 4,0 (м, 1Н); 4,65 (м, 1Н); 5,6 (д, 1Н, становится синглетом за счет обмена); 6,7 (с, 1Н); 7,1 (с, 1Н); 7,35-7,6 (м, 7Н); 7,9 (д, 2Н); 8,0 (д, 1Н обмен.). ИК-спектр: 3300, 2900, 1650, 1470, 1365, 1340, 1265, 1230, 1140, 1085, 840, 750, 700 см-1. Пример 6.В: (3R)-N-(9-Метокси-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамид [формула (1); А = 4-пиридил; R = СН3О] Соединение получают согласно способу Б.а) из промежуточного продукта (3.б) и промежуточного пентафторфенилового эфира изоникотиновой кислоты. Выход = 55%. Аморфный продукт желтого цвета. Т.пл.=220-224°С. [a]D=+2,4° (с=1, дихлорметан). Анализ согласуется с С24Н20N4О3×0,15CH2Cl2. TCX: S.A3; 0,42. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 3,75 (с, 3Н); 4,00 (м, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н, становится синглетом за счет обмена); 6,70 (с, 1Н); 7,10 (с, 1Н); 7,25-7,60 (м, 5Н); 7,80 (д, 2Н); 8,10 (д, 1Н обмен.); 8,80 (д, 2Н). ИК-спектр: 3350, 1685, 1650, 1525, 1570, 1460, 1230, 695 см-1. Пример 6.Г: (9-Метокси-4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3ил)амид (3R)-хинолин-3-карбоновой кислоты [формула (1); А = 3-хинолил; R = СН3О] Соединение получают согласно способу Б.б) по методике, идентичной таковой примера 2.Ц., при использовании промежуточного продукта (3.б) и промежуточного пентафторфенилового эфира хинолин-3-карбоновой кислоты. Выход = 77%. Твердое вещество белого цвета. Т.пл.=112°С. [a]D=+4,6° (с=1, дихлорметан). Анализ согласуется с С28H22N4О3×0,66H2O. TCX: S.B1; 0,30. 1 Н-ЯМР, d (м.д.): 3,1 (м, 1Н); 3,35 (м, 1Н); 3,75 (с, 3Н); 4,0 (м, 1Н); 4,7 (м, 1Н); 5,7 (д, 1Н, становится синглетом за счет обмена); 6,7 (уш.с, 1Н); 7,1 (уш.с, 1Н); 7,25-7,85 (м, 7Н); 7,95 (д, 1Н); 8,2 (д, 1Н); 8,25 (д, 1Н обмен.); 8,75 (м, 1Н); 9,75 (м, 1Н). ИК-спектр: 3300, 1660, 1520, 1480, 1390, 1290, 1230, 1120, 780, 700 см-1. Пример 6.Д: (9-Метокси-4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)амид (3R)-хинолин-6-карбоновой кислоты [формула (1); А = 6-хинолил; R = СН3О] Соединение получают согласно способу Б.б) по методике, идентичной таковой примера 2.Ц., при использовании промежуточного продукта (3.б) и промежуточного пентафторфенилового эфира хинолин-6-карбоновой кислоты. Выход = 80%. Твердое вещество белого цвета. Т.пл.=206°С. [a]D=+2,95° (с=1, дихлорметан). Анализ согласуется с C28H22N4O3×H2O. ТСХ: S.A10; 0,43. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,4 (м, 1Н); 3,75 (с, 3Н); 4,0 (м, 1Н); 4,7 (м, 1Н); 5,65 (д, 1Н, становится синглетом за счет обмена); 6,7 (с, 1Н); 7,1 (с, 1Н); 7,35-7,65 (м, 6Н); 8,2-8,35 (м, 4Н, 1Н обмен.); 8,5 (с, 1Н); 9 (м, 1Н). ИК-спектр: 3400 (уширенная), 1650, 1470, 1370, 1345, 1270, 1230, 1190, 1140, 840, 780, 700 см-1. Пример 6.Е: (9-Метокси-4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3ил)амид (3R)-изохинолин-3-карбоновой кислоты [формула (1); А = 3-изохинолил; R = СН3О] Соединение получают согласно способу Б.б) по методике, идентичной таковой примера 2.Ц, при использовании промежуточного продукта (3.б) и промежуточного пентафторфенилового эфира изохинолин-3-карбоновой кислоты. Выход = 87%. Твердое вещество белого цвета. Т.пл.=211°С. [a]D=+0,30° (с=1, дихлорметан). Анализ согласуется с C28H22N2O3×0,1H2O×0,1CH2Cl2. ТСХ: S.A1; 0,18. 1 Н-ЯМР, d (м.д.): 3,1 (м, 1Н); 3,35 (м, 1Н); 3,75 (с, 3Н); 4,0 (м, 1Н); 4,7 (м, 1Н); 5,7 (д, 1Н, становится синглетом за счет обмена); 6,7 (уш.с), 7,1 (уш.с, 1Н); 7,2-7,8 (м, 7Н); 8,0 (м, 1Н); 8,1 (м, 1Н); 8,65 (с, 1Н); 9,3 (с, 1Н); 9,9 (д, 1Н обмен.). ИК-спектр: 3360, 1665, 1500, 1490, 1470, 1345, 1265, 1225, 1145, 700 см-1. Пример 6.Ж: (9-Метокси-4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)амид (3R)-4,7-диметил-пиразоло-[5,1с][1,2,4]триазин-3-карбоновой кислоты [формула (І); А = 3-(4,7-диметил-пиразол[5,1с][1,2,4]триазинил); R = СН3О] Соединение получают согласно способу В при использовании промежуточного продукта (3.б) и 4,7-диметил-пиразол-[5,1-с][1,2,4]триазин-3-карбоновой кислоты. Выход = 60,9%. Аморфное твердое вещество. Т.пл.=95°С. [a]D=+19,6° (с=1, дихлорметан). Анализ согласуется с C26H23N7O3. ТСХ: S.A9; 0,82. 1 Н-ЯМР, d (м.д.): 2,60 (с, 3Н); 3,05 (м, 1Н); 3,25 (с, 3Н); 3,30 (м, 1Н); 3,65 (с, 3Н); 3,90 (м, 1Н); 4,60 (м, 1Н); 5,60 (д, 1Н); 6,60 (с, 1Н); 7,00 (с, 2Н); 7,257,45 (м, 3Н); 7,55 (м, 2Н); 9,80 (д, 1Н обмен.). ИК-спектр: 3350, 1670, 1570, 1530, 1490, 1440, 1370, 1350, 1300, 1260, 1230, 1140, 1040, 800, 780, 740, 700 см-1. Пример 7.А: (3R)-2,4-Дифтор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)банзамид [формула (І); А = 2,4-дифторфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 2,4-дифторбензоилхлорида. Выход = 88%. Твердое вещество белого цвета. Т.пл.=172°С. [a]D=+42° (с=1, дихлорметан). Анализ согласуется с C24H17N3O2F2. 16 42793 (м, 1Н); 7,36 (м, 3Н); 7,45 (м, 3Н); 7,55 (м, 2Н); 7,80 (д, 1Н); 8,10 (д, 1Н обмен.). Пример 7.Е: (3R)-3,5-Дихлор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид [формула (I); А = 3,5-дихлорфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 3,5-дихлорбензоилхлорида. Выход = 65%. Твердое вещество желтого цвета. Т.пл.=211°С. [a]D=+46° (с=1, дихлорметан). Анализ согласуется с C24H17N3O2Cl2. ТСХ: S.A3; 0,85. 1 Н-ЯМР, d (м.д.): 3,12 (м, 1Н); 3,35 (м, 1Н); 3,95 (м, 1Н); 4,65 (м, 1Н); 5,56 (д, 1Н); 7,10 (м, 1Н); 7,20 (м, 1Н); 7,35 (м, 1Н); 7,45 (м, 6Н); 7,8 (с, 2Н); 8,12 (д, 1Н обмен.). ИК-спектр: 3300, 1680, 1650, 1560, 1530, 1440, 1400, 1280, 1240, 1120, 800, 700 см-1. Пример 7.Ж: (3R)-3,5-бис(Трифторметил)-N(4-оксо-1-фенил-3,4,6,7-тедрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)-бензамид [формула (І); A = 3,5-бис(трифторметил)фенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 3,5-бис(трифторметил)бензоилхлорида. Выход = 92%. Твердое вещество желтоватого цвета. Т.пл.=208°С. [a]D=+46° (с=1, дихлорметан). Анализ согласуется с C26H17N3O2F6. TCX: S.A3; 0,88. 1 Н-ЯМР, d (м.д.): 3,5 (м, 1Н); 3,35 (м, 1Н); 3,98 (к, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н); 7,12 (м, 1Н); 7,25 (м, 2Н); 7,35 (м, 2Н); 7,45 (м, 2Н); 7,52 (м, 2Н); 7,22 (м, 1Н); 7,82 (м, 1Н); 7,95 (д, 1Н обмен.). ИК-спектр: 3250, 1650, 1520, 1440, 1380, 1280, 1170, 1130, 910, 700 см-1. Пример 7.З: (3R)-3,4-Диметокси-N-(4-оксо-1фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hі]индол-3-ил)бензамид [формула (І); A = 3,4-диметоксифенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 3,4-диметоксибензоилхлорида. Выход = 91%. Твердое вещество белого цвета. Т.пл.=144°С. [a]D=+54° (с=1, дихлорметан). Анализ согласуется с С26Н23N3O4. ТСХ: S.A3; 0,33. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 3,95 (д, 6Н); 3,95 (м, 1Н); 4,65 (т, 1Н); 5,65 (д, 1Н); 6,90 (д, 1Н); 7,10 (т, 1Н); 7,35 (т, 2Н); 7,45 (м, 2Н); 7,55 (м, 4Н); 7,95 (д, 1Н обмен.). ИК-спектр: 3300, 1680, 1650, 1600, 1490, 1440, 1260, 1220, 1020, 760, 700 см-1. Пример 7.И: (3R)-3-Хлор-4-метокси-N-(4-оксо1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hi]индол-3-ил)бензамид [формула (I); А = 3-хлор-4-метокси-фенил] Соединение получают согласно способу В из промежуточного продукта (1.б) и 3-хлор-4метокси-бензойной кислоты. Выход = 82%. Твердое вещество розового цвета. Т.пл.=158°С. [a]D=+50° (с=1, дихлорметан). Анализ согласуется с С25Н20N3О3СІ. ТСХ: S.A3; 0,60. 1 Н-ЯМР, d (м.д.): 3,12 (м, 1Н); 3,35 (м, 1Н); 3,95 (с, 3Н); 4,0 (м, 1Н); 5,10 (д, 1Н); 6,95 (д, 1Н); 7,10 (т, 1Н); 7,25 (м, 1Н); 7,35 (м, 2Н); 7,43 (м, 2Н); 7,50 TCX: S.A3; 0,83 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 4,0 (м, 1Н); 4,65 (м, 1Н); 5,55 (д, 1Н); 6,95 (м, 1Н); 7,0 (м, 1Н); 7,12 (м, 1Н); 7,25 (м, 1Н); 7,35 (м, 2Н); 7,45 (м, 2Н); 7,53 (м, 2Н); 8,15 (м, 1Н); 8,50 (м, 1Н обмен.). Пример 7.Б: (3R)-2,5-Дифтор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамид [формула (I); A = 2,5-дифторфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 2,5-дифторбензоилхлорида. Выход = 92%. Твердое вещество белого цвета. Т.пл.=187°С. [a]D=+42° (с=1, дихлорметан). Анализ согласуется с C24H17N3O2F2. TCX: S.A3; 0,80. 1 Н-ЯМР, d (м.д.): 3,14 (м, 1Н); 3,35 (м, 1Н); 3,95 (м, 1Н); 4,65 (м, 1Н); 5,13 (д, 1Н); 7,15 (м, 3Н); 7,25 (м, 1Н); 7,35 (м, 2Н); 7,45 (м, 2Н); 7,55 (м, 2Н); 7,80 (м, 1Н); 8,6 (м, 1Н обмен.). Пример 7.В: (3R)-3,4-Дифтор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамид [формула (I); А = 3,4-дифторфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 3,4-дифторбензоилхлорида. Выход = 77%. Твердое вещество белого цвета. Т.пл.=236°С. [a]D=+46° (с=1, дихлорметан). Анализ согласуется с C24H17N3O2F2. TCX: S.A3; 0,70. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 4,0 (к, 1Н); 4,65 (м, 1Н); 5,58 (д, 1Н); 7,12 (м, 1Н); 7,25 (м, 2Н); 7,35 (м, 2Н); 7,45 (м, 2Н); 7,55 (м, 2Н); 7,72 (м, 1Н); 7,82 (м, 1Н); 7,95 (д, 1Н обмен.). ИК-спектр: 3300, 1690, 1630, 1600, 1540, 1500, 1280, 1250, 780, 690 см-1. Пример 7.Г: (3R)-3,5-Дифтор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид [формула (І); А = 3,5-дифторфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 3,5-дифторбензоилхлорида. Выход = 90%. Твердое вещество бледно-желтого цвета. Т.пл.=279°С. [a]D=+44° (с=1, дихлорметан). Анализ согласуется с С24H17N3O2F2. ТСХ: S.A3; 0,70. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,35 (м, 1Н); 4,0 (м, 1Н); 4,65 (м, 1Н); 5,60 (д, 1Н); 6,95 (м, 1Н); 7,10 (м, 1Н); 7,48 (м, 2Н); 7,45 (м, 6Н); 8,0 (д, 1Н обмен.). ИК-спектр: 3200, 1680, 1640, 1590, 1540, 1440, 1380, 1300, 1120, 990, 840, 690 см-1. Пример 7.Д: (3R)-2,4-Дихлор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамид [формула (І); А = 2,4-дихлорфенил] Соединение получают согласно способу А из промежуточного продукта (1.б) и 2,4-дихлорбензоилхлорида. Выход = 77%. Твердое вещество желтоватого цвета. Т.пл.=186°С. [a]D=+78° (с=1, дихлорметан). Анализ согласуется с C24H17N3O2Cl2. ТСХ: S.A3; 0,64. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,38 (м, 1Н); 4,0 (м, 1Н); 4,20 (м, 1Н); 5,63 (д, 1Н); 7,15 (т, 1Н); 7,25 17 42793 Пример 7.O: (3R)-5,6-Дихлор-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)никотинамид [формула (I); А = 3-(5,6-дихлорпиридил)] Соединение получают согласно способу В из промежуточного продукта (1.б) и 5,6-дихлорникотиновой кислоты. Выход = 49%. Твердое вещество белого цвета. Т.пл.=138-140°С. [a]D=+43,7° (с=1, дихлорметан). Анализ согласуется с C23H16CI2N4O2. ТСХ: S.A3; 0,30. 1 Н-ЯМР, d (м.д.): 3,1-3,25 (м, 1Н); 3,3-3,5 (м, 1Н); 3,95-4,1 (к, 1Н); 4,6-4,75 (т, 1Н); 5,5-5,6 (д, 1Н); 7,1-7,6 (м, 8Н); 8,1-8,25 (д, 1Н); 8,25-8,35 (с, 1Н); 8,75-8,9 (с, 1Н). ИК-спектр: 3250, 1650, 1520, 1360, 1290, 1240, 1150, 1040, 760, 690 см-1. Пример 7.П: (3R)-3,5-Дихлор-(4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3ил)изоникотинамид [формула (I); A = 3,5-дихлор-4-пиридил] Соединение получают согласно способу В из промежуточного продукта (1.б) и 3,5-дихлоризоникотиновой кислоты. Выход = 18%. Твердое вещество белого цвета. Т.пл.=182°С. [a]D=+136,5° (с=1, дихлорметан). Анализ согласуется с С23Н16СІ2N4O2. ТСХ: S.A10; 0,45. 1 Н-ЯМР, d (м.д.): 3,1-3,25 (м, 1Н); 3,35-3,5 (м, 1Н); 3,9-4,1 (м, 1Н); 4,6-4,75 (м, 1Н); 5,6-5,7 (д, 1Н); 7,1-7,6 (м, 8Н); 7,7-7,85 (д, 1Н); 8,5-8,6 (д, 2Н). ИК-спектр: 3300, 1670, 1600, 1520, 1390, 1280, 1200, 880, 820, 700 см-1. Пример 7.Р: (3R)-3-трет.-Бутилоксикарбониламино-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hі]индол-3-ил)изоникотинамид [формула (І); A = 3-трет.-бутилоксикарбониламино-4-пиридил] Соединение получают в диметилформамиде согласно способу В, описанному в примере 1.Б, то есть в присутствии РуВrор и триэтиламина, из промежуточного продукта (1.б) и N-Bocпроизводного 3-амино-изоникотиновой кислоты. Выход = 67%. Твердое вещество желтого цвета. ТСХ: S.A10; 0,40. 1 Н-ЯМР, d (м.д.): 1,45 (с, 9Н); 3,15 (м, 1Н); 3,4 (м, 1Н); 3,95 (к, 1Н); 4,5 (т, 1Н); 5,45 (д, 1Н); 7,5 (м, 9Н); 8,4 (д, 1Н); 9,35 (с, 1Н); 9,9 (с, 1Н); 10,2 (д, 1Н). Пример 7.С: (3R)-3-Амино-N-(4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3ил)изоникотинамид [формула (I); А = 3-амино-4-пиридил]. Из продукта конденсации, полученного в предыдущем примере 7.Р, удаляют N-защитную группу с помощью трифторуксусной кислоты в дихлорметане. После перемешивания в течение 30 минут при комнатной температуре растворитель удаляют, остаток обрабатывают этилацетатом и экстрагируют полученный раствор с помощью насыщенного раствора гидрокарбоната натрия. После высушивания растворитель выпаривают и остаток очищают путем колоночной хроматографии на диоксиде кремния, элюируя смесью дихлорметана с метанолом в соотношении 98:2 по объему. Выход = 68%. Твердое вещество бежевого цвета. Т.пл.=175°С. (м, 2Н); 7,85 (м, 1Н) 7,95 (м, 1Н обмен.); 8,15 (д, 1Н). ИК-спектр: 3300, 1650, 1600, 1480, 1440, 1390, 1260, 1060, 760, 700 см-1. Пример 7.К: (3R)-4-Амино-3,5-дихлор-N-(4оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид [формула (I); А = 4-амино-3,5-дихлорфенил] Соединение получают согласно способу В из промежуточного продукта (1.б) и 4-амино-3,5дихлорбензойной кислоты. Выход = 90%. Твердое вещество светло-розового цвета. Т.пл.=168°С. [a]D=+54° (с=1, дихлорметан). Анализ согласуется с С24Н18N4O2СІ2. ТСХ: S.A3; 0,62. 1 Н-ЯМР, d (м.д.): 7,9 (с, 1Н); 7,3 (м, 8Н); 5,6 (д, 1Н); 4,9 (с, 2Н); 4,7 (т, 1Н); 4 (к, 1Н); 3,4 (м, 1Н); 3,1 (м, 1Н). ИК-спектр: 3300, 1600, 1520, 1470, 1390, 1350, 1280, 1120, 780, 700 см-1. Пример 7.Л: (3R)-2-Ацетамидо-N-(4-оксо-1фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hi]индол-3-ил)бензамид [формула (І); A = 2-ацетамидо-фенил] Соединение получают согласно способу В из промежуточного продукта (1.б) и N-ацетилантраниловой кислоты. Выход = 27%. Твердое вещество белого цвета. Т.пл.=210°С. [a]D=46° (с=1, дихлорметан). Анализ согласуется с С26Н22N4О3. ТСХ: S.A9; 0,26. 1 Н-ЯМР, d (м.д.): 1,75 (уш.с, обмениваемый); 2,85 (с, 3Н); 3,15 (м, 1Н); 3,4 (м, 1Н); 4,0 (м, 1Н); 4,22 (м, 1Н); 7,12 (м, 1Н); 7,20 (с, 1Н); 7,25 (м, 1Н); 7,45 (5Н); 7,55 (д, 2Н); 7,75 (м, 2Н); 8,2 (д, 1Н). Пример 7.М: (3R)-2-Ацетокси-N-(4-оксо-1фенил-3,4,6,7-тедрагидро-[1,4]диазепино[6,7,1hi]индол-3-ил)бензамид [формула (I); А = 2-ацетокси-фенил] Соединение получают согласно способу В из промежуточного продукта (1.б) и ацетилсалициловой кислоты. Выход = 14%. Т.пл.=147°С. [a]D=+57° (с=1, дихлорметан). Анализ согласуется с C26H21О4N3. ТСХ: S.A3; 0,50. 1 Н-ЯМР, d (м.д.): 2,5 (с, 3Н); 3,12 (м, 1Н); 3,36 (м, 1Н); 3,95 (к, 1Н); 4,5 (т, 1Н); 5,63 (д, 1Н); 7,1 (т, 1Н); 7,7 (д, 1Н); 7,25 (м, 1Н); 7,35 (м, 3Н); 7,45 (м, 2Н); 7,62 (м, 3Н); 8,18 (д, 1Н); 8,48 (д, 1Н обмен.). ИК-спектр: 3400, 1760, 1660, 1600, 1500, 1180, 1090, 910, 730, 700 см-1. Пример 7.Н: Калиевая соль (3R)-2-гидрокси-N(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)-бензамида [формула (I); А = калий-2-фенат] Сложноэфирную функцию продукта примера 7.М омыляют с помощью гидроксида калия в метаноле при кипячении с обратным холодильником в течение двух часов, затем растворитель выпаривают. Выход = 89%. Твердое вещество желтого цвета. Т.пл.=243°С. [a]D=+4° (с=1, дихлорметан). Анализ согласуется с С24Н18О3N3К×2,5Н2О. ТСХ: S.A3; 0,67. 1 Н-ЯМР, d (м.д.): 3,16 (м, 1Н); 3,35 (м, 1Н); 3,5 (H2O); 3,92 (к, 1Н); 4,98 (т, 1H); 5,1 (с, 1Н); 6,3 (т, 1Н); 6,75 (д, 1Н); 7,02 (м, 1Н); 7,2 (м, 2Н); 12,7 (1Н, уш., обмен.); 7,48 (м, 5Н); 7,6 (м, 1Н); 7,7 (м, 1Н). 18 42793 ИК-спектр: 3370, 1670, 1600, 1510, 1450, 1390, 1020, 800, 690 см-1. Пример 7.Х: (4-Oксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид (3R)тиофен-2-карбоновой кислоты [формула (I); А = 2-тиенил]. Соединение получают согласно способу В из промежуточного продукта (1.б) и тиофен-2карбоновой кислоты. Выход = 57%. Твердое вещество белого цвета. Т.пл.=217-218°С. [a]D=+56° (с=1, дихлорметан). Анализ согласуется с C22H17N3O2S. ТСХ: S.A8; 0,50. 1 Н-ЯМР, d (м.д.): 3,1-3,25 (м, 1Н); 3,25-3,5 (м, 1Н); 3,9-4,1 (м, 1Н); 4,6-4,75 (м, 1Н); 5,5-5,7 (д, 1Н); 7,0-7,6 (м, 10Н); 7,65-7,75 (д, 1Н); 7,75-7,9 (д, 1Н). ИК-спектр: 3250, 1690, 1630, 1540, 1440, 1380, 1270, 1160, 710, 520 см-1. Пример 8.А: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид (3R)-4хлор-хинолин-3-карбоновой кислоты [формула (I); А = 3-(4-хлорхинолил)]. Соединение получают согласно способу В, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4-хлор-хинолин-3-карбоновой кислоты. Выход = 27%. Твердое вещество оранжевого цвета. Т.пл.=192°С. Анализ согласуется с C27H19ClN4О2. ТСХ: S.B; 0,48. 1 Н-ЯМР, d (м.д.): 3,1 (м, 1Н); 3,35 (м, 1Н); 3,9 (к, 1Н); 4,6 (т, 1Н); 5,6 (д, 1Н); 7,3 (м, 8Н); 7,6 (т, 1Н); 7,7 (т, 1Н); 8,1 (д, 1Н); 8,25 (д, 1Н); 8,35 (д, 1Н); 9,15 (с, 1Н). ИК-спектр: 3200, 1650, 1600, 1500, 1440, 1340, 1240, 840, 760, 700 см-1. Пример 8.Б: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4хлор-6-фтор-хинолин-3-карбоновой кислоты [формула (I); А = 3-(4-хлор-6-фтор-хинолил)]. Соединение получают согласно способу B, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4-хлор-6-фтор-хинолин-3карбоновой кислоты. Выход = 29%. Твердое вещество оранжевого цвета. Т.пл.=191°С. [a]D=+93° (с=1, дихлорметан). Анализ согласуется с C27H18ClFN4O2. TCX: S.B; 0,60. 1 Н-ЯМР, d (м.д.): 3,1 (м, 1Н); 3,4 (м, 1Н); 3,9 (к, 1Н); 4,6 (т, 1Н); 5,6 (д, 1Н); 7,3 (м, 9Н); 7,9 (д, 1Н); 8,1 (д, 1Н); 6,2 (д, 1Н); 9,1 (с, 1Н). ИК-спектр: 3250, 1660, 1600, 1580, 1490, 1440, 1340, 1295, 830, 700 см-1. Пример 8.В: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид (3R)4,6-дихлор-хинолин-3-карбоновой кислоты [формула (I); А = 3-(4,6-дихлор-хинолил)]. Соединение получают согласно способу В, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4,6-дихлор-хинолин-3-карбоновой кислоты. Выход = 31%. Твердое вещество желтого цвета. Т.пл.=200°С. [a]D=+89° (с=1, дихлорметан). Анализ согласуется с C27H18Cl2FN4O2. TCX: S.B; 0,55. 1 Н-ЯМР, d (м.д.): 3,2 (м, 1Н); 3,4 (м, 1Н); 4 (к, 1Н); 4,7 (т, 1Н); 5,7 (д, 1Н); 7,3 (м, 8Н); 7,7 (д, 1Н); 8,1 (д, 1Н); 8,35 (м, 2Н); 9,2 (с, 1Н). ТСХ: S.B; 0,15. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,4 (М, 1Н); 3,95 (к, 1Н); 4,5 (т, 1Н); 5,5 (д, 1Н); 5,75 (с, 1Н); 6,45 (с, 1Н); 7,5 (м, 9Н); 8,2 (с, 1Н); 9,7 (д, 1Н). ИК-спектр: 3300, 2900, 1680, 1640, 1600, 1580, 1500, 1230, 1040, 700 см-1. Пример 7.T: (3R)-3-Ацетамидо-N-(4-оксо-1фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hi]индол-3-ил)изоникотинамид [формула (I); А = 3-ацетамидо-4-пиридил]. 0,2 г (0,5 ммоль) Продукта примера 7.С растворяют в 2 мл пиридина; добавляют 1 мл уксусного ангидрида, и перед добавлением 10 мл воды смесь перемешивают в течение 12 часов при комнатной температуре. После перемешивания в течение 4-х часов при комнатной температуре (после добавления воды) смесь экстрагируют этилацетатом; органическую фазу промывают насыщенным раствором гидрокарбоната натрия, затем сушат. После выпаривания остаток очищают путем колоночной хроматографии на диоксиде кремния, элюируя смесью возрастающей полярности ацетона в дихлорметане. Выход = 45%. Твердое вещество белого цвета. Т.пл.=190°С. ТСХ: S.B; 0,17. 1 Н-ЯМР, d (м.д.): 2,2 (с, 3Н); 3,2 (м, 1Н); 3,4 (м, 1Н); 4 (к, 1Н); 4,7 (т, 1Н); 5,6 (д, 1Н); 7,3 (м, 9Н); 8,3 (д, 1Н); 8,45 (д, 1Н); 9,9 (с, 1Н); 10,5 (с, 1Н). ИК-спектр: 3300, 1680, 1650, 1600, 1560, 1500, 1410, 1280, 1240, 700 см-1. Пример 7.У: (3R)-3-Циклопропилкарбониламино-N-(4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)-изоникотинамид [формула (І); A = 3-циклопропилкарбониламино-4-пиридил] 0,15 г (0,38 ммоль) Продукта примера 7.С растворяют в 2 мл дихлорметана; добавляют 1 эквивалент триэтиламина. Охлаждают и при температуре ниже 5°С добавляют 40 мг (0,38 ммоль) циклопропанкарбонилхлорида. Перемешивают в течение 16 часов при комнатной температуре перед добавлением 20 мл дихлорметана. После промывки 1 н. раствором гидроксида натрия, высушивания и выпаривания растворителя, остаток очищают путем колоночной хроматографии на диоксиде кремния, элюируя смесью S.A8. Выход = 20%. ТСХ: S.A10; 0,17. 1 Н-ЯМР, d (м.д.): 0,85 (м, 2Н); 1,1 (м, 2Н); 1,6 (м, 1Н); 3,15 (м, 1Н); 3,4 (м, 1Н); 4 (к, 1Н); 4,7 (т, 1Н); 5,6 (д, 1Н); 7,3 (м, 9Н); 8,3 (д, 1Н); 8,4 (д, 1Н); 9,9 (с, 1Н); 10,35 (с, 1Н). Пример 7.Ф: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)пиразин-2-карбоновой кислоты [формула (І); А = 2-пиразинил]. Соединение получают согласно способу В из промежуточного продукта (1.б) и пиразин-2карбоновой кислоты. Выход = 72%. Твердое вещество светло-оранжевого цвета. Т.пл.=213214°С. [a]D=+56° (с=1, дихлорметан). Анализ согласуется с C22H17N5O2. ТСХ: S.A10; 0,75. 1 Н-ЯМР, d (м.д.): 3,1-3,25 (м, 1Н); 3,3-3,5 (м, 1Н); 3,9-4,1 (м, 1Н); 4,6-4,75 (м, 1Н); 5,55-5,7 (д, 1Н); 7,7 (м, 8Н); 8,6-8,7 (д, 1Н); 8,7-8,85 (д, 1Н); 9,35-9,6 (м, 2Н). 19 42793 1 Н-ЯМР, d (м.д.): 3,1 (м, 1Н); 3,4 (м, 1Н); 3,9 (к, 1Н); 4,6 (т, 1Н); 5,6 (д, 1Н); 7,3 (м, 10Н); 8,15 (д, 1Н); 8,3 (д, 1Н); 9,1 (с, 1Н). ИК-спектр: 3200, 1660, 1600, 1520, 1440, 1350, 1240, 830, 760, 700 см-1. Пример 8.З: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4хлор-6-метокси-хинолин-3-карбоновой кислоты [формула (I); А = 3-(4-хлор-6-метоксихинолил)]. Соединение получают согласно способу В, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4-хлор-6-метокси-хинолин-3карбоновой кислоты. Выход = 35%. Твердое вещество бежевого цвета. Т.пл.=225°С. [a]D=+94° (с=1, дихлорметан). Анализ согласуется с С28Н21СlN4О3. ТСХ: S.B; 0,55. 1 Н-ЯМР, d (м.д.): 3,1 (м, 1Н); 3,4 (м, 1Н); 4 (м, 4Н); 4,7 (т, 1Н); 5,7 (д, 1Н); 7,3 (м, 10Н); 8,1 (д, 1Н); 8,3 (д, 1Н); 9,05 (с, 1Н). ИК-спектр: 3250, 1640, 1580, 1530, 1490, 1440, 1400, 1230, 820, 700 см-1. Пример 8.И: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4хлор-8-метокси-хинолин-3-карбоновой кислоты [формула (I); А = 3-(4-хлор-8-метоксихинолил)]. Соединение получают согласно способу B, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4-хлор-8-метокси-хинолин-3карбоновой кислоты. Выход = 30%. Твердое вещество желтого цвета. Т.пл.=265°С. [a]D=+91° (с=1, дихлорметан). Анализ согласуется с C28H21ClN4O3. TCX: S.B; 0,20. 1 Н-ЯМР, d (м.д.): 3,05 (м, 1Н); 3,3 (м, 1Н); 3,95 (к, 1Н); 4,05 (с, 3Н); 4,6 (т, 1Н); 5,6 (д, 1Н); 7,3 (м, 10Н); 7,8 (д, 1Н); 8,2 (д, 1Н); 9,1 (с, 1Н). ИК-спектр: 3200, 1655, 1600, 1520, 1360, 1270, 1180, 800, 700 см-1. Пример 8.К: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4хлор-5,7-диметил-хинолин-3-карбоновой кислоты [формула (I); А = 3-(4-хлор-5,7-диметилхинолил)] Соединение получают согласно способу В, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4-хлор-5,7-диметил-хинолин-3карбоновой кислоты. Выход = 26%. Твердое вещество желтого цвета. Т.пл.=236°С. [a]D=+118° (с=1, дихлорметан). Анализ согласуется с С29Н23СlN4О2. TCX: S.B; 0,55. 1 Н-ЯМР, d (м.д.): 2,4 (с, 3Н); 2,9 (с, 3Н); 3,05 (м, 1Н); 3,3 (м, 1Н); 3,9 (к, 1Н); 4,6 (т, 1Н); 5,6 (д, 1Н); 7,3 (м, 9Н); 7,7 (с, 1Н); 8 (д, 1Н); 8,4 (с, 1Н). ИК-спектр: 3250, 1680, 1660, 1600, 1580, 1520, 1440, 1220, 700 см-1. Пример 8.Л: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4хлор-5,8-диметил-хинолин-3-карбоновой кислоты [формула (I); A = 3-(4-хлор-5,8-диметилхинолил)] Соединение получают согласно способу В, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4-хлор-5,8-диметил-хинолин-3 ИК-спектр: 3500, 1660, 1600, 1580, 1480, 1440, 1330, 1240, 820, 700 см-1. Пример 8.Г: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)4,8-дихлор-хинолин-3-карбоновой кислоты [формула (I); А = 3-(4,8-дихлорхинолил)]. Соединение получают согласно способу В, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4,8-дихлор-хинолин-3-карбоновой кислоты. Выход = 33%. Твердое вещество желтого цвета. Т.пл.=225°С. [a]D=+81° (с=1, дихлорметан). Анализ согласуется с C27H18Cl2N4O2. TCX: S.B; 0,90. 1 Н-ЯМР, d (м.д.): 3,1 (м, 1Н); 3,4 (м, 1Н); 3,95 (к, 1Н); 4,2 (т, 1Н); 5,7 (д, 1Н); 7,4 (м, 9Н); 7,95 (д, 1Н); 8,3 (д, 1Н); 8,4 (д, 1Н); 9,3 (с, 1Н). ИК-спектр: 3200, 1660, 1600, 1510, 1465, 1440, 1390, 1340, 750, 700 см-1. Пример 8.Д: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4хлор-6-бром-хинолин-3-карбоновой кислоты [формула (I); А = 3-(4-хлор-6-бром-хинолил)]. Соединение получают согласно способу В, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4-хлор-6-бром-хинолин-3карбоновой кислоты. Выход = 33%. Твердое вещество желтого цвета. Т.пл.=191°С. [a]D=+86° (с=1, дихлорметан). Анализ согласуется с С27Н18ВrСlN4О2×0,5H2O. TCX: S.B; 0,70. 1 Н-ЯМР, d (м.д.): 3,15 (м, 1Н); 3,45 (м, 1Н); 4 (к, 1Н); 4,7 (т, 1Н); 5,7 (д, 1Н); 7,3 (м, 8Н); 7,9 (д, 1Н); 8 (д, 1Н); 8,4 (д, 1Н); 8,55 (с, 1Н); 9,2 (с, 1Н). ИК-спектр: 3250, 1660, 1600, 1580, 1500, 1470, 1330, 1220, 820, 700 см-1. Пример 8.Е: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4хлор-6-метил-хинолин-3-карбоновой кислоты [формула (I); А = 3-(4-хлор-6-метил-хинолил)]. Соединение получают согласно способу В в присутствии TOTU и диизопропилэтиламина, исходя из промежуточного продукта (1.б) и 4-хлор-6метил-хинолин-6-карбоновой кислоты. Выход = 29%. Твердое вещество желтого цвета. Т.пл.=196°С. [a]D=+89° (с=1, дихлорметан). Анализ согласуется с C28H21ClN4O2×0,33H2O. TCX: S.B; 0,55. 1 Н-ЯМР, d (м.д.): 2,6 (с, 1Н); 3,2 (м, 1Н); 3,4 (м, 1Н); 4 (к, 1Н); 4,7 (т, 1Н); 5,7 (д, 1Н); 7,4 (м, 9Н); 8,05 (д, 1Н); 8,1 (с, 1Н); 8,4 (д, 1Н); 9,1 (с, 1Н). ИК-спектр: 3250, 1650, 1600, 1580, 1490, 1440, 1340, 1240, 820, 700 см-1. Пример 8.Ж: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4-хлор-8-метил-хинолин-3-карбоновой кислоты [формула (I); А = 3-(4-хлор-8-метил-хинолил)] Соединение получают согласно способу В, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4-хлор-8-метил-хинолин-3карбоновой кислоты. Выход = 30%. Твердое вещество желтого цвета. Т.пл.=240°С (разложение). [a]D=+82° (c=1, дихлорметан). Анализ согласуется с C28H21ClN4O2. ТСХ: S.B; 0,76. 20 42793 Пример 9.Б: (3R)-(9-метил-4-оксо-1-фенил3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3ил)изоникотинамид [формула (І); А = 4-пиридил; R = СН3] Соединение получают согласно способу А из промежуточного продукта (2.б) и хлорангидрида изоникотиновой кислоты. Выход = 88%. Твердое вещество белого цвета. Т.пл.=238-240°С. [a]D=+54° (с=1, дихлорметан). Анализ согласуется с C24H20N4O2. ТСХ: S.A10; 0,57. 1 Н-ЯМР, d (м.д.): 2,35 (с, 3Н); 3,05 (м, 1Н); 3,25 (м, 1Н); 3,9 (м, 1Н); 4,6 (м, 1Н); 5 (д, 1Н); 7 (с, 1Н); 7,2-7,5 (м, 6Н); 7,7 (д, 2Н); 8,1 (д, 1Н обмениваемый); 8,7 (д, 2Н). ИК-спектр: 3700, 1680, 1650, 1520, 1350, 1280, 1230, 1170, 690, 650 см-1. Пример 9.В: (9-Метил-4-оксо-1-фенил-3,4,6,7тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3ил)амид (3R)-4,7-диметил-пиразол[5,1-с][1,2,4]триазин-3-карбоновой кислоты [формула (I); А = 3-(4,7-диметил-пиразол[5,1с][1,2,4]триазинил); R = СН3] Соединение получают согласно способу В из промежуточного продукта (2.б) и 4,7-диметилпиразол[5,1-с][1,2,4]триазин-3-карбоновой кислоты. Выход = 72%. Твердое вещество желтого цвета. Т.пл.=130°С. [a]D=+20° (с=1, дихлорметан). Анализ согласуется с C26H23N7O2. TCX: S.A4; 0,37. 1 Н-ЯМР, d (м.д.): 2,3 (с, 3Н); 2,5 (с, 3Н); 3,2 (с, 3Н); 5,6 (д, 1Н); 9,8 (д, 1Н). ИК-спектр: 3100, 2950, 1665 см-1. Биологическая часть - Активность в отношении ингибирования фосфодиэстеразы Способность соединений формулы (I) согласно изобретению ингибировать фосфодиэстеразы циклических нуклеотидов оценивают путем определения их ИК50 (концентрация, необходимая для ингибирования 50% ферментативной активности). В случае ФДЭ-IV, эту величину сравнивают с ИК50 ролипрама, специфического ингибитора ФДЭ-IV, путем соотношения ИК50 ролипрама к ИК50 испытуемого продукта по отношению к одному и тому же ферментативному препарату. Различные типы фосфодиэстераз получают, частично очищенными на колонке с диэтиламиноэтилцеллюлозой, из трахеи морской свинки и аорты собаки по методу, разработанному W.J. Thompson et al., 1979, Advances in Cyclic Nucleotide Reseaech, vol. 10: 69-92 (1979), изд. G. Brooker и др., Raven Press, New York; и P.J. Silver и др., Eur. J. Pharmacol., 150, 85-94 (1988). Затем определение ферментативной активности различных типов ФДЭ, и в частности ФДЭ-IV, проводят по методу, также разработанному W.J. Thompson, ссылку см. выше. Для определения ИК50 ферментативную активность измеряют в присутствии ингибитора в диапазоне концентраций от 0,1 до 100 мкмоль. Нижеприводимая таблица иллюстрирует ингибирующую активность в отношении ФДЭ-IV по сравнению с таковой ролипрама при использовании препарата фермента, полученного из трахеи морской свинки. карбоновой кислоты. Выход = 30%. Твердое вещество бежевого цвета. Т.пл.=240°С (разложение). [a]D=+76° (с=1, дихлорметан). Анализ согласуется с C29H23ClN4О2. ТСХ: S.B; 0,80. 1 Н-ЯМР, d (м.д.): 3,05 (м, 1Н); 3,3 (м, 1Н); 3,8 (к, 1Н); 4,6 (т, 1Н); 5,6 (д, 1Н); 7,3 (м, 10Н); 8,1 (д, 1Н); 8,9 (с, 1Н). ИК-спектр: 3250, 1660, 1600, 1520, 1440, 1390, 1220, 830, 730, 700 см-1. Пример 8.М: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4-хлор-6,8-диметил-хинолин-3-карбоновой кислоты [формула (І); A = 3-(4-хлор-5,8-диметилхинолил)] Соединение получают согласно способу В, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4-хлор-6,8-диметил-хинолин-3карбоновой кислоты. Выход = 25%. Твердое вещество белого цвета. Т.пл.=280°С. [a]D=+87° (с=1, дихлорметан). Анализ согласуется с С29Н23СІN4О2×0,33H2O. TCX: S.B; 0,85. 1 Н-ЯМР, d (м.д.): 2,6 (с, 3Н); 2,8 (с, 3Н); 3,1 (м, 1Н); 3,4 (м, 1Н); 3,9 (к, 1Н); 4,65 (т, 1Н); 5,7 (д, 1Н); 7,3 (м, 9Н); 7,95 (с, 1Н); 8,4 (д, 1Н); 9,1 (с, 1Н). ИК-спектр: 3250, 1660, 1600, 1520, 1490, 1440, 1360, 1220, 840, 700 см-1. Пример 8.Н: (4-Оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)амид (3R)-4-хлор-7,8-диметил-хинолин-3-карбоновой кислоты [формула (І); A = 3-(4-хлор-7,8-диметилхинолил)] Соединение получают согласно способу В, описанному в примере 1.Б, из промежуточного продукта (1.б) и 4-хлор-7,8-диметил-хинолин-3карбоновой кислоты. Выход = 35%. Твердое вещество желтого цвета. Т.пл.=203°С. [a]D=+88° (с=1, дихлорметан). Анализ согласуется с С29Н23СlN4О2×0,5Н2О. TCX: S.B; 0,90. 1 Н-ЯМР, d (м.д.): 3,1 (м, 1Н); 3,3 (м, 1Н); 3,9 (к, 1Н); 4,6 (т, 1Н); 5,6 (д, 1Н); 7,3 (м, 9Н); 8 (д, 1Н); 8,3 (д, 1Н); 9,1 (с, 1Н). ИК-спектр: 3250, 1660, 1600, 1515, 1440, 1395, 1360, 1230, 780, 700 см-1. Пример 9.А: (3R)-2-Метокси-N-(9-метил-4оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hі]индол-3-ил)бензамид [формула (І); A = 2-метоксифенил; R = СН3] Соединение получают согласно способу А из промежуточного продукта (2.б) и 2-метоксибензоилхлорида. Выход = 80%. Твердое вещество бледно-желтого цвета. Т.пл.=123-125°С (разложение). [a]D=+34° (с=1, дихлорметан). Анализ согласуется с С26Н23N3О3. ТСХ: S.A9; 0,66. 1 Н-ЯМР, d (м.д.): 2,35 (с, 3Н); 3,1 (м, 1Н); 3,35 (м, 1Н); 4 (м, 1Н); 4,1 (с, 3Н); 4,65 (м, 1Н); 5,7 (д, 1Н); 7-7,5 (м, 10Н); 8,25 (д, 1Н); 9,8 (д, 1Н обмен.). ИК-спектр: 3350, 1680, 1650, 1600, 1510, 1490, 1290, 1240, 1160, 1020, 750, 700 см-1. 21 42793 Таблица Ингибирующее воздействие на ФДЭ-IV по сравнению с таковым ролипрама Пример 1.Б 2.Б 2.В 2.Н 2.О 2.П 2.Р ИК50 ролипрама ИК50 соединения примера 3,7 1,2 1,2 1,3 2,5 1,9 1,5 Пример 2.У 2.Ф 2.Щ 5 6.А 6.Б 6.В ИК50 ролипрама ИК50 соединения примера 3,3 2,0 1,4 1,2 2,7 1,6 1,6 Анализ результатов вышеприведенной таблицы показывает, что испытанные в опыте продукты согласно изобретению ингибируют фермент ФДЭIV трахеи морской свинки как правило более эффективно, чем ролипрам, и в ряде случаев они в 2-3 раза более эффективные, чем ролипрам. Кроме того, испытания, реализуемые на очищенных ФДЭ различных типов из трахеи морской свинки или аорты собаки, показывают, что величины ИК50, получаемые при использовании продуктов согласно изобретению, по отношению к ФДЭ типа III и типов I и V, намного более высокие, чем таковые, определенные для ФДЭ типа IV. Эти результаты доказывают высокую и селективную ингибирующую активность продуктов согласно изобретению в отношении ФДЭ-IV. - Противовоспалительная и антиаллергическая активность ин виво Воздействия продуктов согласно изобретению исследуют на морской свинке в модели инфильтрации эозинофилов, индуцированной путем антигенной стимуляции или путем выдерживания в аэрозоле PAF, по методологии, описанной Lagente V. и др., Вr. J. Pharmacol., 112, 83Р (1994). Введение продуктов согласно примерам (130 мг/кг перорально) значительно уменьшает число эозинофилов в бронхоальвеолярной промывной жидкости. Введение продуктов изобретения также уменьшает воспалительные реакции, индуцированные путем вкапывания в трахею морской свинки интерлейкина-5. - Ингибирование выделения цитокинов Активность продуктов согласно изобретению в отношении выделения цитокинов человеческими мононуклеарами определяют ин витро по методу, описанному Konno S. и др., Eur. J. Pharmacol., 264, 265-268 (1994), и Endo H. и др., Int. Arch. Allergy Immnunol., 101, 425-430 (1993), для интерлейкинов, и по методу, описанному Semmler J. и др.. Int. J. Immunopharmac., 15, 409-413 (1993), и Verghese M.W. и др., J. Pharmacol. Exp. Ther., 272, 1313-1320 (1995) для a-фактора некроза опухоли. Введение доз интерлейкинов-2, -4, -5 и a-фактора некроза опухоли осуществляют по иммуноферментативному способу. Рассчитывают концентрацию ИК50, ингибирующую 50% продуцирования цитокина, стимулируемого конканавалином А, фитогемагглютинином или липополисахаридом. В этих условиях испытуемые продукты формулы (I) согласно изобретению проявляют замет Пример 6.Г 6.Д 6.Е 6.Ж 7.К 9.A 9.В ИК50 ролипрама ИК50 соединения примера 1,9 1,9 1,2 2,2 2,4 1,4 1,0 ную ингибирующую активность с ИК50 как правило ниже или равными 10-5 моль/л. - Токсикология Острую токсичность соединения примера 2.Ц исследуют в случае крысы при введении пероральным путем. Соединение вводили в течение двух недель в виде водной суспензии с 1% метилцеллюлозы, в дозе 100 мг/кг/день. Не было обнаружено никакой активности, которая могла бы быть связана с эффектом токсичности. В частности, отсутствие эффектов, вызывающих рвоту, подтверждено на собаке. Продукты примеров 4 и 9.Б в дозе 3 мг/кг/внутривенно не показывают вызывающих рвоту эффектов. Эти результаты показывают противовоспалительную и/или иммуно-подавляющую активность продуктов согласно изобретению. Продукты согласно изобретению, следовательно, особенно пригодны для лечения или профилактики: - аллергических патологий, и в частности, астмы, атопического дерматита; - воспалительных патологий, в частности на уровне бронхов, но также ревматоидного полиартрита, и также воспалительных кишечных заболеваний (геморрагический ретроколит и болезнь Крона); включая случаи, когда присутствует аутоиммунная компонента. Галеновая часть Продукты согласно изобретению вводят в виде композиций, соответствующих природе и интенсивности излечиваемого заболевания. Суточная доза в случае человека обычно составляет от 2 мг до 1 г продукта, причем ее можно вводить в один или несколько приемов. Композиции получают в формах, совместимых с предусматриваемым путем введения, как, например, таблетки, драже, капсулы, жидкости для полоскания, аэрозоли, порошки для ингаляции, свечи, гели или суспензии. Эти композиции получают известными специалисту способами, и они включают 0,560% масс. действующего начала (соединение формулы (I)) и 40-99,5% масс. фармацевтически соответствующего и совместимого с действующим началом и физической формой предусматриваемой композиции эксципиента. В качестве примера ниже приводится состав и способ получения таблеток, содержащих соединение согласно изобретению: активное вещество формулы (I) 1-75 мг лактоза 124-74 мг микрокристаллическая целлюлоза 36-60 мг 22 42793 поливинилпирролидон 6 мг натриевая соль карбоксиметилкрахмала 8 мг стеарат магния 1 мг. Методика получения: смешать активное вещество, лактозу, микрокристаллическую целлюло зу и карбоксиметилкрахмал. Смочить и гранулировать с помощью водного или спиртового раствора поливинилпирролидона с соответствующей концентрацией. Сушить и сортировать по размеру гранулят. Гомогенно смешивать со стеаратом магния. Прессовать по 200 мг на таблетку. __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 23
ДивитисяДодаткова інформація
Назва патенту англійськоюDiazepinoindol derivates (variants), pharmaceutical composition, pharmaceutical composition with the phosphodiesterase vi inhibiting activity
Автори англійськоюPASCAL YVES, MOODLEY INDRES, CALVET ALAIN, JUNIEN JEAN-LUI, Dal Svein G
Назва патенту російськоюПроизводные диазепиноиндола (варианты), фармацевтическая композиция, фармацевтическая композиция с ингибирующей фосфодиэстеразу vi активностью
Автори російськоюПаскаль Ив, Мудли Индрес, Кальве Алан, Жюньен Жан-Луи, Даль Свеин Г.
МПК / Мітки
МПК: A61K 31/5517, A61P 37/08, A61K 31/55, A61P 11/00, A61P 43/00, C07D 487/06, A61P 29/00, A61P 11/08
Мітки: фармацевтична, фосфодіестеразу, інгібуючою, композиція, діазепіноіндолу, похідні, варіанти, активністю
Код посилання
<a href="https://ua.patents.su/23-42793-pokhidni-diazepinoindolu-varianti-farmacevtichna-kompoziciya-z-ingibuyuchoyu-fosfodiesterazu-iv-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Похідні діазепіноіндолу (варіанти), фармацевтична композиція з інгібуючою фосфодіестеразу iv активністю</a>
Попередній патент: Спосіб електронно-променевого лиття диспергуванням
Наступний патент: Фільтруюча панель для плавального басейну