Похідні аміду фенілциклогексилкарбонової кислоти, суміш їх ізомерів чи окремі ізомери і їх солі, фармацевтична композиція з антиартеріосклеротичною і антирестенозною активністю
Номер патенту: 35623
Опубліковано: 16.04.2001
Автори: Ельтінг Джеймс, Гердес Кристоф, Вольфайль Штефан, Домдай-Бетте Анке, Денцер Дірк, Ломер Штефан, Бойк Мартін, Ялкіноглу Йоцкан, Цайсс Зігфрід, Грютцманн Руді, МЮЛЛЄР-ГЛІМАНН Маттіас, Мюллєр Ульріх
Формула / Реферат
1. Производные амида фенилциклогексилкарбоновой кислоты общей формулы(1)
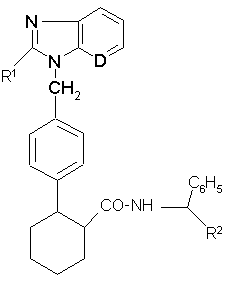
где:
D- группа-СН-или атом азота,
R1 - фенил, циклоалкил с 3 - 6 атомами углерода, неразветвленный или
разветвленный алкил с 1 - 5 атомами углерода,
R2 - неразветвленный или разветвленный алкоксикарбонил с 1
5 атомами углерода или остаток формулы -CO-NH2 или –СН2-ОН, смесь их изомеров или отдельные изомеры и их соли.
2. Производные амида фенилциклогексилкарбоновой кислоты общей формулы (I) по п. 1,
где;
D - группа -СН- или атом азота,
R1 - фенил, циклопропил, циклогексил, неразветвленный или разветвленный алкил с 1 - 4 атомами углерода,
R2 - неразветвленный или разветвленный алкоксикарбонил с 1 - 4 атомами углерода или остаток формулы -CO-NH2 или –СН2-ОН, смесь их изомеров или отдельные изомеры и их соли.
3. Производные амида фенилциклогексилкарбоновой кислоты общей формулы (I) по п. 1, где:
D - группа -СН- или атом азота,
R1 - фенил, циклопропил, этил или изо-пропил,
R2 - неразветвленный или разветвленный алкоксикарбонил с 1 - 4 атомами углерода, или остаток формулы -СО-NН2 или –СН2-ОН, смесь их изомеров или отдельные изомеры и их соли.
4. Производные амида фенилциклогексилкарбоновой кислоты общей формулы (I) по п. 1, где заместители R1, R2 и D имеют указанные в нижеследующей таблице значения, (в этой таблице используется условное сокращение "диа", обозначающее диастереомер.)
R1
D
R2
изомер
![]()
СН
-СН2-ОН
dia A, S
![]()
СН
-СН2-ОН
dia В, S
-CH(CH3)2
N
-СН2-ОН
dia A, S
-CH(CH3)2
N
-СН2-ОН
dia В, S
-CH(CH3)2
СН
-СН2-ОН
dia A, S
-CH(CH3)2
СН
-СН2-ОН
dia В, S
-C2H5
N
-СН2-ОН
dia A, S
-C2H5
N
-СН2-ОН
dia В, S
-C2H5
СН
-СН2-ОН
dia A, S
-C2H5
СН
-СН2-ОН
dia В, S
-C2H5
СН
-СН2-ОН
dia A, S
-C2H5
СН
-СН2-ОН
dia В, S
-СН(СН3)2
СН
-СO2-CН3
dia
-СН(СН3)2
СН
-СO-NН2
dia A
-СН(СН3)2
СН
-СO-NН2
dia В
![]()
СН
-СO-NН2
dia
![]()
СН
-СO-NН2
dia В
-СН(СН3)2
N
-СO-NН2
dia A
-СН(СН3)2
N
-СO-NН2
dia В
-C2H5
N
-СO-NН2
dia
-C2H5
СН
-СO-NН2
dia A
-C2H5
СН
-СO-NН2
dia В
-C6H5
СН
-СO-NН2
dia
смесь их изомеров или отдельные изомеры и их соли.
5. Фармацевтическая композиция с антиартериосклеротической и антирес-тенозной активностью, содержащая по меньшей мере одну инертную нетоксичную, фармацевтически приемлемую целевую добавку и по меньшей мере одно активное начало, отличающаяся тем, что в качестве активного начала содержит соединение вышеуказанной общей формулы (I)

где;
D - группа -СН- или атом азота,
R1 - фенил, циклоалкил с 3 - 6 атомами углерода, неразветвленный или разветвленный алкил с 1 - 5 атомами углерода,
R2 - неразветвленный или разветвленный алкоксикарбонил с 1 - 5 атомами углерода или остаток формулы -СО-МНз или -СН2-ОН,
смесь его изомеров или отдельный изомер или его соль в эффективном
количестве.
Текст
1. Производные амида фенилциклогексилкарбоновой кислоты общей формулы (I) 35623 смесь их изомеров или отдельные изомеры и их соли. 5. Фармацевтическая композиция с антиартериосклеротической и антирестенозной активностью, содержащая по меньшей мере одну инертную нетоксичную, фармацевтически приемлемую целевую добавку и по меньшей мере одно активное начало, отличающаяся тем, что в качестве активного начала содержит соединение вышеуказанной общей формулы (I): D - группа -СН- или атом азота; R1 - фенил, циклоалкил с 3 - 6 атомами углерода, неразветвленный или разветвленный алкил с 1 - 5 атомами углерода; R2 - неразветвленный или разветвленный алкоксикарбонил с 1 - 5 атомами углерода, или остаток формулы -СО-NH2, или -СН2-ОН, смесь его изомеров или отдельный изомер или его соль в эффективном количестве. где: Физиологически приемлемыми солями могут также являться соли металла или аммониевые соли предлагаемых соединений, имеющие свободную карбоксильную группу. Особенно предпочтительными являются, например, соли натрия, калия, магния или кальция, а также аммониевые соли, производимые от аммиака, или органических аминов, таких, как, например, этиламин, диили триэтиламин, ди- или триэтаноламин, дициклогексиламин, диметиламиноэтанол, аргинин, лизин, этилендиамин или 2-фенилэтиламин. Предлагаемые соединения могут иметься в виде стереоизомеров, которые представляют собой прямую и обратную формы (энантиомеры), или не являются таковыми (диастереомеры). Изобретение относится к энантиомерам или диастереомерам или их соответствующим смесям. Рацемические формы, а также диастереомеры известным образом можно разделять на чистые стереоизомеры. Предпочтительными являются соединения общей формулы (I): где: D - группа -СН- или атом азота; R1 - фенил, циклопропил, циклогексил, неразветвленный или разветвленный алкил с 1 - 4 атомами углерода; R2 - неразветвленный или разветвленный алкоксикарбонил с 1 - 4 атомами углерода или остаток формулы -CO-NH2 или –CH2-OH, смесь их изомеров или отдельные изомеры и их соли. Особенно предпочтительными являются соединения общей формулы (I): где: D - группа -СН- или атом азота; R1 - фенил, циклопропил, этил или изо-пропил; R2 - неразветвленный или разветвленный алкоксикарбонил с 1 - 4 атомами углерода или остаток формулы -CO-NH2 или –СН2-ОН, смесь их изомеров или отдельные изомеры и их соли. Изобретение относится к новым химическим веществам с ценными биологическими свойствами, в частности к производным амида фенилциклогексилкарбоновой кислоты общей формулы (I): где: D - группа -СН- или атом азота; R1 - фенил, циклоалкил с 3 - 6 атомами углерода, неразветвленный или разветвленный алкил с 1 - 5 атомами углерода; R2 - неразветвленный или разветвленный алкоксикарбонил с 1 - 5 атомами углерода или остаток формулы -CO-NH2 или –СН2-ОН; смеси их изомеров или отдельным изомерам и их солям. В рамках настоящего изобретения предпочитают физиологически приемлемые соли. Физиологически приемлемыми солями предлагаемых соединений могут являться соли предлагаемых веществ с минеральными кислотами, карбоновыми кислотами или сульфокислотами. Особенно предпочтительными являются соли с такими кислотами, как, например, хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, фос-форная кислота, метансульфокислота, этансульфокислота, толуолсульфокислота, бензолсульфокислота, нафталинди-сульфокислота, уксусная кислота, пропионовая кислота, молочная кислота, винная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота или бензойная кислота. 2 35623 В частности предпочитаются соединения общей формулы (I), где заместители имеют указанные в нижеследующей таблице значения. В этой таблице, а также в нижеследующих, используется условное сокращение "диа", обозначающее диастереомер. омылению, получаемую при этом кислоту, в случае необходимости после предварительной активации, подвергают взаимодействию с производными фенилглицина общей формулы (III): где: R2 - имеет вышеуказанное значение, в среде инертных растворителей, в присутствии основания и/или дегидратирующего срества, и, если R2/R2` означает -СО-NН2, то целевой соответствующий сложный эфир можно подвергать взаимодействию с аммиаком в среде спиртов. Вышеприведенный способ поясняется следующей схемой: Таблица R1 Изомер -CH2-OH dia A, S СН -CH2-OH dia B, S N N CH CH N N CH CH CH CH CH CH CH -CH2-OH -CH2-OH -CH2-OH -CH2-OH -CH2-OH -CH2-OH -CH2-OH -CH2-OH -CH2-OH -CH2-OH -CO-NH2 -CO-NH2 -CO-NH2 dia A, S dia B, S dia A, S dia B, S dia A, S dia B, S dia A, S dia B, S dia A, S dia B, S dia dia A dia B CH -CO-NH2 dia CH -СН(СН3)2 -СН(СН3)2 -С2Н5 -С2Н5 -С2Н5 -С6Н5 R2 СН -СН(СН3)2 -СН(СН3)2 -СН(СН3)2 -СН(СН3)2 -С2Н5 -С2Н5 -С2Н5 -С2Н5 -С6Н5 -С6Н5 -СН(СН3)2 -СН(СН3)2 -СН(СН3)2 D -CO-NH2 dia B N N N CH CH CH -CO-NH2 -CO-NH2 -CO-NH2 -CO-NH2 -CO-NH2 -CO-NH2 dia A dia B dia dia A dia B dia Соединения общей формулы (I) получают за счет того, что соединения общей формулы (II): В качестве растворителя для способа пригодны стандартные органические растворители, не изменяющиеся в условиях реакции. Сюда предпочтительно относятся простые эфиры, такие, как, например, диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир, или углеводороды, такие, как, например, бензол, толуол, ксилол, гексан, циклогексан или нефтяные фракции, или галогенированные углеводороды, такие, как, например, дихлорметан, трихлорметан, тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол, или этилацетат, триэтиламин, пиридин, диметилсульфоксид, диметилформамид, триамид гексаметилфосфорной кислоты, ацетонитрил, ацетон или нитрометан. Можно также приме где: R1 и D имеют вышеуказанное значение и R3 означает неразветвленный или разветвленный алкоксил с 1 - 4 атомами углерода, подвергают 3 35623 нять смеси приведенных растворителей. Предпочтительными являются дихлорметан и тетрагидрофуран. В качестве оснований для вышеописанного способа можно в основном применять неорганические или органические основания. Сюда предпочтительно относятся гидроокиси щелочного металла, как, например, гидроокись натрия или калия, гидроокиси щелочноземельного металла, например, гидроокись бария, карбонаты щелочного металла, как, например, карбонат натрия, калия или цезия, карбонаты щелочноземельного металла, как, например, карбонат кальция, или алкоголяты щелочного или щелочноземельного металла, как, например, метанолат натрия или калия, этанолат натрия или калия или трет.бутилат калия, или органические амины (триалкиламины с 1 - 6 атомами углерода в каждой алкильной группе) как, например, триэтиламин, или гетероциклы, как, например, 1,4-диазабицикло[2.2.2]октан, 1,8-диазабицикло[5.4.0]ундец-7-ен, пиридин, диаминопиридин, метилпиперидин или морфолин. В качестве оснований можно также применять щелочные металлы как, например, натрий, или их гидриды, как, например, гидрид натрия. Предпочтительными являются гидрид натрия, карбонат калия, триэтиламин, триметиламин, пиридин и трет.бутилат калия. В общем основание применяют в количестве от 0,05 до 10 моль, предпочтительно от 1 до 2 моль, на 1 моль соединения формулы (III). Способ в общем осуществляют в диапазоне температур от -50 до +100°С, предпочтительно от –30 до +60°С, в общем при атмосферном давлении. Можно, однако, также осуществлять его при повышенном или пониженном давлении (например, в диапазоне от 0,5 до 5 бар). Амидирование может осуществляться, при необходимости, через галоидангидриды указанной кислоты или ее смешанные ангидриды, получаемые в результате взаимодействия соответствующих кислот с тионилхлоридом, трихлоридом фосфора, пентахлоридом фосфора, трибромидом фосфора, оксалилхлоридом или хлорангидридом метансульфокислоты. Наряду с вышеприведенными основаниями в качестве оснований предпочтительно пригодны триэтиламин и/или диметиламинопиридин, 1,8диазабицикло[5.4.0]ундец-7-ен или 1,4-диазабицикло[2.2.2]октан. Основание применяют в количестве от 0,5 до 10 моль, предпочтительно от 1 до 5 моль, на моль соединений общей формулы (III). В качестве акцептора кислоты для амидирования можно применять карбонаты щелочного или щелочно-земельного металлов, такие, как, например, карбонат натрия или калия, гидроокиси щелочного или щелочно-земельного металлов, такие, как, например, гидроокись натрия или калия, или органические основания, такие, как, например, пиридин, триэтиламин, N-метилпиперидин, или бициклические амидины, такие, как, например, 1,5-диазабицикло[4.3.0]-нонен-5 или 1,5диазабицикло[5.4.0]ундецен-7. Предпочтительным является триэтиламин. В качестве дегидратирующих веществ пригодны карбодиимиды, как, например, диизопропил карбодиимид, дициклогексилкарбодиимид или гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида или же карбонильные соединения, как, например, карбонилдиимидазол или 1,2оксазолиевые соединения, как, например, 2-этил5-фенил-1,2-оксазолий-3-сульфонат или ангидрид пропанфосфоновой кислоты или изобутилхлороформат или гексафторфосфат бензотриазолилокси-трис-(диметиламино)фосфония или амид сложного дифенилового эфира фосфорной кислоты или хлорангидрид метансульфокислоты, в случае необходимости в присутствии оснований, таких, как, например, триэтиламин или N-этилморфолин или N-метилпиперидин или дициклогексилкарбодиимид и N-гидроксисукцинимид. Акцепторы кислоты и дегидратирующие вещества в общем применяют в количестве от 0,5 до 3 моль, предпочтительно от 1 до 1,5 моль, на моль соответствующих карбоновых кислот. Перевод в соответствующие фенилглицинамидоамиды (R2/R2`=-CONH2) осуществляют спиртным аммиаком, предпочтительно насыщенными аммиаком спиртами, такими, как, например, метанол или этанол, предпочтительно метанол, при комнатной температуре. Соединения общей формулы (III) известны или их можно получать стандартными методами. Соединения формулы (II) являются новыми или их получают в результате взаимодействия соединений общей формулы (IV): где: L - типичная удаляемая группа как, например, хлор, бром, йод, тозилат или мезилат, предпочтительно бром; и R3 - имеет вышеуказанное значение, с соединениями общей формулы (V): где: R1 и D имеют вышеуказанное значение, в среде вышеприведенных растворителей, в случае необходимости в присутствии вышеуказанных оснований. Соединения общей формулы (I) обладают неожиданным, ценным фармакологическим спектром действия. Они ингибируют пролиферацию клеток гладких мышц. Поэтому их можно применять для лечения рестеноза, а также артериосклероза. Опыт по выявлению ингибирования пролиферации клеток гладких мышц предлагаемыми соединениями Для определения антипролиферативного действия соединений применяют клетки гладких мышц, получаемые из аорт свиней известным методом (см. Р.Росс, J. Cell. Biol. 50, 172, 1971 г.). Клетки помещают в пригодные чашки, как прави 4 35623 ло, пластины с 96 углублениями, и культивируют при 37°С в течение 2 - 3 дней в среде 199 вместе с 7,5 % ТЭС и 7,5 % СНТ (сыворотка новорожденных телят), 2 ммоль L-глутамина и 15 ммоль буфера HEPES, рН 7,4, в атмосфере, содержащей 5 % двуокиси углерода. Затем клетки синхронизируют на 2 - 3 дня путем удаления сыворотки, после чего их возбуждают к росту с помощью сыворотки или других факторов. Одновременно к среде добавляют испытуемые соединения. Через 16 20 часов добавляют 3H-тимидин и по истечении дальнейших 4 часов определяют включение этого вещества в ДНК клеток, способную к осаждению трихлоруксусной кислотой. Для определения значений KT50 вычисляют концентрацию активного начала, которая при последовательном разведении активного начала обеспечивает 50 %-ное торможение включения тимидинина, вызываемого 10 % ТЭС. Результаты опыта сведены в табл. А. Таблица А Соединение примера № 16 19 жду каудальным и краниальным концами, равном около 1,5 см. У краниального конца этого сегмента сосуда в артерию вводят канюлю, а каудальный конец перфорируют уколом иглой. После промывки физиологическим раствором поваренной соли через сегмент пропускают поток воздуха (25 мл/мин, в течение 4 минут). Затем зажимы удаляют, кровотечение останавливают при небольшом давлении и операционное поле закрывают скобками для соединения краев раны. Через 8 дней после проведения операции животных умерщвляют. Извлекают сегменты сонной артерии, через которые пропускали воздух, а также, в качестве контроля, ее соответствующие контралатеральные сегменты. Аппликацию испытуемых веществ (оральную, внутривенную, внутрибрюшинную и подкожную) начинают за два дня до операции, а дача веществ продолжается в течение всего периода проведения опыта (общая продолжительность дачи веществ: 10 дней). Индуцируемую воздухом пролиферацию клеток гладких мышц определяют путем определения содержания ДНК сегментов сонной артерии по методу Хельмса и др. (см. DNA 43, стр. 39 - 49, 1985 г.). Для этого куски сосудов подвергают переварению протеиназой К, ДНК выделяют и подвергают флуорометрическому анализу в присутствии бисбензимида (ДНК из спермы сельди в качестве стандарта). Содержание ДНК в сосудах указывают в мкг ДНК на мм сонной артерии. Для определения антипролиферативного действия предлагаемых соединений в шейную артерию крыс вводят катетер с раздуваемым баллончиком на конце. Баллончик раздувают и внутреннюю поверхность кровеносного сосуда травмируют путем движения катетера (см. Clowes A.W. и др., Lab. Invest, том 49, № 3, стр. 327, 1983 г.). Данное травмирование приводит к неоинтимальной пролиферации гладких мышц, вызывающей стенозы. Степень сужения сосудов у животных определяют приблизительно через 2 недели с помощью гистологической перебработки кровеносных сосудов. При этом измеряют поверхности пролиферировавшейся ткани по поперечному сечению сосудов. С учетом вышеприведенных данных о биологической активности предлагаемых соединений дальнейшим объектом изобретения является фармацевтическая композиция с антиартериосклеротической и антирестенозной активностью, содержащая наряду с по меньшей мере одной инертной нетоксичной, фармацевтически приемлемой целевой добавкой по меньшей мере одно соединение вышеуказанной общей формулы (I), смесь его изомеров или отдельный изомер или его соль в эффективном количестве. Предлагаемая композиция может иметься в виде стандартных препаратов, таких, как, например, таблетки, драже, пилюли, грануляты, аэрозоли, сиропы, эмульсии, суспензии и растворы. Препараты содержат терапевтически эффективное соединение, как правило, в концентрации около 0,5 - 90 % от веса смеси, то есть в количествах, достаточных для достижения нижеприведенного диапазона дозировки. Под "целевой добавкой" КТ50 (нмоль) 0,28 0,01 Опыт по ингибированию экспресии гена c-fos в клетках гладких мышц предлагаемыми соединениями Исследуют антипролиферативное действие соединений на вызываемую сывороткой и фактором роста сигнальную трансдукцию и индукцию экспресии гена c-fos в репортерных линиях клеток гладких мышц. В качестве репортера при этом служит люцифераза, экспрессия которой управляется промотором c-fos человека. Конструкт промотора c-fos и люциферазы стабильно интегрирован в хромосомальную ДНК клеточной линии А 10 (АТСС CRL 1476) гладких мышц крыс. Репортерные клетки вносят в имеющие 96 углублений пластинки и культивируют в течение 1 - 2 дней при 37°С в содержащей сыворотку среде D-MEM (с 10 % ТЭС, 2 ммоль L-глутамина и 15 ммоль буфера HEPES, рН 7,4) в атмосфере, содержащей 5 % двуокиси углерода. Для подавления активности промотера c-fos до базальных значений клетки "арретируют" путем удаления сыворотки на 24 часа. Потом добавляются испытуемые соединения и клетки стимулируют ТЭС или факторами роста к индукции активности люциферазы. После этого периода обработки (4 часа) клетки лизируют и их экстракты применяют для определения активности люциферазы. Значения KT50 вычисляют из концентрации активного начала, которая при последовательном разведении активного начала обеспечивает 50 %-ное торможение вызываемой соответствующим стимулом активности люциферазы. Опыт ин виво по торможению пролиферации клеток васкуларных гладких мышц на модели сонной артерии крысы с перфузией воздухом Опыт ин виво осуществляют согласно слегка модифицированному методу Фишмэна и др. (см. Lab. Invest. 32, стр. 339 - 351, 1975 г.). Операцию животных делают с применением торгового анестезирующего средства Нембутал. Правую артерию carotis communis раскрывают и двумя зажимами для сосудов пережимают на расстоянии ме 5 35623 подразумевают любые стандартные носители и вспомогательные вещества. Препараты получают, например, путем смешивания активных начал с растворителями и/или носителями, в случае необходимости с применением эмульгаторов и/или диспергаторов, при этом, например, в случае использования воды в качестве разбавителя можно употреблять, в случае необходимости, органические растворители в качестве вспомогательных растворителей. Аппликацию осуществляют стандартным образом, предпочтительно орально или парентерально, в частности чрезъязычно или внутривенно. В случае парентеральной аппликации можно применять растворы активного начала с употреблением пригодных жидких носителей. В общем оказалось преимущественным для достижения эффективных результатов давать активное начала в количестве, равном около 0,001 20 мг/кг, предпочтительно около 0,01 - 5 мг/кг от веса тела при внутривенной аппликации, а при оральной аппликации - около 0,01 - 50 мг/кг, предпочтительно 1-10 мг/кг от веса тела. В случае необходимости все-таки может быть необходимым отклоняться от вышеуказанных количеств, а именно в зависимости от веса тела или же вида аппликации, индивидуального отношения к лекарству, вида препарата и момента или промежутка времени, в который осуществляется аппликация. Так, в некоторых случаях может быть достаточным применять меньше активного начала, чем вышеуказанное минимальное количество, а в других случаях необходимо превышать вышеназванную максимальную концентрацию. В случае аппликации больших количеств рекомендуется распределять их суточную дозу на несколько разовых доз в течение дня. Нижеследующие примеры поясняют получение исходных соединений. Пример I 2-изопропил-бензимидазол tBu = сложный трет.бутиловый эфир 0,75 г (25 ммоль) 80 %-ного гидрида натрия суспендируют в 50 мл диметилформамида, охлаждают до -10°С, после чего при максимальной температуре 0°С прикалывают раствор 4,03 г (25 ммоль) 2-изопропилбензимидазола в 60 мл диметилформамида. После перемешивания в течение 15 минут при макс. 0°С раствор сложного трет.бутилового эфира транс-2-(п-бромметилфенил)-циклогексан-1-карбоновой кислоты подают в 110 мл диметилформамида. После перемешивания при комнатной температуре в течение 2,5 часов смешивают с 25 мл 1-н. уксусной кислоты и сгущают. Остаток распределяют в смеси диэтилового эфира и воды, водную фазу еще два раза экстрагируют, объединенные органические фазы сушат над сульфатом натрия и сгущают. Получаемый продукт очищают путем хроматографии на силикагеле марки 60 с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 3 : 7. Выход: 2,91 г (28 % теории): Rf = 0,73 (смесь дихлорметана и метанола в соотношении 9:1). Пример III транс-2-[4-(2-изопропилбензимидазолил-1 Нметил)фенил]ииклогексанкарбоновая кислота 6,54 г (60 ммоль) 2,3-диаминопиридина смешивают с 5,6 г (60 ммоль) изомасляной кислоты и 45 мл полифосфорной кислоты и нагревают до 130°С в течение 6,5 часов. Через дальнейшие 6,5 часа получаемую смесь подают на 0,4 л ледяной воды и твердой гидроокисью натрия доводят до рН 7. К смеси добавляют карбонат натрия до прекращения образования газа и три раза экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и сгущают. Выход: 8,45 г (87 % теории): Rf = 0,36 (смесь дихлорметана и метанола в соотношении 9:1). Пример II Сложный трет.бутиловый эфир транс-2-[4-(2изопропилбензимидазолил-1Нметил)фенил]ииклогексан-1 -карбоновой кислоты 2,91 г (6,7 ммоль) соединения примера II подают в 9 мл дихлорметана и смешивают с 9 мл трифторуксусной кислоты в течение 2,5 часов при комнатной температуре. Получаемую смесь сгущают, два раза подают в диэтиловый эфир и еще раз сгущают. Остаток распределяют в смеси диэтилового эфира и воды (рН 10), водную фазу подкисляют и еще три раза экстрагируют. Объединенные органические фазы два раза встряхивают вместе со смесью воды и хлористого аммония, два раза с водой, один раз со смесью воды и бикарбоната натрия и один раз со смесью воды и хлористого аммония. Затем сушат над сульфатом натрия и сгущают. Выход: 2,2 г (86 % теории): Rf = 0,45 (смесь дихлорметана и метанола в соотношении 9:1). 6 35623 При этом применяют нижеследующие растворители: А = смесь дихлорметана, метанола и уксусной кислоты в соотношении 9 : 1 : 0,1; Б = смесь дихлорметана, метанола и аммиака в соотношении 9:1 : 0,1; В = смесь дихлорметана и метанола в соотношении 95 : 5. Нижеследующие примеры поясняют получение целевых продуктов вышеуказанной формулы (I). Пример № 3 4 5 6 7 8 9 10 11 12 Пример 1 и пример 2 N-[(8)-фенилглицинол]амид транс-2- {4-[(2циклопропил-бензимидазо-1H-ил)-метил]фенил}циклогексан-1-карбоновой кислоты R1 D -СН(СН3)2 -СН(СН3)2 -СН(СН3)2 -СН(СН3)2 -С2Н5 -С2Н5 -С2Н5 -С2Н5 -С6Н5 -С6Н5 N N CH CH N N CH CH CH CH Изомер dia A dia Б dia A dia Б dia A dia Б dia A dia Б dia A dia Б Rf растворитель 0,73 (Б) 0,60 (Б) 0,53 (Б) 0,41 (Б) 0,56 (Б) 0,44 (Б) 0,70 (Б) 0,60 (Б) 0,77 (В) 0,40 (В) Пример 13 Амид сложного метилового эфира транс-2-[4(2-изопропилбензимидазолил-1Н-метил)фенил]циклогексан-1-карбонил-фенилглицина * транс 0,39 г (1 ммоль) транс-2-{4-[(2-циклопропил-бензимидазо-1Н-ил)-метил]фенил}-циклогексан-1карбоновой кислоты подают в раствор 0,14 г (1 ммоль) L-фенилглицинола в 10 мл дихлорметана, охлаждают до -10°С, смешивают с 0,23 г (1,2 ммоль) гидрохлорида N'-(3-диметиламинопропил)N-этилкарбоди-имида и 0,3 мл триэтиламина и перемешивают в течение ночи при комнатной температуре. Для переработки продукт смешивают с дихлорметаном и встряхивают вместе с насыщенным водным раствором хлористого аммония, бикарбоната натрия и, после дополнительного встряхивания вместе с водой, хлористого натрия. Сушат над сульфатом натрия и сгущают. Продукт очищают путем хроматографии на силикагеле марки 60 с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20 : 1. Выход: 0,16 г (0,32 ммоль / Rf = 0,60 (Б) диа А (пример 1); 0,18 г (0,36 ммоль / Rf = 0,50 (Б) диа А (пример 2). Аналогично примерам 1 и 2 получают приведенные в табл. 1 соединения. 0,55 г (1,46 ммоль) соединения примера III растворяют в атмосфере аргона при -30°С, подают в 12 мл диметилформамида и смешивают с 0,81 мл (5,82 ммоль) триэтиламина и 0,12мл (1,6 ммоль) мезилхлорида и перемешивают в течение часа. Затем прикалывают раствор 0,35 г (1,7 ммоль) сложного метилового эфира фенилглицина, 0,18 г (1,46 ммоль) N,N-диметиламинопиридина и 0,24 мл (1,72 ммоль) триэтиламина в 10 мл диметилформамида и при перемешивании в течение ночи доводят до комнатной температуры. Потом смешивают с водой и три раза экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия и сгущают. Продукт очищают путем хроматографии на силикагеле марки 60 с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20 : 1. Выход: 0,37 г (48 % теории): Rf = 0,51 (смесь дихлорметана и метанола в соотношении 95 : 5). Пример 14 и пример 15 Амипоамид транс-2-[4-(2-изопропилбензимидазолил-1Н-метил)фенил]циклогексан-1карбонил-фенилглицина Таблица 1 7 35623 0,33 г (0,64 ммоль) соединения примера 13 растворяют в 1 мл метанола, смешивают с 4 мл насыщенного аммиаком метанола и перемешивают в течение 5 дней при комнатной температуре. Затем осадок выделяют и раствор сгущают. Остаток очищают путем хроматографии на силикагеле марки 60 с применением в качестве элюента смеси дихлорметана, метанола и аммиака в соотношении 100 : 5 : 0,3. Выход примера 14: 61 мг (19 % теории) диа А; Rf = 0,36 (смесь дихлорметана и метанола в соотношении 9:1). Выход примера 15: 35 мг(11 % теории) диа Б; Rf = 0,32 (смесь дихлорметана и метанола в соотношении 9:1). Аналогично примерам 14 и 15 получают приведенные в табл. 2 соединения. Таблица 2 Пример № D Изомер Rf растворитель 16 CH dia 0,50 (А) 17 CH dia Б 0,43 (Б) N N N CH CH CH dia A dia Б dia dia A dia Б dia 0,39 (Б) 0,35 (Б) 0,51 (Б) 0,42 (Б) 0,38 (Б) 0,85 (Б) 18 19 20 21 22 23 R1 -СН(СН3)2 -СН(СН3)2 -С2Н5 -С2Н5 -С2Н5 -С6Н5 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 8
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of phenylcyclohexylcarboxylic amide, a mixture of isomers thereof or separate isomers and salts thereof, a pharmaceutical composition with antiarteriosclerotic and antirestenosis activity
Автори англійськоюMueller-Gliemann Matthias, Mueller Ulrich, Beuck Martin, Zaiss Siegfried, Gerdes Christoph, Domdey-Bette Anke, Gruetzmann Rudi, Lohmer Stefan, Wohlfeil Stefan, Yalkinoglu Oezkan, Denzer Dirk, Elting James
Назва патенту російськоюПроизводные амида фенилциклогексилкарбоновой кислоты, смесь их изомеров или отдельные изомеры и их соли, фармацевтическая композиция с антиартериосклеротической и антирестенозной активностью
Автори російськоюМюллер-Глиманн Маттиас, Мюллер Ульрих, Бойк Мартин, Цайсс Зигфрид, Гердес Кристоф, Домдай-Бетте Анке, Грютцманн Руди, Ломер Штефан, Вольфайль Штефан, Ялкиноглу Йоцкан, Денцер Дирк, Эльтинг Джеймс
МПК / Мітки
МПК: C07D 235/16, C07D 471/04, A61K 31/4184, C07D 235/18, A61K 31/437, A61K 31/435, A61P 9/10, A61P 9/00, A61K 31/415, C07D 235/08
Мітки: композиція, кислоти, окремі, ізомерів, аміду, антирестенозною, антиартеріосклеротичною, солі, фармацевтична, активністю, фенілциклогексилкарбонової, ізомери, похідні, суміш
Код посилання
<a href="https://ua.patents.su/8-35623-pokhidni-amidu-fenilciklogeksilkarbonovo-kisloti-sumish-kh-izomeriv-chi-okremi-izomeri-i-kh-soli-farmacevtichna-kompoziciya-z-antiarteriosklerotichnoyu-i-antirestenoznoyu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Похідні аміду фенілциклогексилкарбонової кислоти, суміш їх ізомерів чи окремі ізомери і їх солі, фармацевтична композиція з антиартеріосклеротичною і антирестенозною активністю</a>
Попередній патент: Лицьова маска для немовлят
Наступний патент: Роторно-лопатевий двигун внутрішнього згоряння
Випадковий патент: Стовбуропрохідницький комплекс












