Похідні 11b-бензальдоксим-естра-4,9-дієну, спосіб їх одержання і фармацевтична композиція з антипрогестиновою активністю
Номер патенту: 39101
Опубліковано: 15.06.2001
Автори: Курішко Анатолі, ЕЛЬГЕР Вальтер, ШУБЕРТ Герд, Оеттел Міхаель, Кауфманн Гюнтер, Шобек Лотар
Формула / Реферат
1. Производные 11 b-бензальдоксим-эстра-4,9-диена общей формулы (I):
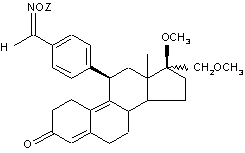 , (I)
, (I)
где Z обозначает -СО-СНз , -CO-O-C2H5, -CO-NH-фенил, -CO-NH-C2H5, -СО-С2Н5, -СНз или -СО-фенил, а также их фармацевтически приемлемые соли, обладающие антипрогестиновой активностью.
2. Соединения по п. 1, а именно:
11b -4-[ацетоксиминометил)-фенил]-17b-метокси-17a-метокси-метил-эстра-4,9-диен-3-он,
11 b -[4-{(-зтоксикарбонил)-оксиминометил}-фенил]-17b-метокси-17a--метоксиметил-эстра-4,9-диен-3-он,
11 b-[4-{(этиламинокарбонил)оксиминометил}-фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-он,
17b-метокси-17a-метоксиметил-11 b-[4-{(фениламинокарбонил)-оксиминометил}-фенил]-эстра-4,9-диен-3-он,
11 b-(4-(пропионилоксиминометил)фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-З-он,
11 b -[4-(метилоксиминометил)-фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-он и
11 b-[4-(бензоилоксиминометил)фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-З-он.
3. Способ получения соединений по п. 1 и их фармацевтически приемлемых солей, отличающийся тем, что соединение общей формулы (II):
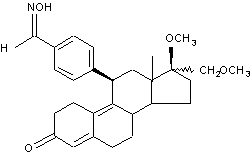 , (II)
, (II)
само по себе известным образом этерифицируют до сложного или простого эфира и, в случае необходимости, полученное соединение переводят в соль.
4. Фармацевтическая композиция, обладающая антипрогестиновой активностью, отличающаяся тем, что она содержит по меньшей мере одно соединение по любому из пп. 1- 2 в эффективном количестве в сочетании с фармацевтически приемлемыми адъювантами.
Текст
1. Производные 11 b-бензальдоксим-эстра4,9-диена общей формулы (I): 11b-[4-{(этиламинокарбонил)оксиминометил}-фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-он, 17b-метокси-17a-метоксиметил-11b-[4-{(фениламинокарбонил)-оксиминометил}-фенил]-эстра-4,9диен-3-он, 11b-(4-(пропионилоксиминометил)фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-З-он, 11b-[4-(метилоксиминометил)-фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-он и 11b-[4-(бензоилоксиминометил)фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-он. 3. Способ получения соединений по п. 1 и их фармацевтически приемлемых солей, отличающийся тем, что соединение общей формулы (II): NOZ NOH OCH3 OCH3 H CH2OCH3 (II) само по себе известным образом этерифицируют до сложного или простого эфира и, в случае необходимости, полученное соединение переводят в соль. 4. Фармацевтическая композиция, обладающая антипрогестиновой активностью, отличающаяся тем, что она содержит по меньшей мере одно соединение по любому из пп. 1,2 в эффективном количестве в сочетании с фармацевтически приемлемыми адъювантами. _______________________ Изобретение относится к новым производным 11b-бензальдоксим-эстра-4,9-диена, способу их получения и содержащим эти соединения лекарственным средствам. 11b-Замещенные фенил-эстратриены уже известны. Получение 11b-арил-17a-пропионил Зоя эстра-4,9-диенов описано уже, например, в европейском патенте 057 115; взаимодействие 11b-(4формилфенил)-эстра-4,9-диен-3-онов с гидроксиламинами уже описано в патенте ФРГ 3 504 421. В указанном способе оксимируется как 11b-формилфенильная группа, так и также 3-кето-группа. Кро (11) где Z обозначает -СО-СНз , -CO-O-C2H5, -CO-NHфенил, -CO-NH-C2H5, -СО-С2Н5, -СНз или -СО-фенил, а также их фармацевтически приемлемые соли, обладающие антипрогестиновой активностью. 2. Соединения по п. 1, а именно: 11b-4-[(ацетоксиминометил)-фенил]-17b-метокси17a-метоксиметил-эстра-4,9-диен-3-он, 11b-[4-{(-этоксикарбонил)-оксиминометил}-фенил]17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-он, O UA (I) (19) O 39101 (13) CH2OCH3 C2 H 39101 ме того, в положении С-3 образуются син- и антиизомеры. О действии описанных соединений до сих пор ничего неизвестно. Прогестерон в больших количествах выделяется яичником и плацентой во время цикла и при беременности. Его регулирующее значение предположительно выяснено не во всех аспектах. Гарантировано, что прогестерон при взаимодействии с эстрогенами вызывает циклические изменения слизистой оболочки матки в менструальном цикле и при беременности. Под влиянием повышенного уровня прогестерона после овуляции слизистая оболочка матки переводится в состояние, которое допускает имплантацию эмбриона (бластоцисты). Сохранение тканей, в которых "расширяется" растущий эмбрион, также зависит от прогестерона. При беременности происходит "драматическое" изменение мышечной функции матки. Мышца матки при беременности реагирует очень ослабленно или вовсе не реагирует на гормональные и механические раздражения, которые вне беременности вызывают боли. Нет никакого сомнения в том, что при этом прогестерон играет ключевую роль, хотя в некоторых фазах беременности, например, непосредственно перед родами, существует высокая реакционная готовность при крайне высоком уровне в крови прогестерона. Другие типичные процессы беременности также связаны с очень высоким уровнем прогестерона. Примерами этого являются строение молочных желез и прочная обтурация маточного зева вплоть до момента вблизи срока родов. Прогестерон субтильным образом принимает участие в управлении процессами овуляции. Известно, что прогестерон в высоких дозах обладает антиовулирующими свойствами. Они вытекают из подавления гипофизной секреции гонадотропина, предпосылки для созревания фолликула и его овуляции. С другой стороны, известно, что сравнительно назначительное выделение прогестерона созревающим фолликулом играет активную роль для подготовки и вызова овуляции. При этом гипофизные механизмы (по времени ограничения, так называемая "позитивная обратная связь" прогестерона с секрецией гонадотропина) играют, как известно, важную роль (Loutradie D; Humаn Reproduction 6, 1991, 1238–1240). Менее хорошо проанализированы функции прогестерона в созревающем фолликуле и в самом желтом теле, в существовании которых нет никакого сомнения. В конечном счете здесь также нужно предполагать стимулирующие и подавляющие воздействия на эндокринную функцию фолликула и желтого тела. Также нужно предполагать значительную роль прогестерона и рецепторов прогестерона в патофизиологических процессах. Рецепторы прогестерона обнаружены в очагах эндометриоза, однако, также в опухолях матки, молочной железы и Ц.Н.С. /менингеома/. Роль этих рецепторов в отношении роста этих патологически "уместных" тканей по необходимости не связана с наличием уровня прогестерона в крови. Оказалось, что вещества, которые характеризуются как антагонисты прогестерона, RU 486 = Мифепристон (европейский патент 0 057 115) и ZK 98299 = Онапристон (выложенное описание изобретения к неакцептованной заявке на патент ФРГ 35 04 421), в этих тканях вызывают глубокие функциональные изменения также тогда, когда в крови имеется незначительный, которым можно пренебречь, уровень прогестерона. Возможно, что при этом изменения транскрипционных действий занятого не прогестероном рецептора прогестерона благодаря антагонистам играют важную роль (Chwalisz K. и др., Endocrinology, 129, 317–322, 1991). Действия прогестерона в тканях генитальных органов и других тканях осуществляется за счет взаимодействия с рецептором прогестерона. В клетке прогестерон с высоким сродством связывается со своим рецептором. Таким образом вызываются изменения рецепторного протеина: конформационные изменения; димеризация 2-х рецепторных единиц в комплекс; обнажение участков ДНК-связывания рецептора за счет удаления вследствие диссоциации протеина (HSP 90); связывание гормонально-ответственных элементов ДНК. Наконец, регулируется транскрипция определенных генов (Gronemeyer H. и др., J. Steroid. Biochem. Molec. Biol. 41, 3–8, 1992). Действие прогестерона или антагонистов прогестерона зависит не только от их концентрации в крови. Концентрация рецепторов в клетке также сильно регулирована. Эстрогены стимулируют синтез рецепторов прогестерона в большинстве тканей. Прогестерон подавляет синтез рецепторов эстрогена и синтез своего собственного рецептора. Вероятно, имеются эти и другие интерактивные [interaktive] отношения между эстрогенами и гестагенами, которые могут объяснить, почему гестагены и антигестагены могут влиять на зависящие от эстрогена процессы без их связывания с рецептором эстрогена. Эти отношения, естественно, имеют большое значение для терапевтического применения антигестагенов. Эти вещества являются пригодными для целевого участия в процессах воспроизводства у женщины, например, после овуляции, чтобы препятствовать нидации, при более поздней беременности, чтобы повысить реакционную готовность матки для простагландинов и окситоцина или чтобы достигать раскрытия и размягчения ("созревания") шейки. Антигестагены у различных высших видов приматов подавляют овуляцию. Механизм этого действия четко невыяснен. Наряду с подавлением секреции гонадотропина дискутируются также овариальные механизмы за счет нарушения пара- и аутокринных функций прогестерона в яичнике. Антигестагены обладают способностью модулировать или ослаблять действия эстрогенов, хотя они сами преобладающе не имеют никакого сродства к рецептору эстрогена в цитоплазматической области и хотя они могут вызывать увеличение концентрации рецептора эстрогена. От соответствующих эффектов, в эндометриозных очагах, соответственно, в опухолевых тканях, которые снабжены рецепторами эстрогена и прогестерона, можно ожидать благоприятного влияния на болезненные состояния. Особые преимущества для благоприятного влияния на болезненные состояния, как эндометриоз, могут быть тогда, когда к подавляющим эффектам антигестагена благодаря 2 39101 действию в ткани добавилось бы подавление овуляции. С подавлением овуляции также отпала бы часть овариального продуцирования гормонов и таким образом отпадающей с этой частью стимулирующий эффект в отношении патологически измененной ткани. Было бы желательно при наличии тяжелого эндометриоза подавлять овуляцию и находящуюся обычно постоянно в перестройке ткань генитального тракта обратимо приводить в спокойное состояние. Также для контрацепции дискутируется способ, при котором обработка антигестагеном подавляет овуляцию, и благодаря последующей обработке гестагеном индуцируется секреторная трансформация эндометрия, так, что из дней обработки с помощью антигестагенов и гестагенов и дней, в которые обработка не производится, вытекает примерно 28-дневный цикл с регулярными кровотечениями [Baulicu E.E. Advances in Contraception, 7, 345–51, 1991]. Антигестагены могут обладать различными гормональными и антигормональными свойствами. Особенно терапевтически уместны при этом антиглюкокортикоидные свойства. Для терапевтических применений, при которых задачей терапии является подавление рецепторов прогестерона, они отрицательны, так как при терапевтических необходимых дозировках они вызывают нежелательные побочные действия, препятствуют введению терапевтически рациональной дозы или могут приводить к вреду лечения. Частичное или полное уменьшение антиглюкокортикоидных свойств представляет собой важную предпосылку для терапии с помощью антигестагенов, в особенности для тех показаний, которые требуют длящегося в течение недель или месяцев лечения (обработки). Задачей настоящего изобретения является получение новых производных 11b-бензальдоксим-эстра-4,9-диента общей формулы (I): Z обозначает -CO-CH3; -CO-O-C2H5; -CO-NH-фенил; -CO-NH-C2H5; -CO-C2H5; -CH3 или -CO-фенил. Предпочтительными, предлагаемыми согласно изобретению, соединениями являются: 11b-[4-(ацетоксиминометил)-фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-он; 11b-[4-({- этоксикарбонил)- оксиминометил}-фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-он; 11b-[4-{(этиламинокарбонил)оксиминометил}фенил]-17b-метокси-17a-метоксиметил-эстра4,9-диен-3-он; 17b-метокси-17a-метоксиметил-11b-[4-{(фениламинокарбонил)-оксиминометил)-фенил]-эстра-4,9-диен-3-он; 11b-[4-(пропионилоксиминометил)фенил]17b-метокси-17a-метоксиметил-эстра-4,9-диен-3он; 11b-[4-(метилоксиминометил)-фенил]-17bметокси-17a -метоксиметил-эстра-4,9-диен-3-он; и 11b-[4-(бензоилоксиминометил)-фенил]-17bметокси-17a-метоксиметил-эстра-4,9-диен-3-он. Изобретение, далее, относится к способу получения соединений общей формулы (I) и их фармацевтически приемлемых солей, который отличается тем, что соединение общей формулы (II): (II) этерифицируют до простого или сложного эфира и в случае необходимости полученное соединение переводят в соль. Получение соединений общей формулы (I) путем этерификации до сложного эфира, этерификации до простого эфира или образования уретана можно осуществлять само по себе известным образом с помощью ацилирующих средств, как ангидриды кислот или хлорангидриды кислот, в присутствии оснований, предпочтительно пиридина; этерификацию до получения простого эфира можно осуществлять с помощью метилиодида в присутствии оснований, предпочтительно трет.-бутилата калия или с помощью диазометана в метаноле; образование уретана можно осуществлять путем реакции с алкил- или арилизоцианатами в инертных растворителях, предпочтительно в толуоле, или путем реакции с карбамоилхлоридами в присутствии оснований, предпочтительно триэтиламина. (I) и их фармацевтически приемлемых солей, а также разработка способа их получения. Другой задачей является получение лекарственных средств, которые содержат соединение общей формулы (I) или его фармацевтически приемлемую соль. В общей формуле (I): Получение исходного соединения общей формулы (II) осуществляют исходя из 5a,10aэпоксида формулы (III): (I) 3 39101 ацетоне [Teutsch и др., патент ФРГ 2801416], расщеплять до соответствующих альдегидов, либо путем этерификации до простых эфиров свободных гидроксильных групп с помощью алкилгалогенидов в присутствии трет.-бутилата калия сначала переводить в простые 5a,17b-диэфиры [Kasch и др., патент ГДP 290 893], которые затем путем кислотного гидролиза, предпочтительно, с помощью п-толуолсульфокислоты в ацетоне, превращать в соответствующие альдегиды, после чего затем таким образом полученные альдегиды путем взаимодействия с гидроксиламином переводят в соединения общей формулы (II). В случае необходимости, полученное согласно изобретению соединение общей формулы (I) переводят в соль присоединения кислоты, предпочтительно в соль физиологически приемлемой кислоты. Обычными, физиологически приемлемыми, неорганическими и органическими кислотами являются, например, соляная кислота, бромоводородная кислота, фосфорная кислота, серная кислота, щавелевая кислота, малеиновая кислота, фумаровая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, салициловая кислота, адипиновая кислота и бензойная кислота. Другие применимые кислоты описаны, например, в Fortschritte der Arzneimittelferschung т. 10, с. 224–225, Birkhäuser Verlug, Basel и Stuttgart 1966, и в Journal of Pharmaceutical Sciences т.66, с. 1–5 (1977). Соли присоединения кислот, как правило, получают само по себе известным образом путем смещения свободного основания или его растворов с соответствующей кислотой или ее растворами в органическом растворителе, например, в низшем спирте, как метанол, этанол, н-пропанол или изопропанол; или в низшем кетоне, как ацетон, метил-этилкетон или метил-изобутилкетон; или в простом эфире, как диэтиловый эфир, тетрагидрофуран или диоксан. Для лучшего отделения кристаллов можно применить также смеси указанных растворителей. Сверх того, можно приготовлять физиологически приемлемые водные растворы солей присоединения кислот соединения формулы (I) в водном кислом растворе. Соли присоединения кислот соединений общей формулы (I) само по себе известным образом, например, с помощью щелочной или ионообменников, можно переводить в свободные основания. Из свободных оснований, путем введения во взаимодействие с неорганическими или органическими кислотами, в особенности с такими, которые пригодны для получения терапевтически применимых солей, можно получать другие соли. Эти или также другие соли нового соединения, как, например, пикрат, могут служить также для очистки свободных оснований, тем, что свободное основание переводят в соль, ее отделяют и из соли снова высвобождают основание. Предметом настоящего изобретения также являются лекарственные средства для орального, ректального, подкожного, внутривенного или внутримышечного введения, которые наряду с обычными носителями и разбавителями содержат соединение общей формулы (I) или его соль присоединения кислоты в качестве биологически активного вещества. (III) [см., например, Nédélu, Bull. Soc. Chim. France (1970), 2548]. Введение фенильного остатка в 11b-положение с образованием D9/10/,5a-гидрокси-структуры формулы (IV) достигают за счет катализируемой солью меди-/1/ реакции Гриньяра [Tetrahedron Letters, 1979, 2051] с п-бромбензальдегидкеталем, предпочтительно п-бромбензальдегиддиметилкеталем, при температурах 0–30оС. (IV) Введение группировки -CH2-O-CH3 в 17-положение осуществляют само по себе известным путем через спиро-эпоксид формулы (V) благодаря взаимодействию с триметилсульфонийиодидом и трет.-бутилатом калия в диметилсульфоксиде [Hübner и др. J. prakt. Chem. 314, 667 (1972); Arzneim, Forsch. 30, 401/1973] (V) и последующему раскрытию цикла с помощью алкоголятов – [Ponsold и др., Z. Chem., 11, 106/1971]. Образующиеся при этом 17a-СН2-О-СН3-соединения формулы (VI): (VI) можно либо путем кислотного гидролиза, предпочтительно с помощью п-толуолсульфокислоты в 4 39101 Лекарственные средства изобретения готовят известным образом с помощью обычных, твердых или жидких носителей или разбавителей и обычно применяемых в фармацевтической технологии вспомогательных веществ, соответственно желательному роду введения, с пригодной дозировкой. Предпочтительные композиции находятся в форме введения, которая пригодна для орального применения. Такими формами введения являются, например, таблетки, таблетки в оболочке, драже, капсулы, пилюли, порошки, растворы или суспензии или пролонгированные формы. Само собой разумеется, принимают во внимание также парентеральные композиции, как растворы для инъекций. Далее, в качестве композиций следует также назвать, например, свечи. Соответствующие таблетки можно получать, например, путем смещения биологически активного вещества с известными вспомогательными веществами, например, инертными разбавителями, как декстроза, сахар, сорбит, маннит, поливинилпирролидон; наполнителями, как кукурузный крахмал или альгиновая кислота; связующими, как крахмал или желатина; смазками, как стеарат магния или тальк; и/или со средствами для достижения пролонгированного эффекта, как карбоксиполиметилен, карбоксиметилцеллюлоза, ацетатфталат целлюлозы или поливинилацетат. Таблетки также могут состоять из нескольких слоев. Соответственно, можно приготовлять драже путем покрытия полученных аналогично таблеткам ядер (сердцевин) с помощью обычно применяемых для покрытия драже средств, например, как поливинилпирролидон или щеллак, гуммиарабик, тальк, диоксид титана или сахар. При этом также оболочка драже может состоять из нескольких слоев, причем можно применять вышеупомянутые в случае таблеток вспомогательные вещества. Растворы или суспензии с предлагаемым согласно изобретению биологически активным веществом дополнительно могут содержать улучшающие вкус средства, как сахарин, цикламат или сахар, а также например, ароматизирующие вещества, как ванилин или апельсиновый экстракт. Кроме того, они могут содержать вспомогательные для суспендирования вещества, как натрийкарбоксиметилцеллюлоза, или консерванты, как пгидрокси-бензоат. Содержащие биологически активные вещества капсулы можно приготовлять, например, тем, что биологически активное вещество смешивают вместе с инертным носителем, как молочный сахар или сорбит, и инкапсулируют в желатиновые капсулы. Пригодные свечи можно приготовлять, например, путем смешения с предусмотренными для этой цели носителями, как нейтральные жиры или полиэтиленгликоль, соответственно, их производные. Предлагаемые согласно изобретению 11bзамещенные бензальдоксим-эстра-4,9-диены являются антигестагенно действующими веществами, которые при превосходящем действии ин виво (см. таблицу 2) обладают отчетливо пониженной, по сравнению с RU 486, антиглюкокортикоидной активностью, обнаруживаемой по уменьшенному связыванию глюкокортикоид-рецептор (см. таблицу 1). Эта комбинация свойств позволяет ожидать от предлагаемых согласно изобретению антигестагенов превосходного ингибирования прогестерона, при одновременно пониженной антиглюкокортикоидной активности. Это преимущество особенно уместно в отношении показаний, которые из-за длительности применения требуют особенно хорошей приемлемости. В цикле вес матки решающе определяется циркулирующими эстрогенами. Уменьшенные веса матки показывают подавление этой функции эстрогенов. Установленное, превосходящее RU 486, подавление веса матки в цикле морской свинки является указанием [косвенным] на антиэстрогенные свойства предлагаемых согласно изобретению соединений. От соответствующих эффектов нужно ожидать особенно благоприятного влияния на патологически измененные ткани, в которых эстрогены способствуют импульсам роста [очаги эндометриозы, миомы, генитальные карциномы и карциномы молочной железы, доброкачественная гипертрофия простаты]. Следующие примеры поясняют изобретение: Примеры Пример 1 180 мг 11b-[4-/Гидроксиминометил/-фенил]17b-метокси-17a-метоксиметил-эстра-4,9-диен-3она ацетилируют в 5 мл смеси ацетангидрида с пиридином (1:1). После добавки воды, трижды экстрагируют этилацетатом, органическую фазу промывают разбавленной соляной кислотой и водой, сушат над сульфатом натрия и концентрируют при пониженном давлении. Получают 172 мг сырого продукта, который очищают путем препаративной тонкослойной хроматографии на силикагеле PF245+366, элюируя смесью растворителей толуол/ацетон в отношении 4:1. Получают 115 мг 11b-[4-/ацетоксиминометил/-фенил]-17b-метокси-17a-метоксиметил-эстра4,9-диен-3-она. Продукт кристаллизуют из этилацетата. Т.пл. = 115–120оС [этилацетат]. /a/D = + 218о (CHCl3); ИК-cпектр в KBr/см-1: 1754 (OAc); 1654 (C=C–C=C–C=O); 1602 (фенил). УФ-спектр в метаноле; lmax= 271 нм, e= 28 157; lmax = 297 нм, e= 26 369 1 Н-ЯМР-спектр в CDCl3 /d м.д./: 0,511/c., 3H, H-18/; 2,227/c., 3H, OCOCH3/; 3,247/c., 3H, 17bOCH3/; 3,408/c.,3H, 17a-CH2OCH3/; 3,386, 3,431, 3,544, 3,580 /м., 2Н, СН2ОСН3/; 4,399 /д., 1H, J = =7,2 гц, Н-11a/; 5,785/c., 1H, H-4/; 7,242, 7,266, 7,618, 7,647 /м., 4Н, АА'BB'-система ароматических протонов/; /8,315/c., 1H, CH-NOAc/. Масс-спектр: m/e = 446; C28H32NO4M+ – CH2OCH3+ Пример 2 К 210 г 11b-[4-/Гидроксиминометил/-фенил]17b-метокси-17a-метоксиметил-эстра-4,9-диен-3она в 5 мл пиридина прикапывают 0,3 мл этилхлорформиата при охлаждении водой. Образуется белый осадок. Спустя 30 минут смешивают с водой; образуется раствор, затем выпадает белого цвета осадок, который отсасывают и промывают водой. Выход после высушивания составляет 133 5 39101 мг. Водную фазу экстрагируют хлороформом, промывают разбавленной соляной кислотой и водой, высушивают и концентрируют при пониженном давлении. Выход = 66 мг. Оба твердых вещества объединяют и очищают путем препаративной хроматографии на силикагеле PF245+366, элюируя смесью растворителей толуол/ацетон = 4:1. Получают 150 мг 11b-[4-/этоксикарбонилоксиминометил/-фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-она, который перекристаллизуют из смеси ацетона с гексаном. Т. пл. = 137– 148оС. /a/D= + 204о (СНСl3). УФ-спектр в метаноле: lmax = 270 нм e = 27 094; lmax =297 нм; e = 25 604 1 Н-ЯМР-спектр в CDCl3 / d м.д./: 0,507/c., 3H, H-18/; 1,383/т., 3H, J = 7,0 гц, OCH2CH3/; 3,246 /c., 3H, 17b-OCH3/; 3,410/c., 3H, 17a-CH2OCH3/; 3,39– 3,56 /м., 2Н, СН2ОСН3/; 4,35/д., 1H, J = 7,0 гц, H11a /; 5,784/c., 1H, H-4/; 7,23, 7,26, 7,61, 7,64/м., 4H, AA'BB'-система ароматических протонов/; 8,303/c., 1H, CH=NP/. Масс-спектр: m/e: 431,24701; C28H33NO3M+ – C2H5OCOOH Пример 3 190 мг 11b-[4-/Гидроксиминометил/-фенил]17b-метокси-17a-метоксиметил-эстра-4,9-диен-3она суспендируют в 10 мл толуола. Последовательно добавляют 0,5 мл фенилизоцианата и 1 мл триэтиламина. Перемешивают 3 часа при комнатной температуре, кипятят с обратным холодильником в течение 2-х часов, отсасывают белого цвета осадок и растворитель концентрируют при пониженном давлении. Получают 310 мг светлокоричневого твердого вещества, которое очищают путем препаративной тонкослойной хроматографии на силикагеле PF245+366, элюируя смесью растворителей толуол-ацетон = 9:1. Выделяют 65 мг 17bметокси-17a-метоксиметил-11b-[4-{/фениламинокарбонил/-оксиминометил}-фенил]-эстра-4,9-диен3-она. Т.пл. = 241–246оС [ацетон]. /a/D= + 178oC /CHCl3/. УФ-спектр в метаноле: lmax = 238 нм; e = 29 444; lmax = 300 нм; e = 29 649 1 Н-ЯМР-спектр в СDCl3 / dм.д./: 0,474/c., 3H, H-18/; 3,245/c., 3H, 17b-OCH3/; 3,405/c., 3H, 17aCH2OCH3/; 3,406–3,545/м., 2H, АВХ-система, 17aСН2ОСН3/; 4,413/д., 1H, J = 6,8 гц, H-11a/; 5,797/c., 1H, H-4/; 7,264 /м., 5H, ароматические/; 7,272, 7,293, 7,548, 7,575 /м., 4H, AA'BB'-система ароматических протонов/; 8,0/c., 1H, CH–N-/. Масс-спектр: m/e: 431,24249; C23H33NO3M+ C6H5CNO + H2O Пример 4 708 мг 11b-[4-/Гидроксиминометил/-фенил]17b-метокси-17a-метоксиметил-эстра-4,9-диен-3она растворяют в 15 мл толуола. Последовательно добавляют 1,5 мл этилизоцианата и 3 мл триэтиламина. Перемешивают 6 часов при комнатной температуре, оставляют стоять в течение ночи, добавляют 20 мл водного раствора аммиака, фазы разделяют, дополнительно экстрагируют толуолом, промывают водой, водным раствором хлорида аммония и водой, сушат над сульфатом натрия и концентрируют по пониженном давлении. Получают 800 мг светложелтого твердого вещест ва, которое очищают путем препаративной хроматографии на силикагеле 60 PF254+366, элюируя смесью растворителей толуол/ацетон = 9:1. Выделяют 610 мг 11b-[4-{/этиламинокарбонил/-оксиминометил}-фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-она. Т.пл. = 142–147оС; разложение на свету [эфир/ацетон/гексан]. 1 Н-ЯМР-спектр в СDCl3 /dм.д./: 0,522/c., 3H, H-18/; 1,241.т., 3H, J = 7,5 гц, NHCH2CH3/; 3,253/c., 3H, 17b-OCH3/; 3,415 /c., 3H, 17a-CH2OCH3/; 3,3663,574 /м., 4H, АВХ-система, 17a-CH2OCH3/; 4.410 /д., 1H, J = 7,2 гц, Р,11a/; 5,790 /c., 1H, H-4/; 6,238 /м., 1H, NHCO/; 7,258, 7, 286, 7,561, 7,589 /м., 4H, AA'BB'-система ароматических протонов/; 8, 294 /м., 1H, CH = N-/. Пример 5. 500 мг 11b-[4-/Гидроксиминометил/-фенил]17b-метокси-17a-метоксиметил-эстра-4,9-диен-3она в 4 мл смеси пропионового ангидрида с пиридином в соотношении 1:1 (по объему) перемешивают в течение 2,5 часов в атмосфере защитного газа. Выливают в воду со льдом, клейкую массу экстрагируют хлороформом, органическую фазу промывают разбавленной соляной кислотой и водой, сушат над сульфатом натрия и концентрируют при пониженном давлении. Светложелтую пену очищают путем хроматографии и перекристаллизуют из этилацетата. Выход = 306 мг 11b-[4/пропионилоксиминометил/-фенил]-17b-метокси17a-метоксиметил-эстра-4,9-диен-3-она. Т. пл.110–114оС [этилацетат]. 1 Н-ЯМР-спектр в СDCl3 /d м.д./: 0,515/c., 3H, H-18/; 1,241/т., 3H, J = 7,6 гц, OCOCH2CH3/; 3,253/c., 3H, 17b-OCH3/; 3,415 /c., 3H, 17aCH2OCH3/; 3,4-3,6 /м., 2H, АВХ-система, 17aCH2OCH3/; 4,128 /д., 1H, J = 7,2 гц, H-11a/; 5,790 /c., 1H, 4-/; 7,244, 7,271, 7,627, 7,655 /м., 4H, AA'BB'-система ароматических протонов/; 8,322 /c., 1H, CH = N-/. Пример 6 К 170 мг 17b-[4-/Гидроксиминометил/-фенил]-17b-метокси-17a-метоксиметил-эстра-4,9диен-3-она в 5 мл метанола при охлаждении льдом добавляют эфирный раствор диазометана вплоть до слабого желтого окрашивания. Перемешивают 2 часа при 5оС, добавляют разбавленный раствор гидроксида натрия, экстрагируют эфиром, промывают до нейтральной реакции, сушат над сульфатом натрия и органическую фазу выпаривают при пониженном давлении. Желтого цвета смолу очищают путем препаративной тонкослойной хроматографии на силикагеле 60 PF254+366, элюируя смесью растворителей толуол/ацетон (4:1). Получают 110 мг 11b-[4-/метоксиминометил/-фенил]-17b-метокси-17a-метоксиметил-эстра4,9-диен-3-она в виде бесцветных листочков. Т.пл. 83-89оС. /a/D= + 197о (CHCl3). ИК-спектр в CHCl3 (см-1): 1700 (С=NOCH3); 1649 /С=С–С=С–С=O/; 1590 (ароматические). УФ-спектр в метаноле: lmax = 275 нм;, e = 23 098; lmax = 300 нм, e = 22 872 1 Н-ЯМР-спектр в СDCl3 /d м.д./: 0,529/c., 3H, H-18/; 3,247/с., 3H, 17b-ОCH3/; 3,408/c., 3H, 17aСH2OCH3/; 3,39-3,598 /м., 2H, АВХ-система, 17a 6 39101 Измерение сродства связывания с рецепто CH2OCH3/; 34,381 /д., 1H, J = 7,5 гц, H-11a/; 5,773 /c., 1H, H-4/; 7,173, 7,201, 7,463, 7,491, /м., 4H, AA'BB'-система ароматических протонов/; 8,023 /c., 1H, CH-фенил/. Пример 7. К 500 мг 11b-[4-/гидроксиминометил/фенил]-17b-метокси-17a-метоксиметил-эстра-4,9диен-3-она добавляют отфильтрованную смесь из 2 мл бензоилхлорида и 3 мл пиридина. Спустя 2 часа примешивают в 150 мл воды со льдом. Стероид осаждается в виде клейкой массы. Добавляют 5 мл разбавленной соляной кислоты, обрабатывают этилацетатом, фазы разделяют, органическую фазу промывают водным раствором бикарбоната и водой, сушат над сульфатом натрия, отфильтровывают и выпаривают при пониженном давлении. Желтое масло [-1,57 г] путем хроматографии на 40 г силикагеля 60 с помощью градиента толуол/этил-ацетат освобождают от неполярных продуктов, основную фракцию /0,7 г/ очищают путем препаративной тонкослойной хроматографии на силикагеле 60 PF254+366, элюируя смесью хлороформ-ацетон. Получают 410 мг вещества в виде бесцветной пены, которую перекристаллизуют из метанола. Получают 263 мг 11b-[4-/бензоилоксиминометил/-фенил]-17b-метокси-17a-метоксиметил-эстра-4,9-диен-3-она в виде бесцветных кристаллов. Т.пл. = 115–122оС /метанол/. /a/D= + 216o (CHCl3). УФ-спектр в метаноле lmax = 279 нм, e= 33 720; lmax = 299 нм, e= 30 120 1 Н-ЯМР-спектр в CDCl3 /d м.д./: 0,527 /c., 3H, H-18/; 3,253 /c., 3H, 17b-OCH3/; 3,415 /c., 3H, 17aCH2OCH3/; 3,403–3,589 /м., 2H, АВХ-система, 17aCH2OCH3/; 4,416 /д., 1H, J = 7,2 гц, Н–11a/; 5,792 /c., 1H, H-4/; 7,299–7,615 /м., 5H, ароматические протоны, СО-фенил/; 7,701, 7,729, 8,111, 8,140 /м., 4Н, АА'BB'-система, ароматические протоны/; 8,520 /c., 1H, CH-фенил/. Пример 8. ром. Сродство связывания с рецептором определяют путем конкурентного связывания специфически связывающегося 3Н-маркированного гормона [меченое вещество] и испытуемого соединения с рецепторами в цитозоле из животных органовмишеней. При этом стремятся к насыщению рецептора и реакционному равновесию. Выбирают следующие условия инкубации: Глюкокортикоид-рецептор: тимус-цитозоль крысы с удаленным надпочечником; тимус хранится при -30оС; буфер: ТЕD. Меченое вещество: 3НДексаметазон, 20 нМ; стандартное вещество: Дексаметазон. После продолжительности инкубации 18 часов при 0–4оС, осуществляют разделение связанного и свободного стероида путем примешивания активного угля с декстраном [1%/0,1%], центрифугирование и измерение связанной 3Н – активности в надосадочной жидкости. Из измерений в ряду концентраций определяют 1С50 для испытуемого соединения и для стандартного вещества и в виде частного обоих значений /x 100%/ получают относительное молярное сродство к связыванию. Пример 9. Подавление ранней беременности у крысы: Самки крысы совокупляются в Proоеs truus. При обнаружении спермы в вагинальном мазке на ближайший день этот день считают как день 1 /=д.1/ беременности. Обработку испытуемым веществом или индиффурентной основой лекарственного средства осуществляют в дни 5–7, аутопсию осуществляют в день 9. Вещества инъекцируют в 0,2 мл эксципиента [бензилбензоат/касторовое масло = 1 + 4] подкожно. Количество полностью подавленных беременностей в различных группах видно из таблицы 1. Для J 917 и J 900 установлено превосходящее R.U. 486 подавление нидации. Таблица 1 Рецепторное связывание выбранных, указанных в примерах 1 и 2, веществ Соединение согласно примеру Относительное молярное сродство к связыванию (RBA) (%) в глюкокортикоид-рецептор (Дексаметазон = 100%) 1 /J 914/ 73 2 /J 900/ 66 для сравнения: RU 486 (Мифепристон) 685 ZK 98299 (Онапристон) 39 7 39101 Таблица 2 Ранее абортивное действие RU 486 и J 914 [пример 1] и J 900 [пример 2] в случае крысы после подкожного введения на 5-й – 7-й день беременности [введение 0,2 мл на животное в день в смеси бензилбензоата с касторовым маслом /1 + 4 по объему/] Группа, вещества Доза [мг/животное/день] Полное подавление беременности N /N + Индифферентная основа лекарственного препарата RU 486 J 900 J 914 + 0/20 0 3,0 1,0 0,3 1,0 0,3 3,0 1,0 0,3 0,1 5/5 2/5 0/5 9/10 0/5 5/5 7/10 1/5 0/6 ++ ЭД50 {мг/животное/день} % – + 100 40 0 90 0 100 70 20 0 = пустая матка; N = число оплодотворенных самок; N* = число небеременных самок; = графическое определение. ++ Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 8 – 1,1 0,6 0,6
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 11b-benzaldoxym-extra-4,9-dien, method for the preparation thereof and pharmaceutical composition with antiprogestin activity
Автори англійськоюSchubert Gerd, Kaufmann Gunter, Schobeck Lothar, Oettel Michael, Elger Walter, Kurishko Anatloly
Автори російськоюШуберт Герд, Кауфманн Гюнтер, Шобек Лотар, Оэттел Михаэль, Элгер Валтер, Куришко Анатоли
МПК / Мітки
МПК: A61K 31/565, C07J 41/00, A61P 13/02, A61P 15/00, C07J 75/00, A61P 35/00
Мітки: фармацевтична, композиція, одержання, 11b-бензальдоксим-естра-4,9-дієну, активністю, антипрогестиновою, спосіб, похідні
Код посилання
<a href="https://ua.patents.su/8-39101-pokhidni-11b-benzaldoksim-estra-49-diehnu-sposib-kh-oderzhannya-i-farmacevtichna-kompoziciya-z-antiprogestinovoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Похідні 11b-бензальдоксим-естра-4,9-дієну, спосіб їх одержання і фармацевтична композиція з антипрогестиновою активністю</a>
Попередній патент: Спосіб подрібнення гірських порід в навалі
Наступний патент: Шахтна вентиляційна система
Випадковий патент: Пристрій захисту батареї статичних конденсаторів з ізольованою нейтраллю від внутрішніх пошкоджень та перевантаження