Нуклеїнові кислоти-ліганди до тенасцину-с
Номер патенту: 75578
Опубліковано: 15.05.2006
Автори: Парма Девід, Уоррен Стефен, Хіке Брайен, Голд Ларрі
Формула / Реферат
l. Нуклеїнова кислота-ліганд до тенасцину-С, виявлена за допомогою способу, який передбачає:
а) приведення в контакт перспективної суміші нуклеїнових кислот із тенасцином-С, при цьому нуклеїнові кислоти, які мають підвищену афінність до тенасцину-С у порівнянні з іншими перспективними кислотами в суміші, можуть бути відділені від інших представників перспективної суміші;
б) відділення нуклеїнових кислот з підвищеною афінністю від інших представників перспективної суміші;
в) ампліфікацію нуклеїнових кислот з підвищеною афінністю з одержанням суміші нуклеїнових кислот з відносно високою афінністю і специфічністю щодо зв'язування з тенасцином-С, за допомогою чого можна виявляти.нуклеїнові кислоти-ліганди тенасцину-С.
2. Нуклеїнова кислота-ліганд за п. 1, де перспективна суміш нуклеїнових кислот складається з одноланцюгових нуклеїнових кислот.
3. Нуклеїнова кислота-ліганд за п. 2, де одноланцюгові нуклеїнові кислоти являють собою рибонуклеїнові кислоти.
4. Нуклеїнова кислота-ліганд за п. 3, де перспективна суміш нуклеїнових кислот складається з 2'-F-(2'-фтор)-модифікованих рибонуклеїнових кислот.
5. Очищена і виділена нуклеїнова кислота-ліганд до тенасцину-С, яка не зустрічається в природних умовах.
6. Очищена і виділена нуклеїнова кислота-ліганд до тенасцину-С, яка не зустрічається в природних умовах за п. 5, де ця нуклеїнова кислота-ліганд є одноланцюговою.
7. Очищена і виділена нуклеїнова кислота-ліганд, яка не зустрічається в природних умовах за п. 6, де ця нуклеїнова кислота-ліганд являє собою РНК.
8. Очищена і виділена РНК-ліганд, яка не зустрічається в природних умовах за п. 7, де цей ліганд являє собою 2'-фтор-(2'-F)-модифіковані нуклеотиди.
9. Очищена нуклеїнова РНК-ліганд, яка не зустрічається в природних умовах за п. 8, де цей ліганд вибирають із групи, яка включає послідовності, наведені в таблицях 3 і 4 та на фіг. 2.
10. Спосіб ідентифікації нуклеїнових кислот-лігандів до тенасцину-С, який передбачає:
а) приведення в контакт перспективної суміші нуклеїнових кислот із тенасцином-С, при цьому нуклеїнові кислоти, які мають підвищену афінність до тенасцину-С у порівнянні з іншими перспективними кислотами в суміші, можуть бути відділені від інших представників перспективної суміші;
б) відділення нуклеїнових кислот з підвищеною афінністю від інших представників перспективної суміші;
в) ампліфікацію нуклеїнових кислот з підвищеною афінністю з одержанням суміші нуклеїнових кислот, які мають відносно високу афінність і специфічність щодо зв'язування з тенасцином-С, за допомогою чого можна виявляти нуклеїнові кислоти-ліганди тенасцину-С.
11. Спосіб за п. 10, який додатково передбачає:
г) повторення стадій а), б) і в).
12. Спосіб за п. 10, де перспективна суміш нуклеїнових кислот складається з одноланцюгових нуклеїнових кислот.
13. Спосіб п. 12, де одноланцюгові нуклеїнові кислоти являють собою рибонуклеїнові кислоти.
14. Спосіб за п. 13, де нуклеїнові кислоти являють собою 2'-F-(2'-фтор)-модифіковані рибонуклеїнові кислоти.
15. Комплекс, який застосовують для діагностики in vivo захворювань, асоційованих з експресією тенасцину-С, який включає нуклеїнову кислоту-ліганд тенасцину-С за будь-яким з пунктів 4-9 і маркер.
16. Комплекс за п. 15, у якому нуклеїнову кислоту-ліганд до тенасцину-С ідентифікують за допомогою способу, який передбачає
а) приведення в контакт перспективної суміші нуклеїнових кислот із тенасцином-С, при цьому нуклеїнові кислоти, які мають підвищену афінність до тенасцину-С у порівнянні з іншими перспективними кислотами в суміші, можуть бути відділені від інших представників перспективної суміші;
б) відділення нуклеїнових кислот з підвищеною афінністю від інших представників перспективної суміші;
в) ампліфікацію нуклеїнових кислот з підвищеною афінністю з одержанням суміші нуклеїнових кислот, яка має високий вміст нуклеїнових кислот з відносно високою афінністю і специфічністю щодо зв'язування з тенасцином-С, за допомогою чого можна виявляти нуклеїнові кислоти-ліганди тенасцину-С.
17. Комплекс за п. 16, у якому перспективна суміш нуклеїнових кислот складається з одноланцюгових нуклеїнових кислот.
18. Комплекс за п. 17, у якому одноланцюгові нуклеїнові кислоти являють собою рибонуклеїнові кислоти.
19. Комплекс за п. 18, у якому перспективна суміш нуклеїнових кислот включає 2'-F-(2'-фтор)-модифіковані рибонуклеїнові кислоти.
20. Комплекс за п. 15, у якому маркер вибирають із групи, яка містить радіонукліди, флуорофори, магнітні сполуки та біотин.
21. Комплекс за п. 20, у якому радіонуклід вибирають із групи, яка містить технецій-99m (Tc-99m), Re-188, Cu-64, Cu-67, F-18,125I, 131I, 111In, 32Ρ, 186Re.
22. Комплекс за п. 21, у якому маркер являє собою технецій-99m.
23. Комплекс за п. 22, який додатково включає лінкер.
24. Комплекс за п. 23, у якому лінкер має структуру
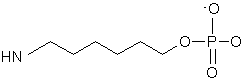
25. Комплекс за п. 24, де комплекс являє
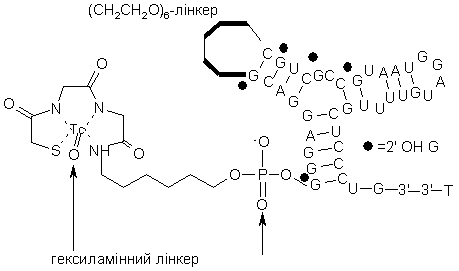
усі А позначають 2'-ОМе,
усі G, за винятком зазначених, є 2'-ОМе-модифікованими,
усі С є 2'-F-модифікованими,
усі U є 2'-F-модифікованими.
26. Спосіб одержання комплексу, який включає нуклеїнову кислоту-ліганд тенасцину-С і маркер, який передбачає:
а) приведення в контакт перспективної суміші нуклеїнових кислот із тенасцином-С, при цьому нуклеїнові кислоти, які мають підвищену афінність до тенасцину-С у порівнянні з іншими перспективними кислотами в суміші, можуть бути відділені від інших представників перспективної суміші;
б) відділення нуклеїнових кислот з підвищеною афінністю від інших представників перспективної суміші;
в) ампліфікацію нуклеїнових кислот з підвищеною афінністю з одержанням суміші нуклеїнових кислот, яка має високий вміст нуклеїнових кислот з відносно високою афінністю і специфічністю щодо зв'язування з тенасцином-С; і
г) ковалентне зв'язування виявленої нуклеїнової кислоти-ліганду тенасцину-С з маркером.
27. Спосіб за п. 26, де маркер вибирають із групи, яка містить радіонукліди, флуорофори, магнітні сполуки та біотин.
28. Спосіб за п. 27, де радіонуклід вибирають із групи, яка містить Tc-99m, Re-188, Cu-64, Cu-67, F-18, 125I,131I, 111In, 32P, 186Re.
29. Спосіб за п. 28, де маркер являє собою Tc-99m.
30. Спосіб за п. 29, який додатково включає лінкер.
31. Спосіб за п. 30, у якому лінкер має структуру

32. Спосіб за п. 31, де комплекс являє собою

усі А позначають 2'-ОМе,
усі G, за винятком зазначених, є 2'-ОМе-модифікованими,
усі С є 2'-F-модифікованими,
усі Ü є 2'-F-модифікованими.
33. Спосіб виявлення присутності хвороби, при якій відбувається експресія тенасцину-С у біологічній тканині, яка може бути уражена хворобою, який передбачає:
а) ідентифікацію нуклеїнової кислоти-ліганду в перспективній суміші нуклеїнових кислот, при цьому нуклеїнова кислота-ліганд є лігандом до тенасцину-С, що включає
(І) приведення в контакт перспективної суміші нуклеїнових кислот із тенасцином-С, при цьому нуклеїнові кислоти, які мають підвищену афінність до тенасцину-С у порівнянні з іншими перспективними кислотами в суміші, можуть бути відділені від інших представників перспективної суміші;
(II) відділення нуклеїнових кислот з підвищеною афінністю від інших представників перспективної суміші;
(III) ампліфікацію нуклеїнових кислот з підвищеною афінністю з одержанням суміші нуклеїнових кислот з відносно високою афінністю і специфічністю щодо зв'язування з тенасцином-С, за допомогою чого виявляють нуклеїнові кислоти-ліганди тенасцину-С;
(б) приєднання маркера, який може використовуватися для діагностики in vivo за допомогою нуклеїнової кислоти-ліганду, виявленої на стадії (III), з одержанням комплексу маркер-нуклеїнова кислота-ліганд;
(в) обробку тканини, яка може бути уражена хворобою, комплексом маркер-нуклеїнова кислота-ліганд; і
г) виявлення присутності комплексу маркер-нуклеїнова кислота-ліганд у тканині, за допомогою чого виявляють хворобу, при якій відбувається експресія тенасцину-С.
34. Спосіб за п. 33, де нуклеїнова кислота-ліганд додатково включає лінкер.
35. Спосіб за п. 34, де маркер вибирають із групи, яка містить радіонукліди, флуорофори, магнітні сполуки та біотин.
36. Спосіб за п. 35, де радіонуклід вибирають із групи, яка містить Tc-99m, Re-188, Cu-64, Cu-67, F-18, 125I, 131I, 111In, 32Ρ, 186Re.
37. Спосіб за п. 36, де маркер являє собою технецій-99m.
38. Спосіб за п. 37, де лінкер має структуру

39. Спосіб за п. 38, де комплекс маркер-нуклеїнова кислота-ліганд являє собою

усі А позначають 2'-ОМе,
усі G, за винятком зазначених, є 2'-ОМе-модифікованими,
усі С є 2'-F-модифікованими,
усі U є 2'-F-модифікованими.
40. Спосіб за п. 33, який додатково передбачає приєднання до комплексу терапевтичного або діагностичного агента.
41. Спосіб за п. 33, де хворобу вибирають із групи, яка містить рак, псоріаз і атеросклероз.
42. Спосіб за п. 41, де хвороба являє собою рак.
43. Спосіб уведення терапевтичного агента до місця, ураженого хворобою, при якій відбувається експресія тенасцину-С, який передбачає ковалентне зв'язування нуклеїнової кислоти-ліганду тенасцину-С з терапевтичним агентом із одержанням комплексу і введення комплексу пацієнтові.
Текст
l. Нуклеїнова кислота-ліганд до тенасцину-С, виявлена за допомогою способу, який передбачає: а) приведення в контакт перспективної суміші нуклеїнових кислот із тенасцином-С, при цьому нуклеїнові кислоти, які мають підвищену афінність до тенасцину-С у порівнянні з іншими перспективними кислотами в суміші, можуть бути відділені від інших представників перспективної суміші; б) відділення нуклеїнових кислот з підвищеною афінністю від інших представників перспективної суміші; в) ампліфікацію нуклеїнових кислот з підвищеною афінністю з одержанням суміші нуклеїнових кислот з відносно високою афінністю і специфічністю щодо зв'язування з тенасцином-С, за допомогою чого можна виявляти.нуклеїнові кислоти-ліганди тенасцину-С. 2. Нуклеїнова кислота-ліганд за п.1, де перспективна суміш нуклеїнових кислот складається з одноланцюгових нуклеїнових кислот. 3. Нуклеїнова кислота-ліганд за п.2, де одноланцюгові нуклеїнові кислоти являють собою рибонуклеїнові кислоти. 4. Нуклеїнова кислота-ліганд за п.3, де перспективна суміш нуклеїнових кислот складається з 2'-F(2'-фтор)-модифікованих рибонуклеїнових кислот. 5. Очищена і виділена нуклеїнова кислота-ліганд 2 (19) 1 3 75578 4 15. Комплекс, який застосовують для діагностики а) приведення в контакт перспективної суміші нукin vivo захворювань, асоційованих з експресією леїнових кислот із тенасцином-С, при цьому нуклетенасцину-С, який включає нуклеїнову кислотуїнові кислоти, які мають підвищену афінність до ліганд тенасцину-С за будь-яким з пунктів 4-9 і тенасцину-С у порівнянні з іншими перспективнимаркер. ми кислотами в суміші, можуть бути відділені від 16. Комплекс за п.15, у якому нуклеїнову кислотуінших представників перспективної суміші; ліганд до тенасцину-С ідентифікують за допомоб) відділення нуклеїнових кислот з підвищеною гою способу, який передбачає афінністю від інших представників перспективної а) приведення в контакт перспективної суміші нуксуміші; леїнових кислот із тенасцином-С, при цьому нуклев) ампліфікацію нуклеїнових кислот з підвищеною їнові кислоти, які мають підвищену афінність до афінністю з одержанням суміші нуклеїнових кистенасцину-С у порівнянні з іншими перспективнилот, яка має високий вміст нуклеїнових кислот з ми кислотами в суміші, можуть бути відділені від відносно високою афінністю і специфічністю щодо інших представників перспективної суміші; зв'язування з тенасцином-С; і б) відділення нуклеїнових кислот з підвищеною г) ковалентне зв'язування виявленої нуклеїнової афінністю від інших представників перспективної кислоти-ліганду тенасцину-С з маркером. суміші; 27. Спосіб за п.26, де маркер вибирають із групи, в) ампліфікацію нуклеїнових кислот з підвищеною яка містить радіонукліди, флуорофори, магнітні афінністю з одержанням суміші нуклеїнових киссполуки та біотин. лот, яка має високий вміст нуклеїнових кислот з 28. Спосіб за п.27, де радіонуклід вибирають із відносно високою афінністю і специфічністю щодо групи, яка містить Tc-99m, Re-188, Cu-64, Cu-67, Fзв'язування з тенасцином-С, за допомогою чого 18, 125I,131I, 111In, 32P, 186Re. можна виявляти нуклеїнові кислоти-ліганди тенас29. Спосіб за п.28, де маркер являє собою Tc-99m. цину-С. 30. Спосіб за п.29, який додатково включає лінкер. 17. Комплекс за п.16, у якому перспективна суміш 31. Спосіб за п.30, у якому лінкер має структуру -O нуклеїнових кислот складається з одноланцюгових нуклеїнових кислот. O P O HN 18. Комплекс за п.17, у якому одноланцюгові нукO леїнові кислоти являють собою рибонуклеїнові 32. Спосіб за п.31, де комплекс являє собою кислоти. (CH2CH2O)6-лінкер 19. Комплекс за п.18, у якому перспективна суміш С G G нуклеїнових кислот включає 2'-F-(2'-фтор)O U G G C U С GC С GU A A A модифіковані рибонуклеїнові кислоти. A GU UU G O U N N СG U G 20. Комплекс за п.15, у якому маркер вибирають із Tc A U -O групи, яка містить радіонукліди, флуорофори, маг=2' OH G S O NH G С O С нітні сполуки та біотин. O P O G С G U G 3' 3' T 21. Комплекс за п.20, у якому радіонуклід вибираO ють із групи, яка містить технецій-99m (Tc-99m), Re-188, Cu-64, Cu-67, F-18,125I, 131I, 111In, 32Ρ, 186Re. гексиламінний лінкер 22. Комплекс за п.21, у якому маркер являє собою усі А позначають 2'-ОМе, технецій-99m. усі G, за винятком зазначених, є 2'-ОМе23. Комплекс за п.22, який додатково включає лінмодифікованими, кер. усі С є 2'-F-модифікованими, 24. Комплекс за п.23, у якому лінкер має структуру усі Ü є 2'-F-модифікованими. -O 33. Спосіб виявлення присутності хвороби, при O P O якій відбувається експресія тенасцину-С у біологіHN O чній тканині, яка може бути уражена хворобою, 25. Комплекс за п.24, де комплекс являє який передбачає: (CH2CH2O)6-лінкер а) ідентифікацію нуклеїнової кислоти-ліганду в перспективній суміші нуклеїнових кислот, при цьоС G G O U G G C U С GC С GU A A му нуклеїнова кислота-ліганд є лігандом до тенасA A UUGU G O N GUU цину-С, що включає N G С Tc (І) приведення в контакт перспективної суміші нукA U -O =2' OH G S O NH G С O С леїнових кислот із тенасцином-С, при цьому нуклеO P O G С G U G 3' 3' T їнові кислоти, які мають підвищену афінність до O тенасцину-С у порівнянні з іншими перспективними кислотами в суміші, можуть бути відділені від гексиламінний лінкер інших представників перспективної суміші; усі А позначають 2'-ОМе, (II) відділення нуклеїнових кислот з підвищеною усі G, за винятком зазначених, є 2'-ОМеафінністю від інших представників перспективної модифікованими, суміші; усі С є 2'-F-модифікованими, (III) ампліфікацію нуклеїнових кислот з підвищеною усі U є 2'-F-модифікованими. афінністю з одержанням суміші нуклеїнових кислот 26. Спосіб одержання комплексу, який включає з відносно високою афінністю і специфічністю щонуклеїнову кислоту-ліганд тенасцину-С і маркер, до зв'язування з тенасцином-С, за допомогою чого який передбачає: виявляють нуклеїнові кислоти-ліганди тена 5 75578 6 сцину-С; кислота-ліганд являє собою (CH2CH2O)6-лінкер (б) приєднання маркера, який може використовуватися для діагностики in vivo за допомогою нуклеС G G O U G їнової кислоти-ліганду, виявленої на стадії (III), з G C U С GC С GU A A A A UGU U одержанням комплексу маркер-нуклеїнова кислоG O N GUU N G С та-ліганд; Tc A U -O =2' OH G S O NH G С (в) обробку тканини, яка може бути уражена хвоO С O P O G С робою, комплексом маркер-нуклеїнова кислотаG U G 3' 3' T O ліганд; і г) виявлення присутності комплексу маркергексиламінний лінкер нуклеїнова кислота-ліганд у тканині, за допомогою усі А позначають 2'-ОМе, чого виявляють хворобу, при якій відбувається усі G, за винятком зазначених, є 2'-ОМеекспресія тенасцину-С. модифікованими, 34. Спосіб за п.33, де нуклеїнова кислота-ліганд усі С є 2'-F-модифікованими, додатково включає лінкер. усі U є 2'-F-модифікованими. 35. Спосіб за п.34, де маркер вибирають із групи, 40. Спосіб за п.33, який додатково передбачає яка містить радіонукліди, флуорофори, магнітні приєднання до комплексу терапевтичного або діасполуки та біотин. гностичного агента. 36. Спосіб за п.35, де радіонуклід вибирають із 41. Спосіб за п.33, де хворобу вибирають із групи, групи, яка містить Tc-99m, Re-188, Cu-64, Cu-67, Fяка містить рак, псоріаз і атеросклероз. 18, 125I, 131I, 111In, 32Ρ, 186Re. 42. Спосіб за п.41, де хвороба являє собою рак. 37. Спосіб за п.36, де маркер являє собою техне43. Спосіб уведення терапевтичного агента до цій-99m. місця, ураженого хворобою, при якій відбувається 38. Спосіб за п.37, де лінкер має структуру -O експресія тенасцину-С, який передбачає ковалентне зв'язування нуклеїнової кислоти-ліганду тенаO P O HN сцину-С з терапевтичним агентом із одержанням O комплексу і введення комплексу пацієнтові. 39. Спосіб за п.38, де комплекс маркер-нуклеїнова У даному винаході описано нуклеїнові кислоти-ліганди, які мають високу афінність щодо тенасцину-С. Також описано способи ідентифікації та одержання нуклеїнових кислот-лігандів, які мають високу афінність щодо тенасцину-С. Спосіб, який застосовують за винаходом для ідентифікації таких нуклеїнових кислот-лігандів, позначено як SALEX, що є скороченням Systematic Evolution of Ligands by Exponential enrichment (систематичне виділення лігандів шляхом експоненціального збагачення). Крім того, описано нуклеїнові кислотиліганди, які мають високу афінність до тенасцинуС. Крім того, описано РНК-ліганди тенасцину-С. Також описано олігонуклеотиди, які містять нуклеотидні похідні, хімічно модифіковані в 2'-положенні пуринів і піримідинів. Додатково описано РНКліганди тенасцину-С, що містять 2'-F- і 2'-Омемодифікації. Олігонуклеотиди за даним винаходом можна застосовувати як діагностичні і/або терапевтичні агенти. Тенасцин-С являє собою гексамерний глікопротеїн з молекулярною масою 1,1-1,5 мільйона Да, локалізований в основному в позаклітинному матриксі Тенасцин-С експресується в процесі ембріогенезу, при загоєнні ран і неоплазії, що дозволяє припустити, що цей протеїн бере участь у ремоделюванні тканини [Erickson і Bourdon, Ann Rev Cell Biol, 5 71-92 (1989)]. Неопластичні процеси також включають ремоделювання тканини, і тенасцин-С надекспресується в багатьох типах пухлин, включаючи карциноми легені, молочної залози, передміхурової залози й ободової кишки, астроцитоми, гліобластоми, меланоми і саркоми [Soini та ін., Am J.Clin Path, 100(2) 145-150 (1993), Koukoulis та ін., Hum Pathol 22(7) 636-643 (1991), Borsi та ін., Int. J. Cancer, 52(5) 688-692 (1992), Koukoulis та ін., J. Submicrosc. Cytol. Pathol., 25(2) 285-295 (1993), Ibrahim та ін., Hum Pathol 24(9) 982-989 (1993), Riedl та ін., Dis Colon Rectum, 41(1) 86-92 (1998), Tiominen і Kallioinen, J. Cutan Pathol., 21(5) 424-429 (1994), Natali та ін., Int. J. Cancer, 46(4) 586-590 (1990), Zagzag та ін., Cancer Res., 55(4) 907-914 (1995), Hasegawa та ін., Acta Neuropathol (Bed) 93(5) 431-437 (1997), Saxon та ін., Pediatr. Pathol. Lab. Med. 17(2) 259-266 (1997), Hasegawa та ін., Hum. Pathol. 26(8) 838-845 (1995)]. Крім того, надекспресія тенасцину-С відбувається при гиперпроліферативних шкірних хворобах, наприклад, псоріазі [Schalkwijk та ін., Br. J. Dermatol. 124(1) 1320(1991)] і атеросклеротичних ушкодженнях [Fukumoto та ін., J. Atheroscler. Tromb. 5(1) 29-35 (1998), Wallner та ін., Circulation 99(10) 1284-1289 (1999)] Мічені за допомогою радіоактивних ізотопів антитіла, які зв'язуються з тенасцином-С, застосовують для візуалізації і терапії пухлин у клінічних умовах [Paganelli та ін, Eur. J. Nucl. Med. 26(4) 348357 (1999), Paganelli та ін., Eur. J. Nucl. Med. 21(4) 314-321 (1994), Bigner та ін.,J. Clin. Oncol. 16(6) 2202-2212 (1998), Merlo та ін., Int. J. Cancer 71(5) 810-816 (1997)]. Аптамери до тенасцину-С потенційно можуть знайти застосування в діагностиці і терапії раку, а також у діагностиці і терапії атеросклерозу і терапії псоріазу У порівнянні з антитілами аптамери є не 7 75578 8 великими (7-20кДА), для них характерний дуже однієї й тієї ж загальної схеми відбору до досягшвидкий кліренс із крові і їх одержують за допомонення відповідності будь-якому потрібному критегою хімічного синтезу Швидкий кліренс із крові є рію афінності і вибірковості зв'язування. Починаюважливим для діагностичної візуалізації in vivo, чи процес із суміші нуклеїнових кислот, які у коли рівні в крові є основними фоновими фактобажаному варіанті включають сегмент рандомізорами, які заважають візуалізації. Швидкий кліренс ваної послідовності, SELEX-метод включає стадії із крові також може бути важливий для терапії, приведення суміші в контакт із мішенню в умовах, коли рівні в крові можуть обумовлювати токсичнайбільш бажаних для зв'язування, відділення ність SELEX-метод дозволяє швидко виділяти апнезв'язаних нуклеїнових кислот від тих нуклеїнотамери, а хімічний синтез дозволяє здійснювати вих кислот, які специфічно зв'язалися з молекулашвидку і сайтспецифічну кон'югацію аптамерів з ми-мішенями, дисоціації комплексів нуклеїнова різними інертними і біологічно активними молекукислота-мішень, ампліфікації нуклеїнових кислот, лами Таким чином, аптамер до тенасцину-С мождисоційованих із комплексів нуклеїнова кислотана застосовувати для терапії пухлин або для in мішень, з одержанням багатої на ліганди суміші vivo чи ex vivo діагностичної візуалізації і/або для нуклеїнових кислот, з наступним повторенням ставведення різних терапевтичних агентів у комплексі дій зв'язування, розділення, дисоціації та ампліфіз нуклеїновими кислотами-лігандами тенасцину-С кації протягом такої кількості циклів, яка потрібна для лікування хворобливих станів, при яких відбудля одержання нуклеїнових кислот-лігандів, що вається експресія тенасцину-С. мають високу афінність стосовно молекули-мішені. Протягом багатьох літ вважалося, що нуклеїПри створенні даного винаходу було встановнові кислоти відіграють головним чином інформалено, що за допомогою SELEX-метода можна ційну роль За допомогою метода, відомого як продемонструвати, що нуклеїнові кислоти, як хіміSystematic Evolution of Ligands by Exponential чні сполуки, можуть мати широку розмаїтість enrichment, позначеного як SELEX-метод, стало форм, розмірів і конфігурацій, і вони мають ширші очевидним, що нуклеїнові кислоти мають різномаспектр зв'язування та інші функції у порівнянні з нітну тривимірну структуру, відмінну від протеїнів тими, котрі нуклеїнові кислоти виявляють у біолоSELEX являє собою метод, призначений для вигічних системах. явлення in vitro молекул нуклеїнових кислот, які Основний SELEX-метод було модифіковано з мають здатність до високоспецифічного зв'язуванметою вирішення різноманітних конкретних задач. ня з молекулами-мішенями, і він описаний [у заявНаприклад, у заявці [на патент US сер. ці на патент США сер. №07/536428, зареєстрова№07/960093, зареєстрованій 14 жовтня 1992р.], у ній 11 червня 1990p.] під назвою "Systematic даний час абандованій, і [в патенті US №5707796], Evolution of Ligands by Exponential Enrichment", на обидва документи озаглавлені "Method for цей час абандовашй, [у патенті США №5475096], Selecting Nucleic Acids on the Basis of Structure", озаглавленому "Nucleic Acid Ligands", [у патенті описано застосування SELEX-метода у комбінації США №5270163 (див також WO 91/19813)], озаз гель-електрофорезом для відбору молекул нукглавленому "Method for Identifying Nucleic Acid леїнових кислот зі специфічними структурними Ligands", кожний з документів спеціально повністю характеристиками, таких як «вигнута ДНК». [У заявключено у даний опис як посилання У кожній із вці на патент US сер. №08/123935, зареєстрованій цих заявок, які у сукупності позначені в даному 17 вересня 1993р.], на цей час абандованій, озаописові як заявки на патент, що стосуються главленій "Photoselection of Nucleic Acids Ligands", SELEX, представлено зовсім новий метод одер[у патенті США №5763177], озаглавленому жання нуклеїнових кислот-лігандів до будь-якої "Systematic Evolution of Ligands by Exponential потрібної молекули-мішені. За допомогою SELEXEnrichment: Photoselection of Nucleic Acids Ligands методу одержують клас продуктів, позначених як and Solution SELEX" і в заявці [на патент US сер. нуклеїнові кислоти-ліганди або аптамери, кожний з №09/093293, зареєстрованій 8 червня 1998p.], який має унікальну послідовність, і які мають здатозаглавленій "Systematic Evolution of Ligands by ність до специфічного зв'язування з потрібними Exponential Enrichment: Photoselection of Nucleic сполукою- або молекулою-мішенню. Кожна виявAcids Ligands and Solution SELEX"], описано мелена за допомогою SELEX-метода нуклеїнова китод, основою якого є SELEX, для відбору нуклеїслота-ліганд являє собою специфічний ліганд данових кислот-лігандів, які містять фотореактивні ної сполуки- або молекули-мішені. SELEX-метод групи, що мають здатність до зв'язування і/або заснований на дуже важливому відкритті того факфотозв'язування і/або до фотоінактивації молекуту, що нуклеїнові кислоти мають властивість, потли-мішені. [У патенті US №5580737], озаглавленорібну для утворення різних дво- і тривимірних му "High-Affinity Nucleic Acids Ligands That структур, і достатню хімічну мінливість їхніх моноDiscriminate Between Theophylline and Caffeine", мерів, що дозволяє їм діяти у функції лігандів описано метод, позначений як Counter-SELEX, (утворюючи специфічно зв'язані пари) практично з ідентифікації високоспецифічних нуклеїнових кискожною хімічною сполукою, як мономерною, так і лот-лігандів, що мають здатність розрізняти близьполімерною. Згідно із SELEX-методом, мішенями коспоріднені молекули, які можуть не відноситися можуть бути молекули будь-якого розміру або до пептидів. [У патенті US №5567588], озаглавлескладу. SELEX-метод, застосовуваний для висоному "Systematic Evolution of Ligands by коафінного зв'язування, включає відбір із суміші Exponential Enrichment: Solution SELEX", описано олігонуклеотидів-кандидатів (перспективна суміш метод, основою якого є SELEX, за допомогою якоолігонуклеотидів) і постадійне повторення зв'язуго досягається високоефективне розділення оліговання, розділення та ампліфікації за допомогою нуклеотидів, що мають високу і низьку афінність 9 75578 10 стосовно молекули-мішені. SELEX-метод передприсутності хвороби, при якій відбувається ексбачає ідентифікацію таких, що мають високу афінпресія тенасцину-С, у біологічній тканині, яка може ність, нуклеїнових кислот-лігандів, які містять мобути уражена хворобою. Крім того, винахід стосудифіковані нуклеотиди, що надають поліпшених ється способу виявлення присутності пухлини, що характеристик лігандові, таких як підвищена стабіекспресує тенасцин-С у біологічній тканині, яка льність in vivo, або поліпшені характеристики при може включати пухлину. Також винахід стосується введенні. Приклади таких модифікацій включають комплексу, призначеного для діагностики in vivo хімічні заміни в положеннях рибози і/або фосфату або ex vivo Винахід також стосується способу ввеі/або основи. Ідентифіковані за допомогою SELEXдення терапевтичних агентів, призначених для методу нуклеїнові кислоти-ліганди описано в пателікування або профілактики уражених захворюнті US № 5660985, озаглавленому "High Affinity ванням тканин, які експресують тенасцин-С. І, наNucleic Acids Ligands Containing Modified решті, винахід стосується комплексу, призначеноNucleotides", у якому описано олігонуклеоиди, що го для введення терапевтичних агентів для містять нуклеотидні похідні, хімічно модифіковані в лікування або профілактики уражених захворюположеннях 5- і 2'-піримідинів. [У патенті US ванням тканин, які експресують тенасцин-С №5580737], вище, описано високоспецифічні нукНа Фіг.1 наведено дані про зв'язування РНКлеїнові кислоти-ліганди, що містять один або кільпулів, отриманих за допомогою клітинного SELEX, ка нуклеотидів, модифікованих за допомогою 2'із клітинами лінії U251. аміногрупи (2'-NH2), 2'-фтору (2'-F) і/або 2'-ОНа Фіг.2 наведено ймовірну вторинну структуметилу (2'-Оме). [У заявці на патент US сер. ру аптамерів ТТА1 і ТТА1 NB. На кресленні пока№08/264029, зареєстрованій 22 червня 1994р.], на зано кон'югацію аптамерів з хелатором Тс-99m. Усі цей час абандованій, озаглавленій "Novel Method А є 2'Oме-модифікованими. Усі G, якщо не зазнаof Preparation of Known ana Novel 2' Modified чено іншого, є 2'Оме-модифікованими. Усі С та U є Nicleosides by Intramolecular Nucleophilic 2'F-модифікованими. Displacement", описано олігонуклеоитиди, які місНа Фіг.3 наведено зображення ксенотрансплатять різноманітні 2'-модифіковані піримідини. нтатів пухлинних клітин лінії U251, отримані з виSELEX-метод передбачає поєднання відібракористанням мічених за допомогою Тс-99m ТТА1 і них олігонуклеотидів з іншими відібраними олігоТТА1. NB через 3год. після ін'єкції. нуклеотидами і неолігонуклеотидними функціонаНа Фіг.4 наведено дані, отримані за допомольними ланками, як це описано [в патенті US гою флуоресцентної мікроскопії зрізу гліобластоми №5637459], озаглавленому "Systematic Evolution of U251 через 3год. після внутрішньовенної ін'єкції Ligands by Exponential Enrichment: Chimeric (і.ν.) міченого за допомогою барвника RhodamineSELEX", і [в патенті US №5683867], озаглавленому Red-X TTA1. "Systematic Evolution of Ligands by Exponential На Фіг.5 показано, яким чином Тс-99m і лінкер Enrichment: Blended SELEX" відповідно. Згідно з зв'язуються через 5'G із ТТА1. наведеними у цих заявках методами, можна поєдНа Фіг.6 наведено дані про поглинання нувати широку розмаїтість форм та інших властиTTA1/GS7641 через 3год. різними ксенотрансплавостей олігонуклеотидів і їх здатність до ефективнтатами пухлин людини в мишах у порівнянні з ної ампліфікації і реплікації з потрібними поглинанням такого, що не зв'язується, контрольвластивостями інших молекул. ного аптамера ID/r означає ін'єковану дозу/г. SELEX-метод також передбачає поєднання віНа Фіг.7 наведено дані про біорозподілення дібраних нуклеїнових кислот-лігандів з ліпофільміченого за допомогою 111Іn TTA1/GS7641 з виконими сполуками або неімуногенними високомолеристанням у функції хелатора або DOTA, або кулярними сполуками в комплекси, призначені для DTPA, міченого за допомогою радіоактивного медіагностики або терапії, як це описано в заявці [на талу, через 3год. після ін'єкцій ID/r означає ін'єкопатент US сер. №08/434465, зареєстрованій 4 травану дозу/г. вня 1995p.], озаглавленій "Nucleic Acid Ligand На Фіг.8 наведено кон'югацію аптамера з Complexes". Усі вищевказані патенти і заявки, у DTPA 111Іn представлений у вигляді хелатного яких описано модифікації основного SELEXкомплексу з DTPA. метода, спеціально повністю включені в даний На Фіг.9 наведено кон'югацію аптамера з опис як посилання. DOTA 111Іn представлений у вигляді хелатного У даному винаході описано спосіб виділення комплексу з DOTA. нуклеїнових кислот-лігандів, які з високою специНа Фіг.10 наведено ймовірну вторинну струкфічністю зв'язуються з тенасцином-С. Крім того, туру аптамера ТТА1. На кресленні зображено описано нуклеїнові кислоти-ліганди до тенасцинукон'югацію аптамерів з хелатором Тс-99m. АптаС. Також описано високоафінні РНК-ліганди до мер наведено у міченій за допомогою Тс-99m фотенасцину-С. Також описано РНК-ліганди до тенармі. Всі А є 2'Оме-модифікованими. Усі G, якщо не сцину-С, з модифікованим 2'-фтором піримідином і зазначено іншого, є 2'Оме-модифікованими. Усі С з модифікованим 2'-Оме пурином. Застосовуваний и U є 2'F-модифікованими. за винаходом спосіб ідентифікації таких нуклеїноОсновний метод, який застосовувався для вих кислот-лігандів названо SALEX, що є скороідентифікації нуклеїнових кислот-лігандів до теначенням Systematic Evolution of Ligands by сцину-С, позначений як SELEX-метод, що є скороExponential enrichment. Під обсяг даного винаходу ченням назви Systematic Evolution of Ligands by також підпадають ліганди, наведені в таблицях 3 і Exponential enrichment, і він включає (а) приведен4 і на Фіг.10. ня в контакт перспективної суміші нуклеїнових киВинахід також стосується способу виявлення слот з тенасцином-С, (б) розділення представників 11 75578 12 перспективної суміші (суміші кандидатів) на основі пективної суміші нуклеїнових кислот з тенасциномафінності до тенасцину-С і (в) ампліфікацію відібС, при цьому нуклеїнові кислоти, які мають підвираних молекул з одержанням суміші нуклеїнових щену афінність до тенасцину-С у порівнянні з інкислот з високим вмістом нуклеотидних послідовшими перспективними кислотами в суміші, можуть ностей, які мають відносно високу афінність до бути відділені від інших представників перспективзв'язування з тенасцином-С. Даний винахід вклюної суміші, (II) відділення нуклеїнових кислот, які чає РНК-ліганди до тенасцину-С. Винахід також мають підвищену афінність, від інших представнивключає специфічні РНК-ліганди до тенасцину-С, ків перспективної суміші, (III) ампліфікацію нуклеїнаведені в таблицях 3 і 4 і на Фіг.10. Більш конкренових кислот, які мають підвищену афінність, із тно винахід стосується нуклеотидних послідовносодержанням суміші нуклеїнових кислот, які мають тей, які є практично гомологічними нуклеїновим відносно високу афінність і специфічність щодо кислотам-лігандам, наведеним у таблицях 3 і 4 і на зв'язування з тенасцином-С, за допомогою чого Фіг.10, і які мають практично таку ж здатність зв'явиявляють нуклеїнові кислоти-ліганди тенасцинузуватися з тенасцином-С. Під практичною гомолоС, (б) приєднання маркера, який може використогією мають на увазі рівень гомології первинної повуватися для діагностики in vivo або ex vivo за дослідовності, що перевищує 70%, бажаніше помогою нуклеїнової кислоти-ліганду, виявленої на перевищує 80%, і в оптимальному варіанті перестадії (III), з одержанням комплексу маркервищує 90, 95 або 99%. Відсоток гомології, як він нуклеїнова кислота-ліганд, (в) обробку тканини, зазначений вище, розраховують як відсоток нукяка може бути уражена хворобою, комплексом леотидів, виявлених у меншій із двох послідовносмаркер-нуклеїнова кислота-ліганд, і (г) виявлення тей, для яких проводиться порівняльний аналіз, з присутності комплексу маркер-нуклеїнова кислотаідентичними нуклеотидними залишками в послідоліганд у тканині, за допомогою чого виявляють вності, з якою проводиться порівняння, при цьому хворобу, при якій відбувається експресія тенасдля полегшення цього порівняльного аналізу може цину-С. бути убудований 1 прорив завдовжки 10 нуклеЩе одним об'єктом даного винаходу є комотидів. плекс, який може застосовуватися для діагностики Поняття "практично така ж здатність зв'язуваin vivo або ex vivo, що включає одну або декілька тися з тенасцином-С" означає, що рівень афінності нуклеїнових кислот-лігандів тенасцину-С і один знаходиться в межах 1 або 2 порядків у порівнянні або декілька маркерів. Об'єктом винаходу також є з рівнем афінності лігандів за даним винаходом. спосіб введення терапевтичних агентів для лікуВизначення того, чи є певна послідовність практивання або профілактики хворобливих станів, при чно гомологічною конкретно представленим у даяких відбувається експресія тенасцину-С. І ще ному описові послідовностям, чи має вона практиодним об'єктом даного винаходу є комплекс, зачно таку ж здатність зв'язуватися з тенасцином-С, стосовуваний для введення терапевтичних агентів знаходиться в компетенції фахівця в даній галузі. для лікування або профілактики хворобливих стаУзагальнення даних про гомології послідовнонів, при яких відбувається експресія тенасцину-С. стей нуклеїнових кислот-лігандів тенасцину-С, Для опису даного винаходу використовують наведених у таблицях 3 і 4 і на Фіг.10, свідчить про різні поняття 3 метою полегшення розуміння опису те, що послідовності, які мають низький рівень компонентів винаходу застосовують такі вигомології або взагалі не мають первинної гомолозначення: гії, можуть мати практично однакову здатність У контексті даного опису поняття "нуклеїнова зв'язуватися з тенасцином-С. Із цих причин під кислота-ліганд" стосується такої, що не зустрічаобсяг даного винаходу також підпадають нуклеїється у природних умовах, нуклеїнової кислоті, яка нові кислоти-ліганди, які мають практично таку ж потрібним чином впливає на мішень. Нуклеїнові установлену структуру або структурні мотиви і кислоти-ліганди часто позначають як "аптамери". здатність зв'язуватися з тенасцином-С, що і нуклеМішенню за даним винаходом є тенасцин-С, тому їнові кислоти-ліганди, наведені в таблицях 3 і 4 і під цим поняттям розуміють нуклеїнову кислотуна Фіг.10. Практично однакова структура або струліганд тенасцину-С. Потрібний вплив включає (але ктурні мотиви можуть бути встановлені за допомоне обмежуючись ним) зв'язування з мішенню, кагою програми Zukerfold [див Zuker, Science 244 48талітичну зміну мішені, взаємодію з мішенню та52 (1989)]. Як відомо в даній галузі, для передбаким чином, що це модифікує/змінює мішень або чення вторинної структури і структурних мотивів функціональну активність мішені, ковалентне приможуть також застосовуватися інші комп'ютерні єднання до мішені у функції інгібітора-"самогубця", програми. Практично така ж структура або струкполегшення взаємодії між мішенню та іншою мотурний мотив нуклеїнових кислот-лігандів, що зналекулою. Згідно з бажаним варіантом, під впливом ходяться в розчині або у вигляді зв'язаної структумають на увазі специфічну афінність до зв'язуванри, також можуть бути встановлені за допомогою ня з молекулою-мішенню, при цьому така молекуЯМР або інших методів, відомих у даній галузі. ла-мішень має тривимірну хімічну структуру, відДаний винахід також стосується способу виявмінну від поліпептиду, який зв'язується з лення присутності хвороби, при якій відбувається нуклеїновою кислотою-лігандом за допомогою експресія тенасцину-С, у біологічній тканині, що механізму, який в основному залежить від спарюможе бути уражена хворобою, спосіб передбачає вання основ Уотсона/ Крика або триплетного спі(а) ідентифікацію нуклеїнової кислоти-ліганду в рального зв'язування, причому нуклеїнова кислоперспективній суміші нуклеїнових кислот, при цьота-ліганд не є нуклеїновою кислотою, що має му нуклеїнова кислота-ліганд є лігандом до тенасвідому фізіологічну функцію, яка виявляється в цину-С, що включає (І) приведення в контакт персзв'язуванні з молекулою-мішенню. З перспективної 13 75578 14 суміші нуклеїнових кислот виділяють нуклеїнові Поняття "SELEX-мішень" або "мішень" означає кислоти-ліганди, які відрізняються тим, що ці нукбудь-яку сполуку, що становить інтерес, або молелеїнові кислоти-ліганди є лігандами до тенасцинукулу, для яких потрібний ліганд. Мішень може явС, методом, який передбачає: а) приведення перляти собою (але не обмежуючись ними) протеїн, спективної суміші в контакт із тенасцином-С, при пептид, вуглеводень, полісахарид, глікопротеш, цьому нуклеїнові кислоти, які мають підвищену гормон, рецептор, антиген, антитіло, вірус, субафінність до тенасцину-С, можуть бути відділені страт, метаболіт, аналог перехідного стану, кофавід інших представників перспективної суміші; б) ктор, інгібітор, лікарський засіб, барвник, живильну відділення нуклеїнових кислот, які мають підвищеречовину, фактор росту і т.д. У даному описові ну афінність, від інших представників перспективSELEX-мішень являє собою тенасцин-С. ної суміші; і в) ампліфікацію нуклеїнових кислот, Поняття "комплекс" у контексті даного опису які мають підвищену афінність, з одержанням суозначає молекулу, утворену за допомогою ковалеміші нуклеїнових кислот з підвищеним вмістом нтного зв'язування однієї або декількох нуклеїнолігандів [див. заявку на патент США №08/434425, вих кислот-лігандів тенасцину-С з одним або декізареєстровану 3 травня 1995p.], на цей час [патент лькома маркерами. У деяких варіантах здійснення US №5789157], включений у даний опис як посиданого винаходу комплекс позначають як A-B-Y, лання. де А означає маркер, В є необов'язковим компоУ контексті даного опису поняття "суміш каннентом і означає лінкер, і Υ означає нуклеїнову дидатів (перспективна суміш)" означає суміш нуккислоту-ліганд тенасцину-С. леїнових кислот, що мають різні послідовності, з Поняття "маркер" у контексті даного опису якої вибирають потрібний ліганд. Джерелом персозначає молекулу або молекули, що утворюють пективної суміші можуть бути нуклеїнові кислоти, комплекси з нуклеїновою кислотою-лігандом тенащо зустрічаються в природних умовах, або їхні сцину-С, або безпосередньо, або через лінкер(и) фрагменти, синтезовані хімічним шляхом нуклеїабо спейсер(и), яка(і) дозволяють виявляти комнові кислоти, синтезовані ферментативним шляплекс in vivo або ex vivo візуально або за допомохом нуклеїнові кислоти або нуклеїнові кислоти, гою хімічних методів. Приклади маркерів включаотримані за допомогою комбінації цих методів. ють (але не обмежуючись ними) радіонуклеотиди, Згідно з бажаним варіантом для полегшення проTc-99m, Re-188, Си-64, Си-67, F-18, 125І, 131І, тІn, 32 цесу ампліфікації кожна нуклеїнова кислота має Р, 186Re; усі флуорофори, включаючи флуоресфіксовану послідовність, яка оточує рандомізовану цин, родамін, техаський червоний (Texas Red); ділянку. похідні вищевказаних флуорофорів, включаючи У контексті даного опису поняття "нуклеїнова Rhodamine-Red-X, магнітні сполуки; і біотин. кислота" означає одноланцюгові або дволанцюгові У контексті даного опису поняття "лінкер" ДНК, РНК і будь-які їхні хімічні модифікації. Модиозначає молекулу, яка з'єднує дві або більшу кільфікації включають (але не обмежуючись ними) кість молекул через ковалентний зв'язок або некомодифікації, які приводять до одержання інших валентні взаємодії і здійснює просторове роздіхімічних груп, що надають основам нуклеїнової лення молекул таким чином, при якому кислоти-ліганду або нуклеїновій кислоті-лігандові в зберігаються функціональні властивості однієї або цілому додатковий заряд, змінену здатність до декількох молекул. Лінкер також позначають як поляризації, утворення водневих зв'язків, електроспейсер. Приклади лінкеров включають (але не статичної взаємодії і текучості. Такі модифікації обмежуючись ними) (СН2СН2О)6 і гексиламіни, включають (але не обмежуючись ними) модифікабудову яких наведено на Фіг.2. ції цукру в 2'-положенні, модифікації піриміду в 5Поняття "терапевтичний" у контексті даного положенні, модифікації пурину в 8-положенні, моопису включає лікування і/або профілактику. Подифікації екзоциклічних амінів, заміну 4няття терапевтичний, якщо воно використовуєтьтіоуридину, заміну 5-бром- або 5-йодурацилу, мося, стосується людей та інших тварин. дифікації каркаса, метилування, незвичні комбінаПоняття "ковалентний зв'язок" означає хімічції спарювання основ, таких як ізооснови ізоцитиний зв'язок, утворений усуспільненням електронів. дин та ізогуанідин, і т.п.Модифікації також можуть Поняття "нековалентні взаємодії" стосується включати 3'-и 5'-модифікації, такі як кемпінг. відмінних від ковалентних зв'язків взаємодій, за "SELEX''-метод включає комбінацію відбору допомогою яких молекули утримуються разом, нуклеїнових кислот-лігандів, які взаємодіють з мівключаючи іонні взаємодії і водневі зв'язки. шенню потрібним чином, наприклад, зв'язуються з Згідно з бажаним варіантом нуклеїнові кислопротеїном, і ампліфікації відібраних нуклеїнових ти-ліганди за даним винаходом одержують за докислот. Необов'язкове циклічне повторення стадій помогою SELEX-методу SELEX-метод описано [у відбору/ампліфікації дозволяє відібрати одну або заявці на патент US сер. №07/536428, зареєстроневелику кількість нуклеїнових кислот, які найсиваній 11 червня 1990p., під назвою "Systematic льніше взаємодіють з мішенню, із групи, що місEvolution of Ligands by Exponential Enrichment", на тить дуже велику кількість нуклеїнових кислот. цей час абандованій, у патенті US №5475096, озаЦиклічне повторення процесу відбору/ампліфікації главленому "Nucleic Acid Ligands", у патенті US продовжують до вирішення поставленої задачі. За №5270163 (див також WO 91/19813), озаглавледаним винаходом, SELEX-метод застосовують з ному "Method for Identifying Nucleic Acid Ligands"]. метою одержання нуклеїнових кислот-лігандів до Ці документи, кожен з яких спеціально включений тенасцину-С. у даний опис як посилання, разом позначені як SELEX-метод описано у заявках на патент, що заявки на патент, у яких описано SELEX. стосуються SELEX SELEX-метод дозволяє одержати клас продук 15 75578 16 тів, наведених молекулами нуклеїнових кислот, кому ступені реалізації SELEX-метод повинен закожна з яких має унікальну послідовність і кожна з безпечити одержання перспективної суміші, що яких має здатність специфічно зв'язуватися з потмістить одну або лише невелику кількість унікальрібними сполукою- або молекулою-мішенню Молених нуклеїнових кислот, які відповідають тим нуккули-мішені у бажаному варіанті являють собою леїновим кислотам з вихідною перспективою супротеїни, але вони також включають, серед іншоміші, для яких характерна найбільш висока го, вуглеводні, пептидоглікани і різні невеликі моафінність стосовно молекули-мішені. лекули. SELEX-метод також можна застосовувати Основний SELEX-метод було модифіковано з для біологічних структур-мішеней, таких як клітинні метою вирішення великої кількості конкретних заповерхні або віруси, з використанням специфічної дач. [Наприклад, у заявці на патент US сер. взаємодії з молекулою, яка є складовою частиною №07/960093, зареєстрованій 14 жовтня 1992p.], на біологічної структури. цей час абандованій, і [в патенті US №5707796], У найбільш загальній формі SELEX-метод мообидва документи озаглавлені "Method for жна охарактеризувати такою послідовністю стадій: Selecting Nucleic Acids on the Basis of Structure", 1) Одержують перспективну суміш нуклеїнових описано застосування SELEX-методу у комбінації кислот з різними послідовностями Перспективна з гель-електрофорезом для відбору молекул нуксуміш зазвичай включає ділянки фіксованих послілеїнових кислот зі специфічними структурними довностей (тобто кожен представник перспективхарактеристиками, таких як «вигнута ДНК». [У заяної суміші містить однакові послідовності в тому ж вці на патент US сер. №08/123935, зареєстрованій самому положенні) і ділянки рандомізованих пос17 вересня 1993р.], на цей час абандованій, озалідовностей. Ділянки фіксованих послідовностей главленій "Photoselection of Nucleic Acids Ligands", вибирають або (а) для полегшення описаних ниж[у патенті US №5763177, озаглавленому че стадій ампліфікації, (б) для імітації послідовнос"Systematic Evolution of Ligands by Exponential ті, для якої відома здатність зв'язуватися з мішенEnrichment: Photoselection of Nucleic Acids Ligands ню, або (в) для підвищення рівня даного and Solution SELEX", і в заявці на патент США сер. структурного аранжування нуклеїнових кислот у №09/093293, зареєстрованій 8 червня 1998p., озаперспективній суміші. Рандомізовані послідовності главленій "Systematic Evolution of Ligands by можуть бути повністю рандомізованими (тобто Exponential Enrichment: Photoselection of Nucleic ймовірність перебування основи в будь-якому поAcids Ligands and Solution SELEX"], описано меложенні становить один до чотирьох) або частково тод, основою якого є SELEX, для відбору нуклеїрандомізованими (наприклад, імовірність перебунових кислот-лігандів, які містять фотореактивні вання основи в будь-якім положенні може бути групи, що мають здатність до зв'язування і/або вибрана з будь-якого рівня від 0 до 100%). фотозв'язування, і/або до фотоінактивації молеку2) Перспективну суміш приводять у контакт з ли-мішені. [У патенті США №5580737, озаглавлевибраною мішенню в умовах, найбільш бажаних ному "High-Affinity Nucleic Acids Ligands That для зв'язування мішені з представниками перспекDiscriminate Between Theophylline and Caffeine"], тивної суміші. У цих умовах взаємодію між мішенописано метод, позначений як Counter-SALEX, ню і нуклеїновими кислотами перспективної суміші ідентифікації високоспецифічних нуклеїнових кисможна розглядати як утворення пар нуклеїнова лот-лігандів, що мають здатність розрізняти близькислота-мішень між мішенню і тими нуклеїновими коспоріднені молекули. [У патенті US №5567588, кислотами, які мають найвищу афінність до міозаглавленому "Systematic Evolution of Ligands by шені. Exponential Enrichment: Solution SELEX"], описано 3) Нуклеїнові кислоти, які мають найвищу метод, основою якого є SELEX, за допомогою якоафінність до мішені, відокремлюють від нуклеїного досягається високоефективне розділення олігових кислот, які мають нижчу афінність до мішені. нуклеотидів, що мають високу і низьку афінність Оскільки тільки дуже невелика кількість послідовстосовно молекули-мішені. [У патенті US ностей (і можливо тільки одна молекула нуклеїно№5496938, озаглавленому "Nucleic Acids Ligands вої кислоти) відповідає нуклеїновим кислотам з to HIV-RT and HIV-1 Rev"], описано засновані на найбільш високою афінністю, які присутні у персвикористанні SELEX методи одержання нуклеїнопективній суміші, як правило, потрібно в такий спових кислот-лігандів з поліпшеними характеристисіб підбирати критерії розділення, щоби значна ками. [У патенті US №5705337, озаглавленому кількість нуклеїнових кислот у перспективній сумі"Systematic Evolution of Ligands by Exponential ші (приблизно 5-50%) зберігалася в процесі роздіEnrichment: Chemi-SELEX"], описано методи ковалення. лентного зв'язування ліганду з його мішенню. 4) Потім ті нуклеїнові кислоти, які відібрані в SELEX-метод передбачає ідентифікацію таких, результаті розділення, як такі, що мають відносно що мають високу афінність, нуклеїнових кислотвисоку афінність стосовно мішені, ампліфікують, лігандів, які містять модифіковані нуклеотиди, що створюючи нову перспективну суміш, з більш винадають поліпшених характеристик лігандові, тасоким вмістом нуклеїнових кислот, що мають відких як підвищена стабільність in vivo, або поліпшеносно високу афінність стосовно мішені. ні характеристики при введенні. Приклади таких 5) У результаті повторення вищенаведених модифікацій включають хімічні заміни в положенстадій розділення і ампліфікації знову отримана нях рибози і/або фосфату і/або основи. Ідентифіперспективна суміш містить усе менше й менше ковані за допомогою SELEX-методу нуклеїнові унікальних послідовностей, при цьому середній кислоти-ліганди описано [в патенті US №5660985, рівень афінності нуклеїнових кислот до мішені в озаглавленому "High Affinity Nucleic Acids Ligands цілому повинен зростати. У своєму найбільш висоContaining Modified Nucleotides"], у якому описано 17 75578 18 олігонуклеотиди, що містять нуклеотидні похідні, нуклеїновій кислоті-лігандові в цілому додатковий хімічно модифіковані в положеннях 5- і 2'заряд, змінену здатність до поляризації, утворення піримідинів. [У патенті US №5580737], вище, опиводневих зв'язків, електростатичної взаємодії і сано високоспецифічні нуклеїнові кислоти-ліганди, текучості. Такі модифікації включають (але не общо містять один або декілька нуклеотидів, модимежуючись ними) модифікації цукру в 2'фікованих за допомогою 2'-аміногрупи (2'-NH2), 2'положенні, модифікації піримідину в 5-положенні, фтору (2'-F) і/або 2'-О-метилу (2'-Оме). [У заявці на модифікації пурину в 8-положенні, модифікації патент US сер. №08/264029, зареєстрованій 22 екзоциклічних амінів, заміну 4-тіоуридину, заміну червня 1994 р.], на цей час абандованій, озаглав5-бром- або 5-йодурацилу; модифікації каркаса, леній "Novel Method of Preparation of Known ana метилування, незвичні комбінації спарювання осNovel 2' Modified Nicleosides by Intramolecular нов, таких як ізооснови ізоцитидин та ізогуанідин і Nucleophilic Displacement", описано олігонуклеотит.п.Модифікації також можуть включати 3'-и 5'ди, які містять різні 2'-модифіковані піримідини. модифікації, такі як кепінг. У бажаних варіантах SELEX-метод передбачає об'єднання відібраздійснення даного винаходу нуклеїнові кислотиних олігонуклеотидів з іншими відібраними оліголіганди являють собою молекули РНК, 2'-фтор-(2'нуклеотидами і не олігонуклеотидними функціонаF)-модифіковані на залишкові цукру піримідинових льними ланками, як це описано [в патенті US фрагментів. №5637459, озаглавленому "Systematic Evolution of Модифікації можуть являти собою модифікаLigands by Exponential Enrichment: Chimeric ції, які здійснюють до або після SELEX-методу. SELEX" і в патенті US №5683867 озаглавленому Модифікації, що здійснюють до SELEX-методу, "Systematic Evolution of Ligands by Exponential дозволяють одержати нуклеїнові кислоти-ліганди, Enrichment: Blended SELEX"] відповідно. Згідно з які мають як специфічність щодо SELEX-мішені, наведеними у цих заявках методами можна поєдтак і поліпшену стабільність in vivo. Модифікації 2'нувати широку розмаїтість форм та інших властиОН-нуклеїнових кислот-лігандів, які здійснюють востей олігонуклеотидів і їхньої здатності до ефекпісля SELEX-методу, дозволяють досягти поліптивної ампліфікації і реплікації з потрібними шеної стабільності in vivo без необхідності впливу властивостями інших молекул. на здатність до зв'язування нуклеїнових кислот[У патенті US №5496938] описано методи оделігандів. ржання за допомогою SELEX нуклеїнових кислотФахівцям у даній галузі відомі й інші модифілігандів з поліпшеними характеристиками. Цей кації. Такі модифікації можуть бути здійснені після патент, озаглавлений "Nucleic Acids Ligands to HIVSELEX-методу (модифікації раніше виявлених RT and HIV-1 Rev", спеціально включено в даний немодифікованих лігандів) або включені в процес опис як посилання. здійснення SELEX-методу. [У заявці на патент US №08/434425, зареєстНуклеїнові кислоти-ліганди за даним винахорованій 3 травня 1995p., озаглавленій "Systematic дом одержують за допомогою описаного вище Evolution of Ligands by Exponential Enrichment: SELEX-методу і в основному з використанням заяTissue SELEX"], на цей час [патент US №5789157], вок на патент, що стосуються SELEX, які повністю описано методи ідентифікації нуклеїнових кислотвключені в даний опис як посилання. лігандів до макромолекулярних компонентів ткаАптамери тенасцину-С за даним винаходом нини, включаючи ракові клітини, і нуклеїнові кисзв'язуються з гепаринзв'язувальним сайтом СОлоти-ліганди, виявлені за допомогою цих методів. ОН-кінця тенасцину-С. Цей патент спеціально включено в даний опис як Згідно з деякими варіантами здійснення данопосилання. го винаходу описані нуклеїнові кислоти-ліганди Одна з потенційних проблем, пов'язана із затенасцину-С застосовують для діагностичних цістосуванням нуклеїнових кислот у діагностичних лей, і вони можуть застосовуватися для візуалізаабо терапевтичних цілях, полягає в тім, що олігоції патологічних станів (таких як візуалізація пухнуклеотиди у вигляді фосфодіефірів ще до виявлин людини). Крім діагностики, нуклеїнові кислотилення їх потрібного впливу можуть швидко розщеліганди тенасцину-С застосовують для прогнозу й плюватися в загальній воді організму під дією моніторингу хворобливих станів, при яких відбувавнутрішньоклітинних і позаклітинних ферментів, ється експресія тенасцину-С. таких як ендонуклеази та екзонуклеази. Для підДля діагностичних агентів потрібно лише, щоб вищення стабільності in vivo нуклеїнових кислотвони дозволяли виявляти наявність даної мішені в лігандів або для підвищення чи зміни характерисконкретному локусі або у певній концентрації. Для тик при введенні нуклеїнових кислот-лігандів можініціації позитивного сигналу для цілей діагностики на використовувати певні хімічні модифікації нукможе бути достатньою тільки наявність здатності леїнових кислот-лігандів [див., наприклад, заявку утворювати єднальні пари з мішенню. Фахівцям у на патент US сер. №08/117991, зареєстровану 8 даній галузі має бути очевидним, як адаптувати вересня 1993р.], на цей час абандовану, і [патент будь-яку нуклеїнову кислоту-ліганд тенасцину-С за US №5660985], обидва документи озаглавлені допомогою відомих у даній галузі методів для "High-Affinity Nucleic Acids Ligands Containing включення маркера, для того щоб виявити присутModified Nucleotides", які спеціально включено в ність нуклеїнової кислоти-ліганду. Такий маркер даний опис як посилання. Модифікації нуклеїнових можна застосовувати в різних діагностичних прокислот-лігандів за даним винаходом включають цедурах, таких як виявлення первинних і метаста(але не обмежуючись ними) модифікації, які притичних пухлин і атеросклеротичних ушкоджень. водять до одержання інших хімічних груп, що наПрикладами маркерів-міток за даним винаходом є дають основам нуклеїнової кислоти-ліганду або технецій-99m і 111Іn, однак інші маркери, такі як 19 75578 20 інші радіонукліди, магнітні сполуки, флуорофори, 1997p.], яку повністю включено в даний опис як біотин і т.п., можуть бути включені в кон'югати з посилання, серед іншого також описано проліки, нуклеїновою кислотою-лігандом тенасцину-С для основою яких є нуклеотиди, що включають нуклеївізуалізації in vivo або ex vivo хворобливих станів, нові кислоти-ліганди, мішенню яких є пухлина, при яких відбувається експресія тенасцину-С (нанаприклад тенасцин-С, призначені для точної лоприклад, раку, атеросклерозу іпсоріазу). Маркер калізації хеморадіосенсибилізаторів і радіосенсиможе бути ковалентно зв'язаний з різними полобилізаторів та інших радіотерапевтичних агентів женнями в нуклеїновій кислоті-лігандові тенасцидля пухлини. ну-С, такими як екзоциклічна аміногрупа основи, 5Також мається на увазі, що як маркер, так і теположення піримідинівого нуклеотиду, 8рапевтичний агент можуть бути зв'язані з нуклеїположення пуринового нуклеотиду, гидоксильна новою кислотою-лігандом тенасцину-С для так, група фосфату або гідроксильна група, або інші щоб виявлення хворобливого стану і введення групи на 5'- або 3'-кінцях нуклеїнової кислотитерапевтичного агента здійснювати одночасно з ліганду тенасцину-С. У варіантах здійснення, у використанням одного аптамера або суміші двох яких маркер являє собою технецій-99m або 111Іn, або більшої кількості різних модифікованих версій його бажано зв'язують з 5'- або 3'-гідроксилом фоодного аптамера. Також мається на увазі, що або сфатної групи або з 5-положенням модифікованомаркер і/або терапевтичний агент, або вони обоє го піримідину. Згідно із найбільш бажаним варіанможуть бути зв'язані з неімуногенною високомолетом здійснення маркер зв'язують з 5'-гідроксилом кулярною сполукою або ліпофільною сполукою, фосфатної групи нуклеїнової кислоти-ліганду за такою як ліпосома. Методи одержання кон'югатів допомогою лінкера або без нього. Згідно з іншим нуклеїнових кислот-лігандів з ліпофільними сполуваріантом здійснення маркер кон'югують з нуклеїками або неімуногенними сполуками в комплексах, новою кислотою-лігандом шляхом включення піпризначених для діагностики або терапії, описано римідину, який містить первинний амін у 5[в заявці на патент US сер. №08/434465, зареєстположенні, і застосування аміну для кон'югації з рованій 4 травня 1995p.], озаглавленій "Nucleic маркером. Приєднання маркера можна здійснюваAcid Ligand Complexes", яка повністю включена в ти безпосередньо або за допомогою лінкера. В даний опис як посилання. одному з варіантів, коли у функції маркера застоНаведені в даному описові діагностичні або совують технецій-99m або 111Іn, бажаним лінкером терапевтичні композиції можна вводити парентеє гексиламінний лінкер, наведений на Фіг.10. рально за допомогою ін'єкції (наприклад, внутрішЗгідно з іншими варіантами нуклеїнову кислоньовенно, підшкірно, внутрішньодермально, всету-ліганд тенасцину-С застосовують для введення редину ушкодження), хоча також можна терапевтичних сполук включаючи (але не обмезастосовувати інші ефективні форми введення, жуючись ними) цитотоксичну сполуку, речовини, такі як внутрішньосуглобна ін'єкція, аерозолі для що підвищують імунітет, і терапевтичні радіонукліінгаляції, активні при пероральному введенні комди) для тканин або органів, у яких відбувається позиції, трансдермальні іонофоретичні композиції експресія тенасцину-С. Хворобливі стани, при яких або супозиторії їх також можна наносити місцево може відбуватися експресія тенасцину-С, включашляхом безпосередньої ін'єкції, вони можуть вивіють (але не обмежуючись ними) рак, атеросклероз льнятися з пристроїв, таких як імплантовані стенти і псоріаз. Фахівцеві в даній галузі ясно, як можна або катетери, або їх можна вводити безпосередадаптувати будь-яку нуклеїнову кислоту-ліганд ньо в мішень за допомогою інфузійного насоса. тенасцину-С за допомогою відомих у даній галузі Одним із бажаних носіїв є фізіологічний розчин, методів включення терапевтичної сполуки в комале мається на увазі, що можна також застосовуплекс. Терапевтична сполука може бути ковалентвати інші фармацевтично прийнятні носії. Згідно з но зв'язаною з різними положеннями нуклеїнової одним із варіантів носій і комплекс, який включає кислоти-ліганду тенасцину С, такими як екзоциклінуклеїнову кислоту-ліганд тенасцину-С і терапевчна аміногрупа основи, 5-положення піримідинівотичний агент, являють собою фізіологічно сумісну го нуклеотиду, 8-положення пуринового нуклеотикомпозицію з повільним вивільненням. Первинний ду, гідоксильна група фосфату або гідроксильна розчинник у такому носієві за своєю природою група, або інші групи на 5'- або 3'-кінцях нуклеїноможе бути або водним, або неводним. Крім того, вої кислоти-ліганду тенасцину-С. Згідно з бажаним носій може включати інші фармакологічно прийняваріантом здійснення терапевтичний агент зв'язутні ексципієнти для зміни або підтримки значення ють з 5'-аміном нуклеїнової кислоти-ліганду. ПриєрН, осмотичного тиску, в'язкості, прозорості, коднання терапевтичного агента можна здійснювати льору, стерильності, стабільності, швидкості розбезпосередньо або за допомогою лінкера. У варічинення або запаху композиції. Аналогічно до цьоантах, у яких хвороба-мішень являє собою рак, 5го носій може також включати ще й інші флуородезоксіурацил або інші нуклеотидні аналофармакологічно прийнятні ексципієнти для зміни ги, для яких виявлено активність щодо пухлин, або підтримки стабільності, швидкості розчинення, можуть бути включені всередину в урацили (U), які вивільнення чи абсорбції нуклеїнової кислотиіснують у нуклеїнових кислотах-лігандах тенасциліганду тенасцину-С. Такі ексципієнти являють ну-С, або додані всередину чи кон'юговані з будьсобою субстанції, які зазвичай застосовують для яким кінцем або безпосередньо, або через лінкер. виготовлення дозованих форм для парентеральКрім того, можна включати як піримідинові аналоги ного введення або у вигляді стандартних доз, або 2',2'-дифлоуроцитидину, так і пуринові аналоги у вигляді форм, що включають декілька доз. (дезоксикоформіцин). [У заявці на патент США Після приготування терапевтичної або діагносер. №08/993765, зареєстрованій 18 грудня стичної композиції й можна зберігати в стерильних 21 75578 22 14 пляшечках у вигляді розчину, суспензії, гелю, ему3 10 молекул. Афінність окремих лігандів до тельсії, твердого або дегідратованого чи ліофілізонасцину-С визначали стандартними методами за ваного порошку. Такі композиції можна зберігати допомогою розподілення на нітроцелюлозному або у вигляді форми, готової до застосування, або фільтрі (Tuerk і Gold, Science, 249(4968): 505-510 у вигляді форми, яку потрібно піддавати віднов(1990)). ленню безпосередньо перед уведенням. Шлях Для кожного SELEX-циклу планшети Луміно введення композицій, які містять нуклеїнові кисло(фірма Labsystems, Нідхем Хеїтс, штат Мінесота) ти-ліганди тенасцину-С, призначені для системносенсибілізували протягом 2год. з використанням го введення, може бути підшкірним, внутрішньо200мкл ЗФР Дульбекко, який містить концентрації м'язовим, внутрішньовенним, інтрадермальним, тенасцину-С, що наведені в таблиці 1. Після сенінтраназальним або за допомогою вагінальних чи сибілізації лунки блокували з використанням ректальних супозиторіїв. HBSMC+буфер [20мМ Hepes, pH 7,4, 137мМ NaCl, Нижче винахід пояснюється на прикладах, які 1мМ СаСl2, 1мМ MgCl2 і 1г/л людського сироватконе обмежують його обсягу. У прикладі 1 описано вого альбуміну (фірма Sigma, фракція V)] протягом матеріали та експериментальні процедури, засто1-6 циклу, а в 7 і 8 циклі лунки блокували з викорисування яких описано в прикладі 2, для одержання станням суміші HBSMC+буфер, який містить 1г/л РНК-лігандів до тенесцину-С. У прикладі 2 описано казеїну (1-блок; фірма Тrоріх). Буфер для зв'язуРНК-ліганди до тенесцину-С і передбачену втовання і промивання містив HBSMC+буфер, який ринну структуру вибраної нуклеїнової кислотивключає 0,05% твін 20. Для кожного циклу SELEX ліганду. У прикладі 3 описано визначення мінімаРНК розбавляли в 100мкл буфера для зв'язування льного розміру, необхідного для високоафінного та інкубували протягом 2год. при 37°C в сенсибілізв'язування вибраної нуклеїнової кислоти-ліганду, і зованих протеїном лунках, які попередньо промизаміну 2-ОН-пуринів на 2'-Оме-пурини. У прикладі вали буфером для зв'язування. Після зв'язування 4 описано біорозподілення мічених за допомогою здійснювали шестиразове промивання, використоТс-99m нуклеїнових кислот-лігандів тенасцину-С у вуючи щораз по 200мкл. Після стадії промивання мишей-носіїв пухлин. У прикладі 5 описано застосуху лунку поміщали на 5хв. на верхню частину сування флуоресцентноміченої нуклеїнової кислонагрівального блоку з температурою 95°С. Станти-ліганду тенасцину-С для локалізації тенасцинудартні реакції з використанням зворотної транскС всередині ураженою пухлиною тканини. У прикриптази AMV (вірус мієлобластоза птахів) (50мкл) ладі 6 описано виявлення пухлин in vivo за допоздійснювали при 48°С безпосередньо в лунці, і могою аптамера ТТА1 (також відомого як GS7641). продукти реакції використовували для стандартної У прикладі 7 описано альтернативний варіант міПЛР і реакцій транскрипції. Два синтетичних прай111 чення за допомогою Іn. мери 5N7 (див. вище) і 3N7a: 5'Приклади TCGCGCGAGTCGTCTTG-3' (SEQ ID NO:3) викоПриклад 1. Застосування SELEX для одерристовували для стадій ампліфікації та зворотної жання нуклеїнових кислот-лігандів до тенасцину-С транскрипції цих матриць. і до клітин гліобластоми лінії 251. Для здійснення клітинного SELEX клітини Матеріали і методи людської гліобластоми лінії U251 (Hum. Hered., 21: Тенасцин-С одержували від фірми Chemicon 238 (1971)) вирощували до конфлюентності в мо(Темекула, штат Каліфорнія). Одноланцюгові ДНКдифікованому за методом Дульбекко середовищі праймери і матриці були синтезовані на фірмі Ігла, доповненому 10% фетальної телячої сироваОреron Technologies Inc. (Аламеда, штат Каліфортки (фірма GIBCO BRL, Геттисберг, Меріленд), у 6нія). лункових планшетах для культури тканини (Becton SELEX-метод докладно описано у заявках на Dickinson Labware, Лінкольн-Парк, штат Ньюпатент, які стосуються SELEX. Дволанцюгові матДжерсі) і тричі промивали буфером, який містить риці для транскрипції одержували в цілому шляЗФР Дульбекко, доповнений СаСl2 (ДЗФР, фірма хом подовження за допомогою фрагмента КленоGIBCO BRL). РНК, у яку шляхом транскрипції ввова олДНК 40N7a: дили внутрішню мітку (Fitzwater (1996), вище), ін5'-TCGCGCGAGTCGTCTG[40N]CCGCATCGTCCTCCC-3' кубували з клітинами при 37°C протягом 1год. По(SEQ ID NO:1) за допомогою праймера 5N7: тім мічену РНК видаляли і клітини промивали 5'-TAATACGACTCACTATAGGGAGGACGATGCGGДЗФР 6 разів по 10хв. при 37°С. Потім додавали 3' (SEQ ID NO:2), що містить промотор полімерази ДЗФР, що містить 5мМ ЕДТК, і інкубували з клітифага Т7 (підкреслений). РНК одержували за допонами протягом 30хв. із метою елюювання зв'язамогою РНК-полімерази фага Т7 за методом, [опиних РНК, які зберігалися після стадій промивання. саним раніше в Fitzwater і Polisky, Method Цю РНК оцінювали кількісно за допомогою станEnzymol., 267: 275-301 (1996)], публікація повністю дартного протоколу з використанням рідинного включена в даний опис як посилання. Усі реакції сцинтиляційного лічильника й ампліфікували за транскрипції здійснювали в присутності піримідидопомогою ЗТ-ПЛР. нових нуклеотидів, 2'-фтор(2'-F)-модифікованих на Аналіз зв'язування з клітинами U251. РНК із цукровому фрагменті. Ця заміна сприяє підвищевнутрішньою міткою інкубували з підвищувальниній стійкості до рибонуклеаз, які використовують ми концентраціями конфлюентних клітин U251 у 62'-гідроксильну групу для розщеплення фосфоділункових планшетах для культури тканини (фірма ефирного зв'язку. Зокрема, кожна суміш для транBecton Dickinson Labware, Лінкольн-Парк, штат скрипції містила 3,3мМ 2'-F-УТФ і 3,3мМ 2'-F-ЦТФ Нью-Джерсі) при 37°С протягом 60хв. Незв'язану поряд із 1мМ ЦТФ і АТФ. Початкова випадкова РНК відмивали за допомогою трьох 10-хвилинних бібліотека РНК, отримана таким чином, включала промивань ДЗФР+СаСl2 при 37°С и зв'язану РНК 23 75578 24 збирали шляхом руйнування клітин за допомогою аналізували шляхом клонування і секвенування трізолу (фірма GIBCO BRL, Геттисберг, Меріленд). лігандів, отриманих після 8-ого циклу SELEXЗв'язану РНК кількісно оцінювали за допомогою експерименту з використанням очищеного тенасрідинного сцинтиляційного лічильника. цину-С ("TN"-послідовності), після 9-ого циклу Клонування і секвенування. Ампліфіковані пуSELEX-експерименту з використанням клітин лінії ли олігонуклеотидів з підвищеною афінністю очиU251 ("Е9"-послідовності) і після 2-ого циклу гібрищували на 8%-вому поліакриламідному гелі, здійсдного SELEX-експерименту з використанням нювали зворотне транскрибування з одержанням U251/тенасцину-С ("Е9Р2"-послідовності). ПосліолДНК і ДНК ампліфікували методом полімеразної довності 34 унікальних клонів наведено в таблиці ланцюгової реакції (ПЛР) за допомогою праймерів, 3, і їх можна розділити на 2 основні групи ліганди що містять сайти, розпізнавані рестриктазами тенасцину-С ("TN"- і "Е9Р2"- послідовності) і ліганВаmНІ і Hindlll. ПЛР-фрагменти клонували, одерди клітин лінії U251 ("Е9"-ліганди). Серед лігандів жували плазміди й аналіз послідовності здійснютенасцину-С більшість клонів (всього 65) представали за допомогою стандартних методів влено одним із двох різних класів послідовностей, [Sambrook та ін. (1989) Molecular Cloning: A позначених як сімейство І і сімейство II (Фіг.1). Laboratory Manual, 2-е вид. 3 тому, Cold Spring Оцінка варіабельної ділянки 12 клонів сімейстHarbor Laboratory Press, Cold Spring Harbor]. ва І дозволила виявити наявність 7 унікальних Приклад 2. РНК-ліганди до тенасцину-С. послідовностей, споріднених із консенсусною посНуклеїнові кислоти-ліганди до клітин U251 лідовністю GACNYUUCCNGCYAC (SEQ ID NO:12) одержували за допомогою SELEX-методу, описаОцінка варіабельної ділянки 18 клонів сімейства II ного [в заявці на патент США №08/434425, зареєсдозволила виявити послідовності, які містять контрованій 3 травня 1995p., озаглавленій "Systematic сенсусну послідовність CGUCGCC (таблиця 3) Е9Evolution of Ligands by Exponential Enrichment: послідовності можна згрупувати в споріднений Tissue SELEX"], на цей час [патент US №5789157]. набір за ознакою наявності консервативних посліДалі підтверджували, що отримані ліганди являли довностей GAY і CAU всередині варіабельних обсобою нуклеїнові кислоти-ліганди тенасцину-С. ластей. Для послідовностей, що залишилися, не З метою одержання олігонуклеотидних ліганвиявлено споріднення з іншими послідовностями, і дів до людського тенасцину-С здійснювали 8 циквони були класифіковані як "сирітські" Домінують лів SELEX із використанням рандомізованої біблітри послідовності Е9Р2-1, Е9Р2-2 і TN9, для яких отеки нуклеотидів, як описано в розділі "Матеріал і частота, з якою вони зустрічаються, становить 14, методи". РНК і протеїн, які використовували в кож16 і 10 разів відповідно У категорії "сирітських поснім циклі, наведено в таблиці 1. Після 8 циклів лідовностей" одна послідовність, TN18, представSELEX афінність пула олігонуклеотидів до тенаслена двічі У цілому ці дані свідчать про збагачений цину-С становила 10нМ, і ця афінність не збільшуу значній мірі пул послідовностей. валася при використанні додаткових циклів Для більшості зразків установлені наномолярSELEX. ні значення констант дисоціації, при цьому три З метою одержання лігандів до клітин гліобланайбільш превалюючі послідовності TN9, Е9Р2-1 і стоми U251 здійснювали 9 циклів SELEX із викоЕ9Р2-2 мають найбільш високі рівні афінності при ристанням рандомізованої бібліотеки нуклеотидів. 5нМ, 2нМ і 8нМ (таблиця 3). Ці результати свідПісля 9 циклів зв'язування з клітинами лінії U251 і чать про те, що SELEX із використанням клітин елюювання за допомогою ЕДТК продукти циклів 3, U251 дозволяє створити пул аптамерів до тенас5 і 9 тестували щодо здатності зв'язуватися з кліцину-С, і що тільки два цикли SELEX потрібні для тинами лінії U251. На Фіг.1 показано, що зі збільвиділення специфічних для тенасцину лігандів із шенням кількості циклів SELEX кількість зв'язаної SELEX-пула, отриманого з використанням клітин. РНК, узятої у певній концентрації, також зростає. Олігонуклеотидні ліганди до інших протеїнів анаЧерез складність тканини-мішені неможливо оцілогічним чином можуть бути виділені з Е9-пула з нити афінність олігонуклеотидних пулів щодо невикористанням у функції мішеней очищених провідомих молекул-мішеней на цих клітинах. теїнів. Потім пул Е9 (9 циклів зв'язування і елююванПриклад 3. Визначення мінімального розміру ня ЕДТК із клітин лінії U251) використовували як TN9 і заміна 2'-ОН-пуринів на 2'-ОМе-пурини синвихідну точку для здійснення SELEX із використез аптамера ТТА1. танням очищеного тенасцину-С. Здійснювали 2 Методи синтезу олігонуклеотидів є стандартцикли SELEX із використанням очищеного тенасними для фахівців у даній галузі (Green та ін., цину-С згідно з описаним раніше методом. ЗастоChem Biol 2(10) 685-695 (1995)) Мономери 2'совувані для двох циклів SELEX концентрації профторпіримідинфосфорамідиту одержували від теїну та РНК (Е9Р1 і Е9Р2) наведено в таблиці 2. фірми JBL Scientific (Сент-Луїс Обіспо, штат КаліУ цілому здійснювали три різних SELEXфорнія), 2-ОМе-пурин, 2'-ОН-пурин, гексиламін і експерименти: експеримент із використанням у (СН2СН2О)6-мономери, а також тверду основу з функції мішені очищеного тенасцину-С, експериdT-полістиролу одержували від фірми Glen мент із використанням у функції мішені клітин гліResearch (Стерлінг, штату Віргінія). Афінність апобластоми лінії U251 і експеримент, у якому тамерів оцінювали на основі розподілення на нітSELEX-пул із клітин гліобластоми лінії U251 застороцелюлозному фільтрі (Green та ін, вище). совували для ініціації SELEX-експерименту, у якоTN9 вибрано для додаткового аналізу на осму як мішень використовували очищений тенові його високої афінності до тенасцину-С Спочанасцин-С. тку визначали мінімальний розмір послідовності, Продукти всіх трьох SELEX-експериментів потрібний для високоафінного зв'язування. За до 25 75578 26 помогою стандартних методів (Green та ін., вище) додаванням лінкера (СН2СН2СО)6 (спейсер 18), 3'встановлено, що нуклеотиди, розташовані від 3'3'-дТ-кепу для захисту від екзонуклеази, 5'кінця до нуклеотиду 55, необхідні для зв'язування гексиламіну (таблиця 4) і всіх пуринів у вигляді 2'з тенасцином-С, при цьому жоден нуклеотид не ОМе-пуринів за винятком 5G, зазначених у таблиці може бути вилучений з 5'-кінця без втрати афінно4. Контрольний аптамер TTA1.NB, який не має сті. Для додаткового зменшення довжини TN9 до здатності до зв'язування, одержували шляхом деменш ніж 55 нуклеотидів зі збереженням високоалеції 5 нуклеотидів на 3'-кінці, одержуючи тим сафінного зв'язування було здійснено спробу визнамим TTA1.NB. ТТА1 зв'язується з тенасцином-С, чити внутрішні делеції TN9. Дані про перші 55 нукпри цьому константа рівноваги дисоціації (Kd) сталеотидів TN9 поряд із даними про перші 55 новить 5нМ, у той час як для TTA1.NB Kd для тенуклеотидів лігандів TN7, TN21 і TN41 із спорідненасцин-С>5мкМ. ного сімейства II вводили в комп'ютерну програму Нуклеотиди 1-26 можна заміняти ненуклеотидля визначення можливої двомірної укладки РНК дним етиленглікольним лінкером. Звідси можна (mfold 3.0, можна одержати за адресою припустити, що ТТА1 можна синтезувати у вигляді http://www.ibc.wustl.edu/~zuker/. Μ. Zuker, D. Η. двох окремих фрагментів, для цього інтродукують Mathews і D. Η. Turner Algorithms and розрив у положенні етиленлікольного лінкера та Thermodynamics for RNA Secondary Structure інтродукують нові 5'- і 3'-кінці. Після синтезу дві Prediction: A. Practical Guide, у RNA Biochemistry молекули інкубують разом, дозволяючи утворитиand Biotechnilogy, J. Barciszewski і В.F.С. Clark ся гібридові. Цей метод дозволяє інтродукувати (ред-ри), NATO ASI Series, Kluwer Academic додаткові аміногрупи, а також нуклеотиди на нові Publishers (1999)). Серед багатьох можливих укла5'- і 3'-кінці. Ці нові функціонально активні молекудок РНК, передбачених за допомогою алгоритму, ли можна використовувати для біокон'югації. Крім було виявлено структуру, загальну для всіх оліготого, синтез із використанням двох фрагментів нуклеотидів. Ця структура, представлена олігонукдозволяє підвищити вихід хімічного синтезу через леотидом ТТА1 на Фіг.2, містить три стебла, що укорочення довжини молекул. сходяться в одному стику, так званому тристеблоПриклад 4. Біорозподілення мічених за доповому стику. Ця укладка приводить до того, що могою Тс-99m аптамерів в організмі мишей-носіїв найбільш консервативні нуклеотиди із сімейства II пухлини. олігонуклеотидів знаходяться в зоні стику. При Біорозподілення аптамерів оцінювали шляхом порівнянні TN9, TN7, TN21 і TN41 виявилося, що кон'югації хелатора Тс-99m (Ні15; Hilger та ін., Tet. друге стебло є варіабельним за довжиною і посліLett. 39:9403-9406 (1998)) з 5'-кінцем олігонуклеодовністю, що дозволяє припустити, що подовжентиду, як показано на Фіг.2, і радіоактивного мічення другого стебла не потрібне для зв'язування з ня аптамера за допомогою Тс-99m. Аптамер у витенасцином-С. При апробації цієї гіпотези на TN9 гляді міченого за допомогою Тс-99m аптамера було встановлено, що нуклеотиди 10-26 можна наведено на Фіг.10. ТТА1 і TTA1.NB кон'югували з заміняти на етиленглікольний лінкер (СН2СН2О)6. Hi15 у концентрації аптамера 50мг/гл у 30%-вому Лінкер служить як замінник петлі й знижує розмір диметилформаміді з 5 молярними еквівалентами аптамера. Крім того, петлі, що складаються з 4 Ні15-N-гідроксисукциніміду, забуференого в 100мМ нуклеотидів (CACU або GAGA), які заміняють нукнатрій-бораті, рН9,3, протягом 30хв. при кімнатній леотиди 10-26, дозволяють одержати послідовнотемпературі. Аптамер у вигляді міченого за допості, що мають високу афінність стосовно тенасцимогою Тс-99m аптамера наведено на Фіг.10. Після ну-С. Фахівцеві в даній галузі має бути очевидним, очищування за допомогою РХВД зі зверненою як визначити інші нуклеотидні петлі або інші спейфазою одержували Ні15-ТТА1 і Hi15-TTA1.NB. Потім сери, що можуть заміняти нуклеотиди 10-26, з олігонуклеотиди мітили за допомогою Тс-99m у одержанням послідовностей, які мають високу такий спосіб: до 1нмолю Ні15-аптамера додавали афінність стосовно тенасцину-С. 200мкл 100мМ натрій-фосфатного буфера, рН8,5, З метою підвищення захисту від нуклеазної 23мг/гл тартрату натрію і 50мкл пертехнетату Тсактивності було виявлено локалізацію пуринів, які 99m (5,0мКи), елюйованого із колонки Мо-99 (фірможна заміняти відповідними 2'-ОМе-пуринами. ма Syncor, Денвер) за 12год. до застосування. РеОлігонуклеотиди довільно розділяли на 5 секторів акцію мічення ініціювали, додаючи 10мкл розчину і всі пурини в кожнім секторі заміняли відповідним SnCl2 з концентрацією 5мг/гл. Реакційну суміш 2'-ОМе-пуриновим нуклеотидом, усього викорисінкубували протягом 15хв. при 90°С. Реакційну товували 5 олігонуклеотидів (таблиця 4, стадія І суміш відокремлювали від Тс-99m, який не проресинтезу). Визначали афінність кожного олігонуклеагував, шляхом спін-діалізу через мембрану з граотиду стосовно тенасцину-С, при цьому було ничним розміром молекулярної маси, що пропусвстановлено, що всі пурини в секторах 1, 3 і 5 мокається, 30000Да (тип Centrex, фірма Schleicher & жна заміняти без помітної втрати афінності. Потім Scheull) із двома 300-мікролітровими промиванняіндивідуальні пурини в секторах 2 і 4 заміняли 2'ми. Цей протокол мічення забезпечує введення ОМе-пуринами й оцінювали вплив на афінність 30-50% Тс-99m, що дозволяє одержати питому (таблиця 4, стадія III синтезу). Із цих експериментів активність 2-3мКи/нмоль РНК. Tc-99m зв'язується установлено, що заміна нуклеотидів G9, G28, G31 через 5'G, що видно на Фіг.5. і G34 на 2'-OMe-G приводить до втрати афінності Для експериментів із біорозподілення одержустосовно тенасцину-С. Отже, ці пурини повинні вали ксентрансплантати пухлин лінії U251 у такий бути збережені у вигляді 2'-ОН-пуринів в аптамері спосіб: клітини лінії U251 культивували в модифіТТА1. кованому за методом Дульбекко середовищі Ігла, Потім синтезували аптамер ТТА1 (таблиця 4) з доповненому 10об.% фетальної телячої сироватки 27 75578 28 (фірма Gibco BRL, Геттисберг, Меріленд). Безтиописаним вище методом. Безтимусним мишам мусним мишам (фірма Harlan Sprague Dawley, Інуводили за допомогою внутрішньовенної ін'єкції діанаполіс, штат Іллінойс) ін'єкували підшкірно 5нМ TTA1-Red або ТТА1 NB-Red і через потрібний проміжок часу мишей піддавали анестезії, здійс1 106 клітин лінії U251. Коли пухлини досягали нювали перфузію 0,9%-вим NaCl і умертвляли. розміру, що відповідає 200-300мг (1-2 тижня), ввоПухлину вирізували і поміщали у формалін. Після дили шляхом внутрішньовенної ін'єкції мічений за витримування протягом 24год. у формаліні робили допомогою Тс-99m аптамер із розрахунку середовище товщиною 10мкМ і Rhodamine-Red-X 3,25мг/кг. У зазначений час тварин анестезували виявляли за допомогою флуоресцентного мікросза допомогою ізофлурану (фірма Fort Dodge копа (типу Eclipse T800, фірма Nikon, Японія). Animal Health, Форт-Додж, штат Айова), брали зраРезультати: афінність до тенасцину-С TTA1зки крові за допомогою серцевої пункції і тварин Red виявилася ідентичною з афінністю некон'югоумертвляли і брали зразки тканини. Рівні Тс-99m ваного батьківського аптамера ТТА1 і становила оцінювали за допомогою лічильника гама5нМ. Було проведено порівняння рівнів флуореспроменів (фірма Wallac Oy, Турку, Фінляндія). Погценції TTA1-Red або ТТА1 NB-Red у пухлинах челинання аптамера тканинами оцінювали у вигляді рез 10хв. після ін'єкції. Аптамер TTA1-Red, здатвідсотка від ін'скованої дози на г тканини (% ІД/г). ний до зв'язування, викликав виражене Зображення мишей одержували за допомогою офарблювання пухлини, але не тканини, що прирентгенівської камери. Мишей поміщали в камеру лягає (Фіг.4). На противагу цьому, при використан(фірма Siemens, LEM+) під анестезією (ізофлуран). ні ТТА1 NB-Red виявлено лише самофлуоресценОдержували дані (30с.-10хв.) і аналізували за доцію тканини. Ці результати демонструють помогою програми Nuclear MAC, версія 3.22.2 (фіможливість застосування аптамера для виявлення рма Scientific Imaging, штат Каліфорнія) з використенасцину-С in vivo, аналогічним чином аптамер танням комп'ютера типу Power МАС G3 (фірма можна використовувати для офарблювання зрізів Apple Computer, штат Каліфорнія). тканин ex vivo. Наведені в таблиці 5 дані експериментів із біПриклад 6. Виявлення пухлин in vivo за допоорозподілення свідчать про швидке й специфічне могою аптамера ТТА1 (який на сьогоднішній день поглинання аптамера тканиною пухлини; незв'язатакож позначають як GS7641) додаткові типи пухний аптамер не зберігався в пухлині. Рівні Тс-99m лин. у крові також швидко знижувалися. При викорисМічення аптамера, біорозподілення й одертанні Ні15-ТТА1 через 3год. час напівжиття Тс-99m жання ксенотрансплантатів безтимусних мишей у пухлині виявився дуже тривалим (>18год.). Це здійснювали згідно з прикладом 4. свідчить про те, що після проникнення аптамера в Відомо, що багато типів людських пухлин експухлину радіоактивна мітка зберігається в пухлині пресують тенасцин-С. Для оцінювання можливості протягом тривалих періодів часу. Ці дані свідчать TTA1/GS7641 виявляти типи пухлин, крім гліоблапро те, що цитотоксичні агенти, включаючи радіостом вирощували лінії клітин пухлин людини у винукліди і нерадіоактивні агенти, кон'юговані з апгляді пухлин у безтимусних мишах. Тестували ткатамером, також повинні зберігатися в пухлині і нини пухлин щодо людського тенасцину-С і ті мати довгі періоди напівжиття. пухлини, у яких відбувалася експресія людського Радіоактивність Тс-99m також присутня в інтенасцину-С, тестували щодо поглинання аптамеших тканинах, особливо в тонкій і товстій кишці. ра. На Фіг.6 показане поглинання аптамера деякиФахівці в даній галузі можуть легко змінити встами пухлинами, включаючи гліобластому, рак моновлену схему гепатобіліарного кліренсу, наприлочної залози, колоректальний рак і клад, змінюючи гідрофільність хелатора Тс-99m, рабдоміосаркому. Специфічне поглинання пухлизмінюючи хелатор або змінюючи всю пару радіоаною продемонстровано шляхом порівняння здатктивний метал/хелатор. ного до зв'язування аптамера (TTA1/GS7641) і Зображення всієї тварини одержували через такого, що не має здатності до зв'язування, апта3год. після ін'єкції міченого за допомогою Тс-99m мера (ТТА1 NB). Слід зазначити, що для KB, тобто Нi15-ТТАІ. На зображеннях мишей, яким ін'єкували ксенотрансплантата, який експресує мишачий, а Hi15-TTA1, на відміну від мишей, яким ін'єкували не людський TN-C, не виявлено поглинання аптаНi15-ТТАІ NB, було ясно видно пухлини (Фіг.3) Домера пухлиною. Цей експеримент дозволяє пошидаткову радіоактивність виявлено в шлунковорити дані, отримані для гліобластоми, на інші каркишковому тракті, як це і було передбачено за доциноми й саркоми, а також свідчить про те, що всі помогою експериментів із біорозподілення. пухлини, які експресують людський тенасцин-С, Приклад 5. Застосування флуоресцентномічепоглинають TTA1/GS7641. ного ТТА1 для локалізації тенасцину-С у тканині Приклад 7. Інший варіант мічення з викориспухлини. танням In111. Матеріали і методи. Досліди з одержання ксенотрансплантатів пуТТА1 і ТТА1 NB синтезували за описаним вихлин і з біорозподілення здійснювали згідно з прище методом. Сукцинімідил-Rhodamine-Red-X (фікладом 4. Для кон'югації DTPA і DOTA з рма Molecular Probes, Eugene, штат Орегон) кон'юTTA1/GS7641 циклічний ангідрид кожної з зазнагували з 5'-аміном аптамерів методом, описаним чених сполук інкубували з аміновмісним для кон'югації Hi15-NHS. Кон'юговані з RhodamineTTA1/GS7641 при нейтральному значенні рН за Red-X аптамери, тобто TTA1-Red і ТТА1 NB-Red, допомогою стандартних методів. Структури DTPA і очищували за допомогою РХВД зі зверненою фаDOTA і кон'югатів наведені на Фіг.8 і Фіг.9 відповізою Культивування клітин лінії U251 і вирощувандно, кожен з них був позначений за допомогою ня пухлини в безтимусних мишах здійснювали за 29 75578 30 In111. DOTA-кон'югати мали лінкери, ідентичні лінтакож одержання зображення кишечнику, передмікерам для DTPA DOTA- і DTPA-кон'югати мітили хурової залози й інших черевних органів. за допомогою In111 шляхом інкубації при 95°С в Таблиця 1 0,5М NaOAc, рН5,5 протягом 30хв. Після видалення невключеної радіоактивної мітки за допомогою Концентрації РНК і протеїну, спін-діалізу через мембрану з граничним розміром використовувані з метою одержання молекулярної маси, що пропускається, 30кДА, ралігандів до тенесцину-С за допомогою SELEX діоактивно мічений аптамер переносили в забуферений фосфатом фізіологічний розчин для ввеЦикл Тенасцин-С (пмолей/лунку) РНК (пмолей/лунку) дення шляхом ін'єкції мишам-носіям пухлини. 1 12 200 111 Біорозподілення міченого за допомогою In 2 12 200 аптамера в значній мірі відрізнялося від міченої за 3 12 200 допомогою Тс композиції, описаної в прикладі 4. Із 4 12 200 5 2 33 Фіг.7 видно, що в порівнянні з міченим за допомо111 6 2 33 гою Tc-99m TTA1/GS7641 радіоактивність In 7 2 33 TTA1/GS7641 у кишечнику виявилася істотно ниж8 0,2 3,3 чою, при цьому виявлено збільшення поглинання печінкою і ниркою. Цей експеримент свідчить про Таблиця 2 те, що хімічні властивості хелатора значно впливають на розподілення радіоактивно міченого Концентрації РНК і протеїну, TTA1/GS7641 у живому організмі. Схеми біорозповикористовувані з метою одержання ділення, відмінні від Hi15-TTA1/GS7641, можна залігандів до клітин/тенесцину-С за допомогою SELEX стосовувати для введення в пухлини при певних клінічних станах, при яких небажаний гепатобіліаЦикл Тенасцин-С (пмолей/лунку) РНК (пмолей/лунку) рний кліренс. Такі умови включають (але не обмеЕ9Р1 2 33 Е9Р2 2 33 жуючись ними) радіотерапевтичні застосування, а 31 75578 32 Продовження таблиці 3 33 75578 Перелік послідовностей 34 35 75578 36 37 75578 38 39 75578 40 41 75578 42 43 75578 44 45 75578 46 ` Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNucleic acids-ligands to tenascin-с
Назва патенту російськоюНуклеиновые кислоты-лиганды к тенасцину-с
МПК / Мітки
МПК: C07H 21/04, C12P 19/34, C12Q 1/68, C07H 21/02
Мітки: тенасцину-с, кислоти-ліганди, нуклеїнові
Код посилання
<a href="https://ua.patents.su/23-75578-nuklenovi-kisloti-ligandi-do-tenascinu-s.html" target="_blank" rel="follow" title="База патентів України">Нуклеїнові кислоти-ліганди до тенасцину-с</a>
Попередній патент: Диференціальний механізм з гальмами золотова
Наступний патент: Спосіб синтезу суміші олігосахаридів
Випадковий патент: Система електроопалення "тепла підлога"












