[фенілсульфанілфеніл]піперидини та способи їх одержання
Формула / Реферат
1. Спосіб одержання сполуки формули IIІ
 , (III)
, (III)
де сполуку формули II
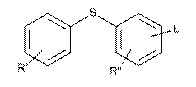 , (II)
, (II)
де R' і R" незалежно являють собою один, два або три атоми водню, галогену, C1-6-алкіл або С2-6-алкілен, і L являє собою відхідну групу, піддають взаємодії з необов'язково заміщеним N-бензил-4-піперидоном
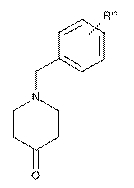 ,
,
де R'" являє собою водень або -O-C1-6-алкіл, з одержанням сполуки формули IIІ.
2. Спосіб за п. 1, де сполуку формули II
 , (II)
, (II)
де R' і R" незалежно являють собою один, два або три атоми водню, галогену, С1-6-алкіл або С2-6-алкілен, і L являє собою відхідну групу, піддають взаємодії з металюючим агентом, вибраним з алкіллітію, алкілмагнію або магнію, і необов'язково заміщеним N-бензил-4-піперидоном
 ,
,
де R"' являє собою водень або -О-С1-6-алкіл, при температурі від приблизно -25 °С до приблизно 5 °С, з одержанням сполуки формули III
 (III).
(III).
3. Спосіб за будь-яким з пп. 1-2, де R' являє собою 4-метил, і R" являє собою водень.
4. Спосіб за будь-яким з пп. 1-3, де R"' являє собою водень.
5. Спосіб за будь-яким з пп. 2-4, де металюючий агент являє собою н-бутиллітій.
6. Спосіб одержання сполуки І
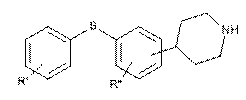 (I)
(I)
і її кислотно-адитивних солей, де R' і R" незалежно являють собою один, два або три атоми водню, галогену, С1-6-алкіл або С2-6-алкілен, який включає стадії взаємодії сполуки формули II
 , (II)
, (II)
де L являє собою відхідну групу, з необов'язково заміщеним N-бензил-4-піперидоном
 ,
,
де R'" являє собою водень або -О-С1-6-алкіл, з одержанням сполуки формули III
 (III)
(III)
та подальшим одержанням сполуки І.
7. Спосіб за п. 6 одержання сполуки І
 (I)
(I)
і її кислотно-адитивних солей, де R' і R" незалежно являють собою один, два або три атоми водню, галогену, C1-6-алкіл або С2-6-алкілен, який включає стадії взаємодії сполуки формули II
 , (II)
, (II)
де L являє собою відхідну групу, з металюючим агентом, вибраним з алкіллітію, алкілмагнію або магнію, і необов'язково заміщеним N-бензил-4-піперидоном
 ,
,
де R'" являє собою водень або -О-С1-6-алкіл, при температурі від -25 °С до 5 °С, з одержанням сполуки формули III
 (III).
(III).
8. Спосіб за будь-яким з пп. 6-7, де R' являє собою 4-метил, і R" являє собою водень.
9. Спосіб за будь-яким з пп. 6-8, де R'" являє собою водень.
10. Спосіб за будь-яким з пп. 7-9, де металюючий агент являє собою н-бутиллітій.
11. Спосіб за будь-яким з пп. 6-10, де сполука II являє собою
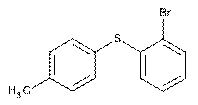 .
.
12. Спосіб за будь-яким з пп. 6-11, де вказана вище сіль являє собою адитивну сіль бромистоводневої кислоти.
13. Спосіб за п. 6, де сполука І являє собою
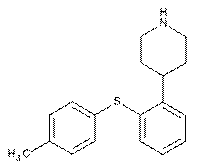
або її кислотно-адитивні солі, який включає стадії взаємодії
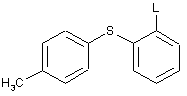
з н-бутиллітієм при температурі нижче 0 °С, з подальшою взаємодією з N-бензил-4-піперидоном, при температурі від приблизно 5 °С до приблизно -25 °С, і НСl, з одержанням сполуки формули
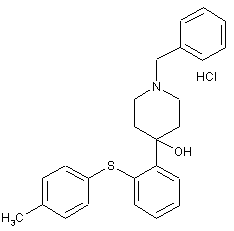 ,
,
яку далі піддають взаємодії з етилхлорформіатом, з одержанням сполуки формули
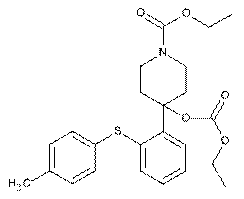 ,
,
яку потім піддають взаємодії з Et3SiH і трифтороцтовою кислотою, з подальшою взаємодією з кислотою для видалення захисної групи N-піперидину і при необхідності з одержанням бажаної кислотно-адитивної солі.
14. Спосіб за п. 13, де L являє собою Вr.
15. Спосіб за будь-яким з пп. 13-14, де вказана вище сіль є адитивною сіллю бромистоводневої кислоти і де N-захисну групу видаляють шляхом взаємодії з бромистоводневою кислотою в оцтовій кислоті.
16. Спосіб одержання сполуки формули

або її кислотно-адитивних солей, який включає стадії взаємодії сполуки формули

з етилхлорформіатом, з одержанням сполуки формули
 ,
,
яку далі піддають взаємодії з Et3SiH і трифтороцтовою кислотою, з подальшою взаємодією з кислотою для видалення захисної групи N-піперидину і при необхідності з одержанням бажаної кислотно-адитивної солі.
17. Спосіб за п. 16, де вказана вище сіль являє собою адитивну сіль бромистоводневої кислоти і де N-захисну групу видаляють шляхом взаємодії з бромистоводневою кислотою в оцтовій кислоті.
18. Спосіб за п. 14, де сполуку

одержують на початковій стадії, на якій 4-метилтіофенол і 2-йодбромбензол піддають взаємодії у присутності джерела паладію і бідентатного фосфінового ліганду при основному рН при підвищених температурах.
19. Сполука формули і) або іі)
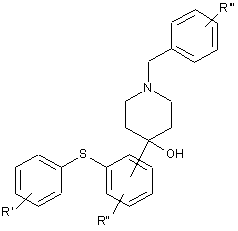 і) або
і) або 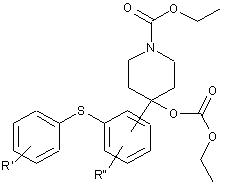 , іі)
, іі)
де R' і R" незалежно являють собою один, два або три атоми водню, галогену, С1-6-алкіл або С2-6-алкілен, R'" являє собою водень або -O-C1-6-алкіл,
i її кислотно-адитивні солі.
20. Сполука за п. 19, вибрана з 1-бензил-4-гідрокси-4-[2-(4-метилфенілсульфаніл)-феніл]піперидину і етилового естеру 4-етоксикарбонілокси-4-(2-п-толілсульфанілфеніл)-піперидин-1-карбонової кислоти і їх кислотно-адитивних солей.
Текст
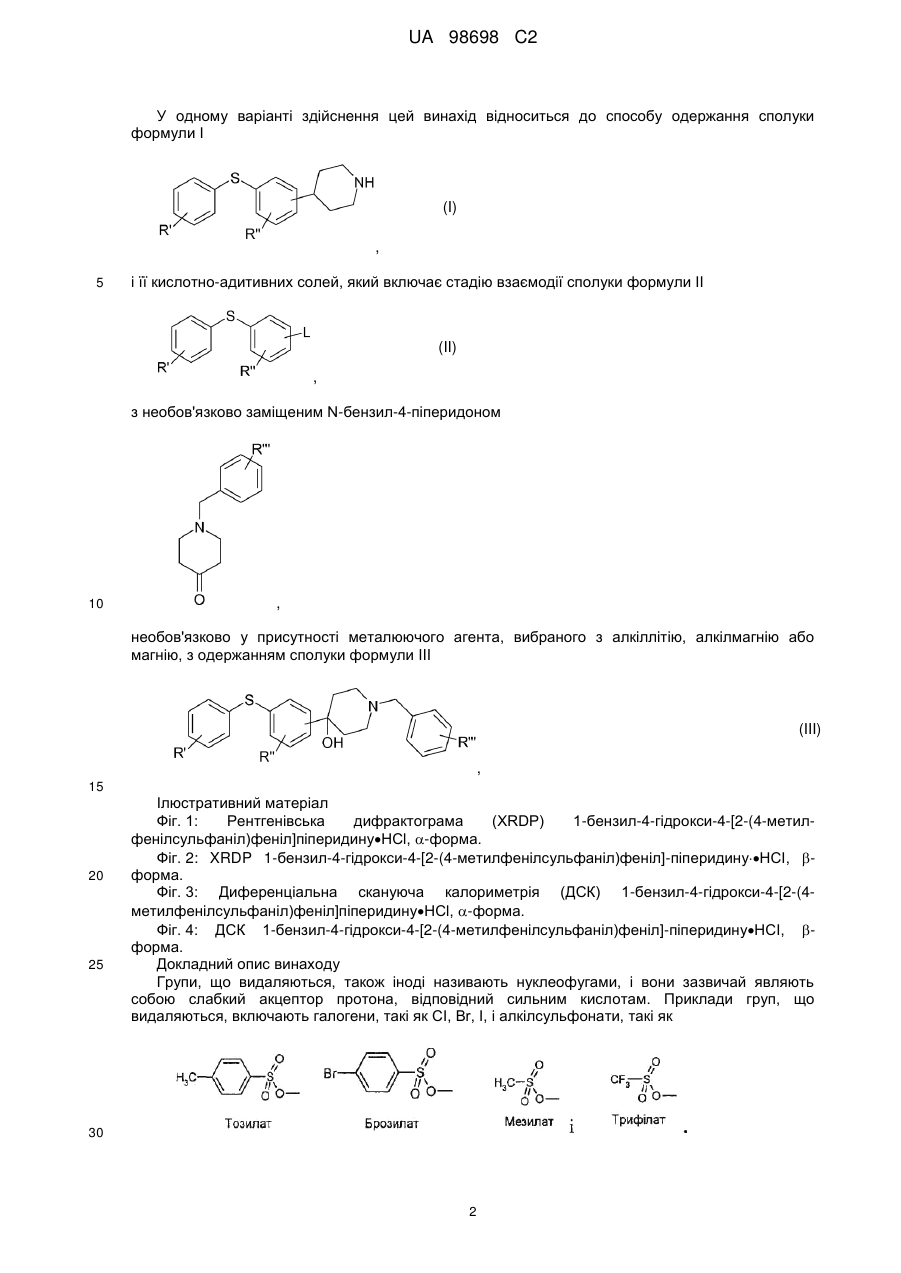
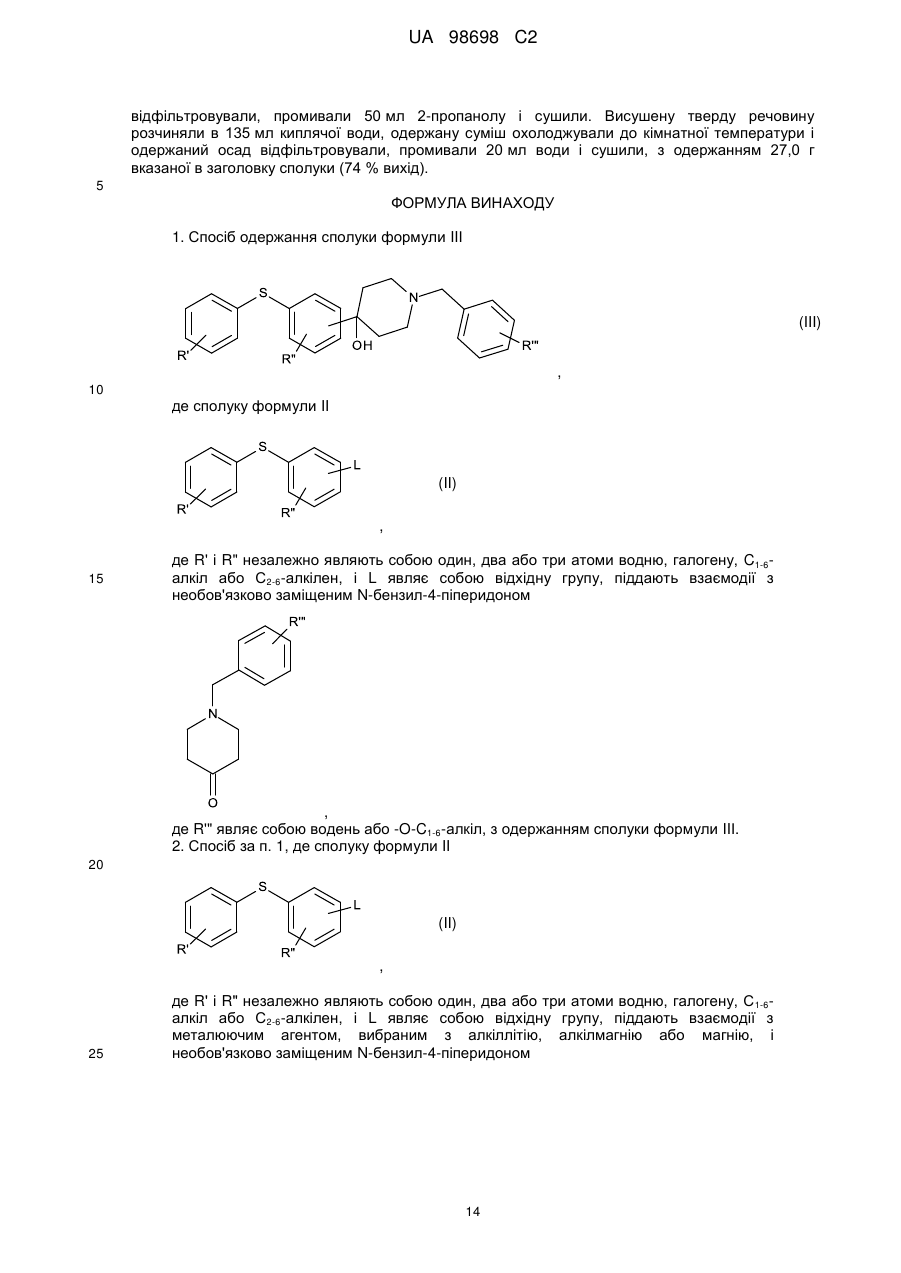
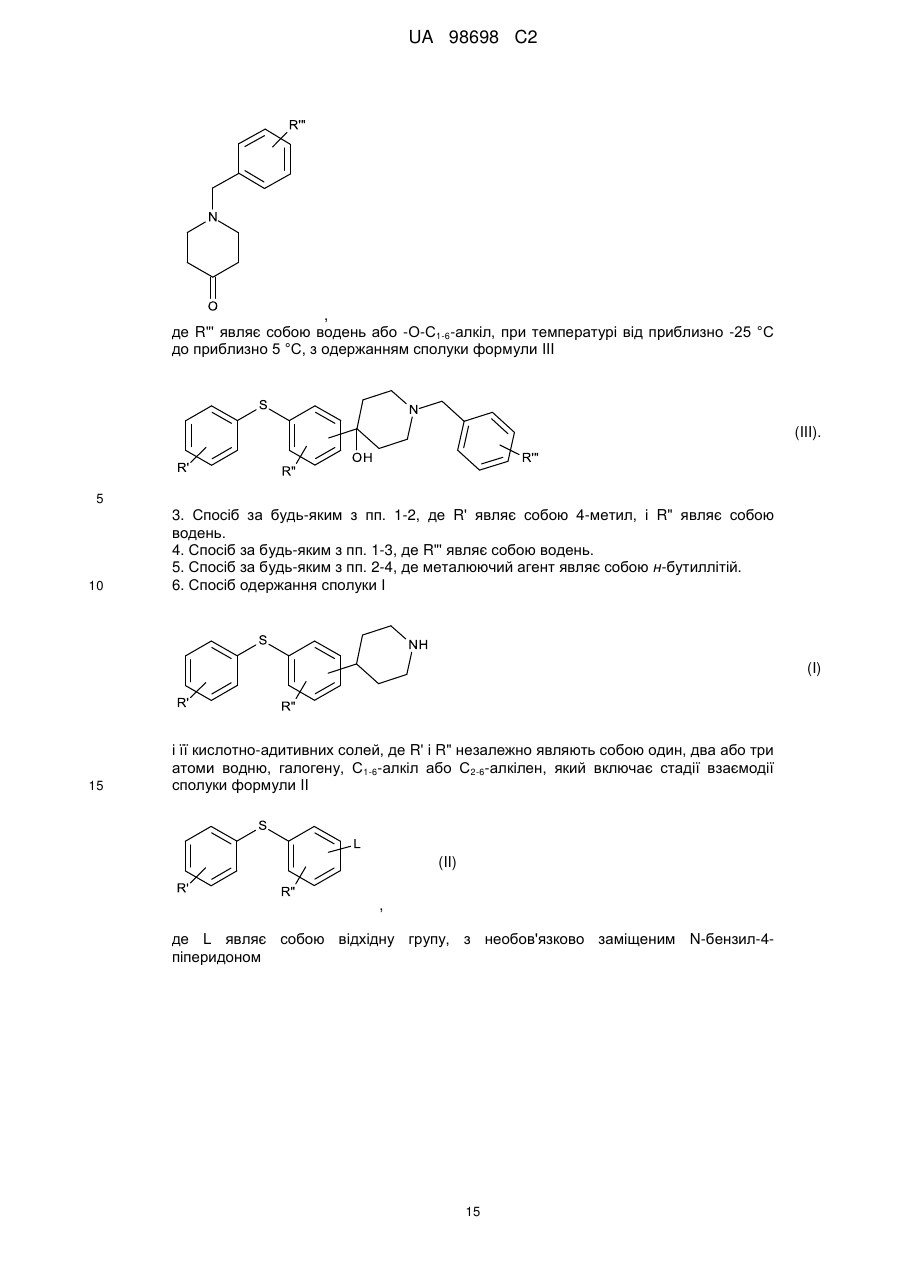
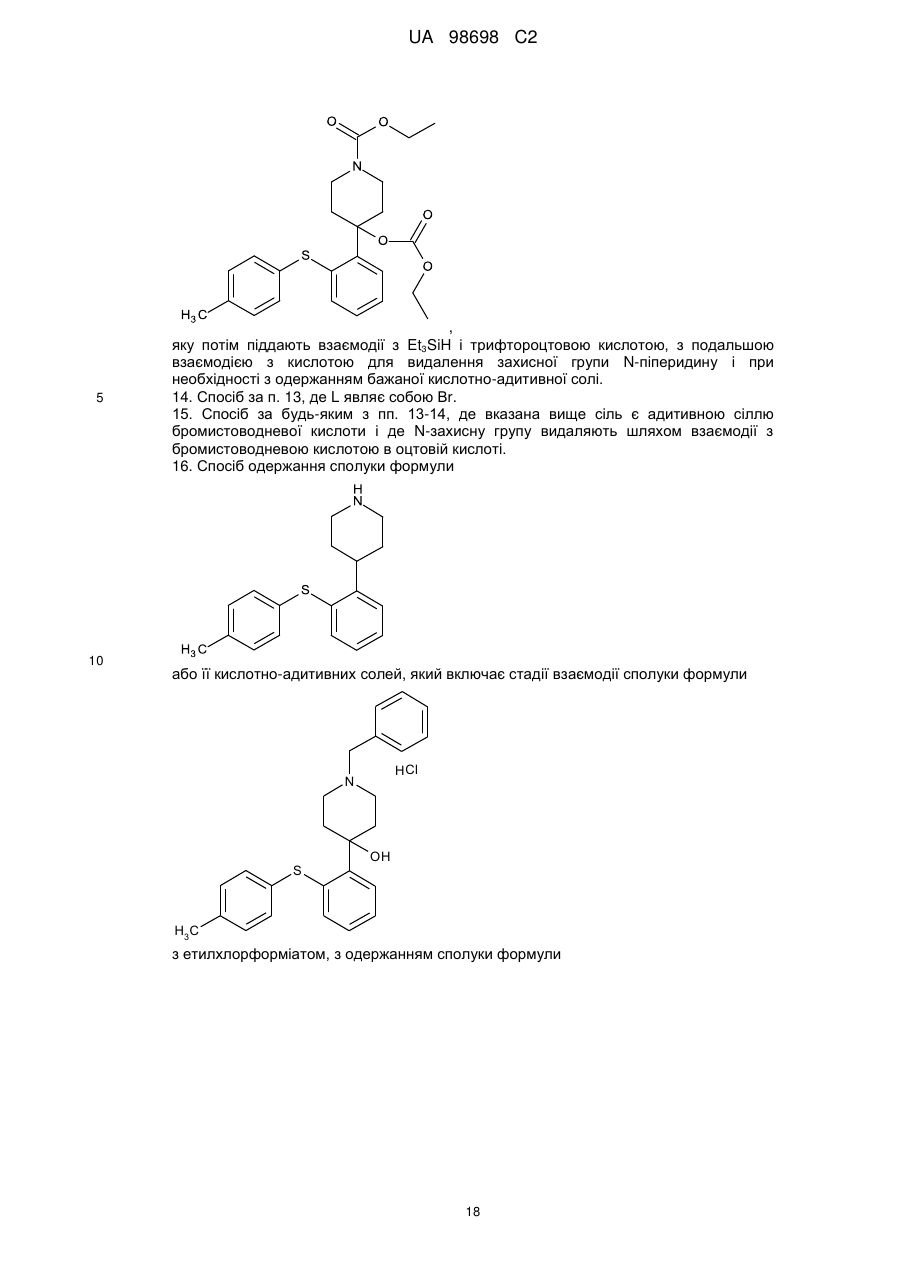
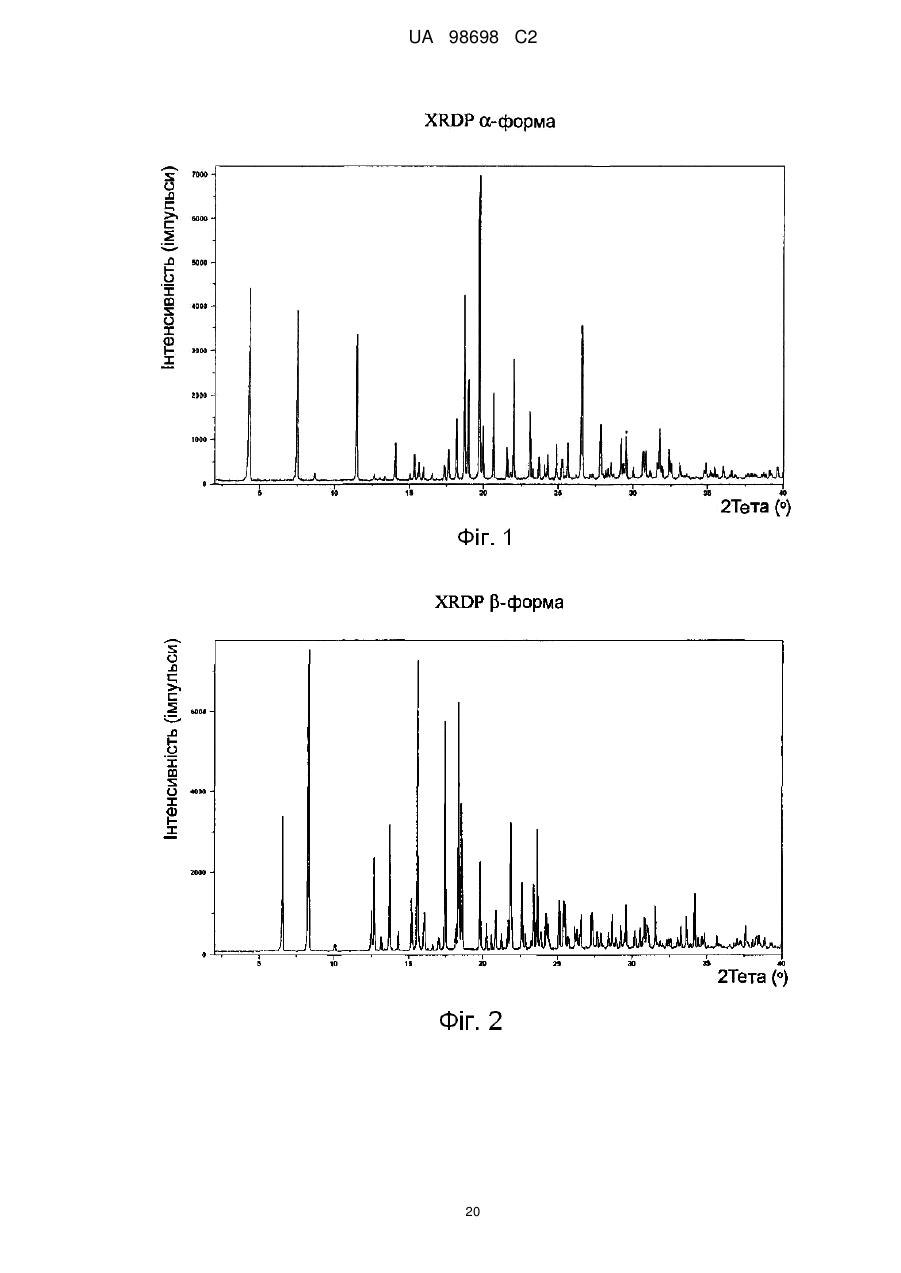
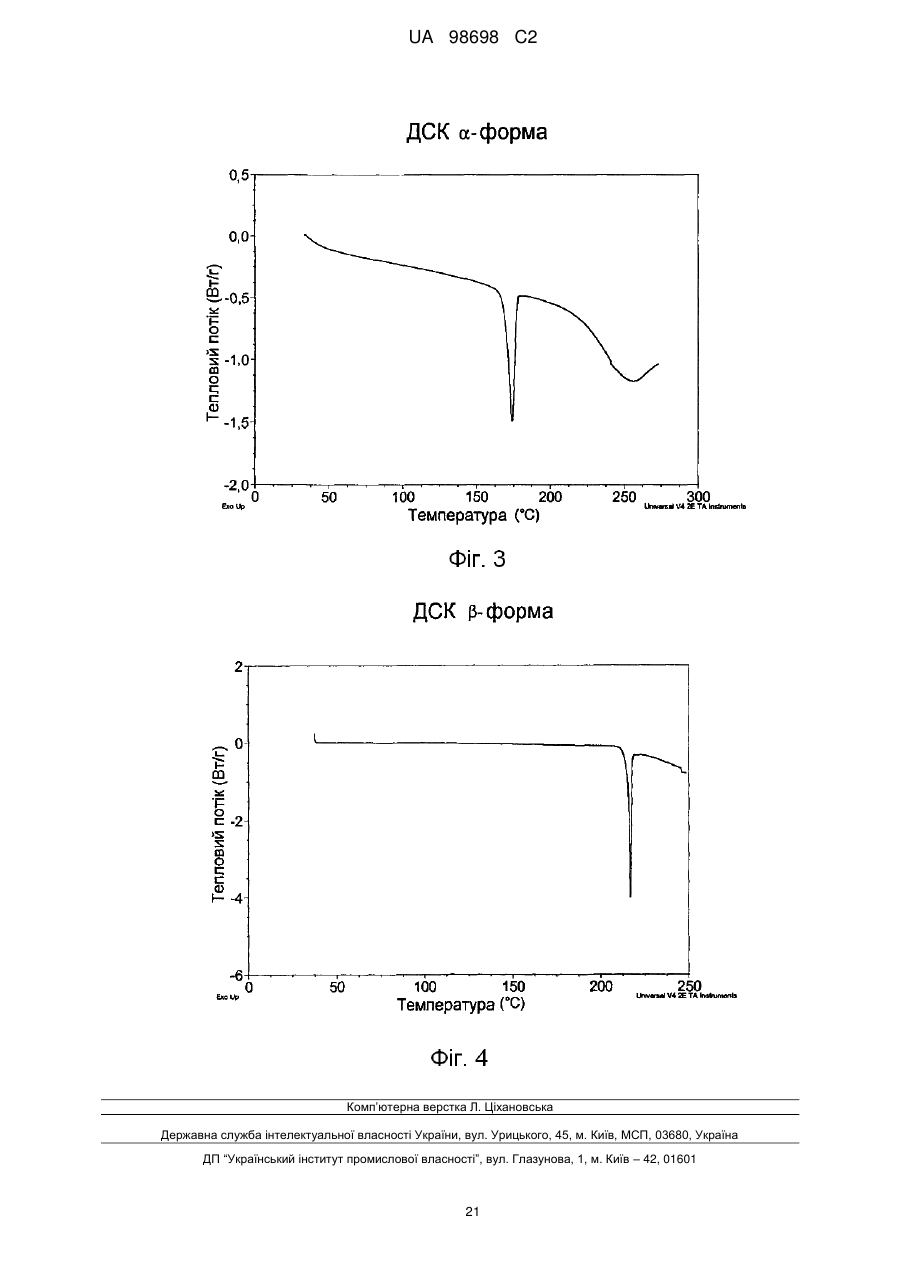
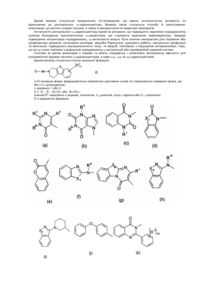
Реферат: Спосіб одержання (не)заміщених [фенілсульфанілфеніл]піперидинів, застосування бензилу як захисної групи N-піперидину. який включає UA 98698 C2 (12) UA 98698 C2 UA 98698 C2 5 10 15 20 25 Даний винахід відноситься до способу одержання [фенілсульфанілфеніл]піперидинів і їх солей. У міжнародних патентних заявках, опублікованих під номерами WO 2003/029232 і WO 2007/144006, розкрито, що сполука 4-[2-(4-метилфенілсульфаніл)феніл]піперидин має фармакологічний профіль, що включає інгібування зворотного захоплення серотоніну і норадреналіну, інгібування серотонінових рецепторів 2А і 3 і адренергічного рецептора 1A, і що вказана вище сполука і її солі можуть застосовуватися при лікуванні ряду показників, таких як депресія, тривога і біль. Отже, існує необхідність в способах одержання вказаної вище сполуки, які будуть легкими, дешевими і які забезпечать високий вихід продукту. У WO 2003/029323 розкритий спосіб, згідно з яким трет-бутоксикарбоніл-захищений піперидин-4-ол перетворюють в оксалат і потім відновлюють за допомогою Bu 3SnН, з одержанням бажаної сполуки після зняття захисту. У WO 2007/144006 розкритий спосіб, згідно з яким етоксикарбоніл-захищений піперидин-4ол одержують шляхом взаємодії 2-(4-толілсульфаніл)фенілброміду з N-карбоетокси-4піперидоном, продукт якої відновлюють за допомогою SiEt3H/TFA, з одержанням бажаної сполуки після зняття захисту. Стадію способу, на якій одержують етоксикарбоніл-захищений піперидин-4-ол, проводять при дуже низьких температурах, тобто -40 °C, і відновлену проміжну сполуку важко виділяти, оскільки вона погано кристалізується. У WO 01/46147 розкритий спосіб відновлення N-захищеного піперидин-4-олу за допомогою SiEt3H/TFA. Суть винаходу Винахідники цього винаходу несподівано виявили, що використання необов'язково заміщеного бензилу як захисної групи N-піперидину робить можливим здійснити спосіб одержання захищеного піперидин-4-олу, який здійснюється при вищих температурах, що приводить до підвищення загальних виходів і забезпечує легше і зручніше виділення і очищення проміжних сполук шляхом кристалізації. Відповідно, в одному варіанті здійснення цей винахід відноситься до способу, де сполуку формули II (II) , 30 де R' і R" незалежно являють собою один, два або три атоми водню, галогену, молекули С 1-6алкілу або С2-6-алкілену, і L являє собою групу, що видаляється, піддають взаємодії з необов'язково заміщеним N-бензил-4-піперидоном , 35 необов'язково у присутності металюючого агента, вибраного з алкіллітію, алкілмагнію або магнію; де R'" являє собою водень або -О-С1-6-алкіл, з одержанням сполуки формули III (III) , 40 1 UA 98698 C2 У одному варіанті здійснення цей винахід відноситься до способу одержання сполуки формули І (I) , 5 і її кислотно-адитивних солей, який включає стадію взаємодії сполуки формули II (II) , з необов'язково заміщеним N-бензил-4-піперидоном 10 , необов'язково у присутності металюючого агента, вибраного з алкіллітію, алкілмагнію або магнію, з одержанням сполуки формули III (III) , 15 20 25 Ілюстративний матеріал Фіг. 1: Рентгенівська дифрактограма (XRDP) 1-бензил-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]піперидинуНСl, -форма. Фіг. 2: XRDP 1-бензил-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]-піперидинуНСІ, форма. Фіг. 3: Диференціальна скануюча калориметрія (ДСК) 1-бензил-4-гідрокси-4-[2-(4метилфенілсульфаніл)феніл]піперидинуНСl, -форма. Фіг. 4: ДСК 1-бензил-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]-піперидинуНСІ, форма. Докладний опис винаходу Групи, що видаляються, також іноді називають нуклеофугами, і вони зазвичай являють собою слабкий акцептор протона, відповідний сильним кислотам. Приклади груп, що видаляються, включають галогени, такі як СІ, Вr, І, і алкілсульфонати, такі як 30 2 UA 98698 C2 5 10 15 20 25 30 35 40 45 Особливе значення надається Br. У одному з варіантів здійснення R' і R" незалежно являють собою водень або С 1-6-алкіл, такий як метил. Зокрема, R' являє собою метил, і R" являє собою водень, і, особливо, R' являє собою метил в положенні 4. У одному варіанті здійснення R' і R" незалежно являють собою один або більше атомів водню або галогену, таких як фтор. У одному варіанті здійснення R'" являє собою водень або метокси, а особливо водень. У одному варіанті здійснення металюючий агент являє собою алкіллітій, такий як нбутиллітій або трет-бутиллітій, а особливо н-бутиллітій. У одному варіанті здійснення кислотно-адитивна сіль є фармацевтично прийнятною сіллю. У ще одному варіанті здійснення зазначеними вище кислотно-адитивними солями солі кислот, які є нетоксичними. Вказані солі включають солі, одержані з органічними кислотами, такими як малеїнова, фумарова, бензойна, аскорбінова, бурштинова, щавлева, біс-метиленсаліцилова, метансульфонова, етандисульфонова, оцтова, пропіонова, винна, саліцилова, лимонна, глюконова, молочна, яблучна, малонова, мигдалева, корична, цитраконова, аспарагінова, стеаринова, пальмітинова, ітаконова, гліколева, п-амінобензойна, глутамінова, бензолсульфонова, теофіліноцтові кислоти, а також з 8-галогентеофілінами, наприклад, з 8бромтеофіліном. Зазначені вище солі також можуть бути одержані з неорганічними кислотами, такими як хлористоводнева, бромистоводнева, сірчана, сульфамінова, фосфорна і азотна кислоти. Слід особливо вказати адитивну сіль бромистоводневої кислоти. У одному з варіантів здійснення один еквівалент сполуки II розчиняють у відповідному розчиннику, такому як вуглеводневий або етерний розчинник, наприклад, гептан, тетрагідрофуран (ТГФ) або їх суміш, і охолоджують до температури від приблизно -25 °C до приблизно 5 °C, наприклад, від приблизно -10 °C до приблизно -25 °C в інертній атмосфері, наприклад, азоту. Зазвичай використовують від 0,1 до 4 еквівалентів ТГФ. До одержаного розчину додають приблизно 1 еквівалент металюючого агента, наприклад, н-бутиллітію, розчиненого в розчиннику, такому як вуглеводень, наприклад гептан, підтримуючи при цьому температуру нижче 0 °C. При охолоджуванні до температури не вище приблизно -15 °C додають приблизно в еквімолярній кількості необов'язково заміщений N-бензил-4-піперидон, розчинений в розчиннику, такому як етерний розчинник, наприклад ТГФ, підтримуючи при цьому температуру нижче приблизно -15 °C. Одразу після завершення додавання реакційній суміші дають нагрітися до кімнатної температури (кт). Одержаний продукт можна піддати фазовому розділенню з використанням відповідного розчинника, такого як етилацетат, і водного розчину основи, наприклад, NaOH при рН приблизно 10-12. Розчинники повністю або частково видаляють вакуумною дистиляцією (максимальна температура ~50 °C). Розчинення одержаного продукту у відповідному розчиннику і видалення вказаного вище розчинника, наприклад, вакуумною дистиляцією, можна повторити, використовуючи, наприклад, ТГФ як розчинник. Одразу після завершення дистиляції додають розчинник, наприклад, ТГФ, з подальшим додаванням кислоти, наприклад, розчин барботують хлористим воднем, і одержаний продукт (сполуку III) осаджують шляхом змішування з відповідним антирозчинником, таким як діетиловий етер, і збирають. Як альтернативу виділенню/очищенню за допомогою антирозчинника можна використовувати внесення як затравки кристалів сполуки III для осадження сполуки III. Щоб отримати гарний вихід, використовувані перед фазовим розділенням розчинники мають бути сухими. Як показано в прикладах, винахідники досліджували описану вище реакцію з використанням різних захисних груп, тобто N-бензил-4-піперидон, N-карбоетокси-4-піперидон, N-третбутоксикарбоніл-4-піперидон і N-бензоїл-4-піперидон, і температур, що знаходяться в діапазоні від приблизно -15 °C до -78 °C. У таблиці 1 нижче наведені одержані виходи. Таблиця 1 Температура N-бензил-4піперидон N-карбоетокси-4піперидон -15 °C 90 % 84 % 30 % (не виділено) 55-60 % -40 °C -78 °C 50 N-третбутоксикарбоніл-4піперидон N-бензоїл-4піперидон 0 % 42 % Таким чином, очевидно, що використання N-бензил-4-піперидону приводить до значно вищого виходу і дає можливість здійснення реакції при значно вищих температурах. 3 UA 98698 C2 5 10 15 20 25 30 35 Проведення реакції при -40 °C, не говорячи вже про -78 °C, в порівнянні з -15 °C, вимагає спеціалізованого устаткування і робить експлуатацію складнішою, що збільшує вартість. Ще однією перевагою використання бензилу як захисної групи є той факт, що при цьому з'являється можливість зручнішого виділення і очищення продукту реакції шляхом кристалізації. Захищена бензилом кислотно-адитивна сіль піперидину легко кристалізується, тоді як інші захищені піперидини - ні. Сполука II може бути одержана шляхом взаємодії тіофенолу з відповідним чином заміщеним бензолом, таким як 1,2-дигалогенбензол, у присутності неорганічної основи, такої як оксиди, наприклад, трет-бутоксид, або Na2CO3. Альтернативно, сполука II може бути одержана в реакції тіофенолу, що каталізується паладієм, з фенілгалогенідом [Advanced Organic Chemistry (1985) J.March (ed.), 589-590, John Wiley]. Як приклад, 4-метилтіофенол і 2-йодбромбензол можуть бути піддані взаємодії при підвищеній температурі (наприклад, вище 80 °C, наприклад, вище 100 °C) у присутності джерела Pd і бідентатного фосфінового ліганду. Приклади джерел Pd включають PdCl 2, Pd(OAc)2 і Pd2DBA2. Приклади фосфінових лігандів включають рацемічний 2,2'-бісдифенілфосфаніл-[1,Г]бінафталеніл (rac-BINAP), 1,Г-біс(дифенілфосфіно)фероцен (DPPF), біс(2-дифенілфосфінофеніловий)етер (DPEphos); DBA являє собою дибензиліденацетон. Для того, щоб отримати кінцевий продукт, тобто сполуку (І) або її кислотно-адитивні солі, сполуку III далі піддають взаємодії з алкілхлорформіатом, таким як етилхлорформіат, з подальшим відновленням Et3SiH/TFA. Бензилхлорид, що вивільняється, можна уловити шляхом взаємодії з етаноламіном. Для взаємодії з кислотою на кінцевій стадії потрібно видалити захисну групу N-піперидину. Відповідний вибір вказаної вище кислоти безпосередньо забезпечить бажану кислотно-адитивну сіль сполуки (І). Сполуку III (1 еквівалент) суспендують разом з надлишком основи, такої як Na 2CO3, в розчиннику, наприклад, кетоні, ацетатах, хлорованих алкілах або ароматичних розчинниках, таких як ацетон або толуол, і додають 2-3 еквіваленти алкілхлорформіату, наприклад, етилхлорформіату. Одержаний продукт можна виділити фазовим розділенням, додаючи воду і розчинник, такий як толуол або дихлорметан, і відокремлюючи органічну фазу, розчинник якої видаляють повністю або частково, наприклад, дистиляцією. Одержаний продукт додають до суміші TFA і Et3SiH (2-3 еквіваленти) при температурі від приблизно -10 °C до приблизно -25 °C. Після завершення реакції одержаній суміші дають нагрітися до кімнатної температури, і одержаний продукт може бути виділений фазовим розділенням при використанні води і розчинника, такого як толуол або дихлорметан. Після видалення цих розчинників, наприклад дистиляцією, додають відповідну кислоту, наприклад, НВr, щоб видалити захисну карбоетоксигрупу і отримати бажану кислотно-адитивну сіль в одну єдину стадію. У одному з варіантів здійснення сполука І являє собою , 40 яку одержують шляхом розчинення 1 еквівалента , 45 у гептані і ТГФ (зазвичай 0,1-3 еквіваленти ТГФ) при температурі від приблизно 5 °C до приблизно -25 °C, наприклад, від приблизно -10 °C до приблизно -25 °C, наприклад, приблизно 15 °C, з подальшим додаванням н-бутиллітію (1-1,5 еквівалента), підтримуючи при цьому температуру нижче 0 °C. Зазвичай L являє собою Вr. Одразу після закінчення додавання одержаний розчин охолоджують до температури від приблизно -10 °C до приблизно -25 °C, 4 UA 98698 C2 5 наприклад, приблизно -15 °C, і додають приблизно еквімолярну кількість ЛГ-бензил-4піперидону, підтримуючи при цьому цю температуру. Після закінчення додавання одержаному розчину дають нагрітися до кімнатної температури. Реакцію гасять водою і одержаний продукт виділяють шляхом фазового розділення, використовуючи відповідний розчинник, такий як етилацетат, і доводячи рН водної фази до 1012, наприклад, за допомогою NaOH. Розчинник видаляють або зменшують його кількість дистиляцією, і свіжий розчинник, такий як, наприклад, ТГФ, додають і видаляють один або більше разів. Додають свіжий розчинник і одержаний розчин барботують хлористим воднем, після чого одержана сполука 10 , 15 20 осаджується у вигляді кристалів після змішування з відповідним антирозчинником, таким як діетиловий етер. Як вказано вище, внесення кристалів як затравки є альтернативним додаванню антирозчинника способом осадження. 1-Бензил-4-гідрокси-4-[2-(4метилфенілсульфаніл)феніл]піперидинНСl існує в поліморфних формах, як обговорюється нижче, тобто - і -формі. Поліморф з вищою температурою плавлення є стабільнішим, а також має тенденцію до меншої розчинності. Переважним є внесення затравки поліморфу з низькою розчинністю, оскільки при цьому в розчині залишатиметься менша кількість сполуки, тобто це покращує вихід. Виявлено, що поліморф з вищою температурою плавлення, тобто -форма, є менш розчинним у відповідних розчинниках. Один еквівалент вказаної вище сполуки суспендують в розчиннику, такому як ацетон, разом з приблизно 2 еквівалентами основи, такої як Na2CO3, і 2-3 еквівалентами, наприклад, з приблизно 2,5 еквівалентом, етилхлорформіату, з одержанням сполуки 25 . 30 Одержану сполуку обробляють додаванням води і розчинника, такого як толуол, і органічну фазу збирають. Розчинник повністю або частково видаляють дистиляцією і одержаний залишок поволі змішують з 2-3 еквівалентами, наприклад, приблизно 2,5 еквівалентом, Et3SiH в TFA при температурі від приблизно -10 °C до приблизно -25 °C, наприклад, при приблизно -15 °C. Після завершення змішування реакційній суміші дають можливість нагрітися до кімнатної температури, з одержанням сполуки 5 UA 98698 C2 , 5 10 яку потім піддають фазовому розділенню. Органічна фаза, яка містить дану сполуку, необов'язково може бути піддана кип'ятінню зі зворотним холодильником з етаноламіном, щоб уловити бензилхлорид, що вивільняється. Для одержання кінцевого продукту додають НВr в оцтовій кислоті (1,5-4 еквіваленти, наприклад, приблизно 2 еквіваленти). На даній стадії можна необов'язково здійснювати перекристалізацію продукту. Відповідні розчинники включають воду і спирти, такі як метанол і етанол. У одному з варіантів здійснення цим винаходом пропонується спосіб одержання сполуки формули , або її кислотно-адитивних солей, який включає стадії взаємодії сполуки формули 15 , з етилхлорформіатом, з одержанням сполуки формули 20 , 6 UA 98698 C2 5 10 15 яку потім піддають взаємодії з Et3SiH і трифтороцтовою кислотою, з подальшою взаємодією з кислотою для видалення захисної групи N-піперидину і необов'язково одержання бажаної кислотно-адитивної солі. Зокрема, адитивну сіль бромистоводневої кислоти можна отримати шляхом взаємодії з бромистоводневою кислотою в оцтовій кислоті для видалення захисної групи N-піперидину і одержання бажаної солі в одну стадію. Як показано в прикладах, даний спосіб одержання 4-[2-(4-метилфенілсульфаніл)феніл]піперидинуHBr забезпечує загальний вихід понад 50 %, тоді як спосіб одержання: використанням карбоетоксигрупи як захисної групи забезпечує вихід тільки приблизно 25 % 45 % залежно від температури. Експерименти щодо проведення наведених вище реакцій в масштабі 50-60 кг дають можливість припустити, що відмінність у виході ста< навіть очевиднішою у великих масштабах. Було показано, що наведені нижче сполуки є особливо корисними проміжними сполуками для одержання [метилфенілсульфанілфеніл]піперидинів, таких як 4-[2-(4метилфенілсульфаніл)феніл]піперидин, і їх кислотно-адитивних солей. і) і його кислотно-адитивні солі, зокрема, 1-бензил-4-гідрокси4-[2-(4-метилфенілсульфаніл)феніл]піперидин 20 і його кислотно-адитивні солі; і ii) 25 і, зокрема, етиловий естер 4-етоксикарбонілокси-4-(2-птолілсульфанілфеніл)-піперидин-1-карбонової кислоти 7 UA 98698 C2 . 5 10 15 20 25 30 35 У одному з варіантів здійснення цей винахід відноситься до сполуки і) або її кислотноадитивних солей, або до сполуки іі). У ще одному варіанті здійснення цей винахід відноситься до 1-бензил-4-гідрокси-4-[2-(4метилфенілсульфаніл)феніл]піперидинуНСl в кристалічній формі, особливо з сигналами XRPD приблизно при 4,36, 7,53, 11,51 і 14,08, такою як XRPD, показаною на фіг. 1 (-форма); або з сигналами XRPD приблизно при 6,59, 8,33, 12,51 і 13,37, такою як XRPD, показаною на фіг. 2 (форма). Як показано на фіг. 3 і 4 (-форма і -форма 1-бензил-4-гідрокси-4-[2-(4метилфенілсульфаніл)феніл]піперидинуНСl мають температури плавлення приблизно 170 °C і приблизно 216 °C, відповідно. -Форму можна отримати кристалізацією з ТГФ; -форму кристалізацією з ацетону. Всі посилання, включаючи публікації, патентні заявки і патенти, процитовані в даному описі, включені, тим самим, шляхом посилання у їх повному обсязі і неначебто кожне з них було окремо і спеціально включене шляхом посилання і було викладене в даному описі в повному обсязі (у максимальному ступені, передбаченому законом), незалежно від окремого включення будь-яких конкретних документів, зробленого ще будь-де в даному описі. Слід розуміти, що застосування однини в контексті опису даного винаходу включає як однину, так і множину, якщо в контексті даного опису не вказане інше або це очевидно не суперечить контексту. Якщо не вказане інше, усі точні величини, наведені в даному описі, репрезентують відповідні приблизні величини (наприклад, можна вважати, що всі точні величини, наведені щодо конкретного чинника або вимірювання, обумовлюють також відповідне приблизне вимірювання, модифіковане словом "приблизно", якщо це є придатним). Розкриття в даному описі будь-якого аспекту або аспекту цього винаходу за допомогою таких термінів, як "що включає", "має", "включаючи" або "що містить", з посиланням на елемент або елементи, ідентично опису аналогічного аспекту або аспекту цього винаходу термінами "складається з", "по суті складається з" або "в основному містить" для конкретного об'єкту або об'єктів, якщо не вказане інше або це очевидно не суперечить контексту. Приклади Температуру плавлення вимірюють за допомогою диференціальної скануючої калориметрії (ДСК). Установка TA-Instruments DSC-Q1000, відкалібрована на 5/хв., щоб отримати температуру плавлення у вигляді початкового значення. Приблизно 2 мг зразка нагрівають із швидкістю 5°/хв. в негерметично закритому реакторі в струмі азоту. Рентгенівські порошкові дифрактограми отримували на рентгенівському дифрактометрі PANalytical X'Pert PRO з використанням випромінювання CuK1. Зразки вимірювали в режимі відбиття в 2-діапазоні 5-40° за допомогою детектора X'celerator. Дифракційні дані представлені як ±0,1 (°2) Приклад 1. 2-(4-Толілсульфаніл)фенілбромід 40 8 UA 98698 C2 5 10 До перемішуваного розчину трет-бутоксиду калію (75 г, 0,668 моль, 1,1 екв.) в N-метил-2піролідоні (225 мл) додавали розчин 4-метилтіофенолу (78 г, 0,628 моль, 1,0 екв.), розчиненого в N-метил-2-піролідоні (225 мл). Потім до реакційної суміші додавали 1,2-дибромбензол (73 мл, 605 моль, 1,0 екв.); одразу після закінчення додавання реакційну суміш нагрівали до 100 °C і підтримували при даній температурі протягом приблизно 22 годин. (Хід реакції відстежували за ВЕРХ). Після охолоджування до кімнатної температури додавали воду (750 мл) і толуол (375 мл), фази розділяли і водну фазу екстрагували толуолом (250 мл). Одержані органічні фази об'єднували і потім органічну фазу концентрували вакуумною дистиляцією. Одразу після закінчення дистиляції одержаний залишок охолоджували і додавали метанол (750 мл). Розчинники видаляли з органічної фази вакуумною дистиляцією і потім додавали метанол (250 мл). При перемішуванні протягом ночі при кімнатній температурі випадав в осад 2-(4-толілсульфаніл)фенілбромід, який виділяли фільтруванням, промивали метанолом (260 мл) і сушили у вакуумі. Вихід = 120,8 г. Приклад 2. 1-Бензил-4-гідрокси-4-[2-('4-метилфенілсульфаніл)феніл1піперидин'НСl 15 20 25 30 35 2-(4-Толілсульфаніл)фенілбромід (419 г, 1,5 моль) розчиняли в гептані (900 мл) і безводному тетрагідрофурані (243 мл, 3 моль) і через 0,5 години реакційну суміш охолоджували до -15 °C в атмосфері азоту. До одержаної суміші додавали н-бутиллітій в гептані 2,7 М (583 мл, 1,6 моль), підтримуючи при цьому температуру в діапазоні від -15 °C до 0 °C. Після того, як додавання було завершене, одержану реакційну суміш охолоджували до приблизно -15 °C, потім додавали розчин N-бензил-4-піперидону (278 мл, 1,5 моль) в безводному тетрагідрофурані (450 мл) з такою швидкістю, щоб температура не піднімалася вище -15 °C. Після завершення додавання реакційній суміші давали нагрітися до кімнатної температури. Реакцію гасили водою (1 л), додавали етилацетат (1 л) і водний розчин гідроксиду натрію (1М, 300 мл). рН підтримували між 10 та 12. Фази розділяли, водну фазу екстрагували етилацетатом (1 л) і органічні фази об'єднували. Розчинники видаляли вакуумною дистиляцією (макс. температура 50 °C). Одразу після завершення дистиляції додавали тетрагідрофуран (2,25 л) і видаляли розчинники вакуумною дистиляцією (макс. температура 50 °C). Одразу після завершення дистиляції додавали тетрагідрофуран (2 л). Одержаний розчин барботували хлористим воднем (85 г, 2,33 моль) і одержаний продукт осаджували додаванням діетилового етеру (9 л) при перемішуванні. Одержаний осад відфільтровували, промивали діетиловим етером (1,2 л) і осад сушили у вакуумній печі протягом ночі (Т = 50 °C), з одержанням 574 г вказаної в заголовку сполуки (90 % вихід). Приклад 3. 4-[2-(4-Метилфенілсульфаніл)феніл]піперидинHBr 9 UA 98698 C2 5 10 15 20 25 Після перемішування суспензії 1-бензил-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]піперидинуНСl (426 г, 1 моль) і карбонату натрію (212 г, 2 моль) в ацетоні (2 л) протягом 1 години, додавали етилхлорформіат (240 мл, 2,5 моль). Після перемішування ще протягом 60 хвилин додавали толуол (3 л) і воду (3,5 л) і одержану реакційну суміш перемішували. Фази розділяли і органічну фазу промивали 2 л 2М водного розчину хлористого водню. Розчинник (приблизно 3 л) видаляли дистиляцією (Тмакс дистиляті = 120 °С). Одержаний розчин поволі додавали до суміші трифтороцтової кислоти (1,11 л, 15 моль) і триетилсилану (400 мл, 2,5 моль, 2,5 екв.) при -15 °C. Одразу після завершення додавання одержаній реакційній суміші давали нагрітися до кімнатної температури, потім додавали воду (4 л) і толуол (3,5 л). Одержану суміш перемішували протягом 30 хвилин, потім фази розділяли, органічну фазу промивали водою (3 л) і до органічної фази додавали етаноламін (300 мл, 5 моль). Органічну фазу кип'ятили із зворотним холодильником протягом ночі, потім додавали 2М водний розчин хлористого водню (2,5 л) і одержану суміш перемішували протягом 30 хвилин. Фази розділяли і органічну фазу промивали розчином хлористого водню (1,5 л, 2 М). Розчинники відганяли з органічної фази при максимальній температурі 130 °C. До розчину, що залишився, додавали бромистий водень в оцтовій кислоті (350 мл, 5,7 М, 2 моль) і одержану реакційну суміш нагрівали при 80 °C протягом ночі. Потім реакційну суміш охолоджували до кімнатної температури, додавали бромистий водень (350 мл, 5,7 М в оцтовій кислоті, 2 моль) і одержану реакційну суміш нагрівали при 80 °C протягом 4 годин, потім охолоджували до кімнатної температури. Додавали діетиловий етер (2 л), одержану реакційну суміш перемішували протягом ночі, потім одержаний осад відфільтрували і промивали 1 л діетилового етеру. Одержаний осад перекристалізовували з 2-пропанолу, з одержанням 208 г вказаної в заголовку сполуки (57 %). Приклад 4. 1 -трет-Бутоксикарбоніл-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]піперидин при -78 °C Див. WO 03/029232, сторінка 18. Приклад 5. 1 -Карбоетокси-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]піперидин при15 °C 30 35 40 2-(4-Толілсульфаніл)фенілбромід (6,98 г, 25 ммоль) розчиняли в гептані (40 мл) і безводному тетрагідрофурані (4,1 мл) і через 1,5 години реакційну суміш охолоджували до 0°С в атмосфері азоту. Додавали н-бутиллітій в гептані 2,7 М (9,8 мл, 26,5 ммоль) при 0 °C і через 45 хвилин реакційну суміш охолоджували до -15 °C. Додавали розчин N-карбоетокси-4піперидону (3,8 мл, 25 ммоль) в тетрагідрофурані (15 мл), підтримуючи при цьому температуру нижче -15 °C. Одразу після завершення додавання реакційну суміш нагрівали до кімнатної температури. Реакцію гасили розбавленим розчином хлористого водню. Зразок з органічної фази показав співвідношення 1-карбоетокси-4-гідрокси-4-[2-(4метилфенілсульфаніл)феніл]піперидину до 1-метил-4-фенілсульфанілбензолу як 28:58. Приклад 6. 1 -Карбоетокси-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]піперидин при 40 °C 10 UA 98698 C2 5 10 У зневодненому реакторі в атмосфері азоту перемішували суміш 2-(4-толілсульфаніл)фенілброміду (600 г, 2,15 моль) в гептані (4,5 л) при кімнатній температурі (25 °C). Потім через канюлю додавали розчин н-Bu-літію (10 М, 236 мл) в гептані. Після перемішування при кімнатній температурі протягом 30 хвилин реакційну суміш охолоджували до -50 °C, потім по краплях додавали розчин карбоетоксипіперидону в ТГФ (1,5 л), підтримуючи при цьому температуру нижче -40 °C. Одразу після закінчення додавання реакційній суміші давали нагрітися до 0 °C, потім додавали розбавлену НСl (1 л), підтримуючи температуру нижче 10 °C. Одразу після завершення додавання реакційну суміш перемішували протягом ще 15 хвилин, потім фазам давали можливість розділитися. Фази розділяли, водний шар екстрагували етилацетатом (1 л) і об'єднували органічні шари. Об'єднаний органічний шар промивали розчином NaCl (15 %) (1 л), сушили над сульфатом магнію, випаровували до сухого стану і суспендували в діетиловому етері (250 мл) протягом 30 хвилин, відфільтровували і сушили при 40 °C у вакуумній печі. Вихід 55-60 %. Приклад 7. 1-Бензоїл-4-гідрокси-4-[2-метилфенілсульфаніл)феніл]піперидин при -15 °C 15 20 25 2-(4-Толілсульфаніл)фенілбромід (6,98 г, 25 ммоль) розчиняли в гептані (40 мл) і безводному тетрагідрофурані (4,1 мл) і через 1,5 години реакційну суміш охолоджували до 0 °C в атмосфері азоту. При 0 °C додавали н-бутиллітій в гептані 2,7 М (9,8 мл, 26,5 ммоль) і через 45 хвилин реакційну суміш охолоджували до -15 °C. До реакційної суміші додавали розчин Nбензилокси-4-піперидону (5,08 г, 25 ммоль) в безводному тетрагідрофурані (40 мл), підтримуючи температуру нижче -15 °C. Одразу після завершення додавання реакційній суміші давали можливість нагрітися до кімнатної температури, потім гасили її розбавленим водним розчином НСl. ВЕРХ показала наявність 1-метил-4-фенілсульфанілбензолу і складної суміші невідомих сполук. Приклад 8. 4-[2-[4-Метилфенілсульфаніл)фенілпіперидинHBr 30 35 До перемішуваної суспензії 1-карбоетокси-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]піперидину (462 г, 1,244 моль) в триетилсилані (362 г, 3,1 моль) додавали трифтороцтову кислоту (2835 г, 24,9 моль). Потім реакційну суміш нагрівали при 60 °C протягом 18 годин, потім охолоджували до 0 °C. До охолодженого розчину додавали толуол (750 мл) і потім воду (750 мл), з подальшим перемішуванням протягом 20 хвилин. Реакційну суміш залишали на 60 хвилин без перемішування, органічну фазу відокремлювали і водну фазу повторно екстрагували толуолом (750 мл). Толуол видаляли при зниженому тиску, з одержанням неочищеного продукту у вигляді оливи. 11 UA 98698 C2 5 Неочищену оливу з попередньої стадії нагрівали в суміші оцтова кислота/HBr при 80 °C (реакція завершувалася через 18 годин). Одержану реакційну суміш охолоджували до кімнатної температури, додавали діетиловий етер (800 мл) і перемішували протягом ще 60 хвилин. Одержаний продукт виділяли фільтруванням, промивали холодним етером (300 мл) і сушили у вакуумі. Вихід = 80 %. Приклад 9. Етиловий естер 4-етоксикарбонілокси-4-(2-п-толілсульфанілфеніл)-піперидин-1карбонової кислоти 10 15 20 25 30 35 40 Суспензію 1-бензил-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]піперидинуНСl (42,6 г, 100 ммоль) і карбонату натрію 21,2 г (200 ммоль, 2 екв.) в дихлорметані (400 мл) перемішували при кімнатній температурі протягом приблизно 90 хвилин, потім додавали етилхлорформіат (24 мл, 250 ммоль). Через 60 хвилин додавали воду (400 мл) і розділяли фази. Одержану органічну фазу промивали спочатку розбавленим водним розчином НСl, потім розбавленим розчином гідроксиду натрію і насиченим розчином солі. Одержану органічну фазу сушили над MgSO4, фільтрували і видаляли розчинник при зниженому тиску. Додавали діетиловий етер (200 мл) і одержану суміш перемішували протягом ночі при кімнатній температурі. Вказану в заголовку сполуку виділяли фільтруванням, промивали діетиловим етером (80 мл) і сушили протягом ночі у вакуумній печі при 50 °C. Вихід = 20,15 г (45 %). Дані ЯМР Наведені нижче дані ЯМР отримували для синтезованих сполук. Етиловий естер 4-етоксикарбонілокси-4-(2-п-толілсульфанілфеніл)піперидин-1 карбонової кислоти: 13 6 С-ЯМР (d -ДМСО, 125,8 МГц): 155,0 (с), 152,4 (с), 140,8 (с), 138,3 (с), 135,4 (с), 133,4 (д), 131,9 (д), 130,9 (с), 130,8 (д), 128,5 (д), 127,1 (д), 126,4 (д), 81,9 (с), 63,6 (т), 61,2 (т), прибл. 39,9 -1 (т), 33,4 (т), 21,0 (кв), 14,9 (кв), 14,5 (кв) ppm (млн ). 4-[2-(4-Метилфенілсульфаніл)феніл]піперидинHBr: 13 С-ЯМР (D2O, 125,8 МГц): 145,0 (с), 137,5 (с), 134,3 (с), 132,5 (д), 131,7 (с), 131,5 (д), 130,6 -1 (д), 128,5 (д), 127,9 (д), 126,7 (д), 44,0 (т), 36,7 (д), 29,1 (т), 21,0 (кв) ppm (млн ). 1-Бензил-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]піперидинНСl: 13 6 С-ЯМР (d -ДМСО, 125,8 МГц): 144,7 (с), 138,1 (с), 137,5 (с), 133,8 (д), 132,3 (с), 132,0 (д), 131,6 (д), 130,7 (д), 130,1 (с), 129,8 (д), 129,1 (д), 128,2 (д), 126,0 (д), 125,9 (д), 69,4 (с), 59,1 (т), 47,8 (т), 32,7 (т), 21,1 (кв). 2-(4-толілсульфаніл)фенілбромід: 13 6 С-ЯМР (d -ДМСО, 125,8 МГц): 139,5 (с), 139,0 (с), 134,4 (д), 133,3 (д), 131,2 (д), 128,8 (д), 128,0 (с), 127,9 (д), 121,6 (с), 21,2 (кв). Приклад 10. 1-Бензил-4-гідрокси-4-[2-('4-метилфенілсульфаніл)феніл]піперидинНСl 12 UA 98698 C2 5 10 15 149,7 кг 2-(4-толілсульфаніл)фенілброміду (536 моль) суспендували в 282 кг гептану і 19,5 кг безводного тетрагідрофурану (270 моль, 0,5 екв.) і реакційну суміш охолоджували до -15 °C. Додавали 143,8 кг 25 % н-бутиллітію в гептані (561 моль, 1,05 екв.) при температурі від -15 °C до -5 °C, потім температуру знижували до -15 °C. Додавали 104,5 кг N-бензил-4-піперидону (552 моль, 1 екв.), розчиненого в 79 кг (1096 моль, 2 екв.) безводного тетрагідрофурану, при температурі нижче -15 °C і реакційній суміші давали нагрітися до кімнатної температури. Додавали 360 л води, 320 кг етилацетату і 25 л 27,7 % водного розчину гідроксиду натрію, фази розділяли і розчинники з органічної фази видаляли вакуумною дистиляцією (макс. температура 39 °C). Додавали 543 л тетрагідрофурану, видаляли розчинники вакуумною дистиляцією (макс. температура 43 °C), потім додавали ще 541 л тетрагідрофурану. До одержаного розчину додавали 20,4 кг газоподібного хлористого водню (560 ммоль, 1,04 екв.) і додавали кристали 1бензил-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]піперидинуНСl (-форма) як затравку. Одержаний осад відфільтровували, промивали 271 л тетрагідрофурану і сушили на вакуумному фільтрі. (83,9 % вихід, 98,5 % чистота за даними ВЕРХ). Приклад 11. 4-[2-(4-Метилфенілсульфаніл)феніл]піперидинHBr 20 25 30 35 40 42,6 г (0,1 моль) 1-бензил-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]-піперидинуНСІ і 21,2 г (0,2 моль, 2 екв.) карбонату натрію суспендували в 0,2 л ацетону, потім перемішували протягом 1,5 години при кімнатній температурі до припинення виділення газу, додавали 24 мл (0,25 моль, 2,5 екв.) етилхлорформіату і реакційну суміш перемішували протягом ночі. Додавали 0,3 л толуолу і 0,35 л води і одержані фази розділяли. Органічну фазу промивали 0,2 л 20 % водної оцтової кислоти. Органічну фазу збирали і відганяли з неї 0,33 л розчинника. 111 мл (1,5 моль, 15 екв.) трифтороцтової кислоти і 40 мл (0,25 моль, 2,5 екв.) триетилсилану змішували і охолоджували до -15 °C. До суміші трифтороцтова кислота/триетилсилан додавали розчин толуолу так, щоб температура не піднімалася вище -15 °C, потім температурі давали піднятися до кімнатної. Додавали 0,4 л води і 0,35 л толуолу, фази розділяли і органічну фазу промивали 0,3 л води. До органічної фази, яку кип'ятили із зворотним холодильником протягом ночі, додавали 30 мл (0,5 моль, 5 екв.) 2-етаноламіну і промивали 0,25 л 2М водного розчину хлористого водню. Фази розділяли і органічну фазу промивали 75 мл 2М водного розчину хлористого водню. Органічну фазу фільтрували через тканинний фільтр, розчинники відганяли і до розчину, що залишився, додавали 35 мл 5,7М бромистого водню в оцтовій кислоті (0,2 моль, 2 екв.). Одержану суміш нагрівали при 80 °C протягом ночі. Потім реакційну суміш охолоджували до кімнатної температури, додавали 35 мл 5,7М бромистого водню в оцтовій кислоті (0,2 моль, 2 екв.) і реакційну суміш нагрівали при 80 °C протягом 4 годин. Потім реакційну суміш охолоджували до кімнатної температури і відганяли розчинники. Додавали 50 мл 2-пропанолу і 20 мл оцтової кислоти і реакційну суміш кип'ятили із зворотним холодильником. Потім суміші давали охолодитися до кімнатної температури, одержаний осад 13 UA 98698 C2 відфільтровували, промивали 50 мл 2-пропанолу і сушили. Висушену тверду речовину розчиняли в 135 мл киплячої води, одержану суміш охолоджували до кімнатної температури і одержаний осад відфільтровували, промивали 20 мл води і сушили, з одержанням 27,0 г вказаної в заголовку сполуки (74 % вихід). 5 ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання сполуки формули IIІ (III) , 10 де сполуку формули II (II) , 15 де R' і R" незалежно являють собою один, два або три атоми водню, галогену, C1-6алкіл або С2-6-алкілен, і L являє собою відхідну групу, піддають взаємодії з необов'язково заміщеним N-бензил-4-піперидоном , де R'" являє собою водень або -O-C1-6-алкіл, з одержанням сполуки формули IIІ. 2. Спосіб за п. 1, де сполуку формули II 20 (II) , 25 де R' і R" незалежно являють собою один, два або три атоми водню, галогену, С 1-6алкіл або С2-6-алкілен, і L являє собою відхідну групу, піддають взаємодії з металюючим агентом, вибраним з алкіллітію, алкілмагнію або магнію, і необов'язково заміщеним N-бензил-4-піперидоном 14 UA 98698 C2 , де R"' являє собою водень або -О-С1-6-алкіл, при температурі від приблизно -25 °С до приблизно 5 °С, з одержанням сполуки формули III (III). 5 10 3. Спосіб за будь-яким з пп. 1-2, де R' являє собою 4-метил, і R" являє собою водень. 4. Спосіб за будь-яким з пп. 1-3, де R"' являє собою водень. 5. Спосіб за будь-яким з пп. 2-4, де металюючий агент являє собою н-бутиллітій. 6. Спосіб одержання сполуки І (I) 15 і її кислотно-адитивних солей, де R' і R" незалежно являють собою один, два або три атоми водню, галогену, С1-6-алкіл або С2-6-алкілен, який включає стадії взаємодії сполуки формули II (II) , де L являє собою відхідну групу, з необов'язково заміщеним N-бензил-4піперидоном 15 UA 98698 C2 , де R'" являє собою водень або -О-С1-6-алкіл, з одержанням сполуки формули III (III) 5 та подальшим одержанням сполуки І. 7. Спосіб за п. 6 одержання сполуки І (I) 10 і її кислотно-адитивних солей, де R' і R" незалежно являють собою один, два або три атоми водню, галогену, C1-6-алкіл або С2-6-алкілен, який включає стадії взаємодії сполуки формули II (II) , 15 де L являє собою відхідну групу, з металюючим агентом, вибраним з алкіллітію, алкілмагнію або магнію, і необов'язково заміщеним N-бензил-4-піперидоном , де R'" являє собою водень або -О-С1-6-алкіл, при температурі від -25 °С до 5 °С, з одержанням сполуки формули III 16 UA 98698 C2 (III). 5 10 8. Спосіб за будь-яким з пп. 6-7, де R' являє собою 4-метил, і R" являє собою водень. 9. Спосіб за будь-яким з пп. 6-8, де R'" являє собою водень. 10. Спосіб за будь-яким з пп. 7-9, де металюючий агент являє собою н-бутиллітій. 11. Спосіб за будь-яким з пп. 6-10, де сполука II являє собою . 12. Спосіб за будь-яким з пп. 6-11, де вказана вище сіль являє собою адитивну сіль бромистоводневої кислоти. 13. Спосіб за п. 6, де сполука І являє собою або її кислотно-адитивні солі, який включає стадії взаємодії L S H3 C 15 з н-бутиллітієм при температурі нижче 0 °С, з подальшою взаємодією з N-бензил-4піперидоном, при температурі від приблизно 5 °С до приблизно -25 °С, і НСl, з одержанням сполуки формули HCl N S OH H3C , яку далі піддають взаємодії з етилхлорформіатом, з одержанням сполуки формули 17 UA 98698 C2 5 10 , яку потім піддають взаємодії з Et3SiH і трифтороцтовою кислотою, з подальшою взаємодією з кислотою для видалення захисної групи N-піперидину і при необхідності з одержанням бажаної кислотно-адитивної солі. 14. Спосіб за п. 13, де L являє собою Вr. 15. Спосіб за будь-яким з пп. 13-14, де вказана вище сіль є адитивною сіллю бромистоводневої кислоти і де N-захисну групу видаляють шляхом взаємодії з бромистоводневою кислотою в оцтовій кислоті. 16. Спосіб одержання сполуки формули або її кислотно-адитивних солей, який включає стадії взаємодії сполуки формули HCl N S OH H3C з етилхлорформіатом, з одержанням сполуки формули 18 UA 98698 C2 5 10 , яку далі піддають взаємодії з Et3SiH і трифтороцтовою кислотою, з подальшою взаємодією з кислотою для видалення захисної групи N-піперидину і при необхідності з одержанням бажаної кислотно-адитивної солі. 17. Спосіб за п. 16, де вказана вище сіль являє собою адитивну сіль бромистоводневої кислоти і де N-захисну групу видаляють шляхом взаємодії з бромистоводневою кислотою в оцтовій кислоті. 18. Спосіб за п. 14, де сполуку одержують на початковій стадії, на якій 4-метилтіофенол і 2-йодбромбензол піддають взаємодії у присутності джерела паладію і бідентатного фосфінового ліганду при основному рН при підвищених температурах. 19. Сполука формули і) або іі) R'" O N O N O S OH S O O R' 15 20 R' R" R" і) або , іі) де R' і R" незалежно являють собою один, два або три атоми водню, галогену, С 1-6алкіл або С2-6-алкілен, R'" являє собою водень або -O-C1-6-алкіл, i її кислотно-адитивні солі. 20. Сполука за п. 19, вибрана з 1-бензил-4-гідрокси-4-[2-(4-метилфенілсульфаніл)феніл]піперидину і етилового естеру 4-етоксикарбонілокси-4-(2-птолілсульфанілфеніл)-піперидин-1-карбонової кислоти і їх кислотно-адитивних солей. 19 UA 98698 C2 20 UA 98698 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenylsulfanylphenyl-piperidines and process for the preparation thereof
Автори англійськоюRock, Michael, Harold, Brandes, Sebastian
Назва патенту російською[фенилсульфанилфенил]пиперидины и способы их получения
Автори російськоюРок Майкл Харольд, Брандес Себастьян
МПК / Мітки
МПК: C07D 211/52
Мітки: способи, фенілсульфанілфеніл]піперидини, одержання
Код посилання
<a href="https://ua.patents.su/23-98698-fenilsulfanilfenilpiperidini-ta-sposobi-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">[фенілсульфанілфеніл]піперидини та способи їх одержання</a>
Попередній патент: Спосіб будування споруди
Наступний патент: Клапанний пристрій
Випадковий патент: Вибухова речовина "зарс-1"