Сполуки, що мають активність антагоніста crth2
Номер патенту: 104584
Опубліковано: 25.02.2014
Автори: Віттакер Марк, Петтіпгер Ерік Рой, Армер Річард Едвард, Шроер Франк, Віле Джуліа, Винне Грагам Мічаел
Формула / Реферат
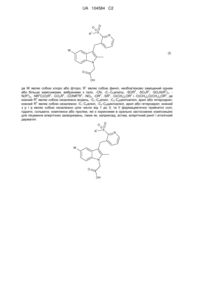
1. Сполука загальної формули (І)
 , (I)
, (I)
де
W являє собою хлор або фтор;
R1 являє собою феніл, необов'язково заміщений одним або більше галоїдними замісниками, або її фармацевтично прийнятна сіль, гідрат або сольват.
2. Сполука загальної формули (II)
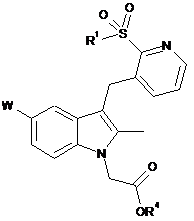 , ІІ
, ІІ
де W являє собою хлор або фтор;
R1 являє собою феніл, необов'язково заміщений одним або більше галоїдними замісниками;
R4 являє собою С1-С6алкіл або бензил,
або її фармацевтично прийнятна сіль.
3. Сполука за п. 1 або п. 2, де W являє собою фтор.
4. Сполука за будь-яким з пунктів 1-3, де фенільна група R1 необов’язково заміщена одним галоїдним замісником.
5. Сполука за п. 4, де галоїдний замісник являє собою фтор або хлор.
6. Сполука за п. 5, де фтор або хлор знаходиться у 4-положенні фенільної групи R1.
7. Сполука, вибрана з групи:
(3-{[2-(бензолсульфоніл)піридин-3-іл]метил}-5-фторо-2-метиліндол-1-іл)-оцтова кислота;
[5-фторо-3-({2-[(4-фторобензол)сульфоніл]піридин-3-іл}метил)-2-метиліндол-1-іл]-оцтова кислота;
[3-({2-[(4-хлоробензол)сульфоніл]піридин-3-іл}метил)-5-фторо-2-метиліндол-1-іл]-оцтова кислота;
або її фармацевтично прийнятна сіль.
8. Спосіб отримання сполуки загальної формули (І) за будь-яким з пунктів 1 або 3-7, в якому сполуку загальної формули (II) за п. 2 піддають реакції з основою у водному або органічному розчиннику або у суміші водного і органічного розчинників.
9. Сполука за будь-яким з пунктів 1-7 для використання у медицині.
10. Сполука за будь-яким з пунктів 1-7 для використання при лікуванні або запобіганні алергічній астмі, цілорічному алергічному риніту, сезонному алергічному риніту, атопічному дерматиту, контактній надмірній чутливості (включаючи контактний дерматит), кон'юнктивіту, особливо алергічному кон'юнктивіту, весняному кератокон'юнктивіту і атопічному кератокон'юнктивіту, еозинофільному бронхіту, харчовим алергіям, еозинофільному гастроентериту, запальному захворюванню кишок, виразковому коліту і хворобі Крона, мастоцитозу, синдрому гіпер-IgЕ, розсіяному склерозу, хронічному обструктивному легеневому захворюванню, фіброзним станам, включаючи ідіопатичний (спонтанний) легеневий фіброз, назальному поліпозу, кропивниці, запаленню стравоходу, мастоцитозу і синдрому Шурга-Штраусса.
11. Застосування сполуки за будь-яким з пунктів 1-7 для отримання засобу для лікування або запобігання алергічній астмі, цілорічному алергічному риніту, сезонному алергічному риніту, атопічному дерматиту, контактній надмірній чутливості (включаючи контактний дерматит), кон'юнктивіту, особливо алергічному кон'юнктивіту, весняному кератокон'юнктивіту і атопічному кератокон'юнктивіту, еозинофільному бронхіту, харчовим алергіям, еозинофільному гастроентериту, запальному захворюванню кишок, виразковому коліту і хворобі Крона, мастоцитозу, синдрому гіпер-ІgЕ, розсіяному склерозу, хронічному обструктивному легеневому захворюванню, фіброзним станам, включаючи ідіопатичний (спонтанний) легеневий фіброз, назальному поліпозу, кропивниці, запаленню стравоходу, мастоцитозу і синдрому Шурга-Штраусса.
12. Спосіб лікування захворювання або стану, опосередкованого дією PGD2 або інших агоністів у СRТН2-рецепторі, де спосіб включає введення пацієнтові, що потребує такого лікування, терапевтично ефективної кількості сполуки за у будь-яким з пунктів 1-7.
13. Спосіб за п. 12, відповідно до якого захворювання або стан вибрано з групи, що складається з
алергічної астми, багаторічного алергічного риніту, сезонного алергічного риніту, атопічного дерматиту, контактної надмірної чутливості (включаючи контактний дерматит), кон'юнктивіту, особливо алергічного кон'юнктивіту, весняного кератокон'юнктивіту і атопічного кератокон'юнктивіту, еозинофільного бронхіту, харчових алергій, еозинофільного гастроентериту, запального захворювання кишок, виразкового коліту і хвороби Крона, мастоцитозу, синдрому гіпер-ІgЕ, розсіяного склерозу, хронічного обструктивного легеневого захворювання, фіброзних станів, включаючи ідіопатичний (спонтанний) легеневий фіброз, назального поліпозу, кропивниці, запалення стравоходу, мастоцитозу і синдрому Шурга-Штраусса.
14. Фармацевтична композиція, яка містить сполуку за будь-яким з пунктів 1-7 разом з фармацевтичним наповнювачем або носієм.
15. Фармацевтична композиція за п. 14, яка має форму, придатну для орального, ректального, назального, бронхіального (інгальованого), локального (включаючи очні краплі, трансбукальне і сублінгвальне введення), вагінального або парентерального (включаючи підшкірне, внутрішньом'язове, внутрішньовенне і внутрішньошкірне введення) застосування.
16. Фармацевтична композиція за п. 14 або п. 15, яка містить один або більше додаткових активних засобів, які є корисними при лікуванні захворювань і станів, опосередкованих дією PGD2 або інших агоністів у СRTН2-рецепторі.
17. Спосіб отримання фармацевтичної композиції за будь-яким з пунктів 14-16, де сполуку за будь-яким з пунктів 1-7 змішують з носієм або наповнювачем, що є фармацевтично або ветеринарно прийнятним.
18. Фармацевтична композиція у формі комбінованого препарату для одночасного, роздільного або послідовного використання для лікування захворювання або стану, опосередкованих дією PGD2 або інших агоністів у СRТН2-рецепторі, яка містить сполуку за будь-яким з пунктів 1-7 і один або більше засобів, корисних для використання при лікуванні захворювань або станів, опосередкованих дією PGD2 або інших агоністів у СRTН2-рецепторі.
19. Застосування сполуки за п. 11, де засіб містить додатковий активний засіб для використання при лікуванні захворювань або станів, опосередкованих дією PGD2 або інших агоністів у CRTH2- і/або DP-рецепторі.
20. Набір для лікування захворювання або стану, опосередкованого дією PGD2 у СRТН2-рецепторі, який містить:
a) перший контейнер, що вміщує сполуку за п. 1 або п. 2; і
b) другий контейнер, що вміщує додатковий засіб для використання при лікуванні захворювання або стану, опосередкованого дією PGD2 або інших агоністів у СRТН2-рецепторі.
Текст
Реферат: Сполуки загальної формули (І) UA 104584 C2 (12) UA 104584 C2 O O S 1 R N W (I) N O OH 1 де W являє собою хлоро або фторо; R являє собою феніл, необов'язково заміщений одним 3 3 2 або більше замісниками, вибраними з гало, -CN, -С1-С6алкілу, -SOR , -SO2R , -SO2N(R )2, 2 2 3 2 2 3 2 2 2 2 N(R )2, -NR C(O)R , -CO2R , -CONR R , -NO2, -OR , -SR , -O(CH2)рOR і -O(CH2)pO(CH2)qOR , де 2 кожний R являє собою незалежно водень, -С1-С6алкіл, -С3-С8циклоалкіл, арил або гетероарил; 3 кожний R являє собою незалежно -С1-С6алкіл, -С3-С8циклоалкіл, арил або гетероарил; кожний з р і q являє собою незалежно ціле число від 1 до 3; та її фармацевтично прийнятні солі, гідрати, сольвати, комплекси або проліки, які є корисними в орально застосовних композиціях для лікування алергічних захворювань, таких як, наприклад, астма, алергічний риніт і атопічний дерматит. O 1 R O S N W N O OH UA 104584 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до сполук, які є корисними як фармацевтичні препарати, до способів приготування цих сполук, композицій, які містять їх, і їхнього використання при лікуванні і запобіганні алергічних захворювань, таких як, наприклад, астма, алергічний риніт й атопічний дерматит, та інших запальних захворювань, опосередкованих дією простогландину D 2 (PGD2) або інших агоністів у CRTH2-рецепторі на клітини, включаючи еозинофіли, базофіли і Th2-лімфоцити. PGD2 являє собою ейкозаноїд – клас хімічного медіатора, який синтезується клітинами у відповідь на місцеве ушкодження тканини, нормальні подразники або гормональні подразники або via провідні шляхи клітинної активації. Ейкозаноїди зв'язуються із специфічними рецепторами поверхні клітин широкого ряду тканин по всьому тілу і служать посередником для виникнення різноманітних ефектів в цих тканинах. Відомо, що PGD 2 продукується мастоцитами, макрофагами і Th2-лімфоцитами і виявляється у високих концентраціях у дихальних шляхах хворих астмою, стимульованою антигеном (Murray et al, (1986), N. Engl. J. Med. 315: 800 – 804). Інстиляція PGD2 у дихальні шляхи може спровокувати багато ознак астматичної реакції, включаючи бронхостеноз (Hardy et al, (1984) N. Engl. J. Med. 311: 209 – 213; Sampson et al, (1997) Thorax 52: 513 – 518) і накопичення еозинофілів (Emery et al, (1989) J. Appl. Physiol. 67: 959 – 962). Потенціал екзогенно застосовуваного PGD 2 для індукування запальних реакцій підтверджений використанням трансгенних мишей, надекспресуючих людську PGD 2-синтазу, що прискорює еозинофільне запалення легень і продукування Th2-цитокіну у відповідь на дію антигену (Fujitani et al, (2002) J. Immunol. 168: 443 – 449). Першим специфічним до PGD2 рецептором, що був відкритий, став DP-рецептор, який зв'язаний з підвищенням внутрішньоклітинних рівнів cAMP. Проте вважається, що велику частину своєї посередницької ролі в протизапальній активності PGD 2 грає через взаємодію з рецептором, зв'язаним з G-протеїном і іменованим CRTH2 (гомологічна молекула хемотактичного рецептора, експресована на Th2-клітинах), що експресується Th2-лімфоцитами, еозинофілами і базофілами (Hirai et al, (2001) J. Exp. Med. 193: 255 – 261, і EP0851030 і EP-A1211513 і Bauer et al, EP-A-1170594). Стає ясним, що вплив PGD2 на активацію Th2-лімфоцитів і еозинофілів опосередкований через CRTH2, оскільки селективні агоністи CRTH2 13,14 дигідро15-кето-PGD2 (DK-PGD2) і 15R-метил-PGD2 можуть виявити цю реакцію, і дія PGD2 блокується анти-CRTH2 антитілом (Hirai et al, 2001; Monneret et al, (2003) J. Pharmacol. Exp. Ther. 304: 349 – 355). На відміну від цього, селективний DP-агоніст BW245C не стимулює міграцію Th2лімфоцитів або еозинофілів (Hirai et al, 2001; Gervais et al, (2001) J. Allergy Clin. Immunol. 108: 982 – 988). Ґрунтуючись на цих фактах, можна зробити висновок, що протидія PGD2 у CRTH2рецепторі є привабливим підходом для лікування запальної складової Th2-залежних алергічних захворювань, наприклад, астми, алергічного риніту й атопічного дерматиту. У EP-A-1170594 запропонований спосіб, який може бути використаний для ідентифікації сполук, корисних при лікуванні алергічної астми, атопічного дерматиту, алергічного риніту, аутоімунного захворювання, реперфузійної травми і ряду запальних станів, причому усі вони опосередковані дією PGD2 або інших агоністів у CRTH2-рецепторі. Сполуки, що зв'язуються з CRTH2, розкриті в WO-A-03066046 і WO-A-03066047. Ці сполуки не є новими, але вони були розкриті вперше разом з аналогічними сполуками в GB 1356834, GB 1407658 і GB 1460348, де вони були заявлені як такі, що мають протизапальну, болезаспокійливу і жарознижуючу дію. В WO-A-03066046 і WO-A-03066047 розкриті сполуки, які є модуляторами активності CRTH2-рецептора і, таким чином, корисні при лікуванні або запобіганні обструктивних захворювань дихальних шляхів, наприклад, астми, хронічного обструктивного захворювання легень (COPD) і ряду інших хвороб, що включають різні стани кісток і суглобів, шкіри й очей, шлунково-кишкового тракту, центральної і периферичної нервової системи та інших тканин, а також відторгнення алотрансплантату. Усі ці сполуки являють собою похідні індолу з оцтовою кислотою як замісником в 3-положенні індольного кільця. PL 65781 і JP 43-24418 також відносяться до похідних індол-3-оцтової кислоти, які за своєю структурою аналогічні індометацину і, подібно індометацину, заявлені як такі, що мають протизапальну і жарознижуючу дію. Таким чином, хоча це і не могло бути оцінене на момент опублікування цих документів, описані сполуки являють собою інгібітори COX, тобто активності, яка цілком відрізняється від активності сполук, запропонованих у відповідності до даного винаходу. Дійсно, інгібітори COX протипоказані при лікуванні багатьох хвороб і станів, наприклад, астми і запальних захворювань кишечнику, для яких сполуки у відповідності до даного винаходу є корисними, хоча вони і можуть іноді використовуватися для лікування артритичних станів. Крім того, з попереднього рівня техніки відома додаткова інформація, яка відноситься до 1 UA 104584 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполук індол-1-оцтової кислоти, хоча ці сполуки й не описані як антагоністи CRTH2. Наприклад, WO-A-9950268, WO-A-0032180, WO-A-0151849 і WO-A-0164205 усі вкупі відносяться до сполук, що являють собою похідні індол-1-оцтової кислоти, але ці сполуки заявлені як інгібітори альдозоредуктази, які корисні при лікуванні цукрового діабету (WO-A-9950268, WO-A-0032180 і WO-A-0164205), або як гіпоурикемічні засоби (WO-A-0151849). У жодному з цих документів відсутня інформація про те, що ці сполуки могли би бути корисними для лікування захворювань і станів, опосередкованих PGD2 або іншими агоністами CRTH2-рецептора. US 4,363,912 відноситься до похідних індол-1-алкілкарбонової кислоти (включаючи аналоги індол-1-оцтової кислоти), які заявлені як інгібітори тромбоксан-синтетази і як корисні при лікуванні таких станів, як тромбоз, ішемічна хвороба серця й інсульт. Ці сполуки мають в еквівалентному положенні незаміщений 3-піридил- або 4-піридил- замісник до піридильної групи загальної формули (I). Оцінювальне порівняння найближчого аналога (5-фтор-2-метил-3(піридин-3-ілметил)-індол-l-іл)-оцтова кислот), що підпадає під формулу винаходу US 4,363,912, зі сполуками, запропонованими у відповідності до даного винаходу, свідчить про те, що він є значно менш активним як антагоніст CRTH2, ніж сполуки у відповідності до даного винаходу. На відміну від сполук у відповідності до даного винаходу (які усі являють собою похідні індол-1оцтової кислоти), переважними сполуками в рамках US 4,363,912 є похідні 3-(індол-l-іл)пропіонової кислоти. WO-A-9603376 відносяться до сполук, які заявлені як інгібітори sPLA2 і які є корисними при лікуванні бронхіальної астми й алергічного риніту. Усі ці сполуки мають амідні або гідразидні замісники замість похідної карбонової кислоти сполук, запропонованих у відповідності до даного винаходу. JP 2001247570 відноситься до способу виробництва 3-бензотіазолілметиліндолоцтової кислоти, яка заявлена як інгібітор альдозоредуктази. US 4,859,692 відноситься до сполук, які заявлені як антагоністи лейкотрієну і які є корисними при лікуванні таких станів, як астма, сінна лихоманка й алергічний риніт, а також деяких запальних станів, таких як, наприклад, бронхіт, атопічна і ектопічна екзема. Деякі із сполук, зазначених в цьому документі, являють собою індол-1-оцтові кислоти, проте в публікації в J. Med. Chem., 33, 1781-1790 (1990) ці ж автори заявляють, що група оцтової кислоти на азоті індолу не має значної пептидолейкотрієнової активності. US 4,273,782 відноситься до сполук, які заявлені як корисні при лікуванні таких станів як, наприклад, тромбоз, ішемічна хвороба серця, інсульт, короткочасне порушення мозкового кровообігу, мігрень і судинні ускладнення, викликані діабетом. В цьому документі немає жодного згадування про стани, опосередковані дією PGD 2 або іншими агоністами у CRTH2-рецепторі. US 3,557,142 відноситься до 3-заміщених 1-індолілкарбонових кислот і складних ефірів, які заявлені як корисні при лікуванні запальних станів. WO-A-03/097598 відноситься до сполук, які є антагоністами CRTH2-рецептора. Вони не мають арилового замісника в 3-положенні індолу. Публікація Cross et al, J. Med. Chem. 29, 342 – 346 (1986) відноситься до способу приготування похідних індол-1-оцтової кислоти з відповідних складних ефірів. Сполуки, до яких він відноситься, заявлені як інгібітори тромбоксан-синтетази. ЕР-А-0539117 відноситься до похідних індол-1-оцтової кислоти, які заявлені як антагоністи лейкотрієну. US 2003/0153751 відноситься до похідних індол-1-оцтової кислоти, які є інгібіторами sPLA2. Проте, усі підтверджені прикладами сполуки мають громіздкі замісники в 2- і 5-положеннях індольної системи і, таким чином, значно відрізняються від сполук, запропонованих у відповідності до даного винаходу. В US 2004/011648 розкриті похідні індол-1-оцтової кислоти, які є інгібіторами PAI-1. В цьому документі відсутня жодна вказівка на те, що ці сполуки могли б мати активність антагоніста CRTH2. WО 2004/058164 відноситься до сполук, які заявлені як модулятори астми й алергічного запалення. Єдині сполуки, які демонструють активність, повністю відрізняються за структурою від похідних індол-1-оцтової кислоти, запропонованих у відповідності до даного винаходу. Сполуки, що зв'язуються з CRTH2-рецептором, розкриті в WO-A-03/097042 і WO-A03/097598. Ці сполуки являють собою індолілоцтові кислоти, але в WO-A-03/097042 зазначено, що індольна система зливається в 2- і 3-положеннях з 5- – 7-членним карбоксильним кільцем. В WO-A-03/097042 зазначено, що в 3-положенні індолу знаходиться піролідинова група. WO-A-03/101981, WO-A-03/101961 і WO-A-2004/007451 усі вкупі відносяться до похідних індол-1-оцтової кислоти, які заявлені як антагоністи CRTH2, але які відрізняються за структурою від сполук загальної формули (I), оскільки немає жодної роздільної групи чи –S- або –SO2-групи, 2 UA 104584 C2 5 10 15 20 25 30 35 40 45 50 прикріпленої до 3-положення індолу замість групи CH2 сполук, запропонованих у відповідності до даного винаходу. В WO-A-2005/019171 також описані похідні індол-1-оцтової кислоти, які заявлені як антагоністи CRTH2 і які заявлені як корисні для лікування різних респіраторних захворювань. Ці сполуки усі мають замісник, який зв'язаний з 3-положенням індолу кисневою роздільною групою. В WO-A-2005/094816 знову ж описані сполуки індол-1-оцтової кислоти – на цей раз з аліфатичним замісником у 3-положенні індольного кільця. Ці сполуки заявлені як антагоністи CRTH2. WO-A-2006/034419 відноситься до індольних сполук як антагоністів CRTH2, які мають гетероциклічний або гетероарильний замісник, безпосередньо зв'язаний з 3-положенням системи індольного кільця. В нашій попередній заявці WO-A-2005/044260 нами були описані сполуки, які є антагоністами PGD2 в CRTH2-рецепторі. Ці сполуки являють собою похідні індол-1-оцтової 8 9 9 8 кислоти, заміщені у 3-положенні групою CR R , де R являє собою водень або алкіл, а R являє собою арильну групу, яка може бути заміщена одним або більше замісниками. Сполуки, що описані в цьому документі, є ефективними антагоністами PGD2 в CRTH2-рецепторі in vitro. Проте, нами було виявлено, що при випробуванні in vivo фармакокінетичний профіль деяких сполук не є оптимальним, а їхня ефективність у випробуванні на змінення форми еозинофілів цільної крові, яке дає індикацію подібної до in vivo активності сполук, часто до певної міри є меншою, ніж це могло б очікуватись від результатів зв'язування in vitro. В іншій з наших попередніх заявок, а саме в WO2006/095183, похідні індол-1-оцтової кислоти заміщені у 3-положенні l-бензолсульфоніл-lH-пірол-2-ілметильной групою, де фенільна група бензолсульфонільної складової може бути заміщена. Ці сполуки є надзвичайно активними антагоністами CRTH2, але швидко засвоюються, що виявлено шляхом інкубування препаратами мікросоми людини. Наша заявка WO2008/012511 також відноситься до сполук-антагоністів CRTH2 – на цей раз похідних індол-1-оцтової кислоти, заміщених у 3-положенні 2- фенілсульфонілбензильною групою. Було виявлено, що положення фенілсульфонільного замісника мало значний вплив як на активність сполук, так і на їхній фармакокінетичний профіль. Даний винахід відноситься до піридилових аналогів сполук, розкритих в WO2008/012511. Ці сполуки не мають недоліків, зв'язаних з метаболічною стабільністю сполук, розкритих в WO2006/095183, і, на подив, було виявлено, що конкретні регіоізомери піридилу і їхнє заміщення приводять до оптимального балансу ефективності і фармакокінетичних властивостей. Більш конкретно, було виявлено, що введення фенілсульфонільного замісника на 2-положення піридин-3-ільного регіоізомера забезпечує одержання сполук з високою ефективністю в функціональному аналізі in vitro разом з хорошою фармакокінетикою in vivo. Факт, що ця комбінація має привести до одержання вельми сприятливої комбінації властивостей не є очевидним, і про це не згадувалося ні в літературі, ні в патентних заявках, що відносяться до антагоністів CRTH2. Особливо викликає подив те, що 2-бензолсульфонілпіридин-3-ільні сполуки є ефективними і специфічними антагоністами CRTH2-рецептора як у аналізі на зв'язування рецептора, так і у функціональному аналізі in vitro, оскільки нами було установлено, що 3-бензолсульфоніл-піридин-2-ільний аналог є значно менш ефективним і що 3бензолсульфоніл-піридин-4-ільний аналог демонструє більш низьку активність у функціональному аналізі in vitro, ніж це могло б очікуватися від його активності у зв'язування рецептора. Таким чином, можна зробити висновок, що положення азоту піридилу є особливо значним чинником в сполуках, запропонованих у відповідності до даного винаходу. Таким чином, даний винахід відноситься до нових сполук, які зв'язуються з CRTH2рецептором і які, таким чином, корисні при лікування захворювань і станів, опосередкованих активністю PGD2 в CRTH2-рецепторі. В даному винаході запропонована сполука загальної формули (I) 3 UA 104584 C2 O O 1 R S W N (I) N O OH 5 10 15 20 25 30 35 40 45 де W являє собою хлоро або фторо; 1 R являє собою феніл, необов'язково заміщений одним або більше замісниками, вибраними 3 3 2 2 2 3 2 2 3 з гало, –CN, –Ci-C6 алкіл, –SOR , –SO2R , –SO2N(R )2, –N(R )2, –NR C(O)R , –CO2R , –CONR R , 2 2 2 2 –NO2, –OR , –SR , –O(CH2)pOR і –O(CH2)pO(CH2)qOR , де 2 кожний R являє собою незалежно водень, –C1-C6 алкіл, –C3-C8 циклоалкіл, арил або гетероарил; 3 кожний R являє собою незалежно –C1-C6 алкіл, –C3-C8 циклоалкіл, арил або гетероарил; кожний з p і q являє собою незалежно ціле число від 1 до 3; або її фармацевтично прийнятна сіль, гідрат, сольват, комплекс або проліки. Сполуки загальної формули (I) являють собою антагоністи в CRTH2-рецепторі і є корисними при лікуванні станів які, опосередковані PGD2 або іншими агоністами, що зв'язуються з CRTH2. До них відносяться алергічні захворювання, астматичні стани і запальні захворювання, прикладами яких є астма, включаючи таку, як алергічна астма, бронхіальна астма, загострення астми і пов'язані з нею алергічні захворювання, обумовлені вірусною інфекцією, особливо такі загострення, які викликані риновірусом і респіраторно-синцитіальним вірусом, ендогенна, екзогенна астма, астма, пов'язана з м'язовим навантаженням, медикаментозна астма, астма, викликана пилом, лікуванні кашлю, включаючи постійний кашель, пов'язаний із запальним і секреторним станом дихальних шляхів, і ятрогенний кашель, гострого і хронічного риніту, включаючи медикаментозний риніт, вазомоторний риніт, багаторічний алергічний риніт, сезонний алергічний риніт, назального поліпозу, гострої вірусної інфекції, включаючи нежить, інфекції, викликаної респіраторно-синцитіальним вірусом, грипом, коронавірусом і аденовірусом, атопічного дерматиту, контактної надмірної чутливості (включаючи контактний дерматит), екзематозного дерматиту, фітодерматиту, фотодерматиту, себорейної екземи, герпетиформного дерматиту, червоного плоского лишаю, склероатрофічного лишаю, гангренозної піодермії, саркоїду шкіри, дископодібного вовчакового еритематозу, пухирчатки, пемфігоїду, бульозної епідермолічної кропивницї, гігантської кропивниці, васкуліту, токсичних еритем, еозинофільного лейкоцитозу шкіри, гніздової алопеції, плішивості чоловічого типу, синдрому Світа, синдрому Вебера-Крисчена, багатоформної еритеми, целюліту, панікуліту, лімфом шкіри, немеланомного раку шкіри та інших диспластичних травм; блефаритного кон'юнктивіту, особливо алергічного кон'юнктивіту, переднього і заднього увеїту, хороїдиту, аутоімунних, дегенеративних або запальних розладів, що впливають на сітківку, офтальмії; бронхіту, включаючи інфекційний і еозинофільний бронхіт, емфіземи, бронхоектазу, екзогенного алергічного альвеоліту, гіперчутливого пневмоніту, ідіопатичних інтерстиціальних пневмоній, ускладнень трансплантації легені, судинних і тромботичних розладів судинної легеневої сітки, легеневої гіпертензії, харчової алергії, гінгівіту, глоситу, пародонтиту, запалення стравоходу, включаючи рефлюкс, еозинофільного гастроентериту, проктиту, анального свербіжу, глютенової хвороби, пов'язаних з їжею алергій, запального захворювання кишок, виразкового коліту і хвороби Крона, мастоцитозу, а також інших CRTH2-опосередкованих хвороб, наприклад, аутоімунних захворювань, таких як, наприклад, синдром гіпер-IgE, тіреоідиту Хашимото, хвороби Грейвса, хвороби Аддисона, цукрового діабету, ідіопатичної тромбоцитопеничної пурпури, еозинофільного пахістозу, антифосфоліпідного синдрому і системного червоного вовчака, СНІД, прокази, синдрому Сезарі, паранеопластичного синдрому, змішаних і недиференційованих захворювань з'єднувальної тканини, запальних міопатій, включаючи дерматоміозит і поліміозит, поліміальгічного ревматичного синдрому, ювенільного артриту, ревматичної лихоманки, васкуліту, включаючи гігантоклітинний артеріїт, синдрому Такаясу, синдрому Шурга-Штраусса, періартеріїту, мікроскопічного поліартеріїту, темпорального 4 UA 104584 C2 5 10 15 20 25 30 35 40 45 50 55 60 артеріїту, міастенічного паралічу, гострого і хронічного болю, синдромів невропатичного болю, злоякісних ускладнень центральні і периферійні нервової системи, інфекційних або аутоімунних процесів, поперекового болю, сімейної лептоспірозної жовтухи, синдрому Макла-Велса, сімейної ірландської лихоманки, хвороби Кікучи, псоріазу, акне, розсіяного склерозу, відторгнення алотрансплантата, реперфузійної травми, хронічного обструктивного легеневого захворювання, а також ревматоїдного артриту, хвороби Стілла, анкілозуючого спондилоартриту, реактивного артриту, недиференційованої спондилоартропатії, псоріатичного артриту, септичного артриту та інших пов'язаних з інфекцією артропатій і розладів кісткової тканини і остеоартриту; гострого і хронічного мікрокристалічного синовіту, включаючи уратну подагру, захворювання, викликаного відкладенням пірофосфату кальцію, синдрому, з пов'язаного відкладенням солей кальцію у сухожиллях, і синовіального запалювання, хвороби Бехчета, системного склерозу, викликаного первинним і вторинним синдромом Шегрена, і обмеженої склеродерми; гепатиту, цирозу печінки, холециститу, панкреатиту, нефриту, нефритичного синдрому, циститу і хронічної виразки сечового міхура, гострого і хронічного уретриту, простатиту, епідидиміту, оофориту, сальпінгиту, вульвовагіниту, хвороби Пейроні, ериктильної дисфункції, хвороби Альцгеймера та інших розладів, пов'язаних із слабоумством; перикардиту, міокардиту, запалювальних і аутоімунних кардіоміопатій, включаючи міокардіальний саркоїд, ішемічних перфузійних травм, ендокардиту, вальвуліту, аортиту, флебіту, тромбозу, лікуванні загальних ракових захворювань і фіброзних станів, таких як, наприклад, ідіопатичний легеневий фіброз, включаючи криптогенний фіброзний альвеоліт, келоїдів, надмірного фіброзного рубцювання/зрощування під час післяопераційного лікування, фіброзу печінки, включаючи фіброз, що асоціюється з гепатитом B і C, фіброми матки, саркоїдозу, включаючи нейросаркоїдоз, склеродерми, фіброзу нирки, викликаного діабетом, фіброзу, пов'язаного з ревматоїдним артритом, атеросклерозу, включаючи атеросклероз мозку, васкуліту, міокардіального фіброзу, викликаного міокардіальним порушенням, кістозного фіброзу, рестенозу, системного склерозу, хвороби Дюпуатрена, фіброзу, що ускладнює протипухлинну терапію і хронічні інфекційні захворювання, включаючи туберкульоз і аспергіломікоз, та інших мікозів, інсульту, викликаного фіброзом центральної нервової системи або стимулювання гоєння без фіброзного рубцювання. Покращена ефективність у випробуванні на змінення форми еозинофілів цільної крові і фармакокінетичного профілю сполук загальної формули (I) є особливо вражаючою, оскільки деякі сполуки з WO-A-2005/044260, які є найближчими за своєю структурою до сполук загальної формули (I), не мають цих переважних властивостей. Більш конкретно, сполука у відповідності до Прикладу 17 з WO-A-2005/044260 аналогічна сполукам, запропонованим у відповідності до даного винаходу, і очікувано мала би мати аналогічні властивості. Проте, в експериментах in vivo, проведених на собаці, заміна 4-метилсульфонілбензильної групи в Прикладі 17 з WO-A2005/044260 на 2-(бензолсульфоніл)піридин-3-ілметильну групу в сполуках формули (I) має значний вплив на фармакокінетику цих сполук, оскільки при оральному введенні сполуки у відповідності до Прикладу 17 з WO-A-2005/044260 її фармакокінетичний профіль in vivo є менш сприятливим, ніж у сполук загальної формули (I). Крім того, нами було встановлено, що для багатьох сполук з WO-A-2005/044260 їхня активність у зміненні форми еозинофілів цільної крові і фармакокінетичного профілю in vitro часто є меншою, ніж мала б очікуватися від їхньої активності in vitro, як це було визначено в експериментах на радіолігандне зв'язування по відношенню до CRTH2-рецептора. Крім того, покращення в активності є дуже специфічним до груп сполук загальної формули (I). Сполуки, які навіть більш близько відносяться до сполук, конкретно розкритих в WO-A2005/044260, не мають таких переважних властивостей. Наприклад, аналоги загальної формули (I), в яких група SO2R не знаходиться в положенні на піридиновому кільці, суміжному із зв'язаною метиленовою складовою, які зв'язана з 3-положенням індолільним каркасом, є менш активними у випробуваннях in vitro на змінення форми еозинофілів цільної крові. В контексті даного опису "алкіл C1-C6" відноситься до насиченого вуглеводню з нерозгалуженим або розгалуженим ланцюгом, що має від одного до шести атомів вуглецю і необов'язково заміщений одним або більше галоїдних замісників і/або однією або більше циклоалкільними групами C3-C8. Приклади таких груп включають метил, етил, n-пропіл, ізопропіл, t-бутил, n-гексил, трифторметил, 2-хлоретил, метиленциклопропіл, метиленциклобутил і метиленциклопентил. Термін "алкіл C1-C18" має те ж значення, як це зазначено віще, за винятком того, що він відноситься до насиченого вуглеводню з нерозгалуженим або розгалуженим ланцюгом, що має від одного до вісімнадцяти атомів вуглецю. В контексті даного опису "циклоалкіл C3-C8" відноситься до насиченої карбоциклічної групи, 5 UA 104584 C2 5 10 15 20 25 30 35 40 яка має в кільці від 3 до 8 атомів і необов'язково заміщена одним або більше галоїдними замісниками. Приклади таких груп включають циклопропіл, циклопентил, циклогексил і 4фтороциклогексил. В контексті даного опису "гало" відноситься до фторо, хлоро, бромо або йодо. Терміни "арил" в контексті даного опису відносяться до системи кілець ароматичного ряду, що має в кільці від 5 до 14 атомів вуглецю й містить до трьох кілець. У тому випадку, коли арильна група містить більш, ніж одне кільце, не усі кільця мають повністю відноситись до ароматичного ряду. Прикладами таких складових ароматичного ряду є бензол, нафталін, індан і інден. Термін "гетероарил" в контексті даного опису відносяться до системи кілець ароматичного ряду, що має в кільці від 5 до 14 атомів вуглецю, щонайменше, один з яких являє собою гетероатом, вибраний з N, O і S, і містить до трьох кілець. У тому випадку, коли гетероарильна група містить більш, ніж одне кільце, не усі кільця мають повністю відноситись до ароматичного ряду. Приклади таких гетероарильних груп включають піридин, піримідин, індол, бензофуран, бензімідазол і індолен. Підходящі фармацевтично і ветеринарно прийнятні солі сполук загальної формули (I) включають основні солі приєднання, наприклад, солі натрію, калію, кальцію, алюмінію, цинку, магнію та інші солі металів, а також холін, діетаноламін, етаноламін, етилдіамин та інші добре відомі основні солі приєднання, як це узагальнено в Paulekuhn et al., (2007) J. Med. Chem. 50: 6665-6672 і/або в інших публікаціях, відомих спеціалістам в даній області техніки. Солі, які не є фармацевтично або ветеринарно прийнятними, також можуть являти цінність як проміжні продукти. Проліки являють собою будь-які ковалентно зв'язані сполуки, що вивільняють активну материнську лікарську речовину відповідно до загальної формули (I) in vivo. Приклади таких проліків включають складні алкілові ефіри сполук загальної формули (I), такі як, наприклад, складні ефіри представленої нижче загальної формули (II). В особливо підходящих сполуках загальної формули (I) W являє собою фторо-замісник, а 1 фенільна група R не заміщена або заміщена одним галоїдним замісником, як правило, фторо 1 або хлоро, який взагалі знаходиться на 4-положенні фенільної групи R . Особливо активними сполуками у відповідності до даного є: (3-{[2-(Бензолсульфоніл)піридин-3-іл]метил}-5-фторо-2-метиліндол-l-іл)-оцтова кислота; [5-Фторо-3-({2-[(4-фторобензол)сульфоніл]піридин-3-іл}метил)-2-метиліндол-l-іл]-оцтова кислота; [3-({2-[(4-Хлоробензол)сульфоніл]піридин-3-іл}метил)-5-фторо-2-метиліндол-l-іл]-оцтова кислота; або їхній складний C1-C6 алкіловий, ариловий, (CH2)mOC(=O)C1-C6 алкіловий, 5 6 ((CH2)mO)nCH2CH2X, (CH2)mN(R )2 або CH((CH2)mO(C=O)R )2 ефір; m дорівнює 1 або 2; n дорівнює 1 – 4; 5 5 X являє собою OR або N(R )2; 5 R являє собою водень або метил; 6 R являє собою C1-C18 алкіл. У відповідності до додаткового аспекту даного винаходу запропоновано сполуку загальної формули (II): 45 O R 1 S O N W N O OR 1 50 4 де W і R – як це визначено для загальної формули (I); а 4 R являє собою C1-C6 алкіл, C1-C6 алкіл, заміщений арилом, арил, (CH2)mOC(=O)C1-C6 алкіл, 5 6 ((CH2)mO)nCH2CH2X, (CH2)mN(R )2 або CH((CH2)mO(C=O)R )2; 6 UA 104584 C2 5 10 15 20 m дорівнює 1 або 2; n дорівнює 1 – 4; 5 5 X являє собою OR або N(R )2; 5 R являє собою водень або метил; 6 R являє собою C1-C18 алкіл; або їхню фармацевтично прийнятну сіль, гідрат, сольват, комплекс або проліки. Сполуки загальної формули (II) є новими і можуть бути використані як проліки для сполук загальної формули (I). Коли сполука загальної формули (II) діє як проліки, вона пізніше трансформується у лікарську речовину під впливом естерази, що знаходиться в крові або в тканинах пацієнта. 4 Приклади особливо підходящих груп R , коли сполука загальної формули (II) 5 використовується як проліки, включають метил, етил, пропіл, феніл, –O(CH2)2O(CH2)2OR , – 5 5 5 O(CH2)2О(CH2)2O(CH2)2ОR , –O(CH2)2O(CH2)2NR 2, –O(CH2)2O(CH2)2O(CH2)2NR 2, –CH2 °C(=O)tBu, 6 5 6 –CH2CH2N(Me)2, –CH2CH2NH2 або –CH(CH2O(C=O)R )2, де R і R – як це визначено вище. 4 На додаток до їхнього використання як проліки, сполуки формули (IІ), де R являє собою С1С6 алкіл або бензил, можуть бути використані в способі приготування сполуки загальної формули (I), причому спосіб включає введення сполуки загальної формули (II) в реакцію з основою, такою як, наприклад, гідроксид натрію або гідроксид літію. Реакція може мати місце у водному розчиннику або в органічному розчиннику або у суміші обох цих розчинників. Типовий розчинник, використовуваний для реакції, являє собою суміш тетрагідрофурану і води. Сполуки загальної формули (ІІ) можуть бути приготовані зі сполуки загальної формули (ІІІ): W N (ІІІ) O OR 4 4 25 де W – як це визначено в загальній формулі (I), а R – як це визначено в загальній формулі (II); шляхом проведення реакції з альдегідом загальної формули (IV): O S N R 1 (IV) O O 1 30 35 де R – як це визначено для загальної формули (I). Реакція може бути здійснена в присутності триметилсилілтрифлату (TMSOTf) в неполярному органічному розчиннику і при приведеній температурі, наприклад, від –5 до 10 °C, як правило, при 0 °C. Проміжний продукт потім відновлюють, наприклад, тріалкілсиланом, таким як, наприклад, тріетилсилан. Методика приготування сполук загальної формули (III) відома спеціалістам в даній області техніки і, в загальних рисах, передбачає алкілування похідної 5-гало-індолу у 1-положенні похідною альфа-бромацетату або спорідненим алкілуючим засобом. Похідні 5-гало-індолу можна легко знайти на ринку або вони можуть бути приготовані способами, відомими спеціалістам в даній області техніки. Сполуки загальної формули (IV) можуть бути приготовані шляхом введення сполуки загальної формули (V): O (V) X N 7 UA 104584 C2 5 10 15 20 25 30 35 40 45 50 55 60 де X являє собою групу, що відщеплюється, таку як, наприклад, гало, особливо фторо або хлоро; в реакцію зі сполукою загальної формули (VI): 1 R –SO2Na (VI) 1 де R – як це визначено для загальної формули (I). Реакція може бути здійснена в полярному органічному розчиннику, такому як, наприклад, DMSO, при підвищеній температурі, як правило, при температурі флегми, протягом тривалого періоду часу, наприклад, від 48 до 120 годин. Сполуки загальної формули (V) і (VI) є комерційно доступними. Сполуки загальної формули (I) являють собою антагоністи CRTH2-рецептора, а сполуки загальної формули (II) являють собою проліки для сполуки загальної формули (I). Сполуки загальних формул (I) і (II) є, таким чином, корисними в способі лікування захворювань і станів, опосередкованих PGD2 або іншими агоністами у CRTH2-рецепторі, причому такий спосіб включає введення пацієнтові, що потребує такого лікування, підходящої кількості сполуки загальної формули (I) або (II). У відповідності до третього аспекту винаходу запропоновано сполуку загальної формули (I) або (II) для використання в медицині, особливо для використання при лікуванні або запобіганні захворювань і станів, опосередкованих PGD2 або іншими агоністами CRTH2-рецептора. Крім того, запропоновано також використання сполуки загальної формули (I) або (II) в приготування засобу для лікування або запобігання захворювань і станів, опосередкованих агоністами CRTH2-рецептора, особливо PGD2. Як було зазначено вище, такі захворювання і стани включають алергічні захворювання, прикладами яких є астма, включаючи таку, як алергічна астма, бронхіальна астма, ендогенна, екзогенна астма, астма, пов'язана з м'язовим навантаженням, медикаментозна астма, астма, викликана пилом, лікуванні кашлю, включаючи постійний кашель, пов'язаний із запальним і секреторним станом дихальних шляхів, і ятрогенний кашель, гострого і хронічного риніту, включаючи медикаментозний риніт, вазомоторний риніт, багаторічний алергічний риніт, сезонний алергічний риніт, назального поліпозу, гострої вірусної інфекції, включаючи нежить, інфекції, викликаної респіраторно-синцитіальним вірусом, грипом, коронавірусом і аденовірусом, атопічного дерматиту, контактної надмірної чутливості (включаючи контактний дерматит), екзематозного дерматиту, фітодерматиту, фотодерматиту, себорейної екземи, герпетиформного дерматиту, червоного плоского лишаю, склероатрофічного лишаю, гангренозної піодермії, саркоїду шкіри, дископодібного вовчакового еритематозу, пухирчатки, пемфігоїду, бульозної епідермолічної кропивницї, гігантської кропивниці, васкуліту, токсичних еритем, еозинофільного лейкоцитозу шкіри, гніздової алопеції, плішивості чоловічого типу, синдрому Світа, синдрому Вебера-Крисчена, багатоформної еритеми, целюліту, панікуліту, лімфом шкіри, немеланомного раку шкіри та інших диспластичних травм; блефаритного кон'юнктивіту, особливо алергічного кон'юнктивіту, переднього і заднього увеїту, хороїдиту, аутоімунних, дегенеративних або запальних розладів, що впливають на сітківку, офтальмії; бронхіту, включаючи інфекційний і еозинофільний бронхіт, емфіземи, бронхоектазу, екзогенного алергічного альвеоліту, гіперчутливого пневмоніту, ідіопатичних інтерстиціальних пневмоній, ускладнень трансплантації легені, судинних і тромботичних розладів судинної легеневої сітки, легеневої гіпертензії, харчової алергії, гінгівіту, глоситу, пародонтиту, запалення стравоходу, включаючи рефлюкс, еозинофільного гастроентериту, проктиту, анального свербіжу, глютенової хвороби, пов'язаних з їжею алергій, запального захворювання кишок, виразкового коліту і хвороби Крона, мастоцитозу, а також інших CRTH2-опосередкованих хвороб, наприклад, аутоімунних захворювань, таких як, наприклад, синдром гіпер-IgE, тіреоідиту Хашимото, хвороби Грейвса, хвороби Аддисона, цукрового діабету, ідіопатичної тромбоцитопеничної пурпури, еозинофільного пахістозу, антифосфоліпідного синдрому і системного червоного вовчака, СНІД, прокази, синдрому Сезарі, паранеопластичного синдрому, змішаних і недиференційованих захворювань з'єднувальної тканини, запальних міопатій, включаючи дерматоміозит і поліміозит, поліміальгічного ревматичного синдрому, ювенільного артриту, ревматичної лихоманки, васкуліту, включаючи гігантоклітинний артеріїт, синдрому Такаясу, синдрому Шурга-Штраусса, періартеріїту, мікроскопічного поліартеріїту, темпорального артеріїту, міастенічного паралічу, гострого і хронічного болю, синдромів невропатичного болю, злоякісних ускладнень центральні і периферійні нервової системи, інфекційних або аутоімунних процесів, поперекового болю, сімейної лептоспірозної жовтухи, синдрому Макла-Велса, сімейної ірландської лихоманки, хвороби Кікучи, псоріазу, акне, розсіяного склерозу, відторгнення алотрансплантата, реперфузійної травми, хронічного обструктивного легеневого 8 UA 104584 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання, а також ревматоїдного артриту, хвороби Стілла, анкілозуючого спондилоартриту, реактивного артриту, недиференційованої спондилоартропатії, псоріатичного артриту, септичного артриту та інших пов'язаних з інфекцією артропатій і розладів кісткової тканини і остеоартриту; гострого і хронічного мікрокристалічного синовіту, включаючи уратну подагру, захворювання, викликаного відкладенням пірофосфату кальцію, синдрому, з пов'язаного відкладенням солей кальцію у сухожиллях, і синовіального запалювання, хвороби Бехчета, системного склерозу, викликаного первинним і вторинним синдромом Шегрена, і обмеженої склеродерми; гепатиту, цирозу печінки, холециститу, панкреатиту, нефриту, нефритичного синдрому, циститу і хронічної виразки сечового міхура, гострого і хронічного уретриту, простатиту, епідидиміту, оофориту, сальпінгиту, вульвовагіниту, хвороби Пейроні, ериктильної дисфункції, хвороби Альцгеймера та інших розладів, пов'язаних із слабоумством; перикардиту, міокардиту, запалювальних і аутоімунних кардіоміопатій, включаючи міокардіальний саркоїд, ішемічних перфузійних травм, ендокардиту, вальвуліту, аортиту, флебіту, тромбозу, лікуванні загальних ракових захворювань і фіброзних станів, таких як, наприклад, ідіопатичний легеневий фіброз, включаючи криптогенний фіброзний альвеоліт, келоїдів, надмірного фіброзного рубцювання/зрощування під час післяопераційного лікування, фіброзу печінки, включаючи фіброз, що асоціюється з гепатитом B і C, фіброми матки, саркоїдозу, включаючи нейросаркоїдоз, склеродерми, фіброзу нирки, викликаного діабетом, фіброзу, пов'язаного з ревматоїдним артритом, атеросклерозу, включаючи атеросклероз мозку, васкуліту, міокардіального фіброзу, викликаного міокардіальним порушенням, кістозного фіброзу, рестенозу, системного склерозу, хвороби Дюпуатрена, фіброзу, що ускладнює протипухлинну терапію і хронічні інфекційні захворювання, включаючи туберкульоз і аспергіломікоз, та інших мікозів, інсульту, викликаного фіброзом центральної нервової системи або стимулювання гоєння без фіброзного рубцювання. Ці сполуки є особливо ефективними при використані для лікування або запобігання алергічної астми, багаторічного алергічного риніту, сезонного алергічного риніту, атопічного дерматиту, контактної надмірної чутливості (включаючи контактний дерматит), кон'юнктивіту, особливо алергічного кон'юнктивіту, весняного кератокон'юнктивіту і атопічного кератокон'юнктивіту, еозинофільного бронхіту, харчових алергій, еозинофільного гастроентериту, запального захворювання кишок, виразкового коліту і хвороби Крона, мастоцитозу, а також інших PGD2-опосередкованих хвороб, наприклад, аутоімунних захворювань, таких як, наприклад, синдром гіпер-IgE і системного червоного вовчака, псоріазу, акне, розсіяного склерозу, відторгнення алотрансплантату, реперфузійної травми, хронічного легеневого захворювання, а також ревматоїдного артриту, псоріатичного артриту, остеоартриту і фіброзних захворювань, викликаних/загострених імунною реакцією Th2, таких як, наприклад, ідіопатичний легеневий фіброз і гіпертрофічні рубці. Сполуки загальної формули (I) або (II) мають бути приготовані у вигляді лікарської форми відповідним чином в залежності від захворювань або станів, які потребують лікування ними. Таким чином, у відповідності до додаткового аспекту даного винаходу запропоновано фармацевтичну композицію, яка містить сполуку загальної формули (I) або (II) разом з фармацевтичним наповнювачем або носієм. Можуть бути присутніми також й інші активні засоби, застосування яких може бути знайдене доцільним або рекомендованим у відношенні захворювання або стану, що підлягає лікуванню. Носій або, якщо є присутніми кілька носіїв, кожний з носіїв має бути прийнятним з точки зору його сумісності з іншими інгредієнтами лікарської форми і не заподіювати шкоди реципієнтові. Лікарські форми включають такі з них, що придатні для орального, ректального, назального, бронхіального (інгальованого), локального (включаючи очні краплі, трансбукальне і сублінгвальне введення), вагінального або парентерального (включаючи підшкірне, внутрішньом'язове, внутрішньовенне і внутрішньошкірне введення) застосування, і можуть бути приготовлені будь-якими способами, добре відомими в області фармацевтики. Схема прийому буде залежати від стану, який підлягає лікуванню, однак переважні композиції формулюються для орального, назального, бронхіального або локального застосування. Композиція може бути приготовлена шляхом об'єднання визначеного вище активного засобу з носієм. В загальних рисах, лікарські форми приготовляються шляхом рівномірного і тісного об'єднання активного засобу з рідкими носіями або дрібно подрібненими твердими носіями або з тими й іншими одночасно, а потім, якщо це вимагають обставини, формуються у продукт. Даний винахід поширюється на способи приготування фармацевтичної композиції, що включають введення сполуки загальної формули (I) або (II) у сполучення або комбінацію з носієм або наповнювачем, прийнятним з фармацевтичної або ветеринарної точки зору. 9 UA 104584 C2 5 10 15 20 25 30 35 40 45 50 55 60 Лікарські форми для орального застосування у відповідності до даного винаходу можуть бути присутніми у вигляді: дискретних одиниць, таких як, наприклад, капсули, саше або таблетки, кожна з яких містить задану кількість активного засобу; у вигляді порошку або гранул; у вигляді розчину або суспензії активного засобу у водному рідкому або безводному рідкому середовищі; або у вигляді рідкої емульсії олії у воді або у вигляді рідкої емульсії води в олії; або у вигляді болюса і так далі. Щодо композицій для орального застосування (наприклад, таблеток і капсул), термін "прийнятний носій" включає такі загальновідомі наповнювачі, як, наприклад, зв'язучі засоби, наприклад, сироп, гуміарабік, желатин, сорбіт, трагакант, полівінілпіролідон (Povidone), метилцелюлозу, етилцелюлозу, натрієву карбоксиметилцелюлозу, гідроксипропілметилцелюлозу, сахарозу і крохмаль; такі наповнювачі і носії, як, наприклад, кукурудзяний крохмаль, желатин, лактозу, сахарозу, мікрокристалічну целюлозу, каолін, манітол, дифосфат кальцію, хлорид натрію й альгінову кислоту; і змащувальні засоби, такі як, наприклад, стеарат магнію, стеарат натрію і стеарати інших металів, гліцеринстеарат, стеаринова кислота, силіконова рідина, воски на основі тальку, масла і колоїдальний діоксид кремнію. Можуть бути також використані смакові добавки, наприклад, перцева м'ята, вінтергрінова олія, вишнева есенція, тощо. Може виявитися бажаним використання підфарбовуючого засобу з метою швидкої ідентифікації дозованої форми. Таблетки можуть бути також виготовлені з покриттям способами, добре відомими в даній області техніки. Таблетка може бути виготовлена методом пресування або формування, при необхідності з одним або більше допоміжними інгредієнтами. Пресовані таблетки можуть бути приготовлені у відповідній машині шляхом пресування активного засобк у вільно текучій формі, наприклад, у вигляді порошку або гранул, при необхідності змішаних зі сполучним засобом, змащувальним засобом, інертним розріджувачем, консервантом, поверхнево-активною або диспергуючою речовиною. Формовані таблетки можуть бути виготовлені у відповідній машині шляхом формування суміші порошкоподібної сполуки й інертного рідкого розріджувача. Таблетки можуть при необхідності бути виготовлені з покриттям або з шорсткістю і можуть бути приготовлені таким чином, щоб забезпечувати уповільнене або регульоване вивільнення активного засобу. Інші лікарські форми, придатні для орального застосування, включають коржики, що містять активний засіб в смаковій добавці, як правило, у сахарозі і гуміарабіку або трагаканті; пастилки, що містять активний засіб в інертній основі, наприклад, у желатині або гліцерині, або у сахарозі і гуміарабіку; і засоби для полоскання рота, що містять активний засіб в підходящому рідкому носії. Для локального застосування на шкірі сполуки загальної формули (I) або (II) можуть бути виготовлені у вигляді крему, мазі, желе, розчину або суспензії і так далі. Лікарські форми у вигляді крему або мазі, які можуть бути використані, являють собою звичайні лікарські форми, добре відомі в даній області техніки, наприклад, як це описано в стандартних посібниках з фармацевтики, наприклад, у British Pharmacopoeia (Британська фармакопея). Сполуки загальної формули (I) або (II) можуть бути використані для лікування дихальних шляхів шляхом назального, бронхіального або трансбукального введення, наприклад, аерозолів або розчинів, які розпилюються, що можуть диспергувати фармакологічний активний інгредієнт у вигляді порошку або у вигляді крапель розчину або суспензії. Фармацевтичні композиції з властивостями диспергування порошку, як правило, містять, крім активного інгредієнта, рідкий витісняючий засіб із точкою кипіння нижче кімнатної температури і, якщо це бажано, допоміжні засоби, наприклад, рідкі або тверді неіоногенні або аніоногенні поверхневоактивні речовини і/або розріджувачі. Фармацевтичні композиції, в яких фармакологічний активний інгредієнт знаходиться в розчині, містять, крім цього, підходящий витісняючий засіб, і, крім того, якщо це необхідно, додатковий розчинник і/або стабілізуючий засіб. Замість витісняючого засобу може бути використане також стиснене повітря: з цією метою для його одержання можна використовувати підходящий компресорно-сильфонний пристрій. Парентеральні лікарські форми взагалі будуть стерильними. Як правило, доза сполуки буде складати приблизно від 0,01 до 100 мг/кг для того, щоб підтримувати концентрацію лікарського засобу в плазмі на рівні, що забезпечує ефективне інгібування PGD2 у CRTH2-рецепторі. Точна кількість сполуки загальної формули (I) або (II), яка є терапевтично ефективною, і схема найкращого введення такої сполуки легко визначаються середнім фахівцем в даній області техніки шляхом порівняння рівня вмісту речовини в крові з іі концентрацією, що вимагається для забезпечення терапевтичного ефекту. Сполуки загальної формули (I) або (II) можуть бути використані в комбінації з однією або більше активними засобами, які вважаються корисними при лікуванні зазначених вище 10 UA 104584 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювань і станів, хоча такі активні засоби і не є обов'язково інгібіторами PGD 2 у CRTH2рецепторі. Таким чином, описана вище фармацевтична композиція може додатково містити одну або більше з цих активних засобів. Запропоновано також використання сполуки загальної формули (I) або (II) у приготуванні засобу для лікування захворювань і станів, опосередкованих PGD 2 у CRTH2-рецепторі, відповідно до якого цей засіб містить також додатковий активний засіб, який є корисним для лікування таких захворювань і станів. Такі додаткові активні засоби можуть являти собою інші антагоністи CRTH2-рецептора або можуть мати зовсім інший принцип дії. Вони включають вже існуючі препарати для лікування алергійних та інших запальних захворювань, включаючи: Суплатасттозилат і подібні сполуки; агоністи β2-адренорецептора, такі як, наприклад, метапротеренол, ізопротеренол, ізопреналін, альбутерол, сальбутамол, формотерол, сальметерол, індакатерол, тербуталін, орципреналін, бітолтеролмезилат і пірбутерол, або метилксантіни, такі як, наприклад, теофілін і амінофілін, стабілізатори мастоцитів, такі як, наприклад, кромоглікат натрію або антагоністи мускаринівого рецептора, такі як, наприклад, тіотропій; антигістаміни, наприклад, антагоністи гістамінового H1-рецептора, такі як, наприклад, лоратадин, цетиризин, деслоратадин, левоцетиризин, фексофенадин, астемізол, азеластин і хлорфенірамін або антагоністи H4-рецептора; агоністи α 1 і α2 адренорецепторів, такі як, наприклад, пропілгекседрин фенілефрин,фенілпропаноламін, псевдофедрин, нафазолінгідрохлорид, оксиметазолінгідрохлорид, тетрагідрозолінгідрохлорид, ксилометазолінгідрохлорид і етилнорепінфрингідрохлорид; модулятори хемокінетичної рецепторної функції, наприклад CCRl, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCRlO і CCRIl (для сімейства C-C) або CXCRl, CXCR2, CXCR3, CXCR4 і CXCR5 (для сімейства C-X-C) і CX3CRl для сімейства C-X3-C; Антагоністи лейкотрієну, такі як, наприклад, монтелукаст і зафірлукаст інгібітори біосинтезу лейкотрієну, наприклад, інгібітори 5-ліпоксигенази або інгібітори протеїну, що активують 5-ліпоксигеназу (FLAP), такі як, наприклад, зилеутон, ABT-761, фенлеутон, тепоксалін, Abbott-79175, N-(5-заміщені)-тіофен-2-алкілсульфонаміди, 2,6-ди-третбутилфенолгідразони, метокситетрагідропірани, такі як, наприклад, ZD2138, SB-210661, піридиніл-заміщені-2-ціанонафталінові сполуки, такі як, наприклад, L-739010, 2-ціанохінолінові сполуки, такі як, наприклад, L-746,530, індолові і хінолінові сполуки, такі як, наприклад, MK-591, MK-886 і BAY x 1005; Інгібітори фосфодіестерази, включаючи інгібітори PDE4, такі як, наприклад, рофлуміласт; лікарські препарати на основі антитіл проти IgE, наприклад, омалізумаб; антиінфекційні препарати, такі як, наприклад, фузидова кислота (особливо для лікування атопічного дерматиту); протигрибкові препарати, такі як, наприклад, клотримазол (особливо для лікування атопічного дерматиту); імуносупресанти, такі як, наприклад, такролімус і, особливо, пімекролімус у випадку запального захворювання шкіри, або, як альтернатива, FK-506, рапаміцин, циклоспорин, азатіоприн або метотрексат; Імунотерапевтичні засоби, включаючи алергеноімунотерапевтичні засоби, такі як, наприклад, Grazax; кортикостероїди, такі як, наприклад, преднізон, преднізолон, флунізолід, тріамцинолонацетонід, беклометазондипропіонат, будезонід, флутиказонпропіонат, мометазонфуроат і флутиказонфуроат, ліки, які стимулюють реакцію Th1-цитокінів, такі як, наприклад, інтерферони, TNF або GM-CSF. Антагоністи CRTH2 можуть бути також об'єднані з лікарськими препаратами, що у даний час розробляються для запальних показань і включають: інші антагоністи PGD2, що діють в інших рецепторах, наприклад, антагоністи DP; ліки, які модулюють продукування цитокіну, такі як, наприклад, інгібітори конвертуючого TNFα-ферменту (TACE); анти-ТNF моноклональні антитіла, молекули імуноглобуліну TNFрецептора, інгібітори інших ізоформ TNF, неселективні інгібітори COX-l/COX-2, такі як, наприклад, піроксикам, диклофенак, пропіонові кислоти, такі як, наприклад, напроксен, флубіпрофен, фенопрофен, кетопрофен і ібупрофен, фенамати, такі як, наприклад, мефанамікова кислота, індометацин, суліндак і апазон, піразолони, такі як, наприклад, фенілбутазон, саліцилати, такі як, наприклад, аспирин; інгібітори COX-2, такі як, наприклад, мелоксикам, целекоксиб, фофекоксиб, вальдекоксиб і еторикоксиб, низько дозований 11 UA 104584 C2 5 10 15 20 25 30 метотрексат, лефуномід, циклезонід, гідроксихлорохін, d-пеніциламін, ауранофін або золото для парентерального або орального застосування; ліки, які модулюють активність Th2-цитокінів IL-4 і IL-5, наприклад, блокуючі моноклональні антитіла і розчинні рецептори; агоністи PPAR-γ, наприклад, розиглітазон; або з анти-RSV антитілами, такими як, наприклад, Synagis (палівізумаб), і засобами, які можуть бути використані для лікування ріновірусної інфекції у майбутньому, наприклад, інтерферональфа, інтерферон-бета або інші інтерферони. У відповідності до ще одного аспекту даного винаходу запропоновано продукт, який містить сполуку загальної формули (I) або (II) і один або більше перелічених вище засобів у вигляді комбінованої лікарської форми для одночасного, роздільного або послідовного використання при лікування захворювання або стану, опосередкованих дією PGD 2 у CRTH2-рецепторі. Нижче представлений більш докладний опис даного винаходу з посиланнями на приклади, що не є обмежуючим чинником. 1 В Прикладі 1 спектри H ЯМР отримували з використанням спектрометра Bruker Advance II, працюючого на частоті 300 МГц. Усі сигнали повіряли відносно залишкового протоновмісного розчинника. В Прикладах 2 і 3 спектри ЯМР отримували на спектрометрі Jeol JNM-GSX, працюючому на 1 13 частоті 400 МГц для збору H ЯМР-даних і на частоті 100 МГц для збору даних C ЯМР. В Прикладі 1 HPLC-CAD-MS здійснювали на Gilson 321 HPLC з виявленням, здійснюваним за допомогою ESA Corona CAD, і на мас-спектрометрі Finnigan AQA, працюючому в режимі іонізації електропульверизацією позитивних іонів. HPLC колонка відносилась до моделі Phenomenex Gemini C18 50 × 4,6 мм 3μ з градієнтом рухомої фази між 100 % – 0,1 % мурашиної кислоти у воді і 100 % – 0,1 % мурашиної кислоти в ацетонітрилі 2,5 хвилин, із загальною тривалістю роботи 6,5 хвилин. В деяких випадках з використанням описаного вище інструментарію були отримані тільки MS. В Прикладах 2 і 3 HPLC здійснювали на Agilent 1050 HPLC з виявленням, здійснюваним за допомогою УФ на довжині хвилі 220 нм. HPLC відносилась до моделі YMC-Pack, ODS-А 150 × 4,6 мм 5 μ, з градієнтом рухомої фази між 100 % – 0,01 % трифтороцтової кислоти у воді і 100 % – 0,01 % трифтороцтової кислоти в ацетонітрилі 16 хвилин, із загальною тривалістю роботи 21 хвилин. Приклад 1 – Приготування 3-{[2-(бензолсульфоніл)піридин-3-іл]метил}-5-фторо-2метиліндол-1-іл)-оцтової кислоти (Сполука 1) 2- (Бензолсульфоніл)ізозонікотинальдегід O O DMSO, 100oC + N 35 40 45 F SO2Na 94 h N S O O До перемішаної суспензії натрієвої солі бензолсульфінової кисоти (9,36 г, 0,057 моль) в DMSO (45 мл) додали 2-фторо-3-піридинкарбоксальдегід (5,20 мл, 0,052 моль). Отриману суміш піддали перемішуванню при 100 °C протягом 94 годин. Після охолодження до кімнатної температури реакційну суміш розподілили між етилацетатом і водою. Органічний шар відокремили, а водний шар екстрагували етилацетатом (3 × 150 мл). Об'єднані органічні екстракти промили водою, а отриманий сольовий розчин (100 мл) просушили над безводним розчином MgSO4, профільтрували і випарили. Отриману тверду речовину очистили методом колонкової хроматографії (елюент: етилацетат:гексан від 0:100 до 60:40 (об'єм/об'єм)), в + результаті чого було одержано 6,56 г (51 %) названої сполуки (LCMS RT=5,63 хв., MH 248). 1 H ЯМР (DMSO): 10,89 (1H, д, J 0,68 Гц), 8,82 (1H, дд, J 1,7, 4,7 Гц), 8,32 (1H, дд, J 1,7, 7,9 Гц), 8,08 – 8,02 (2H, м), 7,85 (1H, дд, J 7,9, 0,7 Гц), 7,81 (1H, дт, J 1,3, 7,5 Гц), 7,73 – 7,65 (2Н, м). Складний етиловий ефір [3-(2-бензолсульфоніл-піридин-3-ілметил)-5-фторо-2-метил-індол1-іл]-оцтової кислоти 12 UA 104584 C2 O O S N O N F S O O F N N CO2 Et 5 10 15 20 CO2 Et Розчин складного етилового ефіру (5-фторо-2-метил-індол-1-іл)-оцтової кислоти (0,95 г, 4,04 ммоль), приготованого за методикою у відповідності до Прикладу 1 з WO/2006/092579, і 2(бензолсульфоніл)ізонікотинальдегіду (1,0 г, 4,04 ммоль) в сухому дихлорметані (45 мл) повільно протягом 5 хвилин додали до перемішаного розчину TMSOTf (1,46 мл, 8,08 ммоль) в сухому дихлорметані (12,5 мл), охолодженому до 0 °C в атмосфері N2. Цю суміш піддали перемішуванню протягом 15 хвилин, після чого до неї в один прийом додали тріетилсилан (1,94 мл, 12,12 ммоль). Отриману реакційну суміш піддали перемішуванню протягом 2 годин 30 хвилин, нагріли до кімнатної температури і загасили шляхом повільного додавання насиченого водного розчину NaHCO3 (10 мл). Отриману двофазну суміш екстрагували дихлорметаном. Об'єднані органічні шари промили сольовим розчином, просушили над безводним розчином MgSO4, профільтрували і випарили. Отриману тверду речовину очистили методом колонкової хроматографії (елюент: етилацетат:гексан: від 0:100 до 60:40 (об'єм/об'єм)), в результаті чого + було одержано 1,21 г (64 %) названої сполуки (LCMS RT=6,63 хв., MH 466,8). 1 H ЯМР (CDCl3): 8,38 (1H, дд, J 1,6, 4,5 Гц), 8,14 – 8,07 (2H, м), 7,67 (3H, ддт, J 1,3, 27,7, 7,4 Гц), 7,40 – 7,34 (1H, м), 7,22 (1H, дд, J 4,6, 7,9 Гц), 7,12 (1H, дд, J 4,2, 8,9 Гц), 6,90 (1H, дт, J 2,5, 9,0 Гц), 6,72 (1H, дд, J 2,4, 9,5 Гц), 4,82 (2H, с), 4,62 (2H, с), 4,24 (2H, кв., J 7,2 Гц), 2,30 (3H, с), 1,29 (3H, т, J 7,2 Гц). (3-{[2-(Бензолсульфоніл)піридин-3-іл]метил}-5-фторо-2-метиліндол-1-іл)-оцтова кислота (Сполука 1) O O S N F O KOH water/THF 3.5h, RT N CO2 Et 30 CO2 H До перемішаного розчину складного етилового ефіру [3-(2-бензолсульфоніл-піридин-3ілметил)-5-фторо-2-метил-індол-1-іл]-оцтової кислоти (1,20 г, 2,56 ммоль) в THF (26 мл) додали розчин гідроксиду калію (0,43 г, 7,68 ммоль) у воді (9 мл). Отриманий розчин піддали перемішуванню при кімнатній температурі протягом 3,5 годин. THF видалили in vacuo, а водний шар, що залишився, підкислили водним розчином HCl (0,1 н., 25 мл). Отриманий продукт зібрали фільтруванням, промили водою і просушили in vacuo, в результаті чого було одержано + 1,12 г (100 %) названої сполуки (LCMS RT=4,58 хв., M -H 437,2). 1 H ЯМР (DMSO): 8,41 – 8,27 (1H, м), 8,06 – 7,91 (2H, м), 7,84 – 7,62 (3H, м), 7,50 – 7,31 (3H, м), 6,93 – 6,78 (2H, м), 4,99 (2H, с), 4,55 (2H, с), 2,27 (3H, с). Приклад 2 – Приготування [5-фторо-3-({2-[(4-фторбензол)сульфоніл]піридин-3-іл}метил)-2метиліндол-1-іл]-оцтової кислоти (Сполука 2) 2-(4-Фторбензолсульфоніл)-піридин-3-карбоксальдегід O O F F DMSO + N 35 N F N 25 S O Cl O + S Na O 2-Хлоро-3-піридинкарбоксальдегід 100oC, 72 h (4,04 г, 13 2,86 N S O ммоль) O і натрієву сіль 4 UA 104584 C2 5 10 15 фторбензолсульфінової кислоти (5,73 г, 3,14 ммоль) розчинили в DMSO (100 мл), а отриману суміш піддали нагріванню при 100 ºC протягом 72 годин в атмосфері азоту. Після охолодження до температури оточуючого середовища отриману суміш розбавили водою (500 мл) і екстрагували EtOAc (3x). Об'єднані органічні фази промили водою, сольовим розчином, просушили (MgSO4) і випарили до сухості, в результаті чого було одержано 7,89 г неочищеного продукту. Неочищену сполуку піддали попередньому абсорбуванню на силікагелі і очистили методом колонкової хроматографі з використанням колонок сухого випарювання (елюент: гептан з використанням градієнта EtOAc), в результаті чого було одержано 4,14 г (41 %) цільового продукту у вигляді твердої речовини жовтого кольору (платівки) (MP=131 – 131,3 °C; -1 IR=1691 см ; HPLC=7,21 хв. >99 %). 1 H ЯМР (400 MГц; CDCl3): 7,23 – 7,29 (2H, м) 7,60 (1H, дд) 8,05 – 8,10 (2H, м) 8,37 (2H, дд) 8,67 (1H, дд) 11,1 (1H, с). 13 C ЯМР (100 MГц, CDCl3): 116,6 (д) 116,8 (д) 127,3 (д) 130,7 (с) 132,6 (д) 134,0 (с) 137,9 (д) 152,5 (с) 159,7 (с) 165,1 (с) 167,7 (с) 188,5 (д). Складний етиловий ефір [5-фторо-3-({2-[(4-фторбензол)сульфоніл]піридин-3-іл}метил)-2метиліндол-1-іл]-оцтової кислоти F O F O O N F S N S O O F N N CO2 Et 20 25 30 35 40 CO2 Et Розчин складного етилового ефіру (5-фторо-2-метил-індол-1-іл)-оцтової кислоти (1,0 г, 4,4 ммоль) і 2-(4-фторбензолсульфоніл)-піридин-3-карбоксальдегіду (1,13 г, 4,3 ммоль) в сухому DCM (50 мл) додали протягом 5 – 10 хв. до перемішаного розчину TMSOTf в сухому DCM (15 мл) при 0 ºC. Отриману суміш піддали старінню протягом 15 хв., після чого до неї в один прийом додали чистий тріетилсилан (2,05 мл, 12,8 ммоль). Отриману суміш піддали перемішуванню протягом додаткових 15 годин і дозволили нагрітися до температури оточуючого середовища. Реакцію загасили шляхом додавання по краплях насиченого розчину NaHCO 3 (10 мл), а отриману двофазну суміш екстрагували DCM (2 × 50 мл). Об'єднані органічні фази промили сольовим розчином (50 мл), а потім просушили (MgSO 4) і випарили до сухості. Реакцію повторили в ідентичному масштабі, і два отриманих неочищених матеріали очистили кожний окремо. Неочищені реакційні матеріали очистили методом колонкової хроматографії з використанням градієнта гептан і етилацетат, в результаті чого було одержано 0,90 г (43 %) і 1,50 г (72 %) цільової сполуки у вигляді відповідно твердої речовини блідо-пурпурового кольору і твердої речовини коричневого кольору різної чистоти (96,0 % і 94,5 % за методом HPLC) -1 (MP=150,5 – 151,5 °C, IR=1751 см ; HPLC=12,24 хв.). 1 H ЯМР (400 MГц; CDCl3): 1,26 (3H, т) 2,29 (3H, с) 4,22 (2H, кв.) 4,62 (2H, с) 4,80 (2H, с) 6,79 (1H, дд) 6,86 (1H, ддд) 7,10 (1H, дд) 7,19 (1H, дд) 7,23 – 7,28 (2H, м) 7,36 (1H, дд) 8,05 – 8,11 (2H, м) 8,29 (1H, дд). 13 C ЯМР (100 MГц, CDCl3): 10,4 (кв.) 14,2 (кв.) 25,3 (т) 45,2 (т) 61,9 (т) 103,4 (д) 103,6 (д) 108,0 (с) 108,1 (с) 109,1 (д) 109,2 (д) 109,5 (д) 109,8 (д) 116,2 (д) 116,4 (д) 127,0 (д) 128,5 (с) 128,6 (с) 132,2 (д) 132,3 (д) 133,3 (с) 135,1 (с) 136,4 (с) 136,6 (с) 139,4 (д) 146,2 (д) 156,2 (с) 157,0 (с) 159,4 (с) 164,7 (с) 167,3 (с) 168,6 (с). [5-Фторо-3-({2-[(4-фторбензол)сульфоніл]піридин-3-іл}метил)-2-метиліндол-1-іл]-оцтова кислота (Сполука 2) 14 UA 104584 C2 F O O S F O N F KOH water/THF 2h, RT N 10 15 20 + 30 35 N F CO2 H KOH (0,34 г, 5,94 ммоль) розчинили у воді (7 мл) і додали до інтенсивно перемішаного розчину складного етилового ефіру [5-фторо-3-({2-[(4-фторбензол)сульфоніл]піридин-3іл}метил)-2-метиліндол-1-іл]-оцтової кислоти (0,96 г, 1,98 ммоль) в THF (21 мл) в атмосфері азоту при температурі оточуючого середовища. Реакцію контролювали за допомогою TLC і LCMS. Через 2 години розчинник видалили in vacuo, а потім відрегулювали pH до 1,5 з використанням 0,1 н. розчину HCl. Осад піддали інтенсивному перемішуванню протягом 15 хв., після чого його відокремили шляхом всмоктувального фільтрування. Зібрану тверду речовину промили водою, а потім MTBE, висушили на повітрі, а потім просушили in vacuo при 50 ºC, в результаті чого було одержано 870 мг (97 %) продукту у вигляді твердої речовини рожевого -1 кольору (MP=125 – 126 °C; IR=1729 см ; HPLC=10,80 хв. 99,3 %). 1 H ЯМР (400 MГц; DMSO): 2,29 (3H, с) 4,56 (2H, с) 4,97 (2H, с) 6,85 – 6,91 (2H, м) 7,37 – 7,7,45 (2H, м) 7,47 (1H, дд) 7,51 – 7,57 (2H, м) 8,06 – 8,15 (2H, м) 8,36 (1H, дд). 13 C ЯМР (100 MГц, DMSO): 10,5 (кв.) 25,0 (т) 45,5 (т) 102,7 (д) 102,9 (д) 107,7 (с) 107,8 (с) 108,8 (д) 109,1 (д) 110,9 (д) 111,0 (д) 117,1 (д) 117,3 (д) 128,1 (д) 128,2 (д) 128,3 (д) 132,7 (д) 132,8 (д) 133,8 (д) 135,5 (с) 136,8 (с) 138,1 (с) 140,4 (д) 147,0 (д) 155,9 (с) 156,6 (с) 158,9 (с) 164,6 (с) 167,1 (с) 171,1 (с). Приклад 3 – Приготування [3-({2-[(4-хлорбензол)сульфоніл]піридин-3-іл}метил)-5-фторо-2метиліндол-1-іл]-оцтової кислоти (Сполуки 3) 2-(4-Хлорбензолсульфоніл)-піридин-3-карбоксальдегід O O Cl Cl DMSO N 25 S N CO2 Et 5 O Cl O N S 100oC, 72 h + S Na O O O 2-Хлоро-3-піридинкарбоксальдегід (5,0 г, 35,0 ммоль) і натрієву сіль 4хлорбензолсульфінової кислоти (7,75 г, 38,8 ммоль) розчинили в DMSO (120 мл), а отриману суміш піддали нагріванню при 100 ºC протягом 72 годин в атмосфері азоту. Після охолодження до температури оточуючого середовища суміш розбавили водою (500 мл) і екстрагували EtOAc (3x). Об'єднані органічні фази промили водою, сольовим розчином, просушили (MgSO 4) і випарили до сухості, в результаті чого було отримано 8,1 г неочищеного матеріалу. Отриману неочищену сполуку піддали попередньому абсорбуванню на силікагелі і очистили методом колонкової хроматографі з використанням колонок сухого випарювання (елюент: гептан з використанням градієнта EtOAc), в результаті чого було одержано 4,62 г (61 %) цільового продукту у вигляді порошкоподібної твердої речовини білого кольору (MP=100,5 – 101 °C; -1 IR=1698 см ; HPLC=8,00 хв. >99 %). 1 H ЯМР (400 MГц; CDCl3): 7,56 (1H, дд) 7,60 (1H, дд) 7,99 (1H, дд) 8,38 (1H, дд) 8,67 (1H, дд) 11,1 (1H, с). 13 C ЯМР (100 MГц, CDCl3): 127,3 (д) 129,6 (д) 130,8 (с) 131,1 (д) 136,5 (с) 138,0 (д) 141,4 (с) 152,5 (д) 159,5 (с) 188,4 (д). Складний етиловий ефір [3-({2-[(4-хлорбензол)сульфоніл]піридин-3-іл}метил)-5-фторо-2метил-індол-1-іл]-оцтової кислоти 15 UA 104584 C2 Cl O O Cl S N O N F S O O F N N CO2 Et 5 10 15 20 CO2 Et Розчин складного етилового ефіру (5-фторо-2-метил-індол-1-іл)-оцтової кислоти (1,0 г, 4,25 ммоль) і 2-(4-хлорбензолсульфоніл)-піридин-3-карбоксальдегіду (1,19 г, 4,22 ммоль) в сухому DCM (50 мл) додали протягом 5 – 10 хв. до перемішаного розчину TMSOTf в сухому DCM (15 мл) при 0 ºC. Отриману суміш піддали старінню протягом 15 хв., після чого до неї в один прийом додали чистий тріетилсилан (2,05 мл, 12,7 ммоль). Отриману суміш піддали перемішуванню протягом додаткових 15 годин і дозволили нагрітися до температури оточуючого середовища. Реакцію загасили шляхом додавання по краплях насиченого розчину NaHCO 3 (10 мл), а отриману двофазну суміш екстрагували DCM (2 × 50 мл). Об'єднані органічні фази промили сольовим розчином (50 мл), а потім просушили (MgSO 4) і випарили до сухості. Реакцію повторили в ідентичному масштабі, і два отриманих неочищених продукти об'єднали. Неочищений реакційний матеріал очистили методом колонкової хроматографії з використанням градієнта гептан і етилацетат, в результаті чого було одержано 1,80 г (42 %) цільової сполуки у -1 вигляді твердої речовини блідо-оранжевого кольору (MP=124,6 – 124,9 °C; IR=1741 см ; HPLC=12,75 хв. 97,3 %). 1 H ЯМР (400 MГц; CDCl3): 1,26 (3H, т) 2,29 (3H, с) 4,20 (2H, кв.) 4,62 (2H, с) 4,80 (2H, с) 6,80 (1H, дд) 6,87 (1H, ддд) 7,10 (1H, дд) 7,19 (1H, дд) 7,37 (1H, дд) 7,54 (2H, дд) 8,00 (2H, дд) 8,28 (1H, дд). 13 C ЯМР (100 MГц, CDCl3): 10,4 (кв.) 14,3 (кв.) 25,3 (т) 45,2 (т) 61,9 (т) 103,4 (д) 103,6 (д) 108,0 (с) 108,1 (с) 109,2 (д) 109,2 (д) 109,5 (д) 109,8 (д) 127,0 (д) 128,5 (с) 128,6 (с) 129,3 (д) 130,8 (д) 133,3 (с) 136,4 (с) 136,6 (с) 137,6 (с) 139,4 (д) 140,5 (с) 146,2 (д) 156,1 (с) 157,0 (с) 159,4 (с) 168,6 (с). [3-({2-[(4-Хлорбензол)сульфоніл]піридин-3-іл}метил)-5-фторо-2-метиліндол-1-іл]-оцтова кислота (Сполуки 3) Cl Cl O O S O N F KOH water/THF 2h, RT N 25 30 35 O S N F N CO2 Et CO2 H KOH (0,60 г, 10,7 ммоль), розчиненого у воді (14 мл), додали до інтенсивно перемішаного розчину складного етилового ефіру [3-({2-[(4-хлорбензол)сульфоніл]піридин-3-іл}метил)-5фторо-2-метиліндол-1-іл]-оцтової кислоти (1,17 г, 3,49 ммоль) в THF (40 мл) в атмосфері азоту при температурі оточуючого середовища. Реакцію контролювали за допомогою TLC і LCMS. Через 2 годин розчинник видалили in vacuo, після чого відрегулювали pH до 1,5 з використанням 0,1 н. розчину HCl. Осад піддали інтенсивному перемішуванню протягом 15 хв., після чого його відокремили шляхом всмоктувального фільтрування. Зібрані тверді речовини промили водою, а потім MTBE, висушили на повітрі, а потім просушили in vacuo при 50 ºC, в результаті чого було одержано 1,31 г (78 %) названої сполуки у вигляді твердої речовини -1 рожевого кольору (MP=125,2 – 126 °C; IR=1729 см ; HPLC=11,37 хв. >99 %). 1 H ЯМР (400 MГц; DMSO): 2,29 (3H, с) 4,56 (2H, с) 4,96 (2H, с) 6,85-6,91 (2H, м) 7,39 (1H, дд) 7,44 (1H, дд) 7,49 (1H, дд) 7,76-7,79 (2H, м) 8,00 – 8,8,03 (2H, м) 8,36 (1H, дд). 13 C ЯМР (100 MГц, DMSO): 10,5 (кв.) 25,0 (т) 45,6 (т) 102,7 (д) 102,9 (д) 107,6 (с) 107,7 (с) 16 UA 104584 C2 108,8 (д) 109,0 (д) 110,9 (д) 111,0 (д) 128,1 (д) 130,0 (д) 131,4 (д) 133,9 (д) 136,9 (с) 138,1 (д) 139,8 (с) 140,5 (с) 147,1 (д) 155,7 (с) 156,5 (с) 158,9 (с) 171,1 (с). У представлених нижче прикладах Сполуки 1 – 3 випробували у порівнянні з наступними сполуками для порівняння: 5 Спо-лука Найменування Структура O S CH3 O A [3-(4-Метилсульфоніл-бензил)-5-фторо-2-метил-індол1-іл]-оцтова кислота F N O OH O O S B [3-(3-Бензолсульфоніл-піридин-4-ілметил)-5-фторо-2метил-індол-1-іл]-оцтова кислота N F N O OH O O C [3-(3-Бензолсульфоніл-піридин-2-ілметил)-5-фторо-2метил-індол-1-іл]-оцтова кислота S N F N O OH O D [3-(1-Бензолсульфоніл-1H-пірол-2-ілметил)-5-фторо-2метил-індол-1-іл]-оцтова кислота S O N F N O OH N F E 5-Фторо-2-метил-3-(піридин-3-ілметил)-індол-1-іл)оцтова кислота N O OH Сполуки В, С і Е приготували з використанням способу, аналогічного використаному для 17 UA 104584 C2 5 10 15 20 25 30 35 40 45 50 55 Сполуки 1. Сполука А являє собою Сполуку 17 з WO 2005/044260, а спосіб приготування цієї сполуки викладено у Прикладі 1 цього документу. Сполука D являє собою Сполуку 1 з WO 2006/095183, а спосіб приготування цієї сполуки викладено у Прикладі 1 цього документу. Приклад 4 – Вимірювання активності антагоніста CRTH2 Матеріали і методи Матеріали Монопольне розчиплювальне середовище було отримане від Dainippon Pharmaceuticals (Osaka, Japan). Мікрогранули Macs, завантажені анти-CD16, були від Miltenyi biotec (Bisley, Surrey). Планшети ChemoTx були придбані у Neuroprobe (Gaithesburg, MD). 96-Лункові планшети з лізиновим покриттям Poly-D були отримані від Greiner (Gloucestershire, UK). 3 3 [ H]PGD2 був від Amersham Biosciences (Buckinghamshire, UK). [ H]SQ29548 був придбаний у Perkin Elmer Life Sciences (Buckinghamshire, UK). Всі інші реагенти були отримані в Sigma-Aldrich (Dorset, UK), якщо не зазначено інше. Методики Клітинна культура Клітини яєчника китайського хом'ячка трансфікували CRTH2- або DP-рецепторами (CHO/CRTH2 і CHO/DP) і утримували в культурів умовах зволоженої атмосфери при 37 °C (5 % CO2) у мінімальному підтримуючому середовищі (MEM), доповненому 10 %-ною сироваткою -1 плоду корови, 2 ммоль глутаміну і 1 мг мл активного G418. Клітини пасивували кожні 2 – 3 дні. Для аналізу на радіолігандне зв'язування приготування клітин здійснювали в колбах з 2 потрійними шарами або в квадратних кюветах площиною 175 см (для приготування мембран). Приготування клітинних мембран Приготування мембран здійснювали або з клітин CHO/CRTH2 і CHO/DP, або з тромбоцитів (як джерела TP-рецепторів). Клітини CHO, вирощені до злиття, промивали фізіологічним розчином, забуференим фосфатом, (ЗФР) і відокремлювали з використанням розчину Версена 2 (Versene) (15 мл на колбу). Коли клітини вирощували в квадратній кюветі площиною 175 см , їх збирали шляхом зскрібання в ЗФР. Клітинні суспензії піддавали центрифугуванню (1700 об./хв, 10 хвилин, 4 °C) і повторно суспендували в 15 мл буферного розчину (1xHBSS, доповненого 10 ммоль HEPES, pН = 7,3). Потім клітинні суспензії гомогенізували з використанням установки Ultra Turrax з настроюванням 4 – 6 протягом 20 секунд. Гомогенат піддавали центрифугуванню при 1700 об./хв. протягом 10 хвилин, а надосадову рідину збирали і піддавали центрифугуванню при 20 000 об./хв. протягом 1 години при 4 °C. Отриманий у пробірці осад повторно суспендували в буферному розчині і зберігали при –80 °C в аліквотних частках 200 – 500 мкл. Концентрацію ротеїну визначали за допомогою метода Бредфорда (Bradford) (1976) з використанням альбуміну сироватки великої рогатої худоби як стандарт. Тромбоцити промивали шляхом центрифугування при 600 xg протягом 10 хвилин і повторно суспендували в охолодженому льодом аналітичному буферному розчині (10 ммоль Tris-HCl, pН = 7,4, 5 ммоль глюкози, 120 ммоль NaCl, 10 мкмоль індометацину) і піддавали безпосередньому центрифугуванню при 20 000 об./хв. протягом 30 хвилин при 4 °C. Отриманий у пробірці осад оброблювали описаним вище способом. Аналізи на радіолігандне зв'язування 3 Експерименти на [ H]PGD2 (160 Сі/ммоль) зв'язування проводили на мембранах, приготовлених, як це описано вище. Аналізи здійснювали в буферному розчині з кінцевим об'ємом 100 мкл (1XHBSS/HEPES 10 ммоль, pН = 7,3). Клітинні мембрани (15 мкг) піддавали повторному інкубуванню при кімнатній температурі з варійованою концентрацією конкуруючого 3 ліганду протягом 15 хвилин. Потім додавали [ H]PGD2 і інкубування продовжували протягом ще однієї години при кімнатній температурі. Реакцію завершували шляхом додавання в кожну лунку 200 мкл охолодженого льодом аналітичного буферного розчину з подальшим швидким фільтруванням крізь скловолоконні фільтри Whatman GF/B з використанням харвестеру клітин Unifilter Cell (PerkinElmer Life Sciences) і шестиразовим промиванням у 300 мкл охолодженого льодом буферного розчину. Планшети Unifilter просушували при кімнатній температурі протягом, щонайменше, 1 години, а радіоактивність, акумульовану на фільтрах, визначали з використанням лічильника Beta Trilux (PerkinElmer Life Sciences) з подальшим додаванням 40 мкл Optiphase Hi-Safe 3 (Wallac) сцинтиляційної рідини. Неспецифічне зв'язування визначали в присутності 10 мкмоль неміченого PGD2. Аналізи здійснювали двократно. Результати експериментів на радіолігандне зв'язування по відношенню до CRTH2- і DPрецепторів представлені в таблиці 1. 18 UA 104584 C2 Таблиця 1 Дані про радіолігандне зв'язування (Ki на CRTH2-рецепторі) Сполуки Сполука 1 Сполука 2 Сполука 3 Сполука А Сполука В Сполука С Сполука D Сполука E 5 10 15 20 Ki (нмоль) 2 2 7 7 1 979 1 258 Сполуки C і E зв'язуються з CRTH2-рецептором тільки дуже слабо і, таким чином, далі не випробувались. Приклад 5 – Аналіз змінення форми еозинофілів цільної крові людини Сполуки 1 – 3 аналізували на їхню дію на PGD2-індуковане змінення форми еозинофілів і порівнювали зі Сполуками для порівняння A, B і D. Методики Аналіз на змінення форми в цільній крові Сполуки (1 мкл, 200 x кінцева концентрація) додавали безпосередньо до 200 мкл суцільної крові, ретельно змішували і піддавали інкубуванню протягом 15 хв., 37 °C, 5 % CO2. Після цього проміжку часу клітинну форму фіксували шляхом додавання 300 мкл буферного розчину Cytofix™ (BD Biosciences) протягом 15 хв. на льоді. До зафіксованих клітин додали 10 мл буферного розчину RBC для лізису клітин, піддавали інкубуванню протягом 5 хв. при кімнатній температурі з подальшим центрифугуванням, 300 x г протягом 5 хв. Кондиційоване середовище (що містило лізовані еритроцити) видаляли і повторювали операцію лізису. Лейкоцити повторно суспендували в 250 мкл RPMI/10 % FCS і за допомогою FACS аналізували змінення форми. Еозинофіли піддавали дискримінації за їхньою аутофлуоресценцією, і для кожного зразка підраховували 2000 еозинофільних подій. Дані аналізували трикратно. Результати аналізу змінення форми еозинофілів представлені в Таблиці 2. Таблиця 2 IC50 Значення для ефективності дії випробуваних сполук на 10 нмоль PGD2-індуковане змінення форми еозинофілів в цільній крові людини Сполука 1 2 3 A B D 25 30 35 Значення, нмоль 9 2,5 10 8 34 8 Сполуки, які є найбільш підходящими для використання як фармацевтичні засоби, мають у випробуванні на змінення форми еозинофілів IC 50 значення між приблизно 1 і 10 нмоль. Таким чином, не дивлячись на те, що Сполука B зв'язуються з CRTH2-рецептором більш специфічно (Таблиця 1), вона є особливо сильнодіючим антагоністом CRTH2 у фізіологічних станах. Особливо варто відмітити, що сполуками для порівняння, найближчими за структурою до Сполуки 1, є Сполуки B і C. З цих сполук Сполука C специфічно не зв'язується з CRTH2рцептором, а Сполука B є менш сильнодіючою, ніж Сполука 1. Приклад 6 – Мікросомальна стабільність Мікросомальну стабільність випробуваних сполук визначали способом, представленим нижче. Випробувану сполуку (1 мкмоль) піддавали інкубуванню з мікросомами печінки людини (загальна концентрація протеїну 0,3 мг/мл) протягом 60 хв. Відсотковий склад випробуваної сполуки, що залишався у зразку через 1 годину, заміряли з метою визначення рівня 19 UA 104584 C2 метаболізму випробуваної сполуки. Результати представлені в Таблиці 3, де показані результати для двох експериментів і отримано середнє значення. Таблиця 3 Результати випробування на мікросомальну стабільність Сполука 1 2 B C D 5 10 15 Випробуваня концентрація, моль -6 1 × 10 -6 1 × 10 -6 1 × 10 -6 1 × 10 -6 1 × 10 Середнє значення вихідної сполуки, що залишилась, % 96 98 69 90 24 Результати, представлені в Таблиці 3, свідчать про те, що через 120 хвилин 96 % Сполуки 1 і 98 % сполуки 2 не засвоїлись в мікросомах печінки людини. Це відповідає значенням 69 % і 90 % відповідно для Сполук B і C, які є регіоізомерами Сполуки 1, і значенню тільки 24 % для Сполука D. Таким чином, коротко кажучи, експерименти, описані в цих Прикладах, свідчать про те, що Сполуки C і E не зв'язуються міцно з CRTH2-рецептором, Сполука B є значно менш активна, ніж Сполука 1 за результатами аналізу змінення форми еозинофілів цільної крові, а Сполука D має низьку стабільністю в мікросомах людини, що обмежує її корисність як фармацевтичного засобу. Сполуки 1 – 3 як антагоністи CRTH2 є на подив активними і на подив стабільними в порівнянні зі сполуками, до яких вони структурно відносяться найбільш близько. Крім того, сполуки у відповідності до даного винаходу мають значно покращені фармакокінетичні профілі in vivo у собаки в порівнянні зі Сполукою A. Час напівжиття у плазмі для Сполук 1 і 2 становив 3 і 5 годин відповідно, у той час як для Сполуки А час напівжиття становив тільки 1 годину. ФОРМУЛА ВИНАХОДУ 20 Сполука загальної формули (І) O 1 R O S N W (I) N O OH 25 де W являє собою хлор або фтор; 1 R являє собою феніл, необов'язково заміщений одним або більше галоїдними замісниками, або її фармацевтично прийнятна сіль, гідрат або сольват. 2. Сполука загальної формули (II) 30 20 UA 104584 C2 O 1 R O S N W (ІІ) N O 4 OR 5 10 15 20 25 30 35 40 45 де W являє собою хлор або фтор; 1 R являє собою феніл, необов'язково заміщений одним або більше галоїдними замісниками; 4 R являє собою С1-С6алкіл або бензил, або її фармацевтично прийнятна сіль. 3. Сполука за п. 1 або п. 2, де W являє собою фтор. 1 4. Сполука за будь-яким з пунктів 1-3, де фенільна група R необов’язково заміщена одним галоїдним замісником. 5. Сполука за п. 4, де галоїдний замісник являє собою фтор або хлор. 1 6. Сполука за п. 5, де фтор або хлор знаходиться у 4-положенні фенільної групи R . 7. Сполука, вибрана з групи: (3-{[2-(бензолсульфоніл)піридин-3-іл]метил}-5-фторо-2-метиліндол-1-іл)-оцтова кислота; [5-фторо-3-({2-[(4-фторобензол)сульфоніл]піридин-3-іл}метил)-2-метиліндол-1-іл]-оцтова кислота; [3-({2-[(4-хлоробензол)сульфоніл]піридин-3-іл}метил)-5-фторо-2-метиліндол-1-іл]-оцтова кислота; або її фармацевтично прийнятна сіль. 8. Спосіб отримання сполуки загальної формули (І) за будь-яким з пунктів 1 або 3-7, в якому сполуку загальної формули (II) за п. 2 піддають реакції з основою у водному або органічному розчиннику або у суміші водного і органічного розчинників. 9. Сполука за будь-яким з пунктів 1-7 для використання у медицині. 10. Сполука за будь-яким з пунктів 1-7 для використання при лікуванні або запобіганні алергічній астмі, цілорічному алергічному риніту, сезонному алергічному риніту, атопічному дерматиту, контактній надмірній чутливості (включаючи контактний дерматит), кон'юнктивіту, особливо алергічному кон'юнктивіту, весняному кератокон'юнктивіту і атопічному кератокон'юнктивіту, еозинофільному бронхіту, харчовим алергіям, еозинофільному гастроентериту, запальному захворюванню кишок, виразковому коліту і хворобі Крона, мастоцитозу, синдрому гіпер-IgЕ, розсіяному склерозу, хронічному обструктивному легеневому захворюванню, фіброзним станам, включаючи ідіопатичний (спонтанний) легеневий фіброз, назальному поліпозу, кропивниці, запаленню стравоходу, мастоцитозу і синдрому Шурга-Штраусса. 11. Застосування сполуки за будь-яким з пунктів 1-7 для отримання засобу для лікування або запобігання алергічній астмі, цілорічному алергічному риніту, сезонному алергічному риніту, атопічному дерматиту, контактній надмірній чутливості (включаючи контактний дерматит), кон'юнктивіту, особливо алергічному кон'юнктивіту, весняному кератокон'юнктивіту і атопічному кератокон'юнктивіту, еозинофільному бронхіту, харчовим алергіям, еозинофільному гастроентериту, запальному захворюванню кишок, виразковому коліту і хворобі Крона, мастоцитозу, синдрому гіпер-ІgЕ, розсіяному склерозу, хронічному обструктивному легеневому захворюванню, фіброзним станам, включаючи ідіопатичний (спонтанний) легеневий фіброз, назальному поліпозу, кропивниці, запаленню стравоходу, мастоцитозу і синдрому ШургаШтраусса. 12. Спосіб лікування захворювання або стану, опосередкованого дією PGD2 або інших агоністів у СRТН2-рецепторі, де спосіб включає введення пацієнтові, що потребує такого лікування, терапевтично ефективної кількості сполуки за у будь-яким з пунктів 1-7. 13. Спосіб за п. 12, відповідно до якого захворювання або стан вибрано з групи, що складається з алергічної астми, багаторічного алергічного риніту, сезонного алергічного риніту, атопічного дерматиту, контактної надмірної чутливості (включаючи контактний дерматит), кон'юнктивіту, 21 UA 104584 C2 5 10 15 20 25 30 особливо алергічного кон'юнктивіту, весняного кератокон'юнктивіту і атопічного кератокон'юнктивіту, еозинофільного бронхіту, харчових алергій, еозинофільного гастроентериту, запального захворювання кишок, виразкового коліту і хвороби Крона, мастоцитозу, синдрому гіпер-ІgЕ, розсіяного склерозу, хронічного обструктивного легеневого захворювання, фіброзних станів, включаючи ідіопатичний (спонтанний) легеневий фіброз, назального поліпозу, кропивниці, запалення стравоходу, мастоцитозу і синдрому ШургаШтраусса. 14. Фармацевтична композиція, яка містить сполуку за будь-яким з пунктів 1-7 разом з фармацевтичним наповнювачем або носієм. 15. Фармацевтична композиція за п. 14, яка має форму, придатну для орального, ректального, назального, бронхіального (інгальованого), локального (включаючи очні краплі, трансбукальне і сублінгвальне введення), вагінального або парентерального (включаючи підшкірне, внутрішньом'язове, внутрішньовенне і внутрішньошкірне введення) застосування. 16. Фармацевтична композиція за п. 14 або п. 15, яка містить один або більше додаткових активних засобів, які є корисними при лікуванні захворювань і станів, опосередкованих дією PGD2 або інших агоністів у СRTН2-рецепторі. 17. Спосіб отримання фармацевтичної композиції за будь-яким з пунктів 14-16, де сполуку за будь-яким з пунктів 1-7 змішують з носієм або наповнювачем, що є фармацевтично або ветеринарно прийнятним. 18. Фармацевтична композиція у формі комбінованого препарату для одночасного, роздільного або послідовного використання для лікування захворювання або стану, опосередкованих дією PGD2 або інших агоністів у СRТН2-рецепторі, яка містить сполуку за будь-яким з пунктів 1-7 і один або більше засобів, корисних для використання при лікуванні захворювань або станів, опосередкованих дією PGD2 або інших агоністів у СRTН2-рецепторі. 19. Застосування сполуки за п. 11, де засіб містить додатковий активний засіб для використання при лікуванні захворювань або станів, опосередкованих дією PGD2 або інших агоністів у CRTH2і/або DP-рецепторі. 20. Набір для лікування захворювання або стану, опосередкованого дією PGD2 у СRТН2рецепторі, який містить: a) перший контейнер, що вміщує сполуку за п. 1 або п. 2; і b) другий контейнер, що вміщує додатковий засіб для використання при лікуванні захворювання або стану, опосередкованого дією PGD2 або інших агоністів у СRТН2-рецепторі. Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 22
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds having crth2 antagonist activity
Автори англійськоюArmer, Richard, Edward, Pettipher, Eric, Roy, Whittaker, Mark, Wynne, Graham, Michael, Vile, Julia, Schroer, Frank
Автори російськоюАрмер Ричард Эдвард
МПК / Мітки
МПК: A61K 31/4439, A61P 29/00, C07D 401/06
Мітки: антагоніста, мають, crth2, активність, сполуки
Код посилання
<a href="https://ua.patents.su/24-104584-spoluki-shho-mayut-aktivnist-antagonista-crth2.html" target="_blank" rel="follow" title="База патентів України">Сполуки, що мають активність антагоніста crth2</a>
Попередній патент: Спосіб та пристрій для визначення масової витрати для пневматичної посівної та/або тукової машини
Наступний патент: Композиція, що містить антитіло, яке зв’язується з доменом ii her2, і його кислі варіанти
Випадковий патент: Спосіб лікування хворих на периферичний рак легені з метастазами в плевру