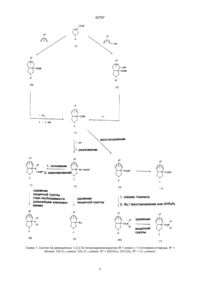
Похідні хінолон- і нафтиридонкарбонової кислоти та похідні ізоіндолу для їх одержання
Номер патенту: 42797
Опубліковано: 15.11.2001
Автори: ШЕНКЕ Томас, ПЕТЕРСЕН Уве, БРЕММ Клаус Дітер, Ендерманн Райнер
Формула / Реферат
1. Производные хинолон- и нафтиридонкарбоновой кислоты общей формулы (I):
T-Q ,(!)
где Q - остаток формул:
или
у которых
R1 - алкил с 1-4 атомами углерода, незамещенный, однозамещенный или двузамещенный галогеном или гидроксилом, алкенил с 2-4 атомами углерода, циклоалкил с 3-6 атомами углерода, незамещенный или замещенный 1 или 2 атомами фтора, бицикло[1.1.1]пент-1-ил, 1,1-диметилпропаргил, 3-оксетанил, метокси, амино, метиламино, диметиламино или фенил, незамещенный, однозамещенный или двузамещенный галогеном, аминогруппой или гидроксилом,
R2 - гидроксил, алкоксил с 1-3 атомами углерода, незамещенный или замещенный гидроксилом, метоксигруппой, аминогруппой или диметиламиногруппой, бензилокси, (5-мєтил-2-оксо-1,3-диоксол-4-ил)метилокси, ацетоксиметилокси, пивалоилоксиметилокси, 5-инданилокси, фталидинилокси, З-ацетокси-2-оксобутилокси, нитрометил или диалкоксикарбонилметил с 1-2 атомами углерода в каждой алкильной части,
R9 - водород или алкил с 1-3 атомами углерода, незамещенный или замещенный метоксигруппой, гидроксилом или галогеном,
R11 - водород, метил или монофторметил,
X1 - галоген или нитро,
X2 - водород, галоген, амино, гидрокси, метокси, меркапто, метил, галоидный метил, винил,
А - азот или группа C-R7, где
R7- водород, галоген, трифторметил, метокси, метоксидифторид, метил, циано,
-СН=СН2, -ССН, или вместе с остатком R1 может образовать мостик структуры -*O-СН2-СН(СН3)-, -*S-CH2-CH2-, -*S-СН2-СН(СН3)-, -*СН2-СН2-СН(СН3)- или -*O-CH2-N(R8)-, при этом маркированный знаком * атом связан с атомом углерода
группы А, при этом
R8 означает водород, метил или формил,
D - азот или группа C-R10, где
R10- водород, галоген, трифторметил, метокси, метоксидифторид, метил, или вместе с остатком R9 может образовать мостик структуры -*O-СН2-, -*NН-СН2-, -*N(СН3)-СН2-, -*N(C2H5)-CH2, -*N(циклопропил)-СН2-, -*S-СН2-, при этом маркированный знаком * атом связан с атомом углерода группы D,
Т - остаток формулы:
у которой
В - остаток (CH2)m-NR3R4 или (CH2)m-OR5, в которых
m означает число 0 или 1,
R3 - водород, метил или алкоксикарбонил с 1-4 атомами углерода в алкильной части,
R4 - водород или метил,
R5 - водород или метил,
R6 - водород или метил,
смесь их изомеров или отдельные изомеры, каждый раз в виде гидрата или соли.
2. Производные хинолон- и нафтиридонкарбоновой кислоты общей формулы (I) по п.1, где Q - остаток формул:
или
в которых
R1 - алкил с 1-4 атомами углерода, незамещенный, однозамещенный или двузамещенный галогеном, алкенил с 2-3 атомами углерода, циклоалкил с 3 или 4 атомами углерода, незамещенный или замещенный 1 атомом фтора, бицикло[1.1.1]пент-1-ил, 1,1-диметилпропаргил, 3-оксетанил, метиламино, фенил, незамещенный, однозамещенный или двузамещенный фтором, аминогруппой или гидроксилом,
R2 - гидроксил, алкоксил с 1-2 атомами углерода, бензилокси, (5-метил-2-оксо-1,3-диоксол-4-ил)метокси,
R9 - водород или алкил с 1-2 атомами углерода, незамещенный или замещенный 1-3 атомами фтора,
X1 - фтор или хлор,
X2 - водород, галоген, амино, метил, трифторметил, винил,
А - азот или группа C-R7, где
R7- водород, галоген, трифторметил, метокси, метоксидифторид, метил, циано,
-СН=СН2, -ССН, или вместе с остатком R1 может образовать мостик структуры
-*O-СН2-СН(СН3)-, -*S-CH2-CH2-. -*СН2-СН2-СН(СН3)- или -*O-CH2-N(R8)-, при этом маркированный знаком * атом связан с атомом углерода группы А, при этом
R8 - водород или метил,
D - азот или группа C-R10, где
R10- водород, фтор, хлор, трифторметил, метокси, метил, или вместе с остатком R9 может образовать мостик структуры -*O-СН2-, -*N(СН3)-СН2-, -N(C2H5)CH2-,
-*N(циклопропил)-СН2-, -*S-CH2-, при этом маркированный знаком * атом связан с атомом углерода группы D,
Т - остаток формулы:
у которой В - остаток –NR3R4 или -ОН, где
R3 означает водород или метил,
R4 - водород или метил,
R6-водород,
смесь их изомеров или отдельные изомеры, каждый раз в виде гидрата или соли.
3. Производные хинолон- и нафтиридонкарбоновой кислоты общей формулы (I) по п.1, у которых Q - остаток формул:
или
в которых
R1 - алкил с 1-4 атомами углерода, незамещенный, однозамещенный или двузамещенный фтором, винил, циклопропил, незамещенный или замещенный 1 атомом фтора, фенил, незамещенный, однозамещенный или двузамещенный фтором,
R2 - гидроксил, алкоксил с 1-2 атомами углерода, (5-метил-2-оксо-1,3-диоксол-4-ил)метокси,
R9 - водород или метил, незамещенный или замещенный 1-3 атомами фтора,
X1 - фтор,
X2 - водород, фтор, амино, метил, винил,
А - азот или группа C-R7, где
R7- водород, фтор, хлор, бром, трифторметил, метокси, метоксидифторид, метил, циано, -СН=СН2, -ССН, или вместе с остатком R1 может образовать мостик структуры -*O-СН2-СН(СН3)-, или -*O-CH2-N(R8)-, при этом маркированный знаком * атом связан с атомом углерода группы А, при этом
R8 означает водород или метил,
D - азот или группа C-R10, где
R10- водород, фтор, хлор, метокси, или вместе с остатком R9 может образовать мостик структуры -*O-СН2-, -*N(СН3)-СН2-, -*N(С2Н5)-СН2-, -*S-СН2-, при этом маркированный знаком * атом связан с атомом углерода группы D,
Т - остаток формулы:
в которой
В - аминогруппа,
R6 - водород, смеси их изомеров или отдельные изомеры, каждый раз в виде гидрата или соли.
4. Производные изоиндола общей формулы (III):
(III)
в которой
В - остаток (CH2)m-NR3R4 или (СН2)m-ОR5, где
m означает число 0 или 1,
R3 - водород, метил или алкоксикарбонил с 1-4 атомами углерода в алкильной части,
R4 - водород или метил,
R5 - водород или метил,
R8 - водород или метил,
смесь их изомеров или отдельные изомеры, представляющие собой исходные соединения для получения производных хинолон- и нафтиридонкарбоновой кислоты общей формулы (I) по пп.1-3.
5. Производные изоиндола общей формулы (III) по п.4, представляющие собой соединения, выбранные из группы, включающей:
За-сложный этиловый эфир 2-сложный метиловый эфир 1,2,3,4,7,7а-гексагидроизоиндол-2,3а-дикарбоновой кислоты,
сложный этиловый эфир 2-бензил-1,2,3,4,7,7а-гексагидроизоиндол-3а-карбоновой кислоты,
За-сложный этиловый эфир 2-сложный метиловый эфир 1,2,3,7а-тетрагидроизоиндол-2,3а-дикарбоновой кислоты,
2-сложный метиловый эфир 1,2,3,7а-тетрагидроизоиндол-2,3а-дикарбоновой кислоты,
сложный метиловый эфир За-метоксикарбониламино-1,2,3,7а-тетрагидроизоиндол-2-карбоновой кислоты,
1,2,3,7а-тетрагидроизоиндол-3а-иламин,
4-метил-1,2,3,7а-тетрагидроизоиндол-3а-иламин,
5-метил-1,2,3,7а-тетрагидроизоиндол-3а-иламин,
6-метил-1,2,3,7а-тетрагидроизоиндол-3а-иламин,
7-метил-1,2,3,7а-тетрагидроизоиндол-3а-иламин,
За-метиламино-1,2,3,7а-тетрагидроизоиндол,
За-диметиламино-1,2,3,7а-тетрагидроизоиндол,
За-трет-бутоксикарбониламино-1,2,3,7а-тетрагидроизоиндол,
За-аминометил-1,2,3,7а-тетрагидроизоиндол,
За-метиламинометил-1,2,3,7а-тетрагидроизоиндол,
За-диметиламинометил-1,2,3,7а-тетрагидроизоиндол, За-гидрокси-1,2,3,7а-тетрагидроизоиндол,
За-гидроксиметил-1,2,3,7а-тетрагидроизоиндол,
смесь их изомеров или отдельные изомеры.
Текст
УКРАЇНА (19) (51) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ UA (11) 42797 (13) C2 7 C07D401/04, 471/04, 471/16, 498/06, 513/04, 513/14, 209/44 ОПИС ДО ПАТЕНТУ НА ВИНАХІД или у которых R1 - алкил с 1-4 атомами углерода, незамещенный, однозамещенный или двузамещенный (13) 42797 где Q - остаток формул: (11) (I) UA T–Q, галогеном или гидроксилом, алкенил с 2-4 атомами углерода, циклоалкил с 3-6 атомами углерода, незамещенный или замещенный 1 или 2 атомами фтора, бицикло[1.1.1]пент-1-ил, 1,1диметилпропаргил, 3-оксетанил, метокси, амино, метиламино, диметиламино или фенил, незамещенный, однозамещенный или двузамещенный галогеном, аминогруппой или гидроксилом, R2 - гидроксил, алкоксил с 1-3 атомами углерода, незамещенный или замещенный гидроксилом, метоксигруппой, аминогруппой или диметиламиногруппой, бензилокси, (5-метил-2-оксо1,3-диоксол-4-ил)метилокси, ацетоксиметилокси, пивалоилоксиметилокси, 5-инданилокси, фталидинилокси, 3-ацетокси-2-оксобутилокси, нитрометил или диалкоксикарбонилметил с 1-2 атомами углерода в каждой алкильной части, R9 - водород или алкил с 1-3 атомами углерода, незамещенный или замещенный метоксигруппой, гидроксилом или галогеном, R11 - водород, метил или монофторметил, X1 - галоген или нитро, X2 - водород, галоген, амино, гидрокси, метокси, меркапто, метил, галоидный метил, винил, А - азот или группа C-R7, где R7 - водород, галоген, трифторметил, метокси, метоксидифторид, метил, циано, -СН Н 2, С = -СΞСН, или вместе с остатком R1 может образовать мостик структуры -*О-СН2-СН(СН3)-, -*SСН2-СН2-, -*S-СН2-СН(СН3)-, -*СН2-СН2-СН(СН3)или -*О-CH2-N(R8)-, при этом маркированный знаком * атом связан с атомом углерода группы А, при этом R8 означает водород, метил или формил, D - азот или группа C-R10, где R10 - водород, галоген, трифторметил, метокси, метоксидифторид, метил, или вместе с остатком R9 может образовать мостик структуры -*О-СН2-, -*NН-СН2-, -*N(СН3)-СН2-, -*N(C2H5)-CH2-, -*N(циклопропил)-СН2-, -*S-СН2-, при этом маркированный знаком * атом связан с атомом углерода группы D, Т - остаток формулы: (19) (21) 95104373 (22) 03.10.1995 (24) 15.11.2001 (31) P4435479.7 (32) 04.10.1994 (33) DE (46) 15.11.2001, Бюл. № 10, 2001 р. (72) Петерсен Уве, DE, Шенке Томас, DE, Бремм Клаус-Дітер, DE, Ендерманн Райнер, DE (73) БАЙЄР АГ, DE (56) ЕР, 0343524, 29.11.1989, кл. C07D215/56. ЕР, 0343560, 29.11.1989, кл. C07D401/04. EP, 0429304, 29.05.1991, кл. C07D401/04. ЕР, 0516861, 09.12.1992, кл. C07D401/04. ЕР, 0588166, 23.03.1994, кл. C07D401/04 (57) 1. Производные хинолон- и нафтиридонкарбоновой кислоты общей формулы (I): C2 (54) ПОХІДНІ ХІНОЛОН- І НАФТИРИДОНКАРБОНОВОЇ КИСЛОТИ ТА ПОХІДНІ ІЗОІНДОЛУ ДЛЯ ЇХ ОДЕРЖАННЯ 42797 у которой В - остаток (CH2)m-NR3R4 или (CH2)m -OR5, в которых m означает число 0 или 1, R3 - водород, метил или алкоксикарбонил с 14 атомами углерода в алкильной части, R4 - водород или метил, R5 - водород или метил, R6 - водород или метил, смесь их изомеров или отдельные изомеры, каждый раз в виде гидрата или соли. 2. Производные хинолон- и нафтиридонкарбоновой кислоты общей формулы (I) по п. 1, где Q – остаток формул: CH2-, при этом маркированный знаком * атом связан с атомом углерода группы D, Т - остаток формулы: у которой В - остаток –NR3R4 или -ОН, где R3 означает водород или метил, R4 - водород или метил, R6 - водород, смесь их изомеров или отдельные изомеры, каждый раз в виде гидрата или соли. 3. Производные хинолон- и нафтиридонкарбоновой кислоты общей формулы (I) по п. 1, у которых Q - остаток формул: или или в которых R1 - алкил с 1-4 атомами углерода, незамещенный, однозамещенный или двузамещенный галогеном, алкенил с 2-3 атомами углерода, циклоалкил с 3 или 4 атомами углерода, незамещенный или замещенный 1 атомом фтора, бицикло[1.1.1]пент-1-ил, 1,1-диметилпропаргил, 3-оксетанил, метиламино, фенил, незамещенный, однозамещенный или двузамещенный фтором, аминогруппой или гидроксилом, R2 - гидроксил, алкоксил с 1-2 атомами углерода, бензилокси, (5-метил-2-оксо-1,3-диоксол-4ил)метокси, R9 - водород или алкил с 1-2 атомами углерода, незамещенный или замещенный 1-3 атомами фтора, X1 - фтор или хлор, X2 - водород, галоген, амино, метил, трифторметил, винил, А - азот или группа C-R7, где R7 - водород, галоген, трифторметил, метокси, метоксидифторид, метил, циано, -СН Н 2, С = -СΞСН, или вместе с остатком R1 может образовать мостик структуры -*O-СН2-СН(СН3)-, -*SCH2-CH2-, -*СН2-СН2-СН(СН3)- или -*O-CH2N(R8)-, при этом маркированный знаком * атом связан с атомом углерода группы А, при этом R8 - водород или метил, D - азот или группа C-R10, где R10 - водород, фтор, хлор, трифторметил, метокси, метил, или вместе с остатком R9 может образовать мостик структуры -*O-СН2-, -*N(СН3)СН2-, -*N(C2H5)-CH2-, -*N(циклопропил)-СН2-, -*S в которых R1 - алкил с 1-4 атомами углерода, незамещенный, однозамещенный или двузамещенный фтором, винил, циклопропил, незамещенный или замещенный 1 атомом фтора, фенил, незамещенный, однозамещенный или двузамещенный фтором, R2 - гидроксил, алкоксил с 1-2 атомами углерода, (5-метил-2-оксо-1,3-диоксол-4-ил)метокси, R9 - водород или метил, незамещенный или замещенный 1-3 атомами фтора, X1 - фтор, X2 - водород, фтор, амино, метил, винил, А - азот или группа C-R7, где R7 - водород, фтор, хлор, бром, трифторметил, метокси, метоксидифторид, метил, циано, -CH=CH2, -CΞCH, или вместе с остатком R1 может образовать мостик структуры -*O-СН2СН(СН3)-, или -*O-CH2-N(R8)-, при этом маркированный знаком * атом связан с атомом углерода группы А, при этом R8 означает водород или метил, D - азот или группа C-R10, где R10 - водород, фтор, хлор, метокси, или вместе с остатком R9 может образовать мостик структуры -*O-CH2-, -*N(СН3)-СН2-, -*N(C2H5)-CH2-, -*SCH2-, при этом маркированный знаком * атом связан с атомом углерода группы D, Т - остаток формулы: 2 42797 сложный этиловый эфир 2-бензил-1,2,3,4,7,7агексагидроизоиндол-3а-карбоновой кислоты, 3а-сложный этиловый эфир 2-сложный метиловый эфир 1,2,3,7а-тетрагидроизоиндол-2,3адикарбоновой кислоты, 2-сложный метиловый эфир 1,2,3,7атетрагидроизоиндол-2,3а-дикарбоновой кислоты, сложный метиловый эфир 3а-метоксикарбониламино-1,2,3,7а-тетрагидроизоиндол-2-карбоновой кислоты, 1,2,3,7а-тетрагидроизоиндол-3а-иламин, 4-метил-1,2,3,7а-тетрагидроизоиндол-3а-иламин, 5-метил-1,2,3,7а-тетрагидроизоиндол-3а-иламин, 6-метил-1,2,3,7а-тетрагидроизоиндол-3а-иламин, 7-метил-1,2,3,7а-тетрагидроизоиндол-3а-иламин, 3а-метиламино-1,2,3,7а-тетрагидроизоиндол, 3а-диметиламино-1,2,3,7а-тетрагидроизоиндол, 3а-трет-бутоксикарбониламино-1,2,3,7а-тетрагидроизоиндол, 3а-аминометил-1,2,3,7а-тетрагидроизоиндол, 3а-метиламинометил-1,2,3,7а-тетрагидроизоиндол, 3а-диметиламинометил-1,2,3,7а-тетрагидроизоиндол, 3а-гидрокси-1,2,3,7а-тетрагидроизоиндол, 3а-гидроксиметил-1,2,3,7а-тетрагидроизоиндол, смесь их изомеров или отдельные изомеры. в которой В - аминогруппа, R6 - водород, смеси их изомеров или отдельные изомеры, каждый раз в виде гидрата или соли. 4. Производные изоиндола общей формулы (III): (ІІІ) в которой В - остаток (CH2)m-NR3R4 или (CH2)m-OR5, где m означает число 0 или 1, R3 - водород, метил или алкоксикарбонил с 14 атомами углерода в алкильной части, R4 - водород или метил, R5 - водород или метил, R8 - водород или метил, смесь их изомеров или отдельные изомеры, представляющие собой исходные соединения для получения производных хинолон- и нафтиридонкарбоновой кислоты общей формулы (I) по пп. 1-3. 5. Производные изоиндола общей формулы (III) по п. 4, представляющие собой соединения, выбранные из группы, включающей: 3а-сложный этиловый эфир 2-сложный метиловый эфир 1,2,3,4,7,7а-гексагидроизоиндол2,3а-дикарбоновой кислоты, Изобретение относится к новым химическим соединениям с ценными свойствами, в частности к производным хинолон- и нафтиридон-карбоновой кислоты общей формулы (I) T–Q или (I) где Q - остаток формул у которых R1 - алкил с 1-4 атомами углерода, незамещенный, однозамещенный или двузамещенный галогеном или гидроксилом, алкенил с 2-4 атомами углерода, циклоалкил с 3-6 атомами углерода, незамещенный или замещенный 1 или 2 атомами фтора, бицикло[1.1.1]пент-1-ил, 1,1диметилпропаргил, 3-оксетанил, метокси, амино, метиламино, диметиламино или фенил, незамещенный, однозамещенный или двузамещенный галогеном, амино-группой или гидроксилом, R2 - гидроксил, алкоксил с 1-3 атомами углерода, незамещенный или замещенный гидроксилом, метокси-группой, амино-группой или диметиламиногруппой, бензилокси, (5-метил-2-оксо1,3-диоксол-4-ил)-метилокси, ацетоксиметилокси, пивалоилоксиметилокси, 5-инданил-окси, 3 42797 фталидинилокси, 3-ацетокси-2-оксо-бутилокси, нитрометил или диалкоксикарбонилметил с 12 атомами углерода в каждой алкильной части, R9 - водород или алкил с 1-3 атомами углерода, незамещенный или замещенный метоксигруппой, гидроксилом или галогеном, R11 - водород, метил или монофторметан, X1 - галоген или нитро, X2 - водород, галоген, амино, гидрокси, метокси, меркапто, метил, галоидный метил, винил, А - азот или группа C-R7, где R7 - водород, галоген, трифторметил, метокси, метоксидифторид, метил, циано, СН=СН2, CºСН, или вместе с остатком R1 может образовать мостик структуры -*O-СН2-СН-СН3, -*S-СН2-СН2-, -*S-СН2-СН-СН3, -*СН2-СН2-СН-СН3 или -*O-CH2N-R8, при этом маркированный знаком * атом связан с атомом углерода группы А, при этом R8 означает водород, метил или формил, D - азот или группа C-R10, где R10 - водород, галоген, трифторметил, метокси, метоксидифторид, метил, или вместе с остатком R9 может образовать мостик структуры -*O-СН2-, -*NH-CH2-, -*N(СН3)-СН2-, -*N(С2Н5)-СН2-, -*N(сС3Н5)-СН2-, -*S-CH2-, при этом маркированный знаком * атом связан с атомом углерода группы D, Т - остаток формулы или в которых R1 - алкил с 1-4 атомами углерода, незамещенный, однозамещенный или двузамещенный галогеном, алкенил с 2-3 атомами углерода, циклоалкил с 3 или 4 атомами углерода, незамещенный или замещенный 1 атомом фтора, бицикло[1.1.1]пент-1-ил, 1,1-диметилпропаргил, 3-оксетанил, метиламино, фенил, незамещенный, однозамещенный или двузамещенный фтором, амино-группой или гидроксилом, R2 - гидроксил, алкоксил с 1-2 атомами углерода, бензилокси, (5-метил-2-оксо-1,3-диоксол-4ил)-метокси, R9 - водород или алкил с 1-2 атомами углерода, незамещенный или замещенный 1-3 атомами фтора, X1 - фтор или хлор, X2 - водород, галоген, амино, метил, трифторметил, винил, А - азот или группа C-R7, где R7 - водород, галоген, трифторметил, метокси, метоксидифторид, метил, циано, СН=СН2, СºСН, или вместе с остатком R1 может образовать мостик структуры -*O-СН2-СН-СН3, -*S-СН2-СН2-, -*СН2-СН2-СН-СН3 или -*O-CH2-N-R8, при этом маркированный знаком * атом связан с атомом углерода группы А, при этом R8 означает водород или метил, D - азот или группа C-R10, где R10 - водород, фтор, хлор, трифторметил, метокси, метил, или вместе с остатком R9 может образовать мостик структуры -*O-СН2-, -*N(СН3)СН2-, -*N(C2H5)-CH2-, -*N(с-С3Н5)-СН2-, -*S-CH2-, при этом маркированный знаком * атом связан с атомом углерода группы D, Т - остаток формулы у которой В - остаток (CH2)m-NR3R4 или (CH2)m-OR5, в которых m означает число 0 или 1, R3 означает водород, метил или алкоксикарбонил с 1-4 атомами углерода в алкильной части, R4 означает водород или метил R5 означает водород или метил R6 - водород или метил, смеси их изомеров или отдельным изомерам, каждый раз в виде гидрата или соли. Предпочитаются фармацетически приемлемые гидраты и кислотно-аддитивные соли, а также соли щелочных и щелочно-земельных металлов, соли серебра и гуанидиния соответствующих карбоновых кислот. Предпочтительными соединениями общей формулы (I) являются соединения, у которых Q остаток формул у которой В - остаток -NR3R4 или -ОН, в которых R3 означает водород или метил, R4 означает водород или метил, R6 - водород, смеси их изомеров или отдельные изомеры, каждый раз в виде гидрата или соли. 4 42797 R10 - водород, фтор, хлор, метокси, или вместе с остатком R9 может образовать мостик структуры -*O-СН2-, -*N(СН3)-СН2-, -*N(C2H5)-CH2-, -*SCH2-, при этом маркированный знаком * атом связан с атомом углерода группы D, Т - остаток формулы В частности предпочитаются соединения общей формулы (I), у которых Q - остаток формул или в которой В - амино-группа, R6 - водород, смеси их изомеров или отдельные изомеры, каждый раз в виде гидрата или соли. Соединения формулы (I) получают, если соединение формулы (II) Y–Q в которых R1 - алкил с 1-4 атомами углерода, незамещенный, однозамещенный или двузамещенный фтором, винил, циклопропил, незамещенный или замещенный 1 атомом фтора, фенил, незамещенный, однозамещенный или двузамещенный фтором, R2 - гидроксил, алкоксил с 1-2 атомами углерода, (5-метил-2-оксо-1,3-диоксол-4-ил)-метокси, R9 - водород или метил, незамещенный или замещенный 1-3 атомами фтора, X1 - фтор, X2 - водород, фтор, амино, метил, винил, А - азот или группа C-R7, где R7 - водород, фтор, хлор, бром, трифторметил, метокси, метоксидифторид, метил, циано, СН СН2, СºСН, или вместе с остатком R1 может = образовать мостик структуры -*O-СН2-СН-СН3, или -*O-CH2-N-R8, при этом маркированный знаком * атом связан с атомом углерода группы А, при этом R8 означает водород или метил, D - азот или группа C-R10, где (II), где Q имеет вышеуказанное значение и Y - означает удаляемую группу, такую, как, например галоген, в частности фтор или хлор, подвергают взаимодействию с соединениями формулы (III) (ІІІ) где В и R6 имеют вышеуказанное значение, в случае необходимости в присутствии акцепторов кислоты, и снимают защитные группы, если такие имеются. Если в качестве исходных соединений применяют, например, 6,7-дифтор-1-циклопропил-1,4дигидро-8-метокси-4-оксо-3-хинолинкарбоновую кислоту и 1,2,3,7а-тетрагидро-изоиндол-3а-иламин, то ход реакции можно изобразить следующей схемой: Используемые в качестве исходных соединений соединения формулы (II) известны или их можно получать известными приемами. При необходимости их можно применять в виде рацемиче ских соединений, а также в виде чистых энантиомеров. В случае недостаточной реакционноспособности соединения формулы (II) можно применять также в виде хелатного соединения бора. 5 42797 Необходимые в качестве исходных соединений бициклические амины формулы (III) новы и поэтому представляют собой дальнейший объект изобретения. Их можно получать приведенными в схеме 1 приемами: Аддукты по Дилсу-Альдеру формулы 2 или 3 получают путем взаимодействия сложного алкильного эфира 2,5-дигидропирролкарбоновой кислоты формулы 1 с подходящими диенами. Вместо диенов также можно применять подходящие диенсинтоны, такие, как, например, a-пирон. Из соединения формулы 2 путем присоединения брома в среде инертного растворителя и последующего дегидробромирования сильным основанием, таким, как, например, трет.бутилат калия, 1,5-диазабицикло[4.3.0]нон-5-ен, 1,8-диазабицикло [5.4.0]ундец-7-ен или этил-диизопропиламин можно получать диен формулы 4, который также можно получать из промежуточного продукта формулы 3 путем обработки кислотой. Сложный алкильный эфир диенкарбоновой кислоты формулы 4 гидролизуют с получением карбоновой кислоты, которую путем, например, перегруппировки Гофманна или Курциуса через уретан формулы 5 в качестве промежуточного продукта переводят в амин формулы 6. Далее, уретан формулы 5 путем избирательного алкилирования на атоме азота уретана можно переводить в алкильный уретан формулы 7, в который после избирательного отщепления уретановой группы можно ввести вторую алкильную группу, после чего соединение можно переводить в соединение формулы 8. Пу тем восстановления сложного эфира диенкарбоновой кислоты формулы 4 комплексными гидридами через промежуточную стадию 9 можно получать гидроксиметильное соединение формулы 12. Далее, из соединения формулы 12 после активации гидроксильной группы путем, например, перевода в О-тозилат или О-мезилат с последующей нуклеофильной реакцией замещения с аминами или ацидами, которые после этого надо восстановить, через амины формулы 10 можно получать амины формулы 11. Вместо сложного алкильного эфира карбоновой кислоты формулы 1 для синтеза также можно использовать аналогичный 2,5дигидропиррол-3-карбонитрил, из которого, например, путем реакции Дильса-Альдера с последующим восстановлением можно получать, например, 3а-аминометил-1,2,3,7а-тетра-гидроизоиндол. Промежуточные продукты соединений 6, 8, 11 и 12 соответствуют общей формуле (III). 1-амино-8-азабицикло[4.3.0]нона-2,4-диен также можно получать переводом сложного метилового эфира 8-азабицикло[4.3.0]нона-2,4-диен-1карбоксамид-8-карбоновой кислоты путем перегруппировки Гофманна, например, гипохлоритом натрия, гипобромитом натрия или йодозобензолом в сложный метиловый эфир 1-амино-8азабицикло[4.3.0]нона-2,4-диен-8-карбоновой кислоты с последующим снятием группы для защиты карбамата путем обработки кислотой или основанием. 6 42797 Схема 1: Синтез 3а-замещенных 1,2,3,7а-тетрагидроизоиндолов (R = алкил с 1-3 атомами углерода, R' = бензил, СО-С1-3-алкил, СO2-С1-3-алкил, R" = Sі(СН3)3, СО-СН3, R'" = С1-4-алкил) 7 42797 5. В течение синтеза бициклических аминов формулы (III) вместо ахиральных защитных групп можно вводить и хиральные защитные группы. Таким образом получают диастереомерные смеси, подвергающиеся разделению. Например, при синтезе промежуточной стадии 4 схемы 1 имеется возможность замещения остатка бензила aфенил-этиловым остатком с конфигурацией R или S, или замещения спиртового компонента сложного эфира формулы 4 энантиомерно чистым спиртом, например ментолом или пантолактоном. Взаимодействие соединения формулы (II) с соединением формулы (III), где соединения формулы (III) можно также применять в виде их солей, например, гидрохлоридов, предпочтительно осуществляют в среде разбавителя, такого, как, например, диметилсульфоксид, N,N-диметилформамид, N-метилпирролидон, трисамид гексаметилфосфорной кислоты, сульфолан, ацетонитрил, вода, спирт, например, метанол, этанол, нпропанол, изопропанол, простой гликольмонометиловой эфир или пиридин. Можно также применять смеси данных разбавителей. В качестве акцепторов кислоты можно применять любые стандартные неорганические или органические акцепторы кислоты, предпочтительно гидроокиси и карбонаты щелочных металлов, органические амины и амидины. В качестве особо пригодных веществ можно назвать триэтиламин, 1,4-диазабицикло-[2.2.2]октан, 1,8-диазабицикло[5.4.0]ундец-7-ен или избыточный амин (III). Температуры реакции можно варьировать в широком диапазоне. В общем работают при температуре 20-200°С, предпочтительно 80-160°С. Реакцию можно осуществлять при атмосферном давлении, а также при повышенном давлении. В общем работают при давлении примерно 1100 бар, предпочтительно 1-10 бар. При осуществлении вышеописанного приема на 1 моль соединения формулы (II) применяют 115 моль, предпочтительно 1-5 моль соединения формулы (III). Свободные аминогруппы можно защищать во время реакции с помощью пригодного защитного остатка для аминогруппы, например, остатка трет.бутоксикарбонила или защитной группы в виде азометина, который по окончании реакции можно опять удалять. Предлагаемые соединения формулы (І), у которых R2 означает CH2NO2 или диалкосксикарбонилметил, можно также получать путем взаимодействия соединения формулы (І), у которого R2 означает ОН, с активатором, например карбонилдиимидазолом, в среде разбавителя, такого, как, например, тетрагидрофуран, дихлорметан или хлороформ, с последующим взаимодействием с СН-ацидном соединением, например нитрометаном или сложным диалкиловым эфиром малоновой кислоты. Это взаимодействие предпочтительно осуществляют в среде растворителя, например тетрагидрофурана, в присутствии основания, такого, как, например, гидрид натрия, карбонат калия, карбонат натрия. Предлагаемые соединения формулы (I), у которых Х2 означает амино, получают также путем взаимодействия соединений формулы (І), у которых X2 означает фтор, с аммиаком в среде поляр В качестве примеров двуненасыщенных бициклических аминов формулы (III) можно называть: 1,2,3,7а-тетрагидро-изоиндол-3а-иламин, 4метил-1,2,3,7а-тетрагидро-изоиндол-3а-иламин, 5метил-1,2,3,7а-тетрагидро-изоиндол-3а-иламин, 6метил-1,2,3,7а-тетрагидро-изоиндол-3а-иламин, 7метил-1,2,3,7а-тетрагидро-изоиндол-3а-иламин, 3а-метиламино-1,2,3,7а-тетрангидро-изоиндол, 3а-диметиламино-1,2,3,7а-тетрагидро-изоиндол, 3а-трет.-бутоксикарбониламино-1,2,3,7атетрагидро-изоиндол, 3а-аминометил-1,2,3,7атетрагидро-изоиндол, 3а-метиламино-метил1,2,3,7а-тетрагидроизоиндол, 3адиметиламинометил-1,2,3,7а-тетрагидроизоиндол, 3а-гидрокси1,2,3,7а-тетрагидроизоиндол, 3а-гидроксиметил-1,2,3,7а-тетрагидроизоиндол. Чисто энантиомерные исходные соединения формулы (III) можно получать следующими приемами: 1. Рацемические бициклические амины формулы (III) можно подвергать взаимодействию с энантиомерно чистыми кислотами, например карбоновыми кислотами или сульфокислотами, такими, как, например, N-ацетил-L-глутаминовая кислота, N-бензоил-L-аналин, 3-бром-камфора-9-сульфокислота, камфора-3-карбоновая кислота, цискамфорная кислота, камфора-10-сульфокислота, O,O'-дибензоилвинная кислота, D- или L-винная кислота, миндальная кислота, a-метоксифенилуксусная кислота, 1-фенил-этансульфокислота, a-фенил-янтарная кислота, с получением смеси диастереомерных солей, которые фракционной кристаллизацией разделяются на диастереомерно чистые соли (см. П. Ньюман, Optical Resolution Procedures for Chemical Compounds; т. 1), из которых путем обработки гидроокисями щелочных или щелочно-земельных металлов можно выделять энантиомерно чистые амины. 2. Подобным приему, описанному в вышеприведенном пункте 1, приемом с применением вышеприведенных энантиомерно чистых кислот можно осуществлять рацемическое разделение основных промежуточных соединений (см. схема 1), получающихся при получении рацемических бициклических аминов. 3. Рацемические амины формулы (III), как и приведенные в схеме 1 промежуточные соединения можно подвергать, при необходимости после предыдущего ацилирования, хроматографическому разделению на хиральных носителях (см., например, Г. Блашке, Angew. Chem., 14, 1980). 4. Рацемические амины формулы (III) также путем химического соединения с хиральными остатками ацила можно переводить в диастереомерные смеси, которые перегонкой, кристаллизацией или хроматографией разделяются на диастереомерно чистые производные ацила, из которых путем омыления можно выделять энантиомерно чистые амины. Примерами реагентов для соединения с хиральными остатками ацила являются: a-метокси-a-трифтор-метил-фенил-ацетилхлорид, ментил-изоцианат, D- или L-a-фенил-этил-изоцианат, сложный ментиловый эфир хлормуравьиной кислоты, хлорангидрид камфера-10-сульфокислоты. 8 42797 ного растворителя, например диметилсульфоксида, при температуре 50-120°С при атмосферном давлении или нагреванием в автоклаве. Предлагаемые соединения формулы (І), у которых А означает С-ОСН3, получают также путем взаимодействия соединений формулы (І), у которых А означает C-F, с метилатами щелочного металла, например метилатом натрия, в среде растворителя, такого, как, например, диметилформамид, сложный гликольдиметиловый эфир, диоксан, тетрагидрофуран, диметилсуьфоксид, трисамид гексаметилфосфорной кислоты или спирты, при температуре 20-150°С. В случае применения низкокипящих растворителей взаимодействие также можно осуществлять в автоклаве под давлением. Добавкой сложных кроновых эфиров, таких, как, например, 15-краун-5 или 18-краун-6 можно ускорять реакцию. Предлагаемые сложные эфиры получают в результате реакции соответствующей карбоновой кислоты предпочтительно в избыточном спирте в присутствии сильных кислот, таких, как, например, сульфокислота, безводный хлористый водород, метансульфокислота, п-толуолсульфокислота, или кислых ионитов, при температуре примерно 20-180°С, предпочтительно 60-120°С. Полученную при этом воду можно удалять, например, путем азеотропной перегонки с хлороформом, тетрахлорметаном или толуолом. Получение сложных эфиров преимущественно можно осуществлять путем нагревания соответствующей кислоты вместе с диалкилацеталем диметилформамида в растворителе, например, диметилформамиде. Переводимые в активные вещества сложные эфиры, например, сложный 5-метил-2-оксо-1,3диоксол-4-ил-метиловый эфир получают в результате взаимодействия соли щелочного металла соответствующей карбоновой кислоты, которая у атома азота может быть защищена защитной группой, с 4-бромметил- или 4-хлорметил-5метил-1,3-диоксол-2-оном в растворителе, такого, как, например, диметилформамид, диметилацетамид, N-метил-пирролидон, диметилсульфоксид или тетраметилмочевина, при температуре примерно 0-100°С, предпочтительно 0-50°С. Кислотно-аддитивные соли предлагаемых соединений получают известными приемами, например растворением в избыточном количестве водной кислоты и осаждением соли смешиваемым с водой органическим растворителем, таким, как, например, метанол, этанол, ацетон, ацетонитрил. Эквивалентные количества соответствующих бетаина и кислоты также можно растворять в воде, с последующей лиофилизацией раствора, или нагревать в воде или спирте, например, простом гликольмонометиловом эфире, после чего смесь упаривают досуха или отсасывают выпавшую соль. В качестве фармацевтически приемлемых солей можно применять, например, соли соляной кислоты, серной кислоты, уксусной кислоты, гликолевой кислоты, молочной кислоты, янтарной кислоты, лимонной кислоты, винной кислоты, 2-оксиглутаровой кислоты, метансульфокислоты, 4толуолсульфокислоты, галактуроновой кислоты, глюкуроновой кислоты, 5-оксотетрагидрофуран-2 карбоновой кислоты, эмбоновой кислоты, глутаминовой кислоты или аспарагиновой кислоты. Соли щелочных или щелочно-земельных металлов предлагаемых карбоновых кислот получают, например, путем растворения соответствующего бетаина в избыточном количестве щелочного или щелочно-земельного раствора, фильтрации нерастворившегося бетаина и упаривания фильтрата досуха. Фармацевтически приемлемыми являются соли натрия, калия или кальция. Путем взаимодействия соли щелочных или щелочноземельных металлов с пригодной солью серебра как, например, нитратом серебра, получают соответствующие соли серебра. Кроме приведенных в примерах активных веществ можно получать и нижеследующие активные вещества, а также указанные в таблицах активные вещества, при этом все активные вещества могут иметься в виде рацематов или энантиромерно чистых соединений, смесей диастереомеров или диастереомерно чистых соединений. 8-(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2ил)-7-фтор-5-оксо-9,1-(эпоксиметано)-5Н-тиазоло[3,2-а]хинолин-4-карбоновая кислота, 7-фтор-8(3а-метиламино-1,2,3,7а-тетрагидро-изоиндол-2ил)-5-оксо-9,1-(эпоксиметано)-5Н-тиазоло-[3,2а]хинолин-4-карбоновая кислота, 8-(3а-аминометил-1,2,3,7а-тетрагидро-изоиндол-2-ил)-7-фтор-5оксо-9,1-(эпоксиметано)-5Н-тиазоло[3,2-а]хинолин-4-карбоновая кислота, 7-фтор-8-(3а-метиламинометил-1,2,3,7а-тетрагидро-изоиндол-2-ил)-5оксо-9,1-(эпоксиметано)-5Н-тиазоло-[3,2-а]хинолин-4-карбоновая кислота, 8-(3а-амино-1,2,3,7атетрагидро-изоиндол-2-ил)-7-фтор-5-оксо-9,1-[(Nметил-имино)метано]-5Н-тиазоло[3,2-а]хинолин-4карбоновая кислота, 7-фтор-8-(3а-метиламино1,2,3,7а-тетрагидро-изоиндол-2-ил)-5-оксо-9,1-[(Nметил-имино)метано]-5Н-тиазоло-[3,2-а]хинолин4-карбоновая кислота, 8-(3а-аминометил-1,2,3,7атетрагидро-изоиндол-2-ил)-7-фтор-5-оксо-9,1-[(Nметилимино)метано]-5Н-тиазоло[3,2-а]хинолин-4карбоновая кислота, 7-фтор-8-(3а-метиламинометил-1,2,3,7а-тетрагидро-изоиндол-2-ил)-5-оксо9,1-[(N-метилимино)метано]-5Н-тиазоло-[3,2-а]хинолин-4-карбоновая кислота, 10-(3а-амино1,2,3,7а-тетрагидро-изоиндол-2-ил)-9-фтор-3метил-7-оксо-2,3-дигидро-7Н-пиридо[1,2,3-d,e][1,3,4]бензоксадиазин-6-карбоновая кислота, 9фтор-3-метил-10-(3а-метиламино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-7-оксо-2,3-дигидро-7Н-пиридо[1,2,3-d,e]-[1,3,4]бензоксадиазин-6-карбоновая кислота, 10-(3а-амино-метил-1,2,3,7а-тетрагидроизоиндол-2-ил)-9-фтор-3-метил-7-оксо-2,3-дигидро-7Н-пиридо[1,2,3-d,e]-[1,3,4]бензоксадиазин-6карбоновая кислота, 8-амино-10-(3а-амино1,2,3,7а-тетрагидро-изоиндол-2-ил)-9-фтор-3метил-7-оксо-2,3-дигидро-7Н-пиридо[1,2,3-d,e][1,3,4]бензоксадиазин-6-карбоновая кислота, 10(3а-диметиламинометил-1,2,3,7а-тетрагидро-изоиндол-2-ил)-9-фтор-3-метил-7-оксо-2,3-дигидро7Н-пиридо[1,2,3-d,е]-[1,3,4]бензоксадиазин-6карбоновая кислота, 9-фтор-3-метил-10-(3аметиламино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-7оксо-2,3-дигидро-7Н-пиридо[1,2,3-d,е]-[1,4]бензоксазин-6-карбоновая кислота, 10-(3а-аминометил1,2,3,7а-тетрагидро-изоиндол-2-ил)-9-фтор-3метил-7-оксо-2,3-дигидро-7Н-пиридо[1,2,3 9 42797 d,e][1,4]бензоксазин-6-карбоновая кислота, 8амино-10-(3а-амино-1,2,3,7а-тетрагидро-изоиндол2-ил)-9-фтор-3-метил-7-оксо-2,3-дигидро-7Н-пиридо[1,2,3-d,e][1,4]бензоксазин-6-карбоновая кислота, 10-(3а-амино-5-метил-1,2,3,7а-тетрагидро-изоиндол-2-ил)-9-фтор-3-метил-7-оксо-2,3-дигидро7Н-пиридо[1,2,3-d,e][1,4]бензоксазин-6-карбоновая кислота, 7-(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-6-фтор-4-оксо-4Н-[1,3]-тиацето[3,2-а]хинолин-3-карбоновая кислота, 7-(3а-амино-1,2,3,7атетрагидро-изоиндол-2-ил)-6-фтор-1-метил-4-оксо4Н-[1,3]-тиацето[3,2-а]хинолин-3-карбоновая кислота, 7-(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2ил)-6-фтор-1-фторметил-4-оксо-4Н-[1,3]тиацето[3,2-а]хинолин-3-карбоновая кислота, 7-(3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1циклопропил-6-фтор-3-нитроацетил-4-оксо-1,4дигидрохинолин, 7-(3а-амино-1,2,3,7а-тетрагидроизоиндол-2-ил)-1-циклопропил-6-фтор-8-метокси 3-нитроацетил-4-оксо-1,4-дигидрохинолин, 7-(3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1циклопропил-6,8-дифтор-3-нитроацетил-4-оксо1,4-дигидрохинолин, 7-(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1-циклопропил-8-хлор-6фтор-3-нитроацетил-4-оксо-1,4-дигидрохинолин, 7-(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1циклопропил-3-(диэтоксикарбонил)ацетил-6-фтор4-оксо-1,4-дигидрохинолин, 7-(3а-амино-1,2,3,7атетрагидро-изоиндол-2-ил)-1-циклопропил-3(диэтоксикарбонил)ацетил-6-фтор-8-метокси-4оксо-1,4-дигидрохинолин, 7-(3а-амино-1,2,3,7атетрагидро-изоиндол-2-ил)-1-циклопропил-3-(диэтоксикарбонил)ацетил-6,8-дифтор-4-оксо-1,4дигидрохинолин, 7-(3а-амино-1,2,3,7а-тетрагидроизоиндол-2-ил)-8-хлор-1-циклопропил-3-(диэтоксикарбонил)ацетил-6-фтор-4-оксо-1,4-дигидрохинолин. Таблица 1 Т* ТI ТI ТI ТI ТI ТI ТI ТI ТI ТI ТI ТI ТI ТI ТII ТII ТII X2 Н Н Н Н Н Н F NH2 Н Н Н Н Н Н F NH2 Н А С-Н C-F С-Сl С-СН3 C-OCH3 N C-F C-F C-F С-Сl С-СºСН С-СН=СН2 C-OCHF2 C-CF3 С-СН3 C-CF3 С-ОСН3 *) TI = 3а-аминометил-1,2,3,7а-тетрагидроизоиндол-2-ил ТII = 3а-амино-1,2,3,7а-тетрагидроизоиндол-2-ил 10 R2 Н Н Н Н Н Н Н Н С2H5 C2H5 Н Н Н Н Н Н С2H5 42797 Таблица 2 Т* TI Tll ТI TII Tll ТI TII ТI TII ТII ТI Tll ТI Tll ТI Tll TII A С-Н N N N C-F С-Н С-Н N N С-ОСН3 С-Н С-Н C-F C-F N N N X2 Н Н Н CH3 Н Н Н Н Н Н Н Н Н Н Н Н Н R1 С(СН3)3 С(СН3)3 С(СН3)3 С(СН3)3 С(СН3)3 фтор-трет.-бутил фтор-трет.-бутил фтор-трет.-бутил фтор-трет.-бутил фтор-трет.-бутил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил R2 Н Н Н Н Н Н C2H5 Н Н Н Н Н Н Н Н Н С2Н5 *) TI = 3а-аминометил-1,2,3,7а-тетрагидроизоиндол-2-ил ТII = За-амино-1,2,3,7а-тетрагидроизоиндол-2-ил Таблица 3 Т* ТI TІІ ТI ТII ТI ТII ТI TII ТІ TII ТI ТII ТI ТII ТI TII TII А С-Н С-Н N N C-F C-F С-ОСН3 С-ОСН3 С-Н С-Н N N C-F C-F С-ОСН3 С-ОСН3 С-Н X2 Н Н Н СН3 Н Н Н Н Н Н Н Н Н Н Н Н Н *) TI = 3а-аминометил-1,2,3,7а-тетрагидроизоиндол-2-ил ТII = 3а-амино-1,2,3,7а-тетрагидроизоиндол-2-ил 11 R1 бицикло[1.1.1]пент-1-ил бицикло[1.1.1]пент-1-ил бицикло[1.1.1]пент-1-ил бицикло[1.1.1]пент-1-ил бицикло[1.1.1]пент-1-ил бицикло[1.1.1]пент-1-ил бицикло[1.1.1]пент-1-ил бицикло[1.1.1]пент-1-ил 3-оксетанил 3-оксетанил 3-оксетанил 3-оксетанил 3-оксетанил 3-оксетанил 3-оксетанил 3-оксетанил 4-фторфенил R2 Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н С2H5 42797 Таблица 4 Т* TIII TIV TIII TIV TIII TIV TIII TIV TIII TIV TIII TIV TIII TIV TIII TIV TIII TIV X2 H H H H H H H H H H H H H H H H H H A C-H C-H C-F C-F C-Cl C-Cl C-OCH3 C-OCH3 C-CHF2 C-CHF2 C-CF3 C-CF3 C-CH3 C-CH3 C-CH=CH2 C-CH=CH2 C-CºCH C-CºCH R2 H H H H H H H H H H H H H H H H H H *) TIII = 3а-метиламино-1,2,3,7а-тетрагидроизоиндол-2-ил TIV = 3а-диметиламино-1,2,3,7а-тетрагидроизоиндол-2-ил Таблица 5 Т* TIII TIV TIII TIV TIII TIV TIII TIV TIII TIV TI TII TIII TIV A C-F C-F C-F C-F N N C-OCH3 C-OCH3 C-OCH3 C-OCH3 C-OCH3 C-OCH3 N N X2 NH2 NH2 F F H H H H H H H H CH3 CH3 12 R2 H H H H H H C2H5 С2H5 (5-мeтил-2-оксо-1,3-диоксол-4-ил)-метил (5-метил-2-оксо-1,3-диоксол-4-ил)-метил (5-метил-2-оксо-1,3-диоксол-4-ил)-метил (5-метил-2-оксо-1,3-диоксол-4-ил)-метил H H 42797 Продолжение табл. 5 Т* TI TII TIII TIV X2 CH3 CH3 CH3 CH3 A C-H C-H C-H C-H R2 H H H H *) ТI = 3а-аминометил-1,2,3,7а-тетрагидроизоиндол-2-ил TII = 3а-амино-1,2,3,7а-тетрагидроизоиндол-2-ил TIII = 3а-метиламино-1,2,3,7а-тетрагидроизоиндол-2-ил TIV = 3a-диметиламино-1,2,3,7а-тетрагидроизоиндол-2-ил Таблица 6 Т* ТI ТI ТI ТI ТI ТI ТI ТI ТI ТI ТII ТII ТII ТII ТII ТII ТII X2 Н Н Н Н Н Н F NH2 Н Н Н Н Н Н Н Н F А С-Н C-F С-Сl C-CH3 С-ОСН3 N C-F C-F C-F С-Сl С-Н C-F С-Сl С-СН3 С-ОСН3 N C-F *) ТI = 3а-аминометил-1,2,3,7а-тетрагидроизоиндол-2-ил ТII = 3а-амино-1,2,3,7а-тетрагидроизоиндол-2-ил 13 R2 Н Н Н Н Н Н Н Н С2Н5 С2H5 Н Н С2H5 Н Н Н Н 42797 Таблица 7 Т* TIII TIII ТІІІ TIII TIII TIII ТIII TIII TIII TIII TIV TIV ТIV TIV ТIV ТIV TIV X2 H H H H H H F NH2 H H H H H H H H F А С-Н C-F C-Cl C-CH3 С-ОСН3 N C-F C-F C-F C-Cl С-Н C-F C-Cl C-CH3 C-OCH3 N C-F R2 H H H H H H H H C2H5 C2H5 H H H H H H H *) TIII = 3а-метиламино-1,2,3,7а-тетрагидроизоиндол-2-ил ТIV = 3а-диметиламино-1,2,3,7а-тетрагидроизоиндол-2-ил Таблица 8 Т* TV TV TV TV TV TV TV TV TV TV TVI TVl TVI TVI TVI TVI TVI X2 H H H H H H F NH2 H H H H H H H H F A C-H C-F C-Cl C-CH3 С-ОСH3 N C-F C-F C-F C-Cl C-H C-F C-Cl C-CH3 C-OCH3 N C-F *) TV = 3а-метиламинометил-1,2,3,7а-тетрагидроизоиндол-2-ил TVI = 3а-этиламинометил-1,2,3,7а-тетрагидроизоиндол-2-ил 14 R2 H H H H H H H H C2H5 C2H5 H H H H H H H 42797 Предлагаемые соединения проявляют высокую антибиотическую активность и при незначительной токсичности обладают широким антибактериальным спектром против грамположительных и грамотрицательных бактерий, в частности против бактерий, резистентных к различным антибиотическим средствам, таким, как, например, пенициллины, цефалоспорины, аминогликозиды, сульфонамиды, тетрациклины, а также против торговых хинолонов. Предлагаемые соединения отличаются, в частности, тем, что по сравнению с соединениями уровня техники они проявляют уменьшенное взаимодействие с дезоксирибонуклеиновой кислотой млекопитающих. Благодаря этим ценным свойствам соединения могут применяться в качестве химиотерапевтических активных начал в медицине и ветеринарии, а также для консервирования неорганических и органических материалов, таких, как, например, полимеры, смазочные вещества, краски, волокна, кожа, бумага и древесина, продовольственные продукты и вода. Предлагаемые соединения проявляют активность против очень широкого спектра микроорганизмов. С их помощью можно бороться с грамположительными и грамотрицательными бактериями и бактериоподобными микроорганизмами, а также с заболеваниями, вызванными этими возбудителями. Предлагаемые соединения отличаются усиленной активностью в отношении неактивных бактерий. В случае неактивных бактерий, т.е. у которых не наблюдается роста, соединения проявляют хорошую бактерицидную активность. Это относится не только к применяемому количеству, но и к темпу умерщвления. Такие результаты наблюдают у грамположительных и грамотрицательных бактерий, в частности у Staphylococcus aureus, Pseudomonas aeruginosa, Enterococcus faecalis и Escherichia coli. Предлагаемые соединения особенно активны против типичных и атипичных микобактерий и Helicobacter pylori, а также против бактериоподобных микроорганизмов, таких, как, например, микоплазмы и риккетсиозы. Благодаря этому они особенно пригодны в медицине и ветеринарии для профилактики и химиотерапии местных и системных инфекций, вызываемых этими возбудителями. Кроме того, соединения особенно пригодны для борьбы с протозоонозами и гельминтозами. Соединения по изобретению можно применять в разных фармацевтических препаратах. Предпочтительными фармацевтическими препаратами являются таблетки, драже, капсулы, пилюли, гранулы, суппозитории, растворы, суспензии, эмульсии, пасты, мази, гели, кремы, лосьоны, пудры и аэрозоли. Соединения по изобретению могут также соединяться с производными b-лактама, такими, как, например, цефалоспорины или пенемы, через ковалентные связи с получением так называемых производных двойного действия. Исходя из вышеприведенных данных, дальнейшим объектом изобретения является фармацевтическая композиция с антибактериальной активностью, содержащая кроме по меньшей мере одного фармацевтически приемлемого носителя соединение вышеуказанной общей формулы (I), смесь его изомеров или отдельный изомер, каждый раз в виде гидрата или соли, в эффективном количестве. В нижеследующих табл. 9 и 10 приведены минимальные концентрации торможения (МКТ) в качестве меры антибактериальной активности, и значения ИД50 (ИД - ингибирующая доза) в качестве меры взаимодействия соединения с дезоксирибонуклеиновой кислотой млекопитающих для соединений по изобретению, а также для соединений по уровню техники (европейский патент № 520240). Эти данные доказывают, что соединения по изобретению при высокой антибактериальной активностью проявляют значительно уменьшенное взаимодействие с дезоксирибонуклеиновой кислотой млекопитающих. Минимальные концентрации торможения (МКТ) определяют путем метода серийного разбавления на агаре Изо-Сенситест. Для каждого испытуемого вещества приготовляют ряд агаровых пластинок, содержащих при двойном разбавлении уменьшающиеся концентрации активного вещества. Агаровые пластинки прививают с помощью многоточечного инокулятора фирмы Денлей. Для прививки применяют выращиваемые в течение ночи культуры возбудителей, которые сначала разбавляют так, чтобы каждая точка прививки содержала около 104 образующих колонию частиц. Привитые агаровые пластинки инкубируют при температуре 37°С, и примерно через 20 часов определяют рост микробов. Значение минимальных концентраций торможения (мкг/мл) дает самую низкую концентрацию активного вещества, при которой невооруженным глазом нельзя обнаружить рост микробов. Под ИД50 подразумевается концентрация вещества, ингибирующая синтез дезоксирибонуклеиновой кислоты в клетках из яичников китайского хомяка на 50%. Это значение определяют после инкубации соответствующих веществ в уменьшающих разбавлениях в течении определенного срока. Для получения значений фторфотометрическими методами определяют синтез дезоксирибонуклеиновой кислоты в клетках яичников китайского хомяка по сравнению с контрольными пробами. 15 42797 Таблица 9 Значения минимальных концентраций торможения (мкг/мл) и значения ИД50 соединений по изобретению Тест-штамм Е. coli Neumann Staph. aureus 133 Staph. aureus ICB 25701 Ps. aeruginosa Walter Вас. fragills ES 25 ИД50 (мкг/мл) 2 £0,015 0,06 2 1 1 32 3 £0,015 £0,015 0,25 0,5 0,125 32 Соединение примера № 4 8 £0,015 £0,015 0,03 £0,015 0,5 0,5 0,5 0,5 2 0,5 >64 16 9 £0,015 0,06 8 1 4 32 Таблица 10 Значения минимальных концентраций торможения (мкг/мл) и значения ИД50 известных активных начал аналогичной формулы и с аналогичной активностью, описанных в ЕР № 520240 Тест-штамм Е. coli Neumann Staph. aureus 133 Staph. aureus ICB 25701 Ps. aeruginosa Walter Вас. fragilis ES 25 ИД50 (мкг/мл) сравн. соед. 1 0,015 0,015 0,06 0,5 0,5 0,015 Соединения из ЕР 520240 сравн. соед. 2 0,015 0,015 0,015 1 0,25 0,1 сравн. соед. 3 0,015 0,015 0,015 0,5 0,125 0,1 Сравнительное соединение 1: 7-(4-амино-7-метил-1,3,3а,4,7,7а-гексагидро-изоиндол-2-ил)-1циклопропил-6,8-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота Сравнительное соединение 2: 7-(4-амино-7-метил-1,3,3а,4,7,7а-гексагидро-изоиндол-2-ил)-1циклопропил-6-фтор-1,4-дигидро-8-метокси-4-оксо-3-хинолинкарбоновая кислота Сравнительное соединение 3: 7-(4-амино-7-метил-1,3,3а,4,7,7а-гексагидро-изоиндол-2-ил)-8-хлор-1циклопропил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновая кислота Нижеследующий пример поясняет получение соединений формулы (III), являющих исходными соединениями для получения активных начал формулы (I). Пример А А. Сложный этиловый эфир 8-бензил-8азабицикло[4.3.0]нон-3-ен-1-карбоновой кислоты (= сложный этиловый эфир 2-бензил-1,2,3,4,7,7агексагидро-изоиндол-3а-карбоновой кислоты) 231 г (1 моль) сложного этилового эфира 1бензил-2,5-дигидропиррол-3-карбоновой кислоты и 10 г 4-трет.-бутилбренцкатехина растворяют в 1500 мл толуола, в автоклав добавляют азот до давления 20 бар, после чего в автоклав подают 350 г 1,3-бутадиена. Нагревают до температуры 120°С в течение 3 дней, после чего охлаждают и давление сбрасывают до атмосферного. Раствор сгущают и перегоняют. Выход: 264,9 г (87,6% теории) Температура кипения: 127-141°С/0,1 мбар Чистота продукта (по газовой хроматографии): 94% Б. 1-сложный этиловый эфир-8-сложный метиловый эфир 8-азабицикло-[4.3.0]нон-3-ен-1,8дикарбоновой кислоты (= 3а-сложный этиловый эфир-2-сложный метиловый эфир 1,2,3,4,7,7агексагидо-изоиндол-2,3а-дикарбоновой кислоты) 16,4 г (57,5 ммоль) 94%-ного сложного этилового эфира 8-бензил-8-азабицикло[4.3.0]нон-3-ен 1-карбоновой кислоты растворяют в 130 мл абсолютного хлороформа, добавляют 7,5 г карбоната натрия, после чего каплями добавляют 12 г (0,12 моль) сложного метилового эфира хлормуравьиной кислоты. Нагревают с обратным холодильником в течение ночи, отсасывают соли, фильтрат сгущают и остаток перегоняют. Выход: 14,4 г (90% теории) Температура кипения: 122-126°С/0,2 мбар Чистота продукта (по газовой хроматографии): 91% В. 1-сложный этиловый эфир-8-сложный метиловый эфир 8-азабицикло[4.3.0]-нона-2,4-диен1,8-дикарбоновой кислоты (= 3а-сложный этиловый эфир-2-сложный метиловый эфир 1,2,3,7атетрагидро-изоиндол-2,3а-дикарбоновой кислоты) К 46 г (0,17 моль) 94%-ного 1-сложного этилового эфира-8-сложного метилового эфира 8азабицикло[4.3.0]нон-3-ен-1,8-дикарбоновой кислоты в 200 мл абсолютного хлороформа каплями с охлаждением в водяной ванне добавляют 30 г карбоната натрия, после чего каплями добавляют 12 г (0,187 моль) брома и перемешивают в течение 2 часов при комнатной температуре. Сгущают, подают в 1 л абсолютного толуола и добавляют 61 г (0,4 моль) 1,8-диазаби-цикло[5.4.0]ундец-7-ен. Нагревают с обратным холодильником в течение 3 часов, после охлаждения декантируют с выпавших кристаллов, раствор промывают водой, сушат над сульфатом магния, сгущают и перегоняют. 16 42797 Выход: 22,3 г (50% теории) Температура кипения: 125-135°С/0,15 мбар Чистота продукта (по газовой хроматографии): 95,5% Г. 8-сложный метиловый эфир 8-азабицикло[4.3.0]нона-2,4-диен-1,8-дикарбоновой кислоты (= 2-сложный метиловый эфир 1,2,3,7атетрагидро-изоиндол-2,3а-дикарбоновой кислоты) 1. 22 г (83,6 ммоль) 95,5%-ного 1-сложного этилового эфира-8-сложного метилового эфира 8азабицикло[4.3.0]нона-2,4-диен-1,8-дикарбоновой кислоты вместе с 3,7 г (92,5 ммоль) гидроокиси натрия в 60 мл метанола нагревают с обратным холодильником в течение ночи. Раствор сгущают, подают в 40 мл воды и однократно экстрагируют трет.-бутилметиловым эфиром. Водный раствор подкисляют 8 мл концентрированной соляной кислоты и многократно экстрагируют хлористым метиленом. После сушки над сульфатом магния сгущают. Выход: 20,9 г в виде масла 2. К 170 г (0,61 моль) 90%-ного (по газовой хроматографии) 1-сложного этилового эфира-8сложного метилового эфира 8-азабицикло[4.3.0]нона-2,4-диен-1,8-дикарбоновой кислоты в 300 мл тетрагидрофурана каплями при комнатной температуре добавляют 32 г (0,76 моль) LiOH×H2O в 300 мл воды и перемешивают в течение ночи при комнатной температуре. Тетрагидрофуран отгоняют, водный раствор однократно экстрагируют трет.-бутилметиловым эфиром, после этого подкисляют концентрированной соляной кислотой и многократно экстрагируют дихлорметаном. Органический раствор сушат над сульфатом магния, сгущают, а кристаллизующий раствор перекристаллизуют из толуола. Выход: 115 г (84,5% теории) Точка плавления: 107-110°С Д. Сложный метиловый эфир 1-метоксикарбониламино-8-азабицикло[4.3.0]-нона-2,4-диен-8карбоновой кислоты (= сложный метиловый эфир 3а-метоксикарбониламино-1,2,3,7а-тетрагидроизоиндол-2-карбоновой кислоты) 20,9 г сырого 8-сложного метилового эфира 8азабицикло[4.3.0]нона-2,4-диен-1,8-дикарбоновой кислоты с 9,6 г (92 ммоль) триэтиламина, 26 г (107 ммоль) дифенилфосфорилацида и 5 г метанола в 300 мл абсолютного толуола в течение ночи нагревают с обратным холодильником. Раствор промывают водой, сушат над сульфатом магния и сгущают. Продукт используется в сыром состоянии. Выход: 20 г Е. 1,2,3,7а-тетрагидро-изоиндол-3а-иламин (= 1амино-8-азабицикло[4.3.0]-нона-2,4-диен) 20 г сырого сложного метилового эфира 1метоксикарбониламино-8-азабицикло[4.3.0]нона2,4-диен-8-карбоновой кислоты с 75 г (0,235 моль) Ва(ОН)2×8Н2O в 250 мл воды нагревают в течение ночи с обратным холодильником. Карбонат бария отсасывают, фильтрат сгущают, а солевые остатки трижды кипятят 1,4-диоксаном. Диоксановые растворы сгущают, остаток перегоняют. Выход: 5 г (43,9% теории в пересчете на стадию Г) Температура кипения: 65°С/0,2 мбар Ж. 8-сложный метиловый эфир (1S,6S)-8азабицикло[4.3.0]нона-2,4-диен-1,8-дикарбоновой кислоты (= 2-сложный метиловый эфир (3aS,7aS)1,2,3,7a-тетрагидро-изоиндол-2,3а-дикарбоновой кислоты Разделение энантиомеров, метод 1: 100 г (0,448 моль) 8-сложного метилового эфира 8азабицикло-[4.3.0]нона-2,4-диен-1,8-дикарбоновой кислоты растворяют в смеси 750 мл сложного диизопропилового эфира с 750 мл тертагидрофурана и добавляют 27 г (0,223 моль) R-(+)-1фенилэтиламина. Перемешивают в течение ночи при комнатной температуре, кристаллы отсасывают, промывают и сушат на воздухе. Выход: 57 г соли [a]D=+156° (с=1,2, метанол) Кристаллы перекристаллизуют из 600 мл изопропанола. Выход: 41 г (53,4% теории) [a]D=+197°(с=1,1, метанол) Разделение энантиомеров, метод 2: 199 г (0,892 моль) 8-сложного метилового эфира 8азабицикло-[4.3.0]нона-2,4-диен-1,8-дикарбоновой кислоты растворяют в смеси 800 мл сложного диизопропилового эфира с 600 мл тертагидрофурана и добавляют 54 г (0,446 моль) S-(-)-1-фенилэтиламина. Реакционную смесь перемешивают в течение ночи при комнатной температуре, выпавшие кристаллы отсасывают, а выделенную соль перекристаллизуют из 1 л изопропанола. Выход: 65,5 г (42,6% теории) [a]D=-205,4° (с=0,97, метанол) Объединенные маточные растворы сгущают, а остаток подают в 1 л простого трет.-бутилметилового эфира. Раствор экстрагируют со смесью 30 г концентрированной сульфокислоты с 200 мл ледяной воды, а водную фазу реэкстрагируют простым трет.-бутил-метиловым эфиром. Объединенные растворы простого трет.-бутилметилового эфира сушат над сульфатом магния и сгущают. Выход: 170,4 г Этот обогащенный 8-сложный метиловый эфир (+)-8-азабицикло-[4.3.0]-нона-2,4-диен-1,8дикарбоновой кислоты растворяют в смесь 800 мл простого диизопропилового эфира с 600 мл тетрагидрофурана и добавляют 55 г R-(+)-1-фенилэтиламина. Соль отсасывают, промывают смесью тетрагидрофурана с простым диизопропиловым эфиром и сушат на воздухе. Выход: 141 г (91,8% теории) [a]D=+161,1° (с=1,928, метанол) Соль дважды перекристаллизуют из смеси изопропанола с простым диизопропиловым эфиром в соотношении 4:1. Выход: 112,5 г [a]D=+215,7° (с=1,1, метанол) Освобождение кислоты: 17 г (49,3 ммоль) полученных кристаллов суспендируют в 100 мл ледяной воды и подкисляют 3 мл концентрированной сульфокислоты. Трижды экстрагируют, каждый раз с применением 100 мл простого трет. 17 42797 бутилметилового эфира, органические фазы сушат над сульфатом магния и сгущают. Выход сырого продукта: 13,2 г Температура плавления: 79-81°С (из простого диизопропилового эфира) [a]D=+254° (с=0,85, дихлорметан) З. Сложный метиловый эфир (1S,6R)-1-метоксикарбониламино-8-азабицикло-[4.3.0]нона-2,4диен-8-карбоновой кислоты (= сложный метиловый эфир (3аS,7аR)-3а-метоксикарбониламино1,2,3,7а-тетрагидро-изоиндол-2-карбоновой кислоты) Аналогично стадии Д 13 г сырого 8-сложного метилового эфира (1S,6S)-8-азабицикло[4.3.0]нона-2,4-диен-1,8-дикарбоновой кислоты подвергают взаимодействию с 5 г (50 ммоль) триэтиламина, 3,2 г метанола и 13,7 г (55 ммоль) дифенилфосфорилацида в 160 мл абсолютного толуола и соответственно обрабатывают. Выход сырого продукта: 11,2 г И. (3aS,7aR)-1,2,3,7а-тетрагидро-изоиндол-3а-иламин (= (1S,6R)-1-амино-8-аза-бицикло[4.3.0]нона2,4-диен) Аналогично стадии Е 11 г сырого сложного метилового эфира (1S,6R)-1-метоксикарбониламино-8-азабицикло[4.3.0]-нона-2,4-диен-8-карбоновой кислоты с 42 г Ва(ОН)2×8Н2O в 150 мл воды подвергают омылению и соответственно обрабатывают. Выход: 3 г (44,6% теории в пересчете на стадию Ж) Температура кипения: 70°С /0,1 мбар [a]D=+235,9° (с=1,14, метанол) Й. 8-метиловый эфир (1R,6R)-8-азабицикло[4.3.0]нона-2,4-диен-1,8-дикарбоновой кислоты (= 2-сложный метиловый эфир (3аR,7аR)-1,2,3,7атетрагидро-изоиндол-2,3а-дикарбоновой кислоты) Аналогично стадии Ж (метод 1) разделение рацемата осуществляют при помощи S-(-)фенилэтиламина с получением 8-сложного метилового эфира (1R,6R)-8-азабицикло[4.3.0]нона-2,4диен-1,8-дикарбоновой кислоты. [a]D=-233,6° (с=0,6, дихлорметан) К. Сложный метиловый эфир (1R,6R)-1-метоксикарбониламино-8-азабицикло-[4.3.0]нона-2,4диен-8-карбоновой кислоты (= сложный метиловый эфир (3аR,7аS)-3а-метоксикарбониламино1,2,3,7а-тетрагидро-изоиндол-2-карбоновой кислоты) Продукт стадии Й реагируют аналогично стадии З с получением сложного метилового эфира (1R,6S)-1-метоксикарбониламино-8-азабицикло[4.3.0]-нона-2,4-диен-8-карбоновой кислоты, который применяют в сыром состоянии. Л. (3аR,7аS)-1,2,3,7а-тетрагидро-изоиндол-3а-иламин (= (1R,6S)-1-амино-8-аза-бицикло[4.3.0]нона2,4-диен) Полученный на стадии К продукт реагируют приемом, аналогичным стадии Е. [a]D=-224° (с=0,8, метанол) М. Сложный метиловый эфир 8-азабицикло[4.3.0]нона-2,4-диен-1-карбоксамид-8-карбоновой кислоты (= сложный метиловый эфир 1,2,3,7атетрагидро-изоиндол-3а-карбоксамид-2-карбоновой кислоты) В 4,5 г (20 ммоль) 8-сложного метилового эфира 8-азабицикло-[4.3.0]-нона-2,4-диен-1,8-дикарбоновой кислоты в 20 мл абсолютного дихлорметана подают 2,2 г (22 ммоль) триэтиламина. Охлаждают до температуры -20°С, каплями добавляют 2,6 г (25 ммоль) сложного этилового эфира хлормуравьиной кислоты и перемешивают в течение 1 часа при температуре -20°С. После этого при той же температуре каплями добавляют 20 мл 25%-ного водного раствора аммиака, дают нагреваться до комнатной температуры и перемешивают в течение 1 часа. Многократно экстрагируют дихлорметаном, сушат над сульфатом магния и сгущают. Продукт выкристаллизуется. Выход сырого продукта: 4,4 г (99% теории) Температура плавления: 117-120°С (из толуола) Н. Сложный метиловый эфир 1-амино-8-азабицикло-[4.3.0]нона-2,4-диен-8-карбоновой кислоты (= сложный метиловый эфир 3а-амино-1,2,3,7атетрагидро-изоиндол-2-карбоновой кислоты) 4,3 г (19,4 ммоль) сложного метилового эфира 8-азабицикло-[4.3.0]-нона-2,4-диен-1-карбоксамид8-карбоновой кислоты с 7,9 г (20,2 ммоль) І-окси-Ітозил-оксийодбензола в 100мл абсолютного ацетонитрила нагревают с обратным холодильником в течение 3 часов. Раствор сгущают, подают в 100 мл хлороформа, промывают 15%-ным раствором гидроокиси калия, сушат над сульфатом магния, сгущают и перегоняют в высоком вакууме. Выход: 1,5 г (40% теории) Температура кипения: 122-125°С/0,07 мбар О. 1,2,3,7а-тетрагидро-изоиндол-3а-иламин (= 1амино-8-аза-бицикло[4.3.0]-нона-2,4-диен) Аналогично стадии Е 1,4 г (7,2 ммоль) сложного метилового эфира 1-амино-8-азабицикло[4.3.0]нона-2,4-диен-8-карбоновой кислоты с 4 г Ва(ОН)2×8Н2О в 20 мл воды подвергают омылению и соответственно обрабатывают. Выход: 0,6 г (61% теории) Температура кипения: 65°С/0,1 мбар Следующие примеры поясняют получение активных начал общей формулы (I). Пример 1 265 мг (1 ммоль) 1-циклопропил-6,7-дифтор1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты вместе со смесью 4 мл ацетонитрила и 2 мл диметилформамида с 170 мг (1,5 ммоль) 1,4диазабицикло[2.2.2]октана и 150 мг (1,1 ммоль) 1,2,3,7а-тетрагидро-изоиндол-3а-иламина нагре 18 42797 вают с обратным холодильником в течение 1 часа. Выпавший осадок отсасывают, промывают 30 мл воды и сушат. Выход: 288мг (75,6% теории) 7-(3а-амино1,2,3,7а-тетрагидро-изоиндол-2-ил)-1-циклопропил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты Точка плавления: 272-274°С (разложение) Пример 2 ил-6-фтор-1,4-дигидро-8-метокси-4-оксо-3-хинолинкарбоновой кислоты Температура плавления: 195-196°С (разложение) Пример 5 289 мг (1 ммоль) 1-циклопропил-8-этинил-6,7дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты в смеси 4 мл ацетонитрила и 2 мл диметилформамида с 170 мг (1,5 ммоль) 1,4диазабицикло[2.2.2]октана и 150 мг (1,1 ммоль) 1,2,3,7а-тетрагидро-изоиндол-3а-иламина нагревают с обратным холодильником в течение 1 часа. Реакционную смесь сгущают и остаток перемешивают с водой (рН=8), после чего добавкой концентрированной кислоты рН доводят до 7. Выпавший осадок отсасывают, промывают водой и сушат. Выход: 382 мг (94% теории) 7-(3а-амино1,2,3,7а-тетрагидро-изоиндол-2-ил)-1-циклопропил-8-этинил-6-фтор-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты Температура плавления: 176-177°С (разложение) Пример 6 Аналогично примеру 1 с применением 1циклопропил-6,7,8-трифтор-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты получают 7-(3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксо-3хинолинкарбоновую кислоту. Выход: 85% теории Температура плавления: 232-233°С (разложение) Пример 3 Аналогично примеру 1 с применением 8-хлор1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты получают 7-(3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-8-хлор1-циклопропил-6-фтор-1,4-дигидро-4-оксо-3хинолинкарбоновую кислоту. Выход: 58% теории Температура плавления: 179-182°С (разложение) Пример 4 Аналогично примеру 5 с применением 1циклопропил-8-дифторметокси-6,7-дифтор-1,4дигидро-4-оксо-3-хинолинкарбоновой кислоты получают 7-(3а-амино-1,2,3,7а-тетрагидро-изоиндол2-ил)-1-циклопропил-8-дифторметокси-6-фтор-1,4дигидро-4-оксо-3-хинолинкарбоновую кислоту. Выход: 66% теории Температура плавления: 215-217°С (разложение) Пример 7 295 мг (1 ммоль) 1-циклопропил-6,7-дифтор1,4-дигидро-8-метокси-4-оксо-3-хинолинкарбоновой кислоты в смеси 4 мл ацетонитрила и 2 мл диметилформамида с 330 мг (2,4 ммоль) 1,2,3,7атетрагидро-изоиндол-3а-иламина нагревают с обратным холодильником в течение 1 часа. Реакционную смесь сгущают и остаток перемешивают с 40 мл воды. Медленно выпадающий осадок отсасывают, промывают водой и сушат при температуре 60°С в высоком вакууме. Выход: 175 мг (43% теории) 7-(3а-амино1,2,3,7а-тетрагидро-изоиндол-2-ил)-1-циклопроп Аналогично примеру 1 с применением (S)9,10-дифтор-2,3-дигидро-3-метил-7-оксо-7Нпиридо[1,2,3-d,е][1,4]бензоксацин-6-карбоновой кислоты получают 10-(3а-амино-1,2,3,7атетрагидро-изоиндол-2-ил)-9-фтор-2,3-дигидро 19 42797 3(S)-метил-7-оксо-7Н-пиридо[1,2,3-d,e][1,4]бензоксацин-6-карбоновую кислоту. Выход: 45% теории Температура плавления: 242-243°С (разложение) Пример 8 смеси дихлорметана с метанолом и 17%-ным аммиаком в соотношении 30:8:1 выделяют 7-(3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-8-бром1-цикло-пропил-6-фтор-1,4-дигидро-4-оксо-3хинолинкарбоновую кислоту. Температура плавления: 200-201°С (разложение) Пример 11 Аналогично примеру 1 с применением рацемического 6,7,8-трифтор-1-(цис-2-фторциклопропил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты получают 7-(3а-амино-1,2,3,7а-тетрагидроизоиндол-2-ил)-6,8-дифтор-1-(цис-2-фторциклопропил)-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту. Выход: 66% теории Температура плавления: 210-211°С (разложение) Пример 9 А К 385 мг (1 ммоль) сложного этилового эфира 7-хлор-1-(2,4-дифторфенил)-6-фтор-1,4-дигидро4-оксо-1,8-нафтиридин-3-карбоновой кислоты в 6 мл ацетонитрила подают 202 мг (1,5 ммоль) 1,2,3,7а-тетрагидро-изоиндол-3а-иламина. Реакционную смесь перемешивают при температуре 30°С в течение 2 часов. Осадок отсасывают, промывают ацетонитрилом, сушат при температуре 90°С и давлении 0,1 мбар (выход сырого продукта: 255 мг) и очищают путем хроматографии на 15 г силикагеля с применением в качестве элюента смеси дихлорметана с метанолом и 17%-ным аммиаком в соотношении 30:8:1. Выход: 86 мг (18% теории) сложного этилового эфира 7-(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты Температура плавления: 202-207°С (разложение) Б 80 мг продукта стадии А в смеси 1 мл уксусной кислоты с 0,75 мл полуконцентрированной соляной кислоты в течение 2 часов нагревают с обратным холодильником. Реакционную смесь сгущают, остаток перемешивают с небольшим количеством воды, осадок отсасывают, промывают водой и сушат при температуре 100°С в высоком вакууме. Выход: 37 мг (45% теории) гидрохлорида 7(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-6фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8нафтиридин-3-карбоновой кислоты. Температура плавления: 208-210°С (разложение) К 283 мг (1 ммоль) 7-хлор-1-циклопропил-6фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты в 6 мл ацетонитрила при температуре 25°С добавляют 270 мг (2 ммоль) 1,2,3,7атетрагидро-изоиндол-3а-иламина. Реакционную смесь перемешивают при температуре 50°С в течение 1 часа. Суспензию охлаждают в ванне льда, осадок отсасывают, промывают ацетонитрилом, перемешивают с водой и сушат при температуре 80°С и давлении 0,1 мбар. Выход: 262 мг (67% теории) 7-(3а-амино1,2,3,7а-тетрагидро-изоиндол-2-ил)-1-циклопропил-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3карбоновой кислоты Температура плавления: 239-240°С (разложение) Пример 10 Аналогично примеру 1 с применением 8-бром1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты получают реакционную смесь, из которой путем хроматографии на силикагеле с применением в качестве элюента 20 42797 Пример 12 Пример 15 Аналогично примеру 1 с применением 1-этил6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты получают 7-(3а-амино-1,2,3,7атетрагидро-изоиндол-2-ил)-1-этил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту. Выход: 63% теории Температура плавления: 229°С (разложение) Пример 16 Аналогично примеру 4 с применением 1-(2,4дифторфенил)-6,7-дифтор-1,4-дигидро-5-метил-4оксо-3-хинолинкарбоновой кислоты получают 7(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1(2,4-дифторфенил)-6-фтор-1,4-дигидро-5-метил-4оксо-3-хинолинкарбоновую кислоту. Выход: 89% теории Температура плавления: 157-159°С (разложение) Пример 13 Аналогично примеру 1 с применением 5-бром1-циклопропил-6,78-трифтор-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты получают 7-(3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-5-бром1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксо-3хинолинкарбоновую кислоту. Выход: 71% теории Температура плавления: 278-280°С (разложение) Пример 17 Аналогично примеру 1 с применением сложного этилового эфира 6,7-дифтор-1-(фтортрет.бутил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты получают реакционную смесь, из которой путем хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана с метанолом в соотношении 95:5 выделяют сложный этиловый эфир 7-(3а-амино-1,2,3,7атетрагидро-изоиндол-2-ил)-6-фтор-1-(фтортрет.бутил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Температура плавления: 219-220°С (разложение) Пример 14 Аналогично примеру 1 с применением 1циклопропил-5,6,78-тетрафтор-1,4-дигидро-4-оксо3-хинолинкарбоновой кислоты получают 7-(3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1-циклопропил-5,6,8-трифтор-1,4-дигидро-4-оксо-3хинолинкарбоновую кислоту. Выход: 70% теории Температура плавления: 244-245°С (разложение) Пример 18 Аналогично примеру 4 с применением 6,7дифтор-1-(фтор-трет.бутил)-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты получают 7-(3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-6-фтор1-(фтор-трет.бутил)-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту. Выход: 78% теории Температура плавления: 229-231°С (разложение) В раствор 50 мг (0,12 ммоль) 7-(3а-амино1,2,3,7а-тетрагидро-изоиндол-2-ил)-1-циклопропил-5,6,8-трифтор-1,4-дигидро-4-оксо-3-хинолин 21 42797 карбоновой кислоты в 5 мл диметилсульфоксида в течение 14 часов при температуре 110-120°С подают поток аммиака. Смесь упаривают и остаток перемешивают с 8 мл этанола. Нерастворившийся осадок отсасывают, промывают этанолом, сушат при температуре 60°С в высоком вакууме с получением 27 мг сырого продукта и очищают путем хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана с метанолом в соотношении 95:5. Выход: 18 мг 5-амино-7-(3а-амино-1,2,3,7атетрагидро-изоиндол-2-ил)-1-циклопропил-6,8дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты Температура плавления: 194-195°С (разложение) Пример 19 Аналогично примеру 4 с применением 1-(2,4дифторфенил)-6,7-дифтор-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты получают 7-(3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1-(2,4дифторфенил)-6-фтор-1,4-дигидро-4-оксо-3хинолинкарбоновую кислоту. Выход: 77% теории Температура плавления: 253-254°С (разложение) Пример 22 Аналогично примеру 4 с применением 1-(2,4дифторфенил)-6,7,8-трифтор-1,4-дигидро-4-оксо5-винил-3-хинолинкарбоновой кислоты получают 7-(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1(2,4-дифторфенил)-6,8-дифтор-1,4-дигидро-4оксо-5-винил-3-хинолинкарбоновую кислоту. Выход: 96% теории Температура плавления: 215-216°С (разложение) Пример 23 Аналогично примеру 5 с применением 1трет.бутил-6,7-дифтор-1,4-дигидро-4-оксо-3хинолинкарбоновой кислоты получают 7-(3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1трет.бутил-6-фтор-1,4-дигидро-4-оксо-3хинолинкарбоновую кислоту. Выход: 69% теории Температура плавления: 228-230°С (разложение) Пример 20 Аналогично примеру 1 с применением рацемического 6,7-дифтор-1-(цис-2-фторциклопропил)1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты получают 7-(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-6-фтор-1-(цис-2-фторциклопропил)-1,4дигидро-4-оксо-3-хинолинкарбоновую кислоту. Выход: 55% теории Температура плавления: 238-239°С (разложение) Пример 24 Аналогично примеру 4 с применением 1циклопропил-6,7,8-трифтор-1,4-дигидро-4-оксо-5винил-3-хинолинкарбоновой кислоты получают 7(3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-1циклопропил-6-фтор-1,4-дигидро-4-оксо-5-винил3-хинолинкарбоновую кислоту. Выход: 75% теории Температура плавления: 227-228°С (разложение) Пример 21 Аналогично примеру 1 с применением рацемического 8-хлор-6,7-дифтор-1-(цис-2-фторциклопропил)-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты после очистки путем хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана с метанолом в соотношении 95:5 получают 7-(3а-амино-1,2,3,7а-тетрагидроизоиндол-2-ил)-8-хлор-6-фтор-1-(цис-2-фторцик 22 42797 1-[(1R,2S)-2-фторциклопропил]-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты Температура плавления: 206-207°С (разложение) [a]D=+2,5° (с=0,5, хлороформ), различные результаты при определении величины угла вращения, определение структуры путем рентгеновского анализа. 217 мг (0,5 ммоль) 7-[(3аS,7аR)3а-амино1,2,3,7а-тетрагидро-изоиндол-2-ил]-8-хлор-1[(1R,2S)-2-фторциклопропил]-6-фтор-1,4-дигидро4-оксо-3-хинолин-карбоновой кислоты растворяют в смеси 5 мл воды с 0,5 мл 1-н. соляной кислоты с последующей лиофилизацией раствора. Гидрохлорид 7-[(3aS,7aR)3a-амино-1,2,3,7а-тетрагидроизоиндол-2-ил]-8-хлор-1-[(1R,2S)-2-фторциклопропил]-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты выделяют в количественном выходе. Подобным приемом также получают мезилат и тозилат. Пример 27 лопропил)-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту. Выход: 55% теории Температура плавления: 196-198°С (разложение) Пример 25 410 мг (1 ммоль) хелатного соединения 1циклопропил-6,7-дифтор-1,4-дигидро-8-метил-4оксо-3-хинолинкарбоновой кислоты и В(O-СОСН3)2 в 8 мл ацетонитрила в атмосфере азота вместе с 224 мг (2 ммоль) 1,4-диазабицикло[2.2.2]октана и 272 мг (2 ммоль) 1,2,3,7атетрагидро-изоиндол-3а-иламина нагревают в течение 15 часов при температуре 60-70°C. Реакционную смесь сгущают в вакууме, а остаток перемешивают со смесью 4 мл ацетона с 0,5 мл концентрированной соляной кислоты и в течение 30 минут в ванне обрабатывают ультразвуковом. Сгущают, остаток подают в воду (рН 3), выпавшую 1-циклопропил-6,7-дифтор-1,4-дигидро-8-метил-4оксо-3-хинолинкарбоновую кислоту отсасывают (90 мг), а рН маточного раствора добавлением 5%-ного раствора бикарбоната натрия доводят до 7,5. Экстрагируют дихлорметаном, сушат над сульфатом магния и сгущают. Выход: 61 мг (15% теории) 7-(3а-амино1,2,3,7а-тетрагидро-изоиндол-2-ил)-1-циклопропил-6-фтор-1,4-дигидро-8-метил-4-оксо-3-хинолинкарбоновой кислоты Температура плавления: 201-203°С Пример 26 Аналогично примеру 26 с применением 8хлор-6,7-дифтор-1-[(1S,2R)-2-фторциклопропил]1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты получают 7-([3аS,7аR]3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-8-хлор-6-фтор-1-[(1S,2R)-2фторциклопропил]-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту. Выход: 71% теории Температура плавления: 170-174°С (разложение) [a]D=+215° (с=0,5, хлороформ). Пример 28 317 мг (1 ммоль) 8-хлор-6,7-дифтор-1-[(1R,2S)2-фторциклопропил]-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты в смеси 4 мл ацетонитрила с 2 мл диметилформамида вместе с 187 мг (1,67 ммоль) 1,4-диазабицикло[2.2.2]-октана и 165 мг (1,2 ммоль) (3aS,7aR)-1,2,3,7а-тетрагидроизоиндол-3а-ил-амина нагревают с обратным холодильником в течение 1 часа. Реакционную смесь в течение ночи храняют в холодильнике. Выпавший осадок отсасывают, промывают 30 мл воды и сушат. Выход: 290 мг (67% теории) 7-([3аS,7аR])3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-8-хлор Аналогично примеру 26 с применением 8хлор-1-циклопропил-6,7-дифтор-1,4-дигидро-4оксо-3-хинолинкарбоновой кислоты получают 7([3аS,7аR]3а-амино-1,2,3,7а-тетрагидро-изоиндол2-ил)-8-хлор-1-циклопропил-6-фтор-1,4-дигидро-4оксо-3-хинолинкарбоновую кислоту. Выход: 86% теории Температура плавления: 169-170°С (разложение) [a]D=+116° (с=0,4, хлороформ) 23 42797 Пример 29 Аналогично примеру 29 с применением 8хлор-6,7-дифтор-1-[(1S,2R)-2-фторциклопропил]1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты получают 7-([3аR,7аS]3а-амино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-8-хлор-6-фтор-1-[(1S,2R)-2фторциклопропил]-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту. Выход: 71% теории Температура плавления: 195-197°С (разложение) [a]D=-6,4° (с=0,5, хлороформ), разные результаты при определении величины угла вращения Пример 31 317 мг (1 ммоль) 8-хлор-6,7-дифтор-1-[(1R,2S)2-фторциклопропил]-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты в смеси 4 мл ацетонитрила с 2 мл диметилформамида вместе с 187 мг (1,67 ммоль) 1,4-диазабицикло[2.2.2]-октана и 165 мг (1,2 ммоль) (3аR,7аS)-1,2,3,7а-тетрагидроизоиндол-3а-ил-амина нагревают с обратным холодильником в течение 1 часа. Реакционную смесь в течение ночи храняют в холодильнике. Выпавший осадок отсасывают, промывают 30 мл воды и сушат. Выход: 235 мг (54% теории) 7-([3аR,7аS])3аамино-1,2,3,7а-тетрагидро-изоиндол-2-ил)-8-хлор1-[(1R,2S)-2-фторциклопропил]-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты Температура плавления: 182-183°С (разложение) [a]D=-245° (с=0,5, хлороформ) Пример 30 Аналогично примеру 29 с применением 8хлор-6,7-дифтор-1-циклопропил-1,4-дигидро-4оксо-3-хинолинкарбоновой кислоты получают 7([3аR,7аS]3а-амино-1,2,3,7а-тетрагидро-изоиндол2-ил)-8-хлор-6-фтор-1-циклопропил-1,4-дигидро-4оксо-3-хинолинкарбоновую кислоту. Выход: 90% теории Температура плавления: 169-170°С (разложение) [a]D=-119° (с=0,4, хлороформ) __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 24
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinolone- and naphthyridonecarboxylic acid derivatives and isoindole derivatives for preparation thereof
Автори англійськоюPetersen Uwe, Schenke Thomas, Bremm Klaus-Dieter, Endermann Rainer
Назва патенту російськоюПроизводные хинолон- и нафтиридонкарбоновой кислоты и производные изоиндола для их получения
Автори російськоюПетерсен Уве, Шенке Томас, Бремм Клаус-Дитер, Эндерманн Райнер
МПК / Мітки
МПК: C07D 209/44, A61P 31/04, C07D 513/04, A61K 31/47, A61K 31/535, C07D 401/04, C07D 513/14, A61K 31/435, C07D 471/04, C07D 498/06
Мітки: похідні, хінолон, кислоти, ізоіндолу, нафтиридонкарбонової, одержання
Код посилання
<a href="https://ua.patents.su/24-42797-pokhidni-khinolon-i-naftiridonkarbonovo-kisloti-ta-pokhidni-izoindolu-dlya-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні хінолон- і нафтиридонкарбонової кислоти та похідні ізоіндолу для їх одержання</a>
Попередній патент: Спосіб виготовлення щіткових виробів з розташованою пучками щетиною та пристрій для його здійснення
Випадковий патент: Спосіб одержання гранул