Спосіб одержання флуоксастробіну
Номер патенту: 115093
Опубліковано: 11.09.2017
Автори: Прасад Вік, Маддані Махагундаппа Рачаппа, Павар Дживан Дхенрадж, Хіндупур Рама Мохан, Вадхва Сендіп, Балакрішнан Санкар, Мане Авінаш Шешрао
Формула / Реферат
1. Спосіб одержання флуоксастробіну, який включає:
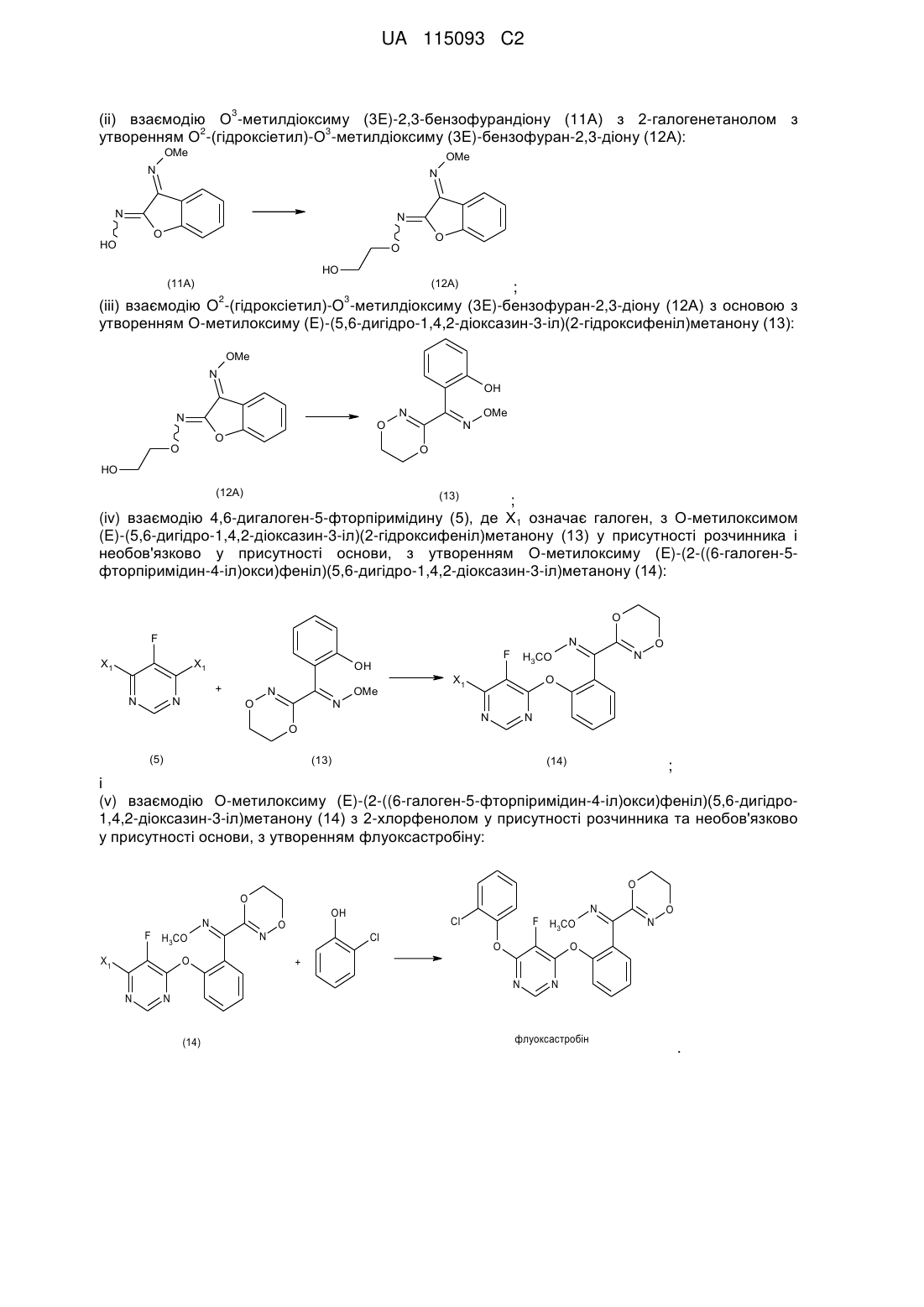
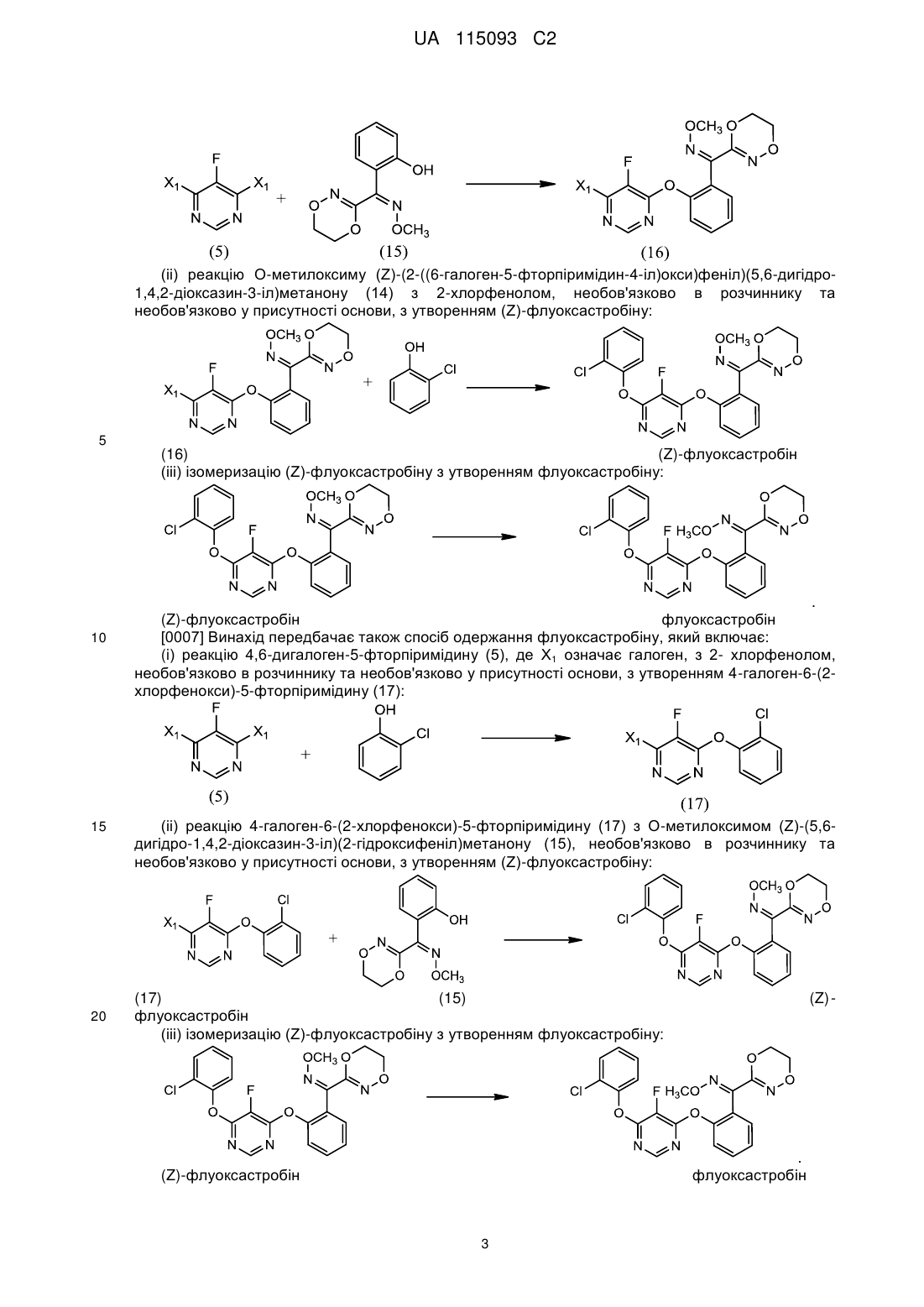
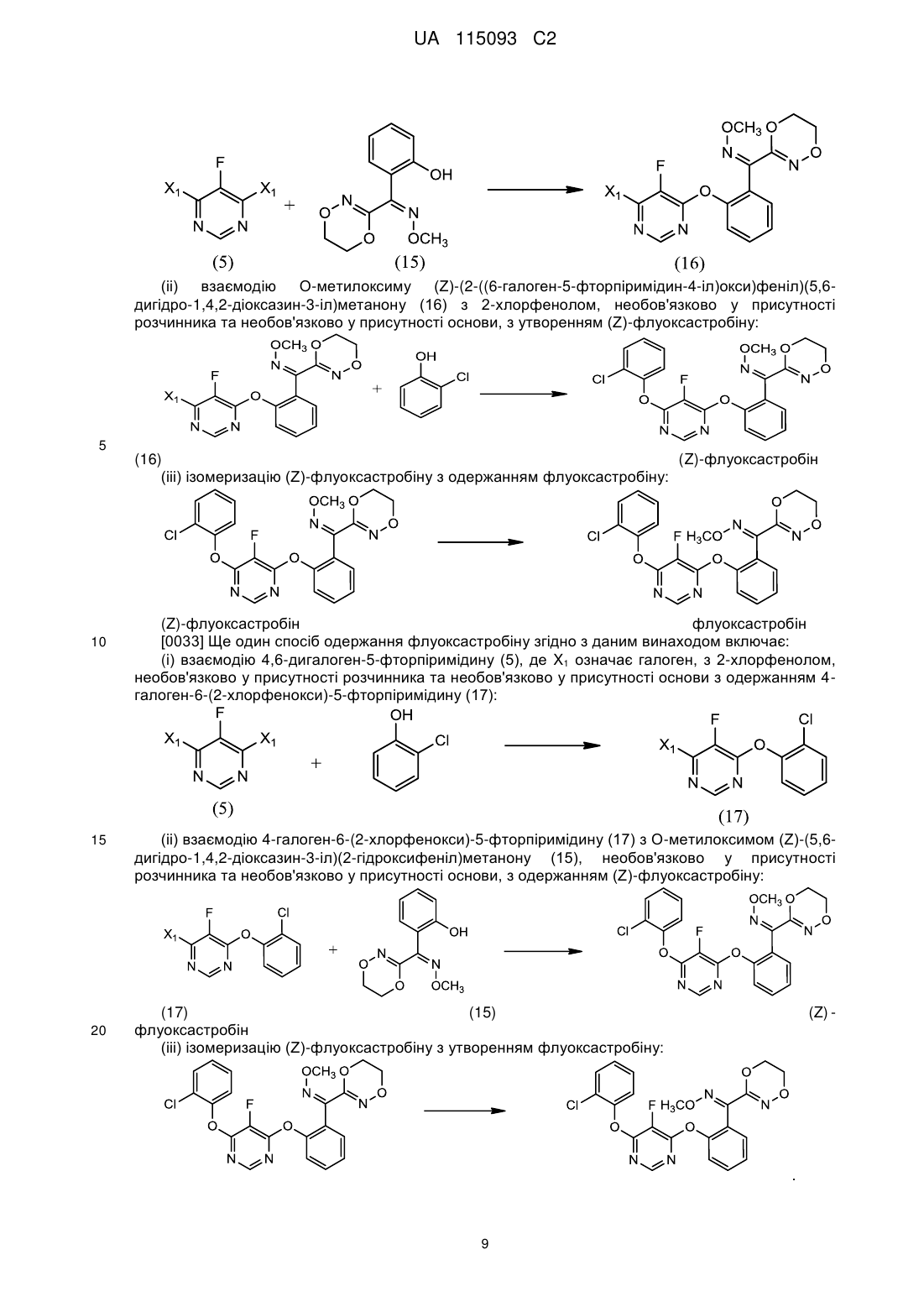
(і) взаємодію 4,6-дигалоген-5-фторпіримідину (5), де Х1 являє собою галоген, з О-метилоксимом (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15), необов'язково у присутності розчинника та необов'язково у присутності основи, з утворенням О-метилоксиму (Z)-(2-((6-галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (16):
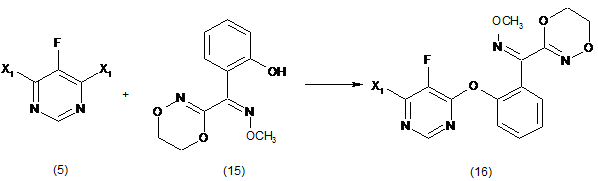 ;
;
(іі) взаємодію О-метилоксиму (Z)-(2-((6-галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (16) з 2-хлорфенолом, необов'язково у присутності розчинника та необов'язково у присутності основи, з утворенням (Z)-флуоксастробіну:
 ;
;
(ііі) ізомеризацію (Z)-флуоксастробіну з утворенням флуоксастробіну:
 .
.
2. Спосіб за п. 1, де ізомеризацію (Z)-флуоксастробіну з утворенням флуоксастробіну здійснюють у присутності розчинника та необов'язково у присутності кислого каталізатора.
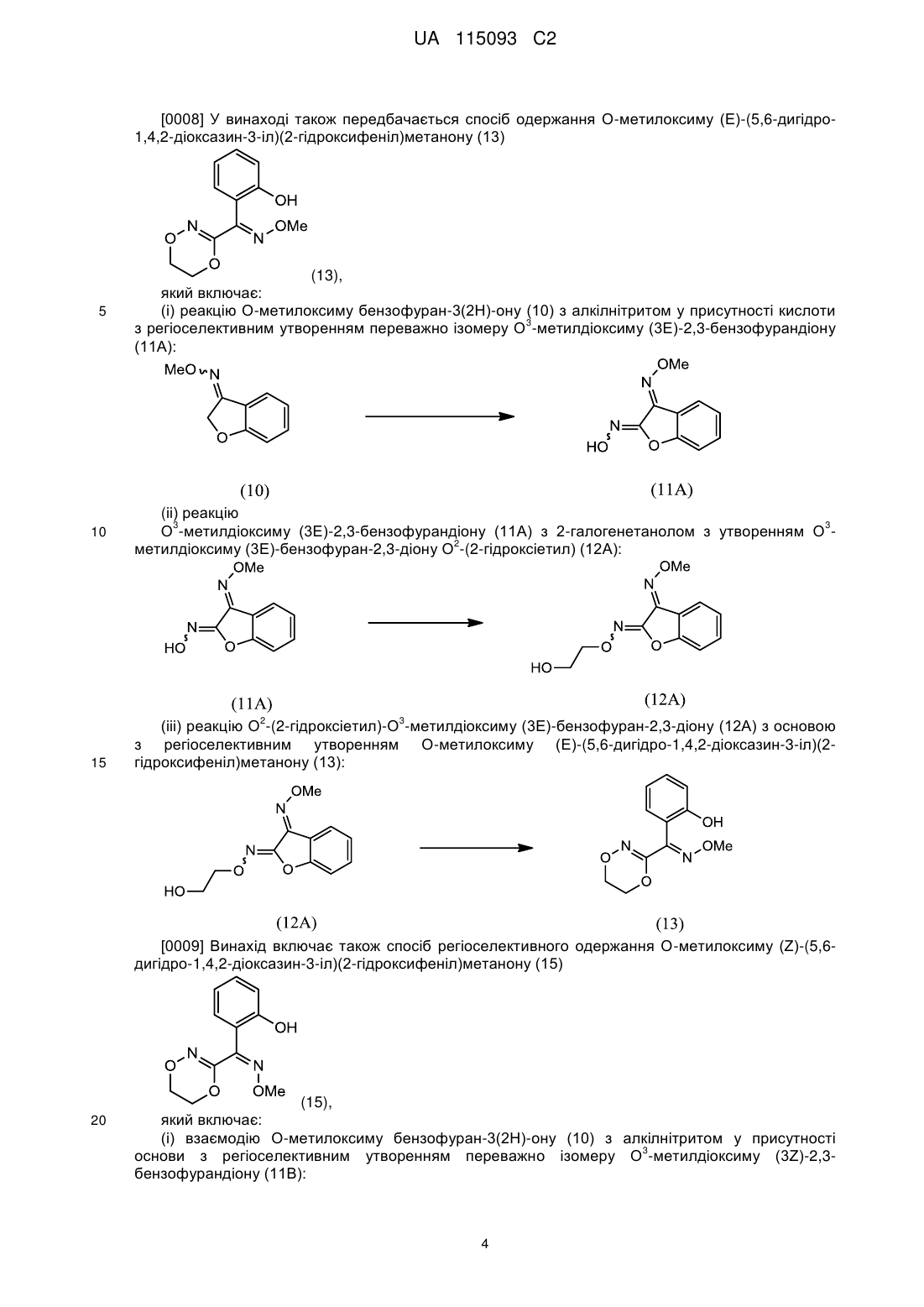
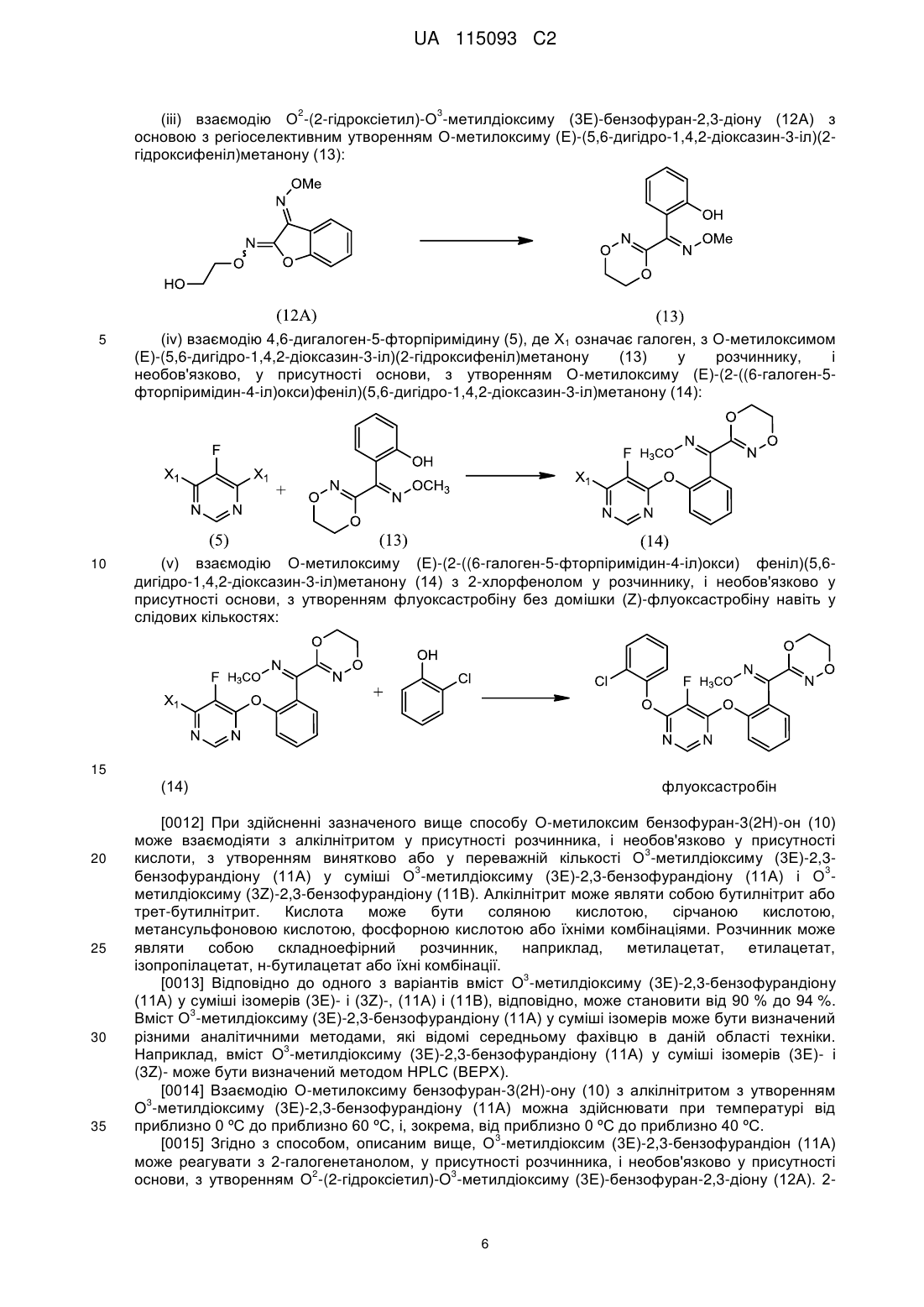
3. Спосіб за п. 1, де О-метилоксим (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15) отриманий шляхом:
(і) взаємодії О-метилоксиму бензофуран-3(2H)-ону (10) з алкілнітритом у присутності основи з утворенням О3-метилдіоксиму (3Z)-2,3-бензофурандіону (11В) як переважного ізомеру:
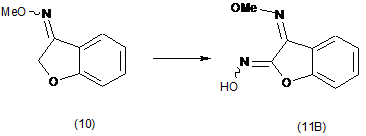 ;
;
(іі) взаємодії О3-метилдіоксиму (3Z)-2,3-бензофурандіону (11В) з 2-галогенетанолом з утворенням О2-(2-гідроксіетил)-О3-метилдіоксиму (3Z)-бензофуран-2,3-діону (12В):
 ;
;
і
(ііі) взаємодії О2-(2-гідроксіетил)-О3-метилдіоксиму (3Z)-бензофуран-2,3-діону (12В) з основою з утворенням О-метилоксиму (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15):
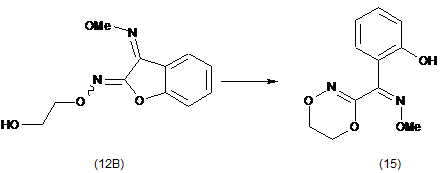 .
.
4. Спосіб за п. 3, де алкілнітрит являє собою н-бутилнітрит або трет-бутилнітрит.
5. Спосіб за п. 3, де основа, яку застосовують при взаємодії О-метилоксиму бензофуран-3(2H)-ону (10) з алкілнітритом, являє собою гідроксид металу, гідрид металу й алкоксид металу.
6. Спосіб за п. 3, де вміст О3-метилдіоксиму (3Z)-2,3-бензофурандіону (11В) у суміші (3Е)- і (3Z)-ізомерів становить від 94 до 98 %.
Текст
Реферат: Спосіб одержання флуоксастробіну, який включає: (і) взаємодію О-метилоксиму бензофуран-3(2H)-ону (10) з алкілнітритом у присутності кислоти з 3 утворенням О -метилдіоксиму (3E)-2,3-бензофурандіону (11А) як переважного ізомеру: OMe MeO N N N O HO (10) O (11A) ; UA 115093 C2 (12) UA 115093 C2 3 (іі) взаємодію О -метилдіоксиму (3E)-2,3-бензофурандіону (11А) з 2-галогенетанолом з 2 3 утворенням О -(гідроксіетил)-О -метилдіоксиму (3E)-бензофуран-2,3-діону (12А): OMe OMe N N N N O HO O O HO (11A) (12A) ; (ііі) взаємодію O -(гідроксіетил)-O -метилдіоксиму (3E)-бензофуран-2,3-діону (12А) з основою з утворенням О-метилоксиму (E)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13): 2 3 OMe N OH N O O O N N OMe O HO (12A) (13) ; (iv) взаємодію 4,6-дигалоген-5-фторпіримідину (5), де Х1 означає галоген, з О-метилоксимом (E)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13) у присутності розчинника і необов'язково у присутності основи, з утворенням О-метилоксиму (E)-(2-((6-галоген-5фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (14): O F X1 X1 + N N N O N OMe O N H3CO O X1 N O (5) N F OH N (13) (14) ; і (v) взаємодію О-метилоксиму (E)-(2-((6-галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро1,4,2-діоксазин-3-іл)метанону (14) з 2-хлорфенолом у присутності розчинника та необов'язково у присутності основи, з утворенням флуоксастробіну: O O F H3CO O X1 N N OH O Cl Cl F H3CO N O O O + N N N N N (14) флуоксастробін . UA 115093 C2 Область техніки [0001] Даний винахід передбачає новий спосіб одержання флуоксастробіну 5 10 15 20 25 (флуоксастробін) Рівень техніки [0002] Флуоксастробін являє собою сполуку типу стробілурину з фунгіцидною активністю для контролю грибкових захворювань, таких як альтернаріоз, фітофтороз, плямистість листів, листова іржа та ризоктоніоз (Rhizoctonia solani). Флуоксастробін зареєстрований як засіб для позакореневого обприскування арахісу, бульбових і цибулинних рослин, рослин із черешковими листами, плодоносних рослин і дерну, а також для протравлення насінної картоплі, насіння арахісу та насіння дернових трав. Застосування, пов'язане з обробкою дерну (ґрунту), повинні здійснювати професіонали-фахівці по боротьбі з сільськогосподарськими шкідниками. [0003] Фірма Bayer пропонує декілька способів синтезу флуоксастробіну, але всі вони включають послідовну реакцію 4,6-дихлор-5-фторпіримідину (5) з 2-хлорфенолом і Ометилоксимом (Е)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл) метанону (13), описану в патенті США № 6,734,304. флуоксастробін [0004] Необхідність у нових ефективних, масштабованих та економічних методах синтезу флуоксастробіну залишається дотепер. Сутність винаходу [0005] У даному винаході передбачається спосіб одержання флуоксастробіну з використанням (i) взаємодії О-метилоксиму бензофуран-3(2Н)-ону (10) з алкілнітритом у присутності 3 кислоти з регіоселективним утворенням переважно ізомеру О -метилдіоксиму (3Е)-2,3бензофурандіону (11А): 1 UA 115093 C2 3 (ii) взаємодії О -метилдіоксиму (3Е)-2,3-бензофурандіону (11А) з 2- галогенетанолом з 2 3 утворенням О -(2-гідроксіетил)-О -метилдіоксиму (3Е)-бензофуран-2,3-діону (12А): 2 5 10 15 20 3 (iii) реакції О -(2-гідроксіетил)-О -метилдіоксиму (3Е)-бензофуран-2,3-діону (12А) з основою з регіоселективним утворенням О-метилоксиму (Е)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2гідроксифеніл)метанону (13): (iv) реакції 4,6-дигалоген-5-фторпіримідину (5), де Х1 означає галоген, з О-метилоксимом (Е)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13) у розчиннику, і даний винахід необов'язково, у присутності основи, з утворенням О-метилоксиму (Е)-(2-((6-галоген-5фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (14): (v) реакції О-метилоксиму (Е)-(2-((6-галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро1,4,2-діоксазин-3-іл)метанону (14) з 2-хлорфенолом у розчиннику, і необов'язково у присутності основи, з утворенням флуоксастробіну без домішки (Z)-флуоксастробіну навіть у слідових кількостях: (14) флуоксастробін [0006] Даний винахід передбачає також спосіб одержання флуоксастробіну, який включає: (i) реакцію 4,6-дигалоген-5-фторпіримідину (5), де Х1 означає галоген, з О-метилоксимом (Z)(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15), необов'язково в середовищі розчинника та необов'язково у присутності основи, з утворенням О-метилоксиму (Z)-(2-((6галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл) метанону (16): 2 UA 115093 C2 (ii) реакцію О-метилоксиму (Z)-(2-((6-галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро1,4,2-діоксазин-3-іл)метанону (14) з 2-хлорфенолом, необов'язково в розчиннику та необов'язково у присутності основи, з утворенням (Z)-флуоксастробіну: 5 (16) (Z)-флуоксастробін (iii) ізомеризацію (Z)-флуоксастробіну з утворенням флуоксастробіну: 10 15 20 . (Z)-флуоксастробін флуоксастробін [0007] Винахід передбачає також спосіб одержання флуоксастробіну, який включає: (i) реакцію 4,6-дигалоген-5-фторпіримідину (5), де Х1 означає галоген, з 2- хлорфенолом, необов'язково в розчиннику та необов'язково у присутності основи, з утворенням 4-галоген-6-(2хлорфенокси)-5-фторпіримідину (17): (ii) реакцію 4-галоген-6-(2-хлорфенокси)-5-фторпіримідину (17) з О-метилоксимом (Z)-(5,6дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15), необов'язково в розчиннику та необов'язково у присутності основи, з утворенням (Z)-флуоксастробіну: (17) (15) флуоксастробін (iii) ізомеризацію (Z)-флуоксастробіну з утворенням флуоксастробіну: (Z) . флуоксастробін (Z)-флуоксастробін 3 UA 115093 C2 [0008] У винаході також передбачається спосіб одержання О-метилоксиму (Е)-(5,6-дигідро1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13) 5 (13), який включає: (i) реакцію О-метилоксиму бензофуран-3(2Н)-ону (10) з алкілнітритом у присутності кислоти 3 з регіоселективним утворенням переважно ізомеру О -метилдіоксиму (3Е)-2,3-бензофурандіону (11А): 10 (ii) реакцію 3 3 О -метилдіоксиму (3Е)-2,3-бензофурандіону (11А) з 2-галогенетанолом з утворенням О 2 метилдіоксиму (3Е)-бензофуран-2,3-діону О -(2-гідроксіетил) (12А): 2 15 3 (iii) реакцію О -(2-гідроксіетил)-О -метилдіоксиму (3Е)-бензофуран-2,3-діону (12А) з основою з регіоселективним утворенням О-метилоксиму (Е)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2гідроксифеніл)метанону (13): [0009] Винахід включає також спосіб регіоселективного одержання О-метилоксиму (Z)-(5,6дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15) 20 (15), який включає: (i) взаємодію О-метилоксиму бензофуран-3(2Н)-ону (10) з алкілнітритом у присутності 3 основи з регіоселективним утворенням переважно ізомеру О -метилдіоксиму (3Z)-2,3бензофурандіону (11В): 4 UA 115093 C2 3 (ii) взаємодію О -метилдіоксиму (3Z)-2,3-бензофурандіону (11В) з 2- галогенетанолом з 2 3 утворенням О -(2-гідроксіетил)-О -метилдіоксиму (3Z)-бензофуран-2,3-діону (12В); 5 10 15 20 і 2 3 (iii) реакцію О -(2-гідроксіетил)-О -метилдіоксиму (3Z)-бензофуран-2,3-діону (12В) з регіоселективним утворенням О-метилоксиму (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2гідроксифеніл)метанону (15): . Докладний опис винаходу [0010] Нижче слідує докладний опис винаходу, проілюстрований прикладеними малюнками. Однак цей винахід може бути втілений в множині різних форм і не обмежується представленими варіантами. Скоріше ці варіанти надаються для того, щоб це розкриття було докладним і вичерпним, і повністю описувало об'єм винаходу фахівцям у даній області техніки. У всьому описі однакові цифри (номера позицій) відносяться до однакових сполук. [0011] Спосіб одержання флуоксастробіну, який включає: (i) взаємодію О-метилоксиму бензофуран-3(2Н)-ону (10) з алкілнітритом у присутності 3 кислоти з регіоселективним утворенням переважно ізомеру О -метилдіоксиму (3Е)-2,3бензофурандіону (11А); 3 (ii) взаємодію О -метилдіоксиму (3Е)-2,3-бензофурандіону (11А) з 2- галогенетанолом з 2 3 утворенням О -(2-гідроксіетил)-О -метилдіоксиму (3Е)-бензофуран-2,3-діону (12А); 5 UA 115093 C2 2 3 (iii) взаємодію О -(2-гідроксіетил)-О -метилдіоксиму (3Е)-бензофуран-2,3-діону (12А) з основою з регіоселективним утворенням О-метилоксиму (Е)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2гідроксифеніл)метанону (13): 5 (iv) взаємодію 4,6-дигалоген-5-фторпіримідину (5), де Х1 означає галоген, з О-метилоксимом (Е)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13) у розчиннику, і необов'язково, у присутності основи, з утворенням О-метилоксиму (Е)-(2-((6-галоген-5фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (14): 10 (v) взаємодію О-метилоксиму (Е)-(2-((6-галоген-5-фторпіримідин-4-іл)окси) феніл)(5,6дигідро-1,4,2-діоксазин-3-іл)метанону (14) з 2-хлорфенолом у розчиннику, і необов'язково у присутності основи, з утворенням флуоксастробіну без домішки (Z)-флуоксастробіну навіть у слідових кількостях: 15 (14) 20 25 30 35 флуоксастробін [0012] При здійсненні зазначеного вище способу O-метилоксим бензофуран-3(2H)-он (10) може взаємодіяти з алкілнітритом у присутності розчинника, і необов'язково у присутності 3 кислоти, з утворенням винятково або у переважній кількості O -метилдіоксиму (3E)-2,33 3 бензофурандіону (11A) у суміші O -метилдіоксиму (3E)-2,3-бензофурандіону (11A) і O метилдіоксиму (3Z)-2,3-бензофурандіону (11B). Алкілнітрит може являти собою бутилнітрит або трет-бутилнітрит. Кислота може бути соляною кислотою, сірчаною кислотою, метансульфоновою кислотою, фосфорною кислотою або їхніми комбінаціями. Розчинник може являти собою складноефірний розчинник, наприклад, метилацетат, етилацетат, ізопропілацетат, н-бутилацетат або їхні комбінації. 3 [0013] Відповідно до одного з варіантів вміст O -метилдіоксиму (3E)-2,3-бензофурандіону (11A) у суміші ізомерів (3E)- і (3Z)-, (11A) і (11B), відповідно, може становити від 90 % до 94 %. 3 Вміст O -метилдіоксиму (3E)-2,3-бензофурандіону (11A) у суміші ізомерів може бути визначений різними аналітичними методами, які відомі середньому фахівцю в даній області техніки. 3 Наприклад, вміст O -метилдіоксиму (3E)-2,3-бензофурандіону (11A) у суміші ізомерів (3E)- і (3Z)- може бути визначений методом HPLC (ВЕРХ). [0014] Взаємодію O-метилоксиму бензофуран-3(2H)-ону (10) з алкілнітритом з утворенням 3 O -метилдіоксиму (3E)-2,3-бензофурандіону (11A) можна здійснювати при температурі від приблизно 0 ºC до приблизно 60 ºC, і, зокрема, від приблизно 0 ºC до приблизно 40 ºC. 3 [0015] Згідно з способом, описаним вище, O -метилдіоксим (3E)-2,3-бензофурандіон (11A) може реагувати з 2-галогенетанолом, у присутності розчинника, і необов'язково у присутності 2 3 основи, з утворенням O -(2-гідроксіетил)-O -метилдіоксиму (3E)-бензофуран-2,3-діону (12A). 2 6 UA 115093 C2 5 10 15 20 25 30 35 40 45 50 55 60 галогенетанол може являти собою 2-хлоретанол або 2-брометанол. Застосовувана основа може бути гідроксидом металу, таким як гідроксид літію, гідроксид натрію, гідроксид калію, або їхніми комбінаціями. Використовуваний розчинник може являти собою кетонний розчинник, нітрильний розчинник, амідний розчинник, сульфоксидний розчинник, сульфонний розчинник, воду або комбінацію зазначених розчинників. Необмежуючі приклади кетонних розчинників включають ацетон, метилетилкетон і метилізобутилкетон. Необмежуючий приклад нітрильних розчинників включає ацетонітрил. Необмежуючі приклади амідного розчинника включають N, Nдиметилформамід ("DMF"), N, N-диметилацетамід ("DME"), N-метилформамід, Nметилпіролідон ("NMP") і гексаметилфосфортриамід ("HMPA"). Необмежуючий приклад сульфоксидного розчинника включає диметилсульфоксид ("DMSO"). Необмежуючий приклад сульфонного розчинника включає сульфолан. 3 [0016] Взаємодію O -метилдіоксиму (3E)-2,3-бензофурандіону (11A) з 2-галогенетанолом з 2 3 утворенням O -(2-гідроксіетил)-O -метилдіоксиму (3E)-бензофуран-2,3-діону (12A) можна здійснювати при температурі від приблизно 20 ºC до приблизно 100 ºC, і зокрема, від приблизно 70 ºC до приблизно 85 ºC. 2 3 [0017] Згідно з способом, описаним вище, O -(2-гідроксіетил)-O -метилдіоксим (3E)бензофуран-2,3-діону (12A) може бути оброблений основою з одержанням O-метилоксиму (E)(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13). Основа може являти собою гідроксид металу, такий як гідроксид літію, гідроксид натрію, гідроксид калію або їх комбінації. 2 3 [0018] Взаємодію O -(2-гідроксіетил)-O -метилдіоксиму (3E)-бензофуран-2,3-діону (12A) з утворенням O-метилоксиму (E)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13) можна здійснювати при температурі від приблизно 20 ºC до приблизно 100 ºC, і зокрема, від приблизно 65 ºC до приблизно 75 ºC. [0019] Згідно з способом, описаним вище, X1 може означати фтор, хлор, бром і йод. Зокрема, X1 може бути хлором. [0020] Стадію взаємодії O-метилоксиму (E)-(2-((6-галоген-5-фторпіримідин-4іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (14) з 2-хлорфенолом можна проводити у присутності третинного аміну, зокрема, 1,4-діазабіцикло[2.2.2]октану ("DABCO"), 1,5діазабіцикло[4.3.0]нон-5-ену ("DBN") або 1,8-діазабіцикло[5.4.0]ундец-7-ену ("DBU"), і, переважно, 1,4-діазабіцикло[2.2.2]октану ("DABCO"). [0021] Відповідно до одного з варіантів кількість 1,4-діазабіцикло[2.2.2]октану може бути рівною від приблизно 0.02 до приблизно 0.4 молей на моль O-метилоксиму (E)-(2-((6-галоген-5фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл) метанону (14). [0022] Відповідно до іншого варіанта кількість 1,4-діазабіцикло[2.2.2]октану може становити від приблизно 0.02 до приблизно 0.2 молей на моль O-метилоксиму (E)-(2-((6-галоген-5фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (14). [0023] Стадії (ii), (iii), (iv) і (v) при здійсненні способу одержання флуоксастробіну можна проводити в одній реакційній посудині, тобто, без виділення й очищення інтермедіатів (12A), (13) і (14). [0024] На стадії взаємодії 4,6-дигалоген-5-фторпіримідину (5), де X1 означає галоген, з Oметилоксимом (E)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл) метанону (13) кількість 4,6дигалоген-5-фторпіримідину (5) може становити від приблизно 1 до приблизно 4 молей на один моль O-метилоксиму (E)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13). [0025] На стадії взаємодії O-метилоксиму (E)-(2-((6-галоген-5-фторпіримідин-4іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (14) з 2-хлорфенолом кількість 2хлорфенолу може бути рівною від приблизно 0.8 до приблизно 4 молей на один моль Oметилоксиму (E)-(2-((6-галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3іл)метанону (14). [0026] Стадії (iv) і (v) способу одержання флуоксастробіну можна здійснювати у присутності розчинника. Відповідно до одного з варіантів розчинник може включати вуглеводневий розчинник, галогеновмісний вуглеводневий розчинник, простий ефір, кетонний розчинник, нітрильний розчинник, амідний розчинник, складноефірний розчинник, сульфоксидний розчинник, сульфонний розчинник, воду або їхню комбінацію. Вуглеводневий розчинник може включати аліфатичний розчинник, аліциклічний розчинник, ароматичний розчинник або їхню комбінацію. Необмежуючі приклади вуглеводневого розчинника включають петролейний ефір, пентан, гексан, гептан, циклогексан, метилциклогексан, бензол, толуол, 1,2-ксилол, 1,3-ксилол, 1,4-ксилол, етилбензол і кумол. Необмежуючі приклади галогеновмісного вуглеводневого розчинника включають хлорбензол, дихлорбензол, дихлорметан, хлороформ, чотирихлористий вуглець, 1,1-дихлоретан, 1,2- дихлоретан, 1,1,1-трихлоретан і 1,1,2-трихлоретан. Необмежуючі приклади простих ефірів включають діетиловий ефір, діізопропіловий ефір, метилтрет 7 UA 115093 C2 5 10 15 20 25 30 35 40 45 50 55 бутиловий ефір, метилтрет-аміловий ефір, 1,4-діоксан, тетрагідрофуран ("THF"), 2метилтетрагідрофуран, 1,2-диметоксіетан ("DME") і анізол. Необмежуючі приклади кетонних розчинників включають ацетон, 2-бутанон, метилізобутилкетон, циклопентанон і циклогексанон. Відповідно до одного з варіантів кетонний розчинник може включати метилізобутилкетон. Необмежуючі приклади нітрильного розчинника включають ацетонітрил ("ACN"), пропіонітрил, н-бутиронітрил, ізобутиронітрил і бензонітрил. Необмежуючі приклади амідних розчинників включають N, N-диметилформамід ("DMF"), N, N-диметилацетамід ("DMA"), N-метилформамід, N-метилпіролідон ("NMP") і гексаметилфосфортриамід ("HMPA"). Необмежуючі приклади складноефірних розчинників включають метилацетат й етилацетат. Необмежуючим прикладом сульфоксидного розчинника є диметилсульфоксид ("DMSO"). Необмежуючим прикладом сульфонного розчинника є сульфолан. [0027] Відповідно до одного з варіантів розчинник може являти собою суміш вуглеводневого розчинника й амідного розчинника. [0028] Наприклад, розчинник може бути сумішшю ароматичного вуглеводню й амідного розчинника. Необмежуючими прикладами ароматичного вуглеводневого розчинника в цій суміші можуть бути бензол, толуол, 1,2-ксилол, 1,3-ксилол, 1,4-ксилол, етилбензол і кумол. Необмежуючі приклади амідних розчинників включають N, N-диметилформамід ("DMF"), N, Nдиметилацетамід ("DMA"), N-метилформамід, N-метилпіролідон ("NMP") і гексаметилфосфортриамід ("HMPA"). Зокрема, розчинник може являти собою суміш ароматичного вуглеводневого розчинника, такого як будь-який ксилол або толуол, і амідного розчинника, що може являти собою, наприклад, N, N-диметилформамід ("DMF"), N, Nдиметилацетамід ("DMA"), N-метилформамід, N-метилпіролідон ("NMP") і гексаметилфосфортриамід ("HMPA"). Частіше розчинник може являти собою суміш ароматичного вуглеводневого розчинника, такого як будь-який ксилол, і амідного розчинника, наприклад, N, N-диметилформаміду ("DMF"), N, N-диметилацетаміду ("DMA"), Nметилформаміду, N-метилпіролідону ("NMP") і гексаметилфосфортриаміду ("HMPA"). Ще частіше розчинник може являти собою суміш ароматичного вуглеводневого розчинника, такого як толуол, і амідного розчинника, такого як N, N-диметилформамід ("DMF"), N, Nдиметилацетамід ("DMA"), N-метилформамід, N-метилпіролідон ("NMP") і гексаметилфосфортриамід ("HMPA"). [0029] Крім того, стадії (iv) і (v) цього способу одержання флуоксастробіну можна здійснювати у присутності основи. Відповідно до одного з варіантів основа може включати неорганічну основу, органічну основу або їхні комбінації. Неорганічна основа може включати гідроксид, гідрид, ацетат, карбонат, бікарбонат або їхні комбінації. Необмежуючі приклади неорганічних основ включають гідроксид натрію, гідроксид калію, гідрид натрію, гідрид калію, гідрид кальцію, ацетат натрію, ацетат калію, карбонат натрію, карбонат калію, карбонат рубідію, карбонат цезію, бікарбонат натрію та бікарбонат калію. Необмежуючі приклади органічних основ включають триметиламін, триетиламін, трибутиламін, N, N-диметиламін, N, N-діізопропілетиламін, N, N-диметилбензиламін, піридин, 2-метилпіридин (2-піколін), 2,6диметилпіридин (2,6-лутидин), N-метилпіперидин, N-метилморфолін ("NMM"), N, Nдиметиламінопіридин ("DMAP"), 1,5-діазабіцикло[4.3.0]нон-5-ен ("DBN") і 1,8діазабіцикло[5.4.0]ундец-7-ен ("DBU"). [0030] При здійсненні способу одержання флуоксастробіну стадію взаємодії 4,6-дигалоген-5фторпіримідину (5), де X1 означає галоген, з O-метилоксимом (E)-(5,6-дигідро-1,4,2-діоксазин-3іл)(2-гідроксифеніл)метанону (13) можна здійснювати при температурі від приблизно 0 °C до приблизно 100 °C, і зокрема, від приблизно 40 °C до приблизно 80 °C. Час реакції може коливатися від приблизно 1 до приблизно 10 год., наприклад, від приблизно 1 до приблизно 6 год. [0031] Також при здійсненні способу одержання флуоксастробіну стадію взаємодії Oметилоксиму (E)-(2-((6-галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3іл)метанону (14) з 2-хлорфенолом можна здійснювати при температурі від приблизно 0 °C до приблизно 100 °C, і зокрема, від приблизно 40 °C до приблизно 90 °C та, переважно, від приблизно 50 °C до приблизно 80 °C. Час реакції може коливатися від приблизно 15 хв до приблизно 3 год., зокрема, від приблизно 30 хв до приблизно 1.5 год. [0032] Інший спосіб одержання флуоксастробіну, передбачений даним винаходом, включає: (i) взаємодію 4,6-дигалоген-5-фторпіримідину (5), де X1 означає галоген, з O-метилоксимом (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15), необов'язково у присутності розчинника та необов'язково у присутності основи, з утворенням O-метилоксиму (Z)-(2-((6галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (16): 8 UA 115093 C2 (ii) взаємодію O-метилоксиму (Z)-(2-((6-галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6дигідро-1,4,2-діоксазин-3-іл)метанону (16) з 2-хлорфенолом, необов'язково у присутності розчинника та необов'язково у присутності основи, з утворенням (Z)-флуоксастробіну: 5 (16) (Z)-флуоксастробін (iii) ізомеризацію (Z)-флуоксастробіну з одержанням флуоксастробіну: 10 15 20 (Z)-флуоксастробін флуоксастробін [0033] Ще один спосіб одержання флуоксастробіну згідно з даним винаходом включає: (i) взаємодію 4,6-дигалоген-5-фторпіримідину (5), де X1 означає галоген, з 2-хлорфенолом, необов'язково у присутності розчинника та необов'язково у присутності основи з одержанням 4галоген-6-(2-хлорфенокси)-5-фторпіримідину (17): (ii) взаємодію 4-галоген-6-(2-хлорфенокси)-5-фторпіримідину (17) з O-метилоксимом (Z)-(5,6дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15), необов'язково у присутності розчинника та необов'язково у присутності основи, з одержанням (Z)-флуоксастробіну: (17) (15) флуоксастробін (iii) ізомеризацію (Z)-флуоксастробіну з утворенням флуоксастробіну: (Z) . 9 UA 115093 C2 флуоксастробін (Z)-флуоксастробін 25 [0034] Стадію ізомеризації (Z)-флуоксастробіну з утворенням флуоксастробіну можна здійснювати у присутності розчинника та необов'язково у присутності кислого каталізатора. [0035] Кислий каталізатор для ізомеризації (Z)-флуоксастробіну з утворенням флуоксастробіну може являти собою органічну кислоту, неорганічну кислоту або їхню суміш. Необмежуючим прикладом органічної кислоти може бути метансульфонова кислота. Необмежуючим прикладом неорганічної кислоти можуть бути сірчана кислота та фосфорна кислота. Кількість кислого каталізатора може становити від приблизно 0.2 моль до приблизно 1.5 моль на один моль (Z)-флуоксастробіну. Конкретно, кількість кислого каталізатора може становити від приблизно 0.8 моль до приблизно 1.1 моль на один моль (Z)-флуоксастробіну. [0036] Розчинник, застосовуваний для ізомеризації (Z)-флуоксастробіну з одержанням флуоксастробіну, може являти собою нітрильний розчинник, амідний розчинник, сульфоксидний розчинник і складноефірний розчинник або їхню комбінацію. Необмежуючим прикладом нітрильного розчинника може бути ацетонітрил. Необмежуючим прикладом амідного розчинника може бути N, N-диметилформамід ("DMF"), N, N-диметилацетамід ("DME"), Nметилформамід, N-метилпіролідон ("NMP") і гексаметилфосфортриамід ("HMPA"). Необмежуючий приклад сульфоксидного розчинника включає диметилсульфоксид ("DMSO"). Необмежуючі приклади складноефірного розчинника включають метилацетат, етилацетат, ізопропілацетат і н-бутилацетат. [0037] O-метилоксим (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл) метанону (15), який використовується в описаному вище способі, може бути отриманий таким способом: (i) здійснюють взаємодію O-метилоксиму бензофуран-3(2H)-ону (10) з алкілнітритом у присутності основи з одержанням O3-метилдіоксиму (Z)-2,3-бензофурандіону (11B) як переважний ізомер: 30 (ii) здійснюють взаємодію O3-метилдіоксиму (Z)-2,3-бензофурандіону (11B) з 2галогенетанолом з одержанням O2-(2-гідроксіетил)-O3-метилдіоксиму (Z)-бензофуран-2,3-діону (12В): 5 10 15 20 2 3 і (iii) здійснюють взаємодію O -(2-гідроксіетил)-O -метилдіоксиму (Z)-бензофуран-2,3-діону (12B) з основою з одержанням O-метилоксиму (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2гідроксифеніл)метанону (15): . 35 10 UA 115093 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0038] При здійсненні описаного вище способу O-метилоксим бензофуран-3(2H)-он (10) може реагувати з алкілнітритом у присутності розчинника, і необов'язково у присутності основи, 3 з утворенням O -метилдіоксиму (Z)-2,3-бензофурандіону (11B), винятково або як переважний 3 3 ізомер, у суміші O -метилдіоксиму (E)-2,3-бензофурандіону (11A) і O -метилдіоксиму (Z)-2,3бензофурандіону (11B). Алкілнітрит може являти собою н-бутилнітрит або трет-бутилнітрит. Основа може бути гідроксидом металу, гідридом металу, алкоксидом металу або їхніми комбінаціями. Гідроксид металу може являти собою гідроксид літію, гідроксид натрію, гідроксид калію або їхні комбінації. Гідрид металу може бути гідридом натрію. Алкоксид металу може бути трет-бутоксидом калію. Розчинник може являти собою складноефірний розчинник, сульфоксидний розчинник або їхню комбінацію. Необмежуючими прикладами амідного розчинника можуть бути N, N-диметилформамід ("DMF"), N, N-диметилацетамід ("DME"), Nметилформамід, N-метилпіролідон ("NMP") і гексаметилфосфортриамід ("HMPA"). Необмежуючий приклад сульфоксидного розчинника включає диметилсульфоксид ("DMSO"). 3 [0039] Вміст O -метилдіоксиму (Z)-2,3-бензофурандіону (11B) у суміші ізомерів (3E)- і (3Z)-, 3 (11A) і (11B) відповідно, може становити від 95 % до 98 %. Вміст O -метилдіоксиму (Z)-2,3бензофурандіону (11B) у суміші ізомерів (3E)- і (3Z)- може бути визначений різними аналітичними методами, відомими середньому фахівцю в даній області техніки. Наприклад, 3 вміст O -метилдіоксиму (Z)-2,3- бензофурандіону (11B) у суміші ізомерів (3E)- і (3Z)- може бути визначений методом HPLC. [0040] Взаємодію O-метилоксиму бензофуран-3(2H)-ону (10) з алкілнітритом з утворенням 3 O -метилдіоксиму (Z)-2,3-бензофурандіону (11B) можна здійснювати при температурі від приблизно 5 ºC до приблизно 60 ºC, зокрема, від приблизно 20 ºC до приблизно 40 ºC. 3 [0041] При здійсненні описаного вище способу O -метилдіоксим (Z)-2,3-бензофурандіон (11B) може реагувати з 2-галогенетанолом у присутності розчинника, і необов'язково у 2 3 присутності основи, з утворенням O -(2-гідроксіетил)-O -метилдіоксиму (Z)-бензофуран-2,3діону (12B). 2-галогенетанол може являти собою 2-хлоретанол або 2-брометанол. Основа може являти собою гідроксид металу, такий як гідроксид літію, гідроксид натрію, гідроксид калію або їхні комбінації. Розчинник може являти собою кетонний розчинник, нітрильний розчинник, амідний розчинник, сульфоксидний розчинник, сульфонний розчинник, воду або комбінацію зазначених розчинників. Необмежуючі приклади кетонних розчинників включають ацетон, метилетилкетон і метилізобутилкетон. Необмежуючий приклад нітрильних розчинників включає ацетонітрил. Необмежуючі приклади амідного розчинника включають N, N-диметилформамід ("DMF"), N, N-диметилацетамід ("DME"), N-метилформамід, N-метилпіролідон ("NMP") і гексаметилфосфортриамід ("HMPA"). Необмежуючий приклад сульфоксидного розчинника включає диметилсульфоксид ("DMSO"). Необмежуючий приклад сульфонного розчинника включає сульфолан. 3 [0042] Взаємодію O -метилдіоксим (Z)-2,3-бензофурандіону (11B) з 2-галогенетанолом з 2 3 утворенням O -(2-гідроксіетил)-O -метилдіоксиму (Z)-бензофуран-2,3-діону (12B) можна проводити при температурі від приблизно 20 ºC до приблизно 100 ºC, і зокрема, від приблизно 70 ºC до приблизно 85 ºC. 2 3 [0043] При здійсненні описаного вище способу O -(2-гідроксіетил)-O -метилдіоксим (Z)бензофуран-2,3-діону (12B) може бути оброблений основою з одержанням O-метилоксиму (Z)(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15). Основа може являти собою гідроксид металу, такий як гідроксид літію, гідроксид натрію, гідроксид калію або їхні комбінації. 2 3 [0044] Взаємодію O -(2-гідроксіетил)-O -метилдіоксиму (Z)-бензофуран-2,3-діону (12B) з утворенням O-метилоксиму (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13) можна проводити при температурі від приблизно 20 ºC до приблизно 100 ºC, і зокрема, від приблизно 65 ºC до приблизно 75 ºC. [0045] Даний винахід далі ілюструється прикладами, які не слід розглядати як обмежувальні. ПРИКЛАДИ [0046] Приблизний підхід до одержання флуоксастробіну показаний на Схемі 1. Відповідно до Схеми 1 синтез починається з хлорування діетилмалонату (1) за допомогою підходящого хлоруючого агента, наприклад, сульфурилхлориду. Отриманий діетил-2-хлормалонат (2) перетворюють у діетил-2-фтормалонат (3), використовуючи підходящий фторуючий реагент, такий як комплекс фтористий водень-триетиламін. Наступна циклізація в середовищі формаміду призводить до одержання 5-фторпіримідин-4,6-діолу (4), що обробляють підходящим хлоруючим агентом, наприклад, оксихлоридом фосфору, з одержанням 4,6-дихлор5-фторпіримідину (5). Як далі зазначено на Схемі 2, 4,6-дихлор-5-фторпіримідин (5) взаємодіє з O-метилоксимом (E)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13) у підходящому розчиннику й у присутності основи з одержанням O-метилоксиму (E)-(2-((6 11 UA 115093 C2 5 10 15 20 галоген-5-фторпіримідин-4-іл)окси) феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (14), що далі реагує з 2-хлорфенолом з утворенням флуоксастробіну. Як описано вище, останні дві стадії синтезу можна здійснювати в одній реакційній посудині, тобто, без виділення інтермедіату, O-метилоксиму (E)-(2-((6-галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро1,4,2-діоксазин-3-іл)метанону (14). Схема 1 флуоксастробін (14) [0047] Синтез O-метилоксиму (E)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13) проілюстрований на Схемі 2A. Відповідно до цього способу здійснюють взаємодію метилсаліцилату з етилхлорацетатом у присутності карбонату калію з одержанням метил-2-(2етоксі-2-оксоетокси)бензоату (6). Гідроліз метил-2-(2-етоксі-2-оксоетокси)бензоату (6) з наступною послідовною циклізацією 2-(карбоксиметокси)бензойної кислоти (7) за допомогою оцтового ангідриду в присутності ацетату натрію призводить до одержання бензофуран-3ілацетату (8), що перетворюють у бензофуран-3(2H)-он (9) шляхом метанолізу. Обробка бензофуран-3(2H)-ону (9) O-метилгідроксиламіном й ацетатом натрію забезпечує одержання Oметилоксиму бензофуран-3(2H)-ону (10), що окисляють трет-бутилнітратом у середовищі соляної кислоти з одержанням O3-метилдіоксиму (3E)-бензофуран-2,3-діону (11A). У присутності гідроксиду калію відбувається розкриття етиленоксидної групи O3-метилдіоксиму (3E)-бензофуран-2,3-діону (11A) з одержанням O2-(2-гідроксіетил)-O3-метилдіоксиму (3E)бензофуран-2,3-діону (12A), який піддають циклізації, що каталізується гідроксидом калію з утворенням O-метилоксиму (E)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл) метанону (13). Схема 2A 12 UA 115093 C2 5 10 15 20 25 [0048] Інший спосіб синтезу O-метилоксиму (E)-(5,6-дигідро-1,4,2-діоксазин-3-іл) (2гідроксифеніл)метанону (13) проілюстрований на Схемі 2B. Відповідно до цього способу здійснюють взаємодію метилсаліцилату з етилхлорацетатом у присутності карбонату калію з одержанням метил-2-(2-етоксі-2-оксоетокси)бензоату (6). Гідроліз метил-2-(2-етоксі-2оксоетокси)бензоату (6) з наступною послідовною циклізацією 2-(карбоксиметокси) бензойної кислоти (7) за допомогою оцтового ангідриду в присутності ацетату натрію призводить до одержання бензофуран-3-ілацетату (8), що перетворюють у бензофуран-3(2H)-он (9) шляхом метанолізу. Обробка бензофуран-3(2H)-ону (9) O-метилгідроксиламіном й ацетатом натрію забезпечує одержання O-метилоксиму бензофуран-3(2H)-ону (10), що окисляють третбутилнітратом у середовищі соляної кислоти з одержанням виняткового або переважного O3метилдіоксиму (3E)-бензофуран-2,3-діону (11A). У присутності гідроксиду калію та 2галоїдетанолу O3-метилдіоксим (3E)-бензофуран-2,3-діону (11A) може утворити O2-(2гідроксіетил)-O3-метилдіоксим (3E)-бензофуран-2,3-діону (12A), який може піддаватися циклізації, що каталізується гідроксидом калію з утворенням O-метил-оксиму (E)-(5,6-дигідро1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13). Схема 2B [0049] Флуоксастробін може бути також отриманий, як показано на Схемі 3. Зокрема, 4,6дихлор-5-фторпіримідин (5) взаємодіє з 2-хлорфенолом у підходящому розчиннику в присутності підходящої основи з утворенням інтермедіату 4-хлор-6-(2-хлорфенокси)-5фторпіримідину (17), що потім реагує з O-метилоксимом (Е)-(5,6-дигідро-l, 4,2-діоксазин-3-іл)(2гідроксифеніл)метанону (13) з одержанням флуоксастробіну. Схема 3 [0050] Як показано на Схемі 4, флуоксастробін може бути отриманий шляхом послідовної взаємодії 4,6-дихлор-5-фторпіримідину (5) з O-метилоксимом (Z)-(5,6-дигідро-1,4,2-діоксазин-3іл)(2-гідроксифеніл)метанону (15) і потім з 2-хлорфенолом з утворенням (Z)-флуоксастробіну, що у підходящих умовах піддається ізомеризації з одержанням флуоксастробіну. Схема 4 30 13 UA 115093 C2 5 10 15 [0051] Як показано далі на Схемі 5, флуоксастробін може бути отриманий шляхом послідовної взаємодії 4,6-дихлор-5-фторпіримідину (5) з 2-хлорфенолом, що призводить до одержання 4-хлор-6-(2-хлорфенокси)-5-фторпіримідину (17), який далі при взаємодії з Oметилоксимом (Z)-(5,6-дигідро-l, 4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15) забезпечує одержання (Z)-флуоксастробіну, що у підходящих умовах піддається ізомеризації з одержанням флуоксастробіну. Схема 5 [0052] Синтез флуоксастробіну далі експериментальних процедур: Метил-2-(2-етоксі-2-оксоетокси)бензоат (6) ілюструється на прикладі наступних [0053] Хлоретилацетат повільно додавали до суміші метилсаліцилату (100 г, 0.657 моль), K2CO3 (100 г, 0.723 моль) в DMF (400 мл) при кімнатній температурі (20-30 °C). Реакційну суміш нагрівали при 65-75 °C протягом 12-18 год. Протікання реакції контролювали методом ВЕРХ (HPLC). Після завершення реакції неорганічні речовини відфільтровували та промивали DMF. DMF відокремлювали від фільтрату з одержанням продукту, що відповідає потрібним вимогам. Вихід – 91-95 %. 14 UA 115093 C2 -1 5 10 15 20 ІЧ (cм ) 2985.71 m, 1725.89 s, 1598.81 s, 1489.10 s, 1448.49 s, 1378.78 m, 1300.25 m, 1250.90 m, 1193.64 s, 1136.53 w, 1088.35 s, 959.50 w, 834.93 w, 756.49 s, 706.30 w, 658.81 w. 1H ЯМР (400 MHz; CDC13) δ 1. 306-1.271 (t, J=3.2 Hz, 3H), 3.906 (s, 3H), 4.292-4.238 (q, 2H), 4.713 (s, 2H), 6.897-6.877 (d, J=8Hz, 1H), 7.068-7.028 (m, 1H, ), 7.464-7.420 (m, 1H), 7.844-7.820 (dd, 1H, J=8Hz). Ступінь чистоти згідно з HPLC становив 98.63 %. 2-(Карбоксиметокси)бензойна кислота (7) [0054] До розчину NaOH (40 г, 0.838 моль) у воді (300 мл) повільно додавали метил-2-(2етоксі-2-оксоетокси)бензоат (6) (100 г, 0.419 моль) при температурі 20-30 °C (екзотермічність спостерігалася до температури 50 °C), і потім реакційну суміш перемішували протягом 1-2 год. Протікання реакції контролювали методом ВЕРХ (HPLC). Після завершення реакції реакційну суміш підкисляли розведеною (1:1 до об'єму) H2SО4 (50 мл) до pH=2-3 при температурі 2035 °C. Отриманий сірий продукт осаджували при витримці при перемішуванні протягом 1 год. при температурі 20-30 °C, потім сирий продукт відфільтровували і промивали водою, одержуючи продукт, що відповідав бажаним характеристикам. Вихід цього продукту склав 7187 %. -1 ІЧ (KBr) (cм ) 3467.78w, 3178.72 m, 2756.30 w, 1743.43 s, 1678.65 s, 1367.36 s, 1236.72 s, 1056.69 s. 1H ЯМР (400 MHz; DMSO-d6) δ 4.734 (s, 2H), 6.975-6.954 (d, J=8.4Hz, 1H), 7.008-6.954 (m, 1H), 7.457-7.413 (m, 1H), 7.633-7.610 (m, J=1.6Hz, 1H), 12.791(bs, 2H). МС (EI) m/z: 195.2 (M1); 137.2, 117,97. Ступінь чистоти згідно з HPLC був рівним 99,605 %. Бензофуран-3-ілацетат (8) 35 [0055] До оцтового ангідриду (300 мл) додавали 2-(карбоксиметокси)бензойну кислоту (7) (100 г, 0.510 моль) при кімнатній температурі та нагрівали до 130-140 °C. Цю температуру реакції підтримували протягом 14-20 год. при перемішуванні. Протікання реакції контролювали методом ВЕРХ (HPLC). Після завершення реакції реакційну суміш охолоджували до 50-80 °C, оцтовий ангідрид виділяли при температурі 50-80 °C при зниженому тиску, і сирий продукт екстрагували дихлорметаном (500 мл). Відокремлювали повністю дихлорметановий шар й одержували продукт, що відповідав бажаним характеристикам. Вихід цього продукту склав 7685 %. -1 ІЧ (см ) 3060.43 w, 1759.45 s, 1577.24 s, 1449.18 s, 1361.45 s, 1179.20 s, 1090.38 s, 890.75, 742.41.1H ЯМР (400 MHz; DMSO-d6) δ 2. 384 (s, 3H), 7.332-7.292 (dd, 1H), 7.411-7.37 (dd, 1H), 7.62-7.576 (dd, J=9 Hz, 2H), 8.2 (s, 1H). ГХ-МС (EI) m/z: 176. Ступінь чистоти згідно з HPLC був рівним 99.81 %. Бензофуран-3(2Н)-он (9) 40 [0056] До розчину бензофуран-3-ілацетату (8) (100 г, 1.42 моль) у метанолі (350 мл) додавали розведену (7.5 %) H2SO4 (500 мл) при кімнатній температурі з наступним нагріванням із зворотним холодильником протягом 1-3 год. Протікання реакції контролювали методом ВЕРХ (HPLC). Після завершення реакції реакційну суміш охолоджували, відфільтровували й отриману 25 30 15 UA 115093 C2 5 10 15 20 25 30 35 суспензію промивали водою та сушили під вакуумом, одержували продукт, що відповідав бажаним характеристикам. Вихід цього продукту склав 83-100 %. -1 ІЧ (см ) 2935.34, 1725.66, 1468.50, 1193.97.1H ЯМР (400 MHz; DMSO) δ 4. 807 (s, 2H), 7.1767.138 (t, 1H), 7.303-7.283 (d, J=8 Hz, 1H), 7.657-7.635 (m, 1H), 7.748-7.705 (m, 1H). ГХ-MС (EI) m/z: 134.13. Температура плавлення була рівною 101-103 °C. Ступінь чистоти згідно з HPLC був рівним 99.51 %. Бензофуран-3(2Н)-ону О-метилоксим (10) [0057] До розчину бензофуран-3(2Н)-ону (9) (100 г, 0.745 моль) у метанолі (700 мл) при кімнатній температурі додавали гідрохлорид O-метилгідроксиламіну (68.5 г, 0.820 моль) і NaOAc (67.3 г, 0.820 моль) з наступним нагріванням із зворотним холодильником протягом 1-3 год. Протікання реакції контролювали методом ВЕРХ (HPLC). Після завершення реакції неорганічні речовини відфільтровували та відокремлювали від фільтрату метанолу, одержуючи залишок. Залишок піддавали екстракції з використанням дихлорметану (500 мл) і води (1 л) з наступним виділенням органічного шару, одержували продукт, що відповідав бажаним характеристикам. Вихід цього продукту склав 75-83 %. -1 ІЧ (cм ) 3070.02, 2898.40, 1604.89 s, 1398.80 s, 1537.36, 1465.17, 1041.49, 985.45 s, 747.70s, 628.55 s, 554.54 s. 1H ЯМР (400 MHz; CDC1 3) δ 3. 990 (s, 3H), 5.081 (s, 2H), 6.997-6.931 (m, 1H), 7.354-7.311 (m, 1H), 7.610-7.589 (m, J=7.8 Hz, 1H). МС (EI) m/z: 164 (M+l); MС (EI) (m/z): 164 (M+l), 132.9. Температура плавлення була рівною 35-37 °C. Ступінь чистоти згідно з HPLC був рівним 98.92 %. 3 (3Е)-бензофуран-2,3-діону О -метилдіоксим (11A) [0058] До приблизно 13 %-ого розчину HCl в етилацетаті (173 г, 0.613 моль) додавали третBUNО2 (69.5 г, 0.675 моль) при температурі 0-5 °C з наступним додаванням розчину Oметилоксиму бензофуран-3(2Н)-ону (10) (100 г, 0.613 моль) в етилацетаті (400 мл) при температурі 0-35 °C. Протікання реакції контролювали методом ВЕРХ (HPLC). Після завершення реакції отриманий продукт виділяли шляхом екстракції з використанням системи етилацетат-вода, отриманий продукт відповідав бажаним характеристикам. Вихід цього продукту склав 70-73 %. -1 1 ІЧ (cм ) 3243.39 s, 3109.24 m, 2935.39 m, 2830.17 m, 1599.15 s. H ЯМР (400 MHz; CDC13) δ 4. 112 (s, 3H), 7.259-7.221 (m, J =1 . 6 Hz, 1H), 7.347-7.327 (d, J =8 Hz, 1Н), 7.605, 7.563 (m, 1H), 8.043-8.022 (m, J=7.6 Hz, 1H), 11.351 (s, 1H). МС (EI) m/z: 193.1 (M+l); МС (EI) (m/z): 193.1 (M+l), 195.3, 175.9, 162.1, 149.2. Температура плавлення була рівною 180-182 °C. Cтупінь чистоти згідно з HPLC був рівним 99.84 %. 3 (3Z)-Бензофуран-2,3-діону О -метилдіоксим (11B) [0059] До перемішуваної суспензії NaH (60 % суспензія; 8.1 г; 202.4 ммоль) в DMF (300 мл) 16 UA 115093 C2 5 10 15 повільно додавали н-бутилнітрит (20.87 г; 202.4 ммоль) при температурі від 0 до 5 °C. Отриману реакційну масу перемішували протягом 10-15 хв при зазначеній температурі. Потім повільно додавали розчин монооксиму бензофурану (Сполука 10, 30 г; 184 ммоль) в DMF (30 мл), підтримуючи температуру реакції рівною від 0 до 5 °C. Потім реакційну масу перемішували протягом 30 хв при температурі від 0 до 5 °C з наступним перемішуванням при 20-30 °C протягом 2-4 год. Протікання реакції контролювали методом HPLC, і після завершення реакції реакційну масу обробляли DM (демінералізованою) водою (300 мл) при температурі від 0 до 10 °C. Встановлювали величину pН реакційної маси рівною 1-2, використовуючи 50 % водний розчин сірчаної кислоти при температурі від 0 до 5 °C. Отриману суспензію перемішували протягом 30 хв при температурі від 5 до 10 °C. Отриманий у такий спосіб осад відфільтровували та промивали суспензію DM водою (3 × 60 мл). Отриманий продукт висушували при 60-70 °C, 3 одержуючи 27.3 г (77.32 % від теоретичного виходу) О -метилдіоксиму (3Z)-бензофуран-2,3діону (11B) з високим ступенем чистоти. Моніторинг реакції методом HPLC (% площі поверхні): діоксим ( 3 Z )-бензофурану (11B): 81.78 % і діоксим 3Е-бензофурану (11A): 2.19 %. Ступінь чистоти виділеного продукту згідно з HPLC (% площі поверхні): діоксиму (3Z )-бензофурану (11B): 98.61 % і діоксиму 3Е-бензофурану (11A): 0.77 %. 2 3 О -(2-гідроксіетил)-О -метилдіоксим (3Е)-бензофуран-2,3-діону (12A) 3 20 25 30 35 40 45 [0060] До розчину О -метилдіоксиму (3Е)-бензофуран-2,3-діону (11A) (100 г, 0.520 моль) в DMSO (300 мл) при кімнатній температурі додавали 2-хлоретанол (50.31 г, 0.624 моля) з наступним додаванням K2CO3 (100.6 г, 0.728 моль). Реакційну суміш перемішували при 75-80 °C протягом 10-12 год. Протікання реакції контролювали методом HPLC, і після завершення реакції реакційну масу обробляли водою (2 л) і перемішували при температурі 20-30 °C протягом 1 год. Отриманий продукт відфільтровували, суспензію промивали водою та сушили з відсмоктуванням, одержували продукт, що відповідав бажаним характеристикам. Вихід був рівним 83-87 %. -1 ІЧ (см , KBr) 3434.29 s, 3078.21 w, 2939.71 s, 2819.94 w, 1594.86 s, 1456.72 s, 1345.45 m, 1 1301.57 w, 1064.99 s, 933.28 w, 868.16 w. H ЯМР (CDCI3, 400 MHz) δ 2. 126-2.140 (t, J = 5.6Hz, 1H), 3.974-3.980 (m, 2H), 4.220 (s, 3H), 4.379-4.389 (m, 2H), 7.162-7.196 (m, 2H), 7.448-7.487 (t, 13 J =8 Hz, 1H), 8.056-8.076 (d, J = 8Hz, 1H). С ЯМР (CDC13, 400 MHz) δ 59. 534 (-CH2-), 64.342, 77.543 (-CH2-), 111.742, 118.106, 124.788, 128.187, 134.436, 142.573, 147.753, 157.036. МС (EI) m/z 236.8 (M+l); МС2 (EI) m/z 237, 193.1, 162.0, 144.0 130.1, 119.1, 104.1, 90.0, 65.2. HPLC (площа поверхні, %): 99.47 %. Температура плавлення була рівною 89-91 °C. 2 3 О -(2-гідроксіетил)-О -метилдіоксим (3Z)-бензофуран-2,3-діону (12B) 3 [0061] До розчину О -метилдіоксиму (3Z)-бензофуран-2,3-діону (11B) (100 г, 0.520 моль) в DMSO (300 мл) додавали 2-хлоретанол (50.31 г, 0.624 моль) з наступним додаванням K2CO3 (100.6 г, 0.728 моль) при кімнатній температурі. Реакційну суміш перемішували при температурі 75-80 °C протягом 10-12 год. Протікання реакції контролювали методом HPLC, і після завершення реакції реакційну масу обробляли водою (2 л) і перемішували при 20-30 °C протягом 1 год. Сирий продукт відфільтровували, суспензію промивали водою та сушили з відсмоктуванням, одержували продукт, що відповідав бажаним характеристикам. Вихід був рівним 83-87 %. 1 H ЯМР (CDCI3, 400 MHz) δ 3. 663-3.698 (m, 2H), 4.118 (s, 3H), 4.167-4.191 (t, J =4.8 Hz, 2H), 4.797-4.822 (t, J = 4.8 Hz, 1H), 7.233-7.270 (t, J =7.6 Hz, 1H), 7.328-7.348 (d, J =8 Hz, 1H) 7.521 17 UA 115093 C2 13 7.559 (t, J=8 Hz, 1H), 7.641-7.659 (d, J = 7.2 Hz, 1H). С ЯМР (CDCI3, 400 MHz) δ 64.379, 69.349, 82.456, 116.550, 125.329, 126.351, 129.486, 137.692, 144.660, 150.969, 161.219. MS (El) m/z 237.0 (M+l). O-метилоксим (Е)-(5,6-дигідро-l, 4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13) 5 15 20 25 30 35 3 2 10 2 3 [0062] До суспензії О -(2-гідроксіетил)-О -метилдіоксиму (3Е)-бензофуран-2,3-діону (12A) (100 г, 0.0423 моль) у воді (400 мл) додавали NaOH (25.3 г, 0.0635 моль) у воді (200 мл) при температурі 60-70 °C з наступним перемішуванням реакційної суміші при температурі 80-85 °C протягом 1-2 год. Протікання реакції контролювали методом HPLC, і після завершення реакції реакційну масу охолоджували до кімнатної температури та підкисляли, використовуючи 50 % оцтову кислоту (100 мл), до величини pН = від 5.0 до 5.5. Потім реакційну суміш перемішували при кімнатній температурі протягом 1 год., тверді речовини відфільтровували та промивали водою, і потім сушили при 50-60 °C з одержанням продукту, що відповідав бажаним характеристикам. Вихід був рівним 88-98 %. -1 ІЧ (см , KBr) 3449.71 s, 2977.41 w, 2939.54 w, 1584.48 s, 1453.48 s, 1354.02 m, 1186.98 m, 1 1089.72 m, 1111.90 m, 1046.19 s, 998.09 m, 906.95 m, 809.57 w, 759.61 w. ЯМР (CDC13, 400 MHz) δ 4. 098 (s, 3H), 4.194-4.215 (t, J =4Hz, 2H), 4.182-4.503 (t, J =5.2 Hz, 2H), 6.244 (s, 1H), 13 6.957-7.001 (m, 2H), 7.212-7.229 (d, J =7.8 Hz, 1H), 7.336-7.357 (m, 1H). ЯМР (CDCI3, 400 MHz) δ 63. 536, 64.100, 64.621, 117.718, 120.224, 130.352, 131.508, 148.369, 152.639, 153.733. МС (EI) m/z 237.0 (M+l); МС2 (EI) m/z 205.0, 178.1, 161.1, 145.1, 133.0, 119.0. HPLC (площа поверхні, %): 99.29 %. Температура плавлення була рівною 159-161 °C. O-метилоксим (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15) [0063] До суспензії О -(2-гідроксіетил)-О -метилдіоксиму (3Z)-бензофуран-2,3-діону (12B) (100 г, 0.0423 моль) у воді (400 мл) додавали NaOH (25.3 г, 0.0635 моль) у воді (200 мл) при температурі 60-70 °C з наступним перемішуванням реакційної суміші при температурі 80-85 °C протягом 1-2 год. Протікання реакції контролювали методом HPLC. Після завершення реакції реакційну масу охолоджували до кімнатної температури та підкисляли до величини pН = 5.0, використовуючи 50 % оцтову кислоту (100 мл). Потім реакційну суміш перемішували при кімнатній температурі протягом 1 год., тверді речовини відфільтровували та промивали водою, і потім сушили при температурі 50-60 °C з одержанням продукту, що відповідав бажаним характеристикам. Вихід був рівним 88-98 %. 1 H ЯМР (CDCI3, 400 MHz) δ 3. 960 (s, 3H), 4.149-4.169 (t, J = 4 Hz, 2H), 4.411-4.431 (t, J =4 Hz, 2H), 6.844-6.907 (m, 4H), 7.270-7.313 (m, 1H), 7.367-7.390 (dd, J =1.2 Hz, J =1.6 Hz, 1H). HPLC (площа поверхні, %): 98.93 %. Температура плавлення була рівною 110-114 °C. O-метилоксим (Е)-(2-((6-хлор-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-l, 4,2-діоксазин-3іл)метанону (14) 18 UA 115093 C2 5 10 15 20 25 30 [0064] До розчину 4,6-дихлор-5-фторпіримідину (DCFP) (100 г, 0.564 моль) у толуолі (500 мл) додавали O-метилоксим (Z)-(5,6-дигідро-l, 4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15) (77.8 г, 0.466 моль), K2CO3 (76 г, 0.55 моль), потім при кімнатній температурі додавали DMF (50 мл). Реакційну суміш перемішували при температурі 80-85 °C протягом 1-2 год. Протікання реакції контролювали методом HPLC. Після завершення реакції реакційну масу промивали водою (500 мл) і 10 % соляним розчином (250 мл) з одержанням продукту в толуольному шарі, що відповідав бажаним характеристикам. Вихід цього продукту був рівним 88-98 %. -1 ІЧ (см , KBr) 3075.01 w, 2980.39 w, 2940.78 s, 2824.82 w, 2410.77 w, 1559.81 s, 1445.46 s, 1415.78 m, 1304.99 m, 1180.73 s, 1110.89 w, 1092.02 w, 1053.57 s, 1001.30 m, 1 6 964.01 m, 908.97 m, 764.16 m. Н ЯМР (DMSO d , 400 MHz) δ 3. 664(s, 3H), 4.034-4.054 (t, J =4 Hz, 2H), 4.343-4.363 (t, J =4.4 Hz, 2H), 7.358-7.381 (m, 2H), 7.439-7.459 (d, J =8 Hz, 1H), 7.51713 6 7.552 (m, 1H), 8.469 (s, 1H). C ЯМР (DMSO d , 400 MHz) δ 62. 855, 64.411, 64.535, 123.116, 123.526, 126.182, 128.613, 129.31, 130.758, 131.083, 140.823, 143.494, 145.771, 146.173, 146.32, 148.682, 151.895, 152.429, 152.546, 157.671, 157.764. MS (EI) m/z 366.9 (M+l); MS2 (EI) m/z 334.9, 291.1, 275.3, 248.4, 223.0, 188.2. HPLC (площа поверхні, %): 97.41 %. Температура плавлення була рівною 83-85 °C. О-метилоксим ((Z)-(2-((6-хлор-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин3-іл)метанону (16) [0065] До розчину 4,6-дихлор-5-фторпіримідину (DCFP) (100 г, 0.564 моль) у толуолі (500 мл) додавали O-метилоксим (Е)-(5,6-дигідро-l, 4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (13) (77.8 г, 0.466 моль), K2CO3 (76 г, 0.55 моль) з наступним додаванням DMF (50 мл) при кімнатній температурі. Реакційну суміш перемішували при температурі 80-85 °C протягом 1-2 год. Протікання реакції контролювали методом HPLC. Після завершення реакції реакційну масу промивали водою (500 мл) і 10 % соляним розчином (250 мл) і одержували в толуольному шарі продукт, що відповідав бажаним характеристикам. Вихід цього продукту був рівним 88-98 %. O-метилоксим (Е)-(2-((6-(2-хлорфенокси)-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-l, 4,2діоксазин-3-іл)метанону [флуоксастробін] [0066] До розчину O-метилоксиму (Е)-(2-((6-хлор-5-фторпіримідин-4-іл)окси)феніл)(5,6дигідро-l, 4,2-діоксазин-3-іл)метанону (14) (100 г, 0.564 моль) у толуолі при кімнатній температурі додавали 2-хлорфенол (54 г, 0.846 моль), K2CO3 (50 г, 0.733 моль) і DMF (50 мл). 19 UA 115093 C2 5 10 15 20 25 30 35 40 45 50 Реакційну суміш перемішували при температурі 50-60 °C протягом 3-4 год. Протікання реакції контролювали методом HPLC. Після завершення реакції додавали водний розчин NaOH (10 %) (200 мл) з наступним додаванням води (300 мл). Перемішували отриману суміш і відокремлювали толуольний шар. Цей толуольний шар промивали соляним розчином (розсолом) (600 мл). Потім толуольний шар повністю виділяли, одержуючи сирий продукт. До цього сирого продукту додавали метанол і нагрівали до температури 60 °C до одержання прозорого розчину. Цей розчин перемішували при кімнатній температурі, одержуючи осад чистого продукту. Чистий флуоксастробін відфільтровували та промивали метанолом. Цей продукт потім сушили з одержанням чистого флуоксастробіну, що відповідав бажаним характеристикам. Вихід продукту був рівним 75-88 %. -1 ІЧ (см , KBr) 3072.99 w, 2981.58 w, 2936.76 s, 2819.79 w, 2502.01 w, 1601.14 s, 1572.37 s, 1447.88 s, 1305.43 m, 1268.11 m, 1217.15 m, 1191.21 m, 1092.60 m, 1049.05 m, 1 1001.26 w, 910.25 w, 762.81 w. H ЯМР (CDC13, 400 MHz) δ 3. 846 (s, 3H), 4.170-4.160 (t, J =4Hz, 13 2H), 4.464-4.484 (t, J = 4Hz, 2H), 7.261-7.295 (m, 2H), 7.322-7.409 (2, 4H), 8.069 (s, 1H). C ЯМР (CDC13, 400 MHz) δ 63. 103, 64.153, 64.550, 122.659, 123.259, 123.823, 125.712, 127.150, 127.397, 128.094, 130.511, 130.679, 130.776, 131.473, 134.138, 146.004, 148.166, 148.943, 150.354, 150.478, 151.819, 157.395, 157.466, 157.783, 157.854. MS (EI) m/z 459.1 (M+l); MS2 (EI) m/z 427.1, 383.0, 366.9, 342.1, 306.2, 246.0, 231.1, 188.0. HPLC (площа поверхні, %): 99.40 %. Температура плавлення була рівною 108-112 °C. O-метилоксим (Z)-(2-((6-(2-хлорфенокси)-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2діоксазин-3-іл)метанону [(Z)-флуоксастробін] [0067] Ізомеризація ( Z )-флуоксастробіну з одержанням ( E)-флуоксастробіну з використанням метансульфонової кислоти. До перемішуваного розчину ( Z )-флуоксастробіну (0.3 г; 0.65 ммоль) в ацетонітрилі (3 мл) по краплях при кімнатній температурі додавали метансульфонову кислоту (0.04 мл, 0.65 ммоля). Реакційну суміш перемішували при тій самій температурі протягом 2-3 год. Протікання реакції контролювали методом тонкошарової хроматографії (TEC). До реакційної маси при кімнатній температурі додавали дихлорметан (5 мл) і DM воду (5 мл). Після здійснення енергійного перемішування шари розділяли. Водний шар піддавали зворотній екстракції із застосуванням дихлорметану (5 мл) і з'єднані дихлорметанові шари промивали 10 %-им водним розчином бікарбонату натрію (20 мл) з наступним промиванням 10 % соляним розчином (20 мл). Дихлорметан відганяли при зниженому тиску при температурі 35-45 °C з одержанням ( E)флуоксастробіну у вигляді сирого продукту (0.25 г, 83 % від теоретичного виходу). Сирий флуоксастробін після очищення в етанолі забезпечив одержання чистого ( E) -флуоксастробіну. Ступінь чистоти виділеного продукту згідно з HPLC (% площі поверхні): (Z)-флуоксастробін: 1.02 % і (E)-флуоксастробін: 95.92 %. [0068] Ізомеризація ( Z )-флуоксастробіну з одержанням ( E)-флуоксастробіну з використанням фосфорної кислоти. До перемішуваного розчину ( Z )-флуоксастробіну (0.25 г; 0.54 ммоля) в ацетонітрилі (4 мл) при кімнатній температурі по краплях додавали фосфорну кислоту (0.03 г, 0.54 ммоля). При тій самій температурі реакційну суміш перемішували протягом 2-3 год. Протікання реакції контролювали методом тонкошарової хроматографії/HPLC. При кімнатній температурі в реакційну суміш додавали дихлорметан (5 мл) і DM воду (5 мл). Після здійснення енергійного перемішування шари розділяли. Водний шар піддавали зворотній екстракції із застосуванням дихлорметану (5 мл). З'єднані дихлорметанові шари промивали 10 %-им водним розчином бікарбонату натрію (20 мл) з наступним промиванням 10 % соляним розчином (20 мл). Дихлорметан відганяли при зниженому тиску при температурі 40-45 °C і одержували (E)флуоксастробін (0.22 г, 88 % від теоретичного виходу). Протікання реакції контролювали методом HPLC (% площі поверхні): (Z)-флуоксастробін: 6.79 % і (E)-флуоксастробін: 88.84 %. Ступінь чистоти виділеного продукту згідно з HPLC (% площі поверхні): (Z)-флуоксастробін: 6.94 % і (E)-флуоксастробін: 84.43 %. -1 ІЧ (см , KBr) 3066.28 w, 2981.58 w, 2939.36 s, 2825.71 w, 2500.61 w, 1602.36 s, 20 UA 115093 C2 5 10 15 20 25 30 35 40 45 50 1572.76 s, 1441.05 s, 1297.05 m, 1218.17 m, 1116.52 s, 1046.15 m 1000.86 w, 904.73 s, 764.71 1 w. H ЯМР (CDCl3, 400 MHz) δ 3. 983 (s, 3H), 4.163-4.218 (t, 2H), 4.432-4.440 (t, J=3.2 Hz, 2H), 7.217-7.352 (m, 4H), 7.371-7.390 (m, 2H),7.483-7.516 (m, 2H), 7.702-7.722 (d, J=8Hz, 1H), 8.016 (s, 1H). MC (EI) m/z 459.1 (M+l); MС2 (EI) m/z 427.0, 382.9, 366.7, 340.0, 305.8, 246.1, 188.0. HPLC (площа поверхні, %): 99.11 %. Температура плавлення була рівною 150-152 °C. [0069] Даний винахід охоплює заявлені сполуки з усіма ізотопами атомів, що містяться в цих сполуках. Ізотопи включають атоми, що мають той же самий атомний номер, але різні масові числа. Наприклад, але без обмеження, ізотопи водню включають тритій і дейтерій та ізотопи 11 13 14 вуглецю включають C, C і C. [0070] Використовувана в даній заявці термінологія призначена для опису тільки конкретних варіантів і не обмежує даний винахід. Використовувані форми в однині включають і множину, у тому числі, і "щонайменше один, ” якщо тільки з контексту не слідує інше. Союз "або" означає "та/або.” Застосовуваний у даній заявці термін "та/або" включає будь-яку та всі комбінації одного або більше перерахованих елементів. Варто також вказати, що терміни "містить" та/або "що містить" або "включає" й/або "включаючий", використовувані в даній заявці, означають наявність зазначених ознак, областей, цілих чисел, стадій, операцій, елементів і/або компонентів, але не виключають присутності або додавання однієї або більше інших ознак, областей, цілих чисел, стадій, операцій, елементів і/або компонентів і/або груп. [0071] Терміни в однині не означають обмеження кількості, але скоріше означають наявність щонайменше одного із зазначених компонентів. Термін "або" означає "та/або". Відкритий термін "що містить" охоплює проміжну перехідну фразу "складається по суті з" й обмежуючу фразу "складається з". Формула винаходу, що містить одну з цих трьох фраз або перехідну фразу, що чергується, таку як "що містить" або "включаючий" може бути викладена з будь-якою іншою перехідною фразою, що ясно виключена контекстом даної заявки або попереднім рівнем техніки. Вказівка інтервалів просто служить для скорочення при окремій вказівці кожної окремої величини, що перебуває в даному інтервалі, якщо не зазначено інше, і кожна така окрема величина включена в даний опис, як якби вона була зазначена окремо. Граничні значення всіх інтервалів входять у ці інтервали та можуть комбінуватися незалежно. Всі способи, описані в даній заявці, можуть здійснюватися у підходящому порядку, якщо не зазначено інше або якщо це ясно не суперечить контексту заявки. Опис будь-якого та всіх прикладів або термінологія цих прикладів (наприклад, "такий як") призначена тільки для кращої ілюстрації даного винаходу та не обмежує об'єм цього винаходу, якщо не заявлено інше. Жоден із термінів (фраз) не можна розглядати як вказуючий (-у) будь-який незаявлений елемент в якості істотного у практиці здійснення даного винаходу, використовуваного в даній заявці. Якщо не зазначено інше, використані в даній заявці технічні та наукові терміни мають те саме значення, що є загальноприйнятим для фахівця в області техніки, до якої відноситься даний винахід. [0072] Використовуваний у даній заявці термін "галоген" відноситься до фтору, хлору, брому або йоду. [0073] Якщо не зазначено інше, використані в даній заявці технічні та наукові терміни мають те саме значення, що є загальноприйнятим для фахівця в області техніки, до якої відноситься даний винахід. Слід також зазначити, що терміни, значення яких визначено у зазвичай використовуваних словниках (довідниках), варто інтерпретувати як такі, що мають значення, яке узгоджується з їхнім значенням у контексті релевантного рівня техніки та даного винаходу і їх не слід розуміти в ідеалізованому або надто формальному змісті, якщо це чітко не випливає з даного опису. [0074] Хоча даний винахід був описаний на прикладі одного з варіантів, фахівці в даній області повинні розуміти, що можуть бути зроблені різні зміни, і різні елементи можуть бути замінені елементами, що є еквівалентними без виходу за рамки даного винаходу. Крім того, можуть бути зроблені різні модифікації для адаптації до конкретної ситуації або до конкретної речовини в рамках суті даного винаходу. Отже, даний винахід не обмежений конкретним варіантом, описаним як краща форма здійснення даного винаходу, але даний винахід буде включати всі варіанти, охоплені прикладеною формулою винаходу. ФОРМУЛА ВИНАХОДУ 55 60 1. Спосіб одержання флуоксастробіну, який включає: (і) взаємодію 4,6-дигалоген-5-фторпіримідину (5), де Х1 являє собою галоген, з О-метилоксимом (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15), необов'язково у присутності розчинника та необов'язково у присутності основи, з утворенням О-метилоксиму (Z)-(2-((6галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро-1,4,2-діоксазин-3-іл)метанону (16): 21 UA 115093 C2 OCH3 F X1 X1 + N N N O O X1 N O N F OH O N (5) N OCH3 O N (15) (16) ; (іі) взаємодію О-метилоксиму (Z)-(2-((6-галоген-5-фторпіримідин-4-іл)окси)феніл)(5,6-дигідро1,4,2-діоксазин-3-іл)метанону (16) з 2-хлорфенолом, необов'язково у присутності розчинника та необов'язково у присутності основи, з утворенням (Z)-флуоксастробіну: OCH3 OCH3 O N F N O X1 OH O Cl N O O O + N N N F Cl O N N (Z)-флуоксастробін (16) 5 ; (ііі) ізомеризацію (Z)-флуоксастробіну з утворенням флуоксастробіну: OCH3 Cl O O N F O N Cl O O N N H3CO N N O O O N (Z)-флуоксастробін 10 F N флуоксастробін . 2. Спосіб за п. 1, де ізомеризацію (Z)-флуоксастробіну з утворенням флуоксастробіну здійснюють у присутності розчинника та необов'язково у присутності кислого каталізатора. 3. Спосіб за п. 1, де О-метилоксим (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2гідроксифеніл)метанону (15) отриманий шляхом: (і) взаємодії О-метилоксиму бензофуран-3(2H)-ону (10) з алкілнітритом у присутності основи з 3 утворенням О -метилдіоксиму (3Z)-2,3-бензофурандіону (11В) як переважного ізомеру: MeO OMe N N N O HO (10) 15 O (11B) ; (іі) взаємодії О -метилдіоксиму (3Z)-2,3-бензофурандіону (11В) з 2-галогенетанолом 2 3 утворенням О -(2-гідроксіетил)-О -метилдіоксиму (3Z)-бензофуран-2,3-діону (12В): 3 22 з UA 115093 C2 OMe OMe N N HO N N O O O HO (11B) (12B) ; і 2 3 (ііі) взаємодії О -(2-гідроксіетил)-О -метилдіоксиму (3Z)-бензофуран-2,3-діону (12В) з основою з утворенням О-метилоксиму (Z)-(5,6-дигідро-1,4,2-діоксазин-3-іл)(2-гідроксифеніл)метанону (15): OMe N OH N O O O HO 5 10 N N O (12B) OMe (15) . 4. Спосіб за п. 3, де алкілнітрит являє собою н-бутилнітрит або трет-бутилнітрит. 5. Спосіб за п. 3, де основа, яку застосовують при взаємодії О-метилоксиму бензофуран-3(2H)ону (10) з алкілнітритом, являє собою гідроксид металу, гідрид металу й алкоксид металу. 3 6. Спосіб за п. 3, де вміст О -метилдіоксиму (3Z)-2,3-бензофурандіону (11В) у суміші (3Е)- і (3Z)ізомерів становить від 94 до 98 %. Комп’ютерна верстка О. Гергіль Міністерство економічного розвитку і торгівлі України, вул.М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing fluoxastrobin
Автори англійськоюPrasad, Vic, Hindupur, Rama Mohan, Mane, Avinash Sheshrao, Balakrishnan, Sankar, Pawar, Jivan Dhanraj, Maddani, Mahagundappa Rachappa, Wadhwa, Sandeep
Автори російськоюПрасад Вик, Хиндупур Рама Мохан, Манэ Авинаш Шэшрао, Балакришнан Санкар, Павар Дживан Дхенрадж, Маддани Махагундаппа Рачаппа, Вадхва Сэндип
МПК / Мітки
МПК: C07D 413/10, C07D 413/12
Мітки: спосіб, одержання, флуоксастробіну
Код посилання
<a href="https://ua.patents.su/25-115093-sposib-oderzhannya-fluoksastrobinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання флуоксастробіну</a>
Попередній патент: Спосіб визначення границі міцності зчеплення наповнювача з матрицею в композиційному матеріалі
Наступний патент: Спосіб виготовлення панелі прямого друку
Випадковий патент: Антибактеріальна композиція для місцевого застосування