Лактами та їх фармацевтичне застосування
Номер патенту: 76969
Опубліковано: 16.10.2006
Автори: Масузава Йоко, Ямазакі Акійо, Мацуеда Хіроюкі, Хірама Рюсуке, Ота Фумьо, Ііно Юкьо, Ікенуе Такао, Кондо Нобуо, Хатанака Тосіхіро
Формула / Реферат
1. Лактам поданої нижче загальної формули (І) або його фармацевтично прийнятна сіль:
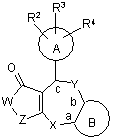 , (I)
, (I)
де А є ароматичний цикл, гетероцикл або аліфатичний цикл; R2, R3 та R4 можуть бути однаковими або різними, і кожний з них, незалежно від інших, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан, трифторметил, алкеніл, який може мати замісник(и), алкініл, який може мати замісник(и), арил, який може мати замісник(и), гетероарил, який може мати замісник(и), бензилоксигрупа, яка може мати замісник(и), арилоксигрупа, яка може мати замісник(и), гетероарилоксигрупа, яка може мати замісник(и), ариламіногрупа, яка може мати замісник(и), арилвініл, який може мати замісник(и), або арилетиніл, який може мати замісник(и); В є ароматичний цикл, який може мати замісник(и), гетероцикл, який може мати замісник(и), або аліфатичний цикл, який може мати замісник(и); -Х-, -Y- та -Z- можуть бути однаковими або різними, і кожний з них, незалежно від інших, є -О-, -NH-, -NR5-, -S-, -SO-, -SО2-, -СН2-, -CR6R7- або -СО-, де R5 є нижчий алкіл, який може мати замісник(и), ацил, який може мати замісник(и), алкоксикарбоніл, який може мати замісник(и), карбамоїл, який може мати замісник(и), або сульфоніл, який може мати замісник(и), R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, який може мати замісник(и), арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; -W- є -NR1-, -О- або –CR8R9-, де R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и), і R8 та R9 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; і кожний з символів а, b, та с вказує положення атома вуглецю, за умови що:
(і) згаданий(-і) замісник(и) вибраний(-і) із групи, до якої входять атоми галоїдів, гідроксил, алкіли, меркаптогрупа, алкоксигрупи, алкілтіогрупи, алкілсульфоніли, ацили, ацилоксигрупи, аміногрупа, алкіламіногрупи, карбоксил, алкоксикарбоніли, карбамоїли, нітрогрупа, ціан, трифторметил, арили та гетероарили,
(іі) якщо В є бензольний цикл, кожний з -X- та -Y- є -NH-, -Z- є –СН2- та -W- є -NH-, то A(R2)(R3)(R4) не може бути фенілом, 4-бромфенілом, 4-гідроксифенілом, 4-метоксифенілом, 2-гідроксифенілом, 3,4-диметоксифенілом або 3-метокси-4-гідроксифенілом;
(ііі) якщо В є бензольний цикл, -X- є -NH-, -Z- є –CR6R7- і -W- є -NH-, то кожний з R6 та R7 не може бути метилом;
(iv) якщо В є бензольний цикл, -X- є -NH-, -Z- є -CO- і -W- є -NR1-, то R1 не може бути п-толілом;
(v) якщо В є бензольний цикл, -X- є -NH-, -Y- є -S-, -Z- є -CR6R7- і -W- є -NH-, то кожний з R6 та R7 не може бути метилом; і
(vi) якщо В є бензольний цикл, -X- є -NH-, -Y- є -S- і -Z- є –СН2-, то -W- не може бути -О-.
2. Лактам або його фармацевтично прийнятна сіль за п. 1, де в загальній формулі (І) А є ароматичний цикл, гетероцикл або аліфатичний цикл; R2, R3 та R4 можуть бути однаковими або різними, і кожний з них, незалежно від інших, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан, трифторметил, арил, який може мати замісник(и), гетероарил, який може мати замісник(и), бензилоксигрупа, яка може мати замісник(и), арилоксигрупа, яка може мати замісник(и), гетероарилоксигрупа, яка може мати замісник(и), ариламіногрупа, яка може мати замісник(и), арилвініл, який може мати замісник(и), або арилетиніл, який може мати замісник(и); В є ароматичний цикл, який може мати замісник(и), гетероцикл, який може мати замісник(и), або аліфатичний цикл, який може мати замісник(и); -Х-, -Y- та -Z- можуть бути однаковими або різними, і кожний з них, незалежно від інших, є -О-, -NH-, -NR5-, -S-, -SO-, -SО2-, -СН2-, –CR6R7- або -СО-, де R5 є нижчий алкіл або ацил, який може мати замісник(и), R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; -W- є –NR1-, де R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и), за умови що:
(і) згаданий(-і) замісник(и) вибраний(-і) із групи, до якої входять атоми галоїдів, гідроксил, алкіли, арили, меркаптогрупа, алкоксигрупи, алкілтіогрупи, алкілсульфоніли, ацили, ацилоксигрупи, аміногрупа, алкіламіногрупи, карбоксил, алкоксикарбоніли, карбамоїли, нітрогрупа, ціан та трифторметил,
(іі) якщо В є бензольний цикл, кожний з -X- та -Y- є -NH- і -Z- є –СН2-, то A(R2)(R3)(R4) не може бути фенілом, 4-бромфенілом, 4-гідроксифенілом, 4-метоксифенілом, 2-гідроксифенілом, 3,4-диметоксифенілом або 3-метокси-4-гідроксифенілом;
(ііі) якщо В є бензольний цикл, -X- є -NH- і -Z- є –CR6R7-, то кожний з R6 та R7 не може бути метилом;
(iv) якщо В є бензольний цикл, -X- є -NH- і -Z- є -СО-, то R1 не може бути п-толілом.
3. Лактам або його фармацевтично прийнятна сіль за п. 1, де в загальній формулі (І) -X- та -Y- можуть бути однаковими або різними, і кожний з них є -NH- або -NR5-, де R5 є нижчий алкіл, який може мати замісник(и), ацил, який може мати замісник(и), алкоксикарбоніл, який може мати замісник(и), карбамоїл, який може мати замісник(и), або сульфоніл, який може мати замісник(и), -Z- є –СН2- або –CR6R7-, де R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; і -W- є –NR1-, де R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и).
4. Лактам або його фармацевтично прийнятна сіль за п. 3, де в загальній формулі (І) В є бензольний цикл, який може мати замісник(и).
5. Лактам або його фармацевтично прийнятна сіль за п. 3, де в загальній формулі (І) В є аліфатичний цикл, який може мати замісник(и).
6. Лактам або його фармацевтично прийнятна сіль за п. 5, де в загальній формулі (І) В є циклогексановий цикл, який може мати замісник(и).
7. Лактам або його фармацевтично прийнятна сіль за п. 6, де в загальній формулі (І) А є бензольний цикл.
8. Лактам або його фармацевтично прийнятна сіль за п. 7, де вуглецеві атоми, позначені в загальній формулі (І) символами a, b та с, мають незалежно один від одного абсолютну конфігурацію R або S.
9. Лактам або його фармацевтично прийнятна сіль за п. 8, де вуглецеві атоми, позначені в загальній формулі (І) символами а та b, мають абсолютну конфігурацію R, а вуглецевий атом с має абсолютну конфігурацію R або S.
10. Лактам або його фармацевтично прийнятна сіль за п. 8, де вуглецеві атоми, позначені в загальній формулі (І) символами а та b, мають абсолютну конфігурацію S, а вуглецевий атом с має абсолютну конфігурацію R або S.
11. Засіб для підвищення здатності до переносу цукру, який містить як активний інгредієнт лактам поданої нижче загальної формули (І) або його фармацевтично прийнятну сіль:
 , (I)
, (I)
де А є ароматичний цикл, гетероцикл або аліфатичний цикл; R2, R3 та R4 можуть бути однаковими або різними, і кожний з них, незалежно від інших, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан, трифторметил, алкеніл, який може мати замісник(и), алкініл, який може мати замісник(и), арил, який може мати замісник(и), гетероарил, який може мати замісник(и), бензилоксигрупа, яка може мати замісник(и), арилоксигрупа, яка може мати замісник(и), гетероарилоксигрупа, яка може мати замісник(и), ариламіногрупа, яка може мати замісник(и), арилвініл, який може мати замісник(и), або арилетиніл, який може мати замісник(и); В є ароматичний цикл, який може мати замісник(и), гетероцикл, який може мати замісник(и), або аліфатичний цикл, який може мати замісник(и); -Х-, -Y- та -Z- можуть бути однаковими або різними, і кожний з них, незалежно від інших, є -О-, -NH-, -NR5-, -S-, -SO-, -SО2-, -СН2-, –CR6R7- або -СО-, де R5 є нижчий алкіл, який може мати замісник(и), ацил, який може мати замісник(и), алкоксикарбоніл, який може мати замісник(и), карбамоїл, який може мати замісник(и), або сульфоніл, який може мати замісник(и), R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, який може мати замісник(и), меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; -W- є -NR1-, -О- або –CR8R9-, де R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и), і R8 та R9 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; і кожний з символів а, b, та с вказує положення атома вуглецю, за умови що:
(і) згаданий (-і) замісник(и) вибраний(-і) із групи, до якої входять атоми галоїдів, гідроксил, алкіли, арили, меркаптогрупа, алкоксигрупи, алкілтіогрупи, алкілсульфоніли, ацили, ацилоксигрупи, аміногрупа, алкіламіногрупи, карбоксил, алкоксикарбоніли, карбамоїли, нітрогрупа, ціан, трифторметил, арили та гетероарили.
12. Засіб для підвищення здатності до переносу цукру за п. 11, де в загальній формулі (І) R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и), А є ароматичний цикл, гетероцикл або аліфатичний цикл; R2, R3 та R4 можуть бути однаковими або різними, і кожний з них, незалежно від інших, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан, трифторметил, арил, який може мати замісник(и), гетероарил, який може мати замісник(и), бензилоксигрупа, яка може мати замісник(и), арилоксигрупа, яка може мати замісник(и), гетероарилоксигрупа, яка може мати замісник(и), ариламіногрупа, яка може мати замісник(и), арилвініл, який може мати замісник(и), або арилетиніл, який може мати замісник(и); В є ароматичний цикл, який може мати замісник(и), гетероцикл, який може мати замісник(и), або аліфатичний цикл, який може мати замісник(и); -Х-, -Y- та -Z- можуть бути однаковими або різними, і кожний з них, незалежно від інших, є -O-, -NH-, -NR5-, -S-, -SO-, -SO2-, -СН2-, -CR6R7- або -СО-, де R5 є нижчий алкіл або ацил, який може мати замісник(и), R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил, за умови, що згаданий(-і) замісник(и) вибраний(-і) із групи, до якої входять атоми галоїдів, гідроксил, алкіли, арили, меркаптогрупа, алкоксигрупи, алкілтіогрупи, алкілсульфоніли, ацили, ацилоксигрупи, аміногрупа, алкіламіногрупи, карбоксил, алкоксикарбоніли, карбамоїли, нітрогрупа, ціан та трифторметил.
13. Засіб для підвищення здатності до переносу цукру, який містить як активний інгредієнт лактам або його фармацевтично прийнятну сіль за будь-яким із пп. 1-10.
14. Гіпоглікемічний засіб, який містить як активний інгредієнт лактам або його фармацевтично прийнятну сіль за будь-яким із пп. 1-12.
15. Засіб для профілактики та/або лікування діабету, периферичної діабетичної невропатії, діабетичної нефропатії, діабетичної ретинопатії, діабетичної макроангіопатії, порушеної толерантності до глюкози або ожиріння, який містить як активний інгредієнт лактам або його фармацевтично прийнятну сіль за будь-яким із пп. 1-12.
16. Фармацевтична композиція, яка містить як активний інгредієнт лактам або його фармацевтично прийнятну сіль за будь-яким із пп. 1-10.
Текст
1. Лактам поданої нижче загальної формули (І) або його фармацевтично прийнятна сіль: C2 2 (19) 1 3 та R9 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; і кожний з символів а, b, та с вказує положення атома вуглецю, за умови що: (і) згаданий(-і) замісник(и) вибраний(-і) із групи, до якої входять атоми галоїдів, гідроксил, алкіли, меркаптогрупа, алкоксигрупи, алкілтіогрупи, алкілсульфоніли, ацили, ацилоксигрупи, аміногрупа, алкіламіногрупи, карбоксил, алкоксикарбоніли, карбамоїли, нітрогрупа, ціан, трифторметил, арили та гетероарили, (іі) якщо В є бензольний цикл, кожний з -X- та -Y- є -NH-, -Z- є –СН2- та -W- є -NH-, то A(R2)(R3)(R4) не може бути фенілом, 4-бромфенілом, 4гідроксифенілом, 4-метоксифенілом, 2гідроксифенілом, 3,4-диметоксифенілом або 3метокси-4-гідроксифенілом; (ііі) якщо В є бензольний цикл, -X- є -NH-, -Z- є – CR6R7- і -W- є -NH-, то кожний з R6 та R7 не може бути метилом; (iv) якщо В є бензольний цикл, -X- є -NH-, -Z- є CO- і -W- є -NR1-, то R1 не може бути п-толілом; (v) якщо В є бензольний цикл, -X- є -NH-, -Y- є -S-, -Z- є -CR6R7- і -W- є -NH-, то кожний з R6 та R7 не може бути метилом; і (vi) якщо В є бензольний цикл, -X- є -NH-, -Y- є -S- і -Z- є –СН2-, то -W- не може бути -О-. 2. Лактам або його фармацевтично прийнятна сіль за п.1, де в загальній формулі (І) А є ароматичний цикл, гетероцикл або аліфатичний цикл; R2, R3 та R4 можуть бути однаковими або різними, і кожний з них, незалежно від інших, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан, трифторметил, арил, який може мати замісник(и), гетероарил, який може мати замісник(и), бензилоксигрупа, яка може мати замісник(и), арилоксигрупа, яка може мати замісник(и), гетероарилоксигрупа, яка може мати замісник(и), ариламіногрупа, яка може мати замісник(и), арилвініл, який може мати замісник(и), або арилетиніл, який може мати замісник(и); В є ароматичний цикл, який може мати замісник(и), гетероцикл, який може мати замісник(и), або аліфатичний цикл, який може мати замісник(и); -Х-, -Y- та -Z- можуть бути однаковими або різними, і кожний з них, незалежно від інших, є -О-, -NH-, -NR5-, -S-, -SO-, -SО2-, -СН2-, –CR6R7або -СО-, де R5 є нижчий алкіл або ацил, який може мати замісник(и), R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; -W- є –NR1-, де R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и), за умови що: 76969 4 (і) згаданий(-і) замісник(и) вибраний(-і) із групи, до якої входять атоми галоїдів, гідроксил, алкіли, арили, меркаптогрупа, алкоксигрупи, алкілтіогрупи, алкілсульфоніли, ацили, ацилоксигрупи, аміногрупа, алкіламіногрупи, карбоксил, алкоксикарбоніли, карбамоїли, нітрогрупа, ціан та трифторметил, (іі) якщо В є бензольний цикл, кожний з -X- та -Y- є -NH- і -Z- є –СН2-, то A(R2)(R3)(R4) не може бути фенілом, 4-бромфенілом, 4-гідроксифенілом, 4метоксифенілом, 2-гідроксифенілом, 3,4диметоксифенілом або 3-метокси-4гідроксифенілом; (ііі) якщо В є бензольний цикл, -X- є -NH- і -Z- є – CR6R7-, то кожний з R6 та R7 не може бути метилом; (iv) якщо В є бензольний цикл, -X- є -NH- і -Z- є СО-, то R1 не може бути п-толілом. 3. Лактам або його фармацевтично прийнятна сіль за п.1, де в загальній формулі (І) -X- та -Y- можуть бути однаковими або різними, і кожний з них є NH- або -NR5-, де R5 є нижчий алкіл, який може мати замісник(и), ацил, який може мати замісник(и), алкоксикарбоніл, який може мати замісник(и), карбамоїл, який може мати замісник(и), або сульфоніл, який може мати замісник(и), -Z- є –СН2або –CR6R7-, де R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, 1 нітрогрупа, ціан або трифторметил; і -W- є –NR -, де R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и). 4. Лактам або його фармацевтично прийнятна сіль за п.3, де в загальній формулі (І) В є бензольний цикл, який може мати замісник(и). 5. Лактам або його фармацевтично прийнятна сіль за п.3, де в загальній формулі (І) В є аліфатичний цикл, який може мати замісник(и). 6. Лактам або його фармацевтично прийнятна сіль за п.5, де в загальній формулі (І) В є циклогексановий цикл, який може мати замісник(и). 7. Лактам або його фармацевтично прийнятна сіль за п.6, де в загальній формулі (І) А є бензольний цикл. 8. Лактам або його фармацевтично прийнятна сіль за п.7, де вуглецеві атоми, позначені в загальній формулі (І) символами a, b та с, мають незалежно один від одного абсолютну конфігурацію R або S. 9. Лактам або його фармацевтично прийнятна сіль за п.8, де вуглецеві атоми, позначені в загальній формулі (І) символами а та b, мають абсолютну конфігурацію R, а вуглецевий атом с має абсолютну конфігурацію R або S. 10. Лактам або його фармацевтично прийнятна сіль за п.8, де вуглецеві атоми, позначені в загальній формулі (І) символами а та b, мають абсолютну конфігурацію S, а вуглецевий атом с має абсолютну конфігурацію R або S. 11. Засіб для підвищення здатності до переносу цукру, який містить як активний інгредієнт лактам поданої нижче загальної формули (І) або його фармацевтично прийнятну сіль: 5 R2 76969 R3 R4 A O (I) W Z c Y b a B X , де А є ароматичний цикл, гетероцикл або аліфатичний цикл; R2, R3 та R4 можуть бути однаковими або різними, і кожний з них, незалежно від інших, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан, трифторметил, алкеніл, який може мати замісник(и), алкініл, який може мати замісник(и), арил, який може мати замісник(и), гетероарил, який може мати замісник(и), бензилоксигрупа, яка може мати замісник(и), арилоксигрупа, яка може мати замісник(и), гетероарилоксигрупа, яка може мати замісник(и), ариламіногрупа, яка може мати замісник(и), арилвініл, який може мати замісник(и), або арилетиніл, який може мати замісник(и); В є ароматичний цикл, який може мати замісник(и), гетероцикл, який може мати замісник(и), або аліфатичний цикл, який може мати замісник(и); -Х-, -Y- та -Z- можуть бути однаковими або різними, і кожний з них, незалежно від інших, є -О-, -NH-, -NR5-, -S-, -SO-, -SО2-, -СН2-, – CR6R7- або -СО-, де R5 є нижчий алкіл, який може мати замісник(и), ацил, який може мати замісник(и), алкоксикарбоніл, який може мати замісник(и), карбамоїл, який може мати замісник(и), або сульфоніл, який може мати замісник(и), R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, який може мати замісник(и), меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; -W- є NR1-, -О- або –CR8R9-, де R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и), і R8 та R9 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; і кожний з символів а, b, та с вказує положення атома вуглецю, за умови що: (і) згаданий (-і) замісник(и) вибраний(-і) із групи, до якої входять атоми галоїдів, гідроксил, алкіли, арили, меркаптогрупа, алкоксигрупи, алкілтіогрупи, алкілсульфоніли, ацили, ацилоксигрупи, аміногрупа, алкіламіногрупи, карбоксил, алкоксикарбоніли, 6 карбамоїли, нітрогрупа, ціан, трифторметил, арили та гетероарили. 12. Засіб для підвищення здатності до переносу цукру за п.11, де в загальній формулі (І) R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и), А є ароматичний цикл, гетероцикл або аліфатичний цикл; R2, R3 та R4 можуть бути однаковими або різними, і кожний з них, незалежно від інших, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан, трифторметил, арил, який може мати замісник(и), гетероарил, який може мати замісник(и), бензилоксигрупа, яка може мати замісник(и), арилоксигрупа, яка може мати замісник(и), гетероарилоксигрупа, яка може мати замісник(и), ариламіногрупа, яка може мати замісник(и), арилвініл, який може мати замісник(и), або арилетиніл, який може мати замісник(и); В є ароматичний цикл, який може мати замісник(и), гетероцикл, який може мати замісник(и), або аліфатичний цикл, який може мати замісник(и); -Х-, -Y- та -Z- можуть бути однаковими або різними, і кожний з них, незалежно від інших, є -O-, -NH-, -NR5-, -S-, -SO-, -SO2-, -СН2-, CR6R7- або -СО-, де R5 є нижчий алкіл або ацил, який може мати замісник(и), R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил, за умови, що згаданий(-і) замісник(и) вибраний(-і) із групи, до якої входять атоми галоїдів, гідроксил, алкіли, арили, меркаптогрупа, алкоксигрупи, алкілтіогрупи, алкілсульфоніли, ацили, ацилоксигрупи, аміногрупа, алкіламіногрупи, карбоксил, алкоксикарбоніли, карбамоїли, нітрогрупа, ціан та трифторметил. 13. Засіб для підвищення здатності до переносу цукру, який містить як активний інгредієнт лактам або його фармацевтично прийнятну сіль за будьяким із пп.1-10. 14. Гіпоглікемічний засіб, який містить як активний інгредієнт лактам або його фармацевтично прийнятну сіль за будь-яким із пп.1-12. 15. Засіб для профілактики та/або лікування діабету, периферичної діабетичної невропатії, діабетичної нефропатії, діабетичної ретинопатії, діабетичної макроангіопатії, порушеної толерантності до глюкози або ожиріння, який містить як активний інгредієнт лактам або його фармацевтично прийнятну сіль за будь-яким із пп.1-12. 16. Фармацевтична композиція, яка містить як активний інгредієнт лактам або його фармацевтично прийнятну сіль за будь-яким із пп.1-10. 7 Цей винахід стосується лактамів та засобу для лікування діабету, який містить один або кілька згаданих лактамів як активний інгредієнт. Лікування діабету типу II лікарськими засобами застосовується у випадках, коли дієтичне лікування або застосування фізичних вправ не забезпечують достатнього поліпшення стану хворого. Розроблено фармацевтичні препарати, що містять інсулін, який є ендогенним гормоном, для регулювання гіпоглікемічної функції, а також гіпоглікемічні засоби для перорального застосування, які прискорюють секрецію інсуліну або поліпшують периферичну стійкість до інсуліну. На цей час основний спосіб медикаментозного лікування діабету типу II включає застосування перорального гіпоглікемічного засобу для ефективного регулювання рівня цукру в крові. Однак у разі, якщо неможливо досягнути ефекту, подібного до дії інсуліну, достатнього для регулювання цукру в крові, то застосовують, головним чином, інсулінову терапію. З іншого боку, інсулінова терапія є єдиним способом лікування хворих на діабет типу І, оскільки в них утрачена здатність до секреції інсуліну. Хоча, таким чином, інсулінова терапія є важливим способом лікування, застосування ін'єкцій викликає утруднення, пов'язані зі складністю техніки лікування та з необхідністю спеціального навчання пацієнта. У зв'язку з цим існує гостра потреба у вдосконаленні способу вживання лікарського засобу з точки зору зручності його застосування. Останнім часом робилися спроби розробити способи застосування інсуліну у формі неін'єкційних препаратів замість інсулінових ін'єкцій. Однак ці способи не застосовуються у практиці з причини низької ефективності засвоєння або непостійності засвоєння. Одною з важливих гіпоглікемічних функцій інсуліну є підвищення здатності периферичних клітин до переносу цукру з метою введення цукру з крові у клітини і, як наслідок, зниження рівня цукру в крові. Винайдення нового придатного для перорального вживання лікарського засобу, здатного зменшити рівень цукру в крові шляхом підвищення здатності периферичних клітин до переносу цукру, дало б можливість розробити сприятливий для хворих спосіб лікування. Однак такі лікарські засоби досі не розроблені. З іншого боку, стосовно до лактамів, у матеріалах, опублікованих у [Хим.-Фарм. Журн. 25(11) (1991) та в Pharmaceutical Chemical Journal 25(11), 768 (1991)], розкрито сполуки загальної формули (І), представленої нижче, де В є бензольний цикл, кожний з -X- та -Y- є -NH-, -Z- є -СН2- -W- є -NH- і A(R2)(R3)(R4) є феніл, 4-бромфеніл, 4гідроксифеніл, 4-метоксифеніл, 2-гідроксифеніл, 3,4-диметоксифеніл або 3-метокси-4гідроксифеніл. Повідомляється, що ці сполуки не мають седативної, протиспазматичної або кардіотонічної дії. В публікаціях [Journal of the Pharmaceutical Society of Japan, 715-20 (1986) та Chem. Pharm. Bull., 3724-9 (1984)] розкрито сполуки загальної формули (І), представленої нижче, де В є бензольний цикл, -X- є -NH-, -Z- є -CR6R7-, -W-є -NH- і 76969 8 кожний з R6 та R7 є метил. Указано, що ці сполуки виявляють слабкий аналгетичний ефект. В публікації [Synthesis, 937-8 (1987)] розкрито сполуку загальної формули (І), представленої нижче, де В є бензольний цикл, -X- є -NH-, -Z- є -CO-, -W- є -NR1- і R1 є п-толіл. Активність цієї сполуки, однак, не описана у вказаній публікації. В публікації [Journal of the Pharmaceutical Society of Japan, 1004-8 (1984)] розкрито сполуки загальної формули (І), представленої нижче, де В є бензольний цикл, -X- є -NH-, -Y- є -S-, -Z- є CR6R7-, -W- є -NH- і кожний з R6 та R7 є метил. Указано, що ці сполуки виявляють слабкий стерилізуючий ефект. В публікації [Journal of Organic Chemistry, 4367-70 (1983)] розкрито сполуку загальної формули (І), представленої нижче, де В є бензольний цикл, -X- є -NH-, -Y- є -S-, -Z- є -СН2- і -W- є -О-. Активність цієї сполуки, однак, не описана у вказаній публікації. Метою цього винаходу є запропонувати новий засіб для терапії діабету, який має високу терапевтичну ефективність та слабкі побічні ефекти. Іншою метою цього винаходу є запропонувати засіб для підвищення здатності до переносу цукру. Ще однією метою цього винаходу є запропонувати гіпоглікемічний засіб. Далі, метою цього винаходу є запропонувати засіб для профілактики та/або лікування діабету, периферичної діабетичної невропатії, діабетичної нефропатії, діабетичної ретинопатії, діабетичної макроангіопатії, порушеної толерантності до глюкози або ожиріння. Ще однією метою цього винаходу є запропонувати нові лактами. Ще іншою метою цього винаходу є запропонувати фармацевтичну композицію. Після інтенсивних досліджень, виконаних із метою винайдення сполук, які спричиняють підвищення здатності до переносу цукру та є корисними для лікування діабету, автори цього винаходу виявили сполуки поданої нижче загальної формули (І). В основу винаходу покладено цей факт. Конкретно, цей винахід пропонує засіб для підвищення здатності до переносу цукру, який містить як активний інгредієнт лактам(и) поданої нижче загальної формули (І) або його (їхні) фармацевтично прийнятну (-і) сіль (солі): де А є ароматичний цикл, гетероцикл або аліфатичний цикл; R2, R3 та R4 можуть бути однаковими або різними, і кожний з них, незалежно від інших, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкіл сульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламі 9 ногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан, трифторметил, алкеніл, який може мати замісник(и), алкініл, який може мати замісник(и), арил, який може мати замісник(и), гетероарил, який може мати замісник(и), бензилоксигрупа, яка може мати замісник(и), арилоксигрупа, яка може мати замісник(и), гетероарилоксигрупа, яка може мати замісник(и), ариламіногрупа, яка може мати замісник(и), арилвініл, який може мати замісник(и), або арилетиніл, який може мати замісник(и); В є ароматичний цикл, який може мати замісник(и), гетероцикл, який може мати замісник(и), або аліфатичний цикл, який може мати замісник(и); -Х-, -Y- та -Z- можуть бути однаковими або різними, і кожний з них, незалежно від інших, є -О-, -NH-, -NR5-, -S-, -SO-, -SO2-, -CH2-, CR6R7- або -СО-, де R5 є нижчий алкіл, який може мати замісник(и), ацил, який може мати замісник(и), алкоксикарбоніл, який може мати замісник(и), карбамоїл, який може мати замісник(и), або сульфоніл, який може мати замісник(и), R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, який може мати замісник(и), меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; -W- є NR1-, -О- або -CR8R9-, де R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и), і R8 та R9 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; і кожний з символів а, b, та с вказує положення атома вуглецю, за умови, що: (і) згаданий(-і) замісник(и) вибраний(-і) із групи, до якої входять атоми галоїдів, гідроксил, алкіли, арили, меркаптогрупа, алкоксигрупи, алкілтіогрупи, алкілсульфоніли, ацили, ацилоксигрупи, аміногрупа, алкіламіногрупи, карбоксил, алкоксикарбоніли, карбамоїли, нітрогрупа, ціан, трифторметил,) та гетероарили. Цей винахід пропонує також нові лактами вищезазначеної формули (І), де: (іі) якщо В є бензольний цикл, кожний з -X- та Y- є -NH-, -Z- є –СН2-та -W- є -NH-, то A(R2)(R3)(R4) не може бути фенілом, 4-бромфенілом, 4гідроксифенілом, 4-метоксифенілом, 2гідроксифенілом, 3,4-диметоксифенілом або 3метокси-4-гідроксифенілом; (ііі) якщо В є бензольний цикл, -X- є -NH-, -Z- є -CR6R7- і -W- є -NH-, то кожний з R6 та R7 не може бути метилом; (iv) якщо В є бензольний цикл, -X- є -NH-, -Z- є -CO- і -W- є -NR1-, то R1 не може бути п-толілом; (v) якщо В є бензольний цикл, -X- є -NH-, -Y- є -S-, -Z- є -CR6R7- і -W-є -NH-, то кожний з R6 та R7 не може бути метилом; і (vi) якщо В є бензольний цикл, -X- є -NH-, -Y- є -S- і -Z- є -СН2-, то -W- не може бути -О-, 76969 10 або фармацевтично прийнятними солями таких сполук. Цей винахід пропонує також гіпоглікемічний засіб, а також засіб для профілактики та/або лікування діабету, периферичної діабетичної невропатії, діабетичної нефропатії, діабетичної ретинопатії, діабетичної макроангіопатії, порушеної толерантності до глюкози або ожиріння, який містить як активний інгредієнт описаний (-і) вище лактам(и) або його (їхні) фармацевтично прийнятну (і) сіль (солі). Оптимальний варіант здійснення винаходу Нижче подано детальний опис цього винаходу. Термін "ефект підвищення здатності до переносу цукру" у значенні, вживаному в цьому описі, означає ефект підвищення здатності до перенесення цукру через біологічну мембрану. Цей ефект охоплює як перенесення цукру із зовнішньої сторони біологічної мембрани до її внутрішньої сторони, так і перенесення із внутрішньої сторони біологічної мембрани до її зовнішньої сторони. Конкретно, цей ефект включає, наприклад, створюваний інсуліном ефект посилення перенесення глюкози в клітини м'язів та жирової тканини. Цукри, що підлягають переносу, означають пентози та гексози, присутні в живому організмі, наприклад, глюкозу, манозу, арабінозу, галактозу та фруктозу. У варіанті, якому віддається перевага, цукор є глюкозою. Термін "нижчий (-і) алкіл(и)" у значенні, вживаному в цьому описі, означає алкіл лінійної, розгалуженої або циклічної будови, який містить від 1 атому до 6 атомів вуглецю, у варіанті, якому віддається перевага, від 1 атому до 3 атомів вуглецю. До таких алкілів належать, наприклад, метил, етил, н-пропіл, н-бутил, н-пентил, н-гексил, ізопропіл, ізобутил, втор-бутил, трет-бутил, ізопентил, трет-пентил, неопентил, 2-пентил, 3-пентил, 3гексил, 2-гексил, циклопропіл, циклобутил, циклопентил та циклогексил. Перевага серед нижчих алкілів віддається метилу, етилу тощо. Термін "арил(и)" у значенні, вживаному в цьому описі, означає моноциклічний або біциклічний ароматичний замісник, який складається з 5-12 вуглецевих атомів, наприклад, феніл, інденіл, нафтил та флуореніл. Перевага серед арилів віддається фенілу. Термін "атом(и) галоїду(-ів)" охоплює атоми фтору, хлору, брому та йоду. Термін "алкіл(и)" у значенні, вживаному в цьому описі, означає алкіл лінійної, розгалуженої або циклічної будови, який містить від 1 до 18 вуглецевих атомів, наприклад, метил, етил, н-пропіл, нбутил, н-пентил, н-гексил, н-гептил, н-октил, нноніл, н-децил, н-ундецил, н-додецил, ізопропіл, ізобутил, втор-бутил, трет-бутил, ізопентил, третпентил, неопентил, 2-пентил, 3-пентил, 3-гексил, 2-гексил, трет-октил, циклопропіл, циклобутил, циклопентил, циклогексил та 1-адамантил. Алкілами, яким віддається перевага, є н-гексил, нгептил, н-октил, н-ноніл, н-децил, н-ундецил, ндодецил, ізопропіл, ізобутил, втор-бутил, третбутил, ізопентил, трет-пентил, неопентил, 2пентил, 3-пентил, 3-гексил, 2-гексил, трет-октил, циклопропіл, циклобутил, циклопентил, циклогек 11 сил, 1-адамантил тощо. Більша перевага серед алкілів віддається ізопропілу, трет-бутилу, третоктилу, 1-адамантилу тощо. Термін "алкеніл(и)" у значенні, вживаному в цьому описі, означає алкеніл лінійної, розгалуженої або циклічної будови, який містить від 1 до 6 вуглецевих атомів, наприклад, вініл, 1-пропеніл, 2пропеніл, ізопропеніл, 1-бутеніл, 2-бутеніл та 3бутеніл. Термін "алкініл(и)" означає алкініл лінійної або розгалуженої будови, який містить від 1 до 6 вуглецевих атомів, наприклад, етиніл, 1-пропініл, 2-пропініл, 1-бутиніл, 2-бутиніл та 3-бутиніл. Термін "алкоксигрупа(-и)" у значенні, вживаному в цьому описі, означає алкоксигрупу лінійної, розгалуженої або циклічної будови, яка містить від 1 до 18 вуглецевих атомів, у варіанті, якому віддається перевага, від 1 до 8 вуглецевих атомів, наприклад, метоксигрупу, етоксигрупу, нпропоксигрупу, н-бутоксигрупу, н-пентилоксигрупу, н-гексилоксигрупу, н-гептилоксигрупу, ноктилоксигрупу, н-нонілоксигрупу, ндецилоксигрупу, н-ундецилоксигрупу, ндодецилоксигрупу, ізопропоксигрупу, ізобутоксигрупу, втор-бутоксигрупу, трет-бутоксигрупу, циклопропоксигрупу, циклобутоксигрупу, циклопентилоксигрупу, циклогексилоксигрупу, циклогептилоксигрупу, 2-циклогексилетоксигрупу, 1-адамантилоксигрупу, 2-адамантилоксигрупу, 1адамантилметилоксигрупу, 2-(1адамантил)етилоксифупу та трифторметоксигрупу. Алкоксигрупами, яким віддається перевага, є метоксигрупа, етоксигрупа, н-пропоксигрупа, ізопропоксигрупа, н-бутоксигрупа, трет-бутоксигрупа, н-пентилоксигрупа та н-гексилоксигрупа. Термін "алкілтіогрупа(-и)" у значенні, вживаному в цьому описі, означає алкілтіогрупу лінійної, розгалуженої або циклічної будови, яка містить від 1 до 12 вуглецевих атомів, у варіанті, якому віддається перевага, від 1 до 6 вуглецевих атомів, наприклад, метилтіогрупу, етилтіогрупу, нпропілтіогрупу, ізопропілтіогрупу, н-бутилтіогрупу, ізобутилтіогрупу, вгор-бутилтіогрупу, третбутилтіогрупу, циклопропілтіогрупу, циклобутилтіогрупу, циклопентилтіогрупу. Термін "алкілсульфоніл(и)" у значенні, вживаному в цьому описі, означає алкілсульфоніл, який містить алкіл лінійної, розгалуженої або циклічної будови, що включає від 1 до 12 вуглецевих атомів, наприклад, метансульфоніл, етансульфоніл, пропансульфоніл, бутансульфоніл, пентансульфоніл, гексансульфоніл, гептансульфоніл, октансульфоніл, нонансульфоніл, декансульфоніл, ундекансульфоніл та додекансульфоніл. Термін "ацил(и)" у значенні, вживаному в цьому описі, означає форміл, ацил, який містить алкіл лінійної, розгалуженої або циклічної будови, що включає від 1 до 6 вуглецевих атомів, ацил, який містить алкеніл лінійної, розгалуженої або циклічної будови, що включає від 1 до 6 вуглецевих атомів, ацил, який містить алкініл лінійної, розгалуженої або циклічної будови, що включає від 1 до 6 вуглецевих атомів, або ацил, який містить арил, який може бути заміщеним, наприклад, форміл, ацетил, пропіоніл, бутирил, ізобутирил, валерил, ізовалерил, півалоїл, гексаноїл, акрилоїл, метак 76969 12 рилоїл, кротоноїл, ізокротоноїл, бензоїл та нафтоїл. Термін "ацилоксигрупа(-и)" у значенні, вживаному в цьому описі, означає формілоксигрупу, ацилоксигрупу, яка містить алкіл лінійної, розгалуженої або циклічної будови, що включає від 1 до 6 вуглецевих атомів, або ацилоксигрупу, яка містить арил, який може бути заміщеним, наприклад, формілоксигрупу, ацетилоксигрупу, пропіонілоксигрупу, бутирилоксигрупу, ізобутирилоксигрупу, валерилоксигрупу, ізовалерилоксигрупу, півалоїлоксигрупу, гексаноїлоксигрупу, акрилоїлоксигрупу, метакрилоїлоксигрупу, кротоноілоксигрупу, ізокротоноїлоксигрупу, бензоїлоксигрупу та нафтоїлоксигрупу. Термін "алкіламіногрупа(-и)" у значенні, вживаному в цьому описі, означає аміногрупу, моноабо дизаміщену алкілом(-ами). Прикладами алкілів є групи, перелічені вище при визначенні терміну "алкіл". До алкіламіногруп належать, наприклад, аміногрупа, метиламіногрупа, етиламіногрупа, пропіламіногрупа, ізопропіламіногрупа, диметиламіногрупа, діетиламіногрупа, дипропіламіногрупа, діізопропіламіногрупа та метилетиламінофупа. Перевага віддається алкіламіногрупам, які містять від 1 до 6 вуглецевих атомів. Термін "алкоксикарбоніл(и)" у значенні, вживаному в цьому описі, означає алкоксикарбоніл, який містить алкіл лінійної, розгалуженої або циклічної будови, що включає від 1 до 8 вуглецевих атомів, наприклад, метоксикарбоніл, етоксикарбоніл, пропоксикарбоніл, ізопропоксикарбоніл, нбутоксикарбоніл, ізобутоксикарбоніл, вторбутоксикарбоніл, трет-бутоксикарбоніл та бензилоксикарбоніл. Термін "карбамоїл(и)" у значенні, вживаному в цьому описі, означає карбамоїл, який може мати при атомі азоту алкіл лінійної, розгалуженої або циклічної будови, що включає від 1 до 6 вуглецевих атомів, наприклад, карбамоїл, Nметилкарбамоїл, N-етилкарбамоїл, N,Nдиметилкарбамоїл, N-піролідилкарбоніл, Nпіперидилкарбоніл та N-морфолінілкарбоніл. Термін "сульфоніл(и)" у значенні, вживаному в цьому описі, означає сульфоніл, який може мати при атомі сірки алкіл лінійної, розгалуженої або циклічної будови, що включає від 1 до 6 вуглецевих атомів, наприклад, метилсульфоніл, етилсульфоніл, пропілсульфоніл та бутилсульфоніл. Термін "ароматичний(-і) цикл(и)" у значенні, вживаному в цьому описі, означає моноциклічну або біциклічну ароматичну систему, що складається з вуглецевих атомів, наприклад, бензол, нафталін, інден або флуорен. Перевага віддається бензолу, нафталіну тощо. Термін "гетероцикл(и)" у значенні, вживаному в цьому описі, означає гетероциклічну систему, що складається з 1-3 циклів, кожний з яких містить 5-7 членів, наприклад, атомів вуглецю та азоту, кисню, сірки тощо. До таких систем належать, наприклад, піридин, дигідропіран, піридазин, піримідин, піразин, пірол, фуран, тіофен, оксазол, ізоксазол, піразол, імідазол, тіазол, ізотіазол, тіадіазол, піролідин, піперидин, піперазин, індол, ізоіндол, бензофуран, ізобензофуран, бензотіофен, бензо 13 піразол, бензімідазол, бензоксазол, бензотіазол, пурин, піразолопіридин, хінолін, ізохінолін, нафтиридин, хіназолін, бензодіазепін, карбазол та дибензофуран. Гетероциклічними системами, яким віддається перевага, є піридин, піримідин, піридазин, фуран та тіофен. Гетероциклічними системами, яким віддається більша перевага, є піридин, піримідин та тіофен. Термін "аліфатичний(-і) цикл(и)" у значенні, вживаному в цьому описі, означає аліфатичну моноциклічну або біциклічну систему, що складається з вуглецевих атомів, наприклад, циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, декалін та норборнан. Аліфатичним циклом, якому віддається перевага, є циклогексан. Термін "гетероарил(и)" у значенні, вживаному в цьому описі, означає гетероарильний(-і) замісник(и), що складається з 1-3 циклів, кожний з яких містить 5-7 членів, котрими є атоми вуглецю та азоту, кисню, сірки тощо, наприклад, піридил, піридазиніл, піримідиніл, піразиніл, піроліл, фураніл, тієніл, оксазоліл, ізоксазоліл, піразоліл, імідазоліл, тіазоліл, ізотіазоліл, тіадіазоліл, індоліл, ізоіндоліл, бензофурил, ізобензофурил, бензотієніл, бензопіразоліл, бензімідазоліл, бензоксазоліл, бензотіазоліл, хіноліл, ізохіноліл, нафтилідиніл та хіназоліл. Гетероарилами, яким віддається перевага, є 2-піридил, 3-піридил, 4-піридил та 1-піразоліл. Термін "арилоксигрупа(-и)" у значенні, вживаному в цьому описі, означає групу, яка містить арил при атомі кисню. Прикладами арилів є групи, перелічені вище при визначенні терміну "арил(и)". Прикладами арилоксигруп є феноксигрупа, 1нафтилоксигрупа та 2-нафтилоксигрупа. Термін "гетероарилоксигрупа(-и)" у значенні, вживаному в цьому описі, означає групу, яка містить гетероарил при атомі кисню. Прикладами гетероарилів є групи, перелічені вище при визначенні терміну "гетероарил(и)". Прикладами гетероарилоксигруп є 2-піридилоксигрупа, 3піридилоксигрупа, 4-піридилоксигрупа та 2піримідинілоксигрупа. Термін "ариламіногрупа(-и)" у значенні, вживаному в цьому описі, означає групу, яка містить арил при атомі азоту. Прикладами арилів є групи, перелічені вище при визначенні терміну "арил(и)". Прикладами ариламіногруп є феніламіногрупа, 1нафтиламіногрупа та 2-нафтиламіногрупа. Арилвінілами є вініли, заміщені арилами в положеннях 1 або 2. Прикладами арилів є групи, перелічені вище при визначенні терміну "арил(и)". Прикладами арилвінілів є 1-фенілвініл та 2фенілвініл. Арилетинілами є етиніли, заміщені арилами в положенні 2. Прикладами арилів є групи, перелічені вище при визначенні терміну "арил(и)". Прикладом арилетинілу є фенілетиніл. Вираз "який може мати замісник(и)" в цьому описі означає, що група не має замісників або, в разі, якщо група є заміщеною, то замісником(-ами) є щонайменше одна з груп, перелічених вище при визначенні формули (І). Замісники можуть бути однаковими або різними. Положення та кількість замісників конкретно не обмежені. 76969 14 Серед лактамів або їхніх фармацевтично прийнятних солей згідно з п.1 перевага віддається сполукам загальної формули (І), де символи мають перелічені нижче значення: 1 R є у варіанті, якому віддається перевага, атом водню, метил, бензил або метоксикарбонілметил, особлива перевага віддається сполукам, де R1 є атом водню або метил. Кожний з R2, R3 та R4 є у варіанті, якому віддається перевага, атом водню, атом галоїду, гідроксил, алкіл, алкоксигрупа, ацил, ацилоксигрупа, аміногрупа, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан, трифторметил, арил, який може мати замісник(и), гетероарил, який може мати замісник(и), бензилоксигрупа, арилоксигрупа, яка може мати замісник(и), або арилетиніл, який може мати замісник(и); більша перевага віддається сполукам, де кожний з R2, R3 та R4 є атом водню, атом галоїду, гідроксил, метил, етил, пропіл, ізопропіл, метоксигрупа, етоксигрупа, н-пропоксигрупа, ізопропоксигрупа, н-бутоксигрупа або бензилоксигрупа; ще більша перевага віддається сполукам, де кожний з R2, R3 та R4 є атом водню, атом галоїду, метил, етил або етоксигрупа. -X- є у варіанті, якому віддається перевага, NH-, -NR5-, де R5 є нижчий алкіл, -S- або -СН2-, більша перевага віддається сполукам, де -X- є NH-, -NMe-. -Y- є у варіанті, якому віддається перевага, NH- або -NR5-, де R5 є ацил, який може мати замісник(и), алкоксикарбоніл, який може мати замісник(и), карбамоїл, який може мати замісник(и), або сульфоніл, який може мати замісник(и), або -О-; більша перевага віддається сполукам, де -Y- є NR5-, де R5 є ацил, який може мати замісник(и), алкоксикарбоніл, який може мати замісник(и), або карбамоїл, який може мати замісник(и), ще більша більша перевага віддається сполукам, де -Y- є NAc-, -N(COCH2CH3)-, -N(COCH2CF3)-, N(COCF2CF3)-, -N(COCH2OEt)-, -N(COCH2OH)-, N(COOMe)- або -N(COOEt)-. -Z- є у варіанті, якому віддається перевага, NH- або -СН2-, у варіанті, якому віддається більша перевага, -Z- є -СН2-. -W- є у варіанті, якому віддається перевага, NH-, -NR1-, де R1 є нижчий алкіл, або -СН2-, у варіанті, якому віддається більша перевага, -W- є -NHабо -NMe-. А є у варіанті, якому віддається перевага, ароматичний цикл або гетероцикл. Більша перевага віддається сполукам, де А є бензол, піридин, піримідин або тіофен. У варіанті, якому віддається ще більша перевага, А є бензол. В є у варіанті, якому віддається перевага, ароматичний цикл, який може мати замісник(и), або аліфатичний цикл, який може мати замісник(и). Більша перевага віддається сполукам, де В є бензол, який може мати замісник(и), або циклогексан, який може мати замісник(и). У варіанті, якому віддається ще більша перевага, В є циклогексан, який може мати замісник(и). Якщо В є циклогексан, який може мати замісник(и), то перевага віддається абсолютній конфігурації R або S вуглецевих атомів у положеннях а та b, а більша перевага - конфігурації R. 15 В цьому винаході перевага віддається сполукам, де R5 є нижчий алкіл або ацил, який може мати замісник(и), де R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, арил, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкіл сульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил, і де -W- є -NR1-. В цьому винаході перевага віддається також сполукам, де -X- та -Y- в загальній формулі (І) можуть бути однаковими або різними, і кожний з них є -NH- або -NR5-, де R5 є нижчий алкіл, який може мати замісник(и), ацил, який може мати замісник(и), алкоксикарбоніл, який може мати замісник(и), карбамоїл, який може мати замісник(и), або сульфоніл, який може мати замісник(и), де -Z- є СН2- або -CR6R7-, R6 та R7 можуть бути однаковими або різними, і кожний з них, незалежно від іншого, є атом водню, атом галоїду, гідроксил, алкіл, меркаптогрупа, алкоксигрупа, алкілтіогрупа, алкілсульфоніл, ацил, ацилоксигрупа, аміногрупа, алкіламіногрупа, карбоксил, алкоксикарбоніл, карбамоїл, нітрогрупа, ціан або трифторметил; де -W- є -NR1-, де R1 є атом водню, нижчий алкіл, який може мати замісник(и), або арил, який може мати замісник(и). Коли сполуки згідно з цим винаходом мають досить кислотний характер, до їхніх фармацевтично прийнятних солей належать солі амонію, солі лужних металів (наприклад, у варіанті, якому віддається перевага, натрію та калію), солі лужноземельних металів (наприклад, у варіанті, якому віддається перевага, кальцію та магнію) та солі органічних основ, наприклад, дициклогексиламіну, бензатину, N-метил-D-глюкану, гідраміну та амінокислот, наприклад, аргініну та лізину. Коли сполуки згідно з цим винаходом мають досить основний характер, до їхніх фармацевтично прийнятних солей належать солі кислот, що утворюються з неорганічними кислотами, наприклад, із хлористоводневою кислотою, сірчаною кислотою, азотною кислотою та фосфорною кислотою, або з органічними кислотами, наприклад, з оцтовою кислотою, молочною кислотою, лимонною кислотою, винною кислотою, малеїновою кислотою, фумаровою кислотою, та монометилсірчаною кислотою. В разі необхідності солі можуть бути кислими або гідратними. Цей винахід охоплює всі ізомери, наприклад, оптичні та геометричні ізомери, гідрати, сольвати та кристалічні форми згаданих сполук. В такому разі перевага віддається сполукам, де вуглецеві атоми, позначені в загальній формулі (І) символами a, b та с, мають незалежно один від одного абсолютну конфігурацію R або S. Перевага віддається також сполукам, де вуглецеві атоми, позначені в загальній формулі (І) символами а та b, мають абсолютну конфігурацію R, а вуглецевий атом с має абсолютну конфігурацію R або S. Крім того, перевага віддається також сполукам, де вуглецеві атоми, позначені в загальній формулі (І) символами а та b, мають абсолютну конфігурацію S, а вуг 76969 16 лецевий атом с має абсолютну конфігурацію R або S. Сполуки згідно з цим винаходом можна синтезувати способами, описаними нижче. Наприклад, сполуки формули (І) згідно з цим винаходом, де -W- є -NH-, -Z- є –CH2-, кожний з -Xта -Y- є -NH- і кожний з А та В є бензольний цикл, можна синтезувати шляхом конденсації тетрамової кислоти (II) з 1,2-фенілендіаміном (III) з одержанням єнаміну (IV) і введення цієї сполуки (IV) у реакцію з відповідним альдегідом (V), як показано нижче: де кожний з R та R' є замісник при бензольному циклі. Сполуки формули (VII), де аміногрупа в положенні 4 заміщена алкілом, можна синтезувати з використанням N-заміщеного 1,2-фенілендіаміну (III'), як показано нижче: де кожний з R та R' є замісник при бензольному циклі, a R" є замісник при аміногрупі в положенні 4. Сполуки формули (VIII), де аміногрупа в положенні 9 заміщена алкілом або ацилом, можна синтезувати шляхом алкілування або ацилювання сполук формули (VI), як показано нижче: де кожний з R та R' є замісник при бензольному циклі, R" є алкіл або ацил, котрий є замісником при аміногрупі в положенні 9, а X є рухома група, наприклад, атом галоїду. Сполуки формули (І) згідно з цим винаходом, де -W- є -NH-, -Z- є -СН2-, -X- є -NH-, -Y- є -NAc-, А є бензольний цикл, а В є циклогексановий цикл, можна синтезувати шляхом конденсації тетрамової кислоти (II) з 1,2-циклогександіаміном (III"), введення одержаної сполуки в реакцію з відповідним альдегідом (V) з одержанням циклічної сполуки (X) і ацетилування цієї сполуки (X) звичайним способом з одержанням сполуки (XI). Сполуки, де Y- є ацил, відмінний від -NAc-, можна синтезувати способом, описаним вище, або шляхом використання хлорангідриду кислоти, конденсувального агента тощо. Сполуки (XI) можна синтезувати також шляхом діацилування циклічних сполук (X) у сполуки (XII) 17 надлишком ангідриду кислоти або аналогічного агента і селективного відщеплення ацилу в положенні 4 у присутності основи, наприклад, карбонату калію: де R є замісник при бензольному циклі. Сполуки вищезазначеної загальної формули, де -Y- є -NR5, де R5 є алкоксикарбоніл, можна синтезувати з використанням відповідного алкілхлоркарбонату, як показано нижче в схемі а). Сполуки вищезазначеної загальної формули, де -Y- є -NR5, де R5 є карбамоїл, можна синтезувати з використанням відповідного ізоціанату, як показано нижче в схемі b). Сполуки вищезазначеної загальної формули, де -Y- є -NR5, де R5 є сульфоніл, можна синтезувати з використанням відповідного сульфонілхлориду, як показано нижче в схемі с). 76969 18 вати шляхом конденсації тетрамової кислоти (II) із 2-амінофенолом (XIX) з одержанням єнаміну (XX) і введення цієї сполуки в реакцію з відповідним альдегідом (V): де кожний з R та R' є замісник при бензольному циклі. Сполуки формули (І) згідно з цим винаходом, де -W- є -NH-, -Z- є -NH-, -X- є -СН2-, -Y- є -NH- і кожний з А та В є бензольний цикл, можна синтезувати шляхом реакції 5-(2-амінофеніл)метил-1,2дигідропіразол-3-ону (XXII), [Journal of Heterocyclic Chemistry, 71-5 (1989)], з альдегідом (V), як показано нижче: де кожний з R та R' є замісник при бензольному циклі. Тетрамову кислоту, використовувану як вихідний матеріал, можна синтезувати показаним нижче способом або відомим способом, описаним у [Journal of Chemical Society, Perkin Trans., 1, 2907 (1973)]: де R є замісник при бензольному циклі. Сполуки формули (І) згідно з цим винаходом, де -W- є -NH-, -Z- є -СН2-, -X- є -S-, -Y- є -NH- і кожний з А та В є бензольний цикл, можна синтезувати шляхом конденсації тетрамової кислоти (II) з 2амінотіофенолом (XVI) з одержанням сульфіду (XVII) і введення цієї сполуки в реакцію з відповідним альдегідом (V): де кожний з R та R' є замісник при бензольному циклі. Сполуки формули (І) згідно з цим винаходом, де -W- є -NH-, -Z- є -СН2-, -X- є -NH-, -Y- є -О- і кожний з А та В є бензольний цикл, можна синтезу Альдегіди можна синтезувати добре відомим способом або іншим способом, розробленим на його основі. Сполуки згідно з цим винаходом можна синтезувати за вищенаведеними схемами реакцій, як показано у Прикладах, поданих нижче. Сполуки згідно з цим винаходом, одержані описаними вище способами, можна очищати різними методами очищення, які звичайно застосовуються в галузі синтезу органічних сполук, наприклад, екстракцією, дистиляцією, кристалізацією та хроматографією на колонках. Сполуки згідно з цим винаходом викликають ефект підвищення здатності до переносу цукру і є корисними при лікуванні пацієнтів за рахунок використання цього ефекту. Особливо, ці сполуки є корисними як засоби для профілактики та/або лікування діабетів, периферичної діабетичної невропатії, діабетичної нефропатії, діабетичної рети 19 нопатії, діабетичної макроангіопатії, порушеної толерантності до глюкози або ожиріння, оскільки вони здатні спричинити зниження рівня цукру у крові за рахунок підвищення здатності до переносу цукру. При застосуванні сполук згідно з цим винаходом як засоби для профілактики та/або лікування діабету, периферичної діабетичної невропатії, діабетичної нефропатії, діабетичної ретинопатії, діабетичної макроангіопатії, порушеної толерантності до глюкози або ожиріння, їх можна вводити в організм пероральним, внутрішньовенним або черезшкірним шляхом. Дози цих сполук, які варіюють залежно від симптомів захворювання, віку пацієнта та способу введення в організм, звичайно становлять від 0,001мг/кг до 1000мг/кг на день. Сполуки згідно з цим винаходом можна вводити до складу фармацевтичних препаратів звичайними способами. Дозованими формами фармацевтичних препаратів є, наприклад, препарати для ін'єкцій, таблетки, гранули, мікрогранули, порошки, капсули, креми та супозиторії. Носіями в таких препаратах є, наприклад, лактоза, глюкоза, Dманіт, крохмаль, кристалічна целюлоза, карбонат кальцію, каолін, желатин, гідроксипропілцелюлоза, гідроксипропілметилцелюлоза, полівінілпіролідон, етанол, карбоксиметилцелюлоза, кальцієва сіль карбоксиметилцелюлози, стеарат магнію, тальк, ацетилцелюлоза, цукор-рафінад, оксид титану, бензойна кислота, складні ефіри парагідроксибензойної кислоти, дегідроацетат натрію, аравійська камедь, трагакант, метилцелюлоза, яєчний жовток, поверхнево-активні речовини, сироп, лимонна кислота, дистильована вода, гліцерин, пропіленгліколь, макрогол, динатрійгідрофосфат, натрійдигідрофосфат, фосфат натрію, хлорид натрію, фенол, тимеросал та гідросульфіт натрію. Носій добирають залежно від форми препарату і змішують зі сполукою згідно з цим винаходом. Уміст активного інгредієнта згідно з цим винаходом у препараті згідно з цим винаходом не обмежено конкретними значеннями, оскільки він варіює в широких межах залежно від форми препарату. Однак уміст активного інгредієнта становить, як правило, від 0,01% до 100% загальної маси композиції, у варіанті, якому віддається перевага, від 1% до 100%. Приклади Подані нижче Приклади конкретно ілюструють цей винахід, жодним чином не обмежуючи його обсяг. Приклад 1 Стадія 1: Синтез піролідин-2,4-діону (II; тетрамова кислота) Триетиламін (72г, 0,713моль) додавали до розчину (800мл) гідрохлориду етиламіноацетату (54,68г, 0,392моль) у дихлорметані, і охолоджували одержану суміш до 0°С. До суміші додавали крапля за краплею протягом 30хв розчин (100мл) метил-3-хлор-3-оксобутаноату (48,5г, 0,355моль) у дихлорметані. Одержану суміш перемішували при кімнатній температурі ще протягом 4год. Після завершення реакції до реакційної суміші додавали воду (1000мл) для відділення дихлорметанового 76969 20 шару. Після промивання водним розчином хлориду натрію з подальшим висушуванням над безводним сульфатом натрію розчинник випаровували. До залишку додавали метанол (600мл) та активне вугілля (10г), одержану суміш перемішували й фільтрували через шар целіту. Розчинник випаровували. Одержано метил-3етоксикарбонілметиламіно-3-оксобутаноат (66,9г, 93%) у вигляді жовтого масла. 1 H-ЯМР (300МГц, DMSO-d6) =1,17 (3Н, t, J=7,2Гц), 3,30 (2Н, s), 3,60 (ЗН, s), 3,83 (2Н, d, J=5,7Гц), 4,07 (2Н, q, J=7,2Гц), 8,50 (1Н, широкий t). До метил-3-етоксикарбонілметиламіно-3оксобутаноату (66,9г, 0,33моль), одержаного, як описано вище, додавали метанол (40мл) і толуол (400мл). До одержаної суміші додавали крапля за краплею при інтенсивному перемішуванні 28%-ний розчин метилату натрію (70г, 0,363моль) у метанолі і нагрівали при 65°С протягом 1год. Після завершення реакції нейтралізували реакційну суміш 2М хлористоводневою кислотою (185мл, 0,37моль). Одержаний таким чином твердий продукт відділяли фільтруванням і сушили. Одержано 3-метоксикарбонілпіролідин-2,4-діон (39,5г, 0,25моль) у вигляді злегка жовтуватого порошку. 1 H-ЯМР (300МГц, DMSO-d6) =3,62 (3Н, s), 3,82 (2Н, s), 7,50 (1Н, широкий s). До 3-метоксикарбонілпіролідин-2,4-діону (39,5г, 0,25моль), одержаного, як описано вище, додавали 1,4-діоксан (2400мл) і воду (240мл), і суміш нагрівали зі зворотним холодильником протягом 30хв. Після завершення реакції розчинник випаровували. Одержано піролідин-2,4-діон (II; тетрамова кислота) (24,35г, 100%) у вигляді світло-жовтої твердої речовини. 1 Н-ЯМР (300МГц, DMSO-d6) кетонна форма =2,93 (2Н, s), 3,77 (2Н, s), 8,23 (1Н, s), єнольна форма =3,74 (2Н, s), 4,75 (1Н, s), 7,07 (1Н, s), відношення кетон:єнол приблизно 3:2. Стадія 2: Синтез 4-((2-амінофеніл)аміно)-3піролін-2-ону Розчин піролідин-2,4-діону (6,93г, 70ммоль), одержаного на стадії 1, та 1,2-фенілендіаміну (7,88г, 70ммоль) у метанолі перемішували при 60°С протягом 1год. Охолоджували реакційну суміш, і кристали, які утворювалися, відділяли фільтруванням. Одержано 4-((2-амінофеніл)аміно)-3шролін-2-он (вихід 11,6г, 87%). 1 Н-ЯМР (300МГц, DMSO-d6) =3,94 (2Н, s), 4,56 (1Н, s), 4,91 (2Н, широкий s), 6,55 (1Н, dt, J=7,5, 1,5Гц), 6,72 (1Н, dd, J=7,8, 1,5Гц), 6,80 (1Н, s), 6,86 (1Н, dt, J=7,5, 1,5Гц), 7,02 (1Н, dd, J=7,8, 1,5Гц), 8,03 (1Н, s). Мас-спектр (іонізація електронним ударом) (MS (ESI)) m/z 190 (М+Н)+. Стадія 3: Синтез сполуки за Прикладом 1 Розчин 4-((2-амінофеніл)аміно)-3-піролін-2-ону (50мг, 0,26ммоль), одержаного на стадії 2, та 4бензилоксибензальдегіду (61мг, 0,29ммоль) у метанолі (3мл) перемішували в присутності оцтової кислоти як каталізатора (0,01мл) при 70°С протягом 2год. Розчинник випаровували, і додавали до залишку дихлорметан. Твердий продукт, який випадав в осад, відділяли фільтруванням. Одержано сполуку за Прикладом 1 (вихід 60мг, 54%). 21 1 Н-ЯМР (300МГц, DMSO-d6) =3,95 (2Н, s), 4,98 (2Н, s), 4,99 (1Н, d, J=4,2Гц), 5,81 (1Н, d, J=4,2Гц), 6,49-6,69 (3Н, m), 6,74-6,84 (3Н, m), 6,967,05 (3Н, m), 7,23-7,41 (5Н, m), 9,14 (1Н, s). MS + (ESI) m/z 384 (M+H) . Сполуки за Прикладами 2-34 синтезували способом, описаним для стадії 3 Прикладу 1, за тим винятком, що вихідну сполуку замінювали відповідним альдегідом. Альдегіди були придбані на ринку або синтезовані звичайним способом. Приклад 2 Сполука за Прикладом 2 (вихід 75%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-хлорбензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =3,97 (2Н, s), 5,03 (1Н, d, J=4,2Гц), 5,90 (1Н, d, J=4,5Гц), 6,51 (1Н, dd, J=8,1, 1,5Гц), 6,59 (1Н, dt, J=7,5, 1,5Гц), 6,68 (1Н, dt, J=8,4, 2,1Гц), 6,83 (1Н, dd, J=7,5, 1,5Гц), 7,06 (1Н, s), 7,13 (2Н, dd, J=6,6, 1,8Гц), 7,22 (2Н, dd, J=6,6, 1,8Гц), 9,23 (1Н, s). MS (ESI) m/z 312 (M+H)+. Приклад 3 Сполука за Прикладом 3 (вихід 65%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-йодбензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =3,96 (2Н, s), 4,98 (1Н, d, J=4,5Гц), 5,89 (1H, d, J=4,5Гц), 6,51 (1Н, d, J=7,8Гц), 6,59 (1Н, t, J=7,8Гц), 6,67 (1Н, t, J=7,8Гц), 6,82 (1H, d, J=7,8Гц), 6,91 (2H, d, J=7,5Гц), 7,05 (1H, s), 7,51 (2H, d, J=7,5Гц), 9,22 (1H, s). MS (ESI) m/z 404 (M+H)+. Приклад 4 Сполука за Прикладом 4 (вихід 66%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-метилбензальдегіду як вихідної сполуки. 1H-ЯМР (300МГц, DMSO-d6) =2,17 (3Н, s), 3,95 (2Н, s), 5,90 (1Н, d, J=4,5Гц), 5,81 (1H, d, J=4,5Гц), 6,50 (1Н, dd, J=8,1, 1,5Гц), 6,59 (1Н, dt, J=7,5, 1,5Гц), 6,68 (1Н, dt, J=8,4, 2,1Гц), 6,81 (1Н, dd, J=7,5, 1,5Гц), 6,92-7,00 (5Н, m), 9,16 (1Н, s). MS (ESI) m/z 292 (М+Н)+. Приклад 5 Сполука за Прикладом 5 (вихід 34%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-трет-бутилбензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =1,18 (9Н, s), 3,92 (2Н, s), 4,96 (1Н, d, J=4,5Гц), 5,87 (1H, d, J=4,5Гц), 6,53-6,67 (3Н, m), 6,80 (1Н, d, J=7,5Гц), 6,96-7,05 (3Н, m), 7,15 (2Н, d, J=8,4Гц), 9,15 (1Н, s). MS (ESI) m/z 334 (M+H)+. Приклад 6 Стадія 1: Синтез 4-(2-фенілетиніл)бензальдегіду 4-бромбензальдегід (370мг, 2ммоль), фенілацетилен (306мг, 3ммоль) та тетракістрифенілфосфінпаладій (45мг) розчиняли в триетиламіні (4мл), і перемішували одержаний розчин при 80°С в атмосфері аргону протягом 24год. Випаровували розчинник, і очищали продукт хроматографією на колонці із силікагелем. Одержано 4(2-фенілетиніл)бензальдегід (вихід 258мг, 63%). 76969 22 1H-ЯМР (300МГц, CDC13) =7,30-7,40 (3Н, m), 7,50-7,60 (2Н, m), 7,68 (2Н, d, J=8,1Гц), 7,87 (2Н, d, J=8,1Гц), 10,02 (1Н, s). Стадія 2: Синтез сполуки за Прикладом 6 Сполука за Прикладом 6 (вихід 34%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-(2фенілетиніл)бензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =3,99 (2Н, s), 5,06 (1Н, d, J=3,9Гц), 5,94 (1Н, d, J=4,5Гц), 6,506,71 (3Н, m), 6,84 (1Н, d, J=7,5Гц), 7,80 (1Н, s), 7,15 (2H, d, J=8,1Гц), 7,35 (2H, d, J=8,1Гц), 7,38-7,42 (3H, m), 7,48-7,54 (2Н, m), 9,25 (1Н, s). MS (ESI) m/z 334 (M+H)+. Приклад 7 Сполука за Прикладом 7 (вихід 24%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-фенілбензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =3,98 (2Н, s), 5,07 (1Н, d, J=4,2Гц), 5,95 (1Н, d, J=4,2Гц), 6,566,71 (3Н, m), 6,84 (1Н, d, J=6,9Гц), 7,05 (1Н, s), 7,20 (2Н, d, J=8,1Гц), 7,26-7,49 (5Н, m), 7,57 (2Н, d, J=8,1Гц), 9,22 (1Н, s). MS (ESI) m/z 354 (M+H)+. Приклад 8 Стадія 1: Синтез 4-(4-нітрофеніл)бензальдегіду 1М розчин діізобутилалюмінійгідриду в толуолі (1,2мл, 1,22ммоль) повільно додавали до розчину (10мл) 4-(4-нітрофеніл)бензонітрилу (224мг, 1ммоль) у толуолі при кімнатній температурі і перемішували протягом 1год. Після охолодження до 0°С повільно додавали до одержаної суміші метанол (0,4мл) та воду (0,4мл) і перемішували. Сушили реакційну суміш над сульфатом натрію. Після очищення хроматографією на колонці із силікагелем (елюент етилацетат/гексан) одержано 4-(4нітрофеніл)бензальдегід у вигляді твердої речовини жовтого кольору (вихід 127мг, 56%). 1Н-ЯМР (300МГц, CDC13) =7,80 (4Н, d, J=8,7Гц), 8,03 (2Н, d, J=8,4Гц), 8,36 (2Н, d, J=9,0Гц), 10,11 (1Н, s). Стадія 2: Синтез сполуки за Прикладом 8 Сполука за Прикладом 8 (вихід 67%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-(4-нітрофеніл)бензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =3,97 (2Н, s), 5,08 (1H, d, J=4,2Гц), 5,98 (1Н, d, J=4,2Гц), 6,556,70 (3Н, m), 6,84 (1Н, d, J=7,2Гц), 7,05 (1Н, s), 7,25 (2Н, d, J=8,4Гц), 7,59 (2Н, d, J=8,4Гц), 7,87 (2Н, d, J=9,0Гц), 8,23 (2Н, d, J=9,0Гц), 9,24 (1Н, s). MS (ESI) m/z 397 (М-Н)-. Приклад 9 Сполука за Прикладом 9 (вихід 22%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 2-флуоренкарбоксіальдегіду як вихідної сполуки. 1 H-ЯМР (300МГц, DMSO-d6) =3,77 (2Н, s), 4,00 (2Н, s), 5,12 (1H, d, J=4,5Гц), 5,90 (1H, d, J=4,5Гц), 6,50-6,69 (3H, m), 6,84 (1H, d, J=7,5Гц), 7,04 (1H, s), 7,14 (1H, d, J=7,5Гц), 7,21-7,36 (3H, m), 7,51 (1H, d, J=7,5Гц), 7,66 (1H, d, J=7,5Гц), 7,77 (1H, d, J=7,5Гц), 9,21 (1H, s). MS (ESI) m/z 366 (M+H)+. 23 Приклад 10 Сполука за Прикладом 10 (вихід 48%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-бутоксибензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =0,88 (3Н, t, J=7,4Гц), 1,30-1,45 (2Н, m), 1,56-1,68 (2Н, т), 3,84 (2Н, t, J=6,3Гц), 3,95 (2Н, s), 4,98 (1Н, d, J=4,2Гц), 5,79 (1H, d, J=4,2Гц), 6,47-6,84 (6Н, m), 6,93-7,06 (3Н, m), 9,13 (1Н, s). MS (ESI) m/z 350 (M+H)+. Приклад 11 Стадія 1: Синтез 4-додецилоксибензальдегіду 4-гідроксибензальдегід (673мг, 5,5ммоль), 1бромдодекан (1,25г, 5ммоль) і карбонат калію (859мг, 6,22ммоль) додавали до диметилформаміду (3мл) і перемішували при 65°С протягом 18год. Після завершення реакції та екстракції етилацетатом одержано 4-додецилоксибензальдегід (вихід 1,45г, 99%) у вигляді білих кристалів. Стадія 2: Синтез сполуки за Прикладом 11 Сполука за Прикладом 11 (вихід 82%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-додецилоксибензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =0,85 (3Н, t, J=6,6Гц), 1,10-1,40 (18Н, m), 1,55-1,68 (2Н, m), 3,82 (2Н, t, J=6,6Гц), 3,95 (2Н, s), 4,98 (1H, d, J=4,5Гц), 5,78 (1H, d, J=4,5Гц), 6,49-6,72 (5Н, m), 6,80 (1Н, d, J=9,0Гц), 6,97-7,04 (3Н, m), 9,13 (1H, s). MS (ESI) m/z 462 (M+H)+. Приклад 12 Сполука за Прикладом 12 (вихід 79%) була синтезована з використанням 4циклогептилоксибензальдегіду як вихідної сполуки за способом, описаним для стадії 3 Прикладу 1. Вихідний альдегід був синтезований з 4гідроксибензальдегіду та бромциклогептану за способом, описаним для стадії 1 Прикладу 11. 1 Н-ЯМР (300МГц, DMSO-d6) =1,29-1,65 (10Н, m), 1,79-1,90 (2Н, m), 3,92 (2Н, s), 4,28-4,40 (1H, m), 4,95 (1H, d, J=3,6Гц), 5,77 (1H, d, J=4,8Гц), 6,48-6,68 (5H, m), 6,79 (1H, d, J=7,8Гц), 6,95-7,02 (3H, m), 9,12 (1H, s). MS (ESI) m/z 388 (M-H)-. Приклад 13 Сполука за Прикладом 13 (вихід 55%) була синтезована з використанням 4-(2адамантилокси)бензальдегіду як вихідної сполуки за способом, описаним для стадії 3 Прикладу 1. Вихідний альдегід був синтезований з 4гідроксибензальдегіду та 2-бромадамантану за способом, описаним для стадії 1 Прикладу 11. 1H-ЯМР (300МГц, DMSO-d6) =1,40-1,50 (2Н, d-подібний), 1,66-1,85 (8Н, m), 1,97 (4Н, sподібний), 4,35 (1Н, s), 4,97 (1Н, d, J=4,2Гц), 5,81 (1Н, d, J=4,2Гц), 6,50-6,85 (6Н, m), 6,96-7,05 (3Н, m), 9,15 (1Н, s). MS (ESI) m/z 428 (M+H)+. Приклад 14 Сполука за Прикладом 14 (вихід 48%) була синтезована з використанням 4-(1адамантилметокси)бензальдегіду як вихідної сполуки за способом, описаним для стадії 3 Прикладу 1. Вихідний альдегід був синтезований з 4гідроксибензальдегіду та 1адамантилметилтрифторметансульфонату за способом, описаним для стадії 1 Прикладу 11. 76969 24 1 Н-ЯМР (300МГц, DMSO-d6) =1,50-1,75 (12Н, т), 1,90-2,00 (3Н, brs), 3,41 (2Н, s), 3,95 (2Н, s), 4,98 (1H, d, J=4,5Гц), 5,78 (1Н, d, J=4,5Гц), 6,48-6,76 (5Н, m), 6,80 (1Н, d, J=8,1Гц), 6,96-7,08 (3Н, m), + 9,14 (1Н, s). MS (ESI) m/z 442 (M+H) . Приклад 15 Сполука за Прикладом 15 (вихід 36%) була синтезована з використанням 4-(2-(1-адамантил) етил)оксибензальдегіду як вихідної сполуки за способом, описаним для стадії 3 Прикладу 1. Вихідний альдегід був синтезований реакцією Міцунобу з 4-гідроксибензальдегіду та 2-(1адамантил)етанолу. 1 Н-ЯМР (300МГц, DMSO-d6) =1,40-1,70 (14Н, m), 1,90 (3Н, brs), 3,90 (2Н, t, J=1,2Гц), 3,95 (2Н, s), 4,98 (1H, d, J=4,5Гц), 5,79 (1Н, d, J=4,5Гц), 6,506,85 (6Н, m), 6,98-6,97-7,03 (3Н, m), 9,14 (1Н, s). MS (ESI) m/z 456 (M+H)+. Приклад 16 Сполука за Прикладом 16 (вихід 54%) була синтезована з використанням 4-(2циклогексилетил)оксибензальдегіду як вихідної сполуки за способом, описаним для стадії 3 Прикладу 1. Вихідний альдегід був синтезований з 4гідроксибензальдегіду та 2циклогексилетилбромІду за способом, описаним для стадії 1 Прикладу 11. 1 Н-ЯМР (300МГц, DMSO-d6) =0,82-1,00 (2Н, m), 1,06-1,26 (3Н, m), 1,32-1,49 (1Н, m), 1,49-1,74 (7Н, m), 3,87 (2Н, t, J=6,6Гц), 3,95 (2Н, s), 4,98 (1H, d, J=4,2Гц), 5,78 (1Н, d, J=4,5Гц), 6,49-6,72 (5Н, m), 6,80 (1Н, dd, J=1,5, 7,8Гц), 6,97-7,03 (3Н, ь), 9,13 (1Р, s). MS (ESI) m/z 402 (M-H)-. Приклад 17 Стадія 1: Синтез 1-(4-формілфеніл)піразолу До розчину формілфенілборної кислоти (100мг, 0,67ммоль) та піразолу (16мг, 0,33ммоль) в 1,4-діоксані (4мл) додавали ацетат міді (91мг, 0,5ммоль), піридин (53мг, 0,67ммоль) і активне молекулярне сито 4А (250мг), і суміш перемішували при кімнатній температурі протягом 72год. Фільтрували реакційну суміш через шар целіту, одержаний фільтрат концентрували й очищали хроматографією в тонкому шарі на силікагелі. Одержано 1-(4-формілфеніл)піразол (вихід 38мг, 66%) у вигляді білого порошку. 1Р-ЯМР (300МГц, CDC13) =6,53-8,04 (7Н, m), 10,02 (1Н, s). Стадія 2: Синтез сполуки за Прикладом 17 Сполука за Прикладом 17 (вихід 74%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 1-(4формілфеніл)піразолу як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =3,99 (2Н, s), 5,08 (1Н, d, J=4,2Гц), 5,93 (1H, d, J=4,5Гц), 6,478,37 (11Н, m), 7,07 (1Н, s), 9,23 (1Н, s). MS (ESI) m/z 344 (M+H)+. Приклад 18 Сполука за Прикладом 18 (вихід 24%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 2-бромбензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =4,02 (2Н, s), 5,28 (1Н, d, J=4,5Гц), 5,39 (1Н, d, J=4,5Гц), 6,42 (1Н, d, J=7,8Гц), 6,56 (1Н, t, J=7,8Гц), 6,68-6,77 (2Н, 25 m), 6,87 (1H, d, J=7,8Гц), 7,01-7,09 (2H, m), 7,12 (1H, s), 7,53-7,62 (1H, m), 9,35 (1H, s). MS (ESI) m/z 356, 358 (M+H)+. Приклад 19 Сполука за Прикладом 19 (вихід 38%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 2-метоксибензальдегіду як вихідної сполуки. 1H-ЯМР (300МГц, DMSO-d6) =3,92 (3Н, s), 3,97 (1Н, d, J=16,5Гц), 4,04 (1Н, d, J=16,5Гц), 5,16 (1Н, d, J=4,5Гц), 5,33 (1Н, d, J=4,5Гц), 6,38 (1Н, d, J=7,5Гц), 6,48-6,68 (4Н, m), 6,80 (1Н, d, J=7,5Гц), 6,95 (1H, d, J=7,5Гц), 7,00-7,12 (2H, m), 9,19 (1H, s). MS (ESI) m/z 308 (M+H)+. Приклад 20 Сполука за Прикладом 20 (вихід 50%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 2,4-дихлорбензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =4,02 (2Н, s), 5,39 (1H, d, J=4,5Гц), 5,43 (1Н, d, J=4,5Гц), 6,47 (1H, d, J=7,5Гц), 6,59 (1Н, t, J=7,5Гц), 6,69-6,77 (2Н, m), 6,88 (1Н, d, J=7,5Гц), 7,07-7,16 (2Н, m), 7,56 (1Н, brs), 9,36 (1H, s). MS (ESI) m/z 346 (M+H)+. Приклад 21 Стадія 1: Синтез 4-бутокси-2-метоксибензальдегіду До розчину 2,4-дигідроксибензальдегіду (500мг, 3,6ммоль) у диметилформаміді (5мл) додавали карбонат калію (1,50г, 10,9ммоль) та бутилйодид (666мг, 3,6ммоль), і суміш перемішували при кімнатній температурі протягом 2год. Потім додавали до реакційної суміші метилйодид (2,57мл) і перемішували при кімнатній температурі протягом 12год. Після екстракції етилацетатом і хроматографії на силікагелі одержано 4-бутокси-2метоксибензальдегід (вихід 233мг, 31%) у вигляді безбарвного масла. 1H-ЯМР (300МГц, CDC13) =1,00 (3Н, t, J=7,5Гц), 1,44-1,59 (2Н, m), 1,73-1,86 (2Н, m), 3,91 (3Н, s), 4,04 (2Н, t, J=6,6Гц), 6,45 (1Н, brs), 6,54 (1Н, d, J=8,4Гц), 7,80 (1Н, d, J=8,4Гц), 10,29 (1Н, s). Стадія 2: Синтез сполуки за Прикладом 21 Сполука за Прикладом 21 (вихід 59%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-бутокси-2метоксибензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =0,89 (3Н, t, J=7,8Гц), 1,31-1,46 (2H, m), 1,56-1,68 (2Н, m), 3,84 (2Н, t, J=6,3Гц), 3,90 (3Н, s), 3,99 (2Н, brs), 5,08 (1Н, d, J=3,9Гц), 5,22 (1H, d, J=3,9Гц), 6,15 (1H, d, J=8,4Гц), 6,35-6,58 (4H, m), 6,64 (1H, t, J=8,4Гц), 6,79 (1H, d, J=8,4Гц), 7,02 (1H, s), 9,15 (1H, s). MS (ESI) m/z 380 (M+H)+. Приклад 22 Стадія 1: Синтез 2,4-дибутоксибензальдегіду До розчину 2,4-дигідроксибензальдегіду (500мг, 3,6ммоль) у диметилформаміді (5мл) додавали карбонат калію (1,50г, 10,9ммоль) та бутилйодид (1,66г, 9,05ммоль), і суміш перемішували при кімнатній температурі протягом 12год. Після екстракції етилацетатом і хроматографії на силікагелі одержано 2,4-дибутоксибензальдегід (вихід 833мг, 92%) у вигляді безбарвного масла. 76969 26 1 Н-ЯМР (300МГц, CDC13) =0,94-1,05 (6Н, m), 1,43-1,60 (4Н, m), 1,73-1,89 (4Н, m), 3,47-4,08 (4Н, m), 6,43 (1Н, brs), 6,52 (1Н, d, J=8,1Гц), 7,80 (1Н, d, J=8,1Гц), 10,33 (1Н, s). Стадія 2: Синтез сполуки за Прикладом 22 Сполука за Прикладом 22 (вихід 12%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 2,4дибутоксибензальдегіду як вихідної сполуки. 1H-ЯМР (300МГц, DMSO-d6) =0,89 (ЗН, t, J=7,5Гц), 1,02 (3Н, t, J=7,5Гц), 1,30-1,46 (2Н, m), 1,48-1,67 (4Н, m), 1,80-1,94 (2Н, m), 3,83 (2Н, t, J=6,3Гц), 3,92-4,18 (4Н, m), 4,89 (1Н, d, J=4,5Гц), 5,23 (1H, d, J=4,5Гц), 6,15 (1Н, dd, J=8,7, 2,4Гц), 6,32 (1Н, d, J=7,5Гц), 6,45 (1Н, d, J=8,7Гц), 6,49 (1Н, d, J=2,4Гц), 6,54 (1Н, t, J=7,5Гц), 6,65 (1H, t, J=7,5Гц), 6,80 (1H, d, J=7,5Гц), 7,04 (1H, s), 9,17 (1H, s). MS (ESI) m/z 422 (M+H)+. Приклад 23 Сполука за Прикладом 23 (вихід 90%) була синтезована з використанням 4-бутокси-2етоксибензальдегіду як вихідної сполуки за способом, описаним для стадії 3 Прикладу 1. Вихідний альдегід був синтезований з 2,4дигідроксибензальдегіду, бутилйодиду та етилброміду за способом, описаним для стадії 1 Прикладу 21. 1 Н-ЯМР (300МГц, DMSO-d6) =0,89 (1H, t, J=7,5Гц), 1,30-1,45 (2Н, m), 1,48 (3Н, t, J=7,2Гц), 1,55-1,67 (2Н, m), 3,83 (2Н, t, J=6,6Гц), 3,99 (2Н, brs), 4,08-4,23 (2Н, m), 4,98 (1Н, d, J=4,5Гц), 5,23 (1H, d, J=4,5Гц), 6,15 (1H, dd, J=8,4, 2,4Гц), 6,36 (1H, d, J=7,8Гц), 6,45 (1H, d, J=8,4Гц), 6,47 (1H, d, J=2,4Гц), 6,53 (1H, t, J=7,8Гц), 6,65 (1H, t, J=7,8Гц), 6,80 (1H, d, J=7,8Гц), 7,03 (1H, s), 9,16 (1H, s). MS (ESI) m/z 394 (M+H)+. Приклад 24 Сполука за Прикладом 24 (вихід 79%) була синтезована з використанням 4-бутокси-2пропоксибензальдегіду як вихідної сполуки за способом, описаним для стадії 3 Прикладу 1. Вихідний альдегід був синтезований з 2,4дигідроксибензальдегіду, бутилйодиду та пропілйодиду за способом, описаним для стадії 1 Прикладу 21. 1H-ЯМР (300МГц, DMSO-d6) =0,89 (3Н, t, J=7,5Гц), 1,10 (3Н, t, J=7,5Гц), 1,30-1,45 (2Н, m), 1,56-1,68 (2Н, m), 1,83-1,97 (2Н, m), 3,83 (2Н, t, J=6,6Гц), 3,93-4,13 (4Н, m), 4,90 (1Н, d, J=4,5Гц), 5,24 (1Н, d, J=4,5Гц), 6,15 (1H, dd, J=8,4, 2,4Гц), 6,33 (1H, d, J=7,8Гц), 6,46 (1Н, d, J=8,4Гц), 6,48 (1Н, d, J=2,4Гц), 6,54 (1H, t, J=7,8Гц), 6,65 (1Н, t, J=7,8Гц), 6,80 (1Н, d, J=7,8Гц), 7,04 (1Н, s), 9,17 (1Н, s). MS (ESI) m/z 408 (M+H)+. Приклад 25 Сполука за Прикладом 25 (вихід 80%) була синтезована з використанням 4-етокси-2пропоксибензальдегіду як вихідної сполуки за способом, описаним для стадії 3 Прикладу 1. Вихідний альдегід був синтезований з 2,4дигідроксибензальдегіду, етилбромІду та пропілйодиду за способом, описаним для стадії 1 Прикладу 21. 1H-ЯШ (300МГц, DMSO-d6) =1,10 (3Н, t, J=7,5Гц), 1,25 (3Н, і, J=7,2Гц), 1,83-1,97 (2Н, m), 27 3,89 (2Н, t, J=7,2Гц), 3,95-4,14 (4Н, m), 4,91 (1Н, d, J=4,2Гц), 5,24 (1Н, d, J=4,2Гц), 6,15 (1Н, dd, J=8,4, 2,4Гц), 6,33 (1Н, d, J=7,8Гц), 6,46 (1Н, d, J=8,4Гц), 6,48 (1Н, d, J=2,4Гц), 6,54 (1Н, t, J=7,8Гц), 6,65 (1Н, t, J=7,8Гц), 6,80 (1Н, d, J=7,8Гц), 7,04 (1H, s), 9,17 (1Н, s). MS (ESI) m/z 380 (M+H)+, Приклад 26 Сполука за Прикладом 26 (вихід 85%) була синтезована з використанням 2-етокси-4пропоксибензальдегіду як вихідної сполуки за способом, описаним для стадії 3 Прикладу 1. Вихідний альдегід був синтезований з 2,4дигідроксибензальдегіду, пропілйодиду та етилброміду за способом, описаним для стадії 1 Прикладу 21. 1 Н-ЯМР (300МГц, DMSO-d6) =0,92 (3Н, t, J=7,5Гц), 1,48 (3Н, t, J=7,2Гц), 1,57-1,72 (2Н, m), 3,78 (2Н, t, J=6,6Гц), 4,00 (2Н, brs), 4,06-4,24 (2H,m), 4,98 (1H,d,J=4,5Гц), 5,23 (1Н, d, J=4,5Гц), 6,16 (1Н, dd, J=8,4, 2,4Гц), 6,36 (1Н, d, J=7,8Гц), 6,45 (1Н, d, J=8,4Гц), 6,47 (1Н, d, J=2,4Гц), 6,54 (1Н, t, J=7,8Гц), 6,65 (1Н, t, J=7,8Гц), 6,79 (1Н, d, J=7,8Гц), 7,03 (1H, s), 9,16 (1H, s). MS (ESI) m/z 380 (M+H)+. Приклад 27 Сполука за Прикладом 27 (вихід 53%) була синтезована з використанням 4-гексилокси-2метоксибензальдегіду як вихідної сполуки за способом, описаним для стади 3 Прикладу 1. Вихідний альдегід був синтезований з 2,4дигідроксибензальдегіду, гексилброміду та метилйодиду за способом, описаним для стадії 1 Прикладу 21. 1H-ЯМР (300МГц, DMSO-d6) =0,85 (3Н, t, 3=7,2Гц), 1,19-1,43 (6Н, m), 1,56-1,69 (2Н, m), 3,83 (2Н, t, J=6,6Гц), 3,90 (3Н, s), 3,99 (2Н, brs), 5,08 (1Н, d, J=4,2Гц), 5,22 (1H, d, J=4,2Гц), 6,15 (1Н, dd, J=8,4, 2,4Гц), 6,38 (1Н, d, J=7,8Гц), 6,44 (1H, d, J=8,4Гц), 6,49 (1Н, d, J=2,4Гц), 6,53 (1Н, t, J=7,8Гц), 6,64 (1Н, t, J=7,8Гц), 6,79 (1H, d, J=7,8Гц), 7,02 (1H, s), 9,15 (1Н, s). MS (ESI) m/z 408 (M+H)+. Приклад 28 Сполука за Прикладом 28 (вихід 23%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-бензилокси-2метоксибензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =3,90 (3Н, s), 3,97 (1Н, d, J=15Гц), 4,02 (1H, d, J=15Гц), 4,97 (2Н, s), 5,10 (1H, d, J=4,5Гц), 5,23 (1Н, d, J=4,5Гц), 6,26 (1H, dd, J=2,4, 8,4Гц), 6,40 (1Н, d, J=7,5Гц), 6,47 (1H, d, J=8,4Гц), 6,53 (1H, t, 5=7,5Гц), 6,58-6,69 (3Н, m), 6,79 (1Н, d, J=7,5Гц), 7,02 (1H, s), 7,26-7,43 (6H, m), 9,16 (1H, s). MS (ESI) m/z 414 (M+H)+. Приклад 29 Стадія 1: Синтез 4-гексилокси-2гідроксибензальдегіду 2,4-дигідроксибензальдегід (3,00г, 21,7ммоль) та гексилбромід (7,62мл, 54,3ммоль) перемішували в диметилформаміді (5мл) у присутності карбонату літію (4,00г, 54,3ммоль) при 55°С протягом ночі. Після нейтралізації хлористоводневою кислотою й екстракції етилацетатом продукт очищали хроматографією на колонці із силікагелем. Одержано 4-гексилокси-2-гідроксибензальдегід (вихід 1,77г, 37%) у вигляді безбарвного масла. 76969 28 1 H-ЯМР (300МГц, CDCl3) =0,91 (3Н, m), 1,321,48 (6Н, m), 1,77-1,84 (2Н, m), 4,01 (2Н, t, J=6,6Гц), 6,41 (1H, d, J=2,1Гц). 6,53 (1H, dd, 1=8,7, 2,1Гц), 7,42 (1H, d, J=8,7Гц), 9,70 (1H, s). Стадія 2: Синтез сполуки за Прикладом 29 Сполука за Прикладом 29 (вихід 73%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-гексилокси-2гідроксибензальдегіду як вихідної сполуки. 1 H-ЯМР (300МГц, DMSO-d6) =0,85 (3Н, t, J6,9Гц), 1,17-1,41 (6Н, m), 1 53-1 68 (2Н, m), 3,76 (2Н, t, J=6,6Гц), 3,99 (2Н, bis), 5,21 (2Н, s), 6,04 (1H, dd, J=8,4, 2,4Гц), 6,34 (1H, d, J=2,4Гц), 6,42 (1H, d, J=8,4Гц), 6,46 (1H, d, J=7,8Гц), 6,57 (1Н, t, J=7,8Гц), 6,65 (1Н, t, J=7,8Гц), 6,81 (1H, d, J=7,8Гц), 7,09 (1H, s), 9,16 (1H, s), 9,92 (1Н, s). MS (ESI) m/z 394 (M+H)+. Приклад 30 Стадія 1: Синтез 4-трет-бутил-2хлорбензальдегіду Стадія 1-1: Синтез 2-хлор-4~грег-бутилфенолу 4-трет-бутилфенол (2,76г, 18,4ммоль) розчиняли в дихлорметані (25мл). До одержаного розчину додавали крапля за краплею сульфурилхлорид (1,6мл, 9,9ммоль), і суміш перемішували при кімнатній температурі протягом 3 днів, після чого концентрували під зниженим тиском. Після очищення хроматографією на колонці із силікагелем одержано 2-хлор-4-трет-бутилфенол (вихід 2,71г, 80%). 1 H-ЯМР (300МГц, CDC13) =1,28 (9Н, s), 5,37 (1Н, s), 6,94 (1Н, d, J=8,6Гц), 7,19 (1Н, dd, J=8,6Гц, 2,5Гц), 7,30 (1H, d, J=2,5Гц). Стадія 1-2: Синтез 2-хлор-4-трет-бутилфенілтрифторметансульфонату Хлоровану сполуку (1,84г, 10ммоль), одержану на стадії 1-1, і піридин (1,2мл) розчиняли в дихлорметані (20мл). Повільно додавали до одержаного розчину ангідрид трифторметансульфокислоти (2,5мл). Після перемішування при кімнатній температурі протягом 10хв. додавали до реакційної суміші гексан (20мл). Нерозчинну фазу видаляли фільтруванням, а фільтрат концентрували під зниженим тиском. Після очищення хроматографією на колонці із силікагелем одержано 2-хлор-4грег-бугилфеніл-трифторметансульфонат (вихід 2,94г, 93%). 1 Н-ЯМР (300МГц, CDC13) =1,32 (9Н, s), 7,25 (1Н, d, J=8,6Гц), 7,34 (1Н, dd, J=8,6Гц, 2,1Гц), 7,50 (1Н, d, J=2,1Гц). Стадія 1-3: Синтез 2-хлор-4-третбутилбензилового спирту Трифторметансульфонат (638мг, 2ммоль), одержаний на стадії 1-2, ацетат паладію (14мг), 1,3-дифенілфосфінпропан (25мг), метанол (4мл) та триетиламін (0,6мл) розчиняли в диметилформаміді (5мл), і одержаний розчин перемішували при 80°С в атмосфері монооксиду вуглецю протягом 16год. Давали реакційній суміші охолодитися, потім екстрагували сумішшю етилацетату з гексаном і очищали хроматографією на колонці із силікагелем. Одержано метил-2-хлор-4-третбутилбензоат. Одержаний таким чином складний ефір розчиняли в дихлорметані (2мл). До одержаного розчину додавали крапля за краплею при 29 78°С в атмосфері аргону 1М розчин (2,5мл) діізобутилалюмінійгідриду в толуолі, і одержану суміш перемішували при цій температурі протягом 5хв. Додавали до реакційної суміші 0,5М хлористоводневу кислоту (20мл), і підвищували температуру до кімнатної. Після екстракції етилацетатом і очищення хроматографією на колонці із силікагелем одержано 2-хлор-4-трет-бутилбензиловий спирт (вихід 204мг, 51%). 1 H-ЯМР (300МГц, CDC13) =1,31 (9Н, s), 1,82,1 (1Н, bг), 4,75 (2Н, s), 7,29 (1Н, dd, J=7,8Гц, 2,1 Гц), 7,36-7,41 (2Н, m). Стадія 1-4: Синтез 2-хлор-4-третбутилбензальдегіду Спирт (195мг, 0,981ммоль), одержаний на стадії 1-3, розчиняли в хлороформі (5мл). До одержаного розчину додавали активований діоксид марганцю (1,27г), і суміш інтенсивно перемішували при 50°С протягом 2год. Давали суміші охолодитися, видаляли діоксид марганцю фільтруванням, а фільтрат концентрували під зниженим тиском. Після очищення хроматографією на колонці із силікагелем одержано 2-хлор-4-третбутилбензальдегід (вихід 152мг, 79%). 1 H-ЯМР (300МГц, CDC13) =1,34 (9Н, s), 7,40 (1H, ddd, J=8,l Гц, 1,8Гц, 0,9Гц), 7,44 (1H, d, J=1,8Гц), 7,86 (1H, d, J=8,1Гц), 10,43 (1Н, d, J=0,9Гц). Стадія 2: Синтез сполуки за Прикладом 30 Сполука за Прикладом 30 (вихід 51%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 4-трет-бутил-2хлорбензальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =1,18 (9Н, s), 4,01 (2Н, s), 5,35 (1Н, d, J=4,8Гц), 5,38 (1Н, d, J=4,8Гц), 6,48-6,61 (2Н, m), 6,66-6,74 (2Н, m), 6,856,90 (1H, m), 7,04 (1H, dd, J=8,3Гц, 1,9Гц), 7,09 (1H, s), 7,35 (1H, J=1,9Гц), 9,32 (1H, s). MS (ESI) m/z 366 (M-H)-. Приклад 31 Сполука за Прикладом 31 (вихід 56%) була синтезована з використанням 4-(1,1,3,3тетраметил бутил)-2-хлорбензальдегіду як вихідної сполуки за способом, описаним для стадії 3 Прикладу 1. Вихідний альдегід був синтезований з 4-(1,1,3,3-тетраметилбутил)фенолу за способом, описаним для стадії 1 Прикладу 30. 1 H-ЯМР (300МГц, DMSO-d6) =0,55 (9Н, s), 1,20 (3Н, s), 1,24 (3Н, s), 1,60 (2Н, s), 4,02 (2Н, s), 5,23 (1H, d, J=4,5Гц), 5,39 (1Н, d, J=4,2Гц), 6,36 (1Н, d, J=7,5Гц), 6,50 (1Н, t, J=7,5Гц), 6,61 (1H, d, J=8,4Гц), 6,68 (1H, t, J=7,5Гц), 6,84 (1Н, d, J=8,4Гц), 7,00 (1Н, d, J=7,5Гц), 7,09 (1H, s), 7,34 (1Н, s), 9,28 (1Н, s). MS (ESI) m/z 422 (M-H)-. Приклад 32 Сполука за Прикладом 32 (вихід 64%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 2піридинкарбоксіальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =3,98 (2Н, s), 5,10 (1Н, d, J=4,5Гц), 5,84 (1H, d, J=4,5Гц), 6,486,59 (2Н, m), 6,65 (1Н, t, J=7,5Гц), 6,83 (1H, d, J=7,5Гц), 6,91 (1Н, d, J=7,5Гц), 7,04 (1Н, s), 7,067,13 (1Н, m), 7,53 (1H, t, J=7,5Гц), 8,39-8,44 (1Н, m), 9,23 (1Н, s). MS (ESI) m/z 279 (M+H)+. 76969 30 Приклад 33 Сполука за Прикладом 33 (вихід 52%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 5-бромтіофен-2карбоксіальдегіду як вихідної сполуки. 1 H-ЯМР (300МГц, DMSO-d6) =3,93 (2Н, s), 5,16 (1Н, d, J=4,5Гц), 6,02 (1Н, d, J=4,5Гц), 6,616,87 (5Н, m), 6,92 (1Н, d, J=3,6Гц), 7,09 (1H, s), 9,26 (1Н, s). MS (ESI) m/z 362, 364 (М+Н)+. Приклад 34 Стадія 1: Синтез 2-феніл-5піримідинкарбоксіальдегіду Розчин тетрафторборнокислої солі 2-диметил аміноетилєн-1,3-біс(диметиліміно)пропану (4ммоль), одержаного за методикою, описаною в [Synthesis 1988, с.641], бензамідину гідрохлориду (4ммоль) та етилату натрію (12ммоль) в етанолі (5мл) перемішували при 80°С протягом 2год. Після екстракції етилацетатом і очищення хроматографією на колонці із силікагелем одержано 2-феніл5-піримідинкарбоксіальдегід (вихід 226мг, 31%). 1 Н-ЯМР (300МГц, CDC13) =7,50-7,60 (3Н, m), 8,54-8,58 (2Н, m), 9,22 (2Н, s), 10,16 (1H, s). Стадія 2: Синтез сполуки за Прикладом 34 Сполука за Прикладом 34 (вихід 37%) була синтезована способом, описаним для стадії 3 Прикладу 1, із використанням 2-феніл-5піримідинкарбоксіальдегіду як вихідної сполуки. 1 Н-ЯМР (300МГц, DMSO-d6) =4,02 (2Н, d, J=4,5Гц), 5,15 (1Н, d, J=4,2Гц), 6,08 (1Н, d, J=4,2Гц), 6,60-6,70 (2Н, m), 6,72-6,78 (1Н, m), 6,93 (1Н, d, J=7,8Гц), 7,16 (1H, s), 7,44-7,51 (3Н, m), 8,25-8,33 (2Н, m), 8,58 (2Н, s), 9,38 (1H, s). MS (ESI) m/z 354 (М-Н)-. Приклад 35 Розчин піролідин-2,4-діону (40мг, 0,404ммоль) та 4,5-диметил-1,2-фенілендіаміну (55мг, 0,404ммоль) у диметилформаміді перемішували в присутності молекулярних сит протягом 9год. Додавали до реакційної суміші 4-бромбензальдегід (75мг, 0,404ммоль) та оцтову кислоту (0,01мл), і суміш перемішували при 70°С протягом ночі. Фільтрували реакційну суміш. Після додавання води кристали, що утворилися, відділяли фільтруванням і промивали дихлорметаном. Одержано сполуку за Прикладом 35 (вихід 100мг, 65%). 1 Н-ЯМР (300МГц, DMSO-d6) =1,94 (3Н, s), 2,01 (3Н, s), 3,93 (2Н, s), 4,96 (1H, d, J=4,2Гц), 5,67 (1H, d, J=4,2Гц), 6,29 (1Н, s), 6,59 (1Н, s), 6,99 (1H, s), 7,04 (2Н, d, J=7,8Гц), 7,35 (2Н, d, J=7,8), 9,08 (1H, s). MS (ESI) m/z 382, 384 (M-H)-. Приклад 36 Стадія 1: Синтез 4-((1R,2R)-(2аміноциклогексил)аміно)-3-піролін-2-ону Розчин піролідин-2,4-діону (40мг, 0,404ммоль) та (1R,2R)-1,2-діамінопиклогександіаміну (46мг, 0,404ммоль) у метанолі (2мл) перемішували при 60°С протягом 2год. Концентрували реакційний розчин. Після очищення на колонці з оксидом алюмінію одержано 4-((1R,2R)-(2аміноциклогексил)аміно)-3-піролін-2-он (вихід 66мг, 84%). 1 Н-ЯМР (300МГц, DMSO-d6) =1,09-1,91 (8Н, m), 2,41 (1Н, m), 2,63 (1H, m), 3,17 (2H, s), 3,70 (1H, d, J=16Гц), 3,78 (1H, d, J=16Гц), 4,39 (1H, s), 6,45 31 (1H, s), 6,61 (1H, d, J=8,1Гц). MS (ESI) m/z 196 (M+H)+, 194 (M-H)-. Стадія 2: Синтез сполуки за Прикладом 36 4-((1R,2R)-(2-аміноциклогексил)аміно)-3піролін-2-он (66мг, 0,337ммоль), одержаний на стадії 1, і 4-бромбензальдегід (63мг, 0,337ммоль) перемішували в етанолі при 70°С протягом ночі. Концентрували реакційну суміш. Діастереомери розділяли та очищали хроматографією на колонці із силікагелем. До одержаної твердої речовини додавали діетиловий ефір. Після фільтрування й промивання одержано сполуку за Прикладом 36 (вихід 12мг, 10%) як сполуку низької полярності. 1 H-ЯМР (300МГц, DMSO-d6) =1,17-1,40 (4Н, m), 1,68-1,74 (2Н, m), 1,93-1,98 (2Н, m), 2,63 (1H, m), 3,15 (1Н, m), 3,80 (1Н, d, J=16,6Гц), 3,94 (1Н, d, J=16,6Гц), 4,62 (1Н, s), 7,26 (2Н, d, J=6,6Гц), 7,40 (2Н, d, J=6,6Гц). MS (ESI) m/z 362, 364 (M+H)+. Приклад 37 Сполуку за Прикладом 37 (вихід 15мг, 12%) одержано як сполуку високої полярності при розділенні та очищенні діастереомерів хроматографією на колонці із силікагелем на стадії 2 Прикладу 36. 1H-ЯМР (300МГц, DMSO-d6) =1,06-1,27 (4Н, m), 1,47 (1Н, m), 1,56-1,68 (2Н, m), 1,90 (1Н, m), 2,29 (1Н, m), 3,02 (1Н, m), 3,90 (1Н, d, J=16,5Гц), 4,02 (1Н, d, J=16,5Гц), 4,96 (1Н, s), 7,20 (2Н, d, J=8,4Гц), 7,43 (2Н, d, J=8,4Гц). MS (ESI) m/z 362, 364 (M+H)+. Сполуки за Прикладами 38-41 були одержані шляхом розділення та очищення діастереомерів хроматографією на колонці із силікагелем так само, як сполука за прикладом 37, за тим винятком, що вихідну сполуку замінювали відповідним альдегідом. Приклад 42 Стадія 1: Синтез 10-(4-бромфенш)1,2,3,4,9,10-тетрагідро-бензо[b]піроло-[3,4е][1,4]дизепін-1-ону 10-(4-бромфеніл)-1,2,3,4,9,10-тетрагідробензо[b]піроло[3,4-е][1,4]дизепін-1-он (вихід 95%) був синтезований за методикою, описаною для стадії 3 Прикладу 1 за тим винятком, що як вихідну сполуку було використано 4-бромбензальдегід. 1 Н-ЯМР (300МГц, DMSO-d6) =3,97 (2Н, s), 5,03 (1Н, d, J=4,2Гц), 5,89 (1Н, d, J=4,5Гц), 6,51 (1Н, dd, J=8,1, 1,5Гц), 6,59 (1Н, dt, J=7,5, 1,5Гц), 6,68 (1Н, dt, J=8,4, 2,1Гц), 6,83 (1Н, dd, J=7,5, 1,5Гц), 7,06 (1Н, s), 7,13 (2Н, d, J=6,6Гц), 7,36 (2Н, d, J=6,6Гц), 9,22 (1H, s). MS (ESI) m/z 356, 358 (M+H)+. Стадія 2: Синтез сполуки за Прикладом 42 Сполуку, одержану на стадії 1 (40мг, 0,11ммоль), та метилйодид (0,137мл, 2,2ммоль) перемішували в метанолі в присутності триетиламіну (0,023мл, 0,17ммоль) протягом 4год. Після завершення реакції продукт очищали хроматографією на силікагелі. До одержаної твердої речовини додавали діетиловий ефір. Після фільтрування й промивання одержано сполуку за Прикладом 42 (вихід 5мг, 12%). 1 Н-ЯМР (300МГц, DMSO-d6) =2,51 (3Н, s), 3,97 (1H, d, J=17Гц), 3,99 (1Н, d, J=17Гц), 4,90 (1Н, s), 6,44 (1Н, d, J=8,4Гц), 6,71 (1Н, t, J=6,9Гц), 6,82 76969 32 6,94 (4Н, m), 7,10 (1H, s), 7,16-7,34 (2Н, m), 9,27 (1Н, s). MS (ESI) m/z 368, 370 (M-H)-. Приклад 43 До розчину сполуки, одержаної на стадії 1 Прикладу 42 (50мг, 0,14ммоль), в піридині додавали оцтовий ангідрид (0,05мл, 0,56ммоль), і суміш перемішували протягом 5год. Концентрували реакційну суміш. До одержаної твердої речовини додавали діетиловий ефір. Після фільтрування й промивання одержано сполуку за Прикладом 43 (вихід 43мг, 77%). 1 H-ЯМР (300МГц, DMSO-d6) =1,70 (3Н, s), 4,03 (2Н, s), 6,77-6,79 (2Н, m), 6,85 (1Н, s), 6,95 (1Н, d, J=8,4Гц), 7,04 (1Н, m), 7,16 (1Н, m), 7,367,39 (4Н, m), 9,50 (1Н, s). MS (ESI) m/z 396, 398 (MH)-. Приклад 44 Сполука за Прикладом 44 (вихід 41%) була синтезована за методикою, описаною в Прикладі 1, за тим винятком, що на стадії 2 Прикладу 1 замість 1,2-фенілендіаміну був використаний Nметил-1,2-фенілендіамін і на стадії 3 Прикладу 1 як вихідний матеріал був використаний 4бромбензальдегід. 1 H-ЯМР (300МГц, DMSO-d6) =3,34 (3Н, s), 4,11 (1Н, d, J=18Гц), 4,30 (1Н, d, J=18Гц), 5,04 (1Н, d, J=4Гц), 5,68 (1Н, d, J=4Гц), 6,43 (1H, dd, J=7,8, 1,5Гц), 6,68 (1Н, d, J=7,2Гц), 6,81-7,10 (3Н, m), 7,28-7,39 (3Н, m), 9,28 (1Н, s). MS (ESI) m/z 368, 370 (М-Н)-. Нижче подано хімічні структури сполук, одержаних за Прикладами 1-44: 33 76969 34 35 Сполуки за Прикладами 45-162 були синтезовані способом, який включає проведення реакції єнаміну (IX) із відповідним альдегідом з одержанням циклічної сполуки (X) та алкілування або ацилювання сполуки (X), як показано нижче: де R є замісник при бензольному циклі, R' є замісник при атомі азоту в положенні 9, a Z є атом галоїду або аналогічна група. Приклад 45 Стадія 1: Процес одержання циклічної сполуки (XI) (R=2-0Me) До розчину 4-((1R,2R)-(2-аміноциклогексил)аміно)-3-піролін-2-ону (9,75г, 50ммоль), одержаного згідно зі стадією 1 Прикладу 36, та 2метоксибензальдегіду (7,48г, 55ммоль) у метанолі (150мл) додавали 0,5мл оцтової кислоти, і суміш перемішували при 65°С протягом ночі. Концентрували реакційну суміш і додавали до одержаних кристалів 90мл змішаного розчинника ефір:дихлорметан (1:1). Після ретельного перемішування твердий продукт відділяли фільтруванням. Одержано циклічну сполуку (XI) (R=2-OMe) у вигляді білої твердої речовини (8,80г, 56%). Ця сполука була ідентичною сполуці, одержаній за Прикладом 39. 76969 36 Стадія 2: Процес одержання сполуки за Прикладом 45 (R=2-OMe, R'=COCH3) Методика синтезу А (ангідридний спосіб): До розчину циклічної сполуки (XI) (R=2-OMe) (3,13г, 10ммоль), одержаної згідно зі стадією 1 Прикладу 45, в дихлорметані (200мл) додавали триетиламін (5,05г, 50ммоль). Потім до одержаної суміші додавали оцтовий ангідрид (4,08г, 40ммоль) і перемішували при 45°С протягом 4год. Після охолодження до кімнатної температури кристали, що утворилися, відділяли фільтруванням. Одержано сполуку за Прикладом 45 у вигляді білої твердої речовини (1,96г, 55%). Сполуки за Прикладами 46-163 були одержані згідно зі стадіями 1 і 2 Прикладу 45. На стадії 2 сполука була синтезована із застосуванням описаної вище методики синтезу А або будь-якої з описаних нижче методик синтезу B-F. Методика синтезу В (хлорангідридний спосіб): Розчин циклічної сполуки (X) (0,33ммоль) та триетиламіну (0,77ммоль) у дихлорметані (15мл) охолоджували до 0°С. Додавали до розчину хлорангідрид відповідної кислоти (1,28ммоль), і суміш перемішували при кімнатній температурі протягом 15год. Після дистиляції розчинника одержаний продукт очищали хроматографією в тонкому шарі на силікагелі й одержували ациловану сполуку (XXVIII). Методика синтезу С (змішаний ангідридний спосіб): До розчину відповідної карбонової кислоти (11ммоль) у безводному тетрагідрофурані (50мл) додавали триетиламін (10ммоль), і охолоджували суміш до -15°С. Додавали до реакційної суміші етилхлорформіат (10ммоль), при цьому утворювалася біла тверда речовина. Перемішували протягом 15хв. Потім додавали до реакційної суміші розчин циклічної сполуки (X) (2ммоль) у дихлорметані (60мл), і суміш перемішували при кімнатній температурі протягом 2год. Після випаровування розчинника й екстракції дихлорметаном продукт очищали хроматографією на колонці із силікагелем і одержували ациловану сполуку (XXVIII). Методика синтезу D (спосіб конденсації із застосуванням WSC): Розчин циклічної сполуки (X) (0,25ммоль) у дихлорметані (10мл) охолоджували до 0°С. Додавали до розчину відповідну карбонову кислоту (1ммоль) і WSC (1-етил-3-(3диметиламінопропіл)карбодііміду гідрохлорид) (1ммоль) і перемішували при кімнатній температурі протягом 15год. Розчинник випаровували, і продукт очищали хроматографією в тонкому шарі на силікагелі й одержували ациловану сполуку (XXVIII). Методика синтезу Е (спосіб приєднання ізоціанату): До розчину циклічної сполуки (X) (0,3ммоль) у дихлорметані (10мл) додавали відповідний ізоціанат (1,5ммоль), і суміш перемішували при кімнатній температурі протягом 24год. Розчинник випаровували, і продукт очищали хроматографією в тонкому шарі на силікагелі й одержували ациловану сполуку (XXVIII). Методика синтезу F (спосіб приєднання дикетену): До розчину циклічної сполуки (X) (1ммоль) в етанолі (10мл) додавали дикетен (10ммоль) і нагрівали при 70°С протягом 4год. Розчинник випа 37 76969 38 ровували, і продукт очищали хроматографією в тонкому шарі на силікагелі й одержували ациловану сполуку (XXVIII). Структурні хімічні формули циклічних сполук (X1-25), одержаних на стадії 1, та характеристики цих сполук подано в Таблицях 1. Структурні хімічні формули сполук, одержаних на стадії 2 Прикладів 46-163, характеристики процесу ацилювання на стадії 2 та характеристики одержаних сполук подано в Таблицях 2-1 – 2-10. 39 76969 40 41 76969 42 Символи в поданих вище таблицях мають такі значення: Co: номер сполуки, No: номер Прикладу, R: замісник при бензольному циклі, R': замісник при атомі азоту, D: характеристики сполуки, S: методика синтезу, базована на стадії 2, ST: структурна хімічна формула, MS: мас-спектр (іонізація електронним ударом), N1: 1H-ЯМР (дейтерований ДМСО, внутрішній стандарт тетраметилсилан, , млн-1), *: примітки. Числа перед позначеннями замісників означають положення замісників при бензольному циклі. Наприклад, 2,5-(ОМе)2 означає, що метоксигрупи знаходяться в положеннях 2 та 5, a COCH2CH2-(3,4-F2-Ph) означає 3-(3,4дифторфеніл)пропаноїл. Z означає бензилоксикарбоніл. Примітки (*1-*11) у таблицях мають такі значення: *1: Сполука була синтезована шляхом гідролізу сполуки за Прикладом 52 гідроксидом натрію за звичайним способом. *2: Сполука була синтезована шляхом гідролізу сполуки за Прикладом 60 гідроксидом натрію за звичайним способом. З*: Сполука була синтезована шляхом відновлення сполуки за Прикладом 60 алюмогідридом літію за звичайним способом. 4*: Сполука була синтезована шляхом відщеплення групи захисту від сполуки за Прикладом 63 шляхом гідрування із застосуванням паладію на вугіллі за звичайним способом. 5*: Сполука була синтезована шляхом відщеплення групи захисту від сполуки за Прикладом 65 шляхом гідрування із застосуванням паладію на вугіллі за звичайним способом. 43 6*: Сполука була синтезована шляхом гідролізу сполуки за Прикладом 91 гідроксидом натрію за звичайним способом. 7*: Сполука була синтезована шляхом відщеплення групи захисту від сполуки за Прикладом 102 шляхом гідрування із застосуванням паладію на вугіллі за звичайним способом. 8*: Сполука була синтезована шляхом відщеплення групи захисту від сполуки за Прикладом 103 шляхом гідрування із застосуванням паладію на вугіллі за звичайним способом. 9*: Сполука була синтезована шляхом відщеплення групи захисту від сполуки за Прикладом 111 шляхом гідрування із застосуванням паладію на вугіллі за звичайним способом. 10*: Сполука була синтезована шляхом гідролізу сполуки за Прикладом 120 гідроксидом натрію за звичайним способом. 11*: Сполука була синтезована шляхом відщеплення групи захисту від сполуки за Прикладом 157 шляхом гідрування із застосуванням паладію на вугіллі за звичайним способом. Сполуки за Прикладами 164-168 були синтезовані таким само способом, як сполука за Прикладом 45. Приклад 169 До розчину сполуки за Прикладом 39 (20мг, 0,06ммоль) у піридині (1мл) додавали оцтовий ангідрид (130мг, 1,3ммоль), і суміш перемішували при 90°С протягом 4год. Розчинник випаровували, продукт очищали хроматографією в тонкому шарі на силікагелі, і одержували сполуку за Прикладом 169 (23мг, 89%) у вигляді білої твердої речовини. Приклади 170 і 171 Сполуки за Прикладами 170 і 171 були синтезовані шляхом метилування сполуки за Прикладом 45 метилйодидом за звичайним способом. Приклад 172 До розчину сполуки за Прикладом 39 (40мг, 0,13ммоль) у дихлорметані (1мл) додавали метилйодид (0,08мл, 1,3ммоль), і суміш перемішували при кімнатній температурі протягом 48год. Розчинник випаровували, продукт очищали хроматографією в тонкому шарі на оксиді алюмінію, і одержували сполуку за Прикладом 172 (9мг, 21%) у вигляді білої твердої речовини. Приклад 173 Сполука за Прикладом 173 була синтезована таким саме чином, як сполука за Прикладом 172, за тим винятком, що метилйодид, використовуваний для алкілування, замінювали етилбромацетатом. Приклад 174 Сполука за Прикладом 174 була синтезована шляхом здійснення реакції, описаної для стадії 1 Прикладу 36 та в Прикладі 45, за тим винятком, що тетрамову кислоту замінювали 1,3циклопентандіоном. Приклад 175 Сполука за Прикладом 175 була синтезована за тою саме схемою, що сполука за Прикладом 1, за тим винятком, що 1,2-фенілендіамін замінювали на 2-амінотіофенол і як альдегід використовували 4-бромбензальдегід. Приклад 176 76969 44 Сполука за Прикладом 176 була синтезована за тою саме схемою, що сполука за Прикладом 1, за тим винятком, що 1,2-фенілендіамін замінювали на 2-амінофенол і як альдегід використовували 4-бромбензальдегід. Приклад 177 До розчину 5-(2-амінофеніл)метил-1,2дигідропіразол-3-ону (50мг, 0,25ммоль) у метанолі (3мл) додавали оцтову кислоту (10мг) та 4бромбензальдегід (54мг, 0,29ммоль), і суміш перемішували при 70°С протягом 20год. Після завершення реакції розчинник випаровували, і до одержаної твердої речовини додавали діетиловий ефір. Після фільтрування продукт промивали, і одержували сполуку за Прикладом 177 (1мг, 2%). Хімічні структурні формули сполук за Прикладами 164-177 та характеристики цих сполук подано в таблицях 3-1-3-3. 45 76969 46 Символи в поданих вище таблицях мають такі значення: No: номер Прикладу, ST: структурна хімічна формула, D: характеристики сполук, MS: мас-спектр (іонізація електронним ударом), N1: 1Н-ЯМР (дейтерований ДМСО, внутрішній стандарт тетраметилсилан, , млн.-1). Сполуки, структурні хімічні формули яких подано в Таблицях 4 та 5, можна легко одержати способом, в основному анологічним способам, описаним у наведених вище Прикладах, або іншими способами, очевидними для фахівців. Символи в цих Таблицях мають такі значення: REF: номер Прикладу, на який дається посилання, R: замісник при бензольному циклі, R': замісник при атомі азоту, ST: структурна хімічна формула. Приклад випробування 1 Оцінка активності переносу цукру 1. Підготовка жирових клітин пацюків Після обезголовлювання та веносекції 6 самців пацюків лінії Wistar (маса тіла 150-200г) черевну порожнину кожного пацюка розрізали для виймання загалом 6г жирової тканини придатків яєчок. Ці тканини подрібнювали розрізанням на шматочки розміром 2 2мм в 6мл розчину HEPES, модифікованого за Кребсом-Рінгером (KRH, склад: 130мМ хлориду натрію, 4,7мМ хлориду калію, 1,2мМ дигі 47 76969 дрофосфату калію, 1,2мМ сульфату магнію, 1мМ хлориду кальцію та 25мМ HEPES, рН=7,6), який містив 5% BSA (бичачого сироваткового альбуміну). До препарату додавали 24мг колагенази (типу І) і піддавали ферментації протягом приблизно 40хв, одержуючи приблизно 6мл ізольованих жирових клітин. Колагеназу видаляли шляхом заміни буфера. До залишку додавали 2%-ний розчин BSA/KRH і одержували 45мл суспензії жирових клітин. 2. Оцінка активності переносу цукру Активність переносу цукру під впливом сполук згідно з цим винаходом оцінювали за методом, описаним у літературі [Annual Review of Biochemistry, Vol. 55, p.1059, 1986]. Для випробування в кожну полістиролову пробірку вмішували 200мкл суспензії жирових клітин, додавали до неї 100мкл розчину випробовуваної речовини (одержаного шляхом розведення KRH розчину речовини 10мг/мл у диметилсульфоксиді), одержану суміш струшували та культивували при 37°С протягом 30хв. Активність переносу цукру визначали шляхом вимірювання кількості 2-[І4С(U)]-деокси-D-глюкози, яка поглинається за одиницю часу. Конкретно, після попереднього культивування до суспензії жирових клітин додавали 2-[14С(U)]-деокси-Dглюкозу (кінцева концентрація 0,5мкКі на зразок). Через 5хв до суміші додавали цитохалазін В (кінцева концентрація в зразку 10мкМ) для припинення перенесення цукру. Після утворення динонілфталатного шару одержану суміш центрифугували для відділення жирових клітин від буферного розчину. Кількість 2-[14С(U)]-деокси-D-глюкози, яка містилася в шарі жирових клітин, визначали із застосуванням лічильника з рідким сцинтилятором. В такій випробувальній системі в разі застосування інсуліну (100нМ), що спричиняє ефект підвищення переносу цукру, цей ефект був приблизно в 7 разів вищий від ефекту, який спостерігався в контрольній групі без інсуліну. Результати оцінювання активності переносу цукру, одержані при застосуванні 100мкг/мл кожної сполуки згідно з цим винаходом, показані в Таблиці 6. Активність переносу цукру в Таблиці 6 оцінюється за порівнянням із посиленням ефекту під впливом інсуліну (100нМ). Позначення "+" вказує, що ефект становив від 20% до 40%, позначення "++" — від 40% до 70%, а позначення "+++" - що ефект становив щонайменше 70% порівняно з ефектом інсуліну. Символи в Таблиці 6 мають такі значення: No: номер Прикладу, А: активність переносу цукру. Таблиця 6 No 1 2 3 5 6 7 A ++ + + + ++ ++ 48 8 9 10 11 12 13 14 15 16 17 20 21 22 23 24 25 26 27 28 29 30 31 34 37 38 39 40 41 43 44 +++ ++ + ++ + ++ +++ ++ ++ + + ++ +++ +++ +++ ++ ++ ++ ++ + + +++ + ++ +++ +++ +++ +++ ++ + Результати оцінювання активності переносу цукру, одержані при застосуванні кожної сполуки згідно з цим винаходом, показані в Таблиці 7. Активність переносу цукру в Таблиці 7 визначається як концентрація (ЕС50, мкг/мл) випробовуваної речовини, що виявляє ефект підсилення, який відповідає 50% ефекту інсуліну, для якого ефект підсилення прийнято за 100%. Символи в Таблиці 7 мають такі значення: No: номер Прикладу, А: активність переносу цукру. Таблиця 7 No 45 46 47 48 49 50 51 52 53 54 55 56 59 60 62 65 A 1,3 0,77 4,6 4,5 0,47 9,5 2 5,9 2 2,2 4,6 5 1,1 4,8 4,8 8 No 107 108 109 110 112 113 114 115 117 118 119 120 121 122 123 124 A 0,82 7,8 8 6 20 10 12 10 6 2 4 8 2,5 6 5 7 49 76969 103 104 105 106 Продовження таблиці 7 66 67 68 69 70 71 72 76 77 78 79 80 81 82 83 84 85 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 8 3,4 0,9 4 4,2 2,6 5,5 10 20 18 8,6 6 4,2 6 11 3,6 7 15 1,9 1,3 5 13 3,8 3,6 4 1,5 7 12 14 2 2 4,8 4 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 153 154 155 156 157 158 Комп’ютерна верстка М. Ломалова 2 5 2,2 2 5,4 6 4 4 20 0,5 1,5 1,5 8,6 6 6 20 3 4 0,5 5 10,7 2 2,4 20 2 2 2 20 1,5 2,7 2 20 12 50 3,6 1 3,7 20 160 161 163 166 4,4 17 6 19 В описаних вище випробуваннях сполуки згідно з цим винаходом виявляли ефект підвищення активності переносу цукру. Приклад випробування 2 Оцінка гіпоглікемічного ефекту для діабетичних мишей Випробовувані речовини вводили перорально мишам лінії C57BL/KsJ-db/dbJcl після 20-годинного голодування. Із хвостової вени кожної миші брали пробу крові безпосередньо перед уведенням сполук, а також через 30хв, 60хв, 120хв та 180хв після введення для визначення рівня цукру в крові. Випробовувані сполуки вводили у формі суспензії в 0,5%-ному розчині метилцелюлози або у формі розчину в поліетиленгліколі-400. При одноразовому введенні 100мг/кг кожної зі сполук, одержаних за Прикладами 80, 88, 119, 129, 131, 137, 140, 154, 155 та 156, спостерігався ефект зниження рівня цукру в крові щонайменше на 30% у порівнянні з рівнем контрольної групи. З одержаних результатів очевидно, що сполуки згідно з цим винаходом спричиняють ефект підвищення активності переносу цукру і що вони корисні для лікування пацієнтів, котрі страждають на діабет. Конкретно, оскільки згадані сполуки здатні спричинити зниження рівня цукру в крові за рахунок ефекту підвищення активності переносу цукру, то вони корисні як засоби для профілактики та/або лікування діабету, периферичної діабетичної невропатії, діабетичної нефропатії, діабетичної ретинопатії, діабетичної макроангіопатії, порушеної толерантності до глюкози або ожиріння. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП ―Український інститут промислової власності‖, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюLactams and their pharmaceutical use
Назва патенту російськоюЛактамы и их фармацевтическое применение
Автори російськоюHirama Ryusuke
МПК / Мітки
МПК: A61K 31/554, A61P 3/10, A61P 13/12, C07D 243/10, C07D 491/147, A61P 27/02, A61K 31/5517, A61P 3/04, C07D 513/04, C07D 498/04, C07D 487/04
Мітки: застосування, лактами, фармацевтичне
Код посилання
<a href="https://ua.patents.su/25-76969-laktami-ta-kh-farmacevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Лактами та їх фармацевтичне застосування</a>
Попередній патент: Спосіб приєднання відкривального пристрою до пакувального матеріалу та упаковка, отримана цим способом
Наступний патент: Електрообігрівач
Випадковий патент: Спосіб розщеплення тонкого повношарового, сітчастого епідермотранслокалізаційного аутодермотрансплантата з кратністю збільшення площі від 1 до 4












