Похідні імідазопіридинзаміщеного тропану з антагоністичною активністю ccr5 рецепторів для лікування віл та запалення
Формула / Реферат
1. Сполука формули (І)
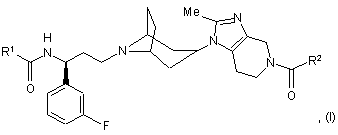
або її фармацевтично прийнятна сіль або сольват, де:
R1 являє собою С1-С6алкіл; і
R2 являє собою С1-С6алкіл або С3-С7циклоалкіл, де вказаний алкіл можливо заміщений CF3.
2. Сполука за п. 1, де R1 являє собою С1-С4алкіл.
3. Сполука за п. 1 або 2, де R1 являє собою метил.
4. Сполука за будь-яким з пп. 1-3, де R2 являє собою С1-С4алкіл, можливо заміщений CF3.
5. Сполука за будь-яким з пп. 1-4, де R2 являє собою метил, етил або ізопропіл.
6. Сполука за будь-яким з пп. 1-3, де R2 являє собою циклопропіл або циклобутил.
7. Сполука за п. 1, вибрана з:
N-{(1S)-3-[3-ендо-(5-ацетил-2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду;
N-{(1S)-3-[3-ендо-(5-циклобутанкарбоніл-2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду;
N-{(1S)-3-[3-ендо-(5-циклопропанкарбоніл-2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду;
N-{(1S)-3-[3-ендо-(5-ізобутирил-2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1] окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду;
N-{(1S)-3-[3-ендо-(2-метил-5-пропіоніл-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду;
N-{(1S)-3-[3-ендо-(5-бутирил-2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду;
N-{(1S)-3-[3-ендо-(2-метил-5-(2,2-диметилпропіоніл)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду;
N-{(1S)-3-[3-ендо-(2-метил-5-(3,3,3-трифторпропіоніл)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду;
і їх фармацевтично прийнятних солей або сольватів.
8. Фармацевтична композиція, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль або сольват за будь-яким з пп. 1-7 разом з одним або більше ніж одним фармацевтично прийнятним ексципієнтом, розріджувачем або носієм.
9. Фармацевтична композиція за п. 8, яка містить один або більше ніж один додатковий терапевтичний агент.
10. Сполука формули (I) або її фармацевтично прийнятна сіль або сольват за будь-яким з пп. 1-7 для застосування як ліків.
11. Сполука формули (I) або її фармацевтично прийнятна сіль або сольват за будь-яким з пп. 1-7 для лікування розладу, в який залучена модуляція CCR5 рецепторів.
12. Сполука за п. 11, де розлад являє собою вірус імунодефіциту людини (ВІЛ), ретровірусну інфекцію, генетично споріднену ВІЛ, синдром набутого імунодефіциту (СНІД) або запальне захворювання.
13. Сполука за п. 11, де розлад являє собою розсіяний склероз, ревматоїдний артрит або відторгнення трансплантата.
14. Сполука за п. 11, де розлад являє собою запальне захворювання кишечнику, ендометріоз, діабет I типу, ниркові захворювання, фіброз, хронічний панкреатит, запальні легеневі стани, енцефаліт, хронічну серцеву недостатність, ішемічну хворобу серця, псоріаз, удар, ожиріння, захворювання центральної нервової системи (ЦНС), анемію, рестеноз, атеросклеротичні бляшки, атопічний дерматит, хронічний панкреатит, рак, біль або реакцію на стрес у результаті хірургічного втручання, інфекції, ушкодження або іншого травматичного ураження.
15. Сполука за п. 11, де розлад являє собою вірус гепатиту В (HBV), вірус гепатиту С (HCV), чуму, поксвірус, токсоплазмоз, мікобактеріальну, трипаносомну інфекцію, пневмонію або цитоспоридіоз.
16. Застосування сполуки формули (I) або її фармацевтично прийнятної солі або сольвату за будь-яким з пп. 1-7 для приготування лікарського засобу для лікування розладу, в який залучена модуляція CCR5 рецепторів.
17. Спосіб лікування ссавця, що страждає розладом, в який залучена модуляція CCR5 рецепторів, при якому здійснюють лікування вказаного ссавця ефективною кількістю сполуки формули (I) або її фармацевтично прийнятної солі або сольвату за будь-яким з пп. 1-7.
18. Сполука за п. 1, яка являє собою фумарат N-{(1S)-3-[3-ендо-(5-ізобутирил-2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду.
19. Комбінація, яка містить сполуку за будь-яким з пп. 1-7 або фармацевтично прийнятну сіль або сольват і один або більше ніж один додатковий терапевтичний агент.
20. Комбінація за п. 19, де додатковий терапевтичний агент або терапевтичні агенти вибирають із агентів, які призначені для лікування захворювань, опосередкованих або асоційованих з модуляцією CCR5 рецептора.
21. Комбінація за п.20, де додатковий терапевтичний агент або терапевтичні агенти вибирають із агентів, які призначені для лікування вірусу імунодефіциту людини (ВІЛ).
22. Комбінація за будь-яким з пп. 19-21, де додатковий терапевтичний агент або терапевтичні агенти вибирають із інгібіторів ВІЛ-протеази, ненуклеозидних інгібіторів зворотної транскриптази, нуклеозидних/нуклеотидних інгібіторів зворотної транскриптази, інших антагоністів CCR5, агентів, які інгібують взаємодію gp120 з CD4, інших агентів, які інгібують проникнення ВІЛ у клітину-мішень, інгібіторів інтегрази та інгібіторів РНКази Н.
23. Комбінація за п. 19, де додатковий терапевтичний агент являє собою інгібітор CYP 3А4.
Текст
1. Сполука формули (І) C2 2 (19) 1 3 84714 4 для лікування розладу, в який залучена модуляція CCR5 рецепторів. 12. Сполука за п. 11, де розлад являє собою вірус імунодефіциту людини (ВІЛ), ретровірусну інфекцію, генетично споріднену ВІЛ, синдром набутого імунодефіциту (СНІД) або запальне захворювання. 13. Сполука за п. 11, де розлад являє собою розсіяний склероз, ревматоїдний артрит або відторгнення трансплантата. 14. Сполука за п. 11, де розлад являє собою запальне захворювання кишечнику, ендометріоз, діабет I типу, ниркові захворювання, фіброз, хронічний панкреатит, запальні легеневі стани, енцефаліт, хронічну серцеву недостатність, ішемічну хворобу серця, псоріаз, удар, ожиріння, захворювання центральної нервової системи (ЦНС), анемію, рестеноз, атеросклеротичні бляшки, атопічний дерматит, хронічний панкреатит, рак, біль або реакцію на стрес у результаті хірургічного втр учання, інфекції, ушкодження або іншого травматичного ураження. 15. Сполука за п. 11, де розлад являє собою вірус гепатиту В (HBV), вір ус гепатиту С (HC V), чуму, поксвірус, токсоплазмоз, мікобактеріальну, трипаносомну інфекцію, пневмонію або цитоспоридіоз. 16. Застосування сполуки формули (I) або її фармацевтично прийнятної солі або сольвату за будьяким з пп. 1-7 для приготування лікарського засобу для лікування розладу, в який залучена модуляція CCR5 рецепторів. 17. Спосіб лікування ссавця, що страждає розладом, в який залучена модуляція CCR5 рецепторів, при якому здійснюють лікування вказаного ссавця ефективною кількістю сполуки формули (I) або її фармацевтично прийнятної солі або сольвату за будь-яким з пп. 1-7. 18. Сполука за п. 1, яка являє собою фумарат N{(1S)-3-[3-ендо-(5-ізобутирил-2-метил-4,5,6,7тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетаміду. 19. Комбінація, яка містить сполуку за будь-яким з пп. 1-7 або фармацевтично прийнятну сіль або сольват і один або більше ніж один додатковий терапевтичний агент. 20. Комбінація за п. 19, де додатковий терапевтичний агент або терапевтичні агенти вибирають із агентів, які призначені для лікування захворювань, опосередкованих або асоційованих з модуляцією CCR5 рецептора. 21. Комбінація за п.20, де додатковий терапевтичний агент або терапевтичні агенти вибирають із агентів, які призначені для лікування вірусу імунодефіциту людини (ВІЛ). 22. Комбінація за будь-яким з пп. 19-21, де додатковий терапевтичний агент або терапевтичні агенти вибирають із інгібіторів ВІЛ-протеази, ненуклеозидних інгібіторів зворотної транскриптази, нуклеозидних/нуклеотидних інгібіторів зворотної транскриптази, інших антагоністів CCR5, агентів, які інгібують взаємодію gp120 з CD4, інших агентів, які інгібують проникнення ВІЛ у клітину-мішень, інгібіторів інтегрази та інгібіторів РНКази Н. 23. Комбінація за п. 19, де додатковий терапевтичний агент являє собою інгібітор CYP 3А4. Даний винахід стосується похідних тропану, способів їх одержання, композицій, що їх містять і їх застосування. Більш особливо, представлений винахід стосується застосування похідних 8азабіцикло[3.2.1]октану при лікуванні різних розладів, включаючи розлади в які включене модулювання, зокрема, антагонізм активності хемокінових CCR5 рецепторів. Відповідно, сполуки згідно з винаходом є придатними для використання при лікуванні ВІЛ, такого як ВІЛ-1 і генетично пов'язаних ретровірусних інфекцій (і як результат синдром набутого імунодефіциту, СНІД) і запальних захворювань. Назва "хемокін", являє собою скорочення терміну "хемотактичні цитокіни". Хемокіни складають велику родину протеїнів, що мають загальні важливі структурні одиниці та які мають здатність притягувати лейкоцити. Як лейкоцитні хемотактичні фактори, хемокіни відіграють необхідну роль в притягуванні лейкоцитів до різних тканин організму, процесі який є необхідним як для запалення, так і для відповіді організму на інфекцію. Оскільки хемокіни та їх рецептори є головними в патофізіології запальних та ін фекційних захворювань, агенти, які є корисними в модулюванні, переважно антагонізації активності хемокінів та їх рецепторів, є корисними в терапевтичному лікуванні таких запальних та інфекційних захворювань. Рецептор хемокіну CCR5 є особливо важливим в лікуванні запальних та інфекційних захворювань. CCR5 є рецептором для хемокінів, особливо для протеїнів запальних макрофагів (МІР), які позначаються як MIP-1a та ΜΙΡ-1β, та для протеїну, який стабілізується при активації і експресується та виділяється нормальною Т-клітиною (RANTES). Нещодавно знайдено групу сполук, що є і сильними і селективними модуляторами, зокрема, антагоністами CCR5 рецептора. Відповідно до першого аспекту представленого винаходу забезпечується сполука формули (І) або її фармацевтично прийнятна сіль, сольват або похідне, де: R1 представляє собою C1-C6 алкіл; і 5 84714 R2 представляє собою C1-C6 алкіл або C3-C7 циклоалкіл, де згаданий алкіл є необов'язково заміщений CF3. Термін "алкіл" як група або частина групи включає нерозгалужені ι розгалужені групи. Приклади алкілів включають метил, етил, н-пропіл, іпропіл, н-бутил, і-бутил, втор-бутил ι т-бутил. Термін "C3-C7 циклоалкіл" означає циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил. У першому втіленні, R1 представляє собою C1C4алкіл. У подальшому втіленні, R1 представляє собою метил. У подальшому втіленні, R2 представляє собою C1-C46алкіл, необов'язково заміщений CF3. У подальшому втіленні, R2 представляє собою циклопропіл або циклобутил. У подальшому втіленні, R2 представляє собою метил, етил або і-пропіл. Слід розуміти, що винахід о хоплює всі комбінації втілень винаходу як описано вище, що узгоджуються з визначенням сполук формули (І). Сполуки згідно з винаходом, включають сполуки формули (І) і фармацевтично прийнятні солі, сольвати або похідні на їх основі (де похідні включають комплекси, пролікарські форми і мічені ізотопами сполуки, також як їх солі і сольвати). У подальшому втіленні, сполуки згідно з винаходом є сполуками формули (І) і їх фармацевтично прийнятними солями і сольватами, зокрема сполуками формули (І). Слід розуміти, що вищезгадані сполуки згідно з винаходом включають їx поліморфи і ізомери. Фармацевтично прийнятні солі сполук формули (І) включають їх кислотно-адитивні й основні солі. Придатні кислотно-адитивні солі одержують з кислот, які утворюють нетоксичні солі. Приклади включають ацетатні, аспартатні, бензоатні, бесилатні, бікарбонатні, бісульфатні, боратні, бромідні, камсилатні, карбонатні, хлоридні, цитратні, едизилатні, езилатні, форміатні, фумаратні, глуцептатні, глюконатні, глюкуронатні, гексафторфосфатні, хібензатні, гідробромідні, гідрохлоридні, гідройодидні, йодидні, ізотіонатні, лактатні, малатні, малеатні, малонатні, мезилатні, метилсульфатні, 2напсилатні, нікотинатні, нітратні, оротатні, оксалатні, пальмітатні, пальмоатні, фосфатні/ гідрофосфатні/дигідрофосфатні, сахаратні, стеаратні, сукцинатні, сульфатні, тартратні, тозилатні і трифторацетатні солі. Придатні основні солі утворюються з основ, що утворюють нетоксичні солі. Приклади включають алюмінієві, аргінінові, бензатинові, кальцієві, холінові, діетиламінові, діоламінові, гліцинові, лізинові, магнієві, меглумінові, оламінові, калієві, натрієві, трометамінові та цинкові солі. Для огляду придатних солей дивіться "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" [Довідник з фармацевтичних солей: властивості, вибір та застосування), Stahl і Wermuth, (Wiley-VCH, Weinheim, Germany 2002]. 6 Фармацевтично прийнятні солі сполук формули (І) можуть бути одержані одним або більшою кількістю з трьох способів: (і) за допомогою реакції сполуки формули (І) з бажаною кислотою; (іі) шляхом видалення кислотно- або основнолабільної захисної групи з придатного прекурсора сполуки формули (І) або відкриттям кільця придатного, циклічного прекурсора, наприклад, лактону або лактаму, з використанням бажаної кислоти; або (ііі) шляхом перетворення однієї солі сполуки формули (І) на іншу за допомогою реакції з відповідною кислотою або за допомогою придатної іонообмінної колонки. Всі три реакції типово виконуються в розчині. Сіль може осаджуватися з розчину і бути зібрана фільтруванням або може бути відновлена шляхом випаровування розчинника. Ступінь іонізації в солі може змінюватися від цілком іонізованого до майже не-іонізованого. Сполуки згідно з винаходом можуть існувати в несольватованих формах, а також в сольватованих формах. Термін "сольват", в даному контексті, використовується для опису молекулярного комплексу, що включає сполуку згідно з винаходом та одну або більше фармацевтично прийнятних молекул розчинника, наприклад, етанолу. Термін "гідрат", в даному контексті, використовується, коли згаданий розчинник є водою. Комплекси включають клатрати, тобто комплекси включення, такі як лікарська речовина"хазяїн", в яких, на відміну від вищезгаданих сольватів, лікарська речовина та "хазяїн" присутні в стехіометричній або не-стехіометричній кількостях. Також включені комплекси є комплексами лікарська речовина, що містить два або більше органічних і/або неорганічних компонентів, що можуть бути в сте хіометричних або не-стехіометричних кількостях. Кінцеві комплекси, можуть бути іонізовані, частково іонізовані або не-іонізовані. Для огляду таких комплексів, дивіться J. Pharm. Sci, 64 (8), 1269-1288, Haleblian (серпень 1975). Сполуки згідно з винаходом можуть мати здатність кристалізуватися в більше ніж одну форму, характеристика відома як поліморфізм і всі такі поліморфні форми ("поліморфи") охоплені в межах винаходу. Поліморфізм головним чином може відбуватися як відповідь на зміни в температурі або тиску або в них обох і може також витікати з видів процесу кристалізації. Поліморфи можуть відрізнятися різними фізичними характеристиками і типово картини дифракції рентгенівських променів, характер розчинності та температура плавлення сполуки використовуються для розрізнення поліморфів. Певні похідні сполук формули (І), що можуть мати невелику або ніяку фармакологічну дію, якщо вводяться в організм або на тіло, можуть бути перетворені у сполуки формули (І), що має бажану дію, наприклад, за допомогою гідролізного розщеплення. Такі похідні відносяться до "проліків". Подальша інформація щодо використання проліків може бути знайдена у "Prodrugs as Novel Delivery System, Vol.14, ACS Symposium Series (T Higuchi і W Stella) та "Bioreversible Carriers in Drug Design", 7 84714 Pergamon Press, 1987 [ред. E B Roche, Американська Фармацевтична Асоціація]. Проліки відповідно до винаходу можуть, наприклад, бути одержані, заміною відповідних функціональних гр уп присутніх у сполуках формули (І) певними фрагментами, відомими фахівцям цієї галузі як "про-фрагменти" як описано, наприклад, в "Design of Prodrugs" H. Bundgaard (Elsevier) 1985. Оскільки сполуки формули (І) містять вторинні аміно-групи (-NHR, де R≠H), приклади проліків відповідно до винаходу включають їх аміди, одержані, наприклад, заміною водню (С1-С10) алканоїлом. Подальші приклади замінних груп відповідно до вищезгаданих прикладів і прикладів інших типів проліків відповідно до винаходу можуть бути знайдені у вищезгаданих цитуваннях, що включені в заявку як посилання. Нарешті, певні сполуки формули (І) можуть самостійно діяти як пролікарські форми інших сполук формули (І). Також у межах винаходу представлені метаболіти сполук формули (І), коли вони утворені in vi vo при введенні лікарського засобу. Деякі приклади метаболітів відповідно до винаходу включають: (і) де сполука формули (І) містить метилову груп у, її гідроксиметилове похідне (-CH3- > CH2OH); (іі) де сполука формули (І) містить третинну аміно-групу, її похідне у вигляді вторинної аміногрупи (-NR1R2- > -NHR 1 або -NHR2); (ііі) де сполука формули (І) містить вторинну аміно-групу, її по хідне у вигляді первинної аміногрупи (-NHR1 - > -NH2); (iv) де сполука формули (І) містить фенільний залишок, його фенольне похідне (-Ph- > -PhOH); і (ν) де сполука формули (І) містить амідну гр упу, її похідне у вигляді карбоксильної групи (CONH2- > COOH). Сполуки формули (І) можуть містити один або більшу кількість асиметричних атомів вуглецю і таким чином існувати у вигляді дво х або більшої кількості стереоізомерів. Заміщення імідазолу тропанового кільця у сполуках формули (І) може бути або в ендо-або екзо- конфігурації і тому можливі геометричні цис/транс (або Ζ/Ε) ізомери. У випадках, коли сполука містить, наприклад, кето групу може існувати таутомерна ізомерія ("таутомерія"). З вищевикладеного випливає, що окрема сполука може існувати в формі більше ніж одного типу ізомерії. Включені в межах представленого винаходу всі сполуки є стереоізомерами сполук формули (І), включаючи всі оптичні ізомери, геометричні ізомери і таутомерні форми, включаючи сполуки, що існують в формі більше ніж одного типу ізомерії і сумішей одного або більшої їх кількості. Включені також кислотно-адитивні або основні солі, де протиіон є оптично активним, наприклад, D-лактат або L-лізин, або рацемічним, наприклад, DL-тартрат або DL-аргінін. Перевага надається заміщенню імідазолу тропанового кільця в ендо- конфігурації. Ендо/екзо ізомери можуть бути виділені за допомогою стан 8 дартних методик, добре відомих фа хівцям даної галузі, наприклад, за допомогою хроматографії та фракційної кристалізації. Стандартні методики для одержання/виділення індивідуальних енантіомерів включають хіральний синтез з прийнятного оптично чистого прекурсора або розділення рацемата (або рацемата солі або похідного) використовуючи, наприклад, хіральну рідинну хроматографію високого тиску (ВЕРХ). Альтернативно, рацемат (або рацемічний прекурсор) можна піддавати реакції з прийнятною оптично активною сполукою, наприклад, спиртом, або у разі, коли сполука формули (І) містить кислий або основний залишок, кислоту або основу, такі як винна кислота або 1-фенілетиламін. Одержана діастереомерна суміш може бути виділена за допомогою хроматографії і/або фракційної кристалізації та один або обидва з діастереоізомерів, перетворюються на відповідні чисті енантіомер(и) за допомогою засобів, добре відомих фа хівцям даної галузі. Хіральні сполуки винаходу (і їх хіральні прекурсори) можуть бути отримані в енантіомернозбагаченій формі, використовуючи хроматографію, типово ВЕРХ, на асиметричній смолі з мобільною фазою, що складається з вуглеводню, зазвичай гептану або гексану, що містить від 0 до 50% ізопропанолу, зазвичай від 2 до 20% і від 0 до 5% алкіламіну, зазвичай 0,1% діетиламіну. Концентруванням елюату одержують збагачену суміш. Стереоізомерні конгломерати можуть бути виділені за допомогою стандартних методик, добре відомих фахівцям цієї галузі - дивіться, наприклад, "Стереохімію Органічних сполук" E. L. Eliel (Wiley, Нью-Йорк, 1994). Представлений винахід також включає всі фармацевтично придатні мічені ізотопами сполуки формули (І), в якій один або більша кількість атомів замінені атомами, що мають той же самий атомний номер, але атомну масу або атомне число, відмінні від природної атомної маси або атомного числа. Приклади ізотопів, що придатні для включення в сполуки згідно з винаходом включають ізотопи водню, такі як 2H і 3H, вуглецю, такі як 11C, 13C і 14C, хлору, такі як 36CI, фтору, такі як 18F, йоду, такі як 123 I і 125 I, азоту, такі як 13N і 15N, кисню, такі як 15O, 17 O і 18 O, фосфору, такі як 32P і сірки, такі як 35S. Певні мічені ізотопами сполуки формули (І), наприклад, наприклад, ті в які включений радіоактивний ізотоп, є корисними в ліках і/або в дослідженнях по розподіленню субстрату у тканинах. Радіоактивних ізотопи тритію, тобто, 3H, та вуглецю-14, тобто, 14C, є особливо корисними для цієї цілі, завдяки легкості їх одержання та здатності для виявлення. Заміщення важкими ізотопами, такими як, дейтерій, тобто, 2H, може мати певні терапевтичні переваги внаслідок їх більшої метаболічної стабільності, наприклад, підвищеного часу напівжиття in vivo або зменшених вимог до дозування і, отже, може бути бажаним в деяких обставинах. Заміщення ізотопами, що випускаються позитроном, такими як 11C, 18F, 15 O та 13N, може бути 9 84714 корисним в Positron Emission Topography (PET) дослідженнях для вивчення інтенсивності зв'язування рецептора з субстратом. Мічені ізотопами сполуки формули (І) можуть взагалі бути одержані за допомогою стандартних методик, відомих фа хівцям даної галузі, або процесів, аналогічних тим, що описані у супровідних Прикладах та Препаративних прикладах, заміщенням легко доступного міченого ізотопом реагента на не мічений ізотопом реагент. Фармацевтично прийнятні сольвати відповідно до винаходу включають ті, в яких розчинник кристалізації може бути заміщений ізотопами, наприклад, D2O, d6-ацетон, d6-ДМСО. Переважні сполуки формули (І) включають сполуки Прикладів 1-8; і їх фармацевтично прийнятні солі, сольвати або похідні. У загальних процесах і схемах, що випливають: R1 і R2 мають попередньо визначені значення, якщо інакше не вказано; Z представляє собою OH, або активуючу гр упу карбонової кислоти, таку як хлор або 1Н-імідазол-1-іл; EsGp представляє собою естер-утворюючу груп у, таку як C1-6 алкіл; PG представляє собою аміно-захисну гр упу, таку як boc; ArLg представляє собою відхідну груп у придатну для ароматичного нуклеофільного заміщення, таку як описана у Jerry March, Ad vanced Organic Chemistry (4-е видання), Wiley lnterscience, 1992, сторінка 652 (включена тут посиланням), наприклад, F, Cl, Br, OMe або OEt; boc представляє собою трет-бутоксикарбоніл; ДМФ представляє собою Ν,Ν-диметилформамід; DCM представляє собою дихлорметан; ТГФ представляє собою тетрагідрофуран; Lg представляє собою відхідну груп у придатну для аліфатичного н уклеофільного заміщення, таку як описана у Jerry March, там же, сторінка 352 (включена тут посиланням), що включає Cl, Br, І і естери сульфонової кислоти (наприклад, тозилат, мезилат і трифлат); WSCDI представляє собою гідрохлорид 1-(3диметиламінопропіл)-3-етилкарбодііміду; DCC представляє собою Ν,Ν'дициклогексилкарбодіімід; HOAT представляє собою 1-гідрокси-7-азабензотриазол; HOBt представляє собою гідрат 1-гідроксибензотриазолу; HBTU представляє собою гексафторфосфат Обензотриазол-1-іл-N,N,N',N'-тетраметилуронію. Відповідно до першого способу (А) сполуки формули (І) можуть бути одержані, за допомогою реакції сполуки формули (II) з сполукою формули (III) 10 при стандартних умовах конденсування карбонова кислота/амін. Стандартно, конденсування здійснюють при умовах, описаних далі відповідно до схеми 1, стадії (і). Відповідно до другого способу (В) сполуки формули (І) можуть бути одержані, за допомогою реакції сполуки формули (XVI) зі сполукою формули (V) при стандартних умовах конденсування карбонова кислота/амін. Стандартно, конденсування здійснюють при умовах, описаних далі відповідно до схеми 1а, стадії (і) Відповідно до третього способу (C) сполуки формули (І) можуть бути одержані за допомогою відновного амінування альдегіду формули (XIX) з аміном формули (XX) при стандартних умовах. Стандартно, відновне амінування здійснюють при умовах, описаних надалі відповідно до схеми 1, стадії (д). Відповідно до четвертого способу (D) сполуки формули (І) можуть бути одержані за допомогою відновного амінування нітрилу формули (XXI) з аміном формули (XX) при стандартних умовах. Стандартно, відновне амінування здійснюють при умовах, описаних надалі відповідно до схеми 1, стадії (д). Відповідно до п'ятого способу (E) сполуки формули (І) можуть бути одержані алкілуванням аміну формули (XX) з сполукою формули (XXII) 11 84714 при стандартних умовах алкілування. Стандартно, алкілування здійснюють в придатному розчиннику, такому як галоалкан (наприклад, DCM), спирт (наприклад, етанол) або етер (наприклад, ТГФ); при необхідності в присутності основи, такої як амін (наприклад, триетиламін або N-етил-N,Nдіізопропіламін); і при температурі в діапазоні від температури навколишнього середовища до підвищеної температури (наприклад, при температурі кипіння). Відповідно до іншого способу (F), сполуки формули (І) можуть бути одержані за допомогою асиметричного відновлення енаміду формули (XXIII) при стандартних умовах відновлення. Стандартно, асиметричне відновлення здійснюють в присутності перехідного металу такого як Rh, Ru, Pd, Pt, Ir або Ті (наприклад, представлені у 0,0010,1моль екв.); хірального ліганда такого як BINAP (2,2-біс(дифенілфосфін)-1,1'-бінафтил), тол-BINAP (2,2-біс(ди-п-толілфосфін)-1,1'-бінафтил), DuPHOS (1,2-біс(2,5-диметилфосфолано)бензол) або Penn-Phos (Ρ,Ρ-1,2-феніленбіс(ендо-2,5-диметил7-фосфабіцикло[2,2,1]гептан) (наприклад, представлений в 0,001-0,2моль екв.); донор водню, такий як молекулярний водень, фенілсилан, 2пропанол або форміат амонію; у розчиннику, такому як спирт (наприклад, метанол, етанол або 2пропанол), нітрил (наприклад, ацетонітрил), естер (наприклад, етилацетат), етер (наприклад, ТГФ) або толуол; при температурі від 0°C до температури кипіння; і при необхідності при підвищеному тиску. Відповідно до іншого способу (G) сполуки формули (І) можуть бути одержані з аміну формули (II) або його солі металу (тобто депротонірованої 12 форми), за допомогою реакції з естером формули (XXIV) R1CO2EsGp (XXIV) при стандартних умовах. С тандартно, реакцію здійснюють в присутності надлишку основи, такої як амін (наприклад, триетиламін або N-етил-N,Nдіізопропіламін); необов'язково каталізатора; у придатному розчиннику, такому як галоалкан (наприклад, DCM), етер (наприклад, ТГФ), естер (наприклад, етилацетат) або толуол, з або без присутності води як спів-розчинника. Альтернативно, реакцію здійснюють в присутності ферментного каталізатора; у придатному розчиннику такому як галоалкан (наприклад, DCM), етер (наприклад, ТГФ), естер (наприклад, етилацетат) або толуол, з або без присутності води як спів-розчинника. Схеми, що надалі ілюструють головні способи одержання сполук формули (І) і їх проміжних сполук наведені нижче. Фахівцям даної галузі буде зрозуміло, що методики описані в схемах одержання сполук формули (І) або їх проміжних сполук не можуть бути застосовані відносно деяких можливих замісників. Фахівцям даної галузі буде зрозуміло, що це може бути необхідним або бажаним для здійснення перетворень, описаних в схемах у послідовності відмінній порівняно з описаною або для модифікування одного або більшої кількості перетворень, для одержання цільової сполуки формули (І). Фахівцям даної галузі також буде зрозуміло що, як проілюстровано в наведених нижче схемах, це може бути необхідним або бажаним на будьякій стадії в синтезі сполук формули (І), для здійснення захисту однієї або більшої кількості чутливих гр уп в молекулі, а також для попередження небажаних побічних реакцій. Зокрема, це може бути необхідним або бажаним для здійснення захисту аміно-груп. Захисні групи, використовувані при одержанні сполук формули (І) можуть використовуватися за стандартною методикою. Дивіться, наприклад, групи, що описані в "Protective Groups in Organic Synthesis" у Theodora W Green і Peter G M Wuts, третє видання, (John Wiley and Sons, 1999), зокрема, глава 7, сторінки 494-653 ("Protection for the Amino Group"), що включене тут як посилання, що також описує способи для видалення таких гр уп. Захисні аміно-групи Ьос, бензилоксикарбоніл, метоксикарбоніл, бензил і ацетил мають специфічне використання при одержанні сполук формули (І) і її проміжних сполук. 13 84714 Особливо посилаючись на схему 1, відображені в ній перетворення можуть здійснюватися наступним чином: (a) Заміщення відхідної групи на нітропіридині формули (XV) аміном формули (XIV) стандартно здійснюють в присутності основи, такої як амін (наприклад, триетиламін або N-етил-N,Nдіізопропіламін) або карбонат лужного металу (наприклад, карбонат натрію або карбонат калію); у розчиннику, такому як спирт (наприклад, метанол або етанол), нітрил (наприклад, ацетонітрил) або амід (наприклад, ДМФ); і при температурі в діапазоні від навколишнього середовища до підвищеної температури (наприклад, до приблизно 120°C). (b) Імідазопіридин формули (XII) може бути одержаний шляхом відновлення і in situ циклізації аміно-нітропіридину формули (XIII). Відновлення стандартно здійснюють в присутності відновлюва 14 льного агента, такого як порошкоподібне залізо; розчиннику, такому як карбонова кислота (наприклад, оцтова кислота); і при температурі в діапазоні від температури навколишнього середовища до приблизно 120°C. Циклізацію проміжного аміноамінопіридину стандартно здійснюють шляхом додаванням оцтового ангідриду та при підвищеній температурі (наприклад, приблизно 140°C). (c) Відновлення імідазопіридину формули (XII) з одержанням імідазопіперидину формули (Xl) стандартно здійснюють каталітичним гідруванням у присутності придатного каталізатора, такого як каталізатор перехідного металу, наприклад, платини (наприклад, оксиду платини) або паладієвого каталізатора (наприклад, гідроксиду паладію або паладію на вуглеці); у розчиннику, такому як спирт (наприклад, метанол або етанол) або карбонова кислота (наприклад, оцтова кислота); при темпе 15 84714 ратурі в діапазоні від температури навколишнього середовища до підвищеної температури (наприклад, до 80°C; і при підвищеному тиску в атмосфері водню, такому як від 150 до 500кПа (наприклад, в атмосфері водню при 400кПа) (d) Імідазопіперидин формули (Xl) може бути захищений за допомогою реакції з алкілхлорформіатом (наприклад, метилхлорформіат). Реакцію стандартно проводять в розчиннику, такому як галоалкан (наприклад, DCM) або етер (наприклад, ТГФ), з використанням основи, такої як амін (наприклад, триетиламін або N-етил-N,Nдіізопропіламін) при кімнатній температурі. (є) Альтернативно до стадій (с) і (d), імідазопіридин формули (XII) обробляють алкілхлорформіатом (наприклад, метилхлорформіатом) і амінною основою (наприклад, триетиламіном або N-етилN,N-діізопропіламіном), з одержанням проміжної сполуки четвертинного амонію, яку відновлюють при стандартних умовах. Стандартно, метилхлорформіат додають до імідазопіридину формули (XII) у присутності розчинника, такого як етер (наприклад, ТГФ) або галоалкан (наприклад, DCM) і при температурі навколишнього середовища, з одержанням проміжної сполуки четвертинного амонію, яку потім відновлювали шляхом додавання галоїду лужного металу, такого як борогідрид літію, при умовах зниженої температури (наприклад, приблизно -70°C). Одержану проміжну сполуку, потім відновлюють шляхом каталітичного гідруванням у присутності придатного каталізатора, такого як каталізатор перехідного металу, наприклад, паладієвого каталізатора (наприклад, гідроксиду паладію або паладію на вуглеці); у розчиннику, такому як спирт (наприклад, метанол або етанол) або карбонова кислота (наприклад, оцтова кислота); при температурі в діапазоні від температури навколишнього середовища до підвищеної температури (наприклад, до 80°C). (f) Коли захисною групою є захисна ацетильна група або подібна група, її видалення стандартно здійснюють обробкою основою, такою як гідроксид лужного металу (наприклад, гідроксид натрію або калію) або кислотою, такою як неорганічна кислота (наприклад, HCI) і при підвищеній температурі, такій як від 60-100°C. (g) Сполуки формули (VII) одержують шляхом відновного амінування альдегіду формули (IX) за допомогою аміну формули (VIII). Стандартно, реакцію проводять в присутності кислоти, такої як органічна кислота (наприклад, оцтова кислота); у розчиннику, такому як етер (наприклад, ТГФ) або галоалкан (наприклад, DCM); з використанням як 16 відновлювального агента гідриду лужного металу, такого як триацетоксиборопдрид натрію, ціаноборогідрид натрію або борогідрид натрію; і при температурі навколишнього середовища. (h) Коли захист на стадії (d) здійснюється за допомогою метоксикарбонільної групи, її видалення стандартно здійснюють обробкою основою, такою як гідроксид лужного металу (наприклад, гідроксид натрію або калію) у розчиннику, такому як водний розчин спирту (наприклад, Н2O/пропан2-ол) при підвищеній температурі (наприклад, 100°C). (і) Конденсування кислота/амін стандартно здійснюють, з використанням аміну формули (Vl) ι хлорангідриду формули (V); надлишку акцептора кислоти, такого як триетиламін або N-етил-N,Nдіізопропіламін; розчинника, такого як галоалкан (наприклад, DCM) або етер (наприклад, ТГФ); і при температурі навколишнього середовища. Альтернативно, конденсування кислота/амін здійснюють, використовуючи кислоту формули (V) активовану реагентами, такими як WSCDI або DCC і HOBt або HOAt; надлишок акцептора кислоти, такої як триетиламін або N-етил-N,Nдіізопропіламін; розчинник, такий як галоалкан (наприклад, DCM) або етер (наприклад, ТГФ); і при температурі навколишнього середовища. (j) Коли захисна група представляє собою bос захисну груп у, її видалення стандартно здійснюють в присутності кислоти, такій як неорганічна кислота (наприклад, безводна HCI) або трифтороцтова кислота; у придатному розчиннику, такому як естер (наприклад, етилацетат), галоалкан (наприклад, DCM) або етер (наприклад, ТГФ); і при температурі від 0°C до температури навколишнього середовища. (k) Конденсування кислота/амін стандартно здійснюють, з використанням аміну формули (II) і кислоти або хлорангідриду (III), при умовах, описаних вище на стадії (і). Фахівцям цієї галузі зрозуміло, що одне або більша кількість перетворень, описаних у схемі 1 може бути виконане в послідовності відмінній порівняно з описаною, або перетворення можуть бути модифіковані, для того щоб одержати цільову сполуку формули (І). У варіанті схеми 1, сполуки формули (І) можуть бути одержані, за допомогою здійснення стадій (h)-(k) у різній послідовності, як проілюстровано в нижченаведеній схемі 1а. 17 84714 Сполуки формули (XX) мають структур у аналогічну стр уктурі сполук формули (І) або її проміжних сполук і можуть бути одержані аналогічними способами. Сполуки формул (III), (V), (IX), (XV), (XIX), (XXI), (XXII) і (XXIII) або відомі сполуки або можуть бути одержані за допомогою стандартної хімії; дивіться, наприклад, WO01/90106 (особливо сторінки 5-19), що включена тут посиланням. Сполуки формули (І) і їх фармацевтично прийнятні солі, сольвати і похідні є придатними для використання, тому що вони мають фармакологічну дію у тварин, включаючи людей. Більш особливо, вони є придатними для використання при лікуванні розладу, у якому залучено модулювання CCR5 рецепторів. Особливий інтерес представляють хворобливі стани, що включають ВІЛ, ретровірусні інфекції, генетично обумовлені ВІЛ, СНІД і запальні захворювання. Сполуки згідно з винаходом можуть використовуватися для лікування респіраторних розладів, включаючи респіраторний дистрессиндром повнолітніх (ARDS), бронхіт, хронічний бронхіт, хронічне обструктивне легеневе захворювання, кістозний фіброз, астму, емфізему, риніт і хронічний синусит. Іншими станами, які можуть лікуватися, є стани ініційовані, викликані дією або будь-яким іншим чином корелюються з трафіком Т-клітин у різні органи. Очікується, що сполуки згідно з винаходом можуть бути корисні для лікування таких станів і зокрема, але не обмежуючись, станів, для яких була встановлена кореляція з CCR5 або CCR5 хемокінами і більш особливо, але не обмежуючись, наступні стани: розсіяний склероз; артрит, такий як ревматоїдний артрит, спондилоартропатія, подагричний артрит, остеоартрит, системний червоний вовчак і ювенільний артрит; і відторгнен 18 ня трансплантату, зокрема, але не обмежуючись, трансплантатів органів, таких як сердця, легені, печінки, нирок і трансплантатів підшлункової залози (наприклад, ниркові і легеневі алотрансплантати). Інші стани, для яких була встановлена подібна кореляція з CCR5 або CCR5 хемокінами, включають, але не обмежуються: запальне захворювання кишечнику, включаючи Хворобу Крона і неспецифічний виразковий коліт; ендометріоз; діабет типу І; ниркові захворювання, такі як гломерулярне захворювання (наприклад, гломерулонефрит); фіброз, такий як печінковий, легеневий і нирковий фіброз; хронічний панкреатит; запальні стани легень; енцефаліт, такий як енцефаліт пов'язаний з ВІЛ; хронічна серцева недостатність; ішемічна хвороба серця; псоріаз; інсульт; ожиріння; захворювання ЦНС, такі як деменція, пов'язана зі СНІД і хвороба Альцгеймера; анемія; рестеноз; атеросклеротичні бляшки; атопічний дерматит; хронічний панкреатит; рак, такий як неходжкінова лімфома, саркома Капоши, меланома і рак молочної залози; біль, такий як ноцицептивний біль і невропатичний біль (наприклад, периферійний невропатичний біль); і відповідь на стрес, викликаний хірургічним втручанням, інфекцією, ушкодженням або іншими видами травм. Інфекційні захворювання, де включено модулювання CCR5 рецептора, включають гострий і хронічний гепатити, викликані інфікуванням вірусом В (HBV) і вірусом C (HCV); бубонну, септимічну і легеневу чуму; поксвірусну інфекцію, таку як віспа; токсоплазмозну інфекцію; мікобактеріальну інфекцію; трипаносомальну інфекцію, таку як Хвороба Чагаса; пневмонію; ι цитоспоридіоз. Останній огляд можливих застосувань хемокінів і блокаторів хемокінового рецептора описаний у Cascieri, M.A., і Springer, M.S., "The 19 84714 chemokine/chemokine receptor family: potential and progress for terapeutic intervention", Curr. Opin. Chem. Biol., 4 (4), 420-7 (серпень 2000). Відповідно, в іншому аспекті винахід забезпечує сполук у формули (І) або її фармацевтично прийнятну сіль, сольват або похідне для використання як лікарського засобу. В іншому аспекті винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або похідне, для лікування розладу, в який включене модулювання CCR5 рецепторів. В іншому аспекті винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або похідне, для лікування ВІЛ, ретровірусної інфекції, генетично пов'язаної з ВІЛ, СНІД або запального захворювання. В іншому аспекті винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або похідне, для лікування респіраторного розладу, включаючи респіраторний дистрессиндром повнолітніх (ARDS), бронхіт, хронічний бронхіт, хронічне обструктивне легеневе захворювання, кістозний фіброз, астму, емфізему, риніт або хронічний синусит. В іншому аспекті винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або похідне, для лікування розсіяного склерозу, ревматоїдного артриту або відторгнення трансплантату. В іншому аспекті винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або похідне, для лікування запального захворювання кишечнику; ендометріозу; діабету типу І; ниркових захворювань; фіброзу; хронічного панкреатиту; запальних станів легень; енцефаліту; хронічної серцевої недостатності; ішемічної хвороби серця; псоріазу; інсульту; ожиріння; захворювань ЦНС; анемії; рестенозу; атеросклеротичних бляшок; атопічног дерматиту; хронічного панкреатиту; раку; болю; або відповіді на стрес, внаслідок хірургічного втручання, інфекції, ушкодження або інших видів травм. В іншому аспекті винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або похідне, для лікування гепатитів, викликаних вірусом В (HBV), вірусом C (HCV), чуми, вірусу віспи, токсоплазмозу, мікобактеріальної інфекції, трипаносомальної інфекції, пневмонії або цитоспоридіозу. В іншому аспекті винахід забезпечує використання сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або похідного для виготовлення лікарського засобу для лікування розладу, в який включене модулювання CCR5 рецепторів. В іншому аспекті винахід забезпечує спосіб лікування розладу у ссавця, в який включене модулювання CCR5 рецепторів, який включає лікування, згаданого ссавця ефективною кількістю сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або похідного. Сполуки згідно з винаходом можуть призначатися у вигляді кристалічного або аморфного продуктів. Вони можуть бути отримані, наприклад, у вигляді твердих тампонів, порошків або плівок за 20 допомогою способів, таких як осаджування, кристалізація, сублімаційна сушка, сушка розпиленням або випаровуванням. Для цієї цілі може використовуватися мікрохвильове або радіочастотне висушування. Сполуки згідно з винаходом можуть призначатися поодинці або в комбінації з одним або більшою кількістю інших лікарських засобів (або у вигляді будь-якої їх комбінації). Взагалі вони будуть призначатися як рецептура у сполученні з одним або більшою кількістю відповідного фармацевтично прийнятного ексціпієнтів. Термін "ексціпієнт", використовуваний тут, описує будь-який інгредієнт, відмінний від сполук(и) винаходу. Вибір ексціпієнта у значній мірі буде залежати від специфічного способу введення, впливу ексціпієнта на розчинність і стабільность і характеру дозованої форми. Фармацевтичні композиції, прийнятні для доставки сполук представленого винаходу та способи їх одержання будуть очевидні для фахівців даної галузі. Такі композиції та способи їх одержання можуть бути знайдені, наприклад, в "Remington's Pharmaceutical Sciences", 19-е Видання (Mack Publishing Company, 1995). Сполуки представленого винаходу можуть вводитися оральним шляхом. Оральне введення може включати ковтання, внаслідок чого сполука потрапляє в шлунково-кишковий тракт, або може застосовуватися букальне або сублінгвальне введення для того, щоб сполука потрапляла в кров безпосередньо з рота. Рецептури, прийнятні для орального введення включають тверді композиції, такі як таблетки, капсули, що містять частинки, розчини або порошки, лозенги (включаючи рідинонаповнені), жувальні гумки, мульти- та наночастинки, гелі, твердий розчин, ліпосоми, плівки (включаючи мукоадгезиви), овули, спреї і рідкі композиції. Рідкі рецептури включають супензії, розчини, сиропи й еліксири. Такі сполуки можуть застовуватися як наповнювачі в м'яких або твердих капсулах і зазвичай включати носій, наприклад, воду, етанол, поліетиленгліколь, пропіленгліколь, метилцелюлозу або придатне масло та один або більшу кількість емульсифікаторів і/або супендувальних агентів. Рідкі рецептури можуть також бути одержані відтворенням твердої речовини, наприклад, з саше. Сполуки згідно з винаходом можуть також використовуватися у вигляді швидкорозчинних дозованих форм та дозованих форм, що швидко розпадаються, як це описано в Expert Opinion in Therapeutic patents, Ц (6), 981-986 Liang ι Chen (2001). Для дозованих форм у ви гляді таблеток, у залежності від дози, лікарській засіб може складати від 0,1ваг.% до 80ваг.%, більш типово від 1ваг.% до 60ваг.%, зокрема, від 5ваг.% до 50ваг.% дозованої форми. На додаток до лікарського засобу, таблетки, як правило, містять дезінтегрант. Приклади дезінтегрантів включають крохмальгліколят натрію, натрійкарбоксиметилцелюлозу, кальційкарбоксиметилцелюлозу, натрійкроскармелозу, кросповідон, полівінілпіролідон, метилцеллюлозу, 21 84714 мікрокристалічну целюлозу, заміщену нижчим алкілом гідроксипропілцелюлозу, крохмаль, прежелатинізований крохмаль та альгінат натрію. Як правило, дезінтегрант буде включати від 0,1ваг.% до 25ваг.%, більш типово від 0,5ваг.% до 20ваг.%, зокрема, від 1ваг.% до 15ваг.% дозованої форми. Зв'язувальні агенти в основному використовуються для надання зв'язувальних властивостей таблетованій формі. Прийнятні зв'язувальні агенти включають мікрокристалічну целюлозу, желатин, цукри, поліетиленгліколь, природні і синтетичні смоли, полівінілпіролідон, прежелатинізований крохмаль, гідроксипропілцелюлозу і гідроксипропілметилцелюлозу. Таблетки можуть також містити розчинники, такі як лактозу (моногідрат, моногідрат висушений розпиленням, безводний і т.п.), маніт, ксиліт, декстрозу, сахарозу, сорбіт, мікрокристалічну целюлозу, крохмаль, карбонат кальцію та двоосновний фосфорнокислий кальцій. Таблетки можуть також необов'язково включати поверхнево-активні агенти, такі як лаурилсульфат натрію та полісорбат 80 та агенти для покращення ковзання, такі як діоксид кремнію та тальк. Якщо агенти присутні, поверхнево-активні агенти можуть складати від 0,2ваг.% до 5ваг.% таблетки та агенти для покращення ковзання можуть складати від 0,2ваг.% до 1ваг.% таблетки. Таблетки також, як правило, містять змащувальні агенти, такі як стеарат магнію, стеарат кальцію, стеарат цинку, стеарилфумарат натрію і суміші стеарату магнію з лаурилсульфатом натрію. Змащувальні агенти, як правило, складають від 0,25ваг.% до 10ваг.%, переважно від 0,5ваг.% до 3ваг.% таблетки. Інші можливі інгредієнти включають антиоксиданти, фарбувальні агенти, ароматизатори, консерванти і смакові агенти. Типові таблетки містять приблизно до 80 % лікарської речовини, приблизно від 10ваг.% до приблизно 90ваг.% зв'язувального агента, приблизно від 0 ваг.% до приблизно 85ваг.% розчинника, приблизно від 1ваг.% до приблизно 10ваг.% дезінтегранту та приблизно від 0,25ваг.% до приблизно 10ваг.% змащувального агента. Таблеткові суміші можуть бути вироблені безпосереднім пресуванням або за допомогою валика, для формування таблеток. Таблеткові суміші або порції сумішей можуть бути альтернативно одержані вологим-, сухим- або гранулюванням з розплаву, твердінням розплаву або екструзією, перед таблетуванням. Кінцева композиція може включати один або декілька шарів і може бути з покриттям або без покриття; може бути навіть інкапсульована. Склад таблеток обговорений у "Pharmaceutical Dosage Forms: Tablets, Vol.1", H. Lieberman і L. Lachman, Marcel Dekker, N. Y., N. Y., 1980 (ISBN 08247-6918-Х). Тверді композиції для орального прийому, для забезпечення негайного і/або модифікованого вивільнення. Композиції модифікованого вивільнення включають відстрочене-, тривале-, імпульсне-, контрольоване-, цільове та запрограмоване вивільнення. 22 Прийнятні композиції модифікованого вивільнення для цілей винаходу описані в патенті США №6,106, 864. Деталі інших придатних методик вивільнення таких форм як високоенергетичні дисперсії або у вигляді осмотичної' дозованої форми і у вигляді покритих частинок, описані в Verma та ін., Pharmaceutical Technology On-line, 25 (2), 1-14 (2001). Використання жувальної гумки, для досягнення контрольованого вивільнення описане в міжнародній публікації патентної заявки WO 00/35298. Сполуки згідно з винаходом також можна вводити безпосередньо в потік крові, в м'яз або у внутрішній орган. Придатними шляхами для парентерального введення є внутрішньовенне, внутрішньоартеріальне, внутрішньоочеревинне, інтратекальне, інтравентрикулярне, інтрауретральне, інтрастернальне, інтракраніальне, внутрішньом'язове і підшкірне. Придатними пристроями для парентерального введення є голкові (включаючи мікроголки) ін'єктори, безголкові ін'єктори і засоби вливання. Парентеральні рецептури типово є водними розчинами, які можуть містити екціпієнти, такі як солі, карбогідрати і буфер уючі агенти (переважно до рН від 3 до 9), але, для деяких застосувань, вони можуть бути більш придатносформовані як стерильний неводний розчин або як суха форма, що використовується у поєднанні з придатним розчинником, таким як стерильна пірогенвільна вода. Одержання парентеральних рецептур в стерильних умовах, наприклад, шляхом ліофілізації, можна легко здійснити використовуючи стандартні фармацевтичні методики добре відомі фахівцю цієї галузі. Розчинність сполук згідно з винаходом, що використовується при одержанні парентеральних розчинів, може бути збільшена шляхом використання прийнятних методик формування рецептур, таких як використання агентів, що збільшують розчинність. Рецептури для парентерального введення можуть бути сформовані для негайного і/або модифікованого вивільнення. Рецептури модифікованого вивільнення мають відстрочене-, тривале-, імпульсне-, контрольоване-, цільове і запрограмоване вивільнення. Таким чином, сполуки згідно з винаходом можуть бути сформовані у вигляді твердої речовини, напівтвердої речовини або тіксотропної рідини для введення як імплантованого депо, що забезпечує модіфіковане вивільнення сполуки. Приклади таких сполук включають покриті лікарським засобом стенти і мікросфери з полі(DL)-молочно-когліколевої кислоти (PGLA). Сполуки згідно з винаходом можуть також призначатися місцево на шкіру або слизову оболонку, тобто, дермально або трансдермально. Типові композиції призначені для цієї цілі включають гелі, гідрогелі, лосьйони, розчини, креми, мазі, присипки, пов'язки, піни, плівки, шкірні пластирі, пластинки, імплантати, тампони, волокна, бандажі та мікроемульсії. Можуть також використовуватися ліпосоми. Типові носії включають спирт, воду, мінеральне масло, рідкий вазелин, білий вазелин, 23 84714 гліцерин, поліетиленгліколь ι пропіленгліколь. Можуть використовуватися підсилювачі проникнення - дивіться, наприклад, J. Pharm. ScL, 88 (10), 955958 Finnin та Morgan (жовтень 1999). Інші засоби місцевого введення включають доставку з використанням , електропорації, іонтофорезу, фонофорезу, сонофорезу і мікроголковою або безголковою ін'єкцією (наприклад, Powderjec™, Bioject™ і т.д.). Композиції для місцевого введення можуть бути сформовані, для забезпечення негайного і/або модифікованого вивільнення. Композиції модифікованого вивільнення включають відстрочене-, тривале-, імпульсне-, контрольоване-, цільове і запрограмоване вивільнення. Сполуки представленого винаходу можуть вводитися інтраназально або інгаляцією, типово в формі сухого порошку (або окремо, або у вигляді суміші, наприклад, сухої суміші з лактозою або частинок компоненту, змішаних, наприклад, з фосфоліпщами, такими як фосфатидилхолін) за допомогою інгалятору сухого порошку або у вигляді аерозольного спрею з контейнеру під тиском, помпи, аерозольного балону, пульверизатора (переважно, пульверизатора з використанням електрогідродинамічних елементів для одержання тонкодисперсного пилу) або розпилювача з або без використання придатного пропеленту такого як 1,1,1,2-тетрафторетан або 1,1,1,2,3,3,3гептафторпропан. Для інтраназального використання порошок може містити біоадгезийний агент, наприклад, хітозан або циклодекстрин. Контейнер під тиском, помпа, аерозольний балон, пульверизатор або розпилювач містять розчин або суспензію сполуки згідно з винаходом, що містять, наприклад, етанол, (при необхідності водний етанол) або придатний альтернативний агент для диспергування, розчинення або затриманого вивільнення сполуки, пропелент(и), як розчинник і довільну поверхнево-активну речовину, наприклад, триолеат сорбіту, олеїнову кислоту або олігомолочну кислоту. Перед використанням в композиції сухого порошку або в суспензії для інгаляції лікарську речовину мікронізують до розмірів, придатних для доставки інгаляцією (зазвичай вважається менше, ніж 5 мікронів). Мікронізація може досягатися за допомогою будь-якого з відповідних способів подрібнення, наприклад, змелюванням за допомогою гвинтового реактивного млина, змелюванням в реактивному млині з псевдозрідженим шаром, використанням надкритичної рідинної кристалізації з утворенням наночастинок, гомогенезацією високим тиском або сушкою розпилюванням. Капсули (зроблені, наприклад, з желатину або ГПМЦ), блістери та картриджі для використання в інгаляторі або інсуфляторі можуть містити порошкову суміш сполуки винаходу, придатну порошкову основу, таку як лактоза або крохмаль та модифікатор ефективності, такий як І-лейцин, маніт або стеарат магнію. Лактоза може бути у безводній формі або у формі моногідрату, переважно у формі останнього. Інші придатні ексціпієнти включають декстран, глюкозу, мальтозу, сорбіт, ксиліт, фруктозу, са харозу і трегалозу. 24 Придатна композиція розчину для використання в розпилювачі із застосуванням електрогідродинамічних елементів для одержання тонкодисперсного пилу може містити від 1мкг до 20мг сполуки згідно з винаходом на запуск і об'єм такого запуску може змінюватися від 1мкл до 100мкл. Звичайна композиція може містити сполуку згідно з винаходом, пропіленгліколь, стерильну воду, етанол та хлорид натрію. Замість пропіленгліколю можуть використовува тися альтернативні розчинники, наприклад, гліцерин або поліетиленгліколь. Придатні ароматизатори, такі як ментол та левоментол або підсолоджувачі, такі як сахарин або сахарин натрію, можуть бути додані до тих рецептур винаходу, що призначені для інгаляційного/інтраназального введення. Композиції для інгаляційного/інтраназального введення можуть бути сформовані, для забезпечення негайного і/або модифікованого вивільнення, наприклад, полі-(DL)-молочно-когліколева кислота (PGLA). Композиції модифікованого вивільнення включають відстрочене-, тривале-, імпульсне-, контрольоване-, цільове і запрограмоване вивільнення. У випадку інгаляторів сухого порошку і аерозолів, одиниця дозування визначається за допомогою клапану, який вивільнює виміряну кількість. Одиниці у відповідності з винаходом типово готуються для введення виміряної дози або "пшику", що містить від 1мкг до 10мг сполуки згідно з винаходом. Загальна добова доза зазвичай знаходиться в інтервалі від 1мкг до 20мг, яка може вводитись однією дозою або, що типовіше, як розподілені дози протягом дня.. Сполуки згідно з винаходом можуть бути введені ректально або вапнально, наприклад, у формі супозиторію, песарію або клізми. Масло какао є традиційною супозиторійною основою, але можуть бути використані різні альтернативи, якщо прийнятно. Рецептури для ректального/інтравагінального введення можуть бути сформовані для негайного і/або модифікованого вивільнення. Рецептури модифікованого вивільнення мають відстрочене-, тривале-, імпульсне-, контрольоване-, цільове і запрограмоване вивільнення. Сполуки згідно з винаходом також можуть бути введені безпосередньо у око або вухо, типово у формі крапель мікронізованої суспензії або розчину в ізотонічному, рН-коригованому, стерильному саліні. Інші рецептури придатні для окулярного або вушного введення включають мазі, здатні до біорозщеплення (наприклад, здатні до абсорбування гелеві губки, колаген) і нездатні до біорозщеплення (наприклад, силікон) імплантати, пластинки, лінзи і частинкові або везикулярні системи, такі як ніосоми або ліпосоми. Можуть бути включені полімери, такі як поперечнозшита поліакрилова кислота, полівініловий спирт, гіалуронова кислота, полімери целюлози, наприклад, гідроксипропілметилцелюлоза, гідроксиетилцелюлоза, або метилцелюлоза, або гетерополісахаридний полімер, наприклад, геланова смола, разом з консервантом, таким як бензалконійхлорид. Такі 25 84714 рецептури можуть бути вивільнені за допомогою іонтофорезу. Рецептури для окулярного/вушного введення можуть бути сформовані для негайного і/або модифікованого вивільнення. Рецептури модифікованого вивільнення мають відстрочене-, тривале-, імпульсне-, контрольоване-, цільове і запрограмоване вивільнення. Сполуки згідно з винаходом можуть бути об'єднані з розчинними макромолекулярними сполуками, такими як циклодекстрин і його придатні похідні або поліетиленгліколь-вмісні полімери, для того щоб покращити їх розчинність, швидкість розчинення, замаскувати смак, біодоступність і/або стабільність для використання в будь-якому з вищезгаданих способів введення. Комплекси лікарський засіб-циклодекстрин, наприклад, знайшли застосування в більшості видів дозованих форм і шляхів введення. Можуть бути використані комплекси включення і невключения. Як альтернатива безпосередньому комплексуванню з лікарським засобом, циклодекстрин може бути використаний як допоміжна добавка, тобто, як носій, розріджувач або солюбілізатор. Найбільш часто для цих цілей використовується альфа-, бета- і гама-циклодекстрини, приклади яких можна знайти в публікаціях міжнародних патентних заявок WO 91/11172, WO 94/02518 і WO 98/55148. По мірі того, як це може бути бажаним призначати сполуку згідно з винаходом в комбінації з іншим терапевтичним агентом, наприклад, для цілей лікування специфічного захворювання або стану, в межах представленого винаходу дві або більша кількість фармацевтичних композицій, принаймні, одна з яких містить сполуку згідно з винаходом, можуть бути легко об'єднані у формі набору, придатного для сумісного призначення композицій. Таким чином, набір згідно з винаходом включає дві або більше окремих фармацевтичних композицій, принаймні одна з яких містить сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або похідне і засоби для окремого збереження згаданих композицій, такі як контейнер, розділена пляшка або розділена упаковка з фольгі. Прикладом такого набору є відома блістер упаковка, використовувана для упакування таблеток, капсул і т.п. Набір винаходу особливо прийнятний для призначення різних дозованих форм, наприклад, оральним і перентеральним, для введення окремими композиціями з різними інтервалами дозування або для титрування окремих композицій для порівняння однієї з іншою. Для дотримання стандартів, набір типово включає інструкції по призначенню і може забезпечуватися так званою пам'яткою. Для призначення людині, що має вагу від приблизно 65кг до 70кг, повна добова доза сполуки згідно з винаходом буде типово знаходитися в діапазоні від приблизно 1 до 10000мг, зокрема від 10 до 1000мг, наприклад, від 25 до 500мг, в залежності, звичайно, від способу введення, віку, стану і ваги пацієнта і буде в будь-якому випадку остаточно визначатися лікарем. Повна добова доза 26 може призначатися в одиничній дозі або розділених доз протягом дня. Згідно з іншим аспектом винахіду забезпечується фармацевтична композиція, що включає сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або похідне разом з одним або більше фармацевтично прийнятними ексціпієтами, розчинниками або носіями. Сполуки формули (І) і їх фармацевтично прийнятні солі, сольвати і похідні мають перевагу, що вони більш селективні, мають більш швидкий початок дії, більш сильні, краще абсорбуються, більш стабільні, більш стійкі до метаболізму, мають знижену "взаємодію з їжею", мають поліпшений профіль безпеки або мають інші більш бажані властивості (наприклад, відносно здатності до розчинення або гігроскопічності), ніж сполуки згідно з попереднім рівнем техніки. Зокрема, сполуки згідно з винаходом мають знижений інгібувальний вплив на калієвий канал HERG. Пролонгування потенційної серцевої діяльності (пролонгування інтервалу QT) було ідентифіковано як наслідок впливу на калієвий канал HERG [Expert Opinion of Pharmacotherapy, 2, сторінки 947-973, 2000]. Відомо, що пролонгування інтервалу QT, потенційно відповідає за призведення до фатальної аритмії серця Тріпотіння - Мерехтіння (TdP). У забезпеченні сполук, що проявляють більш знижений інгібувальний вплив на калієвий канал HERG з співставними або поліпшеними фармакокінетичними параметрами, згідно з винаходом забезпечуються сполуки, що є терапевтично ефективними CCR5 антагоністами з більш поліпшеною кардіальною безпекою. Сполуки формули (І) і їх фармацевтично прийнятні солі, сольвати і похідні можуть призначатися окремо або як частина комбінованої терапії. Таким чином, в межі представленого винаходу включені втілення, що включають сумісне призначення і композицій, що їх містять, у доповнення до сполуки згідно з винаходом, одного або більше додаткових терапевтичних агентів. Такі багаторазові медикаментозні режими, згадувані часто як комбінована терапія, можуть використовуватися в лікуванні та профілактиці кожного з захворювань або станів, опосередкованих або пов'язаних з модулюванням CCR5 хемокінових рецепторів, особливо інфекціювання вірусом імунодефіціту у людей, ВІЛ. Використання таких комбінацій терапевтичних агентів особливо придатне для лікування і профілактики інфекції і розмноження в організмі пацієнта, що потребує лікування, або при виникненні ризику у такого пацієнта людського вірусу імундефіціту, ВІЛ і пов'язаних з цим патогенних ретровірусів. Здатність такого штаму патогена розвиватись в межах відносно короткого періоду часу до резистентного до будь-якої монотерапії, що призначалася згаданому пацієнту, відома з літератури. Рекомендоване лікування для ВІЛ представляє собою комбіновану фармакотерапію, що називається Високо Активна Антиретровірусна Терапія (Higly Acti ve Anti-Retroviral Therapy, або HAART. HAART поєднує три або більшу кількость лікарських засобів призначених для лікування ВІЛ. Таким чином, у способах лікування і 27 84714 фармацевтичних композиціях, згідно з представленим винаходом, може використовуватися сполука, згідно з винаходом, у формі монотерапії, але згадані способи і композиції можуть також використовуватися у формі комбінованої терапії, в якій одна або більша кількість сполук винаходу призначаються сумісно у комбінації з одним або більше додатковими терапевтичними агентами такими як ті, що детально описані тут надалі. В подальшому втіленні, згідно з винаходом, комбінації представленого винаходу включають лікування сполукою формули (І) або її фармацевтично прийнятною сіллю, сольватом або похідним і одним або більшою кількістю додаткових терапевтичних агентів, вибраних з наступних: інгібітори ВІЛ-протеази (PIs), включаючи, але не обмежуючись, індінавір, рітонавір, саквінавір, нелфінавір, лопінавір, ампренавір, атазанавір, тіпранавір, AG1859 і TMC 114; ненуклеозидні інгібітори зворотної транскриптази (NNRTIs), включаючи, але не обмежуючись: невірапін; делавірдин; каправірин; ефавіренц; 5-{[3,5-Діетил-1-(2-гідроксиетил)-1Нпіразол-4-іл]окси}ізофталонітрил або його фармацевтично прийнятні солі, сольвати або похідні; 5{[3-Циклопропіл-1-(2-гідроксиетил)-5-метил-1Нпіразол-4-іл]окси}ізофталонітрил або його фармацевтично прийнятні солі, сольвати або похідні; GW-8248; GW-5634 і ТМС125; нуклеозид/нуклеотидні інгібітори зворотної транскриптази (NRTIs), включаючи, але не обмежуючись, зидовудин, диданозин, залцитабін, ставудин, ламівудин, абакавір, адефовір, дипівоксил, тенофовір, емтрицитабін і аловудин; інші CCR5 антагоністи, включаючи але не обмежуючись: N-{(1S)-3-[3-(3-ізопропіл-5-метил-4Н-1,2,4-триазол4-іл)-екзо-S-азабіцикло[3.2.1]окт-8-ил]-1фенілпропіл}-4,4-дифторциклогексанкарбоксамід або його фармацевтично прийнятні солі, сольвати або похідні, метил 1-ендо-{8-[(3S)-3-(ацетиламіно)-3-(3фтор феніл)пропіл]-8-азабіцикло[3.2.1]окт-3-ил}-2метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин5-карбоксилат або його фармацевтично прийнятні солі, сольвати або похідні, метил 3-ендо-{8-[(3S)-3-(ацетамідо)-3-(3фтор феніл)пропіл]-8-азабіцикло[3.2.1]окт-3-ил}-2метил-4,5,6,7-тетрагідро-3Н-імідазо[4,5-с]піридин5-карбоксилат або його фармацевтично прийнятні солі, сольвати або похідні, етил 1-ендо-{8-[(3S)-3-(ацетиламіно)-3-(3фтор феніл)пропіл]-8-азабіцикло[3.2.1]окт-3-ил}-2метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин5-карбоксилат або його фармацевтично прийнятні солі, сольвати або похідні, Sch D, ONO4128, GW873140, AMD-887 і CMPD167; агенти, які інгібують взаємодію gp120 з CD4, включаючи, але не обмежуючись, BMS806, BMS488043, 5-{(1S)-2-[(2R)-4-Бензоїл-2метилпіперазин-1-іл]-1-метил-2-оксоетокси}-4метоксипіридин-2-карбонової кислоти метиламід і 4-{(1S)-2-[(2R)-4-Бензоїл-2-метилпіперазин-1-іл]1-метил-2-оксоетокси}-3-метокси-Nметилбензамід; інші агенти, які інгібують проникнення ВІЛ у клітину - мішень, включаючи, але не обмежуючись, енфувіритид, Т1249, PRO 542 і PRO 28 140; інгібітори інтегрази, включаючи, але не обмежуючись, L-870,810; і RNaseH інгібітори. В межі представленого винахіду також включені, комбінації сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або похідного, разом з одним або більше додатковими терапевтичними агентами, незалежно вибраними з групи, що включає інгібітори проліферації, наприклад, гідроксисечовину; імуномодулятори, такі як фактори стимуляції росту колонії гранулоцитомакрофагів (наприклад, сарграмостин), модулятори тахікінінового рецептора (наприклад, NK1 антагоністи) і різні форми інтерферону або похідних інтерферону; інші агоністи/антагоністи хемокінового рецептора, такі як CXCR4 антагоністи (наприклад, AMD-070); агенти, що суттєво інгібують, р уйнують або зменшують вір усну транскрипцію, або реплікацію PHK, такі як інгібітори tat (транскрипційний транс-активатор) або nef (негативний регуляторний фактор); агенти, що суттєво інгібують, руйнують або зменшують трансляцію одного або більшої кількості експресованих вірусом білків (включаючи, але не обмежуючись, знижувальну регуляцію експресії білку або антагонізм одного або більшої кількості білків) інші ніж зворотна транскриптаза, такі як Tat або Nef; агенти, що впливають, зокрема, знижувально регулюють еспресію CCR5 рецептора; хемокіни, що індукують інтерналізацію CCR5 рецептора, такі як MIP-1a, MIP-1β, R ANTES і їх похідні; і інші агенти, що інгібують вірусн у інфекцію або покращують стан або наслідки ВІЛ-інфікування осіб через різні механізми. Агенти, що впливають (зокрема, знижувально регулюють) експресію CCR5 рецептора, включає імунодепресанти, такі як кальціневринові інгібітори (наприклад, такролімус і циклоспорин А); стероїди; агенти, що взаємодіють з продукуванням цитокінів або передачею сигналів, такі як інгібітори Янус Кінази (JAK) (наприклад, JAK-3 інгібітори, включаючи 3-{(3R,4R)-4-метил-3-[метил-(7Н-піроло[2,3d]піридимін-4-іл)аміно]піперидин-1-іл}-3оксопропіонітрил) і його фармацевтично прийнятні солі, сольвати або похідні; антитіла цитокінів (наприклад, антитіла, які інгібують рецептор інтерлейкіну-2 (IL-2), включаючи басіліксимаб і даклізумаб); і агенти, що взаємодіють з активацією клітини або клітинним циклом, такі як рапаміцин. Також в межі представленого винаходу включені, комбінації сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або похідного, разом з одним або більше додатковими терапевтичними агентами, що уповільнюють швидкість метаболізму сполуки згідно з винаходом, таким чином приводячи до збільшення дії у пацієнтів. Збільшення впливу таким способом відомо як бустінг. При цьому перевага полягає в підвищенні ефективності сполуки згідно з винаходом або зменшенні дози, необхідної, для досягнення тієї ж самої ефективності як при незбільшеній дозі. Метаболізм сполук згідно з винаходом включає окисні процеси, що здійснюються за допомогою Р450 (CYP450) ферментів, особливо CYP3А4 і кон'югації за допомогою UDP глюкуроносил-трансферази і сульфатуючих ферментів. Таким чином, серед 29 84714 агентів, що можуть використовуватися, для збільшення дії сполуки згідно з винаходом у пацієнта, є ті, які можуть діяти як інгібітори принаймні одного ізоформа ферментів цитохрома Р450 (CYP450). Ізоформи CYP450, що можуть бути придатними для інгібування, включають, але не обмежені, CYP1A2, C YP2D6, CYP2C9, C YP2C19 і CYP3A4. Придатні агенти, що можуть використовуватися, для інгібування CYP3А4, включають, але не обмежені, рітонавір, саквінавір або кетоконазол. Фахівцю даної галузі очевидно, що комбінована фармакотерапія, як описано тут ви ще, може включати дві або більше сполуки, що мають той же самий, або різний, механізм дії. Таким чином, тільки для ілюстрації, комбінація може включати сполуку згідно з винаходом і: один або більшу кількість NRTIs; один або більшу кількість NRTIs і Pl; один або більшу кількість NRTIs і інший CCR5 антагоніст; Pl; Pl і NNRTI; NNRTI; і так далі. На додаток до вимоги терапевтичної ефективності, що може вимагати використання терапевтичних агентів на додаток до сполук згідно з винаходом, можуть бути додаткові пояснення, що змушують або строго рекомендують використання комбінації сполуки згідно з винаходом й іншого терапевтичного агента, такої яку застосовують при лікуванні захворювань або станів, що безпосередньо випливають або побічно супроводжують основні або підосновні захворювання або стани, що моделюються хемокіновим CCR5 рецептором. Наприклад, коли основним захворюванням або станом, що моделюються хемокіновим CCR5 рецептором є ВІЛ інфекція і її розвинення, може бути необхідно або принаймні бажано лікувати Гепатит вірусу C (HCV), Гепатит вірусу В (HBV), Людський Папіломавірус (HPV), опортуністичні інфекції (включаючи бактеріальну і мікозну інфекції), новоутворення і інші стани, що виникають як результат імуноскомпроментованого стану пацієнта, якого лікують. Інші терапевтичні агенти можуть використовуватися зі сполуками згідно з винаходом, наприклад, для забезпечення імунного стимулювання або лікування болю і запалення, що супроводжують початкову і основну стадію захворювання на ВІЛ інфекцію. Відповідно, терапевтичні агенти для використання в комбінації зі сполуками формули (І) і їх фармацевтично прийнятними солями, сольватами і похідними також включають: інтерферони, пегільовані інтерферони (наприклад, пегінтерферон альфа-2а і пегінтерферон альфа-2b), ламівудин, рібавірин і емтрицитабін для лікування гепатиту; протигрибкові агенти, такі як флуконазол, фосфлуконазол, ітраконазол і воріконазол; протибактеріальні агенти, такі як азитроміцин і кларітроміцин; інтерферони, даунорубіцин, доксорубіцин і паклітаксель для лікування пов'язану зі СНІДом саркому Капоши; і цидофовір, фомівірсен, фоскарнет, ганцикловір і валцит для лікування цитомегаловірусного (CMV) ретиніту. Подальші комбінації для використання згідно з винаходом включають комбінацію сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або похідного з CCR1 антагоністом, таким як ВХ-471; агоністом бета-адренорецептора, таким як 30 салметерол; агоністом кортикостероїду, таким як пропіонатфлутицазон; LTD4 антагоністом, таким як монтелукаст; мускариновим антагоністом, таким як тютропіумбромід; PDE4 інгібітором, таким як або рофлуміласт; СОХ-2 інгібітором, таким як целекоксиб валдекоксиб або рофекоксиб; альфа-2дельта лігандом, таким як гапабентин або прегабалін; бета-інтерфероном, таким як REBIF; модулятором рецептора TNF, таким як TNF-альфа інгібітор (наприклад, адалімумаб), інгібітором HMG CoA редуктази, таким як статин (наприклад, аторвастатин); або імунодепресантом, таким як циклоспорин або макролідом, таким як такролімус. У вищезгаданих описаних комбінаціях, сполука формули (І) або її фармацевтично прийнятна сіль, сольват або похідне та інший терапевтичний агент(и) може призначатися, у вигляді дозованих форм, або окремо, або в сполученні одна з однією; і призначення може бути одночасним або послідовним у часі. Таким чином, призначення однокомпонентного агента може бути до, одночасно з, або після введення іншого компонента агентів. Відповідно, у подальшому аспекті винахід забезпечує фармацевтичну композицію, що включає сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або похідне та один або більше додаткових терапевтичних агент(ів). Очевидно, що всі наведені тут посилання на лікування включають лікувальне, паліативне і профілактичне лікування. Винахід проілюстрований наступними Прикладами і Препаративними прикладами, у яких можуть використовуватися нижченаведені наступні скорочення: г = година хв = хвилина HPMC = низькороздільна масспектроскопія BPMC = високороздільна масспектроскопія XIAT+ = хімічна іонізація атмосферного тиску ECI+ = електроспрей іонізація ЯМР = ядерний магнітний резонанс ТШХ - тонкошарова хроматографія Me = метил Приклад 1 N-{(1S)-3-[3-ендо-(5-Ацетил-2-метил-4,5,6,7тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл)ацетамід До перемішуваного розчину аміну N-{(1S)-3-[3ендо-(2-Метил-4,5,6,7-тетрапдро-1Н-імідазо[4,5с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетаміду (94мг, 0,21ммоль) у дихлорметані (5 мл), при кімнатній температурі, додавали ацетилхлорид (18мкл, 0,26ммоль), з 31 84714 наступним додаванням N,N-діізопропілетиламіну (45мкл, 0,26ммоль). Через 15 годин реакційну суміш розводили за допомогою дихлорметану (5мл) і води (5мл) і потім пропускали через картридж фазового розподілу. Органічний компонент концентрували, шляхом пропускання потоку азоту через розчин і одержану суміш, очи щували, використовуючи Mega Bond ElutFlash Si катридж (10г, Varian), елююючи сумішшю дихлорметан:метанол:концентрований водний аміак (у об'ємі 95:5:0,5), з одержанням вказаної в заголовку сполуки, у вигляді піни білого кольору (80мг, 79%). HPMC (електророзпилення): m/z [M+Na +] 504, [MH+] 482. Одержано C, 63,35; H, 7,32; N, 13,59. C27H36N5 FO2 · 0,5CH2CI2 розраховано C, 63,03; H, 7,12; N, 13,36. [a]D - 21,7° (2,12 мг/мл у MeOH) Приклади 2-3 Ці приклади були одержані відповідно до вищеописаної методики для Прикладу 1, використовуючи N-{(1S)-3-[3-ендо-(2-Метил-4,5,6,7тетрагідро-1Н-імдазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетамід ι відповідну сполуку формули (V). Весь HPMC аналіз виконували електроспрей іонізацією. Приклад 2 HPMC: m/z [MH +] 522 Одержано C, 67,01; H, 7,74; N, 12,94. C30H40FN 5O2 · 0,1H2O розраховано C, 66,77; H, 7,84; N, 12,93%. [a]D - 20,9° (2,04мг/мл у MeOH) Приклад 3 HPMC: m/z [MH +] 508 Одержано C, 66,53; H, 7,59; N, 13,23. C29H38FN 5O2 · 0,1H2O розраховано C, 66,26; H, 7,67; N, 13,32%. [a]D - 20,5° (2,38мг/мл у MeOH) Приклад 4 N-((1S)-3-[3-eндo-(5-lзoбутиpил-2-мeтил4.5,6,7-тeтparιдpo-1H-iмiдaзo[4,5-c]піpидин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл)ацетамід 32 До перемішуваного розчину аміну N-{(1S)-3-[3ендо-(2-Метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетаміду (19,9г, 45,3ммоль) у тетрапдрофурані (500мл) додавали триетиламін (7,0мл, 50,0ммоль), з наступним додаванням краплями ізобутирилхлориду (5,3мл, 50,0ммоль). Через 1 годину додавали краплями другу порцію ізобутирилхлориду (0,5мл, 5,0ммоль). Через 0,5 години реакційну суміш концентрували приблизно до 300мл ι додавали етилацетат (200мл). Реакційну суміш промивали за допомогою 10% водного розчину K2CO3 (200мл; м/о). Водну фазу відділяли і екстрагували за допомогою етилацетату (100мл). Органічні компоненти об'єднували, промивали за допомогою насиченого водного розчину хлориду натрію (100мл), сушили (MgSO 4) ι концентрували з одержанням рухливого масла, яке відразу починало утворювати піну. Залишок розчиняли у етилацетаті (100мл) і нагрівали до 90°C. До гарячого розчину додавали воду (0,5мл) і суміш залишали повільно охолоджуватися до кімнатної температури. Осад збирали фільтрацією, промивали етилацетатом (50мл) і сушили при пониженому тиску, з одержанням вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (20,9г, 90%). HPMC: m/z [MH +] 510. 1 H ЯМР (400МГц, CD3OD): δ: 7,29-7,35 (1H, м), 7,12-7,14 (1H, м), 7,05-7,07 (1H, м), 6,92-6,97 (1Н, м), 5,13-5,17 (1H, м), 4,52-4,63 (1Н, м), 4,43-4,44 (2Н, м), 3,78-3,89 (2Н, м), 3,31-3,40 (2Н, м), 2,903,06 (1Н, м), 2,77-2,84 і 2,69-2,75 (2Н, 2×м), 2,392,51 (2Н, м), 2,36 і 2,35 (3Н, 2×с), 2,20-2,30 (2Н, м), 2,03-2,13 (2Н, м), 1,95 (3Н, с), 1,84-1,90 (2Н, м), 1,55-1,65 (4Н, м), 1,08-1,11 і 1,04-1,06 (6Н, 2×м). Ротамери. Одержано C, 66,94; H, 7,92; N, 13,47. C29H40FN 5O2 · 0,5H 2 O. Розраховано C, 67,16; H, 7,97; N, 13,50. [a]D - 23,4° (1,64мг/мл у MeOH). Приклади 5-7 Ці приклади були одержані відповідно до вищеописаної методики для Прикладу 1, використовуючи N-{(1S)-3-[3-ендо-(2-Метил-4,5,6,7тетрапдро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетамід і відповідну сполуку формули (V). Весь HPMC аналіз виконували електророзпиленням, за винятком для Прикладу 6, де використовували хімічну іонізацію атмосферного тиску. Приклад 5 33 84714 34 1мідазо[4,5-c]піридин-1-іл)-8-азабіцикло[3.2.1]окт8-ил]-1-(3-Фторфеніл)пропіл}ацетамід HPMC: m/z 496 [MH +] Одержано С, 67,47; H, 7,75; N, 14,06. C28H38FN 5O2 · 0,15H 2O. Розраховано С, 67,49; H, 7,75; N, 14,05%. [a]D - 21,5° (2,00мг/мл у MeOH) (дані ЯМР наведені в кінці таблиці). Приклад 6 HPMC 532 [M+Na+], 510 [MH +] Одержано С, 65,69; H, 7,97; N, 13,06. C29H40FN 5O2 · 0,1H 2 O. Розраховано С, 66,01; H, 8,02; N, 13,27%. [a]D - 25,5° (2,14мг/мл у MeOH). Приклад 7 HPMC (електророзпилення) 546 [M+Na+], 524 [MH ]. Одержано С, 65,50, H, 7,93; N, 12,45. C30H42FN 5O2 · 0,15H 2O Розраховано С, 65,43; H, 8,24; N, 12,72%. [a]D - 28,2° (2,06мг/мл у MeOH). Приклад 5 ЯМР N-((1S)-3-[3-ендо-(2-Метил-5-пропіоніл-4,5,6,7тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл)ацетамід 1 H ЯМР (400МГц, CD3OD): δ: 7,31-7,37 (1Н, м), 7,14-7,16 (1H, д), 7,06-7,10 (1H, м), 6,94-6,99 (1Н, M), 5,14-5,21 (1H, м), 4,56-4,63 (1H, м), 4,40 і 4,45 (2Н, 2×с), 3,81-3,89 (1H, м), 3,75-3,80 (1H, м), 3,333,41 (2Н, м), 2,78-2,86 (1H, м), 2,70-2,76 (1H, м), 2,40-2,54 (4Н, м), 2,37 і 2,38 (3Н, 2×с), 2,23-2,30 (2H, м), 2,07-2,14 (2Н, м), 1,98 (3Н, с), 1,86-1,93 (2Н, м), 1,57-1,67 (4H, м), 1,07-1,17 (3Н, м). Ротамери. Приклад 8 N-((1S)-3-[3-ендо-(2-Метил-5-(3.3.3трифторпропіоніл)-4.5,6,7-тетрагідро-1Н До перемішуваного розчину 3,3,3трифторпропіонової кислоти (15мкл, 1,71ммоль) у дихлорметані (2мл) додавали гексафторфосфат О-бензотриазол-і-іл-N,N,N',N'-тетраметилуронію (65мг, 1,71ммоль), триетиламін (47мкл, 3,41ммоль) з наступним додаванням аміну N-{(1S)3-[3-ендо-(2-Метил-4,5,6,7-тетрагідро-1Німідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8ил]-1-(3-фторфеніл)пропіл}ацетаміду (50мг, 1,14ммоль). Реакційну суміш нагрівали при 30°C протягом 15 годин, концентрували шляхом пропускання потоку азоту через розчин і очищували за допомогою препаративної ВЕРХ (колонка Phenomenex C18 розмірами 15×10см 10мкм, швидкість потоку 20мл/хв, 225нм детекція, градієнт мобільної фази від 95:5 до 5:95 А:В, (А: 0,1% діетиламін у H2O, В: MeCN)), з одержанням вказаної в заголовку сполуки у вигляді смоли (20мг). HPMC (електророзпилення) 550 [MH+]. BPMC (електророзпилення). Одержано 550,2800. C28H36N5F 4O2 (MH+), розраховано 550,2800. Приклад 9 N-((1S)-3-[3-ендо-(5-Ізобутирил-2-метил4.5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетаміду фумарат + До розчину N-{(1S)-3-[3-ендо-(5-Iзобутирил-2метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетаміду (300мг, 0,59ммоль) у тетрагідрофурані (2мл), при кипінні додавали краплями розчин фумарової кислоти (68мг, 0,59ммоль) у гарячому етанолі (2мл). Через 48 годин додавали тетрагідрофуран (2мл) і через 48 годин кристали збирали фільтрацією, промивали за допомогою тетрагідрофурану (2мл) і сушили повітрям, з одержанням вказаної в заголовку сполуки у вигляді порошку білого кольору (110мг, 30%). 35 84714 36 Одержано C, 62,04; H, 7,26; N, 10,70. C33H44FN 5O6 · 0,75H 2O розраховано C, 62,00; H1 7,17; N, 10,96. Приклад 10 N-((1S)-3-[3-енао-(5-Ізобутирил-2-метил4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл)ацетамід N-{(1S)-3-[3-ендо-(2-Метил-4,5,6,7-тетрагідро1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетамід (264,4г, 0,60моль) додавали до пропан-2-олу (2,67л), з наступним додаванням карбонату калію (92,7 г, 0,67 мл) і одержану суміш охолоджували до 15°C. Потім додавали протягом більше ніж 10 хвилин ізобутирилхлорид (97,8г, 0,91моль), підтримуючи температуру нижче 25°C і після перемішування протягом 10 хвилин реакцію завершували. До одержаної суміші потім додавали карбонат калію (267,2г) у воді (2,40л) і одержані 2 фази відокремлювали. Водний шар потім екстрагували за допомогою етилацетату (2,67л) і об'єднані органічні екстракти промивали за допомогою насиченого водного розчину хлориду натрію (1,32л) і води (800мл), потім концентрували у вакуумі. Залишок розводили за допомогою етилацетату (1,07л) і повторно концентрували у вакуумі. Цю стадію повторного розведення і концентрування повторювали і одержаний залишок обробляли за допомогою етилацетату, поки не досягали загального об'єму 1,07л. Одержану суміш охолоджували до 05°C, перемішували протягом 2 годин, фільтрували і промивали за допомогою холодного етилацетату (2×130мл). Твердий продукт потім сушили у вакуумній печі при 50°C, з одержанням вказаної в заголовку сполуки (269,8г, 0,53моль, 88,0%). Приклад 11 N-{(1S)-3-[3-ендо-(5-Ізобутирил-2-метил4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл)ацетаміду фумарат N-{(1S)-3-[3-ендо-(5-Ізобутирил-2-метил4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетамід (554,0г, 1,08моль) додавали до пропан-2-олу (13,85 л), з наступним додаванням фумарової кислоти (126,2г, 1,09моль) і одержану суміш нагрівали до кипіння і розмішували протягом 20 хвилин. Одержаний розчин потім освітлювали фільтрацією при цій температурі, перед концентруванням у вакуумі до одержання об'єму розчинника 4мл/г на основі вихідної речовини N-{(1S)-3-[3-ендо-(5-Ізобутирил-2-метил-4,5,6,7тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетамід. Одержану суміш о холоджували до 0-5°C, перемішували протягом 2 годин, фільтрували і промивали за допомогою холодного пропан-2-олу (2×550мл). Твердий продукт потім сушили у вакуумній печі при 50°C, з одержанням вказаної в заголовку сполуки (495,9г, 0,79моль, 72,9%). Приклад 12 (D)-тартрат N-{(1S)-3-[3-ендо-(5-Ізобутирил-2метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетаміду одержували відповідно до вищеописаної методики для фумаратної солі Прикладу 9, використовуючи N-{(1S)-3-[3ендо-(5-Ізобутирил-2-метил-4,5,6,7-тетрагідро-1Німідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8ил]-1-(3-фторфеніл)пропіл}ацетамід і D-винну кислоту. Дані дифракційних піків PXRD наведені нижче. Препаративний приклад 1 8-Бензил-8-азабіцикло[3.2.1]октан-3-он Розчин 2,5-диметокситетрагідрофурану (50г, 378ммоль) у хлорводневій кислоті (0,025N, 160мл) охолоджували до 0°C протягом 16 годин. Додавали гідрохлорид бензиламіну (65г, 453ммоль), кетомалонову кислоту (55г, 377ммоль) і водний розчин ацетату натрію (300мл, 0,69M) і реакційну суміш перемішували при кімнатній температурі протягом однієї години. Суміш нагрівали до 50°C протягом подальших 90 хвилин, потім охолоджували у бані з льодом і підлуговували до рН 12 за 37 84714 допомогою 2N розчину гідроксиду натрію. Шари відокремлювали і водну фазу екстрагували за допомогою етилацетату (3×300мл). Об'єднані органічні екстракти промивали водою, сушили (MgSO4), фільтрували і випаровували при пониженому тиску. Залишок у вигляді коричневого масла переганяли при пониженому тиску (126°/3мм Hg), одержуючи вказану в заголовку сполуку у вигляді твердої речовини кремового кольору (37,81г). HPMC: m/z 216,3(MH +). Препаративний приклад 2 трет-Бутил 3-оксо-8-азабіцикло[3.2.1]октан-8карбоксилат Суміш 8-бензил-8-азабіцикло[3.2.1]октан-3-ону (15,0г, 69,7ммоль), ди-трет-бутилдикарбонату (18,2г, 83,4ммоль) і 20% м/м гідроксиду паладію на вуглеці (3,0г) у етилацетаті (165мл) перемішували протягом 4 годин при кімнатній температурі у атмосфері водню при 269кПа. Суміш фільтрували через Arbocel® і розчинник видаляли при пониженому тиску. Залишок очищували за допомогою колонкової хроматографії на силікагелі, використовуючи градієнтне елюювання сумішшю гексан:етер (від 100:0 до 50:50), з одержанням вказаної в заголовку сполуки у вигляді безбарвного масла, яке кристалізувалося при стоянні (16,2г). 1 H ЯМР (400МГц, CDCI3): δ: 1,48 (9Н, с), 1,601,68 (2Н, м), 2,00-2,11 (2Н, м), 2,26-2,34 (2Н, м), 2,48-2,82 (2Н, м), 4,35-4,58 (2Н, м) млн.ч. Препаративний приклад 3 трет-Бутил 3-(бензиламіно)-ендо-8азабіцикло[3.2.1]октан-8-карбоксилат Розчин трет-бутил 3-оксо-вазабіцикло[3.2.1]октан-8-карбоксилату (10,0г, 44,4ммоль), бензиламіну (4,85мл, 49,7ммоль) і триацетоксиборогідриду натрію (14,11г, 66,6ммоль) перемішували протягом 16 годин при кімнатній температурі в суміші льодяна оцтова кислота:дихлорметан (1:9 о/о, 290мл). Розчинники випаровували при пониженному тиску і залишок розчиняли у етилацетаті (200мл), потім промивали за допомогою насиченого водного розчину карбонату натрію (50мл) і води (50мл). Органічний розчин сушили (MgSO 4), фільтрували і випаровували при пониженному тиску. Залишок очищували за допомогою колонкової хроматографії на силікагелі, з використанням як елюенту суміші дихлорметан:метанол:концентрований водний аміак (98:2:0,25), одержуючи вказану в заголовку сполу 38 ку у вигляді твердої речовини білого кольору (7,00г). 1 H ЯМР (400МГц, CDCI3): δ: 1,42-1,48 (11Н, м), 1,52-1,61 (2Н, м), 1,85-2,19 (5Н, м), 2,95-3,03 (1Н, м), 3,74 (2Н, с), 4,03-4,23 (2Н, м), 7,20-7,26 (1Н, м), 7,26-7,32 (4Н, м) млн. ч. Препаративний приклад 4 трет-Бутил 3-ендо-аміно-8азабіцикло[3.2.1]октан-8-карбоксилат Суміш трет-бутил 3-(бензиламіно)-ендо-8азабіцикло[3.2.1]октан-8-карбоксилату (7,00г, 22,1ммоль), форміат амонію (7,00г, 111ммоль) і 20% м/м гідроксиду паладію на вуглеці (0,70г) в етанолі (200мл) нагрівали до 50°C, поки не припинялося виділення газу. Охолоджену суміш фільтрували через Arbocel® і фільтрат випаровували при пониженному тиску. Залишок очищували за допомогою колонкової хроматографії на силікагелі, використовуючи градієнтне елюювання, використовуючи суміш дихлорметан:метанол:концентрований водний аміак (від 98:2:0,25 до 95:5:0,5), одержуючи вказану в заголовку сполуку у вигляді безбарвного масла (4,70г). HPMC: m/z 227,2 (MH +). Препаративний приклад 5 трет-Бутил 3-ендо-[(3-нітро-4піридиніл)аміно1-8-азабіцикло[3.2.1]октан-8карбоксилат трет-Бутил 3-аміно-ендо-8азабіцикло[3.2.1]октан-8-карбоксилат (3,0г, 13,2ммоль), гідрохлорид 4-етокси-З-нітропіридину (2,7г, 13,2ммоль) і N-етил-N,N-діізопропіламін (1,89г, 14,6ммоль) розчиняли у 1-метил-2піролщиноні (5мл) і нагрівали при 120°C протягом 18 годин. Охолоджену реакційну суміш розводили за допомогою етилацетату (150мл) і промивали водою (3×50мл) насиченим водним розчином гідрокарбонату натрію (50мл) і насиченим водним розчином хлориду натрію (30мл). Органічний шар сушили (MgSO 4) і розчинник видаляли шляхом випаровування при пониженному тиску. Одержаний залишок розтирали з діетиловим етером і відфільтровували, одержуючи вказану в заголовку сполуку у вигляді твердої речовини жовтого кольору (1,5г). HPMC: m/z 349 (MH +). Препаративний приклад 6 1-ендо-(8-Ацетил-8-азабіцикло[3.2.1]окт-3-ил)2-метил-1Н-імідазо[4.5-с]піридин 39 84714 трет-Бутил 3-ендо-[(3-нітро-4-піридиніл)аміно]8-азабіцикло[3.2.1]октан-8-карбоксилат (4,40г, 12,6ммоль) і порошок заліза (2,11г, 37,8ммоль) розчиняли в льодяній оцтовій кислоті (50мл) і суміш нагрівали до 60°C протягом двох годин. Потім додавали ангідрид оцтової кислоти (8мл) і суміш нагрівали до 140°C протягом 18 годин. Охолоджену реакційну суміш фільтрували через шар Arbocel® і розчинник видаляли при пониженному тиску. Залишок розподіляли між дихлорметаном (200мл) і водою (200мл) і суміш доводили до показника рН 9 за допомогою 2N водного розчину гідроксиду натрію. Суміш знову фільтрували через шар Arbocel® і органічну фазу відділяли. Водний шар екстрагували за допомогою дихлорметану (100мл) і об'єднані органічні екстракти сушили (MgSO4). Розчинник випаровували при пониженному тиску і залишок розтирали з етилацетатом, відфільтровували і сушили (MgSO 4), з одержанням вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (3,27г). HPMC: m/z 285 (MH +). Препаративний приклад 7 1-ендо-(8-Ацетил-8-азабіцикло[3.2.1]окт-3-ил)5-бензил-2-метил-4,5,6,7-тетрагідро-1Німідазо[4,5-с]піридин Бензилбромід (1,78г, 10,4ммоль) додавали до розчину 1-ендо-(8-ацетил-8-азабіцикло[3.2.1]окт-3ил)-2-метил-1Н-імідазо[4,5-с]піридину (2,47г, 8,7ммоль) в етанолі (20мл) і суміш перемішували при кімнатній температурі протягом 48 годин. Реакційну суміш потім охолоджували до -70°C і додавали порціями борогідрид натрію (0,33г, 8,7ммоль) протягом більш ніж десяти хвилин. Після витримування суміші при -70°C протягом однієї години, реакційну суміш залишали нагріватися до -40°C, потім знову охолоджували до -70°C і потім додавали борогідрид натрію (0,33г, 8,7ммоль). Після витримування суміші при -70°C протягом додаткової години, до суміші додавали воду (10мл) ι реакційну суміш залишали нагріватися до кімнатної температури. При пониженому тиску випаровували етанол ι водний залишок екстрагували за допомогою дихлорметану (3×25мл). Об'єднані органічні екстракти сушили (MgSO 4) і розчинник 40 випаровували при пониженному тиску. Залишок очищували за допомогою колонкової флеш хроматографії на силікагелі, елююючи за допомогою градієнтого розчинника, використовуючи суміш етилацетат:метанол:діетиламін (в об'ємі 100:0:2, змінюючи співвідношення до 98:2:2, потім до 95:5:2). Фракції, які містять продукт випаровували, з одержанням вказаної в заголовку сполуки у вигляді піни білого кольору (2,23г). HPMC: m/z 379 (MH+). Препаративний приклад 8 1-ендо-(8-Азабіцикло[3.2.1]окт-3-ил)-5-бензил2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин 1-ендо-(8-Ацетил-8-азабіцикло[3.2.1]окт-3-ил)5-бензил-2-метил-4,5,6,7-тетрагідро-1Німідазо[4,5-с]піридин (2,23г, 5,89ммоль) розчиняли у 6N водній хлорводневій кислоті (30мл) і нагрівали при кипінні протягом 18 годин. Охолоджену реакційну суміш доводили до рН 10 шляхом додавання 2N водного розчину гідроксиду натрію і екстрагували за допомогою дихлорметану (2×50мл). Об'єднані органічні екстракти сушили (MgSO4) і розчинник випаровували при пониженному тиску. Залишок очищували за допомогою колонкової флеш хроматографії на силікагелі, елююючи за допомогою градієнтого розчинника, з використанням суміші дихлорметан:метанол:діетиламін (в об'ємі 100:0:0,5, змінюючи співвідношення до 93:7:1). Фракції, які містять продукт випаровували, з одержанням вказаної в заголовку сполуки у вигляді піни білого кольору (1,47г). HPMC (електророзпилення): m/z [M+H]+ 337. Препаративний приклад 9 трет-бутил (1S)-1-(3-фторфеніл)-3оксопропілкарбамат Гідрид діізобутилалюмінію (1M у дихлорметан, 39мл, 39ммоль) охолоджували до -78°C і додавали краплями до розчину метил (3S)-3-[(третбутоксикарбоніл)аміно]-3-(3фтор феніл)пропаноату [WO 0039125, стор.60, препаративний приклад 12] (5,4г, 18,2ммоль) у дихлорметані (100мл) при -78°C. Реакційну суміш перемішували протягом 30 хвилин при -78°C, потім додавали метанол (50мл, попередньо охолоджений до -78°C). Реакційну суміш перемішували 41 84714 протягом 30 хвилин, потім додавали 2N хлорводневу кислоту (250мл). Двофазну суміш залишали нагріватися до кімнатної температури, шари відокремлювали і органічний шар сушили (MgSO4), відфільтровували і випаровували при пониженному тиску, з одержанням вказаної сполуки у вигляді прозорого, безбарвного масла, 4,8г. HPMC: m/z 268,1 (MH+). Препаративний приклад 10 трет-бутил (15)-3-[3-ендо-(5-бензил-2-метил4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3Фторфеніл)пропілкарбамат Оцтову кислоту (0,39г, 6,4ммоль) додавали до перемішуваного розчину 1-ендо-(8азабіцикло[3.2.1]окт-3-ил)-5-бензил-2-метил4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридину (2,16г, 6,4ммоль) і трет-бутил (1S)-1-(3-фторфеніл)-3оксопропілкарбамату (2,06г, 7,7ммоль), розчиненого у дихлорметані (25мл) у атмосфері азоту при кімнатній температурі. Потім додавали триацетоксиборогідрид натрію (1,63г, 7,7ммоль) і реакційну суміш підтримували при кімнатній температурі протягом 2 годин. Реакційну суміш розподіляли між насиченим водним розчином гідрокарбонату натрію (50мл) і дихлорметаном (50мл). Органічну фазу видаляли і водну фазу промивали за допомогою дихлорметану (50мл). Об'єднані органічні фази сушили (MgSO 4) і розчинник випаровували при пониженному тиску. Залишок очищували за допомогою колонкової флеш хроматографії на силікагелі, елююючи за допомогою градієнтого розчинника, з використанням суміші дихлорметан:метанол:концентрований водний аміак (в об'ємі 99:1:0,1, змінюючи співвідношення до 96:4:0,4). Фракції, які містять продукт випаровували, з одержанням вказаної в заголовку сполуки у вигляді піни білого кольору (2,56г). HPMC (електророзпилення): m/z [M+H]+ 588. Препаративний приклад 11 трет-Бутил (1S)-3-[3-ендо-(2-метил-4,5,6,7тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропілкарбамат 42 Суміш трет-бутил (1S)-3-[3-ендо-(5-бензил-2метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропілкарбамату (2,55г, 4,34ммоль), форміату амонію (2,73г, 43,4ммоль) і 20% м/м гідроксиду паладію на вуглеці (0,25г) в етанолі (35мл) нагрівали до 60°C. Через одну годину додавали додатковий форміат амонію (0,63г, 10,1ммоль) і продовжували нагрівати при 60°C протягом наступних двох годин. Охолоджену реакційну суміш потім фільтрували через Arbocel® і фільтрат випаровували при пониженному тиску. Залишок розподіляли між дихлорметаном (100мл) і насиченим водним розчином гідрокарбонату натрію (50мл), органічну фазу відокремлювали і промивали водою (30мл). Органічний шар сушили (MgSO 4) і розчинник випаровували при пониженному тиску. Залишок очищували за допомогою колонкової флеш хроматографії на силікагелі, елююючи за допомогою градієнтого розчинника, з використанням суміші дихлорметан:метанол: концентрований водний аміак (в об'ємі 99:1:0,1, змінюючи співвідношення до 93:7:1), одержуючи вказану в заголовку сполуку у вигляді піни білого кольору (1,50г). HPMC (електророзпилення): m/z [Mh-H]+ 498. Препаративний приклад 12 Метил 1-ендо-(8-((3S)-3-[(третбутоксикарбоніл)аміно1-3-(3-Фторфеніл)пропіл)-8азабіцикло[3.2.1]окт-3-ил)-2-метил-4,5,6,7тетрагідро-1Н-імідазо[4,5-с]піридин-5-карбоксилат Метилхлорформіат (0,167г, 1,76ммоль) додавали до розчину трет-бутил (1S)-3-[3-eндо-(2метил-4,5,6,7-тетрапдро-1Н-імідазо[4,5-с]піридин1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропілкарбамату (0,80г, 1,60ммоль) у дихлорметані (10мл) у атмосфері азоту при кімнатній температурі. Реакційну суміш перемішували при кімнатній температурі протягом 1,5 годин і потім промивали за допомогою насиченого водного розчину гідрокарбонату натрію (10мл). Органічну фазу видаляли і водний шар екстрагували великою кількістю дихлорметану (2×10мл). Об'єднані дихлорметанові екстракти сушили (MgSO4) і розчинник видаляли при пониженному тиску. Залишок очищували за допомогою колонкової флеш хроматографії на силікагелі, елююючи за допомогою градієнтого розчинника, з використанням суміші дихлорметан:метанол:концентрований водний аміак (в об'ємі 99:1:0,1, змінюючи співвідношення до 93:7:1), одержуючи вказану в заголовку сполуку у вигляді піни білого кольору (0,84г). HPMC (електророзпилення): m/z [M+H]+ 556. Препаративний приклад 13 43 84714 Тригідрохлорид метил 1-ендо-{8-[(3S)-3-аміно3-(3-фторфеніл)пропіл]-8-азабіцикло[3.2.1]окт-3ил|-2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5с|піридин-5-карбоксилату Газоподібний хлорводень барботували через розчин метил 1-eндo-(8-{(3S)-3-[(третбутоксикарбоніл)аміно]-3-(3-фторфеніл)пропіл}-8азабіцикло[3.2.1]окт-3-ил)-2-метил-4,5,6,7тетрагідро-1Н-імідазо[4,5-с]піридин-5карбоксилату (0,83г, 1,50ммоль) у дихлорметані (15мл) при 0°C, поки розчин не насичувався. Реакційну суміш потім залишали нагріватися до кімнатної температури і перемішували протягом однієї години. Розчинник випаровували при пониженному тиску і залишок суспендували у дихлорметані (10мл). Цей процес повторювали три рази, з одержанням вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (0,82г). HPMC (електророзпилення): m/z [M+H]+ 456. Препаративний приклад 14 Метил 1-ендо-{8-[(3S)-3-(ацетиламіно)-3-(3фтор феніл)пропіл]-8-азабіцикло[3.2.1]окт-3-ил}-2метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин5-карбоксилат Ацетилхлорид (0,062г, 0,79ммоль) додавали до розчину тригідрохлориду метил 1-ендо-{8-[(3І)3-аміно-3-(3-фторфеніл)пропіл]-8азабіцикло[3.2.1]окт-3-ил}-2-метил-4,5,6,7тетрагідро-1Н-імідазо[4,5-с]піридин-5карбоксилату (0,409г, 0,72ммоль) і триетиламіну (0,33г, 3,25ммоль), розчиняли у дихлорметані (10мл) у атмосфері азоту при кімнатній температурі ι реакційну суміш перемішували протягом 2 годин. Потім розчин промивали водою (10мл), 1N розчином гідроксиду натрію (10мл) і насиченим водним розчином хлориду натрію (10мл). Органічну фазу відділяли, сушили (MgSO 4) ι розчинник видаляли при пониженному тиску. Залишок очищували за допомогою колонкової флешхроматографії на силікагелі, елююючи за допомо 44 гою градієнтого розчинника, з використанням суміші дихлорметан:метанол:концентрований водний аміак (в об'ємі 99:1:0,1, змінюючи співвідношення до 97:3:0,3). Фракції, які містять продукт випаровували, з одержанням вказаної в заголовку сполуки у вигляді піни білого кольору (0,24г). HPMC (електророзпилення): m/z [M+H]+ 498. Препаративний приклад 15 N-{(1S)-3-[3-ендо-(2-Метил-4,5,6,7-тетрагідро1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропілІаиетамід До перемішуваного розчину метил 1-ендо-{8[(3S)-3-(ацетиламіно)-3-(3-фторфеніл)пропіл]-8азабіцикло[3.2.1]окт-3-ил}-2-метил-4,5,6,7тетрагідро-1Н-імідазо[4,5-с]піридин-5карбоксилату (13,27г, 26,7ммоль) у пропан-2-олі (80мл) додавали 2М водний розчин гідроксиду натрію (120 мл) і суміш нагрівали при кипінні протягом 48 годин. Після охолодження до кімнатної температури суміш екстрагували за допомогою етилацетату (2×200мл). Об'єднані органічні компоненти промивали за допомогою насиченого водного розчину хлориду натрію (150мл), сушили (MgSO4) і концентрували при пониженному тиску. Суміш неочищених продуктів очищували за допомогою колонкової флеш хроматографії на силікагелі, елююючи за допомогою градієнтого розчинника, з використанням суміші дихлорметан : метанол: концентрований водний аміак (в об'ємі 90 : 10:1, потім 80:20:1), з одержанням вказаної в заголовку сполуки у вигляді піни білого кольору (8,54 г, 73 %). HPMC (хімічна іонізація атмосферного тиску): m/z [MH +] 440 Препаративний приклад 16 N-{(1S)-3-[3-ендо-(2-Метил-4,5,6,7-тетрагідро1Н-імідазо[4.5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл)ацетамід 45 84714 (L)-тартрат метил 1-ендо-{8-[(3S)-3(ацетиламіно)-3-(3-фторфеніл)пропіл]-8азабіцикло[3.2.1]окт-3-ил}-2-метил-4,5,6,7тетрагідро-1Н-імідазо[4,5-с]піридин-5карбоксилату [WO 03/084954, Приклад 46] (898г, 1,39моль) додавали до дихлорметану (4,5л) і води (4,5л). Потім додавали водний гідроксид натрію (10М, 450мл) і одержану суміш перемішували протягом 15 хвилин. Дві фази відділяли і водний шар екстрагували додатковим дихлорметаном (2,25л). Об'єднані органічні екстракти потім концентрували і одержане масло розчиняли в пропан-2-олі (4,5л). Потім додавали водний гідроксид натрію (2М, 6,93л, 13,9моль) і двофазну суміш нагрівали при кипінні протягом 65 годин. Після охолодження до кімнатної температури фази відділяли і водний шар екстрагували за допомогою етилацетату (4,5л). Об'єднані органічні екстракти потім промивали за допомогою насиченого водного хлориду натрію (4,5л) і концентрували у вакуумі. Залишок розводили етилацетатом (9л) і концентрували ще раз у вакуумі. Зрештою, додавали більшу кількість етилацетату (4,5л) і одержану суспензію перемішували при 0-5°C протягом 1 години, фільтрували і промивали холодним етилацетатом (2450мл). Твердий продукт потім сушили у вакуумній печі при 40°C, з одержанням вказаної в заголовку сполуки (547,2г, 1,24моль, 89,8%). Дані HPMC аналізу для вказаної в заголовку сполуки були ідентичні до даних сполуки вказаної в заголовку Препаративного прикладу 15. Біологічні Дані Здатність сполук формули (І) і їх фармацевтично прийнятних солей, сольватів ι похідних, модулювати активність хемокінових рецепторів демонструється відповідно до методик, відомих в даній галузі, таких як дослідження на CCR5 зв'язування згідно з методиками, описаними в Combadiere та інші J. Leukoc. ВіоІ. 60, 147-52 (1996); і/або дослідження щодо інтрацелюлярної мобілізації кальцію, описаних тими ж авторами. Лінії клітин, які експресують рецептор, що представляє інтерес, включають такі лінії, які природним чином експресують рецептор, такий як PM-1 або IL-2 стимульовані лімфоцити периферійної крові (PBL), або клітину, яка запрограмована експресувати рекомбінантний рецептор, такий як CHO, 300.19, L1.2 або НЕК-293. Сполука Прикладу 4, при тестуванні з використанням дослідження на CCR5 зв'язування згідно з Combadiere і інші (там же) мала значення IC50 7,5нМ (MIP-1a), 7,3нМ (ΜΙΡ-1β) і 6,7нM (R ANTES). Сполука Прикладу 5, при тестуванні з використанням дослідження на CCR5 зв'язування згідно з Combadiere і інші мала значення IC50 2,7нМ (MIP1a), 2,4нМ (МІР-1β) і 1,9нM (R ANTES). Усі Приклади, при тестуванні з використанням аналізу щодо інтрацелюлярної мобілізації кальцію згідно з Combadiere і інші (там же) були сильними антагоністами з значеннями IC50 менше ніж 100нМ (МІР-1β). Фармакологічна дія сполук формули (І) і їх фармацевтично прийнятних солей, сольватів і похідних демонструється далі, з використанням аналізу gp160 індукованого клітинного злиття, для визначення значення IC50 сполук в залежності від ВІЛ-1 46 злиття. В аналізі др160 індукованого клітинного злиття, використовують HeLa Р4 лінію клітин і CHO-ТАТ10 лінію клітин. HeLa Р4 лінія клітин експресує CCR5 і CD4 і була трансфекована ВІЛ-1 LTR-β-Галактозидаза. Середовищем для цієї лінії клітин є середовище Дюльбекко модифіковане середовищем Ігла (DMEM) (без L-глутаміну), що містить 10% ембріональну телячу сироватку (FCS), 2мМ L-глутамін пеніцилін/стрептоміцин (Pen/Strep; 100О/мл пеніциліну + 10мг/мл стрептоміцину) і 1 мкг/мл пуроміцину. CHO лінія клітин представляє собою Tat (транскрипційний /пранс-активатор)-експресуючий клон з CHO JRR17.1 лінії клітин, що була трансфекована pTat пуро плазмідой. Середовище для цієї лінії клітин є збагаченим середовищем для клітинної культури ссавців, первинно розробленої в Roswell Park Memorial Institute RPMM 640 (без Lглутаміну), що містить 10% FCS, 2мМ L-глутаміну, 0,5мг/мл Гігроміцину В і 12 мкг/мл пуроміцину. CHO JRR17.1 лінія клітин експресує gp160 (JRFL) і є клоном, що був вибраний завдяки його здатності утворювати продукт злиття з CCR5/CD4 експресуючою лінією клітин. При клітинному злитті, присутність Tat у CHO клітині здатна до трансактивування довгого термінального повтору (LTR), присутнього у HeLa клітині, що веде до експресії ферменту βГалактозидази. Цю експресію потім вимірюють, з використанням набору для проведення аналізу Fluor Асе™ для виявлення β-Галактозидази (BioRad за каталогом №170-3150). Цей набір кількісного флуоресцентного аналізу, що визначає рівень експресії β-Галактозидази, використовуючи 4метилумбеліферул-галактопіранозид (MUG) як субстрат. β-Галактозидаза гідролізує фторгенний субстрат, що приводить до вивільнення флуоресцентної молекули 4-метилумбеліферону (4MU). Флуоресценцію 4-метилумбеліферону потім вимірюють на флуорометрі, використовуючи хвилі збудження довжиною 360нм і хвилі емісії довжиною 460нм. Сполуки, які інгібують злиття, викликають знижений сигнал і після розчинення у відповідному розчиннику і розведенні в культуральному середовищі, для обчислення значення IC50 може використовуватися крива залежності доза - відповідь для кожної сполуки. Всі сполуки Прикладів винаходу мають значення IC50, відповідно до вищезгаданої методики, менше ніж 10нМ. Сполуки Прикладів 1 і 5 мають, відповідно, IC50 значення 130 і 120пM. Дані дифракції рентгенівських променів на порошку (PXRD) Всі дифрактограми PXRD знімали, використовуючи Порошковий Дифрактометр Bruker D5000, з діапазоном кутів 2-тета від 2 до 55°, використовуючи крок сканування 0,02°/крок. Зразок обертався під час опромінення мідним джерелом рентгенівського опромінення K-альфа1 (Довжина хвилі = 1,5046 Ангстреми), відфільтрованого графітовим монохроматором (λ=0,15405нМ) з Рентгенівською трубкою з вольтажем та силою струму 40 кВ/40 мА. Ди фрактометр був калібрований з викорис 47 84714 танням кварцевого зразка як стандарту, перед і після збору даних для кожного зразка. 48 Основні піки (у градусах 2-те та) дифрактограм PXRD для Прикладів 10, 11 і 12 проілюстровані в наступних таблицях: Таблиця 1 Дані піків PXRD для N-{(1S)-3-[3-ендо-(5-Ізобутирил-2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду. Кут (° 2-тета) Інтенсивність (%) Кут (° 2-тета) Інтенсивність (%) Кут (° 2-тета) 8,1 90,5 17,0 49,6 24,1 9,0 20,9 17,8 80,7 24,8 9,8 12,8 18,3 67,4 25,4 10,7 89,1 18,6 43,6 25,6 11,3 39,8 18,9 48,3 26,2 12,3 100,0 19,9 39,2 27,0 13,1 24,2 20,5 48,3 27,9 14,1 67,3 21,0 43,8 28,9 14,5 19,4 21,5 50,4 29,4 15,8 55,4 22,5 51,4 30,0 16,3 49,9 23,1 46,1 35,9 16,6 48,5 23,3 54,9 Інтенсивність (%) 35,8 29,5 38,0 34,6 43,0 21,3 28,6 25,5 24,6 21,7 18,9 Таблиця 2 Дані піків PXRD для фумарату N-{(1S)-3-[3-ендо-(5-Ізобутирил-2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду. Кут (° 2-тета) 6,7 10,0 10,2 10,4 10,9 12,8 13,6 16,7 17,0 17,6 18,2 18,4 Інтенсивність (%) 38,6 34,1 17,7 36,2 16,2 13,1 10,1 100,0 16,1 32,0 31,1 77,8 Кут (° 2-тета) 19,1 19,6 20,1 20,6 20,8 21,1 22,2 22,6 22,9 23,4 24,8 Інтенсивність (%) 18,2 77,8 10,2 65,2 23,4 42,3 20,2 24,1 37,0 12,3 14,3 Кут (° 2-тета) 25,0 25,5 26,7 28,3 28,6 29,0 29,7 30,0 31,0 33,0 34,6 Інтенсивність (%) 12,9 10,1 17,6 24,1 13,6 10,1 19,0 12,8 11,0 15,2 13,2 Таблиця 3 Дані піків PXRD для N-{(1S)-3-[3-ендо-(5-Ізобутирил-2-метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду (D)-тартрату. Кут (° 2-тета) 5,0 6,9 9,0 9,2 10,0 10,4 11,0 12,4 13,6 14,4 14,8 16,4 Інтенсивність (%) 12,5 59,6 17,1 10,9 14,6 17,3 15,1 14,5 12,5 13,7 10,1 41,3 Кут (° 2-тета) 16,6 17,1 18,0 18,5 19,0 19,5 20,0 20,8 21,2 21,4 22,5 25,0 Змодульована дифракгограма PXRD для N{(1S)-3-[3-ендо-(5-Ізобутирил-2-метил-4,5,6,7 Інтенсивність (%) Кут (° 2-тета) Інтенсивність (%) 42,4 28,0 21,2 100,0 29,1 25,7 65,1 29,7 21,6 50,0 30,9 17,2 27,1 32,1 21,0 23,9 31,5 30,6 42,2 39,0 41,6 15,8 тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3 49 84714 фтор феніл)пропіл}ацетаміду фумарату, включаючи кути 2-тета, d-відстані і відносні інтенсивності, була розрахована на окремій кристалічній структурі, використовуючи "Reflex Powder Diffraction" module Accelrys Materials Studi™ [версія 2.2]. Параметри модулювання були наступні: Довжина хвилі випромінювання = 1,540562 Ǻ (Cu Ka) Фактор Поляризації = 0,5 50 Профіль Псевдо-Фойгта (U=0,01, V=-0,001, W=0,002) Основні піки (у градуса х 2-тета), змодельованої дифрактограми PXRD для фумарату N-{(1S)-3[3-ендо-(5-Ізобутирил-2-метил-4,5,6,7-тетрагідро1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетаміду наведені в таблиці 4. Таблиця 4 Змодельовані дані піків PXRD для фумарату N-{(1S)-3-[3-ендо-(5-1зобутирил-2-метил-4,5,6,7-тетрагідро-1Німідазо[4,5-с]піридин-1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3-фторфеніл)пропіл}ацетаміду. Кут (° 2-тета) 6,7 10,0 10,5 11,0 12,8 13,6 16,7 17,0 17,7 18,2 18,5 19,1 Інтенсивність (%) 59,4 64,5 67,7 28,8 12,7 17,0 93,8 19,6 32,3 30,0 100,0 15,4 Дані диференціальної скануючої калориметрії Дані диференціальної скануючої калориметрії (ДСК) одержували, використовуючи калориметр Perkin Elmer PYRIS Diamond DSC, обладнаний пристроєм автоматичної зміни зразків, з продувкою газоподібним азотом. Зразки поміщали в 50мл алюмінієві лотки з отворами і кришечками і піддавали нагріванню в інтервалі температур від 10 до 300°C, з швидкістю нагрівання 20°C за хв. N-{(1S)-3-[3-ендо-(5-Ізобутирил-2-метил4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-1-іл)-8азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл)ацетамід Вага зразка 3,016мг Ендотермічний пік при 118°C - розплав Комп’ютерна в ерстка О. Рябко Кут (° 2-тета) 19,6 20,6 21,1 22,2 22,5 22,9 23,4 26,8 28,3 28,6 29,7 30,0 Інтенсивність (%) 98,3 56,8 45,1 13,8 16,1 39,1 10,0 11,2 15,5 10,8 14,1 11,6 Фумарат N-{(1S)-3-[3-ендо-(5-Ізобутирил-2метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл)ацетаміду Вага зразка 2,905мг Ендотермічний пік при 219°C - розплав Ендотермічна подія при 228°C Екзотермічна подія 246°C (D)-тартрат N-{(1S)-3-[3-ендо-(5-Ізобутирил-2метил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин1-іл)-8-азабіцикло[3.2.1]окт-8-ил]-1-(3фтор феніл)пропіл}ацетаміду Вага зразка 2,979мг Ендотермічний пік при 217°C - розплав. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;imidazopyridine substituted tropane derivatives with ccr5 receptor antagonist activity for the treatment of hiv and inflammation
Автори англійськоюStupple Paul Anthony
Назва патенту російськоюПроизводные имидазопиридинзамещенного тропана с антагонистической активностью ccr5 рецепторов для лечения вич и воспаления
Автори російськоюСтаппл Пол Энтони
МПК / Мітки
МПК: A61P 31/18, A61K 31/4188, C07D 471/04
Мітки: імідазопіридинзаміщеного, віл, рецепторів, похідні, антагоністичною, тропану, запалення, лікування, активністю
Код посилання
<a href="https://ua.patents.su/25-84714-pokhidni-imidazopiridinzamishhenogo-tropanu-z-antagonistichnoyu-aktivnistyu-ccr5-receptoriv-dlya-likuvannya-vil-ta-zapalennya.html" target="_blank" rel="follow" title="База патентів України">Похідні імідазопіридинзаміщеного тропану з антагоністичною активністю ccr5 рецепторів для лікування віл та запалення</a>
Попередній патент: Пристрій для підйому глибинної морської води на поверхню
Наступний патент: Процес кристалізації продукту окиснення, який містить адипінову кислоту
Випадковий патент: Композиція для отримання захисного покриття












