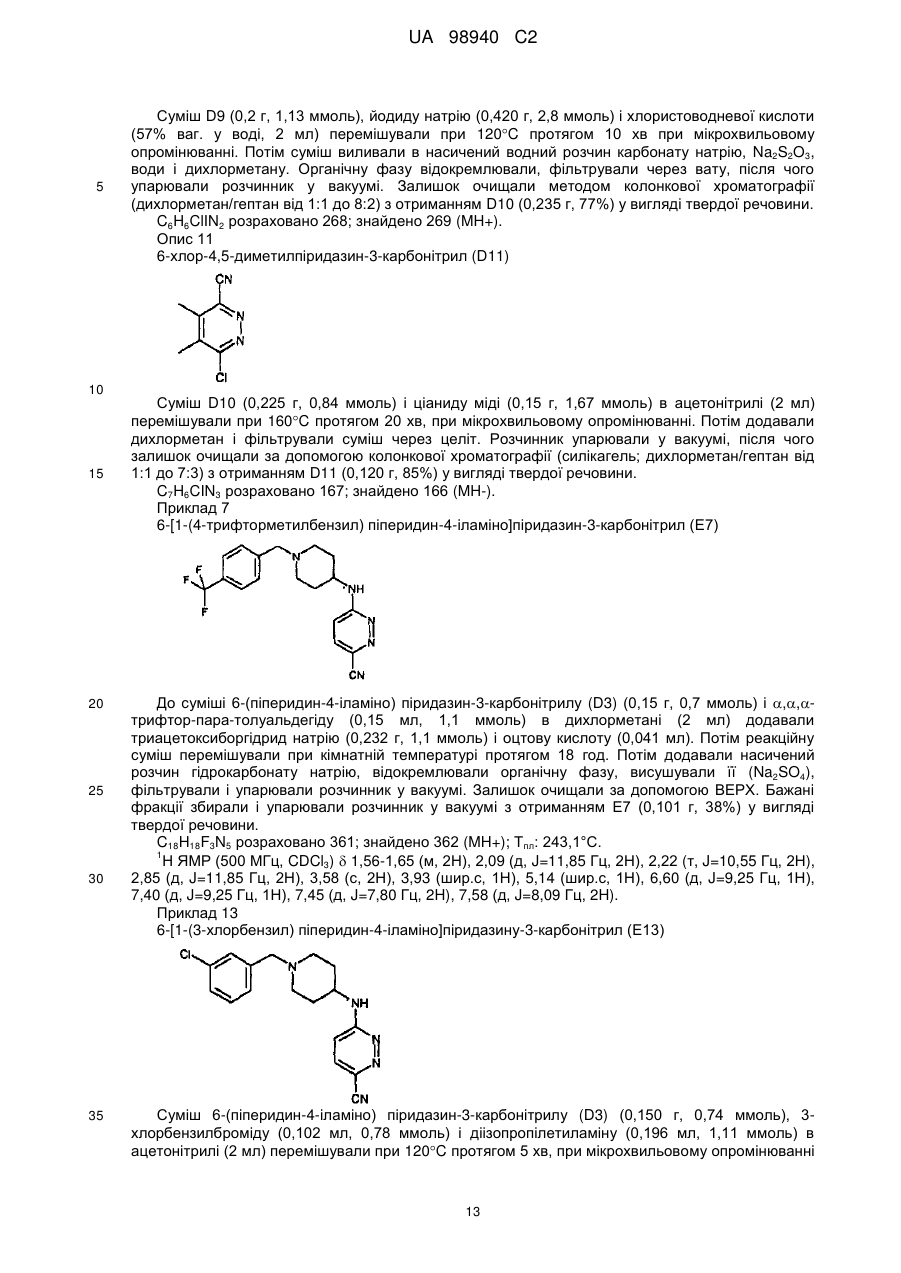
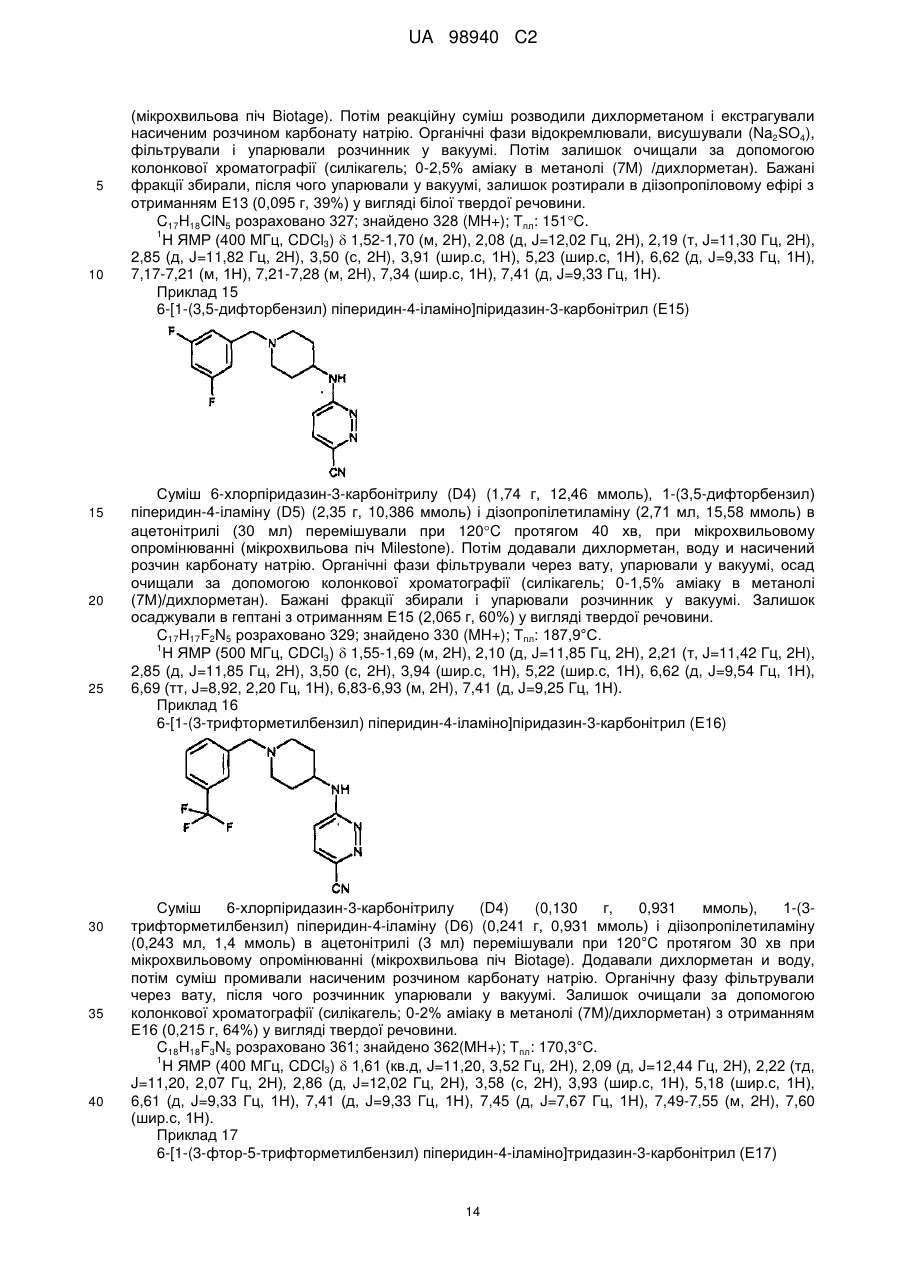
Піперидиніламінопіридазини і їх застосування як швидкодисоціюючих антагоністів рецептора допаміну 2
Номер патенту: 98940
Опубліковано: 10.07.2012
Автори: МакДональд Грегор Джеймс, Андрес-Жиль Хосе Ігнасіо, Бартоломе-Небреда Хосе Мануель, ван ден Кейбус Франс Альфонс Марія, ван Гоол Мішель Люк Марія
Формула / Реферат
1. Сполука формули (І)
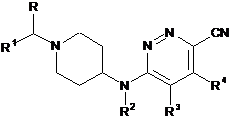 (I)
(I)
або її фармацевтично прийнятна сіль або сольват, або її стереоізомерна форма, де
R є воднем або С1-6алкілом;
R1 є фенілом; фенілом, заміщеним 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, ціано, С1-4алкілу, С1-4алкокси, перфторС1-4алкілу і трифторметокси; тієнілу; тієнілу, заміщеного 1 або 2 замісниками, вибраними з групи, що складається з галогену і С1-4алкілу; С1-4алкілу; С1-4алкілу, заміщеного гідроксилом, С3-8циклоалкілу або С5-7циклоалкенілу; С3-8циклоалкілу або С5-7циклоалкенілу;
R2 є воднем або С1-6алкілом;
кожен з R3 і R4 незалежно є воднем, С1-4алкілом або галогеном, або R3 і R4 разом утворюють 5-, 6- або 7-членне карбоциклічне кільце або 5-, 6- або 7-членне гетероциклічне кільце, що містить щонайменше один атом кисню, азоту або сірки.
2. Сполука за п. 1, де R, R3 і R4 є воднем.
3. Сполука за п. 1, де R2 є воднем або метилом.
4. Сполука за п. 1, де R1 є 3,5-дифторфенілом, 3,4,5-трифторфенілом, 3-трифторметилфенілом, 3-фтор-5-трифторметилфенілом або 3-фтор-4-метилфенілом.
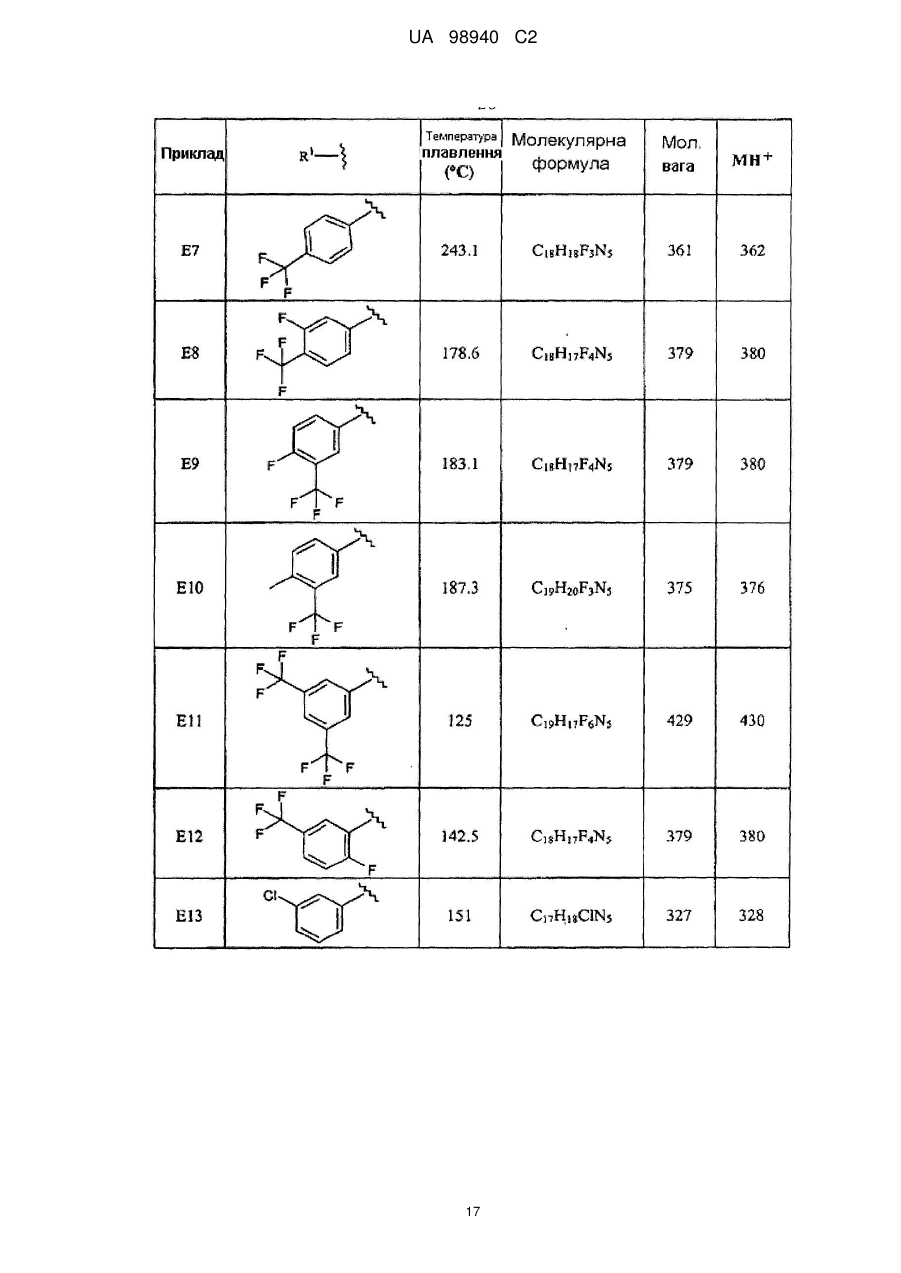
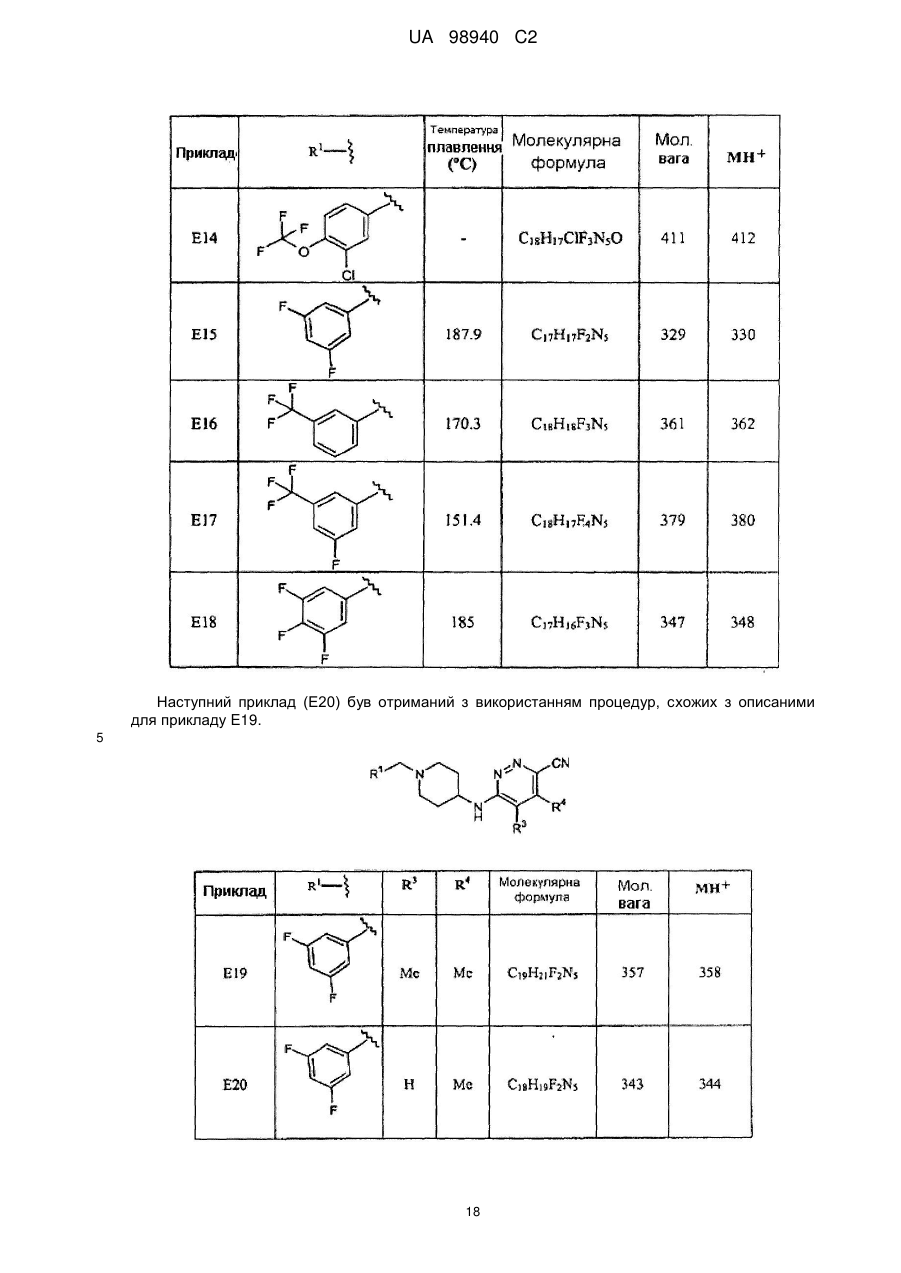
5. Сполука за п. 1, де сполука вибрана з групи, що складається з
6-[1-(3,5-дифторбензил)піперидин-4-іламіно]піридазин-3-карбонітрилу,
6-[1-(3-трифторметилбензил)піперидин-4-іламіно]піридазин-3-карбонітрилу,
6-[1-(3-фтор-5-трифторметилбензил)піперидин-4-іламіно]піридазин-3-карбонітрилу,
6-[1-(3,4,5-трифторбензил)піперидин-4-іламіно]піридазин-3-карбонітрилу і
6-[1-(3-фтор-4-метилбензил)піперидин-4-іламіно]піридазин-3-карбонітрилу.
6. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п. 1.
7. Сполука за п. 1 для застосування як лікарського засобу.
8. Сполука за п. 7 для застосування як антипсихотичного засобу.
9. Сполука за п. 7 для застосування як лікарського засобу для лікування або попередження шизофренії, шизофреноформних розладів, шизоафективних розладів, маревних розладів, короткочасного психотичного розладу, індукованого психотичного розладу, психотичних розладів, викликаних загальним соматичним станом, викликаного вживанням речовин психотичного розладу, психотичних розладів без інших вказівок; психозів, пов'язаних з божевіллям; великого депресивного розладу, дистимічного розладу, передменструального дисфоричного розладу, депресивного розладу без інших вказівок; біполярного розладу І типу, біполярного розладу II типу, циклотимічного розладу, біполярного розладу без інших вказівок, розладів настрою, викликаних загальним соматичним станом, розладу настрою, викликаного вживанням речовин, розладу настрою без інших вказівок; генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, розладів, пов'язаних з гострим стресом, розладів, пов'язаних з посттравматичним стресом; природженого недоумства; аутистичних розладів; розладів, пов'язаних з недостатністю уваги, розладу, пов'язаного з недостатністю уваги і гіперактивністю, дизруптивних розладів поведінки; порушень особистості параноїдального типу, порушень особистості шизоїдного типу, шизотипових розладів особистості; судомних розладів, синдрому Туретта; залежності від речовин; зловживання речовинами; синдрому відміни речовин; трихотиломанії.
10. Спосіб отримання сполуки формули (І)
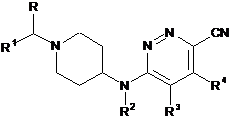 , (І)
, (І)
де R, R1-R4 описані в п. 1, що включає стадію, за якою
здійснюють реакцію проміжної сполуки формули (II)
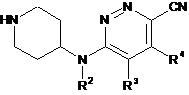 , (ІІ)
, (ІІ)
де R2-R4 описані в п. 1, з проміжною сполукою формули R1-C(=O)-R, де R і R1 описані в п. 1, у присутності відновлюючого агента і кислотного каталізатора, в інертному реакційному розчиннику.
11. Спосіб отримання сполуки формули (І)
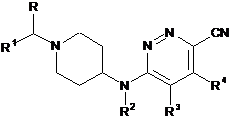 , (І)
, (І)
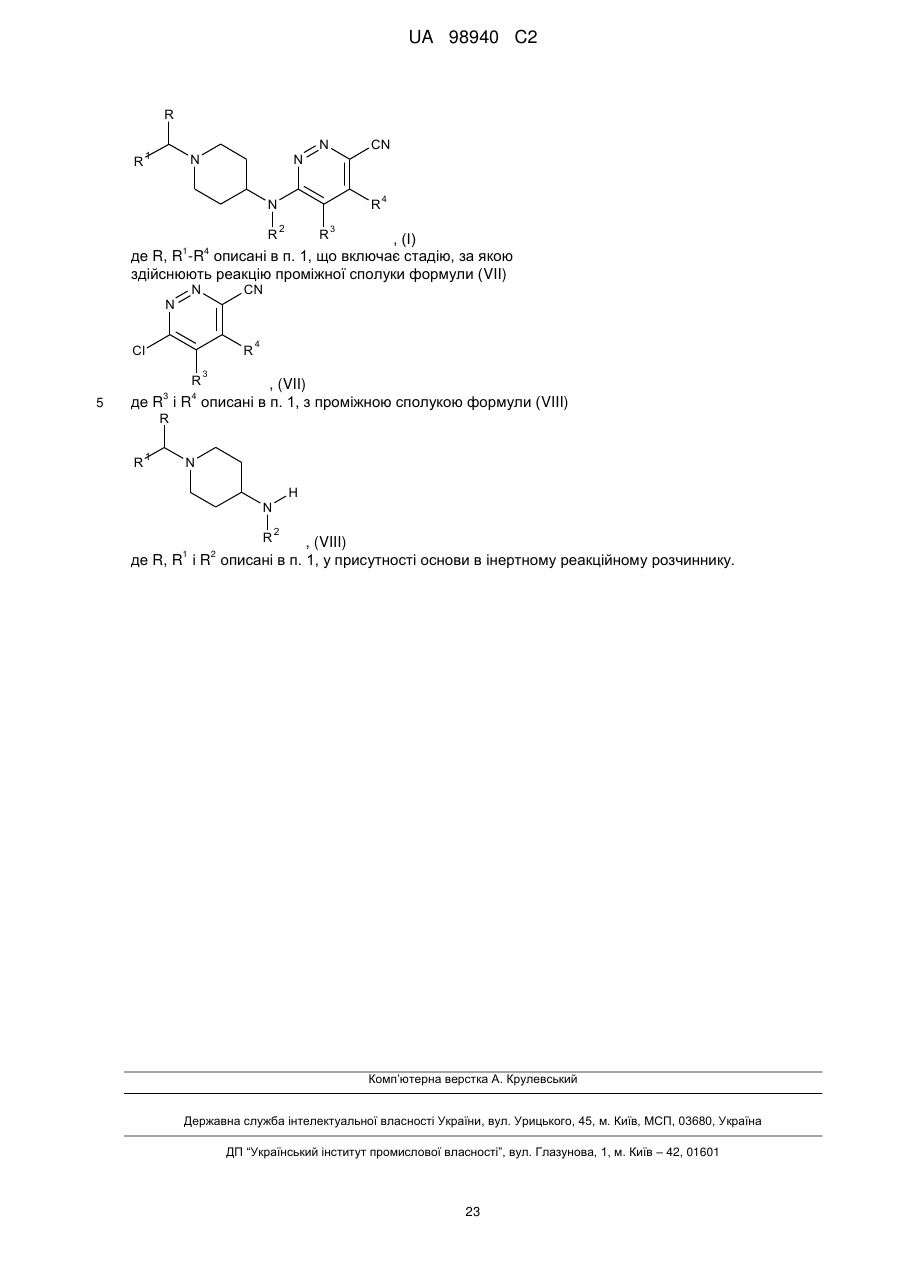
де R, R1-R4 описані в п. 1, що включає стадію, за якою
здійснюють реакцію проміжної сполуки формули (VII)
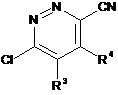 , (VII)
, (VII)
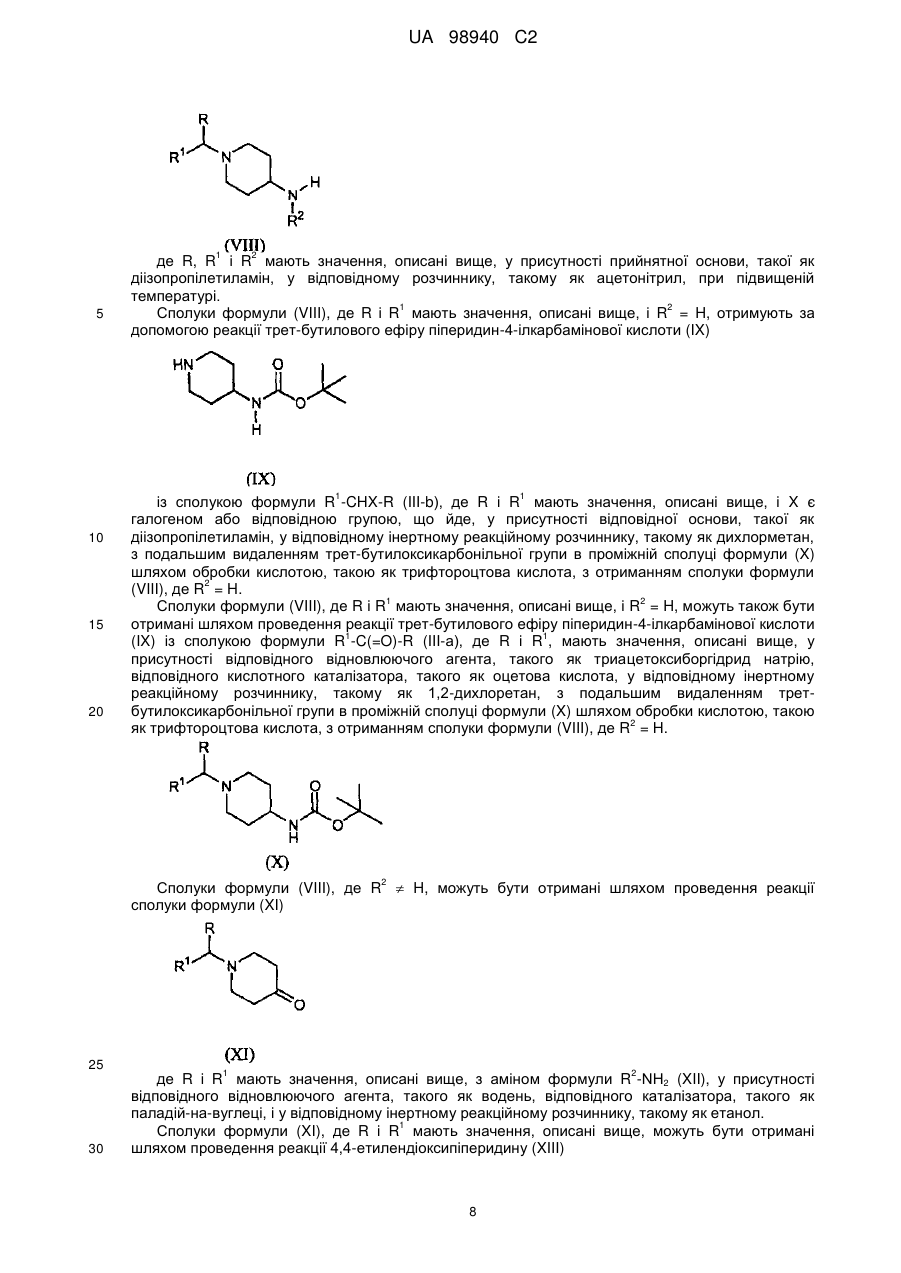
де R3 і R4 описані в п. 1, з проміжною сполукою формули (VIII)
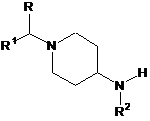 , (VIII)
, (VIII)
де R, R1 і R2 описані в п. 1, у присутності основи в інертному реакційному розчиннику.
Текст
Реферат: Представлений винахід стосується 6-(піперидин-4-іламіно)піридазин-3-карбонітрилів формули (І) R R 1 N N CN N R N R 2 R 3 4 , (I) які є швидкодисоціюючими антагоністами рецепторів допаміну 2, способів отримання цих сполук, фармацевтичних композицій, що містять ці сполуки як активний компонент; а також застосування їх як лікарських засобів для лікування або попередження розладів центральної UA 98940 C2 (12) UA 98940 C2 нервової системи, наприклад шизофренії, демонструючи антипсихотичну дію без моторних побічних ефектів. UA 98940 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дійсний винахід відноситься до 6-(піперидин-4-іламіно) піридазин-3-карбонітрилів, що є швидко диссоціюючими антагоністами рецепторів допаміну 2, способів отримання цих сполук і фармацевтичних композицій, що включають як активний компонент ці сполуки. Ці сполуки знаходять застосування як лікарські засоби для лікування або попередження розладів центральної нервової системи, наприклад шизофренії, надаючи антипсихотичну дію за відсутності побічних моторних ефектів. В J. Med. Chem. (1999), 42(4), 730-741 як інгібітори ацетилхолінестерази описані 6-феніл-N[1-(фенілметил)-4-піперидиніл]-3-тридазинамін і аналогічні сполуки. В Farmaco, Vol.35, no.11, 1980, р.951-964 описані N-[4-піперидиніл]-2-амінопіримідини, що мають допамінергічну активність, тобто більшість описаних сполук є агоністами рецептора допаміну D2. Оскільки жодна з вивчених сполук не перешкоджала стереотипній поведінці, викликаній подальшою дозою апоморфіну, вони можуть також вважатися позбавленими здатності блокувати рецептор допаміну. Відмінність сполук за дійсним винаходом полягає у присутності піридазину замість піримідинової групи і несподівано виявленій антагоністичній дії відносно рецептора допаміну D2. Шизофренія є серйозним хронічним психічним захворюванням, яке вражає приблизно 1% населення. Клінічні симптоми стають помітними у відносно ранньому віці, зазвичай виникаючи в пубертатному періоді або в ранньому дитинстві. Симптоми шизофренії зазвичай розділяються на симптоми, які описують як позитивні, включаючи галюцинації, манії і сплутані думки, і симптоми, які описують як негативні, включаючи соціальну ізоляцію, ослаблення емоцій, зубожіння мови і нездатність відчувати задоволення. Крім того, пацієнти з шизофренією страждають від когнітивних порушень, таких як ушкодження уваги і пам'яті. Етіологія захворювання залишається невідомою, але вважається, що в основі симптомів шизофренії лежить ненормальна дія нейромедіаторів. Найбільш часто браною до уваги гіпотезою є допамінергічна гіпотеза; вона припускає, що за позитивні симптоми, спостережувані у пацієнтів з шизофренією, відповідає гіперактивність допамінової передачі. Ця гіпотеза грунтується на спостереженні того, що препарати, які підсилюють допамін, такі як амфетамін або кокаїн, можуть викликати психози, і на тому, що існує кореляція між клінічними дозуваннями антипсихотичних засобів і їх здатністю блокувати рецептори допаміну D2. Усі антипсихотичні засоби, які є на ринку, проявляють свою терапевтичну дію відносно позитивних симптомів шизофренії, блокуючи рецептор допаміну D2. Якщо відвернутися від клінічної ефективності, то створюється враження, що основні побічні ефекти антипсихотичних засобів, такі як екстрапірамідальні симптоми (EPS) і пізня дискінезія, також пов'язані з антагонізмом допаміну. Ці виснажувальні побічні ефекти найчастіше виявляються з типовими антипсихотичними засобами або антипсихотичними засобами першого покоління (наприклад, галоперидол). Вони є менш вираженими для нетипових антипсихотичних засобів або антипсихотичних засобів другого покоління (наприклад, рисперидону, оланзапіну) і можуть навіть практично бути відсутніми у клозапіну, який є прототипом нетипового антипсихотичного засобу. Серед різних гіпотез, запропонованих для пояснення того, що менше зустрічається EPS, що спостерігається для нетипових антипсихотичних засобів, велику увагу привернула до себе в останні п'ятнадцять років мультирецепторна гіпотеза. Вона є результатом досліджень зв'язування рецепторів, які показують, що багато нетипових антипсихотичних засобів на додаток до рецепторів допаміну D2 взаємодіють з різними іншими рецепторами нейромедіаторів, зокрема з рецепторами серотоніну 5-НТ2, тоді як типові антипсихотичні засоби, такі як галоперидол, більш специфічно зв'язуються з рецепторами D2. Останніми роками ця теорія ставиться під сумнів, оскільки всі основні нетипові антипсихотичні засоби в клінічно значущих дозах повністю займають рецептори серотоніну 5-НТ2, але все одно мають відмінності в тому, що стосується викликання моторних побічних ефектів. Як альтернатива мультирецепторній гіпотезі Kapur і Seeman ("Does fast dissociation from the dopamine D2 receptor explain the action of atypical antipsychotics?: A new hypothesis", Am. J. Psychiatry 2001, 158: 3, p.360-369) припустили, що нетипові антипсихотичні засоби можуть бути відокремлені від типових антипсихотичних засобів за швидкістю, з якою вони дисоціюють від рецепторів допаміну D2. Швидка дисоціація від рецептора D2 робить антипсихотичний засіб більш пристосованим до фізіологічної передачі допаміну, що дозволяє антипсихотичний ефект без моторних побічних ефектів. Гіпотеза є особливо переконливою, коли справа стосується клозапіну і кветіапіну. Ці два препарати мають найбільш високу швидкість дисоціації від рецепторів допаміну D2 і мають найменший ризик викликати у людини EPS. З іншого боку, типовими антипсихотичними засобами, співвідношуваними з високим розповсюдженням EPS, є найбільш поволі дисоціюючі антагоністи рецептора допаміну D2. Таким чином, пошук нових препаратів на підставі швидкості їх дисоціації з рецептором допаміну D2 здається правомірною стратегією отримання нових нетипових антипсихотичних засобів. 1 UA 98940 C2 5 10 15 20 25 30 35 40 45 Додатковим завданням є поєднання властивостей швидко дисоціювати з вибірковістю відносно рецепторів допаміну D2. Мультирецепторний профіль сучасних нетипових антипсихотичних засобів вважається причиною інших побічних ефектів, таких як набір ваги і діабет. Пошук вибіркових антагоністів D2 якийсь час ігнорували як підхід, але автори винаходу вважають, що застосування більш вибіркових сполук в клінічній практиці може зменшити зустрічання метаболічних розладів, пов'язаних з існуючими нетиповими антипсихотичними лікарськими засобами. Предметом дійсного винаходу є надання нових сполук, які є швидко дисоціюючими антагоністами рецептора допаміну 2, що мають сприятливий фармакологічний профіль, як описано вище, зокрема зменшені моторні побічні ефекти, і взаємодію з іншими рецепторами від середнього до незначного, що приводить до зниження ризику розвитку метаболічних розладів. Мета досягається представленими новими сполуками формули І: їх фармацевтично прийнятними солями і сольватами, і їх стереоізомерними формулами, де R є воднем або C1-6алкілом; 1 R є фенілом; фенілом, заміщеним 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, ціано, С 1-4алкілу, С1-4алкілокси, перфторС14алкілу і трифторметокси; тієнілу; тієнілу, заміщеного 1 або 2 замісниками, вибраними з групи, що складається з галогену і С1-4алкілу; С1-4алкілу; С1-4алкілу, заміщеного гідроксилом, С 38циклоалкілу або С5-7циклоалкенілу; С3-8циклоалкілу; або С5-7циклоалкенілу; 2 R є воднем або С1-6алкілом; 3 4 3 4 кожен з R і R є воднем, С1-4алкілом або галогеном, або R і R разом утворюють 5-, 6-або 7членне карбоциклічне кільце, або 5-, 6- або 7-членне гетероциклічне кільце, що містить, щонайменше, один атом кисню, азоту або сірки. Сполуки за винаходом є швидко диссоціюючими антагоністами рецептора D2, ця активність не приписується жодному з похідних 6-феніл-N-[4-піперидиніл]-3-піридазинаміну з J. Med. Chem. (1999), 42(4), 730-741, ні будь-якому із заміщених N-[4-піперидиніл]-2-амінопіримідинів з Farmaco, Vol.35, no.11, 1980, р.951-964. Ця властивість робить сполуки за винаходом особливо прийнятними для застосування як лікарських засобів для лікування або попередження шизофренії, шизофреноформних розладів, шизоафективних розладів, маревних розладів, короткочасного психотичного розладу, індукованого психотичного розладу, психотичних розладів, викликаних загальним соматичним станом, викликаного вживанням речовин психотичного розладу, психотичних розладів без інших вказівок; психозів, пов'язаних з божевіллям; великого депресивного розладу, дистимічного розладу, передменструального дисфоричного розладу, депресивного розладу без інших вказівок; біполярного розладу І типу, біполярного розладу II типу, циклотимічного розладу, біполярного розладу без інших вказівок, розладів настрою, викликаних загальним соматичним станом, розладу настрою, викликаного вживанням речовин, розладу настрою без інших вказівок; генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, розладів, пов'язаних з гострим стресом, розладів, пов'язаних з посттравматичним стресом; природженого недоумства; аутистичних розладів; розладів, пов'язаних з недоліком уваги, розладу, пов'язаного з недоліком уваги і гіперактивністю, дизраптивних розладів поведінки; особових порушень параноїдального типу, особових порушень шизоїдного типу, шизотипових розладів особи; судомних розладів, синдрому Туретта; залежності від речовин; зловживання речовинами; синдрому відміни речовин; трихотиломанії. Фахівець може зробити вибір сполук на підставі експериментальних даних, розміщених тут далі в Експериментальній частині. Будь-який вибір сполук охоплений даним винаходом. 3 4 Перша група сполук формули (І) є сполуками, в яких R, R і R є воднем. 2 Друга група сполук формули (І) є сполуками, в яких R є воднем або метилом. 2 UA 98940 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Третя група сполук є сполуками формули (І), де R є 3,5-дифторфенілом, 3,4,5трифторфенілом, 3-трифторметилфенілом, З-фтор-5-трифторметилфеніл або З-фтор-4метилфеніл. Сполуками формули (І) є, наприклад 6-[1-(3,4-дифторбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E1) 6-[1-(4-фторбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е2) 6-[1-(4-хлорбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е3) 6-[1-(3-фтор-4-метилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е4) 6-[1-(3-фторбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е5) 6-[1-(4-метилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е6) 6-[1-(4-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е7) 6-[1-(3-фтор-4-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е8) 6-[1-(4-фтор-3-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е9) 6-[1-(4-метил-3-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E10) 6-[1-(3,5-біс-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E11) 6-[1-(2-фтор-5-трифторметилбензил)піперидин-4-іламіно]піридазин-3-карбонітрил (E12) 6-[1-(3-хлорбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E13) 6-[1-(3-хлор-4-трифторметоксибензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E14) 6-[1-(3,5-дифторбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E15) 6-[1-(3-трифторметилбензил)піперидин-4-іламіно]піридазин-3-карбонітрил (E16) 6-[1-(3-фтор-5-трифторметилбензил)піперидин-4-іламіно]піридазин-3-карбонітрил (E17) 6-[1-(3,4,5-трифторбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E18) 6-[1-(3,5-дифторбензил) піперидин-4-іламіно]-4,5-диметилпіридазин-3-карбонітрил (E19), 6-[1-(3,5-дифторбензил) піперидин-4-іламіно]-4-метилпіридазин-3-карбонітрил (Е20) і 6-(1-бензилпіперидин-4-іл) піридазин-3-карбонітрил (D2). У дійсній заявці термін «С1-4алкіл», коли використовується сам по собі або в поєднаннях, таких як «С1-4алкілокси», «перфторС1-4алкіл» «диС1-4алкіламіно», включає, наприклад, метил, етил, пропіл, бутил, 1-метилпропіл, 1,1-диметилетил; термін «С1-6алкіл» включає метил, етил, пропіл, бутил, 1-метилпропіл, 1,1-диметилетил, пентил і гексил; «перфторС1-4алкіл» включає, наприклад, трифторметил, пентафторетил, гептафторпропіл і нонафторбутил; «С3-8циклоалкіл» включає циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил; «С 57циклоалкеніл» включає циклопентеніл, циклогексеніл і циклогептеніл. Термін «галоген» включає фтор, хлор, бром і йод. Термін «фармацевтично прийнятні солі» визначений як такий, що включає терапевтично активні нетоксичні форми кислотно-адитивних солей, які можуть утворювати сполуки формули (І). Вказані солі можуть бути отримані шляхом обробки основної форми сполук формули (І) відповідними кислотами, наприклад, неорганічними кислотами, наприклад галогеноводневою кислотою, зокрема хлористоводневою кислотою, бромистоводневою кислотою, сірчаною кислотою, азотною кислотою і фосфорною кислотою; органічними кислотами, наприклад оцтовою кислотою, гліколевою кислотою, пропановою кислотою, молочною кислотою, піровиноградною кислотою, щавлевою кислотою, малоновою кислотою, бурштиновою кислотою, малеїновою кислотою, мигдалевою кислотою, фумаровою кислотою, яблучною кислотою, винною кислотою, лимонною кислотою, метансульфоновою кислотою, етансульфоновою кислотою, бензолсульфоновою кислотою, пара-толуолсульфоновою кислотою, цикламовою кислотою, саліциловою кислотою, пара-аміносаліциловою кислотою, памовою кислотою і мигдалевою кислотою. І навпроти, вказані форми солей можуть бути перетворені у вільні форми шляхом обробки відповідною основою. Термін «сольвати» відноситься до гідратів і алкоголятів, які можуть утворювати сполуки формули (І). Термін «стереохімічно ізомерні форми», використаний в дійсному описі раніше, означає всі можливі ізомерні форми, які можуть приймати сполуки формули (І). Якщо не мається на увазі або не вказано інше, хімічне позначення сполук позначає суміш всіх можливих стереохімічно ізомерних форм, причому вказані суміші містять всі діастереомери і енантіомери основної молекулярної структури. Детальніше, стереогенні центри можуть мати R- або S-конфігурацію; замісники на бівалентних циклічних (частково) насичених радикалах можуть мати або цис- або транс-конфігурацію. Сполуки, що містять подвійні зв'язки, можуть мати на вказаному подвійному зв'язку E- або Z-стереохімічну конфігурацію. Стереохімічно ізомерні форми сполук формули (І) включені в об'єм дійсного винаходу. Сполуки формули (І), які отримуються в описаних нижче способах, можуть бути синтезовані у формі рацемічних сумішей енантіомерів, які можуть бути відокремлені один від одного, 3 UA 98940 C2 5 10 15 20 25 30 35 40 45 50 55 60 слідуючи до методик розділення, відомих з рівня техніки. Рацемічні сполуки формули (І) можуть бути перетворені у відповідні діастереомерні форми солі шляхом реакції з відповідною хіральною кислотою. Вказані діастереомерні форми солі надалі розділяють, наприклад, за допомогою вибіркової або часткової кристалізації, і енантіомери вивільняються з них за допомогою лугів. Альтернативний спосіб розділення енантіомерних форм сполук формули (І) залучає рідинну хроматографію з використанням хіральної нерухомої фази. Вказані чисті стереохімічно ізомерні форми можуть також бути отримані з відповідних чистих стереохімічно ізомерних форм відповідних вихідних речовин за умови, що реакція протікає стереоспецифічно. Переважно, якщо бажаний певний стереоізомер, вказана сполука синтезуватиме з використанням стереоспецифічних способів отримання. Ці способи отримають користь при використанні енантіомерно чистих вихідних речовин. Фармакологія Для того, щоб виявити антипсихотичні сполуки, активні по відношенню до позитивних симптомів і що мають покращений профіль безпеки (низьке зустрічання EPS і відсутність метаболічних розладів), автори дійсного винаходу провели скринінг сполук, що вибірково взаємодіють з рецептором допаміну D2 і швидко дисоціюючих від цього рецептора. Спочатку проводили скринінг сполук по відношенню їх спорідненості з рецептором допаміну D2 в 3 дослідженні зв'язування із застосуванням [ Н]спіперону і мембран людських рецепторних клітин D2L. Сполуки, що показали ІС50 менший ніж 10 мкМ, були досліджені за допомогою непрямого аналізу, адаптованого на основі методу, опублікованого в Josee E. Leysen and Walter Gommeren, Journal of Receptor Research, 1984, 4(7), 817-845, для оцінки швидкості їх дисоціації. Вибрані сполуки Е15, Е16, Е17 і Е18 далі піддавали скринінгу на панелі із понад 50 звичайних пов'язаних з G-білком рецепторів (CEREP) і показали чистий профіль, що свідчить про низьку спорідненість по відношенню до досліджених рецепторів. Більшість сполук були далі досліджені в моделях in vivo, таких як «інгібування викликаного апоморфіном збудження на щурах», при підшкірному і пероральному введенні, і для деяких було виявлено, що вони є біодоступними перорально і активними. В світлі вищезазначеної фармакології сполук формули (І) витікає, що вони придатні для застосування як лікарські засоби, зокрема для застосування як антипсихотичний засіб. Конкретніше, сполуки придатні для застосування як лікарський засіб для лікування або попередження шизофренії, шизофреноформних розладів, шизоафективних розладів, маревних розладів, короткочасного психотичного розладу, індукованого психотичного розладу, психотичних розладів, викликаних загальним соматичним станом, викликаного вживанням речовин психотичного розладу, психотичних розладів без інших вказівок; психозів, пов'язаних з божевіллям; великого депресивного розладу, дистимічного розладу, передменструального дисфоричного розладу, депресивного розладу без інших вказівок; біполярного розладу І типу, біполярного розладу II типу, циклотимічного розладу, біполярного розладу без інших вказівок, розладів настрою, викликаних загальним соматичним станом, розладу настрою, викликаного вживанням речовин, розладу настрою без інших вказівок; генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, розладів, пов'язаних з гострим стресом, розладів, пов'язаних з посттравматичним стресом; природженого недоумства; аутистичних розладів; розладів, пов'язаних з недоліком уваги, розладу, пов'язаного з недоліком уваги і гіперактивністю, дизраптивних розладів поведінки; особових порушень параноїдального типу, особових порушень шизоїдного типу, шизотипових розладів особи; судомних розладів, синдрому Туретта; залежності від речовин; зловживання речовинами; синдрому відміни речовин; трихотиломанії. Для оптимізації лікування пацієнтів, що страждають від таких розладів, як згадані в попередньому параграфі, сполуки формули (І) можуть бути введені разом з іншими психотропними сполуками. Таким чином, у разі шизофренії, об'єктом можуть бути негативні і когнітивні симптоми. Дійсний винахід також пропонує спосіб лікування теплокровних тварин, що страждають від таких розладів, причому вказаний спосіб включає системне введення терапевтичної кількості сполуки формули (І), ефективної для лікування описаних вище розладів. Дійсний винахід далі пропонує спосіб попередження виникнення будь-якого з вищезазначених станів у теплокровних тварин, схильних до виникнення подібних розладів, причому вказаний спосіб включає системне введення терапевтичної кількості сполуки формули (І), ефективної для лікування описаних вище розладів. Дійсний винахід також відноситься до застосування сполук формули (І), описаних тут вище для отримання лікарського засобу, зокрема антипсихотичного лікарського засобу, конкретніше, лікарського засобу для лікування або попередження шизофренії, шизофреноформних розладів, 4 UA 98940 C2 5 10 15 20 25 30 35 40 45 50 55 60 шизоафективних розладів, маревних розладів, короткочасного психотичного розладу, індукованого психотичного розладу, психотичних розладів, викликаних загальним соматичним станом, викликаного вживанням речовин психотичного розладу, психотичних розладів без інших вказівок; психозів, пов'язаних з божевіллям; великого депресивного розладу, дистимічного розладу, передменструального дисфоричного розладу, депресивного розладу без інших вказівок; біполярного розладу І типу, біполярного розладу II типу, циклотимічного розладу, біполярного розладу без інших вказівок, розладів настрою, викликаних загальним соматичним станом, розладу настрою, викликаного вживанням речовин, розладу настрою без інших вказівок; генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, розладів, пов'язаних з гострим стресом, розладів, пов'язаних з посттравматичним стресом; природженого недоумства; аутистичних розладів; розладів, пов'язаних з недоліком уваги, розладу, пов'язаного з недоліком уваги і гіперактивністю, дизраптивних розладів поведінки; особових порушень параноїдального типу, особових порушень шизоїдного типу, шизотипових розладів особи; судомних розладів, синдрому Туретта; залежності від речовин; зловживання речовинами; синдрому відміни речовин; трихотиломанії. Фахівці в галузі лікування і попередження подібних захворювань можуть визначити ефективну щоденну терапевтичну кількість на підставі приведених тут далі досліджень. Ефективна денна терапевтична кількість складає від приблизно 0,01 мг/кг до приблизно 10 мг/кг ваги тіла, переважніше від приблизно 0,05 мг/кг до приблизно 1 мг/кг ваги тіла. Винахід також відноситься до фармацевтичних композицій, що містять фармацевтично прийнятний носій і, як активний компонент, терапевтично ефективну кількість сполуки формули (І). Залежно від шляху введення фармацевтична композиція міститиме від 0,05 до 99% ваг. активного компоненту і від 1 до 99,95% ваг. фармацевтично прийнятного носія. Для спрощення введення дані сполуки можуть бути введені до складу різних фармацевтичних форм для цілей введення. Сполуки за винаходом, зокрема сполуки формули (І), їх фармацевтично прийнятна кислотно- або основно-адитивна сіль, їх стереохімічно ізомерна форма, їх N-оксидна форма і їх проліки, або будь-яка їх підгрупа або їх поєднання, для цілей введення можуть бути представлені у вигляді різних фармацевтичних форм. Як прийнятні композиції можуть бути приведені всі композиції, зазвичай використовувані для препаратів системного застосування. Для отримання фармацевтичних композицій за дійсним винаходом ефективну кількість конкретної сполуки, необов'язково у вигляді адитивної солі, як активний компонент об'єднують у вигляді однорідної добавки з фармацевтично прийнятним носієм, який може приймати різні форми залежно від бажаної для введення форми препарату. Ці фармацевтичні композиції бажано знаходяться в одиничній лікарській формі, придатній, зокрема, для перорального, ректального, підшкірного введення або введення шляхом парентеральної ін'єкції або інгаляції. Наприклад, при приготуванні композицій в пероральній лікарській формі можуть бути використані будь-які звичайні фармацевтичні середовища, такі як, наприклад, вода, гліколі, масла, спирти і тому подібні у разі таких пероральних форм як суспензії, сиропи, еліксири, емульсії і розчини; або тверді носії, такі як крохмалі, цукри, каолін, розчинники, мастила, зв'язувальні речовини, дезінтегрувальні препарати, і тому подібне у вигляді порошків, пілюль, капсул і таблеток. Внаслідок легкості їх введення таблетки і капсули є найбільш переважними пероральними одиничними лікарськими формами, в яких очевидно використовують тверді фармацевтичні носії. Для парентеральних композицій носій зазвичай міститиме стерильну воду, щонайменше в більшій частині, хоча можуть бути включені також й інші компоненти, наприклад для збільшення розчинності. Наприклад, можуть бути виготовлені розчини для ін'єкцій, в яких носій включає сольовий розчин, розчин глюкози або суміш сольового розчину і розчину глюкози. Наприклад, можуть бути виготовлені розчини для ін'єкцій, в яких носій містить сольовий розчин, розчин глюкози або суміш сольового розчину і розчину глюкози. Розчини для ін'єкцій, що містять сполуку формули (І), можуть бути складені на основі олії для пролонгованої дії. Прийнятними оліями для цієї мети є, наприклад, арахісова олія, кунжутна олія, бавовняна олія, кукурудзяна олія, соєва олія, синтетичні ефіри гліцерину і жирних кислот з довгим ланцюгом і суміші цих й інших масел. Можуть бути також приготовані суспензії для ін'єкцій, в цьому випадку можуть застосовуватися відповідні рідкі носії, суспендувальні агенти і тому подібне. Також маються на увазі препарати в твердій формі, які призначені для перетворення безпосередньо перед використанням в препарати в рідкій формі. У композиціях, призначених для підшкірного введення, носій, необов'язково, містить агент, що підсилює проникнення, і/або відповідний змочувальний агент, необов'язково у поєднанні з відповідними добавками будь-якої природи в невеликих кількостях, причому ці добавки не мають шкідливої дії на шкіру. Вказані добавки можуть полегшувати нанесення на шкіру і/або 5 UA 98940 C2 5 10 15 20 25 можуть бути корисні при приготуванні бажаних композицій. Ці композиції можна наносити різними способами, наприклад, у вигляді трансдермального пластиру, точково або як мазь. Кислотно- або основно-адитивні солі сполук формули (І) внаслідок їх збільшеної розчинності у воді в порівнянні з відповідними кислотними або основними формами, більш придатні для отримання водних композицій. Особливо вигідним є складання згаданих вище фармацевтичних композицій у вигляді одиничної лікарської форми для полегшення введення і однорідності дозування. Використовуваний в дійсному описі термін «одинична лікарська форма» відноситься до фізично дискретних одиниць, які застосовні як одиничні дози, причому кожна одиниця містить заздалегідь певну кількість активного компоненту, визначену для досягнення бажаного терапевтичного ефекту, у поєднанні з необхідним фармацевтичним носієм. Прикладами подібних одиничних лікарських форм є таблетки (включаючи шорсткі таблетки або таблетки з покриттям), капсули, пілюлі, пакетики порошку, вафлі, супозиторії, розчини або суспензії для ін'єкцій і подібне і їх окремі різновиди. Оскільки сполуки за винаходом є ефективними сполуками, придатними для перорального введення, фармацевтичні композиції, що містять вказані сполуки для перорального введення, є особливо вигідними. Для того, щоб підсилити розчинність і/або стабільність сполук формули (І) в фармацевтичних композиціях, може бути корисним застосування -, - або -циклодекстринів або їх похідних, зокрема заміщених гідроксіалкілом циклодекстринів, наприклад 2гідроксипропіл--циклодекстрину. Також розчинність і/або стабільність сполук за винаходом можуть збільшувати допоміжні розчинники. Отримання Сполуки формули (І) 1 2 30 35 40 2 3 4 де R, R , R , R і R мають значення, описані вище, отримують за допомогою реакції сполуки формули (II) 3 4 1 де R , R і R мають значення, описані вище, із сполукою формули R -C(=O)-R (III-а), де R i R описані вище, у присутності відповідного відновлюючого агента, такого як триацетоксиборгідрид натрію, відповідного кислотного каталізатора, такого як оцтова кислота, у відповідному інертному реакційному розчиннику, такому як 1,2-дихлоретан. 1 2 3 4 Сполука формули (І), де R, R , R , R і R мають значення, описані вище, також може бути 2 3 4 отримана шляхом проведення реакції сполуки формули (II), де R , R і R мають значення, 1 1 описані вище, із сполукою формули R -CHX-R (III-b), де R і R мають значення, описані вище, і X є галогеном або відповідною групою, що йде, у присутності відповідної основи, такої як діізопропілетиламін, у відповідному інертному реакційному розчиннику, такому як ацетонітрил, при відповідній температурі, зазвичай при нагріванні до 120C при мікрохвильовому випромінюванні. 2 3 4 Сполуки формули (II), де R , R і R мають значення, описані вище, отримують за допомогою реакції похідного хлорпіридазину формули (IV) 1 6 UA 98940 C2 2 5 10 3 4 де R , R і R мають значення, описані вище, і P є відповідною захисною групою, такою як бензил, з ціаністою сіллю, такою як ціанид цинку, у присутності паладієвого каталізатора, такого як тетракіс(трифенілфосфін) паладій, у відповідному інертному розчиннику, такому як Ν,Νдиметилформамід, при відповідних умовах реакції, зазвичай при нагріванні до 160C при мікрохвильовому випромінюванні, з подальшим видаленням захисної групи P, при відповідних умовах, для бензильної групи, таких як реакція з 1-хлоретилхлорформіатом, у присутності відповідної основи, такої як діізопропілетиламін, у прийнятному інертному реакційному розчиннику, такому як дихлорметан. 2 3 4 Сполуки формули (IV), де R , R і R мають значення, описані вище, і P є відповідною захисною групою, отримують за допомогою реакції сполуки формули (V) 2 де R описаний раніше і P є прийнятною захисною групою, такою як бензил, із сполукою формули (VI) 15 20 3 4 3 4 де R і R мають значення, описані вище, у присутності відповідного каталізатора, такого як йодид калію, за відповідних умов реакції, таких як розплавлений стан. Сполуки формули (VI) доступні комерційно або отримують за допомогою методик, схожих з тими, які описані в WO 99/36407. 1 2 3 4 Сполуки формули (І), де R, R , R , R і R мають значення, описані вище, можуть бути також отримані шляхом проведення реакції 3-хлорпіридазину формули (VII) де R і R мають значення, описані вище, з похідним піперидину формули (VIII) 7 UA 98940 C2 1 5 2 де R, R і R мають значення, описані вище, у присутності прийнятної основи, такої як діізопропілетиламін, у відповідному розчиннику, такому як ацетонітрил, при підвищеній температурі. 1 2 Сполуки формули (VIII), де R і R мають значення, описані вище, і R = H, отримують за допомогою реакції трет-бутилового ефіру піперидин-4-ілкарбамінової кислоти (IX) 1 10 15 20 1 із сполукою формули R -CHX-R (III-b), де R і R мають значення, описані вище, і X є галогеном або відповідною групою, що йде, у присутності відповідної основи, такої як діізопропілетиламін, у відповідному інертному реакційному розчиннику, такому як дихлорметан, з подальшим видаленням трет-бутилоксикарбонільної групи в проміжній сполуці формули (X) шляхом обробки кислотою, такою як трифтороцтова кислота, з отриманням сполуки формули 2 (VIII), де R = H. 1 2 Сполуки формули (VIII), де R і R мають значення, описані вище, і R = H, можуть також бути отримані шляхом проведення реакції трет-бутилового ефіру піперидин-4-ілкарбамінової кислоти 1 1 (IX) із сполукою формули R -C(=O)-R (III-а), де R і R , мають значення, описані вище, у присутності відповідного відновлюючого агента, такого як триацетоксиборгідрид натрію, відповідного кислотного каталізатора, такого як оцетова кислота, у відповідному інертному реакційному розчиннику, такому як 1,2-дихлоретан, з подальшим видаленням третбутилоксикарбонільної групи в проміжній сполуці формули (X) шляхом обробки кислотою, такою 2 як трифтороцтова кислота, з отриманням сполуки формули (VIII), де R = H. Сполуки формули (VIII), де R H, можуть бути отримані шляхом проведення реакції сполуки формули (XI) 2 25 30 1 2 де R і R мають значення, описані вище, з аміном формули R -ΝΗ2 (XII), у присутності відповідного відновлюючого агента, такого як водень, відповідного каталізатора, такого як паладій-на-вуглеці, і у відповідному інертному реакційному розчиннику, такому як етанол. 1 Сполуки формули (XI), де R і R мають значення, описані вище, можуть бути отримані шляхом проведення реакції 4,4-етилендіоксипіперидину (XIII) 8 UA 98940 C2 1 5 1 із сполукою формули R -C(=O)-R (III-а), де R і R описані вище, у присутності відповідного відновлюючого агента, такого як триацетоксиборгідрид натрію, відповідного кислотного каталізатора, такого як оцтова кислота, у відповідному інертному реакційному розчиннику, такому як 1,2-дихлоретан, з подальшим видаленням захисної групи з проміжної сполуки формули (XIV) 1 10 15 20 25 де R і R описані вище, шляхом обробки кислотою, такою як хлористоводнева кислота. 3 4 Сполуки формули (VII), де R і R мають значення, описані вище, отримують за допомогою реакції 3-хлор-6-йодпіридазину формули (XV) з ціаністою сіллю, такою як ціанид цинку або міді, у присутності паладієвого каталізатора, такого як тетракис(трифенілфосфін)паладій, у відповідному інертному розчиннику, такому як Ν,Ν-диметилформамід або ацетонітрил, за відповідних умов реакції, зазвичай при нагріванні до 160C за допомогою мікрохвильового випромінювання. Експериментальна частина Хімія Остаточне очищення сполук з прикладів (Е1-Е20) проводили або за допомогою колонкової хроматографії на силікагелі із застосуванням описаного елюента, або за допомогою зворотнофазової препаративної ВЕРХ на колонці Hyperprep RP 18 BDS (Shandon) (8 мкм, 200 мм, 250 г). Три рухомі фази (рухома фаза А: 90% 0,5% ацетату амонію + 10% ацетонітрилу; рухома фаза В: метанол; рухома фаза C: ацетонітрил) використовували для проведення градієнтного методу, починаючи з 75% А і 25% В при швидкості потоку 40 мл/хв (підтримка протягом 0,5 хв за однакових умов з подальшим збільшенням швидкості потоку до 80 мл/хв протягом 0,01 хв), до 50% В і 50% C через 41 хв, до 100% C через 20 хв з підтримкою цих умов протягом 4 хв. 1 Спектр H був записаний на спектрометрі Bruker DPX 360, DPX 400 або Bruker AV-500. Хімічні зрушення виражали в м.д. по відношенню до тетраметилсилану. Опис 1 (1-бензилпіперидин-4-іл)-(6-хлорпіридазин-3-іл)амін (D1) 30 9 UA 98940 C2 5 10 15 20 25 30 35 40 Суміш з 4-аміно-1-бензилпіперидину (4 г, 21 ммоль) і 3,6-дихлорпіридазину (1,56 г, 10,5 ммоль) перемішували протягом 1 години при 120C, до того як додавали н-бутанол (10 мл), і перемішували реакційну суміш ще 1 годину при 120C. Після додавання води і дихлорметану органічну фазу відокремлювали, висушували (Na2SO4), фільтрували і упарювали розчинник у вакуумі. Залишок кристалізували з ацетонітрилу і отриману тверду речовину відокремлювали фільтруванням і висушували з отриманням D1 (1,3 г, 41%) у вигляді твердої речовини. C16H19ClN4 розраховано 302; знайдено 303 (MH+); Тпл: 208,2-209,3C. 1 Н ЯМР (360 МГц, ДМСО-d6) 1,36-1,54 (м, 2Н), 1,94 (д, J=10,98 Гц, 2Н), 2,08 (т, J=10,79 Гц, 2H), 2,78 (д, J=11,71 Гц, 2H), 3,47 (с, 2H), 3,69-3,84 (м, 1H), 6,88 (д, J=9,15 Гц, 1H), 7,03 (д, J=7,32 Гц, 1H), 7,22-7,28 (м, 1H), 7,28-7,34 (м, 4H), 7,34 (д, J=9,51 Гц, 1H). Опис D2 6-(1-бензилпіперидин-4-іламіно) піридазин-3-карбонітрил (D2) Суміш (1-бензилпіперидин-4-іл)-(6-хлорпіридазин-3-іл) аміну (D1) (3 г, 9,9 ммоль), ціаниду цинку (2,09 г, 17,8 ммоль) і тетракис(трифенілфосфін) паладію(0) (2,74 г, 2,3 ммоль) в Ν,Νдиметилформаміді (30 мл) нагрівали при 160C протягом 30 хв за допомогою мікрохвильового випромінювання (мікрохвильова піч Milestone). Розчинник потім упарювали у вакуумі, після чого додавали водний розчин карбонату калію (10%) і етилацетат. Органічну фазу відокремлювали, висушували (Na2SO4), після чого розчинник упарювали у вакуумі. Залишок очищали за допомогою колонкової хроматографії (силікагель; від 0 до 1,5% аміаку в метанолі (7M) /дихлорметан) а потім за допомогою ВЕРХ з отриманням D2 (1,06 г, 36%) у вигляді твердої речовини. C17H19N5 розраховано 293; знайдено 294 (MH+). 1 Н ЯМР (500 МГц, ДМСО-d6) 1,42-1,57 (м, 2Н), 1,92 (д, J=10,40 Гц, 2Н), 2,09 (т, J=10,84 Гц, 2Н), 2,79 (д, J=11,27 Гц, 2Н), 3,48 (с, 2Н), 3,92 (шир.с, 1H), 6,87 (д, J=8,96 Гц, 1H), 7,21-7,27 (м, 2H), 7,27-7,37 (м, 3H), 7,68 (д, J=9,54 Гц, 1H), 7,77 (шир.с, 1H). Опис 3 6-(піперидин-4-іламіно) піридазин-3-карбонітрил (D3) До перемішуваної суміші 6-(1-бензилпіперидин-4-іл) піридазин-3-карбонітрилу (D2) (1,5 г, 5,1 ммоль) і діізопропілетиламіну (2,6 г, 20 ммоль) в дихлорметані (50 мл) при 0C додавали по краплях 1-хлоретилхлорформіат (2,9 г, 20 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 2 год, після чого розчинник упарювали у вакуумі. До залишку додавали метанол (50 мл) і суміш кип'ятили із зворотним холодильником протягом 2 год. Розчинник упарювали у вакуумі і залишок очищали за допомогою колонкової хроматографії (силікагель; від 5 до 12% аміаку в метанолі (7M) /дихлорметан). Збирали бажані фракції, після чого розчинник упарювали у вакуумі з отриманням D3 (0,9 г, 90%) у вигляді твердої речовини. C10H13N5 розраховано 203; знайдено 204 (MH+). 1 Н ЯМР (360 МГц, ДМСO-d6) 1,67-1,86 (м, 2Н), 2,10 (дд, J=13,72, 3,48 Гц, 2Н), 3,03 (тд, J=12,81, 2,93 Гц, 2Н), 3,32 (тт, J=13,17, 3,66 Гц, 2H), 4,24 (шир.с, 1H), 7,00 (д, J=9,51 Гц, 1H), 7,75 (д, J=9,15 Гц, 1H), 8,33 (шир.с, 1H), 8,23 (д, J=6,95 Гц, 1H). Опис 4 6-хлорпіридазин-3-карбонітрил (D4) 10 UA 98940 C2 5 10 15 20 25 30 35 Суміш 3-хлор-6-йодпіридазину (CAS 135034-10-5, 5,5 г, 22,9 ммоль, Goodman, A.J.; Stanforth, S.P.; Tarbit, B. Tetrahedron (1999), 55 (52), 15067-15070) і ціаниду міді (4 г, 44,7 ммоль) в ацетонітрилі (30 мл) перемішували протягом 30 хв при 160C, при мікрохвильовому випромінюванні (мікрохвильова піч Milestone). Потім суміш виливали в дихлорметан (200 мл), фільтрували через целіт, після чого упарювали розчинник у вакуумі. Залишок потім очищали за допомогою колонкової хроматографії (силікагель; дихлорметан/гептан від 1:1 до 7:3) з отриманням D4 (2,84 г, 89%) у вигляді твердої речовини. 1 Н ЯМР (400 МГц, CDCl3) 7,65 (д, J=8,8 Гц, 1H), 7,75 (д, J=8,8 Гц, 1H). Опис 5 1-(3,5-дифторбензил) піперидин-4-іламін (D5) Суміш трет-бутилового ефіру піперидин-4-ілкарбамінової кислоти (5 г, 24,9 ммоль), 3,5дифторбензилброміду (2,9 мл, 22,7 ммоль) і діізопропілетиламіну (5,9 мл, 34,03 ммоль) в дихлорметані (50 мл) перемішували при кімнатній температурі протягом 2 год. Після закінчення цього періоду була додана трифтороцтова кислота (32 мл), після чого реакційну суміш перемішували ще 2 год. Розчинник упарювали у вакуумі, потім додавали насичений розчин карбонату натрію. Суміш екстрагували дихлорметаном, відокремлені органічні фази висушували (Na2SO4), фільтрували і упарювали розчинник у вакуумі з отриманням D5 (4,5 г, 90%) у вигляді твердої речовини. C12H16F2N2 розраховано 226; знайдено 227 (MH+). Опис 6 1-(3-трифторметилбензил) піперидин-4-іламін (D6) Суміш трет-бутилового ефіру піперидин-4-ілкарбамінової кислоти (2,5 г, 12,4 ммоль), 3(трифторметил) бензилброміду (1,7 мл, 11,3 ммоль) і діізопропілетиламіну (2,9 мл, 16,9 ммоль) в дихлорметані (25 мл) перемішували при кімнатній температурі протягом 2 год. Після закінчення цього періоду додавали трифтороцтову кислоту (32 мл) і реакційну суміш перемішували ще 2 год. Розчинник упарювали у вакуумі, потім додавали насичений розчин карбонату натрію. Суміш екстрагували дихлорметаном, відокремлені органічні фази висушували (Na2SO4), фільтрували і упарювали розчинник у вакуумі. Залишок очищали за допомогою колонкової хроматографії (силікагель; 5-10% аміаку в метанолі (7M) /дихлорметан) з отриманням D6 (1,9 г, 60%) у вигляді твердої речовини. C13H17F3N2 розраховано 258; знайдено 259 (MH+). Опис 7 1-(3-фтор-5-трифторметилбензил) піперидин-4-іламін (D7) 11 UA 98940 C2 5 10 15 20 25 30 35 Суміш трет-бутилового ефіру піперидин-4-ілкарбамінової кислоти (4 г, 20 ммоль), 3-фтор-5(трифторметил) бензилброміду (4,6 г, 18,1 ммоль) і діізопропілетиламіну (4,7 мл, 27,1 ммоль) в дихлорметані (25 мл) перемішували при кімнатній температурі протягом 2 год. Після закінчення цього періоду додавали трифтороцтову кислоту (32 мл) і реакційну суміш перемішували протягом ще 2 год. Розчинник упарювали у вакуумі, потім додавали насичений розчин карбонату натрію. Суміш екстрагували дихлорметаном, відокремлювали органічну фазу, висушували її (Na2SO4), фільтрували, після чого упарювали розчинник у вакуумі з отриманням D7 (4 г, 80%) у вигляді твердої речовини. C13H16F4N2 розраховано 276; знайдено 277 (MH+). Опис 8 1-(3,4,5-трифторбензил) піперидин-4-іламін (D8) Суміш трет-бутилового ефіру піперидин-4-ілкарбамінової кислоти (2,5 г, 12,4 ммоль), 3,4,5трифторбензилброміду (2,5 г, 11,3 ммоль) і діізопропілетиламіну (2,9 мл, 16,9 ммоль) в дихлорметані (25 мл) перемішували при кімнатній температурі протягом 2 год. Після закінчення цього періоду в реакцію додавали трифтороцтову кислоту (15,6 мл), потім суміш перемішували ще 2 год. Розчинник упарювали у вакуумі, потім додавали насичений розчин карбонату натрію. Суміш екстрагували дихлорметаном, відокремлені органічні фази висушували (Na2SO4), фільтрували, після чого розчинник упарювали у вакуумі з отриманням D8 (2,9 г, 96%) у вигляді твердої речовини. C12H15F3N2 розраховано 244; знайдено 245 (MH+). Опис 9 3,6-дихлор-4,5-диметилпіридазин (D9) Суміш 6-гідрокси-4,5-диметил-2Н-піридазин-3-ону (2,56 г, 18 ммоль) (отриманого за допомогою процедури, схожої з тією, що описана в WO 99/36407) з оксихлоридом фосфору (8 мл) і діізопропілетиламіном (4 мл) перемішували при 160C протягом 20 хв при мікрохвильовому опромінюванні (мікрохвильова піч Biotage). Потім розчинник частково упарювали у вакуумі, матеріал, який залишився, виливали в суміш холодної води, насиченого розчину гідрокарбонату натрію і дихлорметану. Потім суміш підлужували дозами гідрокарбонату натрію до тих пір, поки не переставав виділятися СО 2. Органічну фазу відокремлювали, висушували (Na2SO4), фільтрували і упарювали розчинник у вакуумі. Залишок очищали методом колонкової хроматографії (дихлорметан/гептан від 1/1 до 10/0) з отриманням D9 (1,7 г, 53%) у вигляді твердої речовини. C6H6Cl2N2 розраховано 176; знайдено 177 (MH+). Опис 10 3-хлор-6-йод-4,5-диметилпіридазин (D10) 12 UA 98940 C2 5 10 15 20 25 30 35 Суміш D9 (0,2 г, 1,13 ммоль), йодиду натрію (0,420 г, 2,8 ммоль) і хлористоводневої кислоти (57% ваг. у воді, 2 мл) перемішували при 120C протягом 10 хв при мікрохвильовому опромінюванні. Потім суміш виливали в насичений водний розчин карбонату натрію, Na2S2O3, води і дихлорметану. Органічну фазу відокремлювали, фільтрували через вату, після чого упарювали розчинник у вакуумі. Залишок очищали методом колонкової хроматографії (дихлорметан/гептан від 1:1 до 8:2) з отриманням D10 (0,235 г, 77%) у вигляді твердої речовини. C6H6ClIN2 розраховано 268; знайдено 269 (MH+). Опис 11 6-хлор-4,5-диметилпіридазин-3-карбонітрил (D11) Суміш D10 (0,225 г, 0,84 ммоль) і ціаниду міді (0,15 г, 1,67 ммоль) в ацетонітрилі (2 мл) перемішували при 160C протягом 20 хв, при мікрохвильовому опромінюванні. Потім додавали дихлорметан і фільтрували суміш через целіт. Розчинник упарювали у вакуумі, після чого залишок очищали за допомогою колонкової хроматографії (силікагель; дихлорметан/гептан від 1:1 до 7:3) з отриманням D11 (0,120 г, 85%) у вигляді твердої речовини. C7H6CIN3 розраховано 167; знайдено 166 (MH-). Приклад 7 6-[1-(4-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е7) До суміші 6-(піперидин-4-іламіно) піридазин-3-карбонітрилу (D3) (0,15 г, 0,7 ммоль) і ,,трифтор-пара-толуальдегіду (0,15 мл, 1,1 ммоль) в дихлорметані (2 мл) додавали триацетоксиборгідрид натрію (0,232 г, 1,1 ммоль) і оцтову кислоту (0,041 мл). Потім реакційну суміш перемішували при кімнатній температурі протягом 18 год. Потім додавали насичений розчин гідрокарбонату натрію, відокремлювали органічну фазу, висушували її (Na2SO4), фільтрували і упарювали розчинник у вакуумі. Залишок очищали за допомогою ВЕРХ. Бажані фракції збирали і упарювали розчинник у вакуумі з отриманням Е7 (0,101 г, 38%) у вигляді твердої речовини. C18H18F3N5 розраховано 361; знайдено 362 (MH+); Тпл: 243,1°С. 1 Н ЯМР (500 МГц, CDCl3) 1,56-1,65 (м, 2Н), 2,09 (д, J=11,85 Гц, 2Н), 2,22 (т, J=10,55 Гц, 2Н), 2,85 (д, J=11,85 Гц, 2Н), 3,58 (с, 2Н), 3,93 (шир.с, 1H), 5,14 (шир.с, 1H), 6,60 (д, J=9,25 Гц, 1H), 7,40 (д, J=9,25 Гц, 1H), 7,45 (д, J=7,80 Гц, 2H), 7,58 (д, J=8,09 Гц, 2H). Приклад 13 6-[1-(3-хлорбензил) піперидин-4-іламіно]піридазину-3-карбонітрил (Е13) Суміш 6-(піперидин-4-іламіно) піридазин-3-карбонітрилу (D3) (0,150 г, 0,74 ммоль), 3хлорбензилброміду (0,102 мл, 0,78 ммоль) і діізопропілетиламіну (0,196 мл, 1,11 ммоль) в ацетонітрилі (2 мл) перемішували при 120C протягом 5 хв, при мікрохвильовому опромінюванні 13 UA 98940 C2 5 10 15 20 25 30 35 40 (мікрохвильова піч Biotage). Потім реакційну суміш розводили дихлорметаном і екстрагували насиченим розчином карбонату натрію. Органічні фази відокремлювали, висушували (Na2SO4), фільтрували і упарювали розчинник у вакуумі. Потім залишок очищали за допомогою колонкової хроматографії (силікагель; 0-2,5% аміаку в метанолі (7M) /дихлорметан). Бажані фракції збирали, після чого упарювали у вакуумі, залишок розтирали в діізопропіловому ефірі з отриманням E13 (0,095 г, 39%) у вигляді білої твердої речовини. C17H18ClN5 розраховано 327; знайдено 328 (MH+); Тпл: 151C. 1 Н ЯМР (400 МГц, CDCl3) 1,52-1,70 (м, 2Н), 2,08 (д, J=12,02 Гц, 2Н), 2,19 (т, J=11,30 Гц, 2H), 2,85 (д, J=11,82 Гц, 2H), 3,50 (с, 2H), 3,91 (шир.с, 1H), 5,23 (шир.с, 1H), 6,62 (д, J=9,33 Гц, 1H), 7,17-7,21 (м, 1H), 7,21-7,28 (м, 2H), 7,34 (шир.с, 1H), 7,41 (д, J=9,33 Гц, 1H). Приклад 15 6-[1-(3,5-дифторбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E15) Суміш 6-хлорпіридазин-3-карбонітрилу (D4) (1,74 г, 12,46 ммоль), 1-(3,5-дифторбензил) піперидин-4-іламіну (D5) (2,35 г, 10,386 ммоль) і дізопропілетиламіну (2,71 мл, 15,58 ммоль) в ацетонітрилі (30 мл) перемішували при 120C протягом 40 хв, при мікрохвильовому опромінюванні (мікрохвильова піч Milestone). Потім додавали дихлорметан, воду и насичений розчин карбонату натрію. Органічні фази фільтрували через вату, упарювали у вакуумі, осад очищали за допомогою колонкової хроматографії (силікагель; 0-1,5% аміаку в метанолі (7М)/дихлорметан). Бажані фракції збирали і упарювали розчинник у вакуумі. Залишок осаджували в гептані з отриманням Е15 (2,065 г, 60%) у вигляді твердої речовини. C17H17F2N5 розраховано 329; знайдено 330 (MH+); Тпл: 187,9°С. 1 Н ЯМР (500 МГц, CDCl3) 1,55-1,69 (м, 2H), 2,10 (д, J=11,85 Гц, 2H), 2,21 (т, J=11,42 Гц, 2H), 2,85 (д, J=11,85 Гц, 2H), 3,50 (с, 2H), 3,94 (шир.с, 1H), 5,22 (шир.с, 1H), 6,62 (д, J=9,54 Гц, 1H), 6,69 (тт, J=8,92, 2,20 Гц, 1H), 6,83-6,93 (м, 2H), 7,41 (д, J=9,25 Гц, 1H). Приклад 16 6-[1-(3-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E16) Суміш 6-хлорпіридазин-3-карбонітрилу (D4) (0,130 г, 0,931 ммоль), 1-(3трифторметилбензил) піперидин-4-іламіну (D6) (0,241 г, 0,931 ммоль) і діізопропілетиламіну (0,243 мл, 1,4 ммоль) в ацетонітрилі (3 мл) перемішували при 120°C протягом 30 хв при мікрохвильовому опромінюванні (мікрохвильова піч Biotage). Додавали дихлорметан и воду, потім суміш промивали насиченим розчином карбонату натрію. Органічну фазу фільтрували через вату, після чого розчинник упарювали у вакуумі. Залишок очищали за допомогою колонкової хроматографії (силікагель; 0-2% аміаку в метанолі (7М)/дихлорметан) з отриманням Е16 (0,215 г, 64%) у вигляді твердої речовини. C18H18F3N5 розраховано 361; знайдено 362(MH+); Тпл: 170,3°C. 1 Н ЯМР (400 МГц, CDCl3) 1,61 (кв.д, J=11,20, 3,52 Гц, 2Н), 2,09 (д, J=12,44 Гц, 2Н), 2,22 (тд, J=11,20, 2,07 Гц, 2Н), 2,86 (д, J=12,02 Гц, 2Н), 3,58 (с, 2Н), 3,93 (шир.с, 1H), 5,18 (шир.с, 1H), 6,61 (д, J=9,33 Гц, 1H), 7,41 (д, J=9,33 Гц, 1H), 7,45 (д, J=7,67 Гц, 1H), 7,49-7,55 (м, 2H), 7,60 (шир.с, 1H). Приклад 17 6-[1-(3-фтор-5-трифторметилбензил) піперидин-4-іламіно]тридазин-3-карбонітрил (Е17) 14 UA 98940 C2 5 10 15 20 25 30 35 Суміш 6-хлорпіридазин-3-карбонітрилу (D4) (1,39 г, 9,95 ммоль), 1-(3-фтор-5трифторметилбензил) піперидин-4-іламіну (D7) (2,5 г, 9,04 ммоль) і діізопропілетиламіну (2,63 мл, 14,92 ммоль) в ацетонітрилі (2 мл) перемішували при 120°C протягом 30 хв при мікрохвильовому опромінюванні (мікрохвильова піч Biotage). Потім суміш розводили дихлорметаном (50 мл) і екстрагували насиченим розчином карбонату натрію. Органічну фазу відокремлювали, висушували (Na2SO4), фільтрували, упарювали у вакуумі і очищали залишок за допомогою колонкової хроматографії (силікагель; 0-2,5% аміаку в метанолі (7М)/дихлорметан). Бажані фракції збирали й упарювали у вакуумі. Залишок осаджувати з діізопропілового ефіру з отриманням Е17 (2,76 г, 73%) у вигляді твердої речовини. C18H17F4N5 розраховано 379; знайдено 380(MH+); Т.пл:151,4°С. 1 H ЯMP (500 МГц, CDCl3) 1,56-1,70 (м, 2Н), 2,11 (д, J=11,85 Гц, 2Н), 2,24 (т, J=11,27 Гц, 2Н), 2,85 (д, J=11,56 Гц, 2Н), 3,56 (с, 1H), 3,96 (шир.с, 1H), 5,24 (шир.с, 1H), 6,63 (д, J=9,25 Гц, 1H), 7,22 (д, J=8,38 Гц, 1H), 7,28 (д, J=9,25 Гц, 1H), 7,39 (с, 1H), 7,42 (д, J=9,25 Гц, 1H). Приклад 18 6-[1-(3,4,5-трифторбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е18) Суміш 6-хлорпіридазин-3-карбонітрилу (D4) (1,32 г, 9,46 ммоль), 1-(3,4,5-трифторбензил) піперидин-4-іламін (D8) (2,10 г, 8,6 ммоль) і діізопропілетиламіну (2,25 мл, 12,9 ммоль) в ацетонітрилі (12 мл) перемішували при 120°С протягом 20 хв, при мікрохвильовому опромінюванні (мікрохвильова піч Milestone). Потім додавали дихлорметан, воду і насичений розчин карбонату натрію. Органічні фази фільтрували через вату, упарювали у вакуумі, після чого залишок очищали за допомогою колонкової хроматографії (силікагель; 0-2% аміаку в метанолі (7М)/дихлорметан). Бажані фракції збирали та упарювали у вакуумі. Залишок осаджували з діізопропілового ефіру з отриманням E18 (2,210 г, 74%) у вигляді твердої речовини. C17H16F3N5 розраховано 347; знайдено 348 (MH+); Тпл: 185°C. 1 Н ЯМР (500 МГц, CDCl3) 1,52-1,69 (м, 2Н), 2,10 (д, J=12,14 Гц, 2Н), 2,21 (т, J=10,69 Гц, 2Н), 2,83 (д, J=11,85 Гц, 2Н), 3,44 (с, 2Н), 3,95 (шир.с, 1H), 5,17 (шир.с, 1H), 6,62 (д, J=9,25 Гц, 1H), 6,89-7,07 (м, 2H), 7,41 (д, J=9,25 Гц, 1H). Приклад 19 6-[1-(3,5-дифторбензил) піперидин-4-іламіно]-4,5-диметилпіридазин-3-карбонітрил (Е19) Суміш 6-хлор-4,5-диметилпіридазин-3-карбонітрилу (D11) (0,120 г, 0,72 ммоль), 1-(3,5дифторбензил) піперидин-4-іламіну (D5) (0,194 г, 0,86 ммоль) і діізопропілетиламіну (0,188 мл, 1,08 ммоль) в ацетонітрилі перемішували при 120°C протягом 20 хв при мікрохвильовому 15 UA 98940 C2 5 10 15 опромінюванні (мікрохвильова піч Biotage), після чого перемішували при 180°C ще протягом 30 хв. Потім додавали дихлорметан, воду і насичений розчин карбонату натрію. Органічну фазу відокремлювали, фільтрували через вату і упарювали у вакуумі. Залишок очищали за допомогою колонкової хроматографії (силікагель; 0-1% аміаку в метанолі (7М)/дихлорметан). Бажані фракції збирали, після чого випарювали розчинник у вакуумі з отриманням E19 (0,108 г, 42%) у вигляді твердої речовини. C19H21F2N5 розраховано 357; знайдено 358 (MH+). 1 Н ЯМР (400 МГц, CDCl3) 1,57 (кв.д, J=11,58, 3,63 Гц, 2Н), 2,07 (с, 3Н), 2,15 (д, J=12,65 Гц, 2Н), 2,18-2,27 (м, 2Н), 2,41 (с, 3Н), 2,85 (д, J=11,82 Гц, 2Н), 3,49 (с, 2Н), 4,23-4,39 (м, 1H), 4,46 (д, J=7,46 Гц, 1H), 6,69 (тт, J=8,91, 2,28 Гц, 1H), 6,82-6,95 (м, 2H). Температуру плавлення для багатьох сполук визначали у відкритих капілярних трубках на апараті Mettler FP62. Температури плавлення були зміряні в температурному градієнті від 3 до 10°С/хв. Максимальна температура складала 300°C. Температури плавлення зчитували з цифрового дисплея, вони отримані з експериментальними погрішностями, зазвичай пов'язаними з аналітичним методом. Наступні додаткові приклади (Е1-Е6, Е8-Е12 і E14) були отримані з D3 і відповідних альдегідів або алкілувальних агентів за допомогою процедур, схожих з описаними для прикладів Е7 і E13. 20 16 UA 98940 C2 17 UA 98940 C2 Наступний приклад (Е20) був отриманий з використанням процедур, схожих з описаними для прикладу E19. 5 18 UA 98940 C2 5 10 15 Масу деяких сполук записували із застосуванням LCMS (рідинної хроматографічної масспектрометрії). Спосіб використовували, як описано нижче: Вимірювання за допомогою ВЕРХ виконували з використанням HP 1100 від Agilent Technologies, що включає насос (подвійний або четверний) з дегазатором, автоматичний пробовідбірник, колонковий термостат, детектор на масиві діодів (DAD) і колонку, таку як описана нижче у відповідних методах. Потік з колонки відводили на MS-спектрометр. MSдетектор був оснащений електророзпилювальним джерелом іонізації. Як газ для розпилювача використовували азот. Температуру джерела підтримували рівною 140°C. Дані отримували за допомогою програмного забезпечення MassLynx-Openlynx. ВЕРХ в зверненій фазі проводилася на колонці ACE-C18 (3,0 мкм, 4,6x30 мм) від Advanced Chromatography Technologies, із швидкістю потоку 1,5 мл/хв при 40°C. Були використані наступні умови градієнта: від 80% А (розчин ацетату амонію 0,5 г/л), 10% В (ацетонітрил), 10% C (метанол) до 50% В і 50% C протягом 6,5 хв, до 100% В через 7 хв і урівноваження до початкових умов, починаючи з 7,5 хв до 9,0 хв. Об'єм уприскування 5 мкл. Мас-спектр високої роздільної здатності (часоплинний, TOF) був отриманий тільки в режимі позитивної іонізації, при скануванні від 100 до 750 протягом 0,5 с при використанні часу витримки 0,1 с. Для режиму позитивної іонізації вольтаж капілярної голки складав 2,5 кВ, конус вольтажу складав 20 В, Як стандартна речовина для калібрування захоплення мас був використаний лейцин-енкефалін. Приклад E14 Е19 Е20 Rt (хвилини) 4,89 4,33 4,10 + (MH ) 412 358 344 20 25 30 35 40 45 50 55 До номерів прикладів відносяться наступні хімічні назви: 6-[1-(3,4-дифторбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E1) 6-[1-(4-фторбензил)тперидин-4-іламіно]піридазин-3-карбонітрил (Е2) 6-[1-(4-хлорбензил) піперидин-4-іламіно] піридазин-3-карбонітрил (Е3) 6-[1-(3-фтор-4-метилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е4) 6-[1-(3-фторбензил)піперидин-4-іламіно]піридазин-3-карбонітрил (Е5) 6-[1-(4-метилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е6) 6-[1-(4-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е7) 6-[1-(3-фтор-4-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е8) 6-[1-(4-фтор-3-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е9) 6-[1-(4-метил-3-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E10) 6-[1-(3,5-біс-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E11) 6-[1-(2-фтор-5-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E12) 6-[1-(3-хлорбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E13) 6-[1-(3-хлор-4-трифторметоксибензил) піперидин-4-іламіно]піридазин-3-карбонітрил (Е14) 6-[1-(3,5-дифторбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E15) 6-[1-(3-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E16) 6-[1-(3-фтор-5-трифторметилбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E17) 6-[1-(3,4,5-трифторбензил) піперидин-4-іламіно]піридазин-3-карбонітрил (E18) 6-[1-(3,5-дифторбензил) піперидин-4-іламіно]-4,5-диметилпіридазин-3-карбонітрил (E19) і 6-[1-(3,5-дифторбензил) піперидин-4-іламіно]-4-метилпіридазин-3-карбонітрил (Е20). Фармакологія Спорідненість зв'язування in vitro з людським рецептором D2L Заморожені мембрани клітин CHO, трансфікованих людським рецептором допаміну D21, розморожували, гомогенізували протягом невеликого часу з використанням гомогенізатора Ultra-Turrax T25, після чого розбавляли буфером для аналізу Tris-НСІ, що містить NaCl, CaCl2, MgCl2, KCl (50, 120, 2, 1 і 5 мМ, відповідно, доведені до рН 7,7 за допомогою HCl) до відповідної концентрації білка, 3 оптимізованої для специфічного або неспецифічного зв'язування. Радіоліганд [ Н]спіперон (NEN, специфічна активність ~70 Кюрі/ммоль) розводили в буфері для аналізу до концентрації 2 нмоль/л. Підготовлений радіоліганд (50 мкл) разом з 50 мкл контролю або 10% ДМСО, або -6 Бутакламолу (10 моль/л до кінцевої концентрації), або сполуки, що цікавить, потім інкубували (30 хв, 37°C) з 400 мкл підготовленого розчину мембран. Пов'язану з мембраною активність фільтрували за допомогою складальника Packard Filtermate на GF/B Unifilterplates і промивали крижаним буфером Tris-HCl (50 мМ; рН 7,7; 6x0,5 мл). Фільтрам дозволяли висохнути, потім додавали сцинтиляційну рідину і враховували на сцинтиляційному лічильнику Topcount. 19 UA 98940 C2 Відсоток специфічних зв'язків і криві конкурентного зв'язування були обчислені з використанням програмного забезпечення S-Plus (Insightful). Приклад D2 E1 Е2 Е3 Е4 Е5 Е6 plC50 5,53 5,39 5,49 5,98 6,39 5,22 6,02 Приклад Е7 Е8 Е9 E10 E11 Е12 Е13 Е14 Е15 Е16 Е17 Е18 Е19 Е20 plC50 2,5 2,5 0,63 0,63 0,63 0,63 0,63 2,5 Доза ро мг/кг 0,63 2,5 2,5 1,25 0,63 1,25 1,25 2,5 ФОРМУЛА ВИНАХОДУ 20 1. Сполука формули (І) R R 1 N N CN N R N R 25 2 R 4 3 (I) або її фармацевтично прийнятна сіль або сольват, або її стереоізомерна форма, де R є воднем або С1-6алкілом; 1 R є фенілом; фенілом, заміщеним 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що складається з водню, галогену, ціано, С 1-4алкілу, С1-4алкокси, перфторС1-4алкілу і трифторметокси; тієнілу; тієнілу, заміщеного 1 або 2 замісниками, вибраними з групи, що складається з галогену і С1-4алкілу; С1-4алкілу; С1-4алкілу, заміщеного гідроксилом, С 38циклоалкілу або С5-7циклоалкенілу; С3-8циклоалкілу або С5-7циклоалкенілу; 2 R є воднем або С1-6алкілом; 21 UA 98940 C2 3 5 10 15 20 25 30 4 3 4 кожен з R і R незалежно є воднем, С1-4алкілом або галогеном, або R і R разом утворюють 5-, 6- або 7-членне карбоциклічне кільце або 5-, 6- або 7-членне гетероциклічне кільце, що містить щонайменше один атом кисню, азоту або сірки. 3 4 2. Сполука за п. 1, де R, R і R є воднем. 2 3. Сполука за п. 1, де R є воднем або метилом. 1 4. Сполука за п. 1, де R є 3,5-дифторфенілом, 3,4,5-трифторфенілом, 3-трифторметилфенілом, 3-фтор-5-трифторметилфенілом або 3-фтор-4-метилфенілом. 5. Сполука за п. 1, де сполука вибрана з групи, що складається з 6-[1-(3,5-дифторбензил)піперидин-4-іламіно]піридазин-3-карбонітрилу, 6-[1-(3-трифторметилбензил)піперидин-4-іламіно]піридазин-3-карбонітрилу, 6-[1-(3-фтор-5-трифторметилбензил)піперидин-4-іламіно]піридазин-3-карбонітрилу, 6-[1-(3,4,5-трифторбензил)піперидин-4-іламіно]піридазин-3-карбонітрилу і 6-[1-(3-фтор-4-метилбензил)піперидин-4-іламіно]піридазин-3-карбонітрилу. 6. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п. 1. 7. Сполука за п. 1 для застосування як лікарського засобу. 8. Сполука за п. 7 для застосування як антипсихотичного засобу. 9. Сполука за п. 7 для застосування як лікарського засобу для лікування або попередження шизофренії, шизофреноформних розладів, шизоафективних розладів, маревних розладів, короткочасного психотичного розладу, індукованого психотичного розладу, психотичних розладів, викликаних загальним соматичним станом, викликаного вживанням речовин психотичного розладу, психотичних розладів без інших вказівок; психозів, пов'язаних з божевіллям; великого депресивного розладу, дистимічного розладу, передменструального дисфоричного розладу, депресивного розладу без інших вказівок; біполярного розладу І типу, біполярного розладу II типу, циклотимічного розладу, біполярного розладу без інших вказівок, розладів настрою, викликаних загальним соматичним станом, розладу настрою, викликаного вживанням речовин, розладу настрою без інших вказівок; генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, розладів, пов'язаних з гострим стресом, розладів, пов'язаних з посттравматичним стресом; природженого недоумства; аутистичних розладів; розладів, пов'язаних з недостатністю уваги, розладу, пов'язаного з недостатністю уваги і гіперактивністю, дизруптивних розладів поведінки; порушень особистості параноїдального типу, порушень особистості шизоїдного типу, шизотипових розладів особистості; судомних розладів, синдрому Туретта; залежності від речовин; зловживання речовинами; синдрому відміни речовин; трихотиломанії. 10. Спосіб отримання сполуки формули (І) R R 1 N N CN N R N 35 R 2 3 , (І) де R, R -R описані в п. 1, що включає стадію, за якою здійснюють реакцію проміжної сполуки формули (II) 1 4 N HN CN N R N R 2 R 4 3 , (ІІ) 1 1 де R -R описані в п. 1, з проміжною сполукою формули R -C(=O)-R, де R і R описані в п. 1, у присутності відновлюючого агента і кислотного каталізатора, в інертному реакційному розчиннику. 11. Спосіб отримання сполуки формули (І) 2 40 R 4 4 22 UA 98940 C2 R R 1 N N CN N R N R 2 R 4 3 , (І) 1 4 де R, R -R описані в п. 1, що включає стадію, за якою здійснюють реакцію проміжної сполуки формули (VII) N CN N R Cl R 5 4 3 , (VII) 3 4 де R і R описані в п. 1, з проміжною сполукою формули (VIII) R R 1 N H N R 2 , (VIII) 1 2 де R, R і R описані в п. 1, у присутності основи в інертному реакційному розчиннику. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperidinylamino-pyridazines and their use as fast dissociating dopamine 2 receptor antagonists
Автори англійськоюMacdonald, Gregor, James, Andres-Gil, Jose, Ignacio, Van Den Keybus Frans Alfons Ma, Bartolome-Nebreda, Jose, Manuel, van Gool, Michiel, Luc, Maria
Назва патенту російськоюПиперидиниламинопиридазины и их применение как быстро диссоциирующих антагонистов рецептора допамина 2
Автори російськоюМакдональд Грегор Джеймс, Андрес-Жиль Хосе Игнасио, ван ден Кейбус Франс Альфонс Мария, Бартоломе-Небреда Хосе Мануэль, ван Гоол Мишель Люк Мария
МПК / Мітки
МПК: A61P 25/18, A61K 31/501, C07D 401/12
Мітки: допаміну, піперидиніламінопіридазини, швидкодисоціюючих, антагоністів, застосування, рецептора
Код посилання
<a href="https://ua.patents.su/25-98940-piperidinilaminopiridazini-i-kh-zastosuvannya-yak-shvidkodisociyuyuchikh-antagonistiv-receptora-dopaminu-2.html" target="_blank" rel="follow" title="База патентів України">Піперидиніламінопіридазини і їх застосування як швидкодисоціюючих антагоністів рецептора допаміну 2</a>
Попередній патент: Промислова установка із зоною, релевантною для забезпечення безпеки
Наступний патент: Термонагрівач – парагенератор благути
Випадковий патент: Розпилювач відцентрово-струминний