Похідні фенантридину як антагоністи брадикініну
Номер патенту: 99707
Опубліковано: 25.09.2012
Автори: Цира Габор, Елеш Янош, Беке Дьюла, Хорнок Каталін, Ваго Іштван, Сентірмаї Ева, Ваштаг Моніка, Бозо Ева, Фаркаш Шандор, Шмідт Ева
Формула / Реферат
1. Антагоніст В1 рецептора брадикініну - похідна фенантридину формули (І):
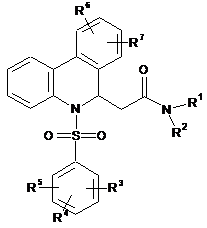 , (I)
, (I)
де:
R1 є атомом водню або С1-С4алкільною групою;
R2 вибраний з (1) атома водню; за умови, що R1 і R2 не можуть бути одночасно атомом водню; (2) -(CH2)n-NRaRb, (3) -(CH2)n-CO-NRaRb, (4) -(CH2)m-X-Q, (5) -CHRC-NRaRb; або
R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце, що включає 1-3 гетероатоми, вибрані з О, S і N; де зазначене кільце необов'язково заміщене -CO-NRaRb, C1-C4алкілом, 4-(4,5-дигідро-1Н-імідазол-2-іл)-бензилом або 4-(1,4,5,6-тетрагідропіримідин-2-іл)-бензилом;
R3, R4, R5, R6 і R7 є незалежно один від іншого атомом водню, атомом галогену, трифторметилом, С1-С4алкілом, С1-С4алкокси- або ацетильною групою;
n є цілим числом від 1 до 4;
Ra i Rb є атомом водню, необов'язково заміщеною С1-С4алкільною групою, або Ra, Rb і атом азоту, до якого вони приєднані, разом утворюють насичене, частково ненасичене або ароматичне 4-7-членне кільце, що включає 1-3 гетероатоми, вибрані з О, S і N; де зазначене кільце необов'язково заміщене 1-піперидинільною, 2-піперидинільною, 4-піперидинільною, 2-піридильною або 4-піридильною групою;
Rc є метильною, гідроксиметильною, бензильною або фенільною групою;
m є цілим числом від 0 до 6;
X є одинарним зв'язком, О або S;
Q є фенільною групою, необов'язково заміщеною [1,4']-біпіперидиніл-1'-ільною, 4,5-дигідро-1Н-імідазол-2-ільною, -(CH2)n-NH-(C=NH)-NH2 або -(CH2)m-(C=NH)-NH2 групою; або 4-піперидинільною групою, необов'язково заміщеною 4-піперидинільною групою; або С5-С7циклоалкільною групою, необов'язково заміщеною -(CH2)m-NRaRb групою, та
її оптичний антипод або рацемат і/або сіль, і/або гідрат, і/або сольват.
2. Сполука за п. 1, вибрана з групи, що складається з
гідрохлориду 2-[5-(3,4-дихлорбензилсульфоніл)-8-фтор-5,6-дигідрофенантридин-6-іл]-N-{2-[4-(4,5-дигідро-1Н-імідазол-2-іл)-феніл]-етил}-ацетаміду,
гідрохлориду 2-[5-(3,4-дихлорбензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-N-{2-[4-(4,5-дигідро-1Н-імідазол-2-іл)-феніл]-етил}-ацетаміду,
2-[5-(3,4-дихлорбензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-N-[2-(4-піридин-4-ілпіперазин-1-іл)-етил]-ацетаміду,
транс-2-[5-(3,4-дихлорбензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-N-[4-(2-піролідин-1-ілетил)-циклогексил]-ацетаміду,
2-[5-(3,4-дихлорбензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-1-{4-[4-(4,5-дигідро-1Н-імідазол-2-іл)-бензил]-піперидин-1-іл}-етанону,
2-[5-(3,4-дихлорбензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-1-{4-[4-(1,4,5,6-тетрагідропіримідин-2-іл)-бензил]-піперидин-1-іл}-етанону,
N-(4-[1,4']біпіперидиніл-1'-ілфеніл)-2-[5-(3,4-дихлорбензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-ацетаміду,
2-[5-(3,4-дихлорбензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-N-[3-(4-піридин-4-ілпіперазин-1-іл)-пропіл]-ацетаміду,
гідрохлориду N-{2-[4-(4,5-дигідро-1Н-імідазол-2-іл)-феніл]-етил}-2-[5-(толуол-4-сульфоніл)-5,6-дигідрофенантридин-6-іл]-ацетаміду,
гідрохлориду N-{2-[4-(4,5-дигідро-1Н-імідазол-2-іл)-феніл]-етил}-2-[5-(2,4,6-триметилбензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-ацетаміду,
гідрохлориду N-{2-[4-(4,5-дигідро-1Н-імідазол-2-іл)-феніл]-етил}-2-[5-(4-метоксибензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-ацетаміду,
гідрохлориду 2-[5-(3,4-дихлорбензилсульфоніл)-10-метокси-5,6-дигідрофенантридин-6-іл]-N-{2-[4-(4,5-дигідро-1Н-імідазол-2-іл)-феніл]-етил}-ацетаміду,
гідрохлориду 2-[5-(3,4-дихлорбензилсульфоніл)-8,10-дифтор-5,6-дигідрофенантридин-6-іл]-N-{2-[4-(4,5-дигідро-1Н-імідазол-2-іл)-феніл]-етил}-ацетаміду,
гідрохлориду 2-[8-ацетил-5-(3,4-дихлорбензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-N-{2-[4-(4,5-дигідро-1Н-імідазол-2-іл)-феніл]-етил}-ацетаміду,
N-[2-(4-карбамімідоїлфеніл)-етил]-2-[5-(3,4-дихлорбензилсульфоніл)-5,6-дигідрофенантридин-6-іл]-ацетаміду або
транс-2-[5-(3,4-дихлорбензилсульфоніл)-10-метокси-5,6-дигідрофенантридин-6-іл]-N-[4-(2-піролідин-1-ілетил)-циклогексил]-ацетаміду.
3. Спосіб одержання сполуки формули (І) за п. 1, згідно з яким здійснюють реакцію похідної боронової кислоти формули (II):
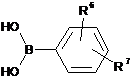 , (II)
, (II)
де значення R6 і R7 відповідають вищеописаному,
з 2-броманіліном формули (III):
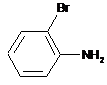 , (III)
, (III)
у присутності каталізатора, переважно тетракис-(трифенілфосфін)-паладію(0), після чого одержану амінобіфенілпохідну формули (IV):
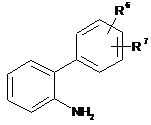 , (IV)
, (IV)
де значення R6 і R7 відповідають визначеному вище,
сульфують з похідною сульфохлориду формули (V):
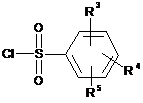 , (V)
, (V)
де значення R3, R4 і R5 відповідають визначеному вище,
і утворену сульфонамідну похідну формули (VI):
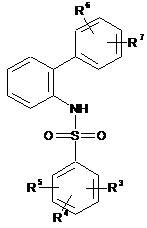 , (VI)
, (VI)
де значення R3, R4, R5, R6 і R7 відповідають визначеному вище,
піддають реакції циклізації з метилакрилатом за наявності ацетату паладію й ацетату міді(II), та одержану похідну ефіру фенантридину й оцтової кислоти формули (VII):
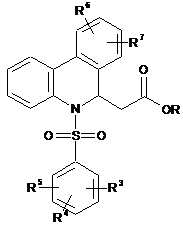 , (VII)
, (VII)
де значення R3, R4, R5, R6 і R7 відповідають визначеному вище, a R є С1-С4алкільною групою,
гідролізують у присутності основи до одержання фенантридинової похідної оцтової кислоти формули (VIII):
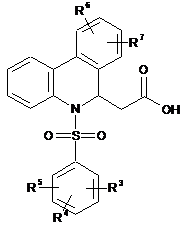 , (VIII)
, (VIII)
де значення R3, R4, R5, R6 і R7 відповідають визначеному вище,
потім останню вводять у реакцію з аміновою похідною формули (IX):
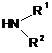 , (IX)
, (IX)
де значення R1 і R2 відповідають вищеописаному.
4. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки формули (І) відповідно до п. 1 або її оптичних антиподів або рацематів, або фармацевтично придатних солей, або гідратів, або сольватів і одного або більше фармацевтично придатних наповнювачів.
5. Застосування сполуки формули (І) за п. 1 або її оптичних антиподів або рацематів, або фармацевтично придатних солей, або гідратів, або сольватів для виробництва медикаменту для профілактики і/або лікування стану, що потребує інгібування рецептора брадикініну.
6. Застосування за п. 5, де рецептором брадикініну є В1 рецептор брадикініну.
7. Спосіб лікування та/або профілактики стану, що потребує інгібування рецептора брадикініну, що включає введення суб'єкту, який цього потребує, ефективної кількості сполуки формули (І) відповідно до п. 1 або її оптичних антиподів або рацематів, або фармацевтично придатних солей, або гідратів, або сольватів.
8. Спосіб лікування та/або профілактики за п. 7, де рецептором брадикініну є В1 рецептор брадикініну.
Текст
Реферат: Даний винахід стосується похідних фенантридину формули (І) R 6 R 7 O N O R S 5 R O R R 4 R N 1 2 3 , (I) 1 2 де R є атомом водню або С1-С4алкільною групою; R вибраний з (1) атома водню; з 1 2 a b умовою, що R і R не можуть бути одночасно атомом водню; (2) –(СН2)n-NR R , (3) –(CH2)n-COa b c a b 1 2 NR R , (4) –(CH2)m-X-Q, (5) –(CHR -NR R ; або R і R разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце, що включає 1-3 гетероатоми, вибрані з a b О, S і N; де зазначене кільце необов‟язково заміщене –CO-NR R , С1-С4алкілом, 4-(4,5-дигідро3 4 5 6 7 1Н-імідазол-2-іл)-бензилом або 4-(1,4,5,6-тетрагідропіримідин-2-іл)-бензилом; R , R , R , R і R є незалежно один від іншого атомом водню, атомом галогену, трифторметилом, С 1-С4алкілом, a b С1-С4алкокси- або ацетильною групою; n є цілим числом від 1 до 4; R і R є атомом водню, a b необов‟язково заміщеною С1-С4алкільною групою, або R , R і атом азоту, до якого вони приєднані, разом утворюють насичене, частково ненасичене або ароматичне 4-7-членне кільце, що включає 1-3 гетероатоми, вибрані з О, S і N; де зазначене кільце необов‟язково заміщене 1піперидинільною, 2-піперидинільною, 4-піперидинільною, 2-піридильною або 4-піридильною c групою; R є енольною, гідроксиметильною, енольною або енольною групою; m є цілим числом від 0 до 6; X є одинарним зв‟язком, О або S; Q є енольною групою, необов‟язково заміщеною [1,4‟]-біпіперидиніл-1‟-ільною, 4,5-дигідро-1Н-імідазол-2-ільною, -(CH2)n-NH-(C=NH)NH2 або –(CH2)m-(C=NH)-NH2 групою; або 4-піперидинільною групою, необов‟язково заміщеною 4-піперидинільною групою; або С5-С7циклоалкільною групою, необов‟язково заміщеною – a b (CH2)m-NR R групою, і їх оптичних антиподів або рацематів і/або солей, і/або гідратів, і/або сольватів; процесів їх виробництва, фармакологічних композицій, що містять їх, і їх застосування в лікуванні або профілактиці больових і запальних процесів. UA 99707 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід стосується нових похідних фенантридину формули (I) і їх оптичних антиподів, або рацематів, і/або солей, і/або гідратів, і/або сольватів, придатних для лікування або профілактики болючих і запальних процесів. Даний винахід також стосується процесів виробництва сполук формули (I) і фармакологічних композицій, що містять їх. Рівень техніки Кініни є ендогенними пептидами, що утворюються в плазмі і периферичних тканинах у відповідь на ушкодження тканини або інфекцію, що супроводжуються каталітичним розщепленням кініногенів калікреїновими ферментами. Кініни відіграють важливу роль у патофізіологічних процесах, що супроводжують біль і запалення. Їх біологічна роль опосередкована двома пов‟язаними з G-білком мембранними рецепторами, що позначаються як В1 і В2. Як В1, так і В2 рецептори були клоновані [Biochem. Biophys. Res. Commun., 184 (1992) 260-268 і J. Biol. Chem., 269 (1994) 21583-21586], і механізми, які регулюють їх експресію, само-підтримку і сигнальну функцію, інтенсивно досліджуються [Pharmacol. Rev., 57 (2005) 2777]. Перша група кінінів, брадикінін (ВК) і калідин (LysBK) переважно діє за допомогою стимуляції В2 рецепторів, які постійно експресуються і швидко десенсибілізуються, та широко поширені в багатьох тканинах. З іншого боку, їх активні карбоксипептидазні метаболіти, друга 9 9 група кінінів, desArg BK (DABK) та LysdesArg BK (LysDABK) активують індуцибельні і недесенсибілізувальні В1 рецептори, які рідко експресуються в не-патологічних умовах. Звичайно В1 рецептори швидко з‟являються після ушкодження різної природи (травма тканин, інфекція, і т.д.). Тому позитивна регуляція В1 рецептора здається частиною генералізованої відповіді, яка включає локальну спільну експресію (внаслідок позитивної регуляції) ферментів, рецепторів, аутокоїдів, цитокінів і хемокінів, які, як відомо, відіграють роль у ранній і пізній відповіді тканин на різні типи ушкодження. На тваринних моделях було продемонстровано, що є переключення переваги функції від В2 на В1 при хронічних запальних станах. У той час як В2 рецептор залучений у гостру фазу запальної і болючої відповіді, В1 рецептор залучається в хронічну фазу даної відповіді. Залучення кінінових рецепторів у запалення і передачу сигналу болю було підтверджено результатами дослідження на мишах, які не мають В1 рецептори брадикініну. В1-рецептордефіцитні миші відрізнялися від мишей дикого типу за сенсорними функціями, проявом підвищеного анальгетичного порогу на пошкоджувальні хімічні та теплові стимули, та за різким зменшенням нагромадження поліморфноядерних лейкоцитів у місцях запалення [PNAS, 97 (2000) 8140-8145 і Neuropharmacology 41 (2201) 006-1012]. Далі, найбільш цікавою знахідкою у В1-рецептор-дефіцитних мишей був прямий доказ ролі центральних кінінових рецепторів у ноцицепції, що дозволяє припустити, що гіпоальгезія, яка спостерігається у В1-рецепторнокаутних мишей, частково обумовлена зниженою центральною сенсибілізацією спинного мозку. Однак за винятком вищевказаних змін, В1-нокаутні миші були явно нормальними без яких-небудь помітних патологічних змін. Крім доказів основної експресії В1 рецепторів на периферії, все більше і більше доказів демонструють, що В1 рецептори постійно експресуються «центрально» у деяких нейрональних елементах, включаючи спинний мозок, а також деякі вищі структури. Функція цих рецепторів неясна, але вони залучені в передачу сигналу болю та гіпералгезію. Таким чином, вважається, що антагоністи В1 рецептора придатні для полегшення болю не тільки в периферичних ділянках, але також можливо, мають більш широкий спектр анальгезуючих ефектів, якщо вони також блокують центральні В1 рецептори [NeuroReport 11 (2000) 4003-4005; NeuroReport, 12 (2001) 2311-2313; Neuroscience 107 (2001) 665-673 і Neuroscience Letters 294 (2000) 175-178]. На основі наукових даних, рецептори брадикініну залучені в опосередкування болю та гіперальгезії декількома шляхами. Антагоністи В1 рецепторів можуть мати різні способи дії. Вони чинять (1) непрямі («периферійні») ефекти на ноцицептори за допомогою інгібування вивільнення інших альгогенних медіаторів (простагландинів, цитокінів і оксиду азоту) із клітин, інших ніж сенсорні нейрони (макрофаги, фібробласти або ендотеліальні клітини); (2) прямі («периферійні») ефекти на ноцицептори, які експресують В1 рецептори (постійно) або при індукції, і (3) «центральні» ефекти на біль, що виникає в поверхневому спинному розі спинного мозку. Таким чином, активні при пероральному прийомі не-пептидні антагоністи рецепторів брадикініну можуть бути потенційними терапевтичними агентами в лікуванні хронічного запального болю. Розкриття винаходу Ми винайшли клас похідних фенантридину, які володіють високою афінністю до В1 1 UA 99707 C2 рецепторів брадикініну і вибірковістю (селективністю), не реагуючи з В2 рецепторами брадикініну. Вибірковість особливо важлива, оскільки небажані побічні ефекти сполук виражені набагато менше. Даний винахід стосується нових похідних фенантридину формули (I): 5 10 15 20 25 30 35 де: 1 R є атомом водню або С1-С4 алкільною групою; 2 1 2 R обраний з (1) атома водню; за умови, що R і R не можуть бути одночасно атомом a b a b c a b водню; (2) –(СН2)n-NR R , (3) –(СН2)n-CО-NR R , (4) –(СН2)m-X-Q, (5) –СНR -NR R ; або 1 2 R і R разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце, яке включає 1-3 гетероатом, обраний із О, S і N; де зазначене кільце не a b обов‟язкове заміщене –CО-NR R , С1-С4 алкілом, 4-(4,5-дигідро-1Н-імідазол-2-іл)-бензилом або 4-(1,4,5,6-тетрагідро-піримідин-2-іл)-бензилом; 3 4 5 6 7 R , R , R , R і R є незалежно один від іншого атомом водню, атомом галогену, трифторметилом, С1-С4 алкілом, С1-С4 алкокси-, або ацетильною групою; n є цілим числом від 1 до 4; a b a b R і R є атомом водню, не обов‟язково заміщене С1-С4 алкільною групою, або R , R і атом азоту, до якого вони приєднані, разом утворюють насичене, частково ненасичене або ароматичне 4-7-членне кільце, що включає 1-3 гетероатом, обраний з О, S і N; де зазначене кільце не обов‟язково заміщене 1-піперидинільною, 2-піперидинільною, 4-піперидинільною, 2піридильною або 4-піридильною групою; с R є метильною, гідроксиметильною, бензильною або фенільною групою; m є цілим числом від 0 до 6; Х є одинарним зв‟язком, О або S; Q є фенільною групою, за необхідності заміщеною [1,4»]-біпіперидиніл-1‟-ільною, 4,5дигідро-1Н-імідазол-2-ільною, -(СН2)n-NН-(С=NН)-NН2 або –(СН2)m- (С=NН)-NН2 групою; або 4піперидинільною групою, необов‟язково заміщеною 4-піперидинільною групою; або С5-С7 а b циклоалкільною групою, необов‟язково заміщеною –(СН2)m-NR R групою, і їх оптичних антиподів, або рацематів, і/або солей, і/або гідратів, і/або сольватів. Винахід також стосується фармацевтичних композицій, що включають сполуки формули (I) або їх оптичні антиподи, або рацемати, або солі, або гідрати, або сольвати як активний інгредієнт. Далі об‟єктами даного винаходу є синтез сполук формули (I), і хімічне або фармацевтичне виробництво медикаментів, що включають дані сполуки, а також способи лікування даними сполуками, що означає введення ссавцям, яких лікують – включаючи людину – ефективної кількості/кількостей сполук формули (I) даного винаходу як таких або як медикамента. Здійснення винаходу Даний винахід стосується нових антагоністів В1 рецептора брадикініну – похідних фенантридину формули (I): 2 UA 99707 C2 5 10 15 20 25 30 35 40 45 де: 1 R є атомом водню або С1-С4 алкільною групою; 2 1 2 R обраний з (1) атома водню; за умови, що R і R не можуть бути одночасно атомом a b a b c a b водню; (2) –(СН2)n-NR R , (3) –(СН2)n-CО-NR R , (4) –(СН2)m-X-Q, (5) –СНR -NR R ; або 1 2 R і R разом з атомом азоту, до якого вони приєднані, утворюють 4-7-членне гетероциклічне кільце, що включає 1-3 гетероатом, обраний з О, S і N; де зазначене кільце за a b необхідності заміщене –CО-NR R , С1-С4 алкілом, 4-(4,5-дигідро-1Н-імідазол-2-іл)-бензилом або 4-(1,4,5,6-тетрагідро-піримідин-2-іл)-бензилом; 3 4 5 6 7 R , R , R , R і R є незалежно один від іншого атомом водню, атомом галогену, трифторметилом, С1-С4 алкілом, С1-С4 алкокси-, або ацетильною групою; n є цілим числом від 1 до 4; a b a b R і R є атомом водню, за необхідності заміщеними С1-С4 алкільною групою, або R , R і атом азоту, до якого вони приєднані, разом утворюють насичене, частково ненасичене або ароматичне 4-7-членне кільце, що включає 1-3 гетероатом, обраний з О, S і N; де зазначене кільце за необхідності заміщене 1-піперидинільною, 2-піперидинільною, 4-піперидинільною, 2піридильною або 4-піридильною групою; с R є метильною, гідроксиметильною, бензильною або фенільною групою; m є цілим числом від 0 до 6; Х є одинарним зв‟язком, О або S; Q є фенільною групою, за необхідності заміщеною [1,4»]-біпіперидиніл-1‟-ільною, 4,5дигідро-1Н-імідазол-2-ільною, -(СН2)n-NН-(С=NН)-NН2 або –(СН2)m- (С=NН)-NН2 групою; або 4піперидинільною групою, необов‟язково заміщеною 4-піперидинільною групою; або С5-С7 а b циклоалкільною групою, необов‟язково заміщеною –(СН2)m-NR R групою, і їх оптичних антиподів, або рацематів, і/або солей, і/або гідратів, і/або сольватів. Винахід також стосується фармацевтичних композицій, що включають сполуки формули (I) або їх оптичні антиподи, або рацемати, або солі, або гідрати, або сольвати як активний інгредієнт. Далі об‟єктами даного винаходу є синтез сполук формули (I), і хімічне або фармацевтичне виробництво медикаментів, що включають дані сполуки, а також способи лікування даними сполуками, що означає введення ссавцям, яких лікують – включаючи людину – ефективної кількості/кількостей сполук формули (I) даного винаходу як таких або як медикамента. Термін «галогеновий» замісник позначає атоми фтору, хлору, брому або йоду. Термін С1-С4 алкільна група, використаний у представленому описі, позначає метильні, етильні, пропільні та ізопропільні та різні бутильні групи. Ці С1-С4 алкільні групи можуть бути у С1-С4 алкоксильних групах і С1-С4 алкоксикарбонільних групах. 1 2 4-7-членне гетероциклічне кільце у значенні R і R може бути, наприклад, приперидином, піролідином, піперазином, гомопіперазином, морфоліном, тіоморфоліном і тому подібним. a b С1-С4 алкільна група у значенні R і R може бути заміщена, наприклад, 4-піперидинільною, 1-піролідинільною або піперазинільною групою. a b Насичене, частково ненасичене або ароматичне 4-7 членне кільце у значенні R і R може бути, наприклад, піперидином, піролідином, піперазином, гомопіперазином, морфоліном, тіоморфоліном і тому подібним. Винахід стосується також солей сполук формули (I), утворених з кислотами або основами. Як органічні, так і неорганічні кислоти можуть застосовуватися для утворення солей приєднання кислот. Придатними неорганічними кислотами можуть бути, наприклад, соляна кислота, сірчана кислота і фосфорна кислота. Представниками одновалентних органічних кислот можуть бути, наприклад, мурашина кислота, оцтова кислота, трифтороцтова кислота, пропіонова кислота, і різні бутанові кислоти, валеріанові кислоти і капринові кислоти. 3 UA 99707 C2 5 10 15 20 Представниками двовалентних органічних кислот можуть бути, наприклад, щавлева кислота, малонова кислота, малеїнова кислота, фумарова кислота і бурштинова кислота. Можуть застосовуватися також інші органічні кислоти, такі як гідроксикислоти, наприклад, лимонна кислота, винна кислота, або ароматичні карбонові кислоти, наприклад, бензойна кислота або саліцилова кислота, а також аліфатичні й ароматичні сульфонові кислоти, наприклад, метансульфонова кислота і п-толуолсульфонова кислота. Особливо цінною групою солей приєднання кислоти є ті, у яких кислий компонент сам по собі не має лікувального ефекту в застосовуваній дозі або не чинить небажаного впливу на ефект активного інгредієнта. Ці солі приєднання кислоти є фармацевтично придатними солями приєднання кислоти. Причиною, з якої солі приєднання кислоти, що не належать до фармацевтично придатних солей приєднання кислоти, застосовуються в даному винаході, є те, що в даному випадку вони можуть мати перевагу при очищенні і виділенні бажаних сполук. Серед солей, утворених з основами, особливо важливими є солі, утворені лужними металами, наприклад, натрієм, калієм, лужно-земельними металами, наприклад, кальцієм і магнієм, а також аміаком або органічними амінами. Останні основи можуть мати додаткові замісники, наприклад, гідрокси- або аміногрупи, які можуть впливати, наприклад, на розчинність і обробку продукту. Солі, утворені основами, є фармацевтично придатними солями приєднання основи. Відповідно до даного винаходу, сполуки формули (I) можуть бути синтезовані в реакції похідного боронової кислоти формули (II): 6 7 де значення R і R відповідає вищеописаному – з 2-броманіліном формули (III): 25 у присутності каталізатора, переважно тетракис-(трифенілфосфін)-паладію(0), одержання аміно-біфеніл похідного формули (IV): 6 до 7 де значення R і R відповідає визначеному вище – сульфонільованого з похідним сульфохлориду формули (V): 30 3 4 5 де значення R , R і R відповідає визначеному вище – і утвореного сульфонамідного похідного формули (VI): 4 UA 99707 C2 3 4 5 6 7 3 4 5 6 7 де значення R , R , R , R і R відповідає визначеному вище – піддається реакції циклізації у відповідності зі способом, описаним у літературі [J. Org. Chem. 63 (1998) 5211-5215], і отримане похідне ефіру фенантридину й оцтової кислоти формули (VII): 5 10 де значення R , R , R , R і R відповідає визначеному вище, а R є С1-С4 алкільною групою – гідролізується в присутності основи до одержання фенантридинового похідного оцтової кислоти формули (VIII): 3 1 15 20 4 5 6 7 де значення R , R , R , R і R відповідає визначеному вище – потім останнє реагує з аміновим похідним формули (IХ): 2 де значення R і R відповідає вищеописаному – і отримане похідне фенантридину формули (I) у даному випадку може бути перетворене в іншу сполуку формули (I) шляхом введення нових замісників і/або модифікації або видалення існуючих, і/або утворення солей, і/або вивільнення сполуки із солей. Реакцію сульфонілування переважно виконують у належному розчиннику, переважно в присутності основи. Реакції контролюють за допомогою тонкошарової хроматографії. Необхідний час реакції складає 6-20 годин. Обробку реакційної суміші можна здійснювати різними способами. a) Реакційну суміш концентрують, і продукт виділяють кристалізацією або екстракцією. Якщо сирий продукт є недостатньо чистим, для його очищення можна застосувати колоночну хроматографію. Колоночну хроматографію проводять або в нормальній фазі, із застосуванням 5 UA 99707 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кізельгеля 60 як адсорбент і різні системи розчинників, наприклад, н-гексану/етилацетату, хлороформу/метанолу, дихлорметану/етилацетату або хлороформу/ацетону як елюента, або в зверненій фазі, із застосуванням колонки типу YMC-Pack ODS-AQ (виробництва YMC) і ацетонітрилу/води/трифтороцтової кислоти як елюента. b) Реакційну суміш наливають у воду з льодом, а продукт виділяють фільтрацією або екстракцією. Сирий продукт кристалізують або очищають колоночною хроматографією, як описано вище. Структуру продуктів визначають за допомогою ІЧ, ЯМР і мас-спектрометрії. Утворення амідного зв‟язку переважно здійснюють шляхом приготування активного похідного карбонової кислоти формули (VIII), що реагує з аміном формули (IХ), переважно в присутності основи. Перетворення карбонової кислоти в активне похідне може бути проведене in situ під час утворення амідного зв‟язку в придатному розчиннику (наприклад, диметилформаміді, ацетонітрилі, хлорованих вуглеводнях або вуглеводнях). Активні похідні можуть бути хлоридними кислотами (наприклад, приготовленими з карбонової кислоти і тіоніл-хлориду), змішаними ангідридами (наприклад, приготовленими з карбонової кислоти та ізобутилхлорформіату в присутності основи, наприклад, триетиламіну), активними ефірами (наприклад, приготовленими з карбонової кислоти і гідроксибензтриазолу (НОВt) і дициклогексилкарбодиімідом (DСС) або О-бензотриазол-1-іл-N, N,N»,N‟-тетраметилуронійгексафторфосфатом (НВТ) у присутності основи, наприклад, триетиламіну), азидами кислот (наприклад, приготовленими з гідразиду карбонової кислоти). Активні похідні можуть бути приготовлені при температурі в діапазоні від 0ºС до кімнатної температури. Придатний амін формули (ІХ) додають як основу або сіль, утворену з неорганічною кислотою, до отриманого в такий спосіб розчину або суспензії в присутності основи, наприклад, триетиламіну, необхідного для вивільнення аміну. Реакції конденсації супроводжуються тонкошаровою хроматографією. Необхідний час реакції складає 6-20 годин. Обробка реакційної суміші може здійснюватися різними способами. Коли реакційна суміш є суспензією, осад відокремлюють фільтрацією, промивають водою і/або органічним розчинником і проводять перекристалізацію з придатного розчинника до одержання чистого продукту. Якщо кристалізація не дає чистий продукт, то може застосовуватися колоночна хроматографія для його очищення. Колоночну хроматографію проводять або в нормальній фазі, із застосуванням Кізельгеля 60 як адсорбенту і різних систем розчинників, наприклад, толуолу/метанолу, хлороформу/метанолу або толуолу/ацетону як елюента, або в зверненій фазі, із застосуванням колонки типу YMC-Pack ODS-AQ (виробництва YMC) і ацетонітрила/води/трифтороцтової кислоти як елюента. Якщо реакційна суміш є розчином наприкінці реакції утворення амідного зв‟язку, його концентрують, а осад кристалізують або екстрагують з придатним органічним розчинником і в даному випадку очищають колоночною хроматографією, як описано вище. Структури продуктів визначають за допомогою ІЧ, ЯМР і мас-спектрометрії. Отримані амідні похідні формули (I) – незалежно від способу готування – у даному випадку можуть бути перетворені в іншу сполуку формули (I) введенням додаткових замісників, і/або їх модифікацією, і/або видаленням існуючих, і/або утворенням солей з кислотами, і/або вивільненням бензамідних похідних формули (I) з отриманих солей приєднання кислот шляхом обробки основою, і/або вільні сульфонамідні похідні формули (I) можуть бути перетворені в сіль шляхом обробки основою. Боронові кислоти формули (II) і сульфонілхлориди формули (V) є комерційно доступними. Більшість амінів формули (ІХ) може бути синтезована різними відомими способами. Синтез деяких нових амінів формули (ІХ) описаний у прикладах. Дотримуючись цих процедур, можна також приготувати інші аміни формули (ІХ). Сполуки даного винаходу, а також їх фармацевтично придатні солі, або гідрати, або сольвати можуть застосовуватися як такі, або в придатній формі фармацевтичних композицій. Ці композиції (ліки) можуть бути у твердій, рідкій або напіврідкій формі, і можуть бути додані фармацевтичні ад‟юванти і допоміжні матеріали, які звичайно застосовуються у практиці, такі як носії, наповнювачі, розріджувачі, стабілізатори, зволожувальні агенти або емульгатори, агенти, що впливають на рН та осмотичний тиск, смакові й ароматизуючі, а також підтримуючих добавок, що забезпечують рецептуру. Дозування, необхідне для прояву лікувального ефекту, може варіювати в широких межах, і бути пристосоване до індивідуальних вимог у кожному окремому випадку, залежно від стадії захворювання, стану і ваги тіла пацієнта, якому призначене лікування, а також чутливості пацієнта до активного інгредієнта, способу застосування і числу щоденних прийомів. Дійсна доза застосовуваного активного інгредієнта може безпечно бути визначена лікуючим лікарем, 6 UA 99707 C2 5 10 15 20 25 30 35 40 45 50 55 60 знаючим у даній галузі техніки, що знає пацієнта, якому призначене лікування. Фармацевтичні композиції, що включають активний інгредієнт відповідно до даного винаходу, звичайно включають від 0,01 до 100 мг активного інгредієнта в окремій формі дозування. Звичайно, можливо, що кількість активного інгредієнта в деяких композиціях може виходити за верхню або нижню межі, зазначені вище. Твердими формами фармацевтичних композицій можуть бути, наприклад, таблетки, драже, капсули, пігулки або ампули з ліофілізованим порошком, придатні для приготування ін‟єкцій. Рідкими композиціями є композиції для введення та інфузії, рідкі медикаменти, упаковані рідини і краплі. Напіврідкими композиціями можуть бути мазі, бальзами, креми, мікстури для струшування і супозиторії. Для простого введення придатна фармацевтична композиція, що включає одиниці дозування, які містять кількість активного інгредієнта, призначеного для застосування одноразово, або кілька разів, або його половину, третю або четверту частину. Такими одиницями дозування є, наприклад, таблетки, що можуть бути постачені борозенками, що дають половину або четверту частину таблетки, щоб точно вводити необхідну кількість активного інгредієнта. Таблетки можуть бути покриті кислото-розчинним шаром, щоб досягти вивільнення вмісту активного інгредієнта після проходження через шлунок. Такі таблетки є таблетками з ентеросолюбільним покриттям. Подібний ефект може досягатися також шляхом інкапсулювання активного інгредієнта. Фармацевтичні композиції для перорального застосування можуть включати, наприклад, лактозу або крохмаль як наповнювачі, натрію карбоксиметилцелюлозу, метилцелюлозу, полівінілпіролідон або крохмальну пасту як зв‟язувальні або гранулюючі агенти. Картопляний крохмаль або мікрокристалічна целюлоза додаються як дезінтегруючі агенти, але ультраамілопектин або формальдегід-казеїн також можуть застосовуватися. Тальк, колоїдна кремнієва кислота, стеарин, стеарат кальцію або магнію можуть застосовуватися як антиадгезивні засоби і любриканти. Таблетки можуть бути зроблені, наприклад, вологим гранулюванням з наступним пресуванням. Змішані активні інгредієнти і наповнювачі, також як і, у даному випадку, частина дезінтегрантів, гранулюють у водному, спиртовому або водно-спиртовому розчині сполучних агентів у придатному обладнанні, а потім висушують гранулят. У висушений гранулят додають інші дезінтегранти, любриканти й антиадгезивні агенти, і пресують суміш у таблетки. У даному випадку таблетки роблять з борозенкою, що розділяє на дві частини, для полегшення застосування. Таблетки можуть бути зроблені безпосередньо із суміші активного інгредієнта і придатних допоміжних речовин шляхом пресування. У даному випадку, таблетки можуть бути покриті з застосуванням добавок, звичайно використовуваних у фармацевтичній практиці, наприклад, стабілізаторів, смакових речовин, фарбуючих агентів, таких як цукор, похідні целюлози (метилабо етилцелюлоза, натрію карбоксиметилцелюлоза і т.д.), полівінілпіролідон, фосфат кальцію, карбонат кальцію, харчові барвники, харчові добавки, ароматичні агенти, пігменти з оксиду заліза, і т.д. У випадку капсул сумішшю активного інгредієнта і допоміжних речовин наповняють капсули. Рідкі пероральні композиції, наприклад, суспензії, сиропи, еліксири можуть бути приготовлені з застосуванням води, гліколей, масел, спиртів, фарбуючих і смакових агентів. Для ректального застосування композиція складається у вигляді супозиторіїв або клістирів. Супозиторій може включати крім активного інгредієнта носій, так званий адепс для супозиторію. Носіями можуть бути рослинні олії, такі як гідрогенізовані рослинні олії, Тригліцериди С 12-С18 жирних кислот (переважно, носії під торгівельним найменуванням Witepsol). Активний інгредієнт гомогенно змішують з розплавленим адепсом для супозиторія, і відливають супозиторії. Для парентерального застосування композицію складають у вигляді розчину для ін‟єкцій. Для виробництва розчину для ін‟єкцій активні інгредієнти розчиняють у дистильованій воді і/або різних органічних розчинниках, таких як гліколь-ефіри, у даному випадку в присутності солюбілізаторів, наприклад, поліоксиетиленсорбітану-монолаурату, -моноолеату, або моностеарату (Твін 20, Твін 60, Твін 80). Розчин для ін‟єкцій може також включати різні допоміжні речовини, такі як агенти, що консервують, наприклад, етилендиамінтетраацетат, а також агенти, що регулюють рН і буфери, і в окремому випадку місцеві анестетики, наприклад лідокаїн. Розчин для ін‟єкцій, що містить активний інгредієнт винаходу, фільтрують перед розливом в ампули, і стерилізують після розливу. Якщо активний інгредієнт є гігроскопічним, він може потім бути стабілізований ліофілізацією. Антагоністи В1 рецептора брадикініну описані, наприклад, у наступних міжнародних заявках 7 UA 99707 C2 5 10 15 20 25 30 35 40 45 50 55 60 на винахід: WO200075107, WO02076964, WO04054584, WO02099388, WO05004810. Застосування Сполуки даного винаходу є антагоністами рецептора брадикініну, зокрема вибірковими антагоністами В1 рецепторів брадикініну, відповідно, вони придатні для лікування або профілактики болючих і запальних процесів. Сполуки можуть бути ефективними в лікуванні болю, включаючи, наприклад, хронічний біль, зокрема біль, викликаний запаленням, гіперальгезію, біль у кістках і зв‟язках (остеоартрит), синдром повторюваних рухів, м‟язевофасціальний біль (ушкодження м‟язів, фіброміалгія), вісцеральний біль (виразковий коліт, панкреатит, цистит, увеїт), періоперативний біль (загальна хірургія, гінекологія), постоперативний біль (постхірургічний болючий синдром), посттравматичний біль (наприклад, розтягання або перелом), невропатологічний біль (постгерпетична невралгія, ушкодження нерву, фантомний біль лімбу, мононейропатія, полінейропатія), зубний біль, і біль при онкології. Далі для лікування болю, пов‟язаного з ангіною, менструацією, діабетичною васкулопатію, посткапілярною резистентністю або симптомами діабету, пов‟язаними з інсулітом (наприклад, гіперглікемією, порушенням діурезу, протеїнурією, і підвищеною екскрецією нітритів і калікреїну із сечею), діабетичною гіперальгезією. Далі, сполуки можуть застосовуватися для лікування ангіоедеми, атеросклерозу, септичного шоку, наприклад, як анти-гіповолемічні і/або антигіпотензивні агенти, і сепсису. Вони можуть застосовуватися як релаксанти гладеньких м‟язів для лікування спазму шлунково-кишкового тракту або матки. Далі, сполуки даного винаходу можуть додатково застосовуватися для лікування запальних захворювань шкіри, таких як псоріаз і екзема, і ушкоджень шкіри, включаючи опіки і сонячні опіки (УФ-еритема і біль). Сполуки можуть застосовуватися для лікування запального болю різного походження (наприклад, ревматоїдного артриту, ревматичного захворювання, теносиновіту, захворювання печінки, синдрому подразненого кишечнику, запального захворювання кишечнику, хвороби Крона, нефриту, алергійного риніту, вазомоторного риніту, увеїту, гінгівіту), алергій. Такі сполуки можуть застосовуватися для лікування захворювання повітроносних шляхів, наприклад, хронічного обструктивного захворювання легень, респіраторного дистрес-синдрому дорослих, бронхіту, пневмонії, астми. Вони можуть застосовуватися для контролю, обмеження або звертання гіперактивності повітроносних шляхів при астмі, лікування ендогенної астми й екзогенної астми, включаючи алергійну астму (атопічну або не-атопічну), професійну астму, астму, обтяжену бактеріальною або вірусною інфекцією, інші не-алергійні астми, синдром задишки у дітей, а також бронхоконстрикцію фізичної напруги. Вони можуть бути ефективними проти пневмоконіозу, включаючи алюміноз, антракоз, асбестоз, халікоз, філоз, сидероз, силікоз, табакоз і бісиноз. Додатково, вони можуть бути ефективними при деяких неврологічних захворюваннях, наприклад, розсіяному склерозі, хворобі Альцгеймера, епілепсії, набряку головного мозку, головному болі, включаючи гістаміновий головний біль, мігрень, включаючи профілактику і застосування в гострому періоді, а також закриту травму голови. Біологічна оцінка Оцінка антагоністичної потужності у відношенні В1 і В2 рецепторів in vitro за допомогою вимірювання концентрації іонів кальцію в цитозолі з флуориметром для сканування мікропланшетів, у клітинах, які експресують рекомбінантні людські В1 і В2 рецептори. Культура клітин Клітини яєчників китайського хом'ячка (СНО), що експресують рекомбінантний людський В1 (СНО-В1, Euroscreen) або В2 (СНО-В2, Perkin-Elmer) рецептори культивували у Дульбекко модифікованому середовищі Ігла (DМЕМ), що містить 10 % ембріональну телячу сироватку (FСS), 100 од./мл пеніциліну, 0,1 мг/мл стрептоміцину, 0,25 мкг/мл амфотерицину В, 1 % Мінімального есенціального середовища Ігла (МЕМ), розчин замінних амінокислот, 600 мкг/мл G418, 1 % піруват (для В2 клітинної лінії). Клітини зберігали при 37ºС в зволоженому інкубаторі в атмосфері 5 %СО2/95 % повітря і пересівали 1:4 три рази на тиждень. Клітини вносили на 4 планшет по 1,5-2,510 клітин/лунку в стандартний 96-лунковий планшет; вимірювання 2+ концентрації іонів кальцію в цитозолі ([Ca ]i) проводили через 1-2 дні після поміщення клітин на планшет. Флуоресцентне вимірювання концентрації кальцію в цитозолі 2+ Вимірювання [Ca ]i проводили на СНО-В1 і СНО-В2 клітинах, що стабільно експресують людські В1 і В2 рецептори, відповідно. Клітини вирощували в стандартних 96-лункових 2+ мікропланшетах, і перед вимірюванням навантажували флуоресцентною [Ca ]-чуттєвою фарбою, флуо-4/АМ (2 мкМ): після видалення культурального середовища додавали до клітин барвник (розчинений у буфері для аналізу: 145 мМ NaCl, 5 мМ KCl, 2 мМ MgCl 2, 2 мМ CaCl2, 10 мМ HEPES, 20 мМ D-глюкоза, 2 мМ пробенецид, 100 мкл/лунку) та інкубували клітини при 37ºС в зволоженому інкубаторі в атмосфері 5 %СО2/95 % повітря протягом 40-120 хвилин. Для 8 UA 99707 C2 5 10 15 20 зупинки навантаження барвником клітини відмивали двічі буфером для аналізу. Після відмивання різні концентрації аналізованих сполук (розведених у екстрацелюлярному середовищі від ДМСО маткового розчину, кінцева концентрація ДМСО була
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenanthridine derivatives as bradykinin antagonists
Автори англійськоюBeke, Gyula, Bozo, Eva, Eles, Janos, Eles, Janos, Farkash Shandor, Hornok, Katalin, Schmidt, Eva, Szentirmay, Eva, Vago Istvan, Vago, Istvan, Vastag, Monika
Назва патенту російськоюПроизводные фенантридина как антагонисты брадикинина
Автори російськоюБеке Дьюла, Бозо Ева, Цира Габор, Элеш Янош, Фаркаш Шандор, Хорнок Каталин, Шмидт Ева, Сентирмаи Ева, Ваго Иштван, Ваштаг Моника
МПК / Мітки
МПК: C07D 401/14, C07D 401/12, C07D 295/12, A61P 25/02, C07D 213/74, A61K 31/473, C07D 221/12, C07D 401/10
Мітки: антагоністи, брадикініну, похідні, фенантридину
Код посилання
<a href="https://ua.patents.su/25-99707-pokhidni-fenantridinu-yak-antagonisti-bradikininu.html" target="_blank" rel="follow" title="База патентів України">Похідні фенантридину як антагоністи брадикініну</a>
Попередній патент: Випробувальний стенд для повірки засобів вимірювання витрати газу
Наступний патент: Одноразова доза полівалентної комбінованої вакцини, яка включає антиген цирковірусу свиней типу 2
Випадковий патент: Спосіб очистки поверхні від льоду












