Похідні n-біфенілметиламіноциклоалканкарбоксаміду з заміщеним метилом, які застосовуються як антагоністи брадикініну
Номер патенту: 77058
Опубліковано: 16.10.2006
Автори: Ентоні Невілл Дж., Су Дай-Сі, Фенг Донг-Мей, Кудук Скотт Д., Вей Дженні Міу-чун, Вуд Майкл Р., Бок Марк Дж.
Формула / Реферат
1. Сполука формули І (3) і її фармацевтично прийнятні солі:
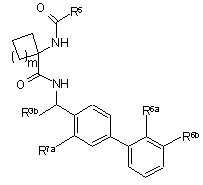 , І (3)
, І (3)
де m дорівнює 0 або 1, R6а означає 2-метил-2Н-тетразол-5-іл, 3-метил-1,2,4-оксадіазол-5-іл, СО2Ra або C(O)NHORa, де Ra означає С1-4алкіл; R6b означає водень, фтор або хлор; R3b означає С1-4алкіл; R5 вибраний з С1-4алкілу, необов'язково заміщеного 1-5 атомами галогену або ціаногрупою, С3-6циклоалкілу, ізоксазолілу, піримідинілу і піридинілу (і його N-оксиду), необов'язково заміщеного галогеном або трифторметилом; і R7a означає водень або фтор.
2. Сполука за п. 1, вибрана з:
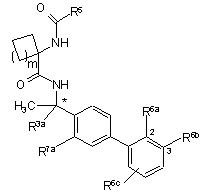
m
R5
R6a
R6b
R6c
R7a
*
R3 означає Н, якщо немає іншої вказівки
0
СН2СF3
СО2СН3
F
Н
Н
R
0
СН2СF3
СОNНОСН3
F
Н
Н
R
0
СF3
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
R
0
СF3
2-СН3-тетразол-5-іл
F
Н
F
R
0
CH2CN
СO2СН3
F
Н
Н
R
0
CH2CN
СО2СН3
Сl
Н
Н
R
0
СН2СF3
СO2СН3
Сl
Н
Н
R
0
СН2СF3
СО2СН3
F
Н
F
(±)
0
ізоксазол-5-іл
СO2СН3
F
Н
F
(±)
0
CH2CN
СО2СН3
F
Н
F
(±)
0
піримідин-5-іл
СO2СН3
F
Н
Н
R
0
СН2СF3
СО2СН3
F
Н
F
S
0
СН2СF3
СO2СН3
F
Н
F
R
0
піримідин-5-іл
СО2СН3
F
Н
F
(±)
0
ізоксазол-5-іл
СO2СН3
F
Н
F
R
0
СF3
СО2СН3
F
Н
F
R
0
піримідин-5-іл
СO2СН3
F
Н
F
R
0
ізоксазол-5-іл
СО2СН3
F
Н
F
S
0
СF3
СO2СН3
F
Н
F
S
0
піримідин-5-іл
СО2СН3
F
Н
F
S
0
СН3
СO2СН3
F
Н
F
R
0
5-Вr-піридин-3-іл
СО2СН3
F
Н
F
R
0
5-Вr-1-оксидопіридин-3-іл
СO2СН3
F
Н
F
R
0
СF3
СО2СН3
Н
Н
F
R
0
піримідин-5-іл
СO2СН3
Н
Н
F
R
0
CClF2
СО2СН3
F
Н
F
R
0
5-(СF3)піридин-3-іл
СO2СН3
F
Н
F
R
0
CClF2
СО2СН3
Сl
Н
F
R
0
CHF2
СО2СН3
F
Н
F
R
0
СF2СF3
СO2СН3
F
Н
F
R
0
CHF2
СО2СН3
Сl
Н
F
R
0
СН3
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
Н
R
0
CH2CN
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
Н
R
0
СН2СF3
3-СН3-1,2,4-оксадіазол-5-iл
F
Н
Н
R
0
ізоксазол-5-іл
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
Н
R
0
СН2СF3
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
S
0
СН2СF3
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
R
0
CH2CN
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
(±)
0
СН2СF3
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
(±)
0
піримідин-5-іл
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
(±)
0
CClF2
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
R
0
піримідин-5-іл
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
R
0
CHF2
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
R
0
CH2CN
2-СН3-тетразол-5-іл
F
Н
Н
R
0
СН2СF3
2-СН3-тетразол-5-іл
F
Н
Н
R
0
ізоксазол-5-іл
2-СН3-тетразол-5-іл
F
Н
F
(±)
0
СН2СF3
2-СН3-тетразол-5-іл
F
Н
F
(±)
0
піримідин-5-іл
2-СН3-тетразол-5-іл
F
Н
F
(±)
0
СF3
2-СН3-тетразол-5-іл
F
Н
F
S
0
CClF2
2-СН3-тетразол-5-іл
F
Н
F
R
0
CHF2
2-СН3-тетразол-5-іл
F
Н
F
R
0
ізоксазол-5-іл
CONHOCH3
F
Н
Н
R
0
СF3
СО2СН3
Сl
Н
F
R
0
СF3
СО2СН3
СН3
Н
F
R
0
CClF2
СО2СН3
СН3
Н
F
R
1
піримідин-5-іл
СО2СН3
F
Н
Н
§
1
СF3
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
R
1
CClF2
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
R
1
піримідин-5-іл
3-СН3-1,2,4-оксадіазол-5-іл
F
Н
F
R
1
СF3
СО2СН3
F
Н
F
R
1
CClF2
СО2СН3
F
Н
F
R
1
піримідин-5-іл
СО2СН3
F
Н
F
R
1
піримідин-5-іл
СО2СН3
F
Н
Н
R
1
піримідин-5-іл
2-СН3-2Н-тетразол-5-іл
F
Н
F
R
1
СF3
СО2СН3
Сl
Н
F
R
1
CClF2
СО2СН3
Сl
Н
F
R
1
CHF2
СО2СН3
Сl
Н
F
R
*стереоконфігурація при вказаному вуглеці,
символ параграфа = R3a означає СН3, або її фармацевтично прийнятна сіль.
3. Сполука за п. 1, вибрана з:
метил-3-фтор-4'-{(1R)-1-[({1-(3,3,3-трифторпропаноїл)аміно]циклопропіл}-карбоніл)аміно}етил}-1,1'-біфеніл-2-карбоксилату,
3-фтор-N-метокси-4'-{(1R)-1-[({1-[3,3,3-трифторпропаноїл)аміно]-циклопропіл}карбоніл)аміно]етил}-1,1'-біфеніл-2-карбоксаміду,
метил-3-фтор-4'-{1-метил-1-[({1-[(трифторацетил)аміно]циклопропіл}-карбоніл)аміно]етил}-1,1'-біфеніл-2-карбоксилату,
N-{(1R)-1-[3,3'-дифтор-2'-(3-метил-1,2,4-оксадіазол-5-іл)-1,1'-біфеніл-4-
іл]етил}-1-[(трифторацетил)аміно]циклопропанкарбоксаміду,
метил-3-хлор-3'-фтор-4'-{(1R)-1-[({1-[(трифторацетил)аміно]циклопропіл}-карбоніл)аміно]етил}-1,1'-біфеніл-2-карбоксилату і
N{(1R)-1-[3,3'-дифтор-2'-(2-метил-2Н-тетразол-5-іл)-1,1'-біфеніл-4-іл]етил}-
1-[(трифторацетил)аміно]циклопропанкарбоксаміду;
і її фармацевтично прийнятні солі.
4. Сполука за п. 1, яка являє собою метил-3-хлор-3'-фтор-4'-{(1R)-1-[({1-[(трифторацетил)аміно]циклопропіл}карбоніл)аміно] етил}-1,1'-біфеніл-2-карбоксилат.
5. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п. 1 і фармацевтично прийнятні наповнювачі.
Текст
УКРАЇНА (19) UA (11) 77058 (13) C2 (51) МПК A61K 31/166 (2006.01) A61K 31/24 (2006.01) A61K 31/41 (2006.01) A61K 31/42 (2006.01) A61K 31/4245 (2006.01) A61K 31/505 (2006.01) A61P 1/02 (2006.01) A61P 1/04 (2006.01) A61P 1/16 (2006.01) A61P 1/18 (2006.01) A61P 9/10 (2006.01) A61P 11/00 (2006.01) A61P 11/06 (2006.01) A61P 11/08 (2006.01) A61P 13/10 (2006.01) A61P 13/12 (2006.01) A61P 17/02 (2006.01) A61P 17/06 (2006.01) A61P 19/02 (2006.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ A61P 19/08 (2006.01) A61P 21/00 (2006.01) A61P 25/04 (2006.01) A61P 25/06 (2006.01) A61P 25/28 (2006.01) A61P 27/16 (2006.01) A61P 29/00 (2006.01) A61P 31/04 (2006.01) A61P 35/00 (2006.01) A61P 37/08 (2006.01) C07C 237/24 (2006.01) C07D 213/82 (2006.01) C07D 239/28 (2006.01) C07D 257/00 (2006.01) C07D 261/18 (2006.01) C07D 271/06 (2006.01) C07D 403/12 (2006.01) C07D 413/12 (2006.01) ОПИС ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) ПОХІДНІ N-БІФЕНІЛМЕТИЛАМІНОЦИКЛОАЛКАНКАРБОКСАМІДУ З ЗАМІЩЕНИМ МЕТИЛОМ, ЯКІ ЗАСТОСОВУЮТЬСЯ ЯК АНТАГОНІСТИ БРАДИКІНІНУ NH NH R3b R5 NH m * R6a R3a 2 R7a R6a R6b R7a , І (3) C2 R6b 3 R6c m R5 (13) (11) NH O H3 C R6a R6b R R * 6c 7 a R5 m O O R3 означає Н, якщо немає іншої вказівки 0 СН2СF3 СО2СН3 0 СН2СF3 СОNНОСН3 0 СF3 3-СН3-1,2,4-оксадіазол-5-іл 0 СF3 2-СН3-тетразол-5-іл 0 CH2CN СO2СН3 0 CH2CN СО2СН3 0 СН2СF3 СO2СН3 0 СН2СF3 СО2СН3 0 ізоксазол-5-іл СO2СН3 F F F F F Сl Сl F F Н Н Н Н Н Н Н Н Н Н Н F F Н Н Н F F (19) O де m дорівнює 0 або 1, R6а означає 2-метил-2Нтетразол-5-іл, 3-метил-1,2,4-оксадіазол-5-іл, СО2Ra або C(O)NHORa, де Ra означає С1-4алкіл; R6b означає водень, фтор або хлор; R3b означає С1-4алкіл; R5 вибраний з С1-4алкілу, необов'язково заміщеного 1-5 атомами галогену або ціаногрупою, С3-6циклоалкілу, ізоксазолілу, піримідинілу і піридинілу (і його N-оксиду), необов'язково заміщеного галогеном або трифторметилом; і R7a означає водень або фтор. 2. Сполука за п. 1, вибрана з: UA (21) 20040907321 (22) 04.02.2003 (24) 16.10.2006 (86) PCT/US03/03338, 04.02.2003 (31) 60/355,062 (32) 08.02.2002 (33) US (31) 60/410,172 (32) 12.09.2002 (33) US (46) 16.10.2006, Бюл. № 10, 2006 р. (72) Вуд Майкл Р., US, Ентоні Невілл Дж., US, Бок Марк Дж., US, Фенг Донг-Мей , US, Кудук Скотт Д., US, Су Дай-Сі , US, Вей Дженні Міу-Чун, US (73) МЕРК ЕНД КО., ІНК., US (56) US5208236 (NEUSTADT BERNARD R) 4 May 1993 WO0202513 (BARBER CHRISTOPHER GORDON; COOK ANDREW SIMON (GB); PRYDE DAVID CAM) 10 January 2002 (57) 1. Сполука формули І (3) і її фармацевтично прийнятні солі: 2 77058 1 R R R R R R R (±) (±) 3 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 1 1 CH2CN піримідин-5-іл СН2СF3 СН2СF3 піримідин-5-іл ізоксазол-5-іл СF3 піримідин-5-іл ізоксазол-5-іл СF3 піримідин-5-іл СН3 5-Вr-піридин-3іл 5-Вr-1оксидопіридин3-іл СF3 піримідин-5-іл CClF2 5(СF3)піридин3-іл CClF2 CHF2 СF2СF3 CHF2 СН3 CH2CN СН2СF3 ізоксазол-5-іл СН2СF3 СН2СF3 CH2CN СН2СF3 піримідин-5-іл CClF2 піримідин-5-іл CHF2 CH2CN СН2СF3 ізоксазол-5-іл СН2СF3 піримідин-5-іл СF3 CClF2 CHF2 ізоксазол-5-іл СF3 СF3 CClF2 піримідин-5-іл СF3 CClF2 77058 СО2СН3 СO2СН3 СО2СН3 СO2СН3 СО2СН3 СO2СН3 СО2СН3 СO2СН3 СО2СН3 СO2СН3 СО2СН3 СO2СН3 СО2СН3 F F F F F F F F F F F F F Н Н Н Н Н Н Н Н Н Н Н Н Н СO2СН3 F Н F R СО2СН3 СO2СН3 СО2СН3 СO2СН3 Н Н F F Н Н Н Н F F F F R R R R СО2СН3 СО2СН3 СO2СН3 СО2СН3 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-iл 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-іл 2-СН3-тетразол-5-іл 2-СН3-тетразол-5-іл 2-СН3-тетразол-5-іл 2-СН3-тетразол-5-іл 2-СН3-тетразол-5-іл 2-СН3-тетразол-5-іл 2-СН3-тетразол-5-іл 2-СН3-тетразол-5-іл CONHOCH3 СО2СН3 СО2СН3 СО2СН3 СО2СН3 3-СН3-1,2,4-оксадіазол-5-іл 3-СН3-1,2,4-оксадіазол-5-іл Сl F F Сl F F F F F F F F F F F F F F F F F F F F F Сl СН3 СН3 F F F Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н F F F F Н Н Н Н F F F F F F F F Н Н F F F F F F Н F F F Н F F R R R R R R R R S R (±) (±) (±) R R R R R (±) (±) (±) S R R R R R R § R R F Н F F F F F F F F F F F (±) R S R (±) R R R S S S R R Даний винахід відноситься до похідних аміноциклоалканкарбоксаміду. Зокрема, даний винахід відноситься до похідних аміноциклоалканкарбоксаміду, які є антагоністами або оберненими агоністами брадикініну. Брадикінін («ВК») є кініном, який відіграє важливу роль в патофізіологічних процесах, супутніх гострому і хронічному болю і запаленню. Брадикінін (ВК), подібно до інших кінінів, є аутакоїдним (локальним) пептидом, продукованим за рахунок каталітичного впливу калікреїнових ферментів на попередники плазми і тканини, названі кініногенами. Біологічні дії ВК опосередковані щонайменше двома основними G-білокпов'язаними рецепторами ВК, названими В1 і В2 Вважається, що рецептори В2, на відміну від рецепторів В1, експресуються в нормальних тканинах і що запалення, 4 1 1 1 1 1 1 1 1 1 піримідин-5-іл СF3 CClF2 піримідин-5-іл піримідин-5-іл піримідин-5-іл СF3 CClF2 CHF2 3-СН3-1,2,4-оксадіазол-5-іл СО2СН3 СО2СН3 СО2СН3 СО2СН3 2-СН3-2Н-тетразол-5-іл СО2СН3 СО2СН3 СО2СН3 F F F F F F Сl Сl Сl Н Н Н Н Н Н Н Н Н F F F F Н F F F F R R R R R R R R R *стереоконфігурація при вказаному вуглеці, символ параграфа = R3a означає СН3, або її фармацевтично прийнятна сіль. 3. Сполука за п. 1, вибрана з: метил-3-фтор-4'-{(1R)-1-[({1-(3,3,3трифторпропаноїл)аміно]циклопропіл}карбоніл)аміно}етил}-1,1'-біфеніл-2-карбоксилату, 3-фтор-N-метокси-4'-{(1R)-1-[({1-[3,3,3трифторпропаноїл)аміно]циклопропіл}карбоніл)аміно]етил}-1,1'-біфеніл-2карбоксаміду, метил-3-фтор-4'-{1-метил-1-[({1[(трифторацетил)аміно]циклопропіл}карбоніл)аміно]етил}-1,1'-біфеніл-2-карбоксилату, N-{(1R)-1-[3,3'-дифтор-2'-(3-метил-1,2,4оксадіазол-5-іл)-1,1'-біфеніл-4іл]етил}-1[(трифторацетил)аміно]циклопропанкарбоксаміду, метил-3-хлор-3'-фтор-4'-{(1R)-1-[({1[(трифторацетил)аміно]циклопропіл}карбоніл)аміно]етил}-1,1'-біфеніл-2-карбоксилату і N{(1R)-1-[3,3'-дифтор-2'-(2-метил-2Н-тетразол-5іл)-1,1'-біфеніл-4-іл]етил}1[(трифторацетил)аміно]циклопропанкарбоксаміду; і її фармацевтично прийнятні солі. 4. Сполука за п. 1, яка являє собою метил-3-хлор3'-фтор-4'-{(1R)-1-[({1[(трифторацетил)аміно]циклопропіл}карбоніл)аміно] етил}-1,1'біфеніл-2-карбоксилат. 5. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п. 1 і фармацевтично прийнятні наповнювачі. пошкодження тканин або бактеріальна інфекція можуть швидко індукувати експресію рецептора В1. Це робить рецептор В1 особливо привабливою мішенню для лікарського засобу. Передбачувана роль кінінів і, зокрема, ВК, в боротьбі з болем і запаленням забезпечила стимул для створення сильних і селективних антагоністів ВК. В останні роки ці зусилля вийшли на перший план в очікуванні, що корисні терапевтичні агенти з анальгезуючими і протизапальними властивостями могли б забезпечувати ослаблення захворювань, медийованих через шлях рецепторів ВК [див., наприклад. M.G. Bock and J. Longmore, Current Opinion in Chem. Biol., 4:401-406 (2000)]. Таким чином, існує потреба в нових сполуках, які є ефективними в блокуванні або оберненні активації рецепторів брадикініну. Такі сполуки були б корисними в 5 77058 6 ослабленні болю і запалення, а також в лікуванні галогеналкілу, де арил вибраний з фенілу, 3,43 або попередженні захворювань ; порушень, опосеметилендіоксифенілу і нафтилу; редкованих брадикініном; далі, такі сполуки є та(6) (СН2)k-гетероциклу, необов'язково заміщекож корисними як інструменти для досліджень (in ного 1-3 групами, незалежно вибраними з галогеvivo і in vitro). ну, нітро, ціано, ORa, SRa, С1-4алкілу і С1[Канадська опублікована заявка №2050769] 3галогеналкілу, де вказаний гетероцикл вибраний з описує сполуки формули: (а) 5-членного гетероароматичного кільця, що має гетероатом кільця, вибраний з N, О і S, і необов'язково має до 3 додаткових атомів азоту кільця, де вказане кільце є необов'язково бензоконденсованим; (Ь) 6-членного гетероароматичного кільця, що містить 1-3 атомів азоту кільця, і його оксидів, які є проміжними продуктами в одержанні анде вказане кільце є необов'язково бензоконденсотагоністів ангіотензину II. ваним; і (с) 5- або 6-членного неароматичного геДаний винахід пропонує похідні біфенілтероциклічного кільця, вибраного і тетрагідрофуциклоалканкарбоксаміду, які є антагоністами браранілу, 5-оксотетрагідрофуранілу, 2-оксо-2Ндикініну або його оберненими агоністами, фармапіранілу, 6-оксо-1,6-дигідропіридазинілу, цевтичні композиції, що містять такі сполуки, і (7) C(O)2Ra I способи застосування їх як терапевтичних агентів. (8) C(O)NRbRc; Даний винахід забезпечує сполуки формули І і R6a вибраний з їх фармацевтично прийнятні солі: (1) С1-8алкілу, необов'язково заміщеного 1-5 групами, незалежно вибраними з галогену, нітро, ціано, CORa, CO2Ra, C(O)NRbRc, ORa, OC(O)Ra, SRa, SO2Rd, S(O)Rd, NRbRc, NRbC(O)Ra, NRbSO2Rd, NRbCO2Ra, (2) С3-8циклоалкілу, (3) С2-8алкенілу, заміщеного CO2Ra, (4) галогену, (5) ціано, (6) нітро, де (7) NRbRc, R1 і R2 незалежно вибрані з (8) NRbC(O)Ra, (1) водню і b a (9) NR CO2R , (2) С1-4алкілу; b 3a (10) NR C(O)NRbRc, R вибраний з (11) NRbC(O)NRbCO2Ra, (1) водню і (12) NRbSO2Rd, (2) С1-4алкілу, необов'язково заміщеного 1-5 (13) CO2Ra, атомами галогену; 3b (14) CORa, R означає С1-4алкіл, необов'язково заміще(15) C(O)NRbRc, ний 1-5 атомами галогену; (16) C(O)NHORa, R4a і R4b незалежно вибрані з (17) C(=NORa)Ra, (1) водню, (18) C(=NORa)NRbRc, (2) галогену і (19) ORa, (3) С1-4алкілу, необов'язково заміщеного 1-4 a a (20) OC(O)Ra, групами, вибраними з галогену. OR , OC(O)R , (21) S(O)kRd, S(O)kRd, OS(O)2Rd i NR1R2, або 4a 4b (22) SO2NRbRc і R і R разом з атомом вуглецю, до якого во(23) необов'язково заміщеного гетероциклу, де ни обидва приєднані, утворюють екзоциклічний цей гетероцикл є 5-членним гетероароматичним метилен, необов'язково заміщений 1-2 групами, кільцем, яке має гетероатом кільця, вибраний з N, вибраними з С1-4алкілу, необов'язково заміщеного О і S, і необов'язково має до 3 додаткових атомів 1-5 атомами галогену і С1-4алкілокси; азоту кільця, 4,5-дигідрооксазолілом і 4,5-дигідроR5 вибраний з 1,2,4-оксадіазопілом, і де вказаний замісник є 1-3 (1) С1-6алкілу, необов'язково заміщеного 1-5 групами, незалежно вибраними з Смалкілу, необогрупами, незалежно вибраними з галогену, нітро, в'язково заміщеного 1-5 атомами галогену, ORa ціано, ORa, SRa, CORa, SO2Rd, CO2Ra, OC(O)Ra, b c b а b a b c або OC(O)Ra, NR R , NR C(O)R , NR C(O)2R , C(O)NR R , С3R6b і R6c незалежно вибрані з 8циклоалкілу, (1) водню і (2) С3-8циклоалкілу, необов'язково заміщеного (2) групи з R6a; зa умови, що не більше ніж 1-5-групами, незалежно вибраними з галогену, один з R6a, R6b і Rbc є гетероциклом; нітро, ціано і фенілу, 7a 7b R i R незалежно вибрані з (3) С3-6алкінілу, (1) водню, (4) С2-6алкенілу, необов'язково заміщеного гід(2) галогену, роксіетилом, (3) ціано, (5) (СН2)k-арилу, необов'язково заміщеного 1-3 (4) нітро, групами, незалежно вибраними з галогену, нітро, (5) ORa, ціано, ORa, SRa, C(O)2Ra, С1-4алкілу і С1(6) CO2Ra, 7 77058 8 (7) C(O)NRbRc, фоніл)оксиметил і т.п.; або R4a і R4b на одному і (8) С1-4алкілу, необов'язково заміщеного 1-5 тому ж атомі вуглецю, взяті разом, означають меатомами галогену, тилен. В одному варіанті формули І включаються (9) NRbRc, і сполуки, в яких один з R4a і R4b означає водень, а d (10) S(O)kR ; іншій вибраний з водню, галогену і С1-4алкілу, неa a R вибраний з обов'язково заміщеного групою, вибраною з OR , a d d 1 2 4a 4b (1) водню, C(O)2R , S(O)kR , OS(O)2R i NR R , або R і R (2) С1-4алкілу, необов'язково заміщеного 1-5 разом з атомом вуглецю, до якого вони обидва атомами галогену, приєднані, утворюють екзоциклічний метилен. В (3) фенілу, необов'язково заміщеного 1-3одному його підваріанті R4a і R4b, кожний, означагрупами, незалежно вибраними з галогену, ціано, ють водень; в іншому підваріанті R4a означає вонітро, ОН, С1-4алкілокси, С3-6циклоалкілу і С1день, a R4b вибраний з СН2-галогену, CH2-ORa, алкілу, необов'язково заміщений 1-5 атомами CH2OC(O)Ra, CH2S(O)kRd, CH2OS(O)2Rd і 4 1 2 галогену; CH2NR R ; в наступному підваріанті R4a означає (4) С3-6циклоалкілу, і водень, a R4b вибраний з гідроксиметилу, ацетило(5) піридилу, необов'язково заміщеного 1-3 ксиметилу, хлор метилу, (метансульфогрупами, незалежно вибраними з галогену і С1ніл)оксиметилу, (метилтіо)метилу і (диметиламіно)метилу. 4алкілу; Rb і Rc незалежно вибрані з Приклади R5 для сполук формули І включають (1) водню в себе метил, етил, н-пропіл, Ізопропіл, н-бутил, (2) С1-4алкілу, необов'язково заміщеного 1-5 втор-бутил, ізобутил, трет-бутил, 1-етилпропіл, групами, незалежно вибраними з галогену, аміно, 2,2-диметилпропіл, бромметил, хлорметил, дихмоно-С1-4алкіламіно, ді-С1-4алкіламіно і SO2Rd, лорметил, дифторметил, трифторметил, хлорди(3) (СН2)k-фенілу, необов'язково заміщеного 1фторметил, ціанометил, амінометил, ацетиламі3-групами, вибраними з галогену, ціано, нітро, ОН, нометил, диметиламінометил, гідроксиметил, С1-4алкілокси, С3-6циклоалкілу і С1-4алкілу. необометоксиметил, етоксиметил, метилсульфонілмев'язково заміщеного 1-5 атомами галогену, і тил, фенілтіометил, феноксиметил, 1-аміноетил. (4) С3-6циклоалкілу, або 1-ацетиламінометил, 1-імідазолілметил, третRb і Rc разом з атомом азоту, до якого вони бутоксикарбоніламінометил, 3приєднані, утворюють 4-, 5- або 6-членне кільце, піридилкарбонілметил, 1-хлоретил, 1,1що необов'язково містить додатковий гетероатом, дихлоретил, 2,2,2-трифторетил. пентафторетил, вибраний з N, О і S; або 2-метоксіетил, 2-фенілетил, 2-циклопентилетил, 2b c R і R разом з атомом азоту, до якого вони карбоксіетил, 2-метоксі-2-оксоетил, 2-нітроетил, приєднані, утворюють циклічний імід; 1,1-дифтор-1-гідроксипропіл, 1-гідроксипропіл, 2Rd вибраний з оксопропіл, 3-метоксі-3-оксопропіл, 1(1) С1-4алкілу, необов'язково заміщеного 1-5 ціаноциклопропіл, циклопропіл, циклопентил, 2атомами галогену, фенілциклопропіл, аліл, етеніл, 1-(1(2) С1-4алкілокси, і гідроксіетил)вініл, 3-бутиніл. пропаргіл, феніл, бе(3) фенілу, необов'язково заміщеного 1-3нзил, 3,5-біс(трифторметил)феніл, 2,4групами, незалежно вибраними з галогену, ціано, дифторфеніл, 4-метилфеніл, 3,4нітро, ОН, С1-4алкілокси, С3-6циклоалкілу і С1диметоксибензил, 3,4-диметоксифеніл, 4ціанофеніл, 3-нітрофеніл. 2-нафтил, 3,44алкілу. необов'язково заміщений 1-5 атомами галогену; метилендіоксифеніл, 3-ціанофеніл, 2-ціанофеніл, k дорівнює 0, 1 або 2; і 3-фторфеніл, 3-метоксифеніл, 3-хлорфеніл, 3,4m дорівнює 0 або 1. дихлорфеніл, 3,5-диметоксифеніл, 3Для сполук формули І, приклади R1 і R2 вклютрифторметилфеніл, 3-метилфеніл, 3,5чають в себе водень, метил. етил, н-пропіл, ізопдихлорфеніл, 2-гідроксифеніл, 3-гідроксифеніл, 3ропіл, н-бутил, трет-бутил, ізобутил і втор-бутил. В нітро-5-(трифторметил)феніл, 5-ізоксазоліл, 2одному варіанті формули І включаються сполуки, бензотієніл, 2-тієнілметил, 3-піридил, 4-піридил, 2в яких R1 і R2, кожний, є воднем. фурил, 3-фурил, 2-тієніл, 3-тієніл, 5-метил-3Приклади R3a і R3b для сполук формули І ізоксазоліл, 3-тетрагідрофураніл, 4-метил-1,2, 5включають в себе водень, метил. етил, н-пропіл, оксадіазол-3-іл, 5-карбокси-3-піридил, 6-гідрокси-2ізопропіл, н-бутил, трет-бутил, ізобутил, вторпіридил, 5-гідрокси-3-піридил, 2-гідрокси-3бутил, хлорметил, фторметил, трифторметил, піридил, 2-метокси-3-піридил, 6-хлор-2-піридил, 22,2,2-трифторетил, 2,2-дифторетил, 1,1,2,2,2хлор-3-піридил, 5-хлор-3-піридил, 5-фтор-3пентафторетил і т.п. В одному варіанті формули І піридил, 5-бром-3-піридил, 5-метил-3-піридил, 3включаються сполуки, в яких один з R3a означає (трифторметил)-4-піридил, 5-(трифторметил)-3водень, a R3b означає С1-4алкіл. В одному його піридил, 1-метил-4-піразоліл, 1-піразолілметил, 1підваріанті R3b означає метил. метил-2-імідазоліл, 1,2,4-триазол-1-ілметил, 44а 4b Приклади R і R для сполук формули І тіазоліл, 5-оксотетрагідрофуран-2-іл, 2-оксо-5включають в себе водень, метил. етил, н-пропіл, піраніл, 3-ізоксазоліл, 3-піридазиніл, 5-піримідиніл, ізопропіл, н-бутил, втор-бутил, ізобутил, трет4-піримідиніл, 1-метил-5-піразоліл, 1-метил-3бутил, хлор, фтор, бром, хлорметил, 1-хлоретил, піразоліл, 5-тіазоліл, 5-метил-1-піразолілметил, (3гідроксиметил, 2-метоксіетил, етоксиметил, ацеметил-1,2,4-триазол-5-іл)метил, 2-(1,2,4-триазолтилоксиметил, метилтіометил, амінометил, мети1-іл)етил, 5-метил-4-тіазоліл, 2-хіноксалініл. метоламінометил, (диметиламіно)метил, (метилсульксикарбоніл, амінокарбоніл, метиламінокарбоніл, 9 77058 10 диметиламінокарбоніл, 2ізоксазолілу, 5-піримідинілу, 5-бром-3-піридилу і (диметиламіно)етиламінокарбоніл, бензиламінойого N-оксиду і 5-трифторметил-3-піридилу. карбоніл, 2-фенетиламінокарбоніл. Для сполук формули І R6a включає в себе 1В одному варіанті формули І включаються метилетил, 1-гідроксіетил, метоксиметил, 2-оксо-2сполуки, в яких R5 означає С1-6алкіл, необов'язкометоксіетил, карбокси, метоксикарбоніл, етоксикаво заміщений 1-5 групами, незалежно вибраними з рбоніл, ізопропоксикарбоніл, феноксикарбоніл, галогену. нітро, ціано, ORa, SRa, CORa, SO2Rd, циклопентоксикарбоніл, циклобутоксикарбоніл, CO2Ra, OC(O)Ra, NRbRc, NRbC(O)Ra, NRbCO2Ra, циклопропоксикарбоніл, 2,2,2C(O)NRbRc, С3-8циклоалкілу. В одному його підватрифторетоксикарбоніл, 4ріанті включаються сполуки, в яких R5 означає С1трифторметилфеноксикарбоніл, метоксіамінокарбоніл, метоксикарбонілметил, форміл, гідрокси, 35алкіл, необов'язково заміщений 1-5 групами. незалежно вибраними з галогену, нітро, ціано, ORa, метил-1,2,4-оксадіазол-5-іл, 5-метил-1,2,4SRa, CO2Ra і С3-8циклоалкілу. В іншому його підваоксадіазол-3-іл, 1-метил-5-тетразоліл, 2-метил-5ріанті включаються сполуки, а яких R5 вибраний з тетразоліл, ціано, гідрокси, метокси, дифторметоС1-5алкілу і С1-3алкілу, заміщених 1-5 групами, вибкси, трифторметокси, трифторметил, хлор, фтор, раними з галогену, ціано, гідрокси. С1-4алкокси і С1метиламіносульфоніл, диметиламіносульфоніл, 5 метоксикарбоніламіно, етоксикарбоніламіно, 24алкоксикарбонілу. В наступному підваріанті R вибраний з С1-Залкілу, заміщеного 1-5 атомами фторетоксикарбоніламіно, ізопропоксикарбонілагалогену або групою, вибраною з ціано, гідрокси, міно, метиламінокарбоніламіно, диметиламіно, С1-4алкокси і С1-4алкоксикарбонілу. метиламінокарбоніл, ізопропіламінокарбоніл, етиВ іншому варіанті формули І включаються ламінокарбоніл, циклопропіламінокарбоніл, циклосполуки, в яких R5 означає С1-6циклоалкіл, необобутиламінокарбоніл, диметиламінокарбоніл і амів'язково заміщений 1-3-групами, незалежно вибнокарбоніл; приклади для R6b для сполук формули раними з галогену, нітро, ціано і фенілу. В одному І включають в себе водень, хлор, фтор, метил і підваріанті R5 означає С3-6циклоалкіл, необов'язметоксикарбоніл; приклади для R6с включають в ково заміщений групою, вибраною з ціано і фенілу. себе водень, хлор, фтор і метил; і приклади R7а і В іншому варіанті формули І включаються R7b включають в себе водень, гідрокси, метокси, сполуки, в яких R5 означає (СН2)k-арил, необов'язметиламіно, метилсульфоніл, хлор і фтор. ково заміщений 1-3 групами, незалежно вибраниВ іншому варіанті формули І включаються вами з галогену. нітро, ціано, ORa, SRa, С1-4алкілу і ріанти, в яких m дорівнює 0. С1-3галогеналкілу, де арил вибраний з фенілу. 3,4В іншому варіанті формули І включаються метилендіоксифенілу і нафтилу. В одному його сполуки, представлені формулою 1 (1): 5 підваріанті R означає феніл, необов'язково заміщений 1-3 групами, незалежно вибраними з галогену. трифторметилу, нітро, ціано, С1-4алкокси і С15 4алкілу; в іншому підваріанті R означає феніл, необов'язково заміщений 1-2 групами, вибраними з метилу. трифторметилу, галогену, ціано, нітро і метокси. В іншому варіанті формули І включаються сполуки, в яких R5 означає (СН2)k-гетероцикл, необов'язково заміщений 1-2 групами, незалежно де m, R1, R2, R3a, R3b, R4a, R4b, R5, R6a, R6b, R6c і вибраними з галогену, нітро, ціано, ORa, SRa, С1R7a мають визначення, наведені під формулою І. 4алкілу і С1-3галогеналкілу, де вказаний гетероцикл У підваріанті формули І (1) включаються сповибраний з ізоксазолілу, тієнілу, піридинілу, бензолуки, в яких R6a вибраний з (1) CO2Ra, (2) тієнілу, фурилу, тетрагідрофуранілу, оксадіазоліC(O)NHORa, (3) ціано, (4) галогену, (5) ORa, (6) С1лу, 1-оксидопіридинілу, піразолілу, імідазолілу, 8алкілу, необов'язково заміщеного 1-5 атомами 1,2,4-триазолілу, тіазолілу, 5галогену або групою, вибраною з CO2Ra, оксотетрагідрофуранілу, 2-оксо-2Н-піранілу, 6C(O)NRbRc і ORa, (7) C(O)NRbRc, (8) оксо-1,6-дигідропіридазинілу, оксазолілу, піридаNRbC(O)NRbRc, (9) NRbC(O)ORa і (10) необов'язкозинілу, піримідинілу і хіноксалінілу. В одному його во заміщеного гетероциклу, де цей гетероцикл підваріанті R5 вибраний з ізоксазолілу, необов'язвибраний з оксадіазолілу і тетразолілу і де вказаково заміщеного 1 або 2 групами С1-4алкілу, тієніний замісник є 1-3 групами, незалежно вибраними лу, піридинілу, необов'язково заміщеного гідрокси, з С1-4алкілу, необов'язково заміщеного 1-5 атоматрифторметилом або галогеном, бензотієнілу, фуми галогену, ORa або OC(O)Ra. В іншому підваріарилу, тетрагідрофуранілу, оксадіазолілу, необов'янті включаються сполуки, в яких R6a вибраний з зково заміщеним С1-4алкілом, 1-оксидопіридинілу. CO2Ra, C(O)NHORa, метилтетразолілу, метилоксанеобов'язково заміщеного галогеном або С1діазолілу, NRbC(O)NRbRc і NRbC(O)ORa. 4алкілом, піразолілу, необов'язково заміщеного С1В іншому підваріанті формули І (1) включають4алкілом, імідазолілу, необов'язково заміщеного ся сполуки, в яких R6b вибраний з водню, галогену С1-4алкілом, 1,2,4-триазолілу, необов'язково заміі CO2Ra. У наступному підваріанті R6b означає вощеного С1-4алкілом, тіазолілу, необов'язково замідень або галоген. щеного С1-4алкілом, 5-оксотетрагідрофуранілу, 2В іншому підваріанті формули І (1) включаютьоксо-2Н-піранілу, 6-оксо-1,6-дигідропіридазинілу, ся сполуки, в яких R6a вибраний з (1) CO2Ra, (2) оксазолілу, піридазинілу, піримідинілу і хіноксаліC(O)NHORa, (3) ціано, (4) галогену, (5) ORa, (6) С1нілу. В іншому підваріанті R5 вибраний з 58алкілу, необов'язково заміщеного 1-5 атомами 11 77058 12 галогену або групою, вибраною з CO2Ra, C(O)NRbRc і ORa, (7) C(O)NRbRc, (8) NRbC (O) NRbRc, (9) NRbC(O)ORa і (10) необов'язково заміщеного гетероциклу, де цей гетероцикл вибраний з оксадіазолілу і тетразолілу і де вказаний замісник є 1-3 групами, незалежно вибраними з С14алкілу, необов'язково заміщеного 1-5 атомами галогену, ORa або OC(O)Ra; R6b вибраний з водню де m дорівнює 0 або 1, R6a означає 2-метилі галогену і R6c означає водень. 2Н-тетразол-5-іл, 3-метил-1,2,4-оксадіазол-5-іл, В іншому підваріанті формули І (1) включаютьCO2Ra або C(O)NHORa, де Ra означає С1-4алкіл, ся сполуки, в яких R5 вибраний з С1-4алкілу, незокрема, метил; R6b означає водень, фтор або обов'язково заміщеного 1-5 атомами галогену або хлор; R3b означає С1-4алкіл, зокрема, метил; R5 ціаногрупою, С3-6циклоалкілу, ізоксазолілу, піримівибраний з С1-4алкілу, необов'язково заміщеного динілу і піридинілу (і його N-оксиду), необов'язково 1-5 атомами галогену або ціаногрупою, С3заміщеного галогеном. 6циклоалкілу, ізоксазолілу, піримідинілу і піридиніВ іншому варіанті формули І включаються лу (і його N-оксиду), необов'язково заміщеного сполуки, представлені формулою І (2): галогеном або трифторметилом, зокрема. трифторметилом, дифторметилом, хлордифторметилом, 2,2,2-трифторетилом. пентафторметилом, ціанометилом, 5-піримідинілом, 5-ізоксазолілом і 5-бром-3-піридинілом і його N-оксидом; і R7a означає водень або фтор. Деякими репрезентативними сполуками є де m, R3b, R5, R6a, R6b, R6c i R7a мають визначення, наведені під формулою І. В одному варіанті формули І (2) R3b означає метил. В іншому варіанті формули І (2) R6b означає водень або галоген. В одному підваріанті R6b 6b означає водень; в іншому підваріанті R означає фтор або хлор. В іншому варіанті формули І (2) R6a вибраний з (1) CO2Ra, (2) C(O)NHORa, (3) ціано, (4) галогену, (5) ORa, (6) С1-4алкілу, необов'язково заміщеного 15 атомами галогену або групою, вибраною з CO2Ra, C(O)NRbRc і ORa, (7) C(O)NRbRc, (8) NRbC(O)NRbRc, (9) NRbC(O)ORa і (10) необов'язково заміщеного гетероциклу, де цей гетероцикл вибраний з оксадіазолілу і тетразолілу і де вказаний замісник є 1-3 групами, незалежно вибраними з С1-4алкілу, необов'язково заміщеного 1-5 атомами галогену, ORa або OC(O)Ra. В одному підваріанті R6a вибраний з CO2Rа, C(O)NHORa, метилтетразолілу, метилоксадіазолілу, NRbC(O)NRbRc і NRbC(O)ORa. В іншому підваріанті R6a вибраний з CO2R3, метилтетразолілу і метилоксадіазолілу. В іншому варіанті формули І (2) R6c означає водень або галоген. В одному підваріанті R6c означає водень. В іншому варіанті R7a означає водень або галоген. В одному підваріанті R7a означає водень. В іншому підваріанті R7 означає фтор. Ще в одному підваріанті R6b означає водень, фтор або хлор, a R7a означає водень або фтор. В іншому варіанті формули І (2) R5 вибраний з С1-4алкілу, необов'язково заміщеного 1-5 атомами галогену або ціаногрупою, С3-6циклоалкілу, ізоксазолілу, піримідинілуі піридинілу (і його N-оксиду), необов'язково заміщеного галогеном. В іншому варіанті формули І включаються сполуки формули І (3): 13 77058 14 ніл, алкініл і т.п., означає вуглецеві ланцюги, які можуть бути лінійними або розгалуженими або їх комбінаціями. Приклади алкільних груп включають в себе метил, етил, пропіл, ізопропіл, бутил, втор- і трет-бутил, пентил, гексил, гептил і т.п. «Алкеніл» означає лінійний або розгалужений вуглецевий ланцюг, що містить щонайменше один зв'язок С=С. Приклади алкенілу включають в себе аліл, 2-бутеніл, 3-бутеніл, 1-метил-2-пропеніл і т.п. «Алкініл» означає лінійний або розгалужений вуглецевий ланцюг, що містить щонайменше один зв'язок С=С. Приклади алкінілу включають в себе пропаргіл, 2-бутиніл, 3-бутиніл, 1-метил-2-пропініл і т.п. «Циклічний імід» включає в себе сукцинімід, малеїмід, фталімід і т.п. «Циклоалкіл» означає карбоцикли, що не містять гетероатомів, і включає в себе моно-, бі- і трициклічні насичені карбоцикли, а також конденсовані циклічні системи. Такі конденсовані циклічні системи можуть включати в себе одне кільце, яке є частково або повністю ненасиченим, таке як бензольне кільце, з утворенням конденсованих циклічних систем, таких як бензоконденсовані карбоцикли. Циклоалкіл включає в себе такі конденсовані циклічні системи, як спіроконденсовані циклічні системи. Приклади циклоалкілу включають в себе циклопропіл, циклобутил, циклопентил, циклогексил, декагідронафталін, адамантин, інданіл, інденіл, флуореніл, 1,2,3,4-тетрагідронафталін і т.п. «Галогеналкіл» означає алкільний радикал, визначений вище, в якому щонайменше один або навіть всі атоми водню замінені галогеном. Приклади таких галогеналкільних радикалів включають в себе хлорметил, 1-брометил, фторметил, дифторметил, трифторметил, 2,2,2-трифторетил і т.п. «Галоген» означає фтор, хлор, бром і йод. Термін «необов'язково заміщені» включає як заміщені, так і незаміщені групи. Так, наприклад, необов'язково заміщений арил міг би являти собою пентафторфенільне або фенільне кільце. Оптичні ізомери - діастереомери - геометричні ізомери - таутомери Описані тут сполуки можуть містити асиметричний центр і, отже, можуть існувати у вигляді енантіомерів. Якщо сполуки даного винаходу мають два або більше асиметричних центрів, вони можуть, крім того, існувати у вигляді діастереомерів. Даний винахід включає в себе все такі можливі стереоізомери у вигляді по суті чистих розділених енантіомерів, їх рацемічні суміші, а також суміші діастереомерів. Наведена вище формула І показана без певної стереохімії в певних положеннях. Даний винахід включає в себе всі стереоізомери формули І і їх фармацевтично прийнятні солі. Пари діастереоізомерів енантіомерів можуть бути розділені, наприклад, фракціонованою (дробовою) кристалізацією з відповідного розчинника і одержана таким чином пара енантіомерів може бути розділена на індивідуальні стереоізомери загальноприйнятими способами, наприклад, за допомосимвол параграфа =R3a означає СН3 гою оптично активних кислоти або основи як розЯкщо немає іншої вказівки, наступні терміни діляючий агент або на хіральній колонці ВЕРХ. мають вказані нижче значення: Далі, будь-який енантіомер або діастереомер спо«Алкіл», а також інші групи, що мають префікс луки загальної формули І може бути одержаний «алк», такі як. наприклад. алкокси, алканоїл, алкестереоспецифічним синтезом з використанням 15 77058 16 оптично чистих вихідних речовин або реагентів себе лікування різних описаних станів конкретно відомої конфігурації. описаною сполукою або сполукою, яка може не Деякі з описаних тут сполук містять олефінові бути конкретно описаною, але буде перетворюваподвійні зв'язки, і, якщо немає інших вказівок, петись в цю вказану сполуку in vivo після введення редбачається, що вони включають в себе геометпацієнту. Загальноприйняті процедури для вибору ричні ізомери як Е, так і Z. і одержання відповідних похідних-проліків описані, Деякі з описаних тут сполук можуть існувати з наприклад, в "Design of Prodrugs," ed. H. різними точками приєднання водню, у вигляді споBundgaard, Elsevier, 1985. Метаболіти цих сполук лук, названих таутомерами. Таким прикладом мовключають в себе активні різновиди молекул, проже бути кетон і його енольна форма, відомі як кедуковані після введення сполук даного винаходу в то-енольні таутомери. біологічне середовище. Індивідуальні таутомери, а також їх суміші Фармацевтичні композиції включені в сполуки формули І. Інший аспект даного винаходу забезпечує фаСолі рмацевтичні композиції, які містять сполуки форТермін «фармацевтично прийнятні солі» відмули І і фармацевтично прийнятний носій. Термін носиться до солей, одержаних з фармацевтично «композиція», наприклад, у виразі фармацевтична прийнятних нетоксичних основ або кислот. Коли композиція, призначений для включення в нього сполука даного винаходу є кислотною, її відповідпродукту, що містить активний інгредієнт (інгредієна сіль може бути зручним чином одержана з фанти) та інертний інгредієнт (інгредієнти) (фармацермацевтично прийнятних нетоксичних основ, в втично прийнятні ексципієнти), які утворюють нотому числі неорганічних основ і органічних основ. сій, а також будь-який продукт, який походить, Солі, одержані з таких неорганічних основ, вклюпрямо або опосередковано, з комбінації, комплекчають в себе солі амонію, кальцію, міді (двоваленсоутворення або агрегації будь-яких двох або бітної і одновалентної), заліза (тривалентного і двольше з цих інгредієнтів, або з дисоціації одного валентного), літію, магнію, марганцю або більше з цих інгредієнтів, або з інших типів (тривалентного і двовалентного), калію. натрію, реакцій або взаємодій одного або більше з цих цинку і т.п. Переважними є солі амонію, кальцію, інгредієнтів. Таким чином, фармацевтичні компомагнію, калію і натрію. зиції даного винаходу включають в себе будь-яку Солі, одержані з фармацевтично прийнятних композицію, приготовану змішуванням сполуки органічних нетоксичних основ, включають в себе формули І, додаткових активних інгредієнта або солі первинного, вторинного і третинного амінів, інгредієнтів і фармацевтично прийнятних наповодержані як з тих, що природно зустрічаються, так нювачів. і синтетичних джерел. Фармацевтично прийнятні Фармацевтичні композиції даного винаходу міорганічні нетоксичні основи, з яких можуть бути стять сполуку, представлена формулою І (або її утворені солі. включають в себе, наприклад, аргіфармацевтичні солі), як активний інгредієнт, фарнін, бетаїн, кофеїн, холін, N,N'мацевтично прийнятний носій і необов'язково інші дибензилетилендіамін, діетиламін, 2терапевтичні інгредієнти або ад'юванти. Ці комподіетиламіноетанол, 2-диметиламіноетанол. етанозиції включають в себе композиції, придатні для ламін, етилендіамін, N-етилморфолін, Nперорального, ректального, місцевого і парентеетилпіперидин, глюкамін, глюкозамін, гістидин, рального (в тому числі підшкірного, внутрішньом'ягідрабамін, ізопропіламін, дициклогексиламін, лізового і внутрішньовенного) введення, хоча найзин, метилглюкамін, морфолін, піперазин, піперибільш відповідний спосіб в кожному конкретному дин, поліамінові смоли, прокаїн, пурини, теобровипадку буде залежати від конкретного хазяїна і мін, триетиламін, триметиламін, трипропіламін, від природи і тяжкості станів, для яких вводять цей трометамін і т.п. активний інгредієнт. Фармацевтичні композиції Коли сполука даного винаходу є основною, її можуть бути представлені для зручності у вигляді відповідна сіль може бути зручним чином одержауніфікованої (стандартної) дозованої форми і мона з фармацевтично прийнятних нетоксичних нежуть бути приготовані будь-яким зі способів, добре органічних і органічних кислот. Такі кислоти вклювідомих в галузі фармації. чають в себе, наприклад, оцтову. На практиці, сполуки, представлені формулою бензолсульфонову, бензойну, камфорсульфонову, І, або їх фармацевтично прийнятні солі даного лимонну, етансульфонову, фумарову, глюконову, винаходу можуть комбінуватись як активний інгреглутамінову, бромистоводневу, хлористоводневу. дієнт в однорідній суміші з фармацевтичним носіізетіонову, молочну, малеїнову, яблучну, мигдалеєм відповідно до загальноприйнятих способів ву, метансульфонову, слизову. азотну, памову, складання фармацевтичних продуктів. Носій може пантотенову, фосфорну, янтарну, сірчану, винну, приймати велику різноманітність форм в залежноп-толуолсульфонову кислоту і т.п. Переважними є сті від форми препарату, бажаного для введення, лимонна, бромистоводнева, хлористоводнева, наприклад, перорального або парентерального (в малеїнова, фосфорна, сірчана і винна кислоти. тому числі внутрішньовенного). Так, фармацевтиПроліки чні композиції даного винаходу можуть бути предВ об'єм даного винаходу включені проліки ставлені у вигляді дискретних одиниць, відповідсполук даного винаходу. У загальному, такі проліних для перорального введення, таких як капсули, ки будуть функціональними похідними сполук дакрохмальні облатки або таблетки, кожна з яких ного винаходу, які in vivo легко перетворюються в містить заздалегідь визначену кількість активного необхідну сполуку. Таким чином, в способах даноінгредієнта. Далі, ці композиції можуть бути предго винаходу термін "введення" буде включати в ставлені у вигляді порошку, у вигляді гранул, у 17 77058 18 вигляді розчину, у вигляді суспензії у водній рідині, формах таблетки можуть бути приготовані формуу вигляді неводної рідини, у вигляді емульсії типу ванням у відповідній машині суміші порошкоподібмасло-у-воді або у вигляді емульсії типу вода-вної сполуки, зволоженій інертним рідким розріджумаслі. Крім звичайних дозованих форм. описаних вачем. Кожна таблетка переважно містить вище, сполука, представлена формулою І, або її приблизно 0,1мг - приблизно 500мг активного інгфармацевтично прийнятна сіль, можуть також редієнта і кожна крохмальна облатка або капсула вводитись з використанням засобу регульованого містить приблизно 0,1мг - приблизно 500мг активвивільнення і/або засобів доставки. Ці композиції ного інгредієнта. можуть бути приготовані будь-яким зі способів Фармацевтичні композиції даного винаходу, відомих у фармації. Звичайно такі способи вклюпридатні для парентерального введення, можуть чають в себе стадію приведення в контакт активбути приготовані у вигляді розчинів або суспензій ного інгредієнта з носієм, який містить один або активних сполук у воді. Може бути включена повебільше необхідних інгредієнтів. Звичайно ці компорхнево-активна речовина, така як, наприклад, гідзиції готують однорідним і тонким змішуванням роксипропілцелюлоза. Можуть бути також пригоактивного інгредієнта з рідкими носіями або тонко товані дисперсії в гліцерині, рідких подрібненими твердими носіями або і тими, й інполіетиленгліколях і їх сумішах в маслах. Далі, шими. Потім цей продукт може бути сформований може бути включений консервант для запобігання в зручну форму для бажаної доставки. шкідливому росту мікроорганізмів. Таким чином, фармацевтичні композиції даноФармацевтичні композиції даного винаходу, го винаходу можуть включати в себе фармацевтипридатні для використання як ін'єкції, включають в чно прийнятний носій і сполуку або фармацевтичсебе стерильні водні розчини або дисперсії. Крім ну сіль формули І. Сполуки формули І або їх того, ці композиції можуть бути у формі стерильфармацевтично прийнятні солі можуть бути також них порошків для незапланованого приготування включені у фармацевтичні композиції в комбінації таких стерильних ін'єкційних розчинів або дисперз одним або більше іншими терапевтично активсій. У всіх випадках кінцева ін'єктована форма поними сполуками. винна бути стерильною і повинна бути досить рідФармацевтичний носій, що використовується, кою для легкого введення за допомогою шприца. може бути, наприклад, твердою речовиною, рідиЦі фармацевтичні композиції повинні бути стабіною або газом. Приклади твердих носіїв включальними в умовах приготування і зберігання; таким ють в себе лактозу, гіпс (сульфат кальцію), сахачином, вони повинні переважно оберігатись проти розу, тальк, желатин, агар, пектин, аравійська забруднюючої дії мікроорганізмів, таких як бактерії камедь, стеарат магнію і стеаринову кислоту. Приі гриби. Носієм може бути розчинник або дисперкладами рідких носіїв є цукровий сироп, арахісове гуюче середовище, що містять, наприклад, воду, масло, оливкова олія і вода. Приклади газоподібетанол, поліол (наприклад, гліцерин, пропіленгліних носіїв включають в себе діоксид вуглецю і коль і рідкий поліетиленгліколь), олії і їх відповідні азот. суміші. У приготуванні композицій для пероральної Фармацевтичні композиції даного винаходу дозованої форми можуть бути використані будь-які можуть бути у формі, придатній для місцевого вивідповідні фармацевтичні середовища. Наприкористання, такій як, наприклад, аерозоль, крем, клад, вода, гліколі, масла, спирти, ароматизатори, мазь, лосьйон, обпудрювальний засіб або т.п. Даконсерванти, фарбувальні агенти і т.п. можуть лі, ці композиції можуть бути у формі, придатній бути використані для утворення пероральних ріддля використання в трансдермальних пристосуких препаратів, таких як суспензії, еліксири і розваннях. Ці форми можуть бути приготовані з викочини; тоді як такі носії, як крохмаль, цукор. мікрокристанням сполуки, представленої формулою І ристалічна целюлоза, розріджувачі, гранулюючі даного винаходу, або її фармацевтично прийнятагенти, змащувальні речовини, зв'язувальні речоної солі, за допомогою загальноприйнятих техновини, дезінтегруючі агенти і т.п. можуть бути викологічних способів. Як приклад, крем або мазь гористані для утворення пероральних твердих претують змішуванням гідрофільного матеріалу і паратів, таких як порошки, капсули і таблетки. води, разом з приблизно 5мас.% - приблизно Внаслідок легкості їх приготування таблетки і кап10мас.% сполуки, з одержанням крему або мазі, сули є переважними пероральними дозованими що має бажану консистенцію. одиницями, що використовують тверді фармацевФармацевтичні композиції даного винаходу тичні носії. Таблетки, необов'язково, можуть бути можуть бути у формі, придатній для ректального покриті покриттям з використанням стандартних введення, в якій носій є твердою речовиною. Певодних або неводних способів. реважно, ця суміш утворює супозиторії, що містять Таблетка, що містить композицію даного винауніфіковану дозу для одноразового застосування. ходу, може бути приготована пресуванням або Відповідні носії включають в себе масло-какао та формуванням, необов'язково з одним або декільінші матеріали, що звичайно використовуються в кома допоміжними інгредієнтами або ад'ювантами. даній галузі. Супозиторії можуть бути зручним чиПресовані таблетки можуть бути приготовані преном приготовані змішуванням спочатку композиції суванням у відповідній таблетувальній машині з розм'якшеним або розплавленим носієм (носіяактивного інгредієнта у вільно текучій формі, такій ми) з подальшим охолоджуванням і формуванням як порошок або гранули, необов'язково змішаного у формах. зі зв'язувальною речовиною, змащувальною речоКрім вищезгаданих інгредієнтів-носіїв, описані виною, інертним розріджувачем, поверхневовище фармацевтичні форми можуть включати в активним або диспергуючим агентом. Відлиті у себе, по мірі необхідності, один або більше додат 19 77058 20 кових інгредієнтів-носіїв, таких як розріджувачі, пов'язаних із захворюванням дихальних шляхів, буфери, ароматизуючі агенти. зв'язувальні речонаприклад, астма, в тому числі алергічної астми вини, поверхнево-активні агенти, загусники, зма(атопічної або не-атопічної), а також індукованого щувальні агенти, консерванти (в тому числі антиофізичним навантаженням бронхостенозу, профексиданти) і т.п. Крім того, можуть бути включені сійної астми, вірусного або бактеріального загостінші ад'юванти для придання формі ізотонічності з рення астми, інших не алергічних типів астми і кров'ю передбачуваного реципієнта. Композиції, «синдрому стерторозного дихання немовлят». що містять сполуку, описану формулою І, або її Сполуки даного винаходу можуть бути також викофармацевтично прийнятні солі, можуть бути також ристані для лікування хронічної обструктивної хвоприготовані у формі порошкоподібного або рідкого роби легень, в тому числі емфіземи, респіраторноконцентрату. го дистрес-синдрому дорослих, бронхіту, Далі наводяться приклади показних дозованих пневмонії, алергічного риніту (сезонного і такого, форм для сполук формули І що триває круглий рік) і вазомоторного риніту. ВоСуспензія для ін'єкцій (І.М.) мг/мл ни можуть бути також ефективними проти пневмоСполука формули І 10 коніозу, в тому числі алюмінозу, антракозу, асбесМетилцелюлоза 5,0 тозу, халікозу, птилозу, сидерозу, силікозу, Твін 80 0,5 табакозу і біссиноз). Бензиловий спирт 9,0 Сполуки даного винаходу можуть бути також Хлорид бензалконію 1,0 використані для лікування запального захворюВода для ін'єкцій до загального об’єму 1мл вання травного тракту, в тому числі хвороби Крона Таблетка мг/таблетка і виразкового коліту, синдрому подразненого травСполука формули І 25 ного тракту, панкреатиту, циститу (інтерсцитіальМікрокристалічна целюлоза 415 ного циститу), увеїту, запальних захворювань шкіПовідон 14,0 ри, таких як псоріаз і екзема, ревматоїдного Переджелатинований крохмаль 43,5 артриту і набряку, що виникає з травми, пов'язаної Стеарат магнію 2,5 з опіками, розтягненням або переломом, набряку 500 головного мозку і ангіоневротичного набряку (хвоКапсула мг/капсула роби Квінке). Вони можуть бути використані для Сполука формули І 25 лікування діабетичної васкулопатії, діабетичної Порошок лактози 573,5 невропатії, діабетичної ретинопатії, посткапілярної Стеарат магнію 1,5 резистентності або діабетичних синдромів, пов'я600 заних з інсулітом (наприклад, гіперглікемії, діурезу, Застосовність протеїнурії і збільшеної екскреції з сечею нітритів і Сполуки даного винаходу є антагоністами або калікреїну). Вони можуть бути використані як релаоберненими агоністами рецептора брадикініну, ксантів гладких м'язів для лікування спазму шлунзокрема, рецептора брадикініну В1, і як такі є заково-кишкового тракту або матки. Крім того, вони стосовними в лікуванні і попередженні захворюможуть бути ефективними проти захворювання вань і станів, опосередкованих рецептором брадипечінки, розсіяного склерозу, серцево-судинного кініну, таких як біль і запалення. Ці сполуки можуть захворювання, наприклад, атеросклерозу, застійбути ефективними в лікуванні або попередженні ної серцевої недостатності, інфаркту міокарда; болю, в тому числі, наприклад. вісцерального бонейродегенеративних захворювань, наприклад, лю (такого як панкреатит, інтерсцитіальний цистит, хвороби Паркінсона і хвороби Альцгеймера, епіниркоподібна колька), невропатичного болю (таколепсії, септичного шоку, наприклад, як антигіпового як постгерпетична невралгія, пошкодження нерлемічних і/або антигіпотензивних агентів. головнова, «динії», наприклад, вульводинія, фантомний го болю, в тому числі гемікранії, мігрені, в тому біль кінцівок, кореневі авульсії, хвороблива травчислі при профілактичному і невідкладному викоматична мононевропатія, хвороблива поліневрористанні, закритої травми голови, раку, сепсису, патія), больові синдроми центральної нервової гінгивіту, остеопорозу, доброякісної гіперплазії системи (що потенційно викликаються фактично передміхурової залози і гіперактивного сечового будь-яким пошкодженням на будь-якому рівні нерміхура. Моделі цих захворювань і станів на тваривової системи) і післяхірургічні больові синдроми нах є добре відомими в даній галузі і можуть бути (наприклад, синдром постмастектомії, синдром придатними для оцінки сполук даного винаходу на постторакоектомії, ампутаційний біль), кісткового і їх потенційну застосовність. Нарешті, сполуки дасуглобового болю (остеоартрит), періодичного ного" винаходу можуть бути також застосовні як болю при руху, зубному болю, болю при раку, міінструменти досліджень (in vivo і in vitro). офасціального болю (при м'язовому пошкодженні, Сполуки даного винаходу застосовні в лікуфіброміалгії), періопераційному болю (при загальванні болю і запалення введенням таблетки, кроній хірургії, гінекологічній хірургії). хронічного бохмальної облатки або капсули, кожна з яких міслю, дисменореї, а також болю, пов'язаного зі стетить, наприклад, 0,1мг, 0,5мг, 1мг, 3мг, 5мг, 10мг, нокардією, і запального болю різних органів 25мг, 50мг, 100мг, 125мг, 250мг або 500мг сполуки (наприклад, при остеоартриті, ревматоїдному артданого винаходу один раз кожні три-чотири годириті, ревматичному захворюванні, тендосиновіті і ни, один раз. два рази або три рази на день або (у подагрі). вигляді форми пролонгованого вивільнення) один Далі, сполуки даного винаходу можуть бути раз, два рази або три рази на тиждень. також використані для лікування гіперреактивних Ці сполуки могли б бути ефективними в лікудихальних шляхів і для лікування запальних подій, ванні або попередженні болю, в тому числі, напри 21 77058 22 клад, кісткового і суглобового болю (остеоартрипролонгованого вивільнення) один раз, два рази ту), періодичного болю при руху, зубного болю, або три рази на тиждень. болю при раку, міофасціального болю (при м'язоВони можуть бути використані для лікування вому пошкодженні, фіброміалгії), періопераційного запальних порушень шкіри. таких як псоріаз і екболю (при загальній хірургії, гінекологічній хірургії) зема, введенням таблетки, крохмальної облатки і хронічного болю, введенням таблетки. крохмальабо капсули. кожна з яких містить, наприклад, ної облатки або капсули, кожна з яких містить, на0,1мг, 0,5мг, 1мг, 3мг, 5мг, 10мг, 25мг, 50мг, 100мг, приклад, 0,1мг, 0,5мг, 1мг, 3мг, 5мг, 10мг, 25мг, 125мг, 250мг або 500мг сполуки даного винаходу 50мг, 100мг, 125мг, 250мг або 500мг сполуки даноодин раз кожні три-чотири години, один раз, два го винаходу один раз кожні три-чотири години, рази або три рази на день або (у вигляді форми один раз, два рази або три рази на день або (у пролонгованого вивільнення) один раз, два рази вигляді форми пролонгованого вивільнення) один або три рази на тиждень. раз, два рази або три рази на тиждень. Вони можуть бути використані як релаксанти Зокрема, запальний біль, такий як, наприклад, гладких м'язів для лікування спазму шлунковозапальне захворювання дихальних шляхів (хронікишкового тракту або матки або в терапії хвороби чна обструктивна хвороба легень), міг би ефектиКрона. виразкового коліту або панкреатиту ввевно лікуватись сполуками даного винаходу за доденням таблетки, крохмальної облатки або капсупомогою введення таблетки. крохмальної облатки ли, кожна з яких містить, наприклад, 0,1мг, 0,5мг, або капсули, кожна з яких містить, наприклад, 1мг, 3мг, 5мг, 10мг, 25мг, 50мг, 100мг, 125мг, 250мг 0,1мг, 0,5мг, 1мг, 3мг, 5мг, 10мг, 25мг, 50мг, 100мг, або 500мг сполуки даного винаходу один раз кожні 125мг, 250мг або 500мг сполуки даного винаходу три-чотири години, один раз, два рази або три один раз кожні три-чотири години, один раз, два рази на день або (у вигляді форми пролонгованого рази або три рази на день або (у вигляді форми вивільнення) один раз, два рази або три рази на пролонгованого вивільнення) один раз, два рази тиждень. або три рази на тиждень. Такі сполуки можуть бути використані терапеДалі, сполуки даного винаходу можуть бути втично для лікування гіперреактивних дихальних додатково використані для лікування астми, запашляхів і для лікування запальних подій, пов'язаних льного захворювання травного тракту, риніту, паніз захворюванням дихальних шляхів, наприклад, креатиту, циститу (інтерсцитіального циститу), астма, і для контролю, обмеження або обернення увеїту, запальних захворювань шкіри, ревматоїдгіперактивності дихальних шляхів у випадку астми ного артриту і набряку, що виникає з травми, повведенням таблетки, крохмальної облатки або в'язаної з опіками. розтягненням або переломом, капсули, кожна з яких містить, наприклад, 0,1мг, введенням таблетки, крохмальної облатки або 0,5мг, 1мг, 3мг, 5мг, 10мг, 25мг, 50мг, 100мг, 125мг, капсули, кожна з яких містить, наприклад, 0,1мг, 250мг або 500мг сполуки даного винаходу один 0,5мг, 1мг, 3мг, 5мг, 10мг, 25мг, 50мг, 100мг, 125мг, раз кожні три-чотири години, один раз, два рази 250мг-^або 500мг сполуки даного винаходу один або три рази на день або (у вигляді форми пролораз кожні три-чотири години, один раз, два рази нгованого вивільнення) один раз. два рази або три або три рази на день або (у вигляді форми пролорази на тиждень. нгованого вивільнення) один раз, два рази або три Вони можуть бути використані для лікування рази на тиждень. екзогенної або ендогенної астми, в тому числі Вони можуть бути використані після хірургічноалергічної астми (атопічної або не-атопічної), загого втручання (наприклад, як післяопераційні аналстреної вірусами або бактеріями астми, інших негетики) і для лікування запального болю різних алергічних типів астми і «синдрому стерторозного органів (наприклад, остеоартриту, ревматоїдного дихання немовлят», введенням таблетки, крохмаартриту, ревматичного захворювання, тендосинольної облатки або капсули, кожна з яких містить, віту і подагри), а також для лікування болю, пов'янаприклад, 0,1мг, 0,5мг, 1мг, 3мг, 5мг. 10мг. 25мг, заного зі стенокардією, менструацією або раком, 50мг, 100мг, 125мг, 250мг або 500мг сполуки дановведенням таблетки, крохмальної облатки або го винаходу один раз кожні три-чотири години, капсули, кожна з яких містить, наприклад, 0,1мг, один раз, два рази або три рази на день або (у 0,5мг, 1мг, 3мг, 5мг, 10мг, 25мг, 50мг, 100мг, 125мг, вигляді форми пролонгованого вивільнення) один 250мг або 500мг сполуки даного винаходу один раз, два рази або три рази на тиждень. раз кожні три-чотири години, один раз, два рази Вони можуть бути ефективними проти пневмоабо три рази на день або (у вигляді форми пролоконіозу, в тому числі алюмінозу, антракозу, асбеснгованого вивільнення) один раз, два рази або три тозу, халікозу, птилозу, сидерозу, силікозу, табакорази на тиждень. зу і біссинозу, а також респіраторного дистресВони можуть бути використані для лікування синдрому дорослих, хронічної обструктивної хводіабетичної васкулопатії, посткапілярної резистенроби легень або захворювання дихальних шляхів, тності або діабетичних синдромів, пов'язаних з бронхіту, алергічного риніту і вазомоторного риніінсулітом (наприклад, гіперглікемії, діурезу, протету, введенням таблетки, крохмальної облатки або їнурії і збільшеної екскреції з сечею нітритів і калікапсули, кожна з яких містить, наприклад, 0,1мг, креїну), введенням таблетки, крохмальної облатки 0,5мг, 1мг, 3мг, 5мг, 10мг, 25мг, 50мг, 100мг, 125мг, або капсули, кожна з яких містить, наприклад, 250мг або 500мг сполуки даного винаходу один 0,1мг, 0,5мг, 1мг, 3мг, 5мг, 10мг, 25мг, 50мг, 100мг, раз кожні три-чотири години, один раз, два рази 125мг, 250мг або 500мг сполуки даного винаходу або три рази на день або (у вигляді форми пролоодин раз кожні три-чотири години, один раз, два нгованого вивільнення) один раз, два рази або три рази або три рази на день або (у вигляді форми рази на тиждень. 23 77058 24 Крім того, вони можуть бути ефективними прорецептора гістаміну Н1, такі як бромфенірамін, ти захворювання печінки. розсіяного склерозу, хлорфенірамін, дексхлорфенірамін, трипролідин, хвороби Альцгеймера, септичного шоку, наприклемастин, дифенгідрамін, дифенілпіралін, трипеклад, як антигіповолемічні і/або антигіпотензивні ленамін, гідроксизин, метдилазин, прометазин, агенти,, набряку головного мозку. головного болю, тримепразин, азатадин, ципрогептадин, антазолін, в тому числі гемікранії, мігрені, в тому числі при фенірамін, піриламін, астемізол, терфенадин, лопрофілактичному і невідкладному використанні, ратадин, цетиризин, деслоратадин, фексофеназакритої травми голови, синдрому подразненого дин і левосетиризин; (5) антагоністи рецептора травного тракту і нефриту, введенням таблетки, гістаміну Н2, такі як циметидин, фамотидин і ранікрохмальної облатки або капсули, кожна з яких тидин; (6) інгібітори протонного насоса, такі як містить, наприклад, 0,1мг, 0,5мг, 1мг, 3мг, 5мг, омепразол, пантопразол і езомепразол; (7) анта10мг, 25мг, 50мг, 100мг, 125мг, 250мг або 500мг гоністи лейкотриєну та інгібітори 5-ліпоксигенази, сполуки даного винаходу один раз кожні тритакі як зафірлукаст, монтелукаст, пранлукаст і зичотири години, один раз, два рази або три рази на лейтон; (8) лікарські засоби, що застосовуються день або (у вигляді форми пролонгованого вивільдля стенокардії, ішемії міокарда, в тому числі нітнення) один раз, два рази або три рази на тижрат, такий як нітрогліцерин і нітрат ізосорбіду, бедень. та-блокатори. такий як атенолол, метопролол, Комбінаторна терапія пропанолол, ацебутолол, бетаксолол, бізопролол, Сполуки формули І можуть бути використані в картеолол, лабеталол, надолол, окспренолол, комбінації з іншими лікарськими засобами, які випребутолол, піндолол, соталол і тимолол, і блокакористовують в лікуванні/попередженні/супресії тори кальцієвих каналів, такі як дилтіазам, вераабо ослабленні захворювань або станів, для яких паміл, ніфедипін, бепридил, фелодипін, флунаризастосовні сполуки формули І. Такі лікарські засозицин, ізрадипін, нікардипін і німодипін; (9) ліки би можуть вводитись способами і в кількості, що проти нетримання сечі, такі як антимускаринові звичайно використовуються для цього, одночасно лікарські засоби, наприклад. толтеродин і оксибуабо послідовно зі сполукою формули 1. При викотинін); (10) шлунково-кишкові антиспазматичні ристанні сполуки формули І одночасно з одним засоби (такі як атропін, скополамін, дицикломін, або декількома іншими лікарськими засобами, антимускаринові засоби, а також дифеноксилат); переважною є фармацевтична композиція, що релаксанти скелетних м'язів (циклобензаприн, містить такі інші лікарські засоби, нарівні зі сполукаризопродол, хлорфенезин, хлорзоксазон, метаккою формули І. Таким чином, фармацевтичні комсалон, метокарбамол, баклофен, дантролен, діапозиції даного винаходу включають в себе композепам або орфенадрин); (11) лікарські засоби прозиції, які містять також один або більше інших ти подагри, такі як алопуринол, пробеніцид і активних інгредієнтів, крім сполуки формули І. колхіцин; (12) лікарські засоби для ревматоїдного Приклади інших активних інгредієнтів, які можуть артриту, такі як метотрексат, ауранофін, ауротіогкомбінуватись зі сполукою формули І, що вводятьлюкоза і золото-натрійтіомалат; (13) лікарські зася або окремо, або в тій же самої фармацевтичній соби для остеопорозу, такі як алендронат і ралоккомпозиції, включають в себе, але не обмежуютьсифен; протинабрякові засоби, такі як ся ними: (1) морфін та інші агоністи опіатного репсевдоефедрин і фенілпропаноламін; (14) місцеві цептора, в тому числі пропоксифен (Дарвон); (2) анестезуючі засоби; (15) лікарські засоби проти нестероїдні протизапальні засоби (NSAID), в тому герпесу, такі як ацикловір, валацикловір і фамцикчислі інгібітори СОХ-2, такі як похідні пропіонової ловір; і (16) протиблювотні засоби, такі як онданкислоти (алмінопрофеп, беноксапрофен, буклоксетрон і гранісетрон. синова кислота, карпрофен, фенбуфен, фенопроБіологічна оцінка: фен, флупрофен, флурбіпрофен, ібупрофен, індоОцінка афінності вибраних сполук відносно профен, кетопрофен, міропрофен, напроксен, зв'язування з рецепторами брадикініну В1 і В2 оксапрозин, пірпрофен, пранопрофен, супрофен, Аналізи зв'язування радіоліганду виконують з тіапрофенова кислота і тіоксапрофен), похідні оцвикористанням мембран з клітин СНО, які стабільтової кислоти (індометацин, ацеметацин, алклоно експресують В1-рецептори людини, кролика, фенак, кліданак, диклофенак, фенклофенак, фенщура або собак, або клітин СНО, які експресують клозинова кислота, фентіазак, фурофенак, В2-рецептор людини. Для всіх типів рецепторів ібуфенак, ізоксепак, окспінак, суліндак, тіопінак, клітини збирають з культуральних колб в ЗФР/1мМ толметин, зидометацин і зомепірак), похідні фенаЕДТА і центрифугують при 1000 g протягом 10 мової кислоти (флуфенамова кислота, меклофехвилин. Осади клітин гомогенізують з використаннамова кислота, мефенамова кислота, ніфлумова ням політрону в охолодженому на льоду 20мМ кислота і толфенамова кислота), похідні біфенілHEPES, 1мМ ЕДТА, рН7,4 (лізисному буфері) і карбонових кислот (дифлунізал і флуфенізал), центрифугують при 20000 g протягом 20 хвилин. оксиками (ізоксикам, проксикам, судоксикам і теноОсади мембран повторно гомогенізують в лізисксикан), саліцилати (ацетилсаліцилова кислота, ному буфері, знову центрифугують при 20000 g і сульфасалазин) і піразолони (апазон, безпіперикінцеві осади повторно ресуспендують при 5мг лон, фепразон, мофебутазон, оксифенбутазон, білка/мл в буфері для аналізу (120мМ NaCl, 5мМ фенілбутазон) і коксиби (целекоксиб, валекоксиб, KСl, 20мМ HEPES, рН7,4), доповненому 1% БСА, і рофекоксиб і еторикоксиб); (3) кортикостероїди, заморожують при -80°С. такі як бетаметазон, будесонід, кортизон, дексаУ день аналізу мембрани центрифугують при метазон, гідрокортизон, метилпреднізолон, пред14000 g протягом 5 хвилин і ресуспендують до нізолон, преднізон і триамцинолон; (4) антагоністи бажаної концентрації білка в буфері для аналізу, 25 77058 26 що містить 100нМ еналіприлат, 140мкг/мл бациттранзиторно (тимчасово) трансфікованих клітин рацину і 0,1% БСА. 3Н-дез-Аrg10-leu9-калідин є НЕК293. Через один день після трансфекції колби радіолігандом, що використовується для В1з клітинами мітили протягом ночі з використанням рецепторів людини і кролика, 3Н-дез-Arg106мкКі/мл [3Н]міоінозиту. У день аналізу середовикалідин використовують для В1-рецепторів щура і ще видаляли і прикріплені клітини обережно злисобаки і 3Н-брадикінін використовують для міченвали 2 20мл забуференого фосфатом сольового ня В2-рецептора людини. розчину. Буфер для аналізу (HEPES-забуферені Для всіх аналізів сполуки розбавляють з вихіфізіологічні солі, рН7,4) додавали і клітини віддідних розчинів в ДМСО з додаванням 4мкл в пробіляли, постукуючи по колбі. Ці клітини центрифугурки для аналізу для одержання кінцевої концентвали при 800 g протягом п'яти хвилин і ресуспенрації ДМСО 2%. Потім додають 100мкл дували при 1 106клітин/мл в буфері для аналізу. радіоліганду і 100мкл суспензії мембран. Неспедоповненому 10мМ хлоридом літію. Після 10 хвицифічне зв'язування для аналізів зв'язування В1лин при кімнатній температурі аліквоти по півмілірецептора визначають з використанням 1мкМ дезлітри розподіляли в пробірки, що містять тестАrg10-калідину, а неспецифічне зв'язування для сполуку або носій. Через ще 10 хвилин пробірки В2-рецептора визначають з використанням 1мкМ переносили на водяну баню 31°С і витримували брадикініну. Пробірки інкубують при кімнатній темпротягом 30 хвилин. Інкубування припиняли додапературі (22°С) протягом 60 хвилин з подальшим ванням 12% розчину перхлорної кислоти і пробірки фільтруванням з використанням системи збирання вміщували на лід на 30 хвилин. Потім кислоту нейдля 96-ямкових планшетів Tomtec. Радіоактивтралізували КОН і пробірки центрифугували для ність, що втримується фільтром, рахують з викоосадження матеріалу, що випав в осад. Утворений ристанням сцинтиляційного лічильника для план[3Н]інозитмонофосфат витягували стандартними шетів Wallac Beta. способами іонообмінної хроматографії і кількісно Сполуки даного винаходу мають афінність вівизначали методом рідинної сцинтиляції. Активдносно В1-рецептора як показано результатами ність оберненого агоністу визначали за мірою, з описаного вище аналізу менше 5мкМ. Переважно, якою тест-сполука зменшувала рівні фону (клітирезультати цього аналізу повинні бути меншими ни, інкубовані з носієм) накопичення ніж 1мкМ, ще більш переважно, щоб вони були [3Н]інозитмонофосфату. меншими ніж 0,5мкМ. Ще більш переважно, щоб Абревіатури, що використовуються сполука даного винаходу мала афінність відносно Наступні абревіатури мають вказані значення, В1-рецептора брадикініну, перевищуючу афінність якщо немає інших вказівок в даному описі: відносно В2-рецептора; більш переважно, афінВОС (bос) трет-бутилоксикарбошл ність відносно В1-рецептора повинна щонайменше ДХМ дихлорметан в 10 разів і переважно в більше ніж 100 разів пеДМФ диметилформамід ревищувати афінність відносно В2-рецептора. ДМСО диметилсульфоксид Аналіз антагоністів брадикініну В1 EDC або 1-(3-диметиламінопропіл)-3Індуковану В1-агоністом мобілізацію кальцію EDCI етилкарбодіімід. НСl піддавали моніторингу з використанням флуоресекв. еквівалент (еквіваленти) центного планшет-рідера зображення (FLIPR). ES (або мас-спектроскопія з іонізацією розКлітини СНО, які експресують В1-рецептор,висіESI)-MS пиленням електронів вали в 96- або 384-ямкові планшети та інкубували Et етил їх в модифікованому Iscove середовищі DMEM EtOAC етилацетат протягом ночі. Ямки промивала два рази фізіологіEtOH етанол чним забуференим насиченим сольовим розчином FAB-MS мас-спектроскопія з бомбардуванням і потім інкубували з 4мкМ Fluo-3 протягом однієї прискореними атомами години при 37°С. Почім планшети промивали два HOBt гідрат 1-гідроксибензотриазолу рази забуференим насиченим сольовим розчином HPLC рідинна хроматографія високого тисі в кожну ямку додавали 100мкл буфера. Планшеку, РХВТ ти вміщували в установку FLIPR і врівноважували LCMS рідинна хроматографія /маспротягом двох хвилин. Потім додавали тестспектроскопія сполуки в об'ємах 50мкл і потім через п'ять хвилин LHMDS біс(триметилсиліл)амід літію 50мкл агоністу (дез-Аrg10-калідину). Відносні виMe метил соти піка флуоресценції за відсутності і у присутMeOH метанол ності антагоніста використали для розрахунку міри МГц мегагерц інгібування реакції агоніста В1-рецептора тестMsCl мезилхлорид сполукою. Оцінювали звичайно 8-10 концентрацій Net3 триетиламін тест-сполуки для побудови кривої інгібування і ЯМР ядерний магнітний резонанс визначення величин ІС50 з використанням звичайTOO трифтороцтова кислота ної побудови кривої нелінійної регресії для чотиТГФ тетрагідрофуран рьох параметрів. Сполуки формули І можуть бути одержані згідАналіз на обернені агоністи брадикініну но з наступними ілюстративними схемами. Активність обернених агоністів при В1рецепторі людини оцінювали з використанням 27 СХЕМА 1 У схемі 1 сполуку (Іа) одержують («збирають») зв'язуванням похідного біарилметанаміну (1) із захищеною аміноциклоалкановою кислотою (2) з використанням стандартних комбінацій реагентів зв'язування пептидів, таких як EDCI/HOBt, у відповідному розчиннику, такому як ТГФ, з одержанням (3). Потім Вос-захисну групу видаляють дією кислоти, такої як НСl, у відповідному розчиннику, такому як МеОН, з одержанням солі амонію, з якої може бути одержане похідне вільної основи (4) з використанням відповідної основи, такої як аміак, і відповідного розчинника, такого як хлороформ. Це похідне аміну (4) взаємодіє потім з карбоновою кислотою або еквівалентом карбонової кислоти з утворенням вказаної в заголовку сполуки (Іа). Альтернативно, може бути використана сіль кислоти (4) в кінцевій реакції з утворенням вказаної в заголовку сполуки (Іа) за умови, що додають відповідну основу, таку як триетиламін. Альтернативно, сполука (Іа) може бути зібрана зв'язуванням похідного біарилметанаміну (1) з ацильованою аміноциклоалкановою кислотою (5), як показано в схемі 1а. 77058 28 Може бути використаний ряд синтетичних стратегій для збирання проміжного похідного біарилметанаміну (1), як показано в схемах 2а-2с. У схемі 2а похідне ціанобіарилу (8) одержують з використанням реакції Сузукі між ароматичним похідним боронової кислоти (6) або відповідним похідним ефіру боронової кислоти і ароматичним галогенідом (7) у присутності триарилфосфіну, такого як трифенілфосфін, і металевого каталізатора, такого як ацетат паладію. Потім одержаний ціанобіарильний проміжний продукт (8) каталітично відновлюють до відповідного амінобіарильного похідного (Іа) з використанням водню і металу, такого як нікель Ренея, у відповідному розчиннику. Альтернативно, як показано в схемі 2Ь, похідне метанаміну (9), після захисту первинної аміногрупи відповідною захисною групою, такою як В ос, перетворюють в ефір борної кислоти і пінакону (11) з використанням паладієвого каталізатора у відповідному розчиннику, такому як диметилсульфоксид. Цей ефір (11), який містить бор, зв'язують з похідним арилгалогеніду (7) з використанням умов реакції Сузукі з одержанням (1). Третій спосіб одержання похідних біарилметанаміну зображений в схемі 2с. Біарильну частину (14) спочатку збирають з використанням каталізованого паладієм зв'язування (12) зі сполукою (13), яка містить арилцинк, як показано. Потім метильну групу біарилу (14) перетворюють відповідно до тристадійної послідовності реакцій галогенування, нуклеофільного заміщення галогену азидом і відновлення з одержанням відповідного проміжного продукту (1а), який містить аміногрупу. Альтернативно, біарилметанамін (1а) може бути також одержаний з арилкарбонітрилу (16) і сполуки (13), яка містить арилцинк, як вихідних сполук, як обговорювалось раніше. Потім одержаний біарилкарбонітрил (8) відновлюють з використанням водню з одержанням (1а). 29 Фахівцям з кваліфікацією в даній галузі буде зрозуміло, що взаємоперетворення функціональних груп може бути використане для забезпечення різноманітних сполук формули І. Як показано в схемі 3, похідне (3а) двічі звільняють від захисних груп спочатку дією сильної кислоти, такої як ТФО, і потім лужним гідролізом у відповідній суміші води і органічного розчинника. такого як метанол, при температурі між 25 і 100°С з одержанням похідного амінокислоти (17). Перед активацією карбонової кислоти (R5COOH) відповідним набором реагентів пептидного зв'язування, таких як EDCI/HOBt, утворюється "активний ефір", який потім взаємодіє з цим похідним амінокислоти (17) з утворенням (18). Остання сполука може реагувати або з амінами b c a (HNR R ), або з алкілоксіамінами (H2NOR ) під дією відповідного набору реагентів пептидного зв'язування, таких як EDCI/HOBt, з утворенням (Іb) і (Іс), відповідно. СХЕМА 3 N-алкілування ілюструється в схемі 4. Амін (4) алкілують надлишком алкілйодиду (I-R1) у відповідному розчиннику, такому як ТГФ, у присутності акцептора кислоти, такого як триетиламін, при підвищених температурах з утворенням (19) разом 77058 30 з біс-алкілованим матеріалом. Потім вторинний амін (19) перетворюють у вказану в заголовку сполуку реакцією з карбоновою кислотою або еквівалентом карбонової кислоти з утворенням (Id) Одержання сполук формули І, що мають 1,2цис- або 1,2-транс-циклопропільну частину молекули, ілюструється в схемах 5 і 6. Згідно з відомими методиками [K. Burgess et al., J. Org. Chem., 57:5931-5936 (1992)], ди-трет-бутилмалонат перетворюють в похідне (20). N-Boc-групу видаляють за допомогою метансульфонової кислоти згідно з [L.S. Lin et al. Tetrahedron Lett., 41:7013-7016 (2000)] з одержанням аміну (21). Цьому аміну дають взаємодіяти з карбоновою кислотою або еквівалентом карбонової кислоти при відповідних умовах пептидного зв'язування з одержанням (22). Потім цей трет-бутиловий ефір відщеплюють кислотою, такою як ТФО, у відповідному розчиннику, такому як ДХМ, з одержанням кислоти (23). Потім біарилметанамін (1) зв'язують з кислотою (23) з використанням відповідного набору реагентів пептидного вв'язування, таких як EDCI/HOBt, з одержанням вказаної в заголовку сполуки (Іе). Подальше перетворення (Іе) в додаткові сполуки формули І може виконуватись з використанням методик, добре відомих фахівцям з кваліфікацією в даній галузі. Наприклад, ацетильна група може бути видалена гідролізом з утворенням відповідного спирту; цей спирт може бути перетворений у відповідний сульфонал обробкою сульфонілхлоридом, і цей сульфонат може бути перетворений у відповідний галогенід обробкою джерелом галогеніду. Ці та інші функціональні перетворення для забезпечення сполук формули І описані в звичайному керівництві з органічної хімії, такому як [March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th Ed., John Wiley & Sons, 2000]. 31 У схемі 6, відповідно до відомих процедур [K. Burgess et al., J. Org. Chem., 57:5931-5936 (1992)], ди-трет-бутклмалонат перетворюють в похідне (24). N-Boc-групу видаляють за допомогою кислоти, такої як ТФО, у відповідному розчиннику, такому як дихлорметан. Цьому аміну дають взаємодіяти з карбоновою кислотою або еквівалентом карбонової кислоти при відповідних умовах зв'язування пептидів, таких як EDC/HOBt/Net3, з одержанням (25). Потім біарилметанаміну дають розкрити лактон (25) у відповідному апротонному розчиннику, такому як ДМФ, при температурі між 20 і 100°С з одержанням вказаної в заголовку сполуки (If). Подальше перетворення (If) в додаткові вказані в заголовку сполуки може виконуватись з використанням методик, добре відомих кваліфікованим в даній галузі фахівцям, як обговорювалось раніше. Наступні приклади приведені для ілюстрації даного винаходу без обмеження цими конкретними прикладами. Сполуки називалися з використанням: ACD/версія назв 4.53 (Advanced Chemistry Development Inc. © 1994-2000). Адреса: 90 Adelaide Street West, Toronto, Ontario, M5H 3V9, Canada. Приклад 1 Метил-3-фтор-4'-{(1R)-1-[({1-[3,3,3трифторпропаноїл)аміно]циклопропіл)карбоніл)аміно]етил}-1,1'-біфеніл-2-карбоксилат У комерційно доступний (1R)-1-(4бромфеніл)етанамін ввели Вос-захиcну групу за допомогою стандартних методик, відомих фахівцям з кваліфікацією в даній галузі, з одержанням трет-бутил-(1R)-1-(4-бромфеніл)етилкарбамату. 77058 32 До розчину трет-бутил-(1R)-1-(4бромфеніл)етилкарбамату (7,6г, 25,3ммоль) в ДМСО (20мл) додавали біс(пінаколато)дибор (7,07г, 27,9ммоль), адукт дихлор[1,Гбіс(дифенілфосфіно)фероцен]паладію (II) і дихлорметану (2,06г, 2,53ммоль) і ацетат калію (7,45г, 76,0ммоль) при кімнатній температурі в атмосфері N2. Одержану суміш нагрівали при 80°С протягом 1 години. Реакцію гасили додаванням ЕtOАС і фільтрували через целіт. Органічний екстракт промивали водою три рази, насиченим NaCl, сушили над MgSO4, фільтрували і концентрували у вакуумі. Залишок очищали на силікагелі, елююючи 020% етилацетатом в гексані з одержанням третбутил-(1R)-1-[4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)феніл]етилкарбамату у вигляді прозорого ясно-жовтого масла з мас-іоном (ES+) 333. До розчину, що перемішується, трет-бутил(1R)-1-[4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан2-іл)феніл]етилкарбамату (1,0г, 2,9ммоль) і метил2-фтор-6-йодбензоату (1,2г, 4,32ммоль) в 25мл суміші 5:1 ТГФ:вода додавали карбонат калію (1,2г, 8,64ммоль), три-о-толілфосфін (350мг, 1,15ммоль) і, нарешті, ацетат паладію (65мг, 0,29ммоль). Потім реакційну судину герметично закривали і вміщували на масляну баню 90°С для перемішування і нагрівання протягом ночі. Через приблизно 18 годин реакційну суміш охолоджували до температури навколишнього середовища і потім розбавляли ЕtOАС. Органічні шари промивали насиченим сольовим розчином ( 4), сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску з одержанням масла. Це масло піддавали колонковій хроматографії на силікагелі, елююючи 10-60% ЕtOАС в гексанах з одержанням метил-4'-{(1R)-1-[(третбутоксикарбоніл)аміно]етил}-3-фтор-1,1'-біфеніл-2карбоксилату (205мг), який, як було виявлено, був чистим, згідно з LC/MS і протонним ЯМР. Метил-4'-{(1R)-1-[(третбутоксикарбоніл)аміно]етил}-3-фтор-1,1'-біфеніл-2карбоксилат (205мг, 0,60ммоль), розчинений в МеОН (15мл), охолоджували до 0°С. Цей гомогенний розчин насичували безводним хлоридом водню і залишали стояти протягом 20 хвилин. Потім через цей розчин барботували сухий азот протягом приблизно 20 хвилин. Потім розчинник видаляли при зниженому тиску з одержанням маслянистого залишку. Потім це масло розчиняли в ДХМ і розчинник видаляли. Цей процес повторювали, поки не одержували твердий гідрохлорид аміну. Вищезгаданий гідрохлорид аміну (85мг, 0,27ммоль) разом з 1-[(третбутоксикарбоніл)аміно]циклопропанкарбоновою кислотою (55мг, 0,26ммоль), HOBt H2O (8,4мг, 0,05ммоль) і триетиламіном (33мг, 0,33ммоль) розчиняли в 4,5мл ТГФ. До цього розчину при кімнатній температурі додавали EDCI (74мг, 0,38ммоль). Після перемішування протягом ночі (приблизно 16,5год.) реакційну суміш розбавляли водою і ЕЮАС. Органічний шар промивали послідовно 1н НСl, 5% бікарбонатом натрію, розбавленим в 2 рази насиченим сольовим розчином ( 3) і потім насиченим сольовим розчином. Органічний шар сушили над сульфатом натрію, фільтрували і 33 77058 34 упарювали при зниженому тиску з одержанням у вакуумі. Залишок розчиняли в МеОН (20мл), 4н залишку, який піддавали хроматографії на силікаNaOH (10мл) і воді (10мл). Цю суміш нагрівали із гелі, елююючи 1-6% МеОН в ДХМ. Збирання фразворотним холодильником при дефлегмації протякцій, які містять продукт, і видалення розчинника гом 4 годин і потім нейтралізували 6н НСl. Очидавали 108мг (86%) метил-4'-{(1R)-1-[({1-[(третщення виконували препаративною РХВТ на колобутоксикарбоніл)аміно]циклопропіл}карбоніл)нці gis delta-pack, 300А, розмір пор 15мкм, з аміно]етил}-3-фтор-1,1'-біфеніл-2-карбоксилату. системою розчинників 0,05% НСІ-вода-водний Метил-4'-{(1R)-1-[({1-[(третацетонітрил з використанням різних лінійних градібутоксикарбоніл)аміно]циклопропіл}карбоніл)єнтів. Фракції, що містять продукт з чистотою 99%, аміно]етил}-3-фтор-1,1'-біфеніл-2-карбоксилат як виміряно за допомогою РХВТ, об'єднували і (108мг, 0,24ммоль), розчинений в МеОН (5,0мл), ліофілізували з одержанням 4'-((1R)-1-{[(1охолоджували до 0°С. Цей гомогенний розчин нааміноциклопропіл)карбоніл]аміно}етил)-3-фторсичували безводним хлоридом водню і залишали 1,1'-біфеніл-2-карбонової кислоти у вигляді білої стояти протягом 30 хвилин. Потім через цей розтвердої речовини. чин барботували сухий азот протягом приблизно До розчину трифторпропіонової кислоти 50 хвилин. Потім розчинник видаляли при зниже(128мг, 1,0ммоль) в ДХМ (1мл) додавали гідрохному тиску з одержанням маслянистого залишку. лорид 1-етил-(3-диметиламінопропіл)карбодііміду Потім це масло розчиняли в ДХМ і розчинник ви(229мг, 1,2ммоль) і 1-гідроксі-7-азабензотриазол даляли. Цей процес повторювали, поки не одер(136мг, 1,0ммоль). Одержаний розчин перемішужували твердий гідрохлорид аміну. вали при кімнатній температурі протягом 20 хвиВищезгаданий гідрохлорид аміну (46мг, лин, потім додавали 4'-((1R)-1-{[(10,12ммоль) разом з трифторпропіоновою кислоаміноциклопропіл)карбоніл]аміно}етил)-3-фтор1,1'-біфеніл-2-карбонову кислоту (171мг, тою (15мг, 0,12ммоль), HOBt H2O (3,6мг, 0,5ммоль) в 1мл ДХМ з подальшим додаванням 0,02ммоль) і триетиламіном (14мг, 0,14ммоль) N,N-діізопропілетиламіну до одержання рН10. Рерозчиняли в 1,6мл ТГФ плюс 1,6мл ДМФ. До цього акційну суміш перемішували при температурі нарозчину при кімнатній температурі додавали EDCI вколишнього середовища в атмосфері N2 протя(31мг, 0,16ммоль). Після перемішування протягом гом 2 годин, концентрували у вакуумі і потім ночі (приблизно 18год.) реакційну суміш розбавлярозподіляли між водою і етилацетатом. Органічли водою і ЕtOАС. Органічний шар промивали ний екстракт промивали насиченим сольовим розпослідовно 1н НСl, 5% бікарбонатом натрію, розчином, сушили над безводним сульфатом магнію, бавленим в 2 рази насиченим сольовим розчином фільтрували і концентрували у вакуумі. Залишок ( 3) і потім насиченим сольовим розчином. Оргапіддавали колонковій хроматографії на силікагелі, нічний шар сушили над сульфатом натрію, фільтелююючи 40% МеОН в СНСl3. Збирання і концентрували і упарювали при зниженому тиску з одеррування відповідних фракцій давало 3-фтор-4'жанням залишку, який піддавали хроматографії на {(1R)-1-[({1-[(3,3,3силікагелі, елююючи 1-2% МеОН в ДХМ. Збирання трифторпропанофракцій, які містять продукт, і видалення розчинїл)аміно]циклопропіл}карбоніл)аміно]етил}ника давали 36мг (67%) вказаної в заголовку спо1,1'біфеніл-2-карбонову кислоту у вигляді білої луки у вигляді піноподібної твердої речовини. Чиствердої речовини. тоту визначали за допомогою LSMS (ES MS, M+H+ До розчину вищезгаданої кислоти (226мг, знайдено: 467) і протонного ЯМR (400МГц. CD3OD: 0,50ммоль) в ДХМ (1мл) додавали гідрохлорид 17,555, 7,540, 7,535, 7,520, 7,515, 7,500, 7,393, етил-(3-диметиламінопропіл)карбодііміду (134мг, 7,737, 7,319, 7,302, 7,298, 7.240, 7,222, 7,221, 0,70ммоль), 1-гідроксі-7-азабензотриазол (68мг, 7,211, 7,188, 7,167, 7,165, 5,116, 5,099, 5,081, 0,50ммоль) і гідрохлорид метоксіаміну (167мг, 5,064, 3,659, 3,268, 3.241, 3,214, 3,187, 1,508, 1,0ммоль) з подальшим додаванням N,N1,490, 1,483, 1,477, 1,474, 1,470, 1,465, 1,454, діізопропілетиламіну до одержання рН10. Одер1,444, 1,056, 1,049, 1,036, 1,031, 1,023, 1,007, жаний розчин перемішували при кімнатній темпе0,999, 0,995, 0,982, 0,974). ратурі протягом 2 годин і потім розподіляли між Приклад 2 етилацетатом і водою. Органічний екстракт про3-N-метокси-4'-{(1R)-1-[({1-[3,3,3мивали насиченим сольовим розчином, сушили трифторпропаноїл)аміно]циклопропіл|над безводним сульфатом магнію, фільтрували і карбоніл)аміно]етил}-1,1'-біфеніл-2-карбоксамід концентрували у вакуумі. Залишок піддавали препаративній РХВТ на колонці Cis delta-pack з системою розчинників 0,05% НСІ-вода-водний ацетонітрил з використанням різних лінійних градієнтів. Фракції, що містять продукт з чистотою 99%, як виміряно за допомогою РХВТ, об'єднували і ліофілізували з одержанням вказаної в заголовку споРозчин метил-3-фтор-4'-{(1R)-1-[({1-[3,3,3луки у вигляді білої твердої речовини. Чистоту трифторпропаноїл)аміно]визначали за допомогою LSMS (ES MS, M+H+ циклопропіл}карбоніл)аміно]етил}-1,1'-біфеніл-2знайдено: 482) і протонного ЯМР (400МГц, DMCOкарбоксилату (466мг, 1,0ммоль) в ДХМ (15мл) і d6): 1,40 (д, J=7,1Гц, 3Н), 0,60-0,80 (м, 2Н), 1,27 ТФО (15мл) перемішували в атмосфері N2 протя(м, 2Н), 3,23 (м, J=11,2Гц, 2Н), 3,44 (с, 3Н), 5,02 гом 20 хвилин при температурі навколишнього (кв., J=8Гц, 1Н), 7,25-7,39 (м, 6Н), 7,52 (м, 1Н), 7,93 середовища, потім органічний розчинник видаляли (д, J=8,2Гц, 1Н), 8,89 (с, 1Н). 35 Приклад 3 Метил-3-фтор-4'-{1-метил-1-[({1[(трифторацетил)аміно]циклопропіл}карбоніл)аміно]етил}-1,1'-біфеніл-2-карбоксилат 77058 36 зниженому тиску з одержанням залишку, який піддавали хроматографії на силікагелі, елююючи 02% МеОН в ДХМ. Збирання утримуючих продукт фракцій і видалення розчинника давали 0,25г метил-4'-(1-{[(бензилокси)карбоніл]аміно}-1метилетил)-3-фтор-1,1'-біфеніл-2-карбоксилату, який давав LC/MS і спектри протонного ЯМР, відповідні теорії. Метил-4'-(1-{[(бензилокси)карбоніл]аміно}-1метилетил)-3-фтор-1,1'-біфеніл-2-карбоксилат (0,25г, 0,59ммоль) розчиняли в 6,0мл безводного Метил-2-(4-бромфеніл)-2-метилпропаноату етанолу. Потім додавали Pd/C (90мг) і атмосферу (3,75г, 14,6ммоль), одержаному згідно з [J. Org. азоту замінювали на водень. Реакційній суміші Chem., 59:2620 2622 (1994)], в 150мл ТГФ давали давали перемішуватись протягом 72 годин. Після реагувати з триметилсиланолатом калію (2,62г, фільтрування через целіт етанол видаляли при 20,4ммоль) при температурі навколишнього серезниженому тиску з одержанням 0,15г метил-4'(1довища протягом 60 годин при безперервному аміно-1-метилетил)-3-фтор-1,1'-біфеніл-2перемішуванні. Потім реакційну суміш розбавляли карбоксилату, який мав достатню чистоту для заводою і ДХМ. Потім рН водної фази доводили стосування безпосередньо в наступній реакції. приблизно до 4 за допомогою 1М НСl. Потім водВищезгаданий амін (80мг, 0,28ммоль) розчиний шар екстрагували три рази додатковою кількіняли в безводному ДХМ (4мл). До цього розчину, стю ДХМ. Органічний шар об'єднували, сушили що перемішується, додавали 1-[(третнад сульфатом натрію. фільтрували і потім концебутоксикарбоніл)аміно]циклопропанкарбонову кинтрували з одержанням 3,59г 2-(4-бромфеніл)-2слоту (67мг, 0,33ммоль), HOBt H2O (8мг, метилпропанової кислоти у вигляді білої твердої 0,08ммоль) і, нарешті, EDCI (69г, 0,36ммоль).Цій речовини, яка давала LC/MS і спектри протонного суміші давали перемішуватися протягом ночі. ПоЯМР, відповідні теорії. тім розчинник видаляли при зниженому тиску і До 82мл толуолу додавали вищезгадану кисзалишок піддавали хроматографії на силікагелі, лоту (2,00г, 8,23ммоль), триетиламін (1,20мл, елююючи 1-3% МеОН в градієнті ДХМ з одержан8,64ммоль) і дифенілфосфорилазид (1,86мл, ням 4'-{1-[({1-[(трет8,64ммоль). Після нагрівання цієї суміші зі зворотбутоксикарбоніл)аміно]циклопропіл[ним холодильником при дефлегмації протягом 1 кардоніл)аміно]-1-метилетил}-1-фтор-1,1'-біфенілгодини в атмосфері азоту додавали бензиловий 2-карбоксилату (82мг), що дає LC/MS і спектри спирт (1,70мл, 16,5ммоль) і реакційної суміші дапротонного ЯМР, відповідні теорії. вали нагріватися при дефлегмації протягом ночі. Описаний вище матеріал (82мг, 0,17ммоль), Розчинник видаляли при зниженому тиску і одеррозчинений в етилацетаті (4мл), охолоджували до жане масло розбавляли етилацетатом. Етилаце0°С. Цей гомогенний розчин насичували безводтатний розчин промивали двічі 5% бікарбонатом ним хлоридом водню і залишали стояти протягом натрію і один раз насиченим сольовим розчином. 30 хвилин. Потім через цей розчин барботували Органічний шар сушили над сульфатом натрію, сухий азот протягом приблизно 30 хвилин. Потім фільтрували і упарювали при зниженому тиску з розчинник видаляли при зниженому тиску з одеродержанням залишку, який піддавали хроматогжанням маслянистого залишку, який використали рафії на силікагелі, елююючи 0-2% МеОН в ДХМ. безпосередньо в наступній реакції. Збирання фракцій, які містять продукт, і видалення До розчину, що перемішується при 0°С, вищерозчинника давали 2,26г бензил-N-[1-(4згаданого аміну (32мг, 0,09ммоль) в ДХМ (2,0мл) бромфеніл)-1-метилетил]карбамату, який давав додавали триетиламін (20мкл, 0,13ммоль) і, нареLC/MS і спектри протонного ЯМР, відповідні теорії. шті, трифтороцтовий ангідрид (20мкл, 0,11ммоль). Вищезгаданий бромід (1,00г, 2,87ммоль) доЧерез 10 хвилин баню з льодом видаляли і передавали до 25мл ДМФ з подальшим додаванням мішування продовжували загалом протягом 30 біс(пінаколато)бору (0,875г, 3,45ммоль), ацетату хвилин. Реакційну суміш піддавали хроматографії калію (0,846г, 8,62ммоль) і PdCl2(dppf)2 CH2Cl2 на силікагелі, елююючи 0,5-2% МеОН в ДХМ. Зби(0,063г, 0,090ммоль). Цю суміш нагрівали до 80°С рання фракцій, які містять продукт, і видалення в атмосфері азоту протягом 3 годин. Після охолорозчинника давали 34мг (84%) вказаної в заголовджування до температури навколишнього середоку сполуки у вигляді піноподібної твердої речовивища додавали метил-2-фтор-6-йодбензоат ни. Чистоту визначали за допомогою LSMS (ES (0,965г, 3,45ммоль), PdCl2(dppf)2CH2Cl2 (0,063г, MS, M+H+ знайдено: 467) і протонного ЯМР 0,090ммоль) і водний карбонат натрію (7,18мл, (400МГц, CD3OD: 7,552, 7,537, 7,531, 7,517, 2М, 14,4ммоль). Потім цю суміш нагрівали до 80°С 7,512, 7,497, 7,442, 7,425, 7,420, 7,302, 7,297, протягом ночі. Після охолоджування до темпера7,280, 7,250, 7,231, 7,203, 7,181, 7,159, 3,644, тури навколишнього середовища велику частину 1,644, 1,444, 1,432, 1,424, 1,412, 1,080, 1,068, ДМФ видаляли при зниженому тиску і двофазну 1,060, 1,048). суміш розбавляли етилацетатом. рН водного шару Приклад 4 робили нейтральним за допомогою 1М НСl перед N-{[(1R)-1-[3,3'-дифтор-2'-(3-метил-1,2,4екстракцією двома додатковими об'ємами етилаоксадіазол-5-іл)-1,1'-біфеніл-4-іл]етил}-1цетату. Об'єднані органічні шари сушили над су{(трифторацетил)аміно]циклопропанкарбоксамід льфатом натрію, фільтрували і упарювали при 37 77058 38 цію гасили водним хлоридом амонію і водний шар екстрагували метиленхлоридом. Об'єднані органічні сушили над Na2SO4, фільтрували і концентрували у вакуумі. Одержаний залишок піддавали колонковій хроматографії на силікагелі, елююючи 10-50% етилацетатом в гексанах з одержанням N[(1R)-1-(4-бром-2-фторфеніл)етил]-2-метилпропанДо розчину 2-фтор-6-йодбензойної кислоти 2-сульфінаміду у вигляді білої твердої речовини, (15,00г, 56,39ммоль) в 150мл СН2Сl2, що містить яка давала спектри протонного ЯМР, які узгоджу0,1мл ДМФ, додавали краплями оксалілхлорид ються з теорією, і мас-іон (ES+) 308,09 для М+Н+ (9,30г, 73,3ммоль). Розчин перемішували при кім(81Вr). натній температурі протягом 75 хвилин. потім конДо розчину N-[(1R)-1-(4-бром-2центрували у вакуумі. Залишок повторно розчиняфторфеніл)етил]-2-метилпропан-2-сульфінаміду ли в 150мл СН2Сl2 і цей розчин насичували три (26,29г, 81,58ммоль) в 40мл метанолу додавали рази газоподібним аміаком. Розчин концентрували розчин НСІ/діоксан (4М, 40,8мл, 0,163моль). Реаку вакуумі і сушили під вакуумом протягом ночі. ційну суміш концентрували у вакуумі і додавали Залишок розчиняли в диметилацеталі N,Nефір. Білу тверду речовину збирали, промивали диметилацетаміду (24,7мл, 0,169моль) і нагрівали холодним ефіром і сушили під вакуумом з одердо 120°С протягом 5 годин. Додавали додатково жанням (1R)-1-(4-бром-2диметилацеталь N,N-диметилацетаміду (25мл, фторфеніл)етанамінійхлориду, який давав спектри 0,17моль) протягом цієї реакції для доведення її протонного ЯМР, що узгоджуються з теорією. до завершення. Цей розчин охолоджували до кімДо розчину вищезгаданого (1R)-1-(4-бром-2натної температури, концентрували у вакуумі і фторфеніл)етанамінійхлориду (14,24г, сушили під вакуумом протягом ночі. До розчину 55,95ммоль) в 300мл СН2Сl2 при 0°С додавали дицього проміжного продукту в 57мл діоксану додатрет-бутилдикарбонат (17,98г, 82,40ммоль) і триевали гідрохлорид гідроксиламіну (4,704г, тиламін (8,256г, 81,58ммоль). Розчин промивали 67,69ммоль), 5н NaOH (13,5мл, 67,7ммоль) і 70% водою і насиченим сольовим розчином, сушили оцтову кислоту (57мл). Суміш перемішували при над Na2SO4, фільтрували і концентрували у вакуу60°С протягом 2 годин, потім при 90°С протягом 3 мі з одержанням неочищеного (1R)-1-(4-бром-2годин. Одержаний розчин охолоджували до кімнафторфеніл)етанамінійхлориду у вигляді білої тветної температури, розбавляли етилацетатом і нейрдої речовини, яка давала спектри протонного тралізували водним розчином бікарбонату натрію. ЯМР, що узгоджуються з теорією. Органічний екстракт промивали водним бікарбонаСуміш (1R)-1-(4-бром-2том натрію і насиченим сольовим розчином, сушифторфеніл)етанамінійхлориду (26,42г, ли над сульфатом натрію, фільтрували і концент83,03ммоль), біс(пінаколато)дибору (31,63г, рували у вакуумі. Залишок фільтрували через 0,1246моль), ацетату калію (24,45г, 0,2491моль) і силікагель, елююючи 10% етилацетатом в гексадихлориду [(1,1'нах з одержанням 5-(2-фтор-6-йодфеніл)-3-метилбісфенілфосфіно)фероцен]паладію (II) (0,265г, 1,2,4-оксадіазолу у вигляді оранжево-жовтих крис0,362ммоль) в 80мл ДМСО нагрівали до 90°С в талів, які давали спектри протонного ЯМР, які узатмосфері N2 протягом 3 годин. Потім цю суміш + годжуються з теорією, і мас-іон (ES ) 305,06 для охолоджували до кімнатної температури і розподіМ+Н+. ляли між етилацетатом і водою. Органічний екстДо розчину (S)-(-)-2-метилпропансульфінаміду ракт промивали водою і насиченим сольовим роз(20,20г, 0,167моль) в 350мл СН2Сl2 додавали 4чином, сушили над Na2SO4, фільтрували і бром-2-фторбензальдегід (35,53г, 0,1750моль), концентрували у вакуумі. Залишок піддавали копіридиній-п-толуолсульфонат (2,09г, 8,33ммоль) і лонковій хроматографії на силікагелі, елююючи 0сульфат магнію (200,6г, 1,667моль). Реакційну 10% етилацетатом в гексанах з одержанням третсуміш перемішували при кімнатній температурі бутил-(1R)-1-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2протягом 48 годин. Додавали додаткову кількість діоксаборолан-2-іл)феніл]етилкарбонату у вигляді сульфату магнію (100,3г, 0,833моль) і реакційну бежевої твердої речовини, яка давала спектри суміш перемішували протягом 24 годин. Суміш протонного ЯМР, що узгоджуються з теорією. фільтрували через целіт. промивали СН2Сl2 і конСуміш 5-(2-фтор-6-йодфеніл)-3-метил-1,2,4центрували у вакуумі. Одержаний залишок піддаоксадіазолу (1,50г, 4,93ммоль), трет-бутил-(1R)-1вали колонковій хроматографії на силікагелі, елю[2-фтор-4-(4,4,5,5-тетраметил-1,3,2юючи 0-10% етилацетатом в гексанах з діоксаборолан-2-іл)феніл]-етилкарбонату (1,80г, одержанням N-{(1R)-(4-бром-24,93ммоль), карбонату калію (1,70г, 12,3ммоль), фторфеніл)метиліден}-2-метилпропан-2три-о-толілфосфіну (0,060г, 0,20ммоль) і ацетату сульфінаміду у вигляді білої твердої речовини, паладію (0,011г, 0,05ммоль) в 25мл ТГФ і 4мл води який давав спектри протонного ЯМР, які узгоджунагрівали в закритій герметично колбі при 100°С ються з теорією, і мас-іон (ES+) 308,09 для М+Н+ протягом ночі. Потім суміш охолоджували і конце(81Вr). нтрували у вакуумі. Одержаний залишок розчиняДо розчину N-{(1R)-(4-бром-2ли в етилацетаті, промивали водою і насиченим фторфеніл)метиліден}-2-метилпропан-2сольовим розчином, сушили над Na2O4, фільтрусульфінаміду (32,65г, 0,1066моль) в 550мл СН2Сl2 вали і концентрували у вакуумі. Залишок піддавапри -48°С додавали краплями метилмагнійхлорид ли хроматографії на силікагелі, елююючи 0-10% (3,0М розчин в ефірі, 53,31мл, 0,1599моль). Реакетилацетатом в гексанах з одержанням трет 39 77058 40 бутил-(1R)-1-[3,3'-дифтор-2'-(3-метил-1,2,4До розчину n-BuLi (2,5М в гексанах, 41,8мл, оксадіазол-5-іл)-1,1'-біфеніл-4-іл]етилкарбамату у 0,104 моль) в 400мл ТГФ при -78°С додавали кравигляді жовтого масла, яке давало спектри проплями 2,2,6,6-тетраметиленпіперидин (14,76г, тонного ЯМР, що узгоджуються з теорією. Цей 0,1045моль) з подальшим додаванням краплями продукт розчиняли в етилацетаті і насичували га3-бромхлорбензолу (20,00г, 0,1045моль). Цю сузоподібним НС1. Розчин концентрували у вакуумі і міш перемішували при -78°С протягом 2 годин, азеотропно переганяли 3 рази з толуолом з одерпотім реакцію гасили сухим льодом і нагрівали до жанням (1R)-1-[3,3'-дифтор-2'-(3-метил-1,2,4кімнатної температури. Розчин концентрували у оксадіазол-5-іл)-1,1'-біфеніл-4вакуумі і одержаний залишок розчиняли у воді і іл]етанамінійхлориду. промивали ефіром. До водної фракції додавали 1н Розчин (1R)-1-[3,3'-дифтор-2'-(3-метил-1,2,4HСІ до рН2 і продукт екстрагували СН2Сl2. Об'єдоксадіазол-5-іл)-1,1'-біфеніл-4нані органічні шари сушили над Na2SO4, фільтруіл]етанамінійхлориду (0,500г, 1,42ммоль), Вос-1вали і концентрували у вакуумі з одержанням 2аміноциклопропан-1-карбонової кислоти (0,300г, бром-6-хлорбензойної кислоти, яка давала спект1,49ммоль), гідрохлориду 1-етил(3ри протонного ЯМР, що узгоджуються з теорією. диметиламінопропіл)карбодііміду (0,545г, До розчину 2-бром-6-хлорбензойної кислоти 2,84ммоль), 1-гідроксі-7-азабензотриазолу (0,010г, (17,7г, 75,2ммоль) в метанолі (200мл) при 0°С до0,15ммоль) і триетиламіну (0,863г, 8,53ммоль) в давали (триметилсиліл)діазометан (2M в гексанах, 10мл СН2Сl2 перемішували при кімнатній темпера100мл, 0,200моль). Розчин перемішували при 0°С турі протягом ночі. Розчин промивали водним біпротягом 1,5 годин, потім нагрівали до кімнатної карбонатом натрію і насиченим сольовим розчитемператури і промивали водним бікарбонатом ном, сушили над Na2SO4, фільтрували і натрію і насиченим сольовим розчином, сушили концентрували. Залишок піддавали хроматографії над Na2SO4, фільтрували і концентрували. Залина силікагелі. елююючи 10-40% етилацетатом в шок піддавали хроматографії на силікагелі, елююгексанах з одержанням трет-бутил-1-[({(1R)-1-[3,3'ючи 0-5% етилацетатом в гексанах з одержанням дифтор-2'-(3-метил-1,2,4-оксадіазол-5-іл)-1,1'метил-2-бром-6-хлорбензоату у вигляді блідобіфеніл-4-іл]етил}аміно)жовтого масла, яке давало спектри протонного карбоніл]циклопропілкарбамату у вигляді білої ЯМР, що узгоджуються з теорією. твердої речовини, яка давала спектри протонного Суміш метил-2-бром-6-хлорбензоату (2,25г, ЯМР, що узгоджуються з теорією. Цей продукт 9,03ммоль), трет-бутил-(1R)-1-[2-фтор-4-(4,4,5,5розчиняли в етилацетаті і насичували газоподібтетраметил-1,3,2-діоксаборолан-2ним НС1. Розчин концентрували у вакуумі і азеотіл)феніл]етилкарбонату (див. приклад 1, 3,00г, ропно переганяли 3 рази с толуолом з одержан8,21ммоль), карбонату калію (2,84г, 20,5ммоль). ням 1-[({(1R)-1-[3,3'-дифтор-2'-(3-метил-1,2,4три-о-толілфосфіну (0,10г, 0,33ммоль) і ацетату оксадіазол-5-іл)-1,1'-біфеніл-4паладію (0,018г, 0,08ммоль) в 40мл ТГФ і 4мл води іл]етил}аміно)карбоніл]нагрівали в герметично закритій колбі при 100°С циклопропанамінійхлориду, який давав мас-іон протягом 4 годин. Потім цю суміш охолоджували і (ES+) 399,21 для М+Н+. концентрували у вакуумі. Одержаний залишок роДо розчину вищезгаданої сполуки (0,290г, зчиняли в етилацетаті, промивали водою і насиче0,667ммоль) в 5мл СН2Сl2 при 0°С додавали триеним сольовим розчином, сушили над Na2SO4, фітиламін (0,135г, 1,33ммоль) і трифтороцтовий анльтрували і концентрували у вакуумі. Залишок гідрид (0,14г, 0,67ммоль). Цей розчин розбавляли піддавали хроматографії на силікагелі, елююючи додаванням СН2Сl2 і промивали водним бікарбо0-10% етилацетатом в гексанах з одержанням натом натрію і насиченим сольовим розчином, метил-4'-{(1R)-1-{(третсушили над Na2SO4, фільтрували і концентрували. бутоксикарбоніл)аміно]етил}-3-хлор-3'-фтор-1,1'Залишок піддавали хроматографії на силікагелі, біфеніл-2-карбоксилату, який давав спектри проелююючи 10-40% етилацетатом в гексанах з одетонного ЯМР, що узгоджуються з теорією. Цей ржанням вказаної в заголовку сполуки, яка давала продукт розчиняли в етилацетаті і насичували гаспектри протонного ЯМР, що узгоджуються з теозоподібним НСl. Розчин концентрували у вакуумі і рією, і мас-іон (ES+) 495,22 для М+Н+: 1Н ЯМР азеотропно переганяли 3 рази з толуолом з одержанням (1R)-1-[3'-хлор-3-фтор-2'(300МГц, MeOH-d4) 9,71 (с, 1Н). 8,29 (д, J=8,3Гц, (метоксикарбоніл)-1,1'-біфеніл-41Н), 7,77-7,70 (м, 1Н), 7,41-7,30 (м, 3Н), 6,95 (с, іл]етанамінійхлориду. 1Н), 6,93-6,91 (м, 1Н). 5,32-5,22 (м, 1Н), 2,36 (с, Розчин вищезгаданої сполуки (1,00г, 3Н), 1,51-1,45 (м, 5Н), 1, 15-1,01(м, 2Н). 2,91ммоль), Вос-1-аміноциклопропан-1-карбонової Приклад 5 кислоти (0,614г, 3,05ммоль), гідрохлориду 1-етилМетил-3-хлор-3'-фтор-4'-{(1R)-1-[({1(3-диметиламінопропіл)карбодііміду (1,11г, [(трифторацетил)аміно]циклопропіл}5,81ммоль), 1-гідроксі-7-азабензотриазолу (0,010г, карбоніл)аміно]етил}-1,1'-біфеніл-2-карбоксилат 0,15ммоль) і триетиламіну (1,76г, 17,4ммоль) в 20мл СН2СІ2 перемішували при кімнатній температурі протягом ночі. Розчин промивали водним бікарбонатом натрію і насиченим сольовим розчином, сушили над Na2SO4, фільтрували і концентрували. Залишок піддавали хроматографії на силікагелі, елююючи 10-40% етилацетатом в гексанах з одержанням метил-4'-{(1R)-1-[({1-[(трет 41 77058 42 бутоксикарбоДо розчину 2-фтор-4-бромбензальдегіду ніл)аміно]циклопропіл}карбоніл)аміно]етил}-3(20,0г, 98,5ммоль) в 500мл ТГФ при 0°С повільно хлор-3'-фтор-1,1'-біфеніл-2-карбоксилату у вигляді додавали розчин метиллітію (1,4М в Et2O, 70,3мл). білої твердої речовини, яка давала спектри проПісля однієї години реакцію обережно гасили натонного ЯМР, що узгоджуються з теорією. Цей сиченим водним хлоридом амонію. екстрагували продукт розчиняли в етилацетаті і насичували гадіетиловим ефіром, промивали насиченим NaCl, зоподібним НСl. Розчин концентрували у вакуумі і сушили над MgSO4 і концентрували. До розчину азеотропно переганяли 3 рази з толуолом з одерцього неочищеного спирту в 200мл СН2Сl2 і TEA жанням 1-[({(1R)-1-[3'-хлор-3-фтор-2'(14,0мл, 100ммоль) при 0°С додавали метансуль(метоксикарбоніл)-1,1'-біфеніл-4фонілхлорид (7,42мл, 95,9ммоль) протягом періоіл]етил}аміно)карбоніл]ду 5 хвилин. Після періоду реакції протягом ночі циклопропанамінійхлориду, який давав мас-іон реакційну суміш екстрагували СН2С12, промивали (ES+) 391,21 для М+Н+. NaHCO3, насиченим NaCl, сушили над MgSO4 і До розчину вищезгаданої сполуки (0,300г, концентрували. Розчин цього неочищеного мези0,702ммоль) в 5мл СН2Сl2 при 0°С додавали триелату в 50мл ДМФ обробляли азидом натрію (12,5г, тиламін (0,142г, 1,40ммоль) і трифтороцтовий ан191ммоль) протягом ночі. Реакційну суміш екстрагідрид (0,147г, 0,70ммоль). Розчин розбавляли гували ЕЮАС, промивали NaHCO3, насиченим додаванням СН2Сl2 і промивали водним бікарбоNaCl, сушили над MgSO4 і концентрували. До рознатом натрію і насиченим сольовим розчином, чину цього неочищеного азиду в 100мл ТГФ додасушили над Na2SO4, фільтрували і концентрували. вали триетилфосфін (1М в ТГФ, 90,1мл) протягом Залишок піддавали хроматографії на силікагелі, періоду 30 хвилин. Через одну годину додавали елююючи 10-40% етилацетатом в гексанах з оде100мл 1н НСl і суміш перемішували протягом ночі. ржанням вказаної в заголовку сполуки, яке давало Суміш охолоджували і промивали Et2O. Водний спектри протонного ЯМР, що узгоджуються з теошар робили лужним додаванням карбонату калію, рією, і мас-іон (ES+) 487,22 для М+Н+: 1Н ЯМР екстрагували Et2O, сушили над MgSO4 і концентрували. Розчин цього неочищеного аміну (9,0г, (300МГц, МеОН-d4) 7,51-7,33 (м, 4Н), 7.17-7,07 41,2ммоль) в 50мл СН2Сl2 обробляли Вос(м, 2Н), 5,31 (кв., J=7,1Гц, 1Н), 3,69 (с, 3Н), 1,52ангідридом (9,00 г, 41,2ммоль). Через одну годину 1,49 (м, 5Н), 1,27-1,03 (м, 2Н). суміш концентрували. До розчину цього неочищеПриклад 6 ного карбамату в 40мл ДМСО додавали ацетат N-{(1R)-1-[3,3'-дифтор-2'-(2-метил-2Нкалію (12,1г, 123,1ммоль), біс(пінаколато)дибор тетразол-5-іл)-1,1'-біфеніл-4-іл]етил}-1(11,5г, 45,4ммоль) і адукт дихлор-[1,1'[(трифторацетил)аміно]циклопропанкарбоксамід біс(дифенілфосфіно)фероцен]паладію (II) і дихлорметану (1,4г, 1,8ммоль). Одержану суміш нагрівали при 80°С протягом 16 годин. Після охолоджування до кімнатної температури суміш розподіляли між водою і ЕtOАС. Органічний екстракт промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували і концентрували у вакуумі. Залишок піддавали хроматографії на сиРозчин 2-фтор-6-йодбензонітрилу (17,82г, лікагелі, елююючи 20% етилацетатом в гексанах з 72,15ммоль) і азидотриметилолова (15,00г, одержанням трет-бутил-1-[2-фтор-4-(4,4,5,572,88ммоль) в 150мл толуолу нагрівали до 125°С тетраметил-1,3,2-діоксаборолан-2протягом 72 годин. Розчин охолоджували до кіміл)феніл]етилкарбамату у вигляді липкої твердої натної температури і розподіляли між етилацетаречовини, яка давала спектр протонного ЯМР, що том і 0,5 н НСl. Органічний екстракт промивали узгоджуються з теорією. водою і насиченим сольовим розчином, сушили Суміш 5-(2-фтор-6-йодфеніл)-2-метил-2Ннад Na2SO4, фільтрували і концентрували у вакуутетразолу (1,49г, 4,89ммоль), трет-бутил-1-[2мі з одержанням 5-(2-фтор-6-йодфеніл)-1Hфтор-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2тетразолу, який давав спектри протонного ЯМР, іл)феніл]-етилкарбамату (1,70г, 4,65ммоль), кар+ що узгоджуються з теорією, і мас-іон (ES ) 291,01 бонату калію (1,61г, 11,6ммоль), три-о+ для М+Н . толілфосфіну (0,057г, 0,19ммоль) і ацетату палаСуміш 5-(2-фтор-6-йодфеніл)-1Н-тетразолу дію (0,010г, 0,05ммоль) в 20мл ТГФ і 4мл води (23,48г, 80,97ммоль), карбонату калію (16,79г, нагрівали в герметично закритій колбі при 100°С 0,121моль) і йодметану (16,09г, 0,113моль) в 25мл протягом ночі. Потім суміш охолоджували і концеДМФ перемішували при кімнатній температурі нтрували у вакуумі. Одержаний залишок розчиняпротягом 3 годин. Суміш розподіляли між етилацели в етилацетаті, промивали водою і насиченим татом і водою і органічний екстракт промивали сольовим розчином. сушили над Na2SO4, фільтруводою і насиченим сольовим розчином, сушили вали і концентрували у вакуумі. Залишок піддаванад Na2SO4, фільтрували і концентрували у вакуули хроматографії на силікагелі, елююючи 0-20% мі. Залишок піддавали хроматографії на силікагеетилацетатом в гексані з одержанням трет-бутиллі, елююючи 0-10% етилацетатом в гексанах з 1-[3,3'-дифтор-2'-(2-метил-2Н-тетразол-5-іл)-1,1'одержанням 5-(2-фтор-6-йодфеніл)-2-метил-2Нбіфеніл-4-іл]етилкарбамату у вигляді жовтого мастетразолу, який давав спектри протонного ЯМР, ла, яке давало спектри протонного ЯМР, що узго+ що узгоджуються з теорією, і мас-іон (ES ) 291,01 джуються з теорією. Цей продукт розчиняли в ети+ для М+Н . лацетаті і насичували газоподібним НСl. Розчин 43 77058 44 концентрували у вакуумі і азеотропно переганяли Вищезгаданий продукт розчиняли в етилаце3 рази з толуолом з одержанням 1-[3,3'-дифтор-2'таті і насичували газоподібним HCl. Розчин конце(2-метил-2Н-тетразол-5-іл)-1,1'нтрували у вакуумі і азеотропно переганяли 3 рази біфеніл]етанамінійхлориду. з толуолом з одержанням (1R)-1-[({1-[3,3'дифторРозчин 1-[3,3'-дифтор-2'-(2-метил-2Н2'-(2-метил-2Н-тетразол-5-іл)-1,1'-біфеніл-4тетразол-5-іл)-1,1'-біфеніл]-етанамінійхлориду іл]етил}аміно)карбоніл]циклопропанамінійхлориду, (0,670г, 1,89ммоль), Вос-1-аміноциклопропан-1який давав мас-іон (ES+) 499,7 для М+Н+. карбонової кислоти (0,419г, 2,08ммоль), 1-етил-(3До розчину вищезгаданої сполуки (0,105г, диметиламінопропіл)карбодіімід-карбонової кис0,241ммоль) в 2мл СН2Сl2 при 0°С додавали триелоти (0,726г, 3,79ммоль), 1-гідроксі-7тиламін (0,049г, 0,48ммоль) і трифтороцтовий аназабензотриазолу (0,010г, 0,15ммоль) і триетилагідрид (0,051г, 0,24ммоль). Розчин розбавляли міну (1,15г, 11,4ммоль) в 10мл СН2Сl2 перемішудодатковою кількістю СН2Сl2 і промивали водним вали при кімнатній температурі протягом 48 годин. бікарбонатом натрію і насиченим сольовим розчиЦей розчин промивали водним бікарбонатом наном, сушили над Na2SO4, фільтрували і конценттрію і насиченим сольовим розчином, сушили над рували. Залишок піддавали хроматографії на силіNa2SO4, фільтрували і концентрували. Залишок кагелі. елююючи 10-40% етилацетатом в гексанах піддавали хроматографії на силікагелі, елююючи з одержанням вказаної в заголовка сполуки, яке 10-50% етилацетатом в гексанах з одержанням давало спектри протонного ЯМР, що узгоджуються трет-бутил-1-[({1-[3,3'дифтор-2'-(2-метил-2Нз теорією, і мас-іон (ES+) 495,32 для М+Н+: 1Н ЯМР тетразол-5-іл)-1,1'-біфеніл-4-іл}аміно)карбоніл](300МГц, MeOH-d4) 7,68-7,61 (м. 1Н), 7.34-7,21 циклопропілкарбамату, який давав спектри про(м, 3Н), 6,89-6,83 (м, 2Н), 5,23 (д, J=7,1Гц, 1Н), тонного ЯМР, що узгоджуються з теорією, і мас-іон 4,86 (с, 3Н), 1,49 (д, J=3,7Гц, 2Н), 1,44 (д, J=7,1Гц, (ES+) 499,7 для М+Н+. Енантіомери розділяли в цій 3Н), 1,18-1,01 (м, 2Н). часовій точці на колонці Chiracel OD з використанНаступні сполуки в таблиці 1 одержували з виням суміші 10% ізопропанол/гексан (що містить користанням способів, аналогічних способам, опи0,1% ТФО). Спочатку елюювався R-енантіомер, і саних в прикладі 1. його використали для іншого синтезу. Наступні сполуки в таблиці 3 одержували з використанням способів, аналогічних способам, описаних у прикладі 1. Наступні сполуки в таблиці 2 одержували з використанням способів, аналогічних способам, описаних в прикладі 1. 45 77058 46 Наступні сполуки в таблиці 5 одержували з використанням способів, аналогічних способам, описаних у прикладі 2. Наступні сполуки в таблиці 6 одержували з використанням способів, аналогічних способам, описаних в прикладі 1. Наступні сполуки в таблиці 7 одержували з використанням способів, аналогічних способам, описаних у прикладі 1. Наступні сполуки в таблиці 8 одержували з використанням способів, аналогічних способам, описаних у прикладі 1. Наступні сполуки в таблиці 9 одержували з використанням способів, аналогічних способам, описаних у прикладі 3, з використанням комерційно доступної 1-[(третбутоксикарбоніл)аміно]циклобутанкарбонової кислоти замість 1-[(третбутоксикарбоніл)аміно]циклопропанкарбонової кислоти. 47 77058 48 Наступні сполуки в таблиці 10 одержували з використанням способів, аналогічних способам, описаних у прикладі 1, з використанням комерційно доступної 1-[(третбутоксикарбоніл)аміно]циклобутанкарбонової кислоти замість 1-[третбутоксикарбоніл)аміно]циклопропанкарбонової кислоти. Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюN-biphenyl(substituted methyl)aminocycloalkanecarboxamide derivatives are bradykinin b1 antagonists
Назва патенту російськоюПроизводные n-бифениламиноциклоалканкарбоксамида с замещенным метилом используются в качестве антагонистов брадикинина
Автори російськоюAnthony, Neville, J., Kuduk, Scott, D.
МПК / Мітки
МПК: C07C 237/24, C07D 413/12, A61P 11/06, A61P 11/08, A61K 31/41, A61P 1/16, A61P 17/06, C07D 271/06, A61P 13/12, A61P 1/18, A61P 37/08, A61P 19/08, C07D 261/18, A61P 35/00, A61K 31/42, A61P 21/00, A61K 31/24, A61P 31/04, A61K 31/505, A61P 1/04, C07D 403/12, A61K 31/166, A61P 11/00, A61P 19/02, A61P 25/06, A61P 25/28, A61P 9/10, C07D 239/28, C07D 213/82, A61P 17/02, A61P 29/00, A61P 13/10, A61P 25/04, A61P 27/16, A61K 31/4245, C07D 257/00, A61P 1/02
Мітки: заміщеним, антагоністи, застосовуються, метилом, похідні, брадикініну, n-біфенілметиламіноциклоалканкарбоксаміду
Код посилання
<a href="https://ua.patents.su/24-77058-pokhidni-n-bifenilmetilaminocikloalkankarboksamidu-z-zamishhenim-metilom-yaki-zastosovuyutsya-yak-antagonisti-bradikininu.html" target="_blank" rel="follow" title="База патентів України">Похідні n-біфенілметиламіноциклоалканкарбоксаміду з заміщеним метилом, які застосовуються як антагоністи брадикініну</a>
Попередній патент: Композиція на основі зипразидону, спосіб її одержання та спосіб контролю складу, фармацевтична композиція
Наступний патент: Кріплення рейок до шпали
Випадковий патент: Апарат для гравітаційного розподілу сумішей і екстрактивної очистки важкої фази












