Похідні піперазину або піперидину, спосіб їх одержання (варіанти), фармацевтична композиція та спосіб лікування захворювань (варіанти)
Номер патенту: 71538
Опубліковано: 15.12.2004
Автори: Плобек Ніклас, Валестедт Клаес, Робертс Едвард
Формула / Реферат
1. Производное пиперазина или пиперидина общей формулы (I)
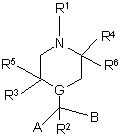 ,
,
где
G представляет собой атом углерода или азота;
А выбирают из
(i) фенила, замещенного любым из -СООН, -CONH2, СООСН3, -CN, NH2 или –СОСН3;
(ii) нафтила, бензофуранила и хинолинила; и
(iii)
 ,
,
 и
и
 ,
,
где фенильное кольцо каждого заместителя А может быть необязательно и независимо замещено одним или двумя заместителями, выбранными из водорода, СН3, (СН2)oСF3, CONR7R8, CO2R7, COR7, (CH2)oNR7R8, (CH2)оСН3(СН2)oSOR7, (CH2)oSO2R7 и (CH2)oSO2NR7R8, где о = 0, 1 или 2, a R7 и R8 имеют нижеуказанные значения;
R1 выбирают из водорода; разветвленного или прямого C1-С6 алкила, C1-С6 алкенила, -CO(C1-С6 алкила), (C1-С6 алкила)-В, где В имеет нижеуказанные значения; C3-С8 циклоалкила; C4-С8 (алкилциклоалкила), где алкил представляет собой C1-С2 алкил, а циклоалкил представляет собой C3-С6 циклоалкил; C6-С10 арила; и гетероарила, имеющего от 5 до 10 атомов, выбранных из любого из С, S, N и О; при этом C6-С10 арил и гетероарил могут быть необязательно замещены одним или двумя заместителями, выбранными из водорода, СН3, (СН2)оСF3, галогена, CONR7R8, CO2R7, COR7, (CH2)oNR7R8, (СН2)оСН3(CH2)oSOR7, (СН2)oSО2R7 и (CH2)oSO2NR7R8, где о = 0, 1 или 2, а R7 и R8 имеют нижеуказанные значения;
каждый из R7 и R8 независимо имеет значения, указанные выше для R1;
R2 выбирают из водорода, СН3, OR1, CO2R1 и CH2CO2R1, где R1 имеет вышеуказанные значения;
каждый из R9, R10, R13, R14, R17 и R18 независимо имеет значения, указанные выше для R1;
В выбирают из фенила, нафтила, индолила, бензофуранила, дигидробензофуранила, бензотиофенила, пиррила, фуранила, хинолинила, изохинолинила, циклогексила, циклогексенила, циклопентила, циклопентенила, инданила, инденила, тетрагид-ронафтила, тетрагидрохинила, тетрагидроизохинолинила, тетрагидрофуранила, пирролидинила, индазолинила и
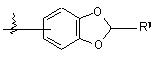 ,
,
при этом каждая В-группа необязательно замещена 1-2 заместителями, независимо выбранными из водорода, СН3, СF3, галогена, (CH2)pCONR7R8, (СН2)pNR7R8, (СН2)рСОR7 и OR7, где р = 0 или 1 и где R7 и R8 имеют вышеуказанные значения;
каждый из R3, R4, R5 и R6 независимо выбирают из R7, (CH2)pCONR7R8, (CH2)pNR7R8, (CH2)pCONR7R8, (CH2)pCO2R7, (CH2)pPh, (CH2)p(p-OHPh), (СН2)р-3-индолилa, (CH2)pSR7 и (CH2)pOR7, где p = 0, 1, 2, 3 или 4, а R7 и R8 имеют вышеуказанные значения;
а также фармацевтически приемлемые соли соединений формулы (I), их изомеры, гидраты, изоформы и пролекарства;
при условии, что В не может представлять собой
(a) фенил, замещенный гидроксилом, и его сложные эфиры;
(b) фенил, замещенный амино и карбоксамидами;
(с) фенил, замещенный СН3, галогеном или группой OR7, где R7 представляет С1-С4 алкил, когда А представляет собой фенил, замещенный -СООН, G представляет N, R2, R3, R4, R5, R6 представляют Н и R1 представляет С1-С4 алкил.
2. Соединение формулы I по п.1, где
G представляет собой атом углерода или азота;
А выбирают из
(i) фенила, замещенного любым из -СООН, -CONH2, СООСН3, -CN, NH2 или -СОСН3;
(ii) нафтила, бензофуранила и хинолинила; и
(iii)
 ,
,
 и
и
 ,
,
где фенильное кольцо каждого заместителя А может быть необязательно и независимо замещено одним или двумя заместителями, выбранными из водорода, СН3, (СН2)oСF3, CONR7R8, CO2R7, COR7, (CH2)oNR7R8, (CH2)оСН3(СН2)oSOR7, (CH2)oSO2R7 и (CH2)oSO2NR7R8, где о = 0, 1 или 2, a R7 и R8 имеют нижеуказанные значения;
R1, R7 и R8 каждый независимо выбирают из водорода; разветвленного или прямого C1-C4 алкила, аллила, -СО-(C1-C6 алкила); C3-C5 циклоалкилa; C4-C8 (алкил-циклоалкилa), где алкил представляет собой C1-C2 алкил, а циклоалкил представляет собой C3-C6 циклоалкил; и фенила;
R2 представляет собой водород, метил или OR1, где R1 имеет вышеуказанные значения;
R9, R10, R13, R14, R17 и R18 каждый независимо имеет значения, указанные выше для R1;
В выбирают из фенила, нафтила, индолила, бензофуранила, дигидробензофуранила, бензотиофенила, пиррила, фуранила, хинолинила, изохинолинила, циклогексила, циклогексенила, циклопентила, циклопентенила, инданила, инденила, тетрагид-ронафтила, тетрагидрохинила, тетрагидроизохинолинила, тетрагидрофуранила, пирролидинила, индазолинила и
 ,
,
при этом каждая В-группа необязательно замещена 1-2 заместителями, независимо выбранными из водорода, СН3, СF3, галогена, (CH2)рСОNR7R8, (CH2)рNR7R8, (CH2)рСOR7 и OR7, где р = 0 или 1, и где R7 и R8 имеют вышеуказанные значения;
R3, R4, R5 и R6 каждый независимо выбирают из водорода, СН3, СН(Ме)2, CH2CH(Me)2, CH(Me)СН2СН3(CH2)pCONR7R8, (СН2)рNR7R8, (CH2)pCONR7R8, (CH2)pCО2R7, (CH2)pPh, (CH2)p(p-OHPh), (СН2)р-3-индолила, (CH2)pSR7 и (СН2)рОR7, где р = 0, 1, 2 или 3, и где R7 и R8 имеют вышеуказанные значения;
при условии, что В не может представлять собой
(a) фенил, замещенный гидроксилом, и его сложные эфиры;
(b) фенил, замещенный амино и карбоксамидами;
(с) фенил, замещенный СН3, галогеном или группой OR7, где R7 представляет С1-С4 алкил, когда А представляет собой фенил, замещенный -СООН, G представляет N, R2, R3, R4, R5, R6 представляют Н и R1 представляет С1-С4 алкил.
3. Соединение формулы I по п.1, где
G представляет собой атом азота;
А выбирают из
 ,
,
 и
и
 ,
,
где
R9, R10, R13, R14, R17 и R18 каждый представляет собой этиловую группу;
R1 выбирают из водорода, метила, этила, аллила или СН2-циклопропила;
R2 представляет собой Н, метил или OR1;
В выбирают из фенила, нафтила, индолила, бензофуранила, дигидробензофуранила, бензотиофенила, фуранила, хинолинила, изохинолинила, циклогексила, циклогексенила, циклопентила, циклопентенила, инданила, инденила, тетрагидронафтила, тетрагидрохинила, тетрагидроизохинолинила, тетрагидрофуранила, индазолинила и
 ,
,
при этом каждая В-группа необязательно замещена 1-2 заместителями, независимо выбранными из водорода, метила, СF3, галогена, (CH2)рСОNR7R8, (CH2)рNR7R8, (CH2)рСOR7 и OR7, где р = 0 или 1, и где R7 и R8 имеют значения, указанные выше для R1;
каждый из R3, R4, R5 и R6 независимо выбирают из Н, СН3, СН(Ме)2, CH2CH(Me)2, CH(Me)СН2СН3(CH2)pCONR7R8, (СН2)рNR7R8, (CH2)pCONR7R8, (CH2)pCО2R7, (CH2)pPh, (CH2)p(p-OHPh), (СН2)р-3-индолила, (CH2)pSR7 и (СН2)рОR7; где р = 0, 1 или 2, и где R7 и R8 имеют вышеуказанные значения.
4. Соединение формулы (I) по п.1, представляющее собой любое из следующих соединений:
(±)-транс-1-(3-метокси-![]() -(1-нафтил)бензил)-2,5-диметилпиперазин;
-(1-нафтил)бензил)-2,5-диметилпиперазин;
(±)-3-((![]() R*/S*)-
R*/S*)-![]() -((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-1-нафтил)анизол;
-((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-1-нафтил)анизол;
(±)-транс-1-(3-метокси-![]() -(2-нафтил)бензил)-2,5-диметилпиперазин;
-(2-нафтил)бензил)-2,5-диметилпиперазин;
(±)-3-((![]() R*/S*)-
R*/S*)-![]() -((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-2-нафтил)анизол;
-((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-2-нафтил)анизол;
(±)-транс-1-(3-метокси-![]() -(2'-бензофуранил)бензил)-2,5-диметилпиперазин;
-(2'-бензофуранил)бензил)-2,5-диметилпиперазин;
(±)-3-((![]() R*/S*)-
R*/S*)-![]() -((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-2-бензофуранил)анизол;
-((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-2-бензофуранил)анизол;
(±)-3-((![]() R*/S*)-
R*/S*)-![]() -((2S*,5R*)-4-циклопропилметил-2,5-диметил-1-пиперазинил)-2-бензофуранил)анизол;
-((2S*,5R*)-4-циклопропилметил-2,5-диметил-1-пиперазинил)-2-бензофуранил)анизол;
(±)-транс-1-(3-метокси-![]() -(6'-хинолинил)бензил)-2,5-диметилпиперазин;
-(6'-хинолинил)бензил)-2,5-диметилпиперазин;
(±)-3-((![]() R*/S*)-
R*/S*)-![]() -((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-6-хинолинил)анизол;
-((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-6-хинолинил)анизол;
(±)-3-((![]() R*/S*)-
R*/S*)-![]() -((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-6-хинолинил)анизол;
-((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-6-хинолинил)анизол;
(±)-3-((![]() R*/S*)-
R*/S*)-![]() -((2S*,5R*)-4-циклопропилметил-2,5-диметил-1-пиперазинил)-6-хинолинил)анизол;
-((2S*,5R*)-4-циклопропилметил-2,5-диметил-1-пиперазинил)-6-хинолинил)анизол;
(±)-транс-1-(3-метокси-![]() -(4-хинолинил)бензил)-2,5-диметилпиперазин;
-(4-хинолинил)бензил)-2,5-диметилпиперазин;
(±)-3-((![]() R*/S*)-
R*/S*)-![]() -((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-4-хинолинил)анизол;
-((2S*,5R*)-4-аллил-2,5-диметил-1-пиперазинил)-4-хинолинил)анизол;
(±)4-((![]() -(1-пиперазинил))-4-хлорбензил)-N,N-диэтилбензамид;
-(1-пиперазинил))-4-хлорбензил)-N,N-диэтилбензамид;
(±)4-((![]() -(4-аллил))-1-пиперазинил))-4-хлорбензил)-N,N-диэтилбензамид•2НСl;
-(4-аллил))-1-пиперазинил))-4-хлорбензил)-N,N-диэтилбензамид•2НСl;
(±)4-((![]() -(1-пиперазинил))-2-нафтилметил)-N,N-диэтилбензамид;
-(1-пиперазинил))-2-нафтилметил)-N,N-диэтилбензамид;
(±)4-((![]() -((4-аллил))-1-пиперазинил))-2-нафтилметил)-N,N-диэтилбензамид;
-((4-аллил))-1-пиперазинил))-2-нафтилметил)-N,N-диэтилбензамид;
(±)4-((![]() -(1-пиперазинил))-4-ксилил)-N,N-диэтилбензамид;
-(1-пиперазинил))-4-ксилил)-N,N-диэтилбензамид;
(±)4-((![]() -((4-аллил)-1-пиперазинил))-4-ксилил)-N,N-диэтилбензамид•2НСl;
-((4-аллил)-1-пиперазинил))-4-ксилил)-N,N-диэтилбензамид•2НСl;
(±)4-((![]() -(1-пиперазинил))-3-ксилил)-N,N-диэтилбензамид•2НСl;
-(1-пиперазинил))-3-ксилил)-N,N-диэтилбензамид•2НСl;
(±)4-((![]() -(1-пиперазинил))-циклогексилметил)-N,N-диэтилбензамид;
-(1-пиперазинил))-циклогексилметил)-N,N-диэтилбензамид;
(±)4-((![]() -(1-пиперазинил))-3,4-диметилбензил)-N,N-диэтилбензамид;
-(1-пиперазинил))-3,4-диметилбензил)-N,N-диэтилбензамид;
(±)4-((![]() -(1-пиперазинил))-1-нафтилметил)-N,N-диэтилбензамид;
-(1-пиперазинил))-1-нафтилметил)-N,N-диэтилбензамид;
4-(4-(2-диметил-5-метилпиперазинил)-3-метоксибензил)-N,N-диэтилбензамид дигидрохлорид;
4-(4-(1-аллил-2-диметил-5-метилпиперазинил)-3-метоксибензил)-N,N-диэтилбензамид дигидрохлорид;
4-(1-(4-аллил-2-диметил-5-метилпиперазинил)-3-метоксибензил)-N,N-диэтилбензамид дигидрохлорид;
4-(1-(2-диметил-5-метилпиперазинил)-3-метоксибензил)- N,N-диэтилбензамид дигидрохлорид;
4-((1-пиперазинил)бензил)-N,N-диэтилбензамид дигидрохлорид;
4-((4-аллил-1-пиперазинил)бензил)-N,N-диэтилбензамид дигидрохлорид;
4-((4-ацетил-1-пиперазинил)бензил)-N,N-диэтилбензамид гидрохлорид;
4-(4-(2-гидроксиметил-5-метил)пиперазинилбензил)-N,N-диэтилбензамид дигидрохлорид;
4-((4-(2-гидроксиметил-5-метил)пиперазинил)-3-метокси-бензил)-N,N-диэтилбензамид дигидрохлорид;
4-((4-(1-аллил-2-гидроксиметил-5-метил)пиперазинил)-3-метоксибензил)-N,N-диэтилбензамид дигидрохлорид;
метил 3-((2-нафтил)-(3-метилпиперазинил)метил)фениловый эфир дигидрохлорид;
метил 3-((2-нафтил)-(4-аллил-2-метилпиперазинил)метил)фениловый эфир дигидрохлорид;
4-((1-пиперазинил)бензил)бензойной кислоты дигидрохлорид;
4-((1-пиперазинил)бензил)-N-этилбензамид гидрохлорид;
метил 4-((4-трет-бутоксикарбонил-1-пиперазинил)бензил)бензоат;
метил 4-((1-пиперазинил)бензил)бензоат дигидрохлорид;
4-(1-пиперазинилбензил)бензонитрил дигидрохлорид;
4-(1-пиперазинилбензил)ацетофенон дигидрохлорид;
4-((![]() -4-пиперидинил)бензил)-N,N-диэтилбензамид;
-4-пиперидинил)бензил)-N,N-диэтилбензамид;
N,N-диэтил-4-(3-метоксибензил-1-пиперазинил)бензамид;
N,N-диэтил-4-[(4-аллил-1-пиперазинил)-3-метоксибензил]бензамид;
4-[(N-бензил-1-пиперазинил)бензил]анилин;
4-[(N-бензил-1-пиперазинил)бензил]ацетанилид;
4-[(N-бензил-1-пиперазинил)бензил]метансульфонамид;
метил-N-4-[(N-бензил-1-пиперазинил)бензил]-2-метилацетат; и
4-[(N-бензил-1-пиперазинил)-3-фторбензил]ацетанилид.
5. Соединение по любому из пп.1-4 в виде его гидрохлоридной соли.
6. Соединение по любому из пп.1-5 для использования в терапии.
7. Соединение по п.6, предназначенное для снятия боли.
8. Соединение по п. 6, предназначенное для терапии желудочно-кишечных заболеваний.
9. Соединение по п. 6, предназначенное для терапии повреждений позвоночника.
10. Соединение по п. 6, предназначенное для терапии нарушений симпатической нервной системы.
11. Соединение по любому из пп.1-5, обладающее анальгезирующей активностью.
12. Соединение по любому из пп.1-5, дополнительно меченое изотопами.
13. Способ лечения желудочно-кишечных заболеваний, отличающийся тем, что пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения по любому из пп. 1-5.
14. Способ лечения повреждений позвоночника, отличающийся тем, что пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения по любому из пп. 1-5.
15. Фармацевтическая композиция, содержащая эффективное количество соединения по любому из пп.1-5 в качестве активного ингредиента вместе с фармацевтически приемлемым носителем.
16. Способ получения соединения по любому из пп.1-5, отличающийся тем, что
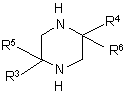
(i) альдегид R'-CHO или кетон R'-C(=О)-R обрабатывают нуклеофилом, таким как реактив Гриньяра R''-MgY, где Y представляет атом галогена, или литийорганический реагент R''-Li, с получением соответствующего спирта R'-CH(ОН)-R'' или R'-CR(ОН)-R'', в котором фрагмент R'-CH-R'' или R'-С(R)-R'' соответствует по структуре R1, определенному в п. 1;
(ii) полученный спирт R'-CH(ОН)-R'' или R'-CR(ОН)-R'' превращают в производное R'-CН(Х)-R'' или R'-CR(X)-R'' с удобной уходящей группой X, такой как сложный эфир, сульфонат или галогенид, которую, в свою очередь, замещают нуклеофилом, таким как замещенный или незамещенный пиперазин формулы
 ,
,
где R3, R4, R5 и R6 определены в п. 1; и
(iii) полученное производное N-(4)-незамещенного пиперазина формулы
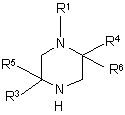
подвергают замещению у атома азота действием органического галогенида R2-C(А)(В)-Y, где R2 определен в п. 1, или аналогичного соединения, или же необязательно подвергают его ацилированию подходящим ацилирующим агентом.
17. Способ получения соединения по любому из пп. 1-5, отличающийся тем, что
(i) N-защищенный сложный эфир аминокислоты
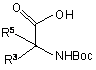
подвергают взаимодействию со вторым эфиром аминокислоты
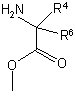 ,
,
затем проводят обработку кислотой с получением пиперазиндиона
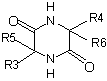 ,
,
в котором R3, R4, R5 и R6 определены в п. 1;
(ii) полученный пиперазиндион подвергают восстановлению до соответствующего пиперазина
 , и
, и
(iii) проводят алкилирование полученного пиперазина действием органического галогенида R2-C(А)(В)-Y, где R2 определен в п. 1, или аналогичного соединения, или же подвергают его ацилированию подходящим ацилирующим агентом по одному или более атомам азота.
18. Способ устранения боли, отличающийся тем, что пациенту вводят эффективное количество соединения по любому из пп.1-5.
Текст
1. Производное пиперазина или пиперидина общей формулы (I) 2 (19) 1 3 71538 4 (CH2)pCO2R7, (CH2)pPh, (CH 2) p(p-OHPh), (СН2)р-3O индолилa, (CH2)pSR7 и (CH2)pOR7, где p = 0, 1, 2, 3 R7 7 8 или 4, а R и R имеют выше указанные значения; O , а также фармацевтически приемлемые соли соепри этом каждая В-группа необязательно замещединений формулы (I), их изомеры, гидраты, изона 1-2 заместителями, независимо выбранными из формы и пролекарства; водорода, СН3, СF3, галогена, (CH2)рСОNR7R8, при условии, что В не может представлять собой (CH2)рNR7R8, (CH2)рСOR7 и OR7, где р = 0 или 1, и (a) фенил, замещенный гидроксилом, и его сложгде R7 и R8 имеют выше указанные значения; ные эфиры; R3, R4, R5 и R6 каждый независимо выбирают из (b) фенил, замещенный амино и карбоксамидами; водорода, СН3, СН(Ме)2, CH2CH(Me)2, (с) фенил, замещенный СН3, галогеном или групCH(Me)СН2СН3(CH2)pCONR7R8, (СН2)рNR7R8, 7 7 пой OR , где R представляет С1-С4 алкил, когда А 7 8 7 (CH2)pCONR R , (CH2)pCО2R , (CH2)pPh, (CH 2)p(pпредставляет собой фенил, замещенный -СООН, OHPh), (СН2)р-3-индолила, (CH2)pSR7 и (СН2)рОR7, 2 3 4 5 6 G представляет N, R , R , R , R , R представляют где р = 0, 1, 2 или 3, и где R7 и R8 имеют вышеукаН и R1 представляет С1-С4 алкил. занные значения; 2. Соединение формулы I по п.1, где при условии, что В не может представлять собой G представляет собой атом углерода или азота; (a) фенил, замещенный гидроксилом, и его сложА выбирают из ные эфиры; (i) фенила, замещенного любым из -СООН, (b) фенил, замещенный амино и карбоксамидами; CONH2, СООСН 3, -CN, NH 2 или -СОСН3; (с) фенил, замещенный СН3, галогеном или груп(ii) нафтила, бензофуранила и хинолинила; и пой OR7, где R7 представляет С1-С4 алкил, когда А (iii) представляет собой фенил, замещенный -СООН, O R9 N R10 , R13 R14 O R9 N N O O R18 G представляет N, R2, R3, R4, R5, R6 представляют Н и R1 представляет С1-С4 алкил. 3. Соединение формулы I по п.1, где G представляет собой атом азота; А выбирают из R 17 R10 и N , где фенильное кольцо каждого заместителя А может быть необязательно и независимо замещено одним или двумя заместителями, выбранными из водорода, СН3, (СН2)oСF3, CONR7R8, CO2R7, COR7, (CH2)oNR7R8, (CH2) оСН3(СН2)oSOR7, 7 7 8 (CH2)oSO2R и (CH2)oSO 2NR R , где о = 0, 1 или 2, a R7 и R8 имеют нижеуказанные значения; R1, R7 и R8 каждый независимо выбирают из водорода; разветвленного или прямого C1-C4 алкила, аллила, -СО-(C1-C6 алкила); C3-C5 циклоалкилa; C4-C8 (алкил-циклоалкилa), где алкил представляет собой C1-C2 алкил, а циклоалкил представляет собой C3-C6 циклоалкил; и фенила; R2 представляет собой водород, метил или OR1, где R1 имеет вышеуказанные значения; R9, R10 , R13 , R14, R17 и R18 каждый независимо имеет значения, указанные выше для R1; В выбирают из фенила, нафтила, индолила, бензофуранила, дигидробензофуранила, бензотиофенила, пиррила, фуранила, хинолинила, изохинолинила, циклогексила, циклогексенила, циклопентила, циклопентенила, инданила, инденила, тетрагид-ронафтила, тетрагидрохинила, тетрагидроизохинолинила, тетрагидрофуранила, пирролидинила, индазолинила и , R13 R14 N O O R18 и R17 N , где R9, R10, R13, R14 , R17 и R18 каждый представляет собой этиловую гр уппу; R1 выбирают из водорода, метила, этила, аллила или СН 2-циклопропила; R2 представляет собой Н, метил или OR1; В выбирают из фенила, нафтила, индолила, бензофуранила, дигидробензофуранила, бензотиофенила, фуранила, хинолинила, изохинолинила, циклогексила, циклогексенила, циклопентила, циклопентенила, инданила, инденила, тетрагидронафтила, тетрагидрохинила, тетрагидроизохинолинила, тетрагидрофуранила, индазолинила и O R7 O , при этом каждая В-группа необязательно замещена 1-2 заместителями, независимо выбранными из водорода, метила, СF3, галогена, (CH2)рСОNR7R8, (CH2)рNR7R8, (CH2)рСOR7 и OR7, где р = 0 или 1, и где R7 и R8 имеют значения, указанные выше 5 71538 6 для R1; (±)4-(( a -(1-пиперазинил))-1-нафтилметил)-N,Nкаждый из R3, R4, R5 и R6 независимо выбирают из диэтилбензамид; Н, СН3, СН(Ме)2, CH2CH(Me)2, 4-(4-(2-диметил-5-метилпиперазинил)-37 8 7 8 CH(Me)СН2СН3(CH2)pCONR R , (СН2)рNR R , метоксибензил)-N,N-диэтилбензамид дигидрохло7 8 7 (CH2)pCONR R , (CH2)pCО2R , (CH2)pPh, (CH 2)p(pрид; 7 7 OHPh), (СН2)р-3-индолила, (CH2)pSR и (СН2)рОR ; 4-(4-(1-аллил-2-диметил-5-метилпиперазинил)-37 8 где р = 0, 1 или 2, и где R и R имеют вышеукаметоксибензил)-N,N-диэтилбензамид дигидрохлозанные значения. рид; 4. Соединение формулы (I) по п.1, представляю4-(1-(4-аллил-2-диметил-5-метилпиперазинил)-3щее собой любое из следующих соединений: метоксибензил)-N,N-диэтилбензамид дигидрохло(±)-транс-1-(3-метокси- a -(1-нафтил)бензил)-2,5диметилпиперазин; (±)-3-(( a R*/S*)- a -((2S*,5R*)-4-аллил-2,5диметил-1-пиперазинил)-1-нафтил)анизол; (±)-транс-1-(3-метокси- a -(2-нафтил)бензил)-2,5диметилпиперазин; (±)-3-(( a R*/S*)- a -((2S*,5R*)-4-аллил-2,5диметил-1-пиперазинил)-2-нафтил)анизол; (±)-транс-1-(3-метокси- a -(2'бензофуранил)бензил)-2,5-диметилпиперазин; (±)-3-(( a R*/S*)- a -((2S*,5R*)-4-аллил-2,5диметил-1-пиперазинил)-2-бензофуранил)анизол; (±)-3-(( a R*/S*)- a -((2S*,5R*)-4циклопропилметил-2,5-диметил-1-пиперазинил)-2бензофуранил)анизол; (±)-транс-1-(3-метокси- a -(6'-хинолинил)бензил)2,5-диметилпиперазин; (±)-3-(( a R*/S*)- a -((2S*,5R*)-4-аллил-2,5диметил-1-пиперазинил)-6-хинолинил)анизол; (±)-3-(( a R*/S*)- a -((2S*,5R*)-4-аллил-2,5диметил-1-пиперазинил)-6-хинолинил)анизол; (±)-3-(( a R*/S*)- a -((2S*,5R*)-4циклопропилметил-2,5-диметил-1-пиперазинил)-6хинолинил)анизол; (±)-транс-1-(3-метокси- a -(4-хинолинил)бензил)2,5-диметилпиперазин; (±)-3-(( a R*/S*)- a -((2S*,5R*)-4-аллил-2,5диметил-1-пиперазинил)-4-хинолинил)анизол; (±)4-(( a -(1-пиперазинил))-4-хлорбензил)-N,Nдиэтилбензамид; (±)4-(( a -(4-аллил))-1-пиперазинил))-4хлорбензил)-N,N-диэтилбензамид•2НСl; (±)4-(( a -(1-пиперазинил))-2-нафтилметил)-N,Nдиэтилбензамид; (±)4-(( a -((4-аллил))-1-пиперазинил))-2нафтилметил)-N,N-диэтилбензамид; (±)4-(( a -(1-пиперазинил))-4-ксилил)-N,Nдиэтилбензамид; (±)4-(( a -((4-аллил)-1-пиперазинил))-4-ксилил)N,N-диэтилбензамид•2НСl; (±)4-(( a -(1-пиперазинил))-3-ксилил)-N,Nдиэтилбензамид•2НСl; (±)4-(( a -(1-пиперазинил))-циклогексилметил)N,N-диэтилбензамид; (±)4-(( a -(1-пиперазинил))-3,4-диметилбензил)N,N-диэтилбензамид; рид; 4-(1-(2-диметил-5-метилпиперазинил)-3метоксибензил)- N,N-диэтилбензамид дигидрохлорид; 4-((1-пиперазинил)бензил)-N,N-диэтилбензамид дигидрохлорид; 4-((4-аллил-1-пиперазинил)бензил)-N,Nдиэтилбензамид дигидрохлорид; 4-((4-ацетил-1-пиперазинил)бензил)-N,Nдиэтилбензамид гидрохлорид; 4-(4-(2-гидроксиметил-5метил)пиперазинилбензил)-N,N-диэтилбензамид дигидрохлорид; 4-((4-(2-гидроксиметил-5-метил)пиперазинил)-3метокси-бензил)-N,N-диэтилбензамид дигидрохлорид; 4-((4-(1-аллил-2-гидроксиметил-5метил)пиперазинил)-3-метоксибензил)-N,Nдиэтилбензамид дигидрохлорид; метил 3-((2-нафтил)-(3метилпиперазинил)метил)фениловый эфир дигидрохлорид; метил 3-((2-нафтил)-(4-аллил-2метилпиперазинил)метил)фениловый эфир дигидрохлорид; 4-((1-пиперазинил)бензил)бензойной кислоты дигидрохлорид; 4-((1-пиперазинил)бензил)-N-этилбензамид гидрохлорид; метил 4-((4-трет-бутоксикарбонил-1пиперазинил)бензил)бензоат; метил 4-((1-пиперазинил)бензил)бензоат дигидрохлорид; 4-(1-пиперазинилбензил)бензонитрил дигидрохлорид; 4-(1-пиперазинилбензил)ацетофенон дигидрохлорид; 4-(( a -4-пиперидинил)бензил)-N,Nдиэтилбензамид; N,N-диэтил-4-(3-метоксибензил-1пиперазинил)бензамид; N,N-диэтил-4-[(4-аллил-1-пиперазинил)-3метоксибензил]бензамид; 4-[(N-бензил-1-пиперазинил)бензил]анилин; 4-[(N-бензил-1-пиперазинил)бензил]ацетанилид; 4-[(N-бензил-1пиперазинил)бензил]метансульфонамид; метил-N-4-[(N-бензил-1-пиперазинил)бензил]-2метилацетат; и 4-[(N-бензил-1-пиперазинил)-3фторбензил]ацетанилид. 5. Соединение по любому из пп.1-4 в виде его гидрохлоридной соли. 6. Соединение по любому из пп.1-5 для использования в терапии. 7 71538 8 R1 7. Соединение по п.6, предназначенное для снятия боли. R4 N 8. Соединение по п. 6, предназначенное для тераR5 пии желудочно-кишечных заболеваний. R6 9. Соединение по п. 6, предназначенное для тераN R3 H пии повреждений позвоночника. подвергают замещению у атома азота действием 10. Соединение по п. 6, предназначенное для теорганического галогенида R2-C(А)(В)-Y, где R2 рапии нарушений симпатической нервной систеопределен в п. 1, или аналогичного соединения, мы. или же необязательно подвергают его ацилирова11. Соединение по любому из пп.1-5, обладающее нию подходящим ацилирующим агентом. анальгезирующей активностью. 17. Способ получения соединения по любому из 12. Соединение по любому из пп.1-5, дополнитепп. 1-5, отличающийся тем, что льно меченое изотопами. (i) N-защищенный сложный эфир аминокислоты 13. Способ лечения желудочно-кишечных заболеO ваний, отличающийся тем, что пациенту, н уждаOH ющемуся в таком лечении, вводят эффективное R5 количество соединения по любому из пп. 1-5. NHBoc R3 14. Способ лечения повреждений позвоночника, подвергают взаимодействию со вторым эфиром отличающийся тем, что пациенту, н уждающемуаминокислоты ся в таком лечении, вводят эффективное количесR4 H2N тво соединения по любому из пп. 1-5. 15. Фармацевтическая композиция, содержащая R6 эффективное количество соединения по любому из пп.1-5 в качестве активного ингредиента вместе O O с фармацевтически приемлемым носителем. , 16. Способ получения соединения по любому из затем проводят обработку кислотой с получением пп.1-5, отличающийся тем, что пиперазиндиона (i) альдегид R'-CHO или кетон R'-C(=О)-R обрабаH тывают нуклеофилом, таким как реактив Гриньяра R4 N O R''-Mg Y, где Y представляет атом галогена, или R5 R6 литийорганический реагент R''-Li, с получением N R3 O соответствующего спирта R'-CH(ОН)-R'' или R'H , CR(ОН)-R'', в котором фрагмент R'-CH-R'' или R'3 в котором R , R4, R5 и R6 определены в п. 1; 1 С(R)-R'' соответствует по стр уктуре R , опреде(ii) полученный пиперазиндион подвергают воссленному в п. 1; тановлению до соответствующего пиперазина (ii) полученный спирт R'-CH(ОН)-R'' или R'H CR(ОН)-R'' превращают в производное R'-CН(Х)R4 N R'' или R'-CR(X)-R'' с удобной уходящей группой X, R5 R6 такой как сложный эфир, сульфонат или галогеN нид, которую, в свою очередь, замещают нуклеоR3 H филом, таким как замещенный или незамещенный ,и пиперазин формулы (iii) проводят алкилирование полученного пипераH зина действием органического галогенида R2R4 N C(А)(В)-Y, где R2 определен в п. 1, или аналогичR5 ного соединения, или же подвергают его ацилироR6 ванию подходящим ацилирующим агентом по одN R3 ному или более атомам азота. H , 18. Способ устранения боли, отличающийся тем, 3 4 5 6 где R , R , R и R определены в п. 1; и что пациенту вводят эффективное количество (iii) полученное производное N-(4)-незамещенного соединения по любому из пп.1-5. пиперазина формулы Область изобретения Настоящее соединение относится к новым соединениям, к способу их получения, их использованию и фармацевтическим композициям, включающим эти соединения. Новые соединения могут быть использованы в терапии, в частности, для снятия боли. Предпосылки изобретения и известный уровень техники Было установлено, что δ-рецептор играет ва жную роль во многих функциях организма, таких как сердечно-сосудистая и болевая системы. Поэтому лиганды для δ-рецептора могут быть потенциально использованы в качестве анальгетиков и/или гипотензивных средств. Было также установлено, что лиганды для δ-рецептора также обладают иммуномодулирующей активностью. Идентификация, по крайней мере, трех различных популяций опиоидных рецепторов (m, δ и к) в настоящее время легко осуществима, и все три 9 71538 10 вида рецепторов легко обнаружить как в центральной, так и периферической нервной системе многих видов, включая человека. Известные в настоящее время селективные опиоидные δ-ли-ганды, за небольшим исключением, имеют пептидную природу и не подходят для введения системными способами. Некоторое время использовались непептидные δ-антагонисты (описание дано Takemori and Portoghese, 1992, Ann.Rev.Pharmacol.Tox., 32:239-269). Эти соединения, например налтриндол, обладают весьма где фенильное кольцо каждого заместителя А низкой (например, более чем в 10 раз) селективможет быть необязательно и независимо замещеностью по отношению к δ-рецептору против свяно одним или двумя заместителями, выбранными зывания μ-рецептора и не проявляют анальтезииз водорода, СН3, (СН2)oCF галогена, CONR7R8 рующей активности, что подчеркивает CO2R7, COR7 , (CH2)oNR7R8 , (CH2)oCH3(CH2) oSOR7, необходимость разработки высокоселективных (CH2)oSO2R7 и (CH2) oSO2NR7R8 , где о = 0, 1 или 2, непептидных δ-агонистов. a R7 и R8 имеют нижеуказанные значения; Недавно непептидный δ-агонист, BW 373U86 R1 выбирают из водорода; разветвленного или был описан Ghang et al., 1993, прямого C1-С6 алкила, С1-С6 алкенила, -СО(С1-С6 J.Pharmacol.Exp.Ther., 267:852-857, как первый δалкил); (С1-С6 алкил)-В, где В имеет нижеуказанселективный непептидный агонист, обладающий ные значения; C3-C8 циклоалкила; С4-С8 (алкиланаль-гезирующей активностью, однако он имеет циклоалкил), где алкил представляет собой C1-C2 существенную аффинность по отношению к μалкил, а циклоалкил представляет собой С 3-С6 рецептору. циклоалкил; С6-С10 арила; и гетероарила, имеюТаким образом, целью настоящего изобретещего от 5 до 10 атомов, выбранных из любого из ния является обнаружение новых анальгетиков, С, S, N и О; при этом C6-C10 арил и гетероарил обладающих хорошим аналь-гезирующим дейстмогут быть необязательно замещены одним или вием, а также меньшим побочным действием по двумя заместителями, выбранными из водорода, сравнению с существующими μ-агонистами и поСН3, (СН2)oСF3 , галогена, CONR7R8, CO2R7, COR7, тенциальной пероральной эффективностью. (CH2)oNR7R8, (CH2)oCH3(CH2)oSOR7 , (CH2)oSO 2R7 и Идентифицированные известные анальгетики (CH2)oSO2NR7R8, где о - 0, 1 или 2, a R 7 и R8 имеют имеют много недостатков: они обладают плохими нижеуказанные значения; фармакокинетическими свойствами и не оказывакаждый из R7 и R8 независимо имеет значеют анальтезирующего действия при введении сисния, указанные выше для R1; темными способами. Также было подтверждено R2 выбирают из водорода, СН3, OR1, СО2R1 и документально, что предпочтительные соединеСH2СО2R1, где R 1 имеет вышеуказанные значения; ния, описанные ранее, при систематическом ввекаждый из R9, R10, R11 , R12, R13, R 14, R15, R16 , дении вызывают значительный конвульсивный 17 R и R18 независимо имеет значения, указанные эффект. выше для R1; В WO93/15062 и WO95/045051 описаны некоВ представляет собой замещенный или незаторые диарил-метилпиперазиновые и диарилмемещенный ароматический, необязательно заметилпиперидиновые соединения, включая щенный C5-С10 гидроароматический, гетероаромаBW373U86, однако эти известные соединения тический или гетерогидроароматический остаток, отличаются по структуре от соединений в сооткаждый из которых имеет от 5 до 10 атомов, выбветствии с настоящим изобретением. ранных из любого из С, S, N и О, будучи необязаВышеупомянутая цель была достигнута путем тельно и независимо замещенным одним или разработки новых пиперазиновых и пиперидинодвумя заместителями, независимо выбранными из вых соединений, как описано ниже. водорода, СН3, CF3, галогена, (CH2)pCONR7R8, Описание изобретения (CH2)pNR7R8, (CH2)pCOR7, (CH2)pCO2R7 , OR7, Новые соединения в соответствии с настоя(CH2)pSOR7, (CH2)pSO2R7 и (CH2)pSO2-NR7R8; где p щим изобретением имеют формулу (I) = 0, 1, 2 или 3 и где R 7 и R8 имеют вышеуказанные значения; каждый из R3, R4, R5 и R6 независимо выбирают из R7, (CH2)pCONR7R9 , (CH2)pNR7R8, 7 8 7 (CH2)pCONR R , (CH2)pCO2R , (CH2)pPh, (CH 2)p(pOHPh), (СН2)р-3-индолил, (CH2)pSR7n (CH2)pOR7; где р = 0, 1, 2, 3 или 4, a R7 и R8 имеют вышеукагде занные значения; G представляет собой атом углерода или азопри условии, что когда А представляет собой та; фенильное кольцо, замещенное группой -CN или А выбирают из группой -NH2, В не может быть (і) фенила, замещенного любым из -COOH, CONH2, COOCH 3, -CN, NH 2 или -СОСН3; (ii) нафтила, бензофуранила и хинолинила; и 11 71538 12 где (CH2)pCONR7R8, (CH2)pCO2R7, (CH2)pPh, (CH 2)p(pΖ1 представляет собой гидроксил и его эфиры; OHPh), (CH 2)p-3- индолила, (CH2)pSR7 и (CH2)pOR7, гидроксимегил и его эфиры; или амино, а также где p = 0, 1, 2 или 3, и где R7 и R8 имеют вышеукакарбоксамиды и сульфонамиды. В объем данного занные значения; изобретения входят фармацевтически приемлепри условии, что когда А представляет собой мые соли соединений формулы (I), а также их фенильное кольцо, замещенное группой -CN или изомеры, гидраты, изоформы и пролекарства. группой -ΝΗ2, В не может быть Предпочтительными соединениями в соответствии с данным изобретением являются соединения формулы (I), где G представляет собой атом углерода или азота; где А выбирают из Ζ1 представляет собой гидроксил и его эфиры; (і) фенила, замещенного любым из -СООН, гидроксиметил и его эфиры; или амино, а также СОNH2, СООСН 3, -CN, NH 2 или -СОСН3; карбоксамиды и сульфонамиды. Особенно пред(ii) нафтила, бензофуранила и хинолинила; и почтительными соединениями в соответствии с данным изобретением являются соединения формулы (I), где G представляет собой атом азота; А выбирают из где фенильное кольцо каждого заместителя А может быть необязательно и независимо замещено одним или двумя заместителями, выбранными из водорода, СН3, (СН2)оСF3, галогена, CONR7R8, CO2R7, COR7, (CH2)oNR7R8, (CH2) oCH3(CH2)oSOR7, (CH2)oS02R7 и (CH2)oSO2NR7R8, где о = 0, 1 или 2, a R7 и R8 имеют нижеуказанные значения; каждый из R1, R7 и R8 независимо выбирают из водорода; разветвленного или прямого С 1-С4 алкила, аллила, -СО-(C1-C6 алкил); (С1-С6 алкил)В, где В имеет нижеуказанные значения; С3-С5 циклоалкила, С4-С8 (алкил-циклоалкил), где алкил представляет собой С1-С2 алкил, а циклоалкил С3-С6 циклоалкил; и фенила; R2 представляет собой водород, метил или 1 OR , где R1 имеет вышеуказанные значения; каждый из R9, R10, R11 , R12, R13, R 14, R15, R16 , R17 и R18 независимо имеет значения, указанные выше для R1; В выбирают из фенила, нафтила, индолила, бензофуранила, дигидробензофуранила, бензотиофенила, пиррила, фуранила, хинолинила, изохинолинила, циклогексила, циклогексенила, циклопентила, циклопентенила, инданила, инденила, тетрагид-ронафтила, тетрагидрохинила, тетрагидроизохинолинила, тетра-гидрофуранила, пирролидинила, индазолинила и при этом каждая В-группа необязательно замещена 1-2 заместителями, независимо выбранными из водорода, СН3, CF3, галогена, (CH2)pCONR7R8, (CH2)pNR7R8, (CH2)pCOR7, (CH2)pCO2R7 и OR 7; где р=0 или 1, и где R7 и R8 имеют вышеуказанные значения; и каждый из R3, R4, R5 и R6 независимо выбирают из водорода, СН3, СН(Ме)2, СН2СН(Ме)2, CH(Me)CH2CH3(СН2)рСONR7R8, (CH2)pNR7R8, где каждый из R9, R10, R11 , R12, R13, R 14, R15, R16 , 17 R и R18 представляет собой этиловую гр уппу; R1 выбирают из водорода, метила, этила, аллила или СН 2-циклолропила; R2 представляет собой Н, метил или OR1, где 1 R имеет вышеуказанные значения; В выбирают из фенила, нафтила, индолила, бензофуранила, дигидробензофуранила, бензотиофенила, фуранила, хинолинила, изохинолинила, циклогексила, циклогексенила, циклопентила, циклопентенила, инданила, инденила, тетрагидронафтила, тет-рагидрохинила, тетрагидроизохинолинила, тетрагидрофуранила, индазолинила и при этом каждая В-группа необязательно замещена 1-2 заместителями, независимо выбранными из водорода, метила, CF3 галогена, (CH2)pCONR7R8, (CH2)pNR7R8, (CH2)pCOR7, (CH2)pCO2R7 и OR7, где р = 0, 1 или 2, и где R 7 и R8 имеют значения, указанные выше для R1; каждый из R3, R4, R5 и R6 независимо выбирают из Н, СН3, СН(Мe)2, СН2СН(Ме)2, CH(Me)CH2CH3(CH2)pCONR7R8, (CH2)pNR7R8, (СН2)pCONR7R8, (CH2)pCO2R7, (CH2)pPh, (CH 2)p(pOHPh), (СН2)р-3-индолил, (CH2)pSR7 и (CH2)pOR7, где p = 0, 1 или 2, и где R 7 и R8 имеют вышеуказанные значения Заместители А и В, соответственно, могут быть необязательно замещены в любой позиции кольца. Под "галогеном" подразумевают хлор, фтор, бром и иод. Под "арилом" мы подразумеваем ароматичес 13 71538 14 кое кольцо, имеющее 6-10 атомов углерода, такилудочно-кишечных нарушений, повреждений пооекак фенил и нафтил. звоночника и наркомании, включая злоупотреблеПод "гетероарилом" мы подразумеваем ароние алкоголем, никотином, опиоидом и другими матическое кольцо, в котором один или более из лекарственными средствами, а также для лечения 5-10 атомов в кольце представляют собой не угнарушений симпатической нервной системы, налерод, а другие элементы, такие как Н, S и О. пример гипертонии. Под "гидроароматическим соединением" поЛучшим способом осуществления настоящего дразумевают частично или полностью насыщенизобретения, известным в настоящее время, явную стр уктур у ароматического кольца, имеющую в ляется использование соединений в соответствии кольце 5-10 атомов углерода. с Примером 21 (соединение 33), Примером 22 Под "гетерогидроароматическим соединени(соединение 34), Примером 23 (соединение 37), ем" подразумевают частично или полностью наПримером 24 (соединение 38), Примером 25 (соесыщенную стр уктуру ароматического кольца, в динение 41), Примером 26 (соединение 42), Прикотором один или более из 5-10 атомов в кольце мером 27 (соединение 45), Примером 29 (соедипредставляют собой не углерод, а другие элеменнение 51), Примером 30 (соединение 54), ты, такие как N, S и О. Примером 35 (соединение 64), Примером 36 (соеПод "изомерами" подразумевают соединения динение 65), Примером 50 и Примером 51. Нумеформулы (I), различающиеся по позиции своей рация соединений соответствует приводимым функциональной группы и/или ориентацией. Под ниже Примерам, а также приводимым ниже Схе"ориентацией" мы подразумеваем стереоизомеры, мам. диастереоизомеры, региоизомеры и энантиомеры. Способы получения Под "изоформами" подразумевают соединеОбобщенный способ А ния формулы (I), различающиеся по своей крисАльдегид или кетон нагревают с нуклеофиталлической решетке, такие как кристаллическое лом, таким как реактив Гриньяра или органолитий, соединение и аморфные соединения. для получения соответствующего спирта. Затем Под "пролекарством" подразумевают фармаэтот спирт может быть превращен в подходящую кологически приемлемые производные, например отщепляемую группу (X), такую как эфир, сульфоэфиры и амиды, в которых продуктом биотранснат или галогенид, которая, в свою очередь, моформации производного является активное лежет быть замещена нуклеофильным соединеникарственное средство. Приводится ссылка на ем, таким как замещенный или незамещенный Goodman and Gilmans, The Pharmacological Basis пиперазин. Производные N-(4)-незамещенного of Therapeutics, 8th ed., McGraw-Hill, Int. Ed. 1992, пиперазина могут быть затем соответствующим "Biotransformation of Drugs", p.13-15, описывающая образом замещены различными группами через пролекарства в общем. свои органогалидные или эквивалентные соедиНовые соединения в соответствии с настоянения, либо ацилированы различными ацилирующим изобретением могут быть использованы в щими соединениями. Такая процедура приводит к терапии, особенно для снятия боли. получению соединений в соответствии с общей Данные соединения также могут быть испольформулой I. зованы для модуляции анальтезирующего эффекОбобщенный способ В та, действующего на уровне подтипа рецептора μN-защищенная аминокислота, в виде ее актиопиоида, при этом модуляция побочного действия вированного эфира, может быть подвергнута реапроисходит при использовании агентов, действукции со вторым аминокислотным эфиром. После ющи х на уровне подтипа рецептора μ-опиоида, обработки кислотой эти соединения могут быть таких как морфин, в особенности угнетение дыхаподвергнуты циклизации для получения пиперания, перистальтика кишечника и склонность к злозиндиона. Этот дион может быть восстановлен с употреблению лекарственными средствами. помощью многих стандартных методов до соотСоединения по данному изобретению также ветствующего пиперазина (например, восстанавмогут быть использованы в качестве иммуномоливающим агентом, таким как литий-алюминий дуляторов, особенно для лечения аутоиммунных гидрид, конверсией в тиоамид и последующей заболеваний, таких как артрит, для пересадки кодесульфуризацией, гидрогенизацией в присутстжи, органов и тому подобных хир ургических вии РОСІ3 и т.д.). Затем этот пиперззин может опeраций, для лечения коллагеновых заболевабыть алкилирован или ацилирован на одном или ний, различных аллергий, в качестве противоопуболее азотах и/или может быть использован в холевых и противовирусных средств. дальнейшем в обобщенном методе А. Соединения по данному изобретению могут В этом случае может потребоваться депротебыть использованы для лечения дегенерации или кция функциональных групп или дальнейшие модисфункции опиоидных рецепторов, а также для дификации; каждый из таких отдельных случаев их предотвращения. При этом в диагностическом описан. Конкретные примеры, иллюстрирующие оборудовании и визуализирующих приборах, тавышеуказанные превращения, приведены в экских как позитронный эмиссионный томограф, мопериментальном виде. гут быть использованы помеченые изотопами ваВсе реагенты, предназначенные для преврарианты соединения по данному изобретению. щений (включая соли), растворители, известные в Соединения по данному изобретению могут химии и биопревращениях, осуществляемых в быть использованы для лечения диареи, депресподходящей биологической среде для проведения сии, недержания мочи, различных психических этих превращений, включают все агенты, усилизаболеваний, кашля, отека легких, различных жевающие реакцию (например, НМРА), а также хи 15 71538 16 ральные разрешения с использованием хиральнораствором, а затем высушивают над MgSO4 ,. Выго солеобразования и хиральные биологические паривая растворители, получают 3-метокси-α-(1разрешения. нафтил)бензил хлорид (1,94г, 72%). GC-MS (R t = Подробное описание изобретения 10,30мин.) 282 (Μ+), 247, 232, 215, 202, 189, 163, Далее данное изобретение описано более по151, 139, 123, 101. дробно с помощью примеров, не предполагающих Пример 1. его ограничение. Получение (±) транс-1- (З-метокси-α- (1В примерах используются следующие сокранафяил) бензил)-2,5-диметилпиперазина (соедищения: нение 3) s - синглет; d - дуплет; dd - двойной дуплет; Смесь транс-2,5-диметилпиперазина (456мг, t - триплет; m - мультиплет; brs - шир.синглет. 4,0ммол.), 3-метокси-α-(1-нафтил)бензил хлорида (430мг, 1,5ммол.) и триэтиламина (2мл) в сухом диметилформамиде (10мл) подвергают кипячению с обратным холодильником в течение 2 часов в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь резко охлаждают IN водным раствором NH4OH и экстрагируют зтилацетатом (3´50мл). Объединенные органические слои промывают 0,5Ν водным раствором NaOH, насыщенным водным NH4CІ и насыщенным солевым раствором, а затем высушивают над MgSO4 . Удаляя растворители, получают (±)-транс-1-(3-метокси-a-(1'-нафтил) бензил) -2,5диметилпиперазин, используемый без обработки на следующей стадии: GC-MS (два измера: Rt = 12,98 и 13,10мин.) 360 (Μ+), 301, 276, 247, 232, 215, 189, 165, 131, 113. Примеры 2 и 3. Получение (±)-3-((aR*/S*)-α-((2S*, 5R*)-4аллил-2,5-ди-диметил-1-пиперазинил)-1Примеры нафтил)анизола (соединения 4 и 5) Соединения в соответствии с Примерами 1-3 Смесь полученного выше (±) -транс-1-(3синтезируют, как показано на вышеприведенной метокси-a-(1-нафтил)бензил)-2,5Схеме 1. диметилпиперазина, К2СО3 (276мг, 2,0ммол.) и А аллилбромида (242мг, 2,0ммол.) в диметилфорI. Получение 3-метокси-α- (1-нафтил) бензимамиде (5мл)/тетрагидрофуране (10мл) перемелового спирта (соединение 1) шивают в течение 3 часов при комнатной темпеК раствору 3-бромоанизола (5,61г, 30,0ммол.) ратуре. Реакционную смесь резко охлаждают 1N в сухом тетрагидрофуране (80мл) по каплям доNH4OH и экстрагируют этилацетатом (3´50мл). бавляют раствор н-бутил лития-гексана (1,6М, Объединенные органические слои промывают 37,5мл, 60ммол.) в атмосфере азота при -78°С. насыщенным водным ΝΗ 4СІ и насыщенным солеРеакционной смеси дают возможность нагреться вым раствором, а затем высушивают над MgSO4. до комнатной температуры в течение 2 часов и Выпаривая растворители, получают сырой (±) -3перед добавлением 1-нафтальдегида (4,69г, ((dR*/S*) -α-((2S*,5R*)-4-аллил-2,5-диметил-130,0ммол. в 10мл тетрагидро-фурана) вновь пиперазинил)-1-нафтил)анизол, который очищают охлаждают до -78°С. Смесь нагревают до комнатна силикагелевой колонке и элюируют AcOEtной температуры в течение 3 часов, затем резко гексаном (2:98®100:1) для получения двух изомеохлаждают раствором водного NH4CІ и экстрагиров (всего 267мг, 45% из 2): руют этилацетатом (3´50мл). Объединенные орПервый изомер, соединение 4: GC-MS ганические фазы промывают насыщенным соле(Rt=14.84мин.) 401.15(М++1, 0.3%), 400.15(М+, 0.9), вым раствором и высушивают над MgSO 4. Удаляя 359.15(0.6), 330.15(0.4), 302.15(3.2), 274.15(8.0), растворители в вакууме, получают 3-метокси-α-(1247.05(23.0), 215.10(12.7), 202.05(7.8),153.15(100); нафтил)бензиловый спирт (4,25г, 54%). Газовая 126.15(10.1); dн (400 MH z, CDCІ3) 1.02(d,J=6.4 Hz, хроматография - масс-спект-роскопия (GC-MS) (Rt + 6Н), 2.15(dd, J-11.2, 6.4 Hz, 1H), 2.31 (dd, J-11.2, = 10,41мин.) 264 (Μ ), 245, 231, 215, 202, 155, 135, 6.4 Hz, 1H), 2.60(m,1H), 2.74(dd, J-11.2, 3.2 Hz, 1H), 128, 109. 2.80(dd, J-11.2, 3.2 Hz, 1H), 2.94(dd, J-13.6, 7.2 Hz, II. Получение 3-метокси-а-(1-нафтил) бензил 1H), 3.03(dt, J-6.4, 3.2 Hz, 1H), 3.20(dd, J-13.6, 5.6 хлорида (соединение 2) Hz, 1H), 3.73(s,3H), 5.12(m,2H), 5.73 (brs, 1H) , К раствору 3-метокси-α-(15.83(m,1H), 6.68(dd, J-8.0, 2.4 Hz, 1H), 7.00(d, J=8.0 нафтил)бензилового спирта (2,5г, 9,5ммол.) в диэHz, 1H), 7.12(m, 2H), 7.42(mr3H). 7.62(d, J=7.2 Hz, тиловом эфире (5мл) при 0°С добавляют 35% со1H) , 7.71 (d, J=8.0 Hz, 1H), 7.80(d, J-8.0 Hz, 1H), ляную кислоту (10мл). Реакционную смесь нагре8.28 (brs, 1H); dс-13 (100 MHz, CDCI3) 13.2, 14.2, вают до комнатной температуры в течение 1 часа, 35.6, 52.1, 53.0, 55.1, 55.2, 57.2, 63.8, 111.6, 114.4, а затем экстрагируют этилацетатом (3´50мл). Об117.2, 121.1, 123.8, 125.2, 125.7, 125.8, 127.2, ъединенные органические слои промывают раст127.5, 127.8, 128.9, 132.1, 134.0, 135.5, 137,4, вором водного NH4CI и насыщенным солевым 17 71538 18 145.5, 159.5. Соединение 7 получают, используя процедуру Его соль НСІ: т.пл. 124-135°С (эфир); синтеза, описанную для соединения 2, но заменяя Vмакс.. (KBr) см -1 3483, 1601, 1264; соединение 1 соединением 6. GC-MS (Rt-10.58мин), 282 (М+), 247, 231, 215, Анал. для C27H 32N2O×2HCl×1.0H2О: 202, 189, 151, 123, 101. Подсчитано С, 65.98; Н, 7.38; N, 5.70. Пример 4. Найдено: С, 66.12; Н, 7.25; N, 5.42. Получение (±)-транс-1-(3-метокси-α-(2Второй изомер, соединение 5; GC-MS (Rt = 14.65 мин) 401.25(М++1, 0.2%), 400.25(М+ 0.8), нафатил)бензил)-2,5-диметил-пиперазина (соединение 8) 359.15(0.4), 330.15(0.4), 302.15(3.1), 274.15(8.0), Соединение 8 получают, используя процедуру 247.05(21.7), 215.10(13.0), 202.05 (7.0), синтеза, описанную для соединения 3, но заменяя 153.15(100), 126.15(9.7); 6н (400 MHz, CDC1 3) соединение 2 соединением 7. 0.93(d, J=6.4 Hz, 3H), 1.15(d, J-6.4 Hz, 3H), 2.14(m,2H), 2.37 (m, 1H), 2.60(dd, J= 11.6, 2.8 Hz, Используют без обработки на следующей стадии: GC-MS (Rt=14.03мин) 360 (М+), 331, 301, 276, 1H), 2.84(ra,2H), 2.96(m,1H), 3.35(dd, J-13.2, 5.2 Hz, 247, 219, 169, 131, 113. 1H), 5.13(m,2H), 5.81(s,1H), 5.86 (m,1H), 6.73(dd, JПримеры 5 и 6. 8.0, 2.8 Hz, 1H), 6.81(s,1H), 6.84 (d, J=8.0 Hz, 1H), 7.16(m,1H), 7.40(m,3H), 7.70(m,2H), 7.80(d, J=8.0 Получение (±)-3-((aR*/S*)-α-((2S*, 5R*)-4аллил-2,5-диметил-1-пиперазинил)-2Hz, 1H), 8.15 (d, J=8.0 H z, 1H); dс-13 (100 MH z, нафтил)анизол (соединения 9 и 10) CDC13) 15.7, 16.3, 38.8, 53.6, 55.0, 55.6, 56.8, 59.3, Соединения из этих Примеров получают, ис63.6, 111.5, 115.6, 117.4, 121.9, 124.6, 125.0, 125.1, пользуя процедуру синтеза, описанную для При125.4, 126.2, 127.4, 128.5, 128.9, 131.6, 133.9, меров 2 и 3, но заменяя соединение 3 на соеди135.0, 138.3, 142.2, 159.4. нение 8. Его соль НСІ: т.пл. 150,5-153°С (эфир); Соединение 9 (один чистый изомер): GC-MS Vмакс (KBr) см -1 3483, 1600, 1262; (Rt=16.05мин) 401.25(0.2%), 400.25(0.8), Анал. для: С27Н32N2 О×2НСI×0.75Н2О: 359.15(0.4), 330.15(0.4), 302.15(3.1), 274.15(8.0), Подсчитано: С, 66.59; Н, 7.35; М, 5.75. 247.05(21.7), 215.10(13.0), 202.05(7.0), 153.15(100), Найдено: С, 66.41; Н, 7.03; N, 5.48. 126.15(9.7); dн (400 MH z, CDCІ) 1.36(d, J=6.4 Hz, 3H), 1.41(d, J=6.4 Hz, 3H), 3.16(dd, J=13.2, 2.4 Hz, 1H), 3.26(d. J=13.2 Hz, 1H), 3.46(m,1Н), 3.86(s,3H), 3.94(dd, J=11.2, 2.8 Hz, 1H), 4.10(m,2H), 4.46(m,2H), 5.58(m,2H), 5.78 (s,1H), 6.05(m,1H), 6.96 (dd, J=8.0, 2.0 Hz,1H), 7.18(s,1H), 7.33(m1), 7.44(m,1H), 7.50(m,2H), 7.83(m,3H), 8.04(d, J=8.0 Hz, 1H), 8.13(s,1H), 13.6(brs,2H). Его соль НСІ: т.пл. 129-138°С (эфир); Vмакс (КВr) см -1 3426, 1600, 1262; Анал. для C27H 32N2O 2×2HCI×0.75H2O: Подсчитано: С, 66.59; Η, 7.35; Ν, 5.75; Найдено: С, 66.80; Η, 7.11; Ν, 5.42. Соединение 10 (смесь двух изомеров). Его соль НСI: т.пл. 160-162,5°С (эфир); Vмакс (КВк) см -1 3380, 1600, 1261; Анал. для С 27Н 32N2О×2НСI×0.50Н2O: Подсчитано: С, 67.21; Н, 7.31; Ν, 5.81; Найдено: С, 67.13; Н, 6.97; Ν, 5.47. Соединения в соответствии с Примерами 4-6 синтезируют, как показано на вышеприведенной Схеме 2. В. I. Получение 3-метокси-a-(2нафтил)бензилового спирта (соединение 6) Соединение 6 получают, используя процедуру синтеза, описанную для соединения 1, но заменяя 1-нафтальдегид на 2-нафтальдегид. GC-MS (Rt - 10.68мин) 264 (Μ+), 247, 231, 215, 202, 155, 135, 128, 109; dн (400 MHz, CDCІ3) 3.15 (brs, 1Н), 3.59 (s,3H), 5.71(s,1H), 6.69(dd, J-8.4, 2.8 Hz, 1H), 6.87(m,2H), 7.11(t, J=8.0 Hz, 1H), 7.29(dd, J-8.4, 1.2 Hz, 1H), 7.35(m,2H), 7.63 (d, J-8.4 Hz, 1H), 7.70(m, 3H); dc-13 (100 MHz, CDCІ3) 55.0, 75.9, 112.1, 112.8, 118.9, 124.6, 124.9, 125.7, 125.9, 127.5, 127.9, 128.1, 129.3, 132.7, 133.1, 141.0, 145.2, 159.5. II. Получение 3-метокси-α-(2-нафтил)бензил хлорида (соединение 7) Соединения в соответствии с Примерами 7-11 19 71538 20 синтезируют, как показано на вышеприведенной CDCІ3) 0.91 (d, J-6.4 Hz, 3H), 1.21 (d, J=6.4 Hz, 3H), Схеме 3. 2.12(m,2H), 2.35(m,1H), 2.65(m,1H), 2.75(dd, J-11.6, С. 2.4 Hz, 1H), 2.81(m,3H), 3.42(dd, J=13.6, 5.2 Hz, 1H), 3.78 (s,3H), 5.14(m,2H), 5.51(s,1H), 5.85(m,1H), I. Получение 3-метокси-a-(26.61(s,1H), 6.81 (dd, J=8.0, 2.4 Hz, 1H), 7.01(d, J-8.0 бензофуранил)бензилового спирта (соединение Hz, 1H), 7.11(s,1H), 7.24(m,3H), 7.44 (d, J=8.0 Hz, 11) Соединение в этом Примере получают, испо1H), 7.54(d, J=8.0 Hz, 1H); dс-13 (100 MHz, CDCI3) льзуя процедуру синтеза, описанную в Примере 1. 17.2, 17.5, 53.1, 54.4, 55.2, 56.0, 56.6, 59.2, 60.4, GC-MS(Rt=9.54мин) 254.15 (М+, 100%), 237.10 106.8, 111.3, 112.1, 114.2, 117.8, 120.6, 120.7, (73.8), 221.05 (19.6), 194.10 (17.8), 165.10 (30.3), 122.6, 123.8, 128.1, 129.0, 134.8, 141.4, 154.9. 147.05 (76.7), 135.10 (69.2), 118.10 (35.4), 108.10 155.2, 159.6. Его соль НСI: т.пл. 122-128°С (эфир); (26.5), 91.10 (47.1); dн (400 MHz CDCІ3) 3.21 Vмакс (КВr) см -1 3490, 1602, 1253; (brs,1H), 3.72 (s,3H), 5.82 (s,1H), 6.47 (s,1H), 6.807.50 (m,8H). Анал. для C25H 30N2O 2×2HCl×0.25H2O: Подсчитано: С, 64.17; Н, 7.00: N, 5.99; II. Получение 3-метокси-a-(2Найдено: С, 64.27; Н, 6.92: N, 5.92. бензофуранил)бензил хлорида (соединение 12) Соединение 12 получают, используя процедуВторой изомер, соединение 15: GC-MS (Rt=13.23мин) 390.20(М+ 3.1%), 349.15(0.5), ру синтеза, описанную для соединения 2, но за292.10(2.2), 264.10(5.5), 237.10(33.2), 221.05(1.8), меняя соединение 1 соединением 11. 194.10(7.1), 165.10(7.7), 153.15 (100), 126.15(7.1), GC-MS (Rt=9.08мин) 272.05(М+, 4.1%), 237.10(100), 221.05(4.5), 194.10(14.7), 165.10(23.1); 98.15(18.4), 84.10(25.0); dн (400 MH z, CDCI3) 1.00(d, J=6.4 Hz, 3Н), 1.21(d, J-6.4 Hz, 3H), 2.12(m, 2H), dн (400 MHz, CDCІ3) 3.78(s,3H), 6.11(s,1H), 2.48(m,1H), 2.61(m,1H), 2.78(dd, J-11.6, 2.4 Hz, 1H), 6.56(s,1H), 6.85-7.50(m,8H). 2.83(m,3H), 3.42(dd, J-13.6, 5.6 Hz, 1H), 3.79(s,3H), Пример 7. 5.15 (m,2H), 5.40(s,1H), 5.85(m,1H), 6.64(s,1H), Получение (±)-транс-1-(3-метокси-a-(2¢6.86(m,3H), 7.20 (m,3H), 7.44(d, J=8.0 Hz, 1H), бензофуранил)-бензил)-2,5-диметилпиперазина 7.50(d, J=8.0 Hz, 1H). (соединение 13) Его соль НСI: т.пл. 97-104°С (эфир); Соединение 13 получают, используя процедуVмакс (КВr) см -1 3438, 1601 (s), 1260; ру синтеза, описанную для соединения 3, но заАнал. для С 25Н 30N2О 2×2НСI×0.50Н2О: меняя соединение 2 соединением 12. GC-MS (Rt=11.87мин и Rt=12.09мин) Подсчитано: С, 63.56; Н, 7.04; N, 5.93; Найдено: С, 63.70; Н, 6.68; N, 5.83. 351.15(М++1, 2.2%), 350.1(М+, 8.6), 321.20(0.4), Примеры 10 и 11. 308.15(0.2), 294.20(18.3), 266.10 (58.6), 237.10(100), 221.05(3.0), 194.10(10.0), 178.05(4.1), Получение (±)-3-((aR*/S*)-a-((2S*,5R*)-4циклопропилметил-2,5-диметил-1-пиперазинил)-2165.10(13.0), 131.05(2.9), 113.10(43.8); dн (400 MH z, бензофуранил)анизола (соединения 16 и 17) CDCІ3) (изомер при Rt=11.87мин) 0.92(d, J=6.4 Hz, Соединения из этих Примеров получают, ис3Н), 1.20(d, J=6.4 Hz, 3H), 1.92(dd, J-11.2, 10.8 Hz, пользуя процедуру синтеза, описанную для при1H) , 2.44(m,1H), 2.69(dd, J=11.2, 10.8 Hz, 1H), меров 2 и 3, за исключением циклопропилметил 2.83(m,2H), 2.90(m,1H), 3.78 (s,3H) 5.56(s,1H), иодида и замены соединения 3 на соединение 13. 6.61(s,1H), 6.80(d, J=8.0 Hz, 1H) , 7.00 (d, J=8.0 Hz, Первый изомер, соединение 16: GC-MS 1H), 7.10(s,1H), 7.24(m,3H), 7.46(d, J=8.0 Hz, 1H), (Rt=14.87мин) 405.25(М++1, 2.3%), 404.25(М+,8.2), 7.56(d, J=8.0 Hz, 1H); (изомер при Rt=12.09мин) 362.20(0.5), 349.15(0.4), 320.20(0.8), 292.20(4.1), 0.96(d, J=6.4 Hz, 3H), 1.22(d, J=6.4 Hz, 3H), 1.83(dd, 291.10(3.4), 265.10(16.5), 237.10(65.9), J=11.2, 10.8 Hz, 1H), 2.40(m,1H), 2.65(m,1H), 194.10(11.5), 167.20(100), 140.20(3.9), 124.15(4.6), 2.90(m,3H), 3.80(s, 3H), 5.47(s,1H), 6.63(s,1H), 6.84(m,2H), 7.21(m,2H), 7.24(m, 2H), 7.46(d, J=8.0 98.15(44.0); dн (400 MHz, CDCІ3) 0.05(m,2H), Hz, 1H), 7.51(d, J=8.0 H z, 1H). 0.46(m,2H), 0.80(m,1H), 0,92(d, J=6.0 Hz, 3H), Его соль НСІ: т.пл. 115-125°С (эфир); 1.21(d, J=6.0 Hz, 3H), 2.01(dd,J-12.8, 7.2 Hz, 1H), Vмакс (KBr) 3373, 1595, 1257; 2.17(m,2H), 2.35(m,1H), 2.64(dd,J=13.2, 6.4 Hz, 1H), 2.66(m,1H), 2.72(dd, J=12.0, 2.4 Hz, 1H), 3.04(dd, Анал. для C22H 26N2O 2×1.70HCl×0.20H2O: J=11.2, 3.2 Hz, 1H), 3.75(s,3H), 5.50(s,1H), Подсчитано: С, 63.51; Η, 6.81; Ν, 6.73; 6.58(s,1H), 6.79(dd, J=8.0, 2.4 Hz, 1H), 7.01 (d, Найдено: С, 63.60; Η, 6.80; Ν, 6.70. J=8.0 Hz, 1H), 7.09(s,1H), 7.20(m,3H), 7.41(d, Примеры 8 и 9. J=8.0Hz, 1H), 7.51(m,1H); d-13(100 MHz, CDCI3) 3.2, Получение (±)-3-((aR*/S*)-a-((2S*,5R*)-44.7, 7.4, 17.4, 17.7, 53.1, 54.5, 55.2, 56.0, 58.3, 59.2, аллил-2,5-диметил-1-пиперазинил)-260.8, 106.8, 111.3, 112.0, 114.2, 120.6, 120.7, 122.6, бензофуранил)анизол (соединения 14 и 15) 123.7, 128.0, 129.0, 141.4, 154.8, 155.2, 159.6. Соединения из этих Примеров получают, исЕго соль HCl: т.пл. 162-164°С (эфир); пользуя процедуру синтеза, описанную для ПриVмакс (KBr) см -1 3414, 1599, 1255; меров 2 и 3, но заменяя соединение 3 на соединение 13. Анал. для С 26Н 32N2О 2×2НСI×0.5Н2О: Первый изомер, соединение 14; GC-MS Подсчитано: С, 64.19; Н, 7.25; N, 5.76; (Rt=13.03мин) 390.20 (М+, 1.5%), 349.15(0.4), Найдено: С, 64,43; Н, 7.30; N, 5.78. 320.10(0.3), 292.10(1.7), 264.10 (4.2), 237.10(25.1), Второй изомер, соединение 17: GC-MS 221.05(1.4), 194.10(5.2), 165.10(5.5), 153.15(100), (Rt=15.17мин) 405.25(М++1, 2.2%), 404.25(М+, 8.9), 362.10(0.6), 349.15 (0.4), 320.10(0.8), 292.10(5.0), 126.15(4.8), 98.05(8.7), 84.10(17.8); dн (400 MH z, 21 71538 22 291.10(3.9), 265.10(19.4), 237.10(72.2), (m,1H), 7.31(m,1H), 7.61(d, J=8.4 Hz, 1H), 7.83 194.10(12.8), 167.20(100), 140.10(3.9), 124.15 (4.8), (s,1H), 7.95(d, J=8.4 Hz, 1H) , 8.07(d, J=8.0 Hz, 1H), 98.15(45.5); dн (400 MHz, CDCI3) 0.08(m,2H), 8.73 (m,1H); dс-13(100 MHz, CDCІ3) 55.2, 75.7, 112.3, 0.48(m, 2H), 0.82 (m,1H), 0.97(d, J=6.4 Hz, 3H), 113.1, 119.1, 121.2, 124.6, 128.5, 129.4, 129.6, 1.25(d, J=6.4 Hz, 3H), 2.10(m,2H), 2.28(dd, J=11.2, 136.3, 142.1, 145.2, 147.6, 150.1, 159.8. 10.0 Hz, 1H), 2.49(m,1H), 2.62(dd, J=13.2, 6.0 Hz, III. Получение 3-метокси-a-(61H), 2.63(m,1H), 2.83(dd, J=11.2, 2.8 Hz, 1H), хинолинил)бензил хлорида (соединение 19) 3.02(dd, J=11.2, 3.2 Hz, 1H), 3.78(s,3H), 5.43 (s, 1H), Соединение 19 получают, используя процеду6.64(s,1H), 6.87(m,3H), 7.21(m,3H), 7.45(dd, J=7.6, ру синтеза, описанную для соединения 2, но за1.2 Hz, 1H), 7.50(m, 1H); dc-13 (100 MHz, CDCI3) 3.3, меняя соединение 1 на соединение 18. 4.6, 7.4, 17.0, 17.6, 52.6, 55.2, 55.4, 55.6, 58-3, 60.3, Используют без обработки на следующей ста61.6, 105.7, 111.3, 112.5, 115.9, 120.5, 122.1, 112.5, дии: dн (400 MH z, CDCI3) 3.73(s,3H), 5.98(s,1H), 6.8123.5, 128.4, 128.9, 137.3, 155.0, 158.3, 159.3. 8.2 (m, 9H), 8.80(s, 1Η). Его соль НСI: т.пл. 92-105°С (эфир); Примеры 12 и 13. Vмакс (KBr) см -1 3398, 1599, 1257; Получение (±)-транс-1-(3-метокси-a-(6'Анал. для C26H 32N2O 2×2HCl×0.5H2O; хинолинил)-бензил)-2,5-диметилпиперазин (соеПодсчитано: С, 64.19; Η, 7.25; Ν, 5.76; динения 20 и 21) Найдено: С, 64.38; Η, 7.14; Ν, 5.73. Соединения из этих Примеров получают, используя процедуру синтеза, описанную для соединения 3, но заменяя соединение 2 на соединение 19. GC-MS (Rt=14.91мин) 361.20(М+, 0.8%), 332.15(0.3), 306.15 (0.6), 302.15(14.4), 277.15(52.5), 248.05(100), 233.00(10.6), 204.05(17.1), 176.05(2.7), 151.05(1.4), 142.10(1.8), 113.10 (19.9). Первый изомер, соединение 20; dн (400 MHz, CDCІ3) 1.06 (d, J=6.4 Hz, 3H), 1.24(d, J=6.4 Hz, 3H), 1.84(dd, J=11.6, 9.2 Hz, 1H), 2.60(m,2H), 2.77(m,2H), 3.06(m,2H), 3.80(s,3H), 5.44(s,1H), 6.77(s,1H), 6.83(d, J=8.0 Hz, 1H), 6.88(dd, J=8.0, 2.4 Hz, 1H), 7.31(m,1H), 7.37(m,1H), 7.82(s,1H), 7.84 (m, 1H), 8.03 (d, J=8.8 Hz, 1H), 8.09 (d, J=8.8 H z, 1H), 8.87(m,1H). Соединение 21 (смесь двух изомеров-25% соединения 20): dн (400 MHz, CDCІ3) 1.20(m,6H), 2.05(m,1H), D. 2.73(т,2Н), 2.87 (т,1Н), 3.13(т,2Н), 3.73 и 3.76(s,3H), I. Получение 6-хинолинкарбоксальдегида 5.38(s,1H), 6.38 (brs, NH), 6.70-8.15(m,9H), Смесь 6-метилхинолина (5,72г, 40,0ммол.) и 8.84(т,1Н). окиси селена (4,44г, 40,0ммол.) нагревают до Пример 14. 220°С в течение 1 часа. После охлаждения остаПолучение (±)-3-((aR*/S*)-a-((2S*,5R*)-4ток растворяют в этилацетате (100мл). Органичесаллил-2,5-диметил-1-пиперазинил)-6кий раствор промывают рассолом и высушивают хинолинил)анизола (соединение 22) над MgSO4. После выпаривания растворителей Соединение данного Примера получают, исполучают твердое вещество, рекристаллизуемое пользуя процедуру синтеза, описанную для Прииз смеси эфира-гексана (1:1) для получения 6меров 2 и 3, но заменяя соединение 3 соединенихинолинкарбоксальдегида (3,45г, 55%). ем 20. + GC-MS (Rt=5.29мин) 157.15(М , 100%), GC-MS (Rt=17.22мин) 401.25(М+, 0.3%), 156.15(92.2), 128.15 (62.9), 101.15(16.0); dн (400 360.20(0.3), 331.10 (0.2), 303.20(1.7), 276.10(4.5), MH z, CDCІ3) 7.53(m,1H), 8.21 (m,2H), 8.33(m,2H), 248.10(17.2), 233.10(4.5), 204.10(8.0), 176.10(1.3), 9.06(m,1H), 10.21(s,1H): dс-13 (100 MHz, СОСІ3) 153.20(100), 126.20(5.4); 5н (400 MH z, CDCІ3) 1.0(d, 122.1, 126.6, 127.6, 130.7, 133.5, 134.2, 137.3, J=6.4 Hz, 3H), 1.21 (d, J=6.4 Hz, 3H), 1.99(m,1H), 150.8, 153.0, 191.3. 2.20(m,1H), 2.56(m,1H), 2.66(m,1H), 2.71 (m,1H), Соединения в соответствии с Примерами 122.85(m,1H), 2.90(m,1H), 3.37(dd, J=13.2, 4.0 Hz, 1H) 17 синтезируют, как показано на вышеприведен, 3.78(s,H), 5.17 (m,2H), 5.35(s,1H), 5.87(m,1H), ной Схеме 4. 6.82(m,3H), 7.26(t, J=7.6 Hz, 1H), 7.36(m,1H), II. Получение 3-метокси-a-(67.81(s,1H), 7.88(d, J=8.8 Hz, 1H), 8.03(d, J=8.8 Hz, хинолинил)бензилового спирта (соединение 18) 1H), 8.09(d, J=7.6 Hz, 1H), 8.87 (m,1H); dс-13 (100 Соединение 18 получают, используя процедуMH z, CDCІ3) 15.7, 16.4, 52.0, 53.7, 55.2, 55.5, 56.8, ру синтеза, описанную для соединения 1, но за58.9, 65.9, 112.1, 116.3, 117.8, 120.9, 122.5, 126.5, меняя 1-нафтальдегид на 6127.9, 128.9, 129.0, 130.2, 134.8, 136.0, 139.2, хинолинкарбоксальдегид. 141.1, 147.6, 150.0, 159.5. + GC-MS (Rt=11.13мин) 265.10(М , 49.0%), Его соль НСІ: т.пл. 128-140°С (эфир); 248.05(2.3), 204.05(9.7), 156.05(37.6), 135.00(100), Vмакс (КВr) см -1 3376, 1596, 1263; 109.00(43.5); dн (400MH z, CDCІ3) 3.73(s,3H), Анал. для C26H 31N3O×2.30HCl×0.1H2O: 5.94(s,1H), 6.78(d, J=8.4 Hz, 1H), 6.95 (m,2H), 7.22 23 71538 24 Подсчитано: С, 64.10; Η, 6.93; Ν, 8.62; 233.10(15.7), 204.10(25.8), 176.10(3.7), 167.15 Найдено: С, 64.08; Η, 6.92; Ν, 8.35. (100), 138.15(12.2), 112.15(46.8); dн (400 MH z, Пример 15. CDCІ3) 0.17 (m,2H), 0.56(m,2H), 0.97(m,1H), 1.11 Получение (±)-3-((aR*/S*)-α-((2S*, 5R*)-4(brs, 3Н), 1.27 (brs, 3Н), 2.24(m,1H), 2.38(m,1H), аллил-2,5-диметил-1-пиперазинил)-62.51 (т,1Н), 2.61(т,1Н), 2.87(т,3Н), 3.13(m,1H), хинолинил)анизол (соединение 23) 3.77(s,3H), 5.34(s,1H), 6.78(d, J=8.0 Hz, 1H), 6.98(d, Соединение данного Примера получают, исJ=8.0 Hz, 1H), 7.08(s,1H), 7.22(t, J=8.0 Hz, 1H), пользуя процедуру синтеза, описанную для При7.39(dd, J=8.4, 4.4 Hz, 1H), 7.60(d, J=8.4 Hz, 1H), меров 2 и 3, но заменяя соединение 3 соединени7.73(s, 1H), 8.04(d, J=8.8 Hz, 1H), 8.16(d, J=8.4 H z, ем 21. 1H), 8.89(d, J=4.0 Hz, 1H); dс-13 (100 MHz, CDCІ3) GC-MS (Rt=17.21мин) 401.35(М+, 0.4%), 4.07, 4.37, 6.9, 14.8, 15.1, 51.4, 55.2, 56.2, 58.2, 360.30(0.2), 331.20(0.2), 303.20(1.6), 276.10(4.8), 60.3, 66.4, 111.8, 114.2, 120.6, 121.2, 128.0, 128.1, 248.10(17.3), 233.10(4.4), 204.10(8.1), 176.10(1.3), 129.2, 131.0, 136.0, 137.0, 143.8, 147.7, 150.3, 153.20(100), 126.20(5.6); dн (400 MH z, CDCІ3) 1.01 159.6. (d, J=6.0 Hz, 3H) , 1.21 (d, J=6.0 Hz, 3H), Его соль НСІ: т.пл. 92-105°С (эфир); 1.95(m,1H), 2.16(m,1H), 2.56(m,1H), 2.66(m,1H), Vмакс (KBr) см -1 3345, 1596, 1259. 2.74 (m,1H), 2.80(m,1H), 2.87(m,1H), 3.30(dd, J=13.6, 5.6 Hz, 1H), 3.77(s,3H), 5.13(m,2H), 5.34(s,1H), 5.82(m,1H), 6.77(dd, J=8.0, 2.4 Hz, 1H), 6.99(d, J=7.6 Hz, 1H), 7.11 (s,1H), 7.21 (d, J=8.0 Hz, 1H), 7.38 (dd, J=8.4, 4.0 Hz, 1H), 7.59(d, J=8.4 Hz, 1H), 7.66(s,1H), 8.03(d, J=8.8 Hz, 1H), 8.11(d, J=8.4 Hz, 1H), 8.88 (m,1H); dс-13 (100 MHz, CDCІ3) 15.3, 16.2, 51.9, 53.4, 55.2, 55.3, 56.8, 58.5, 66.1, 111.8, 114.0, 117.6, 120.6, 121.1, 127.9, 128.3, 128.9, 129.1, 131.4, 134.9, 136.0, 137.1, 144.1, 147.7, 150.2, 159.6. Его соль НСІ: т.пл. 177-182°С (эфир); Vмакс (KBr) см -1 3405, 1597, 1260; Анал. для C26H 31N3O×2.80HCl: Подсчитано: С, 62.01; Н, 6.7 6; N, 8.34. Найдено: С, 61.98; Н, 6.77; N, 8.03. Примеры 16 и 17. Получение (±)-3-((aR*/S*)-α-((2S*,5R*)-4циклопропилметил-2,5-диметил-пиперазинил)-6хинолинил)анизола (соединения 24 и 25) Соединения в соответствии с Примерами 18Соединение данного Примера получают, ис20 синтезируют, как показано на вышеприведенпользуя процедуру синтеза, как описано для Приной Схеме 5. меров 2 и 3, но заменяя аллилбромид циклопроЕ. пилметил-иодидом. I. Получение 3-метокси-a-(4Первый изомер, соединение 24: GC-MS хинолинил)бензиловый спирт (соединение 26) + (Rt=20.77мин) 415.25 (М , 3.8%), 344.15(2.4), Соединение 26 получают, используя процеду302.10(9.5), 276.10(58.8), 248.15 (79.1), ру синтеза, описанную для соединения 1, но за233.10(17.2), 204.10(29.4), 176.10(4.2), 167.15(100), меняя 1-нафтальдегид 4138.15(14.2), 112.15(47.0); dн (400 MHz, CDCI3) хинолинкарбоксальдегидом. 0.10(m,2H), 0.51(m,2H), 0.86(m,1H), 0.97(d, J=6.4 GC-MS (Rt=10.81мин) 266.10(М++1, 11.8%), Hz, 3H), 1.25(d, J=6.4 Hz, 3H), 1.98 (dd, J-11.2, 8.8 265.10(М+, 61.0), 248.05(6.1), 232.00(6.2), Hz, 1H), 2.14(dd, J=13.2, 6.4 Hz, 1H), 2.32(dd, J= 216.05(4.7), 204.00(10.5), 191.05 (2.0), 176.00(3.8), 10.8, 5.6 Hz, 1H) , 2.58(m,2H), 2.66 (dd, J=11.6, 2.8 156.00(13.9), 135.10(100), 129.10(86.6), Hz, 1H), 2.73(m,1H), 3.07(dd, J=11.2, 3.2 Hz, 1H), 109.10(68.2), 102.10(25.5); dн (400 MHz, CDCІ3) 3.78{s,3H), 5.39(s,1H), 6.79(s,1H), 6.84(m,2H), 3.67(s,3H), 5.30(brs,1H), 6.41(s,1H), 6.76(d, J=7.2 7.26(t, J=8.0 Hz, 1H), 7.35(dd, J=8.4, 4.0 Hz, 1H), Hz, 1H), 6.90(m,2H), 7.18 (t, J=7.6 Hz, 1H), 7.83(s, 1H), 7.89(d, J=8.8 Hz, 1H), 8.03(d, J=9.2 H z, 7.38(m,1H), 7.56(t, J=7.6 Hz, 1H), 7.62(m,1H), 1H), 8.09(d, J=8.G Hz, 1H), 8.86(dd, J=4.0, 2.0 Hz, 7.92(d, J=8.4 Hz, 1H), 8.00(d, J=8.4 Hz, 1H), 8.64 1H); δc-13 (100 MH z, CDCI3) 3.4 , 4.4, 7.6, 16.2, 16.9, (dd, J=4.4, 1.2 Hz, 1H); dс-13(100 MH z, CDCІ3) 55.1, 52.1, 53.8, 55.2, 55.6, 58.5, 59.7, 65.6, 112.0, 116.3, 72.1, 113.0, 113.2, 118.5, 119.5, 123.9, 125.7, 126.5, 120.9, 122.6, 126.5, 127.9, 128.8, 129.0, 130.2, 129.0, 129.5, 129.7, 143.8, 147.8, 149.1, 149.9, 136.0, 139.1, 141.1, 147.6, 149.9, 159.4. 159.7. Его соль НСI: т.пл. 127-157°С (эфир); II. Получение 3-метокси-α-(4-1 Vмакс (KBr) см 3402, 1596, 1262; хинолинил)бензил хлорида(соединение 27) Анал. для С 27Н 33Н3О×3НСІ×0.75Н2О: Соединение 27 получают, используя процедуПодсчитано: С, 60.23; Н, 7.02; N, 7.80; ру синтеза, описанную для соединения 2, но заНайдено: С, 60.49; Н, 7.00; N, 7.73. меняя соединение 1 соединением 26. Второй изомер, соединение 25: GC-MS Используют без обработки на следующей ста+ (Rt=20.73мин) 415.25(М , 3.2%), 344.05(2.3), дии: GC-MS(Rt=10.54мин) 285.10(М++2, 11.5%), 302.10(7.7), 276.10(48.5), 248.15(69.6), 25 71538 26 283.10(М+, 33.10), 268.05 (0.2), 248.15(100), 233.10(37.0), 217.05(27.2), 204.10(45.5), 178.10(5.9), 176.10(11,5), 151.10(5.7), 139.05(2.1), 108.60 (11.0), 102.10(17.4). Пример 18. Получение (±)-транс-1-(3-метокси-α-(4хинолинил)бензил-2,5-диметилпиперазин (соединение 28) Соединение данного Примера получают, используя процедуру синтеза, описанную для соединения 3, но заменяя соединение 2 соединением 27. GC-MS (Rt=13.96мин) 362.20 (М++1, 1.4%), 361.20 (М+, 6.6), 306.10 (2.0), 302.15(18.3), 277.15(59.6), 248.15(100), 233.10(15.8) 204.10(20.9), 176.10 (3.8), 151.00(1.8), 143.15(1.4), Соединения в соответствии с Примерами 21113.15 (15.8); dн (400 MH z, CDCІ3) 0.92 (d, J=6.4 H z, 3H), 1.12 (d, J=6.4 Hz, 3H), 1.82(dd, J=11.6, 10.0 Hz, 22 синтезируют, как показано на вышеприведенной Схеме 6. 1H), 2.52 (brs, 1H), 2.62(dd, J=11.6, 2.8 Hz, 1H), 2.72 F. (m,1H), 2.77 (m,1H), 2.88 (m,1Н), 2.98(dd, J=11.6, I. Получение (±)-4-((α-гидрокси)-4-хлорбензил)2.0 Hz, 1H), 3.72(s,3H), 5.86(s,1H), 6.69(s,1H), Ν,Ν-диэтаилбензамида (соединение 31) 6.72(d, J=8.0, 1H), 6.78(dd, J=8.0, 2.4 Hz, 1H), 7.20 (t, J=8.0 Ηz,1Η), 7.37(t, J=8.0 Hz, 1H), 7.60(t, J=8.0 4-Формил-N,N-диэтилбензамид (2,088г, 10,1ммол.) растворяют в 45мл безводного тетраHz, 1H), 7.65(d, J=4.4 H z, 1H), 7.99(d, J=8-8 Hz, 1H), гидрофурана. Раствор охлаждают до -78°С, а за8.09(d, J=8.0 Hz, 1H), 8.89(d, J=4.4 H z, 1H). тем по каплям добавляют 10,1мл (10,1ммол.) 1,0М Примеры 19 и 20. раствора 4-хлорофенилмагния бромида в эфире. Получение (±)-3-((aR*/S*)-α-((2S*, 5R*)-4Смесь нагревают до комнатной температуры в аллил-2,5-диметил-1-пиперазинил)-4-хинолинил) течение 3 часов. Затем добавляют 50мл насыанизола (соединения 29 и 30) щенного раствора NH4CI и смесь экстрагируют Соединения данных Примеров получают, исэтилацетатом (3´30мл). Объединенные органичепользуя процедуру синтеза, описанную для Примеров 2 и 3, но заменяя соединение 3 соединениские слои промывают водой (2´30мл) и насыщенем 28. ным солевым раствором (1´30мл), высушивают Первый изомер, соединение 29: GC-MS (Na2SO4), фильтруют и удаляют растворитель в (Rt=15.97мин) 401.15 (Μ+, 0.8%), 360.20(0.8), вакууме. Остаток подвергают хроматографии на 303.15(3.3), 276.15(5.7), 248.05(15.3), 217.05(6.3), силикагеле, злюируя метанолом:дихлорметаном 204.10(10.4), 176.00(2.2), 153.20 (100), 126.10(5.3), (1:125-3:125) для получения целевого соединения 98.10(13.8); dн (400 MH z, CDCІ3) 0.96(d, J=6.0 Hz, в виде бесцветного масла. 3H), 1.14(d,J=6.0 Hz, 3H), 2.01(m,1H), 2.16 (t, Vмакс (KBr) см -1 3329, 2977, 1595, 1461, 1289, J=10.0 Hz, 1H), 2.47(m,1H), 2.59(d, J=11.2 Hz, 1H), 1094, 1051, 830; 2.86(m, 2H), 2.95(t, J=6.0 Hz, 1H), 3.36(dd, J=13.6, dн (400 MH z, CDCІ3) 1.09(3H,br s) , 1.21(3H,br 4.4 Hz, 1H) , 3.72(s,3H), 5.15(m,2H), 5.77(s,1H), s), 3.22 (2H,br s), 3.33(1H, d, J 3), 3.50(2H,br s), 5.85(m,1H), 6.74(m,3H), 7.17 (t, J=7.6 Hz, 1H), 7.38 5.74(1Н, d, J 3), 7.22-7.34(m,8H); (t, J=8.0 H z, 1H), 7.60(dd, J= 7.2, 0.8 H z, 1H), 7.73(d, II. Получение (±)-4-((α-хлоро)-4-хлорбензил)J=4.4 Hz, 1H), 8.00(d, J=8.4 Hz, 1H), 8.08(d, J=8.8 Ν,Ν-диэтилбензамида (соединение 32) Ηz,1Η), 8.90(d, J=3.6 Hz, 1H); δc-13 (100 MH z, CDCI3) Соединение 32 получают, используя процеду15.9, 16.6, 53.8, 55.1, 55.5, 56.7, 59.4, 63.2, 112.0, ру синтеза, описанную для соединения 2, но за115.7, 117.7, 120.6, 121.9, 124.4, 126.0, 126.8, меняя соединение 1 соединением 31 128.6, 129.3, 130.1, 134.8, 140.3, 148.5, 148.6, Используют без обработки на следующей ста150.2, 159.5. дии. Его соль НСI: т.пл. 158-166°С (AcOEt-эфир); Пример 21. Vмакс (КВr) см -1 3400, 1596, 1263; Получение (±)-4-((a-(1-пиперазинил))-4Анал. для C26H 31N3O×3.0HCl×0.9H2O: хлорбензил)-Ν,Ν-диэтилбензамида (соединение Подсчитано: С, 59.24; Η, 6.85; Ν, 7.97; 33) Найдено: С, 59.31; Η, 6.94; Ν, 7.80. Соединение данного Примера получают, исВторой изомер, соединение 30: GC-MS пользуя процедуру синтеза, описанную для сое(Rt=16.19мин) 401.25(M+,0.5%), 386.20(0.2), динения 3, но заменяя соединение 2 соединением 360.20(0.7), 331.10(0.3), 303.15(3.3), 276.15(4.7), 32. 248.15(13.7), 233.10(5.8), 217.05(4.9), 204.10(9.8), Т.пл. 112-113°С (из ацетонитрила), Vмакс KBr) 176.10(1.8), 153.20(100), 126.20(5.2), 98.10(13.9); dн см -1 3347, 2947, 2809, 1615, 1451, 1318, 1284, (400 MHz, CDCI3); δc-13 (100 MH z, CDCI3). 1094, 836; dн (400 MH z, CDCІ3) 1.10(3H,br s), Его соль НСІ: т.пл. 155-165°С (AcOEt-эфир). 1.21(3H,br s), 1.69(1H,br s), 2.33(4H,br s), 2.862.89(4H,m), 3.24(2H,br s), 3.51 (2H, brs), 4.22(1H,s), 7.23-7.41(8H,m); C22H28N3 OCІO×3H2O требует: С, 67.52; Η, 7.37; Ν, 10.74; 27 71538 28 Найдено: С, 67.68; Η, 7.37; Ν, 10.73. s), 1.19(3H,br s), 1.89 (1H,brs), 2.40(4H,br s), 2.89Пример 22. 2.92(4H,m), 3.21(2H,br s), 3.50(2H, br s), 4.41(1H,s), 7.24-7.84 (HH,3m); Получение (±)-4-((a-((4-аллил)-1пиперазинил)-4-хлорбензил)-N,NC26H31N3 O×0.9H2O требует: С, 74.75; Η, 7.91; Ν, 10.06; диэтилбензамида×2НСI (соединение 34) Найдено: С, 74.68; Η, 7.56; Ν, 10.38. Соединение данного Примера получают, исПример 24. пользуя процедуру синтеза, описанную в ПримеПолучение (±)-4-((α-((4-аллил)-1рах 2 и 3, но заменяя соединение 3 соединением пиперазинил))-2-нафтилметил)-Ν,Ν33. диэтилбензамид (соединение 38) Т.пл. 147-163°С (из эфира), Vмакс (КВr) / см -1 Соединение данного Примера получают, ис3418, 2974, 2355, 1626, 1435, 1286, 1092, 945, 812: пользуя процедуру синтеза, описанную для Приdн (400 MHz, CDCI3) 1.06(3H,br s), 1.19(3H,br s), меров 2 и 3, но заменяя соединение 3 соединени3.0-3.7(14H,m), 5.4-5.6(2H, m), 6.0-6.2(1H,br m), 7.2ем 37, 7.8(9H,m); Vмакс (КВr) / см -1 3053, 2968, 2805, 1629, 1426, C25H34N3 OCl3 требует: С, 60.18; Η, 6.87; Ν, 1288, 1141, 1095, 921, 817; dн (400 MH z, CDCІ3) 8.42; Найдено: С, 60.48; Η, 6.89; Ν, 8.31. 1.06(3H,br s), 1.19 (3H,br s), 2.49(6H,br s), 3.00(2H,m), 3.20(2H,br 3), 3.49 (2H,br s), 4.41(1H,s), 5.08-5.22 (2H, m), 5.78-5.92 (1H,m), 7.267.84(11H,m). C25H34N3 OCІ3×0.6H2O требуе т: С, 76.99; Η, 8.07; Ν, 9.29; Найдено: С, 77.06; Η, 8.09; Ν, 9.32% Соединения в соответствии с Примерами 2324 синтезируют как показано на вышеприведенной Схеме 7, G. I. Получение (±)-4-((a-гидрокси)-2-нафтилметил)-Ν,Ν-диэтилбензамида (соединение 35) Соединение 35 получают, используя процедуру синтеза, описанную для соединения 1, но заменяя 3-броманизол 2-бром-анизолом и 1нафтальдегид N,N-диэтил-4-карбоксибензамидом. Vмакс (KBr) см -1 3302, 2976, 1607, 1430, 1290, 1098, 813; dн (400 MH z, CDC1 3) 1.09(3H,br s), 1.22(3H,br з), 2.60(1Н, d, J 3), 3.24(2H,br s), 3.52(2H,br s), 6.00(1Н, d, J 3), 7.30-7.50(7H,m), 7.76-7.88 (4H,m); II. Получение (±)-4-((α-хлоро)-2-нафтилметил)-N,N-диэтилбензамида (соединение 36) Соединение 36 получают, используя процедуру синтеза, описанную для соединения 2, но заменяя соединение 1 соединением 35. Используют без обработки на следующей стадии. Пример 23. Получение (±)-4-((α-(1-пиперазинил))-2нафтилметил)-Ν,Ν-диэтилбенэамида (соединение 37) Соединение данного Примера получают, используя процедуру синтеза, описанную для Примера 1, но заменяя соединение 2 соединением 36. Т.пл. 106-108°С (из ацетонитрила), Vмакс (KBr) / см -1 3324, 3052, 2964, 2810, 2774, 1613, 1465, 1287, 1130, 1098; 6н (400 MHz, CDCI3) 1.07(3H,br Соединения в соответствии с Примерами 2526 синтезируют, как показано на вышеприведенной Схеме 8. Н. I. Получение (±)-4-((α-гидрокси)-4-ксилил)-Ν,Νдиэтилбензамида (соединение 39) Соединение 39 получают, используя процедуру синтеза, описанную для соединения 31, но заменяя 4-хлорфенилмагний бромид на 4толуилмагний бромид. Vмакс (ΚΒr) / см-1 3364, 2970, 1602, 1455, 1381, 1291, 1101, 1054, 802; dн (400 MHz, CDCІ3) 1.09(3H,br s), 1.22(3H,br s), 2.33(3H,s), 2.55(1H,br s), 3.24(2H,br s), 3.52(2H,br s), 5.78(1H, d, J 3), 7.117.41(8H,m); II. Получение (±)-4-((a-хлор)- -ксилил)-Ν,Νдиэтилбензамид (соединение 40) Соединение 40 получают, используя процедуру синтеза, описанную для соединения 2. Используют на следующей стадии без дальнейшей очистки. Пример 25. Получение (±)-4-(a(-(1-пиперазинил))-4ксилил)-N,N-диэтилбензамида(соединение 41) Соединение данного Примера получают, используя процедуру синтеза, описанную для сое 29 71538 30 динения 3. динения 3. Т. пл. 129-132°С (из ацетонитрила), Vмакс(KBr) / Т.пл. >130°С разл. (из эфира), Vмакс (КВr) / см-1 см -1 3320, 2957, 2811, 1610, 1437, 1285, 1128, 2971, 2805, 2715, 1624, 1434, 1289, 1096, 783; dн 1010, 838; dн (400 MHz, CDC13) 1.10(3H,br s), (400 MHz, CDCІ3, свободное основание) 1.10(3H,br 1.20(3H,br s), 1.83(1H,br s), 2.30(3H,s), 2.34(4H,br s) s), 1.20(3H,br s), 2.31(3Н, s), 2.35-2.45(5H,m), 2.89, 2.86-2.89 (4H,m), 3.24(2H,br s), 3.51(2H,br s), 2.92(4H,m), 3.25(2H,br s), 3.51 (2H,br s), 4.19(1H,s), 4.20(1H,s), 7.06-7.46 (8H, 3m); 6. 98-7.46 (8H,4m); C23H31N3 O требует; С, 75.58; Η, 8.55; Ν, 11.50; Найдено: С, 75.30; Η, 8.54; Ν, 11.56. Пример 26. Получение (±)-4-((α-((4-аллил)-1пиперазинил))-4-ксилил)-Ν,Nдиэтилбензамид×2НСІ (соединение 42) Соединение данного Пример а получают, ис40 пользуя процедуру синтеза, описанную для Примеров 2 и 3. Т.пл. >160°С разл. (из эфира); Vмакс (КВr) / см-1 3437, 2973, 2402, 1625, 1433, 1289, 1097, 944, 809: dн (400 MH z, CDCI3, свободное основание) 1.10(3H,br з), 1.20 (3H,br s), 2.29(3H,s), 2 . 35-2.60 (6H,m), 3.03(2H,m), 3.24(2H, br s), 3.52(2H,br s), 4.22(1H,s), 5.12-5.23 (2H,m), 5.81-5.93 (1H,m), 7.057.45(8H,3m); Соединения в соответствии с Примером 27 синтезируют, как показано на вышеприведенной Схеме 9. I. I. Получение (±)-4-((α-гидрокси)-3-ксилил)-Ν,Νдиэтилбензамида (соединение 43) Соединение 43 получают, используя процедуру синтеза, описанную для соединения 31, но заменяя 4-хлорфенилмагний бромид мтолуилмагний бромидом. Vмакс (KBr) / см-1 3406, 2972, 1613, 1429, 1360, 1287, 1097, 1053, 789; dн (400 MHz, CDCІ3) 1.10(3H,br s), 1.22(3H, br s), 2.34(3H,s), 2.55(1H, d, J 3.5), 3.25(2H,br s), 3.52 (2H,brs), 5.80(1H, d, J3), 7.12-7.42(8H,m); II. Получение (±)-4-((α-хлоро)-3-ксилил)-Ν,Νдиэатилбензамид (соединение 44) Соединение 44 получают, используя процедуру синтеза, описанную для соединения 2. Используют на следующей стадии без дальнейшей очистки. Пример 27. Получение (±)-4-((a-(1-пиперазинил))-4ксилил)-Ν,Ν-1-диэтилбензиламида×2НСІ (соединение 45) Соединение данного Примера получают, используя процедуру синтеза, описанную для сое Соединения в соответствии с Примером 28 синтезируют, как показано на вышеприведенной Схеме 10. J. I. Получение (±)-4-((αгидрокси)циклогексилметил)-Ν,Νдиэтилбензамида (соединение 46) Соединение 46 получают, используя процедуру синтеза, как описано для соединения 31. dн (400 MHz, CDCІ3) 0.85-2.0(18H,m), 3.26(2H,br a), 3.53(2H,br s), 4.35-4.43(1H,m), 7.287.36(4Н,m); II. Получение (±)-4-((αхлоро)циклогексилметил)-N,N-диэтилбензамида (соединение 47) Соединение 47 получают, используя процедуру синтеза, как описано для соединения 2. Используют на следующей стадии без дальнейшей очистки. Пример 28. Получение (±)-4-((a-(1-пиперазинил))циклогексил-метил)-Ν,Ν-диэтилбензамида (соединение 48) Соединение данного Примера получают, используя процедуру синтеза, описанную для соединения 3. Т.пл. 113-116°С (из ацетонитрила), Vмакс (KBr) / см -1 3330, 2936, 2845, 1623, 1431, 1286, 1096, 823; dн (400 MH z, CDCI3) 0.64-2.02(18H,m), 2 .182.40 (4H,m), 2.75-2.87(4H,m), 3.06(1H, d, J 8.8), 3.27(2H,br s), 3.52(2H,br s), 7.1K2H, d, J 8.4), 7.29(2H, d, J 8.4); 31 71538 Соединения в соответствии с Примером 29 синтезируют, как показано на вышеприведенной Схеме 11. К. I. Получение (±)-4-((α-гидрокси)-3,4-диметилбензил)-N,N-диэтилбензамида (соединение 49) Соединение 49 получают, используя процедуру синтеза, описанную для соединения 1. dн (400 MHz, CDCІ3) 1.09(3H,br s), 2.23(6H,s), 2.85(1H, d, J 3), 3.24(2H,br s), 3.51(2H,br s), 5.73(1H, d, J 2), 7.03-7.12(m,3H), 7.26-7.39(m,4H). II. Получение (±)-4-((a-хлоро)-3,4диметилбензил)-Ν,Ν-диэтилбензамида (соединение 50) Соединение 50 получают, используя процедуру синтеза, описанную для соединения 2. Используют на следующей стадии без дальнейшей очистки. Пример 29. Получение (±)-4-((a-пиперазинил)-3,4диметил-бензил)-N,N-диэтилбензамида (соединение 51) Соединение данного Примера получают, используя процедуру синтеза, описанную для соединения 3. Vмакс (КВr) / см -1 3304, 2939, 2810, 1626, 1429, 1286, 1096, 846; dн (400 MH z, CDCІ3) 1.11(3H,br s), 1.20(3H,br s), 1.87(1H,br s), 2.20(3H,s), 2.22(3H,s), 2.34(4H, br s) , 2.86-2.89(4H,m), 3.25(2H,br s), 3.51(2H,br s), 4.15(1H,s), 7.02-7.15(3H,m), 7.267.30(2H,m), 7.42-7.46(2H,m); 32 Соединения в соответствии с Примером 30 получают, используя процедуру синтеза, как показано на вышеприведенной Схеме 12. L. I. Получение (±)-4-((a-гидрокси)-1нафтилметил)-Ν,Ν-диэтилбензамида (соединение 52) Соединение 52 получают, используя процедуру синтеза, как описано для соединения 1. dн (400 MH z, CDCІ3) 1.06(3H,br s), 1.20{3H,br s), 3.01(1H, d, J 4), 3.21(2H,br s), 3.49(2H,br з), 6.47(1H, d, J 4), 7.24-7.48(7H,m), 7.55-7.58 (1H,m), 7.78-7.87 (2H, m), 7.98-8.01 (1H,m); II. Получение (±)-4-((α-хлоро)-1-нафтилметил)Ν,Ν-диэтилбенаамида (соединение 53) Соединение 53 получают, используя процедуру синтеза, как описано для соединения 2. Используют на следующей стадии без дальнейшей очистки. Пример 30. Получение (±)-4-((a-(1-пиперазинил))-1нафтилметил)-Ν,Ν-диэтилбензамида (соединение 54) Соединение данного Примера получают, используя процедуру синтеза, описанную для соединения 3. Vмакс (КВr) / см -1 3307, 3050, 2966, 2814, 1625, 1431, 1287, 1098, 843, 797; dн (400 MH z, CDCI3) 1.04(3H,br s), 1.17(3H,br s), 2.14(1H,br s), 2.40(2H,br s), 2.46(2H,br s), 2.83-2.95 (4H,m), 3.17(2H, br s), 3.48(2H,br s), 5.05(1H,s), 7.22-7.28(2H,m), 7.40-7.54 (5H,m), 7.70-7.94(3H,m), 8.40-8.43(1H,m); Модификация пипериааинового кольца: Общие эксперименты и Примеры Соединения в соответствии с Примерами 3142 синтезируют, как показано на нижеприведенной Схеме 13. М. I. Получение 2-диметил-5-метилпиперазин3,5-диона (Соединение 55) N-трет-Бутоксикарбонил-2-аминоизомасляную кислоту (5,0г, 25ммоль.) и D,L-аланин метилэфир гидрохлорид (3,5г, 25ммол.) растворяют в сухом дихлорметане (50мл) и охлаждают до 0°С. Добавляют триэтиламин (3,5мл, 25ммол.), затем 1-(3диметиламинопропил)-3-этилкарбодиимид гидрохлорид (4,8г, 25ммол.) и смесь перемешивают при 0°С до растворения комков. Реакционную смесь затем оставляют в морозильнике 4d при -20°С. Органический раствор промывают водой, 1М лимонной кислотой (водн.), водой, высушивают (Na2SO4) и выпаривают в вакууме, получая 6,0г (83%) связующего продукта. Большую часть связующего продукта (5г) растворяют в м уравьиной кислоте (50мл) и перемешивают в течение 12 часов при 25°С. Кислоту удаляют в вакууме, остаток растворяют в 2-бутаноле и нагревают с обратным холодильником в течение 4 часов. Раствор охлаждают до 0°С, кристаллы отфильтровывают и высушивают в вакууме при 100°С. Выход составляет 2,6г чистого соединения 55 (82%), которое может быть рекристаллизовано из метанола, т.пл. >300°С; ИК (КВr) (см -1): 3000 (br), 1680 (s) (C=0). 1 Н ЯМР (D20): d = 4.75(s,2H, NH), 4.21(q,1H, 33 71538 34 СНМе), 1.50-1.42 (m,9Η, 3Ме). рация и высушивание кристаллов в вакууме над C7H12N2O 2 требует: С, 53.83; Н, 7.74; N, 17.94; КОН приводит к получению дигидрохлорида, соеНайдено: С, 53.89; Н, 7.90; N, 17.79. динения 58, т.пл. 105-121°С. ИК (соль НСІ, КВr) II. Получение 2-диметил-5-метил-пиперазин (см -1): 3400 (br, ОН), 2500 (br, R2NH2+), 1620 (s) дигидрохлорида (соединение 56) (С=0 или R2NH2+), 1285, 1043 (С-0). 1Н ЯМР: Соединение 55 (2,2г, 14ммол.) растворяют на (амин, CDCI3): δ=7.50-6.60 (m, 8Н, Ar-H), 5.70(m, сухом тетрагидрофуране (120мл). Небольшими 1H, аллил-Н), 5.00(m, 2H, аллил-Н), 4.70 (s,1H, порциями добавляют литийалюминий гидрид CHAr2), 3.70 (з, 3Н, MeO), 3.5+3.3 (2br s, 4H, (42мл, 1М в тетрагидрофуране). Окончив добавМеСН2), 3.0-1.9 (m,7H, пиперазин-Н), 1.2ление, раствор нагревают с обратным холодиль0.8(m,15H, 5Me). ником в течение ночи. Раствору дают возможность C29H41N3 O2×2HCl требует: С, 64.91; Η, 8.08; Ν, охладиться, затем избыточный гидрид разрушают, 7.83; добавляя по каплям воду (1,6мл), NaOH (1,6мл, Найдено: С, 65.70; Η, 8.60; Ν, 8.29. 15% раствор) и воду. Зернистый осадок отфильтΝ. ровывают и растворитель выпаривают в вакууме. Ι. Получение 4-аллил-2-диметил-5Остаток растворяют в дихлометане, высушивают метилпиперазина (соединение 59) (К2СО3), получая, после выпаривания растворитеСоединение 56 (0,14г, 0,91ммол.) растворяют ля в вакууме, 1,5г (84%). Обрабатывая избытком в ацетонитриле и при 0°С добавляют аллилброНСІ в эфире, получают дигидрохлорид, соединемид (80мкл, 0,91ммол.). Через час добавляют еще ние 56, которое может быть рекристаллизовано из одну порцию аллилбромида. Через два часа растметанола/эфира, т.пл. >300°С, ИК КВr (см -1): 2760, воритель выпаривают и остаток очищают флэш1570 (R2NH2+) MS (амин): 128, 113, 84, 71, 58. хроматографией на двуокиси кремния 1 Н ЯМР (D2O+DSS):δ = 2.70-2.50 (m, 5Н, CH2(СН2С12/МеОН), 95:5-80:20, получая моноаллил, N, CH-N), 1.14 (s, 3Н, 1 Me), 1.00-0.94(s+d, 6H, 2 соединение 59, 116мг (69%). Me). Пример 33. C7H16N2×2HCl требует: С, 41.80; Η, 9.02; Ν, Получение 4-(1-(4-аллил-2-диметил-513.93; метилпиперазинил)-3-метоксибензил)-Ν,ΝНайдено: С, 42.03; Η, 9.24; Ν, 14.00. диэтилбензамид дигидрохлорида (соединение 60). Пример 31. Соединение данного Примера получают, исПолучение 4-(4-(2-диметил-5пользуя процедуру синтеза, описанную для Приметилпиперазинил)-3-метокси-бензил)-N,Nмер а 3. диэnbkбензамид дигидрохлорида (соединение 57) Т.пл. 125-130°С. ИК (2НСІ, КВr) (см-1): 4-(Хлоро-(3-метоксифенил)метил)-Ν,N3430(br), 2978, 2480(br), 1607, 1436, 1285. MS диэтилбензамид (0,61г, 2,0ммол.) и соединение 56 (свободный амин): 366, 296, 167. 1Н ЯМР: (0,50г, 3,9ммол.) растворяют в сухом ацетонитри(D2О+DSS): δ = 7.60-6.90 (m, 9H, Ar-H), 6.0-5.5 ле (5мл). Добавляют карбонат калия (0,26г, (m,4H аллил-Н+Аr2СН), 3.80 (2s, 3Н, MeO), 4.0-3.7 2,0ммол.) и смесь нагревают с обратным холоди(m, 11Н, аллил-H, пиперазин-Н, амид-СН2), 1.3льником для 2d. Растворитель удаляют в вакууме 1.0(m, 15Н, пиперазин-Ме, амид-Ме). и остаток очищают флэш-хроматографией на двуАнал. для C29H 41N3O 2×2HCl×2.9H2O: окиси кремния (CH2CI2/-МеОН/NH3, (водн.), 98:1:1Подсчитано: С, 59.15; Н, 8.35; N, 7.14; 95:5:1, получая 0,65г (79%). Обработка избытком Найдено: С, 59.05; Н, 8.00; N, 7.22. НСI в эфире, фильтрация и высушивание крисПример 34. таллов в вакууме над КОН приводит к получению Получение 4-(1-(2-диметил-5дигид-рохлорида, соединения 57, т.пл.: 134-136°С. метилпиперазинил)-3-метоксибензил)-Ν,ΝИК (соль НСI, КВr) (см -1): 3400 (br, ОН), 2900 (br, диэтилбензамид дигидрохлорида (соединение 61) R2NH2+), 1600 (s, C=0 или R2NH2+), 1283, 1038 (ССоединение 56 (42мг, 0,33ммол.) и карбонат 0) . MS (амин) 3 пика: 423, 353, 325, 296, 127. 1Н калия (46мг, 0,33ммол.) растворяют в воде (2мл) и ЯМР: (амин, CDC13): δ = 7.40-6.60 (m, 8H, Ar-H), добавляют ди-трет-бутилдикабонат (79мг, 5.26, 5.25, 4.61(3s,1H CHAr2), 3.70(s,3H, MeO), 3.4, 0,36ммол.). После перемешивания в течение 1 3.2(2 br s, 4H, MeCH 2), 3.1-2.0(m, 5H, пиперазин-Н), часа растворитель выпаривают в вакууме и оста1. 3-0. 9 (m, 15H, 5Me). ток очищают хроматографией на двуокиси кремС26Н37N3 О2×2НСI требует: С, 62.89; Η, 7.92; Ν, ния (СН2СІ2/МеОН, 90:10, получая 43мг моно-N8.4 6; Boc, защищенного 55, который растворяют в суНайдено: С, 63.41; Η, 8.38; Ν, 8.56. хом ацетонитриле вместе с карбонатом калия Пример 32. (26мг, 0,19ммол.) и 4-(хлоро-(3Получение 4-(4-(1-аллил-2-диметил-5-метилметоксифенил)метил)-Ν,Ν-диэтилбензамидом пиперазинил)-3-метоксибензил)-Ν,Ν(63мг, 0,19ммол.). После нагревания в течение 4 диэтилбензамид дигидрохлорида (соединение 58) дней с обратным холодильником растворитель Соединение 57 (0,39г, 0,92ммол.) растворяют удаляют в вакууме и остаток очищают хроматогв сухом ацетонитриле (5мл). Добавляют карбонат рафией на двуокиси кремния (СН2СІ2/МеОН), калия (0,13г, 0,92ммол.) и аллилбромид (90мкл, 100:0, 95:5. Обработка муравьиной кислотой (5мл) 1,02ммол.). Через 3 часа растворитель выпаривав течение 3 часов, выпаривание растворителя в ют при 25°С и остаток очищают флэшвакууме и экстракция остатка с помощью хроматографией на двуокиси кремния СН2СІ2/1М NaOH, высушивание органической фа(СН2С12/МеОН), 98:2-95:5, получая в целом 0,39г зы (К2СО3) и выпаривание растворителя в вакууме (92%). Обработка избытком НСІ в эфире, фильтприводит к получению 27мг (33%) свободного 35 71538 36 амина. Обработка избытком НСІ в эфире привопиперазин-3,5-диона (соединение 66) дит к получению дигидрохлорида, который раст(D,L)-N-трет-Бутоксикарбонилаланин (5,0г, воряют в воде и лио филизируют, т.пл. 145-150°С. 26ммол.) растворяют в метиленхлориде (50мл) ИК (2НСІ, КВr) (см -1): 3500-3400 (br), 1601, 1442, триэтиламином (8,1мл), высушивают молекуляр1285. MS(свободный амин):423, 296, 325, 127. ными ситами 4А и переносят в сухую колбу в токе 1 Н ЯМР (CDCS3): δ = 7.4-6. 6 (m, 8H, Ar-H), азота. При -10°С добавляют изобутилхлорформи5.39, 5.36(2s,1H, Ar2CH), 3.7S(s,3H, Me O), 3.5, ат (3,8мл, 29ммол.). Раствор перемешивают в 3.25(2 br.s,4H, амид-Ме), 2.80, 2.50, 2.05(3m, 5H, течение 15 минут, затем добавляют D,Lпиперазин-Н), 1.5(br.s,1H, N-H) , 1.25-1.0(br m,6H, серинметилэфир гидрохлорид (4,1г, 26ммол.), амид-Ме), 1.15{s,3H, Me), 0.90(d,3H, Me), затем раствору дают возможность нагреться до 0.85(s,3H, Me). 25°С и перемешивают его в течение 12 часов. Промывание раствора рассолом, высушивание Для C26H37N3 O2×2HCІ×7.4H2O: Подсчитано: С, 49.58; Η, 8.61; Ν, 6.67; (MgS04) и выпаривание растворителя в вакууме приводит к получению твердого вещества, которое Найдено: С, 49.61; Η, 7.73; Ν, 6.56. обрабатывают муравьиной кислотой в течение 1 О. часа. Кислоту удаляют в вакууме и остаток растΙ. Получение 4-(фенил-гидроксиметил)-N,Nворяют в безводном 2-бутаноле (5мл) и нагревают диэтил-бензамида (соединение 62) Соединение 62 получают, используя процедус обратным холодильником в течение 2 дней. Растворитель удаляют и остаток кристаллизуют, пору синтеза, описанную для соединения 1. лучая после обработки ацетоном 1г соединения MS: 282, 211, 165, 105. 1Н ЯМР: (CDCІ3): d = 66 (24%). 7.38-7.20(m,9H), 5.80(d, J=3.5 Hz, 1H), 3 .5, 3.2(2 br II. Получение 2-гидроксиметил-5-метилs,4H), 1.2, 1.05(2 br s, 6H). пиперазина (соединение 67) II. Получение 4-(хлорофенилметил)-Ν,ΝСоединение 67 получают, используя процедудиэтилбензамида (соединение 63) ру синтеза, описанную для соединения 55. Соединение 63 получают, используя процедуII. Получение 2-(третру синтеза, описанную для соединения 2. бутилди фенилсилилокси)метил-5-метилGC-MS (2 пика): 296, 225, 165, 121 и 300, 266, пиперазина (соединение 68) 229, 195, 165. 1Н ЯМР: (CDCІ3): δ = 7.45-7.20 (m, Соединение 67 (0,41г, 3,1ммол.) растворяют в 9Н), 6.09(s,1H), 3.4 (br m,4H), 1.1 (br m, 6H). диметил-формамиде (5мл). Добавляют хлороПример 35. трет-бутилдифенилсилан (0,95г, 3,4ммол.) и имиПолучение 4-((1-пиперазинил)бензил)-N,Nдазол (0,47г, 6,9ммол.) и перемешивание продолдиэтилбензамид дигидрохлорида (соединение 64) жают в течение 12 часов. Продукт экстрагируют, Соединение данного Примера получают, исдобавляя при, встряхивании этилацетат, рассол и пользуя процедуру синтеза, описанную для сое1М NaOH. Органическую фазу высуши вают и выдинения 3. паривают в вакууме. После хроматографии остатТ.пл. 157-169°С. ИК (амин, CDCІ3 в клетках ка на двуокиси кремния (СН2СІ2/МеОН, 100:0, 95:5, КВr) (см -1): 3690, 3630, 1613, 1435, 90:10 и 80:20) получают 0,39г (34%) чистого сое1265.MS(свободный амин): 351, 306> 295, 266, динения 68. 194, 165. 1Н ЯМР: (свободный амин, CDC13): δ Пример 37. 7.46-7.16 (m,9H, Ar-H), 4.24(s,1H, CHAr2), 3.5+3.2(2 Получение 4-(4-(2-гидроксиметил-5br s,4H, MeCH2), 2.89(m,4H, пиперазин-Н), 2.36(br метил)пиперазинилбензил)-N,N-диэтилбензамид s,4H, пиперазин-Н), 1.94(br s,1H, NH), 1.2+1.1(2 br дигидрохлорида, (соединение 69) s,6H, 2Me). Соединение из данного Примера, получают, Анал. для C22H 29N3O×2HCl×1.90H2O используя процедуру синтеза, описанную для соПодсчитано: С, 57.61; Η, 7.65; Ν: 9.16; единения 3. Найдено: С, 57.59; Η, 7.66; Ν, 8.92. Т.пл.145-150°С. ИК (2НСІ, KBr) (см -1): 3300 (br), Пример 36. 2700 (br), 1612, 1446, 1382, 1296, 1080. MS (свобоПолучение 4-((4-аллил-1дный амин): 381, 218, 181, 91. 1H ЯМР: (свободный пиперазинил)бензил)-Ν,Ν-диэтилбензамид дигидамин, CDCІ3): δ-7.44-7.18(m,9H, Ar-H), 5.17, рохпорида (соединение 65) 5.14(2s,1H, ArCH2), 3.75-2.60 (m, 12H, пиперазинСоединение из данного Примера получают, Н, амид-СН2), 2.02 (т,1Н, пиперазин-Н), 1.30-1.05 используя процедуру синтеза, описанную для (m, 9H, пиперазин-Ме+амид-Ме). Примеров 2 и 3. Анал. для C24H 33N3О 2×2HCІ×1.8H2O: Т.пл. 175-205°С. ИК (амин, CDCІ3 в клетках Подсчитано: С, 57,55; Н, 7.77; N, 8.39; KBr) (см -1): 3689, 1613, 1455, 1434, 1290, 1143. Найдено: С, 57 05; Н, 7.67; N, 8.19. МS(свободный амин): 391, 165, 125. 1Н ЯМР: (своПример 38. бодный амин CDCI3): δ =7.42-7.12 (m, 9Н, Ar-Н), Получение 4-((4-(2-гидроксиметил-55.81(m,1H, аллил-Н), 5.10(m,2H, аллил-Н), метил)пиперазинил)-3-метокси-бензил)-Ν,Ν4.23(s,1H, CHAr2), 3.5+3.2(2 br s,4H, MeCH 2), диэтилбензамид дигидрохлорида (соединение 70) 3.00(m,2H, аллил-Н), 2.6-2.4(br s,8H, пиперазин-Н), Соединение из данного Примера получают, 1.1(2 br s,6H, 2Me). используя процедуру синтеза, описанную для соАнал. для C25H 35N3O×2HCl×1.0H2O: единения 3. Подсчитано: С, 62.23; Н, 7.73; N, 8.71; Т.пл. 185-190°С. ИК (2НСІ, KBr) (см -1): 3500Найдено: С, 62.22; Н, 7.49; N, 8.42. 2500 (br), 1596, 1440, 1045. 1Н ЯМР: (свободный Р. амин, CDCІ3): δ = 7.40-6.60 (m,8H, Ar-H), 5.05, I. Получение 2-гидроксиметил-5-метил 37 71538 38 5.10(2s,1H, Ar2CH), 3.70(s,3H, MeO), 3.8-2.5(m,12H, Получение дигидрохлорида метил 3-((2пиперазин, амид СН 2), 1.2-1.0 (br s,9H, амид-Ме, нафтил)-(4-аллил-2-метилпиперазинил)метил) пиперазин-Ме). фенилового эфира (соединение 76) Пример 39. Соединение из данного Примера получают, Получение 4-((4-(1-аллил-2-гидроксиметил-5используя процедуру синтеза, описанную для метил)-пиперазинил)-3-метоксибензил)-Ν,ΝПримера 3, диэтилбензамид дигидрохлорида (соединение 71) Т.пл. 173-182°С. ИК (KBr) (см -1): 3430, 2500, Соединение из данного Примера получают, 2355, 1601, 1436, 1265, 1047. MS (амин): 386, 274, используя процедуру синтеза, описанную для 247, 215, 139, 125. 1Н ЯМР: (амин, CDCІ3):d - 7.86Примеров 2 и 3. 6.66 (m, 11Н, Ar-H), 5.82 (т,1Н, аллил-Н), Т.пл. 125-130°С. ИК (2НСІ, КВк) (см -1): 3400 5.12(m,2H, аллил-Н), 4.95 (br. s, 1Н, CHAr2), 3.76, (br), 1603, 1445, 1285. MS (свободный амин): два 3.75 (2s,3H, MeO), 3.04-2.32(m,9H, пиперазин-Н), пика: 310, 239, 135 и 312, 241, 135. 1Н ЯМР: (сво1.15-1.11 (2d,3H, Me). бодный амин, CDCІ3): d= 7.50-6.70 (m,8H, Ar-H). Анал. для С 26Η 32Ν2Ο×2ΗСІ×0.4Η2О, 5.80, 5,20, 5.00(3m,3H, аллил-Н), 4.0-2.3(m,14Н, Подсчитано: С, 66.92; Н, 7.08; Ν, 6.00; пиперазин-Н, аллил-Н, амид-СН2), 3.80(s,3H, Найдено: С, 67.03; Н, 7.09; Ν, 5.88. MeO), 1.2 (br з, 6Н, амид-Ме). Пример 42. Анал, для С 25Н 35N3О 3×2НСІ×3.7Н2О: Получение гидрохлорида 4-((4-ацетил-1Подсчитано: С, 55.57; Н, 8.06; N, 6.94; пиперазинил)-бензил)-Ν,Ν-диэтилбензамида (соеНайдено: С, 55.53; Н, 7.82; N, 7.16. динение 77) Q. Свободный амин соединения 64 (100мг, I. Получение метил 3-(гидрокси-(20,28ммол.) растворяют в метиленхлориде (5мл), нафтил)метил)-фенилового эфира (соединение охлажденном до 0°С. Добавляют триэтиламин 72) (43мкл, 0,31ммол.), а затем по каплям добавляют Соединение 72 получают, используя процедуацетилхлорид (23мкл, 0,31ммол.). Через 10 минут ру синтеза, описанную для соединения 1. раствор промывают карбонатом калия (10%), выMS: 264, 155, 135, 128, 109, 101. 1Н ЯМР: сушивают (К2СО3) и выпаривают в вакууме. Оста(CDC13): δ = 7.90-6.78(m, 11H, Ar-H), 5.98(d, J=3.5 ток очищают хроматографией на двуокиси кремHz, 1H, Ar2H), 3.78 (s,3H, MeO), 2.32(d, J=3.5 Hz, ния (СН2СІ2/МеОН/NH3, 95:5:0,5), получая 116мг 1H, OH). соединения 77 (~100%). II. Получение метил 3-{хлоро-(2Т.пл. 140-150°С. ИК (KBr) (см -1): 3480 (br), нафтил)метил)-фенилового эфира (соединение 2987, 2500 (br), 1623, 1429, 1285, 1245. MS (свобо73) дный амин): 393, 267, 165, 127. 1Н ЯМР: (свободСоединение 73 получают, используя процедуный амин, CDCI3): δ = 7.46-7.18 (m, 9Н, Ar-Н), ру синтеза, описанную для соединения 2. 4.25(5,1Н, CHAr2), 3.70-3.15 (m, 8H, амид-СН2, пиGC-MS (2 пика): 278, 247, 215, 171, 155, 135 и перазин-Н), 2.36(m,4H, пиперазин-Н), 2.05(s,3H, 282, 248, 247, 231, 215. 1Н ЯМР: (CDCІ3): δ - 7.86MeCO), 1.15(br.m, 6Η, амид-Ме). 6.81 (m, 11H, Ar-H), 6.25(з,1H, Ar2H), 3.76(3,3H, Анал. для C24H 31N3O 2×1HCl×0.80H2O: MeO). Подсчитано: С, 64.87; Н, 7.62; N, 9.46; III. Получение 4-аллил-2-метилпиперазина Найдено: С, 65.01; Н, 7.76; N, 9.42. (соединение 74) 2-Метилпиперазин (0,4г, 4ммол.) растворяют в ацето-нитриле (5мл) и при 0°С добавляют аллил бромид (86мкл, 1ммол.). Перемешивание продолжают при 0°С в течение 1 часа, а затем при 25°С в течение 6 часов. Выпаривание растворителя в вакууме и хроматография на двуокиси кремния (СН 2СІ2/МеОН, 80:20) приводят к получению 80мг (57%) чистого соединения 74. Пример 40. Получение дигидрохлорида меяил 3-((2нафтил)-(3-метил-пиперазинил)метил)фенилового эфира (соединение 75) Соединение из данного Примера, получают, используя процедуру синтеза, описанную для соединения 3. Т.пл. 170-174°С. ИК (KBr) (см -1): 3461, 2458, 1600, 1439, 1263, 1043. МS (амин): 386, 247, 215, 139, 112. 1Н ЯМР: (амин, CDCI3): δ- 7.84-6.66 (m, 11Н, Ar-H), 4.33 (s,1H, CHAr2), 3.74, 3.73(2s,3H, MeO), 3.00-2.70(m, 6H, пиперазин-Н), 1.95, 1.65(2m,2Η, пиперазин-Н), 0.98-0.92(2d, J=6.4 Hz, 3H, пиперазин-Ме). Анал. для C23Η 26Ν2O×2ΗCI×1.8Η2O. Подсчитано: С, 61.14; Н, 7.05; Ν, 6.20; Найдено: С, 61.05; Н, 6.48; N. 6.07. Пример 41. 39 71538 40 Замещения диэтилбензамида и т.д. Соединения в соответствии с Примерами 4348 получают, как показано на нижеприведенной Схеме 14. R. I. Получение 4-((4-трет-бутоксикарбонил-1пиперазинил)-бензил)-бензойной кислоты (соединение 78) Соединение 64 (6,0г, 17ммол.) растворяют в 6Ν соляной кислоте и нагревают при 120°С в течение 3 дней. Затем раствор нейтрилизуют водным NaOH (~12г). Раствор концентрируют до 100мл, смешивают с тетрагидрофураном (100мл) и добавляют растворенный в тетрагидрофуране (50мл) ди-трет-бутил дикарбонат (3,7г, 17ммол.). После перемешивания в течение 1 часа при 25°С водную фазу подкисляют 1М лимонной кислотой и дважды экстрагируют этилацетатом. Органичес 41 71538 42 кую фазу высуши вают (К2СО3) и выпаривают, а получению свободного амина, который превраостаток очищают хроматографией на двуокиси щают в соль дигидрохлорида 82. Т.пл. 192-200°C. кремния (EtOAc/гептан/АсОН, 10:90:0-66:33:1), ИК (KBr) (см-1): 3939 (br), 3184 (br), 2700 (br), 1665, получая в целом 3,85г (57%) соединения 78. 1610, 1565, 1426. MS (амин): 295, 250, 210, 165, Пример 43. 152. 1Н ЯМР: (амин, CD3OD): δ = 7.96-7.22 (m, 9H, Получение дигидрохлорида 4-((1Ar-H), 4.93(s,2H, ΝΗ), 4.40(3,111, Ar2CH), 2. 94+2. пиперазинил)-бензил)-бензойной кислоты (соеди46 (2m, 8H, пиперазин-Н). нение 79) Анал.для C18H21N3O×2HCl×1.1H2О: Соединение 78 (150мг, 0,38ммол.) обрабатыПодсчитано: С, 55.70; Н, 6.54; N, 10.83; вают избытком НСІ в уксусной кислоте. Кислоту Найдено: С, 55.83; Н, 6.76; N, 10.75. удаляют в вакууме, а остаток растворяют в метаПример 46. ноле и осаждают, добавляя эфир. Осадок высуПолучение 4-((1-пиперазинил)-бензил)-Nшивают в вакууме при 100°С. этилбензамид гидрохлорида (соединение 83). Т.пл. 172-180°С. ИК (KBr) (см -1): 3000 (br), Соединение из данного Примера получают, 1700, 1606, 1454. 1Н ЯМР: (DMSO-d6): δ=12.85 (s, используя процедуру синтеза, как описано для 1Н, CO2H), 8.95(s,2H, NH), 7.92-7.20 (m,9H, Ar-H), соединения 82, но заменяя аммиак этиламином. 4.56 (s,1H, Ar 2CH), 3.33(s,8H, пиперазин-Н). Т.пл. 180-185°С. ИК ,(KBr) (см -1): 3331 (br) , Анал. для C18H 20N2O 2×2HCl: 2700(br), 1640, 1545, 1440, 1308. MS: (EІ, амин) Подсчитано: С, 58.54; Н, 6.00; N, 7.59; 323, 278, 267, 238, 195, 165. 1Н ЯМР (амин, Найдено: С, 59.90; Н, 6.47; N, 7.88. CD3OD): δ= 7.84-7.14 (m, 9Н, Ar-H), 4.9(br. s, NH), Примеры 44 и 45. 4.45(s,1H, Ar2CH), 3.40(m,2H, этил-СН 2), 3.25, 2.65 Получение метил 4-((4-трет-бутоксикарбонил(2m,8H, пиперазин-Н), 1.20(m,3H, этил-Ме). 1-пиперазинил)-бензил) бензоата (соединение 80) Пример 47. и метил 4-((1-пиперазинил)-бензил)бензоата дигиПолучение 4-(1-пиперазинилдрохлорида (соединение 81) бензил)бензонитрил дигидрохлорида (соединение Соединение 78 (0,15г, 0,38ммол.) и карбонат 84) цезия (0,25г, 0,76ммол.) смешивают в диметилфоСоединение 82 (45мг, 0,11мол.) растворяют в рмамиде (2мл) и добавляют метилиодид (72мкл, сухом тетрагидрофуране (2мл) и охлаждают до 1,1ммол.). Через 2 часа при 25°С добавляют кар0°С. Добавляют пиридин (36мкл, 0,44ммол.) и бонат калия (10%, водн.) и раствор экстрагируют трифтор уксусный ангидрид (31мкл, 0,22ммоль) и этилацетатом. После выпаривания растворителя перемешивание продолжают в течение 1 часа при в вакууме остаток очищают хроматографией на 25°С. Добавляют воду и раствор экстрагируют двуокиси кремния (EtOAc/гептан, 30:70), получая этилацетатом. Органическую фазу промывают 0,13г (87%) метилового эфира, соединение 80. разбавленным NaHCO3 (водн.), высушивают Вос-депротекцию осуществляют, обрабатывая (К2СО3) и выпаривают в вакууме. Остаток обрабаизбытком НСІ в метаноле при 50°С. Растворитель тывают НСІ в метаноле в течение 3 часов при удаляют и остаток вновь очищают на двуокиси 50°С. Удаление растворителя в вакууме и хромакремния. Дигидрохлорид, соединение 81 (35мг), тография остатка на двуокиси кремния получают, используя вышеописанный метод. (CH2CI2/MeOH/NH3, 90:10:1) приводит к получению Т.пл. 185-195°С. ИК (KBr) (см -1): 3400 (br), 2700 15мг (49%). Обрабатывая избытком НСI в эфи(br), 1720, 1612, 1430, 1285, 1190, 1112. MS (EI, ре/метаноле, получают дигидрохлорвд, соединесвободный амин): 310, 265, 225, 206, 165. 1Н ЯМР: ние 84, которое осаждают, растворяют в воде и (D2O/CD3OD+DSS): δ= 8.20-7.34(m, 9Н, Ar-H), лиофилизируют. 5.03(s,1H, CHAr2), 3.89 (s,3H, MeO), 3.42 (m,4H, Т.пл. 141-145°С. ИК (KBr) (см -1): 3400(br), пиперазин-Н), 3.08(m,4H, пиперазин-Н). 2700(br), 2230, 1434. MS (свободный амин): 277, Анал. для Ο 19Η22Ν2О 2×2ΗСІ×1Η2Ο. 232, 192, 165. 1Н ЯМР: (свободный амин, CDCI3): δ Подсчитано: С, 56.86; Η, β.53; Ν, 6.98; = 7.58-7.18 (m, 9Н, Ar-H), 4.27 (s,1H, CHAr2) 2.89, Найдено: С, 56.82; Η, 6.54; Ν, 7.00. 2.35(2m,8H, пиперазин-Н), 1.70(s,NH). S. Анал. для C18H 19N3×2HCl×1H2O: I. Получение 4-((1-пиперазинил)-бензил)Подсчитано: С, 58.70; Η, 6.29; Ν, 11.41; бензамид дигидрохлорида (соединение 82) Найдено: С, 58.88; Η, 6.46; Ν, 11.24. Соединение 78 (0,11г, 0,28ммол.) растворяют Пример 48. в сухом метиленхлориде/тетрагидрофуране, 1:1 Получение 4-(1-пиперазинил-бензил)(5мл), и охлаждают до -20°С . Добавляют сначала ацетофенон дигидрохлорида (соединение 85) триэтиламин (78мкл, 0,56ммол.), а затем изобутиСоединение 78 (0,20г, 0,50ммол.) растворяют лхлорформиат (37мкл, 0,28 ммол.). Через 10 мив сухом тетрагидрофуране (5мл) и охлаждают до нут добавляют аммиак в метиленхлориде (0,51мл, 0°С в атмосфере азота. В течение 1 минуты доба1,1М, 0,56ммол.) и позволяют температуре медвляют метиллитий (3,1мл, 0,8М в эфире, 2,5ммол.) ленно подняться до 25°С. Через 3 часа раствории продолжают перемешивание в течение 2 часов. тель удаляют в вакууме и остаток очищают хроДобавляют хлортриметилсилан (0,63мл, 5,0ммол.) матографией на двуокиси кремния и позволяют температуре подняться до 25°С, за(CH2Cl2/MeОH/NH 3, 95:5:1 и 90:10:1), получая 70мг тем добавляют хлорид аммония (водн.). Органи(62%). Обработка НСІ в метаноле в течение 3 чаческую фазу сливают, выпаривают и остаток очисов при 50°С, удаление растворителя в вакууме и щают хроматографией на двуокиси кремния хроматография на двуокиси кремния (CH2Cl2/MeOH/NH 3, 95:5:1), получая 0,11г (75%) (СН2СІ2/МеОН/NH3, 90:10:1 и 80:20:1) приводят к кетона без Вос-группы. Соль дигидрохлорида, 43 71538 44 соединение 85, получают обработкой избытком ъединенные органические слои промывают расНСI в эфире. солом и высушивают над MgSO 4. Удаляя раствоТ.пл. 175-185°С. ИК (KBr) (см -1); 3400 (br), 2700 рители, получают 4-бензоил-N--трет(br) , 1680, 1607, 1424, 1269. MS (EI, свободный бутоксикарбонилпиперидин: (8,54г, 98%). амин): 294, 249, 209, 165. 1Н ЯМР: (свободный dн (400 MH z, CDCI3) 1.47(s,9H), 1.70(m,2H), амин, CDCI3): δ = 7.77-7.04(m,9H, Ar-Н), 4.22 (s,1H, 1.83(m,2H), 2.91 (m,2H), 3.42(m,2H), 4.18 (brs, 2H) , CHAr2), 2.92 (m, 4H, пиперазин-Н), 7.46(m,2H), 7.56(m,1H), 7.93(m,2H). 2.43(s,3H,MeCO), 2.40(m,4Н, пиперазин-Н). II. Получение 4-(α-гидрокси-a-(4-N-третАнал. для C19H 22N2O×2HCl×1.6H2O: бутокси-карбонилпиперидинил)бензил)-Ν,ΝПодсчитано: С, 57.61; Н, 6.92; N, 7.07; диэтилбензамида (соединение 87) Найдено: С, 57.54; Н, 6.75; N, 6.91. К раствору 4-иодо-N,N-диэтилбензамида (3,03г, 10,0ммол.) и TMEDA (1,28г, 11,0ммол.) в сухом тетрагидрофуране (30мл) при 78°С добавляют трет-бутиллитий (10,0мл, 1,7М, 17,0ммол.). Через 10 минут по каплям добавляют 4-бензоилN-трет-бутоксилкарбонилпиперидин (2,89г, 10,0ммол.) в тетрагидрофуране (5мл). Реакционную смесь нагревают до комнатной температуры, затем гасят водным раствором NH4CI и экстрагируют этилацетатом (2´100мл). Объединенные органические слои промывают рассолом и высушивают над МgSО4 . Удаляя растворители, получают сырой продукт, который очищают на силикагелевоЙ колонке, элюируя с помощью МеОНСН2СІ2 (0:100®2:98) для получения 4-(a-гидроксиα-(4-N-трет-бутоксилкарбонилпиперидинил)бензил)-Ν,Νдиэтилбензамида (MTL 0327, 2,60г, 56%): Т.пл. 100-103°С (СН2СI2): Vмакс (KBr) см-1: 3426, 2973, 1687, 1618, 1428, 1289, 1168; 6н (400 MHz, CDCІ3): 1.08 (brs, 3Н), 1.20 (brs,3H), 1.30(m,4H), 1.41(s,9H), 2.50 (t, J=11.2 Hz, 1H), 2.66(m,2H), 2.86(s, OH), 3.22(brs,2H), 3.50(brs,2H), 4.09 (brs,2H), 7.18(m,1H), 7.26(m,4H), 7.45(m,4H); dC-13 (100 MHz, CDCl3): 12.3, 14.1, 26.2, 28.3, 39.1, 43.2, 44.3, 53.3, 79.2, 79.4, 125.75, 125.79, 126.2, 126.6, 128.1, 135.1, 145.3, 146.3, 154.6, 171.0. Пример 49. Получение 4-((α-4-пиперидинил)бензил)-N-Nдиэтил-бензамида (соединение 88) К раствору 4-(α-гидрокси-a-(4-N-третбутоксилкарбонил-пиперидинил)бензил)-N-Nдиэтилбензамида (466мг, 1,0ммол.) и триэтилсилана (232мг, 2,0ммол.) в сухом дихлорметане (10мл) при комнатной температуре добавляют трифтор уксусн ую кислоту (10,0мл). Через 30 минут при комнатной температуре вновь добавляют триэтилсилан (232мг, 2,0мол,). Реакционную смесь перемешивают в течение 14 часов при комнатной температуре, а затем конденсируют. Остаток растворяют в AcOEt (100мл). Полученный раствор промывают 1N раствором NaOH, водным раствором NH4CI и рассолом, высушивают над MgSO4 . Удаляя растворители, получают сырой Соединения в соответствии с Примером 49 продукт, который очищают на силикагелевой косинтезируют, как показано на вышеприведенной лонке, элюируя с помощью NH4OH (1N)-МеОНСхеме 15. СН2СI2 (2,5:15:82,5) для получения 4-((α-4Т. пиперидинил)бензил)-Ν,Ν-диэтил-бензамида I. Получение 4-бензоил-N-трет(245мг, 70%). Т.пл. 160-162°C (СН2СI2); Vмакс (KBr) бутоксилкарбонил-пиперидина (соединение 86) см -1 3325, 2937, 1613, 1461, 1283, 1095; dн (400 Смесь 4-бензоилпиперидин гидрохлорида MH z, CDCІ3) 1.05(brs,3H), 1.07(m,2H) 1.19 (brs, 3Н), (6,77г, 30,0 ммол.), ди-трет-бутилдикарбоната 1.53 (m, 2H), 2.04 (brs, NΗ), 2.20(m,1H), 2.55(t, (7,2г, 33,0ммол.) и КНСО3 (6,0г, 60ммол.) в Н2ОJ=11.6 Hz, 2Н), 3.01(m,2H), 3.23 (brs,2H), 3.51(d, тетрагидрофуране (50/20мл) кипятят с обратным J=10.4 Hz, 1H), 3.52 (brs, 2H), 7.15(m, 1H), 7.27 холодильником в течение 1 часа. Реакционную (m,8H); смесь экстрагируют этилацетатом (2´100мл). Об 45 71538 46 dc-13 (100 MHz, CDI3) 12.8, 14.1, 32.2, 39.0, 39.9, 43.1, 46,5, 59.0, 126.1, 126.5, 127.9, 128.0, 128.3, 134.8, 143.0, 144.7, 171.0. Пример 50. Получение N,N-диэтил-4-(3-метоксибензил-1пиперазинил)-бензамида Используют такую же процедуру, как и для N,N-диэтил-4-[(2,5,5-триметил-1-пиперазинил)-3метоксибензил]бензамида. N,N-Диэтил-4-(хлоро-3метоксибензил)-бензамид (1,6г, 4,8ммол.) подвергают реакции с пиперазином (1,6г, 19ммол.) в ацетонитриле (20мл) в течение 4 часов при 80°С для получения в целом 1,1г продукта (63%), который превращают в соль дигидрохлорида. Т.пл. 165-182°С. ИК (амин, CDCI3 в клетке KBr) (см -1): 3688, 1611, 1458, 1436, 1285. MS (свободный амин): 381, 336, 296, 224, 196, 165, 152, 112. 1 Н NMR: (амин, CDCI3): δ =1.05, 1.15(2br s,6H, 2Me), 2.51, 3.02(2br.s,8H, пиперазин-Н), 3.2, Соединения Примеров 52-55 синтезируют, как 3.45(2br.s,4H MeCH2), 3.72, 3.73(2s,3H, MeO), показано на вышеприведенной Схеме 16. 4.21(s,1H, CHAr2), 4.5(br.s,1H, NH), 6.60-7.40 (m, U. 8H, Ar-H). Соединение I: 4-(α-гидроксибензил)C23H31N3 O2×2HCl×0.80H2O требует: С, 58.92; Η, нитробензол 7.44; Ν, 8.96; 4-Нитробензоин (4,55г, 20,1ммол.) растворяют Найдено: С, 58.98; Η, 7.76; Ν, 8.86. в 70мл безводного метанола, охлажденного до Пример 51. 0°С в ледяной бане, затем под током N 2 добавляПолучение N,N-диэтил-4-[(4-аллил-1ют NaBH 4 (0,915г, 24,2ммол.), смесь перемешивапиперазинил)-3-метоксибензил]бензамида ют при комнатной температуре в течение ночи, Используют такую же процедуру, как и для гасят с помощью насыщенного водного раствора N,N-диэтил-4-[(4-аллил-2,5,5-триметил-1NH4CI, выпаривают МеОН и добавляют EtOAc. пиперазинил)-3-метоксибензил]бензамида. Смесь промывают водой, органический слой выИз N,N-диэтил-4-(3-метоксибензил-1сушивают над MgSO 4 и концентрируют, получая пиперазинил)бензамида (0,16г, 0,42ммол.) полутвердое вещество в виде целевого продукта чают 30мг продукта (20%), который превращают в (~4,58г, выход ~100%). соль дигидрохлорида. 1 Н ЯМР (СDСІ3, TMS): δ (ppm): 2.40 (s br, 1H, Т.пл. 151-176°С. ИК (амин, CDCІ3 в клетке KBr -1 OH); 5.92 (d, J= 3.2 Hz, 1H, Ar-CH-OH), 7.30(см ): 3688, 1611, 1457, 1435, 1288. MS (свобод7.40(m,5H, Ar); 7.58(d, J=8.6, 2H, Ar-NO2); 8.18 (d, ный амин): 421, 125. 1H ЯМР: (амин, CDCІ3): δ=1.1 J=8.6 Hz, 2H, Ar-NO 2). (2br. s, 6Н, 2Me), 2.3-2.6 (br. s, 8H, пиперазин-Н), Соединение II: 4-(α-хлорбензил)-нитробензол 3.00(m,2H, аллил-Н), 3.2-3.5(2br.s, 4H, MeCH2), Соединение І (4,58г, 20ммол.) растворяют в 3.78 (s,3H, MeO), 4.20 (s,1H, CHAr2,), 5.14(m,2H, безводном СН 2СІ2, затем к смеси под током N 2 аллил-Н), 5.85(m,1H, аллил-Н), 6.70-7.46 (m,8H, добавляют тионилхлорид (4,68г, 39,4ммол.), реакAr-H). ционную смесь подвергают кипячению с обратным С26Н35N3 О2×2НСІ×1.4Н2О требует: С, 60.09; Η, холодильником в течение 5 часов и охлаждают до 7.72; Ν, 8.08; комнатной температуры, растворитель и избыточНайдено: С, 60.12; Η, 7.59; Ν, 7.88. ный тионилхлорид выпаривают в вакууме, получая твердое желтоватое вещество в виде целевого продукта (выход ~100%). 1 Н ЯМР (CDCI3 TMS): δ (ppm): 6.16(s,1H, -CHCI); 7.30-7.40 (m,5H, Ar); 7.59(d, J=8.6 Hz, 2H, ArNO2); 8.20 (d, J=8.6 H z, 2H, Ar-NO2). Соединение III: 4-[(N-бензил-1-пиперазинил)бензил]-нитробензол К соединению II (1,0г, 4,1ммол.) и Nбензилпиперазину (1,45г, 8,2ммол.), растворенному в безводном ацетонитриле, добавляют каталитическое количество карбоната калия, и реакционную смесь кипятят с обратным холодильником в течение ночи. После охлаждения до комнатной температуры, смесь промывают рассолом, органический слой концентрируют в вакууме, получая масло, которое затем очищают с помощью MPLC, используя СН 2СI2/МеOН/МН 4OН = 95/5/1 в качестве растворителя для элюирования для получения 47 71538 48 чистого целевого продукта (1,2г, вы ход 76%). смеси добавляют 10мл EtOAc, промывают насы1 Н ЯМР (CDCІ3, TMS): δ:2.41-2.48 (8Н, br, пищенным водным раствором NH4CI и рассолом, перазиновое кольцо), 3.51(2H,s, Ph-CH 2), органический слой высушивают над MgSO4 , кон4.34(1H,s, Ar-CH-Ar), 7.20-8.12 (14Н, Ar)ppm. центрируют и очищают с помощью МРLС, исполь13 C ЯМР (СОСІ3, TMS): δ:51.7, 53.1, 62.9, 75.5, зуя СН2СI2/МеОН = 99/1~95/5 в качестве раство123.8, 127.0, 128.1, 128.5, 128.7, 129.2, 137.9, рителя для получения чистого продукта в виде 140.9, 146.8, 150.6 ppm. твердого белого вещества (~90мг, вы ход ~70%). Пример 52. Температура плавления: 195~200°С (разл.) 1 Получение 4-[(N-бензил-1Н ЯМР: (CDCI3, TMS) δ: 2,3-2,48 (8Н, br, пипепиперазинил)бензил]анилина (соединение 91) разиновое кольцо), 2.96 (3Н, s, CH 3SO2), 3.51 К соединению III (900мг, 2,33ммол.), раство(2H,s, Ph-CH2), 4.21 (1Η, s, Ar-CH-Ar), 6.25(1H, br, ренному в 10мл МеОН, добавляют Ra-Ni (150мг) и S-NH-), 7.10-7.41(14H, m, Ar) ppm. 13 температуру повышают до 35°С. Затем медленно, C ЯМР: (CDCI3) δ: 142.4, 140.2, 137.9, 135.3, с помощью шприца, при перемешивании добав129.2, 129.1, 128.5, 128.1, 127.9, 127.0, 121.0, 75.5, ляют гидразин (380мг, 11,63ммол.), температуру 63.0, 53.2, 51.8, 39.3 ppm. смеси повышают до 70°С, пока не прекратится Элементарный анализ для: С25Н29N3О 2S×0, выделение газа. Реакционную смесь охлаждают 9Н2О: до комнатной температуры, фильтруют над целиПодсчитано: С, 66,46; Н, 6.87; N, 9,30; том и концентрируют, получая масло, которое Найдено: С, 66,53; Н, 6,61; N, 9,23. очищают с помощью MPLС, используя Пример 55. СН2СІ2/МеОН = 99/1-99/5 в качестве растворителя Получение метил-N-4-[(N-бензил-1для элюирования для получения твердого желтопиперазинил)бензил]-2-метилацетата ватого вещества в виде целевого продукта (660мг, 4-[(N-бензил-1-пиперазинил)бензил]анилин выход ~80%). (соединение 91) (100мг, 0,28ммол.), литий гидрид (2,5мг, 0,3ммол.) и 1-бромметилацетат (44,16мг, Элементарный анализ для: С24Н27N3×0.2H2O 0,28ммол.) смешивают в безводном тетрагидроПодсчитано: С, 79.64; Н, 7.43; Ν, 11.55; фуране, реакционную смесь подвергают кипячеНайдено: С, 7 9.83; Н, 7.65; Ν, 11.64. нию с обратным холодильником в течение 2 часов ИК (NaCl пленка): n= 2807, 1620, 1513, 1451, и охлаждают до комнатной температуры, затем 1282, 1137 см-1. 1Н ЯМР (CDCІ3, TMS): δ:2.3гасят каплями воды, дважды промывают рассо2.48(8Н,br пиперазиновое кольцо), 3.45(2H,s br, лом, высушивают над безводным MgSO4 и концеNH2), 3.48(2H,s, Ph-CH2), 4.10(1H,s, Ar-CH-Ar), нтрируют до масла, очищают с помощью МРLС, 6.51(2H,m, Аr), 7.11-7.37(12H,m, Аr) ppm. используя СН2СI2/МеOН -98/2 в качестве раствоПример 53. рителя, получая продукт в виде масла (~23мг, Получение 4-[(N-бензил-120%). пиперазинил)бензил]-ацетанилида (соединение ИК (пленка NaCl); соль НСI 92) 4-[(N-Бензил-1-пиперазин)бензил]анилин (соn- 3404 (br), 2922 (br), 1745, 1610, 1517, 1439, единение 91) (50мг, 0,14ммол.) и безводный пири1207 cm-1 1Н ЯМР: (CDCI3) δ: 2.40(8H,br, пиперазидин (избыток) растворяют в безводном дихлорменовое кольцо), 3.50 (2H,s, Ph-CH2), 3.75 (3H,s, -Oтане, а затем добавляют уксусный ангидрид (4 CH3), 3.85(2Η, d, J=5.2 Hz, N-CH2), 4.12 (1H,s, Arэкв.). Реакционную смесь перемешивают при комCH-Ar), 4.18 (1H,t, J=5.2 Hz, Ar-NH-CH2), 6.49(2Η, d, натной температуре в течение 30 минут и гасят J=8.4 Hz, -N-Ar), 7.14-7.38(12H,m, Ar) ppm. Н2О, затем промывают насыщенным водным расАнал. для: С27Н31N3 О2×3НСІ: твором NaHCO3 и рассолом. Органический слой Подсчитано: С, 60.17; Η, 6.36; Ν, 7.80; высушивают над безводным MgSО4, фильтр уют и Найдено: С, 59.97; Η, 6.61; Ν, 7.46. концентрируют, получая продукт в виде масла Соединение IV: 4-(3-фторо-a(44мг, выход 80%). гидроксибензил)ацетонитрил 1 Н ЯМР: (CDCІ3, TMS) δ: 2.1(3H,s, -СН3), 2.31-Фторо-3-иодобензол (7,53г, 33,9ммол.) раст2.48 (8Н, br, пиперазиновое кольцо), 3.48 (2Н, s, воряют в безводном тетрагидрофуране и охлажPh-CH 2), 4.16(1H,s, Ar-CH-Ar), 7.20-8.12(14H, Ar) дают до ~78°С. К реакционной смеси с помощью ppm. шприца медленно добавляют н-бутиллитий (2,5М Элементарный анализ для: в тетрагидрофуране, 33,9ммол.). Смесь перемеC26H29N3 O×2,1НСІ×0,3Н2О: шивают в течение 10 минут, а затем к ней добавПодсчитано: С, 64,83; Н, 6,64; N, 8,40; ляют раствор 4-ацет-амидобензальдегида (1,84г, Найдено: С, 64,86; И, 6,64; N ,8,73. 11,3ммол.) в 5мл сухого DME. Перед гашением Пример 54. водным раствором NH4CІ реакционную смесь пеПолучение 4-[N-бензил-1-пиперазинил)бензил] ремешивают при -78°С в течение 30 минут. Оргаметансульфонамида нический слой промывают рассолом и высушива4-[(Ν-бензил-1-пиперазинил)бензил]анилин ют над безводным MgSO4 фильтруют и (соединение 91) (100мг, 0,28ммол.) и пиридин (изконцентрируют до масла, очищают с помощью быток) растворяют в безводном дихлорметане MPLC, используя 10% гептан в СН2СІ2 и 100% (5мл), а затем добавляют метансульфоновый анСН2СІ2 для получения чистого продукта (1,65г, гидрид (97,55мг, 0,56ммол.). Реакционную смесь выход 56%). 1 перемешивают при комнатной температуре з теН ЯМР: (CDCІ3) δ: 2.14(3H,s, ОССН 3), чение 20 минут, подвергают тонкослойной хрома2.55(1Н,s.br, ОН), 5.76 (1H,d, J=3.2 Hz, Ar-CH-Ar), тографии, а затем гасят, добавляя каплю воды. К 7.35(1H,s, CONH), 6.90~7.50(8H, m, Ar) ppm. 49 71538 50 пературой плавления, масло какао и т.п. Соединение v: 4-(3-фторо-aФармацевтически приемлемые соли включают хлорбензил)ацетонитрил Это соединение получают, используя способ, ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, кальций ацетат, камсилат, описанный для получения соединения (II), но искарбонат, хлорид, цетрат, дигидрохлорид, эдетат, пользуя соединение (IV). Его используют на слеэдизилат, эстолат, эзилат, фумарат, глюкаптат, дующей стадии реакции без очистки. 1 глюконат, глютамат, гликоллиларсанилат, гексилН ЯМР: (CDCІ3) δ: 2.15(3H,s, OCCH 3), 6.10(1H,s, Ar-CH-Ar), 7.84(1H,s, CONH), резорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, йодид, изетионат, лактат, 6.90~7.6(8H,m, Ar), 7.84(1H,s,CONH) ppm. лактобионат, малат, малеат, манделат, мезилат, Пример 56. метилбромид, метилнитрат, метилсульфат, м укат, Получение 4-[(N-бензил-1-пиперазинил)-3напсилат, нитрат, памоат (эмбонат), пантотенат, фторбензил]-ацетанилид (соединение 95) фосфа т/ди фосфат, полигалактуронат, салицилат, Это соединение получают, используя способ, стеарат, субацетат, сукцинат, гуль фат, таннат, описанньм для получения соединения (III), но истартрат, теоклат, триэтиодид, бензатин, хлорпользуя соединение (V). 1 прокаин, холин, диэтаноламин, этилендиамин, Н ЯМР: (CDCІ3) δ: 2.14(3H,s, ОССН3), 2.40(8Н, меглюмин, прокаин, алюминий, кальций, литий, br, пиперазин), 3.51 (2H,s, Ph-CH2), 4.19(1H, s, Arмагний, калий, натрий и цинк. CH-Ar), 6.80~7.4C (13H,m, Ar) ppm. Предпочтительными фармацевтически приАнал. для: C26H28 FN3О×2HCI×1.6CH2CІ2×2Η2Ο емлемыми солями являются гидрохлориды и цитПодсчитано: С, 56.24; Η, 6.02; Ν, 7.13. раты. Найдено: С, 56.29; Η, 6.10; Ν, 6.88. Термин "композиция" означает смесь активноФармацевтические композиции го компонента с инкапсулирующим материалом в Новые соединение в соответствии с данным качестве носителя, обеспечивая капсулу, в котоизобретением могут быть введены перорально, рой активный компонент (вместе с другими носивнутримышечно, подкожно, внутрибрюшинно, внутелями или без них) окружен носителем, находятриторакально, внутривенно, подоболочечно и щимся, таким образом, в ассоциации с ним. интрацеребровентрикулярно. Данный термин также подразумевает крахмальДозировка зависит от способа введения, тяные облатки. жести заболевания, возраста и веса пациента и Таблетки, порошки, крахмальные облатки и други х факторов, обычно учитываемых лечащим капсулы могут быть использованы как твердые врачом при определении индивидуальной схемы лекарственные формы, подходящие для перораприема и дозировки лекарственного средства, льного введения. наиболее подходящих для конкретного пациента. Композиции, имеющие жидкую форму, вклюИнертные, фармацевтически приемлемые ночают растворы, суспензии и эмульсии. В качестве сители, используемые для получения фармацевПример а жидких препаратов, подходящих для тических композиций из соединений по данному парентерального введения, могут быть упомянуты изобретению, могут быть твердыми или жидкими. стерильная вода или водно-пропиленовые гликоПрепараты, имеющие твердую лекарственную левые растворы активных соединений. Жидкие форму, включают порошки, таблетки, диспергирукомпозиции также могут входить в виде раствора емые гранулы, капсулы, крахмальные облатки и в водный раствор полиэтиленгликоля. суппозитории. Водные растворы для перорального введения Твердый носитель может включать одно или могут быть получены путем растворения активнонесколько веществ, которые также могут действоге компонента з воде и, при желании, добавления вать как разбавители, корригенты, растворители, подходящих красителей, корригентов, стабилизазамасливатели, суспендирующие aгeнты, связуюторов и загустителей. Водные суспензии для перщие или агенты, расщепляющие таблетки; он такорального использования могут быть получены же может включать инкапсулирующий матариал. путем диспергирования тонкоизмельченного актиВ порошках носитель представляет собой тонвного компонента в воде вместе с вязким материкоизмельченное твердое вещество в смеси с тоналом, таким как натуральные синтетические смокоизмельченным активным компонентом. В таблелы, полимеры, метилцеллюлоза, натрий тках активный компонент смешивают с носителем, карбоксиметилцеллюлоза и другие суспендируюобладающим необходимыми связывающими щие агенты, известные в фармацевтической техсвойствами в соответствующей пропорции, и пренологии приготовления лекарственных средств. ссуют таблетки желаемой формы и размера. Фармацевтические композиции предпочтитеПри получении композиций для суппозиторий льно имеют вид единичных лекарственных форм. воск с низкой температурой плавления, такой как В такой форме композиция разделена на единичсмесь глицеридов жирных кислот и масла какао, ные (разовые) дозы, содержащие соответствуювначале расплавляют и диспергируют в нем актищее количество активного компонента. Единичные вный ингредиент, например путем перемешивадозы составляют упаковку препарата, содержащения. Затем расплавленную гомогенную смесь заго его дискретные количества, например упаковка ливают в формы нужного размера и дают ей таблеток, капсул и порошков во флаконах или возможность остыть и затвердеть. ампулах. Единичная лекарственная форма может Подходящие носители включают карбонат и также иметь вид капсулы, крахмальной облатки стеарат магния, тальк, лактозу, сахар, пектин, декили просто таблетки, она также может включать стрин, крахмал, трагакант, метилцеллюлозу, насоответствующее количество любых расфасовантрий карбоксиметилцеллюлозу, воск с низкой тем 51 71538 52 ных форм. 12 часов в минифлаконах, содержащих 6-7мл сциБиологическое исследование нтилляционной жидкости. Если анализ проводят в А) Модель in vitro 96-луночном планшете, то фильтрацию осуществКлеточная культура ляют через 96 монофильтров, пропитанных полиЧеловеческие клетки 293S, экспрессирующие этиленимином, промытых 3´1мл промывочного клонированные человеческие рецепторы μ, δ, к, а буфера и высушенных в печи при 55°С в течение также резистентность к неомицину, выращивают в 2 часов. Пластинки фильтра подсчитывают с посуспензии при 37°С и 5% СО2 во встряхиваемых мощью счетчика TopCount (Packard) после добавпробирках, содержащих свободную от кальция ления в каждую лунку 50мкл сцинтилляционной модифицированную по способу Дульбекко среду жидкости MS-20. Игла (DMEM), 10% фетальной бычьей сыворотки Анализ данных (FBS), 5% BCS, 0,1% Pluronic F-68 и 600г/мл генеСпецифическое связывание (SB) подсчитытицина. вают как TB-NS, при этом специфическое связыПолучение мембраны вание различных исследуемых пептидов выражаКлетки осаждают центрифугованием и вновь ют как процентную величину от контрольного суспендируют в лизисном буфере (50мм Tris, pH специфического связывания. Величины ІС 50 и ко7,0, 2,5мм этилендиамино-тетрауксусной кислоты, эффициент Хилла (nн) для лигандов при замещепри этом PMSF добавляют непосредственно пении специфически связанного радиолиганда подсред использованием к 0,1мМ из 0,1М смеси в этачитывают на основе logit-диаграмм или подбора ноле), инкубируют на льду в течение 15 минут, а программ по кривым, таким как Ligand, GraphPad затем гомогенизируют политроном в течение Prism, SigmaPlot или ReceptorFit. Величину Кі по30сек. Суспензию центрифугируют при 1000g дсчитывают, используя уравнение Ченга-Прусова. (макс.) в течение 10 минут при 4°С. Верхний слой Среднюю величину IС50, Κi и nн определяют для сохраняют на льду, а гранулы вновь суспендируют лигандов, исследуемых на, по крайней мере, трех и центрифугир уют, как описано ранее. Верхние кривых смещения. слои из обоих спинов объединяют и центрифугиЭксперименты по насыщению рецептора руют при 46000g (макс.) в течение 30 минут. ГраВеличину радиолиганда Кδ определяют путем нулы вновь суспендируют в холодном буфере Tris проведения анализов по связыванию на клеточ(50мм Tris/Cl, pH 7,0) и центрифугир уют. Полученных мембранах с соответствующими радиолиганные гранулы вновь суспендируют в мембранном дами при концентрации, 0,2-5 раз превышающей буфере (50мм Tris, 0,32М сахарозы, рН 7,0). Аликрасчетную величину К δ (до 10 раз, если количествотные доли (1мл) в полипропиленовых пробирках во необходимого радиолиганда является реальзамораживают в сухом льду/этаноле и хранят при ным). Специфическое связывание радиолиганда -70°С до использования. Концентрацию белка опвыражено в виде молярных частей/мг мембранноределяют путем модифицированного анализа го белка. Величину Кδ и Вмакс, в отдельных экспеLowry с использованием додецилсульфата нариментах получают в результате нелинейного трия. подбора специфически связанного (В) против nМ Анализ на связывание. свободного (F) радиолиганда от объекта в соотМембраны оттаивают при 37°С, охлаждают на ветствии с односайтовой моделью. льду, пропускают 3 раза через иглу №25 и разбаB) Биологическая модель (модель in vivo) вляют связующим буфером (50мм Tris, 3мм MgCl2, Мелано-аллодиния у крыс, вызванная полным 1мг/мл бычьего сывороточного альбумина (BSA) адъювантом Фрейнда и манжетой на седалищный (Сигма А-7888), рН 7,4. хранящаяся при 4°С после нерв фильтрации через 0,22м фильтр, к которой непосЖивотные редственно перед испозованием добавляют Используют крыс-самцов Sprague-Dawley 5мкг/мл апротинина, 10мкм бестанина, 10мкм ди(Charles River, St-Constant, Канада) весом 175-200г протина А, не содержащую ди тиотреитола (DTT). к моменту операции. Группами по три особи их Аликвотные доли объемом 100мкл (мкг белка укапомещают в клетки, где с помощью термостата заны в Таблице 1) добавляют в замороженные поддерживается температура 20°С с циклом светполипропиленовые пробирки размером 12x75мм, лое/темное время, составляющим 12:12, и свобосодержащие 100мкл соответствующего радиолидным доступом к еде и воде. После размещения ганда (см. Таблицу 1) и 100мкл исследуемых белживотным дают возможность акклиматизироватьков с различной концентрацией. Общее (ТВ) и ся перед операцией, по крайней мере, в течение 2 неспецифическое (NS) связывание определяют в дней. Эксперименты одобрены соответствующим отсутствии и присутствии 10мкм налоксона, соотКомитетом по медицинской этике по изучению ветственно. Пробирки вращают и инкубируют при животных. 25°С в течение 60-75 минут, после чего их содерПроцедура эксперимента жимое быстро подвергают вакуумной фильтрации Полный адъювант Фрейнда и промывают приблизительно 12мл/пробирку леСначала крыс анестезируют во фторэтановой дяного промывочного буфера (50мм Tris, рН 7,0, камере, после чего им подкожно вводят 10мкл 3мм МgСI2) через фильтры GF/B (Whatman), предполного адъюванта Фрейнда в дорсальный учасварительно замоченные, по крайней мере, в течеток левой ступни между вторым и третьим внешние 2 часов в 0,1% полиэтиленимине. Радиактивними пальцами. Затем животным дают возможность (распадов в минуту), приобретенную ность выйти из анестезии под наблюдением в их фильтрами, измеряют бета-счетчиком после засобственных клетках. мачивания фильтров, по крайней мере, в течение Манжета на седалищный нерв 53 71538 54 Животных готовят в соотве тствии со спосоПри отсутствии реакции отдергивания лапы на бом, описанным Moscoini и Kruger (1996). Крыс первоначально выбранный волос используют боанестезируют интраперитонеально смесью кеталее сильный раздражитель, при отдергивании мина/ксилазина (2мл/кг), кладут на правый бок и лапы используют следующий, более слабый раздделают разрез вдоль оси боковой части левого ражитель. Оптимальный подсчет порога с помобедра. Раздвигают мышцы верхних квадрицепсов щью этого метода требует 6 реакций в непосредси обнажают седалищный нерв, на который надетвенной близости от 50%-ного порога, и подсчет вают пластиковую манжету (трубка РЕ-60, длиной этих 6 реакций начинается при первом изменении 2мм). Затем разрез закрывают двумя слоями виответа, т.е . при первом пересечении порога. В тех крила 3-0 и накладывают шелковые швы. случаях, когда пороги выходят за пределы раздОпределение механо-аллодинии, используя ражителей, берется величина 15,14 (нормальная пробу фон Фрея чувствительность) или 0,41 (максимально аллодиПробу проводят между 8.00 и 16.00 часами, ническая). Результаты позитивных и негативных используя способ, описанный Chaplan et al. (1994). реакций сводят в таблицу, используя следующие Крыс помещают в плексигласовые клетки с провоусловные обозначения: X = о тсутствие отдергивалочным дном, позволяющим касаться лап, и дают ния, 0 = отдергивание, и 50%-ный порог отдергиим возможность привыкнуть в течение 10-15 мивания интерполируют, используя следующую фонут. Пробу проводят в середине подошвы левой рмулу: задней лапы, избегая менее чувствительных по50% г порог = 10(Xf+Кδ)/10000 душечек на подошвах. К лапе подносят набор из 8 где Xf = величина последнего использованного волосков фон Фрея с логарифмически увеличиволоска фон Фрея (log единицы); К = табличная вающейся жесткостью (0,41, 0,69, 1,20, 2,04, 3,63, величина (из Chaplan et aI. (1994)) для схемы по5,50, 8,51 и 15,14г; Stoelting, Иллинойс, США). Воложительных/отрицательных реакций; и δ = средлосок фон Фрея подносят снизу, со стороны проняя разница между раздражителями (log единиволочного дна клетки, перпендикулярно к поверхцы). В данном глучае δ = 0,224. ности стопы с достаточной силой, так чтобы он Пороги фон Фрея переводят в процентную веслегка прогнулся, прикоснувшись к подошве, и личину максимально возможного эффекта (% держат приблизительно 6-8 секунд. Реакция счиМРЕ) в соотве тствии с Chapian et al. (1994). Для тается положительной в том случае, если крыса подсчета % МРЕ используют следующее уравнерезко отдергивает лапу. Вздрагивание сразу же ние: после удаления волоска также считается положиПорог после обработки тельной реакцией. Передвижение считается неяслекарственным средством (г) - порог аллодиной реакцией, и в таких случаях пробу повторяют. нии (г) Протокол тестирования % МРЕ------------------------------------------------´100 Группу крыс, которой был введен полный адПорог контроля (г) - порог аллодинии (г) ъювант Фрейнда, подвергают тестированию на Введение исследуемого вещества первый послеоперационный день, а группу крыс с Перед пробой фон Фрея крысам вводят (поманжетой на седалищном нерве – на седьмой дкожно, внутри-брюшинно или пероральнo) исспослеоперационный день. 50%-ный порог отдерледуемое вещество, при этом время между ввегивания определяют, используя метод Dixon дением исследуемого вещества и пробой Фон (1980) "вверх-вниз". Пробу начинают с волоска Фрея варьируется в зависимости от природы иссвесом 2,04г, находящегося в середине набора. ледуемого вещества. Раздражение всегда осуществляют последовательно, в нарастающем или убывающем порядке. Комп’ютерна в ерстка Л. Купенко Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperazine or piperidine derivatives, a method for the preparation thereof (variants), a pharmaceutical composition and a method for treatment of diseases (variants)
Автори англійськоюPlobeck Niklas
Назва патенту російськоюПроизводные пиперазина или пиперидина, способ их получения (варианты), фармацевтическая композиция и способ лечения заболеваний (варианты)
Автори російськоюПлобек Никлас
МПК / Мітки
МПК: A61K 31/4427, C07D 405/04, A61K 31/00, A61P 25/04, C07D 295/112, A61K 31/443, A61K 31/4465, C07D 307/81, C07D 241/04, A61K 31/4965, A61K 31/495, C07D 405/10, C07D 295/096, A61K 31/496, A61K 31/445, C07D 211/34, C07D 295/185, C07D 215/14, C07D 401/10, C07D 295/135, C07D 295/155, C07D 401/04, C07D 295/205, C07D 295/04
Мітки: спосіб, лікування, одержання, похідні, варіанти, фармацевтична, захворювань, піперазину, піперидину, композиція
Код посилання
<a href="https://ua.patents.su/27-71538-pokhidni-piperazinu-abo-piperidinu-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-ta-sposib-likuvannya-zakhvoryuvan-varianti.html" target="_blank" rel="follow" title="База патентів України">Похідні піперазину або піперидину, спосіб їх одержання (варіанти), фармацевтична композиція та спосіб лікування захворювань (варіанти)</a>
Попередній патент: Спосіб передачі сповіщень у комплексній інтегрованій системі централізованої охорони
Наступний патент: Спосіб для декорування і/або фарбування кахлів або плит з каменеподібних штучних або композитних матеріалів
Випадковий патент: Спосіб підготовки живильної води для екстрагування сахарози із бурякової сировини












