Сполуки на основі лізину
Формула / Реферат
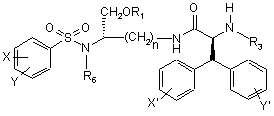
1. Сполука формули І
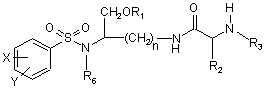 , (I)
, (I)
або її фармацевтично прийнятна сіль,
де n дорівнює 3 або 4,
де Х і Y, однакові або різні, вибрані з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, Сl, Вr, І, -СF3, -ОСF3, -CN, -NO2, -NR4R5, -NHCOR4, -OR4, -SR4, -COOR4, -COR4 і -СН2OН, або Х і Y разом означають алкілендіоксигрупу, вибрану з групи, яка складається з метилендіоксигрупи формули -ОСН2О- і етилендіоксигрупи формули -ОСН2СН2О-,
де R6 вибраний з групи, яка складається з нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, і циклоалкілалкільної групи, яка містить від 3 до 6 атомів вуглецю у своїй циклоалкільній частині і від 1 до 3 атомів вуглецю у своїй алкільній частині,
де R3 вибраний з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, і групи формули R3A-CO-, причому R3A вибраний з групи, яка складається з нерозгалуженої або розгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкілалкільної групи, яка містить від 3 до 6 атомів вуглецю у своїй циклоалкільній частині і від 1 до 3 атомів вуглецю у своїй алкільній частині, алкілоксигрупи, яка містить від 1 до 6 атомів вуглецю, тетрагідро-3-фуранілокси, -СН2ОН, -СF3, -СН2СF3, -СН2СН2СF3, піролідинілу, піперидинілу, 4-морфолінілу, СН3О2С-, СН3О2ССН2-, ацетил-ОСН2СН2-, НО2ССН2- 3-гідроксифенілу, 4-гідроксифенілу, 4-СН3ОС6Н4СН2-, СН3NН-, (СН3)2N-, (CH3CH2)2N-, (СН3СН2СH2)2N-, HOCH2CH2NH-, СН3ОСН2О-, СН3ОСН2CH2О-, С6Н5СН2O-, 2-піролілу, 2-піридилу, 3-піридилу, 4-піридилу, 2-піразинілу, 2-хінолілу, 3-хінолілу, 4-хінолілу, 1-ізохінолілу, 3-ізохінолілу, 2-хіноксалінілу, фенільної групи формули 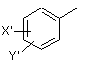 ,
,
піколільної групи, вибраної з групи, яка складається з
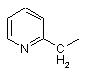 ,
, 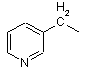 і
і 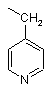 ,
,
піколілоксигрупи, вибраної з групи, яка складається з
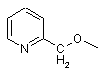 ,
, 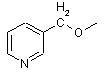 і
і 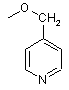 ,
,
заміщеної піридильної групи, вибраної з групи, яка складається з
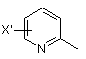 ,
, 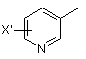 і
і 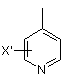 ,
,
і групи формули 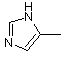 ,
,
де X' і Y', однакові або різні, вибрані з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, Сl, Вr, І, -СF3, -NO2, -NR4R5, -NHCOR4, -OR4, -SR4, -COOR4, -COR4 і -СН2ОН,
де R4 і R5, однакові або різні, вибрані з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, і циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю,
де R2 вибраний з групи, яка складається з дифенілметильної групи формули IV
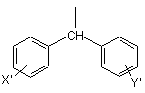 , (IV)
, (IV)
нафтил-1-СН2-групи формули V
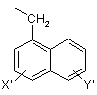 , (V)
, (V)
нафтил-1-СН2-групи формули VI
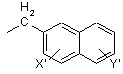 , (VI)
, (VI)
біфенілметильної групи формули VII
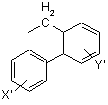 , (VII)
, (VII)
і антрил-9-СН2-групи формули VIII
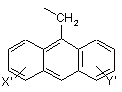 , (VIII)
, (VIII)
і де R1 вибраний з групи, яка складається з (НО)2Р(O), (MО)2Р(O) і групи формули R1A-CO-, де М являє собою лужний метал або лужноземельний метал, де R1А вибраний з групи, яка складається з нерозгалуженої або розгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкілалкільної групи, яка містить від 3 до 6 атомів вуглецю у своїй циклоалкільній частині і від 1 до 3 атомів вуглецю у своїй алкільній частині, алкілоксигрупи, яка містить від 1 до 6 атомів вуглецю, -СН2ОН, СН3О2С-, СН3O2ССН2-, ацетил-ОСН2СН2-, HO2CCH2-, 2-гідроксифенілу, 3-гідроксифенілу, 4-гідроксифенілу, (СН3)2NСН2-, (СH3)2СНСH(NH2)-, HOCH2CH2NH-, СН3ОСН2O-, СН3ОСН2СН2O-, 2-піролілу, 2-піридилу, 3-піридилу, 4-піридилу, 1-метил-1,4-дигідро-3-піридилу, 2-піразинілу, 2-хінолілу, 3-хінолілу, 4-хінолілу, 1-ізохінолілу, 3-ізохінолілу, 2-хіноксалінілу, фенільної групи формули
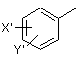 , (III)
, (III)
піколільної групи, вибраної з групи, яка складається з
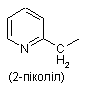 ,
, 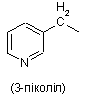 і
і 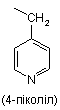 ,
,
піколілоксигрупи, вибраної з групи, яка складається з
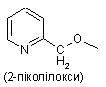 ,
, 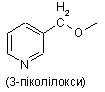 і
і 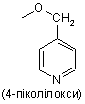 ,
,
заміщеної піридильної групи, вибраної з групи, яка складається з
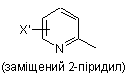 ,
, 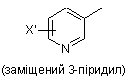 і
і 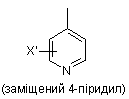 ,
,
і групи формули
 .
.
2. Сполука за п. 1, яка являє собою сполуку формули II
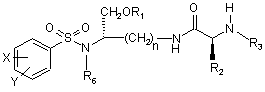 , (II)
, (II)
або її фармацевтично прийнятна сіль.
3. Сполука за п. 2, де R6 являє собою ізобутил і n дорівнює 4.
4. Сполука за п. 3, де R1 являє собою (НО)2Р(О) або (NaO)2P(O).
5. Сполука за п. 4, де R3 вибраний з групи, яка складається з СН3СО, СН3О-СО, (CH3)2N-CO, 3-піридил-СО, 4-піридил-СО і 4-морфолін-СО.
6. Сполука за п. 5, де Х являє собою 4-NH2, a Y являє собою Н або F.
7. Сполука за п. 6, де R2 вибраний з групи, яка складається з дифенілметильної групи формули IV, нафтил-1-СН2-групи формули V і нафтил-2-СН2-групи формули VI.
8. Сполука за п. 2, яка являє собою сполуку формули IIа
 , (IIa)
, (IIa)
або її фармацевтично прийнятна сіль.
9. Сполука за п. 2, де R6 являє собою ізобутил; n дорівнює 4; R1 являє собою (НО)2Р(O) або (NaO)2P(O); R3 вибраний з групи, яка складається з СН3СО, СН3О-СО, (СН3)2N-СО, 3-піридил-СО, 4-піридил-СО і 4-морфолін-СО; Х являє собою 4-NH2, a Y являє собою Н або F.
10. Сполука за п. 1, що вибрана з групи, яка складається з наступних сполук і солей:
 , (I)
, (I)
приклад №
(PL-№)
X
Y
n
R1
R2
R3
R6
X'/Y'
D, L, DL R, S, RS
1 (PL-461)
4-NH2
Н
4
(НО)2Р(O)
(С6Н5)2СН
СН3О-СО
ізобутил
Н/Н
S,S
2 (PL-462)
4-NH2
Н
4
(NaO)2P(O)
(С6Н5)2СН
СН3О-СО
ізобутил
Н/Н
S,S
3 (PL-507)
4-NH2
Н
4
(HO)2P(O)
нафтил-2-СН2
СН3О-СО
ізобутил
Н/Н
S,S
4 (PL-498)
4-NH2
Н
4
(НО)2Р(O)
нафтил-2-СН2
4-морфолін-СО
ізобутил
Н/Н
S,S
5 (PL-504)
4-NH2
Н
4
(НО)2Р(O)
(С6Н5)2СН
СН3СО
ізобутил
Н/Н
S,S
6 (PL-515)
4-NH2
3-F
4
(НО)2Р(O)
(С6Н5)2СН
СН3О-СО
ізобутил
Н/Н
S,S
7 (PL-521)
4-NH2
Н
4
СН3СО
(С6Н5)2СН
СН3О-СО
ізобутил
Н/Н
S,S
8 (PL-520)
4-NH2
Н
4
3-піридил-СО
(С6Н5)2СН
СН3О-СО
ізобутил
Н/Н
S,S
9 (PL-534)
4-NH2
Н
4
(CH3)2NCH2CO
(С6Н5)2СН
СН3О-СО
ізобутил
Н/Н
S,S
10 (PL-530)
4-NH2
Н
4
(CH3)2CHCH(NH2)CO
(С6Н5)2СН
СН3О-СО
ізобутил
Н/Н
S,S
11. Сполука за п. 10, яка являє собою натрієву сіль метилового ефіру (1S,5S)-(1-{5-[(4-амінобензолсульфоніл)ізобутиламіно]-6-фосфоноксигексакарбамоїл}-2,2-дифенілетил)карбамінової кислоти.
12. Сполука за п. 10, яка являє собою метиловий ефір (1S,5S)-(1-{5-[(4-аміно-3-фторбензолсульфоніл)ізобутиламіно]-6-фосфоноксигексакарбамоїл}-2,2-дифенілетил)карбамінової кислоти.
13. Фармацевтична композиція, яка містить щонайменше одну сполуку, визначену у будь-якому з пп. 1-12, або її фармацевтичнo прийнятну сіль, і фармацевтичнo прийнятний носій.
14. Застосування щонайменше однієї сполуки, визначеної у будь-якому з пп. 1-12, або її фармацевтично прийнятної солі, при виготовленні лікарського засобу для лікування або профілактики ВІЛ-інфекції.
15. Спосіб лікування або профілактики ВІЛ-інфекції, при якому вводять щонайменше одну сполуку, визначену у будь-якому з пп. 1-12, або її фармацевтичнo прийнятну сіль ссавцеві, який потребує цього.
Текст
1. Сполука формули І O H CH2OR1 O O N (CH2 ) N S R3 n H N X R2 R6 Y , (I) 2 (19) 1 C2 (54) СПОЛУКИ НА ОСНОВІ ЛІЗИНУ 3 86086 фуранілокси, -СН2ОН, -СF3, -СН2СF3, -СН2СН2СF3, піролідинілу, піперидинілу, 4-морфолінілу, СН3О2С-, СН3О2ССН2-, ацетил-ОСН2СН2-, НО2ССН2- 3-гідроксифенілу, 4-гідроксифенілу, 4СН3ОС6Н4СН2-, СН3NН-, (СН3 )2N-, (CH3CH2)2N-, (СН3СН2СH2)2N-, HOCH2CH2NH-, СН3ОСН2О-, СН3ОСН2CH2О-, С6Н5СН2O-, 2-піролілу, 2піридилу, 3-піридилу, 4-піридилу, 2-піразинілу, 2хінолілу, 3-хінолілу, 4-хінолілу, 1-ізохінолілу, 3ізохінолілу, 2-хіноксалінілу, фенільної групи фор 4 CH X' Y' , (IV) нафтил-1-СН2-групи формули V CH2 X' мули Y' , піколільної групи, вибраної з групи, яка складається з CH2 H2 C N C H2 N N , і , піколілоксигрупи, вибраної з групи, яка складається з H2 C O O N C H2 N , і O X' Y' , (V) нафтил-1-СН2-групи формули VI H2 C X' Y' , (VI) біфенілметильної групи формули VII H2 C Y' X' , (VII) і антрил-9-СН2-групи формули VIII CH2 CH2 N , заміщеної піридильної групи, вибраної з групи, яка складається з X' X' X' N N , і N , H N N і групи формули , де X' і Y', однакові або різні, вибрані з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, Сl, Вr, І, -СF3, -NO2, -NR4R5, NHCOR4, -OR4, -SR4, -COOR4, -COR4 і -СН2ОН, де R4 і R5, однакові або різні, вибрані з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, і циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, де R2 вибраний з групи, яка складається з дифенілметильної групи формули IV Y' X' , (VIII) і де R1 вибраний з групи, яка складається з (НО)2Р(O), (MО)2Р(O) і групи формули R1A-CO-, де М являє собою лужний метал або лужноземельний метал, де R1А вибраний з групи, яка складається з нерозгалуженої або розгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкілалкільної групи, яка містить від 3 до 6 атомів вуглецю у своїй циклоалкільній частині і від 1 до 3 атомів вуглецю у своїй алкільній частині, алкілоксигрупи, яка містить від 1 до 6 атомів вуглецю, -СН2ОН, СН3О2С-, СН3O2ССН2-, ацетил-ОСН2СН2-, HO2CCH2-, 2-гідроксифенілу, 3гідроксифенілу, 4-гідроксифенілу, (СН3)2NСН2 -, (СH3)2СНСH(NH2)-, HOCH2CH2NH-, СН3ОСН2O-, СН3ОСН2СН2O-, 2-піролілу, 2-піридилу, 3-піридилу, 4-піридилу, 1-метил-1,4-дигідро-3-піридилу, 2піразинілу, 2-хінолілу, 3-хінолілу, 4-хінолілу, 1ізохінолілу, 3-ізохінолілу, 2-хіноксалінілу, фенільної групи формули X' Y' , (III) піколільної групи, вибраної з групи, яка складається з 5 86086 6 O S X N C H2 (2-піколіл) N N N (4-піколілокси) , заміщеної піридильної групи, вибраної з групи, яка складається з X' N (заміщений 2-піридил) (CH2) n N , H N N H R3 R2 R6 , (II) або її фармацевтично прийнятна сіль. 3. Сполука за п. 2, де R6 являє собою ізобутил і n дорівнює 4. 4. Сполука за п. 3, де R1 являє собою (НО)2Р(О) або (NaO)2P(O). 5. Сполука за п. 4, де R3 вибраний з групи, яка складається з СН3СО, СН3О-СО, (CH3)2N-CO, 3піридил-СО, 4-піридил-СО і 4-морфолін-СО. 6. Сполука за п. 5, де Х являє собою 4-NH2, a Y являє собою Н або F. 7. Сполука за п. 6, де R2 вибраний з групи, яка складається з дифенілметильної групи формули IV, нафтил-1-СН2-групи формули V і нафтил-2СН2-групи формули VI. 8. Сполука за п. 2, яка являє собою сполуку формули IIа O H CH 2OR 1 O O N (CH 2) N S R3 n H N X R6 Y N (заміщений 3-піридил) X' і X' N (заміщений 4-піридил) O Y (3-піколіл) (4-піколіл) , і , піколілоксигрупи, вибраної з групи, яка складається з H2 C O O N C N H2 (2-піколілокси) (3-піколілокси) , і O CH2 X' O CH2OR1 CH2 H2 C , і групи формули H N (IIa) або її фармацевтично прийнятна сіль. 9. Сполука за п. 2, де R6 являє собою ізобутил; n дорівнює 4; R1 являє собою (НО)2Р(O) або (NaO)2P(O); R3 вибраний з групи, яка складається з СН3СО, СН3О-СО, (СН3)2N-СО, 3-піридил-СО, 4піридил-СО і 4-морфолін-СО; Х являє собою 4NH2, a Y являє собою Н або F. 10. Сполука за п. 1, що вибрана з групи, яка складається з наступних сполук і солей: O CH2OR1 O N . 2. Сполука за п. 1, яка являє собою сполуку формули II Y' , S X O N (CH2 ) n N N H R3 R2 R6 Y H , (I) приклад № (PL-№) X Y n R1 R2 R3 R6 X'/Y' D, L, DL R, S, RS 1 (PL-461) 2 (PL-462) 3 (PL-507) 4-NH2 4-NH2 4-NH2 Н Н Н 4 4 4 (НО)2Р(O) (NaO)2P(O) (HO)2P(O) СН3О-СО СН3О-СО СН3О-СО ізобутил ізобутил ізобутил Н/Н Н/Н Н/Н S,S S,S S,S 4 (PL-498) 4-NH2 Н 4 (НО)2Р(O) (С6Н5)2СН (С6Н5)2СН нафтил-2СН2 нафтил-2СН2 ізобутил Н/Н S,S 5 (PL-504) 6 (PL-515) 7 (PL-521) 8 (PL-520) 4-NH2 4-NH2 4-NH2 4-NH2 Н 3-F Н Н 4 4 4 4 (НО)2Р(O) (НО)2Р(O) СН3СО 3-піридил-СО 4морфолінСО СН3СО СН3О-СО СН3О-СО СН3О-СО ізобутил ізобутил ізобутил ізобутил Н/Н Н/Н Н/Н Н/Н S,S S,S S,S S,S (С6Н5)2СН (С6Н5)2СН (С6Н5)2СН (С6Н5)2СН 7 9 (PL-534) 10 (PL-530) 4-NH2 4-NH2 86086 Н Н 4 4 (CH3)2NCH2CO (С6Н5)2СН (CH3)2CHCH(NH2 (С6Н5)2СН )CO 8 СН3О-СО СН3О-СО ізобутил ізобутил Н/Н Н/Н S,S S,S 11. Сполука за п. 10, яка являє собою натрієву сіль метилового ефіру (1S,5S)-(1-{5-[(4амінобензолсульфоніл)ізобутиламіно]-6фосфоноксигексакарбамоїл}-2,2дифенілетил)карбамінової кислоти. 12. Сполука за п. 10, яка являє собою метиловий ефір (1S,5S)-(1-{5-[(4-аміно-3фторбензолсульфоніл)ізобутиламіно]-6фосфоноксигексакарбамоїл}-2,2дифенілетил)карбамінової кислоти. 13. Фармацевтична композиція, яка містить щонайменше одну сполуку, визначену у будь-якому з пп. 1-12, або її фармацевтичнo прийнятну сіль, і фармацевтичнo прийнятний носій. 14. Застосування щонайменше однієї сполуки, визначеної у будь-якому з пп. 1-12, або її фармацевтично прийнятної солі, при виготовленні лікарського засобу для лікування або профілактики ВІЛінфекції. 15. Спосіб лікування або профілактики ВІЛінфекції, при якому вводять щонайменше одну сполуку, визначену у будь-якому з пп. 1-12, або її фармацевтичнo прийнятну сіль ссавцеві, який потребує цього. Даний винахід стосується сполук на основі лізину, які демонструють хорошу розчинність і біологічну доступність. Більш конкретно, даний винахід стосується сполук на основі лізину, які містять фізіологічно відщеплювану ланку, за допомогою чого при відщіпленні даної ланки сполука здатна вивільняти інгібітор протеази ВІЛ. Сполуки і фармацевтичні композиції за даним винаходом особливо добре підходять для зниження лікарського навантаження і поліпшення дотримання хворим режиму і схеми лікування. Інгібітори вірусної протеази ВІЛ були розроблені відносно нещодавно і їх використання почалося тільки у 1996 році. У наш час вони розглядаються як найбільш ефективні лікарські препарати проти ВІЛ інфекції. На жаль, більшість наявних у наш час інгібіторів протеаз являють собою відносно великі гідрофобні молекули, які мають досить низьку біологічну доступність. Тому для досягнення терапевтичної дози у пацієнта потрібне високе лікарське навантаження. Це є стримуючим фактором, який занадто часто приводить до недотримання хворим режиму і схеми лікування і до недостатніх результатів лікування. Дана ситуація веде до субоптимальної терапевтичної концентрації лікарського препарату, що у свою чергу веде до розвитку стійких штамів ВІЛ. Отже, існує невідкладна потреба поліпшення розчинності і біологічної доступності інгібіторів протеази. Приклади поліпшених сполук були розроблені у формі проліків інгібіторів аспартил-протеази, таких як сполуки, описані, наприклад, у патенті США №6436989 Hale et al., повний зміст якого включено в опис у вигляді посилання. Даний патент показує новий клас молекул, що характеризуються придатною розчинністю у воді, високою пероральною біологічною доступністю і легким генеруванням in vivo активного інгредієнта. Однак добре відомо, що ВІЛ має здатність розвивати стійкість до наявних у наш час лікарських препаратів. Таким чином, існує необхідність в альтернативних інгібіторах ВІЛ протеази, активних стосовно диких типів вірусних штамів і стійких вірусних штамів. Так, для боротьби зі стійкими вірусними штамами бажаними є молекули, одержані з наявних у наш час інгібіторів ВІЛ протеази, що показують поліпшену розчинність і біологічну доступність. Унікальний клас ароматичних похідних, які є інгібіторами аспартил-протеаз, описаний у патенті США №6632816 Stranix et al., повний зміст якого включений шляхом посилання. Більш конкретно, даний патент включає похідні L-лізину, заміщені Ν,-синтетичною амінокислотою, які володіють ефективними інгібуючими властивостями стосовно аспартил-протеази. Однак було б вигідно поліпшити дані похідні, збільшуючи розчинність у воді і біологічну доступність, щоб знизити лікарське навантаження і підтримувати дотримання хворим режиму і схеми лікування. Оскільки є багатообіцяючим створення активних інгібіторів протеази, особливо до диких типів штамів і стійких штамів, то утворення похідних оригінальних інгібіторів ВІЛ протеази, таких як інгібітори, описані у патенті США №6632816 Stranix et al., які, як відомо, є активними стосовно стійких штамів, являє собою життєздатний шлях зі значними перевагами. Більш конкретно, при розробці ефективного лікарського препарату є бажаним одержання сполук з поліпшеними розчинністю у воді, біологічною доступністю, тривалістю дії і властивостями рецептури разом з іншими перевагами. Даний винахід пропонує нові сполуки на основі лізину, джерелом яких є клас похідних, що є ефективними інгібіторами аспартил-протеази, і їх фармацевтично прийнятні похідні. Дані сполуки можуть легко розщеплюватися in vivo, вивільняючи активний інгредієнт. Активний інгредієнт має спорідненість з аспартил-протеазами, зокрема з аспартил-протеазою ВІЛ-1 [патент США №6632816]. Активні інгредієнти також демонструють ефективну антивірусну активність при тестуванні на немутантному вірусному штамі ВІЛ-1 (NL4.3 як дикий тип вірусу), а також декількох мутантних штамах. Тому, сполуки за даним винаходом можуть бути застосовані як засіб для збільшення розчинності і поліпшення біологічної доступності активного інгредієнта (інгібітору протеази). Сполуки за даним 9 винаходом можна використовувати окремо або у комбінації з іншими терапевтичними або профілактичними засобами для лікування або профілактики ВІЛ інфекції. Сполуки за даним винаходом мають хорошу розчинність і біологічну доступність і можуть вводитися перорально у вигляді водного розчину. Основна мета даного винаходу полягає у пропонуванні поліпшеного клас}' сполук на основі лізину, які здатні вивільняти інгібітор аспартилпротеази і. особливо, інгібітори ВІЛ аспартилпротеази. Сполуки на основі лізину за даним винаходом можуть містити відщеплювану ланку, за допомогою чого при відщіпленні даної ланки сполука здатна вивільняти інгібітор ВІЛ протеази. Даний винахід також пропонує фармацевтичні композиції, що включають описані тут сполуки на основі лізину. Отже, даний винахід в одному аспекті пропонує сполуки на основі лізину, які при in vivo фізіологічних умовах (наприклад, метаболічних, кишкових, шлунково-кишкових і т. д.) дозволяють вивільнятися інгібітору протеази (наприклад, інгібітору аспартил-протеази). Сполуки за даним винаходом можуть служити як засіб для поліпшення розчинності і/або біологічної доступності інгібіторів протеази і, тому, можуть знижувати лікарське навантаження і можуть сприяти дотриманню хворим режиму і схеми лікування. Сполуки за даним винаходом можуть містити, наприклад, (наприклад, фізіологічно) розщеплюваний (наприклад такий, що гідролізується) зв'язок або ланку, які при відщіпленні розщеплюваного зв'язку або ланки дають інгібітор протеази (наприклад, активний інгібітор протеази). Інгібітор протеази може діяти на аспартилпротеазу ВІЛ-1, включаючи мутантні або немутантні вірусні штами ВІЛ-1 (наприклад, NL4.3), або на протеазу ВІЛ-2 (мутантного або немутантного) або навіть на протеазу споріднених вірусів (SIV і т. д.). Сполуки за даним винаходом можна використовувати окремо або у комбінації з іншими терапевтичними або профілактичними засобами для лікування або профілактики, наприклад, ВІЛ інфекції. Сполуки і фармацевтичні композиції за даним винаходом можуть вивільняти інгібітор протеази (активний інгредієнт) in vivo і, за допомогою цього, можуть придушувати (наприклад, in vivo) активність ВІЛ аспартил-протеази, ферменту, істотного для розвитку та інфективності вірусу. Сполуки і фармацевтичні композиції за даним винаходом можуть мати більш високу біологічну доступність, а також можуть підходити для зниження необхідних для придушення дозувань і, отже, можуть поліпшувати лікування ВІЛ-інфікованих пацієнтів. Даний винахід відповідно до свого одного аспекту пропонує сполуку (наприклад, сполуку, здатну генерувати інгібітор ВІЛ протеази) формули І: 86086 10 і її фармацевтично прийнятні солі і похідні (наприклад, коли сполука за даним винаходом включає аміногрупу, фармацевтично прийнятна сіль може являти собою сіль амонію), де n може дорівнювати, наприклад, 3 або 4, де X і Υ, однакові або різні, можуть бути вибрані, наприклад, з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, СІ, Br, I, -CF3, -OCF3, -CN, -NO2, -NR4R5, NHCOR4, -OR4, -SR4, -COOR4, -COR4 і -СН2ОН, або X і Υ разом визначають алкілендіоксигрупу, вибрану з групи, яка складається з метилендіоксигрупи формули -ОСН2О- і етилендіоксигрупи формули ОСН2СН2О-, де R6 може бути вибраний, наприклад, з групи, яка складається з нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкілалкільної групи, яка містить від 3 до 6 атомів вуглецю у своїй циклоалкільній частині і від 1 до 3 атомів вуглецю у своїй алкільній частині, де R3 може бути вибраний, наприклад, з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, і групи формули R3AСО-, де R3A може бути вибраний, наприклад, з групи, яка складається з нерозгалуженої або розгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю (наприклад, метальної, етильної, пропільної, ізопропільної, бутильної, ізобутильної, трет-бутильної, трет-бутил-СН2 і т. д.), циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю (наприклад, циклопропільної, циклогексильної і т. д.), циклоалкілалкільної групи, яка містить від 3 до 6 атомів вуглецю у своїй циклоалкільній частині і від 1 до 3 атомів вуглецю у своїй алкільній частині (наприклад, циклопропіл-СН2-, циклогексил-СН2- і т. д.), алкілоксигрупи, яка містить від 1 до 6 атомів вуглецю (наприклад, СН3О-, СН3СН2О-, ізобутилО-, трет-бутил-О- (Вос) і т. д.), тетрагідро-3фуранілокси, -СН2ОН, -CF3, -CH2CF3, -СН2СН2СF3, піролідинілу, піперидинілу, 4-морфолінілу, СН3О2С-, СН3О2ССН2-, ацетил-ОСН2СН2-, НО2ССН2-, 3-гідроксифенілу, 4-гідроксифенілу, 4СН3ОС6Н4СН2-, CH3NH-, (CH3 )2N-, (CH3CH2)2N-, (CH3CH2CH2)2N-, HOCH2CH2NH-, CH3OCH2O-, CH3OCH2CH2O-, C6H5CH2O-, 2-піролілу, 2піридилу, 3-піридилу, 4-піридилу, 2-піразинілу, 2хінолілу, 3-хінолілу, 4-хінолілу, 1-ізохінолілу, 3ізохінолілу, 2-хіноксалінілу, фенільної групи формули піколільної групи, вибраної з групи, яка складається з 11 86086 12 біфенілметильної групи формули VII піколілоксигрупи, вибраної з групи, яка складається з і антрил-9-СН2-групи формули VIII заміщеної піридильної групи, вибраної з групи, яка складається з і групи формули де X¢ і Υ', однакові або різні, можуть бути вибрані, наприклад, з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, СІ, Br, I, -CF3, -NO2, -NR4R5, -NHCOR4, -OR4, SR4, -COOR4, -COR4 і -СН2ОН, де R4 і R5, однакові або різні, можуть бути вибрані, наприклад, з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, де R2 може бути вибраний, наприклад, з групи, яка складається з дифенілметильної групи, формули IV нафтил-1-СН2-групи формули V нафтил-2-СН2-групи формули VI і де R1 може являти собою відщеплювану ланку (наприклад, фізіологічно відщеплювану ланку), за допомогою чого при відщіпленні даної ланки сполука вивільняє інгібітор протеази (інгібітор протеази ВІЛ), за умови, що R1 не є Н. Наприклад, Rj може являти собою ферментно або метаболічно відщеплювану ланку або зв'язок, що гідролізується, які можуть бути відщеплені в умовах, що існують у кишечнику і/або шлунково-кишковому тракті (рН) або інших фізіологічних умовах. За даним винаходом R1 можна вибрати, наприклад, з групи, яка складається з (НО)2Р(О) і (МО)2Р(О), де Μ являє собою лужний метал (наприклад, Na, К, Cs і т. д.) або лужноземельний метал (Са, Mg і т. д.). Далі за даним винаходом R1 може являти собою групу формули R1A-CO-, де R1A може бути вибраний, наприклад, з групи, яка складається з нерозгалуженої або розгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю (наприклад, метальної, етильної, пропільної, ізопропільної, бутильної, ізобутильної, трет-бутильної, третбутил-СН2 - і т. д.), циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю (наприклад, циклопропільної, циклогексильної і т. д.), циклоалкілалкільної групи, яка містить від 3 до 6 атомів вуглецю у своїй циклоалкільній частині і від 1 до 3 атомів вуглецю у своїй алкільній частині (наприклад, циклопропіл-СН2-, циклогексил-СН2- і т. д.), алкілоксигрупи, яка містить від 1 до 6 атомів вуглецю (наприклад, СН3О-, СН3СН2О-, ізобутил-О-, третбутил-О- (Вос) і т. д.), -СН2ОН, СН3О2С-, СН3О2ССН2-, ацетил-ОСН2СН2-, НО2ССН2-, 2гідроксифенілу, 3-гідроксифенілу, 4гідроксифенілу, (CH3)2 NCH2-, (CH3)2CHCH(NH2)-, HOCH2CH2NH-, CH3OCH2O-, CH3OCH2CH2O-, 2піролілу, 2-піридилу, 3-піридилу, 4-піридилу, 1метил-1,4-дигідро-З-піридилу, 2-піразинілу, 2хінолілу, 3-хінолілу, 4-хінолілу, 1-ізохінолілу, 3ізохінолілу, 2-хіноксалінілу, фенільної групи формули 13 піколільної групи, вибраної з групи, яка складається з піколілоксигрупи, вибраної з групи, яка складається з заміщеної піридильної групи, вибраної з групи, яка складається з і групи формули де X¢, Y', R4 і R5 є такими, як визначено у даному описі. В іншому аспекті даний винахід далі пропонує сполуку формули II: 86086 14 ну з групи, яка складається з метилендіоксигрупи формули -ОСН2О- і етилендіоксигрупи формули ОСН2СН2О-, де R6 може бути вибраний, наприклад, з групи, яка складається з нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкілалкільної групи, яка містить від 3 до 6 атомів вуглецю у своїй циклоалкільній частині і від 1 до 3 атомів вуглецю у своїй алкільній частині, де R3 може бути вибраний, наприклад, з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, і групи формули R3AСО-, де R3A може бути вибраний, наприклад, з групи, яка складається з нерозгалуженої або розгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю (наприклад, метальної, етильної, пропільної, ізопропільної, бутильної, ізобутильної, трет-бутильної, трет-бутил-СН2 - і т. д.), циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю (наприклад, циклопропільної, циклогексильної і т. д.), циклоалкілалкільної групи, яка містить від 3 до 6 атомів вуглецю у своїй циклоалкільній частині і від 1 до 3 атомів вуглецю у своїй алкільній частині (наприклад, циклопропіл-СН2-, циклогексил-СН2- і т. д.), алкілоксигрупи, яка містить від 1 до 6 атомів вуглецю (наприклад, СН3О-, СН3СН2О-, ізобутилО-, трет-бутил-О- (Вос) і т. д.), тетрагідро-3фуранілокси, -СН2ОН, -CF3, -CH2CF3, -CH2CH2CF3, піролідинілу, піперидинілу, 4-морфолінілу, СН3О2С-, СН3О2ССН2-, ацетил-ОСН2СН2-, НО2ССН2-, 3-гідроксифенілу, 4-гідроксифенілу, 4СН3ОС6Н4СН2-, CH3NH-, (CH3 )2N-, (CH3CH2)2N-, (CH3CH2CH2)2N-, HOCH2CH2NH-, CH3OCH2O-, CH3OCH2CH2O-, C6H5CH2O-, 2-піролілу, 2піридилу, 3-піридилу, 4-піридилу, 2-піразинілу, 2хінолілу, 3-хінолілу, 4-хінолілу, 1-ізохінолілу, 3ізохінолілу, 2-хіноксалінілу, фенільної групи формули піколільної групи, вибраної з групи, яка складається з і її фармацевтично прийнятні солі і похідні (наприклад, коли сполука за даним винаходом включає аміногрупу, фармацевтично прийнятна сіль може являти собою сіль амонію), де n може дорівнювати 3 або 4, де X і Υ, однакові або різні, можуть бути вибрані, наприклад, з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, СІ, Br, I, -CF3, -OCF3, -CN, -NO2, -NR4R5, NHCOR4, -OR4, -SR4, -COOR4, -COR4 і -СН2ОН, або X і Υ разом визначають алкілендіоксигрупу, вибра піколілоксигрупи, вибраної з групи, яка складається з 15 86086 16 заміщеної піридильної групи, вибраної з групи, яка складається з і групи формули де X' і Y', однакові або різні, можуть бути вибрані, наприклад, з групи, яка складається з Η, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, СІ, Br, І, -CF3, -ΝΟ2, -NR4R5, -NHCOR4, -OR4, SR4, -COOR4, -COR4 і -СН2ОН, де R4 і R5, однакові або різні, можуть бути вибрані, наприклад, з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, і циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, де R2 може бути вибраний, наприклад, з групи, яка складається з дифенілметильної групи, формули IV нафтил-1-СН2-групи формули V і де R1 може являти собою фізіологічно відщеплювану ланку, за допомогою чого при відщіпленні даної ланки сполука може бути здатна вивільняти інгібітор протеази, за умови, що R1 не є Н. За даним винаходом R1 можна вибрати, наприклад, з групи, яка складається з (НО)2Р(О) і (МО)2Р(О), де Μ являє собою лужний метал (наприклад, Na, К, Cs і т. д.) або лужноземельний метал (Са, Mg і т. д.). Далі за даним винаходом R1 може являти собою групу формули R1A-CO-, де R1A може бути вибраний з групи, яка складається з нерозгалуженої або розгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю (наприклад, метальної, етильної, пропільної, ізопропільної, бутильної, ізобутильної, трет-бутильної, трет-бутил-СН2- і т. д.), циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю (наприклад, циклопропільної, циклогексильної і т. д.), циклоалкілалкільної групи, яка містить від 3 до 6 атомів вуглецю у своїй циклоалкільній частині і від 1 до 3 атомів вуглецю у своїй алкільній частині (наприклад, циклопропіл-СН2 -, циклогексил-СН2 - і т. д.), алкілоксигрупи, яка містить від 1 до 6 атомів вуглецю (наприклад, СН3О-, СН3СН2О-, ізобутил-О-, трет-бутил-О- (Вос) і т. д.), -СН2ОН, СН3О2С-, СН3О2ССН2-, ацетил-ОСН2СН2-, НО2ССН2-, 2-гідроксифенілу, 3-гідроксифенілу, 4гідроксифенілу, (CH3)2 NCH2-, (CH3)2CHCH(NH2)-, HOCH2CH2NH-, CH3OCH2O-, CH3OCH2CH2O-, 2піролілу, 2-піридилу, 3-піридилу, 4-піридилу, 1метил-1,4-дигідро-З-піридилу, 2-піразинілу, 2хінолілу, 3-хінолілу, 4-хінолілу, 1-ізохінолілу, 3ізохінолілу, 2-хіноксалінілу, фенільної групи формули нафтил-2-СН2-групи формули VI піколільної групи, вибраної з групи, яка складається з біфенілметильної групи формули VII піколілоксигрупи, вибраної з групи, яка складається з і антрил-9-СН2-групи формули VIII 17 заміщеної піридильної групи, вибраної з групи, яка складається з і групи формули де X¢, Y', R4 і R5 є такими, як визначено у даному описі. У наступному аспекті даний винахід пропонує сполуку формули llа: її фармацевтично прийнятні солі і похідні (наприклад, коли сполука за даним винаходом включає аміногрупу, фармацевтично прийнятна сіль може являти собою сіль амонію), де X і Y, однакові або різні, можуть бути вибрані, наприклад, з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, СІ, Br, I, -CF3, -OCF3, -CN, -NO2, -NR4R5, NHCOR4, -OR4, -SR4, -COOR4, -COR4 і -СН2ОН, або X і Υ разом визначають алкілендіоксигрупу, вибрану з групи, яка складається з метилендіоксигрупи формули -ОСН2О- і етилендіоксигрупи формули ОСН2СН2О-, де X' і Υ', однакові або різні, можуть бути вибрані, наприклад, з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, СІ, Br, I, -CF3, -NO2, -NR4R5, -NHCOR4, -OR4, SR4, -COOR4, -COR4 і -СН2ОН, і де n, R1, R3, R4, R5 і R6 є такими, як визначено у даному описі. У додатковому аспекті даний винахід пропонує сполуку формули llb: 86086 18 її фармацевтично прийнятні солі і похідні (наприклад, коли сполука за даним винаходом включає аміногрупу, фармацевтично прийнятна сіль може являти собою сіль амонію), де X і Y, однакові або різні, можуть бути вибрані, наприклад, з групи, яка складається з Н, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, СІ, Br, I, -CF3, -OCF3, -CN, -NO2, -NR4R5, NHCOR4, -OR4, -SR4, -COOR4, -COR4 і -CH2OH, або X і Υ разом визначають алкілендіоксигрупу, вибрану з групи, яка складається з метилендіоксигрупи формули -ОСН2О- і етилендіоксигрупи формули ОСН2СН2О-, де X' і Υ', однакові або різні, можуть бути вибрані, наприклад, з групи, яка складається з Η, нерозгалуженої алкільної групи, яка містить від 1 до 6 атомів вуглецю, розгалуженої алкільної групи, яка містить від 3 до 6 атомів вуглецю, циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю, F, СІ, Br, I, -CF3, -ΝΟ2, -NR4R5, -NHCOR4, -OR4, SR4, -COOR4, -COR4 і -СН2ОН, і де n, R1, R3, R4, R5 і R6 є такими, як визначено у даному описі. У ще одному додатковому аспекті даний винахід пропонує сполуку формули llс: її фармацевтично прийнятні солі і похідні (наприклад, коли сполука за даним винаходом включає аміногрупу, фармацевтично прийнятна сіль може являти собою сіль амонію), і де n, Χ, Υ, Χ', Υ', R1, R3, R4, R5 і R6 є такими, як визначено у даному описі. В іншому аспекті даний винахід стосується сполуки формули llА 19 де Y, n, R1, R2, R3, X' i Υ' є такими, як визначено у даному описі За даним винаходом R] може являти собою, наприклад, (НО)2Р(О) або (NaO)2P(O). Далі, за даним винаходом n може дорівнювати 4. Υ може, наприклад, являти собою Н. R3 може, наприклад, являти собою СН3О-СО. R2 може, наприклад, являти собою дифенілметильну групу формули IV, де X' і Y' можуть являти собою, наприклад, Н, Отже, сполуки формули llА', а також їх фармацевтично прийнятні солі і похідні, охоплюються даним винаходом, такі як, наприклад, сполука формули llА', де R1 являє собою (НО)2Р(О), або сполука формули llА', де R1 являє собою (NaO)2P(O). У ще одному відмінному аспекті даний винахід стосується фармацевтичної композиції, яка включає, щонайменше, одну сполуку формули І, II, llа, llb, llс, llА, llА¢ або комбінацію сполук формули І, II, llа, llb, llс, llА І/або llА'. Фармацевтична композиція може включати фармацевтично прийнятний носій. Фармацевтична композиція може включати, наприклад, фармацевтично ефективну кількість такої однієї або декількох сполук або, у відповідних випадках, їх фармацевтично прийнятних солей амонію. Наприклад, фармацевтична композиція за даним винаходом може включати одну або декілька з наведених нижче сполук: - сполуку формули llа, де n дорівнює 4, R1 являє собою (НО)2Р(О), X являє собою 4-ΝΗ2, Υ являє собою Н, X' являє собою Η, Υ' являє собою Н, R6 являє собою ізобутил і R3 являє собою СН3ОСО, - сполуку формули llа, де n дорівнює 4, R1 являє собою (NaO)2P(O), X являє собою 4-ΝΗ2, Υ являє собою Н, X' являє собою Η, Υ' являє собою Н, R6 являє собою ізобутил і R3 являє собою СН3О-СО, 86086 20 - сполуку формули llа, де n дорівнює 4, R1 являє собою (НО)2Р(О), X являє собою 4-ΝΗ2, Υ являє собою Н, X' являє собою Η, Υ' являє собою Н, R6 являє собою ізобутил і R3 являє собою СН3СО, - сполуку формули llа, де n дорівнює 4, R1 являє собою (НО)2Р(О), X являє собою 4-ΝΗ2, Υ являє собою 3-F, X' являє собою Η, Υ' являє собою Η, R6 являє собою ізобутил і R3 являє собою СН3О-СО, - сполуку формули llа, де n дорівнює 4, R1 являє собою СН3СО, X являє собою 4-ΝΗ2, Υ являє собою Н, X' являє собою Η, Υ' являє собою Н, R6 являє собою ізобутил і R3 являє собою СН3О-СО, - сполуку формули llа, де n дорівнює 4, R1 являє собою 3-піридил-СО, X являє собою 4-ΝΗ2, Υ являє собою Н, X' являє собою Η, Υ¢ являє собою Н, R6 являє собою ізобутил і R3 являє собою СН3О-СО, - сполуку формули llа, де n дорівнює 4, R1 являє собою (CH3)2NCH2CO, X являє собою 4-ΝΗ2, Υ являє собою Н, X' являє собою Η, Υ¢ являє собою Н, R6 являє собою ізобутил і R3 являє собою СН3О-СО, - сполуку формули llа, де n дорівнює 4, R1 являє собою (CH3)2CHCH(NH2)CO, X являє собою 4ΝΗ2, Υ являє собою Н, X' являє собою Η, Υ' являє собою Н, R6 являє собою ізобутил і R3 являє собою СН3О-СО, - сполуку формули llb, де n дорівнює 4, R1 являє собою (НО)2Р(О), X являє собою 4-ΝΗ2, Υ являє собою Н, X' являє собою Η, Υ' являє собою Η, R6 являє собою ізобутил і R3 являє собою СН3ОСО, і де нафтильна група являє собою нафтил-2СН2 групу, - сполуку формули llb, де n дорівнює 4, R1 являє собою (НО)2Р(О), X являє собою 4-ΝΗ2, Υ являє собою Н, X' являє собою Η, Υ' являє собою Н, R6 являє собою ізобутил і R3 являє собою 4морфолін-СО, і де нафтильна група являє собою нафтил-1-СН2 групу, або - комбінацію будь-якої з вказаних вище сполук. У додатковому аспекті даний винахід стосується використання, щонайменше, однієї сполуки формули І, II, llа, llb, llс, llА, llА' або комбінації сполук формули І, II, llа, llb, llс, llА і/або llА' або її фармацевтично прийнятних солей або похідних (а також їх комбінацій) при виготовленні лікарського препарату (або фармацевтичної композиції) для лікування або профілактики ВІЛ інфекції. У наступному аспекті даний винахід стосується використання, щонайменше, однієї сполуки формули І, II, llа, llb, llс, llА, llА' або комбінації сполук формули І, II, llа, llb, llс, llА і/або llА' або її фармацевтично прийнятних солей або похідних при лікуванні або профілактиці ВІЛ інфекції у ссавців, які потребують цього, або для затримки виникнення СНІДу. У ще одному додатковому аспекті даний винахід стосується способу лікування або профілактики ВІЛ інфекції (або для затримки виникнення СНІДу), що включає введення, щонайменше, однієї сполуки формули І, II, llа, llb, llc, llΑ, llА' або комбінації сполук формули І, II, llа, llb, llс, llА і/або llА¢ або її фармацевтично прийнятних солей або похідних ссавцеві, який потребує цього. 21 В іншому аспекті даний винахід стосується сполуки формули І, II, llа, llb, llc, llА або llА', її фармацевтично прийнятних солей або похідних, для використання при лікуванні або профілактиці ВІЛ інфекції. У ще одному додатковому аспекті даний винахід стосується способу виготовлення сполуки на основі лізину, що використовує будь-яку зі сполук, описаних у патенті США №6632816, виданому Stranix et al., або способу виготовлення сполуки, здатної утворювати будь-яку зі сполук, описаних у патенті США №6632816, виданому Stranix et al., при відщіпленні (in vivo) відщеплюваної ланки. Сполуки, перераховані у даному описі, є ілюстративними варіантами здійснення даного винаходу на практиці і необхідно розуміти, що даний винахід не обмежується тільки даними сполуками. Термін «фармацевтично ефективна кількість» стосується кількості, ефективної для лікування або профілактики ВІЛ-інфекції у пацієнта або для зменшення або виключення симптомів СШД. Також тут необхідно розуміти, що «фармацевтично ефективна кількість» може бути витлумачена як кількість, яка дає бажаний терапевтичний ефект, що приймається у вигляді одноразової дози або багаторазових доз, або у будь-якому дозуванні або маршрутом, або приймається окремо або у комбінації з іншими терапевтичними засобами. У випадку даного винаходу «фармацевтично ефективну кількість» можна розуміти як кількість, що володіє інгібуючою дією на інфекційний цикл ВІЛ (ВІЛ-1 і ВІЛ-2, а також споріднених вірусів (наприклад, HTLV-I і HTLV-II і мавпячого вірусу імунодефіциту (SIV))) (наприклад, придушення розмноження, реінфекції, дозрівання, реплікації і т. д.) і на будьякий організм, життєвий цикл якого залежить від аспартил-протеаз. Інгібуючу дію у контексті даного опису необхідно розуміти як зниження здатності організму (наприклад, ВІЛ) відтворювати себе (реплікувати), реінфікувати оточуючі клітини і т. д. або навіть повне придушення (або знищення) організму. Терміни «ВІЛ протеаза» і «ВІЛ аспартилпротеаза» використовуються взаємозамінно і включають аспартил-протеазу, кодовану вірусом імунодефіциту людини типу 1 або 2. Термін «профілактично ефективна кількість» стосується кількості, ефективної для профілактики ВІЛ інфекції у пацієнта. Використовуваний тут термін «пацієнт» стосується ссавця, включаючи людину. Терміни «фармацевтично прийнятний носій», «фармацевтично прийнятна допоміжна речовина» і «фізіологічно прийнятний розчинник» стосуються нетоксичного носія або допоміжної речовини, які можна вводити пацієнту разом з однією або декількома сполуками за даним винаходом, і які не руйнують їх фармакологічну активність. Даний винахід пропонує фармацевтично прийнятні похідні сполук формули І (такі як сполуки формули II, llа, llb, llс, ІІА і llА¢) і. де застосовно, їх фармацевтично прийнятні солі, такі як, наприклад, солі амонію. «Фармацевтично прийнятне похідне» означає фармацевтично прийнятні сіль, складний ефір або сіль такого складного ефіру, сполуку за 86086 22 даним винаходом або будь-яку іншу сполуку, яка, при введенні реципієнту, здатна надати (прямо або опосередковано) сполуку за даним винаходом або її антивирусно активний метаболіт або залишок. Необхідно розуміти, що «нерозгалужена алкільна група, що містить від 1 до 6 атомів вуглецю», включає, наприклад, метил, етил, пропіл, бутил, пентил, гексил. Необхідно розуміти, що «розгалужена алкільна група, що містить від 3 до 6 атомів вуглецю», включає, наприклад, без обмеження, ізобутил, трет-бутил, 2-пентил, 3-пентил і т. д. Необхідно розуміти, що «циклоалкільна група, що містить від 3 до 6 атомів вуглецю», включає, наприклад, без обмеження, циклопропіл, циклобутил, циклопентил, циклоциклогексил (тобто, С6Н11). Солі, одержані з відповідних основ, включають солі лужних металів (наприклад, натрію), лужноземельних металів (наприклад, магнію), амонію і N-(C1-4алкіл)4+. Сполуки за даним винаходом містять один або більше асиметричних атомів вуглецю і, таким чином, можуть знаходитися у вигляді рацематів і рацемічних сумішей, окремого енантіомеру, діастереомерних сумішей та індивідуальних діастереоізомерів. Всі такі ізомерні форми даних сполук включені у даний винахід. Кожний стереогенний атом вуглецю може мати R або S конфігурацію. Фармацевтично прийнятні солі сполук за даним винаходом включають солі, одержані з фармацевтично прийнятних неорганічних і органічних кислот і основ. Приклади таких солей кислот включають: ацетат, адипат, альгінат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропіонат, диглюконат, додецилгідросульфат, додецилсульфат, етансульфонат, форміат, фумарат, глюкогептаноат, гліцерофосфат, гліколят, гемісульфат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, 2-гідроксіетансульфонат, лактат, малеат, малонат, метансульфонат, 2нафтилсульфонат, нікотинат, нітрат, оксалат, памоат, пектинат, перхлорат, персульфат, 3фенілпропіонат, фосфат, пікрат, півалат, пропіонат, саліцилат, сукцинат, сульфат, тартрат, тіоціанат, тозилат і ундеканоат. Даний винахід також охоплює кватернізацію будь-яких груп сполук, що містять основний азот, розкритих у даному описі. Основний азот можна кватернізувати будь-якими реагентами, відомими фахівцеві у даній галузі, включаючи, наприклад, нижчі алкілгалогеніди, такі як метил-, етил-, пропіл- і бутил- хлориди, броміди і йодиди; діалкілсульфати, включаючи диметил-, діетил-, дибутил- і діамілсульфати; довголанцюжкові галогеніди, такі як, децил-, лаурил-, міристил- і стеарил- хлориди, броміди і йодиди, і аралкілгалогеніди, включаючи бензил- і фенетилброміди. Такою кватернізацією можна одержати водо- або маслорозчинні або дисперсні продукти. Тут необхідно розуміти, що, якщо вказується «діапазон» або «група речовин» стосовно конкретної характеристики (наприклад, температури, 23 концентрації, часу або аналогічного) даного винаходу, то даний винахід стосується і недвозначно включає всі конкретні члени і комбінації піддіапазонів або підгруп у даному описі. Таким чином, будь-які зазначені діапазон або групу необхідно розуміти як стенографічний шлях посилання до всіх членів діапазону або групи індивідуально, а також до всіх можливих піддіапазонів або підгруп, охоплюваних даним описом; і аналогічно стосовно будь-яких піддіапазонів або підгруп даного опису. Таким чином, наприклад, - стосовно числа атомів вуглецю, вказівку діапазону від 1 до 6 атомів вуглецю у даному описі необхідно розуміти як таку, що включає всі індивідуальні кількості атомів вуглецю, а також піддіапазони, такі як, наприклад, 1 атом вуглецю, 3 атоми вуглецю, від 4 до 6 атомів вуглецю і т. д.; - стосовно часу реакції, час, що дорівнює 1 хвилині або більше, необхідно розуміти як такий, що конкретно включає тут всі індивідуальні часи, а також піддіапазони, більше 1 хвилини, такі як, наприклад, 1 хвилина, від 3 до 15 хвилин, від 1 хвилини до 20 годин, від 1 до 3 годин, 16 годин, від 3 годин до 20 годин і т. д.; - і аналогічно щодо інших параметрів, таких як концентрації, елементи і т. д. Зокрема тут необхідно розуміти, що кожна формула сполуки включає всі індивідуальні сполуки, описані таким чином, а також всі можливі класи або підгрупи або підкласи сполук, незалежно від того, визначений такий клас або підклас як такий, що виразно включає конкретні сполуки, виключає конкретні сполуки або як комбінація цього; наприклад, виключаюче визначення для формули (наприклад, І) можна читати наступним чином: (за умови, що коли один з А і В являє собою -СООН, а інший являє собою Н, СООН може не бути присутнім у положенні 4'". Також необхідно розуміти, що "г" або "гм" є посиланням до грамових одиниць маси, а "С" або ''°С" є посиланням до одиниці температури за Цельсієм. Сполуки за даним винаходом можна легко одержати, використовуючи звичайні методи з легко доступних вихідних речовин. Детальні описи даних підходів представлені, наприклад, у схемах 1-5, обговорених нижче. Схема 1 ілюструє характерний приклад одержання фосфатного складного моноефіру III, одержаного з первинного спирту (дивися І), сполуки інгібіторів ВІЛ протеази (дивися приклад 1 (стадії G і Н) в експериментальній частині даного документу як конкретний приклад даного синтезу). Слід зазначити: a) R2 і R3 є такими, як визначено у даному описі. При синтезі фосфатного складного моноефіру III як вихідну речовину можна використовувати інгібітор ВІЛ аспартил-протеази [І, дивися патент США №6632816]. Ефір діетилфосфорної кислоти II одержували з хорошим виходом при обробці діетилхлорфосфатом і гідридом натрію у суміші тетрагідрофурану і триетилфосфату. Потім, додавання триметилсилілброміду у дихлорметані (ДХМ) дало сполуку III з виходами від хорошого до чудового. 86086 24 Схема 1А представляє інший характерний приклад одержання фосфатного складного моноефіру ША, одержаного з первинного спирту (дивися ІА), сполуки інгібіторів ВІЛ протеази. Слід зазначити: а) n, Χ, Υ, R2, R3 і R6 є такими, як визначено у даному описі. Синтез фосфатного складного моноефіру lllА здійснюють, як описано для одержання III (схема 1). Схема 2 ілюструє характерний приклад одержання фосфатного складного моноефіру III, сполуки інгібіторів ВІЛ протеази, з іншим підходом, використовуючи як вихідну речовину (3S)-3ізобутиламіноазепан-2-он (IV). Слід зазначити: a) R2 і R3 є такими, як визначено у даному описі. Як показано на схемі 2, похідне, що представляє собою фосфатний складний моноефір III, одержували з (3S)-3-ізобутиламіноазепан-2-ону (IV) у семистадійній послідовності реакцій. На початку, (2S)-3-ізобутиламіноазепан-2-он (IV) сульфонували 4-ацетамідобензолсульфонілхлоридом у присутності триетиламіну у дихлорметані, одержуючи сполуку V з хорошими виходами. Похідне VI одержували кількісно при обробці V ди-третбутилпірокарбонатом і ДМАП в ацетонітрилі. Відновне розкриття циклу боргідридом натрію в етанолі приводить до ключових проміжних продуктів VII з хорошим виходом. Ефір діетилфосфорної кислоти VIII одержували з хорошим виходом при обробці діетилхлорфосфатом і гідридом натрію у суміші тетрагідрофурану і триетилфосфату. Вос захисні групи видаляли обробкою НСl в етанолі, одержуючи сполуку IX кількісно [T.W. Greene and P.G.M. Wuts, Protective groups in Organic Synthesis, 3rd Edition, John Wiley & Sons, Inc. 1999]. Потім сполучення вільної аміногрупи, присутнє на промі 25 86086 26 жній сполуці IX, з рядом синтетичних амінокислот у присутності 1-гідроксибензотриазолу (НОВt) і 1[3-(диметиламіно)пропіл]-3-етилкарбодіімід гідрохлориду (EDAC) привело до похідного II з виходами від хорошого до чудового. Нарешті, додавання триметилсилілброміду у дихлорметані (ДХМ) дало сполуку III з виходами від хорошого до чудового. Схема 3 представляє перетворення дифенілметильного похідного; метилового ефіру (1S,5S)(1-{5-[(4-амінобензолсульфоніл)ізобутиламіно]-6гідроксигексил-карбамоїл}-2,2-дифеніл етил )карбамі нової кислоти (PL-100) в його аналог XI, що представляє собою натрієву сіль фторованого фосфатного складного моноефіру. Дану послідовність реакцій можна використовувати для одержання будь-яких інших аналогічних сполук, одержаних з незаміщених (або заміщених) дифенілметильних, 1-нафтильних, 2-нафтильних, біфенільних і 9-антрильних груп, описаних у даному винаході. Так, обробка PL-100 за допомогою Selectfluor™ в ацетонітрилі дала похідне X з виходом 38%. Введення групи фосфатного складного моноефіру здійснювали, як описано раніше у схемах 1 і 2. Спочатку проміжну сполуку, що представляє собою ефір діетилтрифосфорної кислоти, одержували з хорошим виходом при обробці діетилхлорфосфатом і гідридом натрію у суміші тетрагідрофурану і триетилфосфату. Потім, додавання триметилсилілброміду у дихлорметані (ДХМ) дало сполуку фосфатного складного моноефіру з виходами від хорошого до чудового. Кінцевий продукт XI легко одержували при обробці фосфатного складного моноефіру розчином гідроксиду натрію з хорошими виходами. Схема 4 ілюструє типовий приклад перетворення фосфотриефіру II в його фторований аналог XIII у двохстадійній послідовності реакцій. Даний типовий приклад представляє другий підхід до синтезу фторованих сполук за даним винаходом. У цьому випадку атом фтору додають до фосфотриефіру II, а не до похідного загальної формули І, що представляє собою первинний спирт, або, більш конкретно, PL-100, як показано на схемі 3. Дану альтернативну послідовність реакцій можна використовувати для синтезу будь-яких інших аналогічних сполук, одержаних з незаміщених (або заміщених) дифенілметильних, 1-нафтильних, 2нафтильних, біфенільних і 9-антрильних груп, описаних у даному винаході. Слід зазначити: a) R2 і R3 є такими, як визначено у даному описі. Коротко, обробка похідного II за допомогою Selectfluor™ в ацетонітрилі дала похідне XII з хорошим виходом. Потім додавання триметилсилілброміду у дихлорметані (ДХМ) дало сполуку XIII, що представляє собою фосфатний складний моноефір, з виходом від хорошого до чудового. Якщо бажано, кінцевий продукт XIII можна легко перетворити в аналог, що представляє собою натрієву сіль фосфатного складного моноефіру, як описано раніше у схемі 3. 27 86086 28 гідрування бензилоксикарбонільної групи, використовуючи 10% паладій на вугіллі, одержуючи кінцеву сполуку XVII. Схема 5 ілюструє синтез різних сполук складних ефірів XVI за винаходом. Відомо, що сполуки складних ефірів легко розщеплюються in vivo ферментами естерази, і у результаті можуть вивільняти активний інгредієнт. У даній схемі R.2 визначений як дифенілметильна група. Однак дану послідовність реакцій можна використовувати для синтезу будь-яких інших аналогічних сполук, одержаних з незаміщених (або заміщених) дифенілметильних, 1-нафтильних, 2-нафтильних, біфенільних і 9-антрильних груп, описаних у даному винаході. Слід зазначити: a) R1A представляє «залишок» молекули кислоти, який зв'язаний з вільною групою первинного спирту, що присутня на проміжній сполуці XV, і є таким, як визначено у даному описі. Сполуки XVI звичайно одержують у трьохстадійній послідовності реакцій з високими виходами. Етерифікація трет-бутилового ефіру (1S)-{4-[(5трет-бутоксикарбоніламіно-1гідроксиметилпентил)ізобутилсульфамоїл]феніл}карбамінової кислоти (VII) різною кислотою у присутності 1гідроксибензотриазолу (HOBt) і 1-[3(диметиламіно)пропіл]-3-етилкарбодіімід гідрохлориду (EDAC) привела до бажаних складних ефірів XIV з чудовими виходами. Складний оцтовокислий ефір одержували кількісно, використовуючи оцтовий ангідрид у присутності Ν,Νдиметиламінопіридину (ДМАП) у дихлорметані (ДХМ). Відриву Вос захисної групи досягали кількісно при обробці трифтороцтовою кислотою (ТФО) у ДХМ. Друге сполучення з (2S)-2метоксикарбоніламіно-3,3-дифенілпропіоновою кислотою здійснюють на первинній аміногрупі проміжної сполуки XV з HOBt і EDAC, одержуючи бажані сполуки XVI з виходами від хорошого до чудового. Якщо необхідно, здійснюють каталітичне Фахівець у даній галузі зрозуміє, що вказані вище синтетичні схеми не мають наміру являти собою повний список всіх засобів, якими можна синтезувати сполуку, описану і заявлену у даній заявці на винахід, а являють собою лише ілюстрацію методів синтезу серед інших. Подальші методи будуть очевидні фахівцям у даній галузі. Сполуки за даним винаходом можна модифікувати, додаючи відповідні функціональності для посилення селективних біологічних властивостей. Такі модифікації відомі з рівня техніки і включають модифікації, які збільшують біологічну проникність у дану біологічну систему (наприклад, кров, лімфатичну систему, центральну нервову систему), збільшують пероральну доступність, збільшують розчинність, щоб дати можливість введення ін'єкцією, змінюють метаболізм і змінюють швидкість виділення. Як обговорено вище, нові сполуки можуть вивільняти активні інгредієнти, які є чудовими лігандами стосовно аспартил-протеаз, наприклад, ВІЛ1 протеази. Відповідно, дані сполуки, за допомогою вивільнення активного інгредієнта, здатні націлюватися і придушувати події пізньої фази при реплікації, тобто процесинг вірусних поліпротеїнів ВІЛ-кодованою протеазою. Сполуки за даним винаходом переважно придушують здатність ВІЛ-1 вірусу інфікувати іморталізовані Т-клітини людини протягом періоду, що становить дні, як визначено аналізом, що вимірює кількість позаклітинного р24 антигену; специфічного маркера реплікації вірусу [див., Meek et al., Nature, 343, pp.90-92 (1990)]. Крім їх використання при профілактиці або лікуванні ВІЛ або HTLV інфекції, сполуки за даним винаходом можна також використовувати як інгібуючі або перериваючі засоби для інших вірусів, які використовують аспартил-протеази, аналогічні ВІЛ або HTLV аспартил-протеазам, у своєму життєвому циклі. Такі сполуки придушують протеолітичний процесинг попередників вірусних поліпротеїнів, придушуючи аспартил-протеазу. Оскільки аспартил-протеаза є істотною для продукції зрілих 29 віріонів, придушення даного процесингу ефективно блокує поширення вірусу, придушуючи продукцію і репродукцію інфекційних вірионів, зокрема з гостро і хронічно інфікованих клітин. Сполуки за даним винаходом переважно придушують аспартил-протеази, таким чином блокуючи здатність аспартил-протеаз каталізувати гідроліз пептидних зв'язків. Сполуки за даним винаходом можна застосовувати звичайним способом для лікування або профілактики ВІЛ, HTLV або інших вірусних інфекцій, які включають у свій життєвий цикл (реплікацію) аспартил-протеази. Такі методи лікування, їх рівні дозувань і вимоги можуть бути вибрані фахівцем у даній галузі з наявних методів і методик. Наприклад, сполуку за даним винаходом можна об'єднати з фармацевтично прийнятною допоміжною речовиною для введення інфікованому вірусом пацієнту у фармацевтично прийнятній мірі та у кількості, ефективній для зниження тяжкості вірусної інфекції. Альтернативно, сполуки за даним винаходом можна використовувати у вакцинах і способах захисту особин від вірусної інфекції протягом триватого періоду часу. Сполуки можна застосовувати у таких вакцинах або окремо, або разом з іншими сполуками за даним винаходом у мірі, що узгоджується з традиційним використанням інгібіторів протеази або похідних інгібіторів протеази у вакцинах. Наприклад, сполуку за даним винаходом можна об'єднати з фармацевтично прийнятними допоміжними речовинами, або системами доставки, звичайно використовуваними у вакцинах, і ввести у профілактично ефективних кількостях для захисту особин протягом тривалого періоду часу від вірусних інфекцій, таких як ВІЛ інфекція. По суті, нові сполуки за даним винаходом (при відщіпленні фізіологічно розщеплюваної ланки) можна вводити як агенти для лікування або профілактики вірусних інфекцій, включаючи ВІЛ інфекцію, у ссавців. Сполуки за даним винаходом можна вводити здоровому або ВІЛ-інфікованому пацієнту (до або після появи симптомів СНІД) у вигляді одиночного агента або у комбінації з іншими противірусними засобами, які заважають циклу реплікації ВІЛ. Вводячи сполуки за даним винаходом з іншими противірусними засобами, які націлені на інші події у життєвому циклі вірусу, терапевтичний ефект даних сполук підсилюється. Наприклад, противірусний засіб, що вводиться спільно, може являти собою засіб, що націлений на ранні події життєвого циклу вірусу, такі як приєднання до клітинного рецептора або входу клітини, зворотну транскрипцію та інтеграцію вірусної ДНК у клітинну ДНК. Противірусні агенти, націлені на такі ранні події життєвого циклу, включають, серед іншого, полісульфовані полісахариди, sT4 (розчинний CD4) та інші сполуки, які блокують зв'язування вірусу з CD4 рецептором на Т-лімфоцитах, що несуть CD4, та інших CD4(+) клітинах, або придушують злиття оболонки вірусу з цитоплазматичною мембраною, і диданозин (ddl), зальцитабін (ddC), ставудин (d4T), зидовудин (AZT) і ламівудин (ЗТС), які інгібують зворотну транскрипцію. Наприклад, зі сполуками за даним винаходом можна використовувати ін 86086 30 ший інгібітор протеази. Інші антиретровірусні і противірусні лікарські засоби також можна спільно вводити зі сполуками за даним винаходом, щоб забезпечити терапевтичне лікування для істотного зниження або виключення вірусної інфекційності і пов'язаних з нею симптомів. Приклади інших противірусних засобів включають ганцикловір, дидеоксицитидин, тринатрію фосфоноформат, ефлорнітин, рибавірин, ацикловір, альфа інтерферон і трименотрексат. Крім того, для посилення дії сполук за даним винаходом можна використовувати інші типи лікарських засобів, такі як інгібітори втрати вірусом оболонки, інгібітори Tat або Rev трансактивуючих білків, антисмислові молекули або інгібітори інтегрази вірусу. Дані сполуки також можна спільно вводити з іншими інгібіторами ВІЛ аспартил-протеази. Крім того, може виявитися корисним вводити сполуки за даним винаходом з іншим лікарським засобом (іншими противірусними сполуками, антибіотиками, аналгезивним засобом і т. д.). Комбіновані терапії за даним винаходом здійснюють синергічний вплив при придушенні реплікації ВІЛ, оскільки кожний компонентний агент комбінації діє на різні ділянки ВІЛ реплікації Використання таких комбінацій також переважно знижує дозування заданого традиційного антиретровірусного засобу, які потрібні були б для бажаної терапевтичної або профілактичної дії, у порівнянні з випадком, коли такий агент вводять у вигляді монотерапії. Дані комбінації можуть зменшити або виключити побічні ефекти традиційних терапій одиночним антиретровірусним засобом, у той самий час не заважаючи антиретровірусній активності даних засобів. Дані комбінації знижують потенціал резистентності до терапій одиночним засобом, у той самий час зводячи до мінімуму супутню токсичність. Дані комбінації також можуть збільшити ефективність традиційного засобу, не збільшуючи супутню токсичність. Комбіновані терапії, охоплювані даним винаходом, включають, наприклад, введення сполуки за винаходом з AZT, З ТС, ddl, ddC, d4T або іншими інгібіторами зворотної транскриптази. Альтернативно, сполуки за даним винаходом можна також спільно вводити з іншими інгібіторами ВІЛ протеази, такими як Ro 31-8959 (Саквінавір; Roche), L-735,524 (Індинавір; Merck), AG-1343 (Нелфінавір; Agouron), A-84538 (Ритонавір; Abbott), ABT-378/r (Лопінавір; Abbott) і VX-478 (Ампренавір; Glaxo), для збільшення ефекту терапії або профілактики проти різних вірусних мутантів або членів інших ВІЛ квазі видів. Ведення сполук за даним винаходом можна здійснити, наприклад, у вигляді одиночних засобів або у комбінації з інгібіторами ретровірусної зворотної транскриптази або іншими інгібіторами ВІЛ аспартил-протеази. Спільне введення сполук за даним винаходом з інгібіторами ретровірусної зворотної транскриптази або інгібіторами ВІЛ аспартил-протеази може здійснити значний синергічний внесок, таким чином запобігаючи, істотно зменшуючи або повністю виключаючи інфекційність вірусу і супутні симптоми. 31 Сполуки за даним винаходом можна вводити таким чином або у формі, що може допускати відщеплення ланки R1 для вивільнення інгібітору протеази. Сполуки за даним винаходом також можна вводити, наприклад, у комбінації з імуномодуляторами (наприклад, бропіриміном, антилюдськими антитілами до альфа інтерферону, IL-2, GM-CSF, метіонін-енцефаліном, інтерфероном альфа, діетилдитіокарбаматом натрію, фактором некрозу пухлини, налтрексоном і rЕРО), антибіотиками (наприклад, пентамідину ізотіонатом) або вакцинами для профілактики або боротьби з інфекцією або хворобою, пов'язаними з ВІЛ інфекцією, такими як СНІД і СНІД-асоційований комплекс. Коли сполуки за даним винаходом вводять у комбінованих терапіях з іншими засобами, їх можна вводити пацієнту послідовно або паралельно. Альтернативно, фармацевтичні або профілактичні композиції за даним винаходом можуть містити комбінацію однієї або декількох сполук за даним винаходом та іншого терапевтичного або профілактичного засобу. Хоча даний винахід зосереджений на використанні сполук, розкритих у даному описі, для профілактики і лікування ВІЛ інфекції, сполуки за даним винаходом також можна використовувати як інгібуючі засоби для інших вірусів, які залежать від аналогічних аспартил-протеаз для обов'язкових подій в їх життєвому циклі. Дані віруси включають, але не обмежуються цим, ретровіруси, що викликають подібні до СНІД захворювання, такі як мавпячі віруси імунодефіциту, ВІЛ-2, HTLV-I і HTLV-II. Крім того, сполуки за даним винаходом також можна використовувати для придушення інших аспартил-протеаз і, зокрема, інших аспартил-протеаз людини, включаючи ренін і аспартил-протеази, які беруть участь у процесинг}' попередників ендотеліну. Фармацевтичні композиції за даним винаходом включають будь-яку сполуку за даним винаходом, і її фармацевтично прийнятні солі, з будьяким фармацевтично прийнятним носієм, допоміжною речовиною або розчинником. Фармацевтично прийнятні носії, допоміжні речовини і розчинники, які можна використовувати у фармацевтичних композиціях за даним винаходом, включають, але не обмежуються цим, іонообмінники, оксид алюмінію, стеарат алюмінію, лецитин, сироваткові білки, такі як людський альбумін, буферні речовини, такі як фосфати, гліцин, сорбінову кислоту, сорбат калію, суміші неповних гліцеридів насичених рослинних жирних кислот, воду, солі або електроліти, такі як протамін сульфат, кислий фосфат динатрію, кислий фосфат дикалію, хлорид натрію, солі цинку, колоїдний кремнезем, трисилікат магнію, полівінілпіролідон, речовини на основі целюлози, поліетиленгліколь, натрій карбоксиметилцелюлозу, поліакрилати, воски, блок-співполімери поліетилен-поліоксипропілен, поліетиленгліколь і ланолін. Фармацевтичні композиції за даним винаходом можна вводити перорально, парентерально аерозолем для інгаляції, місцево, ректально, назшіьно, трансбукально, вагінально або за допомогою імплантованого резервуара. Отже, тут зрозу 86086 32 міло, що пероральне введення або введення ін'єкцією охоплюються даним винаходом. Наприклад, сполуки за даним винаходом, можна вводити, наприклад, перорально у водному розчині. Фармацевтичні композиції за даним винаходом можуть містити будь-які звичайні нетоксичні фармацевтично прийнятні носії, допоміжні речовини або розчинники. Використовуваний тут термін "парентеральне" включає методику підшкірної, внутрішньошкірної, внутрішньовенної, внутрішньом'язової, інтраартикулярної, внутрішньосуглобової, епігастральної, інтратекальної, безпосередньо в уражену тканину, інтракраніальної ін'єкції або інфузії. Фармацевтичні композиції можуть бути у формі стерильного препарату для ін'єкцій, наприклад, у вигляді стерильної впорскуваної водної і масляної суспензії. Рецептуру даної суспензії можна скласти відповідно до методик, відомих з рівня техніки, використовуючи придатні диспергуючі або зволожуючі засоби (такі як, наприклад, Tween 80) і суспендуючі речовини. Стерильний впорскуваний препарат також може являти собою стерильний впорскуваний розчин або суспензію у нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад, у вигляді розчину в 1,3бутандіолі. Серед прийнятних носіїв і розчинників, які можна використовувати, знаходяться амінокислоти, вода, розчин Рінгера та ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендуюче середовище звичайно використовують стерильні, нелеткі масла. Для даної мети можна використовувати будь-яке легке нелетке масло, включаючи синтетичні моно- і дигліцериди. Жирні кислоти, такі як олеїнова кислота і її гліцеридні похідні застосовні при одержанні препаратів для ін'єкцій, як, наприклад, природні фармацевтично прийнятні масла, такі як оливкова олія або касторова олія, особливо у своїх поліоксіетилованих варіантах. Дані масляні розчини або суспензії також можуть містити розріджувачі або диспергуючі речовини, що представляють собою спирти з довгим ланцюгом, такі як Ph. Helv. або аналогічний спирт. Фармацевтичні композиції за даним винаходом можна вводити перорально у будь-якій перорально прийнятній лікарській формі, включаючи, але, не обмежуючись цим, капсули, таблетки і водні суспензії і розчини. У випадку таблеток для перорального використання, носії, які звичайно використовують, включають лактозу і кукурудзяний крохмаль. Також типово додають змащувальні речовини, такі як стеарат магнію. Для перорального введення у формі капсули, застосовні розріджувачі включають лактозу і сухий кукурудзяний крохмаль. Коли водні суспензії вводять перорально, активний інгредієнт об'єднують з ем>льгувальними і суспендуючими речовинами. Якщо бажано, можна додати визначені підсолоджуючі речовини і/або коригенти і/або барвники. Фармацевтичні композиції за даним винаходом також можна вводити у формі супозиторіїв для ректального введення. Дані композиції можна одержати, змішуючи сполуку за винаходом з придатним неподразнюючим наповнювачем, який є 33 твердим при кімнатній температурі, але рідким при ректальній температурі і, отже, буде плавитися у прямій кишці, вивільняючи активні компоненти. Такі матеріали включають, але не обмежуються цим, олію какао, бджолиний віск і поліетиленгліколі. Місцеве введення фармацевтичних композицій за даним винаходом особливо застосовне, коли бажана терапія включає області або органи, легко доступні місцевим нанесенням. Для нанесення місцево на шкіру фармацевтична композиція повинна бути складена у вигляді придатної мазі, що містить активні компоненти, суспендовані або розчинені у носії. Носії для місцевого введення сполук за даним винаходом включають, але не обмежуються цим, мінеральне масло, рідку нафту, білий вазелін, пропіленгліколь, сполуки поліоксіетилену або поліоксипропілену, емульгувальний віск і воду. Альтернативно, фармацевтичну композицію можна скласти у вигляді придатного лосьйону або крему, що містить активну сполуку, суспендовану або розчинену у носії. Придатні носії включають, але не обмежуються цим, мінеральне масло, сорбіт моностеарат, полісорбат 60, цетилові ефіри, віск, цетеариловий спирт, 2октилдодеканол, бензиловий спирт і воду. Фармацевтичні композиції за даним винаходом можна також наносити місцево у нижню частину кишечнику рецептурою ректального супозиторію або у придатній чистій рецептурі. Місцеві трансдермальні пластири також включаються у даний винахід. Фармацевтичні композиції за даним винаходом можна вводити назальним аерозолем або інгаляцією. Такі композиції одержують методиками, добре відомими з рівня техніки фармацевтичних процедур, і їх можна приготувати у вигляді розчинів у насичених розчинах солі, використовуючи бензиловий спирт або інші придатні консерванти, підсилювачі абсорбції для збільшення біологічної доступності, фторвуглеці і/або інші солюбілізатори або диспергуючі агенти, відомі з рівня техніки. Для профілактики або лікування вірусної інфекції, включаючи ВІЛ інфекцію, придатні рівні дозувань приблизно від 0,01 до 25мг/кг маси тіла на день, наприклад, приблизно від 0,5 до 25мг/кг маси тіла на день сполуки активного інгредієнта. Типово фармацевтичні композиції за даним винаходом будуть вводити приблизно від 1 до 5 разів на добу або, альтернативно, у вигляді безперервного вливання. Таке введення можна використовувати у вигляді хронічної або гострої терапії. Кількість активного інгредієнта, яку можна об'єднати з речовинами носія для одержання монолітної лікарської форми, буде відрізнятися в залежності від пацієнта, якого лікують, і конкретного режиму введення. Типовий препарат буде містити приблизно від 5% до 95% активного інгредієнта (мас./мас). Наприклад, такі препарати можуть містити приблизно від 20% до 80% активного інгредієнта. При поліпшенні стану пацієнта, можна вводити підтримуючу дозу сполуки, композиції або комбінації за даним винаходом, якщо це необхідно. Потім дозування або частоту введення, або те і інше, можна знизити, у вигляді функції симптомів, до 86086 34 рівня, при якому зберігається поліпшений стан. Коли симптоми полегшили до бажаного рівня, лікування припиняють. Однак пацієнти можуть потребувати періодичного лікування на довгостроковій основі при рецидиві симптомів захворювання. Фахівцеві у даній галузі зрозуміло, що можуть бути бажані більш низькі або більш високі дози, ніж викладені вище. Конкретні дозування і режими лікування для конкретного пацієнта можуть залежати від різноманітних факторів, включаючи активність конкретної застосовуваної сполуки, вік, масу тіла, загальний стан здоров'я, стать, режим харчування, час введення, швидкість виведення, комбінацію лікарських препаратів, тяжкість і проходження інфекції, схильність пацієнта до інфекції і думку лікаря. У даному описі використовують наступні скорочення: Скорочення Позначення Ас Ацетил АсОН Оцтова кислота АРСІ Хімічна іонізація при атмосферному тиску СНІД Синдром набутого імунодефіциту AZT 3-Азидо-3-деокситимін (зидовудин) Вос Бензилоксикарбоніл t-бутил Трет-бутил САМ Амонію-церію молібдат ДХМ Дихлорметан ДМАП Ν,Ν-диметиламінопіридин ДМСО Диметилсульфоксид ДМФА Диметилформамід ДНК Дезоксирибонуклеїнова кислота EDAC 1-[3-(Диметиламіно)пропіл]-3етилкарбодіімід гідрохлорид ЕtOАс Етилацетат EtOH Етиловий спирт г Грам год. Година Вірус імунодефіциту людини тип ВІЛ-1,-2 1, тип 2 HOBt 1-Гідроксибензотриазол ВЕРХ Високоефективна рідинна хроматографія HTLV-I, -II Т-клітинний лімфотропний вірус людини тип І, тип II IL-2 Інтерлейкін-2 кг Кілограм л Літр РХ-МС Рідинна хроматографія - масспектрометрія Μ Молярний МеОН Метиловий спирт мг Міліграм Τпл. Температура плавлення хв. Хвилина Мос Метоксикарбоніл моль Моль мл Мілілітр ммоль Мілімоль нм Нанометр нМ Наномоль 35 ро rЕРО ТШХ ЗТС ТФО ТГФ Перорально Рекомбінантний еритропоетин Тонкошарова хроматографія 2',3'-Дидеокси-3-тіацитидин Трифтороцтова кислота Тетрагідрофуран Приклади Даний розділ описує синтез сполук на основі лізину, здатних вивільняти інгібітори ВІЛ аспартилпротеази, як описано у даній заявці. Дані приклади подані тільки для ілюстративних цілей, і їх не слід розглядати як такі, що обмежують яким-небудь чином об'єм винаходу. Даний розділ надає детальний синтез сполук №1-10 за даним винаходом. Речовини і методи Аналітичну тонкошарову хроматографію (ТШХ) проводили на 0,25мм силікагелевих пластинах Е. Merck 60 F254 і елюювали показаними системами розчинників. Препаративну хроматографію здійснювали флеш-хроматографією, використовуючи силікагель 60 (EM Science) з показаними системами розчинників і надлишковим тиском повітря, щоб забезпечити належну швидкість елюювання. Визначення сполук здійснювали, впливаючи на піддані елююванню пластини (аналітичні або препаративні) йодом, УФ випромінюванням і/або обробляючи аналітичні пластини 2% розчином панізальдегіду в етанолі, що містить 3% сірчаної кислоти і 1% оцтової кислоти, після чого йшло нагрівання. Альтернативно, аналітичні пластини можна обробити 0,3% розчином нінгідрину в етанолі, що містить 3% оцтової кислоти, і/або САМ розчином, виготовленим з 20г (NH4)6Мо7О24 і 8,3г Ce(SO4)2 полігідрату у воді (750мл), що містить концентровану сірчану кислоту (90мл). Препаративну ВЕРХ проводили на приладі Gilson, обладнаному С18 колонкою, модулем подачі рідини 215 і напірними насосами продуктивністю 25мл/хв. ВЕРХ працює з програмним забезпеченням Gilson UniPoint System. Умови напівпрепаративної ВЕРХ для очищення сполук, що тестуються: Система ВЕРХ: 2 насоси Gilson #305-25мл, пристрій Gilson #215 для введення і збирання рідини і детектор УФ-видимого поглинання Gilson #155, всі пристрої контролюються програмним забезпеченням Gilson UniPoint V1.91. Колонка: Alltech (#96053) Hyperprep PEP, С-18, 100 Åa, 8мкм, 22x250мм Витрата: 15мл/хв. Розчинники: А: Н2О, В: CH3CN Градієнт: від 25% до 80% В протягом 40хв. Детектор: поглинання; l:210 & 265нм Неочищену речовину, розчинену в ацетонітрилі до концентрації приблизно від 50 до 80мг/2 мл, інжектували у кожному циклі. Фракції збирали у кількості 9мл, відношення поглинання визначали УФ-детектором. Якщо не зазначено іншого, всі вихідні речовини одержували з комерційних джерел, таких як Aldrich Co. або Sigma Co. Температури плавлення (Тпл.) визначали на приладі для вимірювання температури плавлення 86086 36 Вϋchi 530 у капілярних трубках, і вони не коригувалися. Мас-спектри записували на системі Hewlett Packard LC/MSD 1100 з використанням джерела АРСІ або електророзпилювального джерела у негативному режимі або позитивному режимі. Спектри ядерного магнітного резонансу (ЯМР) записували на Bruker АМХ-ІІ-500, обладнаному реверсивним або QNP зондом. Зразки розчиняли у дейтерованому хлороформі (CDCl3), дейтерованому ацетоні (ацетон-d6), дейтерованому метанолі (CD3OD) або дейтерованому диметилсульфоксиді (ДМСО-d6). використовуючи тетраметилсилан як внутрішній стандарт для одержання даних. Хімічні зсуви (*) виражені у мільйонних частках (м.ч.), константи взаємодії (J) виражені у Герцах (Гц), тоді як мультиплетності позначають як с для синглету, д для дублету, 2д для двох дублетів, дд для дублету дублетів, т для триплету, кв для квартету, квінт для квінтету, м для мультиплету і у шир. с для уширеного синглету. Докладний опис винаходу приклади: Конкретні приклади одержання похідних загальної формули І Наведені нижче сполуки одержують з похідних L-лізину, використовуючи методики, підсумовані у схемах 1, 1А, 2, 3, 4 і 5 даного винаходу. Приклад 1. Одержання метилового ефіру (1S,5S)-(1-{5-[(4амінобензолсульфоніл)ізобутиламіно]-6фосфоноксигексилкарбамоїл}-2,2дифенілетил)карбамінової кислоти (PL-461) Одержання зазначеної у заголовку сполуки базується на схемах 1 і 2 даного винаходу. Стадія А. Одержання (3S)-3ізобутиламіноазепан-2-ону (IV) L-a-аміно-,-капролактам (22,0г) розчиняють у холодному дихлоретані (ДХМ, 200мл). Повільно додають ізобутиральдегід (12,6г) і перемішують, доки тепло, що виділилося, не розсіється (на поверхні утворюється вода). Холодний розчин додають до 46,5г порошкоподібного NaBH(OAc)3 у ДХМ (0,5л). До даного розчину додають АсОН (70мл). Злегка каламутну суміш перемішують при 20°С протягом 4 годин. До каламутної суміші повільно додають 500мл розчину 2М NaOH, рН доводять до 11, використовуючи концентрований розчин NaOH, і потім суміш перемішують протягом додаткових 20хв. Після екстракції шар ДХМ сушать над MgSO4, фільтрують і випарюють. Одержану таким чином маслянисту речовину повільно кристалізують у нерухомому стані (27,8г, 85%) і використовують без додаткового очищення у наступній стадії. 1 H ЯМР (CDCl3): δ 0,93 (д, J=6,5, 3Н), 0,97 (д, J=6,5, 3H), 1,39 (т, J=9,8, 1H), 1,47 (м, 1Н), 1,781,65 (м, 2Н), 2,00-1,93 (м, 2Н), 2,32-2,2 (м, 2Н), 2,38 (т, J=9,7, 1Н), 3,16 (м, 3Н), 6,62 (с, 1Н (NH)). Тпл 5254°С (гексан). Невеликий зразок перетворюють в Sметилбензилсечовину, додаючи тверду речовину до розчину S-метилбензилізоціанату в MeCN. ЯМР дає 98% еі. 37 Стадія В. Одержання Na-ізобутил-Na-(4ацетамідобензолсульфоніл)-L-a-аміно-,капролактаму (V) Na-ізобутил-L-a-аміно-,-капролактам (IV) (4,1г вільної основи) розчиняють у ДХМ (200мл) і обробляють 4,0г триетиламіну, після чого 4ацетамідобензолсульфонілхлоридом (5,2г). Додають 0,1г частину диметиламінопіридину і суміш перемішують протягом 5 годин. Одержану у результаті в'язку суспензію виливають в 500мл 0,5 Μ НСl і енергійно струшують. Тверду речовину у двофазовому розчині відфільтровують і промивають холодним ацетоном, одержуючи 7,3г (87%) чистого продукту. 1 H ЯМР (ДМСО-d6): * 0,93 (д, J=6,0, ЗН), 0,96 (д, J=6,0, 3Н), 1,39 (т, J-12,0, 1H), 1,85-1,65 (м, 3Н), 2,08-2,18 (м і с, 6Н), 2,90-2,97 (м, 1Н), 3,00-3,06 (м, 2Н), 3,35 (дд. J=14,2, 8,5, 1H), 4,65 (д, J=8,7, 1H), 6,3 (с, 1H), 7,42 (д, J=8,8, 2Н), 7,6 (д, J=8,8, 2Н). Тпл. 230-233°С (ЕtOН). Стадія С. Одержання трет-бутилового ефіру (3S)-3-{[4-ацетил-третбутоксикарбоніламіно)бензолсульфоніл]ізобутиламіно}-2-оксоазепан1-карбонової кислоти (Вос активація) (VI) 4,2г Na-ізобутилNa-(4ацетамідобензолсульфоніл)-L-a-аміно-,капролактаму (V) суспендують у 30мл MeCN і короткочасно обробляють ультразвуком для подрібнення великих шматків. До даної білої суспензії додають 6,7г (3екв.) ди-трет-бутилпірокарбонату у 10мл MeCN. Суспензію перемішують магнітною мішалкою і додають 120мг порцію ДМАП. Розчин стає яскраво-жовтого кольору після декількох хвилин. ТШХ (EtOAc) виявляє 1 продукт Rf 0,9 (вихідна речовина Rf 0,4). Розчин виливають у 20мл дистильованої води і екстрагують ефіром, сушать над Na2SO4 і випарюють, одержуючи 6,90г. Зразок перекристалізовують з гексану. 1 Н ЯМР (ДМСО-d6): * 0,68 (д, J=6,0, 3Н), 0,85 (д, J=6,0, 3Н), 1.39 (с, 10Н), 1,47 (с, 9Н), 1,85-1,65 (м, 3Н), 2,15 (с, 3Н), 2,80 (кв, J=4, 1H), 3,10-3,36 (м, 2Н), 4,01 (д, J=8,0, 1Н), 4,85 (д, J=8,7, 1Н), 7,32 (д, J=8,8, 2Н), 7,87 (д, J=8,8, 2Н) Тпл. 123-124°С. Стадія D. Одержання (1S)-4-аміно-N-(5-аміно1-гідроксиметилпентил)-Nізобутилбензолсульфонаміду (VII-без захисту) (відновне розкриття циклу і зняття захисту) 3,0г порцію трет-бутилового ефіру (3S)-3-{[4ацетил-третбутоксикарбоніламіно)бензолсульфоніл]ізобутиламіно}-2-оксоазепан1-карбонової кислоти (VI, стадія С) розчиняють у 40мл ЕtOН, після чого додають 750мг NaBH4. Короткочасне нагрівання феном дає прозорий розчин. ТШХ виявляє тільки смужкувату пляму через 20хв. (ЕtOАс). Розчин концентрують до пасти, виливають у 40мл 1н NaOH і екстрагують етилацетатом, органічну фазу сушать над Na2SO4 і випарюють, одержуючи 2,8г проміжного продукту (VII); трет-бутилового ефіру (1S)-{4-[(5-третбутоксикарбоніламіно-1гідроксиметилпентил)ізобутилсульфамоїл]феніл}карбамінової кислоти (VII). 86086 38 Вказаний вище проміжний продукт розчиняють у 5мл ЕtOН і додають 5мл 12н НСl. Протягом декількох хвилин спостерігається енергійне виділення газу. Через 2год. розчин випарюють, роблять лужним концентрованим КОН і екстрагують ЕtOАс, одержуючи 1,75г білого порошку. 1 Н ЯМР (ДМСО-d6): * 0,82 (м, 6Н), 0,97-1,12 (м, 2Н), 1,15-1,30 (м, 3Н), 1,57 (м, 1H), 1,84 (м, 1H), 2,40 (т, J=7,8, 2Н), 2,75 (м, 1Н), 2,85 (м. 1Н), 3,21 (м, 1H), 3,44 (д, J=6,4, 2Н), 5,92 (ушир.с, 2Н), 6,59 (д, J=8,0, 2H), 7,39 (д, J=8,0, 2H). Стадія Е. Одержання (2S)-2метоксикарбоніламіно-3,3-дифенілпропіонової кислоти До розчину L-дифенілаланіну (241мг, 1,0ммоль) (Peptech Corp.) у 5мл 1н NaOH і 0,5мл насиченого Na2CO3 (одержаний у результаті розчин при рН 10) додають метоксикарбонілоксисукцинімід ((2,5-діоксопіролідин-1-іл)метиловий ефір вуглекислоти) (180мг, 1,1ммоль), розчинений у 5мл. Після цього реакційну суміш перемішують при кімнатній температурі протягом 2 годин. Лужний розчин один раз екстрагують ефіром (10мл) і водну фазу підкислюють 1н НСl. Дану фазу двічі екстрагують 20мл ЕtOАс і об'єднані органічні фази промивають 50мл 1н НСl. Органічну фазу сушать над Na2SO4, фільтрують і випарюють до маслянистої речовини, яку піддають твердненню, одержуючи 250мг (83%) бажаної речовини. Дане похідне використовують без додаткової обробки у наступній стадії. Стадія F. Одержання метилового ефіру (1S,5S)-(1-{5-[(4амінобензолсульфоніл)ізобутиламіно]-6гідроксигексилкарбамоїл}-2,2дифенілетил)карбамінової кислоти (PL-100) Зазначену у заголовку сполуку одержують з (1S)-4-аміно-N-(5-аміно-1-гідроксиметилпентил)-Nізобутилбензолсульфонаміду (VII-без захисту) (стадія D) і (2S)-2-метоксикарбоніламіно-3,3дифенілпропіонової кислоти (стадія Е), використовуючи процедуру сполучення з HOBt і EDAC, описану у прикладі 3 (стадія D). Кінцевий продукт одержують з виходом 67% (121мг). РХ-МС: 625,3 (М+Н)+, 95% чист. 1 H ЯМР (CD3OD): δ 0,71-0,85 (м, 2Н), 0,88 (д, J=6,3, 5Н), 0,91-0,96 (м, 2Н), 1,29-1,34 5 (м, 1H), 1,41-1,52 (м, 1H) 1,82-1,92 (м, 1H), 2,61-2,68 (м, 1Н), 2,81-2,85 (м, 2Н), 2,94-3,05 (м, 2Н), 3,38-3,40 (т, J=5,0, 1H), 3,50-3,51 (м, 1Н), 3,52 (с, 3Н), 4,28 (д, J=11,0 1H), 4,87 (д, J=11,0, 1Н), 6,69 (д, J=8,0, 2Н), 7,15-718 (м, 2Н), 7,20-7,31 (м, 6Н), 7,33 (д, J=7,9, 2Н), 7,47 (д, J=7,5, 1H). 13 С ЯМР (CD3OD): δ 20,0. 20,1, 23,3, 25,4, 28,1, 28,5, 28,9, 38,1, 40,0, 51,2, 51,6, 53,1, 57,2, 57,4, 59,5, 61,9, 62,4, 112,6, 125,7, 126,2, 126,3, 127,9, 128,1, 128,15, 128,2, 128,4, 128,7, 141,3, 141,9, 152,4, 155,9, 169,9, 172,5. Стадія G. Одержання метилового ефіру (1S,5S)-{1-[5-[(4амінобензолсульфоніл)ізобутиламіно]-6(діетоксифосфорилокси)гексилкарбамоїл]-2,2дифенілетил} карбамінової кислоти Сполуку PL-100 (продукт стадії F, 203мг, 0,325ммоль) розчиняють у суміші сухого тетрагід 39 рофурану (3мл) і 0,2мл триетилфосфату в атмосфері N2. Суміш перемішують при даній температурі протягом 15хв., після чого додають діетилхлорфосфат (0,061мл, 0,423ммоль). При 0°С додають гідрид натрію (60% у мінеральному маслі) (17мг, 0,423ммоль). Розчин перемішують протягом 1 години при 0°С і 12год. при кімнатній температурі. До даного розчину додають 20мл Amberlite XAD-2 і гранули ретельно перемішують з розчинником. До суміші додають воду з льодом 2мл і ТГФ випарюють. Потім гранули 6 разів промивають дистильованою водою 100мл, потім три рази екстрагують етилацетатом (30мл). Об'єднану фазу випарюють і залишок сушать під високим вакуумом. Неочищений продукт очищають флеш-хроматографією, використовуючи суміш етилацетат/гексан (8/2), потім EtOAc 100% як елюент. Вихід даної реакції становить 152мг, 61%. РХ-МС: 761,2 (М+Н)+, 90% чист. 1 H ЯМР (CD3OD): δ 0,68-0,75 (м, 1Η), 0,75-0,84 (м, 1H), 0,84-1,10 (м, 9Н), 1,21-1,50 (м, 8Н), 1,88 (м, 1H), 2,58-2,71 (м, 1Н), 2,80-2,89 (м, 1Н), 2,89-3,08 (м, 2Н), 3,49-3,60 (с, 3Н), 3,65-3,74 (м, 1H), 3,853,95 (м, 1H), 3,97-4,02 (м, 1Н), 4.07-4,21 (м, 4Н), 4,29 (д, J=10,8, 1H), 6,71 (д, J=8,0, 2Н), 7,10-7,20 (м, 2Н), 7,20-7,32 (м, 5Н), 7,32-7,45 (м, 3Н), 7,50 (д, J=7,5,2H), 7,86 (ушир.с, 1Н). 31 Р ЯМР(СD3OD): d 1,62. Стадія Н. Одержання метилового ефіру (1S,5S)-(1-{5-[(4амінобензолсульфоніл)ізобутиламіно]-6фосфоноксигексилкарбамоїл}-2,2дифенілетил)карбамінової кислоти (PL-461) Продукт зі стадії G, приготований вище, (152мг) розчиняють у безводному дихлорметані (3,0мл). При 0°С додають триметилсилілбромід (0,5мл). Суміш перемішують протягом 1год. при даній температурі і протягом ночі при кімнатній температурі. Розчинник випарюють і до залишку додають 0,2мл води. Додають 3мл EtOH, перемішують і випарюють. Дану стадію повторюють три рази і залишок сушать у вакуумі. Вихід 98мг 70% зазначених у заголовку похідних з даного першого прикладу. РХ-МС: 705,2 (М+Н)+, 95% чист. 1 H ЯМР (CD3OD): δ 0,65-0,73 (м, 1Н), 0,75-0,83 (м, 1Н), 0,89 (д, J=5,6, 8H), 1,27-1,38, (м, 1H), 1.424,55 (м, 1H), 1,82-1,94 (м, 1Н), 2,57-2,68 (м, 1H), 2,78-2,90 (м, 1Н), 2,91-20 3,09 (м, 2Н), 3,54 (с, 3Н), 3,60-3,72 (м, 1H), 3,87-4,05 (м, 1H), 4,00 (м, 1H), 4,29 (д, J=11,3, 1Н), 4,90 (д, J=11,4, 1H), 6,73 (д, J=8,0, 2Н), 7,13-7,22 (м, 2Н), 7,22-7,33 (м, 6Н), 7,33-7,45 (м, 2Н), 7,51 (д, J=7,5, 2H). 31 P ЯMP(CD3OD): d 2,80. Приклад 2. Одержання натрієвої солі метилового ефіру (1S,5S)-(1-{5-[(4амінобензолсульфоніл)ізобутиламіно]-6фосфоноксигексилкарбамоїл}-2,2дифенілетил)карбамінової кислоти (PL-462) 70,7мг кінцевого продукту з прикладу 1 додають до 1мл 0,1н NaOH і розбавляють 1мл дистильованої води. Даний розчин потім заморожують і піддають ліофілізації. Вихід 67,2мг (92%) бажаної речовини з чистотою 95%. 86086 40 1 Н ЯМР (CD3OD): δ 0,72-0,83 (м, 1Н), 0,90 (д, J=5,8, 9Н), 1,26-1,38 (м, 1Н), 1,53-1,65 (м, 1H), 1,88-2,00 (м, 1H), 2,60-2,70 (м, 1Н), 2,79-2,89 (м, 1H), 2,98-3,00 (м, 1Н), 3,00-3,08 (м, 1Н), 3,54 (с, 3Н), 3,58-3,71 (м, 1Н), 3,72-3,83 (м, 1H), 3,84-3,95 (м, 1Н), 4,28 (д, J=11,1, 1H), 4,91 (д, J=11,0, 1H), 6,70 (д, J=7,6, 2H), 7,12-7,22 (м, 2Н), 7,22-7,32 (м, 6Н), 7,33-7,40 (м, 2H), 7,50 (д, J=7,7, 2H). 31 Р ЯМР(СD3ОD): d 3,13. Приклад 3. Одержання метилового ефіру (1S,5S)-(1-{5-[(4амінобензолсульфоніл)ізобутиламіно]-6фосфоноксигексилкарбамоїл}-2-нафталін-2ілетил)карбамінової кислоти (PL-507) Одержання зазначеної у заголовку сполуки базується на схемі 2 даного винаходу. Схема А. Одержання трет-бутилового ефіру (1S)-(4-{[5-тpeт-бутоксикарбоніламіно-1(діетоксифосфорилоксиметил)пентил]ізобутилсульфамоїл}феніл)-карбамінової кислоти (VIII) 2,00г (3,7ммоль) трет-бутилового ефіру (1S){4-[(5-тpeт-бутоксикарбоніламіно-1гідроксиметилпентил)ізобутилсульфамоїл]феніл}карбамінової кислоти (VII) (приклад 1, стадія D) розчиняють у суміші 0,63мл триетилфосфату і 10мл ТГФ при 0°С в інертній атмосфері аргону. Додають 0,63мл (4,44ммоль) діетилхлорфосфату і потім порціями додають 0,25г (6,2ммоль) NaH 60% у маслі. Суміші дають нагрітися до кімнатної температури і залишають перемішуватися протягом 2год. (РХ-МС показує завершення після 1год.). До даного розчину додають 20мл смоли Amberlite XAD-2, суспензію ретельно перемішують і додають до 200мл води з льодом. Після перемішування протягом 15хв. суспензію смоли відфільтровують і смолу декілька разів промивають дистильованою водою (500мл). Бажаний продукт десорбують зі смоли ацетоном (5 х 50мл), ЕtOАс (5 x 50мл), потім органічну фазу сушать над Na2SO4. Після випарювання розчинника одержують 2,66г (89%) прозорої маслянистої речовини. Неочищений продукт містить фракцію з двома діетилфосфатами, використовують без додаткової обробки у наступній стадії. 1 H ЯМР (CD3OD): δ 0,91 (д, J=6,3, 6Н), 1,111,21 (м, 2Н), 1,33 (т, J=6,9, 10H), 1,43 (с, 9Н), 1,53 (с, 10Н), 1,90-1,97 (м, 1Н), 2,88-2,96 (м, 3Н), 2,963,04 (м, 1Н), 3,81-3,90 (м, 1H), 3,91-3,99 (м, 1Н), 4,01-4,14 (м, 4Н), 7,61 (д, J=8,3, 2Н), 7,72 (д, J=8,4,2H). 31 P ЯMP(CD3OD): d 1,59. Стадія В. Одержання (діетил)(6-аміно-2-[(4амінобензолсульфоніл)ізобутиламіно]гексилового) ефіру (2S)-фосфорної кислоти (IX) Неочищений продукт, одержаний у попередній стадії (VIII, 2,66г) розчиняють в 12мл ЕtOН. Додають 4мл HClконц. і короткочасно нагрівають до 70°С, потім залишають при кімнатній температурі протягом 3год. Розчинник випарюють і залишок розтирають у 50мл ефіру. Потім в'язкий залишок розчиняють у 3мл води з льодом і рН коригують до 12 50% NaOH. Одержану в'язку суспензію екстрагують EtOAc (3 х 50мл) і органічну фазу сушать над Na2SО4. Після відфільтровування агента, що 41 осушує, органічну фазу відкачують, одержуючи 1,84г (98%) бажаного продукту (IX). РХ-МС: 480,2 (М+Н)+, 95% чист. 1 Н ЯМР (CD3OD): δ 0,91 (с, 6Н), 1,11-1,26 (м, 3Н), 1,28-1,43 (м, 8Н), 1,45-1,51 (м, 1Н), 1,52-1,61 (м, 1Н), 1,89-1,96 (м, 1Н), 2,56 (т, J=6,7, 2Н), 2,852,91 (м, 1Н), 2,98-3,11 (м, 1Н), 3,79-3,99 (м, 1Н), 3,94 (д, J=5,3, 1Н), 4,09-4,11 (м, 4Н), 6,69 (д, J=7,9, 2H), 7,50 (д, J=7,9, 2H). 31 P ЯMP(CD3OD): d 1,61 Стадія С. Одержання (2S)-2метоксикарбоніламіно-3-нафталін-2-ілпропіонової кислоти (або L-Moc-2-нафтилаланіну) До розчину L-2-нафтилаланіну (215мг, 1ммоль) (Peptech Corp.) в 5мл 1н NaOH і 0,5мл насиченого Na2CO3 (рН одержаного у результаті розчину 10) додають метоксикарбонілоксисукцинімід (187мг, 1,1ммоль), розчинений у 5мл. Після цього реакційну суміш перемішують при кімнатній температурі протягом 2год. Лужний розчин один раз екстрагують ефіром (10мл) і водну фазу підкислюють 1н НСl. Дану фазу двічі екстрагують 20мл EtOAc і об'єднані органічні фази промивають 50мл 1н НСl. Органічну фазу сушать над Na2SO4, фільтрують і випарюють до маслянистої речовини, яку піддають твердненню, одержуючи 200мг (73%) бажаної речовини. Дану проміжну речовину (яку називають N-заміщеною амінокислотою) використовують без додаткової обробки у наступній стадії. Стадія D. Одержання метилового ефіру (1S,5S)-(1-{5-[(4амінобензолсульфоніл)ізобутиламіно]-6фосфоноксигексилкарбамоїл}-2-нафталін-2ілетил)карбамінової кислоти (PL-507) 100мг L-Moc-2-нафтилаланіну (стадія С) активують 100мг EDAC і 57мг HOBt в 1,5мл ДМФА протягом 30 хвилин. Потім додають 100мг (6-аміно-2[(4амінобензолсульфоніл)ізобутиламіно]гексил)(діетилового) ефіру фосфорної кислоти (стадія В) і залишають перемішуватися при кімнатній температурі протягом 1год. До розчину ДМФА додають 40мл 1М К2СО3 і залишають протягом 10хв. Потім додають 50мл ЕtOАс і потім суміш енергійно перемішують. Здійснюють відділення фази ЕtOАс, після чого потрібна екстракція один раз 5% лимонною кислотою (50мл), потім 3 рази водою (50мл) і, нарешті, насиченим розчином солі. Органічну фазу відокремлюють і випарюють. Залишок відбирають у 50мл ДХМ і повторно випарюють. Залишок знову відбирають у 50мл ДХМ і додають 0, мл TMSBr. Розчин залишають на ніч (16год.). ДХМ відкачують і додають охолоджений на льодяній бані розчин МеОН:Вода 1:1, короткочасно перемішують і відкачують. Залишок розтирають в ефірі, потім розчиняють в 1н NaOH. Прозорий розчин екстрагують ефіром і водну фазу підкислюють 6н НСl. Потім фільтруванням збирають білий осад і сушать у вакуумі протягом ночі. Вихід 88мг зазначеної у заголовку сполуки. РХ-МС: 679,8 (М+Н)+, 95% чист. 1 Н ЯМР (CD3OD): δ 0,89-0,98 (м, 8Н), 1,15 (м, 2Н), 1,35 (м, 1Н), 1,45 (м, 1Н), 1,88 (м, 1Н), 2,84 (м, 2Н), 2,98 (м, 1Н), 3,01 (м, 2Н), 3,24 (м, 1Н), 3,56 (с, 86086 42 3Н), 3,60 (м, 1Н), 3,81 (м, 1H), 3,99 (м, 1H), 4,39 (т, J=6,8, 1Н), 6.91 (д, J=8,0, 2Н), 7,34 (д, J=8,0, 1H), 7,45 (м, 2Н), 7,58 (д, J=8,0,2H), 7,66 (с, 1H), 7,707,82 (м, 3Н). 31 P ЯMP(CD3OD): d 2,56 Приклад 4. Одержання моно-(2-[(4амінобензолсульфоніл)ізобутиламіно]-6-{2[(морфолін-4-карбоніл)аміно]-3-нафталін-1ілпропіоніламіно}гексилового ефіру (2S,2S)фосфорної кислоти (PL-498) Стадія А. Одержання (2S)-2-[(морфолін-4карбоніл)аміно]-3-нафталін-1-ілпропіонової кислоти До розчину L-1-нафтилаланіну (215мг, 1ммоль) (Peptech Corp.) в 5мл 1н NaOH і 0,5мл насиченого Na2CO3 (pH одержаного у результаті розчину 10) додають морфолін-4-карбонілхлорид (150мг, 1,0ммоль), розчинений у 5мл. Після цього, реакційну суміш перемішують при кімнатній температурі протягом 2год. Лужний розчин один раз екстрагують ефіром (10мл) і водну фазу підкислюють 1н НСl. Дану фазу двічі екстрагують 20мл ЕtOАс і об'єднані органічні фази промивають 50мл 1н НСl. Органічну фазу сушать над Na2SO4, фільтрують і випарюють до маслянистої речовини, яку піддають твердненню, одержуючи 125мг (38%) бажаної речовини. Дану проміжну сполуку використовують без додаткової обробки у наступній стадії. Стадія В. Одержання моно-(2-[(4амінобензолсульфоніл)ізобутиламіно]-6-{2[(морфолін-4-карбоніл)аміно]-3-нафталін-1ілпропіоніламіно}гексилового ефіру (2S,2S)фосфорної кислоти (PL-498) Дану сполуку синтезують також як у методі одержання продукту з прикладу 3 (стадія D) з використанням 100мг (2S)-2-[(морфолін-4карбоніл)аміно]-3-нафталін-1-ілпропіонової кислоти (стадія А даного прикладу). Одержаний у результаті осаджений залишок додатково очищають препаративною ВЕРХ з оберненою фазою. Вихід 41мг кінцевої сполуки. РХ-МС: 734,8 (М+Н)+, 95% чист. 1 H ЯМР (CD3OD): δ 0,83-0,98 (м, 8Н), 1,00-1,25 (м, 4Н), 1,45-1,52 (м, 1Н), 1,52-1,66 (м, 1Н), 1,881,99 (м, 1Н), 2,77-2,92 (м, 2Н), 2,98-3,16 (м, 3Н), 3,40-3,49 (м, 1H), 3,50-3,56 (м, 6Н), 3,67-3,69 (м, 1Н), 3,81-3,89 (м, 1H), 3,99-4,05 (м, 1Н), 4,59 (т, J=6,0, 1H), 6,75 (д, J=8,0, 2Н), 7,30-7,60 (м, 7Н), 7,75 (д, J=8,0, 1H), 7,90 (д, J=7,8, 1H), 8,23 (д, J=7,8 2H). 31 P ЯMP(CD3OD): d 2,71 Приклад 5. Одержання моно-{6-(2ацетиламіно-3,3-дифенілпропіоніламіно)-2-[(4амінобензолсульфоніл)ізобутил-аміно] гексилового}ефіру (2S,2S)-фосфорної кислоти (PL-504) Стадія А. Одержання (2S)-2-ацетиламіно-3,3дифенілпропіонової кислоти До розчину L-дифенілаланіну (100мг, 0,4ммоль) (Peptech Corp.) в 5мл 1н NaOH і 0,5мл насиченого Na2CO3 (pH одержаного у результаті розчину 10) додають ацетилхлорид (0,5ммоль), розчинений у 5мл. Після цього реакційну суміш перемішують при кімнатній температурі протягом 2год. Лужний розчин один раз екстрагують ефіром 43 (10мл) і водну фазу підкислюють 1н НСl. Дану фазу двічі екстрагують 20мл EtOAc і об'єднані органічні фази промивають 50мл 1н НСl. Органічну фазу сушать над Na2SO4, фільтрують і випарюють до маслянистої речовини, яку піддають твердненню, одержуючи 70мг (60%) бажаної речовини. Дану неочищену проміжну сполуку використовують без додаткової обробки у наступній стадії. Стадія В. Одержання моно-{6-(2-ацетиламіно3,3-дифенілпропіоніламіно)-2-[(4амінобензолсульфоніл)ізобутиламіно]гексилового} ефіру (2S,2S)-фосфорної кислоти (PL-504) Дану сполуку синтезують так само як у методі одержання продукту з прикладу 3 (стадія D) з використанням 100мг (2S)-2-ацетиламіно-3,3дифенілпропіонової кислоти (стадія А даного прикладу). Кінцевий продукт одержують з виходом 30% (30мг). РХ-МС: 689,3 (М+Н)+, 95% чист. 1 H ЯМР (CD3OD): δ 0,77-1,04 (м, 9Н), 1,10-1,17 (м, 1H), 1,23-1,49 (м, 1H), 1,46-1,57 (м, 1Н), 1,78 (с, 3Н), 1,88-1,99 (м, 1H), 2,80-2,92 (м, 2Н), 2,92-3,08 (м, 2Н), 3,63-3,75 (м, 1Н), 3,79-3,95 (м, 1H), 4,00 (м, 1Н), 4,34 (д, J=11,3, 1Н), 5,19-5,28 (м, 1H), 6,776,85 (м, 2Н), 7,10-7,20 (м, 2Н), 7,27-7,33 (м, 6Н), 7,32-7,41 (м, 2Н), 7,49-7,62 (м, 2Н). 31 Р ЯМР (CD3OD): δ 2,70 Приклад 6. Одержання метилового ефіру (1S,5S)-(1-{5-[(4-аміно-3фторбензолсульфоніл)ізобутиламіно]-6фосфоноксигексилкарбамоїл}-2,2дифенілетил)карбамінової кислоти (PL-515) Перша методика: Одержання зазначеної у заголовку сполуки базується на схемі 3 даного винаходу. Стадія А. Одержання метилового ефіру (1-{5[(4-аміно-3-фторбензолсульфоніл)ізобутиламіно]6-гідроксигексилкарбамоїл}-2,2дифенілетил)карбамінової кислоти (X) (PL-337) Продукт з прикладу 1, стадія F (0,624г, 1ммоль) розчиняють у 5мл MeCN при 24°С. Однією порцією додають SelectFluor 0,35г (1ммоль) і перемішують протягом 1год. Додають 1мл води і розчин впорскують безпосередньо у препаративну ВЕРХ з оберненою фазою. Продукт збирають і піддають ліофілізації, одержуючи вихід білої твердої речовини 250мг (38%). РХ-МС: 643,3 (М+Н)+, 99% чист. 1 Н ЯМР (MeOD): δ 0,71-0,85 (м, 2Н), 0,88 (д, J=6,3, 6Н), 0,91-0,96 (м, 2Н), 1,21-1,29 (м, 1Н). 1,41-1,52 (м, 1Н) 1,82-1,92 (м, 1Н), 2,61-2,68 (м, 1Н), 2,81-2,85 (м, 2Н), 2,94-3,05 (м, 2Н), 3,38-3,40 (т, J=5, 1Н), 3,49-3,52 (м, 5Н), 4,28 (д, J=10, 1Н), 4,87 (д, J=10, 1Н) 6,90 (τ, J=8,3, 1Н), 7,20 (м, 2H), 7,28 (м, 3Н), 7,33 (м, 3Н), 7,39 (м, 4Н). Стадія В. Одержання метилового ефіру (1S,5S)-{1-[5-[(4-аміно-3фторбензолсульфоніл)ізобутиламіно]-6(діетоксифосфорилокси)гексилкарбамоїл]-2,2дифенілетил}карбамінової кислоти Продукт зі стадії А фосфорилують хлордіетилфосфатом, дотримуючись процедури, описаної у прикладі 1, стадія G. Виходи 157мг, 68%. РХ-МС: 779,3 (М+Н)+, 95% чист. 86086 44 1 Н ЯМР (CD3OD): δ 0,82 (м, 1Н), 0,92 (д, J=6,2, 8Н), 0,96 (м, 3Н), 1,36 (д, J=3,7, 6Н), 1,90 (м, 1Н), 2,69 (м, 1Н), 2,89 (м, 1Н), 2,98 (м, 2Н), 3,56 (с, 3Н), 3,74 (м, 1Н), 3,93 (м, 1Н), 4,03 (м, 1Н), 4,12 (кв, J=7,5 і 14,8,4Н), 4,32 (д, J=11,4, 1Н), 4,92 (д, J=11,4, 1Н), 6,90 (т, J=8,3, 1Н), 7,20 (м, 2Н), 7,28 (м, 3Н), 7,33 (м, 3Н), 7,39 (м, 4Н). 31 P ЯMP(CD3OD): d 1,65 Стадія С. Одержання метилового ефіру (1S,5S)-(1-{5-[(4-аміно-3фторбензолсульфоніл)ізобутиламіно]-6фосфоноксигексилкарбамоїл}-2,2дифенілетил)карбамінової кислоти (XI) (PL-515) Зняття захисту здійснюють, використовуючи процедуру, описану у прикладі 1, стадія G. Виходи 101мг. РХ-МС: 723,2 (М+Н)+, 95% чист. 1 Н ЯМР (CD3OD): 0,65-0,77 (м, 1Н). 0,77-0,85 (м, 1Н), 0,85-1,05 (м, 9Н), 1,25-1,39 (м, 1Н), 1.401,52 (м, 1Н), 1,82-1,98 (м, 1Н), 2,58-2,72 (м, 1Н), 2,82-2,92 (м, 1Н), 2,92-3,05 (м, 2Н), 3,54 (с, 3Н), 3,64-3,75 (м, 1Н), 3,80-3,92 (м, 1Н), 3,91-4,04 (м, 1Н), 4,29 (д, J=11,4, 1Н), 7,19 (т, J=6,6, 1Н), 7,137,21 (м, 2Н), 7,22-7,33 (м, 6Н), 7,34-7,38 (м, 2Н), 7,39-7,48 (м, 2Н) 31 Р ЯМР (CD3OD): δ 2,74 Друга методика: Одержання зазначеної у заголовку сполуки базується на схемі 4 даного винаходу. Стадія А. Одержання метилового ефіру (1S,5S)-(1-{5-[(4амінобензолсульфоніл)ізобутиламіно]-6фосфоноксигексилкарбамоїл}-2,2дифенілетил)карбамінової кислоти (PL-461). (2S)-2-метоксикарбоніламіно-3,3дифенілпропіонову кислоту ((приклад 1, стадія Е) 0,9г, 3ммоль) активують у ДМФА (5мл) за допомогою EDAC (1,7г, 9ммоль) і HOBt (1,2г, 9ммоль). До даного розчину додають 1,17г (діетил)(6-аміно-2[(4амінобензолсульфоніл)ізобутиламіно]гексилового) ефіру (2S)-фосфорної кислоти (IX) (приклад 3, стадія В) і суміш перемішують протягом 3год. Потім додають 20г Amberlite XAD-2 і гранули залишають намокати протягом 10хв. Смолу переносять на скляний фільтр і ретельно промивають дистильованою водою (400мл) і 200мл 1М NaHCO3. Потім гранули промивають 4 x 50мл порціями МеОН, потім EtOAc 200мл. Органічну фазу випарюють. Залишок адсорбують на силікагелі і пропускають через коротку силікагелеву колонку (ЕtOАс), одержуючи 2,4г (83%) білої твердої речовини після випарювання. 1 H ЯМР ідентичний прикладу 1, стадія Н. Стадія В. Одержання метилового ефіру (1S,5S)-{1-[5-[(4-аміно-3фторбензолсульфоніл)ізобутиламіно]-6(діетоксифосфорилокси)гексилкарбамоїл]-2,2дифенілетил}карбамінової кислоти (XII) Продукт з наведеної вище стадії А, метиловий ефір (1S,5S)-(1-{5-[(4амінобензолсульфоніл)ізобутиламіно]-6фосфоноксигексилкарбамоїл}-2,2дифенілетил)карбамінової кислоти (0,555г, 0,73ммоль) розчиняють у 5мл MeCN. Додають 45 Selectfluor (0,26г, 0,7ммоль) і суміш перемішують протягом 30хв. Суміш очищають препаративною ВЕРХ з оберненою фазою і піддають ліофілізації, одержуючи 278мг (вихід 48%) білої твердої речовини. 1 Н ЯМР ідентичний попередньому опису, дивися першу методику вище. Стадія С. Одержання метилового ефіру (1S,5S)-(1-{5-[(4-аміно-3фторбензолсульфоніл)ізобутиламіно]-6фосфоноксигексилкарбамоїл}-2,2дифенілетил)карбамінової кислоти (XIII, у даному конкретному випадку являє собою сполуку XI) (PL515) Процедура, що дає дане похідне, є такою, як описано у стадії зняття захисту для описаної вище методики. Виходи 139мг 70% після ВЕРХ з оберненою фазою. 1 Н ЯМР ідентичний попередньому опису, дивися першу методику вище. Приклад 7. Одержання 2-[(4амінобензолсульфоніл)ізобутиламіно]-6-(2метоксикарбоніламіно-3,3дифенілпропіоніламіно)гексилового ефіру (2S,2S)оцтової кислоти (PL-521) Одержання зазначеного у заголовку похідного базується на схемі 5 даного винаходу. Стадія А. Одержання 6-третбутоксикарбоніламіно-2-[(4-третбутоксикарбоніламінобензолсульфоніл)ізобутиламіно]гексилового ефіру (2S)оцтової кислоти (XIV, R1A=CH3) До перемішуваного розчину трет-бутилового ефіру (1S)-{4-[(5-трет-бутоксикарбоніламіно-1гідроксиметилпентил)ізобутилсульфамоїл]феніл}карбамінової кислоти (проміжний продукт (VII) з прикладу 1, стадія D, 97мг, 0,18ммоль) у безводному СН2Сl2 (3мл) додають Ν,Ν-диметиламінопіридин (22мг, 0,18ммоль) і оцтовий ангідрид (0,014мл, 0,18ммоль). Суміш перемішують при кімнатній температурі протягом 1 години. Розчинник випарюють. Додають етилацетат (50мл) і органічний шар промивають водою (30мл), потім сушать над Na2SO4 і концентрують. Залишок очищають флеш-хроматографією, елююючи етилацетатом. Одержаний вихід є кількісним (100мг). РХ-МС: 586,2 (М+Н)+, 95% чистий. Стадія В. Одержання 6-аміно-2-[(4амінобензолсульфоніл)ізобутил-аміно]гексилового ефіру (2S)-оцтової кислоти (XV, R1A=CH3) Дане похідне одержують з 6-третбутоксикарбоніламіно-2-[(4-третбутоксикарбоніламінобензолсульфоніл)ізобутиламіно]гексилового ефіру (2S)оцтової кислоти, як описано у прикладі 15, стадія В. Тверду речовину жовтого кольору (66мг) використовують у наступній реакції без очищення. РХ-МС: 386,2 (М+Н)+, 95% чист. Стадія С. Одержання 2-[(4амінобензолсульфоніл)ізобутиламіно]-6-(2метоксикарбоніламіно-3,3дифенілпропіоніламіно)гексилового ефіру (2S,2S)оцтової кислоти (XVI, R1A=CH3) (PL-521) 86086 46 Дане похідне одержують з 6-аміно-2-[(4амінобензолсульфоніл)ізобутил-аміно]гексилового ефіру (2S)-оцтової кислоти (продукт зі стадії В), як описано у прикладі 15, стадія В. Кінцевий продукт очищають флеш-хроматографією сумішшю елюентів гексан/етилацетат (2/8). Одержують жовту тверду речовину з виходом 70% (70мг). РХ-МС: 667,3 (М+Н)+, 95% чист. 1 H ЯМР (ацетон-d6): δ 0,85-0,97 (м, 12Н), 1,211,41 (м, 2Н), 1,88-2,00 (с, 3Н), 2,59-2,69 (м, 1H), 2,83-2,90 (м, 1H), 2,90-3,01 (м, 1H), 3,01-3,10 (ушир.с, 1H), 3,45-3,60 (с, 3Н), 3,70-3,80 (м, 1H), 3,93-4,00 (м, 1Н), 4,00-4,11 (м, 1H), 4,38-4,45 (д, J=11,0 1H), 4,89-4,98 (т, J=10,0, 1Н), 5,43-5,58 (ушир.с, 1Н), 6,28-6,48 (д, J=8,9, 1H), 6,72-6,83 (д, J=8,0, 2H), 6,85-6,93 (ушир.с, 1Н), 7,12-7,22 (τ, J=7,4, 1Н), 7,21-7,31 (д, J=7,0, 4H), 7,31-7,45 (м, 5H), 7,48-7,57 (д, J=8,0, 2H). Приклад 8. Одержання 2-[(4амінобензолсульфоніл)ізобутиламіно]-6-(2метоксикарбоніламіно-3,3дифенілпропіоніламіно)гексилового ефіру (2S,2S)нікотинової кислоти (PL-520) Стадія А. Одержання 6-третбутоксикарбоніламіно-2-[(4-третбутоксикарбоніламінобензолсульфоніл)ізобутиламіно]гексилового ефіру (2S)нікотинової кислоти (XIV, R1A=3-піридил) Трет-бутиловий ефір (1S)-{4-[(5-третбутоксикарбоніламіно-1гідроксиметилпентил)ізобутилсульфамоїл]феніл}карбамінової кислоти (проміжний продукт (VII) з прикладу 1, стадія D, 130мг, 0,24ммоль) розчиняють у безводному ДМФА (1мл) і обробляють 0,066мл (0,48ммоль) триетиламіну, після чого EDC (120мг, 0,65ммоль), HOBt (88мг, 0,65ммоль) і нікотиновою кислотою (27мг, 0,22ммоль). Суміш перемішують протягом ночі при кімнатній температурі. Продукт екстрагують сумішшю етилацетату (40мл) і води (40мл). Органічну фазу відокремлюють і сушать над Na2SO4, потім випарюють, одержуючи 200мг неочищеного продукту. Дану сполуку очищають флеш-хроматографією з етилацетатом як елюентом. Одержують прозору маслянисту речовину з виходом 100% (150мг). РХ-МС: 649,3 (М+Н)+, 95% чист. 1 Н ЯМР (ацетон-d6): δ 0,90-1,14 (д, J=5,9, 6Н), 1,31-1,42 (м, 2Н), 1,48 (с, 9Н), 1,51-1,55 (м, 2Н), 1,59 (с, 9Н), 1,62-1,69 (м, 1Н), 1,72-1,83 (м, 1H), 3,00-3,11 (м, 2Н), 3,11-30 3,17 (м, 1H), 3,19-3.27 (м, 1Н), 4,15-4,24 (м, 1H), 4,35-4,44 (т, J=9,1, 1H), 4,504,58 (дд, J=4,4 і 11,5, 1H), 5,89-5,99 (ушир.с, 1H), 7,53-7,60 (м, 1Н), 7,70-7,77 (д, J=8,2, 2Н), 7,80-7,87 (д, J=8,2, 2Н), 8,24-8,31 (д, 5=1,3, 1H), 8,75-8,82 (м, 1Н), 8,82-8,88 (м, 1Н), 9,12-9,18 (ушир.с, 1Н). Стадія В. Одержання 6-аміно-2-[(4амінобензолсульфоніл)ізобутил-аміно]гексилового ефіру (2S)-нікотинової кислоти (XV, R1А-3-піридил) Продукт зі стадії А, 6-третбутоксикарбоніламіно-2-[(4-третбутоксикарбоніламінобензолсульфоніл)ізобутиламіно]гексиловий ефір (2S)нікотинової кислоти (150мг, 0,23ммоль) розчиняють у СН2СІ 2 (5мл) і додають трифтороцтову кис 47 лоту (1мл). Суміш перемішують протягом 2 годин при кімнатній температурі. Розчинник випарюють і залишок екстрагують сумішшю етилацетату (40мл) і NaOH 1М (40мл) (рН=10). Органічну частину відокремлюють, сушать над Na2SO4 і потім випарюють. Залишок (100мг) використовують для наступної реакції без додаткового очищення. Вихід кількісний. РХ-МС: 449,3 (М+Н)+, 95% чист. Стадія С. Одержання 2-[(4амінобензолсульфоніл)ізобутиламіно]-6-(2метоксикарбоніламіно-3,3дифенілпропіоніламіно)гексилового ефіру (2S,2S)нікотинової кислоти (PL-520) Продукт зі стадії В, 6-аміно-2-[(4амінобензолсульфоніл)ізобутил-аміно]гексиловий ефір (2S)-нікотинової кислоти (100мг, 0,22ммоль) розчиняють у безводному ДМФА (2мл) і обробляють 0,062мл (0,45ммоль) триетиламіну, а потім EDC (100мг, 0,56ммоль), HOBt (75мг, 0,56ммоль) і (2S)-2-метоксикарбоніламіно-3,3дифенілпропіоновою кислотою (56мг, 0,19ммоль). Дану суміш перемішують протягом ночі при кімнатній температурі. Продукт екстрагують сумішшю етилацетату (40мл) і води (40мл). Органічний шар відокремлюють, сушать над Na2SO4 і потім випарюють, одержуючи 160мг неочищеної маслянистої речовини. Залишок очищають флешхроматографією з сумішшю елюентів гексан/етилацетат (2/8). Зазначену у заголовку сполуку одержують у вигляді прозорої маслянистої речовини з виходом 20% (25мг). РХ-МС: 730,2 (М+Н)+, 95% чист. 1 H ЯМР (ацетон-d6): δ 0,80-0,97 (м, 9Н), 0,971,13 (м, 2Н), 1,26-1,40 (м, 1Н), 1,40-1,57 (м, 1H), 2,61-2,73 (м, 1Н), 2,86-2,98 (м, 2Н), 3,00-3,17 (м, 2Н), 3,45-3,59 (с, 3Н), 3,91-4,00 (м, 1H), 4,24-4,34 (м, 1Н), 4,34-4,47 (м, 2Н), 4,90-4,99 (т, J=9,7, 1H), 6,35-6,44 (м, 1H), 6,68-6,79 (д, J=7,9, 1Н), 6,91-7,00 (ушир.с, 1H), 7,13-7,22 (м, 2Н), 7,22-7,31 (м, 3Н), 7,35-7,48 (м, 4Н), 7,49-7,64 (м, 2Н), 7,75-7,84 (м, 1Н), 8,25-8,36 (м, 1H), 8,76-8,88 (ушир.с, 1H), 9,129,26 (ушир.с, 1Н). Приклад 9. Одержання 2-[(4амінобензолсульфоніл)ізобутиламіно]-6-(2метоксикарбоніламіно-3,3дифенілпропіоніламіно)гексилового ефіру (2S,2S)диметиламінооцтової кислоти (PL-534) Стадія А. Одержання 6-третбутоксикарбоніламіно-2-[(4-третбутоксикарбоніламінобензолсульфоніл)ізобутиламіно]гексилового ефіру (2S)диметиламінооцтової кислоти (XIV, R1A=(CH3)2NCH2-) Дану зазначену у заголовку сполуку одержують з трет-бутилового ефіру (1S)-{4-[(5-третбутоксикарбоніламіно-1гідроксиметилпентил)ізобутилсульфамоїл]феніл}карбамінової кислоти (проміжний продукт (VII) з прикладу 1, стадія D), як описано у прикладі 15, стадія А, з використанням Ν,Νдиметилгліцину. Одержують прозоре масло з виходом 100% (150мг). РХ-МС: 629,3 (М+Н)+, 95% чист. 86086 48 1 H ЯМР (ацетон-d6): δ 0,81-0,95 (д, J=6,1, 6Н), 1,18-1,30 (м, 2Н), 1,32-1,43 (с, 9Н), 1,43-1,52 (с, 8Н), 1,52-1,62 (м, 1H), 1,93-2,00 (м, 1H), 2,19-2,29 (с, 4Н), 2,69-2,80 (м, ,4Н), 2,90-3,05 (м, 6Н), 3,603,65 (м, 1Н), 3,85-3,97 (м, 1H), 3,98-4,08 (м, 1H), 4,08-4,14 (м, 1Н), 5,78-5,88 (м, 1Н), 7,68-7,80 (м, 3Н), 8,80-8,88 (ушир.с, 1H). Стадія В. Одержання 6-аміно-2-[(4амінобензолсульфоніл)ізобутил-аміно]гексилового ефіру (2S)-диметиламінооцтової кислоти (XV, R1A=(CH3)2NCH2-) Зазначене у заголовку похідне одержують з 6трет-бутоксикарбоніламіно-2-[(4-третбутоксикарбоніламінобензолсульфоніл)ізобутиламіно]гексилового ефіру (2S)диметиламінооцтової кислоти, як описано у прикладі 15, стадія В. Кінцевий продукт (100мг) використовують без додаткової обробки у наступній стадії. РХ-МС: 429,3 (М+Н)+, 90% чист. Стадія С. Одержання 2-[(4амінобензолсульфоніл)ізобутиламіно]-6-(2метоксикарбоніламіно-3,3дифенілпропіоніламіно)гексилового ефіру (2S,2S)диметиламінооцтової кислоти (PL-534) Дану зазначену у заголовку сполуку одержують з 6-аміно-2-[(4амінобензолсульфоніл)ізобутиламіно]гексилового ефіру (2S)-диметиламіно-оцтової кислоти, як описано у прикладі 15, стадія С. Неочищений продукт очищають препаративною РХ. Кінцеву сполуку одержують з виходом 10% (10мг). РХ-МС: 710,3 (М+Н)+, 92% чист. 1 H ЯМР (ацетон-d6): δ 0,81-0,98 (м, 12Н), 1,141,30 (м, 2Н), 1,31-1,45 (м, 1Н), 2,58-2,77 (м, 2Н), 2,79-2,90 (м, 2Н), 3,42-3,56 (с, 3Н), 3,75-3,85 (м, 1H), 3,99-4,17 (м, 3Н). 4,23-4,35 (м, 1H), 4,36-4,45 (м, 1Н), 4,86-4,96 (м, 1H), 6,33-6,42 (м, 1H), 6,746,83 (м, 1Н), 6,85-6,90 (м, 1H), 7,12-7,22 (м, 3Н), 7,23-7,31 (м, 4Н), 7,31-7,44 (м, 5Н), 7,47-7,55 (м, 1H), 7,73-7,80 (м, 1H). Приклад 10. Одержання 2-[(4амінобензолсульфоніл)ізобутиламіно]-6-(2метоксикарбоніламіно-3,3дифенілпропіоніламіно)гексилового ефіру (2S,2S)2-аміно-3-метилмасляної кислоти (PL-530) Стадія А. Одержання 6-третбутоксикарбоніламіно-2-[(4-третбутоксикарбоніламінобензолсульфоніл)ізобутиламіно]гексилового ефіру (2S)-2бензилоксикарбоніламіно-3-метилмасляної кислоти (XIV, R1A=(CH3)2CHCH(NH2)-) Дану зазначену у заголовку сполуку одержують з трет-бутилового ефіру (1S)-{4-[(5-третбутоксикарбоніламіно-1гідроксиметилпентил)ізобутилсульфамоїл]феніл}карбамінової кислоти (проміжний продукт (VII) з прикладу 1, стадія D), як описано у прикладі 15, стадія А з використанням (2S)-2бензилоксикарбоніламіно-3-метилмасляної кислоти. Неочищений продукт очищають флешхроматографією, елююючи сумішшю гексан/етилацетат (1/1). Одержаний вихід дорівнює 100% (150мг). РХ-МС: 777,3 (М+Н)+, 95% чист. 49 1 H ЯМР (ацетон-d6): δ 0,80-1,00 (м. 14), 1,131,28 (с, 2Н), 1,30-1,44 (с, 11Н), 1,45-1,56 (с, 10), 1,58-1,67 (м, 1H), 2,87-3,04 (м, 4Н), 3,84-3,97 (м, 1H), 3,97-4,12 (м, 2Н), 4,12-4,21 (м, 1Н), 4,99-5,14 (м, 2Н), 5,78-5,89 (м, 1H), 6,38-6,52 (м, 1Н), 7,247,34 (м, 1H), 7.34-7,41 (м, 2Н), 7,65-7,83 (м, 4Н), 8,77-8,86 (м, 1Н). Стадія В. Одержання 6-аміно-2-[(4амінобензолсульфоніл)ізобутил-аміно]гексилового ефіру (2S)-бензилоксикарбоніламіно-3метилмасляної кислоти (XV, R1A=(CH3)2CHCH(NH2)-) Дане похідне одержують з 6-третбутоксикарбоніламіно-2-[(4-третбутоксикарбоніламінобензолсульфоніл)ізобутиламіно]гексилового ефіру (2S)-2бензилоксикарбоніламіно-3-метилмасляної кислоти (продукт зі стадії А), як описано у прикладі 15, стадія В. Кінцеву сполуку одержують з кількісним виходом (110мг) і використовують у наступній стадії без очищення. РХ-МС: 577,3 (М+Н)+, 90% чистий. Стадія С Одержання 2-[(4амінобензолсульфоніл)ізобутиламіно]-6-(2метоксикарбоніламіно-3,3дифенілпропіоніламіно)гексилового ефіру (2S,2S)2-бензилоксикарбоніламіно-3-метилмасляної кислоти Зазначену у заголовку сполуку одержують з 6аміно-2-[(4амінобензолсульфоніл)ізобутиламіно]гексилового ефіру (2S)-бензилоксикарбоніл-аміно-3метилмасляної кислоти (продукт зі стадії В), як описано у прикладі 15, стадія С. Прозору маслянисту речовину одержують з виходом 86% (120мг). РХ-МС: 858,3 (М+Н)+, 95% чистий. Стадія D. Одержання 2-[(4амінобензолсульфоніл)ізобутиламіно]-6-(2метоксикарбоніламіно-3,3дифенілпропіоніламіно)гексилового ефіру (2S,2S)2-аміно-3-метилмасляної кислоти (PL-530) До перемішуваного розчину 2-[(4амінобензолсульфоніл)ізобутиламіно]-6-(2метоксикарбоніламіно-3,3дифенілпропіоніламіно)гексилового ефіру (2S,2S)2-бензилоксикарбоніламіно-3-метилмасляної кислоти (стадія С, 120мг, 0,14ммоль) у безводному ТГФ (8мл) в атмосфері азоту додають паладій 10% мас. на активованому вугіллі (160мг). Суміш піддають взаємодії в атмосфері водню протягом ночі при кімнатній температурі. Розчин фільтрують і паладій на вугіллі промивають ТГФ (50мг). Розчинник випарюють і залишок (110мг) очищають флеш-хроматографією, використовуючи етилацетат як елюент. Одержують прозору маслянисту речовину з виходом 47% (47мг). РХ-МС: 796,4 (М+Н)+, 95% чистий. 1 H ЯМР (ацетон-d6): 0,84-0,97 (м, 12Н), 0,971,08 (м, 2Н), 1,27-1,43 (м, 3Н), 1,49-1,62 (м, 4Н), 1,80-1,93 (м, 1H), 1,94-2,00 (м, 1H), 2,36-2,46 (м, 86086 50 1H), 2,58-2,74 (м, 2Н), 2,86-2,96 (м, 3Н), 2.99-3,10 (м, 2Н), 3,46-3,52 (с, 3Н), 3,52-3,60 (м, 2Н), 3,753,87 (м, 2Н), 3,95-4,04 (м, 1H), 4,10-4,18 (м, 1H), 4,37-4,44 (м, 1Н), 4,89-4,97 (м, 1Н), 5,40-5,48 (м, 1H), 6,30-6,40 (м, 1Н), 6,76-6,83 (д, J=8,2, 1H), 6,877,03 (м, 2Н), 7,14-7,22 (м, 1Н), 7,23-7,34 (м, 3Н), 7,35-7,45 (м, 4Н), 7,50-7,56 (м, 1H), 7,57-7,65 (м, 1Н). Біологічна доступність сполук Щоб оцінити ступінь відщіплення фосфатної групи in vivo від передбачуваних сполук, сполуки PL-100, PL-462 (на основі PL-100), PL-337 і PL-515 (на основі PL-337) вводять перорально (50 мг/кг) самцям щурів Спрег-Доулі і їх концентрації у плазмі вимірюють при різних часових інтервалах після введення. PL-100 являє собою активний інгредієнт (інгібітор протеази) наступної формули: PL-337 являє собою активний інгредієнт (інгібітор протеази) наступної формули: Як було показано, даний активний інгредієнт є ефективним стосовно ВІЛ-1 аспартил-протеази [патент США №6632816]. Активні інгредієнти також показують ефективну антивірусну активність при тестуванні на немутантному ВІЛ-1 вірусному штамі (NL4.3 як вірус дикого типу), а також на декількох мутантних штамах. Всі продукти, що тестуються, (PL-100, PL-462, PL-337 і PL-515) готують у різних розчинниках з кінцевою концентрацією 25 мг/мл. Композиція розчинника є наступною: (1) 20% етанолу, 50% пропіленгліколю, 0,05% мас/об. Tween 20 і вода (Суміш); (2) забуферений фосфатом фізіологічний розчин (PBS). Продукти, що тестуються, вводять самцям щурів Спрег-Доулі при одноразовій пероральній дозі 50мг/кг. Кожний продукт тестують для трьох щурів. Зразки крові (0,2-0,3мл) збирають через 10, 20, 40, 60, 120, 180 і 360хв. після введення дози. Зібрану кров центрифугують, щоб виділити плазму. Одержану у результаті плазму відокремлюють і зберігають при -70°С. Зразки плазми разом зі стандартами і зразками контролю якості обробляють, щоб осадити білки, потім аналізують ВЕРХ-МС на присутність PL462, PL-100, PL-515 і PL-337. 51 86086 52 Результати демонструють, що сполуки PL-462 і PL-515 можна доставити перорально у водних розчинах. Жодна зі сполук PL-462 і PL-515, доставлена у вигляді водного розчину, не виявляється у зразках крові, що говорить про швидкий метаболізм вихідних лікарських речовин у PL-100 і PL337. Встановлено, що водні дозування розчинів PL462 і PL-515 злегка перевершують доставку PL 100 і PL-337 у порівнянні з неводними рецептурами PL-100iPL-337. Базуючись на даних результатах всі фосфориловані сполуки, описані у даному винаході, будуть демонструвати аналогічні фармакокінетичні властивості. Коефіцієнти розподілу (LogP) вибраних сполук і відповідних інгібіторів ВІЛ протеази (лікарських засобів) є наступними: LogP вимірюють стандартно, розчиняючи 1мг сполуки в 0,8мл октанолу або фосфатного буфера рН 7,4 (0,04 Μ ΚΗΡΟ4). Концентрацію сполук у фазах визначають РХ-МС. Даний тест демонструє розчинність сполук при фізіологічному значенні рН. Одержані LogP показують, що сполуки добре розчинні у порівнянні з відповідними лікарськими засобами. Сполуки, перераховані у таблиці 3, готують за наступними схемами 1, 1А, 2, 3, 4 або 5; і, більш конкретно, як описано у кожному прикладі, перерахованому вище. Номера сполук, перерахованих у таблиці 3 (Прикл. №), відповідають номерам прикладів, наведених вище. 53 Комп’ютерна верстка Л. Купенко 86086 Підписне 54 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюLysine based compounds
Автори англійськоюStranix Brent Richard, Perron Valerie
Назва патенту російськоюСоединения на основе лизина
Автори російськоюСтреникс Брент Ричард, Перрон Валери
МПК / Мітки
МПК: C07D 241/44, A61K 31/4164, C07D 403/12, C07D 217/22, A61K 31/47, A61K 31/5375, C07C 311/37, A61K 31/445, C07D 215/38, C07D 405/12, A61K 31/498, A61K 31/44, C07D 265/30, C07D 401/12, A61K 31/18, C07D 233/88, C07D 213/72, C07D 207/44
Мітки: основі, лізину, сполуки
Код посилання
<a href="https://ua.patents.su/27-86086-spoluki-na-osnovi-lizinu.html" target="_blank" rel="follow" title="База патентів України">Сполуки на основі лізину</a>
Попередній патент: Триколісний пасажирський транспортний засіб
Наступний патент: Похідні нафталімідооцтової кислоти як інтеркалюючі у днк індуктори інтерферону та противірусні агенти
Випадковий патент: Спосіб бактеріального вилуговування полімінеральних руд












