1,2,3-заміщені похідні індолізину, інгібітори fgfs, спосіб їх отримання та фармацевтична композиція, що їх містить
Номер патенту: 78016
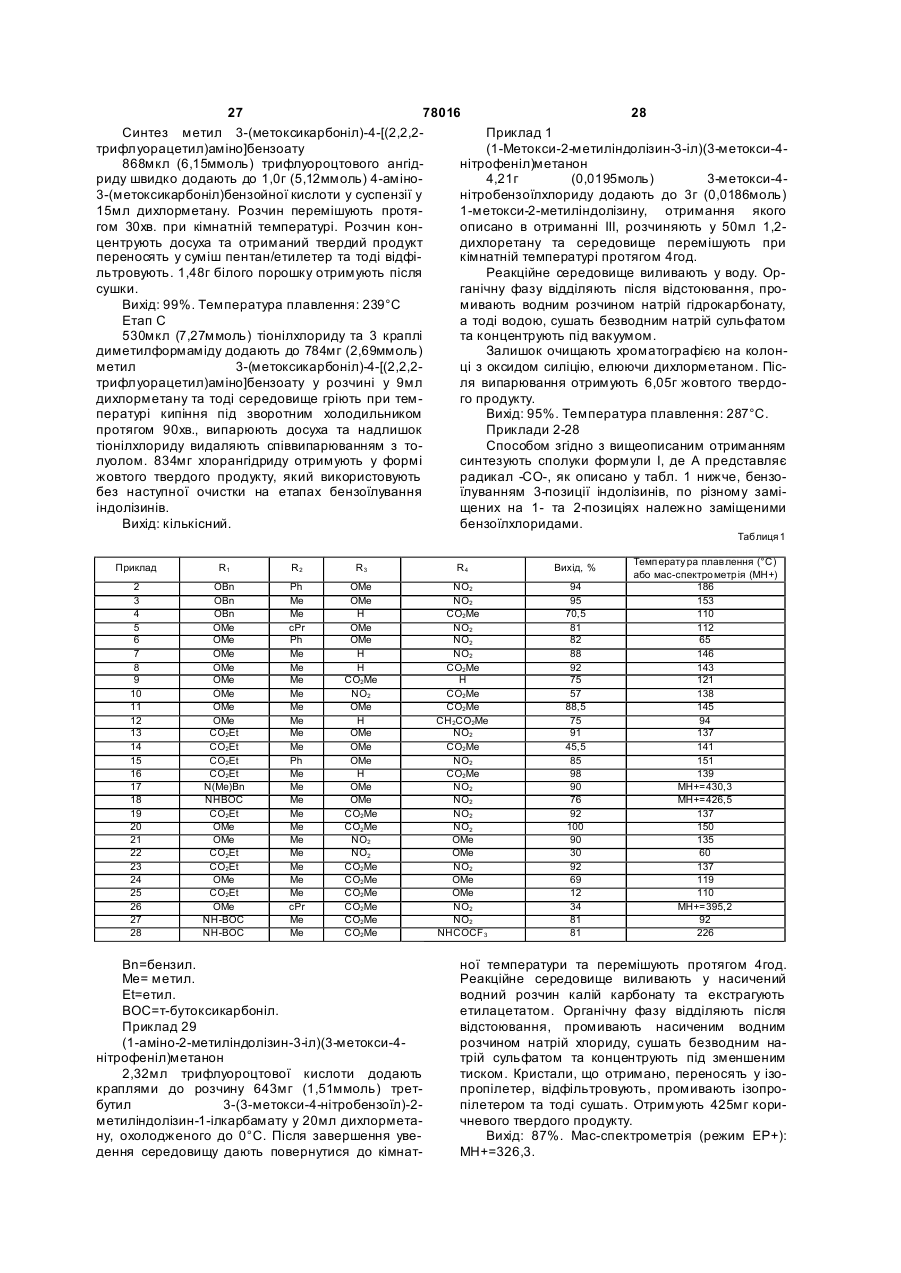
Опубліковано: 15.02.2007
Автори: Борд Марі-Франсуаз, Боно Франсуаз, Ербер Жан-Марк, ійо Наталі, Бадорк Ален
Формула / Реферат
1. Сполуки формули І
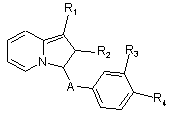 , (I)
, (I)
в яких
R1 представляє гідроксирадикал, лінійний або розгалужений алкоксирадикал з 1-5 атомами карбону, карбоксирадикал, алкоксикарбонілрадикал з 2-6 атомами карбону або радикал формули:
-NR5R6,
-NH-SO2-Alk,
-NH-SO2-Ph,
-NH-CO-Ph,
-N(Alk)-CO-Ph,
-NH-CO-NH-Ph,
-NH-CO-Alk,
-NH-CO2-Alk,
-O-(CH2)n-cAlk,
-O-Alk-COOR7,
-O-Alk-O-R8,
-O-Alk-OH,
-O-Alk-C(NH2):NOH,
-O-Alk-NR5R6,
-O-Alk-CN,
-O-(CH2)n-Ph,
-O-Alk-CO-NR5R6,
-CO-NH-(CH2)m-COOR7,
-CO-NH-Alk,
в яких
Alk представляє алкілрадикал або лінійний або розгалужений алкіленрадикал з 1-5 атомами карбону,
cAlk представляє циклоалкілрадикал з 3-6 атомами карбону,
n дорівнює цілому числу від 0 до 5,
m дорівнює цілому числу від 1 до 5,
R5 та R6, які є ідентичними або різними, представляють, кожний, атом гідрогену, лінійний або розгалужений алкілрадикал з 1-5 атомами карбону або бензилрадикал,
R7 представляє атом гідрогену або алкілрадикал з 1-5 атомами карбону,
R8 представляє алкілрадикал з 1-5 атомами карбону або радикал -CO-Alk,
Ph представляє фенілрадикал, який заміщено, як варіант, одним або більше атомами галогену, одним або більше алкоксирадикалами з 1-5 атомами карбону, одним або більше карбоксирадикалами або одним або більше алкоксикарбонілрадикалами з 2-6 атомами карбону,
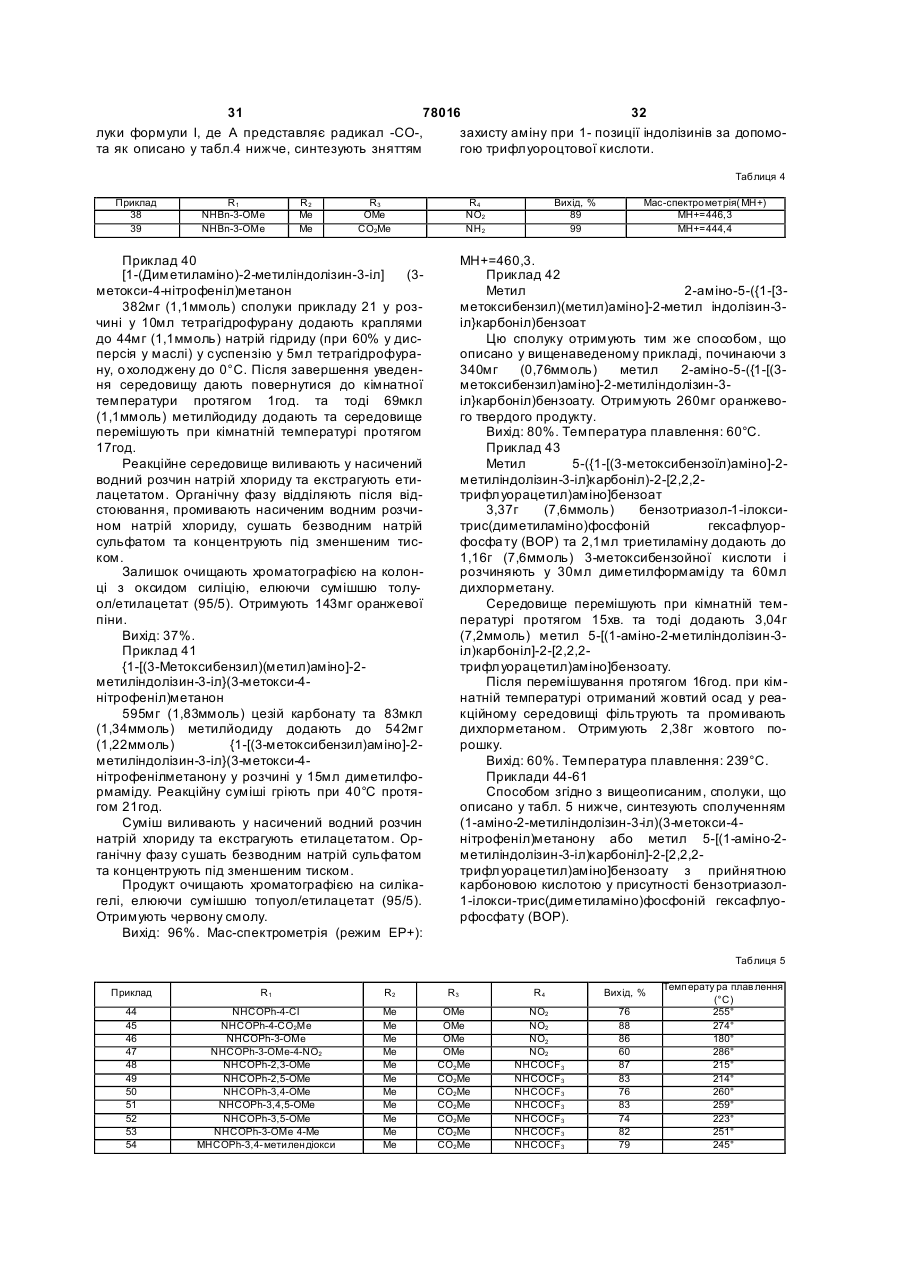
R2 представляє атом гідрогену, алкілрадикал з 1-5 атомами карбону, алкілгалогенорадикал з 1-5 атомами карбону, що містить 3-5 атомів галогену, циклоалкілрадикал з 3 -6 атомами карбону або фенілрадикал, який заміщено, як варіант, одним або більше атомами галогену, одним або більше алкоксирадикалами з 1-5 атомами карбону, одним або більше карбоксирадикалами або одним або більше алкоксикарбонілрадикалами з 2-6 атомами карбону,
А представляє радикал -CO-, -SO- або -SO2-,
R3 та R4, які є ідентичними або різними, представляють, кожний, атом гідрогену, алкоксирадикал з 1-5 атомами карбону, амінорадикал, карбоксирадикал, алкоксикарбонілрадикал з 2-6 атомами карбону, гідроксирадикал, нітрорадикал, гідроксіамінорадикал, радикал формули:
-Alk-COOR7,
-NR5R6,
-NH-Alk-COOR7,
-NH-COO-Alk,
-N(R11)-SO2-Alk-NR9R10,
-N(R11)-SO2-Alk,
-N(R11)-Alk-NR5R6,
-N(R11)-CO-Alk-NR9R10,
-N(R11)-CO-Alk,
-N(R11)-CO-CF3,
-NH-Alk-HetN,
-O-Alk-NR9R10,
-O-Alk-CO-NR5R6,
-O-Alk-HetN,
в яких n, m, Alk, R5, R6 та R7 мають значення, наведені вище для R1, а
R9 та R10, які є ідентичними або різними, представляють, кожний, атом гідрогену або алкілрадикал з 1-5 атомами карбону,
R11 представляє атом гідрогену або радикал -Alk-COOR12, де R12 представляє атом гідрогену, алкілрадикал з 1-5 атомами карбону або бензилрадикал,
HetN представляє 5- або 6-членний гетероцикл, що містить принаймні один атом нітрогену та, як варіант, другий гетероатом, вибраний з нітрогену та оксигену,
або R3 та R4 утворюють разом 5-6-членний ненасичений гетероцикл, за умови, однак, що коли R3 представляє алкоксирадикал, a R4 представляє радикал -O-Alk-NR9R10 або гідроксирадикал, тоді R1 не представляє атом гідрогену чи алкоксирадикал,
як варіант, у формі одної з їх фармацевтично прийнятних солей.
2. Сполуки формули І, за п. 1, в яких
R1 представляє гідроксирадикал, лінійний або розгалужений алкоксирадикал з 1-5 атомами карбону, карбоксирадикал, алкоксикарбонілрадикал з 2-6 атомами карбону або радикал формули:
-NR5R6,
-NH-SO2-Alk,
-NH-SO2-Ph,
-NH-CO-Ph,
-N(Alk)-CO-Ph,
-NH-CO-NH-Ph,
-NH-CO-Alk,
-NH-CO2-Alk,
-O-(CH2)n-cAlk,
-O-Alk-COOR7,
-O-Alk-O-R8,
-O-Alk-OH,
-O-Alk-NR5R6,
-O-Alk-CN,
-O-(CH2)n-Ph,
-O-Alk-CO-NR5R6,
-CO-NH-(CH2)m-COOR7,
-CO-NH-Alk,
в яких
Alk представляє алкілрадикал або лінійний або розгалужений алкіленрадикал з 1-5 атомами карбону,
cAlk представляє циклоалкілрадикал з 3-6 атомами карбону,
n дорівнює цілому числу від 0 до 5,
m дорівнює цілому числу від 1 до 5,
R5 та R6, які є ідентичними або різними, представляють, кожний, атом гідрогену, лінійний або розгалужений алкілрадикал з 1-5 атомами карбону або бензилрадикал,
R7 представляє атом гідрогену або алкілрадикал з 1-5 атомами карбону,
R8 представляє алкілрадикал з 1-5 атомами карбону або радикал -CO-Alk,
Ph представляє фенілрадикал, який заміщено, як варіант, одним або більше атомами галогену, одним або більше алкоксирадикалами з 1-5 атомами карбону, одним або більше карбоксирадикалами або одним або більше алкоксикарбонілрадикалами з 2-6 атомами карбону,
R2 представляє алкілрадикал з 1-5 атомами карбону, трифлуорметилрадикал, циклоалкілрадикал з 3-6 атомами карбону або фенілрадикал, який заміщено, як варіант, одним або більше атомами галогену, одним або більше алкоксирадикалами з 1-5 атомами карбону, одним або більше карбоксирадикалами або одним або більше алкоксикарбонілрадикалами з 2-6 атомами карбону,
А представляє радикал -CO- або -SO2-,
R3 та R4, які є ідентичними або різними, представляють, кожний, атом гідрогену, алкоксирадикал з 1-5 атомами карбону, амінорадикал, карбоксирадикал, алкоксикарбонілрадикал з 2-6 атомами карбону, нітрорадикал, гідроксіамінорадикал, радикал формули:
-Alk-COOR7,
-NR5R6,
-NH-Alk-COOR7,
-NH-COO-Alk,
-N(R11)-SO2-Alk-NR9R10,
-N(R11)-SО2-Alk,
-N(R11)-Alk-NR5R6,
-N(R11)-CO-Alk-NR9R10,
-N(R11)-CO-Alk,
-N(R11)-CO-CF3,
-NH-Alk-HetN,
в яких n, m, Alk, R5, R6 та R7 мають значення, наведені вище для R1, a
R9 та R10, які є ідентичними або різними, представляють, кожний, атом гідрогену або алкіл-радикал з 1-5 атомами карбону,
R11 представляє атом гідрогену або радикал -Alk-COOR12, де R12 представляє атом гідрогену, алкілрадикал з 1-5 атомами карбону або бензилрадикал,
HetN представляє 5- або 6-членний гетероцикл, що містить принаймні один атом нітрогену та, як варіант, другий гетероатом, вибраний з нітрогену та оксигену,
як варіант, у формі одної з їх фармацевтично прийнятних солей.
3. Сполуки формули І, за будь-яким одним з пп. 1 та 2, в яких
R1 представляє алкоксирадикал з 1-5 атомами карбону, карбоксирадикал, радикал -O-Alk-COOH, в якому Alk представляє алкіленрадикал з 1-5 атомами карбону, радикал формули -O-Alk-Ph, в якому Alk представляє алкіленрадикал з 1-5 атомами карбону, а Ph представляє фенілрадикал, який заміщено, як варіант, одним або більше атомами галогену або одним або більше алкоксирадикалами з 1-5 атомами карбону або одним або більше карбоксирадикалами, радикал формули -NH-CO-Ph, радикал формули -NH-SO2-Ph або радикал формули -NH-CO-NH-Ph,
R2 представляє алкілрадикал з 1-5 атомами карбону,
А представляє радикал -СО-,
R3 та R4, які є різними, представляють, кожний, атом гідрогену, алкоксирадикал з 1-5
атомами карбону, амінорадикал, карбоксирадикал або алкоксикарбонілрадикал з 2-6
атомами карбону,
як варіант, у формі одної з їх фармацевтично прийнятних солей.
4. Сполука формули І за п. 1, яку вибрано з наступних сполук:
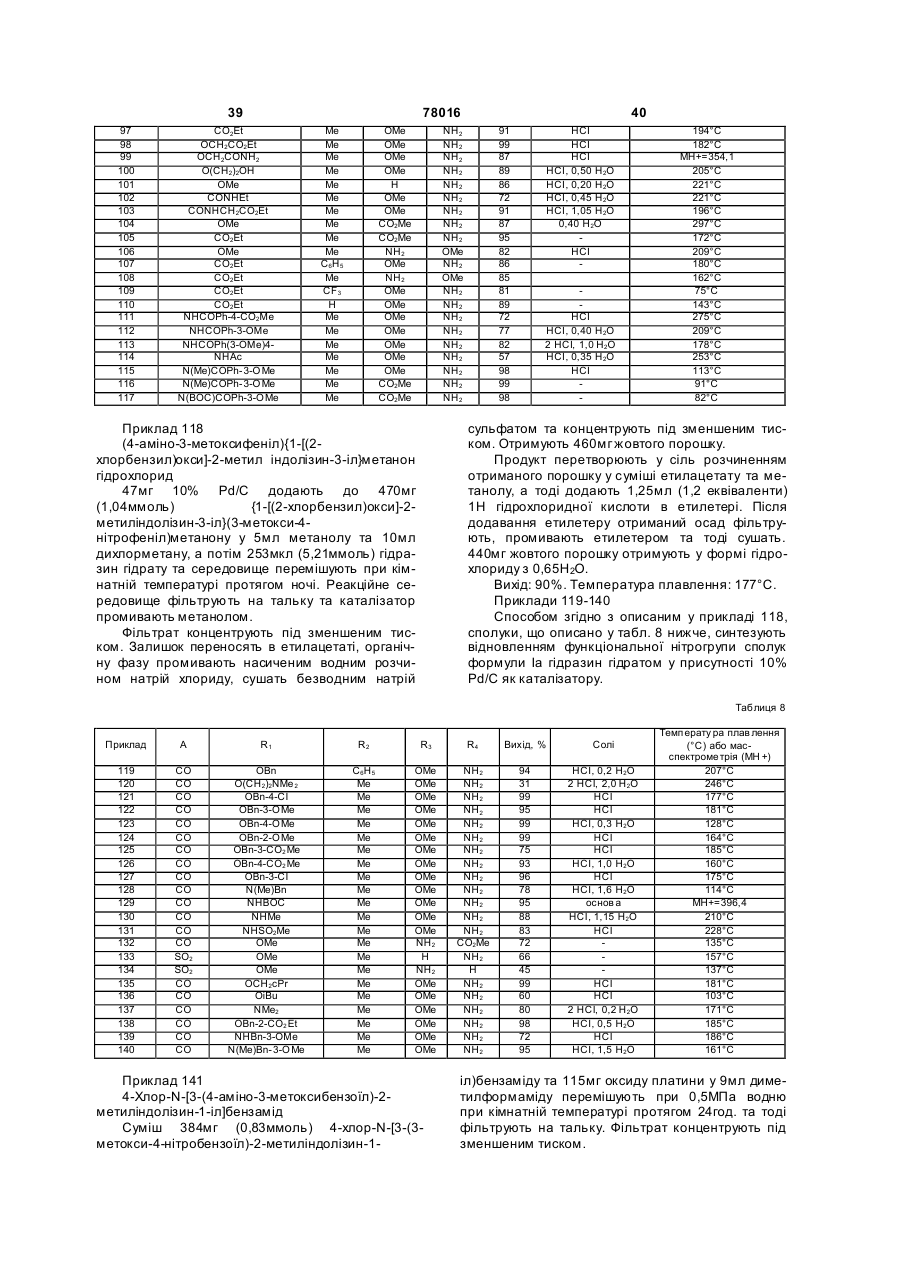
(4-аміно-3-метоксифеніл)(1-метокси-2-метиліндолізин-3-іл)метанон, 3-(4-аміно-3-метоксибензоїл)-2-метиліндолізин-1-ілкарбонова кислота, 2-{[3-(4-аміно-3-метоксибензоїл)-2-метиліндолізин-1-іл]оксі}оцтова кислота, (4-аміно-3-метоксифеніл)-{1-[(4-хлорбензил)окси]-2-метиліндолізин-3-іл}метанон, (4-аміно-3-метоксифеніл)-{1-[(3-метоксибензил)окси]-2-метиліндолізин-3-іл}метанон, 4-({[3-(4-аміно-3-метоксибензоїл)-2-метиліндолізин-1-іл]окси}метил)бензойна кислота,
3-(4-карбоксибензоїл)-2-метиліндолізин-1-ілкарбонова кислота, метил-3-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]бензоат,
4-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]бензойна кислота, 2-аміно-5-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]бензойна кислота, 2-аміно-5-({1-[(3-метоксибензоїл)аміно]-2-метиліндолізин-3-іл}карбоніл)бензойна кислота,
2-аміно-5-({2-метил-1-[(3,4,5-триметоксибензоїл)аміно]індолізин-3-іл)карбоніл)-
бензойна кислота,
2-аміно-5-({1-{[(3-метоксифеніл)сульфоніл]аміно}-2-метиліндолізин-3-іл}карбоніл)-
бензойна кислота,
як варіант, у формі одної з їх фармацевтично прийнятних солей.
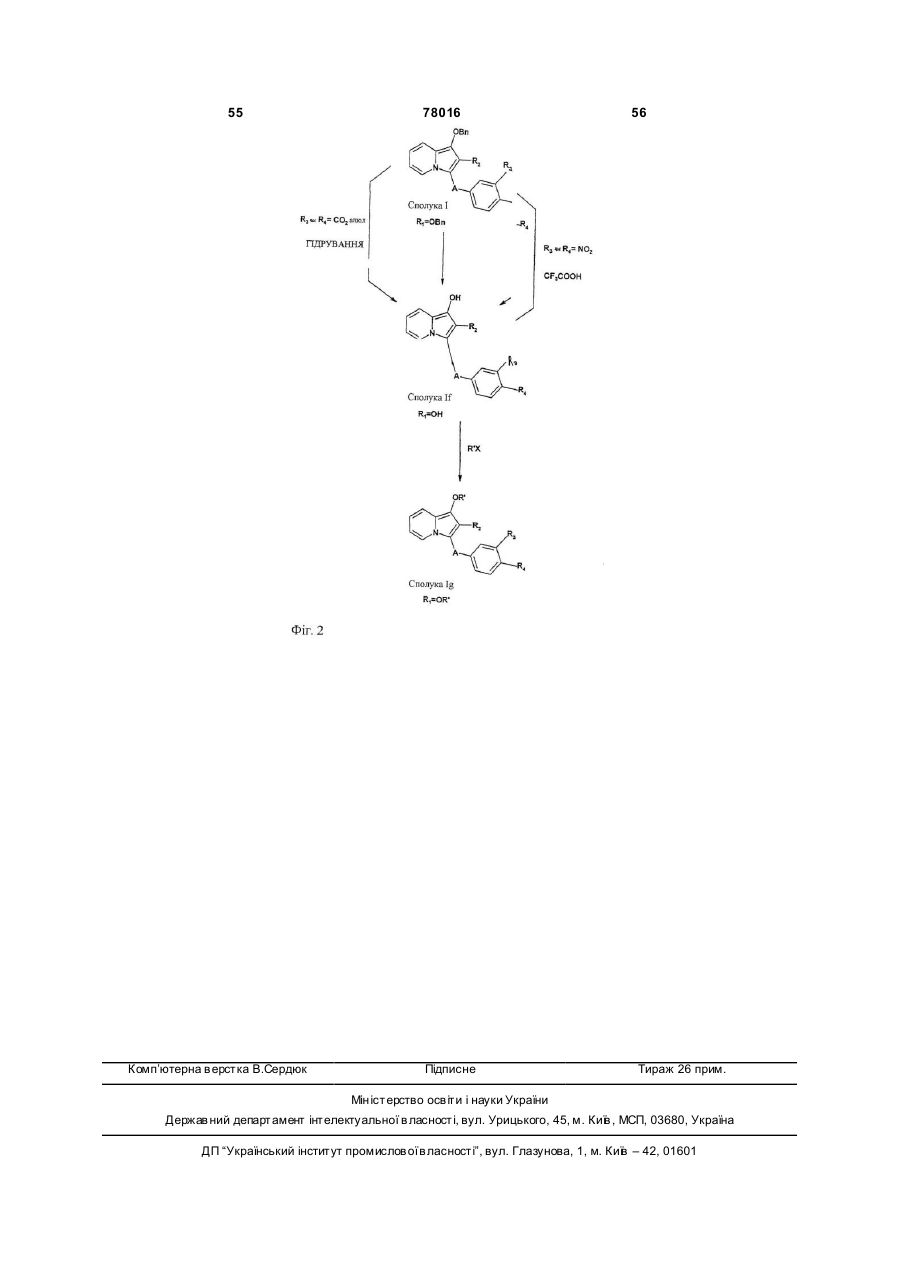
5. Спосіб отримання сполук формули І за пп. 1-4, що характеризується тим, що
А) похідне індолізину формули II
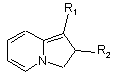 (II),
(II),
в якому R1 та R2 мають значення, наведені для формули І, але R2 не представляє атом гідрогену або галогеноалкілрадикал, конденсують з похідним формули III
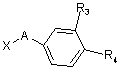 , (III)
, (III)
в якому X представляє атом галогену, а R3 або R4, які є ідентичними або різними, представляють, кожний, атом гідрогену, нітрорадикал, трифлуорацетамідорадикал або алкоксикарбонілрадикал з 2-6 атомами карбону, з отриманням сполук формул Ia, Id або Ik
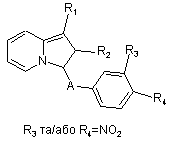 , (Ia)
, (Ia)
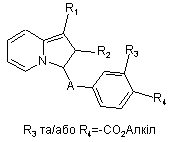 , (Id)
, (Id)
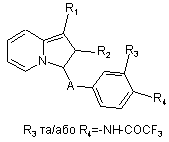 , (Ik)
, (Ik)
а тоді, а) сполуки формули Іа відновлюють з отриманням сполук формули Іb,
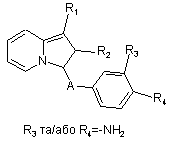 , (Ib)
, (Ib)
в яких R3 та/або R4 представляють амінорадикал, ці сполуки формули Ib тоді піддають дії алкілгалогеніду з отриманням сполук формули І, в яких R4 та/або R3 представляють радикал –NR5R6 (в якому R5 представляє атом гідрогену, a R6 представляє алкілрадикал з 1-5 атомами карбону) та радикал -NH-Alk-NR5R6 або радикал -NH-Alk-COOR7 (в якому R7 не представляє атом гідрогену), з яких наступним омиленням отримують сполуки формули І, де R4 та/або R3 представляють радикал -NH-Alk-COOR7, в якому R7 представляє атом гідрогену,
або ацилують з отриманням сполук формули І, в яких R4 та/або R3 представляють радикал -NH-CO-Alk або радикал -NH-CO-Alk-NR9R10, які тоді алкілують з отриманням радикалу -N(R11)-CO-Alk або радикалу -N(R11)-CO-Alk-NR9R10, де R11 представляє радикал -Alk-COOR12, в якому R12 не представляє атом гідрогену, останні сполуки тоді, як варіант, омилюють для отримання сполук формули І, в яких R4 та/або R3 представляють радикал -N(R11)-CO-Alk або радикал-N(R11)-CO-Alk-NR9R10, де R11 представляє радикал -Alk-COOH, або
сульфують з отриманням сполук формули І, в яких R4 та/або R3 представляють радикал -NH-SO2-Alk або радикал -NH-SO2-Alk-NR9R10, які тоді алкілують з отриманням радикала
-N(R11)-SO2-Alk або радикала -N(R11)-SO2-Alk-NR9R10, де R11 представляє радикал –AlkCOOR12, в якому R12 не представляє атом гідрогену, останні сполуки тоді, як варіант, омилюють для отримання сполук формули І, в яких R4 та/або R3 представляють радикал - N(R11)-SO2-Alk або радикал -N(R11)-SO2-Alk-NR9R10, де R11 представляє радикал -Alk-COOH
b) сполуки формули Id, в яких R3 та/або R4 представляють алкоксикарбонілрадикал, омилюють з отриманням сполук формули І, в яких R3 та/або R4 представляють карбоксірадикал,
або
c) коли R1 представляє бензилоксирадикал, сполуки формули Ia піддають дії трифлуороцтової кислоти, або сполуки формули Id гідрують з отриманням сполук формули Іf
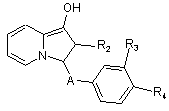 , (If)
, (If)
в яких R3 та/або R4 мають значення, наведені вище, а тоді сполуки формули If піддають O-алкілуванню з отриманням сполук формули Ig,
в яких R3 та/або R4 мають значення, наведені вище, а R1 представляє лінійний або розга-
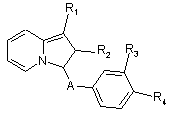 (Іg)
(Іg)
лужений алкоксирадикал з 1-5 атомами карбону, радикал -O-(CH2)n-cAlk, радикал -O-Alk-COOR7, радикал -O-Alk-NR5R6, радикал -O-(СН2) n-Ph, або радикал -O-Alk-O-R8, який, коли R8 представляє радикал –СОСН3, може давати при наступному омиленні радикал -O-Alk-OH- або радикал -O-Alk-CN, який при обробці гідроксиламіном дає радикал -O-Alk-C(NH2)=NOH, aбo
d) коли R1 представляє алкоксикарбонілрадикал, сполуки формули Іа омилюють з отриманням сполук формули Ih
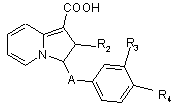 , (Ih)
, (Ih)
в яких R3 та/або R4 мають значення, наведені вище, які тоді піддають дії амінопохідного з отриманням сполук формули І, в яких R1 представляє радикал -CO-NH-Alk, або дії амінокислотного похідного для отримання сполук формули І, в яких R1 представляє радикал –CO-NH-(CH2)m-COOR7,
або
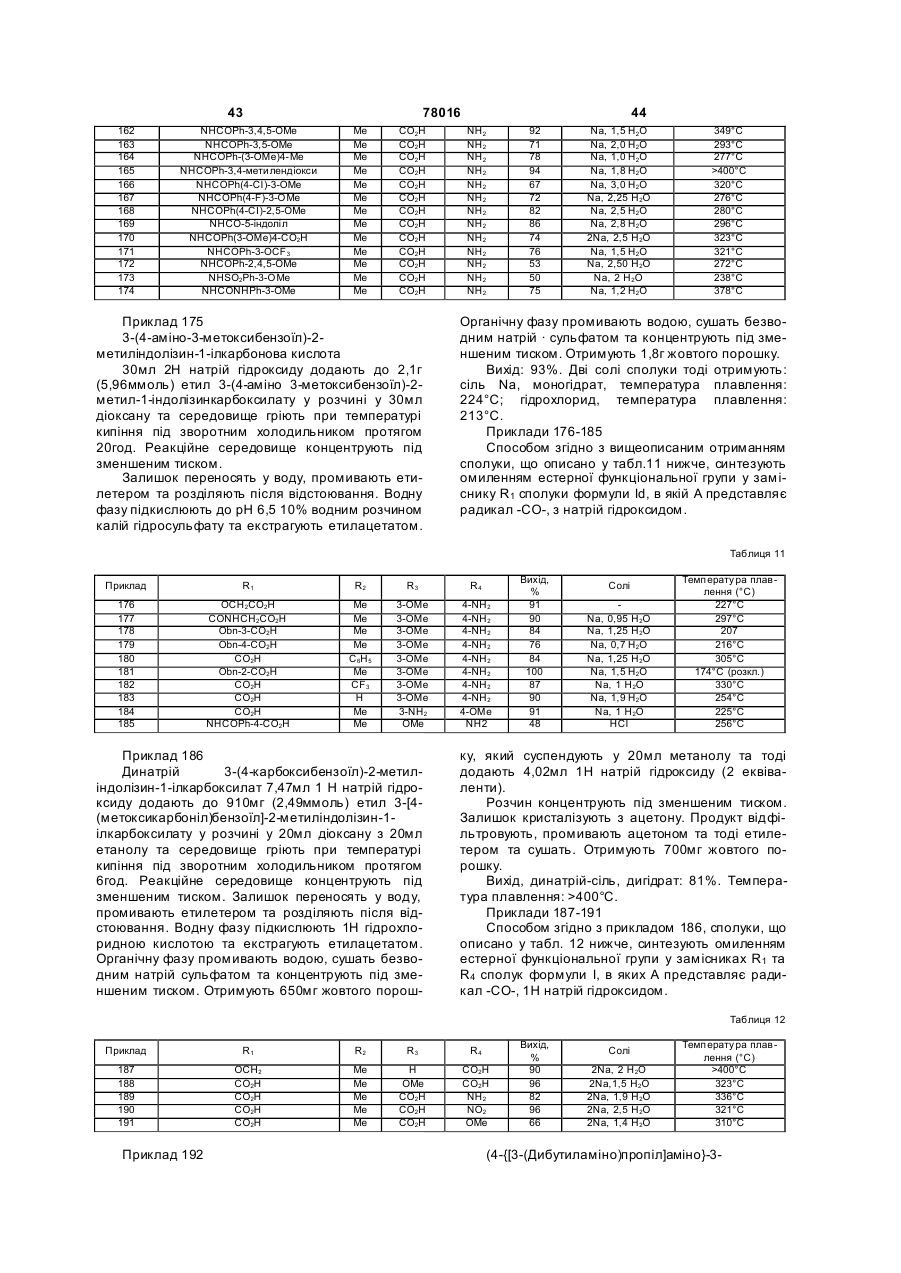
е) коли R1 представляє радикал -NН-СO2-т-бутил, сполуки формули Іа або Id
алкілують, а потім знімають захист та, як варіант, алкілують знов для отримання сполук формули Іi
або знімають захист, а потім ацилують з отриманням сполук формули Ij, в яких R5 представляє атом гідрогену, а потім, як варіант, алкілують знов з отриманням сполук формули Ij, в яких R5 представляє алкілрадикал
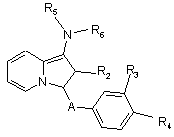 , (Ii)
, (Ii)
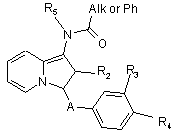 , (Ij)
, (Ij)
f) коли R1 представляє радикал -NH-СО2-т-бутил, зі сполук формули Ik знімають захист, а потім ацилують з отриманням сполук формули II
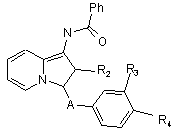 , (II)
, (II)
або знімають захист, а потім сульфують з отриманням сполук формули Іm
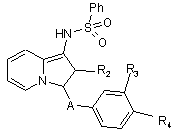 , (Im)
, (Im)
або знімають захист, а потім обробляють фенілізоціанатом з отриманням сполук формули In
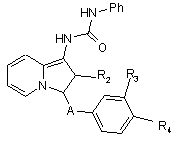 , (In)
, (In)
В) коли R1 представляє електроноакцепторну групу, R2 представляє атом гідрогену або алкілгалогенорадикал, а А представляє радикал -СО-, піридин піддають реакції з бромацетофеноном формули IV
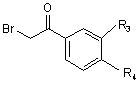 (IV)
(IV)
з отриманням сполук формули V
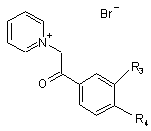 , (V)
, (V)
які тоді піддають 1,3-диполярному циклододаванню з етилакрилатом або галогенованим похідним етилкротонату у присутності окисника з отриманням сполук формули Іа, в яких R1 представляє етоксикарбонілрадикал, a R2 представляє атом гідрогену або алкілгалогенорадикал.
6. Фармацевтична композиція, що містить як активний інгредієнт сполуку формули І за будь-яким одним з пп. 1-4, як варіант, у комбінації з одним або більше інертними та прийнятними ексципієнтами.
7. Фармацевтична композиція за п. 6, яка є корисною у лікуванні хвороб, що потребують модуляції b-FGF.
8. Фармацевтична композиція за п. 6, яка є корисною у лікуванні карцином, що мають високий ступінь васкуляризації, як-то карциноми легенів, молочної залози, простати та стравоходу, типів раку, які індукують метастази, як-то рак ободової кишки та рак шлунка, меланом, гліом, лімфом та лейкемій.
9. Фармацевтична композиція за п. 6, яка є корисною у лікуванні серцево-судинних хвороб, як-то атеросклероз, рестеноз після ангіопластики, хвороб пов'язаних з ускладненнями, які виявляються після вставлення ендосудинних протезів та/або хірургічного шунта аортокоронарної артерії або інших судинних трансплантатів, серцевої гіпертрофії, або судинних ускладнень при діабеті, як-то діабетична ретинопатія.
10. Фармацевтична композиція за п. 6, яка є корисною у лікуванні хронічних запальних хвороб, як-то ревматоїдний артрит або запальні хвороби кишечнику.
11. Фармацевтична композиція за п. 6, яка є корисною у лікуванні ахондроплазії (АСН), гіпохондроплазії (НСН) та TD (танатофорної дисплазії).
12. Застосування сполуки формули І за п. 1, для отримання фармацевтичної композиції, яка є корисною у лікуванні хвороб, що потребують модуляції b-FGF.
Текст
1. Сполуки формули І N СПОСІБ (11) 1 FGFS, UA (54) 1,2,3-ЗАМІЩЕНІ ПОХІДНІ ІНДОЛІЗИНУ, ІНГІБІТОРИ ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ, ЩО ЇХ МІСТИТЬ (19) ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 78016 4 в яких або R3 та R4 утворюють разом 5-6-членний ненаAlk представляє алкілрадикал або лінійний або сичений гетероцикл, за умови, однак, що коли R3 розгалужений алкіленрадикал з 1-5 атомами карпредставляє алкоксирадикал, a R4 представляє бону, радикал -O-Alk-NR9R10 або гідроксирадикал, тоді cAlk представляє циклоалкілрадикал з 3-6 атомаR1 не представляє атом гідрогену чи алкоксирадими карбону, кал, n дорівнює цілому числу від 0 до 5, як варіант, у формі одної з їх фармацевтично приm дорівнює цілому числу від 1 до 5, йнятних солей. R5 та R6, які є ідентичними або різними, представ2. Сполуки формули І, за п. 1, в яких ляють, кожний, атом гідрогену, лінійний або розгаR1 представляє гідроксирадикал, лінійний або розлужений алкілрадикал з 1-5 атомами карбону або галужений алкоксирадикал з 1-5 атомами карбону, бензилрадикал, карбоксирадикал, алкоксикарбонілрадикал з 2-6 R7 представляє атом гідрогену або алкілрадикал з атомами карбону або радикал формули: 1-5 атомами карбону, -NR5R6, R8 представляє алкілрадикал з 1-5 атомами кар-NH-SO2-Alk, бону або радикал -CO-Alk, -NH-SO2-Ph, Ph представляє фенілрадикал, який заміщено, як -NH-CO-Ph, варіант, одним або більше атомами галогену, од-N(Alk)-CO-Ph, ним або більше алкоксирадикалами з 1-5 атомами -NH-CO-NH-Ph, карбону, одним або більше карбоксирадикалами -NH-CO-Alk, або одним або більше алкоксикарбонілрадикала-NH-CO2-Alk, ми з 2-6 атомами карбону, -O-(CH2)n-cAlk, R2 представляє атом гідрогену, алкілрадикал з 1-5 -O-Alk-COOR7 , атомами карбону, алкілгалогенорадикал з 1-5 ато-O-Alk-O-R8 , мами карбону, що містить 3-5 атомів галогену, -O-Alk-OH, циклоалкілрадикал з 3 -6 атомами карбону або -O-Alk-NR5R6, фенілрадикал, який заміщено, як варіант, одним -O-Alk-CN, або більше атомами галогену, одним або більше -O-(CH2)n-Ph, алкоксирадикалами з 1-5 атомами карбону, одним -O-Alk-CO-NR 5R6, або більше карбоксирадикалами або одним або -CO-NH-(CH2)m-COOR 7, більше алкоксикарбонілрадикалами з 2-6 атомами -CO-NH-Alk, карбону, в яких А представляє радикал -CO-, -SO- або -SO2-, Alk представляє алкілрадикал або лінійний або R3 та R4, які є ідентичними або різними, представрозгалужений алкіленрадикал з 1-5 атомами карляють, кожний, атом гідрогену, алкоксирадикал з бону, 1-5 атомами карбону, амінорадикал, карбоксираcAlk представляє циклоалкілрадикал з 3-6 атомадикал, алкоксикарбонілрадикал з 2-6 атомами ками карбону, рбону, гідроксирадикал, нітрорадикал, гідроксіаміn дорівнює цілому числу від 0 до 5, норадикал, радикал формули: m дорівнює цілому числу від 1 до 5, -Alk-COOR7, R5 та R6, які є ідентичними або різними, представ-NR5R6, ляють, кожний, атом гідрогену, лінійний або розга-NH-Alk-COOR7, лужений алкілрадикал з 1-5 атомами карбону або -NH-COO-Alk, бензилрадикал, -N(R11)-SO2-Alk-NR9R10, R7 представляє атом гідрогену або алкілрадикал з -N(R11)-SO2-Alk, 1-5 атомами карбону, -N(R11)-Alk-NR5R6, R8 представляє алкілрадикал з 1-5 атомами кар-N(R11)-CO-Alk-NR 9R10 , бону або радикал -CO-Alk, -N(R11)-CO-Alk, Ph представляє фенілрадикал, який заміщено, як -N(R11)-CO-CF3, варіант, одним або більше атомами галогену, од-NH-Alk-HetN, ним або більше алкоксирадикалами з 1-5 атомами -O-Alk-NR9R10 , карбону, одним або більше карбоксирадикалами -O-Alk-CO-NR 5R6, або одним або більше алкоксикарбонілрадикала-O-Alk-HetN, ми з 2-6 атомами карбону, в яких n, m, Alk, R5, R6 та R7 мають значення, наR2 представляє алкілрадикал з 1-5 атомами карведені вище для R1, а бону, трифлуорметилрадикал, циклоалкілрадикал R9 та R10, які є ідентичними або різними, предстаз 3-6 атомами карбону або фенілрадикал, який вляють, кожний, атом гідрогену або алкілрадикал з заміщено, як варіант, одним або більше атомами 1-5 атомами карбону, галогену, одним або більше алкоксирадикалами з R11 представляє атом гідрогену або радикал -Alk1-5 атомами карбону, одним або більше карбоксиCOOR12, де R12 представляє атом гідрогену, алкірадикалами або одним або більше алкоксикарболрадикал з 1-5 атомами карбону або бензилрадинілрадикалами з 2-6 атомами карбону, кал, А представляє радикал -CO- або -SO2-, HetN представляє 5- або 6-членний гетероцикл, R3 та R4, які є ідентичними або різними, представщо містить принаймні один атом нітрогену та, як ляють, кожний, атом гідрогену, алкоксирадикал з варіант, другий гетероатом, вибраний з нітрогену 1-5 атомами карбону, амінорадикал, карбоксирата оксигену, дикал, алкоксикарбонілрадикал з 2-6 атомами ка 5 78016 6 рбону, нітрорадикал, гідроксіамінорадикал, ради3-(4-карбоксибензоїл)-2-метиліндолізин-1кал формули: ілкарбонова кислота, метил-3-[(1-метокси-2-Alk-COOR7, метиліндолізин-3-іл)карбоніл]бензоат, -NR5R6, 4-[(1-метокси-2-метиліндолізин-3-NH-Alk-COOR7, іл)карбоніл]бензойна кислота, 2-аміно-5-[(1-NH-COO-Alk, метокси-2-метиліндолізин-3-іл)карбоніл]бензойна -N(R11)-SO2-Alk-NR9R10, кислота, 2-аміно-5-({1-[(3-метоксибензоїл)аміно]-2-N(R11)-SО2-Alk, метиліндолізин-3-іл}карбоніл)бензойна кислота, -N(R11)-Alk-NR5R6, 2-аміно-5-({2-метил-1-[(3,4,5-N(R11)-CO-Alk-NR 9R10 , триметоксибензоїл)аміно]індолізин-3-іл)карбоніл)-N(R11)-CO-Alk, бензойна кислота, -N(R11)-CO-CF3, 2-аміно-5-({1-{[(3-метоксифеніл)сульфоніл]аміно}-NH-Alk-HetN, 2-метиліндолізин-3-іл}карбоніл)в яких n, m, Alk, R5, R6 та R7 мають значення, набензойна кислота, ведені вище для R1, a як варіант, у формі одної з їх фармацевтично приR9 та R10, які є ідентичними або різними, предстайнятних солей. вляють, кожний, атом гідрогену або алкіл-радикал 5. Спосіб отримання сполук формули І за пп. 1-4, з 1-5 атомами карбону, що характеризується тим, що R11 представляє атом гідрогену або радикал -AlkА) по хідне індолізину формули II R1 COOR12, де R12 представляє атом гідрогену, алкілрадикал з 1-5 атомами карбону або бензилради(II) R2 кал, N HetN представляє 5- або 6-членний гетероцикл, в якому R1 та R2 мають значення, наведені для що містить принаймні один атом нітрогену та, як формули І, але R2 не представляє атом гідрогену варіант, другий гетероатом, вибраний з нітрогену або галогеноалкілрадикал, конденсують з похідта оксигену, ним формули III як варіант, у формі одної з їх фармацевтично приR3 йнятних солей. 3. Сполуки формули І, за будь-яким одним з пп. 1 A (III) X R4 та 2, в яких R1 представляє алкоксирадикал з 1-5 атомами в якому X представляє атом галогену, а R3 або R4, карбону, карбоксирадикал, радикал -O-Alk-COOH, які є ідентичними або різними, представляють, в якому Alk представляє алкіленрадикал з 1-5 кожний, атом гідрогену, нітрорадикал, трифлуораатомами карбону, радикал формули -O-Alk-Ph, в цетамідорадикал або алкоксикарбонілрадикал з 2якому Alk представляє алкіленрадикал з 1-5 ато6 атомами карбону, з отриманням сполук формул мами карбону, а Ph представляє фенілрадикал, Ia, Id або Ik який заміщено, як варіант, одним або більше атоR1 мами галогену або одним або більше алкоксирадикалами з 1-5 атомами карбону або одним або R2 R3 N більше карбоксирадикалами, радикал формули (Ia) A NH-CO-Ph, радикал формули -NH-SO2-Ph або раR4 дикал формули -NH-CO-NH-Ph, R3 та /або R 4=NO2 R2 представляє алкілрадикал з 1-5 атомами карбону, R1 А представляє радикал -СО-, R3 та R4, які є різними, представляють, кожний, R2 R3 атом гідрогену, алкоксирадикал з 1-5 N (Id) атомами карбону, амінорадикал, карбоксирадикал A R4 або алкоксикарбонілрадикал з 2-6 атомами карбону, R3 та/або R4=-CO2А лкіл як варіант, у формі одної з їх фармацевтично прийнятних солей. R 4. Сполука формули І за п. 1, яку вибрано з настуR пних сполук: R N (Ik) (4-аміно-3-метоксифеніл)(1-метокси-2A метиліндолізин-3-іл)метанон, 3-(4-аміно-3R метоксибензоїл)-2-метиліндолізин-1-ілкарбонова R та/або R =-NH-COCF кислота, 2-{[3-(4-аміно-3-метоксибензоїл)-2а тоді, а) сполуки формули Іа відновлюють з отриметиліндолізин-1-іл]оксі}оцтова кислота, (4-аміноманням сполук формули Іb, 3-метоксифеніл)-{1-[(4-хлорбензил)окси]-2R метиліндолізин-3-іл}метанон, (4-аміно-3метоксифеніл)-{1-[(3-метоксибензил)окси]-2R R N метиліндолізин-3-іл}метанон, 4-({[3-(4-аміно-3(Ib) A метоксибензоїл)-2-метиліндолізин-1R іл]окси}метил)бензойна кислота, 1 2 3 4 3 4 3 1 2 3 4 R3 та/або R4 =-NH2 7 78016 8 в яких R3 та/або R4 представляють амінорадикал, d) коли R1 представляє алкоксикарбонілрадикал, ці сполуки формули Ib тоді піддають дії алкілгалосполуки формули Іа омилюють з отриманням спогеніду з отриманням сполук формули І, в яких R4 лук формули Ih COOH та/або R3 представляють радикал –NR5R6 (в якому R5 представляє атом гідрогену, a R6 представляє R R N (Ih) алкілрадикал з 1-5 атомами карбону) та радикал A NH-Alk-NR5R6 або радикал -NH-Alk-COOR7 (в якоR му R7 не представляє атом гідрогену), з яких нав яких R3 та/або R4 мають значення, наведені виступним омиленням отримують сполуки формули ще, які тоді піддають дії амінопохідного з отриманІ, де R4 та/або R3 представляють радикал -NH-Alkням сполук формули І, в яких R1 представляє раCOOR7, в якому R7 представляє атом гідрогену, дикал -CO-NH-Alk, або дії амінокислотного або ацилують з отриманням сполук формули І, в похідного для отримання сполук формули І, в яких яких R4 та/або R3 представляють радикал -NH-COR1 представляє радикал –CO-NH-(CH 2)m-COOR 7, Alk або радикал -NH-CO-Alk-NR 9R10, які тоді алкіабо лують з отриманням радикалу -N(R11)-CO-Alk або е) коли R1 представляє радикал -NН-СO2-т-бутил, радикалу -N(R11)-CO-Alk-NR 9R10, де R11 представсполуки формули Іа або Id ляє радикал -Alk-COOR12, в якому R12 не предстаалкілують, а потім знімають захист та, як варіант, вляє атом гідрогену, останні сполуки тоді, як варіалкілують знов для отримання сполук формули Іi ант, омилюють для отримання сполук формули І, в або знімають захист, а потім ацилують з отриманяких R4 та/або R3 представляють радикал -N(R11)ням сполук формули Ij, в яких R5 представляє CO-Alk або радикал-N(R11)-CO-Alk-NR 9R10, де R11 атом гідрогену, а потім, як варіант, алкілують знов представляє радикал -Alk-COOH, або з отриманням сполук формули Ij, в яких R5 предсульфують з отриманням сполук формули І, в яких ставляє алкілрадикал R4 та/або R3 представляють радикал -NH-SO2-Alk R5 або радикал -NH-SO2-Alk-NR9R10, які тоді алкілуN R6 ють з отриманням радикала -N(R11)-SO2-Alk або радикала -N(R11)-SO2-Alk(Ii) R2 R3 N NR9R10, де R11 представляє радикал –AlkCOOR12, A в якому R12 не представляє атом гідрогену, останні R4 сполуки тоді, як варіант, омилюють для отримання сполук формули І, в яких R4 та/або R3 представR Alk or Ph ляють радикал - N(R11)-SO2-Alk або радикал N N(R11)-SO2-Alk-NR9R10, де R11 представляє радиO кал -Alk-COOH R (Ij) R N b) сполуки формули Id, в яких R3 та/або R4 предA ставляють алкоксикарбонілрадикал, омилюють з R отриманням сполук формули І, в яких R3 та/або R4 f) коли R1 представляє радикал -NH-СО2-т-бутил, представляють карбоксірадикал, зі сполук формули Ik знімають захист, а потім ациабо лують з отриманням сполук формули II c) коли R1 представляє бензилоксирадикал, сполуPh ки формули Ia піддають дії трифлуороцтової кисN O лоти, або сполуки формули Id гідрують з отриманR (II) R ням сполук формули Іf N 2 3 4 5 2 3 4 2 OH A R4 R3 R2 N A (If) R4 в яких R3 та/або R4 мають значення, наведені вище, а тоді сполуки формули If піддають Oалкілуванню з отриманням сполук формули Ig, в яких R3 та/або R4 мають значення, наведені вище, а R1 представляє лінійний або розгаR1 R2 N A 3 (Іg) R3 або знімають захист, а потім сульфують з отриманням сполук формули Іm HN R2 N (Im) R3 A R4 або знімають захист, а потім обробляють фенілізоціанатом з отриманням сполук формули In HN P h R4 лужений алкоксирадикал з 1-5 атомами карбону, радикал -O-(CH2)n-cAlk, радикал -O-Alk-COOR7, радикал -O-Alk-NR5R6, радикал -O-(СН2) n-Ph, або радикал -O-Alk-O-R8, який, коли R8 представляє радикал –СОСН3, може давати при наступному омиленні радикал -O-Alk-OH- або радикал -O-AlkCN, який при обробці гідроксиламіном дає радикал -O-Alk-C(NH 2)=NOH, aбo Ph S O O HN O R2 N (In) R3 A R4 В) коли R1 представляє електроноакцепторну групу, R2 представляє атом гідрогену або алкілгалогенорадикал, а А представляє радикал -СО-, піридин піддають реакції з бромацетофеноном формули IV 9 78016 10 лочної залози, простати та стравоходу, типів раку, R3 Br які індукують метастази, як-то рак ободової кишки (IV) та рак шлунка, меланом, гліом, лімфом та лейкеR4 мій. з отриманням сполук формули V 9. Фармацевтична композиція за п.6, яка є корисBr ною у лікуванні серцево-судинних хвороб, як-то N атеросклероз, рестеноз після ангіопластики, хвоR (V) роб пов'язаних з ускладненнями, які виявляються O після вставлення ендосудинних протезів та/або R хірургічного шунта аортокоронарної артерії або які тоді піддають 1,3-диполярному циклододаванінших судинних трансплантатів, серцевої гіперню з етилакрилатом або галогенованим похідним трофії, або судинних ускладнень при діабеті, як-то етилкротонату у присутності окисника з отримандіабетична ретинопатія. ням сполук формули Іа, в яких R1 представляє 10. Фармацевтична композиція за п.6, яка є корисетоксикарбонілрадикал, a R2 представляє атом ною у лікуванні хронічних запальних хвороб, як-то гідрогену або алкілгалогенорадикал. ревматоїдний артрит або запальні хвороби кишеч6. Фармацевтична композиція, що містить як актинику. вний інгредієнт сполуку формули І за будь-яким 11. Фармацевтична композиція за п.6, яка є корисодним з пп.1-4, як варіант, у комбінації з одним або ною у лікуванні ахондроплазії (АСН), гіпохондропбільше інертними та прийнятними ексципієнтами. лазії (НСН) та TD (танатофорної дисплазії). 7. Фармацевтична композиція за п.6, яка є корис12. Застосування сполуки формули І за п.1, для ною у лікуванні хвороб, що потребують модуляції отримання фармацевтичної композиції, яка є коb-FGF. рисною у лікуванні хвороб, що потребують моду8. Фармацевтична композиція за п.6, яка є корисляції b-FGF. ною у лікуванні карцином, що мають високий ступінь васкуляризації, як-то карциноми легенів, моO + 3 4 Об'єктом представленого винаходу є нові 1,2,3-заміщенІ похідні індолізину, як є інгібіторами FGF (основні фактори росту фібробластів), спосіб їх отримання та фармацевтичні композиції, що їх містять. FGF є родиною поліпептидів, як синтезуються великим числом клітин при ембріональному розвитку та клітинами дорослих тканин у різних патологічних станах. Деякі похідні нафтиридиндіамінів та відповідні сечовини відомі як селективні інгібітори FGF-1 [Batley В. et al. // Life Sciences. – 1998. - Vol. 62. №2. – P. 143-150; Thompson A. et al. // J. Med. Chem. – 2000. - Vol. 43. – P. 4200-4211]. Деякі похідні індолізину описано у патентних заявках та патентах [US, 4378362; FR, 2341578; GB, 2064536; ЕР,0097636; ЕР, 302792; ЕР, 0382628; ЕР, 0235111]. Ці сполуки є корисними у лікуванні стенокардії та аритмії. Інгібувальні властивості стосовно транс-локації кальцію описано для деяких з цих сполук. Патентна заявка [ЕР, 0022762] також описує деяк похідні індолізинів як мають інгібувальну активність стосовно ксантин-оксидази та аденозиндеамінази та активність стосовно виведення сечової кислоти. Ці сполуки можна використовувати у лікуванні фізіологічних розладів, які є результатом надлишку сечової кислоти, розладів імунної системи та як паразитичні засоби. Зараз знайдено, що деякі сполуки, похідні від індолізину, є потужними антагоністами приєднання FGF до їх рецепторів. Відповідно, об'єктом представленого винаходу є нові похідні індолізину формули І: I де: R1 представляє гідроксирадикал, лінійний або розгалужений алкоксирадикал з 1-5 атомами карбону, карбоксирадикал, алкоксикарбонілрадикал з 2-6 атомів карбону або радикал формул: -NR5R6, -NH-SO2-Alk, -NH-SO2-Ph, -NH-CO-Ph, -N(Alk)-CO-Ph, -NH-CO-NH-Ph, -NH-CO-Alk, -NH-CO2-Alk, -O-(CH2)n-cAlk, -O-Alk-COOR7 , -O-Alk-O-R8 , -O-Alk-OH, -O-Alk-C(NH 2):NOH -O-Alk-NR5R6, -O-Alk-CN, -O-(CH2)n-Ph, -O-Alk-CO-NR 5R6, -CO-NH-(CH2)m-COOR 7, -CO-NH-Alk, в яких: Alk - представляє алкілрадикап або лінійний або розгалужений алкіленрадикал з 1-5 атомами карбону; cAlk - представляє циклоалкілрадикал з 3-6 11 78016 12 атомами карбону; 5-6-членний ненасичений гетероцикл, за умови, n - дорівнює цілому числу від 0 до 5; однак, що коли R3 представляє алкоксирадикал, a m - дорівнює цілому числу від 1 до 5; R4 представляє радикал -О-Alk-NR9R10 або гідроR5 та R6 - які є ідентичними або різними, предксирадикал, тоді R1 не представляє алкоксирадиставляють, кожний, атом гідрогену, лінійний або кал, розгалужений алкілрадикал з 1-5 атомами карбону як варіант, у формі одної з їх фармацевтично або бензилрадикап; прийнятних солей. R7 - представляє атом гідрогену або алкілраСполука формули І є кращою, коли дикал з 1-5 атомами карбону; R1 - представляє гідроксирадикал, лінійний R8 - представляє алкілрадикал з 1-5 атомами або розгалужений алкоксирадикал з 1-5 атомами карбону або радикал -CO-Alk; карбону, карбоксирадикал, алкоксикарбонілрадиPh - представляє фенілрадикал, який заміщекал з 2 - 6 атомами карбону або радикал формули: но, як варіант, одним або більше атомами галоге-NR5R6, ну, одним або більше алкоксирадикалами з 1-5 -NH-SO2-Alk, атомами карбону, одним або більше карбоксира-NH-SO2-Ph, дикалами або одним або більше алкоксикарбоніл-NH-CO-Ph, радикалами з 2-6 атомами карбону; -N(Alk)-CO-Ph, R2 - представляє атом гідрогену, алкілрадикал -NH-CO-NH-Ph, з 1-5 атомами карбону, алкілгалогено-радикал з 1-NH-CO-Alk, 5 атомами карбону, що містить 3-5 атомів галоге-NH-СО2-АІk, ну, циклоалкілрадикал з 3-6 атомами карбону або -О-(СН2)n-сАІk, фенілрадикал, який заміщено, як варіант, одним -O-Alk-COOR7 , або більше атомами галогену, одним або більше -O-Alk-O-R8 , алкоксирадикалами з 1-5 атомами карбону, одним -O-Alk-OH, або більше карбоксирадикалами або одним або -O-Alk-NR5R6, більше алкоксикарбонілрадикалами з 2-6 атомами -O-Alk-CN, карбону; -O-(CH2)n-Ph, А - представляє радикал -CO-, -SO- або -SO2-; -O-Alk-CO-NR 5R6, R3 та R4 - які є ідентичними або різними, пред-CO-NH-(CH2)m-COOR 7, ставляють, кожний, атом гідрогену, алкоксиради-CO-NH-Alk, в яких: кал з 1-5 атомами карбону, амінорадикал, карбокAlk - представляє алкілрадикал або лінійний сирадикал, алкоксикарбонілра-дикал 2-6 атомів або розгалужений алкіленрадикал з 1-5 атомами карбону; карбону; R3 та R4 - які є ідентичними або різними, предcAlk - представляє циклоалкілрадикал з 3 - 6 ставляють, кожний, атом гідрогену, алкоатомами карбону; ксирадикал з 1-5 атомами карбону, амінорадикал, n - дорівнює цілому числу від 0 до 5; карбоксирадикал, алкоксикарбонілрадикал 2-6 m - дорівнює цілому числу від 1 до 5; атомів карбону, гідроксирадикал, нітрорадикал, R5 та R6 - які є ідентичними або різними, предгідроксіамінорадикал, радикал формули: ставляють, кожний, атом гідрогену, лінійний або -Alk-COOR7, розгалужений алкілрадикал з 1-5 атомами карбону -NR5R6, або бензилрадикал; -NH-Alk-COOR7, R7 - представляє атом гідрогену або алкілра-NH-COO-Alk, дикал з 1-5 атомами карбону; -N(R11)-S02-Alk-NR9R10 , R8 - представляє алкілрадикал з 1-5 атомами -N(R11)-SO2-Alk, карбону або радикал -CO-Alk; -N(R11)-AIk-NR5R6, Ph - представляє фенілрадикал, який заміще-N(R11)-CO-Alk-NR 9R10 , но, як варіант, одним або більше атомами галоге-N(R11)-CO-Alk, ну, одним або більше алкоксирадикалами з 1-5 -N(R11)-CO-CF3, атомами карбону, одним або більше карбоксира-NH-Alk-HetN, дикалами або одним або більше алкоксикарбоніл-O-Alk-NR9R10 , радикалами з 2-6 атомами карбону; -O-Alk-CO-NR 5R6, R2 - представляє алкілрадикал з 1-5 атомами -O-Alk-HetN, карбону, трифлуорметилрадикап, цикпоалкілрадив яких n, m, Alk, R5, R6 тa R7 мають значення, кал з 3-6 атомами карбону або фенілрадикал, який наведені вище для R1, та заміщено, як варіант, одним або більше атомами R9 та R10 - які є ідентичними або різними, галогену, одним або більше алкоксирадикалами з представляють, кожний, атом гідрогену або алкіл1-5 атомами карбону, одним або більше карбоксирадикал з 1-5 атомами карбону; радикалами або одним або більше алкоксикарбоR11 - представляє атом гідрогену або радикал нілрадикалами з 2-6 атомами карбону; Alk-COOR 12, де R12 представляє атом гідрогену, А - представляє радикал -CO- або -SO2-; алкілрадикал з 1-5 атомами карбону або бензил R3 та R4 - які є ідентичними або різними, предрадикал; ставляють, кожний, атом гідрогену, алкоксираHetN - представляє 5- або 6-членний гетеродикал з 1-5 атомами карбону, амінорадикал, карцикл, що містить принаймні один атом нітрогену боксирадикал, алкоксикарбонілрадикал з 2-6 атота, як варіант, другий гетероатом, вибраний з нітмами карбону, нітрорадикал, гідроксіамінорадикал, рогену та оксигену, або R3 та R4 утворюють разом радикал формули: 13 78016 14 -Alk-COOR7, метил 3-[(1 -метокси-2-метиліндолізин-3-іл ка-NR5R6, рбоніл]бензоат; -NH-Alk-COOR7, 4-[(1-метокси-2-метиліндолізин-3-NH-COO-Alk, іл)карбоніл]бензойна кислота; -N(R11)-SO2-Alk-NR9R10, 2-аміно-5-[(1-метокси-2-метиліндолізин-3-N(R11)-SO2-Alk, іл)карбоніл)бензойна кислота; -N(R11)-Alk-NR5R6, 2-аміно-5-({1 -[(3-метоксибензо(л)аміно]-2- ме-N(R11)-CO-Alk-NR 9R10 , тиліндолізин-3-іл}карбоніл)бензойна кислота; -N(R11)-CO-Alk, 2-аміно-5-({2-метил-1-[(3,4,5-N(R11)-CO-CF3, триметоксибензоїл)аміно]індолізин-3-іл}карбоніл)-NH-Alk-HetN, бензойна кислота; в яких: n, m, Alk, R 5, R6 та R7 мають значення, 2-аміно-5-({1-{[(Знаведені вище для R1, та метоксифеніл)сульфоніл]аміно}-2-метиліндолізинR9 та R10 - які є ідентичними або різними, 3-іл}карбоніл)-бензойна кислота, представляють, кожний, атом гідрогену або алкіляк варіант, у формі одної з її фармацевтично радикал з 1-5 атомами карбону; прийнятних солей. R11 - представляє атом гідрогену або радикал Представлений винахід стосується також споAlk-COOR 12, де R12 представляє атом гідрогену, собу отримання сполуки формули І, що характериалкілрадикал з 1-5 атомами карбону або бензилзується тим, що радикал; А) по хідне індолізину формули II: HetN представляє 5- або 6-членний гетероцикл, що містить принаймні один атом нітрогену II та, як варіант, другий гетероатом, вибраний з нітрогену та оксигену, як варіант, у формі одної з її фармацевтично в якому: прийнятних солей. R1 та R2 - мають значення, наведені для форСполука формули І є особливо кращою, коли мули І, але R2 не представляє атом гідрогену або R1 - представляє алкоксирадикал з 1-5 атомаалкілгалогенорадикал, ми карбону, карбоксирадикал, радикал -О-Alkконденсують з похідним формули III: COOH, в якому Alk представляє лінійний або розгалужений алкіленрадикал з 1-5 атомами карбону, III радикал формули -O-Alk-Ph, в якому Alk представляє алкіленрадикал з 1-5 атомами карбону та Ph представляє фенілрадикал, який заміщено, як вав якому: X - представляє атом галогену; ріант, одним або більше атомами галогену або R3 або R4 - які є ідентичними або різними, одним або більше алкоксирадикалами з 1-5 атопредставляють, кожний, атом гідрогену, нітрорамами карбону або одним або більше карбоксирадикал, трифлуорацетамідорадикал або алкоксикадикалами, радикал формули -NH-CO-Ph, радикал формули -NH-SO2-Ph або радикал формули -NHрбонілрадикал з 2-6 атомами карбону, для отримання сполуки формули la, Id або Ik: CO-NH-Ph; R2 - представляє алкілрадикал з 1-5 атомами карбону; А - представляє радикал -CO-; Ia R3 та R4 - як є різними, представляють, кожний, атом гідрогену, алкоксирадикал з 1-5 атомами карбону, амінорадикал, карбоксирадикал або алде: коксикарбонілрадикал з 2-6 атомами карбону, R3 та/або R4=-NO2. як варіант, у формі одної з її фармацевтично прийнятних солей. Серед сполук винаходу, сполуки особливо кращими є сполуки: Id (4-аміно-3-метоксифеніл)(1-метокси-2метиліндолізин-3-іл)метанон; 3-(4-аміно-3-метоксибензоїл)-2де: метиліндолізин-1-іл карбонова кислота; R3 та/або R4=-CO2-Alk. 2-{[3-(4-аміно-3-метоксибензоїл)-2- метиліндолізин-1-іл]окси}оцтова кислота; (4-аміно-3-метоксифеніл){1-[(4хлорбензил)окси]-2-метиліндолізин-3-іл}метанон; Ik (4-аміно-3-метоксифеніл){1-[(3метоксибензил)окси]-2-метиліндолізин-3іл)метанон; де: 4-({[3-(4-аміно-3-метоксибензоїл)-2- метилінR3 та/або R4=-NH-COCF3. долізин-1-іл]окси}метил)бензойна кислота; а тоді, 3-(4-карбоксибензоїл)-2-метиліндолізин-1-іл а) сполуки формули la відновлюють для отрикарбонова кислота; мання сполук формули Іb: 15 78016 Ib де: R3 та/або R4=-NH2. в яких: R3 та/або R4 представляють амінорадикал, сполуки формули Іb тоді піддають дії алкіл галогеніду для отримання сполук формули І, в яких R4 та/або R3 представляють радикал -NR5R6 (в якому R5 представляє атом гідрогену, a R6 представляє алкілрадикал з 1-5 атомами карбону) та радикал NH-Alk-NR5R6 або радикал -NH-Alk-COOR7 (в якому R7 не представляє атом гідрогену), з якої наступним омиленням отримують сполуки формули І, в яких R4 та/або R3 представляють радикал -NHAlk-COOR 7, в якому R7 представляє атом гідрогену, або ацилують для отримання сполук формули І, в яких R4 та/або R3 представляють радикал -NH-COAlk, або радикал -NH-CO-Alk-NR 9R10, які тоді алкілують для отримання радикал -N(R11)-CO-Alk або радикал -N(R11)-CO-Alk-NR 9R10, де R11 представляє радикал -Alk-COOR12, в якому R12 не представляє атом гідрогену, останні сполуки тоді, як варіант, омилюють для отримання сполук формули І, в яких R4 та/або R3 представляють радикал -N(R11)CO-Alk або радикал –N(R11)-CO-Alk-NR 9R10 , де R11 представляє радикал -Alk-COOH, або сульфонілують для отримання сполук формули І, в яких R4 та/або R3 представляють радикал NH-SO2-Alk або радикал -NH-S02-Alk-NR9R10, які тоді алкілують для отримання радикалу -N(R11)SO2-Alk або радикалу –N(R11)-SO2-Alk-NR9R10, де R11 представляє радикал -АІк-COOR12, в яких R12 не представляє атом гідрогену, останні сполуки тоді, як варіант, омилюють для отримання сполук формули І, в яких R4 та/або R3 представляють радикал –N(R 11)-SO2-Alk або радикал –N(R11)-SO2AIk-NR9R10, де R11 представляє радикал -AlkCOOH. b) сполуки формули Id, в яких R3 та/або R4 представляють алкоксикарбонілрадикал, омилюють для отримання сполук формули І, в яких R3 та/або R4 представляють карбоксирадикал, або с) коли R1 представляє бензилоксирадикал, сполуки формули Іа піддають дії трифлуороцтової кислоти або сполуки формули Id гідруванню, для отримання сполук формули If: If в яких R3 та/або R4 мають значення, наведені вище, а тоді сполуки формули If піддають Оалкілуванню для отримання сполук формули Іg: 16 Ig в яких R3 та/або R4 мають значення, наведені вище, a R1 представляє лінійний або розгалужений алкоксирадикал з 1-5 атомами карбону, радикал -O-(CH2)n-cAlk, радикал -O-Alk-COOR7, радикал -O-Alk-NR5R6, радикал -O-(CH2)n-Ph, або радикал -O-Alk-O-R8, які, коли R8 представляє радикал -СОСН3, можуть давати наступним омиленням радикал -O-Alk-OH або радикал -О-Alk-CN, який обробкою гідроксиламіном дає радикал -OAlk-C(NH2)=NOH, або d) коли R1 представляє алкоксикарбонілрадикал, сполуки формули Іа омилюють для отримання сполук формули Ih: Ih в яких R3 та/або R4 мають значення, наведені вище, які тоді піддають дії амінопохідного для отримання сполук формули І, в яких R1 представляє радикал -CO-NH-Alk, або дії амінокислотного похідного для отримання сполук формули І, в яких R1 представляє радикал -CO-NH-(CH2)m-COOR 7, aбo e) коли R1 представляє радикал -NH-СО2-тБутил, сполуки формули Іа або Id піддають або алкілуванню, а потім зняттю захисту та, як варіант, другому алкілуванню для отримання сполук формули Іi: Ii або зняттю захисту, а потім ацилуванню для отримання сполук формули Ij: Ij в яких R5 представляє атом гідрогену, а потім, як варіант, алкілуванню для отримання сполук формули Ij, в яких R5 представляє алкілрадикал, або f) коли R1 представляє радикал -NH-СО2-тБутил, сполуки формули Ik піддають або зняттю захисту, а потім ацилуванню для отримання сполук формули II: Il або зняттю захисту з наступним сульфонілуванням для отримання сполук формули Іm: 17 78016 18 формули Іа відновленням нітрофункціональної групи. Піддаванням сполуки формули Іb дії алкілгалогеніду отримують сполуки формули Іс, в яких Im R3 та/або R4 представляють радикал -NR5R6 (де R5 представляє атом гідрогену, a R6 має значення, наведені вище), радикал -NH-Alk-NR 5R6 або радиабо зняттю захисту з наступною обробкою фекал -NH-Alk-COOR 7, в яких R7 не представляє нілізоціанатом для отримання сполук формули In: атом гідрогену. Сполуки, в яких R1 представляє атом гідрогену, отримують з останніх сполук піддаванням їх наступному омиленню. In Ацилуванням сполук формули Іb, отримують сполуки формули Іс, де R3 та/або R4 представляють радикал -NH-CO-Alk або радикал -NH-CO-AlkNR9R10. або Піддаванням цих сполук, де R3 та/або R4 В) коли R1 представляє електроноакцепторну представляють радикал -NH-CO-Alk або радикал груп у, R2 представляє атом гідрогену або алкілгаNH-CO-Alk-NR9R10, алкілуванню похідним, що міслогенорадикал, а А представляє радикал -CO-, тить алкоксикарбонільний залишок, отримують піридин реагує з бромацетофеноном формули IV: сполуки формули І, де R 3 та/або R4 представляють радикал -N(R11)-CO-Alk або радикал -N(R11)-COIV Alk-NR9R10, де R11 представляє радикал -AlkCOOR12, де R12 не представляє атом гідрогену. Піддаванням останніх продуктів омиленню, отридля отримання сполук формули V: мують сполуки, де R3 та/або R4 представляють радикал -N(R11)-CO-Alk або радикал -N(R11)-COAlk-NR9R10, де R11 представляє радикал -AlkV COOH. Сульфонілуванням сполук формули Іb, сполуки формули Іс отримують, де R3 та/або R4 предякі тоді піддають 1,3-диполярному циклододаставляють радикал -NH-SO2-Alk або радикал -NHванню з етилакрилатом або галогенованим похідSO2-Alk-NR9R10. ним етилкротонату у присутностіокиснику для Піддаванням цієї сполуки, де R3 та/або R4 отримання сполук формули Іа, в яких R1 предстапредставляють радикал -NH-SO2-Alk або радикал вляє етоксикарбонілрадикал, a R2 представляє NH-S02-Alk-NR9R10, алкілуванню похідним, що місатом гідрогену або алкілгалогенорадикал. тить алкоксикарбонільний залишок, отримують Фіг.1 та Фіг.2 представляють схему синтезу сполуку формули І, де R3 та/або R4 представляють продуктів від Іа до Іg та Ik. радикал -N(R11)-SO2-Alk або радикал -N(R11)-SO2Сполуки формули Іа, в яких R2 представляє Alk-NR9R10, де R11 представляє радикал -Alkатом гідрогену або алкілгалогенорадикал, А предCOOR12, де R12 не представляє атом гідрогену. ставляє радикал -CO-, a R1 представляє електроПіддаванням останніх продуктів омиленню, отриноакцепторну груп у, як-то алкоксикарбоніл, отримують сполуки, де R3 та/або R4 представляють мують згідно з відомими способами радикал -N(R11)-SO2-Alk або радикал -N(R11)-S02циклододавання [J. Heterocyclic Chem. – 2001. – Alk-NR9R10, де R11 представляє радикал -Alk38. – P.853-857]. COOH. Реагуванням похідного індолізину формули II з алкоксикарбонілбензоїлхлоридним похідним формули III отримують сполуки формули Id, в яких R3 та/або R4 представляють алкоксикарбонілрадикал. Піддаванням останніх сполук омиленню отримуСполуки(Ia)A=CO ють сполуки формули Іе, в яких R3 та/або R4 предR,=CO2Et R2=H або АлкXn ставляють карбоксирадикал. Кватернізація піридину прийнятно заміщеним Реагуванням похідного індолізину формули II з бромацетофеноном дає піридиній. 1,3-диполярне трифлуорацетамідобензоїлхлоридним похідним циклододавання останнього провадять у присутформули III, отримують сполуки формули Ik, в яких ності окиснику, як-то тетрапіридинкобальт(ІІ) дихR3 та/або R4 представляють трифлуорацетамідний ромат, у полярному розчиннику, як-то диметилфорадикал. Піддаванням останніх сполук основному рмамід. гідролізу отримують сполуки формули Ik, в яких R3 Сполуки згідно з винаходом, коли R3 та/або R4 та/або R4 представляють карбоксил та/або амінопредставляють нітрорадикал, отримують відомими радикал. способами бензоїлування [Eur. J. Med. Chem. Як представлено на Фіг.2, починаючи зі сполук Chim. Ther. – 1983. - 18(4). – P.339-346] з похідного формули І, в яких R1 представляє бензилоксираіндолізину формули II та похідного нітробензоїлхдикал, a R3 або R4 представляють алкоксикарбонілориду або похідного нітробензолсульфонілхлолрадикал, можливо отримувати піддаванням цих риду, ці сполуки відповідають сполуці формули III. сполук гідруванню сполуки формули If. Коли R3 Сполуки формули Іа отримують таким чином. або R4 представляє нітрорадикал, сполуки формуСполуки формули Іb, в яких R3 та/або R4 предли If отримують дією трифлуороцтової кислоти. ставляють амінорадикал, отримують зі сполуки 19 78016 20 Піддаванням сполуки формули If Омозку. Відтак, нерегульовану проліферацію ендоалкілуванню, отримують сполуки формули Іg, в теліальних клітин та мобілізацію ангіобластів з яких R1 представляє лінійний або розгалужений кісткового мозку спостерігають у процесах неовасалкоксирадикал з 1-5 атомами карбону, радикал куляризації пухлин. Показано in vitro та in vivo, що O-(CH2)n-cAlk, радикал -O-Alk-COOR7, радикал -Oкілька факторів росту стимулюють ендотеліальну Alk-NR5R6, радикал -О-(СН2)n-Ph, радикал -O-Alkпроліферацію, а зокрема, FGF1 або a-FGF та O-R8 - який, коли R8 представляє радикал -СОСН3, FGF2 або b-FGF. Ці два фактори індукують проліможе давати омиленням, радикал -O-Alk-OH, раферацію, міграцію та продукування протеази ендикал -O-Alk-CN, який може давати радикал -Одотеліальними клітинами у культурі та неоваскуAlk-C(NH2):NOH обробкою гідроксиламіном. ляризацію in vivo. a-FGF та b-FGF взаємодіють з Для отримання сполук формули Іh, в яких R1 ендотеліальними клітинами через два класи рецепредставляє карбоксирадикал, а А представляє пторів, з тирозин-кіназною активністю (FGFR) та радикал -CO- або радикал -SO2, сполуки формули рецепторів з низькою афінністю типу протеоглікану Іа, в яких R1 представляє алкоксикарбонілрадикал, гепарин-сульфату (HSPG), розташованих на повеомилюють. Похідні індолізин-1-ілкарбонової кислорхні клітин та у зовніклітинних матрицях. Паракти формули Ih, так отримані, можна тоді піддавати ринна роль цих двох факторів стосовно ендотелідії аміну для отримання сполук формули Ih, в яких альних клітин описано широко, a-FGF та b-FGF R1 представляє радикал -CO-NH-Alk, або дії аміномогли б також діяти на ці клітини автокринним кислотного похідного для отримання сполук форпроцесом. Відтак, a-FGF та b-FGF та їх рецептори мули І, в яких R1 представляє радикал -CO-NHпредставляють дуже придатні цілі для терапії при (CH2)m-COOR 7. інгібуванні процесу ангіогенезу [Keshet Ε., BenСполуки формули II, коли R1 представляє раSasson S.A. // J. Clin. Invest. – 1999. - Vol.501. – дикал -NH-СО2-т-Бутил або радикал P.104-1497; Presta M., Rusnati M., Dell'Era P., N(CH3)CH2C6H5, отримують згідно з наступними Tanghetti E., Urbinati C, Giuliani R. et al. - New York: схемами синтезу, застосовуючи реакцію ЧичибабіPlenum Publishers, 2000. - P.7-34; Billottet C, Janji на [Synthesis. – 1975. – P. 209] для отримання інВ., Thiery J.P., Jouanneau J. // Oncogene. – 2002. долізинів. Vol. 21. – P.8128-8139]. Більш того, систематичні дослідження для визначення експресії внаслідок a-FGF та b-FGF та їх рецепторів (FGFR) на різних типах клітин пухлин демонструють, що клітинна реакція на ці два фактори F є функціональною у великій більшості досліджених ліній пухлин людини. Ці результати підтримують гіпотезу, що антагоніст a-FGF та b-FGF міг би також інгібувати проліферацію клітин пухлин [Chandler L.A., Sosnowski B.A., Greenlees L, Aukerman S.L, Baird Α., Pierce G.F. // Int. J. Cancer. – 1999. - Vol.58. - P.81-451]. a-FGF та b-FGF грають важливу роль у рості Сполуки формули II, коли R1 представляє рата підтримці клітин простати, важливу роль у продикал -ОСН3 або радикал -ОСН2С6Н5, також отригресуванні раку простати. Дійсно, у цих патологіях мують, застосовуючи реакцію Чичибабіна згідно з реєструють збільшення продукування a-FGF та bнаступними схемами синтезу: FGF фібробластами та ендотеліальними клітинами у пухлині та збільшення експресії рецепторів FGFR на клітинах пухлин. Відтак, відбувається паракринна стимуляція раку клітин простати, і цей процес міг би бути головним компонентом цієї патології. Сполука, що має антагонізувальну активність стосовно рецептору FGFR, як-то сполуки Сполуки формули І є потужними антагоністами представленого винаходу, може представляти FGF1 та 2. Їх можливості інгібувати як утворення кращу терапію при цих патологіях [Gin D., Ropiquet нових судин з диференційованих ендотеліальних F. // Clin. Cancer Res. – 1999. - Vol. 71. – P.5-1063; клітин, так і для блокування диференціації клітин Doll J.A., Reiher F.K., Crawford S.E., Pins M.R., кісткового мозку дорослої людини CD34+ в ендоCampbell S.C., Bouck N.P. // Prostate. – 2001. теліальні клітини CD133+, продемонстровано in Vol.305. - P.49-293]. vitro. Далі, їх можливість інгібувати патологічний Кілька досліджень показують присутність aангіогенез продемонстровано in vivo. FGF та b-FGF та їх рецепторів FGFR у лініях пухВзагалі, FGF сильно залучено шляхом автолин молочної залози людини (зокрема, MCF7) та у кринної, паракринної або юкстакринної секреції, у біопсії пухлин. Ці фактори могли б бути відповідявища дерегулювання стимуляції росту ракових ними за цю патологію стосовно виникнення дуже клітин. Далі, FGF впливають на ангіогенез пухлин, агресивного фенотипу, що індукує високе виникякий грає переважну роль у рості п ухлин, а також у нення метастазів. Відтак, сполука, що має антагоявищах виникнення метастазів. нізувальну активність стосовно рецептору FGF, якАнгіогенез є способом створення нових капіто сполуки формули І, може представляти кращу лярних судин з попередньо існуючих судин або терапію у цих патологіях [Vercoutter-Edouart A-S., мобілізацією та диференціацією клітин кісткового Czeszak X., Crepin M., Lemoine J., Boilly В., Le 21 78016 22 Bourhis X. et al. // Exp. Cell Res. – 2001. - Vol.262. з прогресуванням деяких цих патологій. P.59-68]. Більш конкретно показано у клітинах CLL (хроЗлоякісні меланоми є пухлинами, які індукують нічна лімфоцитна лейкемія), що b-FGF індукує метастази з високою частотою та які є дуже резисзбільшення експресії антиапоптотичного білку тентними до різних типів хемотерапії. Процеси (ВсІ2), викликаючи збільшення виживання цих кліангіогенезу грають переважну роль у прогресувантин та тому приймаючи сильну участь в їх перені злоякісної меланоми. Далі, показано, що можлитворенні у злоякісні. Далі, рівні b-FGF, виміряні у вість виникнення метастазів збільшується дуже цих клітинах, дуже добре корелюють з етапом клісильно зі збільшенням васкуляризації первинної нічного прогресу хвороби та резистентністю до пухлини. Клітини меланоми продукують та секрехемотерапії, застосованої при цій патології (флутують різні ангіогенні фактори, включаючи a-FGF дарабін). ' Відтак, сполука, що має антагонізувальта b-FGF. Більш того , показано, що інгібування ну активність стосовно рецептору FGFR, як-то клітинної дії цих двох факторів розчинним FGFR1 сполуки представленого винаходу, може предстаблокує проліферацію in vitro та виживання клітин вляти кращу терапію, у комбінації з флуда-рабіном пухлини меланоми та блокує прогресування пухабо іншими активними продуктами, при цій патолин in vivo. Відтак, сполуку, що має антагонізувалогії [Thomas D.A., Giles F.J., Cortes J., Albitar Μ., льну активність стосовно рецептору FGFR, як-то Kantarjian H.M. // Acta Haematol. – 2001. - Vol.207. сполуки представленого винаходу, може предстаP.106-190; Gabrilove J.L. // Oncologist. – 2001. вляти кращу терапію у цих патологіях [Rofstad Vol.6. - P.4-7]. Ε.Κ., Halsor E.F. // Cancer Res. - 2000; Yayon Α., Ma Існує кореляція між процесом ангіогенезу кістY-S., Safran M., Klagsbrun M., Halaban R. // кового мозку та екстрамедулярними хворобами у Oncogene. – 1997. - Vol.14. - P.2999-3009]. CML (хронічна мієломоноцитна лейкемія). Різні Клітини гліоми продукують in vitro та in vivo aдослідження демонструють, що інгібування ангіоFGF та b-FGF та мають різні FGFR на їх поверхні. генезу, зокрема, сполукою, що має антагонізуваЦе тому підказує, що ці два фактори шляхом автольну активність стосовно рецептору FGFR, могло кринної та паракринної дії грають основну роль у б представляють кращу терапію при цій патології. прогресуванні цього типу пухлин. Далі, подібно Проліферація та міграція клітин гладеньких більшості твердих пухлин, прогресування гліом та м'язів судин сприяють інтимальній гіпертрофії арїх здатності індукувати метастази є високо залежтерій та відтак грають переважну роль у атероним від ангіогенних процесів у первинній пухлині. склерозі та у рестенозі після ангіопластики та енТакож показано, що антирозпізнавання FGFR1 дартеректомії. блокують проліферацію астроцитом людини. Далі, Дослідження in vivo показують локальне проописано похідні нафталінсульфонату стосовно дукування a-FGF та b-FGF після ураження сонної інгібування клітинної дії а-FGF та b-FGF in vitro та артерії пораненням балоном. У цій моделі ангіогенезу, індукованого цими факторами росту in aнтиFGF2 нейтралізуюче антитіло інгібує проліфеvi vo. Інтрацеребральна ін'єкція цих сполук індукує рацію клітин гладеньких м'язів та відтак зменшує дуже значне збільшення апоптозу та суттєве змеінтимальну гіпертрофію. ншення ангіогенезу, призводячи до о значної реХимерний білок FGF2 зв'язаний з молекулою, гресії гліом у щури. Відтак, сполука, що має антаяк-то сапонін, блокує приєднання b-FGF до їх регоністичну активність стосовно a-FGF рецепторів цепторів FGFR, інгібує проліферацію клітин гладета/або b-FGF та/або FGFR, як-то сполуки предстаньких м'язів in vitro та інтимальну гіпертрофію in вленого винаходу, може представляти кращу теvi vo [Epstein C.E., Siegall С.В., Biro S., Fu Y.M., рапію у цих патологіях [Yamada S.M., Yamaguchi FitzGerald D. // Circulation. – 1991. - Vol.87. - P.84F., Brown R., Berger M.S., Morrison R.S. // Glia. – 778; Waltenberger J. // Circulation. – 1997. - P.961999. - Vol.76. - P. 28-66; Auguste P., Gursel D.B., 4083]. Lemiere S., Reimers D., Cuevas P., Carceller F. et al. Відтак, антагоністи рецепторів FGFR, як-то // Cancer Res. – 2001. - Vol. 26. - P. 61-1717]. сполуки представленого винаходу, представляють Нещодавно документовано потенційну роль кращу терапію, поодинці або у комбінації зі сполупроангіогенних засобів у лейкемії та лімфомах. ками антагоністів інших факторів росту, залучених Дійсно, взагалі показано, що клітинні клони у цих у цих патологіях, як-то PDGF, у лікуванні патологій патологіях можуть природно руйнуватися імунною пов'язаних з проліферацією клітин гладеньких м'ясистемою або переключатися на ангіогенний фезів, як-то атеросклероз, рестеноз після ангіопласнотип, який підтримує їх виживання, а тоді їх протики або після вставки ендосудинних протезів ліферацію. Цю зміну фенотипу індуковано зверхе(стентів) або хір ургічного шунта аортокспресією ангіогенних факторів, зокрема, -коронарної артерії. макрофагами, та/або мобілізацією цих факторів із Серцева гіпертрофія відбувається у реакції на зовніклітинної матриці [Thomas D.A., Giles F.J., стрес шлуночкової стінки, індукований перевантаCortes J., Albitar M., Kantarjian H.M. // Acta женням у термінах тиску або об'єму. Це переванHaematol. – 2001. - Vol.207. - P.106-190]. Серед таження може бути наслідком ряду фізіопатологічангіогенних факторів b-FGF виявлено у ряді лімних станів, як-то гіпертензія, АС (коарктація аорти), фобластичних та гематопоетичних ліній клітин інфаркт міокарду та різні судинні розлади. Наслідпухлин. Рецептори FGFR також присутні на більками цієї патології є морфологічні, молекулярні та шості цих ліній, що підказує можливу автокринну функціональні зміни, як-то гіпертрофія серцевих клітинну дію a-FGF та b-FGF, що індукують проліміоцитів, накопичення матричних білків та реекспферацію цих клітин. Більш того, показано, що ангіре-сія зародкових генів. b-FGF залучено при цій огенез кісткового мозку паракринною дією корелює патології. Дійсно, додавання b-FGF до культур 23 78016 24 кардіоміоцитів новонароджених щурів модифікує рактеризуються імунною дисфункцією, яка припрофіль відповідних генів стосовно скорочувальзводить до неприйнятного продукування запальних білків, викликаючи профіль гена зародкового них цитокінів, що індукують утворення локальної типу. На додаток, міоцити дорослих щурів показумікросудинної системи. Наслідком цього ангіогенеють гіпертрофічну реакцію під дією b-FGF, цю реазу запального походження є кишкова ішемія, індукцію блокують антиb-FGF нейтралізуючі антитіла. кована звуженням судин. Високі циркуляційні та Експерименти проведені in vivo на трансгенних локальні рівні b-FGF вимірюють у пацієнтів, що нокаутних мишах стосовно b-FGF показують, що bпотерпають від цих патологій [Kanazawa S., FGF є головним стимулювальним фактором при Tsunoda Т., Onuma Ε., Majima Т., Kagiyama Μ., гіпертрофії серцевих міоцитів при цій патології Kkuchi К. // American Journal of Gastroenterology. – [Schultz Je.J., Witt S.A., Nieman M.L., Reiser P.J., 2001. - Vol.28. - P.96-822; Th або Ν Μ., Raab Υ., Engle S.J., Zhou M. et al. // J. Clin. Invest. – 1999. Larsson Α., Gerdin В., Hallgren R. // Scandinavian Vol.19. - P.104-709]. Journal of Gastroenterology. – 2000. - Vol.12. - P.35Відповідно, сполука, як-то сполуки представ408]. Сполуки винаходу, які виявляють високу анленого винаходу, що має антагонізувальну активтиангіогенну активність у моделі запального ангіоність стосовно рецептору FGFR, представляє генезу, представляють кращу терапію у цих патокращу терапію у лікуванні серцевої недостатності логіях. та будь-якої іншої патології, асоційованої з дегеFGFR1, 2 та 3 залучено у процеси хроногенезу нерацією серцевої тканини. Це лікування можна та остеогенезу. Мутації, викликаючи експресі пербуло б провадити поодинці або у комбінації з суманентно активованих FGFR, пов'язані з великим часними типами лікування (бета-блокатори, діуречислом генетичних хвороб людини в результаті тики, антагоністи ангіотензину, антіаритміки, антидефектів скелету, як-то синдроми Пфейфера, Крокальцієві засоби, антитромботики, тощо). усона, Аперта, Джексона-Вейсса та зморшкуватої Судинні розлади, викликані діабетом, характешкіри Беара-Стивенсона. Деякі з цих мутацій, які ризуються зміною реакційності судин та потоку впливають більш особливо на FGFR3, викликають, крові, гіперпроникністю, загостреною проліферазокрема, ахондроплазію (АСН), гіпохондроплазію тивною реакцією та збільшенням відкладень мат(НСН) та TD (Танатофорна дисплазія), АСН є найричного білку. Точніше, a-FGF та b-FGF, наявні у звичайнішою формою нанізму. З біохімічної точки преретинальних мембранах пацієнтів з діабетичзору безперервна активація цих рецепторів відбуною ретинопатією, у мембранах нижчерозташовавається через димеризацію рецептору у відсутносних капілярів та у рідині склоподібного тіла пацієнті ліганду [Chen. L, Adar R., Yang X., Monsonego тів, що потерпають від проліферативної E.O., LI С., Hauschka P.V., Yagon А., Deng C.X. // ретинопатії. Розчинний рецептор FGFR здатний до Journal of Clin. Invest. – 1999. - Vol.104. - №11. приєднання a-FGF та b-FGF, розвивається при P.1517-1525]. Відтак, сполуки винаходу, які виявсудинних розладах, пов'язаних з діабетом [Tilton ляють антагоністичну активність стосовно приєдR.G., Dixon R.A.F., Brock Т.А. // Exp. Opin. . In vest. нання b-FGF та FGFR, а відтак інгібують димериЛіки. – 1997. - Vol.84. - P.6-1671]. Відтак, сполука, зацію рецептору, представляють кращу терапію у як-то сполуки формули І, що має антагонізувальну цих патологіях. активність стосовно рецептору FGFR, представляє Внаслідок їх низької токсичності та їх фармакращу терапію поодинці або у комбінації зі сполукологічних та біологічних властивостей сполуки ками антагоністів інших факторів росту, залучених представленого винаходу знаходять застосування у ци х патологіях, як-то VEGF. у лікуванні будь-якої карциноми, що має високий Ревматоїдний артрит (RA) є хронічною хвороступінь васкуляризації (легені, молочні залози, бою невідомої етіології. Оскільки він вражає ряд простата, стравохід), або індукує метастаз (ободоорганів, найсуворіша форма RA представляє прова кишка, шлунок, меланома) або чутливі до aгресивне синовіальне запалення суглобів, виклиFGF або до b-FGF автокринним чином, або, під каючи деструкцію. Ангіогенез виявляє сильний кінець, у патологіях типу лімфоми та лейкемії. Ці вплив на прогресування цієї патології. Відтак, aсполуки представляють кращу терапію поодинці FGF та b-FGF виявлені у синовіальній тканині та у або у комбінації з прийнятною хемотерапією. Спорідині суглобів пацієнтів, що потерпають від RA, луки згідно з винаходом також знаходять застосувказуючи, що цей фактор росту залучено у ініціавання у лікуванні серцево-судинних хвороб, як-то цію та/або прогресування цієї патології. У ΑΙΑ моатеросклероз, пост-ангіопластичний рестеноз, у делі (індукована ад'ювантом модель артриту) у лікуванні хвороб, пов'язаних з ускладненнями, які щурів показано, що зверхекспресія b-FGF збільз'являються після вставки ендосудинних протезів шує суворість хвороби, а антиb-FGF нейтралізуюта/або шунта аорто-коронарної артерії або інших че антитіло блокує прогресування RA [Yamashita судинних трансплантатів, та серцевою гіпертрофіΑ., Yonemitsu Y., Okano S., Nakagawa К., Nakaєю або судинними ускладненнями при діабеті, якshima Υ., Irisa Т. et al. // J. Immunol. – 2002. - Vol.57. то діабетична ретинопатія. Сполуки згідно з вина- P.168-450; Manabe N., Oda H., Nakamura K., Kuga ходом також знаходять застосування у лікуванні Y., Uchida S., Kawaguchi H. // Rheumatol. – 1999. хронічних запальних хвороб, як-то ревматоїдний Vol.20. - P.38-714]. Отже, сполуки згідно з винахоартрит або IBD. Під кінець, сполуки згідно з винадом представляють кращу терапію при .цій патоходом можна використовувати у лікуванні ахондлогії. роплазії (АСН), гіпохондроплазії (НСН) та TD (таIBD (запальні хвороби кишечнику) містять дві натофорна дисплазія). форми хронічних запальних хвороб кишечнику: UC Згідно з іншими його можливостями об'єктом (виразковий коліт) та хвороба Крона (CD). IBD хапредставленого винаходу є тому фармацевтична 25 78016 26 композиція, що містить як активний інгредієнт споілкарбамату луку формули І згідно з винаходом або одну з її 11,7г (62,4ммоль) калій карбонату та 6,3г фармацевтично прийнятних солей, як варіант, у (72ммоль) літій броміду додають до 10г (48ммоль) комбінації з одним або більше інертними та притрет-бутил [(піридин-2-іл)метил]карбамату у 50мл йнятними ексципієнтами. ацетонітрилу, а потім 5мл (62,4ммоль) хлорацетоВказані ексципієнти вибрано згідно з фарману та середовище гріють при температурі кипіння цевтичною формою дозування та бажаним режипід зворотним холодильником протягом ночі, охомом застосування: пероральний, сублінгвальний, лоджують та додають 40мл води та 11,7г підшкірний, внутрішньом'язовий, внутрішньовен(62,4ммоль) калій карбонату і середовище гріють ний, трансдермальний, крізьслизовий, локальний при 90°С протягом 2,5год. Реакційне середовище або ректальний. охолоджують та екстрагують етилацетатом. Фармацевтичні композиції згідно з представОрганічну фазу видаляють після відстоюванленим винаходом переважно застосовують пеня, промивають насиченим водним розчином нароральним шляхом. трій хлориду, сушать безводним натрій сульфатом У фармацевтичних композиціях представленота концентрують під зменшеним тиском. Продукт го винаходу для перорального застосування актиочищають флеш-хроматографією на колонці з оквні інгредієнти можна застосовувати у формі одисидом силіцію, елюючи сумішшю толуниць дозування для застосування як суміші зі ол/етилацетат (95:5). Збирають 6,27г білого порозвичайними фармацевтичними носіями. Прийнятні шку. форми одиниць дозування для застосування місВихід: 53%. Температура плавлення: 111°С. тять, наприклад, таблетки, які є, які варіант, рифОтримання II леними, желатинові капсули, порошки, гранули та Синтез N-бензил-N-метил-N-(2пероральні розчини або суспензії. метиліндолізин-1-іл)аміну Коли тверду композицію отримують у формі Цю сполуку отримують тим же способом, що таблеток, головний активний інгредієнт змішують з сполуку з отримання І, застосовуючи реакцію Чифармацевтичним наповнювачем, як-то желатин, чибабіна та, починаючи з 2,47г N-бензил-N-метилкрохмаль, лактоза, магній стеарат, тальк, гуміараN-[(піридин-2-іл)метил]амін та хлорацетон. Отрибік тощо. мують 970мг жовтого масла. Вихід: 34% MacМожливо покривати таблетки сахарозою або спектрометрія (режим ЕР+): МН+=251. іншими прийнятними матеріалами, або альтернаОтримання III тивно можливо обробляти їх так, щоб вони мали Синтез 1-метокси-2-метиліндолізину пролонговану або затриману активність та безпеЦю сполуку отримують, починаючи з 2рервно вивільнення попередньо визначеної кіль(метоксиметил)піридину та хлорацетону, застосокості активного інгредієнту. вуючи реакцію Чичибабіна. Продукт виділяють у Препарат у формі желатинових капсул отриформі жовтого масла, яке кристалізується у холомують змішуванням активного інгредієнту з розрідильнику. Вихід: 77,5% Mac-спектрометрія (режим джувачем та засипкою отриманої суміші у м'які або ЕР+): МН+=161,8. тверді желатинові капсули. Отримання IV Препарат у формі сиропу або еліксиру може Синтез 1-бензилокси-2-метиліндолізину містити активний інгредієнт разом з підсолоджуваЦю сполуку отримують тим же способом, що чем, переважно малокалорійним, метилпарабеном описано в отриманні І, застосовуючи реакцію Чита пропілпарабеном як антисептиками, посилювачибабіна. чем смаку та прийнятним барвником. Продукт виділяють у формі жовтого масла. Водо-дисперсивні порошки або гранули моВихід: 39%. жуть містити активний інгредієнт як суміш з диспеОтримання V ргувальними засобами, змочувальними засобами Синтез метил 5-(хлоркарбоніл)-2[(2,2,2або суспендувальними засобами, як-то полівінілтрифлуорацетил) аміно]бензоату піролідон та з підсолоджувачами або ароматизаЕтап А торами. Синтез 4-аміно-3-(метоксикарбоніл)бензойної Активний інгредієнт можна також формувати у кислоти формі мікрокапсул, як варіант, з одним або більше 150мг (1,21ммоль) 4-диметиламінопіридину носіями або адитивами. додають до 2,5г (12,1ммоль) 2,4-діоксо-1,4У фармацевтичних композиціях згідно з преддигідро-2Н-3,1-[бензоксазин-6-карбонової кислоти ставленим винаходом, активний інгредієнт може [описано J. Wed. Chem. – 1981. - 24(6). – P.735також мати форму комплексу включення у цикло742] у розчині у 10мл диметилформаміду та 10мл декстрини, їх етери або їх естери. метанолу і суміш гріють при 60°С протягом 3год. Кількість активного інгредієнту для застосуРеакційне середовище концентрують під зменшевання залежить, як завжди, від ступеню прогресуним тиском. Залишок переносять у воду та екстравання хвороби та віку і маси пацієнта. гують етилацетатом. Органічну фазу промивають Композиції згідно з винаходом для пероральнасиченим розчином натрій хлориду, сушать безного застосування містять тому рекомендовану водним натрій сульфатом та концентрують під дозу 0,01-700мг. зменшеним тиском. Отриманий твердий продукт Наступні приклади ілюструють, але без обмепереносять в етилацетаті, фільтрують та сушать. ження, представлений винахід. Отримують 1,98г білого порошку. Отримання І Вихід: 84%. Температура плавлення: 224,5°С. Синтез трет-бутил 2-метиліндолізин-1Етап В 27 78016 28 Синтез метил 3-(метоксикарбоніл)-4-[(2,2,2Приклад 1 трифлуорацетил)аміно]бензоату (1-Метокси-2-метиліндолізин-3-іл)(3-метокси-4868мкл (6,15ммоль) трифлуороцтового ангіднітрофеніл)метанон риду швидко додають до 1,0г (5,12ммоль) 4-аміно4,21г (0,0195моль) 3-метокси-43-(метоксикарбоніл)бензойної кислоти у суспензії у нітробензоїлхлориду додають до 3г (0,0186моль) 15мл дихлорметану. Розчин перемішують протя1-метокси-2-метиліндолізину, отримання якого гом 30хв. при кімнатній температурі. Розчин конописано в отриманні III, розчиняють у 50мл 1,2центрують досуха та отриманий твердий продукт дихлоретану та середовище перемішують при переносять у суміш пентан/етилетер та тоді відфікімнатній температурі протягом 4год. льтровують. 1,48г білого порошку отримують після Реакційне середовище виливають у воду. Орсушки. ганічну фазу відділяють після відстоювання, проВихід: 99%. Температура плавлення: 239°С мивають водним розчином натрій гідрокарбонату, Етап С а тоді водою, сушать безводним натрій сульфатом 530мкл (7,27ммоль) тіонілхлориду та 3 краплі та концентрують під вакуумом. диметилформаміду додають до 784мг (2,69ммоль) Залишок очищають хроматографією на колонметил 3-(метоксикарбоніл)-4-[(2,2,2ці з оксидом силіцію, елюючи дихлорметаном. Пістрифлуорацетил)аміно]бензоату у розчині у 9мл ля випарювання отримують 6,05г жовтого твердодихлорметану та тоді середовище гріють при темго продукту. пературі кипіння під зворотним холодильником Вихід: 95%. Температура плавлення: 287°С. протягом 90хв., випарюють досуха та надлишок Приклади 2-28 тіонілхлориду видаляють співвипарюванням з тоСпособом згідно з вищеописаним отриманням луолом. 834мг хлорангідриду отримують у формі синтезують сполуки формули І, де А представляє жовтого твердого продукту, який використовують радикал -СО-, як описано у табл. 1 нижче, бензобез наступної очистки на етапах бензоїлування їлуванням 3-позиції індолізинів, по різному замііндолізинів. щених на 1- та 2-позиціях належно заміщеними Вихід: кількісний. бензоїлхлоридами. Таблиця 1 Приклад R1 R2 R3 R4 Вихід, % 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 OBn ОВn ОВn ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе CO2Et CO2Et CO2Et CO2Et N(Me)Bn NHBOC CO2Et OMe OMe CO2Et CO2Et OMe CO2Et OMe NH-BOC NH-BOC Ph Me Me cPr Ph Me Me Me Me Me Me Me Me Ph Me Me Me Me Me Me Me Me Me Me cPr Me Me OMe OMe Η OMe OMe Η Η CO2Me NO2 OMe Η OMe OMe OMe Η OMe OMe CO2Me CO2Me NO2 NO2 CO2Me CO2Me CO2Me CO2Me CO2Me CO2Me NO2 NO2 CO2Me NO2 NO2 NO2 CO2Me Η CO2Me CO2Me CH 2CO2Me NO2 CO2Me NO2 CO2Me NO2 NO2 NO2 NO2 OMe OMe NO2 OMe OMe NO2 NO2 NHCOCF 3 94 95 70,5 81 82 88 92 75 57 88,5 75 91 45,5 85 98 90 76 92 100 90 30 92 69 12 34 81 81 Вn=бензил. Ме= метил. Et=етил. ВОС=т-бутоксикарбоніл. Приклад 29 (1-аміно-2-метиліндолізин-3-іл)(3-метокси-4нітрофеніл)метанон 2,32мл трифлуороцтової кислоти додають краплями до розчину 643мг (1,51ммоль) третбутил 3-(3-метокси-4-нітробензоїл)-2метиліндолізин-1-ілкарбамату у 20мл дихлорметану, охолодженого до 0°С. Після завершення уведення середовищу дають повернутися до кімнат Темп ерату ра плав лення (°С) або мас-спектрометрія (МН+) 186 153 110 112 65 146 143 121 138 145 94 137 141 151 139 МН+=430,3 МН+=426,5 137 150 135 60 137 119 110 МН+=395,2 92 226 ної температури та перемішують протягом 4год. Реакційне середовище виливають у насичений водний розчин калій карбонату та екстрагують етилацетатом. Органічну фазу відділяють після відстоювання, промивають насиченим водним розчином натрій хлориду, сушать безводним натрій сульфатом та концентрують під зменшеним тиском. Кристали, що отримано, переносять у ізопропілетер, відфільтровують, промивають ізопропілетером та тоді сушать. Отримують 425мг коричневого твердого продукту. Вихід: 87%. Mac-спектрометрія (режим ЕР+): МН+=326,3. 29 78016 30 Приклади 30-31 CO- та як описано у табл.2 нижче, синтезують Способом згідно з вищеописаним отриманням зняттям захисту аміну при 1-позиції індолізинів за сполуки формули І, де А представляє радикал допомогою трифлуороцтової кислоти. Таблиця 2 Приклад 30 31 R1 NH 2 NH 2 R2 Me Me R3 CO2Me CO2Me Приклад 32 N-[3-(3-Метокси-4-нітробензоїл)-2метиліндолізин-1-іл]метансульфонамід 0,292мл (3,78ммоль) мезилхлориду додають до розчину 350мг (1,08ммоль) сполуки прикладу 29 у 3мл піридину та середовище перемішують при кімнатній температурі протягом 4год. Реакційне середовище концентрують під зменшеним тиском. Залишок · переносять у 1Η гідрохлоридну кислоту та екстрагують ди хлорметаном. Органічну фазу відділяють після відстоювання, промивають насиченим водним розчином натрій хлориду, сушать безводним натрій сульфатом та концентрують під зменшеним тиском. Залишок кристалізують з етанолу. Отримують 327мг жовтих кристалів. Вихід: 75%. Мас-спектрометрія (режим ЕР+): МН+=404,3. Приклад 33 Метил 5-[(1-{[(3метоксифеніл)сульфоніл]аміно}-2-метиліндолізин3-іл)карбоніл]-2-[(2,2,2трифлуорацетил)аміно]бензоат Цю сполуку отримують способом з попереднього прикладу суль фонілуванням метил 5-[(1аміно-2-метиліндолізин-3-іл)карбоніл]-2-[2,2,2трифлуорацетил)аміно]бензоату 3метоксибензолсульфонілхлоридом. Отримують 466мг жовтого порошку. Вихід: 83%. Температура плавлення: 220,5°С. Приклад 34 Метил 5-[(1-{[(3-метоксіаніліно)карбоніл]аміно}2-метиліндолізин-3-іл)карбоніл]-2-[(2,2,2трифлуорацетил)аміно]бензоат 140мкл (1,05ммоль) 3-метоксифенілізоціанату додають до 400мг (0,95ммоль) метил 5-[(1-аміно2-метиліндолізин-3-іл)карбоніл]-2-[2,2,2трифлуорацетил)аміно]бензоату і розчиняють у 13мл тетрагідрофурану. Реакційну суміш гріють при 40°С протягом 20год. та концентрують під зменшеним тиском. Отриманий залишок переносять в ацетон, твердий продукт відфільтровують та промивають ацетоном та тоді етилетером. Отримують 442мг жовтого порошку. Вихід: 82%. Температура плавлення: 314°С. Приклад 35 (3-Метокси-4-нітрофеніл)[2-метил-1(метиламіно)індолізин-3-іл]метанон Етап А Синтез трет-бутил 3-(3-метокси-4 R4 NO2 NHCOCF 3 Вихід, % 91 88 Темп ерату ра плав лення, °С 162 231 нітробензоїл)-2-метиліндолізин-1іл(метил)карбамату 3,05г (7,2ммоль) трет-бутил 3-(3-метокси-4нітробензоїл)-2-метиліндолізин-1-ілкарбамату у розчині у 50мл тетрагідрофурану додають краплями до 315мг (7,9ммоль) натрій гідриду (у 60% дисперсії у маслі) у суспензію у 10мл тетрагідрофурану, о холоджену до 0°С. Після перемішування протягом 1год. при 0°С, 0,59мл (9,5ммоль) метилйодид додають, при цьому середовище тримають при 0°С. Йому дають повернутися до кімнатної температури та перемішують протягом 1год. Реакційне середовище виливають у насичений водний розчин натрій гідрокарбонату та екстрагують етилацетатом. Органічну фазу відділяють після відстоювання, промивають насиченим водним розчином натрій хлориду, сушать безводним натрій сульфатом та концентрують під зменшеним тиском. Отримують 3,47г оранжевої піни. Вихід: 96%. Mac-спектрометрія (режим ЕР+): МН+=440,3. Етап В 13мл трифлуороцтової кислоти додають краплями до розчину 3,38г (7,7ммоль) продукту, отриманого на етапі А у 60мл дихлорметану, охолодженого до 0°С. Після завершення уведення середовищу дають повернутися до кімнатної температури та перемішують протягом 3год. Реакційне середовище виливають у насичений водний розчин натрій гідрокарбонату та екстрагують етилацетатом. Органічну фазу відділяють після відстоювання, промивають насиченим водним розчином натрій хлориду, сушать безводним натрій сульфатом та концентрують під зменшеним тиском. Залишок очищають флеш-хроматографією на колонці з оксидом силіцію, елюючи сумішшю толуол/етилацетат (9/1). Після випарювання, отримують 2,2г червоного порошку. Вихід: 76%. Mac-спектрометрія (режим ЕР+): МН+=340,2. Приклади 36 та 37 Способом згідно з прикладом 35 - Етап А, сполуки формули І, де А представляє радикал -СО- та як описано у табл.3 нижче, синтезують алкілуванням трет-бутил карбамату на 1-позиції індолізинів з 3-метоксибензилхлоридом присутності натрій гідриду у розчиннику, як-то тетрагідрофуран та диметилформамід. Таблиця 3 Приклад R1 R2 R3 R4 Вихід, % 36 37 N(BОC)Bn-3-О Me N(BОC)Bn-3-О Me Me Me ОMe CO2Me NO2 NO2 91 80 Приклади 38 та 39 Темп ерату ра плав лення (°С) або мас-спектрометрія (МН+) МН+=546,4 65°С Способом згідно з прикладом 35 - Етап В, спо 31 78016 32 луки формули І, де А представляє радикал -CO-, захисту аміну при 1- позиції індолізинів за допомота як описано у табл.4 нижче, синтезують зняттям гою трифлуороцтової кислоти. Таблиця 4 Приклад 38 39 R1 NHBn-3-ОМе NHBn-3-ОМе R2 Me Me R3 OMe CO2Me R4 NO2 NH 2 Приклад 40 [1-(Диметиламіно)-2-метиліндолізин-3-іл] (3метокси-4-нітрофеніл)метанон 382мг (1,1ммоль) сполуки прикладу 21 у розчині у 10мл тетрагідрофурану додають краплями до 44мг (1,1ммоль) натрій гідриду (при 60% у дисперсія у маслі) у суспензію у 5мл тетрагідрофурану, о холоджену до 0°С. Після завершення уведення середовищу дають повернутися до кімнатної температури протягом 1год. та тоді 69мкл (1,1ммоль) метилйодиду додають та середовище перемішують при кімнатній температурі протягом 17год. Реакційне середовище виливають у насичений водний розчин натрій хлориду та екстрагують етилацетатом. Органічну фазу відділяють після відстоювання, промивають насиченим водним розчином натрій хлориду, сушать безводним натрій сульфатом та концентрують під зменшеним тиском. Залишок очищають хроматографією на колонці з оксидом силіцію, елюючи сумішшю толуол/етилацетат (95/5). Отримують 143мг оранжевої піни. Вихід: 37%. Приклад 41 {1-[(3-Метоксибензил)(метил)аміно]-2метиліндолізин-3-іл}(3-метокси-4нітрофеніл)метанон 595мг (1,83ммоль) цезій карбонату та 83мкл (1,34ммоль) метилйодиду додають до 542мг (1,22ммоль) {1-[(3-метоксибензил)аміно]-2метиліндолізин-3-іл}(3-метокси-4нітрофенілметанону у розчині у 15мл диметилформаміду. Реакційну суміші гріють при 40°С протягом 21год. Суміш виливають у насичений водний розчин натрій хлориду та екстрагують етилацетатом. Органічну фазу сушать безводним натрій сульфатом та концентрують під зменшеним тиском. Продукт очищають хроматографією на силікагелі, елюючи сумішшю топуол/етилацетат (95/5). Отримують червону смолу. Вихід: 96%. Mac-спектрометрія (режим ЕР+): Вихід, % 89 99 Мас-спектрометрія( МН+) МН+=446,3 МН+=444,4 МН+=460,3. Приклад 42 Метил 2-аміно-5-({1-[3метоксибензил)(метил)аміно]-2-метил індолізин-3іл}карбоніл)бензоат Цю сполуку отримують тим же способом, що описано у вищенаведеному прикладі, починаючи з 340мг (0,76ммоль) метил 2-аміно-5-({1-[(3метоксибензил)аміно]-2-метиліндолізин-3іл}карбоніл)бензоату. Отримують 260мг оранжевого твердого продукту. Вихід: 80%. Температура плавлення: 60°С. Приклад 43 Метил 5-({1-[(3-метоксибензоїл)аміно]-2метиліндолізин-3-іл}карбоніл)-2-[2,2,2трифлуорацетил)аміно]бензоат 3,37г (7,6ммоль) бензотриазол-1-ілокситрис(диметиламіно)фосфоній гексафлуорфосфа ту (ВОР) та 2,1мл триетиламіну додають до 1,16г (7,6ммоль) 3-метоксибензойної кислоти і розчиняють у 30мл диметилформаміду та 60мл дихлорметану. Середовище перемішують при кімнатній температурі протягом 15хв. та тоді додають 3,04г (7,2ммоль) метил 5-[(1-аміно-2-метиліндолізин-3іл)карбоніл]-2-[2,2,2трифлуорацетил)аміно]бензоату. Після перемішування протягом 16год. при кімнатній температурі отриманий жовтий осад у реакційному середовищі фільтрують та промивають дихлорметаном. Отримують 2,38г жовтого порошку. Вихід: 60%. Температура плавлення: 239°С. Приклади 44-61 Способом згідно з вищеописаним, сполуки, що описано у табл. 5 нижче, синтезують сполученням (1-аміно-2-метиліндолізин-3-іл)(3-метокси-4нітрофеніл)метанону або метил 5-[(1-аміно-2метиліндолізин-3-іл)карбоніл]-2-[2,2,2трифлуорацетил)аміно]бензоату з прийнятною карбоновою кислотою у присутності бензотриазол1-ілокси-трис(диметиламіно)фосфоній гексафлуорфосфату (ВОР). Таблиця 5 Приклад R1 R2 R3 R4 Вихід, % 44 45 46 47 48 49 50 51 52 53 54 NHCOPh-4-CI NHCOPh-4-CO2Me NHCOPh-3-OMe NHCOPh-3-OMe-4-NO2 NHCOPh-2,3-OMe NHCOPh-2,5-OMe NHCOPh-3,4-OMe NHCOPh-3,4,5-OMe NHCOPh-3,5-OMe NHCOPh-3-OMe 4-Ме МНСОPh-3,4- метилен діокси Me Me Me Me Me Me Me Me Me Me Me OMe OMe OMe OMe CO2Me CO2Me CO2Me CO2Me CO2Me CO2Me CO2Me NO2 NO2 NO2 NO2 NHCOCF 3 NHCOCF 3 NHCOCF 3 NHCOCF 3 NHCOCF 3 NHCOCF 3 NHCOCF 3 76 88 86 60 87 83 76 83 74 82 79 Темп ерату ра плав лення (°С) 255° 274° 180° 286° 215° 214° 260° 259° 223° 251° 245° 33 55 56 57 58 59 60 61 NHCOPh-3-OMe 4-СІ NHCOPh-3-OMe 4-F NHCOPh-2,5-OMe 4-CI NHCO-5-індолі л NHCOPh-3-OMe 4-СО2 Ме NHCOPh-3-OCF 3 NHCOPh-2,4,5-OMe 78016 Me Me Me Me Me Me Me Приклад 62 N-[3-(3-Метокси-4-нітробензоїл)-2метиліндолізин-1-іл]ацетамід 1,20мл (12,60ммоль) оцтового ангідриду додають до 410мг (1,26ммоль) (1-аміно-2метиліндолізин-3-іл)(3-метокси-4нітрофеніл)метанону і розчиняють у 10мл дихлормета-ну. Реакційну суміші перемішують при кімнатній температурі протягом 15хв. Отриманий осад відфільтровують та промивають етилетером та тоді сушать, отримуючи 295мг оранжевого порошку. Вихід: 63%. Температура плавлення: 238°С. Приклад 63 3-Метокси-N-[3-(3-метокси-4-нітробензоїл)-2метиліндолізин-1-іл]-N-метилбензамід 51мг натрій гідриду (60% суспензію у маслі) додають до 466мг (1,01ммоль) 3-метокси-N-[3-(3метокси-4-нітробензоїл)-2-метиліндолізин-1іл]бензаміду у розчині у 19мл тетрагідрофурану. Середовище перемішують при кімнатній температурі протягом 10хв. та тоді додають 65мкл метилйодиду. Після перемішування протягом 2год., воду додають до реакційного середовища та тоді середовище екстрагують етилацетатом. Органічну фазу промивають насиченим водним розчином натрій хлориду, сушать безводним натрій сульфатом та концентрують під зменшеним тиском. Продукт очищають хроматографією на силікагелі, елюючи дихлорметаном. Отримують 435мг жовтого твердого продукту. Вихід: 91%. Температура плавлення: 190°С. Приклад 64 Метил 5-({1-[(3-метоксибензоїл)(метил)аміно]2-метиліндолізин-3-іл}карбоніл)-2-нітробензоат Цю сполуку отримують як у вищенаведеному прикладі метилуванням 1,9г (3,9ммоль) метил 5({1-[(3-метоксибензоїл)аміно]-2-метиліндолізин-3іл}карбоніл)-2-нітробензоату метилйодидом. Отримують 1,85г червоного твердого продукту. Вихід: 84%. Температура плавлення: 158,5°С. Приклад 65 Етил [3-(3-метокси-4-нітробензоїл)-2(трифлуорметил)індолізин-1-іл]карбоксилат Етап А Синтез 1-[2-(3-метокси-4-нітрофеніл)-2оксоетил]піридиній броміду 467мкл (5,78ммоль) піридину додають до 1,32г (4,82ммоль) 2-бром-1-(3-метокси4-нітрофеніл)-1етанону описано [Bull. Soc. Chim. Fr. – 1962. – P. 2255-2261] у розчині у 13мл ацетонітрилу та середовище перемішують при кімнатній температурі протягом 5год. Реакційне середовище осаджують. Етилетер додають, кристали відфільтровують, промивають етилетером та тоді сушать. Отримують 1,65г жовтих кристалів. Вихід: 97%. Температура плавлення: 216°С. Етап В 500мг (1,42ммоль) 1-[2-(3-метокси-4 CO2Me CO2Me CO2Me CO2Me CO2Me CO2Me CO2Me 34 NHCOCF 3 NHCOCF 3 NHCOCF 3 NHCOCF 3 NHCOCF 3 NHCOCF 3 NHCOCF 3 82 27 82 76 77 60 64 264° 260° 242° 186° 191° 258° 253° нітрофеніл)-2-оксоетил]піридиній броміду додають порціями, до 219мкл (1,56ммоль) триетиламіну у 4,5мл диметилформаміду, а потім 1,06мл (7,08ммоль) етил 4,4,4-трифлуоркротонату та 561мг (0,92ммоль) тетрапіридинкобальт(ІІ) дихромату. Реакційне середовище гріють при 90°С протягом 6год. Реакційне середовище охолоджують та тоді виливають у 1Η гідрохлоридну кислоту та отриманий продукт екстрагують етилацетатом. Органічну фазу відділяють після відстоювання, промивають водою та тоді промивають насиченим водним розчином натрій хлориду, сушать безводним натрій сульфатом та концентрують під зменшеним тиском. Отриманий продукт очищають хроматографією на колонці з оксидом силіцію, елюючи дихлорметаном. Отримують 437мг жовтого порошку. Вихід: 71%. Температура плавлення: 63°С. Приклад 66 Етил [3-(3-метокси-4-нітробензоїл)індолізин-1іл]карбоксилат Цю сполуку отримують способом з попереднього прикладу на етапі В 1,3-диполярним циклододаванням 1-[2-(3-метокси-4-нітрофеніл)-2оксоетил]піридиній броміду (отримано на етапі А попереднього прикладу) з етилакрилатом. Жовтий порошок отримують після очистки флешхроматографією на колонці з оксидом силіцію, елюючи дихлорметаном. Вихід: 78%. Температура плавлення: 168°С. Приклад 67 (1-Гідрокси-2-метиліндолізин-3-іл) 3-метокси-4нітрофеніл)метанон Розчин 5г (12ммоль) [1-(бензилокси-2метиліндолізин-3-іл](3-метокси-4нітрофеніл)метанону, сполуки прикладу 3, у 30мл трифлуороцтової кислоти, гріють при температурі кипіння під зворотним холодильником протягом 2год. Реакційне середовище випарюють під зменшеним тиском. Залишок переносять в етилацетат, промивають водним розчином натрій гідрокарбонату та водою і тоді органічну фазу сушать безводним натрій сульфатом та випарюють під зменшеним тиском. Отриманий продукт очищають хроматографією на колонці з оксидом силіцію, елюючи сумішшю дихлорметан/метанол (99/1). Отримують 2,93г оранжевого порошку. Вихід: 75%. Температура плавлення: 193°С. Приклад 68 Метил 4-({[3-(3-метокси-4-нітробензоїл)-2метиліндолізин-1-іл]окси]метил)бензоат 812мг (3,37ммоль) метил 4(бромметил)бензоат додають до розчину 1г (3,06ммоль) (1-гідрокси-2-метил-3-індолізиніл)(3метокси-4-нітрофеніл)метанону у 16мл диметилформаміду, у присутності 508мг (3,68ммоль) of 35 78016 36 калій карбонат та середовище гріють при 90°С Вихід: 60,5%. Температура плавлення: 154°С. протягом 4год. Приклади 69-84 Реакційне середовище виливають у воду та Способом згідно з описаним у прикладі 68, екстрагують етилацетатом. сполуки, що описано у табл. 6 нижче, синтезують Органічну фазу промивають водою, сушать алкілуванням (1-гідрокси-2-метил індолізин-3-іл)(3безводним натрій сульфатом та випарюють досуметокси-4-нітрофеніл)метанону прийнятно вибраха. Отриманий продукт очищають хроматографією ними галогенованими похідними. Для отримання на колонці з оксидом силіцію, елюючи сумішшю сполук прикладу 80 сполуку прикладу 79 омилютолуол/етилацетат (9/1). Отримують 880мг жовтоють. го порошку. Таблиця 6 Сполу ки форму ли Ia, де R1 представ ляє OR’ Приклад R’ Вихід, % 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 CH 2C 6H 5-2Cl CH 2C 6H 5-3Cl CH 2C 6H 5-4Cl CH 2C 6H 5-2OMe CH 2C 6H 5-3OMe CH 2C 6H 5-4OMe CH 2C 6H 5-3CO2Me CH 2CO2Et CH 2CO2NH 2 (CH 2)2NMe2 (CH 2)2OAc (CH 2)2OH CH 2CN IPr CH 2CPr CH 2C 6H 5-2-CO2 Me 90 74 82 84 67,5 71 57 91 65 26 68 90 91,5 19 22 82 Приклад 85 Метил 4-[(1-гідрокси-2-метиліндолізин-3-іл) карбоніл]бензоат 8,75мл (86,37ммоль) циклогексену додають до 3,45г (8,64ммоль) метил 4-[(1-(бензилокси)-2метиліндолізин-3-іл)карбоніл]бензоату у 40мл етанолу у присутності 690мг 10% Pd/C та середовище гріють при температурі кипіння під зворотним холодильником протягом 1год. Реакційне середовище охолоджують до кімнатної температури та каталізатор видаляють фільтруванням на тальку. Фільтрат під зменшеним тиском. Отриманий продукт очищають хроматографією на колонці з оксидом силіцію, елюючи сумішшю дихлорметан/метанол (98/2). Отримують 2,5г оранжевого порошку. Вихід: 93,5%. Температура плавлення: 192°С. Приклад 86 Метил 4-{[1-(2-етокси-2-оксоетокси)-2метиліндолізин-3-іл]карбоніл}бензоат 202мкл (1,78ммоль) етилбромацетату додають до 500мг (1,62ммоль) метил 4-[(1-гідрокси-2метиліндолізин-3-іл)карбоніл]бензоату, сполуки прикладу 85, у 10мл диметилформаміду у присутності 268мг (1,94ммоль) калій карбонату та середовище гріють при 90°С протягом 1год. Реакційне середовище охолоджують, виливають у воду та екстрагують етилацетатом і тоді розділяють після відстоювання. Органічну фазу промивають водою, сушать безводним натрій су Темп ерату ра плав лення, °С 173 179 162 148 145 135 171 127 222 108 Масло 142 176 283 111 146 льфатом та випарюють під зменшеним тиском. Отриманий продукт очищають хроматографією на колонці з оксидом силіцію, елюючи сумішшю толуол/етилацетат (9/1). Отримують 570мг жовтого порошку. Вихід: 89%. Температура плавлення: 84,5°С. Приклад 87 Метил 4-({1 -[(3-метоксибензил)окси]-2метиліндолізин-3-іл}карбоніл)бензоат Цю сполуку отримують тим же способом, що способом прикладу 86, О-алкілуванням метил 4[(1-гідрокси-2-метиліндолізин-3-іл)карбоніл] з 3метоксибензилбромідом. Отримують жовтий порошок. Вихід: 76%. Температура плавлення: 106°С. Приклад 88 3-(3-Метокси-4-нітробензоїл)-2метиліндолізин-1-ілкарбонова кислота 26,2мл 1Η натрій гідроксиду додають до 5г (13,1ммоль) етил 3-(3-метокси-4-нітробензоїл)-2метиліндолізин-1-ілкарбоксилату, сполуки з прикладу 13, отриманої способом з прикладу 1 бензоїлуванням етил (2-метиліндолізин-1іл)карбоксилату, описаного [J. Chem. Soc. – 1963. – P.3277-3280], у суспензії у 50мл діоксану та середовище гріють при температурі кипіння під зворотним холодильником протягом 17год. Реакційне середовище концентрують під зменшеним тиском. Залишок переносять у воду, промивають етилетером та середовище відділяють після відстоювання. Водну фазу підкислюють до рН 6 розчином 37 78016 38 калій гідросульфату та екстрагують етилацетатом. нітрофеніл)сульфоніл]індолізин Органічну фазу промивають водою, сушать безвоЦю сполуку отримують способом, що описано дним натрій сульфатом та концентрують під змеу ви щенаведеному прикладі, сульфонілуванням 1г ншеним тиском. Отримують 4,9г оранжевого по(6,2ммоль) 1-метокси-2-метиліндолізину 3рошку. нітробензолсульфонілхлоридом. Отримують 540мг Вихід: кількісний. Температура плавлення: жовтого масла. 215°С. Вихід: 98%. Приклад 89 Приклад 93 N-Етил 3-(3-метокси-4-нітробензоїл)-2Натрій 4-[(1-метокси-2-метиліндолізин-3метиліндолізин-1-ілкарбоксамід іл)сульфоніл]бензоат 0,61мл (4,34ммоль) триетиламіну додають до Цю сполуку отримують тим же способом, що розчину 750мг (2,12ммоль) кислоти з прикладу 88 сполуку прикладу 91, сульфонілуванням 1у 12мл диметилформаміду, а потім порціями метокси-2-метиліндолізину 4983мг (2,22ммоль) бензотриазол-1хлорсуль фонілбензойною кислотою. Продукт очиілокситрис(диметиламіно)фосфоній гексафлуорщають флеш-хроматографією на колонці з оксифосфа ту. Середовище перемішують протягом 5хв. дом силіцію, елюючи сумішшю дихлормепри кімнатній температурі та тоді додають 182мг тан/ацетон (9/1). Отримують 120мг жовтого (2,22ммоль) етиламіну гідрохлориду. порошку. Реакційне середовище перемішують протягом Вихід: 11%. ночі при кімнатній температурі, виливають у воду Продукт розчиняють у метанолі і перетворюта екстрагують етилацетатом. Органічну фазу відють у сіль додаванням одного еквіваленту 1Η наділяють після відстоювання, промивають водою, трій гідроксиду. Метанол випарюють та залишок сушать безводним натрій сульфатом та конценткристалізують з ацетону. Продукт фільтрують, рують під зменшеним тиском. промивають ацетоном та тоді етилетером та суПродукт очищають хроматографією на колонці шать. 100мг солі натрію отримують у формі з оксидом силіцію, елюючи сумішшю ди хлормежовтого порошку. тан/метанол (98/2). Отримують 700мг жовтого поТемпература плавлення: 175°С. рошку. Приклад 94 Вихід: 87%. Температура плавлення: 188°С. (4-аміно-3-метоксифеніл)(1-метокси-2Приклад 90 метиліндолізин-3-іл)метанон Етил 2-({[3-(3-метокси-4-нітробензоїл)-2700мг 10% Pd/C додають до 6г (0,0176моль) метиліндолізин-1-іл]карбоніл}аміно)ацетат (1-метокси-2-метил-3-індолізиніл)(3-метокси-4Цю сполуку отримують способом для поперенітрофеніл)метанону, сполуки прикладу 1, у 100мл дньої сполуки, сполученням 3-(3-метокси-4етанолу, а потім 35,71мл (0,352моль) циклогексену нітробензоїл)-2-метиліндолізин-1-ілкарбонової та середовище гріють при температурі кипіння під кислоти з етилгліцинату гідрохлоридом. зворотним холодильником протягом 2год. РеакПродукт очищають хроматографією на колонці ційне середовище охолоджують, фільтрують через з оксидом силіцію, елюючи сумішшю ди хлорметальк та каталізатор промивають дихлорметаном. тан/метанол (93/7). Отримують жовтий порошок. Фільтрат концентрують під зменшеним тиском. Вихід: 86%. Температура плавлення: 191°С. Залишок переносять у дихлорметан. Органічну Приклад 91 фазу промивають 1Η натрій гідроксидом, а тоді 1-[Метокси-2-метил-3-[(4водою, суша ть безводним натрій сульфатом та нітрофеніл)сульфоніл]індолізин концентрують під зменшеним тиском. Отримують 690мг (3,1ммоль) 45,05г жовтого порошку. нітробензолсульфонілхлориду у розчині у 4мл 1,2Продукт перетворюють у сіль розчиненням дихлоретану додають до 500мг (3,1ммоль) 1отриманого порошку у 60мл дихлормета-ну з 20мл метокси-2-метиліндолізину у розчині у 8мл 1,2метанолу та тоді додаванням 21мл 1Η гідрохлоридихлоретану та середовище перемішують при дної кислоти в етилетері. Після додавання етилекімнатній температурі протягом 20год. Реакційне теру отриманий осад відфільтровують, промивасередовище виливають у воду та ди хлорметан. ють етилетером та тоді суша ть. Отримують 5,4г Органічну фазу відділяють після відстоювання, жовтого порошку у формі гідрохлориду. промивають водою, сушать безводним натрій суВихід: 88%. Температура плавлення: 198°С льфатом та концентрують під зменшеним тиском. Приклади 95-117 Продукт очищають хроматографією на колонці Способом згідно з вищеописаним отриманням з оксидом силіцію, елюючи сумішшю циклогексполуки, що описано у табл.7 нижче, синтезують сан/етилацетат (9/1). Отримують 330мг жовтого відновленням функціональної нітрогрупи сполук масла. формули Іа циклогексеном у присутності 10% Pd/C Вихід: 31%. як каталізатору. Приклад 92 1-[Метокси-2-метил-3-[(3Таблиця 7 Приклад R1 R2 R3 R4 95 96 ОМе ОМе C 6H 5 cPr OMe OMe NH 2 NH 2 Вихід, % 90 95 Солі HCI, 0,45 Η 2Ο НСІ, 0,15 Н 2О Темп ерату ра плав лення (°С) або мас-спектрометрія (МН+) 209°С 191°С 39 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 78016 CO2Et OCH 2CO2Et OCH 2CONH 2 О(CH 2)2OH OMe CONHEt CONHCH 2CO2Et OMe CO2Et OMe CO2Et CO2Et CO2Et CO2Et NHCOPh-4-CO2Me NHCOPh-3-OMe NHCOPh(3-OMe)4NHAc N(Me)COPh- 3-O Me N(Me)COPh- 3-O Me N(BOC)COPh-3-O Me Me Me Me Me Me Me Me Me Me Me С 6Н 5 Me CF 3 Η Me Me Me Me Me Me Me OMe OMe OMe OMe Η OMe OMe CO2Me CO2Me NH 2 OMe NH 2 OMe OMe OMe OMe OMe OMe OMe CO2Me CO2Me 40 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 OMe NH 2 OMe NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 Приклад 118 (4-аміно-3-метоксифеніл){1-[(2хлорбензил)окси]-2-метил індолізин-3-іл}метанон гідрохлорид 47мг 10% Pd/C додають до 470мг (1,04ммоль) {1-[(2-хлорбензил)окси]-2метиліндолізин-3-іл}(3-метокси-4нітрофеніл)метанону у 5мл метанолу та 10мл дихлорметану, а потім 253мкл (5,21ммоль) гідразин гідрату та середовище перемішують при кімнатній температурі протягом ночі. Реакційне середовище фільтрують на тальку та каталізатор промивають метанолом. Фільтрат концентрують під зменшеним тиском. Залишок переносять в етилацетаті, органічну фазу промивають насиченим водним розчином натрій хлориду, сушать безводним натрій 91 99 87 89 86 72 91 87 95 82 86 85 81 89 72 77 82 57 98 99 98 HCI HCI HCI HCI, 0,50 H 2O HCI, 0,20 H 2O HCI, 0,45 H 2O HCI, 1,05 H 2O 0,40 H 2O HCI HCI HCI, 0,40 H 2O 2 HCI, 1,0 H 2O HCI, 0,35 H 2O HCI 194°С 182°С MH+=354,1 205°С 221°С 221°С 196°С 297°С 172°С 209°С 180°С 162°С 75°С 143°С 275°С 209°С 178°С 253°С 113°С 91°С 82°С сульфатом та концентрують під зменшеним тиском. Отримують 460мг жовтого порошку. Продукт перетворюють у сіль розчиненням отриманого порошку у суміші етилацетату та метанолу, а тоді додають 1,25мл (1,2 еквіваленти) 1Η гідрохлоридної кислоти в етилетері. Після додавання етилетеру отриманий осад фільтрують, промивають етилетером та тоді сушать. 440мг жовтого порошку отримують у формі гідрохлориду з 0,65Н2О. Вихід: 90%. Температура плавлення: 177°С. Приклади 119-140 Способом згідно з описаним у прикладі 118, сполуки, що описано у табл. 8 нижче, синтезують відновленням функціональної нітрогрупи сполук формули Іа гідразин гідратом у присутності 10% Pd/C як каталізатору. Таблиця 8 Приклад A R1 R2 R3 R4 Вихід, % Солі 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 CO CO CO CO CO CO CO CO CO CO CO CO CO CO SO2 SO2 CO CO CO CO CO CO OBn O(CH 2)2NMe 2 OBn-4-CI OBn-3-О Ме OBn-4-О Ме OBn-2-О Ме OBn-3-CO2 Me OBn-4-СО2 Ме OBn-3-CI N(Me)Bn NHBOC NHMe NHSO2Me OMe OMe OMe OCH 2cPr OiBu NMe2 OBn-2-CO2 Et NHBn-3-ОМе N(Me)Bn- 3-O Me C 6H 5 Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me OMe OMe OMe OMe OMe OMe OMe OMe OMe OMe OMe OMe OMe NH 2 Η NH 2 OMe OMe OMe OMe OMe OMe NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 CO2Me NH 2 Η NH 2 NH 2 NH 2 NH 2 NH 2 NH 2 94 31 99 95 99 99 75 93 96 78 95 88 83 72 66 45 99 60 80 98 72 95 HCI, 0,2 H 2O 2 HCI, 2,0 H 2O HCI HCI HCI, 0,3 H 2O HCI HCI HCI, 1,0 H 2O HCI HCI, 1,6 H 2O основ а HCI, 1,15 H 2O HCI HCI HCI 2 HCI, 0,2 H 2O HCI, 0,5 H 2O HCI HCI, 1,5 H 2O Приклад 141 4-Хлор-N-[3-(4-аміно-3-метоксибензоїл)-2метиліндолізин-1-іл]бензамід Суміш 384мг (0,83ммоль) 4-хлор-N-[3-(3метокси-4-нітробензоїл)-2-метиліндолізин-1 Темп ерату ра плав лення (°С) або масспектроме трія (МН +) 207°С 246°С 177°С 181°С 128°С 164°С 185°С 160°С 175°С 114°С MH+=396,4 210°С 228°С 135°С 157°С 137°С 181°С 103°С 171°С 185°С 186°С 161°С іл)бензаміду та 115мг оксиду платини у 9мл диметилформаміду перемішують при 0,5МПа водню при кімнатній температурі протягом 24год. та тоді фільтрують на тальку. Фільтрат концентрують під зменшеним тиском. 41 78016 42 Продукт очищають хроматографією на силікаіндолізиніл)карбоніл]бензоат гелі, елюючи сумішшю толуол/ацетон (9/1-8/2). 2,45мл 1Η натрій гідроксиду додають до 720мг 1мл 1Η гідрохлоридної кислоти в етилетері дода(2,23ммоль) метил 4-[(1-метокси-2-метиліндолізинють до отриманого жовтого порошку, суспендують 3-іл)карбоніл]бензоату, сполуки прикладу 8, у розу 5мл дихлорметану та 5мл метанолу. Отриманий чині у 15мл метанолу з 15мл діоксану та середоосад відфільтровують, промивають ацетоном та вище перемішують при кімнатній температурі протоді розчиняють у 2мл метанолу та 40мл води. тягом ночі. Реакційне середовище концентрують Гідрохлорид сушать сублімацією. Отримують під зменшеним тиском. Залишок переносять у во162мг оранжевого порошку. ду, промивають етилетером та розділяють після Вихід: 50%. Температура плавлення: 191°С. відстоювання. Водну фазу підкислюють 1Η гідроПриклад 142 хлоридною кислотою та екстрагують дихлормета[1-(2-Пдроксіетокси)-2-метиліндолізин-3-іл](3ном. метокси-4-нітрофеніл)метанон Органічну фазу промивають водою, сушать 1,52мл 1Η натрій гідроксиду додають до 420мг безводним натрій сульфатом та концентрують під (1,02ммоль) 2-{[3-(3-метокси-4-нітробензоїл)-2зменшеним тиском. Отримують 700мг оранжевого метиліндолізин-1-іл]окси}етилацетату, сполуки порошку отримують, який суспендують у 20мл меприкладу 79, розчиняють у 6мл діоксану та серетанолу та тоді додають один еквівалент 1Η натрій довище перемішують при кімнатній температурі гідроксиду. Розчин концентрують під зменшеним протягом 6год. Реакційне середовище виливають тиском. Залишок кристалізують з ацетону. Продукт у воду та етилацетат. Ор ганічну фазу відділяють відфільтровують, промивають ацетоном та тоді після відстоювання, промивають водою, сушать етилетером, сушать та отримують 680мг жовтого безводним натрій сульфатом та концентрують під порошку. зменшеним тиском. Отримують 340мг оранжевого Вихід (сіль Na): 92%. Температура плавлення: порошку, який використовують без наступної очис>400°С.Приклади 144-157 тки у наступному етапі відновлення нітрогрупи. Способом згідно з описаним у прикладі 143, Вихід: 90%. Температура плавлення: 142°С. сполуки, що описано у табл. 9 нижче, синтезують Приклад 143 омиленням естерної функціональної групи сполук Натрій 4-[(1-метокси-2-метил-3формули Id. Таблиця 9 Приклад R1 R2 R3 R4 Вихід, % Солі 144 145 146 147 148 149 150 151 152 153 154 155 156 157 ОМе ОМе ОМе OBn-3-О Ме ОМе ОМе ОМе ОМе ОМе Η ОМе N(Me)COPh- 3-O Me NHBn-3-ОМе N(Me)Bn- 3-O Me Me Me Me Me Me Me Me Me Me Me cPr Me Me Me CO2H NO2 NH 2 Η ОМе Η CO2H CO2H CO2H CO2H CO2H CO2H CO2H CO2H Η CO:Η СО2Н СО2Н СО2Н СН 2СО2 ΝΗ 2 ΝΟ2 ОМе ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 76 85 77 81 87 91 98 83 92 95 100 77 83 78 Na Na Na Na, 0,7 H 2O Na, 1 H 2O Na, 0,7 H 2O Na, 1 H 2O Na, 0,95 H 2O Na, 0,65 H 2O Na, 1,3 H 2O Na, 1,75 H 2O Na, 3,2 H 2O Na, 1,15 H 2O Na, 1,2 H 2O Приклад 158 2-аміно-5-({1-[3-метоксибензоїл)аміно]-2метиліндолізин-3-іл}карбоніл)бензойна кислота 6,6мл розчину натрій гідроксиду (2N) додають до 3,31г (6,0ммоль) метил 5-({1-[(3метоксибензоїл)аміно]-2-метиліндолізин-3іл}карбоніл)-2-[2,2,2-трифлуорацетил)аміно]бензоату у суспензію у 40мл діоксану та 20мл метанолу. Реакційне середовище гріють при температурі кипіння під зворотним холодильником протягом 2,5год. та тоді дають повернутися до кімнатної температури та концентрують під зменшеним тиском. Отриманий залишок переносять у насичений водний розчин натрій гідрокарбонату та екстрагують етилацетатом. Після декантації водну Темп ерату ра плав лення (°С) 218°С 265°С 315°С 268°С 235°С 248°С 258°С 164°С 318°С 300°С 249°С 230°С 164°С 211°С фазу підкислюють молярною гідрохлоридною кислотою. Отриманий осад відфільтровують, промивають водою та сушать під вакуумом. Отримують 2,4г жовтого порошку. Вихід: 90%. Температура плавлення: 290°С. Сіль Na, моногідрат: температура плавлення: 265°С. Приклади 159 до 174 Способом згідно з вищеописаним, сполуки формули І, в як А представляє -СО- та які описано у таблиці 10 нижче, синтезують гідролізом метилового естеру та трифлуорацетаміду R3 та R4 натрій гідроксидом. Таблиця 10 Приклад R1 R2 R3 R4 159 160 161 NHCOPh-2,3-OMe NHCOPh-2,5-OMe NHCOPh-3,4-OMe Me Me Me CO2H CO2H CO2H ΝΗ 2 ΝΗ 2 ΝΗ 2 Вихід, % 75 77 79 Солі Na, 3,0 H 2O Na, 2,5 H 2O Na, 2,0 H 2O Темп ерату ра плав лення(°С) 236°С 265°С 331°С 43 162 163 164 165 166 167 168 169 170 171 172 173 174 NHCOPh-3,4,5-OMe NHCOPh-3,5-OMe NHCOPh-(3-OMe)4- Me NНСОPh-3,4-метилендіокси NHCOPh(4-CI)-3-OMe NHCOPh(4-F)-3-O Me NHCOPh(4-CI)-2,5-OMe NHCO-5-індолі л NHCOPh(3-OMe)4-CO2H NHCOPh-3-OCF 3 NHCOPh-2,4,5-OMe NHSO2Ph-3-O Me NHCONHPh-3-OMe 78016 Me Me Me Me Me Me Me Me Me Me Me Me Me CO2H CO2H CO2H CO2H CO2H CO2H CO2H CO2H CO2H CO2H CO2H CO2H CO2H Приклад 175 3-(4-аміно-3-метоксибензоїл)-2метиліндолізин-1-ілкарбонова кислота 30мл 2Η натрій гідроксиду додають до 2,1г (5,96ммоль) етил 3-(4-аміно 3-метоксибензоїл)-2метил-1-індолізинкарбоксилату у розчині у 30мл діоксану та середовище гріють при температурі кипіння під зворотним холодильником протягом 20год. Реакційне середовище концентрують під зменшеним тиском. Залишок переносять у воду, промивають етилетером та розділяють після відстоювання. Водну фазу підкислюють до рН 6,5 10% водним розчином калій гідросульфату та екстрагують етилацетатом. 44 ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 ΝΗ 2 NH 2 92 71 78 94 67 72 82 86 74 76 53 50 75 Na, 1,5 H 2O Na, 2,0 H 2O Na, 1,0 H 2O Na, 1,8 H 2O Na, 3,0 H 2O Na, 2,25 H 2O Na, 2,5 H 2O Na, 2,8 H 2O 2Na, 2,5 H 2O Na, 1,5 H 2O Na, 2,50 H 2O Na, 2 H 2O Na, 1,2 H 2O 349°С 293°С 277°С >400°С 320°С 276°С 280°С 296°С 323°С 321°С 272°С 238°С 378°С Органічну фазу промивають водою, сушать безводним натрій · сульфатом та концентрують під зменшеним тиском. Отримують 1,8г жовтого порошку. Вихід: 93%. Дві солі сполуки тоді отримують: сіль Na, моногідрат, температура плавлення: 224°С; гідрохлорид, температура плавлення: 213°С. Приклади 176-185 Способом згідно з вищеописаним отриманням сполуки, що описано у табл.11 нижче, синтезують омиленням естерної функціональної групи у заміснику R1 сполуки формули Id, в якій А представляє радикал -CO-, з натрій гідроксидом. Таблиця 11 Приклад R1 R2 R3 R4 176 177 178 179 180 181 182 183 184 185 ОСН 2СО2Н CONHCH 2CO2H Obn-3-CO2H Obn-4-CO2H СО2Н Obn-2-CO2H СО2Н СО2Н СО2Н NHCOPh-4-CO2H Me Me Me Me С 6Н 5 Me CF 3 Η Me Me 3-OMe 3-OMe 3-OMe 3-OMe 3-OMe 3-OMe 3-OMe 3-OMe 3-NH 2 OMe 4-NH 2 4-NH 2 4-NH 2 4-NH 2 4-NH 2 4-NH 2 4-NH 2 4-NH 2 4-OMe NH2 Приклад 186 Динатрій 3-(4-карбоксибензоїл)-2-метиліндолізин-1-ілкарбоксилат 7,47мл 1 Η натрій гідроксиду додають до 910мг (2,49ммоль) етил 3-[4(метоксикарбоніл)бензоїл]-2-метиліндолізин-1ілкарбоксилату у розчині у 20мл діоксану з 20мл етанолу та середовище гріють при температурі кипіння під зворотним холодильником протягом 6год. Реакційне середовище концентрують під зменшеним тиском. Залишок переносять у воду, промивають етилетером та розділяють після відстоювання. Водну фазу підкислюють 1Η гідрохлоридною кислотою та екстрагують етилацетатом. Органічну фазу промивають водою, сушать безводним натрій сульфатом та концентрують під зменшеним тиском. Отримують 650мг жовтого порош Вихід, % 91 90 84 76 84 100 87 90 91 48 Солі Na, 0,95 H 2O Na, 1,25 H 2O Na, 0,7 H 2O Na, 1,25 H 2O Na, 1,5 H 2O Na, 1 H 2O Na, 1,9 H 2O Na, 1 H 2O HCI Темп ерату ра плав лення (°С) 227°С 297°С 207 216°С 305°С 174°С (розкл.) 330°С 254°С 225°С 256°С ку, який суспендують у 20мл метанолу та тоді додають 4,02мл 1Η натрій гідроксиду (2 еквіваленти). Розчин концентрують під зменшеним тиском. Залишок кристалізують з ацетону. Продукт відфільтровують, промивають ацетоном та тоді етилетером та сушать. Отримують 700мг жовтого порошку. Вихід, динатрій-сіль, дигідрат: 81%. Температура плавлення: >400°С. Приклади 187-191 Способом згідно з прикладом 186, сполуки, що описано у табл. 12 нижче, синтезують омиленням естерної функціональної групи у замісниках R1 та R4 сполук формули І, в яких А представляє радикал -CO-, 1Η натрій гідроксидом. Таблиця 12 Приклад R1 R2 R3 R4 187 188 189 190 191 ОСН 2 СО2Н СО2Н СО2Н СО2Н Me Me Me Me Me Η OMe СО2Н СО2Н СО2Н СО2Н СО2Н NH 2 NO2 OMe Приклад 192 Вихід, % 90 96 82 96 66 Солі 2Na, 2 H 2O 2Na,1,5 H 2O 2Na, 1,9 H 2O 2Na, 2,5 H 2O 2Na, 1,4 H 2O Темп ерату ра плав лення (°С) >400°С 323°С 336°С 321°С 310°С (4-{[3-(Дибутиламіно)пропіл]аміно}-3 45 78016 46 метоксифеніл)(1-метокси-2-метиліндолізин-3ній температурі протягом ночі. Реакційне середоіл)метанону гідрохлорид вище концентрують під зменшеним тиском. Зали700мг (2,25ммоль) (4-аміно-3-метоксифеніл)(1шок переносять у воду, промивають етилетером метокси-2-метиліндолізин-3-іл)метанону, сполуки, та розділяють після відстоювання. Водну фазу описаної у прикладі 94, розчиняють у 5мл тетрагінейтралізують 1Η гідрохлоридною кислотою. дрофурану, додають до 278,4мг (2,25ммоль) калій Утворений осад відфільтровують, промивають трет-бутоксиду у 5мл тетрагідрофурану та сереводою, суша ть та тоді переносять у етилетер, фідовище перемішують протягом 15хв. при кімнатній льтрують та сушать. Отримують жовтий порошок. температурі. Вихід: 48,5%. Температура плавлення: 196°С. 510,5мг (2,48ммоль) дибутиламінопропілхлоПриклад 197 риду у 5мл тетрагідрофурану тоді додають та сеЕтил 2-{2-метокси-4-[(1 -метокси-2редовище гріють при температурі кипіння під звофеніліндолізин-3-іл)карбоніл]аніліно}ацетат ротним холодильником протягом ночі. Цю сполуку отримують способом, описаним у Реакційне середовище охолоджують та вилиприкладі 192, алкілуванням (4-аміно-Звають у воду та тоді екстрагують етилацетатом. метоксифеніл)(1-метокси-2-феніліндолізин-3Органічну фазу відділяють після відстоювання, іл)метанону, сполуки прикладу 95, етилбромацепромивають водою, сушать безводним натрій сутатом. Отримують жовтий порошок. льфатом та концентрують під зменшеним тиском. Вихід: 78%. Температура плавлення: 132°С. Продукт очищають хроматографією на колонці Приклад 198 з оксидом силіцію, елюючи сумішшю ди хлорме2-{2-Метокси-4-[(1-метокси-2-феніліндолізин-3тан/ацетон (9/1), а тоді (1/1). іл)карбоніл]аніліно}оцтова кислота Отримують 700мг оранжевої смоли, яку переОтримана тим же способом, що сполука притворюють у сіль у етилетері додаванням одного кладу 196, омиленням етил 2-{2-метокси-4-[(1еквіваленту 1Η гідрохлоридної кислоти в етиметокси-2-феніліндолізин-3летері. іл)карбоніл]аніліно}ацетату, сполуки прикладу 197, Кристали відфільтровують, промивають ети1Η натрій гідроксидом. Отримують жовтий полетером та сушать. Оранжевий порошок отримурошок. ють у формі гідрохлориду, 1,25 Н2О. Вихід: 80%. Температура плавлення: 206°С. Вихід: 65%. Температура плавлення: 51°С. Приклад 199 Приклад 193 3-(Дибутиламіно)-М-{2-метокси-4-[(1-метокси[3-Метокси-4-(метиламіно)феніл](1 -метокси-22-метиліндолізин-3-іл)карбоніл]феніл}метиліндолізин-3-іл)метанону гідрохлорид пропанаміду гідрохлорид Цю сполуку отримують тим же способом, що 2,5мл (17,7ммоль) триетиламіну додають до описано у прикладі 192, алкілуванням (4-аміно-32,5г (8,06ммоль) (4-аміно-З-метоксифеніл)(1метоксифеніл)(1-метокси-2-метиліндолізин-3метокси-2-метиліндолізин-3-іл)метанону, сполуки іл)метанону метилйодидом. прикладу 94, у 20мл дихлорметану, о холодженого Отримують жовтий порошок. до 5°С, а потім 846мкл (8,86ммоль) 3Вихід: 45%. Температура плавлення: 172°С. хлорпропіонілхлориду у розчині у 10мл дихлормеПриклад 194 тану та середовище перемішують протягом 3год. (4-{[3-(Дибутиламіно)пропіл]аміно}-3при кімнатній температурі. Реакційне середовище метоксифеніл)(1-метокси-2-феніліндолізин-3промивають водою та тоді промивають насиченим іл)метанон дигідрохлорид водним розчином натрій хлориду, суша ть натрій Отримано тим же способом, що описано у сульфатом та концентрують під зменшеним прикладі 192, алкілуванням (4-аміно-Зтиском. метоксифеніл)(1-метокси-2-феніліндолізин-3Отриманий залишок розчиняють у 40мл етаіл)метанону, сполуки прикладу 95, дибутиламінопнолу та додають 1,7г (13,2ммоль) дибутиламіну, а ропілхлоридом. Отримують оранжевий порошок тоді середовище гріють при температурі кипіння (дигідрохлорид: 1,3 Н2О). під зворотним холодильником протягом 7год. РеаВихід: 37%. Температура плавлення: 158°С. кційне середовище концентрують під зменшеним Приклад 195 тиском. Продукт очищають хроматографією на Етил 2-{2-метокси-4-[(1-метокси-2колонці з оксидом силіцію, елюючи сумішшю дихметиліндолізин-3-іл)карбоніл]аніліно}ацетат лорметан/метанол (98:2). Отримують 2,6г продукЦю сполуку отримують тим же способом, що ту, який перетворюють у сіль додаванням 1Η гідописано у прикладі 192, алкілуванням (4-аміно-3рохлоридної кислоти в етилетері. Отримують метоксифеніл)(1-метокси-2-метиліндолізин-3жовтий порошок (гідрохлорид, 0,25 Н2О). іл)метанону, сполуки прикладу 94, етилбромацеВихід: 65%. Температура плавлення: 82°С. татом. Отримують жовтий порошок. Приклад 200 Вихід: 60,5%. Температура плавлення: 125°С. 3-(Дибутиламіно)-М-{2-метокси-4-[(1-метоксиПриклад 196 2-феніліндолізин-3-іл)карбоніл]феніл}-пропанаміду 2-{2-Метокси-4-[(1-метокси-2-метиліндолізингідрохлорид 3-іл)карбоніл]аніліно}оцтова кислота Цю сполуку отримують тим же способом, що 3,15мл 1Η натрій гідроксиду додають до 1г описано у прикладі 199, ацилуванням (4-аміно-3(2,52ммоль) етил 2-{2-метокси-4-[(1-метокси-2метоксифеніл)(1-метокси-2-феніліндолізин-3метиліндолізин-3-іл)карбоніл]аніліно}ацетату, споіл)метанону 3-хлорпропіонілхлоридом, а потім луки, отриманої у прикладі 195, у розчині у 10мл амінуванням дибутиламіном. Отримують жовтий етанолу та середовище перемішують при кімнатпорошок (гідрохлорид, напівгідрат). 47 78016 48 Вихід: 52%. Температура плавлення: 190°С. ном. Органічну фазу сушать безводним натрій Приклад 201 сульфатом та концентрують під зменшеним N-{2-Метокси-4-[(1-метокси-2-метиліндолізинтиском. 3-1л)карбоніл]феніл}ацетамін Продукт очищають флеш-хроматографією на Цю сполуку отримують тим же способом, що колонці з оксидом силіцію, елюючи сумішшю дихописано у прикладі 199, ацилуванням (4-аміно-3лорметан/метанол (8:2). Отримують 230мг масла, метоксифеніл)(1-метокси-2-метиліндолізин-3яке розчиняють в етилацетаті та перетворюють у іл)метанону, сполуки прикладу 94, ацетилхлорисіль додаванням одного еквіваленту 1Η гідрохлодом. Продукт очищають флеш-хроматографією на ридної кислоти в етилетері. Отримують жовтий оксиді силіцію, елюючи сумішшю ди хлормепорошок (гідрохлорид, 0,6 Н2О). тан/метанол (99:1). Отримують жовтий порошок Вихід: 71%. Температура плавлення: 151°С. (0,3 Н2О). Приклад 205 Вихід: 73%. Температура плавлення: 180°С. Етил 2-{[3-(дибутиламіно)пропаноїл]-2Приклад 202 метокси-4-[(1-метокси-2-феніл-3-індолізиніл) карЕтил 2-метокси-4-[(1-метокси-2боніл] аніліно} ацетату гідрохлорид метиліндолізин-3-іл)карбоніл]фенілкарбамат Отримано способом, описаним у прикладі 203, Цю сполуку отримують тим же способом, що алкілуванням 3-(дибутиламіно)-І\І-{2-метокси-4-[(1описано у прикладі 199 ацилуванням (4-аміно-3метокси-2-феніліндолізин-3метоксифеніл)(1-метокси-2-метиліндолізин-3іл)карбоніл]феніл}пропанаміду, сполуки прикладу іл)метанону етилхлорформіатом. 200, етилбромацетатом. Отримують жовтий пороПродукт очищають флеш-хроматографією на шок (гідрохлорид) після солеутворен-ня 1Η гідрооксиді силіцію, елюючи дихлорметаном, Отримухлоридною кислотою в етилетері. ють жовтий порошок. Вихід: 55%. Температура плавлення: 64°С. Вихід: 41%. Температура плавлення: 140°С. Приклад 206 Приклад 203 Гідрохлорид; 2-{[3-(дибутиламіно)пропаноїл]-2Етил 2-{[3-(дибутиламіно)пропаноїл]-2метокси-4-[(1-метокси-2-феніліндолізин-3метокси-4-[(1-метокси-2-метиліндолізин-3-їл) каріл)карбоніл]аніліно}оцтова кислота боніл]аніліно}ацетату гідрохлорид Отримано способом з прикладу 204 омилен1г (2,03ммоль) 3-(дибутиламіно-М-{2-метоксиням етил 2-{[3-(дибутиламіно)пропаноїл]-24-[(1-метокси-2-метиліндолізин-3метокси-4-[(1-метокси-2-феніліндолізин-3іл)карбоніл]феніл)пропанаміду, сполуки прикладу іл)карбоніл]аніліно}ацетату, сполуки прикладу 205, 199, у розчині у 10мл диметилформа-міду додають 1Η натрій гідроксидом. Отримують жовтий порокраплями до 89,1мг (2,23ммоль) натрій гідриду, у шок після солеутворення 1Η гідрохлоридною кис60% дисперсії у маслі, у 10мл диметилформаміду лотою в етилетері. та тоді середовище перемішують при кімнатній Вихід: 75%. Температура плавлення: 113°С. температурі протягом 1год. 247мкл (2,23ммоль) Приклад 207 етилбромацетату тоді додають та середовище 2-(Дибутиламіно)-М-{2-метокси-4-[(1-метоксиперемішують при кімнатній температурі протягом 2-метиліндолізин-3-іл)карбоніл]феніл}-1ночі. етансульфонаміду гідрохлорид Реакційне середовище виливають у воду та 471,5мкл (3,38ммоль) триетиламіну додають етилацетат. Органічну фазу відділяють після віддо 1г (3,22ммоль) (4-аміно-З-метоксифеніл)(1стоювання, промивають водою, сушать безводним метокси-2-метиліндолізин-3-іл)метанону у 15мл натрій сульфатом та концентрують під зменшеним дихлорметану, а потім 346,9мкл (3,22ммоль) 2тиском. Продукт очищають флеш-хроматографією хлоретилсульфонілхлориду у розчині у 5мл дихна колонці з оксидом силіцію, елюючи сумішшю лорметану та середовище перемішують при кімнадихлорметан/метанол (97:3). Отримують 850мг тній температурі протягом ночі. Реакційне середомасла, яке розчиняють у етилетері та перетворювище промивають водою та тоді промивають ють у сіль додаванням одного еквіваленту 1Η гіднасиченим водним розчином натрій хлориду, сурохлоридної кислоти в етилетері. Отримують жовті шать безводним натрій сульфатом та концентрукристали (гідрохлорид, гідрат). ють під зменшеним тиском. Вихід: 72%. Температура плавлення: 67°С. Отриманий залишок розчиняють у 10мл етаПриклад 204 нолу, додають 375мг (2,9ммоль) дибутиламіну та Гідрохлорид 2-{[3-(дибутиламіно)пропаноїл]-2середовище гріють при температурі кипіння під метокси-4-[(1-метокси-2метиліндолізин-3зворотним холодильником протягом 4 годин. Реаіл)карбоніл]аніліно}оцтова кислота кційне середовище концентрують під зменшеним 586мкл 1Η натрій гідроксиду додають до 340мг тиском. Продукт очищають хроматографією на (0,586ммоль) етил 2-{[3-(дибутиламіно)пропаноїл]колонці з оксидом силіцію, елюючи сумішшю дих2-метокси-4-[(1-метокси-2-метиліндолізин-3лорметан/метанол (98:2). Отримують 1,18г продуіл)карбоніл]аніліно}-ацетату, отриманого у приклакту, який перетворюють у сіль додаванням 1Η гідді 203, у розчині у 5мл етанолу та середовище рохлоридної кислоти в етилетері. Отримують перемішують при кімнатній температурі протягом жовтий порошок (гідрохлорид, напівгідрат). ночі. Реакційне середовище концентрують під Вихід: 69%. Температура плавлення: 91°С. зменшеним тиском. Залишок переносять у воду, Приклад 208 промивають етилетером та розділяють після від2-(Дибутиламіно)-ІЧ-{2-метокси-4-[(1-метоксистоювання. Водну фазу нейтралізують 1Η гідро2-феніліндолізин-3-іл)карбоніл]феніл}-1хлоридною кислотою та екстрагують дихлорметаетансульфонаміду гідрохлорид 49 78016 50 Цю сполуку отримують тим же способом, що до 400мг (0,755ммоль) 2-(дибутиламіно)-N-{2сполуку прикладу 207, сульфонілуванням (4-амінометокси-4-[(1-метокси-2-метиліндолізин-33-метоксифеніл)(1-метокси-2-феніліндолізин-3іл)карбоніл]феніл}-1-етансульфонаміду, сполуки іл)метанон 2-хлоретилсульфонілхлоридом, а потім прикладу 207, у розчині у 10мл диметилформаміамінуванням дибутиламіном. Отримують жовтий ду, а потім 142мкл (0,906ммоль) бензилбромацепорошок (гідрохлорид, напівгідрат). тату, та середовище гріють при 60°С протягом Вихід: 63%. Температура плавлення: 111°С. 1год. Реакційне середовище виливають у воду та Приклад 209 етилацетат. N-{2-Meтoкcи-4-[(1-мeтoкcи-2-мeтилiндoлiзинОрганічну фазу відділяють після відстоюван3-iл)кapбoнiл]фeнiл}мeтaнcyльфoнaмiд ня, промивають водою, сушать безводним натрій Отримано тим же способом, що сполуку присульфатом та концентрують під зменшеним тискладу 207, сульфонілуванням (4-аміно-Зком. метоксифеніл)(1-метокси-2-метиліндолізин-3Продукт очищають флеш-хроматографією на іл)метанону метансульфонілхлоридом. Продукт колонці з оксидом силіцію, елюючи сумішшю дихочищають хроматографією на колонці з оксидом лорметан/метанол (98:2). Отримують 440мг масла, силіцію, елюючи сумішшю толуол/етилацетат яке використовують безпосередньо у наступному (7:3). Отримують жовтий порошок. етапі. Вихід: 67%. Температура плавлення: 165°С. Вихід: 86%. Приклад 210 Етап В Етил 3-{3-метокси-41,3мл (12,7ммоль) циклогексену додають до [(метилсульфоніл)аміно]бензоїл}-2430мг (0,634ммоль) бензил 2-{{[2метиліндолізин-1-ілкарбоксилат (дибутиламіно)етил]сульфоніл}-2-метокси-4-[(1Цю сполуку отримують тим же способом, що метокси-2-метиліндолізин-3описано у прикладі 207, сульфонілуван-ням етил іл)карбоніл]аніліно}ацетату у 5мл етанолу у прису3-(4-аміно-3-метоксибензоїл)-2-метиліндолізин-1тності 100мг 10% Pd/C та середовище гріють при ілкарбоксилату, сполуки прикладу 97, метансультемпературі кипіння під зворотним холодильником фонілхлоридом. Продукт очищають хроматографіпротягом 3год. Реакційне середовище охолоджуєю на колонці з оксидом силіцію, елюючи сумішшю ють, каталізатор відфільтровують та фільтрат контолуол/етил ацетат (8:2). Отримують жовтий поцентрують під зменшеним тиском. рошок. Продукт очищають флеш-хроматографією на Вихід: 57%. Температура плавлення: 178°С. колонці з оксидом силіцію, елюючи сумішшю дихПриклад 211 лорметан/метанол (9:1). Отримують 250мг масла, Натрій 3-{3-метокси-4яке розчиняють в етилацетаті та перетворюють у [(метилсульфоніл)аміно]бензоїл}-2сіль додаванням одного еквіваленту 1N гідрохлометиліндолізин-1-ілкарбокислат ридної кислоти в етилетері. Отримують оранжевий 1мл каустичної соди додають до 290мг порошок (гідрохлорид, дигідрат). (0,675ммоль) етил 3-{3-метокси-4Вихід: 67%. Температура плавлення: 85°С. [(метилсульфоніл)аміно]бензоїл}-2-метиліндоліг-1Приклад 213 ілкарбоксилату у 7мл діоксану з 7мл води та сереБензил 2-{{[2-(дибутиламіно)етил]сульфоніл}довище гріють при температурі кипіння під зворот2-метокси-4-[(1-метокси-2-феніліндолізин-3ним холодильником протягом 6год. іл)карбоніл]аніліно}ацетату гідрохлорид Середовище охолоджують, виливають у воду Цю сполуку отримують способом з прикладу та нейтралізують водним розчином калій гідро212, Етап А, алкілуванням 2-(дибутиламіно)-N-{2сульфату та тоді екстрагують етилацетатом. Орметокси-4-[(1-метокси-2-метиліндолізин-3ганічну фазу промивають водою, сушать безводіл)карбоніл]феніл}-1-етансульфонаміду бензилбним натрій сульфатом та концентрують під ромацетатом. зменшеним тиском. Жовтий порошок (гідрохлорид, напівгідрат) Отримують 220мг жовтого порошку. Продукт отримують після солеутворення 1Η гідрохлоридперетворюють у сіль додаванням одного еквіваленою кислотою в етилетері. нту 1Η натрій гідроксиду у суспензії продукту у воді Вихід: 55%. Температура плавлення: 95°С. та перемішують при кімнатній температурі до поПриклад 214 вної розчинності. Гідрохлорид; 2-{{[2Розчин тоді сушать сублімацією. Отримують (дибутиламіно)етил]сульфоніл}-2-метокси-4-[(1жовтий продукт (сіль Na, 1,85 Н2О). метокси-2-феніліндолізин-3Вихід: 81%. Mac-спектрометрія (режим ЕР+): іл)карбоніл)аніліно}оцтова кислота МН+=403,2. Цю сполуку отримують способом прикладу Приклад 212 212, Етап В, гідруванням бензил 2-{{[2Гідрохлорид; 2-{{[2(дибутиламіно)етил]сульфоніл}-2-метокси-4-[(1(дибутиламіно)етил]сульфоніл}-2-метокси-4-[(1метокси-2-феніліндолізин-3метокси-2-метиліндолізин-3іл)карбоніл]аніліно}ацетату, сполуки прикладу 213, іл)карбоніл]аніліно}оцтова кислота циклогексеном у присутності Pd/C у етанолі. ЖовЕтап А тий порошок (гідрохлорид, 1,5 Н2О) отримують Бензил 2-{{[2-(дибутиламіно)етил]сульфоніл}після солеутворення 1Η гідрохлоридною кислотою 2-метокси-4-[(1-метокси-2-метиліндолізин-3в етилетері. іл)карбоніл]аніліно}ацетат Вихід: 75%. Температура плавлення: 113°С. 125мг (0,906ммоль) калій карбонату додають Приклад 215 51 78016 52 Дослідження спорідненості стосовно приєдабо ендотеліальні клітини аорти свині (РАЕС) при 15х103клітин/комірку у 400мкл середовища ЕВМ нання 125l-b-FGF до очищеного рецептору FGF R a IIIс способом сцинтиляції NBS-планшети (NBS(Clonetics C3121)+2% FBS+hEGF 10 (мк/мл для HUVEC та DMEM+3% FCS+2мМ глутамін+1мМ планшет, 96-комірковий, суцільний, білий натрій піруват+1% замінних амінокислот (GIBCO) CORNING 3600) покривають 100мкл 0,1% желатидля РАЕС. ну на комірку, протягом 2год. при 37°С. Під кінець Стимулюють b-FGF (TEBU/Peprotech) 10нг/мл інкубування покриття видаляють, планшет промивають та сушать. 100мкл буферу для приєднання або a-FGF (TEBU/Peprotech) 10нг/мл у присутності або інакше продуктів винаходу протягом 24год. (40мМ Біс Трис буфер, рН 7,0) розподіляють у при 37°С у присутності 5% СО2. планшет. Після 24год. фіксують клітини та фарбують Розбавлення сполук винаходу розподіляють слайди трихром Masson перед дослідженням під по коміркам у кількості 10мкл/комірку. Тоді розподіляють по 10мкл/комірку b-FGF (AMΕRSНАМ ARM мікроскопом з лінзою x4 та аналізом зображення (ВІОСОМ - програмне забезпечення Visiolab 2000 35050) та 10мкл/комірку FGF R α IIIс (R&D Систеsoftware). ми 658 FR). Далі, додають по 10мкл/комірку 125l-bПри тестуванні in vitro ангіогенезу, індукованоFGF (Dupont NEN NEX 268 - специфічна активність го b-FGF або a-FGF, сполуки винаходу продемонс>70нКі) та 50мкл/комірку кульок SPA (AMERSHAM RPQN 00019). Планшет струшують протягом кільтрували специфічну активність між 10-7Μ та 10-11 М. Приклад 218 кох секунд та інкубують протягом 60хв. при 37°С, Модель запального ангіогенезу у мишей захищеним від світла. Ангіогенез потрібний для розвитку хронічних Під кінець інкубування, планшет зчитують у лізапальних хвороб, як-то ревматоїдний артрит, IBD, чильнику радіоактивності MIBROBETA TRILUX (WALL AC-PERKINELMER). але також для розвитку твердих пухлин. Утворення нових судин не тільки дозволяє перфузію патоСполуки винаходу продемонстрували специлогічних тканин, але також транспорт цитокінів, фічну активність між 10-6Μ та 10-9 М. відповідний за встановлення хронічності хвороби. Приклад 216 Модель, описана [Colville-Nash P. et al. // D. Дія сполук формули І на проліферацію HUVEC у порівнянні з 30нг/мл b-FGF або 10нг/мл a-FGF JPET. – 1995. - Vol.274. - №3. - P.1463-1472], робить можливим дослідження фармакологічних Покривають 24-коміркові планшети (FALCON засобів, здатних модулювати виникнення ангіогеPRIMARIA) 200мкл розчину фібронектину незу. (50мкг/мл, отримано у PBS) на комірку. Тварин, неєдинокровних білих мишей приблиЗасівають у кількості 30000клітини/мл/комірку у середовищі RPMI 1640+10% FCS+1% глутазно по 25г, анестезують натрій пентобарбіталом (60мг/кг; Sanofi Nutrition Sante Animale) інтраперимін+гепарин-ECGF (НЕ). Інкубують при 37°С, 5% тональним шляхом. СО2, протягом 1год., потрібного для злипання кліНа боку миші створюють повітряну кишеню тин. ін'єктуванням 3мл повітря підшкірно. Розчиняють продукти та отримують розчини у суміші ДМСО/реакційного середовища, що має Після опритомнення тварини отримують лікування, загалом посиленим харчуванням та отрикінцеву концентрацію 1мкМ кінцево при 10-7М. мують ін'єкції по 0,5мл ад'юванту Фрейнда (Sigma) Після злипання клітин протягом 6год. при 37°С з 0,1% кротонового масла (Sigma) у кишеню. у присутності 5% СО2 , середовище замінують Сім діб пізніше мишей знов анестезують та RPMI 1640 0,1% FSC+глутамін+НЕ. Для дериватизації використовують як негативпоміщають на нагрівальний планшет при 40°С. 1мл карміну червоного (5% у 10% желатину ний контроль 0,1% FCS, як позитивний контроль Aldrich Chemical) ін'єктують у хвостову вену. Тва0% FCS та як контроль 0,1% FCS+30нг/мл b-FGF рин тоді тримають при 4°С протягом 2-3год. або 10нг/мл a-FGF. Інкубування тоді провадять Шкіру тоді видаляють та сушать протягом протягом 24год. при 37°С у присутності 5% СО2. Другої доби клітини промивають 1мл PBS та 48год. у ша фі при 56°С. Сухі тканини зважують та тримають у 1,8мл буферу для ферментативного 200мкл трипсину та тоді збирають в ізотон, підрагідролізу (2мМ дитіотреітол, 2мМ Na2HPO4, 1мМ хунок провадять (n>9мкм). EDTA, 12од./мл папаїну) протягом 24год. У цьому тесті проліферації ендотеліальних Фарбу тоді розчиняють у 0,2мл 5Μ NaOH. шкіклітин індукованої b-FGF або a-FGF, сполуки винаходу продемонстрували специфічну активність між ру центрифугують при 2000g протягом 10хв. Надосадкові шари фільтрують на мембранах з ацетату 10-5Μ та 10-9 М. целюлози 0,2мкм. Фільтрати зчитують у спектроПриклад 217 фотометрі при 492нм проти калібрувальної серії Модель ангіогенезу in vitro карміну червоного. Отримують гелі розподіленням у кожну комірку (колаген хвоста щура Biocoat Cellware, Тип І: BecДва параметри є дослідженими: суха маса грануломи та кількість фарби після гідролізу цієї ton Dickinson 354630) 160мкл матричного гелю, тканини. розбавленого 1/6 (матричний гель зменшення фаРезультати виражено як середні значення ктору росту Matrigel: Becton Dickinson 356230) ко(±СВ). різниці між групами, що тестують за дополагеном (колаген хвоста щура, тип І: Becton Dickinson 354236). Дають утворюватися гелю промогою ANOVA, а потім тесту Дуннета, де посилальною групою є група «контролю розчинником». тягом 1год. при 37°С. Сполуки винаходу є активними з пероральним Засівають ендотеліальні клітини вен людини шляхом уведення при дозах 0,1-100мг/кг. (HUVEC ref: C-015-10C - cascade Biologies, INC) 53 78016 54 Приклад 219 даляють з м'язів та шкіри, фіксують протягом ночі Модель MATRIGEL-ангіогенез у мишей у 10% розчині формальдегіду та вбудовуютьу паМодель, що описано [Passaniti et al. // Laboraрафін (Embedder Leica®). Грануломи тоді нарізаtory In vestigation. – 1992. - 67(4). – P. 519-524] роють за допомогою мікротома (Leica) та фарбують бить можливим дослідження фармакологічних барвником трихром Masson's . Неоваскуляризацію засобів, здатних модулювати виникнення ангіогегранулом тоді оцінюють. Рівні васкуляризації є між незу, який є специфічно індукованим b-FGF. FGF2 значеннями 0 та 5. (Peprotech) додають до Matrigel (Beckton Dickinson) Сполуки винаходу є активними при уведенні у рідкій формі при 4°С, у кількості 300нг/мл. Після пероральним шляхом при дозах 0,1-100мг/кг. гомогенізації суміш (0,5мл) підшкірно ін'єктують в Приклад 220 основу спини самицям чорних мишей (С57/В16) Модель ангіогенезу пухлин у мишей приблизно по 20г, анестезованих перед тим натрій Ця модель робить можливим дослідження пентобарбіталом (60мг/кг; Sanofi Nutrition Sante фармакологічних засобів, здатних модулювати Animale) інтраперитональним шляхом. Тварин виникнення ангіогенезу, специфічно індукованого лікують посиленим харчуванням. Після 5дн. мирозвитком пухлин. Ми шей C56/B16 приблизно по шей знов анестезують та шкіру основи спини ви20г анестезують натрій пентобарбіталом (60мг/кг; даляють; на цьому етапі оцінюють якісні відмінноSanofi Nutrition Sante Animale) інтраперитональним сті у васкуляризації грануломи (оцінка за балами) шляхом. Пухлини утворюють підшкірною ін'єкцією та грануломи фотографують. Аналіз ДНК у грануна спині мишей Lewis клітин легенів у кількості ломах тоді провадять для виміру целюлярності. 2x105 клітин/мишу. Після 5дн. миші лікують протяДля цього виділені грануломи розщеплюють колагом 1дн. посиленим харчуванням. Розмір пухлин геназою (3мг/мл) протягом ночі при 37°С. Після вимірюють двічі на тиждень протягом 21дн. та об'центрифугування при 850g протягом 10хв., надоєм пухлин розраховують, застосовуючи формулу: садковий шар видаляють та гранулу перерозчиp няють у 1,2мл буфер у PBS, що містить 1мМ СаСІ2, 6 ( w1 ´ w2 ) 1мМ МgСІ2 та 5мМ глюкозу. Кількість наявної ДНК де: w1 , w 2 - найбільший та найменший діавимірюють за допомогою комплекту (Cyquant-GR®, метр пухлин відповідно. Molecular probe) згідно з інструкціями постачальРезультати виражено як середні значення ника. (±СВ). Відмінності між групами тестують за допоРезультати виражено як середні значення могою ANOVA, а потім тесту Дуннета, де посила(±СВ). Відмінності між групами тестують за допольною групою є група “контролю розчинником”. могою ANOVA, а потім тесту Дуннета, де посилаСполуки винаходу є активними при уведенні льною групою є група “контролю розчинником”. пероральним шляхом при дозах 0,1-100мг/кг. Для гістологічного дослідження грануломи ви 55 Комп’ютерна в ерстка В.Сердюк 78016 Підписне 56 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1,2,3-substituted indolysin derivatives, fgfs inhibitors, method for production and pharmaceutical composition
Автори англійськоюBono, Francoise, Herbert Jean-Marc
Назва патенту російською1,2,3-замещенные производные индолизина, ингибиторы fgfs, способ их получения и содержащая их фармацевтическая композиция
Автори російськоюБоно Франсуаз, Эрбер Жан-Марк
МПК / Мітки
МПК: A61P 1/00, A61P 11/00, A61P 19/00, C07D 471/04, A61P 43/00, A61P 9/00, A61P 19/08, A61P 35/02, A61K 31/437, A61P 35/00, A61P 9/08, A61P 9/10, A61P 19/02, A61P 25/00, A61P 15/00, A61P 3/10, A61P 27/02, A61P 29/00, A61P 13/08
Мітки: спосіб, отримання, індолізину, фармацевтична, похідні, інгібітори, композиція, 1,2,3-заміщені, fgfs, містить
Код посилання
<a href="https://ua.patents.su/28-78016-123-zamishheni-pokhidni-indolizinu-ingibitori-fgfs-sposib-kh-otrimannya-ta-farmacevtichna-kompoziciya-shho-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">1,2,3-заміщені похідні індолізину, інгібітори fgfs, спосіб їх отримання та фармацевтична композиція, що їх містить</a>
Попередній патент: Сировинна суміш для виготовлення легких теплоізоляційних матеріалів
Наступний патент: Спосіб обробки овочів (варіанти)
Випадковий патент: Спосіб визначення витрати газу в трубопроводі