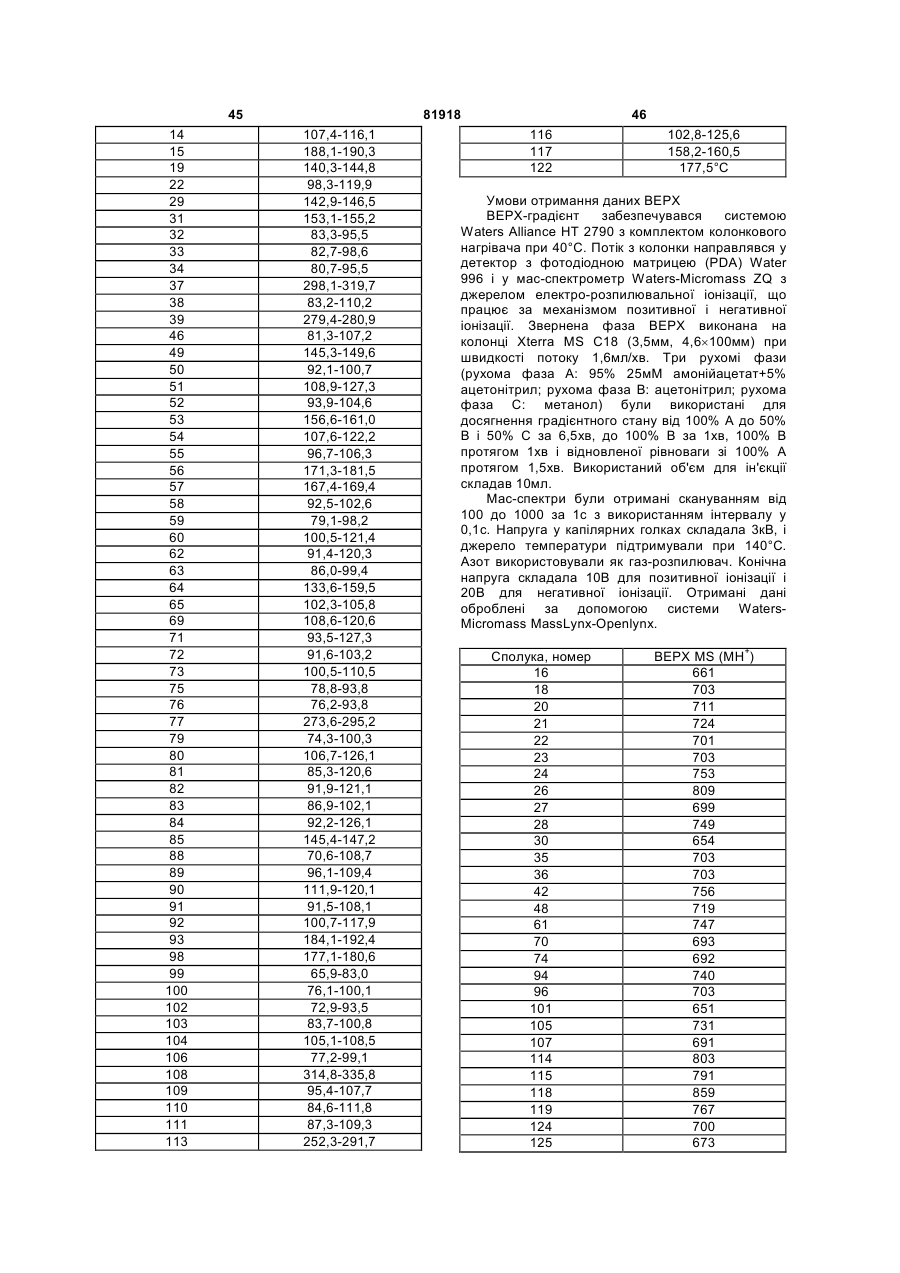
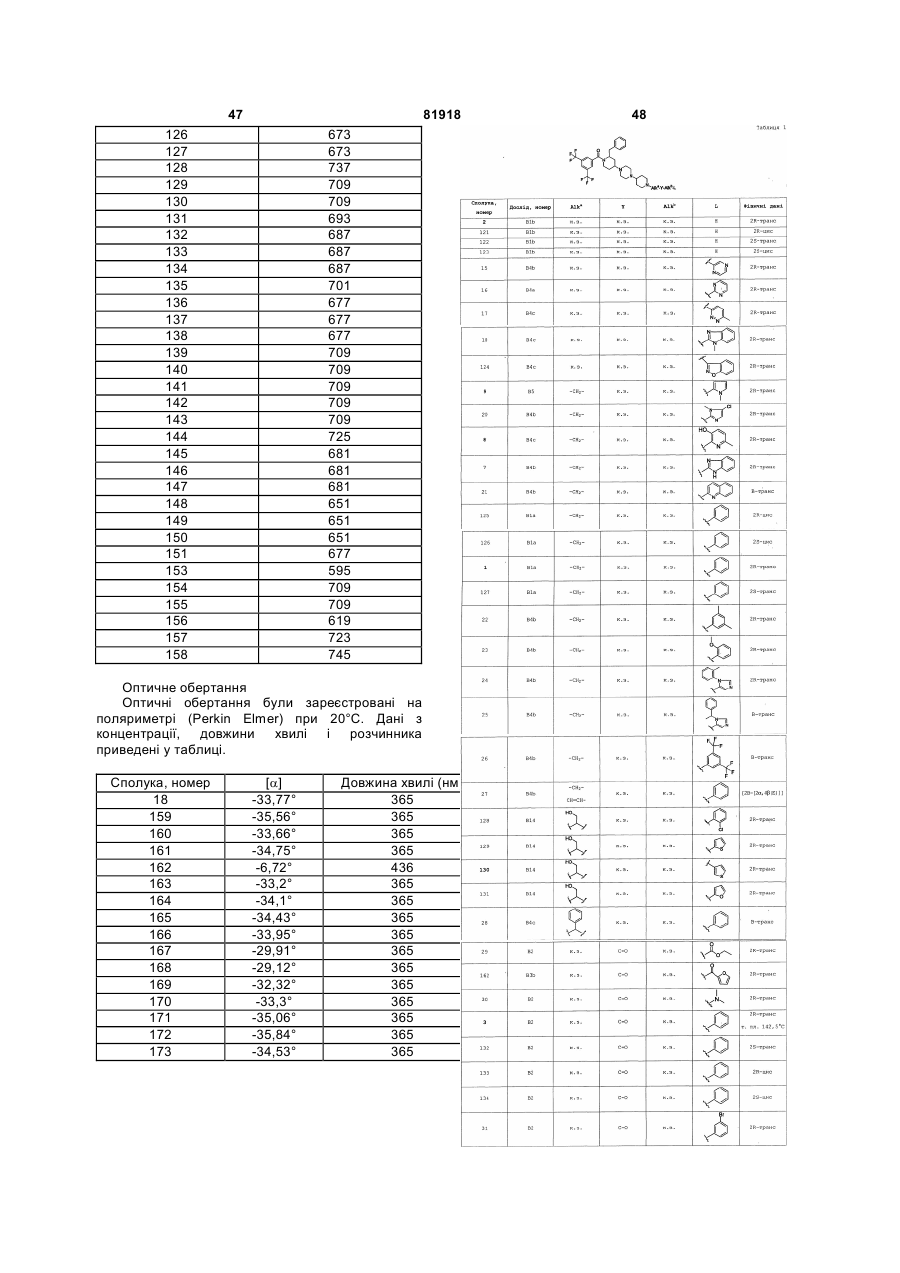
Заміщені похідні 1,4-дипіперидин-4-ілпіперазину та їх застосування як нейрокінінових антагоністів
Номер патенту: 81918
Опубліковано: 25.02.2008
Автори: Ділс Гастон Станіслас Марселла, Соммен Франсуа Марія, ван Роосбрек Ів Еміль Марія, де Бек Бенуа Крістіан Альберт Хіслен, Леенартс Йозеф Елізабет, Янссенс Франс Едуард
Формула / Реферат
1. Сполука загальної формули (І)
 , (I)
, (I)
її фармацевтично прийнятні кислотно-адитивні або основно-адитивні солі, її стереохімічно ізомерні форми, її N-оксидна форма і її проліки, де:
n являє собою ціле число, яке дорівнює 0, 1 або 2;
m являє собою ціле число, яке дорівнює 1 або 2, за умови, що якщо m дорівнює 2, то n дорівнює 1;
р являє собою ціле число, яке дорівнює 1 або 2;
Q являє собою О або NR3;
Х являє собою ковалентний зв'язок або двовалентний радикал формули -O-, -S- або -NR3-;
кожен R3 незалежно один від одного являє собою водень або алкіл;
кожен R1 незалежно один від одного вибраний з групи, Аr1, Аr1-алкіл і ді(Аr1)алкіл;
q являє собою ціле число, яке дорівнює 0 або 1;
R2 являє собою алкіл, Аr2, Аr2-алкіл, Het1 або Неt1-алкіл;
Y являє собою ковалентний зв'язок або двовалентний радикал формули -С(=O)- або -SO2-;
кожен Alk являє собою, незалежно один від одного, ковалентний зв'язок; двовалентний прямий або розгалужений, насичений або ненасичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю; або циклічний насичений або ненасичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; кожен радикал необов'язково заміщений на одному або декількох атомах вуглецю одним або кількома алкіл-, феніл-, галоген-, ціано-, гідрокси-, форміл- і амінорадикалами;
L вибраний з групи, що містить водень, алкілокси, Аr3-окси, алкілоксикарбоніл, моно- і ді(алкіл)аміно, моно- і ді(Аr3)аміно, моно- і ді(алкілоксикарбоніл)аміно, Аr3, Аr3-карбоніл, Het2 і Неt2-карбоніл;
Аr1 являє собою феніл, необов'язково заміщений 1, 2 або 3 замісниками, кожен з яких незалежно один від одного вибраний з групи, що містить галоген, алкіл, ціано, амінокарбоніл і алкілокси;
Аr2 являє собою нафталініл або феніл, кожен необов'язково заміщений 1, 2 або 3 замісниками, кожен з яких незалежно один від одного вибраний з групи, що містить галоген, нітро, аміно, моно- і ді(алкіл)аміно, ціано, алкіл, гідрокси, алкілокси, карбоксил, алкілоксикарбоніл, амінокарбоніл і моно- і ді(алкіл)амінокарбоніл;
Аr3 являє собою нафталініл або феніл, необов'язково заміщений 1, 2 або 3 замісниками, кожен з яких незалежно один від одного вибраний з групи, що містить алкілокси, алкіл, галоген, гідрокси, піридиніл, морфолініл, піролідиніл, імідазо[1, 2-a]піридиніл, морфолінілкарбоніл, піролідинілкарбоніл, аміно і ціано;
Het1 являє собою моноциклічний гетероциклічний радикал, вибраний з групи, що містить піроліл, піразоліл, імідазоліл, фураніл, тієніл, оксазоліл, ізоксазоліл, тіазоліл, тіадіазоліл, ізотіазоліл, піридиніл, піримідиніл, піразиніл і піридазиніл; або біциклічний гетероциклічний радикал, вибраний з групи, що містить хінолініл, хіноксалініл, індоліл, бензімідазоліл, бензоксазоліл, бензізоксазоліл, бензотіазоліл, бензізотіазоліл, бензофураніл і бензотієніл; кожен гетероциклічний радикал необов'язково може бути заміщений на будь-якому атомі радикалом, вибраним з групи, що містить галоген або алкіл;
Het2 являє собою моноциклічний гетероциклічний радикал, вибраний з групи, що містить піролідиніл, діоксоліл, імідазолідиніл, піразолідиніл, піперидиніл, морфолініл, дитіаніл, тіоморфолініл, піперазиніл, імідазолідиніл, тетрагідрофураніл, 2Н-піроліл, піролініл, імідазолініл, піразолініл, піроліл, імідазоліл, піразоліл, триазоліл, фураніл, тієніл, оксазоліл, ізоксазоліл, тіазоліл, тіадіазоліл, ізотіазоліл, піридиніл, піримідиніл, піразиніл, піридазиніл і триазиніл; або біциклічний гетероциклічний радикал, вибраний з групи, що містить бензопіперидиніл, хінолініл, хіноксалініл, індоліл, ізоіндоліл, хроменіл, бензімідазоліл, імідазо[1,2-а]піридиніл, бензоксазоліл, бензізоксазоліл, бензотіазоліл, бензізотіазоліл, бензофураніл і бензотієніл; кожен радикал необов'язково заміщений одним або кількома радикалами, вибраними з групи, що містить Аr1, Аr1-алкіл, галоген, гідрокси, алкіл, піперидиніл, піроліл, тієніл, оксо, алкілокси, алкілоксіалкіл і алкілоксикарбоніл; і
алкіл являє собою прямий або розгалужений насичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю; або циклічні насичені вуглеводневі радикали, що містять від 3 до 6 атомів вуглецю; кожен радикал необов'язково заміщений на одному або декількох атомах вуглецю одним або кількома радикалами, вибраними з групи, що містить феніл-, галоген-, ціано-, оксо-, гідрокси-, форміл- і амінорадикали.
2. Сполука за п. 1, яка відрізняється тим, що
n дорівнює 1;
m дорівнює 1;
р дорівнює 1;
Q являє собою O;
Х являє собою ковалентний зв'язок;
кожен R1 являє собою Аr1 або Аr1-алкіл;
q дорівнює 0 або 1;
R2 являє собою Аr2;
Y являє собою ковалентний зв'язок або двовалентний радикал формули -С(=O)- або -SO2-;
кожен Alk являє собою, незалежно один від одного, ковалентний зв'язок; двовалентний прямий або розгалужений, насичений або ненасичений вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю; або циклічний насичений або ненасичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; кожен радикал необов'язково заміщений на одному або декількох атомах вуглецю одним або кількома феніл-, галоген-, ціано-, гідрокси-, форміл- і амінорадикалами;
L вибраний з групи, що містить водень, алкілокси, Аr3-окси, алкілоксикарбоніл, моно- і ді(алкіл)аміно, моно- і ді(Аr3)аміно, Аr3 і Het2;
Аr1 являє собою феніл, необов'язково заміщений 1, 2 або 3 алкілрадикалами;
Аr2 являє собою феніл, необов'язково заміщений 1, 2 або 3 алкілрадикалами;
Аr3 являє собою феніл, необов'язково заміщений 1, 2 або 3 замісниками, кожен з яких незалежно один від одного вибраний з групи, що містить алкілокси, алкіл, галоген, гідрокси, піридиніл, морфолініл, піролідиніл, імідазо[1,2-а]піридиніл, морфолінілкарбоніл, піролідинілкарбоніл, аміно і ціано;
Het2 являє собою моноциклічний гетероциклічний радикал, вибраний з групи, що містить піролідиніл, піперидиніл, морфолініл, піроліл, імідазоліл, піразоліл, фураніл, тієніл, ізоксазоліл, тіазоліл, тіадіазоліл, піридиніл, піримідиніл, піразиніл і піридазиніл; або біциклічний гетероциклічний радикал, вибраний з групи, що містить бензопіперидиніл, хінолініл, хіноксалініл, індоліл, хроменіл і бензімідазоліл; кожен радикал необов'язково заміщений одним або кількома радикалами, вибраними з групи, що містить Аr1, Аr1-алкіл, галоген, гідрокси, алкіл, піперидиніл, піроліл, тієніл, оксо і алкілоксикарбоніл; і
алкіл являє собою прямий вуглеводневий радикал, що містить від 1 до 6 атомів вуглецю, необов'язково заміщений одним або кількома галогенрадикалами.
3. Сполука за будь-яким з пп. 1-2, яка відрізняється тим, що R1 являє собою Аr1-метил і приєднаний у положенні 2, або R1 являє собою Аr1 і приєднаний у положенні 3.
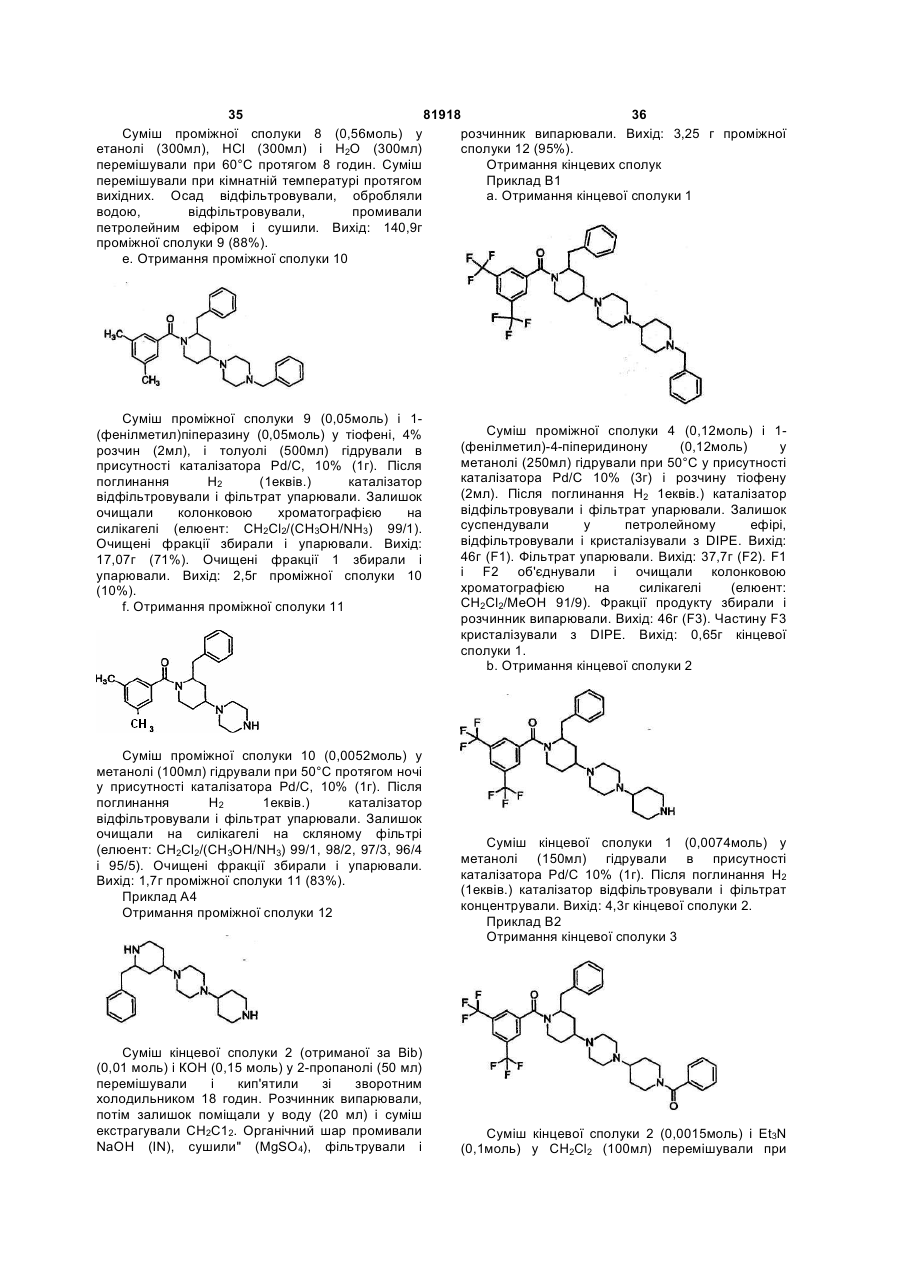
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що R2-X-C(=Q)-фрагмент являє собою 3,5-ди(трифторметил)фенілкарбоніл.
5. Сполука за будь-яким з пп. 1-4 для застосування як лікарського засобу.
6. Лікарський засіб для лікування нейрокінінопосередкованих станів, який містить сполуку за будь-яким з пп. 1-4.
7. Лікарський засіб для лікування блювання, депресії, станів тривоги, болю, панкреатиту, розладів сечовипускання, зокрема гіперфункції сечового міхура, і синдрому подразненого кишечнику (IBS), який містить сполуку за п. 6.
8. Фармацевтична композиція, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4.
9. Фармацевтична композиція за п. 8, яка відрізняється тим, що вона знаходиться у формі, придатній для орального введення.
10. Спосіб отримання композиції за будь-яким з пп. 1-4, який відрізняється тим, що фармацевтично прийнятний носій однорідно змішують з терапевтично ефективною кількістю сполуки за будь-яким з пп. 1-4.
11. Спосіб отримання сполуки формули (І), який відрізняється тим, що
a) кінцеву сполуку формули (І) отримують N-гідроалкілуванням проміжної сполуки формули (II), де R1, R2, X, Q, m, n і р приймають значення, визначені у формулі (І), з N-заміщеним піперидиноном формули (III), де R1, Alk, Y, L і q приймають значення, визначені у формулі (І), у реакційноінертному розчиннику і в присутності відновника;
або
 ;
;
b) кінцеву сполуку формули (І) отримують перетворенням сполук формули (І) одна в одну згідно з добре відомими у даній області реакціями перетворення; і, додатково, перетворенням сполук формули (І) у кислотно-адитивну сіль обробкою кислотою або у основно-адитивну сіль обробкою основою, або навпаки, кислотно-адитивна сольова форма може бути перетворена у вільну основу обробкою лугом, або основно-адитивна сіль може бути перетворена у вільну кислоту обробкою кислотою; і отриманням N-оксиду і/або його стереохімічно ізомерних форм.
12. Спосіб отримання сполуки формули (І), формули (Iа), формули (Іb) або формули (Ic), який відрізняється тим, що
a) кінцеву сполуку формули (Iа) отримують ацилюванням кінцевої сполуки формули (I'), де R1, R2, X, Q, m, n, р і q приймають значення, визначені у формулі (І), за допомогою ацильної сполуки формули (V) , де Alk і L приймають значення, визначені у формулі (І), і W1 являє собою відхідну групу, у реакційноінертному розчиннику і в присутності основи,
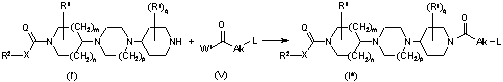 ; або
; або
b) кінцеву сполуку формули (Iа) отримують реакцією каталізованого основою нуклеофільного приєднання кінцевої сполуки формули (I'), де R1, R2, X, Q, m, n, р і q приймають значення, визначені у формулі (І), до карбонової кислоти формули (VI), де Alk і L приймають значення, визначені у формулі (І), або до її складного ефіру, у реакційноінертному розчиннику і в присутності основи, або
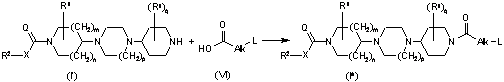 ; або
; або
c) кінцеву сполуку формули (Іb) отримують реакцією каталізованого основою нуклеофільного приєднання кінцевої сполуки формули (I'), де R1, R2, X, Q, m, n, р і q приймають значення, визначені у формулі (І), до сполуки формули (VIII), де Alk і L приймають значення, визначені у формулі (І), і W2 являє собою відхідну групу, у реакційноінертному розчиннику і в присутності основи,
 ; або
; або
d) кінцеву сполуку формули (Ic) отримують гідроамінуванням/гідроалкілуванням кінцевої сполуки формули (I'), де R1, R2, X, Q, m, n, р і q приймають значення, визначені у формулі (І), за допомогою сполуки формули (VIII), де Alk і L приймають значення, визначені у формулі (І), і W3 являє собою відхідну групу, у реакційноінертному розчиннику і в присутності основи,
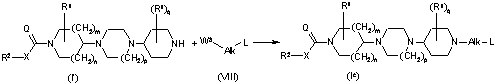 ; або
; або
e) кінцеву сполуку формули (І) отримують перетворенням сполук формули (І) одна в одну згідно з добре відомими у даній області реакціями перетворення; і, додатково, перетворенням сполук формули (І) у кислотно-адитивну сіль обробкою кислотою або у основно-адитивну сіль обробкою основою, або навпаки, кислотно-адитивна сольова форма може бути перетворена у вільну основу обробкою лугом, або основно-адитивна сіль може бути перетворена у вільну кислоту обробкою кислотою; і отриманням N-оксиду і/або його стереохімічно ізомерних форм.
13. Спосіб отримання сполуки формули (XIII), який відрізняється тим, що сполука формули (XI), де А являє собою арил або гетероарил, Z може бути будь-яким фрагментом, краще фрагментом Z1, як визначено нижче, де кожен замісник приймає значення, визначені у формулі (І), Hal являє собою галоген і r являє собою ціле число, що змінюється від 1 до числа, рівного числу доступних атомів вуглецю в арилі або у гетероарильному фрагменті А, піддають взаємодії з ненасиченим гетероарилом Het формули (XII) у присутності каталітичних кількостей Pd(OAc)2 і 1,3-біс-дифенілфосфінопропану, у присутності придатної основи, краще Сs2СО3 або К(АсО), у реакційноінертному полярному розчиннику,
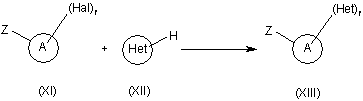 ,
,
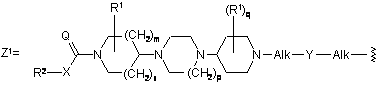 .
.
14. Спосіб за п. 13, в якому Hal являє собою бром або йод, А являє собою феніл або піридиніл, Z являє собою Z1 і Het є вибраним з групи, що містить імідазо[1,2-а]піридиніл, піроліл і тієніл.
Текст
1. Сполука загальної формули (І) R1 ЇХ (19) 1 ТА 3 81918 4 Аr3 являє собою нафталініл або феніл, прямий або розгалужений, насичений або необов'язково заміщений 1, 2 або 3 замісниками, ненасичений вуглеводневий радикал, що містить кожен з яких незалежно один від одного вибраний від 1 до 6 атомів вуглецю; або циклічний з групи, що містить алкілокси, алкіл, галоген, насичений або ненасичений вуглеводневий гідрокси, піридиніл, морфолініл, піролідиніл, радикал, що містить від 3 до 6 атомів вуглецю; імідазо[1, 2-a]піридиніл, морфолінілкарбоніл, кожен радикал необов'язково заміщений на піролідинілкарбоніл, аміно і ціано; одному або декількох атомах вуглецю одним або Het1 являє собою моноциклічний кількома феніл-, галоген-, ціано-, гідрокси-, гетероциклічний радикал, вибраний з групи, що форміл- і амінорадикалами; містить піроліл, піразоліл, імідазоліл, фураніл, L вибраний з групи, що містить водень, тієніл, оксазоліл, ізоксазоліл, тіазоліл, тіадіазоліл, алкілокси, Аr3-окси, алкілоксикарбоніл, моно- і ізотіазоліл, піридиніл, піримідиніл, піразиніл і ді(алкіл)аміно, моно- і ді(Аr3)аміно, Аr3 і Het2; піридазиніл; або біциклічний гетероциклічний Аr1 являє собою феніл, необов'язково радикал, вибраний з групи, що містить хінолініл, заміщений 1, 2 або 3 алкілрадикалами; хіноксалініл, індоліл, бензімідазоліл, Аr2 являє собою феніл, необов'язково бензоксазоліл, бензізоксазоліл, бензотіазоліл, заміщений 1, 2 або 3 алкілрадикалами; бензізотіазоліл, бензофураніл і бензотієніл; кожен Аr3 являє собою феніл, необов'язково гетероциклічний радикал необов'язково може бути заміщений 1, 2 або 3 замісниками, кожен з яких заміщений на будь-якому атомі радикалом, незалежно один від одного вибраний з групи, що вибраним з групи, що містить галоген або алкіл; містить алкілокси, алкіл, галоген, гідрокси, Het2 являє собою моноциклічний піридиніл, морфолініл, піролідиніл, імідазо[1,2гетероциклічний радикал, вибраний з групи, що а]піридиніл, морфолінілкарбоніл, містить піролідиніл, діоксоліл, імідазолідиніл, піролідинілкарбоніл, аміно і ціано; піразолідиніл, піперидиніл, морфолініл, дитіаніл, Het2 являє собою моноциклічний тіоморфолініл, піперазиніл, імідазолідиніл, гетероциклічний радикал, вибраний з групи, що тетрагідрофураніл, 2Н-піроліл, піролініл, містить піролідиніл, піперидиніл, морфолініл, імідазолініл, піразолініл, піроліл, імідазоліл, піроліл, імідазоліл, піразоліл, фураніл, тієніл, піразоліл, триазоліл, фураніл, тієніл, оксазоліл, ізоксазоліл, тіазоліл, тіадіазоліл, піридиніл, ізоксазоліл, тіазоліл, тіадіазоліл, ізотіазоліл, піримідиніл, піразиніл і піридазиніл; або піридиніл, піримідиніл, піразиніл, піридазиніл і біциклічний гетероциклічний радикал, вибраний з триазиніл; або біциклічний гетероциклічний групи, що містить бензопіперидиніл, хінолініл, радикал, вибраний з групи, що містить хіноксалініл, індоліл, хроменіл і бензімідазоліл; бензопіперидиніл, хінолініл, хіноксалініл, індоліл, кожен радикал необов'язково заміщений одним ізоіндоліл, хроменіл, бензімідазоліл, імідазо[1,2або кількома радикалами, вибраними з групи, що а]піридиніл, бензоксазоліл, бензізоксазоліл, містить Аr1, Аr1-алкіл, галоген, гідрокси, алкіл, бензотіазоліл, бензізотіазоліл, бензофураніл і піперидиніл, піроліл, тієніл, оксо і бензотієніл; кожен радикал необов'язково алкілоксикарбоніл; і заміщений одним або кількома радикалами, алкіл являє собою прямий вуглеводневий радикал, вибраними з групи, що містить Аr1, Аr1-алкіл, що містить від 1 до 6 атомів вуглецю, галоген, гідрокси, алкіл, піперидиніл, піроліл, необов'язково заміщений одним або кількома тієніл, оксо, алкілокси, алкілоксіалкіл і галогенрадикалами. алкілоксикарбоніл; і алкіл являє собою прямий або 3. Сполука за будь-яким з пп. 1-2, яка розгалужений насичений вуглеводневий радикал, відрізняється тим, що R1 являє собою Аr1-метил і що містить від 1 до 6 атомів вуглецю; або циклічні приєднаний у положенні 2, або R1 являє собою Аr1 насичені вуглеводневі радикали, що містять від 3 і приєднаний у положенні 3. до 6 атомів вуглецю; кожен радикал необов'язково заміщений на одному або декількох атомах 4. Сполука за будь-яким з пп. 1-3, яка вуглецю одним або кількома радикалами, відрізняється тим, що R2-X-C(=Q)-фрагмент вибраними з групи, що містить феніл-, галоген-, являє собою 3,5-ди(трифторметил)фенілкарбоніл. ціано-, оксо-, гідрокси-, форміл- і амінорадикали. 5. Сполука за будь-яким з пп. 1-4 для 2. Сполука за п. 1, яка відрізняється тим, застосування як лікарського засобу. що n дорівнює 1; 6. Лікарський засіб для лікування m дорівнює 1; нейрокінінопосередкованих станів, який містить р дорівнює 1; сполуку за будь-яким з пп. 1-4. Q являє собою O; Х являє собою ковалентний зв'язок; 7. Лікарський засіб для лікування кожен R1 являє собою Аr1 або Аr1-алкіл; блювання, депресії, станів тривоги, болю, q дорівнює 0 або 1; панкреатиту, розладів сечовипускання, зокрема R2 являє собою Аr2; гіперфункції сечового міхура, і синдрому Y являє собою ковалентний зв'язок або подразненого кишечнику (IBS), який містить двовалентний радикал формули -С(=O)- або -SO2-; сполуку за п. 6. кожен Alk являє собою, незалежно один від одного, ковалентний зв'язок; двовалентний 5 81918 6 8. Фармацевтична композиція, що містить реакційноінертному розчиннику і в присутності фармацевтично прийнятний носій і як активний основи, або R R (R ) (R ) інгредієнт терапевтично ефективну кількість O O (CH ) (CH ) Q Q сполуки за будь-яким з пп. 1-4. L Alk L N N N NH + N N N N HO Alk 1 1 1 q 1 2 m R2 9. Фармацевтична композиція за п. 8, яка відрізняється тим, що вона знаходиться у формі, придатній для орального введення. 10. Спосіб отримання композиції за будьяким з пп. 1-4, який відрізняється тим, що фармацевтично прийнятний носій однорідно змішують з терапевтично ефективною кількістю сполуки за будь-яким з пп. 1-4. 11. Спосіб отримання сполуки формули (І), який відрізняється тим, що a) кінцеву сполуку формули (І) отримують N-гідроалкілуванням проміжної сполуки формули (II), де R1, R2, X, Q, m, n і р приймають значення, визначені у формулі (І), з N-заміщеним піперидиноном формули (III), де R1, Alk, Y, L і q приймають значення, визначені у формулі (І), у реакційноінертному розчиннику і в присутності відновника; або R1 (R1)q (CH2)m Q N N X R2 NH + O Alk N Y L Alk R1 N R2 X R1 R1 (R1)q O (CH2 )m Q N X N (CH2) n (I') ; або N (CH2) p NH + W1 Alk (V) L (R1) q N R2 X O (CH2) m Q N (CH2 )n N N Alk L (CH2)p (Ia ) b) кінцеву сполуку формули (Iа) отримують реакцією каталізованого основою нуклеофільного приєднання кінцевої сполуки формули (I'), де R1, R2, X, Q, m, n, р і q приймають значення, визначені у формулі (І), до карбонової кислоти формули (VI), де Alk і L приймають значення, визначені у формулі (І), або до її складного ефіру, у N (CH2)p (CH2)n 2 NH + W Alk (I') L Alk (R1)q N R2 O (CH2)m Q N (CH2)p N X (CH2)n N Alk Alk L (I b) (VII) ; або d) кінцеву сполуку формули (Ic) отримують гідроамінуванням/гідроалкілуванням кінцевої сполуки формули (I'), де R1, R2, X, Q, m, n, р і q приймають значення, визначені у формулі (І), за допомогою сполуки формули (VIII), де Alk і L приймають значення, визначені у формулі (І), і W3 являє собою відхідну групу, у реакційноінертному розчиннику і в присутності основи, R1 X R1 (R1 )q N (CH 2)n N (CH2)p 3 NH + W Alk (VIII) (R1)q (CH 2)m Q (CH2 )m (I') 12. Спосіб отримання сполуки формули (І), формули (Iа), формули (Іb) або формули (Ic), який відрізняється тим, що a) кінцеву сполуку формули (Iа) отримують ацилюванням кінцевої сполуки формули (I'), де R1, R2, X, Q, m, n, р і q приймають значення, визначені у формулі (І), за допомогою ацильної сполуки формули (V) , де Alk і L приймають значення, визначені у формулі (І), і W1 являє собою відхідну групу, у реакційноінертному розчиннику і в присутності основи, (CH2)p R1 O N N b) кінцеву сполуку формули (І) отримують перетворенням сполук формули (І) одна в одну згідно з добре відомими у даній області реакціями перетворення; і, додатково, перетворенням сполук формули (І) у кислотно-адитивну сіль обробкою кислотою або у основно-адитивну сіль обробкою основою, або навпаки, кислотно-адитивна сольова форма може бути перетворена у вільну основу обробкою лугом, або основно-адитивна сіль може бути перетворена у вільну кислоту обробкою кислотою; і отриманням N-оксиду і/або його стереохімічно ізомерних форм. (CH2 )n (Ia ) (R1)q (CH2)m Q R2 ; X (VI) c) кінцеву сполуку формули (Іb) отримують реакцією каталізованого основою нуклеофільного приєднання кінцевої сполуки формули (I'), де R1, R2, X, Q, m, n, р і q приймають значення, визначені у формулі (І), до сполуки формули (VIII), де Alk і L приймають значення, визначені у формулі (І), і W2 являє собою відхідну групу, у реакційноінертному розчиннику і в присутності основи, (I) (III) R2 (CH2) p ; або Q (II) R2 (CH2) n (I') (CH2)p (CH2)n X q 2 m N L R2 X N (CH2 )n N (CH2 )p N Alk L (Ic) ; або e) кінцеву сполуку формули (І) отримують перетворенням сполук формули (І) одна в одну згідно з добре відомими у даній області реакціями перетворення; і, додатково, перетворенням сполук формули (І) у кислотно-адитивну сіль обробкою кислотою або у основно-адитивну сіль обробкою основою, або навпаки, кислотно-адитивна сольова форма може бути перетворена у вільну основу обробкою лугом, або основно-адитивна сіль може бути перетворена у вільну кислоту обробкою кислотою; і отриманням N-оксиду і/або його стереохімічно ізомерних форм. 13. Спосіб отримання сполуки формули (XIII), який відрізняється тим, що сполука формули (XI), де А являє собою арил або гетероарил, Z може бути будь-яким фрагментом, краще фрагментом Z1, як визначено нижче, де кожен замісник приймає значення, визначені у формулі (І), Hal являє собою галоген і r являє собою ціле число, що змінюється від 1 до числа, рівного числу доступних атомів вуглецю в арилі або у гетероарильному фрагменті А, піддають взаємодії з ненасиченим гетероарилом Het формули (XII) у присутності каталітичних кількостей Pd(OAc)2 і 1,3-бісдифенілфосфінопропану, у присутності придатної основи, краще Сs2СО3 або К(АсО), у реакційноінертному полярному розчиннику, 7 81918 (Hal)r Z A 8 R1 (Het)r H + Het Z Z1= N R2 (XI) (XII) (CH2)m Q A (XIII) , Даний винахід стосується похідних 1,4дипіперидин-4-ілпіперазину, що мають нейрокінінову антагоністичну активність, зокрема, ΝΚ1-антагоністичну активність, їх отримання, композицій, що містять означені сполуки, а також їх застосування як лікарських засобів, зокрема, для лікування блювоти, стану тривоги, депресії, панкреатиту та ISB (синдром подразненого кишечнику). Нейрокініни належать до групи коротких пептидів, широко розподілених у центральній і периферичній нервовій системі ссавців [Bertrand and Geppetti, Trends Pharmacol. Sci. 17:255-259 (1996); Lundberg, Can. J. Physiol. Pharmacol. 73:908-914 (1995); Maggi, Gen. Pharmacol. 26:911944 (1995); Regoli et al., Pharmacol. Rev. 46 (1994)]. Вони містять спільну С-кінцеву послідовність PheXaa-Gly-Leu-Met-NH2. Вважається, що нейрокініни, що звільняються з периферичних чутливих нервових закінчень, включаються до нейрогенного запалення. У спинному мозку/центральній нервовій системі нейрокініни можуть відігравати роль у передачі/відчутті болю і у деяких автономних рефлексах і поведінкових реакціях. Три основних нейрокініни являють собою речовину Ρ (SP), нейрокінін A (NKA) і нейрокінін В (ΝΚΒ) з переважною спорідненістю до трьох різних підтипів рецепторів, називаних ΝΚ1, ΝΚ2 і NK3, відповідно. Однак функціональне вивчення на клонованих рецепторах свідчить про сильну функціональну перехресну взаємодію між 3 нейрокінінами і їх відповідними рецепторами [Maggi and Schwartz, Trends Pharmacol. Sci. 18:351-355 (1997)]. Видові відмінності у структурі ΝΚχ-рецепторів відповідальні за відмінності у ефективності ΝΚιантагоністів по відношенню до видів (Maggi, Gen. Pharmacol. 26:911-944 (1995); Regoli et al., Pharmacol. Rev. 46(4):551-599 (1994)). ΝΚ1рецептор людини дуже схожий на ΝΚ1-рецептор морських свинок і піщанок, але значно відрізняється від ΝΚ1-рецептора гризунів. Розробка нейрокінінових антагоністів призвела на сьогоднішній день до серії пептидних сполук, з аналізу яких можна зробити висновок, що вони є метаболічно занадто лабільні для застосування як фармацевтично активних речовин [Longmore J. et al., DN&P 8(1):5-23 (1995)]. Нейрокініни беруть участь у реакціях, асоційованих з блювотою, станом тривоги X (R1)q N (CH2)n N N Alk Y Alk (CH2)p . 14. Спосіб за п. 13, в якому Hal являє собою бром або йод, А являє собою феніл або піридиніл, Z являє собою Z1 і Het є вибраним з групи, що містить імідазо[1,2-а]піридиніл, піроліл і тієніл. (зв'язаних зі стресом), запальними реакціями, скороченням гладкого м'язу і відчуттям болю. Нейрокінінові антагоністи розробляють для наступних показань: блювота, стан тривоги і депресія, синдром подразненого кишечнику (IBS), розлади циркадного ритму, вісцеральний біль, нейрогенне запалення, астма, порушення сечовипускання і чутливість до болю. Блювота Нудота і блювота відносяться до найбільш виснажуючих побічних ефектів ракової хіміотерапії. Вони знижують якість життя і можуть викликати у пацієнтів затримку прийому або відмову від потенційно корисного лікарського засобу [Kris et al., J. Clin. Oncol., 3:1379-1384 (1985)]. Частота, інтенсивність і тип блювоти визначаються різними чинниками, такими як хіміотерапевтичний засіб, доза і шлях введення. Звичайно швидка або гостра блювота починається протягом перших 4 годин після проведення хіміотерапії, досягаючи максимуму у період від 4 годин до 10 годин, і знижується у період від 12 до 24 годин. Відкладена блювота (що розвивається через 24 години і продовжується аж до 3-5 днів після хіміотерапії) спостерігається при прийомі більшості "високоблювотних" хіміотерапевтичних лікарських засобів [рівень 4 і 5 згідно з Hesketh et al., J. Clin. Oncol. 15:103 (1997)]. У людей дані "високоблювотні" протиракові терапії, що включають цисплатин, викликають гостру блювоту у >98% і відкладену блювоту у 60-90% ракових хворих. Досліди на тваринних моделях з хіміотерапії на прикладі викликаної цисплатином блювоти у африканських тхорів [Rudd and Naylor, Neuropharmacology 33:1607-1608 (1994); Naylor and Rudd, Cancer. Surv. 21:117-135 (1996)], дали змогу успішно завбачити клінічну ефективність антагоністів 5-НТ3-рецепторів. Хоча дане відкриття призвело до успішної терапії при лікуванні нудоти у ракових хворих, викликаної хіміотерапією і опромінюванням, 5-НТ3-антагоністи, такі як ондансетрон і гранісетрон (ні той ні інший не зв'язані з дексаметазоном), є ефективними у регулюванні гострої блювотної фази (перші 24 години), але можуть тільки зменшити розвиток відкладеної фази (>24 години) зі слабкою ефективністю [De Mulder et al., Annuals of Internal Medicine 113:834-840 (1990); Roila, Oncology 50:163-167 (1993)]. Всупереч даним з сучасних 9 81918 10 найбільш ефективних терапій для попередження сучасними оцінками, поширеність глибокої як гострої, так і відкладеної блювоти, аж до 50% депресії протягом життя (MDD, DSM-IV) складає пацієнтів страждають від відкладеної блювоти 10-25% серед жінок і 5-12% серед чоловіків, і/або нудоти [Antiemetic Subcommittee, Annals причому у приблизно 25% пацієнтів MDD протягом Oncol. 9:811-819 (1998)]. життя рецидивує без повного між нападами У протилежність 5-НТ3-антагоністам, ΝΚ1одужання і накладається на дистимічний розлад. антагоністи, такі як СР-99994 [Piedimonte et al., L. Існує висока спільна поширеність депресії з Pharmacol. Exp. Ther. 266:270-273 (1993) і іншими психічними розладами, і особливо серед апрепітант (також відомий як МК-869 або Lбільш молодого населення, сильно зв'язана зі 754030; Kramer et al., Science 281:1640-1645 зловживанням наркотиками і алкоголем. Через те, (1998); Rupniak and Kramer, Trends Pharmacol. Sci. що депресія в основному вражає населення віком 20:1-12 (1999)] показані зараз для інгібірування не від 18 до 44 років, тобто найбільш працездатне тільки гострої, але також і відкладеної фази населення, очевидно, що все це накладає великий блювоти у тварин, викликаної цисплатином [Rudd тягар відповідальності на людей, сім'ї і на et al., Br. J. Pharmacol. 119:931-936 (1996); суспільство в цілому. Tattersall et al., Neuropharmacology 39:652-663 Серед терапевтичних можливостей найбільш (2000)]. ΝΚ1-антагоністи також продемонстровані ефективною безперечно є терапія з для зниження "відкладеної" блювоти у людини при використанням антидепресантів. Велика кількість відсутності супутньої терапії [Cocquyt et al., Eur. J. антидепресантів була розроблена і випущена на Cancer 37:835-842 (2001); Navari et al., N. Engl. L. ринок протягом останніх 40 років. Проте жоден з Med. 340:190-195 (1999)]. Окрім того, при введенні сучасних антидепресантів не задовольняє усім разом з дексаметазоном і 5-НТ3-антагоністами, критеріям ідеального лікарського засобу ΝΚ1-антагоністи (такі як МК-869 і CJ-11974, також (високотерапевтична і профілактична відомий як езлопітант) були рекомендовані для ефективність, швидкий початок дії, достатньо отримання додаткових ефектів у запобіганні задовільна короткочасна і довгочасна безпека, гострій блювоті [Campos et al., J. Clin. Oncol. проста і сприятлива фармакокінетика) або має 19:1759-1767 (2001); Hesketh et al., J. Clin. Oncol. побічні ефекти, які тим чи іншим чином обмежують 17:338-343 (1999)]. їх застосування у всіх групах або підгрупах Центральні нейрокінінові ΝΚ1-рецептори пацієнтів, що страждають депресією. відіграють головну роль у регулюванні блювоти. Оскільки зараз не існують, а також не ΝΚι-антагоністи є активними проти широкого очікуються методи лікування причини депресії, набору стимуляторів блювоти [Watson et al., Br. J. немає ніяких антидепресантів, ефективних для Pharmacol. 115:84-94 (1995); Tattersall et al., більш ніж 60-70% пацієнтів, тому розробка нового Neuropharmacol. 35:1121-1129 (1996); Megens et антидепресанта, який може перебороти будь-який al., J. Pharmacol. Exp. Ther. 1-14 (2002)]. Вважають, з недоліків доступних лікарських засобів, що дані сполуки діють блокуванням центральних виправдана. ΝΚ1-рецепторів у ядрі одиночного шляху (nucleus Декілька фактів указує на включення SP у стан tractus solitarius). Окрім ΝΚ1-антагонізму тривоги, пов'язаний зі стресом. Центральна проникність ЦНС (CNS) являє собою таким чином ін'єкція SP викликає кардіо-васкулярну відповідь, необхідне як умову для проявлення схожу з класичною реакцією "боротьба або протиблювотної активності даних сполук. відступ", що фізіологічно характеризується Викликана лоперамідом блювота у африканських васкулярною дилатацією у скелетних м'язах і тхорів може бути "використана як швидка і зменшенням мезентеріального і ниркового достовірна скринінгова модель для визначення кровотоку. Дана кардіоваскулярна реакція протиблювотної активності ΝΚ1-антагоністів. супроводжується поведінковою відповіддю, що Подальша оцінка їх терапевтичної сили у лікуванні спостерігається у гризунів після отруйних як гострої, так і уповільненої (відкладеної) фаз подразників або стресу [Culman and Unger, Can. J. блювоти, викликаної цисплатином, була Physiol. Pharmacol. 73:885-891 (1995)]. У мишей продемонстрована на використаній моделі центрально введені ΝΚι-антагоністи і антагоністи африканського тхора [Rudd et al., Br. J. Pharmacol. являють собою анксіогенні і анксіолітичні засоби, 119:931-936 (1994)]. Ha даній моделі відповідно [Teixeira et al., Eur. J. Pharmacol. 311:7досліджується як "гостра", так і "відкладена" 14 (1996)]. Здатність ΝΚ1-антагоністів інгібірувати блювота після введення цисплатину, яка сильний вплив, викликаний SP [або електричним виражається у вигляді її чутливості до антагоністів шоком; Ballard et al., Trends Pharmacol. Sci. 17:2555-НТ3-рецепторів, глюкокортикоїдів [Sam et al., Eur. 259 (2001)], могла б відповідати даній J. Pharmacol. 417:231-237 (2001)] та інших антидепресантній/анксіолітичній активності, тому фармакологічних навантажень. Малоймовірно, що що у випадку піщанок сильні впливи відіграють будь-який майбутній протиблювотний засіб буде роль сигналів тривоги або попереджувальних клінічно ухвалений, якщо тільки він не буде сигналів для особин, що належать до одного виду. ефективним у лікуванні як "гострої", так і ΝΚ1-рецептор широко розповсюджений у "відкладеної" фаз блювоти. лімбічній системі і тривого-провідних шляхах Депресія і стан тривоги головного мозку, що включають мигдалевидне Депресія являє собою один із найзагальніших тіло, гіпокамп, перегородку, гіпоталамус і афективних розладів сучасного суспільства з періакведуктальну сіру речовину. Крім того, високим і все зростаючим поширенням, особливо речовина Ρ вивільняється у центральній нервовій серед більш молодої частини населення. Згідно з системі у відповідь на травматичні або отруйні 11 81918 12 подразники, і нейротрансмісія, асоційована з речовини Ρ відіграє більш важливу роль для речовиною Р, може давати внесок або бути прояву вісцерального, аніж соматичного болю. включеною в стан тривоги, страху і в емоційні Фактично більш ніж 80% вісцеральних первинних розлади, які супроводжують афективні порушення, аферентів містять речовину Ρ у порівнянні з 25% такі як депресія і тривога. Підтвердженням даної шкірних аферентів. ΝΚ1-рецептори включаються точки зору служать зміни у вмісті речовини Ρ у також у моторику шлунково-кишкового тракту дискретних ділянках мозку у відповідь на стресові [Tonini et al., Gastroenterol. 120:938-945 (2001); подразники [Brodin et al., Neuropeptides 26:253-260 Okano et al., J. Pharmacol. Exp. Ther. 298:559-564 (1994)]. (2001)]. Через зазначену подвійну роль як у Центральна ін'єкція міметиків (агоністів) моториці шлунково-кишкового тракту, так і у прояві речовини Ρ викликає ряд захисних поведінкових і больового синдрому, вважають, що ΝΚ1кардіоваскулярних змін, що включають вироблену антагоністи мають потенціал для зменшення реакцію антипатії до даного місця [Elliott, Екр. інтенсивності синдромів у пацієнтів, що Brain. Res. 73:354-356 (1988)], посилений страждають IBS. акустичний старт-рефлекс [Krase et al., Behav. Панкреатит Brain. Res. 63:81-88 (1994)], дистресові вокалізації, Припускалося, що речовина Р, як один з двох видільну реакцію [Kramer et al., Science 281: 1640головних нейропептидів, що включені у 1645 (1998)] і тривогу на підвищене замішання нейрогенне запалення і діють через ΝΚ1-рецептор, [Aguiar and Brandao, Physiol. Behav. 60:1183-118 6 відіграє важливу протизапальну роль у (1996)]. Дані сполуки не змінювали рухову регулюванні тяжкості гострого панкреатиту і активність і координацію на роторному апараті або легеневого ушкодження, зв'язаного з здатність пересуватися при активізації у клітці. панкреатитом. Послаблена легенева функція при Зниження регулювання біосинтезу речовини Ρ тяжких гострих панкреатитах є головною причиною відбувається у відповідь на введення відомих розповсюдженості захворювання і смертності у анксіолітичних і антидепресантних лікарських даному стані. Це було чітко продемонстровано при засобів [Brodin et al., Neuropeptides 26:253-260 використанні ΝΚ1-/-мишей [Bhatia et al., Proceedings (1994); Shirayama et al., Brain. Res. 739:70-78 of the National Academy of Sciences of the USA (1996)]. Аналогічно, реакція вокалізації у морських 95(8):4760-4765 (1998)]. Також було показано, що свинок, що викликана центрально введеним ΝΚ1делеція гену препротахікініну-А захищає мишей антагоністом, може бути придушена (інгібірувана) від гострого панкреатиту [Bhatia et al., American J. антидепресантами, такими як іміпрамін і of Physiology 284 (5):G380-G386 (2003)]. Крім того, флуоксетин, а також за допомогою L-733060, ΝΚ1були опубліковані дослідження, які вказують на те, антагоніста. Приведені дослідження забезпечують що ΝΚ1-антагоністи (наприклад, СР-96345 і СРдоказ, який підтверджує, що блокада центральних 99994) можуть відігравати роль при лікуванні ΝΚι-рецепторів може інгібі-рувати фізіологічний панкреатиту, наприклад, впливати на стрес способом, схожим з впливом інтенсивність, тривалість і частоту болю у антидепресантів і анксіолітиків [Rupniak and пацієнтів, що страждають від хронічного Kramer, Trends Pharmacol. Sci. 20:1-12 (1999)], але панкреатиту [Маа et al., American J. of Physiology без побічних ефектів даних лікарських засобів. 279:G726-G732 (2000); Grady et al., British J. of Приведене припущення підтверджується даними, Pharmacology 130 (3):505-512 (2000); Veraякі показують, що апрепітант являє собою клінічно Portocarrero et al., Anesthesiology 98 (2):474-484 ефективний антидепресант зі значною (2003) and Shrikhande et al., Pain 91(3):209-217 анксіолітичною активністю у рандомізованому (2001)]. подвійному сліпому плацебо-контрольованому Попередній рівень техніки досліді [Kramer et al., Science 281:1640Сполуки, що містять 1-піперидин-41645,(1998)]. ілпіперазинільний фрагмент, були опубліковані в Синдром подразненого кишечнику (ISB) [WO 97/16440-A1, опублікованій May 9, 1997 by Для пацієнтів з синдромом подразненого Janssen Pharmaceutica N.V.], для застосування як кишечнику характерна знижена якість життя, і вони антагоністів речовини Р, в [WO 02/32867, інтенсивно використовують джерела охорони опублікованій April 25, 2002 by Glaxo Group Ltd.], здоров'я у пошуках кращих "вирішень" (що по відношенню до їх специфічних переваг як включають необхідність повторних досліджень або нейрокінінових антагоністів (конкретніше, були навіть хірургії). Хоча дані пацієнти страждають від розкриті амідні похідні 4-піперазин-1-ілпіперидин"легкого" розладу (іншими словами, вони не 1-карбонової кислоти), у [WO 01/30348-А1, помруть або отримають значні ускладнення), але опублікованій May 3, 2-1 by Janssen Pharmaceutica проте вони створюють значне економічне N.V.], для застосування як антагоністів речовини Ρ навантаження за рахунок інтенсивного з метою впливу на циркадну часову систему і у використання джерел охорони здоров'я і [WO 02/062784-A1, опублікованій August 15, 2002 відсутності на роботі. by Hoffman-La Roche AG], для застосування як Був опублікований прийнятний ряд доклінічних антагоністів нейрокінінових 1-рецепторів. публікацій про роль ΝΚ1-рецепторів у прояві Сполуки даного винаходу відрізняються від вісцерального болю. При використанні мишей без сполук рівня техніки заміщенням піперазинільного ΝΚ1-рецепторів і ΝΚ1-антагоністів на моделях фрагменту, являючи собою заміщену тварин, різні групи дослідників показали важливу піперидинільну групу, а також їх підвищеною роль, яку здійснюють ΝΚ1-рецептори в гіпералгезії здатністю як сильнодіючих, орально і центрально і вісцеральному болю. Розподіл ΝΚ1-рецепторів і активних нейрокінінових антагоністів 13 81918 14 терапевтичного значення, особливо для лікування Ar3 являє собою нафталініл або феніл, блювоти, тривожного стану і депресії, синдрому необов'язково заміщений 1, 2 або 3 замісниками, подразненого кишечнику (IBS), розладів кожен з яких незалежно один від одного вибраний циркадного ритму, вісцерального болю, з групи, що містить алкілокси, алкіл, галоген, нейрогенного запалення, астми, порушень гідрокси, піридиніл, морфолініл, піролідиніл, сечовипускання і больового синдрому. імідазо[1,2-а]піридиніл, морфолінілкарбоніл, Даний винахід стосується нових похідних 1,4піролідинілкарбоніл, аміно і ціано; дипіперидин-4-ілпіперазину загальної формули (І), Het1 являє собою моноциклічний гетероциклічний радикал, вибраний з групи, що містить піроліл, піразоліл, імідазоліл, фураніл, тієніл, оксазоліл, ізоксазоліл, тіазоліл, тіадіазоліл, ізотіазоліл, піридиніл, піримідиніл, піразиніл і піридазиніл; або біциклічний гетероциклічний радикал, вибраний з групи, що містить хінолініл, хіноксалініл, індоліл, бензімідазоліл, бенїх фармацевтично прийнятних кислотнозоксазоліл, бензізоксазоліл, бензотіазоліл, адитивних або основно-адитивних солей, їх бензізотіазоліл, бензофураніл і бензотієніл; кожен стереохімічно ізомерних форм, їх N-оксидної гетероциклічний радикал необов'язково може бути форми і їх проліків, де: заміщений на будь-якому атомі радикалом, n являє собою ціле число, яке дорівнює 0, 1 вибраним з групи, що містить галоген або алкіл; або 2; Het2 являє собою моноциклічний m являє собою ціле число, яке дорівнює 1 або гетероциклічний радикал, вибраний з групи, що 2, за умови, що якщо m дорівнює 2, то n дорівнює містить піролідиніл, діоксоліл, імідазолідиніл, 1; піразолідиніл, піперидиніл, морфолініл, дитіаніл, p являє собою ціле число, яке дорівнює 1 або тіоморфолініл, піперазиніл, імідазолідиніл, 2; тетрагідрофураніл, 2Н-піроліл, піролініл, Q являє собою O або NR3; імідазолініл, піразолініл, піроліл, імідазоліл, X являє собою ковалентний зв'язок або піразоліл, тріазоліл, фураніл, тієніл, оксазоліл, двовалентний радикал формули -O-, -S- або -NR3-; ізоксазоліл, тіазоліл, тіадіазоліл, ізотіазоліл, кожен R3 незалежно один від одного являє піридиніл, піримідиніл, піразиніл, піридазиніл і собою водень або алкіл; триазиніл; або біциклічний гетероциклічний кожен R1 незалежно один від одного вибраний радикал, вибраний з групи, що містить з групи, що містить Ar1, Ar1-алкіл і ді(Ar1)-алкіл; бензопіперидиніл, хінолініл, хіноксалініл, індоліл, q являє собою ціле число,яке дорівнює 0 або ізоіндоліл, хроменіл, бензімідазоліл, імідазо[1,21; а]піридиніл, бензоксазоліл, бензізоксазоліл, R2 являє собою алкіл, Ar2, Ar2-алкіл, Het1 або бензотіазоліл, бензізотіазоліл, бензофураніл і Неt1-алкіл; бензотієніл; кожен радикал необов'язково Υ являє собою ковалентний зв'язок або заміщений одним або кількома радикалами, двовалентний радикал формули -С(=O)- або -SO2-; вибраними з групи, що містить Ar1, Ar1-алкіл, кожен Alk являє собою, незалежно один від галоген, гідрокси, алкіл, піперидиніл, піроліл, одного, ковалентний зв'язок; двовалентний прямий тієніл, оксо, алкілокси, алкілоксиалкіл і або розгалужений, насичений або ненасичений алкілоксикарбоніл; і вуглеводневий радикал, що містить від 1 до 6 алкіл являє собою прямий або розгалужений атомів вуглецю; або циклічний насичений або насичений вуглеводневий радикал, що містить від ненасичений вуглеводневий радикал, що містить 1 до 6 атомів вуглецю; або циклічні насичені від 3 до 6 атомів вуглецю; кожен радикал вуглеводневі радикали, що містять від 3 до 6 необов'язково заміщений на одному або декількох атомів вуглецю; необов'язково заміщений на атомах вуглецю одним або кількома алкіл-, феніл-, одному або декількох атомах вуглецю одним або галоген-, ціано-, гідрокси-, формілі кількома радикалами, вибраними з групи, що амінорадикалами; містить феніл-, галоген-, ціано-, оксо-, гідрокси-, L вибраний з групи, що містить водень, форміл- і амінорадикали. алкілокси, Ar3-окси, алкілоксикарбоніл, моно- і Конкретніше, даний винахід стосується ді(алкіл)аміно, моно- і ді(Ar3)аміно, моно- і сполуки загальної формули (І), її фармацевтично ді(алкілоксикарбоніл)аміно, Ar3, Ar3-карбоніл, Het2 і прийнятних кислотно-адитивних або основноНеt2-карбоніл; адитивних солей, її стереохімічно ізомерних форм, Ar1 являє собою феніл, необов'язково її N-оксидної форми і її проліку, де: заміщений 1, 2 або 3 замісниками, кожен з яких n дорівнює 1; незалежно один від одного вибраний з групи, що m дорівнює 1; містить галоген, алкіл, ціано, амінокарбоніл і p дорівнює 1; алкілокси; Q дорівнює 0; Ar2 являє собою нафталініл або феніл, кожен X являє собою ковалентний зв'язок; необов'язково заміщений 1, 2 або 3 замісниками, кожен R1 являє собою Ar1 або Ar1-алкіл; кожен з яких незалежно один від одного вибраний q дорівнює 0 або 1; з групи, що містить галоген, нітро, аміно, моно- і R2 являє собою Ar2; ді(алкіл)аміно, ціано, алкіл, гідрокси, алкілокси, Υ являє собою ковалентний зв'язок або карбоксил, алкілоксикарбоніл, амінокарбоніл і двовалентний радикал формули -С(=O)- або -SO2-; моно- і ді(алкіл)амінокарбоніл; 15 81918 16 кожен Alk являє собою, незалежно один від адитивних солей, її стереохімічно ізомерних форм, одного, ковалентний зв'язок; двовалентний прямий її N-оксидної форми і її проліку, де R2-X-C(=Q)або розгалужений, насичений або ненасичений фрагмент являє собою 3,5вуглеводневий радикал, що містить від 1 до 6 ди(трифторметил)фенілкарбоніл. атомів вуглецю; або циклічний насичений або У рамках даного винаходу алкіл визначений як ненасичений вуглеводневий радикал, що містить прямий або розгалужений насичений від 3 до 6 атомів вуглецю; кожен радикал вуглеводневий радикал, що містить від 1 до 6 необов'язково заміщений на одному або декількох атомів вуглецю, наприклад, метил, етил, пропіл, атомах вуглецю одним або кількома феніл-, бутил, 1-метилпропіл, 1,1-диметилетил, пентил, галоген-, ціано-, гідрокси-, формілі гексил; алкіл далі означає одновалентний амінорадикалами; циклічний насичений вуглеводневий радикал, що L вибраний з групи, що містить водень, містить від 3 до 6 атомів вуглецю, наприклад, алкілокси, Ar3-окси, алкілоксикарбоніл, моно- і циклопропіл, метилциклопропіл, циклобутил, ді(алкіл)аміно, моно- і ді (Ar3) аміно, Ar3 і Het2; циклопентил і циклогексил. Означення алкілу Ar1 являє собою феніл, необов'язково включає також алкільний радикал, необов'язково заміщений 1, 2 або 3 алкілрадикалами; заміщений на одному або декількох атомах Ar2 являє собою феніл, необов'язково вуглецю одним або кількома феніл-, галоген-, заміщений 1, 2 або 3 алкілрадикалами; ціано-, оксо-, гідрокси-, формілі Ar3 являє собою феніл, необов'язково амінорадикалами, такими, наприклад, як заміщений 1, 2 або 3 замісниками, кожен з яких гідроксиалкіл, особливо гідроксиметил і незалежно один від одного вибраний з групи, що гідроксиетил, і полігалогеналкіл, особливо містить алкілокси, алкіл, галоген, гідрокси, дифторметил і трифторметил. піридиніл, морфолініл, піролідиніл, імідазо[1,2У рамках даного опису "галоген" являє собою а]піридиніл, морфолінілкарбоніл, загальний термін, що відноситься до фтор-, хлор-, піролідинілкарбоніл, аміно і ціано; бром- і йодрадикалів. Het2 являє собою моноциклічний У рамках даного опису вираз "сполуки даного гетероциклічний радикал, вибраний з групи, що винаходу" означає сполуку загальної формули (І), містить піролідиніл, піперидиніл, морфолініл, її фармацевтично прийнятні кислотно-адитивні піроліл, імідазоліл, піразоліл, фураніл, тієніл, або основно-адитивні солі, її стереохімічно ізоксазоліл, тіазоліл, тіадіазоліл, піридиніл, ізомерні форми, її N-оксидну форму і її пролік. піримідиніл, піразиніл і піридазиніл; або У рамках даного опису, зокрема, у фрагменті біциклічний гетероциклічний радикал, вибраний з Alka-Y-Alkb у формулі (І), якщо два або кілька групи, що містить бензопіперидиніл, хінолініл, послідовних елементи зазначеного фрагменту хіноксалініл, індоліл, хроменіл і бензімідазоліл; означають ковалентний зв'язок, то у даному кожен радикал необов'язково заміщений одним випадку указаний простий ковалентний зв'язок. або кількома радикалами, вибраними з групи, що Наприклад, коли Alka і Υ обидва означають містить Ar1, Ar1-алкіл, галоген, гідрокси, алкіл, ковалентний зв'язок і Alkb являє собою -СН2-, то піперидиніл, піроліл, тієніл, оксо і фрагмент Alka-Y-Alkb означений як -СН2-. алкілоксикарбоніл; і Термін "фармацевтично прийнятні солі" алкіл являє собою прямий вуглеводневий охоплює терапевтично активні нетоксичні радикал, що містить від 1 до 6 атомів вуглецю, кислотно-адитивні сольові форми, які спроможні необов'язково заміщений одним або кількома утворювати сполуки формули (І). Зазначені солі галогенрадикалами. можуть бути отримані обробкою основної форми Особливо, даний винахід стосується сполуки сполук формули (І) придатними кислотами, загальної формули (І), її фармацевтично наприклад, неорганічними кислотами, такими як прийнятних кислотно-адитивних або основногалоїдоводнева кислота, зокрема, хлороводнева адитивних солей, її стереохімічно ізомерних форм, кислота, бромоводнева кислота, сірчана кислота, її N-оксидної форми і її проліку, де R1 являє собою азотна кислота і фосфорна кислота; органічними Аr1-метил, приєднаний у положенні 2, або R1 являє кислотами, такими, наприклад, як оцтова кислота, собою Ar1, приєднаний у положенні 3, як гідроксіоцтова кислота, пропанова кислота, приведено у вигляді прикладу у будь-якій з молочна кислота, піровиноградна кислота, наступних формул для сполук, що відповідають щавлева кислота, малонова кислота, янтарна формулі (І), де m і n дорівнює 1 і Ar являє собою кислота, малеїнова кислота, фумарова кислота, незаміщений феніл. Краще, якщо Ar1-метил являє яблучна кислота, винна кислота, лимонна кислота, собою незаміщений бензильний радикал. метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, птолуолсульфонова кислота, цикламова кислота, саліцилова кислота, п-аміносаліцилова кислота і памова кислота. Особливо найкращою є фумарова кислота. Сполуки формули (І), що містять кислотні протони, можуть бути також перетворені у їх терапевтично активні нетоксичні металові сольові Особливо, даний винахід стосується сполуки форми або аміно-адитивні сольові форми загальної формули (І), її фармацевтично обробкою придатними органічними і прийнятних кислотно-адитивних або основнонеорганічними основами. Відповідні основні 17 81918 18 сольові форми містять, наприклад, солі амонію, особливо або не вказано, то хімічне позначення солі лужних або лужноземельних металів, сполук відноситься до суміші усіх можливих зокрема, літію, натрію, калію, магнію і кальцію, солі стереохімічно ізомерних форм, причому зазначені з органічними основами, наприклад, солі суміші містять усі діастереомери і енантіомери бензатину, N-метил-О-глюкаміну, гібраміну, і солі з основної молекулярної структури. Конкретніше, амінокислотами, наприклад, з аргініном і лізином. стереогенні центри можуть мати R- або SНавпаки, зазначені сольові форми можуть конфігурацію; замісники у двовалентних циклічних бути перетворені у вільні форми обробкою (частково) насичених радикалах можуть бути або у відповідною основою або кислотою. цис- або у транс-конфігурації. Сполуки з Термін "адитивна сіль", використовуваний у подвійними зв'язками можуть відповідати Е- або Zданому описі, включає також сольвати, які можуть стереоізомерам при зазначеному подвійному утворювати сполуки формули (І), а також і їх солі. зв'язку. Очевидно, що стереохімічно ізомерні Такі сольвати, наприклад, являють собою гідрати і форми сполук формули (І) призначені для алкоголяти. охоплення рамками даного винаходу. N-оксидні форми сполук формули (І) За правилами CAS номенклатури, у випадку призначені для включення тих сполук формули (І), присутності у молекулі двох стереогенних центрів в яких один або декілька атомів азоту окислені до відомої абсолютної конфігурації позначення R або так званого N-оксиду, особливо, тих N-оксидів, де S віднесені (згідно з правилом послідовності Cahnодин або кілька третинних атомів азоту Ingold-Prelog (Кана-Інгольда-Прелога)) до (наприклад, у піперазинілабо хірального центра з найменшим номером, піперидинілрадикалах) є N-окисленими. Подібні Nеталонного центра. Конфігурація другого оксиди можуть бути отримані фахівцями без стереогенного центра вказана з застосуванням особливих зусиль, і вони являють собою очевидні відповідних позначень [R*,R*] або [R*,S*], де R* альтернативи для сполук формули (І), тому що є завжди відноситься до еталонного центра і [R*,R*] метаболітами, які утворюються за рахунок відноситься до центрів з однаковою хіральністю, a окислення у організмі людини після поглинання. [R*,S*] відноситься до центрів з різною Як загальновідомо, окислення звичайно є першою хіральністю. Наприклад, якщо хіральний центр з стадією, включеною у метаболізм лікарського найменшим номером у молекулі має Sзасобу [Textbook of Organic Medicinal and конфігурацію і другий центр являє собою R, то Pharmaceutical Chemistry, 1977, pages 70-75]. стереопозначення повинно виглядати як S-[R*,S*]. Також загальновідомо, що метаболітна форма Якщо застосовані позначення "a" і "b": положення сполуки може бути також введена людині замість найстаршого замісника при асиметричному атомі самої сполуки майже з тими самими ефектами. вуглецю у циклічній системі, що має найнижчий Сполуки даного винаходу мають, номер у кільці, є завжди довільним у "a"-положенні щонайменше, два атоми азоту, здатні до середньої площини, що визначається даною окислення (фрагменти третинних амінів). Отже циклічною системою. Положення найстаршого існує висока імовірність того, що N-оксиди повинні замісника при іншому асиметричному атомі утворюватися у процесі метаболізму в людині. вуглецю в циклічній системі (водневий атом у Сполуки формули (І) можуть бути перетворені сполуках, що відповідають формулі (І)) відносно у відповідні N-оксидні форми за відомими у даній положення найстаршого замісника при області процедурами для перетворення еталонному атомі, позначеному як "a", якщо він трьохвалентного азоту у N-оксидну форму. знаходиться з тієї ж самої сторони середньої Зазначені реакції N-окислення як правило можуть площини, що визначається циклічною системою, бути проведені взаємодією вихідного продукту або "b", якщо він знаходиться з іншої сторони формули (І) з відповідним органічним або середньої площини, що визначається циклічною неорганічним пероксидом. Відповідні неорганічні системою. пероксиди включають, наприклад, пероксид Сполуки формули (І) і деякі проміжні сполуки водню, пероксиди лужних металів або містять, щонайменше, два стереогенних центра у лужноземельних металів, наприклад, пероксид своїй структурі, а саме, у 2-положенні натрію, пероксид калію; відповідні органічні піперидинільного фрагмента (R або S) і у 4пероксиди включають надкислоти, такі, наприклад, положенні, де приєднаний радикал може як бензолкарбопероксокислота або знаходитись або у цис-, або - у транс-положенні по галогензаміщена бензолкарбопероксокислота, відношенню до радикала у 2-положенні наприклад, 3-хлорбензолкарбопероксокислота, піперидинільного фрагмента. пероксоалканові кислоти, наприклад, Даний винахід містить також похідні (звичайно пероксооцтова кислота, алкілгідропероксиди, називані як "проліки") фармакологічно активних наприклад, трет-бутилгідропероксид. Придатні сполук даного винаходу, які розкладаються in vivo розчинники являють собою, наприклад, воду, з утворенням сполук даного винаходу. Проліки нижчі спирти, наприклад, етанол і т.п., вуглеводні, звичайно (але не завжди) мають меншу наприклад, толуол, кетони, наприклад, 2-бутанон, ефективність по відношенню до цільового галогеновані вуглеводні, наприклад, дихлорметан, рецептора у порівнянні зі сполуками, які вони або суміші таких розчинників. утворюють у результаті розкладу. Проліки Термін "стереохімічно ізомерні форми", особливо застосовні, коли бажана сполука має використовуваний у даному винаході вище, хімічні або фізичні властивості, які утруднюють її охоплює всі можливі ізомерні форми, які можуть введення або роблять його неефективним. мати сполуки формули (І). Якщо не обговорено Наприклад, необхідна сполука може бути 19 81918 20 ΝΚι-рецептора, надлишковим вивільненням слабкорозчинною, вона може погано речовини Ρ та інших нейрокінінів у конкретних переміщатися по слизовому епітелію або може клітинах, таких як нейронні сплетення шлунковомати небажано короткий період півроспаду в кишкового тракту, немієлінізовані первинні плазмі. Подальший розгляд проліків може бути сенсорні аферентні нейрони, симпатичні і знайдений у [публікації Stella V.J. et al., "Prodrugs", парасимпатичні нейрони і ненейронні клітинні типи Drug Delivery Systems, 1985, pp.112-176, and [DN&P 8(1):5-23 (1955) and Longmore J. et al., Drugs, 1985, 29, pp.455-473]. "Neurokinin Receptors" Pharmacological Reviews Пролікові форми фармакологічно активних 46(4):551-599 (1994)]. сполук даного винаходу як правило будуть Сполуки даного винаходу є сильними включати сполуки формули (І), їх фармацевтично інгібіторами нейрокінін-опосередкованих ефектів, прийнятні кислотно- або основно-адитивні солі, їх особливо, опосередкованих за допомогою ΝΚ1стереохімічно ізомерні форми і їх N-оксиди, що рецептора, і тому можуть бути описані як містять кислотну групу, що етерифікована або нейрокіні-нові антагоністи або тахікінінові амідована. Подібні етерифіковані кислотні групи антагоністи, особливо, як антагоністи речовини Р, являють собою групи формули -COORx, де Rx як встановлено in vitro шляхом антагонізму являє собою С1-6алкіл, феніл, бензил або одну з релаксації коронарних артерій свині, викликаної наступних груп: речовиною Ρ, що описаний у даному винаході нижче. Спорідненість зв'язування сполук даного винаходу для нейрокінінових рецепторів людини, морської свинки і піщанок може бути визначена in vitro у тесті по зв'язуванню рецептора з застосуванням 3Н-речовини Ρ як радіоліганда. Сполуки також проявляють антагоністичну Амідовані групи включають групи формули активність стосовно речовини Ρ in vivo, що може CONRyRz, де Ry являє собою Н, С1-6алкіл, феніл бути доведене, наприклад, антагонізмом або бензил і Rz являє собою -ОН, Н, С1-6алкіл, викликаної речовиною Ρ екстравазації плазми у феніл або бензил. Сполуки даного винаходу, що морських свинок або антагонізмом викликаної містять аміногрупу, можуть бути перетворені дією лікарськими засобами блювоти у африканських кетона або альдегіда, такого як формальдегід, у тхорів [Watson et al., Br. J. Pharmacol. 115:84-94 основу Маніха. Зазначена основа у водному (1995)]. розчині буде гідролізуватися за кінетикою першого З урахуванням їх здатності протидіяти діям порядку. нейрокінінів шляхом блокування нейрокінінових Сполуки формули (І), отримані за способами, рецепторів і, особливо, протидії діям речовини Ρ описаними нижче, можуть бути синтезовані у через блокування ΝΚ1-рецептора, сполуки даного формі рацемічних сумішей енантіомерів, які винаходу є корисними як лікарські засоби, можуть бути відділені один від одного за відомими особливо для профілактики і терапевтичного у даній області процедурами. Рацемічні сполуки лікування нейрокінін-опосередкованих станів. формули (І) можуть бути перетворені у відповідні Отже даний винахід стосується сполуки діастереомерні сольові форми взаємодією з загальної формули (І), її фармацевтично придатною хіральною кислотою. Зазначені прийнятних кислотно- або основно-адитивних діастереомерні сольові форми потім розділені, солей, її стереохімічно ізомерних форм, її Nнаприклад, селективною або фракційною оксидної форми та їх проліків, для застосування як кристалізацією і енантіомери виділені лугом. лікарських засобів. Альтернативний спосіб розділення енантіомерних Винахід також стосується застосування форм сполук формули (І) включає рідинну сполуки за будь-яким з пп.1-3 для виготовлення хроматографію з застосуванням хіральної лікарського засобу для лікування, або стаціонарної фази. Зазначені стереохімічно чисті профілактичного, або терапевтичного або для того ізомерні форми можуть бути також отримані з і іншого, нейрокінін-опосередкованих станів. відповідних стереохімічно чистих ізомерних форм Сполуки даного винаходу застосовні для відповідних вихідних продуктів за умови, що лікування розладів ЦНС, особливо депресії, станів взаємодія відбувається стереоспецифічно. Краще, тривоги, порушень, зв'язаних зі стресом, порушень якщо потрібен специфічний стереоізомер, то сну, порушень пізнавальної здатності, розладів зазначену сполуку належить синтезувати особистості, шизоафективних порушень, порушень стереоспецифічними способами отримання. У харчування, нейродегенеративних захворювань, даних способах будуть переважно наркологічних порушень, порушень настрою, використовуватися енантіомерно чисті вихідні сексуальної дисфункції, больових та інших станів, продукти. зв'язаних з ЦНС; запалення; алергічних порушень; Фармакологія блювоти; шлунково-кишкових розладів, особливо, Речовина Ρ та інші нейрокініни включаються у синдрому подразненого кишечнику (IBS); шкірних безліч біологічних взаємодій, таких як передача порушень; вазоспастичних захворювань; болю (чутливість до болю), нейрогенне запалення, фіброзних і колагенових захворювань; порушень, скорочення гладкого м'язу, екстравазація протеїнів зв'язаних з підвищенням або придушенням плазми, вазодилатація, секреція, дегрануляція імунітету, ревматичних захворювань і для тучних клітин, а також у активацію імунної регулювання маси тіла. системи. Вважають, що ряд хвороб викликаються активацією нейрокінінових рецепторів, зокрема 21 81918 22 Зокрема, "сполуки даного винаходу застосовні загальним медичним станом; порушення сну, при лікуванні або попередженні депресії, яка викликане речовиною. включає, але не обмежується тільки ними, глибокі Зокрема, сполуки даного винаходу застосовні депресивні порушення, у тому числі біполярну при лікуванні або попередженні пізнавальної депресію; уніполярну депресію; одиничні або здатності, які включають, але без обмеження повторювані глибокі депресивні напади з або без тільки ними, деменцію; розлади, що відносяться психотичних ознак, кататонічних ознак, до амнезії, і неспецифіковані порушення меланхолічних особливостей, атипових ознак або пізнавальної здатності, зокрема деменцію, післяродового прояву і, у випадку повторюваних викликану дегенеративними розладами, нападів, з або без сезонних особливостей. Інші патологічними змінами, травмами, інфекціями, емоційні розлади, охоплені терміном "глибокий судинними порушеннями, токсинами, гіпоксією, депресивний розлад", включають дистимічне вітамінною недостатністю або ендокринними порушення з раннім або пізнім початком розладами; деменцію типу хвороби Альцгеймера з захворювання і з або без атипових ознак, раннім або пізнім початком з пригніченим біполярний І розлад, біполярний II розлад, настроєм; деменцію, асоційовану зі СНІД, або циклотимічний розлад, рецидивуючий розлади пам'яті, викликані алкоголем або іншими короткочасний депресивний розлад, змішаний причинами недостатності тіаміну, двостороннім афективний розлад, невротичну депресію, ураженням скроневої долі головного мозку, посттравматичний стресовий розлад і соціальну обумовленим енцефалітом від Herpes simplex, та фобію; слабоумство типу хвороби Альцгеймера з іншими лімбічними енцефалітами, нейронною раннім або пізнім початком, з пригніченим недостатністю, вторинною від настроєм; викликані речовиною емоційні розлади, гіпоксії/гіпоглікемії/тяжких конвульсій і такі як розлади настрою, викликані алкоголем, оперативного втручання, дегенеративними амфетамінами, кокаїном, галюциногенами, розладами, судинними порушеннями або летучими препаратами, опіоїдами, патологією III шлуночка головного мозку. Крім того, фенциклідином, седативними засобами, сполуки даного винаходу застосовні як снотворними засобами, анксіолітиками та іншими підсилювачі пам'яті і пізнавальної здатності у речовинами; шизоафективний розлад пригніченого здорових людей, які не страждають дефіцитом типу; регуляторні розлади з пригніченим настроєм. пізнавальної здатності і/або пам'яті. Глибокі депресивні розлади можуть бути також Зокрема, сполуки даного винаходу застосовні результатом загального медичного стану, який при лікуванні або попередженні розладів включає, але не обмежується ними, інфаркт особистості, які включають, але без обмеження міокарда, діабет, викидень або аборт і т.д. тільки ними, параноїдну зміну особистості; Зокрема, сполуки даного винаходу застосовні шизоїдну зміну особистості; шизотипову зміну при лікуванні або попередженні станів тривоги, які особистості; антисоціальну зміну особистості; включають, але без обмеження тільки ними, напад пограничну зміну особистості; неприродну зміну паніки; агорафобію; панічний стан без агорафобії; особистості; нарцисистичну зміну особистості; агорафобію без попереднього панічного розладу; уникому зміну особистості; залежну зміну специфічну фобію; соціальну фобію; обсесивноособистості; обсесивно-компульсивну зміну компульсивний розлад; посттравматичний особистості і неспецифіковану зміну особистості. стресовий розлад; гострий стресовий розлад; Зокрема, сполуки даного винаходу застосовні генералізований стан тривоги; стан тривоги, при лікуванні або попередженні шизоафективних обумовлений загальним медичним станом; стан розладів, отриманих від різних причин, і які тривоги, викликаний речовиною; і включають шизоафективні розлади маніакального неспецифікований стан тривоги. типу, депресивного типу, змішаного типу; Зокрема, сполуки даного винаходу застосовні параноїдну, деструктивну, кататонічну, при лікуванні або попередженні порушень, недиференційовану і залишкову шизофренію; зв'язаних зі стресом, зв'язаних з депресією і/або шизофреноформальний розлад; шизоафективний тривогою, які включають, але без обмеження розлад; маревний розлад; звичайний психотичний тільки ними, гостру стресову реакцію; регуляторні розлад; частковий психотичний розлад; розлади, такі як короткочасна депресивна реакція, психотичний розлад, викликаний речовиною, і пролонгована депресивна реакція, змішані тривога неспецифічний психотичний розлад. і депресивна реакція, регуляторний розлад з Зокрема, сполуки даного винаходу застосовні переважним порушенням провідності, також при лікуванні або попередженні розладів регуляторний розлад зі змішаним розладом емоцій харчування, які включають неврозну анорексію; і провідності і регуляторні розлади з іншими атипову неврозну анорексію; неврозну булімію; специфічними переважними симптомами; інші атипову неврозну булімію; переїдання, зв'язане з реакції на тяжкий стрес. іншими фізіологічними порушеннями; блювоту, Зокрема, сполуки даного винаходу застосовні зв'язану з іншими фізіологічними порушеннями; і при лікуванні або попередженні порушень сну, які неспецифіковані розлади харчування. включають, але без обмеження тільки ними, Зокрема, сполуки даного винаходу застосовні дисомнію і/або парасомніаз як первинні розлади також при лікуванні або попередженні сну; інсомнію; сонну асфіксію; нарколепсію; розлад нейродегенеративних хвороб, які включають, але циркадного ритму; порушення сну, зв'язані з іншим без обмеження тільки ними, хворобу Альцгеймера; психічним розладом; порушення сну, обумовлене хорею Хантингтона; хворобу Крейцфельда-Якоба; хворобу Піка; демі-єлінізуючі порушення, такі як 23 81918 24 розсіяний склероз і ALS (хворобу Альцгеймера); спондилоартрит; подагру; опіки; рубцевий біль; інші невропатії і невралгію; розсіяний склероз; кліщову коросту і таламічний біль, такий як боковий аміотрофічний склероз; раптовий напад і постударний таламічний біль. головну травму. Зокрема, сполуки даного винаходу застосовні Зокрема, сполуки даного винаходу застосовні також при лікуванні або попередженні наступних також при лікуванні або попередженні розладів, інших станів, зв'язаних з ЦНС, таких як акінезія, зв'язаних з наркоманією, які включають, але без акінетикригідні синдроми, дискінезія і паркінсонізм, обмеження тільки ними, залежність від речовини викликані лікарськими засобами, синдром Жиль де або зловживання нею з або без фізіологічної ла Турета і його симптоми, тремор, хорея, залежності, особливо у випадках, коли речовина міоклонус, тики і дистонія, дефіцит являє собою алкоголь, амфетаміни, уваги/гіперактивність (ADHD), хвороба Паркінсона, амфетаміноподібні речовини, кофеїн, кокаїн, паркінсонізм, викликаний лікарськими засобами, галюциногени, летучі препарати, нікотин, опіоїди постенцефалітний паркінсонізм, прогресуючий (такі як гашиш, героїн і морфін), фенциклідин, супрануклеарний параліч, множинна системна фенциклідиноподібні сполуки, седативноатрофія, кортикобазальна дегенерація, снотворні засоби, бензодіазепіни і/або інші сполучення паркінсонізм-ALS деменція і базальна речовини, частково використовувані для лікування гангліозна кальцифікація, поведінкові порушення і абстиненції по відношенню до вищевказаних розлади провідності в деменції і психічно речовин і алкогольного абстинентного делірію. загальмовані, включаючи занепокоєння і ажітацію, Зокрема, сполуки даного винаходу застосовні екстрапірамідальні рухові розлади, хвороба Дауна також при лікуванні або попередженні розладів і акатизія. настрою, викликаних особливо алкоголем, Зокрема, сполуки даного винаходу застосовні амфетамінами, кофеїном, гашишем, кокаїном, також при лікуванні або попередженні запалення, галюциногенами, летучими препаратами, яке включає, але без обмеження тільки ними, нікотином, опіоїдами, фенциклідином, запальні стани при астмі, пневмонії, хронічних седативними засобами, снотворними засобами та бронхітах і ревматоїдних артритах; запалення у іншими речовинами. шлунково-кишковому тракті, такі як, але без Зокрема, сполуки даного винаходу застосовні обмеження тільки ними, хвороба Крона, також при лікуванні або попередженні сексуальної виразковий коліт, синдром подразненого дисфункції, яка включає, але без обмеження кишечнику, ушкодження, викликане нестероїдними тільки ними, розлади сексуального бажання; протизапальними лікарськими засобами; запальні розлади сексуального збудження; розлади стани шкіри, такі як герпес і екзема; запальні стани оргазму; сексуально-больові розлади; сексуальну сечового міхура, такі як цистит і нетримання сечі; дисфункцію, обумовлену загальним медичним запалення очей і зубів і панкреатит, особливо станом; сексуальну дисфункцію, викликану хронічний і гострий панкреатит. речовиною, і неспецифіковану сексуальну Зокрема, сполуки даного винаходу застосовні дисфункцію. також при лікуванні або попередженні алергічних Зокрема, сполуки даного винаходу застосовні реакцій, які включають, але без обмеження тільки також при лікуванні або попередженні болю, який ними, алергічні ураження шкіри, такі як, але без включає, але без обмеження тільки ними, обмеження тільки ними, кропивниця, алергічні травматичний біль, такий як післяопераційний ураження дихальних шляхів, такі як, але без біль; травматичний авульсійний біль, такий як біль обмеження тільки ними, риніти. плечового сплетення; хронічний біль, такий як Зокрема, сполуки даного винаходу застосовні хронічний біль, викликаний панкреатитом, або також при лікуванні або попередженні блювоти, артритний біль, що виникає при тобто нудоти, що викликає позив на блювоту і остеоревматоїдному або псоріатичному артриті; саму блювоту, яка включає, але без обмеження невропатичний біль, такий як постгерпетична тільки ними, гостру блювоту, відкладену блювоту і невралгія, тригемінальна невралгія, сегментальна періодичну блювоту; блювоти, що викликана або міжреберна невралгія, фіброміалгія, каузалгія, лікарськими засобами, такими як периферична невропатія, діабетична невропатія, хіміотерапевтичні протиракові засоби, такі як невропатія, викликана хіміотерапією, невропатія, алкілуючі засоби, наприклад, циклофосфамід, зв'язана зі СНІД, потилична невралгія, невралгія кармустин, ломустин і хлорамбуцил; цитотоксичні при синдромі колінчатого ганглія, антибіотики, наприклад, дактиноміцин, глософарингеальна невралгія, рефлекторна доксорубіцин, мітоміцин-С і блеоміцин; симпатична дистрофія і фантомний біль; різні антиметаболіти, наприклад, цитарабін, форми головного болю, такі як мігрень, гострий і метотрексат і 5-фторурацил; алкалоїди рослин хронічний головний біль від тиску, скроневороду Vinca, наприклад, етопозид, вінбластин і нижньощелепний головний біль, верхньощелепний вінкристин; та інші лікарські засоби, такі як пазушний головний біль і "гістаміновий" головний цисплатин, дакарбазин, прокарбазин і біль; зубний біль; біль при раку; вісцеральний біль; гідроксисечовина; і їх комбінації; блювоти, шлунково-кишковий біль; біль при защемленні викликаної променевою хворобою; променевою нерва; біль при спортивному ушкодженні; терапією, такою як при лікуванні раку; отруєннями; дисменорею; менструальний біль; менінгіт; токсинами, такими як токсини, викликані арахноїдіт; скелетно-м'язовий біль; задньонижній метаболічними порушеннями або інфекцією, біль, такий як спінальний стеноз, пролапс диску, такою як гастрит, або ті, що вивільняються у ішіалгія, стенокардія, анкілозуючий процесі бактеріальної або вірусної шлунково 25 81918 26 кишкової інфекції; вагітністю; вестибулярними активний інгредієнт, об'єднують в однорідну суміш розладами, такими як захитування, з фармацевтично прийнятним носієм, який можна запаморочення, хвороба Меньєра; використовувати у різних формах в залежності від післяопераційною нудотою; шлунково-кишковою форми препарату, потрібної для введення. Дані непрохідністю; зниженою шлунково-кишковою фармацевтичні композиції бажані у одиничній перистальтикою; вісцеральним болем, таким як дозованій формі, придатній, зокрема, для інфаркт міокарда і перитоніт; мігренню; введення орально, ректально, підшкірно, підвищеним внутрішньочерепним тиском; інгаляцією або за допомогою парентеральної зниженим внутрішньочерепним тиском (висотною ін'єкції. Наприклад, для отримання композицій у хворобою); опіоїдними анальгетиками, такими як дозованій формі для орального введення може морфін; гастро-езофагеальним рефлюксом; бути використане будь-яке фармацевтичне кислотною диспепсією; зайвим споживанням їжі середовище, таке як, наприклад, вода, гліколі, олії, або напоїв; кислотним шлунком; подразненим спирти і т.п. у випадку оральних рідких препаратів, шлунком; печією/регургітацією; печією, такою як таких як суспензії, -сиропи, еліксири, емульсії і епізодична печія, нічна печія і печія, викликана розчини; або тверді носії, такі як крохмалі, цукри, їжею; і диспепсією. каолін, розріджувачі, лубриканти, сполучні засоби, Зокрема, сполуки даного винаходу застосовні дезінтегранти і т.п. у випадку порошків, гранул, також при лікуванні або попередженні шлунковокапсул і таблеток. Через простоту введення кишкових розладів, які включають, але без таблетки і капсули являють собою найвигідніші обмеження тільки ним, синдром подразненого оральні дозовані форми, в яких звичайно кишечнику (IBS), уражень шкіри, таких як псоріаз, застосовують тверді фармацевтичні носії. Для сверблячка і сонячний опік; вазоспастичних парентеральних композицій носій звичайно буде захворювань, таких як стенокардія, васкулярний містити стерильну воду, принаймні, у великій головний біль і хвороба Рейно, церебральна кількості, хоча можуть бути включені і інші ішемія, така як церебральний вазоспазм, інгредієнти, наприклад, для підвищення супроводжуваний субарахноїдальною геморагією; розчинності. Розчини для ін'єкцій, наприклад, фіброзних і колагенових захворювань, таких як можуть бути отримані з носієм, що містить склеродермія і еозинофільний фасціольоз; фізіологічний розчин, розчин глюкози або суміш розладів, зв'язаних з активізацією або фізіологічного розчину і розчину глюкози. Суспензії придушенням імунітету, таких як системна для ін'єкцій можуть бути також приготовані з червона вовчанка і ревматичні захворювання, такі використанням відповідних рідких носіїв, як фіброзити; кашлю; і для регулювання маси тіла, суспендуючих засобів і т.п. Включеними до об'єму включаючи ожиріння. винаходу також є препарати у твердій формі, які Даний винахід також стосується способу призначені незадовго перед застосуванням для лікування і/або профілактики захворювань, перетворення у рідкі препарати. У композиціях, опосередкованих нейрокінінами, зокрема, для придатних для введення через шкіру, носій лікування і/або профілактики депресії, станів необов'язково містить засіб, що підвищує тривоги, блювоти і синдрому подразненого проникнення, і/або придатний змочуючий агент, кишечнику (IBS), який включає введення пацієнту, необов'язково об'єднаний з придатними що потребує подібного введення, ефективної добавками будь-якої природи у малих кількості сполуки даного винаходу, зокрема, тієї, співвідношеннях, причому добавки не створюють що відповідає формулі (І), її фармацевтично шкідливого впливу на шкіру. Зазначені добавки прийнятних кислотно-або основно-адитивних можуть полегшувати введення у шкіру і/або солей, її стереохімічно ізомерних форм, її Nможуть сприяти приготуванню бажаної композиції. оксидної форми і її проліків. Дані композиції можуть бути введені різними Винахід також стосується фармацевтичної шляхами, наприклад, як трансдермальний композиції, що містить фармацевтично пластир, наклейка, мазь. прийнятний носій і, як активний інгредієнт, Особливо вигідно складати вищезгадані терапевтично ефективну кількість сполуки даного фармацевтичні композиції у вигляді одиничної винаходу, зокрема, сполуки формули (І), її дозованої форми для полегшення введення і для фармацевтично прийнятних кислотноабо однорідності дозування. Одинична дозована основно-адитивних солей, її стереохімічно форма, як це використано у даному винаході, ізомерних форм, її N-оксидної форми і її проліку. відноситься до фізично дискретних одиниць, Сполуки даного винаходу, зокрема, сполуки придатних як одиничні дози, причому кожна формули (І), їх фармацевтично прийнятні одиниця містить раніше визначену кількість кислотноабо основно-адитивні солі, їх активного інгредієнта, обчислену для досягнення стереохімічно ізомерні форми, їх N-оксидна форма бажаного терапевтичного ефекту у сполученні з і їх проліки або будь-яка їх підгрупа або комбінація необхідним фармацевтичним носієм. Прикладами можуть бути складені у різні фармацевтичні подібних одиничних дозованих форм є таблетки форми для цілей введення. Як відповідні (що включають шороховаті таблетки або таблетки композиції можуть бути зазначені усі композиції, з покриттям), капсули, гранули, пакети з звичайно використовувані для систематичного порошком, облатки, супозиторії, розчини або введення лікарських засобів. Для отримання суспензії для ін'єкцій і т.п. і їх сегреговані множинні фармацевтичних композицій даного винаходу форми. ефективну кількість конкретної сполуки, Оскільки сполуки даного винаходу є сильними необов'язково у вигляді адитивної солі, як ΝΚχ ΝΚ1-антагоністами для орального введення, 27 81918 28 то фармацевтичні композиції, що містять зазначені Утворена сполука даного винаходу потім може сполуки для орального введення, є найкращими. бути перетворена у інші сполуки даного винаходу Отримання за допомогою відомих у даній області процедур Сполуки даного винаходу як правило можуть перетворення, наприклад, ацилування і бути отримані послідовністю стадій, кожна з яких алкілування. відома спеціалісту у даній області техніки. Зокрема, сполуки формули (Iа) можуть бути Сполуки формули (І) отримують придатним отримані взаємодією кінцевої сполуки формули способом N-гідроалкілуванням проміжної сполуки (І'), де R1, R2, X, Q, m, n, p і q приймають значення, 1 2 формули (II), де R , R , X, Q, m, n і p приймають визначені у формулі (І), з ацильною сполукою значення, визначені у формулі (І), з N-заміщеним формули (V), де Alk і L приймають значення, піперидиноном формули (III), де R1, Alk, Y, L і q визначені у формулі (І), і W1 являє собою приймають значення, визначені у формулі (І). відповідну відхідну групу, таку як, наприклад, Зазначене N-гідроалкілування може бути галоген, наприклад, хлор або бром, або відхідну проведене у реакційно-інертному розчиннику, сульфонілоксигрупу, наприклад, такому як, наприклад, дихлорметан, етанол або метансульфонілокси або бензолсульфонілокси. толуол або їх суміш, і в присутності відповідного Реакція може бути проведена у реакційновідновника, такого як, наприклад, борогідрид, інертному розчиннику, такому як, наприклад, наприклад, борогідрид натрію, ціаноборогідрид хлорований вуглеводень, наприклад, натрію або тріацетоксиборогідрид. У випадку дихлорметан, спирт, наприклад, етанол, або застосування борогідриду як відновника можна кетон, наприклад, метилізобутилкетон, і в використовувати комплексоутворюючий агент, присутності придатної основи, такої як, наприклад, такий як, наприклад, ізопропілат титану (IV), як карбонат натрію, гідрокарбонат натрію або описано у [публікації J. Org. Chem., 1990, 55, 2552тріетиламін. Перемішування може підвищувати 2554]. Застосування зазначеного швидкість реакції. Реакція краще може бути комплексоутворюючого агента може також проведена при "температурі від кімнатної до призводити до покращеного співвідношення температури флегми. цис/транc-ізомерів на користь транс-ізомера. Як відновник може також бути використаний водень у комбінації з придатним каталізатором, таким як, наприклад, паладій-на-вуглі. У випадку застосування водню як відновника може бути корисно додавати у реакційну суміш дегідратуючий агент, такий як, наприклад, третАльтернативно, сполуки формули (Iа) можуть бутоксид алюмінію. Для запобігання небажаному бути отримані взаємодією кінцевої сполуки подальшому гідруванню деяких функціональних формули (І'), де R1, R2, X, Q, m, n, p і q приймають груп у реагуючих речовинах і в продуктах реакції значення, визначені у формулі (І), з карбоновою може бути корисно додавати у реакційну суміш кислотою формули (VI), де Alk і L приймають каталітичну отруту, наприклад, тіофен або значення, визначені у формулі (І) (каталізована хінолін/сірку. Перемішування і необов'язково основою реакція нуклеофільного приєднання). підвищені температури і/або тиск можуть Реакція може бути проведена у реакційнозбільшувати швидкість реакції. інертному розчиннику, такому як, наприклад, хлорований вуглеводень, наприклад, дихлорметан, спирт, наприклад, етанол, або кетон, наприклад, метилізобутилкетон, і в присутності придатної основи, такої як, наприклад, карбонат натрію, гідрокарбонат натрію або тріетиламін. Перемішування може підвищувати У даному і в наступних синтезах продукти швидкість реакції. Реакція краще може бути реакції можуть бути виділені з реакційної суміші і, проведена при температурі від кімнатної до якщо необхідно, додатково очищені відповідно температури флегми. методологіям, добре відомим у даній області, таким як, наприклад, екстракція, кристалізація, порошкування і хроматографія. Особливо придатним є отримання сполуки даного винаходу за представленою раніше схемою реакції, де Alk-Y-Alk-L-фрагмент є бензилом, що таким чином веде до сполуки Реакція, представлена вище, може бути формули (І), де Alk-Y-Alk-L-фрагмент являє собою проведена з ефіром карбонової кислоти формули бензил. Зазначена сполука є фармакологічно (VI) за еквівалентних умов. активною і може бути перетворена у сполуку Зокрема, сполуки формули (Іb) можуть бути даного винаходу, в якій Alk-Y-Alk-L-фрагмент отримані взаємодією кінцевої сполуки формули являє собою водень, відновним гідруванням з (І'), де R1, R2, X, Q, m, n, p і q приймають значення, використанням, наприклад, водню як відновника у визначені у формулі (І), з кето-сполукою формули комбінації з придатним каталізатором, таким як, (VII), де W2 являє собою відповідну відхідну групу, наприклад, паладій-на-вуглі або платина-на-вуглі. 29 81918 30 таку як, наприклад, галоген, наприклад, хлор або борогідриду як відновника можна використовувати бром, або відхідну сульфонілоксигрупу, комплексоутворюючий агент, такий як, наприклад, наприклад, метансульфонілокси або ізопропілат титану (IV), як описано у [публікації J. бензолсульфонілокси. Реакція може бути Org. Chem., 1990, 55, 2552-2554]. Застосування проведена у реакційно-інертному розчиннику, зазначеного комплексоутворюючого агента може такому як, наприклад, хлорований вуглеводень, також призводити до покращеного співвідношення наприклад, дихлорметан, спирт, наприклад, цис/транс-ізомерів на користь транс-ізомера. Як етанол, або кетон, наприклад, відновник може бути також використаний водень у метилізобутилкетон, і в присутності придатної комбінації з придатним каталізатором, таким як, основи, такої як, наприклад, карбонат натрію, наприклад, паладій-на-вуглі або платина-на-вуглі. гідрокарбонат натрію або тріетиламін. У випадку застосування водню як відновника Перемішування може підвищувати швидкість можна додавати у реакційну суміш дегідратуючий реакції. Реакція краще може бути проведена при агент, такий як, наприклад, трет-бутоксид температурі від кімнатної до температури флегми. алюмінію. Для запобігання небажаному подальшому гідруванню деяких функціональних груп у реагуючих речовинах і в продуктах реакції можна додавати у реакційну суміш каталітичну отруту, наприклад, тіофен або хінолін/сірку. Перемішування і необов'язково підвищені температури і/або тиск можуть збільшувати Сполуки формули (Ic) можуть бути отримані швидкість реакції. гідроамінуван-ням/гідроалкілуванням кінцевої сполуки формули (І'), де R1, R2, X, Q, m, n, p і q приймають значення, визначені у формулі (І), зі сполукою формули (VIII), де Alk і L приймають значення, визначені у формулі (І), і W3 являє собою відповідну відхідну групу, таку як, наприклад, галоген, наприклад, хлор або бром, або відхідну сульфонілоксигрупу, наприклад, Отримання зазначених та інших проміжних метансульфонілокси або бензолсульфонілокси. сполук описано у [публікації WO 97/16440-А1, Реакція може бути проведена у реакційноопубліковано May 9, 1997 by Janssen інертному розчиннику, такому як, наприклад, Pharmaceutica N.V.], яка приводиться тут як хлорований вуглеводень, наприклад, посилання, а також у інших публікаціях, цитованих дихлорметан, спирт, наприклад, етанол, або у [WO 97/16440-A1, таких як, наприклад, ЕРкетон, наприклад, метилізобутилкетон, і в 0532456-А]. присутності придатної основи, такої як, наприклад, Сполуки даного винаходу можуть бути карбонат натрію, гідрокарбонат натрію або перетворені одна в одну за відомими у даній тріетиламін. Перемішування може підвищувати області реакціями перетворення, представленими швидкість реакції. Реакція краще може бути далі. проведена при температурі від кімнатної до Конкретніше, сполуки формули (XIII), де А температури флегми. являє собою арил або гетероарил, Ζ може бути будь-яким фрагментом, краще фрагментом Ζ1, визначеним нижче, Het являє собою ненасичений гетероарил і r являє собою ціле число, що змінюється від 1. до числа, рівного числу доступних атомів вуглецю в арилі або у гетероарильному фрагменті А, наприклад, 5 у фенілі і 4 у піролілі, можуть бути отримані за Вихідні продукти і деякі проміжні сполуки реакцією Хека (Heck) нового типу, за якою сполука являють собою відомі сполуки і є комерційно формули (XI), де Z, A i r приймають значення, доступними або можуть бути отримані за визначені у формулі (XIII), і Hal являє собою відповідними придатними методиками, звичайно галоген, і, отже, що містить активний або відомими у даній області. Наприклад, проміжна неактивний галогензаміщений арил або сполука формули (II) може бути отримана Nгалогензаміщений гетероарил, краще моно- або гідроалкілуванням проміжної сполуки формули (IX) полізаміщений бром- і/або йодарил або за допомогою проміжної сполуки формули (X), де гетероарильний фрагмент, піддають взаємодії з W4 являє собою бензильний радикал, після чого ненасиченим гетероарилом формули (XII) у сполуку формули (X) відновлюють з утворенням присутності каталітичних кількостей Pd(OAc)2 і 1,3проміжної сполуки формули (II). Зазначене Nбіс-дифенілфосфінопро-пану, у присутності гідроалкілування може бути проведене у придатної основи, краще Cs2CO3 або K(АсО), у реакційно-інертному розчиннику, такому як, реакційно-інертному полярному розчиннику, наприклад, дихлорметан, етанол, толуол або їх такому як краще NMP (N-метил-2-піролідон), DMA суміш, і в присутності відповідного відновника, (диметилацетамід), DMF (диметилформамід) і т.п., такого як, наприклад, борогідрид, наприклад, і при підвищеній температурі реакції, краще при борогідрид натрію, ціано-борогідрид натрію або 140-150°С, протягом визначеного періоду часу, тріацетоксиборогідрид. У випадку застосування краще приблизно 6-20 годин, краще 12-18 годин. 31 81918 32 Краще, коли r дорівнює 1. Het може являти тил)бензоїлхлорид (0,5моль) протягом більше 1 собою ненасичений моноциклічний або години (екзотермічна реакція). Суміш біциклічний гетероарильний фрагмент, такий як, перемішували при кімнатній температурі 2 години, наприклад, імідазо[1,2-а]піридиніл, піроліл, тієніл, потім її залишали на вихідні, після чого промивали тіазоліл, імідазоліл, оксазоліл, фураніл, три рази водою (500мл, 2´250мл). Органічний шар бензімідазоліл, бензоксазоліл, бензтіазоліл, відділяли, висушували, фільтрували і розчинник бензофураніл, бензотієніл або індоліл або будьвипарювали. Вихід: 245г (100%). Частину даної який з ненасичених радикалів у групах Het1 і Het2, фракції кристалізували з петролейного ефіру. як визначено у формулі (І), необов'язково Осад відфільтровували і висушували. Вихід: 1,06г заміщений одним або кількома радикалами, проміжної сполуки 1. вибраними з групи, що містить Ar1, Ar1-алкіл, b. Отримання проміжної сполуки 2 галоген, гідрокси, алкіл, піперидиніл, піроліл, тієніл, оксо, алкілокси, алкілоксиалкіл і алкілоксикарбоніл. Краще, коли А являє собою феніл або піридиніл. Зазначена реакція веде до більшого виходу у порівнянні зі способом, описаним у рівні техніки [Yutaka Aoyagi et al., Heterocycles, 1992, 33, 257 and Sommai Pivsa-Art, Bull. Chem. Soc. Jpn., 1998, 71, 467]. НСl х.ч. (cр) (300мл) додавали до суміші проміжної сполуки 1 (0,5моль) у етанолі (300мл). Реакційну суміш перемішували при 60°С протягом 20 годин. Осад відфільтровували, подрібнювали, перемішували з водою, відфільтровували, промивали петролейним ефіром і сушили. Вихід: 192г проміжної сполуки 2 ((+-)-1-[3,5біс(трифторметил)бензоїл]-2-(фенілметил)-4піпери-динон) (89,4%) (суміш R- і S-енантіомерів). с. Отримання проміжної сполуки 3 Також сполуки даного винаходу можуть бути перетворені у кислотно-адитивну сіль обробкою кислотою або у основно-адитивну сіль обробкою основою або, навпаки, кислотно-адитивна сольова форма може бути перетворена у вільну основу обробкою лугом, або основно-адитивна сіль може бути перетворена у вільну кислоту обробкою кислотою. Наступні приклади призначені для ілюстрації, але не для обмеження об'єму даного винаходу. Експериментальна частина Тут і далі "RT" означає кімнатну температуру, "CDI" означає 1,1'-карбонілдіімідазол, "DIPE" означає діізопропіловий ефір, "МІК" означає метилізобутилкетон, "BINAP" означає [1,1'бінафталін]-2,2'-діїл-біс[дифенілфосфін], "NMP" означає 1-метил-2-піролідон, "Рd2(dbа)3" означає трис (дибензиліденацетон)дипаладій і "DMF" означає N,N-диметилформамід. Отримання проміжних сполук Приклад А1 а. Отримання проміжної сполуки 1 EtsN (0,55моль) додавали до перемішуваної суміші 7-(фенілметил)-1,4-діокса-8азаспіро[4,5]декану (0,5моль) у толуолі (1500мл). Потім до вмісту додавали 3,5-біс(трифторме Суміш проміжної сполуки 2 (0,046моль), 1(фенілметил)піперазину (0,051моль) і С (0,056моль) перемішували 2 години при 40°С. Реакційну суміш охолоджували до кімнатної температури. До вмісту додавали етанол (350мл), аналітично чистий (р.а.). Потім додавали BH4Na (0,138моль). Отриману реакційну суміш перемішували одну годину при кімнатній температурі, потім одну годину при 50°С. Додавали ще BH4Na (5,2г) і реакційну суміш перемішували 2 години при 50°С. Знову додавали BH4Na і реакційну суміш перемішували протягом ночі при кімнатній температурі, потім 2 години при 50°С. До вмісту додавали воду (10мл). Суміш перемішували протягом 15хв. Додавали СН2Сl2 (200мл) і суміш перемішували протягом 15 хв. Органічну фазу відділяли, сушили (MgSO4), додавали дикаліт (dicalite). Суміш фільтрували від дикаліту і фільтрат випарювали. Дану фракцію розділяли на (CIS) і (TRANS) колонковою хроматографією на силікагелі. Цільові (TRANS)фракції збирали і розчинник випарювали, отримуючи 14,8г залишку ((І), 1,06% (CIS)) і 4,9г залишку ((II), 6% (CIS)). Розділення і очищення (TRANS)-фракцій (±20г в цілому) проводили хроматографією на стаціонарній фазі Chiralcel OD 33 81918 34 (1900Gr) у Prochrom LC110 35bar (елюент: гексан/етанол 90/10). Цільові фракції збирали і розчинник випарювали. Вихід: 9,5г проміжної сполуки 3, (2R-транс)-1-[3,5біс(трифторметил)бензоїл]-2-(фенілметил)-4-[4(фенілметил)-1-піперазиніл]піперидин. Суміш 1,1-диметилетилового ефіру 7d. Отримання проміжної сполуки 4 (гідроксифенілметил)-1,4-діокса-8азаспіро[4,5]декан-8-карбонової кислоти (0,5моль) і калієвої солі 2-метил-2-пропанолу (6г) у толуолі (900мл) перемішували і кип'ятили зі зворотним холодильником протягом 2 годин. Суміш упарювали і залишок збовтували у петролейному ефірі з невеликою кількістю води. Суміш декантували і залишок збовтували у DIPE. Осад відфільтровували і висушували. Вихід: 127,4г Суміш проміжної сполуки 3 (0,288моль) у проміжної сполуки б (92%). метанолі (700мл) гідрували при 40°С у присутності b. Отримання проміжної сполуки 7 каталізатора Pd/C, 10% (5г). Після поглинання Н2 (1еквів.) каталізатор відфільтровували і фільтрат упарювали. Вихід: 141,2г проміжної сполуки 4, (+)(2R-транс)-1-[3,5-біс(трифторметил)бензоїл]-2(фенілметил)-4-(1-піперазиніл)піперидин. Приклад А2 а. Отримання проміжної сполуки 5 Суміш проміжної сполуки 6 (0,5моль) у метанолі (700мл) гідрували при 50°С протягом ночі у присутності каталізатора Pd/C, 10% (5г). Після поглинання Н2 (1eквів.) каталізатор відфільтровували і фільтрат упарювали. Залишок обробляли водою і екстрагували СН2Сl2. Органічний шар сушили (MgSO4), фільтрували і упарювали. Вихід: 99г проміжної сполуки 7 (85%). с. Отримання проміжної сполуки 8 Суміш Ν-[(1,1-диметилетокси)карбоніл]-Lтирозин-і,1-диметилетилкарбонату (0,005моль), N,N-диметил-4-піридинаміну (0,006моль) і Et3N (0,006моль) у СН2Сl2, аналітично чистий (р.а.) (10мл) перемішували при кімнатній температурі. Моногідрохлорид N-(етилкарбонімідоїл)-N,Nдиметил-1,3-пропандіамину (0,006моль) додавали порціями і суміш перемішували 45 хвилин при кімнатній температурі. Потім додавали кінцеву сполуку 2 (описану в прикладі B1.b) (0,005моль) і реакційну суміш перемішували протягом ночі при кімнатній температурі. Суміш промивали Н2О і Na2CO3. Відділений органічний шар сушили, фільтрували і розчинник випарювали. Залишок очищали на силікагелі на скляному фільтрі (елюент: СН2Сl2/МеOН 100/0;98/2;96/4;94/6). Найчистіші фракції об'єднували і розчинник випарювали. Вихід: 1,4г проміжної сполуки 5 (30%). Приклад A3 а. Отримання проміжної сполуки 6 Et3N (0,55моль) додавали до суміші проміжної сполуки 7 (0,5моль) у толуолі (1500мл). До вмісту повільно додавали по краплям 3,5диметилбензоїлхлорид (0,5моль) протягом більше 1 години, при цьому температуру підтримували нижче 50°С і продовжували перемішування. Суміш перемішували протягом ночі при кімнатній температурі, потім промивали три рази водою (500мл, 2´250мл) і розділяли шари. Органічний шар сушили (MgSO4), фільтрували і розчинник випарювали. Вихід: 197г (113%). Частину даної фракції висушували. Вихід: 0,65г проміжної сполуки 8. d. Отримання проміжної сполуки 9 35 81918 36 Суміш проміжної сполуки 8 (0,56моль) у розчинник випарювали. Вихід: 3,25 г проміжної етанолі (300мл), НСl (300мл) і Н2О (300мл) сполуки 12 (95%). перемішували при 60°С протягом 8 годин. Суміш Отримання кінцевих сполук перемішували при кімнатній температурі протягом Приклад В1 вихідних. Осад відфільтровували, обробляли а. Отримання кінцевої сполуки 1 водою, відфільтровували, промивали петролейним ефіром і сушили. Вихід: 140,9г проміжної сполуки 9 (88%). e. Отримання проміжної сполуки 10 Суміш проміжної сполуки 9 (0,05моль) і 1(фенілметил)піперазину (0,05моль) у тіофені, 4% розчин (2мл), і толуолі (500мл) гідрували в присутності каталізатора Pd/C, 10% (1г). Після поглинання Н2 (1еквів.) каталізатор відфільтровували і фільтрат упарювали. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Сl2/(CH3OH/NH3) 99/1). Очищені фракції збирали і упарювали. Вихід: 17,07г (71%). Очищені фракції 1 збирали і упарювали. Вихід: 2,5г проміжної сполуки 10 (10%). f. Отримання проміжної сполуки 11 Суміш проміжної сполуки 10 (0,0052моль) у метанолі (100мл) гідрували при 50°С протягом ночі у присутності каталізатора Pd/C, 10% (1г). Після поглинання Н2 1еквів.) каталізатор відфільтровували і фільтрат упарювали. Залишок очищали на силікагелі на скляному фільтрі (елюент: СН2Сl2/(CH3OH/NH3) 99/1, 98/2, 97/3, 96/4 і 95/5). Очищені фракції збирали і упарювали. Вихід: 1,7г проміжної сполуки 11 (83%). Приклад А4 Отримання проміжної сполуки 12 Суміш кінцевої сполуки 2 (отриманої за Bib) (0,01 моль) і КОН (0,15 моль) у 2-пропанолі (50 мл) перемішували і кип'ятили зі зворотним холодильником 18 годин. Розчинник випарювали, потім залишок поміщали у воду (20 мл) і суміш екстрагували СН2С12. Органічний шар промивали NaOH (IN), сушили" (MgSO4), фільтрували і Суміш проміжної сполуки 4 (0,12моль) і 1(фенілметил)-4-піперидинону (0,12моль) у метанолі (250мл) гідрували при 50°С у присутності каталізатора Pd/C 10% (3г) і розчину тіофену (2мл). Після поглинання Н2 1еквів.) каталізатор відфільтровували і фільтрат упарювали. Залишок суспендували у петролейному ефірі, відфільтровували і кристалізували з DIPE. Вихід: 46г (F1). Фільтрат упарювали. Вихід: 37,7г (F2). F1 і F2 об'єднували і очищали колонковою хроматографією на силікагелі (елюент: СН2Сl2/МеОН 91/9). Фракції продукту збирали і розчинник випарювали. Вихід: 46г (F3). Частину F3 кристалізували з DIPE. Вихід: 0,65г кінцевої сполуки 1. b. Отримання кінцевої сполуки 2 Суміш кінцевої сполуки 1 (0,0074моль) у метанолі (150мл) гідрували в присутності каталізатора Pd/C 10% (1г). Після поглинання Н2 (1еквів.) каталізатор відфільтровували і фільтрат концентрували. Вихід: 4,3г кінцевої сполуки 2. Приклад В2 Отримання кінцевої сполуки 3 Суміш кінцевої сполуки 2 (0,0015моль) і Et3N (0,1моль) у СН2Сl2 (100мл) перемішували при 37 81918 38 фільтрували і розчинник випарювали. Залишок кімнатній температурі. Бензоїлхлорид очищали колонковою хроматографією· на (0,0025моль) розчиняли у СН2Сl2 і додавали по силікагелі.(елюент: СН2Сl2/СН3ОН від 100/0 до краплям до реакційної суміші. Суміш 90/10). Фракції продукту збирали і розчинник перемішували 1 годину при кімнатній температурі. випарювали. Вихід: 0,749г кінцевої сполуки 5 Потім до вмісту додавали NaOH (1N; 100мл) і (58%). суміш перемішували 30 хвилин при кімнатній Приклад В4 температурі. Відділений водний шар екстрагували а. Отримання кінцевої сполуки 6 СН2Сl2. Органічний шар промивали водою, сушили (MgSO4), фільтрували і розчинник випарювали. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Сl2/МеOН 100/0;90/10). Цільові фракції збирали і розчинник випарювали. Вихід: 0,624г кінцевої сполуки 3 (61%). Приклад В3 а. Отримання кінцевої сполуки 4 Суміш 5-метил-4-ізоксазолкарбонової кислоти (0,0015моль) у СН2Сl2 (20мл) і 1,1'-карбоніл-біс-1Німідазолу (0,0015моль) перемішували 2 години при кімнатній температурі. До вмісту додавали кінцеву сполуку 2 (отриману за B1.b) (0,001моль). Після перемішування протягом ночі реакційну суміш промивали розведеним розчином NaOH, потім Н2О, сушили, фільтрували і розчинник випарювали. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Сl2градієнт 0->10%МеОН). Фракції продукту збирали і розчинник випарювали. Залишок сушили. Вихід: 0,204г кінцевої сполуки 4. b. Отримання кінцевої сполуки 5 Суміш 3-тіофенкарбонової кислоти (0,00188моль), N,N-диметил-4-піридинаміну (0,00255моль) і Et3N (0,00255моль) у СН2Сl2 (200мл) перемішували при кімнатній температурі. До вмісту додавали порціями N,N-диметил-N'(метилкарбонімідоїл)-1,3-пропандіамін (0,00255моль) і суміш перемішували одну годину при кімнатній температурі. Потім додавали по краплям розчин кінцевої сполуки 2 (отриманої за B1b) (0,00188моль) у СН2Сl2 і реакційну суміш перемішували протягом вихідних при кімнатній температурі. Суміш виливали у 1г NaOH/вода. Шари розділяли. Водний шар екстрагували СН2СІ2. Відділений органічний шар сушили (MgSO4), Суміш кінцевої сполуки 2 (отриманої за B1b) (0,005моль), 4-(хлорфенілацетил)морфоліну (0,005моль) і Nа2СО3 (0,01моль) у МІК, аналітично чистий (р.а.) (125мл) перемішували і кип'ятили зі зворотним холодильником 18 годин з відділенням води. Реакційну суміш промивали водою, сушили, фільтрували і розчинник випарювали. Залишок очищали на силікагелі на скляному фільтрі (елюент: СН2Сl2/(CH3OH/NH3) 95/5). Фракції продукту збирали і розчинник випарювали. Осад суспендували у DIPE, відфільтровували і висушували. Вихід: 1,7 02г кінцевої сполуки 6. b. Отримання кінцевої сполуки 7 Суміш кінцевої сполуки 2 (отриманої за B1b) (0,0012моль), 2-(хлорметил)-1Н-бензімідазолу (0,0014моль) і K2СО3 (0,0018моль) у CH3CN (5мл) перемішували і кип'ятили зі зворотним холодильником 12 годин, потім охолоджували до кімнатної температури і розчинник випарювали. Залишок обробляли СН2СI2. Органічний шар промивали Н2О, сушили (MgSO4), фільтрували і розчинник випарювали. Залишок (0,95г) очищали колонковою хроматографією на силікагелі (елюент: СН2Сl2/СН3ОН/NH4ОН 90/10/0,5; 1540мкм). Очищені фракції збирали і розчинник випарювали. Залишок (0,14г) кристалізували з DIPE. Осад відфільтровували і висушували. Вихід: 0,087г кінцевої сполуки 7 (10%) (т. пл. 135°С). с. Отримання кінцевої сполуки 8 39 До суміші кінцевої сполуки 2 (отриманої за B1b) (0,005моль) і 2-(хлорметил)-б-метил-3піридинолу (0,006моль) у DMF (50мл) додавали Nметил-N-(1-метилетил)пропанамін (0,02моль). Реакційну суміш перемішували при ±65°С протягом ночі. Розчинник випарювали. Залишок обробляли СН2СІ2 і промивали розведеним розчином NH3. Відділений органічний шар сушили, фільтрували і розчинник випарювали. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2СІ2/(МеОН/NН3) 95/5). Цільові фракції збирали і розчинник випарювали. Осад суспендували у DIPE. Осад відфільтровували и висушували. Вихід: 1,423г кінцевої сполуки 8. Приклад В5 Отримання кінцевої сполуки9 Суміш кінцевої сполуки 2 (отриманої за B1b) (0,003моль) і 1-метил-1Н-пірол-2-карбоксальдегіду (0,0046моль) гідрували при дії Н2 при 50°С в присутності каталізатора Pd/C 10% (1г) і розчину тіофену (1мл). Після поглинання Н2 (1еквів.) каталізатор відфільтровували і фільтрат упарювали. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Сl2/(МеОН/NH3) 97/3;95/5). Фракції продукту збирали і розчинник випарювали. Осад суспендували у петролейному ефірі. Вихід: 1,079г кінцевої сполуки 9. Приклад В6 Отримання кінцевої сполуки 10 і 11 81918 40 Суміш проміжної сполуки 2 (отриманої за A1b) (0,005моль), проміжної сполуки 11 (отриманої за A3f) (0,005моль) і Ті(ОіРrо)4 (3г) у метанолі (150мл) гідрували при 50°С у току N2 в присутності каталізатора Pd/C 10% (1г) і розчину тіофену (1мл). Після поглинання Н2 (1еквів.) каталізатор відфільтровували і фільтрат упарювали. Залишок обробляли Н2О і СН2Сl2. Суміш перемішували 10хв і фільтрували через дикаліт. Відділений органічний шар сушили, фільтрували і розчинник випарювали. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Сl2/(CH3OH/NH3) 97/3). Дві фракції збирали і випарювали з них розчинник. Вихід: 0,53г сполуки 10 і 0,4г сполуки 11. Приклад В7 Отримання кінцевої сполуки 12 Суміш "кінцевої сполуки 2 (отриманої за B1b) (0,001моль) у СН2СІ2 (50мл) і CDI (0,0015моль) перемішували протягом ночі. Реакційну суміш промивали розведеним розчином NaOH, потім Н2О, сушили і розчинник випарювали. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Сl2/СН3ОН 100/0 і 90/10). Фракції продукту збирали і розчинник випарювали. Вихід: 0,645г кінцевої сполуки 12. Приклад В8 Отримання кінцевої сполуки 13 41 81918 Суміш проміжної сполуки 5 (отриманої за А2) (0,0015 моль) у НСl/2-пропанолі (5мл) і метанолі (20мл) перемішували і кип'ятили зі зворотним холодильником протягом 1 години. Реакційну суміш кристалізували, фільтрували і сушили. Вихід: 0,43г кінцевої сполуки 13 (38%). Приклад В9 Отримання кінцевої сполуки 40 Суміш кінцевої сполуки 31 (отриманої за В2) (0,065ммоль), 4-піридинілборонової кислоти (0,09ммоль), Pd(OAc)2 (0,015ммоль), 1,3-біс (дифенілфосфіно) пропану (0,03ммоль), Nа2СО3, 2М (1мл) і DME (2мл) перемішували при 100°С протягом 16 годин. Розчинник випарювали, залишок обробляли Н2О і екстрагували СН2Сl2. Органічний шар відділяли, сушили над MgSO4 і розчинник випарювали. Залишок очищали колонковою хроматографією на кромазилі (градієнт: СН2Сl2/СН3ОН 95/5). Бажані фракції збирали і розчинник випарювали. Вихід: 1мг кінцевої сполуки 40. Приклад В10 Отримання кінцевої сполуки 85 Суміш кінцевої сполуки 83 (отриманої за В2) (0,0004моль), піролідину (0,0006моль), Pd2(dba)3 (0,00001моль), ΒΙΝΑΡ (0,00003моль) і натрієвої солі 2-метил-2-пропанолу (0,0006моль) у толуолі (5мл) перемішували при 100°С протягом 16 годин.· Розчинник випарювали, залишок обробляли Н2О і екстрагували СН2СІ2. Органічний шар відділяли, сушили над MgSO4 і розчинник випарювали. Залишок очищали колонковою хроматографією на кромазилі (градієнт: СН2Сl2/СН3OН 95/5). Бажані фракції збирали і розчинник випарювали. Вихід: 0,119г кінцевої сполуки 85. Приклад В11 Отримання кінцевої сполуки 43 42 Суміш кінцевої сполуки 31 (отриманої за В2) (0,065ммоль), імідазо(1,2-а)піридину (0,09ммоль), Pd(OAc)2 (0,015ммоль), 1,3біс(дифенілфосфіно)пропану (0,03ммоль) і Cs2CO3 (0,09ммоль) у NMP (5мл) перемішували при 140°С протягом 16 годин. Розчинник випарювали, залишок обробляли Н2О і екстрагували СН2Сl2. Органічний шар відділяли, сушили над MgSO4 і розчинник випарювали. Залишок очищали колонковою хроматографією на кромазилі (градієнт: СН2СІ2/СН3ОН 95/5). Бажані фракції збирали і розчинник випарювали. Вихід: 8мг кінцевої сполуки 43. Приклад В12 Отримання кінцевої сполуки 44 Суміш сполуки 31 (отриманої за В2) (0,065ммоль), морфоліну (0,2ммоль), Pd(OAc)2 (0,015ммоль) і 1,3-біс(дифенілфосфіно) пропану (0,03ммоль) у диглімі (3мл) у присутності CO (1 атмосфера) перемішували при 150°С протягом 16 годин. Розчинник випарювали, залишок обробляли Н2О і екстрагували СН2Сl2. Органічний шар відділяли, сушили над MgSO4 і розчинник випарювали. Залишок очищали колонковою хроматографією на кромазилі (градієнт: СН2Сl2/СН3ОН 95/5). Бажані фракції збирали і розчинник випарювали. Вихід: 3мг кінцевої сполуки 44. Приклад В13 Отримання кінцевої сполуки 144 43 Суміш метилового ефіру 4-[(4ацетилокси)метил]-1,2,3-тіа-діазол-5-карбонової кислоти (0,001моль), кінцевої сполуки 2 (отриманої за B1b) (0,002моль), NaCN (20мг) у метанолі (20мл) перемішували і кип'ятили зі зворотним холодильником протягом 20 годин. Розчинник випарювали і залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Сl2/МеОН від 100/0 до 80/20). Бажані фракції збирали і розчинник випарювали. Залишок суспендували у петролейному ефірі. Осад відфільтровували і висушували. Вихід: 0,110г кінцевої сполуки 144. Приклад В14 Отримання кінцевої сполуки 130 Суміш кінцевої сполуки 2 (отриманої за B1b) (0,001моль), димеру гліколевого альдегіду (0,001моль) і 3-тіофенборонової кислоти (0,001моль) у 2,2,2-трифторетанолі (5мл) перемішували при кімнатній температурі протягом 18 годин. Потім додавали розчин K2СО3 (10%) і суміш екстрагували етилацетатом. Об'єднані органічні шари сушили над MgSO4, фільтрували і концентрували у вакуумі. Залишок (0,6г) очищали хроматографічно на колонці з силікагелем (CH2Cl2/MeOH/NH4OH 92/08/0,2 і фракції продукту концентрували, отримуючи 0,29г (47%) кінцевої сполуки 130. Приклад В15 Отримання кінцевої сполуки 153 81918 44 Суміш проміжної сполуки 12 (отриманої за А4) (0,00934моль) і Et3N (0,02моль) у СН2СІ2 (200мл) перемішували при охолодженні на бані з льодом, потім до реакційної суміші додавали по краплям розчин 4-метил-1,2,3-тіадіазол-5-карбоніл-хлориду (0,00943моль) у СН2Сl2 (20мл) протягом 15 хвилин при 0°С. Реакційну суміш залишали нагріватися до кімнатної температури і перемішували 1 годину при кімнатній температурі, потім додавали NaOH (20мл) і перемішували ще 15 хвилин при кімнатній температурі. Шари розділяли і водний шар екстрагували СН2Сl2. Органічний шар промивали Н2О, сушили над MgSO4, фільтрували і розчинник випарювали. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Сl2/МеOН/ (MeOH/NH3) від 100/0/0 до 90/10/0). Дві фракції продукту збирали і з кожної випарювали розчинник. Вихід фракції 1: 1,260г кінцевої сполуки 153 (22%). Сполуки, представлені у наступних таблицях, були отримані аналогічними способами, описаними у вищенаведених прикладах В1-В15. Аналітичні дані Для ряду сполук були визначені температури плавлення або дані ВЕРХ або оптичне обертання. Температури плавлення По можливості температури плавлення (або інтервали) визначалися на апараті В-545 Büchi для визначення температур плавлення. Середовище для нагрівання являє собою металічний блок. Плавлення зразка візуально спостерігають за допомогою лінз, що збільшують зображення, і при сильному світловому контрасті. Температури плавлення вимірюють при температурному градієнті З або 10 градусів Цельсію за хвилину. Сполука, номер 1 2 3 4 5 6 7 8 9 10 11 12 13 Т. пл. (°С) 115,9-119,7 160,6-163,2 149,9-151,7 180,5-182,1 87,8-121,4 87,7-111,2 141,0-177,3 162,3-164,3 122,1-123,8 97,0-120,4 111,9-125,4 66,7-79,0 284,5-288,6 45 14 15 19 22 29 31 32 33 34 37 38 39 46 49 50 51 52 53 54 55 56 57 58 59 60 62 63 64 65 69 71 72 73 75 76 77 79 80 81 82 83 84 85 88 89 90 91 92 93 98 99 100 102 103 104 106 108 109 110 111 113 81918 107,4-116,1 188,1-190,3 140,3-144,8 98,3-119,9 142,9-146,5 153,1-155,2 83,3-95,5 82,7-98,6 80,7-95,5 298,1-319,7 83,2-110,2 279,4-280,9 81,3-107,2 145,3-149,6 92,1-100,7 108,9-127,3 93,9-104,6 156,6-161,0 107,6-122,2 96,7-106,3 171,3-181,5 167,4-169,4 92,5-102,6 79,1-98,2 100,5-121,4 91,4-120,3 86,0-99,4 133,6-159,5 102,3-105,8 108,6-120,6 93,5-127,3 91,6-103,2 100,5-110,5 78,8-93,8 76,2-93,8 273,6-295,2 74,3-100,3 106,7-126,1 85,3-120,6 91,9-121,1 86,9-102,1 92,2-126,1 145,4-147,2 70,6-108,7 96,1-109,4 111,9-120,1 91,5-108,1 100,7-117,9 184,1-192,4 177,1-180,6 65,9-83,0 76,1-100,1 72,9-93,5 83,7-100,8 105,1-108,5 77,2-99,1 314,8-335,8 95,4-107,7 84,6-111,8 87,3-109,3 252,3-291,7 46 116 117 122 102,8-125,6 158,2-160,5 177,5°C Умови отримання даних ВЕРХ ВЕРХ-градієнт забезпечувався системою Waters Alliance HT 2790 з комплектом колонкового нагрівача при 40°С. Потік з колонки направлявся у детектор з фотодіодною матрицею (PDA) Water 996 і у мас-спектрометр Waters-Micromass ZQ з джерелом електро-розпилювальної іонізації, що працює за механізмом позитивної і негативної іонізації. Звернена фаза ВЕРХ виконана на колонці Xterra MS C18 (3,5мм, 4,6´100мм) при швидкості потоку 1,6мл/хв. Три рухомі фази (рухома фаза А: 95% 25мМ амонійацетат+5% ацетонітрил; рухома фаза В: ацетонітрил; рухома фаза С: метанол) були використані для досягнення градієнтного стану від 100% А до 50% В і 50% С за 6,5хв, до 100% В за 1хв, 100% В протягом 1хв і відновленої рівноваги зі 100% А протягом 1,5хв. Використаний об'єм для ін'єкції складав 10мл. Мас-спектри були отримані скануванням від 100 до 1000 за 1с з використанням інтервалу у 0,1с. Напруга у капілярних голках складала 3кВ, і джерело температури підтримували при 140°С. Азот використовували як газ-розпилювач. Конічна напруга складала 10В для позитивної іонізації і 20В для негативної іонізації. Отримані дані оброблені за допомогою системи WatersMicromass MassLynx-Openlynx. Сполука, номер 16 18 20 21 22 23 24 26 27 28 30 35 36 42 48 61 70 74 94 96 101 105 107 114 115 118 119 124 125 ВЕРХ MS (MH+) 661 703 711 724 701 703 753 809 699 749 654 703 703 756 719 747 693 692 740 703 651 731 691 803 791 859 767 700 673 47 81918 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 153 154 155 156 157 158 48 673 673 737 709 709 693 687 687 687 701 677 677 677 709 709 709 709 709 725 681 681 681 651 651 651 677 595 709 709 619 723 745 Оптичне обертання Оптичні обертання були зареєстровані на поляриметрі (Perkin Elmer) при 20°С. Дані з концентрації, довжини хвилі і розчинника приведені у таблиці. Сполука, номер 18 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 [a] -33,77° -35,56° -33,66° -34,75° -6,72° -33,2° -34,1° -34,43° -33,95° -29,91° -29,12° -32,32° -33,3° -35,06° -35,84° -34,53° Довжина хвилі (нм) 365 365 365 365 436 365 365 365 365 365 365 365 365 365 365 365 Концентрація (мас./об. %) 0,4086 0,4302 0,5288 0,4058 0,6400 0,4638 0,4340 0,4298 0,4094 0,4848 0,4602 0,4548 0,4354 0,4164 0,4380 0,4054 Розчинник СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН СН3ОН 49 81918 50 51 81918 52 53 81918 54 рецептора, причому більшість з них проявило більш ніж 100-разову селективність у порівнянні з h-ΝΚ2- і h-ΝΚ3-рецепторами. Приклад С.2: Сигнальна трансдукція У даному досліді оцінювали in vitro функціональну NK1-антагоністичну активність. Для вимірювань внутрішньоклітинних концентрацій Са++ клітини вирощували на 96-лункових планшетах (чорна стінка/прозоре дно) від Costar протягом 2 днів, поки вони не утворили суцільний шар. Клітини навантажували 2мкМ Fluo3 у DMEM, що містив 0,1% BSA і 2,5мМ пробенециду (probenecid) протягом 1 години при 37°С. Потім їх промивали 3 рази буфером Кребса (140мМ NaCl, 1мМ МgСl2´6Н2О, 5мМ KСI, 10мМ глюкоза, 5мМ HEPES; 1,2.5мМ СаСI2; рН 7,4), що містив 2,5мМ пробенециду і 0,1% BSA (Са++-буфер). Клітини попередньо інкубували з рядом концентрацій антагоністів протягом 20хв при кімнатній температурі і вимірювали Са++-сигнали після додавання агоністів за допомогою пристрою зчитування Fluorescence Image Plate Reader (FLIPR від Molecular Devices, Crawley, England). Пік Са++-переходу розглядали як релевантний сигнал і середні величини від відповідних комірок С. Фармакологічні приклади аналізували, як описано нижче. Приклад Сю1: Експеримент зі зв'язування hСигмоїдні криві доза-відповідь аналізували NK1-, h-NK2- і h-NK3-рецепторів комп'ютеризованою апроксимацією кривих, Сполуки даного винаходу досліджували для використовуючи GraphPad Program. Величина взаємодії з різними нейромедіаторними ЕС50 сполуки представляє собою ефективну дозу, рецепторами, іонними каналами і сайтами що виявляє 50% максимального ефекту. Для зв'язування переносника з використанням усереднених кривих відповідь до агоніста з методики радіолігандного зв'язування. Мембрани максимальною ефективністю нормалізували до від гомогенатів тканин або з клітин, що 100%. Для відповіді антагоністів величину ІС50 експресують рецептор або переносників, що обчислювали за допомогою нелінійної регресії. представляють інтерес, інкубували з радіоактивною міченою речовиною ([3Н]- або [125І] Сполука, ліганд) для мічення конкретного рецептора. h-NK1 РІС50 h-NK2 РІС50 h-NK3 РІС50 номер Специфічне рецепторне зв'язування радіоліганда 2 8,6 5,8 5,2 відрізняли від неспецифічного мембранного 3 8,9 6,3 6,6 зв'язування за допомогою селективного 4 8,8 5,2 6,7 інгібірування рецептора, що взаємодіє з неміченим 5 10,0 6,1 6,3 лікарським засобом, що конкурує з радіолігандом 6 9,0 за зв'язування з рецепторними сайтами. Після інкубації мічені мембрани збирали і обробляли 7 8,1 6,0 6,0 надлишком холодного буфера для видалення 8 9,2 незв'язаної радіоактивності шляхом швидкої 9 8,9 6,2 6,3 фільтрації з відсмоктуванням. Мембранозв'язану 10 7,3 6,4 6,2 радіоактивність визначали сцинтиляційним 11 7,4 6,2 6,6 лічильником і результати виражали у імпульсах за 12 9,1 6,0 6,1 хвилину (срm). 13 8,9 6,2 6,0 Сполуки розчиняли у ДМСО і випробували у 16 9,0 6,3 6,8 -10 -5 10 концентраціях в інтервалі від 10 до 10 М. 22 9,4 6,2 6,5 Оцінювали здатність сполук даного винаходу 3 26 7,4 6,0 6,0 витісняти [ Н]-речовину Ρ з клонованих h-NK132 8,8 6,2 6,8 рецепторів людини, експресованих на СНО36 9,0 6,1 6,1 клітинах, витісняти [3Н]-SR-48968 з клонованих h37 8,4 6,3 6,6 NK2-рецепторів людини, експресованих у Sf9клітинах, і витісняти [3Н]-SR-142801 з клонованих 39 9,1 6,0 6,0 h-NK3-рецепторів людини, експресованих на СНО42 8,6 клітинах. 45 9,5 Величини РІС50 для h-ΝΚ1-, h-ΝΚ2- і h-NK351 8,9 6,2 6,4 рецепторів, що характеризують селективність 56 9,0 6,3 6,7 сполук, представлені в таблиці 3. 62 9,2 6,4 6,6 Усі селективні сполуки показали 64 8,1 6,4 6,4 (суб)наномолярне споріднення до h-NK165 8,4 6,2 6,6 55 9,0 9,1 8,2 9,3 8,5 8,6 7,5 9,5 9,0 9,2 9,0 8,8 10,0 9,0 8,6 7,6 8,0 8,4 7,7 8,8 8,5 8,1 8,9 9,0 ? 9,4 81918 56 Отриманим розчином наповнювали придатні 77 6,1 5,6 ємності. 78 6,4 6,0 Приклад D.3: Таблетки з плівковим покриттям 79 6,5 6,4 Отримання таблетки 80 6,1 6,6 Суміш 100г а. і., 570г лактози і 200г крохмалю 85 добре перемішували, після чого зволожували 89 6,2 6,2 розчином 5г додецилсульфату натрію і 10г 90 6,5 6,9 полівінілпіролідону у приблизно 200мл води. 97 6,3 6,4 Вологу порошкоподібну суміш просіювали, сушили 102 і знову просіювали. Потім додавали 100г 104 5,8 5,8 мікрокристалічної целюлози і 15г гідрогенізованої 106 6,0 6,3 рослинної олії. Усю масу добре перемішували і 108 пресували у таблетки, отримуючи 10000 таблеток, 110 кожна з яких містила 10мг активного інгредієнта. 113 6,4 6,4 Покриття До розчину 10г метилцелюлози у 75мл 116 6,1 6,8 денатурованого етанолу додавали розчин 5г 119 6,0 6,0 етилцелюлози у 150мл дихлорметану. Потім до 132 5,7 5,5 суміші додавали 75мл дихлорметану і 2,5мл 1,2,3133 5,9 6,1 пропантріолу. 10г поліетиленгліколю розплавляли 134 5,6
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;substituted 1,4-di-piperidin-4-yl-piperazine derivatives and their use as neurokinin antagonists
Автори англійськоюJanssens, Frans, Eduard, Sommen Francois Maria, De Boeck Benoit Christian Albert Ghislain, Leenaerts Joseph Elisabeth, Van Roosbroeck Yves Emiel Mari, Diels, Gaston, Stanislas, Marcell
Назва патенту російськоюЗамещенные производные 1,4-дипиперидин-4-илпиперазина и их применение в качестве нейрокининовых антагонистов
Автори російськоюЯнссенс Франс Эдуард, Соммен Франсуа Мария, де Бек Бенуа Кристиан Альберт Хислен, Леенартс Йозеф Элизабет, ван Роосбрек Ив Эмиль Мария, Дилс Гастон Станислас Марселла
МПК / Мітки
МПК: C07D 401/14, C07D 211/58, C07D 409/14, C07D 405/14, C07D 471/04, C07D 417/14, C07D 413/14
Мітки: заміщені, 1,4-дипіперидин-4-ілпіперазину, нейрокінінових, застосування, похідні, антагоністів
Код посилання
<a href="https://ua.patents.su/28-81918-zamishheni-pokhidni-14-dipiperidin-4-ilpiperazinu-ta-kh-zastosuvannya-yak-nejjrokininovikh-antagonistiv.html" target="_blank" rel="follow" title="База патентів України">Заміщені похідні 1,4-дипіперидин-4-ілпіперазину та їх застосування як нейрокінінових антагоністів</a>
Попередній патент: Передавальний механізм для сільськогосподарської машини, сівалка і насіннєвий ящик з таким передавальним механізмом
Наступний патент: Похідні бензимідазолу, спосіб їх одержання та застосування цих сполук у виробництві різних медикаментів, та фармацевтична композиція, що містить такі сполуки
Випадковий патент: Спосіб діагностики стеатозу печінки у хворих на хронічний гепатит с