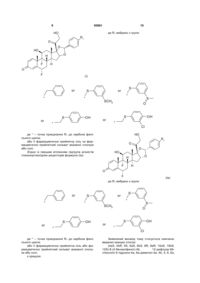
Агоністи рецептора глюкокортикоїду
Номер патенту: 95861
Опубліковано: 12.09.2011
Автори: Міллан Дейвід Саймон, Прайс Дейвід Ентоні, лоссоп Пол Алан
Формула / Реферат
1. Сполука формули (І):
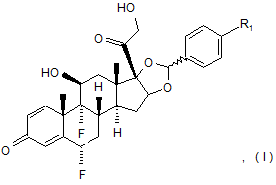
де R1 вибрано з групи:
 або
або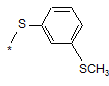 , або
, або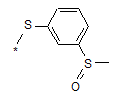 , або
, або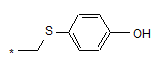 , або
, або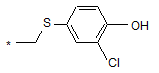 ,
,
де * - точка приєднання R1 до карбона фенільного цикла;
або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі.
2. Сполука за п. 1 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі, вибрана з групи:
(4aS,4bR,5S,6aS,6bS,8R,9aR,10aS,10bS,12S)-8-(4-бензилфеніл)-4b,12-дифлуор-6b-гліколоїл-5-гідрокси-4а,6а-диметил-4а,4b,5,6,6а,6b,9а,10,10а,10b,11,12-додекагідро-2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он;
(4aS,4bR,5S,6aS,6bS,8R,9aR,10aS,10bS,12S)-4b,12-дифлуор-6b-гліколоїл-5-гідрокси-4а,6а-диметил-8-(4-{[3-(метилтіо)феніл]тіо}феніл)-4а,4b,5,6,6а,6b,9а,10,10а,10b,11,12-додекагідро-2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он;
(4aS,4bR,5S,6aS,6bS,8R,9aR,10aS,10bS,12S)-4b,12-дифлyop-6b-rлiкoлoїл-5-гідрокси-8-(4-{[(4-гідроксифеніл)тіо]метил}феніл)-4а,6а-диметил-4а,4b,5,6,6а,6b,9а,10,10а,10b,11,12-додекагідро-2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он;
(4aS,4bR,5S,6aS,6bS,8R,9aR,10aS,10bS,12S)-4b,12-дифлуор-6b-гліколоїл-5-гідрокси-4а,6а-диметил-8-(4-{[3-(метилсульфініл)феніл]тіо}феніл)-4a,4b,5,6,6a,6b,9a,10,10a,10b,11,12-додекагідро-2Н-нафто-[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он та
(4aS,4bR,5S,6aS,6bS,8R,9aR,10aS,10bS,12S)-8-(4-{[(3-хлор-4-гідроксифеніл)тіо]метил}феніл)-4b,12-дифлуор-6b-гліколоїл-5-гідрокси-4а,6а-диметил-4а,4b,5,6,6а,6b,9a,10,10a,10b,11,12-додекагідро-2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он.
3. Фармацевтична композиція, що містить ефективну кількість сполуки формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятну сіль або фармацевтично прийнятний сольват вказаної сполуки або солі та один або більше фармацевтично прийнятних наповнювачів.
4. Сполука формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі для застосування як медикаменту.
5. Сполука формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі для застосування у лікуванні хвороб, розладів та станів, в яких бере участь глюкокортикоїдний рецептор.
6. Сполука формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі для застосування у лікуванні хвороб, розладів та станів, вибраних з групи: хвороби шкіри, як-то екзема, псоріаз, дерматит, свербіж та реакції гіперчутливості; запальні стани носа, горла та легень, як-то риніт, синусит, астма, назальні поліпи, хронічна обструктивна хвороба легень (COPD) та фіброз; запальні хвороби кишечнику, як-то запальна хвороба кишечнику, хвороба Крона та виразковий коліт; та автоімунні хвороби, як-то ревматоїдний артрит; та очні стани, як-то кон'юнктивіт.
7. Застосування сполуки формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату вказаної сполуки або солі для виробництва ліків для лікування хвороб, розладів та станів, в яких бере участь глюкокортикоїдний рецептор.
8. Застосування сполуки формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату вказаної сполуки або солі для виробництва ліків для лікування хвороб, розладів та станів, вибраних з групи за п. 6.
9. Комбінація сполуки за будь-яким з пп. 1 або 2 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату вказаної сполуки або солі з іншими терапевтичними агентами, вибраними з групи:
(a) інгібітори 5-ліпоксигенази (5-LO) або антагоністи білка активування 5-ліпоксигенази (FLAP),
(b) антагоністи лейкотриєну (LTRA), у тому числі антагоністи LTB4, LTC4, LTD4 та LTE4,
(c) інгібітори лейкотриєн-С4-синтази,
(d) антагоністи рецептора гістаміну, у тому числі антагоністи Н1, Н3 та Н4,
(e) a1- та a2-адреноміметичні судинозвужувальні симпатоміметичі агенти для протизастійного застосування,
(f) інгібітори PDE, наприклад інгібітори PDE3, PDE4 та PDE5,
(g) теофілін,
(h) натрію хромоглікат,
(і) інгібітори СОХ, неселективні та селективні інгібітори СОХ-1 або СОХ-2 (NSAID),
(j) антагоністи рецептора простагландину та інгібітори простагландинсинтази, як-то hPGDS,
(k) антагоністи мускаринового рецептора М3 або антихолінергічні агенти,
(l) b2-адреноміметики;
(m) моноклональні антитіла, активні проти ендогенних прозапальних сутностей, як-то, наприклад, IgE, IL3, IL4, ІL9, IL10, IL13, IL17A, GMCSF та їх рецептори,
(n) антипухлинні агенти фактору некрозу (aнтиTNF-a),
(о) інгібітори адгезії молекул, у тому числі антагоністи VLA-4,
(р) антагоністи рецептора кінін-В1 та -В2,
(q) імунодепресанти, у тому числі інгібітори шляху метаболізму IgE та циклоспорин,
(r) інгібітори матриксних металопротеаз (ММР), як-то, наприклад, ММР9 та ММР12,
(s) агоністи рецептора тахікініну NK1, NK2 та NK3,
(t) інгібітори протеази, як-то інгібітори еластази, зокрема інгібітори нейтрофілеластази,
(u) А2а-агоністи рецептора аденозину та А2b-антагоністи,
(v) інгібітори урокінази,
(w) сполуки, що діють на рецептори допаміну, як-то D2-агоністи,
(х) модулятори шляху метаболізму NFkb, як-то інгібітори ІКК,
(у) модулятори шляхів передачі сигналів цитокіну, як-то МАР-кіназа р38, РІ3-кінази, JAK-кінази, syk-кіназа, EGFR, МК-2, fyn-кінази або ІТК,
(z) агенти, що можна класифікувати як муколітики або засоби проти кашлю,
(аа) агенти, які посилюють або повторно сенсибілізують реакції на інгаляційні кортикостероїди, як-то, наприклад, аналоги маколіду та інгібітори РІ3Кd або АКТ1,2,3,
(bb) антибіотики та антивірусні агенти, ефективні проти мікроорганізмів, які можуть колонізувати респіраторний тракт,
(сс) активатори HDAC,
(dd) антагоністи CXCR1, CXCR2 та CXCR3,
(ее) антагоністи інтегрину,
(ff) хемокіни та агоністи рецепторів хемокінів,
(gg) блокатори епітеліального каналу натрію (ENaC) або інгібітори епітеліального каналу натрію (ENaC),
(hh) блокатори іонного каналу CRAC або інгібітори CRAC,
(іі Р2Y2-агоністи та інші агоністи нуклеотидного рецептора,
(jj) антагоністи Р2Х7,
(kk) інгібітори VAP1,
(ll) інгібітори тромбоксану,
(mm) ніацин, та
(nn) фактори адгезії, у тому числі VLAM, ІСАМ та ELAM.
10. Фармацевтична композиція за п. 3, яка додатково містить ще один терапевтично активний агент.
11. Фармацевтична композиція за п. 10, де вказаним іншим терапевтично активним агентом є b2-адреноміметики.
12. Фармацевтична композиція за п. 10, де вказаним іншим терапевтично активним агентом є антихолінергічний агент.
13. Фармацевтична композиція за п. 3, яка додатково містить b2-адреноміметики та антихолінергічний агент.
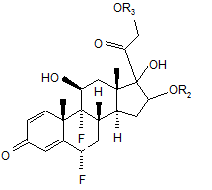
14. Спосіб отримання сполуки формули (І) за будь-яким з пп. 1 або 2, за яким здійснюють взаємодію формули (II):
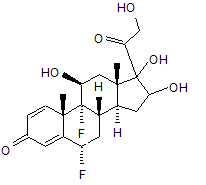 (ІІ)
(ІІ)
або формули (III):
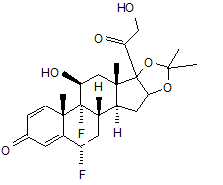 , (ІІІ)
, (ІІІ)
або формули (IV):
 , (IV)
, (IV)
де R2 та R3 - форміл,
з відповідним альдегідом формули (IIа):
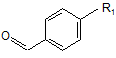 (ІІа)
(ІІа)
або з відповідним еквівалентом альдегіду формули (IIb):
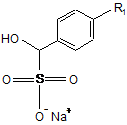 , (IIb)
, (IIb)
де R1 визначено за п. 1.
15. Спосіб отримання сполуки формули (І) за будь-яким з пп. 1 або 2, де R1 має формулу:
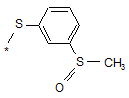 ,
,
за яким сполуки формули (І) за будь-яким з пп. 1 або 2, де R1 має формулу:
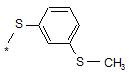 ,
,
окиснюють.
Текст
УКРАЇНА (19) UA (11) 95861 (13) C2 (51) МПК (2011.01) C07J 71/00 A61K 31/58 (2006.01) C07J 7/00 A61P 11/06 (2006.01) A61P 5/46 (2006.01) ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) АГОНІСТИ РЕЦЕПТОРА ГЛЮКОКОРТИКОЇДУ 1 2 H F O H O F де R1 вибрано з групи: , (I) or * S або * S * OS SCH3 S OH or O O * , або S or * S OH *Cl , * Cl S OH or * OH OH OH або , Cl де * - точка приєднання R1 до карбона фенільного цикла; або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі. 2. Сполука за п. 1 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі, вибрана з групи: (4aS,4bR,5S,6aS,6bS,8R,9aR,10aS,10bS,12S)-8-(4бензилфеніл)-4b,12-дифлуор-6b-гліколоїл-5гідрокси-4а,6а-диметил4а,4b,5,6,6а,6b,9а,10,10а,10b,11,12-додекагідро2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он; (4aS,4bR,5S,6aS,6bS,8R,9aR,10aS,10bS,12S)4b,12-дифлуор-6b-гліколоїл-5-гідрокси-4а,6адиметил-8-(4-{[3-(метилтіо)феніл]тіо}феніл)4а,4b,5,6,6а,6b,9а,10,10а,10b,11,12-додекагідро2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он; (4aS,4bR,5S,6aS,6bS,8R,9aR,10aS,10bS,12S)4b,12-дифлyop-6b-глiкoлoїл-5-гідрокси-8-(4-{[(4гідроксифеніл)тіо]метил}феніл)-4а,6а-диметил4а,4b,5,6,6а,6b,9а,10,10а,10b,11,12-додекагідро2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он; Cl C2 S S S or S or * S or OH * SCH3 * or * або S O S S or * SCH3 * , SCH3 * (13) S or or S 95861 * * or (11) * S or UA O HO S or (19) (21) a201004781 (22) 17.11.2008 (24) 12.09.2011 (86) PCT/IB2008/054801, 17.11.2008 (31) 60/991,354 (32) 30.11.2007 (33) US (31) 61/057,241 S S or (32) 30.05.2008 or or (33) US * * * * (31) 61/079,555 SCH3 (32) 10.07.2008 (33) US (46) 12.09.2011, Бюл.№ 17, 2011 р. (72) ҐЛОССОП ПОЛ АЛАН, GB, МІЛЛАН ДЕЙВІД S САЙМОН, GB, ПРАЙС ДЕЙВІД ЕНТОНІ, US OH S or OH or (73) ПФАЙЗЕР ЛІМІТЕД, GB or * * (56) US 3 197 * 469 A WO 2005/028495 A1 RAVIKUMAR K. S. ET AL.: "A Selective Conversion of Sulfide to Sulfoxide in Hexafluoro-2-propanol" TETRAHEDRON LETTERS, 1998, vol. 39, no. 20, pages 3141-3144 (57) 1. Сполука формули (І): HO R1 O 3 (4aS,4bR,5S,6aS,6bS,8R,9aR,10aS,10bS,12S)4b,12-дифлуор-6b-гліколоїл-5-гідрокси-4а,6адиметил-8-(4-{[3(метилсульфініл)феніл]тіо}феніл)4a,4b,5,6,6a,6b,9a,10,10a,10b,11,12-додекагідро2Н-нафто-[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он та (4aS,4bR,5S,6aS,6bS,8R,9aR,10aS,10bS,12S)-8-(4{[(3-хлор-4-гідроксифеніл)тіо]метил}феніл)-4b,12дифлуор-6b-гліколоїл-5-гідрокси-4а,6а-диметил4а,4b,5,6,6а,6b,9a,10,10a,10b,11,12-додекагідро2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он. 3. Фармацевтична композиція, що містить ефективну кількість сполуки формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятну сіль або фармацевтично прийнятний сольват вказаної сполуки або солі та один або більше фармацевтично прийнятних наповнювачів. 4. Сполука формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі для застосування як медикаменту. 5. Сполука формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі для застосування у лікуванні хвороб, розладів та станів, в яких бере участь глюкокортикоїдний рецептор. 6. Сполука формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі для застосування у лікуванні хвороб, розладів та станів, вибраних з групи: хвороби шкіри, як-то екзема, псоріаз, дерматит, свербіж та реакції гіперчутливості; запальні стани носа, горла та легень, як-то риніт, синусит, астма, назальні поліпи, хронічна обструктивна хвороба легень (COPD) та фіброз; запальні хвороби кишечнику, як-то запальна хвороба кишечнику, хвороба Крона та виразковий коліт; та автоімунні хвороби, як-то ревматоїдний артрит; та очні стани, як-то кон'юнктивіт. 7. Застосування сполуки формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату вказаної сполуки або солі для виробництва ліків для лікування хвороб, розладів та станів, в яких бере участь глюкокортикоїдний рецептор. 8. Застосування сполуки формули (І) за будь-яким з пп. 1 або 2 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату вказаної сполуки або солі для виробництва ліків для лікування хвороб, розладів та станів, вибраних з групи за п. 6. 9. Комбінація сполуки за будь-яким з пп. 1 або 2 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату вказаної сполуки або солі з іншими терапевтичними агентами, вибраними з групи: (a) інгібітори 5-ліпоксигенази (5-LO) або антагоністи білка активування 5-ліпоксигенази (FLAP), (b) антагоністи лейкотриєну (LTRA), у тому числі антагоністи LTB4, LTC4, LTD4 та LTE4, (c) інгібітори лейкотриєн-С4-синтази, (d) антагоністи рецептора гістаміну, у тому числі антагоністи Н1, Н3 та Н4, 95861 4 (e) 1- та 2-адреноміметичні судинозвужувальні симпатоміметичі агенти для протизастійного застосування, (f) інгібітори PDE, наприклад інгібітори PDE3, PDE4 та PDE5, (g) теофілін, (h) натрію хромоглікат, (і) інгібітори СОХ, неселективні та селективні інгібітори СОХ-1 або СОХ-2 (NSAID), (j) антагоністи рецептора простагландину та інгібітори простагландинсинтази, як-то hPGDS, (k) антагоністи мускаринового рецептора М3 або антихолінергічні агенти, (l) 2-адреноміметики; (m) моноклональні антитіла, активні проти ендогенних прозапальних сутностей, як-то, наприклад, IgE, IL3, IL4, ІL9, IL10, IL13, IL17A, GMCSF та їх рецептори, (n) антипухлинні агенти фактору некрозу (aнтиTNF-), (о) інгібітори адгезії молекул, у тому числі антагоністи VLA-4, (р) антагоністи рецептора кінін-В1 та -В2, (q) імунодепресанти, у тому числі інгібітори шляху метаболізму IgE та циклоспорин, (r) інгібітори матриксних металопротеаз (ММР), якто, наприклад, ММР9 та ММР12, (s) агоністи рецептора тахікініну NK1, NK2 та NK3, (t) інгібітори протеази, як-то інгібітори еластази, зокрема інгібітори нейтрофілеластази, (u) А2а-агоністи рецептора аденозину та А2bантагоністи, (v) інгібітори урокінази, (w) сполуки, що діють на рецептори допаміну, якто D2-агоністи, (х) модулятори шляху метаболізму NF, як-то інгібітори ІКК, (у) модулятори шляхів передачі сигналів цитокіну, як-то МАР-кіназа р38, РІ3-кінази, JAK-кінази, sykкіназа, EGFR, МК-2, fyn-кінази або ІТК, (z) агенти, що можна класифікувати як муколітики або засоби проти кашлю, (аа) агенти, які посилюють або повторно сенсибілізують реакції на інгаляційні кортикостероїди, як-то, наприклад, аналоги маколіду та інгібітори РІ3К або АКТ1,2,3, (bb) антибіотики та антивірусні агенти, ефективні проти мікроорганізмів, які можуть колонізувати респіраторний тракт, (сс) активатори HDAC, (dd) антагоністи CXCR1, CXCR2 та CXCR3, (ее) антагоністи інтегрину, (ff) хемокіни та агоністи рецепторів хемокінів, (gg) блокатори епітеліального каналу натрію (ENaC) або інгібітори епітеліального каналу натрію (ENaC), (hh) блокатори іонного каналу CRAC або інгібітори CRAC, (іі Р2Y2-агоністи та інші агоністи нуклеотидного рецептора, (jj) антагоністи Р2Х7, (kk) інгібітори VAP1, (ll) інгібітори тромбоксану, (mm) ніацин, та 5 95861 (nn) фактори адгезії, у тому числі VLAM, ІСАМ та ELAM. 10. Фармацевтична композиція за п. 3, яка додатково містить ще один терапевтично активний агент. 11. Фармацевтична композиція за п. 10, де вказаним іншим терапевтично активним агентом є 2адреноміметики. 12. Фармацевтична композиція за п. 10, де вказаним іншим терапевтично активним агентом є антихолінергічний агент. 13. Фармацевтична композиція за п. 3, яка додатково містить 2-адреноміметики та антихолінергічний агент. 14. Спосіб отримання сполуки формули (І) за будьяким з пп. 1 або 2, за яким здійснюють взаємодію формули (II): HO 6 OR3 O OH HO OR2 H F H O , ( IV) F , (IV) де R2 та R3 - форміл, з відповідним альдегідом формули (IIа): R1 O (ІІа) або з відповідним еквівалентом альдегіду формули (IIb): R1 O OH HO H OH HO H F O , ( II ) F (ІІ) , ( IIb ) , (IIb) де R1 визначено за п. 1. 15. Спосіб отримання сполуки формули (І) за будьяким з пп. 1 або 2, де R1 має формулу: HO O F O O * S CH3 O H , ( III ) F + S O H O O Na або формули (III): HO S O , за яким сполуки формули (І) за будь-яким з пп. 1 1 або 2, де R має формулу: , (ІІІ) S або формули (IV): * S CH3 , окиснюють. Заявлений винахід стосується нових агоністів глюкокортикоїдних рецепторів та їх фармацевтично прийнятних солей або фармацевтично прийнятних сольватів вказаних агоністів глюкокортикоїдних рецепторів або солей, способів та інтермедіатів для їх отримання. Заявлений винахід також стосується фармацевтичних композицій, що містять ці сполуки, їх комбінації з одним або більше іншими терапевтичними агентами, а також їх застосування для лікування ряду запальних та алергічних хвороб, розладів та станів. Агоністи глюкокортикоїдних рецепторів є потужними антизапальними ліками, що є необхідними для лікування багатьох запальних та імунологічних розладів. Перші сполуки, уведені у терапію, були похідними природного кортикостероїду гідрокортизону. Перші структурні модифікації серцевинної молекули призначалися для збільшення селективності до глюкокортикоїду 7 95861 відносно мінералокортикоїдного рецептору. На основі кращого розуміння співвідношень структура-активність, наступна генерація сполук виявляла вищі афінності стосовно рецептору та таким чином вищу ефективність. Для місцево застосовуваних глюкокортикоїдів, наступний прогрес було досягнуто націлюванням ліків, наприклад, інгаляцією або нанесення препаратів кортикостероїду на шкіру. Сучасні розробки сфокусовані на найбільш можливому зменшенні шкідливої дії уведенням метаболічно лабільних функціональних груп в активну молекулу для мінімізації системного піддавання дії після місцевого застосування. Високу афінність до терапевтичної цільової тканини вважають якістю, що посилює цільову ефективність та тривалість дії, в той час обмежуючи цільову системну дію уповільненням перерозподілу у системний кровообіг. Агоністи глюкокортикоїдних рецепторів застосовують у лікуванні запальних та алергічних розладів, як-то, астма, обструктивні хвороби дихальних шляхів, риніт, запальна хвороба кишечнику, псоріаз, екзема тощо. Приклади наявних у продажу глюкокортикоїдів охоплюють: HO O CH2CH2CH3 O 8 F S O O HO O H F CH2CH3 H O F Флутиказон пропіонат (Фловент, Флоназ) Ці сполуки зв'язуються з глюкокортикоїдними рецепторами та активують їх у багатьох типах клітин. Активований рецептор зв'язується з елементами чутливості на глюкокортикоїді у ядрах, активуючи або інгібуючи транскрипцію генів, що мають ключові регуляторні функції. Зокрема, ці сполуки є ефективними при запальних хворобах запобіганням поповнення запальних лейкоцитів, як-то еозинофіли та нейтрофіли, до зон запалення, а також інгібування утворення та вивільнення запальних медіаторів від лейкоцитів та клітин тканин. Відтоді запропоновано ряд кортикостероїди, що мають відмінні структури, як-то, наприклад, сполуки, які описані у WО05/028495 формули: H HO O O Будезонід (Ринокорт, Пульмікорт) O O - - O H O HO O O Циклезонід (Авеско) де може бути подвійним зв'язком, R1 та R2 можуть бути F, R3 може бути ОН, R4 може бути Н, а R5 може бути С5-10 арил, котрий може бути, як варіант, заміщеним фенілом, вказаний феніл, як варіант, заміщений алкілом, алкоксилом або галогеном. Однак, існує необхідність у поліпшених агоністах глюкокортикоїдних рецепторів, що мають найбільш прийнятний фармакологічний профіль, наприклад, у термінах потужності, терапевтичного індексу, фармакокінетики, взаємодій ліки/ліки та/або побічної дії. У цьому контексті запропоновано сполуку формули (І): 9 95861 10 де R1 вибрано з групи: HO R1 O O HO O H F H O F (І) or * * * S or S or S S SCH3 OH O S or OH * * Cl де * – точка приєднання R1 до карбона фенільного цикла; або її фармацевтично прийнятну сіль чи фармацевтично прийнятний сольват вказаної сполуки або солі. Згідно із першим втіленням підгрупа агоністів глюкокортикоїдних рецепторів формули (Іа): HO R1 O O HO O H F H O F (Іа) де R1 вибрано з групи: or * * S or OH * де * – точка приєднання R1 до карбона фенільного цикла; або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват вказаної сполуки або солі, є кращою. S or S * SCH3 S O S or OH * Cl Заявлений винахід тому стосується нижченаведених кращих сполук: (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-8-(4-бензилфеніл)-4b, 12-дифлуор-6bгліколоїл-5-гідрокси-4а, 6а-диметил-4а, 4b, 5, 6, 6а, 11 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро-2Ннафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он; (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-4b,12-дифлуор-6b-гліколоїл-5-гідрокси-4а, 6адиметил-8-(4-{[3-(метилтіо)феніл]тіо}феніл)-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он; (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-4b, 12-дифлуор-6b-гліколоїл-5-гідрокси-8-(4{[(4-гідроксифеніл)тіо]метил}феніл)-4а, 6адиметил-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро-2Н-нафто[2',1':4,5]індено[1,2d][1,3]діоксол-2-он; (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-4b, 12-дифлуор-6b-гліколоїл-5-гідрокси-4а, 6а-диметил-8-(4-{[3(метилсульфініл)феніл]тіо}феніл)-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро-2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он; та (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-8-(4-{[(3-сhlоrо-4-гідроксифеніл)тіо] метил}феніл)-4b, 12-дифлуор-6b-гліколоїл-5-гідрокси4а, 6а-диметил-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро-2Н-нафто[2',1':4,5]індено[1,2d][1,3]діоксол-2-он. Наступним кращим агоністом глюкокортикоїдного рецептору заявленого винаходу є (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-4b, 12дифлуор-6b-гліколоїл-5-гідрокси-4а, 6а-диметил-8 95861 12 (4-{[3-(метилтіо)феніл]тіо}феніл)-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро-2Ннафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он. Ще одним кращим агоністом глюкокортикоїдного рецептору заявленого винаходу є (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-4b, 12дифлуор-6b-гліколоїл-5-гідрокси-8-(4-{[(4гідроксифеніл)тіо]метил}феніл)-4а, 6а-диметил-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12додекагідро-2Н-нафто[2',1':4,5]індено[1,2d][1,3]діоксол-2-он. Ще одним кращим агоністом глюкокортикоїдного рецептору заявленого винаходу є (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-8-(4-{[(3сhlоrо-4-гідроксифеніл) тіо]метил}феніл)-4b, 12дифлуор-6b-гліколоїл-5-гідрокси-4а, 6а-диметил4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12додекагідро-2Н-нафто[2',1':4,5]індено[1,2d][1,3]діоксол-2-он. Сполуки формули (І) заявленого винаходу можна отримувати різними шляхами звичайними способами, як-то нижченаведеними ілюстративними способами, у котрих R1 заздалегідь визначено для сполуки формули (І), якщо не визначено інше. Але спеціалісту ясно, що інші шляхи можуть бути однаковою мірою реальними. Сполуки формули (І) можна отримувати за нижченаведеною схемою 1: 13 95861 Схема 1 14 SCHEME 1 HO HO O O O OH HO H F HO O OH H H F O R1 F (II) R1 F O (III) H O + (IIa) O or Na + + R1 (IIa) or R1 HO HO (IIb) O S O Na + O S O O (IIb) O OR3 HO R1 O O OH O HO HO OR2 H F F H R1 O F (IV) + O H H O (I) F O (IIa) or R1 HO Na + O S O O За схемою 1 сполуки формули (І) можна отримувати реакцією сполуки формули (ІІ) з придатним альдегідом формули (ІІа) або з придатним еквівалентом альдегіду формули (ІІb). Реакцію зручно проводити з надлишком альдегіду або еквіваленту альдегіду, або стехіометричною кількістю альдегіду або еквіваленту альдегіду у присутності кислоти, як-то алкілсульфонової кислоти (наприклад, трифлуорметансульфонової кислоти), у присутності придатного розчиннику (наприклад, ацетонітрил, етиленгліколю диметил-етер, 1,4-діоксан або дихлорметан), як варіант, у присутності сушильного агенту (як-то магній сульфат або натрій сульфат), та при зовнішній температурі або зменшеній температурі. Сполуку формули (ІІ) можна отримувати реакцією сполуки формули (ІІІ) відомими у літературі способами (наприклад, Frіеd, J. US 3,177,231 (1965)) або обробкою водною гідрофлуорборатною кислотою при зовнішній температурі або підвищеній температурі, як-то 40 °C. (IIb) Альтернативно, сполуку формули (І), де R1 має формулу: S * S O можна також отримувати реакцією сполуки 1 формули (І) де R має формулу: S * S з придатним окисником. Реакцію зручно проводити з невеликим надлишком окиснику, як-то гідроген пероксид, у присутності придатного розчиннику (наприклад, гексафлуорізопропанолу), та при зовнішній температурі або зменшеній темпе 15 95861 ратурі (дивись Теt. Lеtt., 39, 3141-3144, J.Р. Веguе еt аl, 1998). Сполуки формули (І) можна також отримувати реакцією сполуки формули (ІІІ) з придатним альдегідом формули (ІІа) або з придатним еквівалентом альдегіду формули (ІІb). Реакцію зручно проводити з надлишком альдегіду або еквіваленту альдегіду, або стехіометричною кількістю альдегіду або еквіваленту альдегіду у присутності кислоти (як-то, наприклад, трифлуорметансульфонової кислоти або перхлоратної кислоти); у присутності придатного розчиннику (як-то, наприклад, ацетонітрил або 1,4-діоксан); як варіант, у присутності добавки (як-то, наприклад, пісок) та при зовнішній температурі або зменшеній температурі. Сполуки формули (І) можна також отримувати реакцією сполуки формули (ІV) де R2 та R3 визначені як форміл, з придатним альдегідом формули (ІІа) або з придатним альдегідом еквівалент формули (ІІb) відомими у літературі способами (наприклад, WО2005/028495). Сполуки формули (ІV) де R2 та R3 визначені як форміл, можна отримувати реакцією сполуки формули (ІІІ) відомими у літературі способами (наприклад, WО2005/028495). Сполука формули (ІІІ) є у продажу. Згідно заявленого винаходу, "придатний альдегід" означає альдегід формули (ІІа): R1 O (ІІа) де R1 заздалегідь визначено для сполуки формули (І). Іншими словами, придатний альдегід заявленого винаходу вибрано з групи: 4-Бензилбензальдегід формули (Vа): 16 S (VIIIa) O S O або 4-{[(3-хлор-4гідроксифеніл)тіо]метил}бензальдегід формули (ІХа): S O (IXa) Cl OH Альтернативно, "придатний еквівалент альдегіду" означає сполуку формули (ІІb): R1 HO Na O S O + O (ІІb) котра є "бісульфітним адуктом", де R1 визначено заздалегідь для сполуки формули (І). Іншими словами, придатний еквівалент альдегіду заявленого винаходу вибрано з групи: Натрій гідроксил(бензилфеніл)метансульфонат формули (Vb): (Vb) HO (Va) O O S O 4-{[3-(Метилтіо)феніл]тіо}бензальдегід формули (VІа): S (VIa) Na + O Натрій гідрокси(4-{[3(метилтіо)феніл]тіо}феніл)метансульфонат (VІb): S O HO S (VIb) O S O 4-{[(4-Гідроксифеніл)тіо]метил}бензальдегід формули (VІІа): Na S O (VIIa) + S O Натрій гідроксил(4-{[(4гідроксифеніл)тіо]метил}феніл)метансульфонат формули (VІІb): S HO OH 4-{[3-(Метилсульфініл)феніл]тіо}бензальдегід формули (VІІІа): Na + (VIIb) O S O O OH 17 95861 Натрій гідрокси(4-{[4(метилсульфініл)феніл]тіо}феніл)метансульфонат формули (VІІІb): S (VIIIb) HO Na + S O S O O O або Натрій (4-{[(3-хлор-4гідроксифеніл)тіо]метил}феніл)(гідрокси) метансульфонат формули (ІХb): S HO Na + (IXb) O S O O Cl OH Вищезгадані альдегіди або еквіваленти альдегіду є у продажу або їх можна легко отримувати звичайними способами, добре відомими спеціалісту. Для деяких етапів вищеописаного способу отримання сполук формули (І), може бути необхідним захищати можливі реакційні функціональні групи, що не повинні реагувати, та відтинати вказані захисні групи. У такому випадку можна застосовувати будь-який сумісний захисний радикал. Зокрема, можна застосовувати способи захисту та зняття захисту, як-то описані Т.W. GRЕЕNЕ (Рrоtесtіvе Grоuрs іn Оrgаnіс Sуnthеsіs, А. WіlеуІntеrsсіеnсе Рublісаtіоn, 1981) або Р. J. Косіеnskі (Рrоtесtіvе Grоuрs, Gеоrg Тhіеmе Vеrlаg, 1994). Усі з вищенаведених реакцій та нових вихідних матеріалів, застосовуваних у попередніх способах, є звичайними, та прийнятні реагенти та реакційні умови для їх виконання або отримання, а також способи виділення потрібних продуктів є добре відомими спеціалістам з літератури та прикладів. Також, сполуки формули (І), а також інтермедіати для їх отримання можна очищати добре відомими способами, як-то, наприклад, кристалізацією або хроматографією. Фармацевтично прийнятні солі сполук формули (І) охоплюють солі їх основ. Придатні солі основ утворюють з основ, котрі утворюють нетоксичні солі. Приклади охоплюють солі алюмінію, аргініну, бензатину, кальцію, холіну, діетиламіну, діоламіну, гліцину, лізину, магнію, меглуміну, оламіну, калію, натрію, трометаміну та цинку. Фармацевтично прийнятні солі сполук формули (І) можуть також зрештою охоплювати солі їх кислот. Гемісолі кислот та основи можна також утворювати, наприклад, гемісульфатні та гемікальцієві солі. Для огляду придатних солей, дивись Наndbооk оf Рhаrmасеutісаl Sаlts: Рrореrtіеs, Sеlесtіоn, та Usе bу Stаhl та Wеrmuth (Wіlеу-VСН, 2002). 18 Фармацевтично прийнятні солі сполук формули (І) можна отримувати одним або більше з трьох способів: (і) реакцією сполуки формули (І) з потрібною кислотою або основою; (іі) усуненням кислотно- або основно-лабільної захисної групи з придатного попереднику формули (І) або розкриттям циклу придатного циклічного попереднику, наприклад, лактону або лактаму, застосовуючи потрібну кислоту або основу; або (ііі) перетворенням одної солі сполуки формули (І) у ще одну реакцією з прийнятною кислотою або основою або за допомогою придатної іонообмінної колонки. Усі три реакції звичайно проводять у розчині. Утворену сіль можна осаджувати та збирати фільтруванням або можна отримувати випарюванням розчиннику. Ступінь іонізації утвореної солі може варіювати від повністю іонізованої до майже неіонізованої. Сполуки винаходу можуть існувати у станах від повністю аморфного до повністю кристалічного. Термін "аморфний" стосується стану, у котрому матеріал втрачає дальній порядок на молекулярному рівні та, залежно від температури, може виявляти фізичні властивості твердого матеріалу або рідини. Звичайно такі матеріали не дають особливих рентгенодифрактограм та, виявляючи властивості твердого матеріалу, більш формально описуються як рідина. При нагріванні відбувається зміна властивостей від твердого матеріалу до рідини, що характеризується зміною стану, звичайно другого порядку („скловання‟). Термін "кристалічний" стосується твердої фази, у котрій матеріал має регулярні впорядковані внутрішні структури на молекулярному рівні та дає особливу рентгенодифрактограму з визначеними піками. Такі матеріали при достатньому нагріванні також виявлятимуть властивості рідини, але зміна від твердого матеріалу до рідини характеризується фазовою зміною, звичайно першого порядку („точка плавлення‟). Сполуки винаходу та солі їх мож також існувати у несольватованій та сольватованій формі. Термін "сольват" застосовують тут для опису молекулярного комплекса, що містить сполуку винаходу та одну або більше молекул фармацевтично прийнятного розчиннику, наприклад, етанолу. Термін "гідрат" застосовують, коли вказаним розчинником є вода. Сучасною класифікаційною системою для органічних гідратів є система, що визначає гідрати ізольованої ділянки, канальні, або координовані біля іона металу гідрати - дивись Роlуmоrрhіsm іn Рhаrmасеutісаl Sоlіds К. R. Моrrіs (Еd. Н. G. Вrіttаіn, Маrсеl Dеkkеr, 1995). Гідратами ізольованої ділянки є гідрати, у котрих є ізольованими від безпосереднього контакту проміжними органічними молекулами. У канальних гідратах молекули води лежать у каналах решітки, де вони є разом з іншими молекулами води. У координованих біля іона металу гідратах, молекули води є зв'язаними з іоном металу. 19 Коли розчинник або вода є щільно зв'язаними, комплекс матиме добре визначену стехіометрію незалежно від вологості. Коли, однак, розчинник або вода є слабко зв'язаними, як у канальних сольватах та гігроскопічних сполуках, вміст води/розчиннику буде залежним від вологості та умов сушки. У таких випадках нестехіометрія буде нормою. Також охоплено рамками винаходу багатокомпонентні комплекси (інші, ніж солі та сольвати), де ліки та принаймні один інший компонент є у стехіометричній або нестехіометричній кількості. Комплекси цього типу охоплюють клатрати (комплекси включення лікихазяйн) та співкристали. Останні є звичайно визначеними як кристалічні комплекси нейтральних молекулярних складових, що є зв'язаними разом нековалентними взаємодіями, але можуть також бути комплексом нейтральної молекули із сіллю. Співкристали можна отримувати перекристалізацією з розплаву, перекристалізацією з розчинників, або розмеленням компоненти разом - дивись Сhеm Соmmun, 17, 1889-1896, bу О. Аlmаrssоn та М. J. Zаwоrоtkо (2004). Для загального огляду багатокомпонентних комплексів, дивись J Рhаrm Sсі, 64 (8), 1269-1288, Наlеblіаn (Аugust 1975). Сполуки винаходу можуть також існувати у мезоморфному стані (мезофаза або рідкий кристал)у придатних умовах. Мезоморфний стан є проміжним між кристалічним станом та рідким станом (розплав або розчин). Мезоморфізм є результатом зміни температури і описаний як "термотропний", що утворений від додавання другого компоненту, як-то вода або ще один розчинник, і описан як "ліотропний". Сполуки, що мають можливість утворювати ліотропні мезофази, є описаними як "амфіфільні" та складаються з молекул, котрі мають іонні (як-то + - + + СОО Nа , -СОО К , або -SО3 Nа ) або неіонні (як-то - + -N N (СН3)3) полярні групи. Для більшого інформування, дивись Сrуstаls та Роlаrіzіng th Місrоsсоре bу N. Н. Наrtshоrnе та А. Stuаrt, 4 Еdіtіоn (Еdwаrd Аrnоld, 1970). Далі усі посилання на сполуки винаходу охоплюють посилання на їх солі, сольвати, багатокомпонентні комплекси та рідкі кристали та на сольвати, багатокомпонентні комплекси та рідкі кристали їх солей. Сполуки винаходу охоплюють сполуки формули (І), у тому числі усі їх поліморфи та кристалічні структури, їх проліки та ізомери (у тому числі оптичні, геометричні та таутомерні ізомери), які далі визначено, та мічені ізотопами сполуки формули (І). Як вказано, так звані "проліки" сполук винаходу також охоплено рамками винаходу. Таким чином, певні похідні сполук формули (І), котрі також мають малу або не мають фармакологічної активності самі по собі, можуть, при введенні в або на організм, бути перетворені на сполуки формули (ІІ), що мають необхідну активність, наприклад, гідролітичним відщепленням. Такі похідні мають назву «проліки».Наступне інформування на 95861 20 застосування проліків мож бути знайдене у Рrоdrugs аs Nоvеl Dеlіvеrу Sуstеms, Vоl. 14, АСS Sуmроsіum Sеrіеs (Т. Ніguсhі та W. Stеllа) та Віоrеvеrsіblе Саrrіеrs іn Drug Dеsіgn, Реrgаmоn Рrеss, 1987 (Еd. Е. В. Rосhе, Аmеrісаn Рhаrmасеutісаl Аssосіаtіоn). Проліки згідно з винаходом можна, наприклад, отримувати заміщенням прийнятних функціональних груп у сполуках формули (І) певними групами, відомими як "прогрупи" як описано, наприклад, у Dеsіgn оf Рrоdrugs bу Н. Вundgааrd (Еlsеvіеr, 1985). Деякі приклади проліків згідно з винаходом охоплюють ті, де сполука формули (І) містить спиртову функціональну групу (-ОН), її етер, наприклад, сполука, де гідроген спиртової функціональної групи сполуки формули (І) заміщують (С1С6)алканоїлоксиметилом. Наступні приклади заміщення груп згідно з вищезгаданими прикладами та прикладами інших типів проліків можна знайти у вищезгаданих посиланнях. Більш того, певні сполуки формули (І) можуть самі діяти як проліки інших сполук формули (І). Також охоплено рамками винаходу метаболіти сполук формули (І), що є сполуками, утвореними іn vіvо при застосуванні ліків. Деякі приклади метаболітів згідно з винаходом охоплюють нижченаведені: (i) , де сполука формули (І) містить метил, його гідроксиметильне похідне (-СН3 -СН2ОН); (ii) де сполука формули (І) містить феніл, його фенольне похідне (-Рh -РhОН); та (iii) де сполука формули (І) містить сульфід, його сульфоксидне похідне (-SРh -S(О)Рh). Сполуки формули (І), що містять один або більше асиметричних атомів карбону, можуть існувати як два або більше стереоізомерів. Коли структурні ізомери є взаємозамінюваними внаслідок низького енергетичного бар'єру, може відбуватися таутомерна ізомерія („таутомерія‟). Це може мати форму протонної таутомерії у сполуках формули (І), що містять, наприклад, іміно, кето, або оксимогрупу, або так званої валентної таутомерії у сполуках, що містять ароматичну групу. Звідси одна сполука може виявляти більше, ніж один тип ізомерії. Охоплені рамками винаходу усі стереоізомери, геометричні ізомери та таутомерні форми сполук формули І, у тому числі сполуки, виявляючі більше, ніж один тип ізомерії, та суміші одної або більше їх. Також охоплені кислото-адитивні солі або солі основ, де протийон є оптично активним, наприклад, d-лактат або lлізин, або рацемічним, наприклад, dl-тартрат або dl-аргінін. Звичайні способи отримання/виділення індивідуальних енантіомерів охоплюють хіральний синтез з придатного оптично чистого попереднику або розділення рацемату (або рацемату солі або похідного), наприклад, хіральною високоефективною рідинною хроматографією (ВЕРХ). Альтернативно, рацемат (або рацемічний попередник) може реагувати з придатною оптично активною сполукою, наприклад, спиртом, або у випадку, де сполука формули (І) містить кислотну 21 або основну групу, основою або кислотою, як-то 1фенілетиламін або винна кислота. Утворену діастеремерну суміш можна розділяти хроматографією та/або фракційною кристалізацією, та один або обидва діастереоізомери перетворувати у відповідні чисті енантіомери засобами, добре відомими спеціалісту. Хіральні сполуки винаходу (та їх хіральні попередники) можна отримувати у енантіомернозбагаченій формі, застосовуючи хроматографію, звичайно ВЕРХ, на асиметричній смолі з мобільною фазою, що складається з вуглеводню, звичайно гептану або гексану, що містить від 0 до 50 об% ізопропанолу, звичайно від 2 % до 20 %, та від 0 до 5 об% алкіламіну, звичайно 0,1 % діетиламіну. Концентрація елюату дає збагачену суміш. Коли будь-який рацемат кристалізується, кристали двох відмінних типів є можливими. Першим типом є рацемічна сполука (рацемат), де одну гомогенну форму кристалу отримують, що містить обидва енантіомери в еквімолярній кількості. Другим типом є рацемічна суміш або конгломерат, де дві форми кристалу отримують з еквімолярною кількістю кожного одиничного енантіомеру. Тоді як обидві кристалічні форми у рацемічній суміші мають ідентичні фізичні властивості, вони можуть мати відмінні фізичні властивості порівняно з рацематом. Рацемічні суміші можна розділяти звичайними відомими способами дивись, наприклад, Stеrеосhеmіstrу оf Оrgаnіс Соmроunds Е. L. Еlіеl та S. Н. Wіlеn (Wіlеу, 1994). Заявлений винахід стосується усіх фармацевтично прийнятних мічених ізотопами сполук формули (І), де один або більше атомів заміннено на атоми, що мають те ж атомне число, але атомну масу або масове число, відмінні від атомної маси або масового числа, що переважають у природі. Приклади ізотопів, придатних для уведення у сполуки винаходу, охоплюють ізотопи гідрогену, 2 3 11 13 14 як-то Н та Н, карбону, як-то С, С та С, хлору, 36 18 123 125 як-то Сl, флуору, як-то F, йоду, як-то І та І, 13 15 15 17 нітрогену, як-то N та N, оксигену, як-то О, О 18 32 35 та О, фосфору, як-то Р, та сульфуру, як-то S. Певні мічені ізотопами сполуки формули (І), наприклад, сполуки з радіоактивним ізотопом, є корисними у дослідженнях ліків та/або розподілу субстратів у тканині. Радіоактивн ізотопи тритій, 3 14 тобто Н, та карбон-14, тобто С, є особливо корисними для цього внаслідок легкості їх уведення та засобів визначення. Заміщення важчими ізотопами, як-то дейтерій, 2 тобто Н, може давати певні терапевтичні переваги внаслідок більшої метаболічної стабільність, наприклад, збільшеного іn vіvо періоду напіввиведення або зменшеної потреби дозування, та звідси можуть бути кращими у деяких обставинах. Заміщення ізотопами, що емітують позитрон, 11 18 15 13 як-то С, F, О та N, може бути корисним у позитронній еміссійнній томографії (РЕТ) для дослідження займання рецепторів убстрату. 95861 22 Мічені ізотопами сполуки формули (І) можна загалом отримувати звичайними відомими способами або способами, аналогічними описаним у прикладах та отриманнях, застосовуючи прийнятний мічений ізотопами реагент замість заздалегідь застосовуваного неміченого реагенту. Фармацевтично прийнятні сольвати згідно з винаходом охоплюють ті, де розчинник кристалізації може бути заміщеним ізотопом, наприклад, D2О, d6-ацетон, d6-ДМСО. Сполуки формули (І) слід оцінювати на їх біофармацевтичні властивості, як-то розчинність та стабільність у розчині (при різних рН), проникність, тощо, для вибору найбільш прийнятної форми дози та шляху застосування для лікування гаданих показань. Сполуки винаходу, призначені для фармацевтичного застосування, можна застосовувати як кристалічні або аморфні продукти. Їх можна отримувати, наприклад, як тверді корки, порошки, або плівки способами, як-то осадження, кристалізація, сушка сублімацією, сушка розпиленням, або випарювальна сушка. Мікрохвильову або радіочастотну сушку можна застосовувати для цього. Їх можна застосовувати поодинці або у комбінації з одною або більше іншими сполуками винаходу або у комбінації з одними або більше іншими ліками (або як будь-якими їх комбінаціями). Загалом, їх застосовуватимуть як композицію в асоціації з одним або більше фармацевтично прийнятними наповнювачами. Термін "наповнювач" застосовують тут для опису будь-якого інгредієнту, іншого, ніж сполука винаходу, як-то, наприклад, розріджувачі, носії та ад'юванти. Вибір наповнювачу головним чином залежатиме від факторів, якто певний режим застосування, дія наповнювачу на розчинність та стабільність, та природа форми дози. Фармацевтичні композиції, придатні для доставляння сполук винаходу, та способи їх отримання відомі. Такі композиції та способи їх отримання можна знайти, наприклад, у Rеmіngtоn's Рhаrmасеutісаl Sсіеnсеs, 19th Еdіtіоn (Масk Рublіshіng Соmраnу, 1995). Сполуки винаходу можна застосовувати перорально. Пероральне застосування може охоплювати ковтання, так щоб сполук потрапляла у шлунково-кишковий тракт, та/або букальне, лінгвальне або сублінгвальне застосування, котрим сполука потрапляє у кровообіг безпосередньо з роту. Композиції, придатні для перорального застосування, охоплюють тверді, напівтверді та рідкі системи, як-то таблетки; м'які або тверді капсули, що містять макрочастинки або наночастинки, рідини, або порошки; пастилки (у тому числі заповнені рідиною); жуйки; гелі; швидко дисперсивні форми доз; плівки; спреї; та букальні/слизоадгезивні пластири. Рідкі композиції охоплюють суспензії, розчини, сиропи та еліксири. Такі композиції можна застосовувати як наповнювачі у м'яких або твердих капсулах (наприклад, з желатину або гідроксипропілметилцелюлози) та звичайно містять носій, як-то, вода, етанол, поліетиленгліколь, пропіленгліколь, метилцелюлоза, або придатна олія, та один або 23 більше емульгаторів та/або суспендувальних агентів. Рідкі композиції можна також отримувати розбавленням твердого матеріалу, наприклад, з пакетику. Сполуки винаходу можна також застосовувати у швидкорозчинних, швидкорозпадних формах доз, як-то описаних у Ехреrt Оріnіоn іn Тhеrареutіс Раtеnts, 11 (6), 981-986, Lіаng та Сhеn (2001). Для таблеток, залежно від дози, ліки можуть складати 1-80 мас% форми дози, більш звичайно 5-60 мас% форми дози. На додаток до ліків таблетки загалом містять дезинтегратор. Приклади дезинтеграторів охоплюють натрій-гліколят крохмалю, натрій-карбоксиметилцелюлозу, кальційкарбоксиметилцелюлозу, натрій-кроскармелозу, кросповідон, полівінілпіролідон, метилцелюлозу, мікрокристалічну целюлозу, заміщену нижчим алкілом гідроксипропілцелюлозу, крохмаль, прежелатинізований крохмаль та натрій альгінат. Загалом, дезинтегратор містить 1-25 мас%, переважно 5-20 мас% форми дози. Зв'язуючі загалом застосовують для зчеплення до композиції таблеток. Придатні зв'язуючі охоплюють мікрокристалічну целюлозу, желатин, цукри, поліетиленгліколь, природні та синтетичні камеді, полівінілпіролідон, прежелатинізований крохмаль, гідроксипропілцелюлозу та гідроксипропілметилцелюлозу. Таблетки можуть також містять розріджувачі, як-то лактоза (моногідрат, висушений розпиленням моногідрат, безводний тощо), манітол, ксилітол, декстроза, сахароза, сорбітол, мікрокристалічна целюлоза, крохмаль та двоосновний кальцій фосфат дигідрат. Таблетки можуть також, як варіант, містити поверхнево-активні агенти, як-то натрій лаурилсульфат та полісорбат 80, та гліданти, як-то силіцій діоксид та тальк. При наявності поверхневоактивні агенти можуть складати 0,2-5 мас% таблетки, та гліданти можуть складати 0,2-1 мас% таблетки. Таблетки також загалом містять лубриканти, як-то магній стеарат, кальцій стеарат, цинк стеарат, натрій стеарилфумарат, та суміші магній стеарату із натрій лаурилсульфатом. Лубриканти загалом містять 0,25-10 мас%, переважно 0,5-3 мас% таблетки. Інші можливі інгредієнти охоплюють антіоксиданти, барвники, ароматизатори, консерванти та смакомаскувальні агенти. Зразкові таблетки містять приблизно до 80 % ліків, приблизно 10-90 мас% зв'язуючого, приблизно 0-85 мас% розріджувачу, приблизно 2-10 мас% дезинтегратору та приблизно 0,25-10 мас% лубриканту. Таблеткові суміші можна пресувати безпосередньо або валком для утворення таблетки. Таблеткові суміші або частини сумішей можуть альтернативно бути вологими, сухими, або гранульованими з розплаву, замороженими з розплаву, або видавленими перед таблетуванням. Кінцева композиція може містити один або більше шарів та може бути покритою або непокритою; вона може навіть бути інкапсульованою. 95861 24 Склад таблеток обговорено у Рhаrmасеutісаl Dоsаgе Fоrms: Таblеts, Vоl. 1, Н. Lіеbеrmаn та L. Lасhmаn (Маrсеl Dеkkеr, Nеw Yоrk, 1980). Витратні пероральні плівки для застосування для людини або ветеринарного застосування є звичайно поступливими водорозчинними або водонабрякаючими тонкими плівками, котрі можуть бути швидко розчинними або слизоадгезивними та звичайно містять сполуку формули І, плівкотвірний полімер, зв'язуюче, розчинник, зволожувач, пластифікатор, стабілізатор або емульгатор, модифікатор в'язкості та розчинник. Деяк компоненти композиції можуть виконувати більше, ніж одну функцію. Сполука формули (І) може бути водорозчинною або нерозчинною. Водорозчинна сполук звичайно містить 1-80 мас%, більш звичайно 20-50 мас%, розчинених речовин. Менш розчинні сполуки можуть містити більшу частину композиції, звичайно до 88 мас% розчинених речовин. Альтернативно, сполука формули (І) може бути у вигляді кульок з великої кількості частинок. Плівкотвірний полімер може бути вибраним з природних полісахаридів, білків, або синтетичних гідроколоїдів та є звичайно у межах 0,01-99 мас%, більш звичайно у межах 30-80 мас%. Інші можливі інгредієнти охоплюють антіоксиданти, барвники, ароматизатори та ароматизатори, консерванти, слинні стимулятори, охолоджувачі, співрозчинники (у тому числі оливи), пом'якшувачі, наповнювачі, антиспінювачі, ПАР та смакомаскувальні агенти. Плівки згідно з винаходом звичайно отримують випарювальною сушкою тонких водних плівок, на легковідокремлюваній несній підкладці або папері. Це можна робити у сушильній шафі, звичайно комбінованій сушарці, або сушкою сублімацією або вакуумуванням. Тверді композиції для перорального застосування можна формувати для негайного та/або модифікованого вивільнення. Композиції з модифікованим вивільненням охоплюють затримане, безперервне, імпульсне, контрольоване, цільове та програмоване вивільнення. Придатні композиції з модифікованим вивільненням для мети винаходу є описаними у патенті США № 6,106,864. Деталі інших придатних способів вивільнення, як-то високоенергетичні дисперсії та осмотичні та покриті частки можна знайти у Рhаrmасеutісаl Тесhnоlоgу Оn-lіnе, 25(2), 1-14, bу Vеrmа еt аl (2001). Застосування жуйки для досягнення контрольованого вивільнення описано у WО 00/35298. Сполуки винаходу можна також уводити безпосередньо у кровообіг, у м'язи, або у внутрішній орган. Придатні засоби для парентерального застосування охоплюють внутрішньовенні, інтраарттеріальні, інтраперитонеальні, інтратекальні, інтравентрикулярні, інтрауретральні, інтрастернальні, інтракраніальні, внутрішньом'язові, інтрасиновіальні та підшкірні. Придатні пристрої для парентерального застосування охоплюють голкові (у тому числі 25 мікроголкові) ін'єктори, безголкові ін'єктори та способи вливання. Парентеральні композиції є звичайно водними розчинами, котрі можуть містити наповнювачі, якто солі, вуглеводи та буфери (переважно до рН 39), але для деяких застосувань їх можна більш відповідно формувати як стерильний неводний розчин або у висушеній формі для застосування разом з придатним носієм, як-то стерильна, вода без пірогену. Отримання парентеральних композицій у стерильних умовах, наприклад, ліофілізацією, можна легко досягти, звичайними відомими фармацевтичними способами. Розчинність сполук формули (І) у препаратах парентеральних розчинів можна збільшити застосуванням прийнятних способів композиції, якто уведення агентів, що посилюють розчинність. Композиції для парентерального застосування можна формувати для негайного та/або модифікованого вивільнення. Композиції з модифікованим вивільненням охоплюють затримане, безперервне, імпульсне, контрольоване, цільове та програмоване вивільнення. Таким чином сполуки винаходу можна формувати як суспензію або як тверді, напівтверді або тиксотропн рідкі продукти для застосування як імплантованого депо, забезпечуючи модифіковане вивільнення активної сполуки. Приклади таких композицій охоплюють покриті ліками стенти та напівтверді матеріали та суспензії, що містять завантажені ліками полі(dlмолочна-співгліколева)кислота (РGLА) мікросфери. Сполуки винаходу можна також застосовувати місцево, інтрадермально або трансдермально до шкіри або слизової. Типові композиції для цієї мети охоплюють гелі, гідрогелі, лосьйони, розчини, креми, мазі, антисептичні порошки, матеріали для перев'язування, пінки, плівки, шкірні пластири, облатки, імплантати, тампони, волокна, перев'язки та мікроемульсії. Ліпосоми можна застосовувати також. Типові носії охоплюють спирт, воду, мінеральну оливу, рідкий вазелін, білий вазелін, гліцерин, поліетиленгліколь та пропіленгліколь. Можна уводити посилювачі проникності - дивись, наприклад, J Рhаrm Sсі, 88 (10), 955-958, bу Fіnnіn та Моrgаn (Осtоbеr 1999). Інші засоби місцевого застосування охоплюють уведення електропорацією, іонофорезом, фонофорезом, сонофорезом та мікроголковою або безголковою (наприклад, Роwdеrjесt™, Віоjесt™, тощо) ін'єкцією. Композиції для місцевого застосування можна формувати для негайного та/або модифікованого вивільнення. Композиції з модифікованим вивільненням охоплюють затримане, безперервне, імпульсне, контрольоване, цільове та програмоване вивільнення. Сполуки винаходу можна також застосовувати інтраназально або інгаляцією, звичайно у формі сухого порошку (будь-як поодинці, як суміш, наприклад, у сухій суміші з лактозою, або як частку змішаних компонентів, наприклад, змішаною з фосфоліпідами, як-то фосфатидилхолін) з інгалятору 95861 26 для сухого порошку, як аерозоль з контейнеру під тиском, насос, спрей, пульверизатор (переважно пульверизатор, що застосовує електрогідродинамічні пристрої для отримання якісного туману), або розпилювач, із застосуванням чи ні придатного пропеленту, як-то 1,1,1,2-тетрафлуоретан або 1,1,1,2,3,3,3-гептафлуорпропан, або як назальні краплі. Для інтраназального застосування, порошок може містити біоадгезивний агент, наприклад, хітозан або циклодекстрин. Контейнер під тиском, насос, спрей, пульверизатор, або розпилювач містить розчин або суспензію сполуки винаходу, що містить, наприклад, етанол, водний етанол, або придатний альтернативний агент для диспергування, розчинення, або пролонгування вивільнення активного інгредієнту, пропеленти як розчинник та довільну ПАР, як-то сорбітан триолеат, олеїнова кислота або олігомолочна кислота. Перед застосуванням у композиції сухого порошку чи суспензії, ліки мікронізують до розміру, придатного для доставляння інгаляцією (звичайно менше, ніж 5 мікрон). Це може бути досягнутим будь-яким прийнятним способом подрібнення, якто спіральне струминне розмелення, розмелення у псевдозрідженому шарі, надкритична рідинна обробка для утворення наночасток, гомогенізація під високим тиском, або сушка розпиленням. Капсули (наприклад, з желатину або гідроксипропілметилцелюлози), блістери та картриджі для застосування в інгаляторах або апараті для вдування можна формувати з вмістом порошкової суміші сполуки винаходу, придатної порошкової основи, як-то лактоза або крохмаль та модифікатор вироблення, як-то l-лейцин, манітол, або магній стеарат. Лактоза може бути безводною або у формі моногідрату, переважно останнього. Інші придатні наповнювачі охоплюють декстран, глюкозу, мальтозу, сорбітол, ксилітол, фруктозу, сахарозу та трегалозу. Придатна композиція розчину для застосування у пульверизаторі, застосовуючи електрогідродинамічні пристрої для отримання якісного туману, може містити від 1 мкг до 20 мг сполуки винаходу на спрацьовання та об'єм спрацьовання може варіювати від 1 мкл до 100 мкл. Типова композиція може містити сполуку формули І, пропіленгліколь, стерильну воду, етанол та натрій хлорид. Альтернативні розчинники, котрі можна застосовувати замість пропіленгліколю, охоплюють гліцерин та поліетиленгліколь. Придатні ароматизатори, як-то ментол та левоментол, або замінники цукру, як-то сахарин або натрій-сахарин, можна додавати до композицій винаходу, призначених для інгаляції/інтраназального застосування. Композиції для інгаляції/інтраназального застосування можна формувати для негайного та/або модифікованого вивільнення, застосовуючи, наприклад, РGLА. Композиції з модифікованим вивільненням охоплюють затримане, безперервне, імпульсне, контрольоване, цільове та програмоване вивільнення. У випадку інгаляторів сухого порошку та аерозолів, дозована одиниця визначається клапаном, 27 котрий постачає виміряну кількість. Одиниці згідно з винаходом звичайно регулюють для застосування виміряної дози або "вприскування", що містить від 0,001 мг до 10 мг сполуки формули (І). Загальна добова доз звичайно є у межах 0,001 мг – 40 мг, що можна застосовувати одиничною дозою або, більш звичайно, як поділені дози протягом доби. Сполуки винаходу можна застосовувати ректально або вагінально, наприклад, у формі супозиторію, песарію, або клізми. Масло какао є традиційною основою супозиторію, але застосовувати як прийнятні різні альтернативи можна. Композиції для ректального/вагінального застосування можна формувати для негайного та/або модифікованого вивільнення. Композиції з модифікованим вивільненням охоплюють затримане, безперервне, імпульсне, контрольоване, цільове та програмоване вивільнення. Сполуки винаходу можна також застосовувати безпосередньо до очей або вух, звичайно у формі крапель мікронізованої суспензії або розчину в ізотонічному, рН-доведеному, стерильному фізіологічному розчині. Інші композиції, придатні для очного та вушного застосування охоплюють мазі, гелі, біорозкладні (наприклад, тампони із всмоктуваним гелем, колаген) та біонерозкладні (наприклад, силікон) імплантати, облатки та сипучі або везикулярні системи, як-то ніосоми або ліпосоми. Полімер, як-то перехресно зв'язана поліакрилова кислот, полівініловий спирт, гіалуронова кислота, полімер целюлози, як-то, гідроксипропілметилцелюлоза, гідроксіетилцелюлоза чи метилцелюлоза, або гетерополісахаридний полімер, як-то, геланова смола, можна уводити разом консервантом, якто бензалконій хлоридом. Такі композиції можуть також бути доставленими іонофорезом. Композиції для очного/вушного застосування можна формувати для негайного та/або модифікованого вивільнення. Композиції з модифікованим вивільненням охоплюють затримане, безперервне, імпульсне, контрольоване, цільове або програмоване вивільнення. Сполуки формули (І) заявленого винаходу є особливо придатними для назального застосування, інгаляцією та місцевого застосування. Сполуки винаходу можуть бути комбінованими з розчинними макромолекулярними речовинами, як-то циклодекстрин та його придатні похідні або поліетиленгліколь-вмісні полімери, для поліпшення їх розчинності, швидкості розчинення, смакомаскувальності, біозасвоюваності та/або стабільності для застосування у будь-якому вищезгаданих режимів застосування. Комплекси ліки-циклодекстрин, наприклад, є знайденими як загалом корисні для більшості форм доз та шляхів застосування. Комплекси включення та невключення можна застосовувати. Як альтернативу до безпосереднього комплексоутворення з ліками як добавку можна застосовувати циклодекстрин, тобто як носій, розріджувач або солюбілізатор. Найбільш часто застосовуваними для цієї мети є альфа-, бета- та гаммациклодекстрини, приклади котрих можна знайти у 95861 28 міжнародній патентній заявці № WО 91/11172, WО 94/02518 та WО 98/55148. Оскільки може бути бажаним застосування комбінації активних сполук, наприклад, для лікування певної хвороби або розладу, у рамках винаходу дві або більше фармацевтичні композиції, принаймні одна з котрих містить сполуку згідно з винаходом, можна зручно комбінувати у формі комплекту, придатного для співзастосування композицій. Таким чином комплект винаходу містить дві або більше окремі фармацевтичні композиції, принаймні одна з котрих містить сполуку формули (І) згідно з винаходом, та засоби для окремого зберігання вказаних композиції, як-то контейнер, поділений флакон, або поділений пакет з фольги. Прикладом такого комплекту є блістерна упаковка для упаковки таблеток, капсул тощо. Комплект винаходу є особливо придатним для застосування відмінних форм доз, наприклад, пероральної та парентеральної, для застосування окремих композицій при відмінних інтервалах дозування, або для титрування окремої композиції проти ще одної. Для зручності комплект звичайно містить інструкції для застосування. Для застосування до пацієнтів, загальна добова доза сполук винаходу є звичайно у межах 0,001 мг – 5000 мг, переважно у межах 0,01 мг – 1000 мг, залежно, безумовно, від режиму застосування. Наприклад, пероральне застосування або внутрішньовенне, внутрішньом'язове, внутрішньосуглобове або навколосуглобове застосування може потребувати загальної добової дози від 0,01 мг до 1000 мг, переважно від 0,01 мг до 100 мг. Загальну добову дозу можна застосовувати одиничною або поділеними дозами та можна, на розсуд лікаря, виходити за надані тут типові межі. Ці дози розраховані на середню людину, що має масу приблизно 60-70 кг. Лікар легко визначеить дози для суб'єктів, чия маса виходить за ці типові межі, як-то діти та літні люди. Для уникнення сумнівів, посилання у цій заявці на "лікування" охоплюють посилання на цілюще, паліативне та профілактичне лікування. Сполуки формули (І) мають здатність взаємодіяти з глюкокортикоїдним рецептором та мають широкі межі терапевтичного застосування, як описано далі, внаслідок суттєвої ролі, котру глюкокортикоїдний рецептор грає у фізіології усіх ссавців. Таким чином винахід стосується сполук формули (І), або їх фармацевтично прийнятних солей або фармацевтично прийнятних сольватів вказаних сполук або солей, для застосування у лікуванні або запобіганні хвороб, розладів та станів, у котрих приймає участь глюкокортикоїдний рецептор. Винахід крім того стосується застосування сполук формули (І), або їх фармацевтично прийнятних солей або фармацевтично прийнятних сольватів вказаних сполук або солей, для виробництва медикаменту для лікування хвороб, розладів та станів, у котрих глюкокортикоїдний рецептор приймає участь. Винахід також стосується способу лікування ссавця, у тому числі людини, агоністом глюкокортикоїдного рецептору у тому числі ліку 29 вання вказаного ссавця ефективною кількістю сполуки формули (І) або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату вказаної сполуки або солі. Приклади таких хвороб, розладів та станів охоплюють хвороби шкіри, як-то екзема, псоріаз, дерматит, свербіж та реакції гіперчутливості; запальні стани носа, горла та легень, як-то риніт, синусит, астма, назальні поліпи, хронічна обструктивна хвороба легень (СОРD) та фіброз; запальні хвороби кишковику, як-то запальна хвороба кишечнику, хвороба Крона та виразковий коліт; автоімунні хвороби, як-то ревматоїдний артрит; розсіяний склероз та дисемінований червоний вовчак; очні стани, як-то неінфекційне запалення (кон'юнктивіт). Сполуки можуть також мати застосування при раку (наприклад, гліоми та рак простати), синдром набутого імунодефіциту, остеоартрит, септичний шок, відторгнення трансплантату, емфізема (особливо у пацієнтів, що мають СОРD), постішемічні ураження, гіпертензія легень, гострий респіраторний дистрес-синдром, запобігання рестенозу після коронарної ангіопластики, синдром Стевенса-Джонсона, НЕLLР-синдром (варіант суворої предеклампсії), пневмонія, хронічний активний гепатит, гематологічні розлади, ниркова хвороба та гостре поранення спинного мозку. Більш конкретно, сполуки заявленого винаходу є корисними для лікування хвороб шкіри, як-то екзема, псоріаз, дерматит, свербіж та реакції гіперчутливості; запальні стани носа, горла та легень, як-то риніт, синусит, астма, назальні поліпи, хронічна обструктивна хвороба легень (СОРD) та фіброз легень; запальні хвороби кишковику, як-то запальна хвороба кишечнику, хвороба Крона та виразковий коліт; та автоімунні хвороби, як-то ревматоїдний артрит; та очні стани, як-то кон'юнктивіт. Більш конкретно, заявлений винахід також стосується сполук формули (І), або їх фармацевтично прийнятних солей або фармацевтично прийнятних сольватів вказаних сполук або солей, для застосування у лікуванні хвороб, розладів та станів, вибраних з групи: - хвороби шкіри будь-якого типу, етіології або патогенезу, зокрема, екзема, псоріаз, алергічний дерматит, нейродерматит, свербіж та реакції гіперчутливості; - очні стани, як-то неінфекційні очні запалення (кон'юнктивіт); - сезонний алергічний риніт чи цілорічний алергічний риніт або синусит будь-якого типу, етіології або патогенезу, зокрема, синусит, вибрана з групи: гнійний або негнійний синусит, гострий або хронічний синусит та решітчастий, фронтальний, щелепний або сфеноїдний синусит; - астма будь-якого типу, етіології або патогенезу, зокрема, астма, вибрана з групи: атопічна астма, неатопічна астма, алергічна астма, атопічна бронхіальна опосередкована lgЕ астма, бронхіальна астма, есенціальна астма, справжня астма, притаманна астма, викликана патофізіологічними порушеннями, набута астма, викликана зовнішніми факторами, есенціальна астма невідомої або нез'ясованої причини, неатопічна астма, бронхітна 95861 30 астма, емфізематозна астма, викликана фізичними вправами астма, викликана алергеном астма, викликана холодним повітрям астма, професійна астма, інфекційна астма, викликана бактеріальною, грибковою, протозойною або вірусною інфекцією, неалергічна астма, астма, що починається, синдром хрипкості дитини та бронхіоліт; - обструктивні або запальні хвороби дихальних шляхів будь-якого типу, етіології або патогенезу, зокрема, обструктивна або запальна хвороба дихальних шляхів, вибрана з групи: хронічна еозинофільна пневмонія, хронічна обструктивна хвороба легень (СОРD), СОРD, а саме хронічний бронхіт, емфізема легень або задишка, асоційована або не асоційована з СОРD, СОРD, що характеризується незворотною, поступовою обструкцією дихальних шляхів, респіраторний дистрессиндром дорослих (АRDS), загострення гіперреактивності дихальних шляхів після терапії іншими ліками та хвороба дихальних шляхів, що асоційована з гіпертензією легень; - назальні поліпи будь-якого типу, етіології або патогенезу; - фіброз будь-якого типу, етіології або патогенезу, зокрема, фіброз легень, асоційований з запальною хворобою дихальних шляхів; - запальні хвороби кишковику будь-якого типу, етіології або патогенезу, зокрема, хвороба Крона та виразковий коліт; - автоімунні хвороби будь-якого типу, етіології або патогенезу, зокрема, ревматоїдний артрит, розсіяний склероз, та дисемінований червоний вовчак, Навіть більш конкретно, сполуки заявленого винаходу є корисними для лікування вибраного з групи: астма, СОРD, алергічний риніт, назальні поліпи, хвороба Крона, екзема та псоріаз. Згідно з ще одним втіленням винаходу, сполуки винаходу, або їх фармацевтично прийнятні солі або фармацевтично прийнятні сольвати вказаних сполук або солей, можна також застосовувати як комбінацію з одним або більше додатковими терапевтичними агентами для співзастосування до пацієнта для отримання певного особливо потрібного терапевтичного кінцевого результату, як-то способи лікування патофізіологічно доречних хвороб а саме, але без обмеження (і) бронхостеноз, (іі) запалення, (ііі) алергія, (іv) руйнування тканин, (v) ознаки та симптоми, як-то порушення дихання, кашель. Другий та більше додаткових терапевтичних агентів можуть також бути сполукою формули (І), або її фармацевтично прийнятною сіллю або фармацевтично прийнятним сольватом вказаної сполуки або солі, або одним або більше з відомих агоністів глюкокортикоїдних рецепторів. Більш звичайно, другий та більше додаткових терапевтичних агентів вибрано з відмінного класу терапевтичних агентів. Як застосовувано тут, терміни "співзастосування", "співзастосуваний" та "у комбінації з", стосуються сполуки винаходу та одного або більше інших терапевтичних агентів та не стосуються нижченаведеного: - одночасне застосування такої комбінації сполук формули (І) та терапевтичних агентів до паціє 31 нта при потребі лікування, коли такі компоненти формують разом у форму одиничної дози, котра вивільняє вказані компоненти по суті одночасно, - по суті одночасне застосування такої комбінації сполук формули (І) та терапевтичних агентів до пацієнта при потребі лікування, коли такі компоненти формують окремо від кожного іншого в окремі форми доз, котрі вказаний пацієнт приймає по суті одночасно, внаслідок чого вказані компоненти вивільняються по суті одночасно, - послідовне застосування такої комбінації сполук формули (І) та терапевтичних агентів до пацієнта при потребі лікування, коли такі компоненти формують окремо від кожного іншого в окремі форми доз, котрі вказаний пацієнт приймає послідовно зі значним інтервалом часу між кожним застосуванням, внаслідок чого вказані компоненти вивільняються по суті у відмінний час; та - послідовне застосування такої комбінації сполук формули (І) та терапевтичних агентів до пацієнта при потребі лікування, коли такі компоненти формують разом у форму одиничної дози, котра вивільняє вказані компоненти контрольованим чином внаслідок чого вони одночасно, послідовно, та/або сумісно застосовуються вказаним пацієнтом у той же та/або відмінний час, де кожну частину можна застосовувати будьяким тим же або відмінним шляхом. Придатні приклади інших терапевтичних агентів, котрі можна застосовувати у комбінації із сполуками винаходу, або їх фармацевтично прийнятними солями або фармацевтично прийнятними сольватами вказаних сполук або солей, охоплюють, але без обмеження: (a) інгібітори 5-ліпоксигенази (5-LО) або антагоністи білку активування 5-ліпоксигенази (FLАР), (b) антагоністи лейкотриєну (LТRА) у тому числі антагоністи LТВ4, LТС4, LТD4, та LТЕ4, (c) Інгібітори лейкотриєн-С4-синтази, (d) антагоністи рецептору гістаміну у тому числі антагоністи Н1, Н3 та Н4, (e) 1- та 2-адреномиметики судинозвужувальні симпатоміметичі агенти для протизастійного застосування, (f) інгібітори РDЕ, наприклад, інгібітори РDЕ3, РDЕ4 та РDЕ5, (g) Теофілін, (h) Натрій хромоглікат, (i) інгібітори СОХ, неселективні та селективні інгібітори СОХ-1 або СОХ-2 (NSАІD), (j) Антагоністи рецептору простагландину та інгібітори простагландин-синтази, як-то hРGDS, (k) Антагоністи мускаринового рецептору М3 або антихолінергічні агенти, (l) -адреномиметики; (m) Моноклональні антитіла, активні проти ендогенних прозапальних сутностей, як-то, наприклад, ІgЕ, ІL3, ІL4, ІL9, ІL10, ІL13, ІL17А, GМСSF та їх рецептори, (n) Антипухлинні агенти фактору некрозу (антиТNF-), (o) Інгібітори адгезії молекул у тому числі антагоністи VLА-4, (p) антагоністи рецептору кінін-В1 - та В2, 95861 32 (q) Імунодепрессанти, у тому числі інгібітори шляху метаболізму ІgЕ та циклоспорин, (r) Інгібітори матриксних металопротеаз (ММР), як-то, наприклад, ММР9 та ММР12, (s) агоністи рецептору тахікініну NК1, NК2 та NК3, (t) інгібітори протеази, як-то інгібітори еластази, зокрема, інгібітори нейтрофіл-еластази, (u) А2а-агоністи рецептору аденозину та А2bантагоністи, (v) Інгібітори урокінази, (w) Сполуки, що діють на рецептори допаміну, як-то D2-агоністи, (x) Модулятори шляху метаболізму NF((, як-то інгібітори ІКК, (y) модулятори шляхів передачі сигналів цитокіну, як-то МАР-кіназа р38, РІ3-кінази, JАК-кінази, sуk-кіназа, ЕGFR, МК-2, fуn-кінази або ІТК, (z) Агенти, що можна класифікувати як муколітики або засоби проти кашлю, (aa) Агенти, котрі посилюють або повторно сенсибілізують реакції на інгаляційні кортикостероїди, як-то, наприклад, аналоги маколіду та інгібітори РІ3К( або АКТ1,2,3, (bb) Антибіотики та антивірусні агенти, ефективні проти мікроорганізмів, котрі можуть колонізувати респіраторний тракт, (cc) активатори НDАС, (dd) антагоністи СХСR1, СХСR2 та СХСR3, (ee) антагоністи інтегрину, (ff) хемокіни та агоністи рецептору хемокіну, (gg) блокатори епітеліального каналу натрію (ЕNаС) або інгібітори епітеліального каналу натрію (ЕNаС), (hh) блокатори іонного каналу СRАС або інгібітори СRАС, (ii) Р2Y2-агоністи та інші агоністи нуклеотидного рецептору, (jj) антагоністи Р2 × 7, (kk) Інгібітори VАР1, (ll) Інгібітори тромбоксану, (mm) ніацин, та (nn) фактори адгезії у тому числі VLАМ, ІСАМ, та ЕLАМ. Згідно із заявленим винаходом комбінація сполуки формули (І) з нижченаведеним: - агоністи мускаринового рецептору М3 або антихолінергічні агенти у тому числі, наприклад, солі іпраторію, а саме бромід, солі тіотропію, а саме бромід, солі окситропію, а саме бромід, солі троспію, солі аклидинію, перензепін, та телензепін, - 2-адреномиметики у тому числі, наприклад, ефедрин, адреналін, ізопреналін, метапротеренол, фенілефрин, фенілпропаноламін, пірбутерол, репротерол, римітерол, ізоетарин, толобутерол, кармотерол, албутерол, тербуталін, бамбутерол, фенотерол, салбутамол, тулобутерол, формотерол, салметерол та агоністи, описані у WО 05/080313, WО 05/080324, WО 05/092840 та WО2007/010356; - інгібітори РDЕ4, зокрема, інгаляційні інгібітори РDЕ4, - Теофілін, 33 95861 - Антагоністи рецептору гістаміну у тому числі антагоністи Н1 та Н3, наприклад, лоратидин та метапірилен; або - А2а-агоністи рецептору аденозину, наприклад, описані у WО01/94368 є кращими. Згідно з кращим аспектом сполуки винаходу можуть бути комбінованими з ще одним терапевтичним агентом, вибраним з 2-адреномиметиків та антихолінергічних агентів. Ще один кращий аспект охоплює потрійну комбінацію сполуки заявленого винаходу разом з 2-адреномиметиками та антихолінергічним агентом. Нижченаведені необмежувальні приклади ілюструють винахід: Фіг. 1/6: ДСК-термограма з прикладу 1 Фіг. 2/6: Ретгенодифрактограма з прикладу 1 Фіг. 3/6: ДСК-термограма з прикладу, 2 Фіг. 4/6: Ретгенодифрактограма з прикладу 2 Фіг. 5/6: ДСК-термограма з прикладу 5 Фіг. 6/6: Ретгенодифрактограма з прикладу 5 Протоколи Для усіх прикладів нижченаведених, були застосовуваними наступні експериментальні умови: Диференційна сканувальна калориметрія (ДСК) Диференційну сканувальну калориметрію виконували, застосовуючи прилад ТА Іnstrumеnt Q1000 ДСК у чашках з алюмінію з ковпаками. Приблизно 3 мг зразків нагрівали при 20 °C на хвилину у межах 10 °C – 250 °C або 10 °C – 300 °C або 20 °C – 300 °C, залежно від зразків, з продувкою азотом. Спосіб рентгенодифракції від порошку (РХRD) Рентгенодифрактограму від порошку визначали, застосовуючи рентгенодифрактометр для порошку Вrukеr-АХS Ltd. D4 з автоматичним зразків перемикачем, гоніометром тета-тета, автоматичною щілиною розходження променя, та детектором РSD Vаntес-1. Зразок отримували для аналізу монтуванням на пластину із силіцій із заглибленням та низьким фононом. Зразок обертали. опромінюючи рентгенопроменями К-альфа1 міді (довжина хвилі = 1,5406 ангстрем) рентгенотрубкою при 40 кВ/35 мА. Аналізи виконували гоніометром у безперервному режимі протягом 0,2 с підрахунку на крок 0,018° у межах 2-тета 2° – 55°. Приклади Отримання 1 (6,11,16)-6,9-Дифлуор-11,16,17,21тетрагідроксипрегна-1,4-дієн-3,20-діон HO 34 (4bR, 6bS, 9аR, 12S)-4b, 12-Дифлуор-6bгліколоїл-5-гідрокси-4а, 6а, 8, 8-тетраметил-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он (10,3 г, 22,76 ммоль, є у продажу) суспендували у 48 % водній гідрофлуорборатній кислоті (100 мл) та утворену суспензію перемішували при зовнішній температурі під азотом для 7 годин. Суспензію тоді розбавляли водою (200 мл), фільтрували та твердий матеріал промивали водою (500 мл). Твердий шар на фільтрі суспендували у метанолі (200 мл) та концентрували під вакуумом. Утворений твердий матеріал суспендували у трет-бутилметил-етері (150 мл), фільтрували та промивали трет-бутил-метил-етером (200 мл), отримуючи заголовну сполуку як білий твердий матеріал, 95 % виходу, 8,9 г. 1 Н ЯМР г (400 МГц, ДМСО-d6) : 0,82 (s, 3Н), 1,46 (s, 3Н), 1,31-1,51 (m, 3Н), 1,77-1,87 (m, 1Н), 2,08-2,33 (m, 3Н), 2,37-2,46 (m, 1Н), 4,08 (d, 1Н), 4,09-4,16 (m, 1Н), 4,48 (d, 1Н), 4,63 (br, 1Н), 4,75 (dd, 1Н), 5,35 (d, 1Н), 5,51-5,69 (m, 1Н), 6,08 (s, 1Н), –1 6,26 (dd, 1Н), 7,24 (dd, 1Н) млн . РХ-МС (ІЕР): m/z 411 [М-Н] Отримання 2 4-Бензилбензальдегід O Бензилбромід (41 г, 240 ммоль), 4формілбензенборонову кислоту (28 г, 186,7 ммоль), паладій тетракістрифенілфосфін (7,9 г, 6,84 ммоль) та калій карбонат (84,7 г, 613 ммоль) комбінували у тетрагідрофурані (620 мл) та нагрівали при 80 °C під азотом протягом 8 годин. Утвореній суспензії давали охолонути до зовнішньої температури та перемішували протягом ночі. Реакційну суміш виливали у 10 % лимонну кислоту (50 мл) та екстрагували етилацетатом (3-кратно 50 мл). Комбіновані органічні екстракти промивали розсолом (100 мл) та сушили (магній сульфат) та розчинник видаляли під вакуумом. Утворену оливу очищали колонковою хроматографією на силікагелі, елюючи етилацетатом:гептаном, (0:1 зміна до 1:5, за об'ємом), отримуючи заголовну сполуку як безбарвну оливу, 83 % виходу, 30,45 г. 1 Н ЯМР г (400 МГц, СDСl3) : 4,06 (s, 2Н), 7,38–1 7,17 (m, 7Н), 7,83-7,79 (m, 2Н), 9,97 (s, 1Н) млн . + РХ-МС (ІЕР): m/z 197 [М+Н] Отримання 3 4-{[3-(Метилтіо)феніл]тіо}бензальдегід S O O OH HO OH H F O F H S Розчин 3-(метилтіо)бензентіолу (19,9 г, 127,3 ммоль), отриманий як вказано у Rumрf, Р., Вull. sос. сhіm. (1940), 7, рр. 632-4, в ацетонітрилі (60 мл) обробляли 4-флуорбензальдегідом (13,4 мл, 127 ммоль), а потім калій карбонатом (19,4 г, 140 ммоль). Після перемішування при зовнішній тем 35 пературі протягом 18 годин суспензію розбавляли водою (200 мл) та екстрагували етилацетатом (3кратно 300 мл). Комбіновані органічні екстракти промивали розсолом (2-кратно 100 мл) та сушили (магній сульфат) та розчинник видаляли під вакуумом, отримуючи безбарвну оливу. Сиру оливу очищали колонковою флеш-хроматографією на силікагелі, елюючи гептаном:етилацетатом (1:0 зміна до 9:1, за об'ємом), отримуючи заголовну сполуку як безбарвну оливу, 33 % виходу, 10,8 г. 1 Н ЯМР г (400 МГц, СDСl3) : 2,48 (s, 3Н), 7,25–1 7,34 (m, 5Н), 7,38 (m, 1Н), 7,73-7,75 (d,2Н) млн . + РХ-МС (АРІ): m/z 261 [М+Н] Отримання 4 4-{[(4-Гідроксифеніл)тіо]метил}бензальдегід S O OH Розчин 4-бромметилбензальдегіду (0,3 г, 1,5 ммоль) та 4-гідрокситіофенолу (0,2 г, 1,5 ммоль) у 1,4-діоксані (10 мл) дегазували та обробляли триетиламіном (0,44 мл, 3,11 ммоль). Після перемішування протягом 1 доби суміш розбавляли водою (20 мл) та екстрагували етилацетатом (2кратно 20 мл). Комбіновані органічні екстракти промивали розсолом та сушили (натрій сульфат) та розчинник видаляли під вакуумом. Сирий матеріал очищали колонковою флеш-хроматографією на силікагелі, елюючи гептаном:етилацетатом (9:1 змін до 0:1, за об'ємом), отримуючи заголовну сполуку як твердий матеріал, 62 % виходу, 220 мг. 1 Н ЯМР г (400 МГц, ДМСО-d6) : 4,01 (s, 2Н), 6,66 (d, 2Н), 7,13 (d, 2Н), 7,38 (d, 2Н), 7,77 (d, 2Н), –1 9,54 (s, 1Н), 9,93 (s, 1Н) млн . РХ-МС (ІЕР): m/z 243 [М-Н] Отримання 5 3-хлор-4-гідроксифенілтіоціанат OH NC S Cl Триметилсиліл ізотіоціанат (24,5 г, 187 ммоль) у гексафлуорізопропанолі (10 мл) додавали краплями до охолодженого льодом розчину 2хлорфенолу у гексафлуорізопропанолі (30 мл). Реакційну суміш перемішували протягом 10 хвилин та тоді додавали краплями [Біс(трифлуорацетокси)йод]бензен (60,2 г, 140 ммоль), тримаючи внутрішню температуру нижче 5С. Після повного додавання реакційну суміш перемішували протягом 4 годин при 5-10С, та тоді концентрували під вакуумом, отримуючи жовтий твердий матеріал. Це переносили у дихлорметан (100 мл) та фільтрували через шар броунмілериту. Фільтрат концентрували під вакуумом, отримуючи жовту оливу, котру очищали колонковою флешхроматографією на силікагелі, елюючи дихлорметаном:гептаном (3:7 зміна до 0:1 за об'ємом), отримуючи продукт як жовтий твердий матеріал, 30 % виходу, 5,2 г. 95861 36 Н ЯМР г (400 МГц, СDСl3) : 5,99 (bs, 1Н), 7,06-7,10 (m, 1Н), 7,40-7,43 (m, 1Н), 7,59 (s, 1Н). + РХ-МС (ІЕР): m/z 186 [М+Н] Альтернативно, 3-хлор-4-гідроксифеніл тіоціанат отримували таким чином: Розчин брому (0,40 мл, 7,78 ммоль) в оцтовій кислоті (0,80 мл) додавали краплями до суспензії 2-хлорфенолу (1,00 г, 7,78 ммоль) та натрій тіоціанату (2,27 г, 28,0 ммоль) в оцтовій кислоті (6 мл). Внутрішню температуру тримали між 16 °C та 25С протягом додавання. Реакційну суміш перемішували при зовнішній температурі протягом 1 години. 30 мл води та 30 мл етилацетату тоді додавали до реакційної суміші та фільтрували через шар броунмілериту. Шари розділяли та водний шар екстрагували етилацетатом (2-кратно 30 мл). Комбіновані органічні шари сушили (магній сульфат) та концентрували під вакуумом, отримуючи оранжевий напівтвердий матеріал. Це переносили у 50 мл етилацетату та фільтрували через другий шар броунмілериту, отримуючи 1,31 г темнооранжевої оливи. Цей матеріал було застосовувано в отриманні 6 без подальшого очищення. Отримання 6 2-хлор-4-меркаптофенол 1 OH HS Cl Літій алюмогідрид (як 1М розчин у тетрагідрофурані, 71,0 мл, 71,0 ммоль) додавали краплями до охолодженого льодом розчину 3-хлор-4гідроксифенілтіоціанату (4,20 г, 22,6 ммоль) у тетрагідрофурані (100 мл) під азотом. Реакційну суміш перемішували та давали нагрітися до кімнатної температури протягом 5 годин. Суміш охолоджували до 5С та гасили 1:1 сумішшю тетрагідрофуран:вода до припинення виділення газу. 1 Н розчин хлоридної кислоти у воді (30 мл) тоді додавали, та суміш екстрагували етилацетатом (2кратно 70 мл). Комбіновані органічні шари сушили (натрій сульфат) та концентрували під вакуумом, отримуючи безбарвний кристалічний твердий матеріал, 100 % виходу, 3,60 г. 1 Н ЯМР г (400 МГц, СDСl3) : 3,42 (s, 1Н), 5,67, (bs, 1Н), 6,89-6,92 (m, 1Н), 7,13-7,16 (m, 1Н), 7,33 (s, 1Н). + РХ-МС (ІЕР): m/z 161 [М+Н] Отримання 7 4-{[(3-хлор-4гідроксифеніл)тіо]метил}бензальдегід OH S Cl OHC Триетиламін (5,0 мл, 35,9 ммоль) додавали краплями до розчину 2-хлор-4-меркаптофенолу (3,60 г, 22,4 ммоль) та 4-бромметилбензальдегіду (3,93 г, 19,7 ммоль) у діоксані (150 мл) при кімнатній температурі під азотом. Реакційну суміш перемішували при кімнатній температурі протягом 20 37 95861 годин. Воду (100 мл) додавали до реакційної суміші та тоді розподіляли між етилацетатом та розсолом (200 мл кожного). Водний шар знов екстрагували етилацетатом (100 мл). Комбіновані органічні шари сушили натрій сульфатом та концентрували під вакуумом, отримуючи жовтий твердий матеріал. Це очищали розтиранням у порошок з ацетонітрилом (5 мл/г) протягом 30 хвилин. Після фільтрування це дало світло-жовтий твердий матеріал як чистий продукт, 84 % виходу, 5,27 г. 1 Н ЯМР г (400 МГц, СDСl3) : 3,96 (s, 2Н), 5,55 (bs, 1Н), 6,82-6,86 (m, 1Н), 7,02-7,06 (m, 1Н), 7,197,23 (m, 1Н), 7,24-7,28 (m, 1Н), 7,71-7,74 (m, 2Н), 9,92 (s, 1Н). + РХ-МС (ІЕР): m/z 279 [М+Н] Отримання 8 3-(Метилтіо)бензентіол HS S Розчин бензен-1,3-дитіолу (50 г, 0,351 ммоль) у 2-метилтетрагідрофурані (375 мл, 0,351 ммоль) обробляли диметилсульфатом (33,3 мл, 0,351 моль), а потім 2-метилтетрагідрофураном (25 мл, застосовувано як серійну промивку). Утворений розчин охолоджували до 0 °C – 5 С та додавали краплями натрій гідроксид (2М водний розчин, 210,6 мл), тримаючи температуру реакційної суміші нижче 15ºС, а потім 2-метилтетрагідрофуран (25 мл, застосовувано як серійну промивку) та нагрівали під азотом до 50 ºС протягом 4 годин. Після охолодження до зовнішньої температури утворений розчин обробляли трет-бутилметилетером (500 мл) та фази розділяли. Органічну фазу екстрагували натрій гідроксидом (2 М водний розчин, 250 мл) та комбіновані водні фази охолоджували до 10ºС та додавали хлоридну кислоту (6М водний розчин, 500 мл), тримаючи температуру суміші нижче 25 ºС. Утворений розчин екстрагували третбутилметилетером (2-кратно 250 мл) та комбіновані органічні фази промивали водою (500 мл) та концентрували під вакуумом, отримуючи заголовну сполуку як жовту оливу, 78 % виходу, 42,9 г. Цей матеріал було знайдено за допомогою ВЕРХ як ідентичний матеріалу, отриманому способом Rumрf (Вull. sос. сhіm. (1940), 7, рр. 632-4). Отримання 9 Натрій гідрокси(4-{[3(метилтіо)феніл]тіо}феніл)метансульфонат S HO O S O Na + S O Розчин 3-(метилтіо)бензентіолу з отримання 8 (290 г, 1,856 моль) в ацетонітрилі (3 л) продували азотом протягом 1 години та тоді обробляли 4флуорбензальдегідом (196 мл, 1,856 моль), а по 38 тім ацетонітрилом (150 мл, застосовувано як серійну промивку). Утворений розчин обробляли 1,1",3,3‟-тетраметилгуанідином (256 мл, 2,04 моль), а потім ацетонітрилом (150 мл застосовувано як серійну промивку) та нагрівали до 50ºС під азотом протягом 16 годин. Утвореному розчину давали охолонути до зовнішньої температури та розбавляли етилацетатом (3 л) та промивали хлоридною кислотою (2М водний розчин, 1,5 л) та натрій гідрогенкарбонатом (1 М водний розчин, 3 л) та розсолом (напівнасиченим, 1,5 л). Утворений розчин концентрували відгонкою під атмосферним тиском до об'єму 2 л та розбавляли ацетонітрилом (3 л). Утворений розчин концентрували відгонкою під атмосферним тиском до об'єму 2 л та розбавляли ацетонітрилом (3 л) і концентрували відгонкою під атмосферним тиском до кінцевого об'єму 3 л. Утворений розчин охолоджували до зовнішньої температури та обробляли розчином натрій метабісульфіту (377 г, 1,982 моль) у воді (3 л). Після перемішування при зовнішній температурі протягом 48 годин утворену суспензію фільтрували та зібраний твердий матеріал промивали водою (2кратно 2,5 л) та ацетонітрилом (2-кратно 2,5 л). Твердий матеріал суспендували в ацетонітрилі (2 л) та перемішували при зовнішній температурі протягом 18 годин, після чого суспензію фільтрували та твердий матеріал промивали ацетонітрилом (2-кратно 1 л) та сушили під вакуумом при 50 ºС, отримуючи заголовну сполуку як білий твердий матеріал, 55 % виходу, 368,7 г. 1 Н ЯМР г (400 МГц, ДМСО-d6) : 2,41 (s, 3Н), 4,97 (d, 1Н), 5,90 (d, 1Н), 6,98 (m, Н), 7,12 (m, 2Н), –1 7,26 (m, 3Н), 7,46 (d, 2Н) млн . Приклад 1 (PF-4357415) (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-8-(4-Бензилфеніл)-4b,1 2-дифлуор-6bгліколоїл-5-гідрокси-4а, 6а-диметил-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро-2Ннафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он HO O O HO O H F H O F (4bR, 6bS, 9аR, 12S)-4b, 12-Дифлуор-6bгліколоїл-5-гідрокси-4а, 6а, 8, 8-тетраметил-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро2Н-нафто-[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он (8 г, 18 ммоль) та 4-Бензилбензальдегід, отриманий в отриманні 2 (10,4 г, 53 ммоль), додавали при перемішуванні до охолодженої льодом суспензії піску (80 г) у толуєні (80 мл). 70 % водну перхлоратну кислоту (4 мл, 70 ммоль) додавали краплями протягом 5 хвилин та тоді розчин перемішували при зовнішній температурі протягом 21 години. Насичений розчин натрій гідрогенкарбонату (100 мл) додавали до реакційної суміші, а потім етила 39 95861 цетат (100 мл) та розчин перемішували і тоді фільтрували. Пісок промивали насиченим розчином натрій гідрогенкарбонату (50 мл), та тоді етилацетатом (100 мл). Водний шар відділяли та екстрагували етилацетатом (2-кратно 50 мл), та комбіновані органічні екстракти промивали розсолом (100 мл) та сушили (магній сульфат) і розчинник видаляли під вакуумом. Утворену в'язку жовту оливу (10 г) розбавляли сумішшю ДХМ:етилацетат (9:1, за об'ємом), що призводило до осадження твердого матеріалу, котрий збирали фільтруванням. Після сушки твердий матеріал перекристалізовували з суміші етилацетат:гептан (4:1, за об'ємом), отримуючи білий кристалічний матеріал, 44 % виходу, 4,36g. 1 Н ЯМР г (400 МГц, ДМСО-d6) : 0,82 (s, 3Н), 1,45 (s, 3Н), 1,43-1,50 (m, 1Н), 1,62-1,71 (m, 3Н), 40 1,97-2,03 (m, 1Н), 2,16-2,30 (m, 2Н), 2,51-2,65 (m, 1Н), 3,87 (s, 2Н), 4,12-4,18 (m, 1Н), 4,15 (dd, 1Н), 4,46 (dd, 1Н), 4,91 (d, 1Н), 5,02 (t, 1Н), 5,40 (s, 1Н), 5,45 (d, 1Н), 5,51-5,69 (m, 1Н), 6,09 (s, 1Н), 6,25 –1 (dd, 1Н), 7,10-7,24 (m, 8Н), 7,29-7,32 (m, 2Н) млн . + РХ-МС (ІЕР): m/z 591 [М+Н] Зразок 1,960 мг аналізували диференційною сканувальною калориметрією (ДСК) з лінійним збільшенням від 10 °C до 300 °C при 20 °C/хвилину. ДСК-термограму показано у Фіг. 1 з рівним початком та гострим ендотермом, відповідним плавленню при 250,6 °C. Кристалічна форма, отримана описаним вище способом, також має характеристики, показані у відповідній рентгенодифрактограмі з Фіг. 2. Головні характеристичні піки є при 8,0, 16,0, 16,9, 24,0 та 24,2° 2-тета 0,1° 2-тета та надані у таблиці 1. Таблиця 1 Характеристичні рентгенодифракційні піки для прикладу 1 Інтенсивність (%) 2,4 83,6 4,0 6,9 1,6 3,6 1,4 6,8 100,0 13,8 8,2 5,0 11,4 4,2 3,3 2,7 Кут 2-Тета (° 0,1) 6,6 8,0 9,6 11,2 12,7 13,4 14,4 15,6 16,0 16,9 17,1 17,7 19,2 20,1 20,8 22,1 Приклад 2 (PF-4714224) (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-4b,12-дифлуор-6b-гліколоїл-5-гідрокси-4а, 6адиметил-8-(4-{[3-(метилтіо)феніл]тіо}феніл)-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро2Н-нафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он HO S O O HO O H F S H O F Суспензію (6, 11, 16)-6, 9-дифлуор-11, 16, 17, 21-тетрагідроксипрегна-1, 4-дієн-3, 20-діону з отримання 1 (6,6 г, 16 ммоль) та 4-{[3(метилтіо)феніл]тіо}бензальдегіду з отримання 3 (4,5 г, 17,28 ммоль) у 1,4-діоксані (70 мл) обробляли магній сульфатом (10 г, 83,1 ммоль). Суспензію Кут 2-Тета (° 0,1) 23,5 24,0 24,2 25,1 25,5 26,6 27,0 28,6 30,3 30,8 31,0 32,2 32,9 36,3 37,0 Інтенсивність (%) 3,2 16,7 25,1 3,7 2,4 3,9 3,9 3,2 3,7 3,4 4,5 3,0 4,1 2,0 2,3 охолоджували у водяній бані та додавали трифлуорметансульфонову кислоту (7,5 мл, 82 ммоль). Після перемішування при кімнатній температурі протягом 24 годин суміш розбавляли водою (200 мл) та екстрагували етилацетатом (2-кратно 200 мл). Комбіновані органічні екстракти промивали водою (200 мл) та розсолом (2-кратно 150 мл) та сушили (магній сульфат) і розчинник видаляли під вакуумом. Сиру смолу очищали колонковою флеш-хроматографією на силікагелі, елюючи гептаном:трет-бутил-метил-етером (4:1 зміна до 1:0, за об'ємом) тоді гептаном:етилацетатом (3:7 зміна до 0:1, за об'ємом), отримуючи жовту пінку. Наступна колонкова флеш-хроматографія на силікагелі, елюючи пентаном:етилацетатом (4:1 зміна до 2:3, за об'ємом) дала жовтий твердий матеріал. Цей твердий матеріал перекристалізовували з 2бутанону та тоді з ацетонітрилу, отримуючи заголовну сполуку як білий твердий матеріал, 18 % виходу, 1,93 г. 1 Н ЯМР г (400 МГц, ДМСО-d6) : 0,85 (s, 3Н), 1,43-1,53 (m, 1Н), 1,48 (s, 3Н), 1,65-1,71 (m, 3Н), 1,97-2,06 (m, 1Н), 2,14-2,31 (m, 2Н), 2,41 (s, 3Н), 2,55-2,67 (m, 1Н), 4,16-4,22 (m, 2Н), 4,49-4,55 (dd, 41 95861 1Н), 4,95 (d, 1Н), 5,09 (t, 1Н), 5,48 (s, 1Н), 5,50-5,51 (m, 1Н), 5,54-5,79 (m, 1Н), 6,10 (s, 1Н), 6,26-6,29 (m, 1Н), 7,05-7,07 (m, 1Н), 7,18-7,20 (m, 2Н), 7,237,26 (m, 1Н), 7,27-7,29 (m, 1Н), 7,31-7,33 (d, 2Н), –1 7,41-7,43 (d, 2Н) млн . + РХ-МС (ІЕР): m/z 655 [М+Н] Альтернативно, заголовну сполуку отримували таким чином: Суспензію (6, 11, 16)-6, 9-дифлуор-11, 16, 17, 21-тетрагідроксипрегна-1, 4-дієн-3, 20-діону з отримання 1 (434 г, 1,050 моль) та магній сульфату (417 г, 3,47 моль) в ацетонітрилі (4,34 л) перемішували під азотом протягом 18 годин. Натрій гідрокси(4-{[3(метилтіо)феніл]тіо}феніл)метансульфонат з отримання 9 (460 г, 1,26 моль) додавали та утворену суспензію обробляли трифлуорметансульфоновою кислотою (443 мл, 5,01 ммоль), тримаючи температуру суміші нижче 24 ºС. Після перемішування при зовнішній температурі протягом 75 хвилин суміш обробляли н-бутилацетатом (4,4 л) та водою (4,4 л) та переносили у сепаратор, застосовуючи н-бутилацетат (400 мл) як серійну промивку. Фази розділяли та органічну фазу промивали водою (4,4 л) та промивали натрій гідрогенкарбонатом (10 % водний розчин, 2-кратно 2,2 л) та промивали водою (2,2 л). Утворену суспензію фільтрували та фільтрат концентрували під вакуумом для видалення 4,26 л розчиннику. Залишку давали охолонути до 35 ºС та обробляли 2бутаноном (4 л) та давали охолонути до зовнішньої температури і перемішували протягом 18 годин. Утворену суспензію фільтрували та твердий матеріал промивали 2-бутаноном (2-кратно 2 л). Твердий матеріал суспендували в етанолі (дена 42 турованому 2-бутаноном, 8 л) та нагрівали до кипіння під зворотним холодильником протягом 10 хвилин та давали охолонути до зовнішньої температури. Утворену суспензію фільтрували та твердий матеріал промивали етанолом (денатурованим 2-бутаноном, 2-кратно 2 л) та ацетонітрилом (900 мл). Твердий матеріал суспендували в ацетонітрилі (2,6 л) та нагрівали до кипіння під зворотним холодильником та обробляли ацетонітрилом (1,3 л) та концентрували відгонкою під атмосферним тиском, видаляючи 2,7 л розчиннику. Утворену суспензію обробляли ацетонітрилом (1,75 л) та нагрівали до кипіння під зворотним холодильником та давали охолонути до зовнішньої температури. Утворену суспензію фільтрували та твердий матеріал промивали ацетонітрилом (2-кратно 450 мл) та сушили під вакуумом при 40 ºС, отримуючи заголовну сполуку як білий твердий матеріал, 37 % виходу, 307,3 г. Сполука, отримана таким чином, була ідентична сполуці, отриманій попереднім способом. Зразок 2,847 мг продукту, отриманого вищеописаним способом, аналізували диференційною сканувальною калориметрією (ДСК) з лінійним збільшенням від 10 до 300 °C при 20 °C/хвилину. Перший ендотерм спостерігали при 114,5 °C, що ймовірно відповідає забрудненню. Плавлення спостерігають при 184,8 °C. Відповідну термограму показано у Фіг. 3. Кристалічна форма, отримана описаним вище способом, також має характеристики, показані у відповідній рентгенодифрактограмі з Фіг. 4. Головні характеристичні піки є при 10,0, 16,5, 17,0, 20,0 та 25,5° 2-тета 0,1° 2-тета та надані у таблиці 2 нижче. Таблиця 2 Характеристичні рентгенодифракційні піки для прикладу 2 Кут 2-Тета (° 0,1) 8,5 10,0 12,1 12,9 13,7 14,5 16,0 16,5 17,0 17,7 19,5 20,0 20,4 Інтенсивність(%) 9,1 98,2 8,9 9,5 19,1 13,0 11,4 70,7 100,0 22,2 24,3 68,3 10,1 Приклад 3 (PF-4726447) (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-4b, 12-Дифлуор-6b-гліколоїл-5-гідрокси-8-(4{[(4-гідроксифеніл)тіо]метил}феніл)-4а, 6а Кут 2-Тета (° 0,1) 21,9 23,2 23,8 24,2 25,5 26,0 27,3 27,7 30,2 30,3 31,7 34,2 34,6 Інтенсивність(%) 20,0 14,6 30,6 9,8 43,8 12,7 13,7 15,4 20,1 22,1 10,6 14,4 12,1 диметил-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро-2Н-нафто[2',1':4,5]індено[1,2d][1,3]діоксол-2-он 43 95861 HO S O O HO O H F OH H O F Суспензію (6, 11, 16)-6, 9-дифлуор-11, 16, 17, 21-тетрагідроксипрегна-1, 4-дієн-3, 20-діону з отримання 1 (99,8 мг, 0,24 ммоль) та 4-{[(4гідроксифеніл)тіо]метил}бензальдегіду з отримання 4 (148 мг, 0,61 ммоль) у 1,4-діоксані (3 мл) сушили безводним магній сульфатом (430 мг, 3,57 ммоль) та трифлуорметансульфоновою кислотою (43 мкл, 0,49 ммоль). Після перемішування протягом 1 доби реакційну суміш фільтрували та зібраний твердий матеріал промивали етилацетатом (20 мл). Комбіновані фільтрати виливали у воду (100 мл) та екстрагували етилацетатом (3-кратно 20 мл). Комбіновані органічні екстракти промивали розсолом (50 мл) та сушили (натрій сульфат) та розчинник видаляли під вакуумом. Сирий матеріал очищали колонковою флеш-хроматографією на силікагелі, елюючи гептаном:етилацетатом (3:1 змін до 0:1, за об'ємом), отримуючи заголовну сполуку як білий твердий матеріал, 14 % виходу, 21 мг. 1 Н ЯМР г (400 МГц, ДМСО-d6) : 0,85 (s, 3Н),1,48 (s, 3Н), 1,5 (m, 1Н), 1,62-1,73 (m, 3Н), 2,012,05 (m, 1Н), 2,17-2,24 (m, 1Н), 2,25-2,31 (m, 1Н), 2,55-2,70 (m, 1Н), 4,01 (s, 2Н), 4,15-4,22 (m, 2Н), 4,50 (dd, 1Н), 4,94 (d, 1Н), 5,05 (t, 1Н), 5,43 (s, 2Н), 5,48 (m, 1Н), 5,55-5,71 (m, 1Н), 6,11 (s, 1Н), 6,28 (dd, 1Н), 6,66 (d, 2Н), 7,13 (d, 2Н), 7,24 (m, 3Н), 7,31 –1 (d, 2Н), 9,48 (s, 1Н) млн . + РХ-МС (ІЕР): m/z 639 [М+Н] Приклад 4 (PF-4786719) (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS,1 0bS, 12S)-4b, 12-дифлуор-6b-гліколоїл-5-гідрокси-4а, 6а-диметил-8-(4-{[3(метилсульфініл)феніл]тіо}феніл)-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро-2Ннафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он HO S O O HO O H F S O H O F (4аS, 4bR, 5S, 6аS ,6bS, 8R, 9аR, 10аS, 10bS,12S)-4b, 12-Дифлуор-6b-гліколоїл- 5 5-гідрокси-4а, 6а-диметил-8-(4-{[3(метилтіо)феніл]тіо}феніл)-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро-2Ннафто[2',1':4,5] 44 індено[1,2-d][1,3]діоксол-2-он з прикладу 2 (979 мг, 1,50 ммоль) суспендували у гексафлуорізопропанолі (6 мл, 57,0 ммоль) та охолоджували у льодяній бані перед додаванням краплями гідрогенпероксиду (30 % мас у воді, 203 мг, 1,79 ммоль). Реакційну суміш перемішували при зовнішній температурі протягом 90 хвилин. Реакційну суміш тоді виливали у 25 % водний розчин натрій сульфіту (30 мл). Водний шар екстрагували етилацетатом (3-кратно 50 мл) та комбіновані органічні екстракти сушили (натрій сульфат) та розчинник видаляли під вакуумом. Сирий матеріал очищали колонковою флеш-хроматографією на силікагелі, елюючи дихлорметаном:метанолом (9:1 за об'ємом), отримуючи заголовну сполуку як білий твердий матеріал, 61 % виходу, 610 мг. 1 Н ЯМР г (400 МГц, ДМСО-d6) : 0,87 (s, 3Н), 1,50 (s, 3Н), 1,47-1,59 (m, 1Н), 1,65-1,78 (m, 3Н), 2,01-2,09 (m, 1Н), 2,17-2,34 (m, 2Н), 2,58-2,71 (m, 1Н), 2,74 (m, 3Н), 4,18-4,26 (m, 2Н), 4,52-4,58 (m, 1Н), 4,98 (d, 1Н), 5,10-5,13 (m, 1Н), 5,52 (s, 1Н), 5,53-5,54 (m, 1Н), 5,58-5,78 (m, 1Н), 6,12 (s, 1Н), 6,31 (dd, 1Н), 7,27 (d, 1Н), 7,41-7,48 (m, 5Н), 7,54–1 7,64 (m, 3Н) млн . + РХ-МС (ІЕР): m/z 671 [М+Н] Приклад 5 (PF-4744055) (4аS, 4bR, 5S, 6аS, 6bS, 8R, 9аR, 10аS, 10bS, 12S)-8-(4-{[(3-хлор-4гідроксифеніл)тіо]метил}феніл)-4b, 12-дифлуор6b-гліколоїл-5-гідрокси-4а, 6а-диметил-4а, 4b, 5, 6, 6а, 6b, 9а, 10, 10а, 10b, 11, 12-додекагідро-2Ннафто[2',1':4,5]індено[1,2-d][1,3]діоксол-2-он OH HO S O Cl O HO O H F H O F Трифлуорметансульфонову кислоту (4,76 мл, 53,8 ммоль) додавали краплями до охолодженої льодом суспензії 4-{[(3-хлор-4гідроксифеніл)тіо]метил}бензальдегіду з отримання 7 (5,25 г, 18,8 ммоль), (6, 11, 16)-6, 9дифлуор-11, 16, 17, 21-тетрагідроксипрегна-1, 4дієн-3, 20-діон з отримання 1 (7,40 г, 17,9 ммоль) та магній сульфату (6,82 г, 53,8 ммоль) в ацетонітрилі (80 мл) під азотом. Реакційну суміш перемішували при 5-10С протягом 4 годин тоді виливали у лід-воду (100 мл) та екстрагували етилацетатом (3-кратно 150 мл). Комбіновані органічні шари сушили (натрій сульфат) та концентрували під вакуумом, отримуючи коричневу пінку. Це очищали колонковою флеш-хроматографією (силікагель), елюючи дихлорметаном:метанолом (100:0 зміна до 90:10 за об'ємом), отримуючи оранжеву пінку. Це крім того очищали колонковою флеш-хроматографією (силікагель), елюючи дихлорметаном:метанолом (100:0 зміна до 90:10 за об'ємом), отримуючи жовту пінку (6,0 г). Це переносили у гарячий етилацетат та засівали для оса 45 95861 дження. Твердий матеріал фільтрували та сушили, отримуючи 1,18 г блідо-жовтого твердого матеріалу. Маточник випарювали, знов переносили в етилацетат та засівали для отримання другої партії 1,46 г. Це повторювали тричі, отримуючи кінцеву партію 2,40 г. Усі три партії комбінували та розтирали у порошок у гарячому етилацетаті, фільтрували та сушили, отримуючи 3,5 г блідожовтого твердого матеріалу, 27 % виходу. 1 Н ЯМР г (400 МГц, ДМСО-d6) : 0,86 (s, 3Н), 1,50 (s, 3Н), 1,48-1,57 (m, 1Н), 1,62-1,77 (m, 3Н), 2,01-2,08 (m, 1Н), 2,18-2,33 (m, 2Н), 2,55-2,72 (m, 1Н), 4,09 (s, 2Н), 4,16-4,24 (m, 2Н), 4,48-4,55 (m, 1Н), 4,93-4,97 (m, 1Н), 5,45 (s, 1Н), 5,50-5,53 (m, 1Н), 5,55-5,61 (m, 1/2Н), 5,68-5,74 (m, 1/2Н), 6,13 46 (s, 1Н), 6,27-6,32 (m, 1Н), 6,85-6,88 (s, 1Н), 7,107,13 (m, 1Н), 7,25-7,36 (m, 1Н), 10,28 (bs, 1Н). РХ-МС (ІЕР): m/z 673 [М] Зразок 2,769 мг аналізували диференційною сканувальною калориметрією (ДСК) з лінійним збільшенням від 10 °C до 300 °C при 20 °C/хвилину. ДСК-термограму показано у Фіг. 5 з рівним початком та гострим ендотермом, відповідним плавленню, з піком при 255 °C. Кристалічна форма, отримана описаним вище способом, також має характеристики, показані у відповідній рентгенодифрактограмі з Фіг. 6. Головні характеристичні піки є при 14,1, 16,6, 20,0, 21,8 та 25,2° 2-тета 0,1° 2-тета та надані у таблиці 3 нижче. Таблиця 3 Характеристичні рентгенодифракційні піки для прикладу 5 Кут 2-Тета (° 0,1) 11,9 14,1 15,3 15,5 16,6 18,3 20,0 20,3 21,4 21,8 22,4 22,6 23,1 24,5 25,2 25,4 26,8 Інтенсивність(%) 37,4 100,0 10,8 32,0 88,7 39,5 57,6 18,8 14,5 49,3 30,4 33,1 42,4 27,0 70,8 20,1 30,8 Приклад 6: Фармакологічна активність іn vіtrо Фармакологічну активність сполук формули (І) оцінювали в аналізах іn vіtrо активності агоністів глюкокортикоїдів та у крові людини та аналізах вивільнення виділених лейкоцитів ТNF-, котрі є прогнозувальними стосовно антизапальної активності іn vіvо. Потужність агоністів глюкокортикоїдних рецепторів (GR) визначали у лінії клітин хондросаркоми людини SW1353, стабільно трансфектованих репортерним констрактом ММТV-люциферази. SW1353 природно експресує людини GR, що при зв'язуванні агоністів глюкокортикоїдів активує елементи чутливості на глюкокортикоїд у промотері ММТV, при експресії гена люциферази. Заморожені клітини SW1353 відновлювали у середовищі DМЕМ, без натрій пірувату або фенолчервоного, доповненому 2 мМ L-глутаміну, 1 мкг/мл інсуліну, 2 мг/мл гідрозилату лактальбуміну та 0,5 мкг/мл аскорбату. Клітини засівали приблизно при 5000 клітин/лунку (35 мкл/лунку) у 384лункові планшети з прозорим дном для культур тканин. Розбавлення отримували у розріджувачі стероїдів (РВS, що містить 2,5 об% ДМСО та 0,05 об% плюронового детергенту), та 5 мкл додавали Кут 2-Тета (° 0,1) 27,3 27,6 28,3 28,6 29,9 30,1 30,3 30,8 31,8 33,4 33,6 35,8 36,5 38,2 38,9 40,3 Інтенсивність(%) 22,9 19,4 12,0 12,2 15,4 31,9 26,4 22,1 12,9 10,3 12,2 15,1 11,7 12,9 15,4 12,4 у кожну лунку. Об'єм доводили до 50 мкл на лунку розріджувачем стероїдів. Позитивні контрольні лунки містили 1 мкМ дексаметазону. Планшети інкубували протягом приблизно 18 годин при 37С в атмосфері повітря/5 % СО2 у зволоженому інкубаторі перед додаванням у кожну лунку реагенту Брителіта (10 мкл; Реrkіn-Еlmеr). Кожний планшет інкубували протягом 2 хвилин у темряві та визначали люмінесценцію,застосовуючи люменометр LJL Віоsуstеms Аnаlуst. Дані для тест-сполук (виражені як процент від позитивного контролю дексаметазону) були застосовуваними для створення кривих доза-реакція, з котрих оцінювали значення ЕК50. Отримані нижченаведені дані: Приклад № 1 2 3 4 5 GR-агоністи ЕК50 (нМ) 0,75 5,0 1,7 0,5 9,84 Анти–запальну активність сполук проти лейкоцитів людини іn vіtrо також оцінювали визначенням інгібування вивільнення фактору- некрозу пухлин 47 (ТNF-) зі стимульованої ліпополісахаридом (LРS) суцільної крові людини (WВ) та виділених периферійних моноядерних клітин людини (РВМС). Периферійну венозну кров від здорових нелікованих донорів збирали, застосовуючи етилендіамінтетраоцтову кислоту (ЕDТА) як антикоагулянт. Для отримання РВМС, зразки крові розбавляли 1:1 стерильним буферованим фосфатом фізіологічним розчином та тоді розділяли, застосовуючи ТМ туби АССUSРІN Sуstеm-Ніstораquе®-1077 (Sіgmа-Аldrісh, St Lоuіs, МО), центрифугували при 400 g протягом 35 хвилин. Клітини лейкоцитної плівки видаляли у РВS, центрифугували при 200 g протягом 10 хвилин та ресуспендували у буфері для РВМС-аналізу (збалансований розчин солі Ханкса, 0,28 % 4-[2-гідроксіетил]-1піперазинетансульфонова кислота [НЕРЕS], 0,01 % альбуміну сироватки корів з низьким ендотоксином [ВSА]. Диференційний підрахунок білих клітин 6 виконували та РВМС розбавляли до 1 × 10 лімфоцитів на мл у буфері для РВМС-аналізу. Тест-сполуки розчиняли у ДМСО та розбавляли у буфері для РВМС-аналізу (кінцева концентрація ДМСО 1 %) до прийнятної концентрації, наприклад, 0,001 нМ – 10000 нМ. Зразки розчину або носія тест-сполук (20 мкл) додавали у 96-лункові планшети для культур тканин (Соrnіng) та РВМС (160 мкл) або WВ (160 мкл) додавали у кожну лунку. Суміші інкубували при 37С протягом 1 години у зволоженому інкубаторі, що містить атмосферу повітря, доповнену 5 % СО2 перед додаванням LРS (20 мкл 100 нг/мл для РВМС або 1 мкг/мл для WВ). Планшети повертали в інкубатор ще на 18 годин, та тоді центрифугували перед видаленням зразків з супернатанту. ТNF- у зразках визначали, застосовуючи імуноферментний твердофазний аналіз (ЕLІSА) (комплект Іnvіtrоgеn без СНС-1754; Іnvіtrоgеn Саrlsbаd, СА) та за інструкціями виробника. Криві доза-реакція створювали, з них розраховували значення ЕК50. Отримані нижченаведені дані: Приклад № 1 2 3 4 5 ІК50 (нМ) для інгібування вивільнення ТNF- РВМС Суцільна кров 0,098 17 0,092 49 0,061 24 0,059 40 0,032 8,73 Приклад 7: Фармакологічна активність іn vіvо Фармакологічну активність можна оцінювати у моделі запалення легень іn vіvо, як-то описаному нижче. Об'єктом цього способу було визначення антизапальної активності сполук формули (І), при застосуванні безпосередньо у легені через трахею. Тест-сполуки розчиняли або отримували як дрібну суспензію у буферованому фосфатом фізіологічному розчині, що містить 0,5 % Тwееn-80 для забезпечення рівнів доз. Самців щурів СD Sрrаguе-Dаwlеу (300-450 г) рандомізували для дослідження груп з n=6 та анестезували 5 % ізоф 95861 48 лурану у 3 л/хвилину О2. Одну з композицій тестсполук або дозу носія (100 мкл) уводили безпосередньо у трахею кожного анестезованого щура, застосовуючи шприц Гамільтона. Тваринам тоді давали відновитися від анестезії. Залежно від плану дослідження, тварини отримували одиничну дозу сполуки або раз на добу 4 наступних доби. 4 години після дозування (або 4 години після кінцевої дози у дослідженні повторного дозування) щурів поміщали у камеру (300×300×450 мм), сполучену з ультразвуковим розпилювачем та вентилятор для гризунів настроювали на максимальний припливно-відпливний об'єм та швидкість (5 мл, 160 циклів/хвилину). 10 мл 1 мг/мл LРS (Sіgmа-Аldrісh, L2630) у фізіологічному розчині, попередньо нагрітому до 37ºС, розпилювали у камеру. Через 15 хвилин вентилятор та розпилювач відключали та тварин залишали у камері для вдихання туман ще 15 хвилин перед поверненням до своєї клітки. Через 4 години після закінчення застосування LРS тварин в кінці анестезували 1 мл/ кг Пентоджект ІР. Трахею канюлювали та легені промивали 4×2,5 мл РВS, що містить 2,6 мМ ЕDТА та промивальну рідину збирали. 1 мл бронхоальвеолярної промивки (ВАL) додавали до 125 мкл 40 % альбуміну сироватки корів (ВSА) та підрахунок клітин визначали, застосовуючи гематологічну систему Аdvіа 120 (Sіеmеns). У дослідженні повторного дозування, маси тіла та маси надниркових залоз та тимусу також визначали, оскільки вони, як відомо, зменшують реакції на агоністи глюкокортикоїдів та застосовувані для оцінки системної дії агоністів глюкокортикоїдів. У деяких дослідженнях повторного дозування, періодичні зразки крові збирали від кожного щура, отримували сироватку та плазму, та концентрації кортикостерону у сироватці та АСТН у плазмі визначали як додаткові маркери системної дії агоністів глюкокортикоїдів. У деяких дослідженнях відомі агоністи глюкокортикоїдів, флутиказон пропіонат, застосовували до окремих груп щурів як позитивний контроль. Окремі криві доза-реакція створювали для інгібування індукованих LРS нейтрофілів легень, та кожного маркеру системної дії агоністів глюкокортикоїдів. Напівмаксимальне значення дії дози (ЕД50) оцінювали з підігнаних кривих. Значення ЕД50 стосовно дії на системні маркери активності агоністів глюкокортикоїдів були також поділені на ЕД50 для інгібування нейтрофілії легень для визначення значення терапевтичного індексу (ТІ). Таким чином знайдено, що сполуки формули (І) заявленого винаходу, що тестовані у вищенаведеному аналізі, показують активність стосовно інгібування нейтрофілії легень після застосування одиничної дози, як показано у таблиці нижче: Приклад № 1 2 3 4 5 ЕД50 (мкг) 0,27 0,18 0,45 2,00 3,6 49 95861 50 51 95861 52 53 95861 54 55 Комп‟ютерна верстка А. Крижанівський 95861 Підписне 56 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюGlucocorticoid receptor agonists
Автори англійськоюGlossop, Paul Alan, Millan, David Simon, Price, David Anthony
Назва патенту російськоюАгонисты рецептора глюкокортикоида
Автори російськоюГлоссоп Поль Алан, Миллан Дейвид Саймон, Прайс Дейвид Энтони
МПК / Мітки
МПК: A61P 11/06, A61P 5/46, A61K 31/58, C07J 71/00, C07J 7/00
Мітки: рецептора, глюкокортикоїду, агоністи
Код посилання
<a href="https://ua.patents.su/28-95861-agonisti-receptora-glyukokortikodu.html" target="_blank" rel="follow" title="База патентів України">Агоністи рецептора глюкокортикоїду</a>
Попередній патент: Різальний апарат машини для скошування і подрібнення рослин або їх решток
Наступний патент: Основа для виробництва косметичних та лікувальних грязьових препаратів
Випадковий патент: Спосіб одержання соєво-гарбузового порошку