Агоністи рецептора нейропептиду-2
Номер патенту: 90039
Опубліковано: 25.03.2010
Автори: Хан Ваджіха, Фотоухі Надер, Свісток Джозеф, Конде-Нейп Карін, Фрай Девід С., Конкар Аніш, Ерліх Джордж, Тіллі Джефферсон Р., Данхо Валід, Рондіноне Крістіна Марта, Тауб Ребекка Енн
Формула / Реферат
1. Агоніст рецептора нейропептиду-2 формули (І)
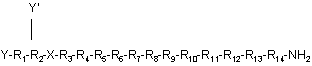 ,(I)
,(I)
де
X означає 4-оксо-6-(1-піперазиніл)-3(4Н)-хіназоліноцтову кислоту (Pqa),
Y означає Н, ацил, заміщений або незаміщений алкіл, заміщений або незаміщений (нижч.) алкіл, заміщений або незаміщений арил, заміщений або незаміщений гетероарил, заміщений або незаміщений алкокси, залишок поліетиленгліколю, ПЕГm-SSA, ПЕГm-b-SBA, ПЕГm-SPA або ПЕГm-ВТС,
Y' означає Н, залишок поліетиленгліколю, ПЕГm-SSA, ПЕГm-b-SBA, ПЕГm-SPA або ПЕГm-ВТС,
R1 означає Ilе, Ala, (D)Ile, N-метил-Ilе, Aib, 1-1-Аіс, 2-2-Aic, Ach або Аср,
R2 означає Lys, Ala, (D)Lys, NMeLys, Nle або (Lys-Gly),
R3 означає Arg, Ala, (D)Arg, N-метил-Arg, Phe, 3,4,5-трифтор-Рhе або 2,3,4,5,6-пентафтор-Phe,
R4 означає His, Ala, (D)His, N-метил -His, 4-MeOApc, 3-Pal або 4-Pal,
R5 означає Туr, Ala, (D)Tyr, N-метил-Туr, Trp, Tic, Вір, Dip, (1) Nal, (2) Nal, 3,4,5-трифтор-Phe або 2,3,4,5,6-пентафтор-Рhе,
R6 означає Leu, Ala, (D)Leu або N-метил-Lеu,
R7 означає Asn, Ala або (D)Asn,
R8 означає Leu або Trp,
R9 означає Val, Ala, (D)Val або N-метил-Vаl,
R10 означає Thr, Ala або N-метил-Тhr,
R11 означає Arg, (D)Arg або N-метил-Arg,
R12 означає Gln або Ala,
R13 означає Arg, (D)Arg або N-метил-Arg,
R14 означає Туr, (D)Tyr або N-метил-Туr, модифікований-Туr, Phe, модифікований-Phe, Cha, (1) Nal, (2) Nal, С-a-метил-Tyr або Тrр, і
ПЕГm означає ПЕГ із MM від 1 до 60 kDa,
або його фармацевтично прийнятна сіль.
2. Агоніст рецептора нейропептиду-2 за п. 1 формули (Іа)
![]() , (Іа)
, (Іа)
де
X означає N-піперазин-1-іл-4-(3Н)-хіназолінон-3-оцтову кислоту (Pqa),
Y означає Н, ацил, заміщений або незаміщений алкіл, заміщений або незаміщений (нижч.) алкіл, заміщений або незаміщений арил, заміщений або незаміщений алкокси, залишок поліетиленгліколю, ПЕГ-SSA, ПЕГ-b-SBA, ПЕГ-SPA або ПЕГ-ВТС,
R1 означає Ilе, Ala, (D)Ile, N-метил-Ilе, Aib, 1-1-Аіс, 2-2-Aic, Ach або Аср,
R2 означає Lys, Ala, (D)Lys, NMeLys, Nle або (Lys-Gly),
R3 означає Arg, Ala, (D)Arg, N-метил-Arg, Phe, 3,4,5-трифтор-Рhе або 2,3,4,5,6-пентафтор-Phe,
R4 означає His, Ala, (D)His, N-метил-His, 4-MeOApc, 3-Pal або 4-Pal,
R5 означає Туr, Ala, (D)Tyr, N-метил-Туr, Trp, Tic, Вір, Dip, (1) Nal, (2) Nal, 3,4,5-трифтор-Phe або 2,3,4,5,6-пентафтор-Рhе,
R6 означає Leu, Ala, (D)Leu або N-метил-Lеu,
R7 означає Asn, Ala або (D)Asn,
R8 означає Leu або Trp,
R9 означає Val, Ala, (D)Val або N-метил-Vаl,
R10 означає Thr, Ala або N-метил-Тhr,
R11 означає Arg, (D)Arg або N-метил-Arg,
R12 означає Gln або Ala,
R13 означає Arg, (D)Arg або N-метил-Arg і
R14 означає Туr, (D)Tyr або N-метил-Туr, модифікований-Туr, Phe, модифікований-Phe або Trp,
або його фармацевтично прийнятна сіль.
3. Агоніст рецептора нейропептиду-2 за п. 2, де R2 заміщений групою Y', a Y' означає Н, залишок поліетиленгліколю, ПЕГm-SSA, ПЕГm-b-SВА, ПЕГm-SPA або ПЕГm-ВТС.
4. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1 або 3, де Y' означає залишок поліетиленгліколю, ПЕГm-SSA, ПЕГm-b-SBA, ПЕГm-SPA або ПЕГm-ВТС.
5. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-4, де Y означає Н або ацил, а
Y' означає залишок поліетиленгліколю, ПЕГm-SSA, ПЕГm-b-SBA, ПЕГm-SPA або ПЕГm-ВТС.
6. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-5, де Y означає ацил.
7. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-6, де Y означає Н.
8. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1 або 3-7, де Y' означає Н.
9. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-8, де R1 означає Ilе, R2 означає Lys або Nle, R3 означає Arg, R4 означає His, R5 означає Tyr, R6 означає Leu, R7 означає Asn, R8 означає Leu або Trp, R9 означає Val, R10 означає Thr, R11 означає Arg, R12 означає Gln, R13 означає Arg або (N-мeтил)Arg, R14 означає Y, (m-)Y, (3-I)Y, (3,5-ди-F)Y, (2,6-ди-F)Y, (2,6-ди-Ме)Y, F(4-O-CH3), F, (4-NH2)Phe, (4-F)Phe, (4-CH2OH)Phe, (4-CF3)Phe, (3-F)Phe, (2,3,4,5,6-пeнтa-F)Phe, (3,4-ди-Сl)Рhе, Cha, W, (l)Nal, (2)Nal або С-a-Me-Tyr.
10. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-9, де R14 означає Туr або (2,6-ди-F)Туr.
11. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-10, де молекулярна маса ПЕГm дорівнює від 20 до 40 kDa.
12. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-11, де молекулярна маса ПЕГm дорівнює 30 kDa.
13. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-12, який вибирають із групи, яка включає
IK-Pqa-RHYLNLVTRQRY,
IK-Pqa-RHYLNLVTRQ(N-мeтил)RY,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(m-)Y,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(3-I)Y,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(3,5-ди-F)Y,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(2,6-ди-F)Y,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(2,6-ди-Me)Y,
IK-Pqa-RHYLNLVTRQ(N-мeтил)RF(4-O-CH3),
ІК-Pqa-RHYLNLVTRQ(N-мeтил)RF,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(4-NH2)Phe,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(4-F)Phe,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(4-CH2OH)Phe,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(4-CF3)Phe,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(3-F)Phe,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(2,3,4,5,6-пeнтa-F)Phe,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(3,4-ди-Cl)Phe,
IK-Pqa-RHYLNLVTRQ(N-мeтил)RCha,
IK-Pqa-RHYLNLVTRQ(N-мeтил)RW,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(1)Nal,
IK-Pqa-RHYLNLVTRQ(N-мeтил)R(2)Nal,
IK-Pqa-RHYLNLVTRQR-C-a-Me-Tyr,
IK-Pqa-RHYLNWVTRQ(N-мeтил)RY,
INle-Pqa-RHYLNWVTRQ(N-мeтил)RY,
Ac-IK-Pqa-RHYLNWVTRQ(N-мeтил)R(2,6-ди-F)Y,
Ac-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY,
пeнтил-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY,
тpимeтилaцeтил-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY,
циклогексил-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY,
бeнзоїл-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY,
aдaмaнтил-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY,
(ПEГ-30000SPA)IK-Pqa-RHYLNWVTRQ(N-мeтил)RY,
(ПEГ-40000BTC)-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY,
(ПEГ-30000)-SSA-INle-Pqa-RHYLNWVTRQ(N-мeтил)RY,
(ПEГ-30000)-бeтa-SBA-INle-Pqa-RHYLNWVTRQ(N-мeтил)RY,
Ac-Ile-Lys(ПEГ-30000 SPA)-Pqa-RHYLNWVTRQ(N-мeтил)RY,
Ac-Ile-Lys(ПEГ-30000 SSA)-Pqa-RHYLNWVTRQ(N-мeтил)RY і
IK(ПEГ-30000 SSA)-Pqa-RHYLNWVTRQ(N-мeтил)RY
або їх фармацевтично прийнятні солі.
14. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-13, який вибирають із групи, яка включає
Ac-Ile-Lys(ПEГ-30000 SPA)-Pqa-RHYLNWVTRQ(N-мeтил)RY,
Ac-Ile-Lys(ПEГ-30000 SSA)-Pqa-RHYLNWVTRQ(N-мeтил)RY і
IK(ПEГ-30000 SSA)-Pqa-RHYLNWVTRQ(N-мeтил)RY
або їх фармацевтично прийнятні солі.
15. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-14, яким є Ac-IK-Pqa-RHYLNWVTRQ(N-мeтил)R(2,6-ди-F)Y.
16. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-14, яким є Ac-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY.
17. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-14, яким є (ПЕГ-30000)-SPA-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY.
18. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-14, яким є (ПЕГ-30000)-SSA-INle-Pqa-RHYLNWVTRQ(N-мeтил)RY.
19. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-14, яким є Ас-Іlе-Lys(ПEГ-30000 SSA)-Pqa-RHYLNWVTRQ(N-мeтил)RY.
20. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-14, яким є Н-Ilе-Lys(ПEГ-30000 SSA)-Pqa-RHYLNWVTRQ(N-мeтил)RY.
21. Фармацевтична композиція, яка включає агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-20 і фармацевтично прийнятний носій та/або ад'ювант.
22. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-20 для застосування як терапевтично активних речовин.
23. Агоніст рецептора нейропептиду-2 за будь-яким з пп. 1-20 для застосування як терапевтично активних речовин, призначених для лікування та/або профілактики захворювань, які модулюються агоністами рецептора нейропептиду-2.
Текст
1. Агоніст рецептора нейропептиду-2 формули (І) Y' Y-R1-R2-X-R3-R4-R5-R6-R7-R8-R9-R10-R11-R12-R13-R14-NH2 де X означає N-піперазин-1-іл-4-(3Н)-хіназолінон-3оцтову кислоту (Pqa), Y означає Н, ацил, заміщений або незаміщений алкіл, заміщений або незаміщений (нижч.) алкіл, заміщений або незаміщений арил, заміщений або , (Іа) незаміщений алкокси, залишок поліетиленгліколю, ПЕГ-SSA, ПЕГ- -SBA, ПЕГ-SPA або ПЕГ-ВТС, R1 означає Ilе, Ala, (D)Ile, N-метил-Ilе, Aib, 1-1-Аіс, 2-2-Aic, Ach або Аср, R2 означає Lys, Ala, (D)Lys, NMeLys, Nle або (LysGly), C2 (13) 90039 (11) R5 означає Туr, Ala, (D)Tyr, N-метил-Туr, Trp, Tic, Вір, Dip, (1) Nal, (2) Nal, 3,4,5-трифтор-Phe або 2,3,4,5,6-пентафтор-Рhе, R6 означає Leu, Ala, (D)Leu або N-метил-Lеu, R7 означає Asn, Ala або (D)Asn, R8 означає Leu або Trp, R9 означає Val, Ala, (D)Val або N-метил-Vаl, R10 означає Thr, Ala або N-метил-Тhr, R11 означає Arg, (D)Arg або N-метил-Arg, R12 означає Gln або Ala, R13 означає Arg, (D)Arg або N-метил-Arg, R14 означає Туr, (D)Tyr або N-метил-Туr, модифікований-Туr, Phe, модифікований-Phe, Cha, (1) Nal, (2) Nal, С- -метил-Tyr або Тrр, і ПЕГm означає ПЕГ із MM від 1 до 60 kDa, або його фармацевтично прийнятна сіль. 2. Агоніст рецептора нейропептиду-2 за п. 1 формули (Іа) UA де X означає 4-оксо-6-(1-піперазиніл)-3(4Н)хіназоліноцтову кислоту (Pqa), Y означає Н, ацил, заміщений або незаміщений алкіл, заміщений або незаміщений (нижч.) алкіл, заміщений або незаміщений арил, заміщений або незаміщений гетероарил, заміщений або незаміщений алкокси, залишок поліетиленгліколю, ПЕГmSSA, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВТС, Y' означає Н, залишок поліетиленгліколю, ПЕГmSSA, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВТС, R1 означає Ilе, Ala, (D)Ile, N-метил-Ilе, Aib, 1-1-Аіс, 2-2-Aic, Ach або Аср, R2 означає Lys, Ala, (D)Lys, NMeLys, Nle або (LysGly), R3 означає Arg, Ala, (D)Arg, N-метил-Arg, Phe, 3,4,5-трифтор-Рhе або 2,3,4,5,6-пентафтор-Phe, R4 означає His, Ala, (D)His, N-метил -His, 4MeOApc, 3-Pal або 4-Pal, ,(I) (19) Y-R1-R2-X-R3-R4-R5-R6-R7-R8-R9-R10-R11-R12-R13-R14-NH2 3 90039 4 R3 означає Arg, Ala, (D)Arg, N-метил-Arg, Phe, ІК-Pqa-RHYLNLVTRQ(N-мeтил)RF, 3,4,5-трифтор-Рhе або 2,3,4,5,6-пентафтор-Phe, IK-Pqa-RHYLNLVTRQ(N-мeтил)R(4-NH2)Phe, R4 означає His, Ala, (D)His, N-метил-His, 4IK-Pqa-RHYLNLVTRQ(N-мeтил)R(4-F)Phe, MeOApc, 3-Pal або 4-Pal, IK-Pqa-RHYLNLVTRQ(N-мeтил)R(4-CH2OH)Phe, R5 означає Туr, Ala, (D)Tyr, N-метил-Туr, Trp, Tic, IK-Pqa-RHYLNLVTRQ(N-мeтил)R(4-CF3)Phe, Вір, Dip, (1) Nal, (2) Nal, 3,4,5-трифтор-Phe або IK-Pqa-RHYLNLVTRQ(N-мeтил)R(3-F)Phe, 2,3,4,5,6-пентафтор-Рhе, IK-Pqa-RHYLNLVTRQ(N-мeтил)R(2,3,4,5,6-пeнтaR6 означає Leu, Ala, (D)Leu або N-метил-Lеu, F)Phe, R7 означає Asn, Ala або (D)Asn, IK-Pqa-RHYLNLVTRQ(N-мeтил)R(3,4-ди-Cl)Phe, R8 означає Leu або Trp, IK-Pqa-RHYLNLVTRQ(N-мeтил)RCha, R9 означає Val, Ala, (D)Val або N-метил-Vаl, IK-Pqa-RHYLNLVTRQ(N-мeтил)RW, R10 означає Thr, Ala або N-метил-Тhr, IK-Pqa-RHYLNLVTRQ(N-мeтил)R(1)Nal, R11 означає Arg, (D)Arg або N-метил-Arg, IK-Pqa-RHYLNLVTRQ(N-мeтил)R(2)Nal, R12 означає Gln або Ala, IK-Pqa-RHYLNLVTRQR-C- -Me-Tyr, R13 означає Arg, (D)Arg або N-метил-Arg і IK-Pqa-RHYLNWVTRQ(N-мeтил)RY, R14 означає Туr, (D)Tyr або N-метил-Туr, модифіINle-Pqa-RHYLNWVTRQ(N-мeтил)RY, кований-Туr, Phe, модифікований-Phe або Trp, Ac-IK-Pqa-RHYLNWVTRQ(N-мeтил)R(2,6-ди-F)Y, або його фармацевтично прийнятна сіль. Ac-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY, 3. Агоніст рецептора нейропептиду-2 за п. 2, де R2 пeнтил-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY, заміщений групою Y', a Y' означає Н, залишок потpимeтилaцeтил-IK-Pqa-RHYLNWVTRQ(Nліетиленгліколю, ПЕГm-SSA, ПЕГm- -SВА, ПЕГmмeтил)RY, SPA або ПЕГm-ВТС. циклогексил-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY, 4. Агоніст рецептора нейропептиду-2 за будь-яким бeнзоїл-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY, з пп. 1 або 3, де Y' означає залишок поліетиленгліaдaмaнтил-IK-Pqa-RHYLNWVTRQ(N-мeтил)RY, (ПEГ-30000SPA)IK-Pqa-RHYLNWVTRQ(Nколю, ПЕГm-SSA, ПЕГm- -SBA, ПЕГm-SPA або мeтил)RY, ПЕГm-ВТС. (ПEГ-40000BTC)-IK-Pqa-RHYLNWVTRQ(N5. Агоніст рецептора нейропептиду-2 за будь-яким мeтил)RY, з пп. 1-4, де Y означає Н або ацил, а (ПEГ-30000)-SSA-INle-Pqa-RHYLNWVTRQ(NY' означає залишок поліетиленгліколю, ПЕГm-SSA, мeтил)RY, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВТС. (ПEГ-30000)-бeтa-SBA-INle-Pqa-RHYLNWVTRQ(N6. Агоніст рецептора нейропептиду-2 за будь-яким мeтил)RY, з пп. 1-5, де Y означає ацил. Ac-Ile-Lys(ПEГ-30000 SPA)-Pqa-RHYLNWVTRQ(N7. Агоніст рецептора нейропептиду-2 за будь-яким мeтил)RY, з пп. 1-6, де Y означає Н. Ac-Ile-Lys(ПEГ-30000 SSA)-Pqa-RHYLNWVTRQ(N8. Агоніст рецептора нейропептиду-2 за будь-яким мeтил)RY і з пп. 1 або 3-7, де Y' означає Н. IK(ПEГ-30000 SSA)-Pqa-RHYLNWVTRQ(N9. Агоніст рецептора нейропептиду-2 за будь-яким мeтил)RY з пп. 1-8, де R1 означає Ilе, R2 означає Lys або Nle, або їх фармацевтично прийнятні солі. R3 означає Arg, R4 означає His, R5 означає Tyr, R6 14. Агоніст рецептора нейропептиду-2 за будьозначає Leu, R7 означає Asn, R8 означає Leu або яким з пп. 1-13, який вибирають із групи, яка вклюTrp, R9 означає Val, R10 означає Thr, R11 означає чає Arg, R12 означає Gln, R13 означає Arg або (NAc-Ile-Lys(ПEГ-30000 SPA)-Pqa-RHYLNWVTRQ(Nмeтил)Arg, R14 означає Y, (m-)Y, (3-I)Y, (3,5-ди-F)Y, мeтил)RY, (2,6-ди-F)Y, (2,6-ди-Ме)Y, F(4-O-CH3), F, (4Ac-Ile-Lys(ПEГ-30000 SSA)-Pqa-RHYLNWVTRQ(NNH2)Phe, (4-F)Phe, (4-CH2OH)Phe, (4-CF3)Phe, (3мeтил)RY і F)Phe, (2,3,4,5,6-пeнтa-F)Phe, (3,4-ди-Сl)Рhе, Cha, IK(ПEГ-30000 SSA)-Pqa-RHYLNWVTRQ(NW, (l)Nal, (2)Nal або С- -Me-Tyr. мeтил)RY 10. Агоніст рецептора нейропептиду-2 за будьабо їх фармацевтично прийнятні солі. яким з пп. 1-9, де R14 означає Туr або (2,6-ди-F)Туr. 15. Агоніст рецептора нейропептиду-2 за будь11. Агоніст рецептора нейропептиду-2 за будьяким з пп. 1-14, яким є Ac-IK-Pqaяким з пп. 1-10, де молекулярна маса ПЕГm дорівRHYLNWVTRQ(N-мeтил)R(2,6-ди-F)Y. нює від 20 до 40 kDa. 16. Агоніст рецептора нейропептиду-2 за будь12. Агоніст рецептора нейропептиду-2 за будьяким з пп. 1-14, яким є Ac-IK-Pqaяким з пп. 1-11, де молекулярна маса ПЕГm дорівRHYLNWVTRQ(N-мeтил)RY. нює 30 kDa. 17. Агоніст рецептора нейропептиду-2 за будь13. Агоніст рецептора нейропептиду-2 за будьяким з пп. 1-14, яким є (ПЕГ-30000)-SPA-IK-Pqaяким з пп. 1-12, який вибирають із групи, яка вклюRHYLNWVTRQ(N-мeтил)RY. чає 18. Агоніст рецептора нейропептиду-2 за будьIK-Pqa-RHYLNLVTRQRY, яким з пп. 1-14, яким є (ПЕГ-30000)-SSA-INle-PqaIK-Pqa-RHYLNLVTRQ(N-мeтил)RY, RHYLNWVTRQ(N-мeтил)RY. IK-Pqa-RHYLNLVTRQ(N-мeтил)R(m-)Y, 19. Агоніст рецептора нейропептиду-2 за будьIK-Pqa-RHYLNLVTRQ(N-мeтил)R(3-I)Y, яким з пп. 1-14, яким є Ас-Іlе-Lys(ПEГ-30000 SSA)IK-Pqa-RHYLNLVTRQ(N-мeтил)R(3,5-ди-F)Y, Pqa-RHYLNWVTRQ(N-мeтил)RY. IK-Pqa-RHYLNLVTRQ(N-мeтил)R(2,6-ди-F)Y, IK-Pqa-RHYLNLVTRQ(N-мeтил)R(2,6-ди-Me)Y, IK-Pqa-RHYLNLVTRQ(N-мeтил)RF(4-O-CH3), 5 90039 6 20. Агоніст рецептора нейропептиду-2 за будь22. Агоніст рецептора нейропептиду-2 за будьяким з пп. 1-14, яким є Н-Ilе-Lys(ПEГ-30000 SSA)яким з пп. 1-20 для застосування як терапевтично Pqa-RHYLNWVTRQ(N-мeтил)RY. активних речовин. 21. Фармацевтична композиція, яка включає аго23. Агоніст рецептора нейропептиду-2 за будьніст рецептора нейропептиду-2 за будь-яким з пп. яким з пп. 1-20 для застосування як терапевтично 1-20 і фармацевтично прийнятний носій та/або активних речовин, призначених для лікування ад'ювант. та/або профілактики захворювань, які модулюються агоністами рецептора нейропептиду-2. Даний винахід стосується вкорочених аналогів пептиду PYY3-36. Аналоги є агоністами рецептора нейропептиду-2 і використовуються для лікування метаболічних захворювань і розладів, таких як, наприклад, ожиріння, діабет типу 2, метаболічний синдром, резистентність до інсуліну й дисліпідемія. Агоніст рецептора нейропептиду-2 за даним винаходом характеризується формулою (І) де X означає 4-оксо-6-(1-піперазиніл)-3(4Н)хіназоліноцтову кислоту (Pqa), Υ означає Н, ацил, заміщений або незаміщений алкіл, заміщений або незаміщений арил, заміщений або незаміщений гетероарил, заміщений або незаміщений алкокси, залишок поліетиленгіліколю, ПЕГm-SSA, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВTС, Y означає Η, залишок поліетиленгліколю, ПЕГm-SSA, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВТС, R1 означає IIе, Ala, (D)Ile, N-метил-IIе, Aib, 1-1Аіс, 2-2-Aic, Ach або Аср, R2 означає Lys, Ala, (D)Lys, NMeLys, Nle або (Lys-Gly), R3 означає Arg, Ala, (D)Arg, N-метил-Arg, Phe, 3,4,5-трифтор-Phe або 2,3,4,5,6-пентафтор-Phe, R4 означає His, Ala, (D)His, N-метил-Ніs, 4MeOApc, 3-Pal або 4-Pal, R5 означає Tyr, Ala, (D)Tyr, N-метил-Tyr, Trp, Tic, Вір, Dip, (1) Nal, (2) Nal, 3,4,5-трифтор-Phe або 2,3,4,5,6-пентафтор-Рhе, R6 означає Leu, Ala, (D)Leu або N-метил-Lеu, R7 означає Asn, Ala або (D)Asn, R8 означає Leu або Trp, R9 означає Val, Ala, (D)Val або N-метил-Val, R10 означає Thr, Ala або N-метил-Тhr, R11 означає Arg, (D)Arg або N-метил-Arg, R12 означає Gln або Ala, R13 означає Arg, (D)Arg або N-метил-Arg, R14 означає Tyr, (D)Tyr або N-метил-Tyr, модифікований Tyr, Phe, модифікований Phe, Cha, (1) Nal, (2) Nal, С- -метил-Tyr або Trp і ПЕГm означає ПЕГ із MM від 1кDa до 60кDa, або використовують його фармацевтично прийнятну сіль. Всі процитовані в даному описі документи включені в опис як посилання. Метаболічні захворювання й розлади широко поширені, представляють серйозну проблему охорони здоров'я в розвинених країнах і в США набувають характеру епідемії. Наприклад, відповідно до сучасних досліджень у США більше 50% населення характеризується зайвою масою тіла, у більше 25% населення встановлений діагноз клініч ного ожиріння зі значним ризиком захворювання серця, діабету типу 2 і деяких видів раку. Ця епідемія представляє серйозну проблему в системі охорони здоров'я, тому що тільки в США плановані витрати на лікування ожиріння становлять більше 70млрд. на рік. Стратегії лікування ожиріння включають зниження споживання їжі й збільшення витрати енергії. Нейропептид Υ (ΝΡΥ), пептидний нейромедіатор, який складається з 36 амінокислотних залишків, належить до класу поліпептидів підшлункової залози (нейромедіатори/нейрогормони), які присутні як у периферичній, так і центральній нервовій системі. ΝΡΥ є одним з найбільш сильних агентів, що збуджують апетит, які, як відомо, відіграють важливу роль у регуляції споживання їжі у тварин, включаючи людину. У цей час клонували шість рецепторів нейропептиду Υ (ΝΡΥ), підтипи Y1, Y2, Υ3, Υ4, Υ5 і Υ6, які належать до 7 родопсиноподібних сполучених з G-білком трансмембранних рецепторів (GPCR). Рецептор ΝΡΥ Υ2 (Y2R) включає 381 амінокислотний залишок і інгібує активацію аденілатциклази через Gі, і в теж час характеризується низьким ступенем гомології з іншими відомими рецепторами ΝΡΥ. Відзначається високий рівень консервативності (98%) амінокислотної послідовності рецепторів Υ2 щура й людини. Рецептор Y2R широко розповсюджений у центральній нервовій системі як гризунів, так і людини. У гіпоталамусі мРНК Υ2 локалізована в дугоподібному, преоптичному й дорсомедіальному ядрах. У головному мозку людини як підтип рецептора Υ превалює Y2R. У дугоподібному ядрі більше 80% ΝΡΥ нейронів спільно експресують mRNA Y2R. Встановлено, що застосування Y2селективного агоніста знижує вивільнення NPY з гіпоталамічних зрізів in vitro, тоді як Y2непептидний антагоніст ВІІЕ0246 збільшує вивільнення NPY. Ці дані підтверджують роль Y2R як пресинаптичного авторецептора, що регулює вивільнення NPY і отже Y2R може брати участь у регуляції споживання їжі (Kaga Τ і ін., Peptides 22: 7 90039 8 501-506 (2001) і King PJ і ін., Eur J Pharmacol 396: селективність відносно рецепторів Y1, Y4 і Y5, а R1-3 (2000)). також фармакокінетичні й фармакологічні властиПептид YY3-36 (ΡΥΥ3-36) являє собою прямий вості. Переважно існує необхідність у сполуках, які пептидний ланцюг з 34 амінокислотних залишків і мають активність протягом тривалого періоду часу проявляє агоністичну активність у відношенні нейв порівнянні з відомими агентами. Існує також неропептиду Υ2 (NPY2R). Було встановлено, що при обхідність в одержанні аналогів PYY, що включавведенні ΡΥΥ3-36 у дугоподібні ядра або внутрішють залишок ПЕГ, наприклад, з метою збільшити ньоочеревинно спостерігається зниження спожиперіод напіврозпаду білка й знизити імуногенність вання корму щурами, а при тривалому лікуванні в організмі суб'єктів, які потребують таких агонісспостерігається зниження маси тіла. При внутріштів. ньовенному введенні ΡΥΥ3-36 (IV) (0,8пмоль/кг/хв) На Фіг.1 наведені результати РХВР реакційної протягом 90хв знижується споживання їжі здоросуміші, що містить сполуки (приклад 34) за даним вими людьми й тими, які страждають від ожирінвинаходом. ням протягом більше 24год. Ці дані свідчать про На Фіг.2 наведені результати РХВР очищеної те, що систему PYY можна використовувати як сполуки (приклад 34) за даним винаходом. терапевтичну мішень при лікуванні ожиріння На Фіг.3 показані результати МС MALDI-TOF (Batterham RL і ін., Nature 418: 650-654 (2002), сполуки (приклад 34) за даним винаходом. Batterham RL і ін., New Engl J Med 349: 941-948 На Фіг.4 наведені результати РХВР реакційної 2 27 (2003)). Крім того, Cys -(D)Cys -циклічний аналог суміші іншої сполуки (приклад 35) за даним винаPYY, у якому залишки 5-24 замінені на метиленоходом. вий ланцюг з 5-8 атомів вуглецю, характеризуєтьНа Фіг.5 наведені результати РХВР очищеної ся активацією кишкових рецепторів PYY, за данисполуки (приклад 35) за даним винаходом. ми фіксації напруги методом петч-кламп для На Фіг.6 показані результати МС MALDI-TOF препаратів тонкої кишки щура (зниження струму, сполуки (приклад 35) за даним винаходом. що протікає через препарати) (Krstenansky і ін., На Фіг.7 наведені результати РХВР реакційної Peptides, Proceedings of the Twelfth American суміші, що містить сполуки (приклад 36) за даним Peptide Symposium, (ред.) J. Smith і J. Rivier винаходом. Editors, ESCOM. Leiden Page 136-137). На Фіг.8 наведені результати РХВР очищеної Крім того, ковалентна модифікація білків полісполуки (приклад 36) за даним винаходом. етиленгліколем або поліегиленоксидом (у даному На Фіг.9 показані результати МС MALDI-TOF описі ПЕГ) описана на прикладі супероксиддисмусполуки (приклад 36) за даним винаходом. тази (Somack R. і ін., Free Rad Res Commun, 12На Фіг.10 наведені результати РХВР реакцій13:553-562 (1991), U.S. 5283317 і 5468478) і інших ної суміші, що містить сполуки (приклад 37) за датипів білків, наприклад, цитокінів (Saifer Μ G. P. і ним винаходом. ін., Polym Preprints, 38:576-577 (1997), Sherman Μ. На Фіг.11 наведені результати РХВР очищеної R. і ін., (ред.) J M Harris і ін., Poly(ethylene glycol), сполуки (приклад 37) за даним винаходом. Chemistry and Biological Applications, ACS На Фіг.12 показані результати МС MALDI-TOF Symposium Series 680 (pp. 155-169) (1997), сполуки (приклад 37) за даним винаходом. Washington, D.C.: American Chemical Society). На Фіг.13 наведені результати РХВР реакційКрім того, недавно було встановлено, що в ної суміші іншої сполуки (приклад 38) за даним пацієнтів із шунтованим шлунком спостерігається винаходом. швидке й значне збільшення рівня PYY, що може На Фіг.14 наведені результати РХВР очищеної частково зв'язане з раннім глікемічним контролем і сполуки (приклад 38) за даним винаходом. тривалим підтриманням маси тіла, що свідчить На Фіг.15 показані результати МС MALDI-TOF про важливу роль цього пептиду в патогенезі месполуки (приклад 38) за даним винаходом. таболічних захворювань. Інші відомі функції PYY На Фіг.16 наведені результати РХВР реакційвключають зниження швидкості спорожнення шлуної суміші, що містить сполуки (приклад 39) за данка й уповільнений шлунково-кишковий транспорт, ним винаходом. які відіграють важливу роль у поліпшенні глікемічНа Фіг.17 наведені результати РХВР очищеної ного контролю після прийому їжі. Показники гіперсполуки (приклад 39) за даним винаходом. глікемії, такі як НbА1C і фруктозамін, знижуються за На Фіг.18 показані результати МС MALDI-TOF дозозалежним механізмом після периферичного сполуки (приклад 39) за даним винаходом. введення ΡΥΥ3-36, як показано на моделях тварин з На Фіг.19 наведені результати РХВР реакційдіабетом типу 2. Таким чином, встановлено, що ної суміші, що містить сполуки (приклад 41) за даΡΥΥ3-36 або фармацевтично споріднені агоністи є ним винаходом перед видаленням захисних груп. перспективними агентами при розробці терапевНа Фіг.20 наведені результати РХВР реакційтичного підходу для тривалого глікемічного контної суміші, що містить сполуки (приклад 41) за даролю й контролю маси тіла (Korner і ін., J Clin ним винаходом після видалення захисних груп. Endocrinol Metabol 90: 359-365 (2005), Chan JL і ін., На Фіг.21 наведені результати РХВР очищеної Obesity 14: 194-198 (2006), Stratis С і ін., Obes Surg сполуки (приклад 41) за даним винаходом. 16: 752-758 (2006), Borg CM і ін., Вr J Surg 93: 210На Фіг.22 показані результати МС MALDI-TOF 215 (2006) і Pittner RA і ін., Int J Obes 28: 963-971 сполуки (приклад 41) за даним винаходом. (2004)). На Фіг.23 показаний вплив стандартних підгосУ цей час існує необхідність у розробці нових трих доз сполуки (приклад 41) на масу тіла самцівнизькомолекулярних аналогів PYY, які у той же час щурів з викликаним дієтою ожирінням (DIO). мають еквівалентну або більшу ефективність й 9 90039 10 На Фіг.24 показаний вплив введення високої стандартні й нестандартні скорочення назв різних дози сполуки (приклад 41) на переносимість глюамінокислот. Скорочення амінокислот відомі фахікози (перорально) (OGTT) у самок-мишей db/db. вцям і представлені нижче: На Фіг.25 показаний вплив стандартних підгосAsp і D означають аспарагінову кислоту, Ala і А трих доз сполуки (приклад 41) на базовий рівень означають аланін, Arg і R означають аргінін, Asn і глюкози в крові (А) і переносимість глюкози (пероN означають аспарагін, Gly і G означають гліцин, рально) (В) у самок-мишей db/db. Glu і Ε означають глутамінову кислоту, Gln і Q Хоча па практиці можна використовувати означають глутамін, His і Η означають гістидин, ІІе будь-які способи, пристрої й матеріали, аналогічні і І означають ізолейцин, Leu і L означають лейцин, або еквівалентні до описаних у даному контексті, Lys і K означають лізин, Met і Μ означають метіопереважні способи, пристрої й матеріали описані нін, Phe і F означають фенілаланін, Pro і Ρ ознанижче. чають пролін, Ser і S означають серин, Thr і Τ Всі послідовності пептидів зображені в даному означають треонін, Trp і W означають триптофан, контексті в стандартному вигляді, тобто N-кінцевий Tyr і Υ означають тирозин, Cys і С означають цисфрагмент розташований ліворуч, а С-кінцевий теїн, Val і V означають Валін, Nle означає норправоруч, якщо не вказане інше. Лінія між двома лейцин. залишками амінокислот означає пептидний зв'яВ описі використані також наступні скорочення зок. Якщо амінокислота знаходиться в ізомерній або символи для позначення фрагментів, реагенформі, то вона знаходиться в L-формі, якщо не тів і т.п. вказане інше. У даному описі використовуються Ас Aib 1-1-Аіс 2-2-Аіс Ach Аср Tic 3-Pal 4-Раl 4-Мсо-Арс Вір Dip Pqa 3,4,5, F3-Phe 2,3,4,5,6, F5-Phc Cha (1) Nal (2) Nal Fmoc Mtt 2Pip Ρme CH2Cl2 A2O CH3CN ДМА ДМФА DIPEA ΤΦΚ HΟΒT DIG BOP HBTU NMP SSA -SBA SPA ВТС MALDI-TOF FAB-MS ЕS-MS PЕGm-SSA PЕGm- -SBA ацетил, альфа-аміноізомасляна кислота, 1-аміноіндан-1-карбонова кислота, 2-аміноіндан-2-карбонова кислота, альфа-аміноциклогексанкарбонова кислота, альфа-аміноциклопентанкарбонова кислота, альфа-аміно-1,2,3,4-тетрагідроізохінолін-3-карбонова кислота, альфа-аміно-3-піридилаланінкарбонова кислота, альфа-аміно-4-піридилаланінкарбонова кислота, 1-аміно-4-(4-метоксифеніл)циклогексан-1-карбонова кислота, 4-фенілфенілаланінкарбонова кислота, 3,3-дифенілалаиінкарбонова кислота, 4-оксо-6-(1-піперазиніл)-3-(4Н)-хіназоліноцтова кислота (номер за каталогом 88995808-1), 3,4,5-трифторфенілаланін, 2,3,4,5,6-петафторфенілаланін, циклогексилаланін, 1-нафтилаланін, 2-нафтилаланін, 9-флуоренілметилоксикарбоніл, 4-метилтритил, 2-фенілізопропіловий ефір, 2,2,5,7,8-пентаметилхроман-6-сульфоніл, хлористий метилен, оцтовий ангідрид, ацетонітрил, диметилацетамід, диметилформамід, Ν,Ν-діізопропілетиламін, трифтороцтова кислота, N-гідроксибензотриазол, Ν,Ν-діізопропілкарбодіімід, гексафторфосфат бензотриазол-1-ілокситрис(диметиламіно)фосфонію гексафторфосфат 2-(1Н-бензотриазол-1-іл)-1,1,3,3-тетраметилуронію 1-метил-2-піролідинон, сукцинімідилсукцинамід, сукцинімідил-бета-бутанова кислота, сукцинімідилпропіонова кислота, бензотриазолкарбонат, часо пролітна мас-спектроскопія, іонізація лазерною десорбцією з використанням матриці, мас-спектрометрія, бомбардування швидкими атомами, мас-спектрометрія, електроспрей, ПЕГm-CH2CH2NHCOCH2CH2CO-, ПЕГm-СН(СН3)СН2СО-, PEGm-SPA PEGm-BTC PEGm 11 90039 12 ПЕГm-СН2СН2СО-, ПЕГm-СО- і залишок поліетиленгліколю з молекулярною масою більше приблизно 1кDa. Термін «алкіл» означає розгалужений або нерозгалужений, циклічний або ациклічний, насичений або ненасичений вуглеводневий радикал, заміщений або незаміщений. Циклічний алкіл містить переважно від 3 до 12, більш переважно від 5 до 10, більш переважно від 5 до 7 атомів вуглецю. Ациклічний алкіл містить переважно від 1 до 10, більш переважно від 1 до 6 атомів вуглецю, більш переважно означає метил, етил, пропіл (н-пропіл або ізопропіл), бутил (н-бутил, ізобутил або третбутил) або пентил (включаючи н-пентил і ізопентил), більш переважно метил. Мається на увазі, що термін «алкіл», використаний у даному контексті, включає алкіл (розгалужений або нерозгалужений), заміщений алкіл (розгалужений або нерозгалужений), заміщений алкініл (розгалужений або нерозгалужений), циклоалкіл, заміщений циклоалкіл, циклоалкеніл, заміщений циклоалкеніл, циклоалкініл і заміщений циклоалкініл. Переважно алкільні групи є ациклічними й насиченими. Термін «(нижч.)алкіл» означає розгалужений або нерозгалужений, циклічний або ациклічний, насичений або ненасичений вуглеводневий радикал, причому вказаний циклічний (нижч.)алкіл містить 5, 6 або 7 атомів вуглецю, а вказаний ациклічний (нижч.)алкіл містить 1, 2, 3 або 4 атоми вуглецю, його вибирають із групи, яка включає метил, етил, пропіл (н-пропіл або ізопропіл) або бутил (н-бутил, ізобутил або трет-бутил) Мається на увазі, що термін «(нижч.)алкіл», використаний у даному контексті, включає (нижч.)алкіл (розгалужений або нерозгалужений), (нижч.)алкеніл (розгалужений або нерозгалужений), (нижч.)алкініл (розгалужений або нерозгалужений), цикло(нижч.)алкіл і цикло(нижч.)алкеніл. Переважно (нижч.)алкільні групи є ациклічними й насиченими. Термін «ацил» означає необов'язково заміщений алкіл, циклоалкіл, гетероцикліл, арил або гетероарил, зв'язаний через карбонільну групу й який включає такі групи, як ацетил, пропіонал, бензоїл, 3-піридинілкарбоніл, 2-морфолінокарбоніл, 4-гідроксибутаноїл, 4-фторбензоїл, 2-нафтоїл, 2фенілацетил, 2-метоксиацетил і т.п. Термін «арил» означає заміщену або незаміщену карбоциклічну ароматичну групу, таку як феніл або нафтил. Термін «гетероарил», окремо або в комбінації з іншими групами, означає моноциклічний або біциклічний радикал, що містить від 5 до 12 атомів у циклі й принаймні один ароматичний цикл, що містить один, два або три гетероатоми, вибраних з N, О і S, інші циклічні атоми є атомами вуглецю, при цьому гетероарильний радикал приєднаний до ароматичного циклу. Один або два циклічних атоми вуглецю в складі гетероарильної групи можна замінити на карбонільну групу. Алкіл, арил і гетероарил є заміщеними або незаміщеними. Якщо вони заміщені, то містять від 1 до 3, переважно 1 замісник. Замісники включають: вуглецьвмісні групи, такі як алкіл, арил, арилалкіл (наприклад, заміщений і незаміщений феніл, заміщений і незаміщений бензил), атоми галогену й галогенвмісні групи, такі як галогеналкіл (наприклад, трифторметил), кисеньвмісні групи, такі як спирти (наприклад, гідроксил, гідроксіалкіл, арил(гідрокси)алкіл), алкокси, арилокси, алкоксіалкіл, арилоксіалкіл, ацил, кислоти (наприклад, карбокси, карбоксіалкіл), похідні кислот, такі як складні ефіри (наприклад, алкоксикарбоніл, алкоксикарбонілалкіл, алкілкарбонілокси, алкілкарбонілоксіалкіл), аміди (наприклад, амінокарбоніл, моно- або ди-алкіламінокарбоніл, амінокарбонілалкіл, моно- або ди-алкіламінокарбонілалкіл, ариламінокарбоніл), карбамати (наприклад, алкоксикарбоніламіно, арилоксикарбоніламіно, амінокарбонілокси, моноабо диалкіламінокарбонілокси, ариламінокарбонілокси), сечовини (наприклад, моноабо диалкіламінокарбоніламіно або ариламінокарбоніламіно), азотвмісні групи, такі як аміни (наприклад, аміно, моно-або ди-алкіламіно, аміноалкіл, моноабо ди-алкіламіноалкіл), азиди, нітрили (наприклад, ціано, ціаноалкіл), нітро, сірковмісні групи, такі як тіоли, тіоефіри, сульфоксиди й сульфони (наприклад, алкілтіо, алкілсульфініл, алкілсульфоніл, алкілтіоалкіл, алкілсульфінілалкіл, алкілсульфонілалкіл, арилтіо, арилсульфініл, арилсульфоніл, арилтіоалкіл, арилсульфінілалкіл, арилсульфонілалкіл), і гетероциклічні групи, яка містять один або більше, переважно один гетероатом (наприклад, тієніл, фураніл, піроліл, імідазоліл, піразоліл, тіазоліл, ізотіазоліл, оксазоліл, оксадіазоліл, тіадіазоліл, азиридиніл, азетидиніл, піролідиніл, піролініл, імідазолідиніл, імідазолініл, піразолідиніл, тетрагідрофураніл, піраніл, піроніл, піридил, піразиніл, піридазиніл, піперидил, гексагідроазепініл, піперазиніл, морфолініл, тіанафтил, бензофураніл, ізобензофураніл, індоліл, оксііндоліл, ізоіндоліл, індазоліл, індолініл, 7-азаіндоліл, бензопіраніл, кумариніл, ізокумариніл, хінолініл, ізохінолініл, нафтридиніл, цинолініл, хіназолініл, піридопіридил, бензоксазиніл, хіноксалініл, хроменіл, хроманіл, ізохроманіл, фталазиніл і карбоніл). (Низч.)алкільні групи є заміщеними або незаміщеними, переважно незаміщеними. Якщо вони заміщені, то містять від 1 до 3, переважно 1 замісник. Замісники включають перераховані вище групи замісників, відмінні від алкілу, арилу й арилалкілу. Термін «алкокси» означає алкіл-О- і термін «алканоїл» означає алкіл-СО-. Алкокси або алкокси-вмісні групи заміщені однією або більше алкільними групами. Термін «галоген» означає фтор, хлор, бром або йод, переважно фтор, хлор або бром, більш переважно фтор або хлор. Термін «фармацевтично прийнятна сіль» означає кислотно-адитивні солі або основноадитивні солі, які зберігають біологічну ефективність і властивості сполук формули І і які с солями придатних нетоксичних органічних або неорганічних кислот або органічних або неорганічних основ. Приклади кислотно-адитивних солей включають солі неорганічних кислот, таких як хлористоводне 13 90039 14 ва кислота, бромистоводнева кислота, йодистовоТермін «модифікований-Tyr» означає тирозин, днева кислота, сірчана кислота, сульфамінова модифікований будь-яким способом, що переважкислота, фосфорна кислота й азотна кислота, а но містить 1-3 замісники, переважно 1-2 замісники, також солі органічних кислот, таких як оцтова киснезалежно вибраних із групи, яка включає лота, пара-толуолсульфонова кислота, саліцилова (нижч.)алкіл і галоген. Переважно модифікованийкислота, метансульфонова кислота, щавлева кисTyr означає метилтирозин, переважно С- лота, янтарна кислота, лимонна кислота, яблучна метилтирозин (С- -Ме-Tyr), 3-йодтирозин ((3-I)Y), кислота, молочна кислота, фумарова кислота й 3,5-дифтортирозин ((3,5-ди-Р)Y), 2,6т.п. Приклади основно-адитивних солей включадифтортирозин ((2,6-ди-Р)Y) і 2,6-диметилтирозин ють солі амонію, калію, натрію й гідроксиди четве((2,6-ди-Ме)Y). Інший переважний модифікованийртинного амонію, таких як, наприклад, гідроксид Tyr означає мета-тирозин ((m-)Y). Насамперед тетраметиламонію. Перетворення фармацевтичпереважний модифікований-Tyr вибирають із наної сполуки (наприклад, лікарського препарату) у ведених нижче конкретних прикладів. сіль відоме й використовується з метою поліпшенТермін «модифікований-Phe» означає феніланя властивостей, включаючи фізичну й хімічну ланін, модифікований будь-яким способом, що стабільність, наприклад, гігроскопічність, текучість переважно містить 1-4 замісники, незалежно вибабо розчинність сполук. Див. наприклад, Н. Ansel і. раних із групи, яка включає (нижч.)алкіл, гідрокдр., Pharmaceutical Dosage Forms and Drug си(нижч.)алкіл, фтор(нижч.)алкіл, (нижч.)алкокси, Delivery Systems, (6 вид.), стор. 196 і 1456-1457 аміно й галоген. Переважно модифікований-Phe (1995). означає 4-метоксифенілаланін (F(4-O-CH3)), 4Термін «фармацевтично прийнятний ефір» амінофенілаланін ((4-NH2)Phe), 4означає етерифіковаиу сполуку формули І, що фторфенілаланін ((4-F)Phe), 4містить карбоксильну групу, яка зберігає біологічну гідроксиметилфенілаланін ((4-CH2OH)Phe), 4ефективність і властивості сполук формули І і ротрифторметилфенілаланін ((4-CF3)Phe), 3зщеплюється in vivo (в організмі) до відповідної фторфенілаланін ((3-F)Phe), 2,3,4,5,6активної карбонової кислоти. Приклади ефірних пентафторфенілаланін ((2,3,4,5,6-пента-Р)Рhе) і груп, які розщеплюються (при гідролізі) in vivo до 3,4-дихлорфенілаланін ((3,4-ди-Сl)Рhе). Насампевідповідних карбонових кислот, включають групи, у ред переважний модифікований-Phe вибирають із яких відщеплюваний водень замінений на наведених нижче конкретних прикладів. (нижч.)алкіл, який необов'язково заміщений, наТермін «гідрокси(нижч.)алкіл» означає приклад, гетероциклом, циклоалкілом і т.п. Прик(нижч.)алкільні групи, як вказано вище, заміщені лади заміщених (нижч.)алкільних ефірів включагідрокси групою, переважно гідроксиметил. ють ефіри, у яких (нижч.)алкіл заміщений Термін «фтор(нижч.)алкіл» означає наступними групами: піролідин, піперидин, мор(нижч.)алкільні групи, як вказано вище, моно-або фолін, N-метилпіперазин і т.п. Група, яка відщепполі-заміщені фтором. Приклади люється in vivo, означає, наприклад, етил, морфофтор(нижч.)алкільних груп включають, наприклад, ліноетил і діетиламіноетил. У даний винахід також CFH2, СF2Н, СF3, CF3CH2, CF3(CH2)2, (CF3)2CH і включена група -CONH2, тому що -NH2 відщеплюCF2H-CF2, переважно СF3. ється in vivo і замінюється на гідроксигрупу з утвоДаний винахід стосується агоніста рецептора ренням відповідної карбонової кислоти. нейропептиду-2 формули (І) де X означає 4-оксо-6-(1-піперазиніл)-3(4Н)хіназоліноцтову кислоту (Pqa), Υ означає Η, ацил, заміщений або незаміщений алкіл, заміщений або незаміщений (нижч.)алкіл, заміщений або незаміщений арил, заміщений або незаміщений гетероарил, заміщений або незаміщений алкокси, залишок поліетиленгліколю, ПЕГm-SSA, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВТС, Y' означає Н, залишок поліетиленгліколю, ПЕГm-SSA, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВТС, R1 означає ІІе, Ala, (D)Ile, N-метил-ІІе, Aib, 1-1Аіс, 2-2-Aic, Ach або Аср, R2 означає Lys, Ala, (D)Lys, NMeLys, Nle або (Lys-Gly), R3 означає Arg, Ala, (D)Arg, N-метил-Arg, Phe, 3,4,5-трифтор-Рhе або 2,3,4,5,6-пентафтор-Phe, R4 означає His, Ala, (D)His, М-метил-Ніs, 4MeOApc, 3-Pal або 4-Pal, R5 означає Tyr, Ala, (D)Tyr, N-метил-Tyr, Trp, Tic, Вір, Dip, (1) Nal, (2) Nal, 3,4,5-трифтор-Phe або 2,3,4,5,6-пентафтор-Рhе, R6 означає Leu, Ala, (D)Leu або N-метил-Leu, R7 означає Asn, Ala або (D)Asn, R8 означає Leu або Trp, R9 означає Val, Ala, (D)Val або N-метил-Vаl, R10 означає Thr, Ala або N-метил-Тhr, R11 означає Arg, (D)Arg або N-метил-Arg, R12 означає Gln або Ala, R13 означає Arg, (D)Arg або N-мeтил-Arg, R14 означає Tyr, (D)Tyr або N-метил-Tyr, модифікований-Tyr, Phe, модифікований-Phe, Cha, (1) Nal, (2) Nal, С- -метил-Tyr або Trp, і ПЕГm означає ПЕГ із ММ від 1 до 60кDa, або його фармацевтично прийнятної солі. 15 90039 16 Переважними є сполуки формули (І) в індивіПереважно R1 у складі агоніста рецептора дуальній формі й у формі їх фармацевтично принейропептиду-2, як описано вище, означає llе. йнятних солей, насамперед переважними є сполуКрім того, переважно R2 означає Lys або Nle. Крім ки формули (І). того, переважно R3 означає Arg. Крім того, переПереважним агоністом рецептора нейропепважно R4 означає His. Крім того, переважно R5 тиду-2, як описано вище, є сполуки формули (Іа) означає Tyr. Крім того, переважно R6 означає Leu. Крім того, переважно R7 означає Asn. Крім того, Y-R1-R2-X-R3-R4-R5-R6-R7-R8-R9-R10-R11-R12-R13переважно R8 означає Leu або Trp. Крім того, пе(Іа) R14-NH2 реважно R9 означає Val. Крім того, переважно R10 означає Thr. Крім того, переважно R11 означає Arg. де Крім того, переважно R12 означає Gln. Крім того, X означає N-піперазин-1-іл-4-(3Н)-хіназолінонпереважно R13 означає Arg або (N-метил)Arg. Крім 3-оцтову кислоту (Pqa), того, переважно R14 означає Tyr, (D)Tyr або NΥ означає Η, ацил, заміщений або незаміщеметил-Tyr, модифікований-Tyr, Phc, модифікований алкіл, заміщений або незаміщений ний-Phe або Trp. Переважно R14 означає Y, (m-)Y, (нижч.)алкіл, заміщений або незаміщений арил, (3-І)Υ, (3,5-ди-Р)Y, (2,6-ди-F)Y, (2,6-ди-Me)Y, F(4-Oзаміщений або незаміщений алкокси, залишок CH3), F, (4-NH2)Phe, (4-F)Phe, (4-CH2OH)Phe, (416-CF3)Phe, (3-F)Phe, (2,3,4,5,6-пента-F)Phe, (3,4поліетиленгліколю, ΠΕΓ-SSA, ΠΕΓ- -SBA, ΠΕΓди-СІ)Рhе, Cha, W, (1) Nal, (2) Nal або С- -Me-Tyr. SPA або ПЕГ-ВТС, 14 R1 означає ІІе, Ala, (D)Ile, N-метил-ІІе, Aib, 1-1Більш переважно, R означає Tyr або (2,6 ди Аіс, 2-2-Aic, Ach або Аср, F)Tyr. R2 означає Lys, Ala, (D)Lys, NMeLys, Nle або Переважно агоніст рецептора нейропептиду-2, (Lys-Gly), як описано вище, вибирають із групи, яка включає R3 означає Arg, Ala, (D)Arg, N-метил-Arg, Phe, IK-Pqa-RHYLNLVTRQRY, 3,4,5-трифтор-Рhе або 2,3,4,5,6-пентафтор-Phc, IK-Pqa-RHYLNLVTRQ(N-мeтил)RY, R4 означає His, Ala, (D)His, N-метил-Ніs, 4IK-Pqa-RHYLNLVTRQ(N-метил)R(m-)Y, MeOApc, 3-Pal або 4-Pal, IK-Pqa-RHYLNLVTRQ(N-мeтил)R(3-I)Y, R5 означає Tyr, Ala, (D)Tyr, N-метил-Tyr, Тrp, IK-Pqa-RHYLNLVTRQ(N-метил)R(3,5-ди-F)Y, Tic, Вір, Dip, (1) Nal, (2) Nal, 3,4,5-грифтор-Phe або IK-Pqa-RHYLNLVTRQ(N-метил)R(2,6-ди-F)Y, 2,3,4,5,6-пентафтор-Рhе, IK-Pqa-RHYLNLVTRQ(N-мeтил)R(2,6-ди-Me)Y, R6 означає Leu, Ala, (D)Leu або N-метил-Lеu, IK-Pqa-RHYLNLVTRQ(N-метил)RF(4-O-CH3), R7 означає Asn, Ala або (D)Asn, IK-Pqa-RHYLNLVTRQ(N-метил)RF, R8 означає Leu або Trp, IK-Pqa-RHYLNLVTRQ(N-метил)R(4-NH2)Phe, R9 означає Val, Ala, (D)Val або N-метил-Val, IK-Pqa-RHYLNLVTRQ(N-метил)R(4-F)Phe, R10 означає Thr, Ala або N-метил-Тhr, IK-Pqa-RHYLNLVTRQ(N-метил)R(4R11 означає Arg, (D)Arg або N-метил-Arg, CH2OH)Phe, R12 означає Gln або Ala, IK-Pqa-RHYLNLVTRQ(N-метил)R(4-CF3)Phe, R13 означає Arg, (D)Arg або N-мeтил-Arg і IK-Pqa-RHYLNLVTRQ(N-мeтил)R(3-F)Phe, R14 означає Tyr, (D)Tyr або N-метил-Tyr, моIK-Pqa-RHYLNLVTRQ(N-мeтил)R(2,3,4,5,6дифікований-Tyr, Phe, модифікований-Phe або Trp, пeнтa-F)Phe, або її фармацевтично прийнятна сіль. IK-Pqa-RHYLNLVTRQ(N-метил)R(3,4-диПереважний варіант даного винаходу стосуCl)Phe, ється агоніста рецептора нейропептиду-2, як опиIK-Pqa-RHYLNLVTRQ(N-метил)RCha, сано вище, у якому R2 заміщений групою Y', a Y' IK-Pqa-RНYLNLVTRQ(N-метил)RW, означає Н, залишок поліетиленгліколю, ПЕГm-SSA, IK-Pqa-RHYLNLVTRQ(N-метил)R(1)NaI, IK-Pqa-RHYLNLVTRQ(N-метил)R(2)Nal, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВТС. Більш переважно Y' означає залишок поліетиленгліколю, IK-Pqa-RHYLNLVTRQR-C- -Me-Tyr, IK-Pqa-RНYLNWVTRQ(N-метил)RY, ПЕГm-SSA, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВТС. ІNlc-Pqa-RНYLNWVTRQ(N-метил)RY, Інший переважний варіант даного винаходу Ac-IK-Pqa-RНYLNWVTRQ(N-метил)R(2,6-дистосується агоніста рецептора нейропептиду-2, як F)Y, описано вище, у якому Ac-IK-Pqa-RHYLNWVTRQ(N-метил)RY, Υ означає Η або ацил, а пентил-IK-Pqa-RНYLNWVTRQ(N-метил)RY, Υ' означає залишок поліетиленгліколю, ПЕГmтриметилацетил-IK-Pqa-RHYLNWVTRQ(NSSA, ПЕГm- -8ВА, ПЕГm-SPA або ПЕГm-ВТС. Більш метил)RY, переважно Υ' означає ПЕГm-SSA або ПЕГm-SPA. циклогексил-IK-Pqa-RHYLNWVTRQ(NПереважно Υ означає ацил. В іншому переваметил)RY, жному варіанті Υ означає Н. Крім того, переважно бензоїл-IK-Pqa-RHYLNWVTRQ(N-метил)RY, Υ' означає Н. адамантил-IK-Pqa-RHYLNWVTRQ(NПереважно молекулярна маса ПЕГm у складі метил)RY, агоніста рецептора нейропептиду-2, як описано (ПЕГ-30000 SPA)IK-Pqa-RHYLNWVTRQ(Nвище, дорівнює 20-40кDa. Переважно молекулярметил)RY, на маса ПЕГm дорівнює 30кDa. Переважно, моле(ПЕГ-40000 BTC)-IK-Pqa-RHYLNWVTRQ(Nкулярна маса залишку поліетиленгліколю станометил)RY, вить від 1 до 60кDa, більш переважно 20-40кDa, (ПЕГ-30000)-SSA-INle-Pqa-RHYLNWVTRQ(Nнайбільш переважно 30кDa. метил)RY, 17 90039 18 (ПЕГ-30000)-бета-SBA-INle-PqaAc-IA-Pqa-RHYLNLVTRQRY, RHYLNWVTRQ(N-метил)RY, AK-Pqa-RHYLNLVTRQRY, Ac-Ile-Lys(ПЕГ-30000 SPA)-PqaIK-Pqa-RHYLNLVTRQR(D)Y, RHYLNWVTRQ(N-метил)RY, IK-Pqa-RHYLNLVTRQ(D)RY, Ac-Ile-Lys(ПЕГ-30000 SSA)-PqaIK-Pqa-RHYLNLVT(D)RQRY, RHYLNWVTRQ(N-метил)RY і IK-Pqa-RHYLNL(D)VTRQRY, IK(ПЕГ-30000 SSA)-Pqa-RHYLNWVTRQ(NIK-Pqa-RHYL(D)NLVTRQRY, метил)RY, IK-Pqa-RHY(D)LNLVTRQRY, або їх фармацевтично прийнятну сіль. IK-Pqa-RH(D)YLNLVTRQRY, Інший переважний агоніст рецептора нейропеIK-Pqa-R(D)НYLNLVTRQRY, птиду-2, як описано вище, вибирають із групи, яка 1K-Pqd-(D)RНYLNLVTRQRY, включає I(D)K-Pqa-RНYLNLVTRQRY, Ac-Ile-Lys(ПЕГ-30000 SPA)-Pqa(D)IK-Pqa-RHYLNLVTRQRY, RHYLNWVTRQ(N-метил)RY, IK-Pqa-RHYLNLVTRQR(N-метил)Y, Ac-Ile-Lys(ПЕГ-30000 SSA)-PqaIK-Pqa-RHYLNLVTRQ(N-мeтил)RY, RHYLNWVTRQ(N-метил)RY і IK-Pqa-RHYLNLVT(N-метил)RQRY, IK(ПЕГ-30000 SSA)-Pqa-RHYLNWVTRQ(NIK-Pqa-RHYLNLV(N-метил)TRQRY, метил)RY, IK-Pqa-RH YLNL(N-метил)VTRQRY, або їх фармацевтично прийнятну сіль. IK-Pqa-RHY(N-метил)LNLVTRQRY, Переважні описані вище сполуки не є фармаIK-Pqa-RH(N-метил)YLNLVTRQRY, цевтично прийнятними солями. Кожна з конкретIK-Pqa-R(N-метил)HYLNLVTRQRY, них сполук, згаданих вище, є переважним варіанIK-Pqa-(N-метил)RHYLNLVTRQRY, том. I(N-мeтил)K-Pqa-RHYLNLVTRQRY, Насамперед переважним агоністом рецептора (N-метил)IK-Pqa-RHYLNLVTRQRY, нейропептиду-2, як описано вище, є Ac-IK-PqaINle-Pqa-RHYLNLVTRQRY, RHYLNWVTRQ(N-метил)R(2,6-ди-F)Y. Ac-INle-Pqa-RHYLNLVTRQRY, Іншим насамперед переваленим агоністом реAc-INle-Pqa-FHYLNLVTRQRY, цептора нейропептиду-2, як описано вище, є AcIK-Pqa-RHWLNLVTRQRY, IK-Pqa-RHYLNWVTRQ(N-метил)RY. IK-Pqa-AHWLNLVTRQRY, Іншим насамперед переважним агоністом реAc-INle-Pqa-RHYLNLVTRQR(D)Y, цептора нейропептиду-2, як описано вище, є (ПЕГAc-INle-Pqa-RHYLNLVTRQR(N-метил)Y, 30000)-SPA-IK-Pqa-RHYLNWVTRQ(N-метил)RY. Ac-INle-Pqa-RHTicLNLVTRQRY, Іншим насамперед переважним агоністом реAc-INle-Pqa-RHBipLNLVTRQRY, цептора нейропептиду-2, як описано вище, є (ПЕГAc-INle-Pqa-RHDipLNLVTRQRY, 30000)-SSA-INle-Pqa-RHYLNWVTRQ(N-метил)RY. Ac-INle-Pqa-RH(1)NalLNLVTRQRY, Іншим насамперед переважним агоністом реAc-INlc-Pqa-RH(2)NalLNLVTRQRY, цептора нейропсптиду-2, як описано вище, є AcAc-INle-Pqa-RH(3,4,5-трифторIle-Lys(ПЕГ-30000 SSA)-Pqa-RHYLNWVTRQ(NPhe)LNLVTRQRY, метил)RY. Аc-INle-Pqa-RH(2,3,4,5,6-пeнтaфтоpІншим насамперед переважним агоністом реPhe)LNLVTRQRY, цептора нейропептиду-2, як описано вище, є Н-IlcAc-INle-Pqa-R(4-MeOApc)YLNLVTRQRY, Lys(ПЕГ-30000 SSA)-Pqa-RHYLNWVTRQ(NAc-INlc-Pqa-R(3-Pal)YLNLVTRQRY, метил)RY. Ac-INlc-Pqa-R(4-Pal)YLNLVTRQRY, Агоністи рецептора нейропептиду-2, як описаAc-INle-Pqa-(3,4,5-трифторно вище, які не містять залишок ПЕГ, наприклад, у Phe)HYLNLVTRQRY, яких обидва Υ і Υ' не означають залишок ПЕГ, Ac-INlc-Pqa-(2,3,4,5,6-пeнтaфтоPhe)HYLNLVTRQRY, ПЕГm-SSA, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВТС, Ac-Aib-Nlc-Pqa-RНYLNLVTRQRT, можна використовувати як проміжні сполуки для Ac1-1-Aic-Nle-Pqa-RHYLNLVTRQRT, одержання сполук, у яких один або обидва Υ і Υ' Ac1-1-Aic-Nle-Pqa-RHYLNLVTRQRT, означають залишок полі(етилен)гліколю, ПЕГmAc-2-2Aic-Nle-Pqa-RHYLNLVTRQRT, SSA, ПЕГm- -SBA, ПЕГm-SPA або ПЕГm-ВТС. Такі Ac-Ach-Nle-Pqa-RHYLNLVTRQRT, групи Υ і Υ' вводять стандартними методами. Ac-Acp-Nle-Pqa-RHYLNLVTRQRT, Переважно агоніст рецептора нейропептиду-2, H-INle-Pqa-RHYLNLVTRQRY, як описано вище, не вибирають із групи, яка вклю(ПЕГ-10000) INle-Pqa-RHYLNLVTRQRY і чає (ПЕГ-30000) INle-Pqa-RHYLNLVTRQRY. IK-Pqa-RHYLNLVTRQRY, Перевага сполук за даним винаходом полягає c-IK-Pqa-RHYLNLVTRQRY, в тому, що, наприклад, вони є вкороченими фрагIK-Pqa-RHYLNLVTRARY, ментами ΡΥΥ3-36. Більш короткі пептиди, наприIK-Pqa-RHYLNLVARQRY, клад, можна одержати не тільки більш простими IK-Pqa-RHYLNLATRQRY, методами синтезу й очищення, але вони також IK-Pqa-RHYLALVTRQRY, дозволяють підвищити ефективність процесу пеIK-Pqa-RHYANLVTRQRY, реробки й знизити вартість продукту. Крім того, IK-Pqa-RHALNLVTRQRY, сполуки за винаходом взаємодіють переважно з IK-Pqa-RAYLNLVTRQRY, рецепторами Y2, а не з їх гомологами, такими як IK-Pqa-AHYLNLVTRQRY, IA-Pqa-RHYLNLVTRQRY, 19 90039 20 NPY Y1, Y4 і Y5. Таким чином, небажані побічні дії порушеного рівня глюкози в крові натще й поруяк агоніста або антагоніста зведені до мінімуму. шення толерантності до глюкози. Сполуки за винаходом переважно можна виВинахід також стосується застосування агоніскористовувати для лікування метаболічних захвота рецептора нейропептиду-2, як описано вище, рювань або розладів. До таких метаболічних задля одержання лікарських засобів, призначених хворювань і розладів належать, наприклад, для медикаментозного та/або профілактичного ожиріння, діабет, насамперед типу 2, метаболічлікування захворювань, які модулюються агонісний синдром (відомий також як синдром X), резистами рецептора нейропептиду-2, насамперед для тентність до інсуліну, дисліпідемія, порушений медикаментозного й профілактичного лікування рівень глюкози в крові натще й порушення толераожиріння, діабету типу 2, метаболічного синдрому, нтності до глюкози. резистентності до інсуліну, дисліпідемії, порушеноУ зв'язку із цим винахід також стосується фаго рівня глюкози в крові натще й порушення толермацевтичних композицій, які включають агоніст рантності до глюкози. Лікарські засоби включають рецептора нейропептиду-2, як описано вище, і також агоніст рецептора нейропептиду-2, як опифармацевтично прийнятний носій та/або ад'ювант. сано вище. Більш того, винахід включає агоніст рецептора Слід розуміти, що даний винахід не обмеженейропептиду-2, як описано вище, для застосуний конкретними варіантами, описаними в даному вання як терапевтично активна речовина, насамконтексті й що можливо модифікації конкретних перед як терапевтично активна речовина, признаваріантів, які не виходять за межі обсягу доданої чена для лікування та/або профілактики формули винаходу. Слід розуміти, що використані захворювань, які модулюються агоністами рецепдля опису винаходу терміни не обмежують обсяг тора нсйропетиду-2, насамперед як терапевтично винаходу, який визначений у пунктах формули активна речовина, призначена для лікування винаходу. та/або профілактики ожиріння, діабету типу 2, меДокладна інформація про одержання й застотаболічного синдрому, резистентності до інсуліну, сування складних ефірів для доставки фармацевдисліпідемії, порушеною рівня глюкози в крові натичних сполук описані в статтях Design of тще й порушення толерантності до глюкози. Prodrugs, ред. Bundgaard H., (Elsevier, 1985), Η. В іншому варіанті здійснення даного винаходу Ansel і ін., Pharmaceutical Dosage Forms and Drug пропонується спосіб медикаментозного та/або Delivery Systems (6-е видання), 108-109 (1995), профілактичного лікування захворювання, яке моKrogsgaard-Larsen і ін., Textbook of Drug Design дулюється агоністами рецептора нейропептиду-2, and Development (2-е видання), 152-191 (1996). насамперед для медикаментозного та/або профіТипові сполуки за винаходом можна синтезулактичного лікування метаболічних захворювань і вати за відомою стандартною методикою утворенрозладів, насамперед ожиріння, діабету типу 2, ня пептидних зв'язків між амінокислотами. Така метаболічного синдрому, резистентності до інсулістандартна методика включає, наприклад, будьну, дисліпідемії, порушеного рівня глюкози в крові який розчин, у якому проводять конденсацію між натще й порушення толерантності до глюкози, і вільною -аміногрупою амінокислоти або залишку, вказаний спосіб включає введення агоніста рецепу яких карбоксильна група й інші реакційноздатні тора нейропептиду-2, як описано вище, людині групи захищені, і вільною первинною карбоксильабо тварині. У переважному способі, як описано ною групою іншої амінокислоти або залишку, у вище, вказаний агоніст рецептора нейропептиду яких аміногрупи або інші реакційноздатні групи вводять вказаному пацієнтові один раз на добу. захищені. Переважно вказаний агоніст рецептора нейропепТакі стандартні методи синтезу нових сполук тиду-2 вводять вказаному пацієнтові один раз чеза даним винаходом включають, наприклад, будьрез кожні три доби. Більш переважно вказаний який метод твердофазного синтезу пептидів. Таагоніст рецептора нейропептиду вводять вказанокий метод одержання нових сполук включає посліму пацієнтові один раз на тиждень. Переважно довне приєднання необхідних амінокислотних завказаний агоніст рецептора нейропептиду-2 вволишків (у цей момент часу одного амінокислотного дять вказаному пацієнтові пероральним, інтраназалишку) до зростаючого пептидного ланцюга згізальним, внутрішньовенним, підшкірним, парентедно із загальним принципом твердофазного меторальним, черезшкірним, внутрішньоочеревинним, ду синтезу. Такі методи описані, наприклад, у ректальним або інгаляційним способами. Перевастаттях Merrifield R. В., J. Amer. Chem. Soc. 85, жно агоніст рецептора нейропептиду-2 вводять 2149-2154 (1963); Вarany і ін., The Peptides, інтраназальним способом. Переважно вказаний Analysis, Synthesis and Biology, т. 2, (ред.) Gross Ε. агоніст рецептора нейропептиду-2 вводять підшкіі Mcicnhofer J., Academic Press, 1-284 (1980), які рним способом. Вказаний агоніст рецептора нейвключені в даний опис як посилання. ропептиду-2 вводять вказаним вище способом у Основний принцип хімічного синтезу пептидів дозі від приблизно 0,001мг до приблизно 100мг. полягає в захисті реакційноздатних груп у боковоВинахід також стосується застосування агонісму ланцюзі різних амінокислотних залишків відпота рецептора нейропептиду-2, як вказано вище, відними захисними групами, які виключають хімічдля медикаментозного та/або профілактичного ну взаємодію цієїгрупи доги, поки захисна група лікування захворювань, які модулюються агонісне вилучена. Звичайно захищають -аміногрупу в тами рецептора нейропептиду-2, насамперед для амінокислоті або фрагменті, і в реакції бере участь медикаментозного та/або профілактичного лікукарбоксильна група, потім вибірково видаляють вання ожиріння, діабету типу 2, метаболічного захисну групу -аміногрупи, яка потім бере участь синдрому, резистентності до інсуліну, дисліпідемії, у наступній стадії реакції нарощування пептидного 21 90039 22 ланцюга. У той час як специфічні захисні групи для одержували на фірмі Halocarbon або Fluka і викотвердофазного синтезу описані в літературі, слід ристовували без додаткового очищення. зазначити, що для захисту кожної амінокислоти Діізопропілкарбодіімід (DIC) і діізопропілетиможна використовувати стандартні захисні групи, ламін (DIPEA) одержували на фірмі Fluka або які використовуються для синтезу пептидів у розAldrich і використовували без додаткового очичині. щення. Гідроксбензотриазол (НОВТ), диметилсульфід (DMS) і 1,2-етандитіол (EDT) одержували на -Аміногрупи захищають відповідними захисфірмі Sigma Chemical Co. і використовували без ними групами, які вибирають із ароматичних захидодаткового очищення. Захищені амінокислоти в сних груп уретанового типу, таких як алілоксикаросновному в конфігурацію L одержували на фірбоніл, бензилоксикарбоніл (Z) і заміщений мах Bachem або Neosystem. Ступінь чистоти реабензилоксикарбоніл, такі як парагентів підтверджували методом тонкошарової хлорбензилоксикарбоніл, парахроматографії, ЯМР і вимірюванням точки плавнітробензилоксикарбоніл, паралення перед використанням. Бензгідриламінну бромбензилоксикарбоніл, парасмолу (ВНА), співполімер стиролу - 1%, дивінілбебифенілізопропілоксикарбоніл, 9нзолу (100-200 або 200-400меш) одержували на флуоренілметилоксикарбоніл (Fmoc) і парафірмі Bachem або Advanced Chemtech. Загальний метоксибензилоксикарбоніл (Moz), аліфатичні завміст азоту в зразках смоли звичайно становив хисні групи уретанового типу, такі як трет0,3-1,2мекв./г. бутилоксикарбоніл (Вос), діізопропілметилоксикаУ переважному варіанті здійснення даного вирбоніл, ізопропілоксикарбоніл і алілоксикарбоніл. У находу пептиди одержували методом твердофазданому контексті Fmoc є найбільш переважною ного синтезу, який в основному описаний у статті амінозахисною групою. Merrifield, J. Amer. Chem. Soc, 85, 2149 (1963), хоча Гуанідинові групи можна захищати відповідможна використовувати й інші аналогічні методи ними захисними групами, вибраними з нітро, парахімічного синтезу, відомі в даній галузі техніки, як толуолсульфоніл (Tos), (Ζ), пентаметилхроманеописано вище. Твердофазний синтез починають із сульфоніл (Pmc), 4-метокси-2,3,6,С-кінцевого фрагмента пептиду, тобто до відповітриметилбензолсульфоніл (Mtr), причому групи дної смоли приєднують захищену по -аміногрупі (Pmc) і (Mtr) є найбільш переважними для захисту амінокислоту. Такий вихідний матеріал одержують аргініну (Arg). приєднанням -амінозахищеної амінокислоти че-Аміногрупи можна захищати відповідними рез складноефірний зв'язок до смоли з іммобілізозахисними групами, вибраними з 2ваним пара-бензилоксибензилспиртом (смола хлорбензилоксикарбоніл (2-CІ-Z), 2Wang), або через амідний зв'язок між Fmocбромбензилоксикарбоніл (2-Br-Z) і третлінкером, таким як пapa-((R,S)- -(1-(9Н-флуоренбутилоксикарбоніл (Вос). Вос є найбільш переважною групою для захисту Lys. 9-іл)метоксиформамідо-2,4Гідроксильні групи (ОН) можна захищати віддиметилоксибензил)феноксіоцтова кислота (лінповідною захисною групою, вибраною із групи, яка кер Rink), і бензгідриламіногрупами смоли (ВНА). включає бензил (Bzl), 2,6-дихлорбензил (2,6-diClОдержання смоли з іммобілізованими гідроксимеBzl), і трет-бутил (t-Bu), причому (t-Bu) є найбільш тильними групами описано в літературі. Смолу переважною групою для захисту (Tyr), (Ser) і (Thr). Fmoc-лінкер-ВНА можна придбати на фірмі й використовувати, якщо пептид, який необхідно син- і -Амідні групи можна захищати відповідтезувати, містить у С-кінцевому фрагменті незаною захисною групою, вибраною із групи, яка міщений амід. включає 4-метилтритил (Mtt), 2,4,6Звичайно, амінокислоту або її міметик приєдтриметоксибензил (Tmob), 4,4-димстоксидитил-біснують до смоли Fmoc-лінкер-ВНА, з використан(4-метоксифеніл)метил (Dod) і тритил (Trt). Trt с ням Fmoc-захищеної амінокислоти або міметика, у найбільш переважною групою для захисту (Asn) і присутності 2-5екв. амінокислоти й конденсуючого (Gln). реагента. Після конденсації, смолу відмивають і Індольні групи (ОН) можна захищати відповідсушать у вакуумі. Вміст амінокислоти в смолі виною захисною групою, вибраною із групи, яка значають за результатами амінокислотного аналівключає форміл (For), мезитил-2-сульфоніл (Mts) і зу зразка смоли, що містить Fmoc і амінокислоту, трет-бутилоксикарбоніл (Вос). Вос с найбільш пеабо методом УФ-спектроскопії за вмістом груп реважною групою для захисту (Trp). Fmoc. Будь-які аміногрупи, які не прореагували, Імідазольну групу можна захищати відповідблокують при обробці смоли оцтовим ангідридом і ною захисною групою, вибраною із групи, яка діізопропілетиламіном у хлористому метилені. включає бензил (Bzl), трет-бутилоксикарбоніл Амінокислоти приєднують до смоли послідов(Вос) і тритил (Trt). Trt є найбільш переважною но в ході повторних циклів обробки. Fmocгрупою для захисту (His). амінозахисні групи видаляють у лужних умовах. Синтез амінокислоти Pqa описаний у статті J. Для цих цілей використовують піперидин, піпераHutchinson і ін., J .Med. Chem., 39, 4583-4591 зин або морфолін (20-40об.%) у ДМФА, переважно (1996). Похідне Fmoc-Pqa одержували на фірмі 40% піперидин у ДМФА. NeoMPS Inc. (San Diego CA). Потім після видалення -амінозахисної групи Всі розчинники, ізопропанол (iPrOH), хлористий метилен (СН2Сl2), диметилформамід (ДМФА) і на кожній стадії приєднують наступні захищені N-метилпіролідон (NMP) одержували на фірмі амінокислоти в необхідному порядку й одержують Fisher або Burdick & Jackson і використовували без проміжне похідне, захищену пептид-смолу. Викододаткової перегонки. Трифтороцтову кислоту ристовують активуючі реагенти для конденсації 23 90039 24 амінокислот, відомі для твердофазного синтезу їзопропілсилану й 9,5мл трифтороцтової кислоти пептидів. Наприклад, придатні реагенти для такого на 1г смоли при кімнатній температурі протягом синтезу включають гексафторфосфат бензотриа180хв. Смолу відокремлювали фільтруванням і зол-1-ілокситри(диметиламіно)фосфонію (ВОР), пептид у фільтраті осаджували охолодженим етигексафторфосфат бром-трис-піролідинофосфонію ловим ефіром. Осад центрифугували, а ефірний (РуВrоР), гексафторфосфат 2-(1Н-бензотриазол-1шар відкидали. Залишок промивали двома або іл)-1,1,3,3-теграметилуронію (HBTU), і діізопропілтрьома об'ємами Еt2О і знову центрифугували. карбодіімід (DIC). Переважними є HBTU і DIC. МоНеочищені продукти висушували у вакуумі. жна використовувати інші активуючі агенти, опиПептиди в основному очищали в системі сані в книзі Ваrаnу і Merrifield, The Peptides, т. 2, Shimadzu LC-8A для РХВР на колонці зі обернеред. J. Meienhofer, Academic Press, стор. 1-284 ною фазою С-18 (50 250мм, 300 А, 10-15мкм). (1979). Для оптимізації циклів пептидного синтезу Пептиди наносили на колонку у мінімальному в конденсовану суміш можна додавати різні реагеоб'ємі розчину 0,1 АсОН/Н2О або СН3СН/Н2О. нти, такі як 1-гідроксибензотриазол (НОВТ), NЕлюцію проводили в градієнті концентрації ацетогідроксисукцинімід (HOSu) і 3,4-дигідро-3-гідроксинітрилу: спочатку 2% буферний розчин В, потім 4-оксо-1,2,3-бензотриазин (НООВТ). У цьому ви2%-70% В протягом 70хв, (буферний розчин А: падку переважним є НОВТ. 0,1% ТФК/Н2О, буферний розчин В: 0,1% Для одержання N-кінцевих ацетилпохідних ТФК/СН3СN), швидкість потоку 50мл/хв, УФпроводять ацетилування, тобто зв'язаний зі смодетекція при 220/280нм. Фракції, що містять пролою пептид обробляють 20% оцтовим ангідридом дукти, збирали, і ступінь чистоти пептидів оцінюу ДМФА в присутності 5% DIEA. Іншу реакцію Nвали в аналітичній системі Shimadzu LC-10AT, на кінцевого ацилування проводять із використанням колонці з оберненою фазою Асе СІ8 (4,6 50мм), відповідної карбонової кислоти, що активують in швидкість потоку 2мл/хв, градієнт (2-70%) протяsitu у присутності DIC/HOВТ протягом 30хв. гом 10хв (буферний розчин А: 0,1% ТФК/Н2О, буНижче показана типова методика циклу синтеферний розчин В: 0,1% ТФК/СН3СN)). Фракції, що зу. містять пептид з високим ступенем очищення, збирали й висушували ліофільно. Методика 1 Чистоту кінцевих продуктів оцінювали аналітичної РХВР на колонці з оберненою фазою, як вкаСтадія Реагент Час зано вище. Чистота всіх продуктів становила при1 ДМФА близно 95-99%. Всі кінцеві продукти аналізували 2 30с також методом мас-спектрометрії, MC(FAB) або 2 20% піперидин/ДМФА 1хв MC(ES). Всі продукт характеризуються очікуваною 3 20% піперидин/ДМФА 15хв масою вихідного іона в стандартних межах. 4 ДМФА 2 30с Сполуки за даним винаходом одержують у 5 iPrOH 2 30с формі фармацевтично прийнятних солей Прикла6 ДМФА 3 x30с ди переважних солей включають фармацевтично 7 конденсація 60хв-18год прийнятні солі органічних кислот, наприклад, таких 8 ДМФА 2 30с як оцтова, молочна, малеїнова, лимонна, яблучна, 9 iPrOH 1 30с аскорбінова, янтарна, бензойна, саліцилова, ме10 ДМФА 1 30с тансульфонова, толуолсульфонова, трифтороцто11 CH2Cl2 2 30с ва або памоєва кислоти, а також полімерних кислот, таких як танінова кислот або карбоксиметилцелюлоза, і солі неорганічних кисРозчинники для всіх промивань і конденсацій лот, таких як галогенводневі кислоти (наприклад, додавали в кількості 10-20мл/г смоли. Повноту хлористоводнева кислота), сірчана кислота або реакції конденсації протягом усього синтезу вифосфорна кислота й т.п. Для одержання фармазначали нінгідриновим методом Кайзера (Kaiser і цевтично прийнятних солей можна використовуваін., Anal. Biochem. 34, 595-598 (1970)). Повільна ти будь-яку відому методику. кінетика спостерігалася при конденсації Fmoc-Arg При здійсненні способу за даним винаходом (Pmc) і при конденсації із вторинними амінами чена практиці ефективна кількість одного з пептидів рез стерично утруднену конформацію амінокислот. за даним винаходом або комбінації будь-яких пепУ випадку неповної реакції конденсації, стадію тидів за даним винаходом або їх фармацевіично повторювали з використанням свіжоприготовленої прийнятної солі, вводять будь-яким стандартним активованої амінокислоти або цей амінокислотний способом або комбінацією відомих способів. Спозалишок блокували при обробці смоли оцтовим луки можна вводити, наприклад, один раз на добу, ангідридом, як описано вище. Смолу із приєдна1 раз кожні 3 дні або 1 раз на тиждень. Сполуки ним пептидом, що містить всю необхідну амінокиабо композиції можна вводити пероральним спослотну послідовність, сушили у вакуумі протягом собом (трансбуккальним), сублінгвальним, парендекількох годин. теральним способом (наприклад, внутрішньом'яДля одержання більшості сполук блокуючі грузово, внутрішньовенно або підшкірно), ректальним пи видаляли й пептид відщеплювали від смоли. способом (наприклад, у вигляді супозиторіїв або Наприклад, пептид-смолу, обробляли 100мкл етарозчинів для промивання), черезшкірним спосондитіолу, 100мкл диметилсульфіду, 300 кл анізолу бом (наприклад, шкірної електропорацією) або й 9,5мл трифтороцтової кислоти на 1г смоли при інгаляційним способом (наприклад, у вигляді аекімнатній температурі протягом 180хв. Або в інрозолю) і у формі твердих, рідких або газоподібних шому варіанті пептид-смолу обробляли 1,0мл три 25 90039 26 лікарських засобів, включаючи таблетки й суспенрилізацією розчину. Придатні фармацевтичні ексзії. Введення можна здійснювати у вигляді окремих ципієнти включають крохмаль, целюлозу, тальк, стандартних лікарських форм у режимі тривалого глюкозу, лактозу, желатин, солод, рис, борошно, лікування або у вигляді однократної дози за рекокрейда, діоксид кремнію, стеарат магнію, стеарат мендацією лікаря. Терапевтичну композицію оденатрію, моностеарат гліцерину, хлорид натрію, ржують також у формі масляної емульсії або диссухе знежирене молоко, гліцерин, пропіленгліколь, персії в складі ліпофільних солей, таких як сіль воду, етанол і т.п. У композиції можна додавати памоєвої кислоти, або у формі біорозщеплювальстандартні фармацевтичні добавки, такі як консеної композиції з уповільненим вивільненням для рванти, стабілізатори, зволожувальні або емульгупідшкірного або внутрішньом'язового введення. вальні агенти, солі для регулювання осмотичного Таким чином, спосіб за даним винаходом мотиску, буферні речовини й т.п. Відповідні фармажна використовувати, коли терміново потрібно цевтичні носії і їх лікарські форми описані в роботі знизити інтенсивність симптомів або у випадку Е. W. Martin, Remington's Pharmaceutical Sciences. невідкладної допомоги. В іншому варіанті спосіб за Такі композиції в кожному разі містять ефективну даним винаходом можна ефективно використовукількість активної сполуки в суміші із придатним вати для тривалого або профілактичного лікуванносієм, тобто являють собою відповідну лікарську ня. форму для введення реципієнтові. Як придатні фармацевтично прийнятні носії Доза сполуки за даним винаходом залежить для одержання композицій можна використовувавід ряду факторів, таких як, наприклад, спосіб ти тверді, рідкі або газоподібні носії, тобто одервведення, вік і маса тіла суб'єкта, стан суб'єкта, жувати композиції у формі таблеток, пігулок, каппризначений для лікування, і в основному дозу сул, супозиторіїв, порошків, складів з призначає лікар або ветеринар. Така кількість акентеросолюбільним покриттям або покриттям інтивної сполуки, що визначається лікарем або вешого типу (наприклад, у складі іонообмінної смоли теринаром, у даному контексті називається «ефеабо в білково-ліпідних везикул), складів з уповільктивною кількістю». Наприклад, доза для неним вивільненням, розчинів, суспензій, еліксиінтраназального введення звичайно становить від рів, аерозолів і т.п. Носій вибирають із різних маприблизно 0,001 до приблизно 0,1мг/кг маси тіла. сел, включаючи вазелінове масло, масла Переважна підшкірна доза для людини становить тваринного, рослинного походження або синтетивід приблизно 0,001мг до приблизно 100мг, перечні масла, наприклад, арахісова олія, соєва олія, важно від приблизно 0,1 до приблизно 15мг пепмінеральне масло, кунжутна олія й т.п. Придатні тиду. Доза активного фармакологічного інгредієнта рідкі носії включають воду, сольовий розчин, вод(АРІ) становить від приблизно 0,015мг до приблиний розчин декстрози, гліколі, насамперед ізотонізно 100мг, переважно від приблизно 1 до приблично сумісні із кров'ю ін'єкційні розчини. Наприклад, зно 100мг. лікарські форми для внутрішньовенного введення У наступному розділі наведені приклади, які включають стерильні водні розчини активного інгілюструють даний винахід, але не обмежують його редієнта (інгредієнтів), які отримані при розчиненні обсяг. твердого активного інгредієнта (інгредієнтів) у воді Приклади для одержання водного розчину з наступною стеОдержання реагенту У круглодонну колбу об'ємом 1л, обладнану магнітним стрижнем для перемішування, пасткою Дина-Старка, зворотним холодильником і введенням для продування аргоном (або азотом), поміщали mПЕГ 30кDa (100г, 3,34ммоля, фірми Nippon Oil and Fat) і толуол (500мл). Розчин ПЕГ у толуолі упарювали азеотропною перегонкою, при цьому відганяли 250мл толуолу, потім охолоджували до кімнатної температури. У розчин додавали безводний дихлорметан (200мл), охолоджували до 05°С і потім по краплях за допомогою шприца через гумову мембрану додавали триетиламін (0,67мл, 4,84ммоля) і метансульфонілхлорид (0,33мл, 4,34ммоля). Отриману суміш перемішували при приблизно 4°С протягом 2год, а потім при кімнатній температурі в атмосфері аргону протягом ночі. Отриману суміш концентрували на роторному випарнику й фільтрували через крупнопористий скляний фільтр для видалення солей. (Увага: фільтр нагрівали в процесі фільтрування, щоб виключити затвердіння розчину). Продукт випадав в осад при додаванні суміші холодного ізопропілового спирту й діетилового ефіру (приблизно 1800мл, 30:70, об./об.). Продукт відокремлювали й сушили у вакуумі при кімнатній температурі протягом ночі, при цьому одержували тверду речовину білого кольору (90г, 90%). 27 90039 28 Стадія 2 У круглодонну колбу об'ємом 2л, обладнану магнітним стрижнем для перемішування, і введенням для продування аргоном, поміщали mПЕГ30кDa-мезилаі 2 (90г, 3ммоля), отриманий вище, і водний розчин гідроксиду амонію (1600мл, 30%, об./об.). В отриманий розчин додавали хлорид амонію (160г). Розчин обережно нагрівали для повного розчинення ПЕГ-мезилату. Отриманий розчин перемішували при кімнатній температурі протягом 48год для видалення надлишку газу через барбатер, щоб виключити підвищення тиску в реакційній колбі. Після завершення реакції додавали хлорид натрію (160г, 10мас.%) і отриману суміш екстрагували дихлорметаном (3 200мл). Об'єднані органічні екстракти сушили над безводним сульфатом натрію протягом приблизно 1год, фільтрували й концентрували на роторному випарнику. Продукт випадав в осад при додаванні холодного діетилового ефіру (1800мл). Продукт фільтрували й сушили у вакуумі при кімнатній температурі протягом ночі, при цьому одержували тверду речовину 3 білого кольору (85г, 94%). Стадія 3 mПЕГ30k-сукцинамова кислота У круглодонну колбу об'ємом 1л, обладнану магнітним стрижнем для перемішування, і введенням для продування аргоном, поміщали mПЕГ30кDa-амін 3 (60г, 2,00ммоля) і безводний ацетонітрил (500мл). Розчин охолоджували до приблизно 4°С і повільно через краплинну лійку додавали янтарний ангідрид (2г, 20,00ммоля) у безводному ацетонітрилі (50мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі при продуванні аргоном. Після завершення реакції розчинник досуха упарювали на роторному випарнику. Отриманий продукт розчиняли у воді (400мл). Величину рН розчину доводили до 7,0 додаванням 1Μ розчину NaOH, і при вказаній величині рН розчин перемі шували протягом 1год. В отриманий розчин додавали хлорид натрію (40г, 10мас.%) і величину рН розчину доводили до ~4,2 додаванням 6н. розчину НСl. Отриману водну суміш екстрагували дихлорметаном (200, 100 і 50мл). Об'єднані органічні екстракти сушили над безводним сульфатом натрію протягом приблизно 1год, сульфат натрію відокремлювали фільтруванням і фільтрат концентрували на роторному випарнику. Продукт випадав в осад при додаванні холодного діетилового ефіру (1л). Продукт фільтрували й сушили у вакуумі при кімнатній температурі протягом ночі, при цьому одержували тверду речовину 4 білого кольору (56г, 93%). 29 90039 30 Стадія 4 mПЕГ30k-сукцинімідилсукцинамід У круглодонну колбу об'ємом 500мл, обладнану магнітним стрижнем для перемішування, і введенням для продування аргоном, поміщали mПЕГ30кDa сукцинамову кислоту 4 (56г, 1,87ммоля) і безводний дихлорметан (500мл). В отриманий розчин повільно додавали N-гідроксисукцинімід (0,24г, 2,05ммоля) і 1,3-дициклогексилкарбодіімід (0,46г, 2,24ммоля). Реакційну суміш перемішували при кімнатній температурі протягом ночі при продуванні аргоном. Після завершення реакції розчинник досуха упарювали на роторному випарнику. Отриманий продукт розчиняли в безводному толуолі (200мл) і розчин фільтрували через попередньо нагрітий крупнопористий скляний фільтр із шаром целіту. Продукт випадав в осад при додаванні холодного безводного ізопропілового спирту й діетилового ефіру (1200мл, 30:70, об./об.). Продукт відокремлювали й сушили у вакуумі при кімнатній температурі протягом ночі, при цьому одержували тверду речовину 5 білого кольору (20г, 80%). Одержання переважних сполук Приклад 1 Одержання смоли Fmос-лінкeр-ВНА Бензгідриламінну смолу на основі співполімеру стиролу й 1% дивінілбензолу (10,0г, 9,3мeкв., 100-200 ASTM меш, фірма ChemTech) витримували в CH2Cl2 (100мл), фільтрували й ретельно промивали CH2Cl2, 6% DIPEA/CH2Cl2 (два рази), CH2Cl2 (два рази) (кожного по 100мл). Смолу обробляли пара-((R,S)- -(1-(9Н-флуорен-9іл)метоксиформамідо)-2,4диметоксибензил)феноксіоцтовою кислотою (Fmoc-лінкер, 7,01г, 13,0ммоля), Nгідроксибензотриазолом (2,16г, 16,0ммоля) і діізопропілкарбодіімідом (2,04мл, 13,0ммоля) в 25% ДМФА/CH2Cl2 (100мл) при кімнатній температурі протягом 24год. Смолу фільтрували й ретельно промивали CH2Cl2 (два рази), ізопропанолом (два рази), ДМФА й CH2Cl2 (три рази) (кожного по 100мл). Результати аналізу в присутності нінгідрину методом Кайзера свідчили про відсутність пеп тидів. Смолу сушили у вакуумі, при цьому одержували смолу Fmoc-лінкер-ВНА (16,12г). У зразку отриманої смоли (3,5мг) видаляли Fmoc-групи й вміст іммобілізованих активних груп визначали УФ-спектроскопією, що становило 0,56ммоля/г. Приклад 2 Методика синтезу пептидів на синтезаторі Applied Biosystem 433A з використанням флуоренілметоксикарбонільних груп (Fmoc) Для синтезу пептидів у кількості 0,25ммолів використовували синтезатор Applied Biosystem 433A (Foster City, CA), цикли проводили в режимі методу «0,25 mmole FastMoc» у реакторі об'ємом 41мл, зразки смоли відбирали на аналіз або не відбирали. Смолу з іммобілізованою Fmocамінокислотою розчиняли в суміші 2,1г NMP, 2г 0,45Μ HOBT/HBTU у ДМФА й 2Μ DIEA, потім переносили в реактор. Для синтезу використовували основний цикл конденсації "BADEIFD", причому кожна буква означає певний модуль синтезу (як визначено в інструкції фірми Applied Biosystems). Наприклад, В означає модуль для видалення груп Fmoc в 20% піридині/NMP, що відповідають промивань і детектування протягом 30хв (УФспектроскопія або провідність), А означає модуль для активації амінокислоти в картриджах у присутності 0,45Μ HOBT/НBTU у ДМФА й 2Μ DIEA, для змішування при пропущенні азоту, D означає модуль для промивань смоли в реакторі, Ε означає модуль для переносу активованої амінокислоти в реактор для конденсації, І означає модуль для промивань протягом 10хв при перемішуванні на мішалці типу Вортекс у реакторі й в іншій судині, F означає модуль для очищення картриджа, конденсації протягом 10хв і видалення реакційної суміші з реактора. Період конденсації звичайно збільшують при включенні модуля 1 один або більше раз. Наприклад, два повторні цикли конденсації проводять із використанням методу "BADEНADEIFD". Можна використовувати інші модулі, такі як «с» для промивань хлористим метиленом, і «С» для блокування оцтовим ангідридом. Вказані модулі можна модифікувати, наприклад, змінюючи трива 31 90039 32 лість різних функцій, таких як тривалість переносу, нання третьої амінокислоти, "BADEНADEIFD" для щоб змінити кількість переносимих розчинника або приєднання четвертої амінокислоти й метод реагентів. У кожному із вказаних циклів звичайно BIDDcc для кінцевого видалення захисних груп і приєднують (на стадії конденсації) один залишок промивання. амінокислоти. Для синтезу тетрапептидів цикли Приклад 3 повторюють і об'єднують у послідовність циклів. Одержання H-IIe-Lys-Pro-Glu-Ala-Pro-Glv-GluНаприклад, метод "BADEНADEIFD" використовуAsp-Ala-Ser-Pro-Glu-Glu-Leu-Asn-Arg-Tyr-Tyr-Alaють для приєднання першої амінокислоти, потім Ser-Leu-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Glnвикористовують "BADEНADEIFD" для приєднання Arg-Tyr-NH2 (ΡΥΥ3-36) другої амінокислоти, "BADEНADEIFD" для приєд Вказаний вище пептид синтезували з використанням груп Fmoc на синтезаторі Applied Biosystem 433A. При цьому використовували два цикли конденсації й модулі, описані в прикладі 2. Синтез проводили в кількості 0,25ммолів з використанням смоли Fmoc-лінкер-ВНЛ (450мг, 0,25ммоля), отриманої, як описано в прикладі 1. При завершенні синтезу смолу переносили в реактор і струшували на качалці для відщеплення Пептид відщеплювали від смоли з використанням 13,5мл 97% ТФК/3% Н2O і 1,5мл триізопропілсилану протягом 180хв при кімнатній температурі. Для видалення захисних груп у розчин додавали 100мл охолодженого діетилового ефіру й промивали 1мл ТФК, і для осадження пептиду додавали 30мл охолодженого діетилового ефіру. Пептид відокремлювали центрифугуванням у поліпропіленових пробірках (2(50мл). Осади з окремих пробірок об'єднували в одну пробірку, промивали три рази охолодженим діетиловим ефіром, сушили в ексикаторі у вакуумі. Неочищений матеріал очищали препаративної РХВР на колонку Pursuit C-18 (250 50мм, розмір часток 10мкм) і елюювали в лінійному градієнті 2-70% В (буфер А: 0,1% ТФК/Н2О, буфер В: 0,1% TФК/CH3CN) протягом 90хв, швидкість потоку 60мл/хв, детектування при 220/280нм. Фракції збирали й аналізували методом аналітичної РХВР. Фракції, що містять очищений продукт, об'єднували й ліофілізували, при цьому одержували аморфний порошок білого кольору (151мг, + 15%). МС-РХ (ES) m/e: розр. для С180Н279N53О54 4049,55, знайд. 4050,40. Приклад 4 Oдepжaння H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (48мг, 9%). МС-РХ (ES) m/e: розр. для C98H155N33O21 2131,53, знайд. 2130,56. Приклад 5 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-Tyr-NH2 + 33 90039 34 + Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу (N-метил-Arg вводили в положення 35 вказаної послідовності), отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний поро шок білого кольору (32мг, 6%). МС-РХ (ES) m/e: розр. для C99H155N33O21 2143,56, знайд. 2143,50. Приклад 6 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-m-Tyr-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (38,5мг, 7%). МС-РХ (ES) m/e: розр. для C99H155N33O21 2143,5477, знайд. 2143,50. Приклад 7 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-3-йод-Tyr-NН2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (41мг, 7%). МС-РХ (ES) m/e: розр. для C99H154IN33O21 2269,44, знайд. 2269,20. Приклад 8 Одержання Н-Іlе-Lуs-Рgа-Arg-Нis-Tyr-LeuАsn-Leu-Vаl-Тhr-Arg-Gln-(NМе)Arg-(3,5-ди-F-Tyr)NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (28мг, 5%). МС-РХ (ES) m/e: розр. для С99Н153F2N33О21 2179,52, знайд. 2179,46. Приклад 9 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(2,6-ди-F-Tyr)NH2 + + + 35 90039 36 + Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (49,3мг, 9%). МС-РХ (ES) m/e: розр. для C99H153F2N33O21 2179,53, знайд. 2179,50. Приклад 10 Одержання H-IIe-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(2,6-ди-МeTyr)-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (13,5мг, 3%). МС-РХ (ES) m/e: розр. для C101H159N33O21 2171,60, знайд. 2171,40. Приклад 11 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(4-метоксиPhe)-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (72мг, 13%). МС-РХ (ES) m/e: розр. для С100Н157F2N33О21 2157,57, знайд. 2157,58. Приклад 12 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-Phe-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (85,3мг, 16%) МС-РХ (ES) m/e: розр. для C99H155N13O20 2127,55, знайд. 2127,53. Приклад 13 + + + 37 90039 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuNH2 Asn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(4-аміно-Phc) 38 + Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (51,4мг, 10%). і МС-РХ (ES) m/e: розр. для C99H156N34O20 2142,56, знайд. 2142,55. Приклад 14 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(4-F-Phe)-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого + кольору (35мг, 7%) МС-РХ (ES) m/c розр. для C99H154FN33O20 2145,54, знайд. 2145,51. Приклад 15 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-((4-CH2OH)Phe)-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (24мг, 4%). МС-РХ (ES) m/e: розр. для C100H1571N33O21 2157,57, знайд. 2157,56. Приклад 16 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(4трифторметил-Рhе)-NН2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пе птид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо + 39 90039 40 + ру (81мг, 15%). ι МС-РХ (ES) m/e: розр. для Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuC100H154F3N33O20 2195,54, знайд. 2195,51. Asn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(3-(фтор-Phe)Приклад 17 NН2 + Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (84мг, 16%). МС-РХ (ES) m/c: розр. для C99H154FN33O20 2145,54, знайд. 2145,53. Приклад 18 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(2,3,4,5,6пентафтор-Phe)-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (89мг, 16%) МС-РХ (ES) m/e розр. для C99H150FN33O20 2217,50, знайд. 2217,48. Приклад 19 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(3,4-дихлорPhe)-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (46мг, 8%) МС-РХ (ES) m/e: розр. для C99H153CI2N33O20 2196,44, знайд. 2196,41. Приклад 20 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-Cha-NH2 + + 41 90039 42 + Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (49мг, 9%). МС-РХ (ES) m/e: розр. для С106Н162N34О21 2248,69, знайд. 2248,71. Приклад 21 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-Trp-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (57мг, 10%) МС-РХ (ES) m/e: розр. для С108Н157F2N35О21 2281,68, знайд. 2281,67 Приклад 22 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(1-Nal)-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (45мг, 8%) МС-РХ (RS) m/e розр. для С103Н157N33О20 2177,61, знайд. 2177,59 Приклад 23 Одержання Н-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-(2-NaІ)-NН2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (43мг, 8%). МС-РХ (ES) m/e: розр. для С103Н157N33О20 2177,60, знайд. 2177,58. Приклад 24 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Leu-Val-Thr-ArR-Gln-Arg-(C- -метил-Tyr)-NН2 + + + 43 90039 44 + Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (35,1мг, 7%). МС-РХ (ES) m/e: розр. для С99Н155N33О21 2143,55, знайд. 2143,56. Приклад 25 Одержання H-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Trp-Val-Thr-Arg-Gln-(NMe)Arg-Tyr-NН2 Смолу Fmoc-лінкер-ВHА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (130мг, 23%). МС-РХ (ES) m/e: розр. для С104Н154N34О21 2216,60, знайд. 2216,62. Приклад 26 Одержання Н-ІIе-NIе-Pqa-Arg-Нis-Tyr-LeuАsn-Тrp-Vаl-Тhr-Arg-Gln-(NМе)Arg-Tyr-NH2 Смолу Fmoc-лінкер-ВHА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (84мг, 15%). МС-РХ (ES) m/e: розр. для С104Н153N33О21 2201,59, знайд. 2201,56. Приклад 27 Одержання Ac-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Trp-Val-Thr-Arg-Gln-(NMe)Arg-(2,6-F2-Tyr)NH2 Смолу Fmос-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (24мг, 4%) МС-РХ (ES) m/e. розр. для С106Н154F2N34О22 2099,49, знайд. 2100,3. Приклад 28 Одержання Ac-Ilc-Lys-Pqa-Arg-His-Tyr-LeuAsn-Trp-Val-Thr-Arg-Gln-(NMe)Arg-Тyr-NН2 + + + 45 90039 46 + Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (68мг, 12%). МС-РХ (ES) m/e: розр. для С106Н156N34О22 2258,64, знайд. 2258,61. Приклад 29 Одержання пeнтoїл-Ile-Lys-Pqa-Aгg-His-TyrLeu-Asn-Trp-Val-Thr-Arg-Gln-(NMe)Arg-Tyr-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (67мг, 12%). МС-РХ (ES) m/e: розр. для C109H162N34O22 2300,72, знайд. 2300,69. Приклад 30 Одержання триметилацетил-Ile-Lys-Pqa-ArgHis-Tyr-Leu-Asn-Trp-Val-Thr-Arg-Gln-(NMe)Arg-TyrNH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (6мг, 1%). МС-РХ (ES) m/e: розр. для С109Н162F2N34О22 2300,72, знайд. 2300,68. Приклад 31 Одержання циклогексилацетил-IIе-Lуs-PqaArg-Ніs-Tyr-Leu-Аsn-Тrp-Vаl-Тhr-Arg-Gln(NMe)Arg-Tyr-NH2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьо му одержували аморфний порошок білого кольо+ ру (15мг, 3%). МС-РХ (ES) m/e: розр. для С112Н166N34О22 2340,79, знайд. 2340,81. Приклад 32 + + Одержання 47 90039 48 бензоїл-Ile-Lys-Pqa-Arg-His-TyrLeu-Asn-Trp-Val-Thr-Arg-Gln-(NMc)Arg-Tyr-NН2 + Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольо кольору (23мг, 4%) МС-РХ (ЕS) m/e: розр. для С111Н158N34О22 2320,71, знайд. 2320,68. Приклад 33 Одержання адамантоїл-Ilc-Lys-Pqa-Arg-HisTуr-Leu-Asn-Trр-Val-Thr-Arg-Gln-(NMe)Arg-Tyr-NН2 Смолу Fmoc-лінкер-ВНА (450мг, 0,25ммоля), отриману, як описано в прикладі 1, використовували для твердофазного синтезу, отриманий пептид очищали, як описано в прикладі 3, при цьому одержували аморфний порошок білого кольору (29мг, 5%). МС-РХ (ES) m/e: розр. для C116H170N34O22 2392,86, знайд. 2392,89. Аналіз пептидів, отриманих у прикладах 3439 і 41 Досліджувані й контрольні зразки аналізували методом РХВР із оберненою фазою/УΦ: Автодозатор Об'єм нанесення зразка Температура при нанесенні Фотодіодний детектор Довжина хвилі детектування Колонка Температура колонки Швидкість потоку Мобільна фаза А Мобільна фаза В Час циклу Концентрація зразка Розріджувач + Alliance Waters 2690 Separation Module 10мкл кімнатна Waters 996 Photodiode Array Detector 280нм Agilent Eclipse XDB-C8, 5мкм, внутр. діаметр150мм 4,6мм, PN:99367-906 25°C 1,0мл/хв (~1000 фунтів на кв. дюйм) водна 0,05% ТФК ацетонітрил/0,05% ТФК приблизно 30хв приблизно 0,2-0,5мг/мл деіонізована вода. Градієнт 1, мобільна фаза (оф-РХВР1) Час, хв 0 20 26 Мобільна фа- Мобільна фаРежим за А, % за В, % 95 5 Лінійний 5 95 95 5 Рівновага Градієнт 2, мобільна фаза (оф-РХВР2) Час, хв 0 20 26 Мобільна фа- Мобільна фаРежим за А, % за В, % 85 15 Лінійний 25 75 85 15 Рівновага 49 Приклад 34 Одержання суміші (ПЕГ-30000)СН2СН2СО)ІlеLуs-Pqa-Arg-Нis-Tyr-Leu-Аsn-Тrp-Val-Thr-Arg-Gln(NMe)Arg-Tyr-NH2 i Ile((ПЕГ 90039 50 30000)CH2CH2CO)( )Lys-Pqa-Arg-His-Tyr-LeuAsn-Trp-Val-Thr-Arg-Gln-(NMe)Arg-Tyr-NH2 де n=~675 i де n=~675 Аналітичний метод Результат Метод оф-РХВР1 - суКонверсія 69,8% міш (rхn) Метод оф-РХВР1 очиЧас утримання 10,1хв щений пептид МС: MALDI-TOF Середня маса 33,9кDa Зважували 25мг пептиду, отриманого в прикладі 25, і розчиняли його в 50мМ боратному буферному розчині, рН 7,5. Зважували ПЕГсукцинімідилпропіонову кислоту (500мг, 30кDa, фірма Nektar) і додавали в розчинений пептид у співвідношенні ПЕГ/пептид 2:1. Реакційну суміш струшували при кімнатній температурі протягом ночі, потім розбавляли в 10 разів у буферному розчині 20мМ NaOAc, pH 4,5, і очищали катіоннообмінною хроматографією на колонці SPSepharose FF. На Фіг.1 наведені результати РХВР реакційної суміші. Вихід пептиду з молекулярною масою 30кDa склав 69,8%. Моно-пегілований пептид PYY елюювали в східчастому градієнті NaCl. Звичайно необхідний моно-пегілований пептид PYY елюювали 250мм NaCl. Елюйований ПЕГ-PYY-подібний пептид концентрували в комірці для ультрафільтрації Amicon на мембрані з молекулярною масою відсікання 10кDa. Концентрат розбавляли в 10 разів розчином ФСБ і піддавали діафільтрації. Концентрат пептиду, отриманий у прикладі 34, аналізували, визначали біологічну активність і зберігали при -20°С. На Фіг.2 наведені результати РХВР очищеного пептиду ΠΕΓ-ΡΥΥ, 30кDa (час утримання 10,1хв). Чистота пептиду 30кDa становить >97%. На Фіг.3 наведені результати МС MALDI-TOF пептиду ΠΕΓ-ΡΥΥ, 30кDa, які підтверджують його молекулярну масу. Для визначення ділянок включення ПЕГ у пептид використовували комбінацію методів, що включає МС: MALDI-TOF, офРХВР, розщеплення протеазами й визначення N-кінцевої послідовності методом Едмана. Отримані результати аналізу свідчать про те, що залишок ПЕГ в основному приєднаний до пептидного ланцюга через аміногрупу лізину в положенні 2. Приклад 35 Одержання суміші ((ПЕГ-40000)СО)Іlе-LуsPqa-Arg-Нis-Tyr-Leu-Аsn-Тrp-Vаl-Тhr-ArR-Gln(NMe)Arg-Tyr-NH2 i Ile(ПЕГ-40000)CO)( )Lys-PqaArg-His-Tyr-Leu-Asn-Trp-Val-Thr-Arg-Gln(NMe)Arg-Tyr-NH2 51 90039 52 де n=~900 i де n=~900 Аналітичний метод Результат Метод оф-РХВР1 - суКонверсія 60,4% міш (rхn) Метод оф-РХВР1 очиЧас утримання 10,1хв щений пептид МС: MALDI-TOF Середня маса 41,9кDa Зважували 25мг пептиду, отриманого в прикладі 25, і розчиняли його в 50мМ боратному буферному розчині, рН 8,0. Зважували ПЕГбензотриазолкарбонат (319мг, 40кDa) і додавали в розчинений пептид у співвідношенні ПЕГ/пептид 0,8:1. Реакційну суміш струшували при кімнатній температурі протягом 1год, потім розбавляли в 10 разів у буферному розчині 20мМ NaOAc, рН 4,5, і очищали катіонно-обмінною хроматографією на колонці SP-Sepharose FF. На Фіг.4 наведені результати РХВР реакційної суміші. Вихід пептиду з молекулярною масою 40кDa склав 60,4%. де n=~675 Аналітичний метод Результат Метод оф-РХВР1 - суКонверсія 94,1% міш (rхn) Метод оф-РХВР1 очи- Час утримання 10,4хв Моно-пегілований пептид PYY елюювали в східчастому градієнті NaCl. Звичайно необхідний моно-пегілований пептид PYY елюювали 250мм NaCl. Елюйований ПЕГ-ΡΥΥ-подібний пептид концентрували в комірці для ультрафільтрації Amicon на мембрані з молекулярною масою відсікання 10кDa. Концентрат розбавляли в 10 разів розчином ФСБ і піддавали діафільтрації. Концентрат пептиду, отриманий у прикладі 35, аналізували, визначали біологічну активність і зберігали при -20°С. На Фіг.5 наведені результати РХВР очищеного пептиду ПЕГ-ΡΥΥ, 40кDa (час утримання 10,1хв). Чистота пептиду 40кDa становить >90% На Фіг.6 наведені результати MALDI-TOF пептиду ΠΕΓ-ΡΥΥ, 40кDa, які підтверджують його молекулярну масу. Приклад 36 Одержання ((ПЕГ30000)СН2СІ2NHCOCН2CH2CO)Ile-Nle-Pqa-ArgНis-Tyr-Leu-Asn-Тrp-Val-Thr-Arg-Gln-(NMe)Arg-ТyrNН2 щений пептид МС: MALDI-TOF Середня маса 34,2кDa Зважували 13мг пептиду, отриманого в прикладі 26, і розчиняли його в 50мМ боратному буферному розчині, рН 8,0. Зважували ПЕГ 53 90039 54 сукцинімідилсукцинамід (624мг, 30kDa) і додаваAmicon на мембрані з молекулярною масою відсіли в розчинений пептид у співвідношенні кання 10кDa. Концентрат розбавляли в 10 разів ПЕГ/пептид 4:1. Реакційну суміш струшували при розчином ФСБ і піддавали діафільтрації. кімнатній температурі протягом 2год, потім розКонцентрат пептиду аналізували, визначали бавляли в 10 разів у буферному розчині 20мМ біологічну активність і зберігали при -20°С. На NaOAc, рН 4,5, і очищали катіонно-обмінною Фіг.8 наведені результати РХВР очищеного пепхроматографією на колонці SP-Sepharose FF тиду ΠΕΓ-ΡΥΥ, 30кDa (час утримання 10,4хв). (Amersham). На Фіг.7 наведені результати РХВР Чистота пептиду 30кDa становить >90%. На Фіг.9 реакційної суміші. Вихід пептиду з молекулярною наведені результати MALDI-TOF пептиду ΠΕΓмасою 30кDa склав 94,1%. ΡΥΥ, 30кDa, які підтверджують його молекулярну Моно-пегілований пептид PYY елюювали в масу. східчастому градієнті NaCl. Звичайно необхідний Приклад 37 моно-пегілований пептид PYY елюювали 250мм Одержання ((ПЕГ-30000)CH(CH3)CH2CO)IleNaCl. Елюйований ПЕГ-PYY-подібний пептид Nle-Pqa-Arg-His-Tyr-Leu-Asn-Trp-Val-Thr-Are-Glnконцентрували в комірці для ультрафільтрації (NMe)Arg-Tyr-NH2 де n=~675 Аналітичний метод Результат Метод оф-РХВР1 - суКонверсія 93,4% міш (rхn) Метод оф-РХВР1 очиЧас утримання 10,5хв щений пептид МС: MALDI-TOF Середня маса 34,6кDa Зважували 1,25мг пептиду, отриманого в прикладі 26, і розчиняли його в 50мМ боратному буферному розчині, рН 8,0. Зважували ПЕГсукцинімідил-бета-SBA (62мг, 30кDа) і додавали в розчинений пептид у співвідношенні ПЕГ/пептид 4:1. Реакційну суміш струшували при кімнатній температурі протягом 2год, потім розбавляли в 10 разів у буферному розчині 20мМ NaOAc, рН 4,5, і очищали катіонно-обмінною хроматографією на колонці SP-Sepharose FF (Amersham). На Фіг.10 наведені результати РХВР реакційної су міші. Вихід пептиду з молекулярною масою 30кDa склав 93,4%. Моно-пегілований пептид PYY елюювали в східчастому градієнті NaCl. Звичайно необхідний моно-пегілований пептид PYY елюювали 250мм NaCl. Елюйований ПЕГ-PYY-подібний пептид концентрували в комірці для ультрафільтрації Аmісоn на мембрані з молекулярною масою відсікання 10кDa. Концентрат розбавляли в 10 разів розчином ФСБ і піддавали діафільтрації. Концентрат пептиду аналізували, визначали біологічну активність і зберігали при -20°С. На Фіг.11 наведені результати РХВР очищеного пептиду ΠΕΓ-ΡΥΥ, 30кDa (час утримання 10,5хв). Чистота пептиду 30кDa становить >90%. На Фіг.12 наведені результати МС MALDI-TOF пептиду ΠΕΓ-ΡΥΥ, 30кDa, які підтверджують його молекулярну масу. Приклад 38 Одержання Ac-Ile((ПЕГ30000)CH2CH2CO)( )Lys-Pqa-Arg-His-Tyr-Leu-AsnTrp-Val-Thr-Arg-Gln-(NMe)Arg-Tyr-NH2 55 де n=~675 Аналітичний метод Результат Метод оф-РХВР1 - суКонверсія 83,3% міш (rхn) Метод оф-РХВР1 очиЧас утримання 9,5хв щений пептид МС: MALDI-TOF Середня маса 34,6кDa Зважували 100мг пептиду, отриманого в прикладі 28, і розчиняли його в 50мМ боратному буферному розчині, рН 8,0. Зважували ПЕГсукцинімідилпропіонову кислоту (1,8г, 30кDa) і додавали в розчинений пептид у співвідношенні ПЕГ/пептид 1,5:1. Реакційну суміш струшували при кімнатній температурі протягом ночі, потім розбавляли в 10 разів у буферному розчині 20мМ NaOAc, рН 4,5, і очищали катіонно-обмінною хроматографією на колонці SP-Sepharose FF. На Фіг.13 наведені результати РХВР реакційної суміші. Вихід пептиду з молекулярною масою 30кDa склав 83,3%. де n=~675 Аналітичний метод Результат Метод оф-РХВР1 - суКонверсія 81,4% міш (rхn) Метод оф-РХВР1 очиЧас утримання 9,5хв щений пептид МС: MALDI-TOF Середня маса 33,6кDa Зважували 100мг пептиду, отриманого в прикладі 26, і розчиняли його в 50мМ боратному буферному розчині, рН 8,0. Зважували ПЕГсукцинімідилсукцинамід (3,6г, 30кПа) і додавали в розчинений пептид у співвідношенні ПЕГ/пептид 3:1. Реакційну суміш струшували при кімнатній температурі протягом ночі, потім розбавляли в 10 разів у буферному розчині 20мМ NaOAc, рН 4,5, і очищали катіонно-обмінною хроматографією на колонці SP-Sepharose FF (Amersham). На Фіг.16 наведені результати РХВР реакційної суміші. 90039 56 Моно-пегілований пептид PYY елюювали в східчастому градієнті NaCl. Звичайно необхідний моно-пегілований пептид PYY елюювали 250мм NaCl. Елюйований ПЕГ-PYY-подібний пептид концентрували в комірці для ультрафільтрації Amicon на мембрані з молекулярною масою відсікання 10кDa. Концентрат розбавляли в 10 разів розчином ФСБ і піддавали діафільтрації. Концентрат пептиду, отриманий у прикладі 38, аналізували, визначали біологічну активність і зберігали при -20°С. На Фіг.14 наведені результати РХВР очищеного пептиду ΠΕΓ-ΡΥΥ, 30кDa (час утримання 9,5хв). Чистота пептиду 30кDa становить >95%. На Фіг.15 наведені результати МС MALDI-TOF пептиду ΠΕΓ-ΡΥΥ, 30кDа, які підтверджують його молекулярну масу. Приклад 39 Одержання Ac-Ile((ПЕГ30000)CH2CH2NHCOCH2CH2CO)( )Lys-Pqa-ArgHis-Tyr-Leu-Asn-Trp-Val-Thr-Arg-Gln-(NMe)Arg-TyrNH2 Вихід пептиду з молекулярною масою 30кDa склав 81,4%. Моно-пeгілований пептид ΡΥΥ елюювали в східчастому градієнті NaCl. Звичайно необхідний моно-пегілований пептид PYY елюювали 250мм NaCl. Елюйований ПЕГ-PYY-подібний пептид концентрували в комірці для ультрафільтрації Amicon на мембрані з молекулярною масою відсікання 10кDa. Концентрат розбавляли в 10 разів розчином ФСК і піддавали діафільтрації. Концентрат пептиду, отриманий у прикладі 39, аналізували, визначали біологічну активність і зберігали при -20°С. На Фіг.17 наведені результати РХВР очищеного пептиду ПЕГ-ΡΥΥ, 30кDa (час утримання 9,5хв). Чистота пептиду 30кDa становить >97%. На Фіг.18 наведені результати МС MALDI-TOF пептиду ΠΕΓ-ΡΥΥ, 30кDa, які підтверджують його молекулярну масу. Приклад 40 Одержання Fmoc-Ile-Lys-Pqa-Arg-His-Tyr-LeuAsn-Trp-Val-Thr-Arg-Gln-(NMe)Arg-Tyr-NH2 57 Смолу Fmoc-лінкер-ВНА (55,0г, 0,45ммоля/г, фірма AnaSpec Inc., номер за каталогом # 408/452-5055) використовували для твердофазного синтезу пептиду й пептид одержували за наступною методикою: Fmoc-захищені амінокислоти приєднували в присутності DIC/HOBt (надлишок 25%) (55,0г 0,45ммоля/г 1,25екв. 31,0ммоля). Всі захисні групи видаляли протягом 2 10хв у присутності 20% піпeридину в ДМФА в об'ємі приблизно 10мл/г (вказані параметри відповідно змінювали в міру зростання об'єму смоли-пептиду). Після видалення захисних груп смола-пептид промивали ДМФА 4 рази по 20 об'ємів. Всі цикли конденсації проводили при додаванні ~40мл DIC (~6екв.) і 4,5г HOBt (1,25екв.). Після завершення циклу конденсації відбирали зразок смоли ~0,25мл, промивали його хлористим метиленом і повноту конденсації контролювали методом аналізу в присутності нінгідрину. Після конденсації з NMe-Arg і Pqa смолу промивали хлористим метиленом і визначали наявність вторинних амінів при додаванні 3 крапель 2% хлориналю в DMAc і 3 краплі 2% ацетальдегіду в DMAc (якщо вторинні аміни відсутні, то фарбування розчину жовтого кольору не змінюється, а якщо реакція конденсації не завершена, то гранули смоли здобувають фарбування від синього до чорною цвіїу). Якщо аналіз свідчив про незавершення реакції, то в реакційну суміш для конденсації додавали DIEA і реакцію продовжували протягом ще 1год. Після завершення конденсації смолу промивали ДМФА 4 рази по 20 об'ємів. Fmoc-Tyr(But)-OH. 14,0г. Fmoc-NMeArg(Mtr)OH: 20,0г. Fmoc-Gln(Trt)-OH: 18,5г. Fmoc-Arg(Pbf)OH: 20,0г. Fmoc-Thr(But)-OH: 18,0г. Fmoc-Val-OH: 10,5г. Fmoc-Trp-OH: 13,0г. Fmoc-Asn(Trt)-OH. 18,0г. Fmoc-Lеu-OH 11,0г, Fmoc-Tyr(But)-OH 14,0г, Fmoc-His(Trt)-OH 20,0г, Fmoc-Arg(Pbf)-OH 20,0г, Fmoc-Pqa-OH 15,4г, Fmoc-Lys(Boc)-OH 14,1г, Fmoc-Ile-OH 11,0г. Смолу-пептид промивали ДМФА 3 рази, хлористим метиленом 3 рази й МеОН 3 рази, сушили у вакуумі й одержували 115,38г смоли-пептиду. Всю кількість смоли розділяли на 6 порцій по 19,25г і пептид відщеплювали від смоли в ТФК. 19,25г смоли-пептиду інкубували (для відщеплення пептиду від смоли) у суміші наступного складу: 8,0мл DTE/анілзол/тіоанізол (1:1:1), 8,0мл iPr3SiH, 8,0мл води й 200мл ТФК протягом 6год (з де n=~675 Аналітичний метод Результат Конверсія 93,8%(захищений Метод оф-РХВР1 ПЕГ-пептид) Загальний вихід суміш (rхn) 89,5% (ПЕГ-пептид з вилуче 90039 58 6.30 до 13.30), потім пептид осаджували при додаванні 2,0л охолодженого (-20°С) діетилового ефіру. Осад збирали центрифугуванням у поліпропіленових пробірках для центрифугування (8(50мл) і промивали 3 рази охолодженим діетиловим ефіром. Потім осад сушили у вакуумі протягом ночі й одержували 6,5г неочищеного пептиду. Сумарна кількість неочищеного пептиду після 6 циклів видалення захисних груп становила 38,71г. Очищення неочищеного пептиду проводили в системі Shimadzu LC-8A методом РХВР на колонці із оберненою фазою Pursuit С-18 (50 250мм, 300А°, 10мкм). 38,71г неочищеного пептиду очищали з використанням 36 циклів препаративної хроматографії. Кожну порцію неочищеного пептиду (1,1г) розчиняли в мінімальній кількості води й ацетонітрилу й наносили на колонку. Елюцію проводили на першому етапі 20% буферним розчином В, потім у градієнті від 20% до 70% буферного розчину В впродовж 70хв (буферний розчин А: 0,1% ТФК/вода, буферний розчин В: 0,1% ТФК/ацетонітрил) при швидкості потоку 50мл/хв. Детектування проводили при 220/280нм. Фракції, що містять продукти, збирали й чистоту продуктів визначали в аналітичній системі Shimadzu LC10AT на колонці із оберненою фазою Pursuit C18 (4,6 50мм) при швидкості потоку 2,5мл/хв у градієнті від 20 до 70% протягом 10хв (буферний розчин А: 0,1% ТФК/вода, буферний розчин В: 0,1% ТФК/ацетонітрил). Фракції, що містять пептиди з високим ступенем очищення, збирали й висушували ліофільно, при цьому одержували аморфний порошок білого цвіту. Ліофілізований продукт, отриманий після 36 циклів хроматографії, поєднували, знову ліофілізували й одержували 8,233г очищеного пептиду (12,6%). Чистоту кінцевого продукту знову визначали в аналітичній системі на колонці із оберненою фазою, як описано вище, чистота становила приблизно 9599%, МС-РХ (ES+): m/e розр. для C119H164N34O23 2438,85, знайд. 2438,84. Приклад 41 Одержання Ile(ПЕГ30000)СН2CH2NHCOCH2CH2CO)( )Lys-Pqa-ArgHis-Tyr-Leu-Asn-Trp-Val-Thr-Arg-Gln-(NMe)Аrg-TyrNH2 ними захисними групами) Метод оф-РХВР1 Час утримання 10,1хв очищений пептид МС: MALDI-TOF Середня маса 35кDa 59 90039 60 Зважували 1,8г пептиду, отриманого в прик(25мкл) додавали в лунки, що містять клітини, і ладі 40, і розчиняли його в 50мМ боратному бупланшети інкубували протягом 1год при 37°С. ферному розчині, рН 7,5. Зважували ПЕГУ ході інкубації готовили розчин досліджувасукцинімідилсукцинамід (37,5 г, 30 кDa) і додаваної сполуки (3,5 необхідної концентрації) у розли в розчинений пептид у співвідношенні чині HBSS (20mM HEPES)/0,05% БСА/1% ДМСО ПЕГ/пептид 2:1. Реакційну суміш перемішували й додавали в лунки 384-лункового планшета, при кімнатній температурі протягом 2год. Пегілопризначеного для реєстрації флуоресценції на ваний пептид деблокували при додаванні піперифлуоресцентному рідері (FLIPR , фірми дину (20%) у реакційну суміш і витримували її при Molecular Devices Соrp.). кімнатній температурі протягом 1год. Реакційну Після інкубації планшети, що містять клітини, суміш охолоджували на льодяній лазні й підкисі планшети, що містять сполуки, переносили в ляли, повільно додаючи льодяну оцтову кислоту рідер FLIPR і 20мкл розведеної сполуки перено(20%), потім розбавляли в 10 разів у буферному сили в планшет, що містить клітини, причому вкарозчині 20мМ NaOAc, рН 4,5, і очищали катіоннозану операцію проводили безпосередньо в рідері обмінною хроматографією па колонці SPFLIPR . У процесі аналізу флуоресценцію одноSepharose FF. На Фіг.19 наведені результати часно реєстрували у всіх 384 лунках кожні 1,5с. РХВР реакційної суміші. Вихід захищеного ПЕГП'ять показань використовували для одержання пептиду склав 93,8%. На Фіг.20 наведені резульстабільної базової лінії, а потім по 20мкл зразка тати РХВР деблокованої реакційної суміші. Загашвидко (30мкл/с) і одночасно додавали в кожну льний вихід пегілованого пептиду з вилученими лунку планшета, що містить клітини. Флуоресцезахисними групами склав 89,5%. нцію безперервно реєстрували перед додаванМоно-пегілований пептид PYY елюювали в ням зразка, у процесі його додавання й після ньосхідчастому градієнті NaCl. Звичайно необхідний го протягом 100с і реєстрували реакцію-відповідь моно-пегілований пептид PYY елюювали 175мм (зростання піку флуоресценції) у кожній лунці NaCl. Елюйований ПЕГ-PYY-подібний пептид після додавання сполуки. Значення початкової концентрували в комірці для ультрафільтрації флуоресценції, яку зчитують в кожній лунці перед Amicon на мембрані з молекулярною масою відсістимуляцією лігандом, використовували як нукання 10кDa. Концентрат розбавляли в 10 разів льову базову лінію для даних у вказаній лунці. розчином ФСБ і піддавали діафільтрації. Реакцію-відповідь виражали у відсотках від макКонцентрат пептиду, отриманий у прикладі симальної відповіді в позитивному контролі. 39, аналізували, визначали біологічну активність і Приклад 43 зберігали при -20°С. На Фіг.21 наведені результаВизначення цАМФ ти РХВР очищеного пептиду ΠΕΓ-ΡΥΥ, 30кDa У даному аналізі використовували наступні (час утримання 10,1хв). Чистота пептиду 30кDa матеріали: 384-лункові планшети, набір Tropix становить >95%. На Фіг.22 наведені результати cAMP-Screen: (Applied Biosystems, номер за каМС MALDI-TOF пептиду ΠΕΓ-ΡΥΥ, 30кDa, які підталогом Т1504), форсколін (Calbiochcm, номер за тверджують його молекулярну масу. каталогом 344270), клітинні лінії: Приклад 42 HEK293/hNPY2R, культуральне середовище: Аналіз припливу кальцію DMEM/F12 у присутності/відсутності барвника Клітини НЕДО-293, стійко трансфектовані гіфенолового червоного (Gibco, номер за каталобридним G-білком G qi9 і геном резистенції до гом 1133032), 10% інактивована нагріванням ETC гігроміцину-В, трансфектували рецептором NPY2 (Gibco, помер за каталогом 10082-147), 1% пенілюдини і відбирали клони з використанням антицилін/стрептоміцин (Gibco, номер за каталогом біотика G418. Після селекції з використанням 15140-122), 500мг/мл G418 (генетицин, Gibco, гігроміцину В і G148, окремі клони аналізували в номер за каталогом 11811-031). присутності PYY. Трансфектовані клітини Клітини лінії НEK293/hNPY2R додавали при 4 (HEK293/hNPY2R) культивували в середовищі щільності 10 клітин у лунку 384-лункового планDMEM, що містить 10% ETC (ембріональної тешета, використовуючи дозатор Multi-drop і планлячої сироватки), 50мкг/мл гігроміцину-В, 2мМ шети інкубували протягом ночі при 37°С. Наступглутаміну, 100Од./мл пеніциліну, 100мкг/мл стреного дня клітини із щільністю 75-80% птоміцину й 250мкг/мл G418. Клітини збирали з використовували в експерименті. Середовища й використанням розчину трипсин/ЕДТА й підрахореагенти нагрівали до кімнатної температури. вували їх число з використанням реагенту Перед розведенням вихідний розчин лігандів реViaCount. Об'єм клітинної суспензії доводили до цептора Y2 і контрольний розчин у ДМСО (Sigma, щільності клітин 4,8 10клігин/мл у повнім сереномер за каталогом D2650) нагрівали до 32°С довищі для росту клітин. Аліквоти по 25мкл додапротягом 5-10хв. Сполуки розбавляли в інкубавали в лунки 384-лункового мікропланшету з поційному середовищі (DMEM/F12, що містить лі-D-лізиновим покриттям (Falcon) і 0,5мМ 3-ізобутил-1-метилксантин ІВМХ, мікропланшети витримували в СО2-інкубагорі при Calbiochem, номер за каталогом 410957) і 37°С протягом ночі. 0,5мг/мл БСА (Sigma, номер за каталогом Буферний розчин для нанесення (Calcium-3 А8806)). Кінцева концентрація ДМСО й форсколіAssay Kit, Molecular Devices) готовили при розчину в інкубаційному середовищі становила 1,1% і ненні вмісту одного флакона (Express Kit) в 5мкМ, відповідно. 1000мл збалансованого сольового розчину ХенкСередовище видаляли при обережному песа (HBSS), що містить 20мм HEPES і 5мМ проберекиданні 384-лункового планшета на паперовий нециду. Аліквотні частини розведеного барвника рушник і додавали інкубаційне середовище
ДивитисяДодаткова інформація
Назва патенту англійськоюNeuropeptide-2 receptor-agonists
Автори англійськоюConde-Knape Karin, Danho Waleed, Ehrlich George, Fotouhi Nader, Fry David C., Khan Wajiha, Konkar Anish, Rondinone Cristina Martha, Swistok Joseph, Taub Rebecca Anne, Tilley Jefferson W.
Назва патенту російськоюАгонисты рецептора нейропептида-2
Автори російськоюКонде-Нейп Карин, Данхо Валид, Эрлих Джордж, Фотоухи Надер, Фрай Девид С., Хан Ваджиха, Конкар Аниш, Рондиноне Кристина Марта, Свисток Джозеф, Тауб Ребекка Энн, Тилли Джефферсон Р.
МПК / Мітки
МПК: A61K 38/16, A61P 3/10
Мітки: агоністи, нейропептиду-2, рецептора
Код посилання
<a href="https://ua.patents.su/78-90039-agonisti-receptora-nejjropeptidu-2.html" target="_blank" rel="follow" title="База патентів України">Агоністи рецептора нейропептиду-2</a>
Попередній патент: Сульфоксимінові похідні як інгібітори р38 map-кінази
Наступний патент: Насос багатоступеневий
Випадковий патент: Остов індукційного апарату












