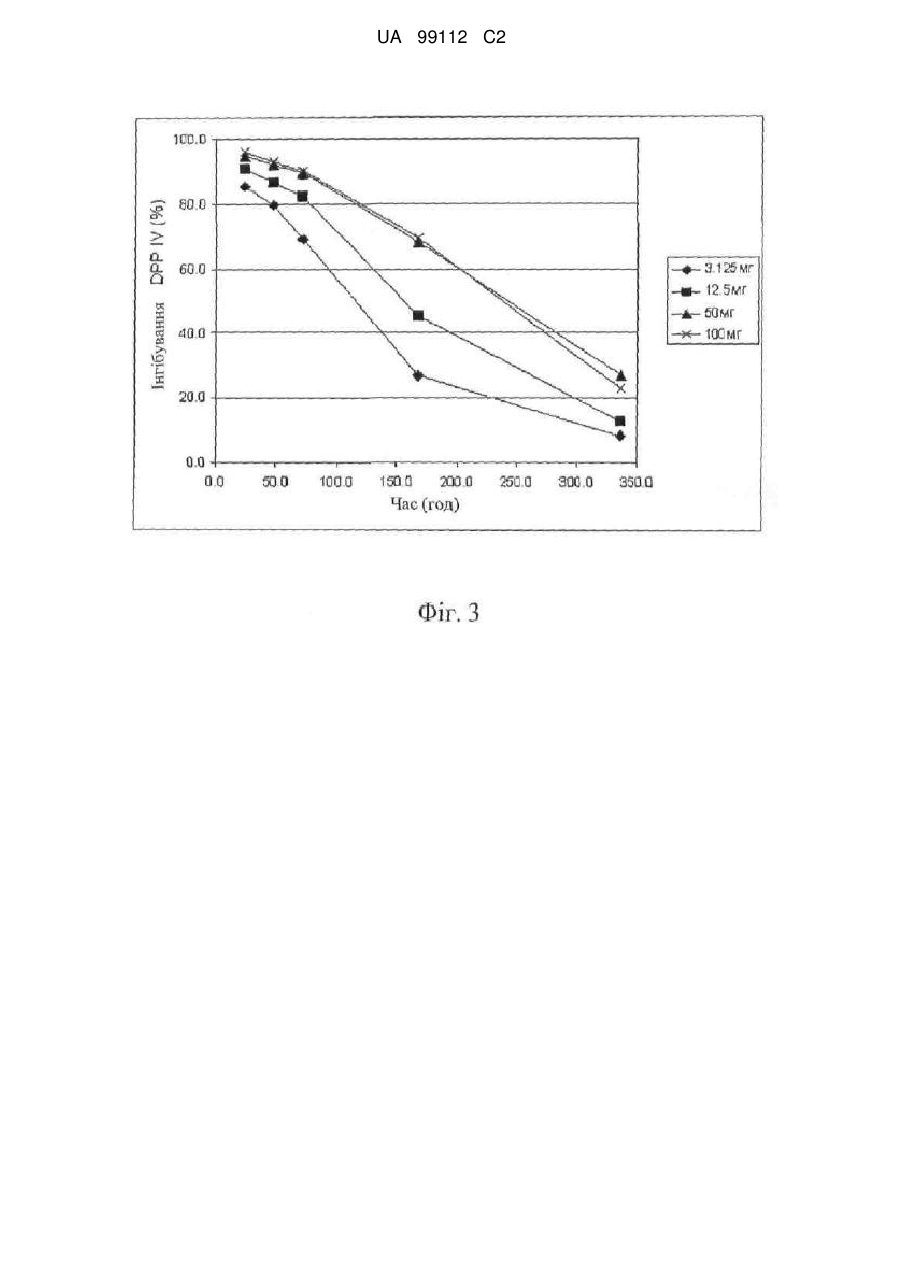
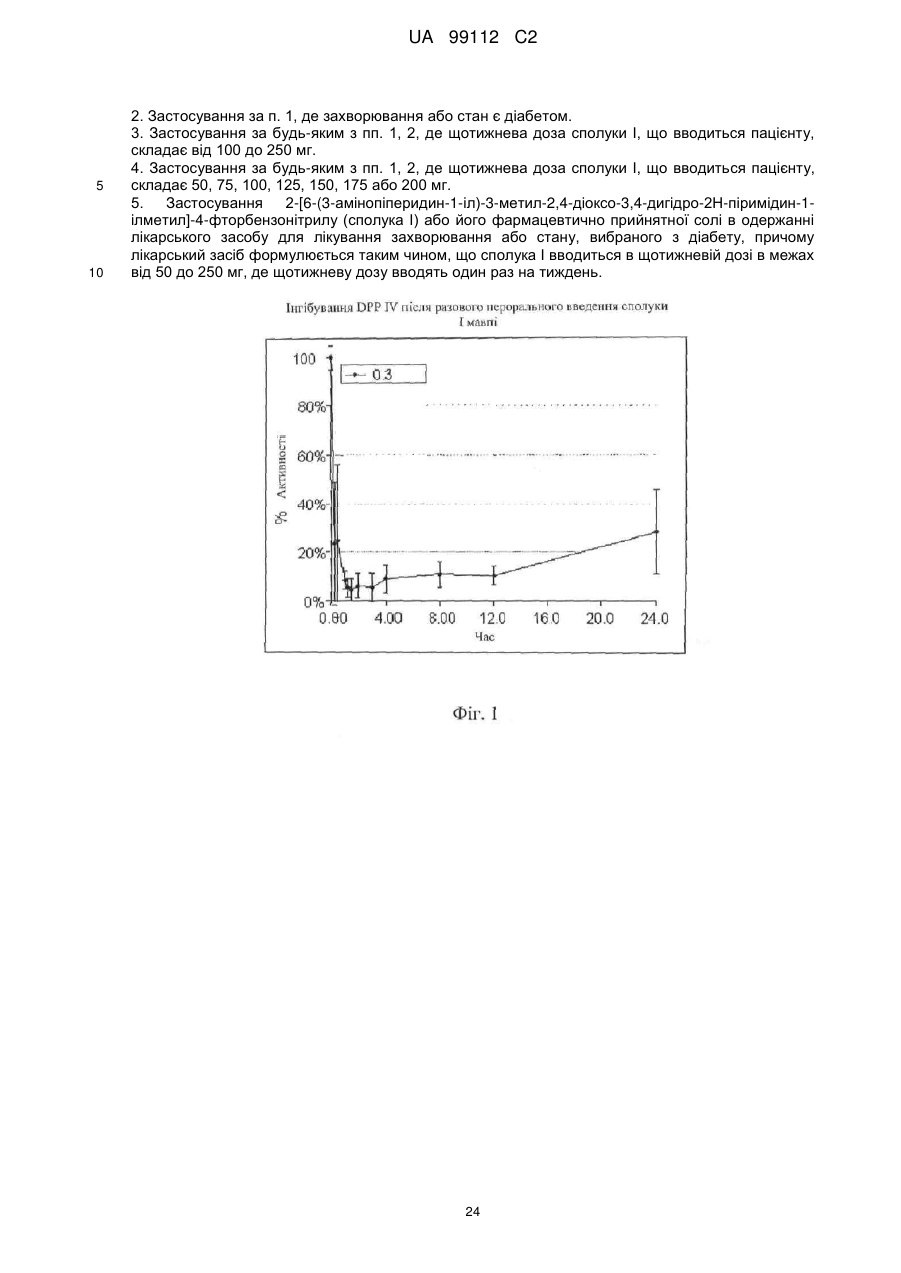
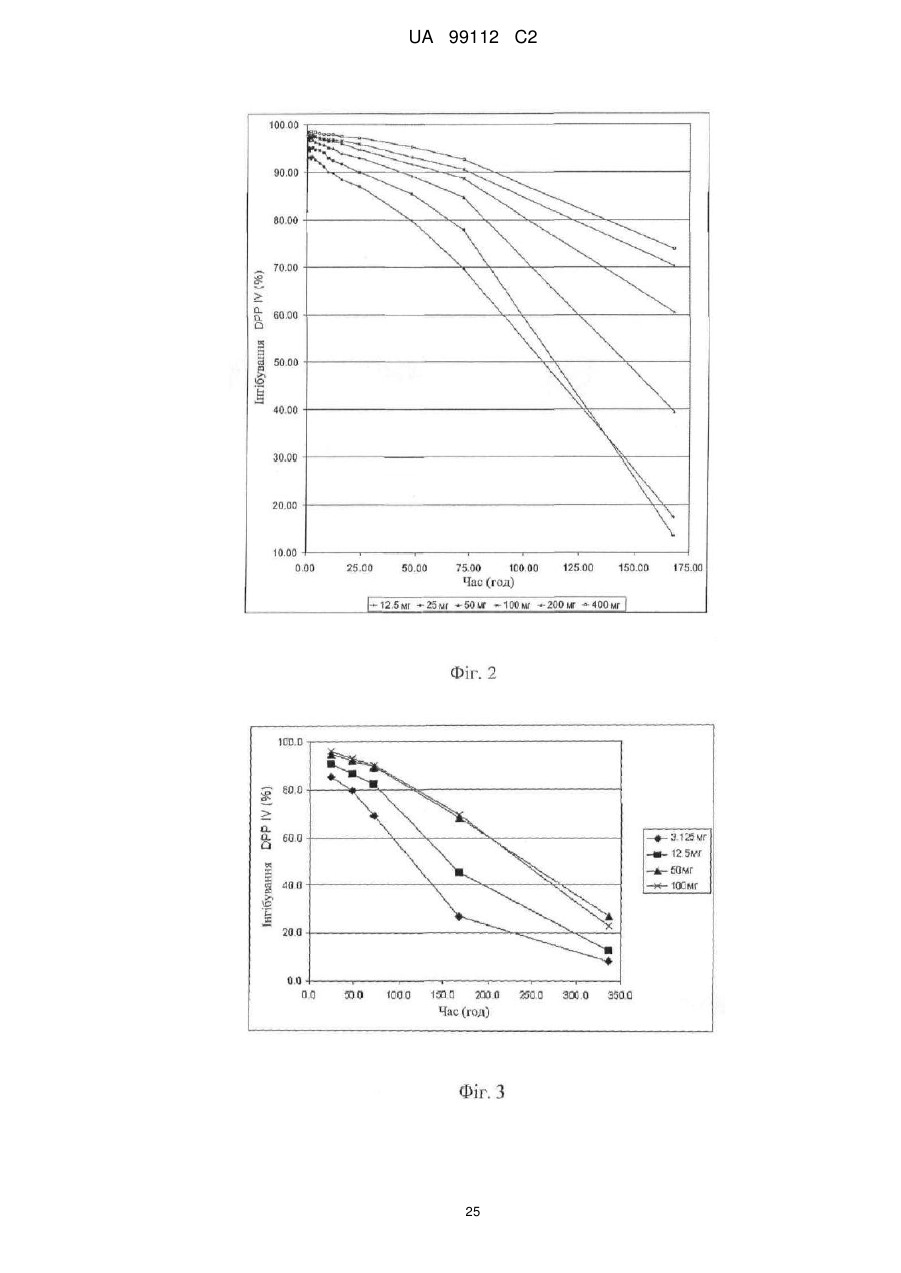
Застосування 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2н-піримідин-1-ілметил]-4-фторбензонітрилу
Номер патенту: 99112
Опубліковано: 25.07.2012
Автори: Крістофер Роналд Дж., Огава Ацусі, Ковінгтон Пол
Формула / Реферат
1. Застосування 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4-фторбензонітрилу (сполука І) або його фармацевтично прийнятної солі як лікарського засобу для лікування захворювання або стану, для якого показано інгібування DPP-IV, при введені щотижневої дози у межах від 50 до 250 мг сполуки І пацієнту, де щотижневу дозу вводять один раз на тиждень.
2. Застосування за п. 1, де захворювання або стан є діабетом.
3. Застосування за будь-яким з пп. 1, 2, де щотижнева доза сполуки І, що вводиться пацієнту, складає від 100 до 250 мг.
4. Застосування за будь-яким з пп. 1, 2, де щотижнева доза сполуки І, що вводиться пацієнту, складає 50, 75, 100, 125, 150, 175 або 200 мг.
5. Застосування 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4-фторбензонітрилу (сполука І) або його фармацевтично прийнятної солі в одержанні лікарського засобу для лікування захворювання або стану, вибраного з діабету, причому лікарський засіб формулюється таким чином, що сполука І вводиться в щотижневій дозі в межах від 50 до 250 мг, де щотижневу дозу вводять один раз на тиждень.
Текст
Реферат: Винахід належить до галузі медицини і стосується застосування 2-[6-(3-амінопіперидин-1-іл)-3метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4-фторбензонітрилу (сполука І) або його фармацевтично прийнятної солі для лікування захворювання або стану, для якого показано інгібування DPP-IV, зокрема для лікування діабету, шляхом введення пацієнту щотижневої дози від 50 до 250 мг сполуки І один раз на тиждень. UA 99112 C2 (12) UA 99112 C2 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід стосується способу введення сполук, що використовуються для інгібування дипептиділпептидази IV, а також способів лікування, основаних на такому введенні. Дипептиділпептидаза IV (IUBMB Enzyme Nomenclature EC.3,4,14,5) являє собою мембранний білок типу II, який у літературі має безліч різних найменувань, включаючи DPP4, DP4, DAP-IV, FAP, білок 2, що утворює комплекс з аденозиндезаміназою, аденозиндезаміназазв'язуючий білок (ADAbp), дипептиділамінопептидаза IV; Xaa-Pro-дипептиділамінопептидаза; Gly-Pro нафтиламідаза; постпроліндипептиділамінопептидаза IV; лімфоцитарний антигенний CD26; глікопротеїн GP110; дипептиділпептидаза IV; гліцилпролінамінопептидаза; гліцилпролінамінопептидаза; X-пролілдипептиділамінопептидаза; pep X; лейкоцитарний антигенний CD26; гліцилпролілдипептиділамінопептидаза; дипептиділ-пептидгідролаза; гліцилпроліламінопептидаза; дипептиділамінопептидаза IV; DPP IV/CD26; аміноацилпролілдипептиділамінопептидаза; молекула, що запускає механізм Т-клітин Tp103; X-PDAP. Дипептиділпептидаза IV у даній заявці позначена як "DPP-IV". DPP-IV являє собою некласичну серинамінодипептидазу, яка видаляє Xaa-Pro дипептиди з аміно-кінця (N-кінця) поліпептидів і білків. Так само повідомлялося про DPP-IV-залежне повільне вивільнення дипептидів типу X-Gly або X-Ser для деяких природних пептидів. DPP-IV конститутивно експресується на епітеліальних і ендотеліальних клітинах різних тканин (кишечнику, печінки, легень, нирок і плаценти) і вона також виявлена в рідинах організму. DPP-IV також експресується на циркулюючих Т-лімфоцитах, і було показано, що вона є синонімічною до клітинно-поверхневого антигену CD-26. DPP-IV є відповідальною за метаболічне розщеплення деяких ендогенних пептидів (GLP-1 (7-36), глюкагон) in vivo і продемонструвала протеолітичну активність проти різних інших пептидів (GHRH, NPY, GLP-2, VIP) in vitro. GLP-1 (7-36) являє собою пептид, що складається з 29 амінокислот, одержаний внаслідок пост-трансляційного процесингу проглюкагону в тонкому кишечнику. GLP-1 (7-36) виявляє різні дії in vivo, включаючи стимуляцію секреції інсуліну, інгібування секреції глюкагону, сприяє насиченню і сповільненню випорожнення шлунка. На основі його фізіологічного профілю вважають, що дії GLP-1 (7-36) є сприятливими для профілактики і лікування діабету типу II і потенційного ожиріння. Наприклад, було виявлено, що екзогенне введення GLP-1 (7-36) (безперервна інфузія) пацієнтам, що страждають на діабет, є ефективним у такій популяції пацієнтів. Нажаль, GLP-1 (7-36) швидко розкладається in vivo, і було показано, що він має короткий період напівжиття in vivo (t1/2=1,5 хвилин). На основі дослідження генетично виведених мишей із DPP-IV "нокаутом" і на основі in vivo/in vitro досліджень із селективними інгібіторами DPP-IV, було показано, що DPP-IV є основним ферментом, який розкладає GLP-1 (7-36) in vivo. GLP-1 (7-36) розкладається під дією DPP-IV ефективним чином до GLP-1 (9-36), який, як вважають, діє як фізіологічний антагоніст GLP-1 (736). Тому вважають, що інгібування DPP-IV in vivo повинне бути корисним для потенціювання ендогенних рівнів GLP-1 (7-36) і зниження утворення його антагоніста GLP-1 (9-36). Таким чином, вважають, що інгібітори DPP-IV являють собою корисні засоби для профілактики, сповільнення розвитку і/або лікування станів, опосередкованих DPP-IV, зокрема, діабету і, конкретніше, цукрового діабету типу 2, діабетичної дисліпідемії, станів, що характеризуються порушеною толерантністю до глюкози (IGT), станів, що характеризуються порушенням рівня глюкози в плазмі натщесерце (IFG), метаболічного ацидозу, надмірного накопичення кетонових тіл, регуляції апетиту та ожиріння. Було показано, що деякі сполуки інгібують DPP-IV. Проте, все ще існує потреба в нових інгібіторах DPP-IV і способах введення таких інгібіторів для лікування захворювання. Запропонований спосіб одержання, що включає: щоденне введення пацієнту дози сполуки I у межах від 1 мг/день до 250 мг/день, необов'язково в межах від 2,5 мг до 200 мг сполуки I, необов'язково в межах від 2,5 мг до 150 мг сполуки I і необов'язково в межах від 5 мг до 100 мг сполуки I. В одному варіанті сполуку I вводять щодня з використанням дози 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг або 100 мг. В іншому варіанті сполуку Iвводять один раз на тиждень при дозі 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг або 100 мг. В одному варіанті введення здійснюють 1 раз на день і, необов'язково, його здійснюють із використанням разової дози 1 раз на день. Необов'язково, введення здійснюють 1 раз на день протягом періоду часу щонайменше 30 днів і, необов'язково, протягом періоду часу щонайменше 60 днів. В одному варіанті введення здійснюють 1 раз на день вранці і, необов'язково, здійснюють 1 раз на день вранці до першого приймання їжі пацієнтом у цей день. В одному варіанті введення здійснюють 1 раз на тиждень і, необов'язково, його здійснюють 1 раз на тиждень у вигляді разової дози. Необов'язково, введення здійснюють 1 раз на тиждень 1 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом періоду часу щонайменше 30 днів і, необов'язково, протягом періоду часу щонайменше 60 днів. В одному варіанті введення здійснюють 1 раз на тиждень вранці і, необов'язково, здійснюють 1 раз на тиждень вранці до першого прийому їжі пацієнтом у цей день. Введення можна здійснювати за допомогою різних способів введення, включаючи, але не обмежуючись цим, спосіб, вибраний із групи, що включає пероральне, парентеральне, інтраперитонеальне, внутрішньовенне, внутрішньоартеріальне, черезшкірне, сублінгвальне, внутрішньом'язове, ректальне, трансбукальне, інтраназальне, ліпосомальне, за допомогою інгаляції, вагінальне, внутрішньоочне, за допомогою локальної доставки, підшкірне, введення в жирову тканину, внутрішньосуглобове, інтраперитонеальне і інтратекальне введення. В одному конкретному варіанті введення здійснюють перорально. Сполуку I можна використати для лікування ряду захворювань. В одному варіанті введення сполуки I здійснюють для лікування такого хворобливого стану пацієнта, як діабет типу I або типу II. В іншому варіанті введення сполуки I здійснюють для лікування пацієнтів із переддіабетом. Ще в одному варіанті введення сполуки I здійснюють для лікування запального захворювання кишечнику, хвороби Крона, ентеритів, викликаних хіміотерапією, мукозиту слизової оболонки порожнини рота або синдрому укороченої товстої кишки. В іншому варіанті введення сполуки I або фармацевтичної композиції, що включає сполуку I, здійснюють для поліпшення приживлюваності після трансплантації кісткового мозку. В іншому варіанті введення сполуки I здійснюють для лікування пацієнтів, страждаючих від станів, опосередкованих DPP-IV, таких як діабет і, конкретніше, цукровий діабет типу 2; діабетична дисліпідемія; порушена толерантність до глюкози (IGT); порушений рівень глюкози в плазмі натщесерце (IFG); метаболічний ацидоз; надмірне накопичення кетонових тіл; для регулювання апетиту; ожиріння; ускладнення, пов'язані з діабетом, включаючи діабетичну невропатію, діабетичну ретинопатію і захворювання нирок; гіперліпідемія, включаючи гіпертригліцеридемію, гіперхолестеринемію, гіпо(ЛВЩ)емію і постпрандіальну гіперліпідемію; атеросклероз; артеріальна гіпертензія; інфаркт міокарда, стенокардія, церебральний інфаркт, церебральна апоплексія і метаболічний синдром. Також забезпечується спосіб введення сполуки I у сполученні з однією або декількома протидіабетичними або інкретиновими сполуками, які відрізняються від сполуки I. В одному варіанті такий спосіб комбінованої терапії здійснюють при введенні пацієнту добової дози, що знаходиться в межах від 1 мг/день до 250 мг/день сполуки I, необов'язково в межах від 2,5 мг до 200 мг сполуки I, необов'язково в межах від 2,5 мг до 150 мг сполуки I і необов'язково в межах від 5 мг до 100 мг сполуки I. В одному варіанті пацієнту вводять добову дозу 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг або 100 мг сполуки I у сполученні з однією або декількома протидіабетичними сполуками, які відрізняються від сполуки I. В одному варіанті такий спосіб комбінованої терапії здійснюють при введенні пацієнту один раз на тиждень дози, що знаходиться в межах від 1 мг до 250 мг сполуки I, необов'язково в межах від 2,5 мг до 200 мг сполуки I, необов'язково в межах від 2,5 мг до 150 мг сполуки I і необов'язково в межах від 5 мг до 100 мг сполуки I. В одному варіанті пацієнту один раз на тиждень вводять дозу 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг або 100 мг, 150 мг або 200 мг сполуки I у сполученні з однією або декількома протидіабетичними сполуками, які відрізняються від сполуки I. Необхідно зазначити, що в даній заявці передбачаються деякі інші межі доз для конкретної протидіабетичної та інкретинової сполуки. Передбачається, що в обсяг даного винаходу включені сполучення лікарських засобів, що охоплюють всі межі, що розкриваються для сполуки I у сполученні з будь-якими межами доз, описаних у даній заявці для інших протидіабетичних або інкретинових сполук. Сполучення сполуки I з однією або декількома протидіабетичними сполуками, що відрізняються від сполуки I, забезпечує ефекти, що відрізняються, такі як 1) посилення терапевтичних ефектів сполуки I і/або протидіабетичних сполук; 2) зниження побічних ефектів сполуки I і/або протидіабетичних сполук; і 3) зниження дози сполуки I і/або протидіабетичних сполук. Одна або декілька протидіабетичних або інкретинових сполук для введення в сполученні зі сполукою I, необов'язково, можуть бути вибрані з групи, що включає модулятори сигнального шляху інсуліну, сполуки, що впливають на порушену продукцію глюкози в печінці, засоби, що посилюють чутливість до інсуліну, і засоби, що стимулюють секрецію інсуліну. Одна або декілька протидіабетичних або інкретинових сполук для введення в сполученні зі сполукою I також, необов'язково, можуть бути вибрані з групи, що включає інгібітори протеїнтирозинфосфатази, інгібітори глютамін-фруктоза-6-фосфатамідотрансферази, інгібітори 2 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 глюкоза-6-фосфатази, інгібітори фруктоза-1,6-бісфосфатази, інгібітори глікогенфосфорилази, антагоністи рецептора глюкагону, інгібітори фосфоенолпіруваткарбоксикінази, інгібітори кінази піруватдегідрогенази, інгібітори альфа-глюкозидази, інгібітори випорожнення шлунка, активатори глюкокінази, агоністи рецептора GLP-1, агоністи рецептора GLP-2, модулятори UCP, модулятори RXR, інгібітори GSK-3, модулятори PPAR, метформін, інсулін, 2-адренергічні антагоністи, деацетилази (наприклад, резерватрол, агоніст сиртуїну, поліфеноли) та інгібітори натрій-залежного транспорту глюкози (SGLT2). Одна або декілька протидіабетичних або інкретинових сполук для введення в сполученні зі сполукою I також, необов'язково, можуть бути вибрані з групи, що включає інгібітори GSK-3, агоністи ретиноїдного X рецептора, агоністи бета-3 AR, модулятори UCP, протидіабетичні тіазолідиндіони, агоністи PPAR гамма не-глітазонового типу, агоністи подвійної дії PPAR гамма/PPARальфа, протидіабетичні ванадійвмісні сполуки і бігуаніди. Одна або декілька протидіабетичних або інкретинових сполук для введення в сполученні зі сполукою I також, необов'язково, можуть являти собою тіазолідиндіони, вибрані з групи, що включає (S)-((3,4-дигідро-2-(фенілметил)-2H-1-бензопіран-6-іл)метилтіазолідин-2,4-діон, 5-{[4-(3(5-метил-2-феніл-4-оксазоліл)-1-оксопропіл)феніл]метил}тіазолідин-2,4-діон, 5-{[4-(1метилциклогексил)метокси)феніл]метил]тіазолідин-2,4-діон, 5-{[4-(2-(1індоліл)етокси)феніл]метил}тіазолідин-2,4-діон, 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}тіазолідин-2,4-діон, 5-(2-нафтилсульфоніл)тіазолідин-2,4-діон, біс{4[(2,4-діоксо-5-тіазолідиніл)метил]феніл}метан, 5-{4-[2-(5-метил-2-феніл-4-оксазоліл)-2гідроксіетокси]бензил}тіазолідин-2,4-діон, 5-[4-(1-феніл-1циклопропанкарбоніламіно)бензил]тіазолідин-2,4-діон, 5-{[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл])-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл])-2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діон, 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4-діон, 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діон, 5-{[4-((3,4-дигідро-6-гідрокси-2,5,7,8тетраметил-2H-1-бензопіран-2-іл)метокси)феніл]метил)тіазолідин-2,4-діон, 5-[6-(2фторбензилокси)нафталін-2-ілметил]тіазолідин-2,4-діон, 5-([2-(2-нафтил)бензоксазол-5іл]метил}тіазолідин-2,4-діон і 5-(2,4-діоксотіазолідин-5-ілметил)-2-метокси-N-(4трифторметилбензил)бензамід, включаючи будь-які фармацевтично прийнятні солі цих сполук. В одному варіанті одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I включають метформін. В одному конкретному варіанті метформін у зазначеному сполученні включає одну або декілька фармацевтично прийнятних солей метформіну. В іншому конкретному варіанті метформін у зазначеному сполученні включає HCl сіль метформіну. В іншому конкретному варіанті метформін у зазначеному сполученні вводять при добовій дозі в межах від 125 до 2550 мг. В іншому варіанті метформін у зазначеному сполученні вводять при добовій дозі в межах від 250 до 2550 мг. У інших варіантах метформін у зазначеному сполученні вводять у лікарській формі негайного вивільнення або пролонгованого вивільнення. В іншому варіанті одна або декілька протидіабетичних сполук для введення у сполученні зі сполукою I включають одну або декілька похідних сульфонілсечовини. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть бути вибрані з групи, що включає глізоксепід, глібурид, глібенкламід, ацетогексамід, хлорпропамід, гліборнурид, толбутамід, толазамід, гліпізид, карбутамід, гліквідон, глігексамід, фенбутамід, толцикламід, глімепірид і гліклазид, включаючи їхні будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I включають глімепірид. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть бути вибрані з групи, що включає інкретинові гормони або їхні міметики, антагоністи бета-клітинних імідазолінових рецепторів і швидкодіючі стимулятори секреції інсуліну. В іншому варіанті одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I включають інсулін. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть являти собою один або декілька агоністів GLP-1, включаючи, наприклад, екстендатид. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть являти собою один або декілька агоністів GLP-2, включаючи, наприклад, рекомбінантний людський GLP-2. 3 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть являти собою одну або декілька протидіабетичних похідних Dфенілаланіну. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть бути вибрані з групи, що включає репаглінід, мітиглінід і натеглінід, включаючи їхні будь-які фармацевтично прийнятні солі. В одному варіанті, одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I включають кальцієву сіль мітиглініду у формі гідрату. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть являти собою один або декілька інгібіторів альфа-глюкозидази. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть бути вибрані з групи, що включає акарбозу, воглібозу і міглітол, включаючи їхні будь-які фармацевтично прийнятні солі. В одному варіанті, одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I включають воглібозу. В іншому варіанті воглібозу, що використовується в такому сполученні, вводять при добовій дозі в межах від 0,1 до 1 мг. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть являти собою розіглітазон, включаючи його будь-які фармацевтично прийнятні солі. В одному варіанті, розіглітазон, що використовується в такому сполученні, включає малеатну сіль розіглітазону. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть являти собою тезаглітазар, мураглітазар або навеглітазар, включаючи їхні будь-які фармацевтично прийнятні солі. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть являти собою піоглітазон, включаючи його будь-які фармацевтично прийнятні солі. В одному варіанті, піоглітазон, що використовується в такому сполученні, включає HCl сіль піоглітазону. В іншому варіанті, піоглітазон, що використовується в такому сполученні, вводять при добовій дозі в межах від 7,5 до 60 мг. В іншому варіанті, піоглітазон, що використовується в такому сполученні, вводять при добовій дозі в межах від 15 до 45 мг. Одна або декілька протидіабетичних сполук для введення в сполученні зі сполукою I також, необов'язково, можуть включати метформін і піоглітазон. В одному варіанті, піоглітазон, що використовується в такому сполученні, включає одну або декілька фармацевтично прийнятних солей піоглітазону. В іншому варіанті, піоглітазон, що використовується в такому сполученні, включає HCl сіль піоглітазону. Ще в одному варіанті, піоглітазон, що використовується в такому сполученні, вводять при добовій дозі в межах від 7,5 до 60 мг. В іншому варіанті, піоглітазон, що використовується в такому сполученні, вводять при добовій дозі в межах від 15 до 45 мг. В іншому варіанті кожного з вищенаведених варіантів, метформін, що використовується в такому сполученні, включає одну або декілька фармацевтично прийнятних солей метформіну. В одному конкретному варіанті, метформін, що використовується в такому сполученні, включає HCl сіль метформіну. В іншому конкретному варіанті, метформін, що використовується в такому сполученні, вводять при добовій дозі в межах від 125 до 2550 мг. Ще в одному варіанті, метформін, що використовується в такому сполученні, вводять при добовій дозі в межах від 250 до 2550 мг. Стосовно кожного з наведених вище варіантів втілення винаходу та їхніх варіантів, сполуку I можна вводити у формі вільної основи або у формі її фармацевтично прийнятної солі. У конкретних варіантах, сполуку I вводять у формі HCl, метансульфонатної, сукцинатної, бензоатної, толуолсульфонатної, R-(-)манделатної або бензолсульфонатної солі сполуки I. Також забезпечуються фармацевтичні композиції. В одному варіанті втілення винаходу забезпечується фармацевтична композиція, сформульована в лікарську форму, що містить разову дозу, при цьому така форма, що містить разову дозу, включає від 1 мг/день до 250 мг/день сполуки I, необов'язково від 2,5 мг до 200 мг сполуки I, необов'язково від 2,5 мг до 150 мг сполуки I, і необов'язково від 5 мг до 100 мг сполуки I. У конкретних варіантах фармацевтична композиція включає 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг або 100 мг сполуки I. В одному варіанті втілення винаходу забезпечується фармацевтична композиція, сформована в лікарську форму, що містить разову дозу, при цьому така форма, що містить разову дозу, включає від 1 мг/тиждень до 250 мг/тиждень сполуки I, необов'язково від 2,5 мг до 200 мг сполуки I, необов'язково від 2,5 мг до 150 мг сполуки I, і необов'язково від 5 мг до 100 мг сполуки I. У конкретних варіантах фармацевтична композиція включає 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг або 100 мг сполуки I із розрахунку на один прийом на тиждень. 4 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому варіанті втілення винаходу забезпечується фармацевтична композиція, яка містить сполуку I та одну або декілька протидіабетичних або інкретинових сполук, що відрізняються від сполуки I, у лікарській формі, що містить разову дозу. Необов'язково, сполука I є присутньою в лікарській формі, що містить разову дозу, у дозованій кількості в межах від 1 мг/день до 250 мг/день сполуки I, необов'язково від 2,5 мг до 200 мг сполуки I, необов'язково від 2,5 мг до 150 мг сполуки I і необов'язково від 5 мг до 100 мг сполуки I. У конкретних варіантах фармацевтична композиція містить 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг або 100 мг сполуки I. Сполучення сполуки I з однією або декількома протидіабетичними сполуками, що відрізняються від сполуки I, забезпечує чудові ефекти, такі як 1) посилення терапевтичних ефектів сполуки I і/або протидіабетичних сполук; 2) зниження побічних ефектів сполуки I і/або протидіабетичних сполук; і 3) зменшення дози сполуки I і/або протидіабетичних сполук. Відповідно до наведеного вище варіанту втілення винаходу, одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, необов'язково можуть бути вибрані з групи, що включає модулятори сигнального шляху інсуліну, сполуки, що впливають на порушення продукції глюкози в печінці, засоби, що посилюють чутливість до інсуліну, інкретини і засоби, що посилюють секрецію інсуліну. Також, відповідно до описаного вище варіанту втілення винаходу, одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, необов'язково можуть бути вибрані з групи, що включає інгібітори протеїнтирозинфосфатази, інгібітори глютамін-фруктоза6-фосфатамідотрансферази, інгібітори глюкоза-6-фосфатази, інгібітори фруктоза-1,6бісфосфатази, інгібітори глікогенфосфорилази, антагоністи рецептора глюкагону, інгібітори фосфоенолпіруваткарбоксикінази, інгібітори кінази піруватдегідрогенази, інгібітори альфаглюкозидази, інгібітори випорожнення шлунка, активатори глюкокінази, агоністи рецептора GLP1, агоністи рецептора GLP-2, модулятори UCP, модулятори RXR, інгібітори GSK-3, модулятори PPAR, метформін, інсулін і 2-адренергічні антагоністи. Також, відповідно до описаного вище варіанту втілення винаходу, одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, необов'язково можуть бути вибрані з групи, що включає інгібітори GSK-3, агоністи рецептора ретиноїду X, агоністи Бета-3 AR, модулятори UCP, протидіабетичні тіазолідиндіони, агоністи PPAR гамма не-глітазонного типу, подвійні агоністи PPAR гамма/PPAR альфа, що містять ванадій протидіабетичні сполуки і бігуаніди. Також, відповідно до описаного вище варіанту втілення винаходу, одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, необов'язково можуть являти собою тіазолідиндіони, вибрані з групи, що включає (S)-((3,4-дигідро-2-(фенілметил)-2H1-бензопіран-6-іл)метилтіазолідин-2,4-діон, 5-{[4-(3-(5-метил-2-феніл-4-оксазоліл)-1оксопропіл)феніл]метил}тіазолідин-2,4-діон, 5-{[4-(1метилциклогексил)метокси)феніл]метил]тіазолідин-2,4-діон, 5-{[4-(2-(1індоліл)етокси)феніл]метил}тіазолідин-2,4-діон, 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}тіазолідин-2,4-діон, 5-(2-нафтилсульфоніл)тіазолідин-2,4-діон, біс{4[(2,4-діоксо-5-тіазолідиніл)метил]феніл}метан, 5-{4-[2-(5-метил-2-феніл-4-оксазоліл)-2гідроксіетокси]бензил}тіазолідин-2,4-діон, 5-[4-(1-феніл-1циклопропанкарбоніламіно)бензил]тіазолідин-2,4-діон, 5-{[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл])-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл])-2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діон, 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4-діон, 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діон, 5-{[4-((3,4-дигідро-6-гідрокси-2,5,7,8тетраметил-2H-1-бензопіран-2-іл)метокси)феніл]метил)тіазолідин-2,4-діон, 5-[6-(2фторбензилокси)нафталін-2-ілметил]тіазолідин-2,4-діон, 5-([2-(2-нафтил)бензоксазол-5іл]метил}тіазолідин-2,4-діон і 5-(2,4-діоксотіазолідин-5-ілметил)-2-метокси-N-(4трифторметилбензил)бензамід, включаючи будь-які фармацевтично прийнятні солі цих сполук. В одному варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають метформін. В одному конкретному варіанті, метформін, що використовується в такому сполученні, включає одну або декілька фармацевтично прийнятних солей метформіну. В іншому конкретному варіанті метформін, що використовується в такому сполученні, включає HCl сіль метформіну. В іншому конкретному варіанті метформін, що використовується в такому сполученні, вводять при добовій дозі в межах від 125 до 2550 мг. В іншому варіанті метформін, що використовується в такому сполученні, вводять при добовій дозі в межах від 250 до 2550 мг. 5 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають одну або декілька похідних сульфонілсечовини. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають протидіабетичну сполуку, вибрану з групи, що включає глізоксепід, глібурид, глібенкламід, ацетогексамід, хлорпропамід, гліборнурид, толбутамід, толазамід, гліпізид, карбутамід, гліквідон, глігексамід, фенбутамід, толцикламід, глімепірид і гліклазид, включаючи їхні будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають глімепірид. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають протидіабетичну сполуку, вибрану з групи, що включає інкретинові гормони або їхні міметики, антагоністи бета-клітинних імідазолінових рецепторів і швидкодіючі стимулятори секреції інсуліну. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають інсулін. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають один або декілька агоністів GLP-1. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають один або декілька агоністів GLP-2, включаючи форми рекомбінантного людського GLP-2. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають одну або декілька протидіабетичних похідних D-фенілаланіну. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають протидіабетичну сполуку, вибрану з групи, що включає репаглінід і натеглінід, включаючи їхні будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають кальцієву сіль мітиглініду у формі гідрату. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають один або декілька інгібіторів альфа-глюкозидази. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають протидіабетичну сполуку, вибрану з групи, що включає акарбозу, воглібозу і міглітол, включаючи їхні будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають воглібозу. В іншому варіанті воглібозу, що використовується в такому сполученні, вводять при добовійдозі в межах від 0,1 до 1 мг. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають розіглітазон, включаючи її будь-які фармацевтично прийнятні солі. В одному варіанті розіглітазон, що використовується в такому сполученні, включає малеатну сіль розіглітазону. Одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, також необов'язково можуть являти собою тезаглітазар, мураглітазар або навеглітазар, включаючи їхні будь-які фармацевтично прийнятні солі. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають піоглітазон, включаючи його будь-які фармацевтично прийнятні солі. В одному конкретному варіанті піоглітазон, що використовується в такому сполученні, включає HCl сіль піоглітазону. В іншому конкретному варіанті піоглітазон, що використовується в такому сполученні, вводять при добовій дозі в межах від 7,5 до 60 мг. В іншому конкретному варіанті піоглітазон, що використовується в такому сполученні, вводять при добовій дозі в межах від 15 до 45 мг. В іншому варіанті одна або декілька протидіабетичних сполук, включених у фармацевтичну композицію, включають метформін і піоглітазон. В одному конкретному варіанті піоглітазон, що використовується в такому сполученні, включає одну або декілька фармацевтично прийнятних солей піоглітазону. В іншому конкретному варіанті піоглітазон, що використовується в такому сполученні, включає HCl сіль піоглітазону. В іншому конкретному варіанті піоглітазон, що використовується в такому сполученні, вводять при добовій дозі в межах від 7,5 до 60 мг. Ще в одному конкретному варіанті піоглітазон, що використовується в такому сполученні, вводять при добовій дозі в межах від 15 до 45 мг. У додатковому варіанті кожного з наведених вище варіантів, метформін, що використовується в такому сполученні, включає одну або декілька фармацевтично прийнятних солей метформіну. Ще в одному додатковому варіанті метформін, що використовується в такому сполученні, включає HCl сіль метформіну. В іншому додатковому варіанті метформін, що використовується в такому сполученні, вводять при добовій дозі в 6 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 межах від 125 до 2550 мг. Ще в одному додатковому варіанті метформін, що використовується в такому сполученні, вводять при добовій дозі в межах від 250 до 2550 мг. Стосовно кожного з описаних вище варіантів втілення винаходу та їхніх варіантів, які стосуються фармацевтичних композицій, сполука I може бути введена у формі вільної основи або у формі її фармацевтично прийнятної солі. У конкретних варіантах сполуку I вводять у формі HCl, метансульфонатної, сукцинатної, бензоатної, толуолсульфонатної, R-(-)манделатної або бензолсульфонатної солі сполуки I. Також стосовно кожного з описаних вище варіантів втілення винаходу та їхніх варіантів, що стосуються фармацевтичних композицій, фармацевтична композиція необов'язково може бути в лікарській формі, що містить разову дозу, адаптованій для перорального введення, необов'язково у вигляді твердої лікарської форми, адаптованої для перорального введення, і необов'язково у вигляді таблетки або капсули, адаптованої для перорального введення. Фармацевтична композиція також може являти собою фармацевтичну композицію пролонгованого вивільнення, адаптовану для перорального введення. Також стосовно кожного з описаних вище варіантів втілення винаходу та їхніх варіантів, що стосуються фармацевтичних композицій, фармацевтичну композицію можна застосовувати для профілактики або лікування станів, опосередкованих DPP-IV, таких як діабет і, конкретніше, цукровий діабет типу 2; діабетична дисліпідемія; порушена толерантність до глюкози (IGT); порушений рівень глюкози в плазмі натщесерце (IFG); метаболічний ацидоз; надмірне накопичення кетонових тіл; для регулювання апетиту; ожиріння; ускладнення, пов'язані з діабетом, включаючи діабетичну невропатію, діабетичну ретинопатію і захворювання нирок; гіперліпідемія, включаючи гіпертригліцеридемію, гіперхолестеринемію, гіпо(ЛВЩ)емію і гіперліпідемію після приймання їжі; атеросклероз; артеріальна гіпертензія; інфаркт міокарда, стенокардія, церебральний інфаркт, церебральна апоплексія і метаболічний синдром. Також стосовно кожного з описаних вище варіантів втілення винаходу та їх варіантів, що стосуються фармацевтичних композицій, фармацевтична композиція необов'язково може бути в лікарській формі, що містить разову дозу, адаптованій для парентерального (підшкірного, внутрішньовенного, субдермального або внутрішньом'язового) введення, необов'язково у вигляді композиції розчину, адаптованого для парентерального введення, і необов'язково у вигляді композиції суспензії, адаптованої для парентерального введення. Фармацевтична лікарська форма також може являти собою композицію пролонгованого вивільнення, адаптовану для перорального введення. Також забезпечуються набори, що включають декілька доз фармацевтичної композиції відповідно до даного винаходу. В одному варіанті, набори додатково включають інструкції, які містять один або декілька видів інформації, вибраних із групи, що включає зазначення хворобливого стану, при якому потрібно застосовувати фармацевтичну композицію, інформацію, що стосується зберігання фармацевтичної композиції, інформацію про дозування та інструкції, що стосуються способу введення фармацевтичної композиції. Також забезпечуються вироби, що включають декілька доз фармацевтичної композиції відповідно до даного винаходу. В одному варіанті виробу додатково включають пакувальні матеріали, такі як контейнер, який містить декілька доз фармацевтичної композиції і/або етикетку із зазначенням одного або декількох видів інформації, вибраних із групи, що включає зазначення хворобливого стану, при якому потрібно вводити сполуку, інформацію, що стосується зберігання, інформацію про дозування і/або інструкції, що стосуються способу введення композиції. Стосовно всіх наведених вище варіантів втілення винаходу необхідно відмітити, що варіанти втілення винаходу потрібно розглядати як необмежувальні, у тому значенні, що способи можуть включати додаткові дії, крім описаних, включаючи введення пацієнту інших фармацевтично активних речовин. Аналогічно до цього, якщо не зазначено інше, фармацевтичні композиції, набори і вироби можуть додатково включати інші речовини, включаючи інші фармацевтично активні речовини. Фіг. 1 ілюструє інгібування DPP IV у плазмі після разового перорального введення сполуки I мавпі. Фіг. 2 ілюструє інгібування DPP IV у плазмі після разового перорального введення сполуки I людині. Фіг. 3 ілюструє інгібування DPP IV у плазмі після разового перорального введення сполуки I людині. Визначення 7 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 Якщо не встановлено інше, наступні терміни, що використовуються в описі і формулі винаходу, повинні мати такі значення з метою даної заявки. "Захворювання" конкретно включає будь-який хворобливий стан тварини або її органу і включає хворобливий стан, який може бути викликаний або пов'язаний із медичним або ветеринарним лікуванням, що застосовується до цієї тварини, тобто "побічними ефектами" такого лікування. "Фармацевтично прийнятний" означає корисний для одержання, такий, що є загалом безпечним, нетоксичним і що не є ні біологічно ні якимось іншим чином небажаним, включаючи прийнятний як для застосування у ветеринарії, так і для фармацевтичного застосування для людини. "Фармацевтично прийнятні солі" означає солі, які є фармацевтично прийнятними, як визначено вище, і які мають бажану фармакологічну активність. Такі солі включають, але не обмежуються цим, кислотно-адитивні солі, утворені з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота та інші; або з органічними кислотами, такими як оцтова кислота, трифтороцтова кислота, пропіонова кислота, капронова кислота, енантова кислота, циклопентанпропіонова кислота, гліколева кислота, піровиноградна кислота, молочна кислота, малонова кислота, бурштинова кислота, оксибурштинова кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, орто-(4гідроксибензоїл)бензойна кислота, корична кислота, мигдалева кислота, метансульфонова кислота, етансульфонова кислота, 1,2-етандисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, пара-хлорбензолсульфонова кислота, 2нафталінсульфонова кислота, пара-толуолсульфонова кислота, камфорсульфонова кислота, 4метилбіцикло[2,2,2]окт-2-ен-1-карбонова кислота, глюкогептонова кислота, 4,4-метиленбіс(3гідрокси-2-ен-1-карбонова кислота), 3-фенілпропіонова кислота, триметилоцтова кислота, третбутилоцтова кислота, лаурилсірчана кислота, глюконова кислота, глутамінова кислота, гідроксинафтойна кислота, саліцилова кислота, стеаринова кислота, муконова кислота та інші. Фармацевтично прийнятні солі також включають, але не обмежуються цим, основноадитивні солі, які можуть бути утворені, коли присутні кислотні протони здатні до взаємодії з неорганічними або органічними основами. Прийнятні неорганічні основи включають, але не обмежуються цим, гідроксид натрію, карбонат натрію, гідроксид калію, гідроксид алюмінію і гідроксид кальцію. Прийнятні органічні основи включають, але не обмежуються цим, етаноламін, діетаноламін, триетаноламін, трометамін, N-метилглюкамін та інші. "Об'єкт" і "пацієнт" включає людей, ссавців, що не стосуються людини (наприклад, собак, котів, кроликів, велику рогату худобу, коней, овець, кіз, свиней, оленів і подібних) і нессавців (наприклад, птахів і подібних). "Терапевтично ефективна кількість" означає, що кількість сполуки, яка при введенні тварині для лікування захворювання, є достатньою для здійснення лікування такого захворювання. "Лікування" або "лікувати" означає будь-яке введення терапевтично ефективної кількості сполуки і включає: (1) профілактику виникнення захворювання у тварини, яка може бути схильна до захворювання, але поки ще не зазнає або не виявляє патологію або симптоматологію такого захворювання, (2) інгібування захворювання у тварини, яка зазнає або виявляє патологію або симптоматологію такого захворювання (тобто зупинку подальшого розвитку патології і/або симптоматології), або (3) полегшення захворювання у тварини, яка зазнає або виявляє патологію або симптоматологію такого захворювання (тобто зворотний розвиток патології і/або симптоматології). 1. 2-[6-(3-Амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2H-піримідин-1-ілметил]-4фторбензонітрил і його композиції Даний винахід стосується, головним чином, введення 2-[6-(3-амінопіперидин-1-іл)-3-метил2,4-діоксо-3,4-дигідро-2H-піримідин-1-ілметил]-4-фторбензонітрилу (позначеного в даній заявці як "Сполука I"), структура якого наведена нижче. 8 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 Приклад 1 описує один спосіб одержання сполуки I. Необхідно зазначити, що можуть бути використані інші способи синтезу сполуки I, як повинно бути зрозуміло фахівцям у даній галузі. Як описано нижче, сполука I має пролонговану дію інгібування DPP-IV. Сполуку I можна вводити у формі її вільної основи і також можна вводити у формі солей, гідратів і проліків, які перетворюються in vivo у форму вільної основи сполуки I. Наприклад, в обсяг даного винаходу входить введення сполуки I у вигляді фармацевтично прийнятної солі, одержаної з різних органічних і неорганічних кислот і основ, відповідно до процедур, добре відомих у даній галузі. Як використовується в даній заявці, сполука I включає солі, гідрати і проліки сполуки I, якщо не зазначено інше. Фармацевтично прийнятна сіль сполуки I переважно надає поліпшені фармакокінетичні властивості сполуці I порівняно з формою її вільної основи. Фармацевтично прийнятні солі також можуть спочатку надавати бажані фармакокінетичні властивості сполуці I, які раніше були відсутніми у цієї сполуки, і навіть можуть позитивно впливати на фармакодинамічні властивості сполуки, у тому, що стосується її терапевтичної активності в організмі. Конкретні приклади солей, гідратів і проліків сполуки I включають, але не обмежуються цим, форми солей, утворених із неорганічними або органічними кислотами, наприклад, гідрогалогеніди, такі як гідрохлорид, гідробромід, гідройодид; інші мінеральні кислоти та їхні відповідні солі, такі як сульфат, нітрат, фосфат і т.д.; алкіл і моноарилсульфонати, такі як етансульфонат, толуолсульфонат і бензолсульфонат; та інші органічні кислоти і їхні відповідні солі, такі як ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, саліцилат і аскорбат. Додаткові кислотно-адитивні солі включають, але не обмежуються цим: адипат, альгінат, аргінат, аспартат, бісульфат, бісульфіт, бромід, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, циклопентанпропіонат, диглюконат, дигідрофосфат, динітробензоат, додецилсульфат, фумарат, галактерат (із муцинової кислоти), галактуронат, глюкогептаоат, глюконат, глутамат, гліцерофосфат, гемісукцинат, гемісульфат, гептаноат, гексаноат, гіпурат, гідрохлорид, гідробромід, гідройодид, 2-гідроксіетансульфонат, йодид, ізетіонат, ізобутират, лактат, лактобіонат, малат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногідрофосфат, 2-нафталінсульфонат, нікотинат, нітрат, оксалат, олеат, памоат, пектинат, персульфат, фенілацетат, 3-фенілпропіонат, фосфат, фосфонат і фталат. У конкретних варіантах, сполуку I вводять у вигляді HCl, метансульфонатної, сукцинатної, бензоатної, толуолсульфонатної, R-(-)манделатної або бензолсульфонатної солі сполуки I. Приклад 1 описує одержання форми сукцинатної солі сполуки I. 2. Введення і застосування сполуки І Даний винахід стосується, головним чином, способу, що включає введення сполуки I пацієнту при добовій дозі в межах від 1 мг/день до 250 мг/день сполуки I, необов'язково в межах від 2,5 мг до 200 мг сполуки I, необов'язково в межах від 2,5 мг до 150 мг сполуки I і необов'язково в межах від 5 мг до 100 мг сполуки I (у кожному випадку з розрахунку на молекулярну масу форми вільної основи сполуки I). Конкретні кількості доз, які можуть бути використані, включають, але не обмежуються цим, 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг і 100 мг сполуки I на день. Необхідно відмітити, що, якщо конкретно не зазначено інше, сполуку I можна вводити у формі її вільної основи або у вигляді фармацевтично прийнятної солі. Однак розмір доз і діапазони, зазначені в даній заявці, завжди даються з розрахунку на молекулярну масу форми вільної основи сполуки I. Даний винахід також стосується способу, що включає введення сполуки I пацієнту один раз на тиждень із використанням дози в межах від 1 мг/день до 250 мг/день сполуки I, необов'язково в межах від 10 мг до 200 мг сполуки I, необов'язково в межах від 10 мг до 150 мг сполуки I і необов'язково в межах від 10 мг до 100 мг сполуки I (у кожному випадку з розрахунку на молекулярну масу форми вільної основи сполуки I). Конкретні кількості доз, які можуть бути використані, включають, але не обмежуються цим, 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг і 100 мг сполуки I на тиждень у режимі "один раз на тиждень". Необхідно відмітити, що 9 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 якщо конкретно не зазначено інше, сполуку I можна вводити у формі її вільної основи або у вигляді фармацевтично прийнятної солі. Однак розмір доз і діапазони, зазначені в даній заявці, завжди даються з розрахунку на молекулярну масу форми вільної основи сполуки I. Сполуку I можна вводити будь-яким способом введення. Однак у конкретних варіантах втілення винаходу спосіб за даним винаходом здійснюють шляхом перорального введення сполуки I. Цей тип введення є переважним, завдяки його простоті, а також тому, що пацієнт самостійно може здійснювати введення. Сполуку I можна вводити один або декілька разів на день. Перевага даного винаходу, однак, полягає в тому, що сполуку I можна ефективно вводити при рівнях дозування, описаних у даній заявці, один раз на день, а також можна вводити у вигляді лікарської форми, що містить разову дозу, один раз на день. Можливість введення сполуки I при рівнях дозування, описаних у даній заявці, один раз на день і перорально полегшує пацієнтам самостійне введення сполуки I, таким чином, підвищуючи можливість його використання серед пацієнтів, що потребують інгібування активності DPP-IV in vivo. Переважно, сполука I є придатною для тривалого постійного застосування, і її можна вводити пацієнтам протягом тривалого періоду часу. Отже, є можливим здійснення способу, де сполуку I вводять пацієнту кожен день (необов'язково 1 раз на день) протягом періоду часу щонайменше 1 місяць, необов'язково протягом щонайменше 3 місяців і, якщо необхідно, необов'язково протягом всього періоду протікання захворювання у пацієнтів. Оскільки сполука I має пролонгований ефект інгібування DPP-IV, передбачається використання режиму дозування рідше, ніж один раз на день. Переважно, сполуку I можна вводити в будь-який час протягом дня. Необов'язково, сполуку I можна вводити щодня один раз на день, коли введення проводять вранці перед їжею. Оскільки сполука I може стимулювати секрецію інсуліну, коли рівень глюкози в крові досягає рівнів вищих за 100 мг/дл, може бути доцільним, коли сполука I знаходиться в системному кровотоці до підвищення рівнів глюкози в крові, що виникають після приймання їжі. Сполуку I можна вводити будь-якому пацієнту, для якого може бути корисним курс лікування, що призводить до зниження активності DPP-IV in vivo. Фіг. 1 ілюструє, а Приклад 3 описує ефект впливу на активність DPP-IV в плазмі у мавп після разового перорального введення, який спостерігається при введенні сполуки I. Як може бути видно з даних, наданих на Фіг.1, при введенні сполуки I один раз на день при рівнях дозування, описаних у даній заявці, сполуку I можна ефективно використати стосовно хворобливих станів, коли бажано знизити активність DPP-IV у плазмі. У світлі наведених даних вважають, що при введенні пацієнту щонайменше 2,5 мг сполуки I, активності DPP-IV у плазмі пацієнта можна знизити більш ніж на 60 % стосовно базової лінії протягом періоду часу щонайменше 6 годин, 12 годин, 18 годин і навіть 24 години після введення. Крім того, як детально описано нижче, Фіг.2 і 3 ілюструють ефект впливу на активність DPPIV в плазмі людини після разового перорального введення, який спостерігається при введенні сполуки I. Як може бути видно з даних, наданих на Фіг.2, при введенні сполуки I при рівнях дозування, описаних у даній заявці, сполука I може бути ефективно використана стосовно хворобливих станів, коли бажано знизити активність DPP-IV у плазмі. У світлі наведених даних, вважають, що при введенні пацієнту щонайменше 12,5 мг сполуки I, активність DPP-IV у плазмі пацієнта може бути знижена більше ніж на 10 % щодо базової лінії протягом періоду часу щонайменше 168 годин після введення; при введенні пацієнту щонайменше 50 мг сполуки I, активність DPP-IV у плазмі пацієнта може бути знижена більше ніж на 35 % щодо базової лінії протягом періоду часу щонайменше 168 годин після введення; і при введенні пацієнту щонайменше 200 мг або 400 мг сполуки I, активність DPP-IV у плазмі пацієнта може бути знижена більше ніж на 70 % щодо базової лінії протягом періоду часу щонайменше 168 годин після введення. Приклади конкретних застосувань для введення сполуки I включають, але не обмежуються цим, профілактику, сповільнення розвитку і/або лікування станів, опосередкованих DPP-IV, зокрема, діабету і, конкретніше, цукрового діабету типу 2, діабетичної дисліпідемії, порушеної толерантності до глюкози (IGT), порушеного рівня глюкози в плазмі натщесерце (IFG), метаболічного ацидозу, надмірного накопичення кетонових тіл, регулювання апетиту, ожиріння та ускладнень, пов'язаних із діабетом, включаючи діабетичну невропатію, діабетичну ретинопатію, запального захворювання кишечнику, хвороби Крона, ентеритів, викликаних хіміотерапією, мукозитів слизової оболонки порожнини рота, синдрому укороченої товстої кишки і захворювання нирок. Стани, опосередковані DPP-IV, додатково включають гіперліпідемію, таку як гіпертригліцеридемія, гіперхолестеринемія, гіпо(ЛВЩ)емія і гіперліпідемія після приймання їжі; атеросклероз; артеріальну гіпертензію; інфаркт міокарда, стенокардію, церебральний інфаркт, церебральну апоплексію і метаболічний синдром. 10 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вважається, що введення сполуки I пацієнтам, що страждають на діабет типу I або типу II, протягом мінімального періоду лікування щонайменше 30 днів поліпшує один або декілька серцево-судинних показників. Приклади серцево-судинних показників, які можуть бути поліпшені, включають, але не обмежуються цим, зниження середнього показника систолічного кров'яного тиску, підвищення ЛВЩ холестерину, поліпшення відношення ЛНЩ/ЛВЩ і зниження рівня тригліцеридів. Також вважається, що введення сполуки I у сполученні з однією або декількома протидіабетичними сполуками пацієнтам, що страждають на діабет типу I або типу II, протягом мінімального періоду лікування щонайменше 30 днів поліпшує один або декілька серцевосудинних показників. Приклади серцево-судинних показників, які можуть бути поліпшені, включають, але не обмежуються цим, зниження середнього показника систолічного кров'яного тиску, підвищення ЛВЩ холестерину, поліпшення відношення ЛНЩ/ЛВЩ і зниження рівня тригліцеридів. Також вважається, що введення сполуки I у сполученні з однією або декількома протидіабетичними або інкретиновими сполуками пацієнтам, що страждають на шлунковокишкові запальні захворювання (включаючи, але не обмежуючись цим, запальне захворювання кишечнику, хворобу Крона, ентерити, викликані хіміотерапією, мукозит слизової оболонки порожнини рота і синдром укороченої товстої кишки) протягом мінімального періоду лікування щонайменше 30 днів поліпшує стан слизової вистілки шлунково-кишкового тракту. Поліпшення стану слизової вистілки шлунково-кишкового тракту може бути продемонстровано, але не обмежується цим, збільшенням площі поверхні в кишечнику, зниженням запалення і/або підвищенням абсорбції поживних речовин. В одному варіанті сполуку I вводять пацієнту, що страждає на діабет типу 2. Пацієнти, що приймають сполуку I, також можуть частіше мати порушення функції секреції інсуліну з панкреатичних острівців, ніж у пацієнтів, у яких спостерігається розвиток резистентності до інсуліну в периферичних інсулін-чутливих тканинах/органах. Переважно, введення сполуки I один раз на день, або один раз на тиждень при рівнях дозування, описаних у даній заявці, також можна використати для лікування пацієнтів із переддіабетом. Вважається, що введення сполуки I пацієнту з переддіабетом, є корисним для сповільнення розвитку діабету типу II у такого пацієнта. Підтримка підвищеного рівня глюкози в крові десенсибілізує функцію панкреатичних острівців і порушує секрецію інсуліну. Шляхом поліпшення рівнів циклічного AMP і динаміки кальцію в бета клітинах, клітини активують гени, що відновлюють ушкоджені клітинні компоненти, і є менш чутливими до токсичності глюкози. Очікується, що введення сполуки I один раз на день або один раз на тиждень при рівнях дозування, описаних у даній заявці, буде мати ряд бажаних біологічних ефектів in vivo. Наприклад, введення сполуки I один раз на день або один раз на тиждень при рівнях дозування, описаних у даній заявці, знижує рівень глюкози в крові пацієнта в порівнянні з плацебо контролем. Таке зниження рівня глюкози в крові після приймання їжі допомагає пацієнтам, що страждають на діабет, підтримувати більш низькі рівні глюкози. Очікується також, що введення сполуки I один раз на день або один раз на тиждень при рівнях дозування, описаних у даній заявці, буде мати ефект підвищення рівня інсуліну у пацієнта або чутливості до інсуліну. Інсулін сприяє надходженню глюкози в м'язову, жирову і деякі інші тканини. Механізм, за допомогою якого клітини можуть поглинати глюкозу, полягає в полегшенні дифузії шляхом стимуляції інсулінового рецептора. С-пептид та інсулін являють собою білкові ланцюги, утворені шляхом активації і розподілу проінсуліну (неактивного попередника інсуліну). С-пептид та інсулін утворюються і зберігаються в бета клітинах підшлункової залоза. Коли інсулін вивільняється в кровотік, також вивільняються рівні кількості С-пептиду. Це робить С-пептид корисним у ролі маркера продукції інсуліну. Введення сполуки I відповідно до даного винаходу, як очікується, буде підвищувати рівні С-пептиду в організмі пацієнта. Очікується також, що введення сполуки I один раз на день або один раз на тиждень при рівнях дозування, описаних у даній заявці, буде мати ефект зниження рівня гемоглобіну Alc у пацієнта більше ніж на 0,5 % у порівнянні з плацебо контролем після тривалого лікування сполукою I. Крім того, очікується, що введення сполуки I один раз на тиждень при рівнях дозування, описаних у даній заявці, буде мати ефект зниження рівня гемоглобіну Alc у пацієнта більше ніж на 0,2 % у порівнянні з плацебо контролем після тривалого лікування сполукою I. Показники Hb-Alc, як це відомо, прямо пропорційні концентрації глюкози в крові протягом тривалості життя еритроцитів. Hb-Alc, таким чином, є показником рівнів глюкози в крові пацієнта протягом останніх 90 днів безпосередньо перед аналізом, які розглядають з розрахунку на останні 30 днів безпосередньо перед аналізом. Зниження рівнів гемоглобіну Alc, що 11 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 спостерігається у пацієнта, таким чином, підтверджує тривале зниження рівнів глюкози в крові пацієнта як результат введення сполуки I один раз на день при рівнях дозування, описаних у даній заявці. 3. Комбінована терапія, що включає сполуку I Даний винахід також стосується застосування сполуки I у сполученні з однією або декількома іншими протидіабетичними і/або інкретиновими сполуками. Приклади таких інших протидіабетичних сполук включають, але не обмежуються цим, модулятори сигнального шляху інсуліну, подібні до інгібіторів протеїнтирозинфосфатази (PTPаза) та інгібіторів глютамінфруктоза-6-фосфатамідотрансферази (GFAT); сполуки, що впливають на порушену продукцію глюкози в печінці, подібні до інгібіторів глюкоза-6-фосфатази (G6Pаза), інгібіторів фруктоза-1,6бісфосфатази (F-1,6-BPаза), інгібіторів глікогенфосфорилази (GP), антагоністів рецептора глюкагону та інгібіторів фосфоенолпіруваткарбоксикінази (PEPCK); інгібітори піруватдегідрогеназакінази (PDHK); засоби, що підвищують чутливість до інсуліну (інсулінсенсибілізуючі речовини); засоби, що підвищують секрецію інсуліну (підсилювачі секреції інсуліну); інгібітори альфа-глюкозидази; інгібітори випорожнення шлунка; активатори глюкокінази, агоністи рецептора GLP-1, агоністи рецептора GLP-2, модулятори UCP, модулятори RXR, інгібітори GSK-3, модулятори PPAR, метформін, інсулін; і 2-адренергічні антагоністи. Сполуку I можна вводити щонайменше з однією із інших зазначених протидіабетичних сполук, або одночасно у вигляді однієї дози, в один і той же час у вигляді роздільних доз або послідовно (тобто, коли одну дозу вводять до або після введення іншої дози). Приклади інгібіторів PTPази, які можуть бути використані в сполученні зі сполукою I, включають, але не обмежуються цим, інгібітори, розкриті в патентах США №№ 6057316, 6001867 і публікаціях заявок PCT №№ WO 99/58518, WO 99/58522, WO 99/46268, WO 99/46267, WO 99/46244, WO 99/46237, WO 99/46236 і WO 99/15529. Приклади інгібіторів GFAT, які можуть бути використані в сполученні зі сполукою I, включають, але не обмежуються цим, інгібітори, розкриті в Mol. Cell. Endocrinol. 1997, 135(1), 6777. Приклади інгібіторів G6Pази, які можуть бути використані в сполученні зі сполукою I, включають, але не обмежуються цим, інгібітори, розкриті в публікаціях заявок PCT №№ WO 00/14090, WO 99/40062 і WO 98/40385, Європейської патентної публікації № EP682024 і Diabetes 1998, 47, 1630-1636. Приклади інгібіторів F-1,6-BPази, які можуть бути використані в сполученні зі сполукою I, включають, але не обмежуються цим, інгібітори, розкриті в Публікаціях заявок PCT №№ WO 00/14095, WO 99/47549, WO 98/39344, WO 98/39343 і WO 98/39342. Приклади інгібіторів GP, які можуть бути використані в сполученні зі сполукою I, включають, але не обмежуються цим, інгібітори, розкриті в Патенті США № 5998463, публікаціях заявок PCT №№ WO 99/26659, WO 97/31901, WO 96/39384 і WO9639385 і Європейських патентних публікаціях №№ EP 978279 і EP 846464. Приклади антагоністів рецептора глюкагону, які можуть бути використані в сполученні зі сполукою I, включають, але не обмежуються цим, антагоністи, розкриті в патентах США №№ 5880139 і 5776954, публікаціях заявок PCT №№ WO 99/01423, WO 98/22109, WO 98/22108, WO 98/21957, WO 97/16442 і WO 98/04528 і описані в Bioorg. Med. Chem. Lett. 1992, 2, 915-918, J. Med. Chem. 1998, 41, 5150-5157 і J. Biol Chem. 1999, 274; 8694-8697. Приклади інгібіторів PEPCK, які можуть бути використані в сполученні зі сполукою I, включають, але не обмежуються цим, інгібітори, розкриті в патенті США № 6030837 і Mol. Biol. Diabetes 1994, 2, 283-99. Приклади інгібіторів PDHK, які можуть бути використані в сполученні зі сполукою I, включають, але не обмежуються цим, інгібітори, розкриті в J. Med. Chem. 42 (1999) 2741-2746. Приклади засобів, що підвищують чутливість до інсуліну, які можуть бути використані в сполученні зі сполукою I, включають, але не обмежуються цим, інгібітори GSK-3, агоністи рецептора ретиноїду X (RXR), агоністи Бета-3 AR, модулятори UCP, протидіабетичні тіазолідиндіони (глітазони), агоністи PPAR гамма не-глітазонного типу, подвійні агоністи PPAR гамма/PPAR альфа, протидіабетичні сполуки, що містять ванадій, і бігуаніди, такі як метформін. Приклади інгібіторів GSK-3 включають, але не обмежуються цим, інгібітори, розкриті в публікаціях заявок PCT №№ WO 00/21927 і WO 97/41854. Приклади модуляторів RXR включають, але не обмежуються цим, сполуки, розкриті в патентах США №№ 4981784, 5071773, 5298429 і 5506102 і публікаціях заявок PCT №№ WO89/05355, WO91/06677, WO92/05447, WO93/11235, WO95/18380, WO94/23068 і WO93/23431. 12 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади агоністів Бета-3 AR включають, але не обмежуються цим, CL-316,243 (Lederle Laboratories) і агоністи, розкриті в патенті США № 5705515 і публікаціях заявок PCT №№ WO 99/29672, WO 98/32753, WO 98/20005, WO 98/09625, WO 97/46556 і WO 97/37646. Приклади модуляторів UCP включають агоністи UCP-1, UCP-2 і UCP-3. Приклади модуляторів UCP включають, але не обмежуються цим, модулятори, розкриті в Vidal-Puig et al, Biochem. Biophys. Res. Commun., Vol. 235(1) pp. 79-82 (1997). Приклади протидіабетичних, PPAR-модулюючих тіазолідиндіонів (глітазонів) включають, але не обмежуються цим, (S)-((3,4-дигідро-2-(фенілметил)-2H-1-бензопіран-6іл)метилтіазолідин-2,4-діон (енглітазон), 5-{[4-(3-(5-метил-2-феніл-4-оксазоліл)-1оксопропіл)феніл]метил}тіазолідин-2,4-діон (дарглітазон), 5-{[4-(1метилциклогексил)метокси)феніл]метил]тіазолідин-2,4-діон (циглітазон), 5-{[4-(2-(1індоліл)етокси)феніл]метил}тіазолідин-2,4-діон (DRF2189), 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}тіазолідин-2,4-діон (BM-13.1246), 5-(2-нафтилсульфоніл)тіазолідин2,4-діон (AY-31637), біс(4-[(2,4-діоксо-5-тіазолідиніл)метил]феніл}метан (YM268), 5-{4-[2-(5метил-2-феніл-4-оксазоліл)-2-гідроксіетокси]бензил}тіазолідин-2,4-діон (AD-5075), 5-[4-(1-феніл1-циклопропанкарбоніламіно)бензил]тіазолідин-2,4-діон (DN-108), 5-{[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл])-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл])-2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діон, 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4-діон (розіглітазон), 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діон (піоглітазон; що продається під торговою маркою ACTOS™), 5-[6-(2-фтор-бензилокси)нафталін-2-ілметил]тіазолідин-2,4-діон (MCC555), 5-([2-(2-нафтил)бензоксазол-5-іл]метил}тіазолідин-2,4-діон (Т-174), едаглітазон (BM-13-1258), ривоглітазон (CS-011) і 5-(2,4-діоксотіазолідин-5-ілметил)-2-метокси-N-(4трифторметилбензил)бензамід (KRP297). Приклади агоністів PPAR гамма не-глітазонного типу включають, але не обмежуються цим, аналоги N-(2-бензоїлфеніл)-L-тирозину, такі як GI-262570, регліксан (JTT501) і FK-614 і метаглідазен (MBX-102). Приклади подвійних агоністів PPAR гамма/PPAR альфа включають, але не обмежуються цим, омега-[(оксохіназолінілалкокси)феніл]алканоати та їхні аналоги, включаючи описані в PCT публікації № WO 99/08501 і Diabetes 2000, 49(5), 759-767; тезаглітазар, мураглітазар і навеглітазар. Приклади протидіабетичних сполук, що містять ванадій, включають, але не обмежуються цим, сполуки, розкриті в патенті США № 5866563. Метформін (диметилдигуанід) і його гідрохлоридна сіль постачаються на ринок під торговою маркою GLUCOPHAGE™. Приклади засобів, що підвищують секрецію інсуліну, включають, але не обмежуються цим, антагоністи рецептора глюкагону (як описано вище), похідні сульфонілсечовини, інкретинові гормони або їхні міметики, зокрема, глюкагон-подібний пептид-1 (GLP-1), або агоністи GLP-1, антагоністи бета-клітинних імідазолінових рецепторів і швидкодіючі стимулятори секреції інсуліну, подібні до протидіабетичних похідних фенілоцтової кислоти, протидіабетичних похідних D-фенілаланіну і мітиглініду та їхні фармацевтично прийнятні солі. Приклади похідних сульфонілсечовини включають, але не обмежуються цим, глізоксепід, глібурид, глібенкламід, ацетогексамід, хлорпропамід, гліборнурид, толбутамід, толазамід, гліпізид, карбутамід, гліквідон, глігексамід, фенбутамід, толцикламід; глімепірид і гліклазид. Толбутамід, глібенкламід, гліклазид, гліборнурид, гліквідон, глізоксепід і глімепірид можна вводити у формі, в якій вони постачаються на ринок під торговими марками RASTINON HOECHST™, AZUGLUCОN™, DIAMICRONT™, GLUBORID™, GLURENORM™, PRO-DIABAN™ і AMARYL™, відповідно. Приклади агоністів GLP-1 включають, але не обмежуються цим, агоністи, розкриті в патентах США №№ 5120712, 5118666 і 5512549 і PCT публікації № WO 91/11457. Зокрема, агоністи GLP-1 включають сполуки, подібні GLP-1 (7-37), при цьому в таких сполуках на 36 карбокси-кінці амідної функціональної групи Arg замінюється на Gly у 37 положенні і GLP-1 (79 9 36)NH2 молекули, і їхні варіанти та аналоги, включаючи GLN -GLP-1 (7-37), D-GLN -GLP-1 (79 18 8 37), ацетил LYS -GLP-1 (7-37), LYS -GLP-1 (7-37) і, зокрема, GLP-1 (7-37)OH, VAL -GLP-1 (78 8 37), GLY -GLP-1 (7-37), THR -GLP-1 (7-37), GLP-1 (7-37) і 4-імідазопропіоніл-GLP-1. Одним конкретним прикладом агоніста GLP-1 є Екстендатид, що складається з 39амінокислот пептид-амід, який постачається на ринок під торговою маркою BYETTA™. Екзенатид має емпіричну формулу C184H282N50O60S і молекулярну масу 4186,6 Дальтон. Амінокислотна послідовність Екзенатиду наступна: H-His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Leu 13 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-GlyAla-Pro-Pro-Pro-Ser-NH2. Приклади агоністів глюкагон-подібного пептиду-2 (GLP-2) або GLP-2 включають, але не обмежуються цим, агоністи, розкриті в патенті США № 7056886 і публікаціях заявок PCT №№ WO 00/53208, WO 01/49314 і WO 03/099854. Одним конкретним прикладом агоніста GLP-2 є TEDUGLUTIDE™, 39-амінокислотний пептид-амід (NPS Pharmaceuticals, Inc.). Приклади антагоністів бета-клітинних імідазолінових рецепторів включають, але не обмежуються цим, антагоністи, описані в PCT публікації № WO 00/78726 і J. Pharmacol. Exp. Ther. 1996; 278; 82-89. Прикладом протидіабетичного похідного фенілоцтової кислоти є репаглінід і його фармацевтично прийнятні солі. Приклади протидіабетичних похідних D-фенілаланіну включають, але не обмежуються цим, натеглінід (N-[(транс-4-ізопропілциклогексил)карбоніл]-D-фенілаланін, EP 196222 і EP 526171) і репаглінід ((S)-2-етокси-4-{2-[[3-метил-1-[2-(1-піперидиніл)феніл]бутил]аміно]-2оксоетил}бензойна кислота, EP 0 147 850 A2 і EP 0 207 331 A1). Передбачається, що натеглінід включає конкретні кристалічні форми (поліморфи), розкриті в патенті США № 5488510 і Європейській патентній публікації № EP 0526171 B1. Репаглінід і натеглінід можна вводити у формі, в якій вони постачаються на ринок під торговими марками NOVONORM™ і STARLIX™, відповідно. Приклади інгібіторів альфа-глюкозидази включають, але не обмежуються цим, акарбозу, N(1,3-дигідрокси-2-пропіл)валіоламін (воглібозу) і 1-дезоксиноіриміцинову похідну міглітолу. Акарбоза являє собою 4,6-дидезокси-4-[(1S)-(1,4,6,5)-4,5,6-тригідрокси-3-гідроксиметил-2циклогексеніламіно)мальтотриозу. Структура акарбози також може бути описана як О-4,6дидезокси-4-{[1S, 4R, 5S, 6S]-4,5,6-тригідрокси-3-(гідроксиметил)-2-циклогексен-1іл]аміно)альфа-D-глюкопіранозил-(1-4)-O-альфа-D-глюкопіранозил-(1-4)-D-глюкопіраноза. (Патент США № 4062950 і Європейська патентна публікація № EP 0 226 121). Акарбозу і міглітол можна вводити у формах, в яких вони постачаються на ринок під торговими марками GLUCOBAY™ і DIASTABOL 50™, відповідно. Приклади інгібіторів випорожнення шлунка, що відрізняються від GLP-1, включають, але не обмежуються цим, інгібітори, розкриті в J. Clin. Endocrinol. Metab. 2000, 85(3), 1043-1048 і Diabetes Care 1998; 21; 897-893, зокрема, Амілін і його аналоги, такі як прамлінтид. Амілін описаний у Diabetologia 39, 1996, 492-499. Приклади 2-адренергічних антагоністів включають, але не обмежуються цим, мідаглізол, який описаний у Diabetes 36,1987, 216-220. Інсулін, який може бути використаний у сполученні зі сполукою I, включає, але не обмежується цим, препарати тваринного інсуліну, виділені з підшлункової залози бика і свині; препарати людського інсуліну, генетично синтезовані з використанням Escherichia coli або дріжджів; цинк інсулін; протамінцинк інсулін; фрагмент або похідна інсуліну (наприклад, INS-1) і пероральний інсуліновий препарат. В одному конкретному варіанті втілення винаходу, протидіабетичну сполуку для введення в сполученні зі сполукою I вибирають із групи, що включає натеглінід, мітиглінід, репаглінід, метформін, екстендатид, розіглітазон, тезаглітазар, піоглітазон, глізоксепід, глібурид, глібенкламід, ацетогексамід, хлорпропамід, гліборнурид, толбутамід, толазамід, гліпізид, карбутамід, гліквідон, глігексамід, фенбутамід, толцикламід, глімепірид і гліклазид, включаючи їхні будь-які фармацевтично прийнятні солі. Приклади препарату і композиції інгібіторів PTPази, інгібіторів GSK-3, що не є малими молекулами сполук-міметиків, інгібіторів GFAT, інгібіторів G6Pази, антагоністів рецептора глюкагону, інгібіторів PEPCK, інгібіторів F-1,6-BPази, інгібіторів GP, модуляторів RXR, агоністів Бета-3 AR, інгібіторів PDHK, інгібіторів випорожнення шлунка і модуляторів UCP розкриті в патентах, заявках на патенти і посиланнях, наведених у даній заявці. У разі комбінованої терапії зі сполукою I, іншу протидіабетичну сполуку можна вводити (наприклад, шляхом введення і в лікарській формі) способом, відомим per se для такої сполуки. Сполуку I та іншу протидіабетичну сполуку можна вводити послідовно (тобто в різний час) або одночасно, або одну за іншою у формі двох роздільних доз, або в одній об'єднаній разовій дозі. В одному конкретному варіанті втілення винаходу, іншу протидіабетичну сполуку вводять зі сполукою I у вигляді однієї об'єднаної лікарської форми. Доза протидіабетичної сполуки може бути вибрана з діапазону, відомого для клінічного застосування такої сполуки. Будь-які терапевтичні сполуки для лікування діабетичних ускладнень, антигіперліпедемічні сполуки, засоби проти ожиріння або гіпотензивні сполуки можна використати в сполученні зі сполукою I таким же чином, як і описані вище протидіабетичні сполуки. Приклади терапевтичних сполук від діабетичних ускладнень включають, але не обмежуються цим, інгібітори альдозредуктази, такі 14 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 як толрестат, епалрестат, зенарестат, зополрестат, міналрестат, фідарестат, CT-112 і ранірестат; нейротропні фактори і посилюючі їх сполуки, такі як NGF, NT-3, BDNF і промотори продукції-секреції нейротрофіну, описані в WO01/14372 (наприклад, 4-(4-хлорфеніл)-2-(2-метил1-імідазоліл)-5-[3-(2-метилфенокси)пропіл]оксазол); стимулятори регенерації нервової тканини, такі як Y-128; інгібітори PKC, такі як рубоксистауринмезилат; інгібітори AGE, такі як ALT946, пімагедин, N-фенацилтіазолійбромід (ALT766), ALT-711, EXO-226, піридорин і піридоксамін; акцептори реактивного кисню, такі як тіокаприлова кислота; церебральні вазоділататори, такі як тіаприд і мексилетин; агоністи рецептора соматостатину, такі як BIM23190; та інгібітори регулюючої сигнали апоптозу кінази-1 (ASK-1). Приклади антигіперліпедемічних сполук включають, але не обмежуються цим, інгібітори HMG-CoA редуктази, такі як правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, розувастатин і пітавастатин; інгібітори скваленсинтази, такі як сполуки, описані у WO97/10224 (наприклад, N-[[(3R, 5S)-1-(3-ацетокси2,2-диметилпропіл)-7-хлор-5-(2,3-диметоксифеніл)-2-оксо-1,2,3,5-тетрагідро-4,1-бензоксазепін3-іл]ацетил]піперидин-4-оцтова кислота); фібратні сполуки, такі як безафібрат, клофібрат, симфібрат і клінофібрат; інгібітори ACAT, такі як авасиміб і ефлюциміб; аніонно-обмінні смоли, такі як колестирамін; пробукол; лікарські засоби на основі нікотинової кислоти, такі як нікомол і ніцеритрол; етилікозапентат; і рослинні стероли, такі як соєвий стерол і -оризанол. Приклади засобів проти ожиріння включають, але не обмежуються цим, дексфенфлурамін, фенфлурамін, фентермін, сибутрамін, амфепрамон, дексамфетамін, мазіндол, фенілпропаноламін, клобензорекс; антагоністи рецептора MCH, такі як SB-568849 і SNAP-7941; антагоністи нейропептиду Y, такі як CP-422935; антагоністи канабіноїдного рецептора, такі як SR-141716 і SR-147778; антагоніст греліну; інгібітори 11-гідроксистероїддегідрогенази, такі як BVT-3498; інгібітори панкреатичної ліпази, такі як орлістат і ATL-962; агоністи Бета-3 AR, такі як AJ-9677; пептидні препарати, що знижують апетит, такі як лептин і CNTF (Ciliary Neurotropic Factor); агоністи холецистокініну, такі як лінтитрипт і FPL-15849; і засоби для пригнічення апетиту, такі як Р-57. Приклади гіпотензивних сполук включають інгібітори ангіотензин-перетворюючого ферменту, такі як каптоприл, еналаприл і делаприл; антагоністи ангіотензину II, такі як кандезартанцилексетил, лозартан, епрозартан, валзартан, телмізартан, ірбезартан, олмезартанмедоксоміл, тазозартан і 1-[[2-(2,5-дигідро-5-оксо-4H-1,2,4-оксадіазол-3-іл)біфеніл4-іл]метил]-2-етокси-1H-бензімідазол-7-карбонова кислота; блокатори кальцієвих каналів, такі як манідипін, ніфедипін, нікардипін, амлодипін і ефонідипін; відкривачі калієвих каналів, такі як левкромакалім, L-27152, AL0671 і NIP-121; клонідин; деацетилази, такі як резерватрол, агоніст сиртуїну, поліфеноли; агоніст MCR4; натрій-залежні інгібітори транспорту глюкози (SGL T2). Структура активних засобів, зазначених у даній заявці під кодовими номерами, родовими або товарними найменуваннями, можуть бути взяті з діючого видання збірника "The Merck Index" або з баз даних, наприклад, міжнародних патентів (наприклад, IMS World Publications). Їхній відповідний зміст включений у дану заявку за допомогою посилання. Будь-який фахівець у даній галузі має повну можливість ідентифікувати активні речовини і, на основі зазначених посилальних документів, також може одержувати і досліджувати фармацевтичні показання і властивості на стандартних моделях для досліджень, як in vitro, так і in vivo. 4. Композиції, що включають сполуку I Сполука I може бути включена у фармацевтичну композицію, адаптовану для різних способів введення. Наприклад, сполука I може бути включена в фармацевтичну композицію, адаптовану для введення способом, вибраним із групи, що включає пероральне, парентеральне, інтраперитонеальне, внутрішньовенне, внутрішньоартеріальне, черезшкірне, сублінгвальне, внутрішньом'язове, ректальне, трансбукальне, інтраназальне, ліпосомальне введення, введення за допомогою інгаляції, вагінальне, внутрішньоочне введення, введення за допомогою цілеспрямованої доставки (наприклад, за допомогою катетера або стента), підшкірне, введення в жирову тканину, внутрішньосуглобове, інтраперитонеальне та інтратекальне введення. Як таку, сполуку I можна формулювати в різні фармацевтично прийнятні композиції, включаючи форми для ін'єкцій (наприклад, підшкірних, внутрішньовенних, внутрішньом'язових та інтраперитонеальних ін'єкцій), краплинні вливання, форми для зовнішнього застосування (наприклад, назальні спреї, черезшкірні препарати; мазі і т.д.), і супозиторії (наприклад, ректальні і вагінальні супозиторії). Ці різні фармацевтично прийнятні композиції можна одержувати відомими способами, що традиційно використовуються у фармацевтичній промисловості, із використанням фармацевтично прийнятного носія, який традиційно використовують у фармацевтичній промисловості. Як це використовується в даній заявці, композиція, що включає сполуку I, охоплює форму вільної основи сполуки I, солі, гідрати і проліки сполуки I, так само як і будь-які інші речовини, які можуть бути включені в таку композицію для її передбачуваного призначення, включаючи інші 15 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 активні інгредієнти, якщо не зазначено інше. Конкретні форми солей сполуки I, які можна використати, включають, але не обмежуються цим, HCl, метансульфонатну, сукцинатну, бензоатну, толуолсульфонатну, R-(-)манделатну або бензолсульфонатну сіль сполуки I. Як відмічено вище, сполуку I можна вигідним чином використати при введенні пацієнту при добовій дозі в межах від 1 мг/день до 250 мг/день сполуки I, необов'язково в межах від 2,5 мг до 200 мг сполуки I, необов'язково в межах від 2,5 мг до 150 мг сполуки I і необов'язково в межах від 5 мг до 100 мг сполуки I (у кожному випадку з розрахунку на молекулярну масу форми вільної основи сполуки I). Конкретні кількості доз, які можуть бути використані, включають, але не обмежуються цим, 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг і 100 мг сполуки I на день. Як вже відмічено вище, бажано, коли сполуку I вводять один раз на день. Відповідно, фармацевтичні композиції за даним винаходом можуть бути представлені в лікарській формі, що являє собою разову дозу, що включає від 1 мг/день до 250 мг/день сполуки I, необов'язково в межах від 2,5 мг до 200 мг сполуки I, необов'язково в межах від 2,5 мг до 150 мг сполуки I і необов'язково в межах від 5 мг до 100 мг сполуки I. У конкретних варіантах втілення винаходу фармацевтична композиція містить 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг або 100 мг сполуки I. Як вже відмічено вище, сполуку I переважно можна використати для перорального введення. Отже, композиції за даним винаходом, необов'язково, можуть бути адаптовані для перорального введення. В одному варіанті така фармацевтична композиція являє собою тверду лікарську форму, адаптовану для перорального введення. У зв'язку з цим, композиція, наприклад, може бути у формі таблетки або капсули. Приклад 2 представляє приклади твердих лікарських форм, що включають сполуку I, адаптованих для перорального введення. В іншому варіанті така фармацевтична композиція являє собою рідку лікарську форму, адаптовану для перорального введення. Як вже було відмічено вище, сполуку I переважно можна використати для парентерального введення. Отже, композиції за даним винаходом, необов'язково, можуть бути адаптовані для парентерального введення. В одному варіанті така фармацевтична композиція являє собою лікарську форму у вигляді розчину, адаптовану для парентерального введення. В іншому варіанті така фармацевтична композиція являє собою лікарську форму у вигляді суспензії, адаптовану для парентерального введення. Як відмічено вище, сполуку I переважно можна використати в сполученні з однією або декількома іншими протидіабетичними і/або інкретиновими сполуками. Отже, композиції за даним винаходом необов'язково можуть містити сполуку I у сполученні з однією або декількома іншими протидіабетичними або інкретиновими сполуками в об'єднаній лікарській формі у вигляді разових доз. Необов'язково, така форма у вигляді разових доз, що включає сполуку I у сполученні з однією або декількома іншими протидіабетичними і/або інкретиновими сполуками, є адаптованою для перорального введення і необов'язково являє собою тверду лікарську форму для перорального використання. Альтернативно, така форма у вигляді разових доз, що включає сполуку I у сполученні з однією або декількома іншими протидіабетичними і/або інкретиновими сполуками, може бути адаптована для парентерального введення і необов'язково являє собою лікарську форму у вигляді розчину. В одному варіанті така форма у вигляді разової дози, що включає сполуку I у сполученні з однією або декількома іншими протидіабетичними сполуками, містить від 1 мг/день до 250 мг/день сполуки I на пацієнта, необов'язково в межах від 2,5 мг до 200 мг сполуки I, необов'язково в межах від 2,5 мг до 150 мг сполуки I і необов'язково в межах від 5 мг до 100 мг сполуки I (у кожному випадку з розрахунку на молекулярну масу форми вільної основи сполуки I). У конкретних варіантах втілення винаходу така комбінована лікарська форма у вигляді разової дози, що включає сполуку I у сполученні з однією або декількома іншими протидіабетичними сполуками, містить 2,5 мг, 5 мг, 6,25 мг, 10 мг, 20 мг, 25 мг, 50 мг, 75 мг і 100 мг сполуки I. Будь-яка протидіабетична сполука або ряд протидіабетичних сполук можуть бути об'єднані зі сполукою I з утворенням такої комбінованої форми у вигляді разових доз. У конкретних варіантах втілення винаходу така комбінована лікарська форма у вигляді разових доз містить сполуку I і один або декілька членів із групи, що включає модулятори сигнального шляху інсуліну, подібні до інгібіторів протеїнтирозинфосфатази (PTPaза) та інгібіторів глютамінфруктоза-6-фосфатамідотрансферази (GFAT), сполуки, що впливають на порушення продукції глюкози в печінці, подібні до інгібіторів глюкоза-6-фосфатази (G6Paза), інгібіторів фруктоза-1,6бісфосфатази (F-1,6-BPaза), інгібіторів глікогенфосфорилази (GP), антагоністів рецептора глюкагону і інгібіторів фосфоенолпіруваткарбоксикінази (PEPCK); інгібітори піруватдегідрогеназакінази (PDHK); засоби, що посилюють чутливість до інсуліну (інсулін 16 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 60 сенсибілізуючі засоби); засоби, що підвищують секрецію інсуліну (засоби, що посилюють секрецію інсуліну); інгібітори альфа-глюкозидази; інгібітори випорожнення шлунка; активатори глюкокінази, агоністи рецептора GLP-1, агоністи рецептора GLP-2, модулятори UCP, модулятори RXR, інгібітори GSK-3, модулятори PPAR, метформін, інсулін; і 2-адренергічні антагоністи. Сполуку I можна вводити щонайменше з однією із інших зазначених протидіабетичних сполук, або одночасно у вигляді однієї дози, в один і той же час у вигляді роздільних доз, або послідовно (тобто, коли одну дозу вводять до або після введення іншої дози). В одному варіанті така комбінована лікарська форма у вигляді разової дози містить сполуку I і протидіабетичний тіазолідиндіон. Конкретні приклади тіазолідиндіонів, які можуть бути використані в цьому варіанті, включають, але не обмежуються цим, (S)-((3,4-дигідро-2(фенілметил)-2H-1-бензопіран-6-іл)метилтіазолідин-2,4-діон (енглітазон), 5-{[4-(3-(5-метил-2феніл-4-оксазоліл)-1-оксопропіл)феніл]метил}тіазолідин-2,4-діон (дарглітазон), 5-{[4-(1метилциклогексил)метокси)феніл]метил]тіазолідин-2,4-діон (циглітазон), 5-{[4-(2-(1індоліл)етокси)феніл]метил}тіазолідин-2,4-діон (DRF2189), 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}тіазолідин-2,4-діон (BM-13,1246), 5-(2-нафтилсульфоніл)тіазолідин2,4-діон (AY-31637), біс{4-[(2,4-діоксо-5-тіазолідиніл)метил]феніл}метан (YM268), 5-{4-[2-(5метил-2-феніл-4-оксазоліл)-2-гідроксіетокси]бензил}тіазолідин-2,4-діон (AD-5075), 5-[4-(1-феніл1-циклопропанкарбоніламіно)бензил]тіазолідин-2,4-діон (DN-108), 5-{[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл)-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл) -2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діон, 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4-діон (розіглітазон), 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діон (піоглітазон), 5-[6-(2-фторбензилокси)нафталін2-ілметил]тіазолідин-2,4-діон (MCC555), 5-([2-(2-нафтил)бензоксазол-5-іл]метил)тіазолідин-2,4діон (Т-174), едаглітазон (BM-13-1258), ривоглітазон (CS-011) і 5-(2,4-діоксотіазолідин-5ілметил)-2-метокси-N-(4-трифторметилбензил)бензамід (KRP297). В одному конкретному варіанті тіазолідиндіон у такій комбінованій лікарській формі у вигляді разової дози являє собою 5-{[4-(2-(5-етил-2-піридил)етокси)феніл]метил}тіазолідин-2,4-діон (піоглітазон) і його гідрохлорид, який постачається на ринок під торговою маркою ACTOS™. В іншому конкретному варіанті тіазолідиндіон являє собою 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4-діон (розіглітазон) і його малеатну сіль. В іншому варіанті така комбінована лікарська форма у вигляді разової дози містить сполуку I і агоніст PPAR гамма не-глітазонного типу. В іншому варіанті така комбінована лікарська форма у вигляді разової дози містить сполуку I і бігуанід. Конкретний приклад бігуаніду, який може бути використаний у цьому варіанті, являє собою Метформін (диметилдигуанід) і його гідрохлоридну сіль, який постачається на ринок під торговою маркою GLUCOPHAGE™. В іншому варіанті така комбінована лікарська форма у вигляді разової дози містить сполуку I і похідну сульфонілсечовини. Конкретні приклади похідних сульфонілсечовини, які можуть бути використані в цьому варіанті, включають, але не обмежуються цим, глізоксепід, глібурид, глібенкламід, ацетогексамід, хлорпропамід, гліборнурид, толбутамід, толазамід, гліпізид, карбутамід, гліквідон, глігексамід, фенбутамід, толцикламід; глімепірид і гліклазид. Толбутамід, глібенкламід, гліклазид, гліборнурид, гліквідон, глізоксепід і глімепірид можна вводити у формі, в якій вони постачаються на ринок під торговими марками RASTINON HOECHST™, AZUGLUCON™, DIAMICRONT™, GLUBORID™, GLURENORM™, PRO-DIABAN™ і AMARIL™, відповідно. В іншому варіанті така комбінована лікарська форма у вигляді разової дози містить сполуку I і протидіабетичну похідну D-фенілаланіну. Конкретні приклади протидіабетичних похідних Dфенілаланіну, які можуть бути використані в цьому варіанті, включають, але не обмежуються цим, репаглінід і натеглінід, які можна вводити у формі, в якій вони постачаються на ринок під торговими марками NOVONORM™ і STARLIX™, відповідно. В іншому варіанті така комбінована лікарська форма у вигляді разової дози містить сполуку I та інгібітор альфа-глюкозидази. Конкретні приклади інгібіторів альфа-глюкозидази, які можуть бути використані в цьому варіанті, включають, але не обмежуються цим, акарбозу, міглітол і воглібозу, які можна вводити у формі, в якій вони постачаються на ринок під торговими марками GLUCOBAY™, DIASTABOL 50™ і BASEN™, відповідно. В одному конкретному варіанті втілення винаходу протидіабетичну сполуку для введення в сполученні зі сполукою I у такій комбінованій формі у вигляді разової дози вибирають із групи, що включає натеглінід, репаглінід, метформін, екстендатид, розіглітазон, піоглітазон, 17 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 глізоксепід, глібурид, глібенкламід, ацетогексамід, хлорпропамід, гліборнурид, толбутамід, толазамід, гліпізид, карбутамід, гліквідон, глігексамід, фенбутамід, толцикламід, глімепірид і гліклазид, включаючи їхні будь-які фармацевтично прийнятні солі. Стосовно кожного з перерахованих вище варіантів втілення винаходу і варіантів, що стосуються комбінованої форми у вигляді разової дози, що включає сполучення сполуки I з однією або декількома іншими протидіабетичними сполуками, фармацевтична композиція, необов'язково, може бути адаптована для перорального введення і, у зв'язку з цим, необов'язково може являти собою тверду лікарську форму, таку як таблетка або капсула, або, альтернативно, може являти собою рідку лікарську форму, адаптовану для перорального введення. Доза протидіабетичної сполуки може бути вибрана з діапазону, відомого для застосування такої сполуки в клінічних умовах. Будь-яку з терапевтичних сполук для лікування діабетичних ускладнень, антигіперліпедемічних сполук, засобів проти ожиріння або гіпотензивних сполук можна використати в сполученні зі сполукою I таким же способом, як і описані вище протидіабетичні сполуки. Приклади терапевтичних сполук для лікування діабетичних ускладнень включають, але не обмежуються цим, інгібітори альдозаредуктази, такі як толрестат, епалрестат, зенарестат, зополрестат, міналрестат, фідарестат, CT-112 і ранірестат; нейротропні фактори і підсилюючі їх сполуки, такі як NGF, NT-3, BDNF, і промотори продукції-секреції нейротрофіну, описані у WO01/14372 (наприклад, 4-(4-хлорфеніл)-2-(2-метил1-імідазоліл)-5-[3-(2-метилфенокси)пропіл]оксазол); стимулятори регенерації нервової тканини, такі як Y-128; інгібітори PKC, такі як рубоксистауринмезилат; інгібітори AGE, такі як ALT946, пімагедин, N-фенацилтіазолійбромід (ALT766), ALT-711, EXO-226, піридорин і піридоксамін; акцептори реактивного кисню, такі як ліпоєва кислота; церебральні вазодилататори, такі як тіаприд і мексилетин; агоністи рецептора соматостатину, такі як BIM23190; та інгібітори регулюючої сигнали апоптозу кінази-1 (ASK-1). Приклади антигіперліпедемічної сполуки включають, але не обмежуються цим, інгібітори HMG-CoA редуктази, такі як правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, розувастатин і пітавастатин; інгібітори скваленсинтази, такі як сполуки, описані в WO97/10224 (наприклад, N-[[(3R, 5S)-1-(3-ацетокси2,2-диметилпропіл)-7-хлор-5-(2,3-диметоксифеніл)-2-оксо-1,2,3,5-тетрагідро-4,1-бензоксазепін3-іл]ацетил]піперидин-4-оцтова кислота); фібратні сполуки, такі як безафібрат, клофібрат, симфібрат і клінофібрат; інгібітори ACAT, такі як авасиміб і ефлюциміб; аніонно-обмінні смоли, такі як колестирамін; пробукол; лікарські засоби на основі нікотинової кислоти, такі як нікомол і ніцеритрол; етилікозапентат; і рослинні стероли, такі як соєвий стерол і -оризанол. Приклади засобів проти ожиріння включають, але не обмежуються цим, дексфенфлурамін, фенфлурамін, фентермін, сибутрамін, амфепрамон, дексамфетамін, мазіндол, фенілпропаноламін, клобензорекс; антагоністи рецептора MCH, такі як SB-568849 і SNAP-7941; антагоністи нейропептиду Y, такі як CP-422935; антагоністи канабіноїдного рецептора, такі як SR-141716 і SR-147778; антагоніст греліну; інгібітори 11-гідроксистероїддегідрогенази, такі як BVT-3498; інгібітори панкреатичної ліпази, такі як орлістат і ATL-962; агоністи Бета-3 AR, такі як AJ-9677; пептидні препарати, що знижують апетит, такі як лептин і CNTF (Ciliary Neurotropic Factor); агоністи холецистокініну, такі як лінтитрипт і FPL-15849; і засоби для пригнічення апетиту, такі як Р-57. Приклади гіпотензивних сполук включають інгібітори ангіотензин-перетворюючого ферменту, такі як каптоприл, еналаприл і делаприл; антагоністи ангіотензину II, такі як кандезартанцилексетил, лозартан, епрозартан, валзартан, телмізартан, ірбезартан, олмезартанмедоксоміл, тазозартан і 1-[[2-(2,5-дигідро-5-оксо-4H-1,2,4-оксадіазол-3-іл)біфеніл4-іл]метил]-2-етокси-1H-бензімідазол-7-карбонова кислота; блокатори кальцієвих каналів, такі як манідипін, ніфедипін, нікардипін, амлодипін і ефонідипін; відкривачі калієвих каналів, такі як левкромакалім, L-27152, AL0671 і NIP-121; клонідин. 5. Набори і вироби, що включають сполуку I Даний винахід також стосується наборів, що включають фармацевтичну композицію відповідно до даного винаходу, що включає сполуку I (і, необов'язково, одну або декілька інших протидіабетичних сполук), де такий набір додатково включає інструкції, які містять один або декілька видів інформації, вибраних із групи, що включає зазначення хворобливого стану, при якому потрібно застосовувати фармацевтичну композицію, інформацію, що стосується зберігання фармацевтичної композиції, інформацію про дозування і інструкції, що стосуються способу введення фармацевтичної композиції. Набір також може включати пакувальні матеріали. Пакувальні матеріали можуть включати контейнер, який містить фармацевтичну композицію. Контейнер необов'язково може містити етикетку із зазначенням хворобливого стану, при якому потрібно вводити сполуку, інформацію, що стосується зберігання, інформацію про дозування і/або інструкції, що стосуються способу введення композиції. Набір також може 18 UA 99112 C2 5 10 15 20 25 30 35 40 45 50 55 включати додаткові компоненти для зберігання або введення композиції. Набір також може включати композицію у формі разової дози або у формі декількох доз. В одному варіанті втілення винаходу фармацевтична композиція в наборі містить декілька доз фармацевтичної композиції відповідно до даного винаходу, де така фармацевтична композиція являє собою лікарську форму у вигляді разових доз, яка містить сполуку I у кількості, яка знаходиться в одній із меж доз, визначених у даній заявці. В іншому варіанті втілення винаходу фармацевтична композиція в наборі містить декілька доз фармацевтичної композиції відповідно до даного винаходу, де така фармацевтична композиція являє собою лікарську форму у вигляді разових доз, яка містить сполуку I та одну або декілька інших протидіабетичних сполук, описаних у даній заявці. Даний винахід також стосується виробу, що включає фармацевтичну композицію відповідно до даного винаходу, що включає сполуку I (і, необов'язково, одну або декілька інших протидіабетичних сполук), де такі вироби додатково містять пакувальні матеріали. В одному варіанті пакувальний матеріал містить контейнер, який містить композицію. В іншому варіанті даний винахід забезпечує виріб, де упаковка містить етикетку, що зазначає один або декілька видів інформації, вибраних із групи, що включає зазначення хворобливого стану, при якому потрібно застосовувати фармацевтичну композицію, інформацію, що стосується зберігання фармацевтичної композиції, інформацію про дозування і/або інструкції, що стосуються способу введення фармацевтичної композиції. В одному варіанті втілення винаходу фармацевтична композиція у виробі включає декілька доз фармацевтичної композиції відповідно до даного винаходу, де така фармацевтична композиція являє собою лікарську форму у вигляді разових доз, які містять сполуку I у кількості, яка знаходиться в одній із меж доз, визначених у даній заявці. В іншому варіанті втілення винаходу фармацевтична композиція у виробі включає декілька доз фармацевтичної композиції відповідно до даного винаходу, де така фармацевтична композиція являє собою лікарську форму у вигляді разових доз, яка містить сполуку I та одну або декілька інших протидіабетичних сполук, описаних у даній заявці. Необхідно відмітити, що пакувальний матеріал, що використовується в наборах і виробах відповідно до даного винаходу, може утворювати безліч роздільних контейнерів, таких як розділений флакон або розділений пакет із фольги. Упаковка може бути у будь-якій зручній формі або у формі, відомій у даній галузі, яка виконана з фармацевтично прийнятного матеріалу, наприклад, такого як папір або картонний футляр, скляний або пластиковий бутель або посудина, контейнер, що закривається (наприклад, для вмісту в ньому з "повторними заповненнями" таблеток для уміщення в інший контейнер) або блістерна упаковка з індивідуальними дозами для видавлювання з упаковки у відповідності зі схемою терапевтичного лікування. Контейнер для використання залежить від конкретної лікарської форми, для якої він призначений. Є можливим використання більше ніж одного контейнера разом в єдиній упаковці для комерційного продажу лікарської форми у вигляді разових доз. Наприклад, таблетки можуть міститися у флаконі, який, у свою чергу, міститься в коробці. Одним конкретним прикладом набору відповідно до даного винаходу є так звана блістерна упаковка. Блістерні упаковки добре відомі в пакувальній індустрії і широко використовуються для упаковки фармацевтичних стандартних лікарських форм (таблетки, капсули та інші). Блістерні упаковки, в основному, складаються з листа з відносно жорсткого матеріалу (переважно, із жорсткого прозорого пластика), покритого фольгою. У процесі упаковування в жорсткому матеріалі утворюють поглиблення. Поглиблення мають розмір і форму індивідуальних таблеток або капсул, які повинні бути упаковані, або можуть мати розмір і форму для розміщення в упаковці безлічі таблеток і/або капсул. Далі таблетки або капсули вміщують у відповідні поглиблення і лист відносно жорсткого матеріалу покривають гнучкою фольгою з герметичним ущільненням, при цьому лицьова сторона фольги протилежна напрямку, в якому були утворені поглиблення. У результаті, таблетки або капсули є індивідуально запаяними або запаяними разом, як це бажано, у поглибленнях між фольгою і листом. Міцність листа переважно є такою, щоб таблетки або капсули могли бути витягнуті з блістерної упаковки вручну при натисненні на поглиблення, при цьому у фользі утвориться отвір в місці поглиблення. Таблетку або капсулу потім можна витягнути через зазначений отвір. ПРИКЛАДИ 1. Одержання 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2H-піримідин-1ілметил]-4-фторбензонітрилу і фармацевтично прийнятних солей 19 UA 99112 C2 5 10 15 20 25 30 35 4-Фтор-2-метилбензонітрил (3) Суміш 2-бром-5-фтортолуолу (2) (3,5 г, 18,5 ммоль) і CuCN (2 г, 22 ммоль) у ДМФА (100 мл) нагрівали при кип'ятінні зі зворотним холодильником протягом 24 годин. Реакційну суміш розводили водою та екстрагували гексаном. Органічні шари сушили над MgSO 4 і розчинник видаляли з одержанням продукту 3 (вихід 60 %). 1 H-ЯМР (400 MГц, CDCl3): 7,60 (дд, J=5,6, 8,8 Гц, 1H), 6,93-7,06 (м, 2H), 2,55 (с, 3H). 2-Бромметил-4-фторбензонітрил (4) Суміш 4-фтор-2-метилбензонітрилу (3) (2 г, 14,8 ммоль), NBS (2,64 г, 15 ммоль) і AIBN (100 мг) у CCl4 нагрівали при кип'ятінні зі зворотним холодильником в атмосфері азоту протягом 2 годин. Реакційну суміш охолоджували до кімнатної температури. Тверді речовини видаляли за допомогою фільтрації. Органічний розчин концентрували з одержанням неочищеного продукту у вигляді масла, яке використали на наступній стадії без додаткового очищення. 1 H-ЯМР (400 MГц, CDCl3): 7,68 (дд, J=5,2, 8,4 Гц, 1H), 7,28 (дд, J=2,4, 8,8 Гц, 1H), 7,12 (м, 1H), 4,6 (с, 2H). 2-(6-Хлор-3-метил-2,4-діоксо-3,4-дигідро-2H-піримідин-1-ілметил)-4-фторбензонітрил (6) Суміш неочищеного 3-метил-6-хлорурацилу (5) (0,6 г, 3,8 ммоль), 2-бромметил-4фторбензонітрилу (0,86 г, 4 ммоль) і K2CO3 (0,5 г, 4 ммоль) у ДМСО (10 мл) перемішували при 60С протягом 2 годин. Реакційну суміш розводили водою та екстрагували за допомогою EtOAc. Органічні шари сушили над MgSO4 і розчинник видаляли. Залишок очищали за допомогою колонкової хроматографії. Одержували 0,66 г продукту (вихід: 60 %). 1 H-ЯМР (400 MГц, CDCl3): 7,73 (дд, 1=12, 8,4 Гц, 1H), 7,26 (д, J=4,0 Гц, 1H), 7,11-7,17 (м, 1H), 6,94 (дд, J=2,0, 9,0 Гц, 1H), 6,034 (с, 2H), 3,39 (с, 3H). MS (ES) [m+Н] розраховане для C13H9ClFN3O2, 293,68; знайдено, 293,68. 2-[6-(3-Амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2H-піримідин-1-ілметил]-4фторбензонітрил, сіль ТФОК (1) (сіль ТФОК сполуки I) 2-(6-Хлор-3-метил-2,4-діоксо-3,4-дигідро-2H-піримідин-1-ілметил)-4-фторбензонітрил (5) (300 мг, 1,0 ммоль), дигідрохлорид (R)-3-амінопіперидину (266 мг, 1,5 ммоль) і бікарбонат натрію (500 мг, 5,4 ммоль) перемішували в запаяній пробірці в EtOH (3 мл) при 100С протягом 2 годин. Кінцеву сполуку одержували у вигляді солі ТФОК після очищення за допомогою ВЕРХ. 1 H-ЯМР (400 MГц, CD3OD): 7,77-7,84 (м, 1H), 7,16-7,27 (м, 2H), 5,46 (с, 1H), 5,17-5,34 (ABq, 2H, J=35,2, 15,6 Гц), 3,33-3,47 (м, 2H), 3,22 (с, 3H), 2,98-3,08 (м, 1H), 2,67-2,92 (м, 2H), 2,07-2,17 (м, 1H), 1,82-1,92 (м, 1H), 1,51-1,79 (м, 2H). MS (ES) [m+Н] розраховане для C18H20FN5O2, 357,38; знайдено, 357,38. 2-[6-(3-Амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2H-піримідин-1-ілметил]-4фторбензонітрил, HCl сіль 20 UA 99112 C2 5 10 15 20 25 30 Сіль ТФОК сполуки I суспендували в ДХМ і потім промивали насиченим розчином Na 2CO3. Органічний шар сушили і видаляли під вакуумом. Залишок розчиняли в ацетонітрилі і при 0C додавали HCl у діоксані (1,5 екв.). Після видалення розчинника одержували сіль HCl. 1 H-ЯМР (400 MГц, CD3OD): 7,77-7,84 (м, 1H), 7,12-7,26 (м, 2H), 5,47 (с, 1H), 5,21-5,32 (ABq, 2H, J=32,0, 16,0 Гц), 3,35-3,5 (м, 2H), 3,22 (с, 3H), 3,01-3,1 (м, 1H), 2,69-2,93 (м, 2H), 2,07-2,17 (м, 1H), 1,83-1,93 (м, 1H), 1,55-1,80 (м, 2H). MS (ES) [m+Н] розраховано для C18H20FN5O2, 357,38; знайдено, 357,38. Основна процедура одержання солей сполуки I Бензонітрильний продукт може бути виділений у вигляді вільної основи, якщо потрібно, але переважно, продукт може бути далі перетворений у відповідну кислотно-адитивну сіль. Зокрема, бензонітрильний продукт (приблизно 10 мг) у розчині MeOH (1 мл) обробляли різними кислотами (1,05 еквівалентів). Розчинам давали вистоятися протягом трьох днів на відкритому повітрі. Якщо утворювався осад, то суміш фільтрували і сіль сушили. Якщо не було ніякого твердого осаду, то суміш концентрували у вакуумі і виділяли осад. Таким способом одержували солі сполуки I із наступних кислот: бензойної, пара-толуолсульфонової, бурштинової, R-(-)мигдалевої і бензолсульфонової. Стадії виділення і/або очищення проміжних сполук в описаних вище способах можуть бути необов'язковими, якщо одержані з реакційної суміші проміжні сполуки відносно чисті і побічні продукти або домішки в реакційній суміші не служать перешкодою для подальших стадій реакції. Де це є можливим, одну або декілька стадій виділення можна виключити для досягнення коротшого часу обробки, і виключення подальших обробок також може забезпечити вищі виходи продуктів реакції. 2. Приклади композицій лікарських форм, що включають сукцинатну сіль 2-[6-(3амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2H-піримідин-1-ілметил]-4фторбензонітрилу Нижче представлені приклади композицій таблеток, які можна використати для введення сукцинатної солі 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2H-піримідин-1ілметил]-4-фторбензонітрилу (Сукцинатна сіль сполуки I) відповідно до даного винаходу. Необхідно відмітити, що представлені композиції можуть варіювати, як це відомо фахівцям у даній галузі. Приклади композицій таблеток наступні: 12,5 мг сполуки I (маса форми вільної основи) на таблетку Склад ядра таблетки (1) 2-[6-(3-Амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2H-піримідин-1ілметил]-4-фторбензонітрил (сукцинатна сіль) (2) Моногідрат лактози, NF, Ph, Eur (FOREMOST 316 FAST FLO) (3) Мікрокристалічна целюлоза, NF, Ph, Eur (AVICEL PH 102) (4) Натрійкроскармелоза, NF, Ph, Eur (AC-DO-SOL) (5) Колоїдний діоксид кремнію, NF, Ph, Eur (CAB-O-SIL M-5P) (6) Стеарат магнію, NF, Ph, Eur (MALLINCKRODT, Non-bovine Hyqual) УСЬОГО (на таблетку) 35 40 Плівкове покриття (12,0 мг всього) (1) Opadry II 85F18422, Білий - Частина 1 (COLORCON) (2) Opadry II 85F18422, Білий - Частина 2 (COLORCON) (3) Opadry II 85F18422, Білий - Частина 3 (COLORCON) 25 мг сполуки I (маса форми вільної основи) на таблетку 21 17,0 мг 224,6 мг 120,1 мг 32,0 мг 3,2 мг 3,2 мг 400,0 мг UA 99112 C2 Склад ядра таблетки (1) 2-[6-(3-Амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2H-піримідин-1ілметил]-4-фторбензонітрил (сукцинатна сіль) (2) Моногідрат лактози, NF, Ph, Eur (FOREMOST 316 FAST FLO) (3) Мікрокристалічна целюлоза, NF, Ph, Eur (AVICEL PH 102) (4) Натрійкроскармелоза, NF, Ph, Eur (AC-DO-SOL) (5) Колоїдний діоксид кремнію, NF, Ph, Eur (CAB-O-SIL M-5P) (6) Стеарат магнію, NF, Ph, Eur (MALLINCKRODT, Non-bovine Hyqual) УСЬОГО (на таблетку) 5 34,0 мг 207,6 мг 120,1 мг 32,0 мг 3,2 мг 3,2 мг 400,0 мг Плівкове покриття (12,0 мг всього) (1) Opadry II 85F18422, Білий - Частина 1 (COLORCON) (2) Opadry II 85F18422, Білий - Частина 2 (COLORCON) (3) Opadry II 85F18422, Білий - Частина 3 (COLORCON) 50 мг сполуки I (маса форми вільної основи) на таблетку Склад ядра таблетки (1) 2-[6-(3-Амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2Hпіримідин-1-ілметил]-4-фторбензонітрил (сукцинатна сіль) (2) Моногідрат лактози, NF, Ph, Eur (FOREMOST 316 FAST FLO) (3) Мікрокристалічна целюлоза, NF, Ph, Eur (AVICEL PH 102) (4) Натрійкроскармелоза, NF, Ph, Eur (AC-DO-SOL) (5) Колоїдний діоксид кремнію, NF, Ph, Eur (CAB-O-SIL M-5P) (6) Стеарат магнію, NF, Ph, Eur (MALLINCKRODT, Non-bovine Hyqual) УСЬОГО (на таблетку) 10 15 20 25 30 35 68,0 мг 173,6 мг 120,1 мг 32,0 мг 3,2 мг 3,2 мг 400,0 мг Плівкове покриття (12,0 мг всього) (1) Opadry II 85F18422, Білий - Частина 1 (COLORCON) (2) Opadry II 85F18422, Білий - Частина 2 (COLORCON) (3) Opadry II 85F18422, Білий - Частина 3 (COLORCON) 6. Ефект введення на активність у плазмі DPP-IV Разову дозу сполуки I вводили перорально мавпі при дозі 0,3 мг/кг. Фіг. 1 ілюструє ефект впливу на активність DPP-IV в плазмі мавп після введення, який спостерігається при введенні сполуки I. Як можна бачити, сполука I знижувала активність DPP-IV у плазмі у мавп більш ніж на 90 % стосовно базової лінії через 12 годин після введення. Таким чином, як можна бачити з даних, наданих на Фіг.1, при введенні сполуки I один раз на день при рівнях дозування, визначених у даній заявці, сполука I може бути ефективно використана стосовно хворобливих станів, де є бажаним зниження активності DPP-IV у плазмі. У світлі наведених даних вважають, що при введенні пацієнту щонайменше 25 мг сполуки I активність DPP-IV у плазмі пацієнта може бути знижена більш ніж на 60 % відносно базової лінії протягом періоду часу щонайменше 6 годин, 12 годин, 18 годин і навіть 24 годин безпосередньо після введення. 7. Ефект спільного введення з піоглітазоном на рівень глюкози в плазмі Ефект введення сполуки I у сполученні з піоглітазоном був досліджений за допомогою db db вимірювання рівнів глюкози в плазмі у мишей. Самок мишей db/db (BKS. Cg-+Lepr /+Lepr ) (вік - 6 тижнів, CLEA Japan (Tokyo, Japan)) ділили на 4 групи (n=7 у кожній групі), включаючи від Групи А до Групи D. Група А мала вільний доступ до подрібненого корму CE-2 (CLEA Japan) протягом 21 дня. Група В мала вільний доступ до подрібненого корму CE-2 (CLEA Japan), що містить 0,03 % (мас/мас) сукцинатної солі сполуки I, протягом 21 дня. Дозу Сполуки I у Групі В розраховували так, щоб вона становила 74,82,5 (середнє значенняSD) мг/кг маси тіла/день. Група С мала вільний доступ до подрібненого корму CE-2 (CLEA Japan), що містить 0,0075 % (мас/мас) піоглітазонгідрохлориду, протягом 21 дні. Дозу піоглітазону в Групі С розраховували так, щоб вона становила 17,70,6 (середнє значенняSD) мг/кг маси тіла/день. Група D мала вільний доступ до подрібненого корму CE-2 (CLEA Japan), що містить 0,03 % (мас/мас) сукцинатної солі сполуки I у сполученні з 0,0075 % (мас/мас) піоглітазонгідрохлориду, протягом 21 дня. Дози сполуки I і піоглітазону в Групі D розраховували так, щоб вони становили 63,11,9 (середнє значенняSD) мг/кг маси тіла/день і 15,80,5 (середнє значенняSD) мг/кг маси 22 UA 99112 C2 5 тіла/день, відповідно. Протягом 21 дня введення порошкоподібного корму не було ніякої істотної різниці в кількості порошкоподібного корму, що вводять, у зазначених 4 групах. Після 21 дня введення порошкоподібного корму брали проби крові з очноямкових вен мишей за допомогою капілярної піпетки в умовах доступу до корму, і рівні глюкози в плазмі визначали ферментативним методом із використанням Autoanalyzer 7080 (Hitachi, Japan). Результати представлені в Таблиці 1. Дані в таблиці представлені у вигляді середнього значення (n=7)стандартне відхилення. Таблиця 1 Група Група А (контроль) Група В (сполука I) Група С (піоглітазон) Група D (сполука Iпіоглітазон) 10 15 20 25 30 35 40 45 Рівень глюкози в крові (мг/дл) 472,974,6 410,347,9 394,447,9 256,162,5 Як показано в Таблиці 1, сполучення сполуки I з піоглітазоном демонструє чудові ефекти зі зниження рівнів глюкози в плазмі. 8. Ефект введення на активність DPP-IV у плазмі Разову дозу сполуки I вводили перорально 6 суб'єктам при дозі 12,5 мг, 25 мг, 50 мг, 100 мг, 200 мг і 400 мг, відповідно (всього 36 чоловік). Фіг.1 ілюструє ефект впливу на активність DPP-IV у плазмі людини після введення, який спостерігається при введенні сполуки I. Як можна було побачити, сполука I знижувала активність DPP-IV у плазмі людини більше ніж на 10 % відносно базової лінії через 168 годин після введення. Таким чином, як можна бачити з даних, наданих на Фіг.1, при введенні сполуки I один раз на тиждень при рівнях дозування, визначених у даній заявці, сполука I може бути ефективно використана стосовно хворобливих станів, де є необхідним зниження активності DPP-IV у плазмі. У світлі наведених даних вважають, що при введенні пацієнту щонайменше 50 мг сполуки I активність DPP-IV у плазмі пацієнта може бути знижена більше ніж на 35 % щодо базової лінії протягом періоду часу щонайменше 168 годин безпосередньо після введення, при введенні пацієнту щонайменше 100 мг сполуки I активність DPP-IV у плазмі пацієнта може бути знижена більше ніж на 60 % щодо базової лінії протягом періоду часу щонайменше 168 годин безпосередньо після введення, і при введенні пацієнту щонайменше 200 мг сполуки I, активність DPP-IV у плазмі пацієнта може бути знижена більше ніж на 70 % щодо базової лінії протягом періоду часу щонайменше 168 годин безпосередньо після введення. 9. Ефект введення на активність DPP-IV у плазмі Разову дозу сполуки I вводили перорально при дозі 3,125 мг (9 чоловік), 12,5 мг (8 чоловік), 50 мг (7 чоловік) і 100 мг (8 чоловік), відповідно. Фіг. 2 ілюструє ефект впливу на активність DPPIV в плазмі людини після введення, який спостерігається при введенні сполуки I. Як можна бачити, сполука I знижувала активність DPP-IV у плазмі людини більш ніж на 20 % щодо базової лінії на час 168 годин після введення. Таким чином, як можна бачити з даних, наданих на Фіг.2, при введенні сполуки I один раз на тиждень при рівнях дозування, визначених у даній заявці, сполука I може бути ефективно використана щодо хворобливих станів, де є необхідним зниження активності DPP-IV у плазмі. У світлі наведених даних, вважають, що введення пацієнту щонайменше 50 мг сполуки I активність DPP-IV у плазмі пацієнта може бути знижена більше ніж на 65 % щодо базової лінії протягом періоду часу щонайменше 168 годин після введення. Фахівцям у даній галузі повинно бути зрозумілим, що стосовно сполук, композицій, наборів і способів даного винаходу можливі різні модифікації і варіанти без відхилення від суті або обсягу винаходу. Таким чином передбачається, що даний винахід охоплює модифікації і варіанти цього винаходу, за умови, що вони входять в обсяг доданих пунктів формули винаходу та їхніх еквівалентів. ФОРМУЛА ВИНАХОДУ 50 1. Застосування 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1ілметил]-4-фторбензонітрилу (сполука І) або його фармацевтично прийнятної солі як лікарського засобу для лікування захворювання або стану, для якого показано інгібування DPPIV, при введені щотижневої дози у межах від 50 до 250 мг сполуки І пацієнту, де щотижневу дозу вводять один раз на тиждень. 23 UA 99112 C2 5 10 2. Застосування за п. 1, де захворювання або стан є діабетом. 3. Застосування за будь-яким з пп. 1, 2, де щотижнева доза сполуки І, що вводиться пацієнту, складає від 100 до 250 мг. 4. Застосування за будь-яким з пп. 1, 2, де щотижнева доза сполуки І, що вводиться пацієнту, складає 50, 75, 100, 125, 150, 175 або 200 мг. 5. Застосування 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1ілметил]-4-фторбензонітрилу (сполука І) або його фармацевтично прийнятної солі в одержанні лікарського засобу для лікування захворювання або стану, вибраного з діабету, причому лікарський засіб формулюється таким чином, що сполука І вводиться в щотижневій дозі в межах від 50 до 250 мг, де щотижневу дозу вводять один раз на тиждень. 24 UA 99112 C2 25 UA 99112 C2 Комп’ютерна верстка Л. Купенко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 26
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of 2-[6-(3-amino-piperidin-1-yl)-3-methyl-2,4-dioxo-3,4-dihydr0-2h-pyrimidin-1-ylmethyl]-4-fluorobenzonitrile
Автори англійськоюChristopher, Ronald J., Ogawa, Atsushi, Covington, Paul
Назва патенту російськоюПрименение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2н-пиримидин-1-илметил]-4-фторбензонитрила
Автори російськоюКристофер Роналд Дж., Огава Ацуси, Ковингтон Пол
МПК / Мітки
МПК: A61P 37/00, A61K 31/513, A61P 35/00, A61P 3/10, A61P 31/18, A61P 5/50
Мітки: 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2н-піримідин-1-ілметил]-4-фторбензонітрилу, застосування
Код посилання
<a href="https://ua.patents.su/28-99112-zastosuvannya-2-6-3-aminopiperidin-1-il-3-metil-24-diokso-34-digidro-2n-pirimidin-1-ilmetil-4-ftorbenzonitrilu.html" target="_blank" rel="follow" title="База патентів України">Застосування 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2н-піримідин-1-ілметил]-4-фторбензонітрилу</a>
Попередній патент: Препаративні пестицидні форми у вигляді емульсії пікерінга
Наступний патент: Рідка пестицидна композиція, що містить n-фенілсемікарбазонові пестицидні сполуки
Випадковий патент: Запірний пристрій