Заміщені 1-арил-4-циклопропілпіразоли, протипаразитна фармацевтична або ветеринарна композиція
Номер патенту: 83397
Опубліковано: 10.07.2008
Автори: Уолш Найджел Дерек Артур, Гезін Девід Морріс, Чабб Натан Ентоні Логан, Біллен Деніс, Холл Кім Томас, Робертс Лі Річард
Формула / Реферат
1. Сполука формули (І):
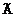 , (І)
, (І)
в якій:
R1 є CF3, OCF2H, OCF3, -SCF3, -SOCF3, -SO2CF3, або SF5;
R2 є Н, фтором або С1-4алкілом, необов'язково заміщеним 1-5 атомами галогену, незалежно вибраними з хлору і фтору;
R3, R4, R5 і R6 незалежно представляють Н, С1-4алкіл, необов'язково заміщений 1-5 групами галогену, незалежно вибраними з хлору і фтору, або хлор, або фтор;
R7 є Сl або фтором;
X є CR8 або N, де R8 є Сl або фтором; і
R9 є NRaRb;
Ra вибирають з водню, С1-6алкілу, С2-6алкенілу, C3-8циклоалкілу, С(О)ОС1-6алкілу і С1-6алканоїлу, де кожна з вищевказаних груп може включати один або більшу кількість необов'язкових замісників, які, коли хімічно можливо, незалежно вибрані з гало, гет, фенілу, гідрокси, -С(О)ОН, -С(О)ОС1-6алкілу, С1-6алкілу, С1-6галоалкілу, C3-8циклоалкілу, С1-6алкокси, С1-6галоалкокси, аміно, С1-6алкіламіно і ді-С1-6алкіламіно;
Rb вибирають з водню, С1-6алкілу, С2-6алкенілу, С1-6алканоїлу і С(О)ОС1.6алкілу, де кожна з вищевказаних груп може включати один або більшу кількість необов'язкових замісників, які, коли хімічно можливо, незалежно вибрані з, гало, фенілу, гідрокси, -СООН, -С(О)ОС1-6алкілу, С1-6алкілу, С1-6галоалкілу, C3-8циклоалкілу, С1-6алкокси, С1-6галоалкокси, аміно, С1-6алкіламіно і ді-С1-6алкіламіно;
або Ra і Rb разом із N атомом, до якого вони приєднані, можуть утворювати три-семичленне гетероциклічне кільце, яке містить один або більшу кількість додаткових N, О або S атомів, і де вказане гетероциклічне кільце може нести один або більшу кількість необов'язкових замісників, вибраних з оксо, гало, гет, фенілу, гідрокси, -СООН, -С(О)ОС1-6алкілу, С1-6алкілу, С1-6галоалкілу, С3-8циклоалкілу, С1-6алкокси, С1-6галоалкокси, аміно, С1-6алкіламіно і ді-С1-6алкіламіно; і
гет представляє чотири-семичленну гетероциклічну групу, яка є ароматичною або неароматичною, і яка містить один або більшу кількість гетероатомів, вибраних з азоту, кисню, сірки і їх сумішей, і де вказане гетероциклічне кільце необов'язково заміщене, де дозволяє валентність, одним або більшою кількістю замісників, вибраних з гало, ціано, нітро, С1-6алкілу, С1-6галоалкілу, С1-6алкокси, OC(O)С1-6алкілу, C(O)С1-6алкілу, С(О)ОС1-6алкілу і NRcRd, де Rc і Rd незалежно вибрані з водню, С1-6алкілу і С2-6алкенілу, де кожна з вищевказаних груп може включати один або більшу кількість необов'язкових замісників, які, де хімічно можливо, незалежно вибрані з гало, фенілу, гідрокси, -СООН, С(О)С1-6алкілу, С1-6алкілу, С1-6галоалкілу, C3-8циклоалкілу, С1-6алкокси, С1-6галоалкокси, аміно, С1-6алкіламіно і ді-С1-6 алкіламіно;
або її фармацевтично прийнятна сіль або проліки;
за умови, що принаймні один з R2, R3, R4, R5 або R6 є фтором.
2. Сполука за п. 1, в якій R1 є CF3 або SF5.
3. Сполука за п. 1 або 2, в якій R2 є F, CF3 або CHF2.
4. Сполука за будь-яким пп. 1-3, в якій R3 і R4 обидва представляють фтор, і R5 і R6 представляють водень.
5. Сполука за будь-яким пп. 1-4, в якій R2 є CF3, R3 і R4 обидва представляють фтор і R5 і R6 представляють водень.
6. Сполука за будь-яким пп. 1-5, в якій X є CR8 і R7 і R8 є обидва хлором.
7. Сполука за будь-яким пп. 1-6, в якій R9 вибраний з NH2, С1-6алкоксикарбоніламіно, з необов'язковими заміщенням по алкільній групі однією або більшою кількістю фторгруп, ді-С1-6алкіламіно і гет, С1-6алкіламіно, з необов'язковими заміщенням по алкільній групі однією або більшою кількістю фторгруп, C3-8циклоалкілів, фенілів і гетероциклічну групу.
8. Сполука за будь-яким пп. 1-7, в якійR9 є NH2.
9. Сполука формули (І) за п. 1, вибрана з:
5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(1,2,2-трифторциклопропіл)-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(пентафторциклопропіл)-1Н-піразол-3-карбонітрилу;
5-аміно-4-(2,2-дихлор-1-фторциклопропіл)-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-(пентафторциклопропіл)-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-(1,2,2-трифторциклопропіл)-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(2,2-дифторциклопропіл)-1Н-піразол-3-карбонітрилу;
5-аміно-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1-[2,6-дифтор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Н-піразол-3-карбонітрилу;
5-аміно-4-{1-[хлор(фтор)метил]-2,2-дифторциклопропіл}-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрилу;
1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-5-(метиламіно)-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(фторметил)циклопропіл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(2,2-дифтор-1-метилциклопропіл)-1Н-піразол-3-карбонітрилу;
5-аміно-1-{2,6-дихлор-4-[(трифторметил)тіо]феніл}-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрилу;
етил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату;
1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-5-(2-оксо-1,3-оксазолідин-3-іл)-1Н-піразол-3-карбонітрилу;
5-аміно-1-[3-хлор-5-(трифторметил)піридин-2-іл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрилу;
2-(диметиламіно)етил-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату;
2,2,2-трифторетил-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату;
5-аміно-1-{2,6-дихлор-4-[(трифторметил)сульфоніл]феніл}-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрилу;
1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-5-[(піридин-4-ілметил)аміно]-1Н-піразол-3-карбонітрил;
5-аміно-1-[2,6-дихлор-4-(дифторметокси)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрилу;
5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Н-піразол-3-карбонітрилу;
ізопропіл-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату;
піридин-4-ілметил-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату;
піридин-3-ілметил-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-5-іл]-карбамату;
піридин-2-ілметил-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату;
1Н-імідазол-5-ілметил-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату;
2-піролідин-1-ілетил-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату і
5-аміно-4-{1-[хлор(дифтор)метил]-2,2-дифторциклопропіл}-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3-карбонітрилу;
або її фармацевтично прийнятна сіль.
10. Сполука формули (І) за п. 1, якою є 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрил, або її фармацевтично прийнятна сіль.
11. Сполука формули (І) за п. 1, якою є 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрил, або її фармацевтично прийнятна сіль.
12. Сполука формули (І) за п. 1, якою є 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(1,2,2-трифторциклопропіл]-1Н-піразол-3-карбонітрил, або її фармацевтично прийнятна сіль.
13. Сполука формули (І) за п. 1, якою є 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(пентафторциклопропіл]-1Н-піразол-3-карбонітрил, або її фармацевтично прийнятна сіль.
14. Сполука або її фармацевтично прийнятна сіль за будь-яким одним з пп. 1-13 для застосування як медикаменту.
15. Сполука або її фармацевтично прийнятна сіль за будь-яким одним з пп. 1-13 для застосування як протипаразитного медикаменту.
16. Протипаразитна фармацевтична або ветеринарна композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль і придатний екципієнт або носій.
17. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким одним з пп. 1-13 при виробництві протипаразитного лікарського засобу для людини або тварини.
Текст
Цей винахід стосується похідних піразолу, які мають протипаразитні властивості. Сполуки, що розглядаються, є фторованими циклопропіларилпіразолами і, власне, винахід стосується 1-арил-4циклопропілпіразолів, в яких присутній принаймні один атом фтору, приєднаний до циклопропілового кільця. В опублікованій [міжнародній патентній заявці № (WO) 9824767, Європейській опублікованій патентній заявці № (ЕР) 933363 і ЕР 957094] описані 4-циклопропіларилпіразоли, які мають протипаразитну активність при боротьбі з членистоногими. Відомі сполуки не завжди проявляли гарну активність, або не мали тривалої дії при боротьбі з паразитами. Подібно, деякі протипаразитні агенти придатні лише для вузького спектру паразитів. Метою цього винаходу є усунення різних недоліків, або покращення властивостей відомих сполук. Тому, мета цього винаходу полягає в одержанні арилпіразолу, який має покращену протипаразитну активність у порівнянні із відомими сполуками. Сполуки за цим винаходом мають особливо гарну здатність до боротьби з широким спектром паразитів, що підтверджено результатами досліджень, які демонструють їх активність і ефективність. Зокрема, сполуки за цим винаходом є значно активнішими до бліх, ніж відомі сполуки. Також метою цього винаходу є одержання сполук із тривалою дією. Більш переважно, сполуки запобігають інвазії членистоногих на час принаймні двадцять-вісім днів. Збільшений термін дії в цілому відноситься до збільшеного напівжиття сполуки in vivo у тварині-носії. Також є бажаним, щоб сполуки за цим винаходом мали покращені фармакокінетичні властивості, підвищену безпечність, стабільність і розчинність. Тож, винахід стосується сполуки формули (І): в якій: R1 є CF3, OCF2H, OCF3, -SCF3, -SOCF3, -SO2CF3, або SF5; R2 є Н, фтором, або C1-4 алкілом, необов'язково заміщеним 1-5 атомами галогену, незалежно вибраними з хлору або фтору; R3, R4, R5 і R6 незалежно представляють Н, C1-4 алкіл, необов'язково заміщений 1-5 групами галогену, незалежно вибраними з хлору і фтору, або хлор або фтор; R7 є СІ або фтором; X є CR8 або N, де R8 є СІ або фтором; і R9 є NRaRb; Ra вибраний з водню, С1-6 алкілу, С2-6 алкенілу, С3-8 циклоалкілу, C(O)OC1-6 алкілу і С1-6 алканоїлу, де кожна з вищевказаних груп може включати один або більшу кількість необов'язкових замісників, які, де хімічно можливо, незалежно вибрані з гало, гет, фенілу, гідрокси, -С(О)ОН, -C(O)O С1-6 алкілу, С1-6 алкілу, С1-6 галоалкілу, С3-8 циклоалкілу, С1-6 алкокси, С1-6 галоалкокси, аміно, С1-6 алкіламіно і ди-С1-6 алкіламіно, Rb вибраний з водню, С1-6 алкілу, С2-6 алкенілу, С1-6 алканоїлу і С(О)ОС1-6 алкілу, де кожна з вищевказаних груп може включати один або більшу кількість необов'язкових замісників, які, де хімічно можливо, незалежно вибрані з, гало, фенілу, гідрокси, -СООН, -C(O)O С1-6 алкілу, С1-6 алкілу, С1-6 галоалкілу, С3-8 циклоалкілу, С1-6 алкоксиу, С1-6 галоалкокси, аміно, С1-6 алкіламіно і ди-С1-6 алкіламіно; або Ra і Rb разом із N атомом, до якого вони приєднані, можуть утворювати трьох-семи-членне гетероциклічне кільце, яке містить один або більшу кількість додаткових N, О або S атомів, і де вказане гетероциклічне кільце може нести один або більшу кількість необов'язкових замісників, вибраних з оксо, гало, гет, фенілу, гідрокси, -СООН, -C(O)O С1-6 алкілу, С1-6 алкілу, С1-6 галоалкілу, С3-8 циклоалкілу, С1-6 алкокси, С1-6 галоалкокси, аміно, С1-6 алкіламіно і ди-С1-6 алкіламіно; і гет представляє чотирьох-семи-членну гетероциклічну групу, яка є ароматичною, або неароматичною і яка містить один або більшу кількість гетероатомів, вибраних з азоту, кисню, сірки і їх сумішей, і де вказане гетероциклічне кільце необов'язково заміщене, де дозволяє валентність, одним або більшою кількістю замісників, вибраних з гало, ціано, нітро, С1-6 алкілу, С1-6 галоалкілу, С1-6 алкокси, OC(O)С1-6 алкілу, C(O)С1-6 алкілу, C(O)OС1-6 алкілу і NRcRd, де Rc і Rd незалежно вибрані з водню, С1-6 алкілу і С2-6 алкенілу, де кожна з вищевказаних груп може включати один або більшу кількість необов'язкових замісників, які, де хімічно можливо, незалежно вибрані з гало, фенілу, гідрокси, -СООН, С(О)ОС1-6 алкілу, С1-6 алкілу, С1-6 галоалкілу, С3-8 циклоалкілу, С1-6 алкокси, С1-6 галоалкокси, аміно, С1-6 алкіламіно і ди-С1-6 алкіламіно; або її фармацевтично прийнятну сіль або проліки; за умови, що принаймні один з R2, R3, R4, R5, або R6 є фтором. У сполуках за формулою (І), С1-6 галоалкіл або С1-6 галоалкокси означає С1-6 алкіл або С1-6 алкокси, заміщений 1-5 хлор- або фторгрупами, які вибрані незалежно. Також, "гало" означає групу, вибрану з фтору, брому, хлору, брому або йоду. Відповідно, R1 є CF3 або SF5, переважно CF3 Відповідно, R2 є CF3 або CHF2, переважно CF3. В альтернативному відповідному втіленні, R2 є фтором. Відповідно, R3, R4, R5 і R6 незалежно представляють Η або фтор. Переважно, R2 є CF3, і R3, R4, R5 і R6 незалежно представляють 2, 3 або 4 фторгрупи, більш переважно 2 фторгрупи, найбільш переважно на R3 і R4 і R5 і R6 представляють Н. Також переважно, R2 є CHF2, і R3, R4, R5 і R6 незалежно представляють 2, 3 або 4 фторгрупи, більш переважно 2 фторгрупи, найбільш переважно на R3 і R4 і R5 і R6 представляють Н. Також переважно, R2 є фтором, і R3, R4, R5 і R6 незалежно представляють 2, 3 або 4 фторгрупи, більш переважно R3 і R4 є обидва фтором, і R5 і R6 представляють Η або всі R3, R4, R5 і R6 є фтором. Переважно X є CR8. Більш переважно R8 є хлором. Іншими переважними сполуками є ті, в яких R7 і R8 є однаковими. Більш переважно, обидва R7 і R8 є CI. Відповідно, Ra є С(О)ОС1-6 алкілом, наприклад етилом, пропілом, або ізопропілом, з необов'язковим заміщенням, вибраним з однієї до п'яти фторгруп, наприклад з утворенням 2,2,2,-трифторетилу, ди-С1-6 алкіламіно, наприклад диметиламіно і гет, наприклад піролідинілу, піридилу і імідазолілу. Більш відповідно, Ra є етоксикарбонілом, диметиламіноетоксикарбонілом, 2,2,2-трифторетоксикарбонілом, ізопропоксикарбонілом, 4-піридилметоксикарбонілом, 3-піридилметоксикарбонілом, 2піридилметоксикарбонілом, 1Н-імідазол-5-ілметоксикарбонілом, або 2-піролідин-1-ілетоксикарбонілом. Також придатно, якщо Ra є С1-6 алкілом, наприклад метилом, з необов'язковими заміщенням, вибраним з однієї - п'яти фторгруп, наприклад з утворенням трифторметилу, С3-8 циклоалкілу, наприклад циклогексилу, фенілу і гет, наприклад піридилу, наприклад 4-піридилу, піперидинілу, морфолінілу, піролідинілу, або піперазинілу. Більш відповідно, Ra є метилом, або 4-піридилметилом. Також придатно, якщо Ra і Rb разом із N атомом, до якого вони приєднані, утворюють піролідиніл, піперидиніл, піперазиніл, морфолініл, або 2-оксо-оксазолідиніл, наприклад 2-оксо-1,3-оксазолідин-3-ільну групу, більш придатно 2-оксо-1,3-оксазолідин-3-ільну групу. Відповідно, Rb є воднем. Переважно або альтернативно, R9 вибраний з NH2, С1-6 алкоксикарбоніламіно, з необов'язковим заміщенням по алкоксигрупі однією - п'ятьма фторгрупами, ди-С1-6 алкіламіно і гет, і С1-6 алкіламіно, з необов'язковим заміщеннями по алкільній групі однією - п'ятьма фторгрупами, С3-8 циклоалкілами, фенілами і гет. Більш переважно, R9 є NH2 Переважні окремі сполуки за винаходом вибрані з: 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(1,2,2-трифторциклопропіл)-1Н-піразол-3карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(пентафторциклопропіл)-1Н-піразол-3-карбонітрилу; 5-аміно-4-(2,2-дихлор-1-фторциклопропіл)-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-3карбонітрилу; 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-(пентафторциклопропіл)-1Н-піразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-(1,2,2-трифторциклопропіл)-1H-піразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1H-піразол3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(2,2-дифторциклопропіл)-1Н-піразол-3-карбонітрилу; 5-аміно-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1-[2,6-дифтор-4-(трифторметил)феніл]-1Hпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1H-піразол-3карбонітрилу; 5-аміно-4-{1-[хлор(фтор)метил]-2,2-дифторциклопропіл}-1-[2,6-дихлор-4-(трифторметил)феніл]-1Hпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Hпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрилу; 1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-5-(метиламіно)-1Hпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Нпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Нпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(фторметил)циклопропіл]-1H-піразол-3карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(2,2-дифтор-1-метилциклопропіл)-1H-піразол-3карбонітрилу; 5-аміно-1-{2,6-дихлор-4-[(трифторметил)тіо]феніл}-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрилу; етил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-5-ілкарбамату; 1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-5-(2-оксо-1,3оксазолідин-3-іл)-1Н-піразол-3-карбонітрилу; 5-аміно-1-[3-хлор-5-(трифторметил)піридин-2-іл]-4-[2,2-дифтор-1-(трифторметил)цикпопропіл]-1Нпіразол-3-карбонітрилу; 2-(диметиламіно)етил3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату; 2,2,2-трифторетил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1 (трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату; 5-аміно-1-{2,6-дихлор-4-[(трифторметил)сульфоніл]феніл}-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрилу; 1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-5-[(піридин-4ілметил)аміно]-1H-піразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(дифторметокси)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Hпіразол-3-карбонітрилу; ізопропіл 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)цикпопропіл]1Н-піразол-5-ілкарбамату; піридин-4-ілметил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1H-піразол-5-ілкарбамату; піридин-3-ілметил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1Н-піразол-5-іл]-карбамату; піридин-2-ілметил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату; 1Н-імідазол-5-ілметил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1H-піразол-5-ілкарбамату; 2-піролідин-1-ілетил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1H-піразол-5-ілкарбамату; і 5-аміно-4-{1-[хлор(дифтор)метил]-2,2-дифторциклопропіл}-1-[2,6-дихлор-4-(трифторметил)феніл]-1Hпіразол-3-карбонітрилу; або їх фармацевтично прийнятної солі або проліків. Більш переважні окремі сполуки за цим винаходом вибрані з: 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрилу; (-)-5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Н-піразол3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1H-піразол-3карбонітрилу; 5-аміно-4-{1-[хлор(фтор)метил]-2,2-дифторциклопропіл}-1-[2,6-дихлор-4-(трифторметил)феніл]-1Нпіразол-3-карбонітрилу; 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Нпіразол-3-карбонітрилу; і 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрилу; або їх фармацевтично прийнятної солі або проліків. В об'єм цього винаходу також входять так звані "проліки" сполуки формули (і). Тож, певні похідні сполук формули (І), які можуть мати дуже низьку фармакологічну активність, або взагалі її не проявляти як такі, можуть при введені у тіло або нанесенні на тіло перетворюватись у сполуки формули (І), які мають бажану активність, наприклад, в результаті гідролітичного розщеплення. Такі похідні називають "проліками". Має усвідомлюватись, що деякі сполуки формули (І) можуть самі діяти як проліки інших сполук формули (І). Додаткову інформацію щодо застосування проліків можна знайти у [публікації "Pro-drugs as Novel Delivery Systems", Vol.14, ACS Symposium Series (T Higuchi and W Stella) і 'Bioreversible Carriers in Drug Design', Pergamon Press, 1987 (ed. Ε Β Roche, American Pharmaceutical Association)]. Проліки за цим винаходом можна одержати, наприклад, шляхом заміщення 5-амінозамісника на піразольному кільці в сполуках формули (І) певними замісниками, відомими фахівцям у галузі як "пролікарські замісники" як описано, наприклад, в ["Design of Prodrugs" by H Bundgaard (Elsevier, 1985), "Design і application of prodrugs," Textbook of Drug Design and Discovery, (3 rd Edition), 2002, 410-458, (Taylor and Francis Ltd., London); і в вказаних в них посиланнях]. Придатні проліки можуть мати N-вмісну групу в 5-положенні піразольного кільця формули (І) і бути зв'язаними з кільцем через Ν. 5-Ν група може бути заміщена один раз або двічі. Прикладами замісників є: алкіламіни, ариламіни, аміди, сечовини, карбамати, циклічні карбамати, іміни, енаміни, іміди, циклічні іміди, сульфенаміди, і сульфонаміди. Вуглеводнева частина цих груп містить С1-6 алкіл, феніл, гетероарил, такий як піридил, С2-6 алкеніл і С3-8 циклоалкіл; де кожна з вищевказаних груп може включати один або більшу кількість необов'язкових замісників, які, де хімічно можливо, незалежно вибрані з: гало; гідрокси, С1-6 алкілу і С1-6 алкокси. Додаткові приклади груп-замісників з урахуванням вищенаведених прикладів і прикладів інших видів проліків можна знайти у вищевказаних цитованих публікаціях. Проліки за цим винаходом можна легко визначити шляхом їх введення у піддослідну тварину і забору зразка рідини тіла на виявлення сполуки формули (І). В іншому варіанті, вказаний винахід включає способи одержання сполуки формули (І), або її фармацевтично, ветеринарно або сільськогосподарсько прийнятної солі, або фармацевтично, ветеринарно або сільськогосподарсько прийнятного сольвату (включаючи гідрат) будь-якої сполуки як проілюстровано нижче. Фахівцю у галузі буде очевидно, що чутливі функціональні групи можуть вимагати захисту і зняття захисту під час синтезування сполуки за винаходом. Це можна здійснити відомими способами, наприклад описаними в ["Protective Groups in Organic Synthesis" авторів TW Greene and PGM Wuts, John Wiley & Sons Inc (1999), і вказаних в публікації посиланнях]. Тож, наступні способи є ілюстрацією загальним методик синтезу, які можна використати для одержання сполук за винаходом. 1. Сполуку формули (І) можна одержати циклопропануванням алкену формули (II): де R1, R2, R3, R4, R7 і X мають значення, визначені вище для формули (І), і R9 представляє R9 або Nзахищений R9, з наступним зняттям захисту при необхідності. Придатним захистом є імідоформамідний захист, наприклад застосовуючи Ν,Ν-диметилімідоформамід, де захист можна зняти в стандартних умовах. Сполуки формули (II) можуть взаємодіяти з карбеноїдними сполуками: CR5R6, в яких R5 і R6 мають значення, визначені вище для формули (І), які можна одержати in situ. Наприклад, якщо R5=R6=F, реактивні сполуки, такі як триметилсиліл дифтор(фторсульфоніл)ацетат (TFDA), можуть взаємодіяти зі сполукою формули (II), в якій R9 представляє N-захищений R9, з необов'язковим аполярним розчинником при підвищеній температурі в присутності фториду натрію з виходом продукту формули (І) після зняття захисту. Іншими окремими способами є обробка хлороформу основою, переважно в умовах міжфазного каталізу, термолізис придатного органометалічного попередника, такого як арилтрифторметил, трихлорметил, або похідна феніл(трифторметил)ртуті, або обробка діазоалканом в присутності каталізатора на основі перехідного металу, і обробка діазоалкану без каталізатора на основі перехідного металу, з наступним термолізисом проміжного піразоліну, або одержання сірчаного виходу. Сполуку формули (II), де R9 представляє N-захищену групу, можна одержати зі сполуки формули (IV): в якій X' є бромом або йодом, і R1, R7 і X мають значення, визначені вище для формули (IIа), наприклад, шляхом реакції перехресного конденсування, каталізованої перехідним металом, сполуки (IV) з придатним вінілюючим реагентом в придатному необов'язково дегазованому розчиннику. Відповідно, перехідним металом є паладій і вінілюючим реагентом є органотин, органоборна кислота, або органоцинкова похідна. Альтернативно, (IV) можна нагріти до кипіння із зворотним холодильником із придатно заміщеними алкенілборними кислотами в присутності тетракіс(трифенілфосфін)паладію (0) і гідрокарбонату натрію в придатному розчиннику. Альтернативно, (IV) можна обробити органоцинковою сполукою, наприклад активованим цинком (таким як цинк Ріке), в інертній атмосфері, придатним бромалкеном, таким як бромтрифторетилен або бромдифторетилен, в апротонному розчиннику в присутності сполук паладію (0), таких як тетракіс(трифенілфосфін)паладій (0), при підвищеній температурі. Альтернативно, (IV) можна обробити активованим цинком (цинк Ріке) в апротонному розчиннику з виходом органоцинкату, який можна поперечно конденсувати з галоалкеном в присутності сполук паладію (II), таких як дихлорбіс(трифенілфосфін) паладій (II), і відновлюючого реагенту, такого як гідрид диізобутилалюмінію, при кипінні із зворотним холодильником в апротонному розчиннику. Сполуки формули (IV) можуть бути корисними для одержання проміжних сполук формули (V). Таким чином, сполуку формули (IV) можна обробити реагентом Грігнарда, таким як хлорид ізопропілмагнію, в інертних умовах із застосуванням апротонного розчиннику при пониженій температурі перед обробкою хлоридом або ангідридом хлоралканової кислоти, при нагріванні до кімнатної температури одержують бажану сполуку кетону, представлену формулою (V). Сполуки формули (V) можна застосувати для одержання сполук формули (II), в яких R3 і R4 є Η і R9 є N захищеним. Тож, сполуку формули (V) можна метилювати шляхом обробки реагентом Віттіга в інертних умовах при пониженій температурі в розчиннику, такому як тетрагідрофуран. Сполуки формули (II), де R9 є N-захищеним, можна також одержати із сполук формули (V), шляхом обробки галоалкеном, таким як дибромдифторметан, в присутності трифенілфосфіну і цинку Ріке в апротонному розчиннику. Альтернативно, сполуки формули (II), в яких R9 є N-захищеним, можна одержати із сполук формули (IV) шляхом обробки придатним третинним спиртом з наступними стандартними методиками хлоруваннядепдрохлорування. Сполуку формули (IV) можна одержати зі сполуки формули (VI), в якій R1, R7, і X мають значення, визначені вище для формули (І): двома стандартними стадіями бромування/йодування і захисту, причому будь-яка з двох може бути першою. Сполуки формули (VI) можна легко захистити, наприклад імідоформамідом, і потім перетворити безпосередньо у сполуки формули (V) шляхом реакції з реактивним ангідридом кислоти в аполярному розчиннику. 2. Сполуку формули (І) можна також одержати шляхом синтезування необхідних карбеноїдних сполук з піразоловмісного попередника і їх обробки придатним алкеном. Наприклад, сіль алкілметалу, переважно літію, сполуки формули (VII): в якій Ar є фенілом або нафтилом, будь-який з яких необов'язково заміщений C1-С4 алкілом, C1-С4 алкокси, або гало, і R1, R2, R7, R9 ι Χ мають визначені вище значення, можна розкласти під впливом температури в присутності каталізатора на основі перехідного металу, такого як ацетат родію (II), і алкену формули (VIII): де R3, R4, R5 і R6 мають значення, визначені вище для формули (І), необов'язково в придатному розчиннику, такому як дихлорметан, і необов'язково під тиском, з одержанням сполуки формули (І). 3. Сполуки формули (І) можна одержати реакцією Яппа-Клінгеманна. Ця реакція описана в [Org. React., 1959, 10, 143-178]. Звичайно необхідно здійснити наступні стадії синтезу для утворення 3,4,5-тризаміщених піразолів із більш різноманітними 4-замісниками. Окрім того, групи, які таким чином можна ввести, обмежені тими, які походять від первинного введеного 4-замісника. В той же час, ми виявили спосіб, за допомогою якого можна одержати 3,4,5-тризаміщені 1-арилпіразоли безпосередньо в реакції, яка включатиме конденсування сполук арилдіазонію з придатно заміщеним попередником, який містить бажаний замісник. Бажаний замісник одночасно вводять в С-4 положення способом, який не передбачає жодних реконструкцій. Окрім того, в результаті реакції одразу одержуємо три-заміщений піразол. Тож, зникає необхідність в тривалій процедурі синтезування і необхідності в декількох обробках проміжних продуктів, в той час забезпечуючи гарний вихід. Цей спосіб має значні переваги тому, що С-4 замісник можна ввести в первісну похідну тетразаміщеного етану, яка є одним із вихідних матеріалів і яка вступає в реакцію з сполуками арилдіазонійю з одержанням піразолу. Тому в реакції повністю контролюється положення заміщення на одержаному піразольному кільці. Окрім того, легко і одразу можна ввести різноманітні 4замісники. Тож, сполуку формули (І), в якій R9 є NH2, можна одержати шляхом взаємодії сполуки формули (IX) із сполукою формули (X) необов'язково в присутності кислоти, в якій: R1-R8 мають значення, визначені для сполук формули (І); L є активуючою групою; і Ζ є сумісним протиіоном, з наступним видаленням групи L. Протиіон Ζ- може бути будь-яким придатним іоном, який звичайно присутній при діазонієвих реакціях. Переважно, Ζ- є галогеном, HSO4-, або тетрафторборатом, і найбільш переважно, є тетрафторборатом. Група L є електрон-акцепторною групою, що стабілізує аніонну проміжну сполуку в процесі. Тому, переважно, L є групою, здатною стабілізувати негативний заряд на прилеглому атомі вуглецю. Група L також повинна бути придатна для видалення. L можна виділити в основних умовах, наприклад основним гідролізом, або можна виділити відновленням і/або відщепленням. Група L є важливою через те, що вона допомагає скеровувати хід реакції діазонієвих сполук із сполуками формули (IX), але на наступних стадіях реакції її видаляють. Переважно, L є естерною групою, або групою COR10. Більш переважно, L є групою, вибраною з: - S(O)pR11, де p є 1 або 2, (R11O)2PO, COOR11 і -COR10, де R10 вибраний з: С1-8 алкілу, ди-С1-8 алкіламіно, С1-8 алкілтіо, С3-8 циклоалкілу, (CH2)nPh і (СН2)n гетероарилу, де n=0, 1 або 2, причому кожна з цих груп може бути необов'язково заміщеною на будь-якому атомі вуглецю однією або більшою кількістю груп, незалежно вибраних з: галогену, гідрокси, ціано, нітро, C1-4 алкокси, C1-4 галоалкокси, C1-4 алканоїлу, C1-4 галоалканоілу, C1-4 алкілсульфінілу, C1-4 галоалкілсульфінілу, C1-4 алкілсульфонілу, C1-4 галоалкілсульфонілу, С3-8 циклоалкілу і С3-8 галоциклоалкілу; і R10 може бути воднем; і де R11 вибраний з: С1-8 алкілу, С3-8 циклоалкілу, (CH2)nPh і (СН2)n гетероарилу, де n=0, 1 або 2, причому кожна з цих груп може бути необов'язково заміщеною на будь-якому атомі вуглецю однією або більшою кількістю груп, незалежно вибраних з: галогену, гідрокси, ціано, нітро, C1-4 алкокси, C1-4 галоалкокси, C1-4 алканоїлу, C1-4 галоалканоїлу, C1-4 алкілсульфінілу, C1-4 галоалкілсульфінілу, C1-4 алкілсульфонілу, C1-4 галоалкілсульфонілу, С3-8 циклоалкілу і С3-8 галоциклоалкілу; і R11 може бути воднем. Переважно, L є групою, вибраною з COR10 і COOR11. Більш переважно, L є -СООМе або -COOEt. У деяких випадках, природа відхідної групи L передбачає, що одержана проміжна сполука не має відповідного рівня окислення. Тому, при необхідності, додають одну або більшу кількість стадій реакції для забезпечення досягнення відповідного рівня окислення перед циклізацією для одержання арилпіразолу. Вищевказаний процес конденсування можна застосувати для одержання будь-якої з сполук формули (І). Наприклад, приведені нижче Схеми 1 і 2 ілюструють загальні способи, застосовані при одержанні 5аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3карбонітрилу. Для реакції конденсування з метою одержання сполуки формули (І) є оптимальним, щоб розчинник був полярним і не реагував з жодною з солей або катіонів діазонію, або сполукою формули (IX). Необов'язково, реакцію можна проводити у помірно кислотних умовах. Сіль діазонію формули (X) можна одержати як відомими способами, так і in situ для наступної реакції, або можна виділити і застосовувати у наступній стадії реакції. Окремі приклади сполук формули (IX) і (XI) представлені на Схемах 1 і 2. Альтернативні сполуки формули (IX) можна таким же чином одержати із сполук формули (XI), де R2, R3, R4, R5, R6 і L мають визначені вище значення, наприклад, шляхом обробки сполуки формули (XI) джерелом ціанідних іонів. Сполуки формули (XI) можна одержати шляхом відновлення з наступною дегідратацією сполуки формули (XII). Сполуки формули (XII) можна одержати, наприклад, шляхом конденсування алкілціаноалканоату, наприклад метилціаноацетату, хлорангідридом кислоти в апротонному розчиннику, такому як дихлорметан, в присутності кислоти Льюіса, такої як хлорид магнію і слабка основа, така як триетиламін, при пониженій температурі. Альтернативно, як показано на Схемі 1, сполуки формули (XI) можна одержати в результаті конденсації Кноевенагеля придатного альдегіду з алкілалканоатом, таким як метилціаноацетат. Ефективні умови для одержання циклопропіл-заміщених сполук, використовуючи триметилсиліл-2,2дифтор-2-(фторсульфоніл)ацетат (TFDA), джерело дифторкарбену, описані [Dolbier et al. в J. Fluor Chem., 2004, 125, 459]. Сполуки формули (XIII) можуть також застосовуватись в реакції Яппа-Клінгеманна при взаємодії із сполукою формули (X) для синтезування сполук формули (VI) за аналогією при вищеописаних умовах. Сполуки формули (XIII), в яких L=СO2C1-С6 алкілу, синтезують шляхом повільного додавання гліконітрилу, необов'язково при зниженій температурі, до одержання С1-С6 алкілціаноацетату в апротонному розчиннику, такому як диметилформамід, з наступним додаванням основи, такої як карбонат калію. Проміжні сполуки формули (VIII), (XI) і (XII) можна також одержати, або за аналогією до Схем 1 і 2, або відомими методиками синтезу, відповідно до звичайних підручників з органічної хімії або передньої літератури з легко доступних початкових матеріалів із застосування відповідних реагентів і реакційних умов. 4. В іншому варіанті, винахід стосується способу одержання сполук формули (І) із альтернативних сполук формули (І). Наприклад, сполуки, в яких R9=NRaRb, де Ra і Rb мають значення, визначені для формули (І), можна одержати стандартними реакціями із сполуки формули (І), де R9 представляє NH2 . Сполуки формули (VI) можна одержати із сполук формули (XIV) де CO2R11 представляє придатну естерну групу, шляхом перетворення естру у амід (XV) з наступним відновленням оксихлоридом фосфору при підвищеній температурі. Сполуки формули (XIV) можна одержати шляхом реакції естеру 3-ціано-2-оксо-пропіонової кислоти, наприклад етилового естеру, з відповідно заміщеним гідразидом сполуки (XVII) в спиртовому розчиннику при підвищеній температурі з наступним додаванням основи, такої як карбонат натрію, і подальшим нагріванням. Сполуки формули (XVII) можна легко одержати за стандартних умов, наприклад шляхом заміщення відповідної фторпохідної реагентом на основі гідразину, таким як моногідрат гідразину, при кипінні із зворотним холодильником в спиртовому розчиннику, такому як етанол. Окрім того, фахівцям у галузі будуть відомі модифікації описаних способів і альтернативи до них, за допомогою яких також можна одержати сполуки, визначені формулою (І). Фахівцям у галузі також буде очевидно, що у деяких описаних способах послідовність стадій синтезу може змінюватись і буде залежати, серед іншого, від таких факторів як природа інших функціональних груп, присутніх у певному субстраті, наявність основних проміжних сполук і загального принципу вибору захисних груп (якщо вони використовуються). Очевидно, що такі фактори впливатимуть на вибір реагенту для застосування у вказаних стадіях синтезу. Фахівцям у галузі буде очевидно, що сполуки за винаходом можна було б одержати способами, відмінними від описаних тут, шляхом адаптації описаних тут способів і/або способів, відомих з рівня техніки, наприклад описаного тут рівня техніки, або ґрунтуючись на стандартних підручниках, таких як ["Comprehensive Organic Transformations - A Guide to Functional Group Transformations", RC Larock, WileyVCH (1999 або later editions)]. Має усвідомлюватись, що вказані тут способи синтезу є лише ілюстративними і можуть проводитись у багатьох інших послідовностях для бажаної структури сполук. Досвідчений хімік спиратиметься на власний погляд і знання відносно найбільш ефективної послідовності реакцій для синтезування певної заданої сполуки. Даний винахід також стосується проміжних сполук формули (ІА), наведеної нижче: де R1-R7, X і Ra і Rb мають значення, визначені відносно сполук формули (І), і де переважні сполуки для R -R7 і X також є переважними для (ІА). Посилаючись на формулу (ІА), відповідно, Ra=Rb=метил. Має усвідомлюватись, що сполуки формули (І) можуть містити один або більшу кількість асиметричних 1 атомів вуглецю, тож сполуки за винаходом можуть існувати як два або більша кількість стереоізомерів. В об'єм цього винаходу включені всі стереоізомери, такі як енантіомери і діастеромери, всі геометричні ізомери і таутомерні форми сполук формули (І), включно із сполуками, які проявляють більше, ніж один вид ізомеризму, і їх суміші. Також включені кислотно-адитивні і основні солі, в яких протиіон є оптично активним, наприклад D-лактат, або L-лізин, або рацемічні суміші, наприклад, DL-тартрат, або DL-аргінін. Геометричні ізомери можна виділити стандартними методиками, відомими фахівцям, наприклад, хроматографією і фракційною кристалізацією. Відомі методики для одержання/виділення окремих енантіомерів включають хіральний синтез з придатного оптично чистого попередника, або розділення рацемату (або рацемату солі або похідної), застосовуючи, наприклад, хіральну високоефективну рідинну хроматографію (ВЕРХ). Альтернативно, рацемат (або попередник рацемату) може взаємодіяти з придатною оптично активною сполукою, наприклад, спиртом, або, якщо сполука формули (І) містить кислотний або основний замісник, кислотою або основою, такими як винна кислота або 1-фенілетиламін. Одержану діастереомерну суміш можна виділити хроматографією і/або фракційною кристалізацією, і один або обидва з діастереомерів перетворити у відповідний чистий енантіомер(и) способами, відомими фахівцю у галузі. Хіральні сполуки за винаходом (і їх хіральні попередники) можна одержати в енантіомерно-збагаченій формі шляхом хроматографії, звичайно ВЕРХ, на асиметричній смолі із рухомою фазою, що складається з вуглеводню, звичайно гептану або гексану, містить 0-50% ізопропанолу, звичайно 2-20%, і 0-5% алкіламіну, звичайно 0,1% діетиламіну. Концентрація елюату забезпечує одержання збагаченої суміші. Стереоізомерні конгломерати можна розділити методиками, відомими фахівцям у галузі - [див., наприклад, "Stereochemistry of Organic Сполуки" автора Ε L Eliel (Wiley, New York, 1994)]. Фармацевтично, ветеринарно і сільськогосподарсько придатні кислотно-адитивні солі деяких сполук формули (І) також можна одержати відомим способом. Наприклад, розчин вільної основи можна обробити придатною кислотою, або чистою, або в придатному розчиннику, і одержану сіль відділити або фільтрацією, або випарюванням при зниженому тиску розчинника реакції. Огляд придатних солей можна знайти у ["Handbook of Pharmaceutical Salts: Properties, Selection, і Use" авторів Stahl і Wermuth (Wiley-VCH, Weinheim, Germany, 2002)]. Сполуки за винаходом можуть існувати як у несольватованій, так і сольватованій формах. Термін "сольват" застосовується тут для опису молекулярного комплексу, який містить сполуку за винаходом і один або більшу кількість фармацевтично придатних молекул розчинника, наприклад етанолу. Термін "гідрат" застосовується тут коли вказаним розчинником є вода. Сполуки за винаходом, тобто сполуки формули (І), мають протипаразитну активність на людях, тваринах і рослинах. Вони є особливо придатними для боротьби з ектопаразитами. Для застосування сполук за винаходом на ссавцях, винахід включає: фармацевтичну протипаразитну композицію, яка містить сполуку формули (І), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват будь-якої з речовин, разом з фармацевтично придатним розріджувачем або носієм, яка може бути пристосована для перорального, парентерального введення, або місцевого нанесення; сполуку формули (І), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват будь-якої з речовин, або фармацевтичну композицію, яка містить будь-що з вказаного вище, для застосування як лікарського засобу; застосування сполуки формули (І), або її фармацевтично прийнятної солі, або фармацевтично прийнятного сольвату будь-якої з речовин, або фармацевтичної композиції, що містить будь-що з вказаного вище, для виробництва лікарського засобу для лікування зараження паразитами; і спосіб лікування зараження паразитами у ссавця, який включає лікування вказаного ссавця ефективною кількістю сполуки формули (І), або її фармацевтично прийнятної солі, або фармацевтично прийнятного сольвату будь-якої з речовин, або фармацевтичної композиції, яка містить будь-що з вказаного вище. Відповідно до іншого варіанту цього винаходу, винахід включає спосіб боротьби з членистоногими, рослинними нематодами, або гельмінтами на місці ураження, який включає обробку місця ураження (наприклад шляхом нанесення або введення) ефективною кількістю сполуки загальної формули І, або її пестицидно прийнятної солі. Даний винахід включає всі фармацевтично придатні мічені ізотопами сполуки формули (І), в яких один або більша кількість атомів заміщена атомами, атомний номер, або атомна маса яких відрізняються від атомної маси або масового номеру , які звичайно знаходять в природі. Приклади ізотопів, придатних для включення в сполуки за винаходом, включають ізотопи водню, такі як 2 Н і 3 Н, вуглецю, такі як 11С, 13С і 14С, хлору, такий як 36СІ, фтору, такий як 18F, йоду, такі як 123І і 125І, азоту, такі як 13 N і 15 N, кисню, такі як 15О, 17О і 18О, фосфору, такий як 32Р, і сірки, такий як 35S. Сполуки за винаходом також можна змішати з однією або більшою кількістю біологічно активних сполук, або агентів, включно з інсектицидами, акаріцидами, антигельмінтами, фунгіцидами, нематоцидами, протипротозойними засобами, бактерицидними засобами, регуляторами росту, ентомопатогенними бактеріями, вірусами або грибами, з утворенням багатокомпонентного пестициду, який забезпечує навіть ширший спектр фармацевтичного, ветеринарного або сільськогосподарського застосування. Тож, даний винахід такою стосується композиції, яка містить біологічно ефективну кількість сполук за винаходом і ефективну кількість принаймні однієї додаткової біологічно активної сполуки, або агента, і може також ще містити одну або більшу кількість поверхнево-активних речовин, розріджувач у твердій формі, або розріджувач у рідкій формі. Окремі додаткові активні сполуки включають описані в [патентній заявці Великобританії №GB0406137 0, на сторінках 37-41]. Сполуки за винаходом, призначені для фармацевтичного застосування, можуть вводитись як продукти в кристалічній або аморфній формах. Сполуки можна одержати, наприклад, у вигляді твердих свічок, порошків, або плівок такими способами як осадження, кристалізація, сушіння виморожуванням, або сушіння розпиленням, або сушіння випарюванням. Сушіння мікрохвилями або радіочастотна сушка також можуть застосовуватись для цих цілей. Сполуки можуть вводитись окремо, або в комбінації з однією або більшою кількістю інших сполук за винаходом, або в комбінації з однією або більшою кількістю лікарських засобів (або у вигляді будь-якої їх комбінації). В цілому, вони вводитимуться як рецептура разом з одним або більшою кількістю фармацевтично придатних екципієнтів Термін "екципієнт" застосовується тут для опису будь-якого компоненту, який не є сполукою(ами) за винаходом. Вибір екципієнта значною мірою залежатиме від факторів, таких як заданий шлях введення, вплив екципієнта на розчинність і стабільність, а також природа дозованої форми. Фармацевтичні композиції, придатні для доставки сполук за цим винаходом, ι способи їх одержання будуть очевидними для фахівців у галузі. Такі композиції і способи їх одержання можна знайти, наприклад, у ['Remington's Pharmaceutical Sciences', 19th Edition (Mack Publishing Company, 1995)]. Щодо їх застосування на ссавцях, сполуки можна вводити окремо, або в рецептурі, придатній для певного заданого використання, певного виду ссавця-носія, якого необхідно лікувати, і виду паразиту. Способи, якими сполуки можна вводити, включають пероральне введення у формі капсул, болюсу, таблетки, порошків, пігулок, гумок, мульті- та наночастинок, гелів, твердих розчинів, плівок, спреїв, або рідких рецептур. Рідкі форми включають суспензії, розчини, сиропи, мікстури і еліксири. Такі рецептури можуть використовуватись як наповнювачі м'яких або твердих желатинових капсул і звичайно містять носій, наприклад, воду, етанол, поліетиленгліколь, пропіленгліколь, метилцелюлозу, або придатне масло, і один або більшу кількість емульсифікаторів ι/або суспендуючих агентів. Рідкі рецептури можна також одержати шляхом розведення розчином твердої речовини, наприклад, пакету-саше. Пероральні мікстури звичайно одержують шляхом розведення або суспендування активного компонента в придатному середовищі. Таким чином, композиції, придатні для перорального введення, можна одержати шляхом змішування активного компонента із придатним тонкоподрібнений розріджувачем і/або дезінтегруючим агентом і/або зв'язуючим агентом, і/або змащувачем, і т.д. Іншими можливими компонентами можуть бути антиоксиданти, барвники, ароматизатори, консерванти і смакові добавки. Для пероральних дозованих форм, в залежності від дози, частина лікарського засобу може становити 1ваг.%-80ваг.% дозованої форми, частіше 5ваг.%-60ваг.% дозованої форми. Прикладами дезінтегруючих агентів є натрію крохмаль гліколят, карбоксиметилцелюлоза натрію, карбоксиметилцелюлоза кальцію, кроскармелоза натрію, кросповідон, полівінілпіролідон, метилцелюлоза, мікрокристалічна целюлоза, заміщена нижчим алкілом гідроксипропілцелюлоза, крохмаль, попередньо желатизований крохмаль і альгінат натрію. В цілому, дезінтегруючий агент складатиме 1ваг.%-25ваг.%, переважно 5ваг.%-20ваг.% дозованої форми. Зв'язуючі агенти в цілому використовують для надання таблетованій рецептурі характеристик зв'язування. Придатними зв'язуючими агентами є мікрокристалічна целюлоза, желатин, цукри, поліетиленгліколь, натуральні і синтетичні смоли, полівінілпіролідон, попередньо желатинизований крохмаль, гідроксипропілцелюлоза і гідроксипропілметилцелюлоза. Прикладами розріджувачів є лактоза (моногідрат, висушений розпиленням моногідрат, безводна і т.д.), маніт, ксиліт, декстроза, цукроза, сорбіт, мікрокристалічна целюлоза, крохмаль і дигідрат фосфату кальцію двооснового. Пероральні рецептури можуть також необов'язково містити поверхнево-активні агенти, такі як лаурилсульфат натрію і полісорбат 80, і речовини, що сприяють ковзанню, такі як діоксид кремнію і тальк. Якщо вони присутні, поверхнево-активні агенти можуть складати 0,2ваг.%-5ваг.% таблетки, і речовини, що сприяють ковзанню, можуть складати 0,2ваг.%-1ваг.% таблетки. Змащуючі агенти включають стеарат магнію, стеарат кальцію, стеарат цинку, натрію стеарин фумарат, і суміші стеарату магнію з лаурилсульфатом натрію. Змащуючи агенти в цілому складають 0,25ваг.%10ваг.%, переважно 0,5ваг.%-3ваг.% таблетки. Ілюстративні таблетки містять до приблизно 80% лікарського засобу, від приблизно 10ваг.% до приблизно 90ваг.% зв'язуючого агента, від приблизно 0ваг.% до приблизно 85ваг.% розріджувача, від приблизно 2ваг.% до приблизно 10ваг% дизінтегруючого агента, і від приблизно 0,25ваг.% до приблизно 10ваг.% змащуючого агента. Рецептура таблеток описана в ["Pharmaceutical Dosage Forms: Tablets, Vol. 1", авторів Η. Lieberman і L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-Х)]. Сполуки можуть наноситись місцево на шкіру або слизову оболонку, тобто дермально або трансдермально. Типові рецептури для такого призначення включають розчин для струменевого нанесення, розчин для крапельного нанесення, розчин для занурення, спрей, мус, шампунь, порошкову рецептуру, гелі, гідрогелі, лосьйони, розчини, креми, мазі, присипки, пов'язки, піни, плівки, термальні пластирі, капсули, імплантати, губки, волокна, бандажі і мікроемульсії. Також можуть застосовуватись ліпосоми. Типовими носіями є спирт, вода, мінеральне масло, рідкий вазелін, медичний вазелін, гліцерин, поліетиленгліколь і пропіленгліколь. Можна вводити покращувачі проникнення - [див., наприклад, J Pharm Sci, 88 (10), 955-958 by Finnin i Morgan (жовтень 1999)]. Розчини для струменевого нанесення або розчини для крапельного нанесення можна одержати шляхом розчинення активного компонента в придатному рідкому носії, такому як бутилкаучук, рідкий парафін, або нелеткий естер, необов'язково із додаванням леткого компоненту, такого як пропан-2-ол. Альтернативно, розчин для струменевого нанесення, розчин для крапельного нанесення, або рецептури спреїв можна одержати інкапсулюванням для збереження залишку активного агента на тілі тварини. Впорскувані рецептури можна одержати у вигляді стерильного розчину, який може містити інші речовини, наприклад достатню кількість солей або глюкози для одержання розчину, ізотонічного до крові. Придатними рідкими носіями є рослинні масла, такі як кунжутне масло, гліцериди, такі як триацетин, естери, такі як бензилбензоат, ізопропілміристат і похідні жирних кислот і пропіленгліколю, а також органічні розчинники, такі як піролідин-2-он і гліцерин формаль. Рецептури одержують шляхом розчинення або суспендування активного компонента в рідкому носії таким чином, щоб одержати кінцеву рецептури із вмістом 0,01-10 вагових % активного компонента. Альтернативно, сполуки можна вводити парентерально, або впорскуванням безпосередньо в кров'яний потік, м'язи, або у внутрішній орган. Придатними шляхами для перентерального введення є внутрішньовенний, внутрішньоартеріальний, внутрішньоочеревенний, інтратекальний, інтравентикулярний, внутрішньоуретральний, внутрішньобрюшинний, внутрішньочерепний, внутрішньом'язовий і підшкірний. Придатними пристроями для парентерального введення є голкові (включно із мікроголковими) шприци, безголкові шприци і крапельні системи. Парентеральні рецептури є звичайно водними розчинами, які можуть містити екципієнти, такі як солі, карбогідрати і буферуючі агенти (переважно для досягнення рівня рН від 3 до 9), але, для деяких застосувань, буде більш придатним, якщо вони будуть сформульовані у вигляді стерильних неводних розчинів, або порошків, причому суха форма призначена для використання із придатним носієм, таким як стерильна вода без вмісту пірогену. Приготування парентеральних рецептур в стерильних умовах, наприклад, шляхом ліофілізації, можна легко здійснити за допомогою стандартних фармацевтичних методик, відомих у галузі. Розчинність сполук формули (І), використаних для приготування парентеральних розчинів, може бути підвищена за допомогою відповідних рецептурних методик, таких як введення агентів, що підвищують розчинність. Такі рецептури одержують відомим способом відповідно до стандартної медичної або ветеринарної практики. Ці рецептури відрізнятимуться за вмістом активної сполуки, в залежності від виду тварини-носія, яку необхідно лікувати, важкості стану і виду зараження, а також ваги тіла носія. Для парентерального, місцевого і перорального введення, звичайна доза активного компонента знаходиться в межах 0,01-100мг на масу тіла тварини. Переважно, у межах 0,1-10мг на кг. Рецептури можуть бути негайного і/або модифікованого, контрольованого вивільнення. Рецептури контрольованого вивільнення включають рецептури модифікованого вивільнення, включно з відстроченим, уповільненим, пульсуючим, контрольованим, цільовим, або запрограмованим вивільненням. Придатні рецептури модифікованого вивільнення для цілей винаходу описані в [патенті США №6106864]. Детальну інформацію про інші придатні техніки вивільнення, такі як високо енергійні дисперсії, осмотичні і покриті частинки, можна знайти у [Verma et al, Pharmaceutical Technology On-line, 25(2), 1-14 (2001)]. Використання жувальної гумки для досягнення контрольованого вивільнення описано в [WO 00/35298]. Альтернативно, сполуки за винаходом можуть бути сформульовані як тверді, напівтверді, або як тиксотропна рідина для ведення як імплантованого депо, що забезпечує модифіковане вивільнення активної сполуки. Приклади таких рецептур включають стенти із лікарськими засобами і PGLA мікросфери. Альтернативно, тваринам, тобто ссавцям, що не належать до людського роду, сполуки можуть постачатись із кормом, і для цих цілей можна одержати концентровану харчову добавку, або попередньо приготовану суміш для змішування із звичайним кормом для тварин. Сполуки за винаходом застосовують для боротьби з членистоногими паразитами. Зокрема, вони можуть використовуватись у галузі ветеринарної медицини, тваринництва і охорони здоров'я: проти членистоногих, які паразитують зовні або всередині хребетних, зокрема теплокровних хребетних, включаючи людину і свійських тварин, таких як собаки, коти, велика рогата худоба, вівці, кози, коні, свині, домашня птиця і риба. Окрім того, також їх можна застосовувати для боротьби із шкідниками рослин, шкідниками, що живуть в землі, і іншими шкідниками, що знаходяться в оточуючому середовищі. Рідкі композиції за винаходом можуть, окрім звичайних сфер застосування в сільському господарстві, застосовуватись, наприклад, для обробки субстратів, або заражених ділянок, або ділянок, які можуть бути заражені членистоногими (або іншими паразитами, боротьбу з якими можна здійснювати задопомогою сполук за винаходом), включаючи приміщення, місця зберігання або обробки ззовні та в приміщеннях, контейнери, або обладнання, або стоячу або проточну воду. Всі ці водні дисперсії або емульсії, або суміші у формі спрею можна використовувати, наприклад на посівах, будь-якими придатними способами, в основному розпиленням, при концентрації звичайно порядку від приблизно 100 до приблизно 1200 літрів суміші для розпилення на гектар, але вона може бути вищою, або нижчою (наприклад низькою або дуже низькою) в залежності від необхідності, або методики застосування. Сполуки або композиції за винаходом зручно використовувати на рослинах, зокрема на коренях, або листках, заражених паразитами, яких необхідно знищити. Іншим способом застосування сполук або композицій за винаходом є їх внесення, точніше внесення рецептури, яка містить активний компонент, в воду для зрошення (поливу). Зрошення можуть застосовувати для пестицидів для листяної частини, а полив (наземний, або підземний) можна проводити для ґрунтових або системних пестицидів. Концентровані суспензії, які можна наносити розприскуванням, одержують таким чином, щоб забезпечити стабільний рідкий продукт, який не осаджується (дрібний помел), який звичайно містить від приблизно 10 до приблизно 75 вагових % активного компонента, від приблизно 0,5 до приблизно 30% поверхнево-активних речовин, від приблизно 0,1 до приблизно 10% тиксотропних агентів, від приблизно 0 до приблизно 30% придатних домішок, таких як агенти проти спінювання, інгібітори корозії, стабілізатори, пенетранти, зв'язуючі агенти, і, як носії, воду, або органічну рідину, в якій активний компоненти слабко розчинний, або нерозчинний. Деякі органічні тверді речовини, або неорганічні солі можна розчинити в носії для запобігання осадженню, або як антифриз для води. Зволожувані порошки (або порошки для розпилення) звичайно одержують таким чином, щоб вони містили від приблизно 10 до приблизно 80 вагових % активного компонента, від приблизно 20 до приблизно 90% твердого носія, від приблизно 0 до приблизно 5% зволожуючого агента, від приблизно 3 до приблизно 10% диспергуючого агента і, якщо необхідно, від приблизно 0 до приблизно 80% одного або більшої кількості стабілізаторів і/або інших добавок, таких як пенетранти, зв'язуючі речовини, агенти, що запобігають злежуванню/злипанню, барвники і подібні. Для одержання цих зволожуваних порошків, активний(і) компоненти(и) ретельно змішують у відповідному змішувачі із додатковими речовинами, якими можна просякнути пористий фільтр і подрібнити за допомогою млина або іншого придатного подрібнювача. Таким чином одержують зволожувальні порошки, перевагами яких є придатність до зволоження і суспендування. їх можна суспендувати у воді з одержанням бажаної концентрації і таку суспензію можна використовувати із багатьма перевагами, зокрема для листової частини рослин. "Дисперсні у воді гранули (ВГ)" (тобто гранули, які легко диспергуються у воді), мають композицію, яка в цілому подібна композиції зволожуваних порошків. їх можна одержати гранулюванням, описаним для зволожуваних порошків, або вологим способом (компонуванням тонкоподрібненого активного компоненту з інертним наповнювачем і невеликою кількістю води, наприклад 1-20 вагових %, або водним розчином диспергуючого або зв'язуючого агента з наступним висушуванням та просіванням), або сухим способом (компонування з наступними розмелюванням і просіванням). Дози і концентрації одержаних композицій можуть різнитись з огляду на спосіб нанесення, або природу композицій, або спосіб їх застосування. В цілому, композиції для боротьби з членистоногими, рослинними нематодами, гельмінтами, або протозойними паразитами звичайно містять від приблизно 0,00001% до приблизно 95%, більш точно від приблизно 0,0005% до приблизно 50 вагових % однієї або більшої кількості сполук формули (І), або їх пестицидно прийнятних солей, або активних компонентів загалом (тобто сполуки формули (І), або її пестицидно прийнятної солі, разом із іншими речовинами, токсичними для членистоногих, або рослинних нематодів, антигельмінтами, протикокцидними засобами, синергістами, мікроелементами, або стабілізаторами). Власне композиція, яку фактично застосовують, і її доза вибиратиметься таким чином, щоб досягти бажаного ефекту(ів) фермером, тваринником, медиком або ветеринарним лікарем, особою, відповідальною за боротьбу з паразитами, або іншим фахівцем у галузі. Сполуки за винаходом також можуть використовуватись для боротьби з членистоногими шкідниками на рослинах. Активну сполуку звичайно наносять у місці, зараженому членистоногими, у дозі від приблизно 0,005кг до приблизно 25кг активної сполуки на гектар (га) місця обробки, переважно 0,02-2кг/га. В ідеальних умовах, в залежності від виду членистоногих, з яким провадиться боротьба, достатньою може бути і менша доза. З іншої сторони, негативні погодні умови і інші фактори можуть вимагати використання активного компонента у більших пропорціях. Для нанесення на листову частину може використовуватись доза 0,011кг/га. Переважно, місцем є поверхня рослин, або грунт навколо рослини, яку необхідно обробити. Сполуки за винаходом є особливо цінними при боротьбі з членистоногими, які шкодять, або розповсюджують, або є переносниками захворювань людей і свійських тварин, наприклад зазначеними вище і, зокрема для боротьби з кліщами, кліщиками, вошами, блохами, комарами і мошками, мухами, що надокучають і викликають міаз. Вони особливо корисні при боротьбі з членистоногими, які знаходяться всередині свійських тварин, або які живляться у шкірі або на ній, або ссуть кров тварин, для чого вони можуть вводитись перорально, парентерально, підшкірно або місцево. Сполуки також цінні для захисту лісу (лісу, що стоїть, зрубаного, обробленого, лісу, що зберігається, або будівельного лісоматеріалу) від нашестя справжніх пильщиків, або жуків, або термітів. Вони також можуть використовуватись для захисту продуктів, що зберігаються, таких як зерно, фрукти, горіхи, спеції і тютюн, необроблених, подрібнених, або як компонентів інших продуктів, від молі, жуків і кліщів. Також можна захистити продукти тваринного походження, які зберігаються, такі як шкіра, хутро, шерсть і пір'я необроблені і оброблені (наприклад у вигляді килимів або текстилю) від кліщів і жуків; а також від жуків, кліщів і мух - м'ясо і рибу, що зберігається. Тверді або рідкі композиції для нанесення на ліс, продукти, що зберігаються, або господарські товари, звичайно містять від приблизно 0,00005% до приблизно 90%, більш точно від приблизно 0,001% до приблизно 10 вагових % однієї або більшої кількості сполук формули (І), або їх пестицидно прийнятних солей. Даний винахід також стосується способу чищення здорових тварин, який включає застосування на тварині сполуки формули (І), або ветеринарно прийнятної солі. Метою цього чищення є профілактика або уникнення зараження людей паразитами, що знаходяться на тваринах, і для очищення середовища, в якому живуть люди. Сполуки за винаходом застосовують для боротьби з членистоногими паразитами. Зокрема, вони можуть використовуватись у галузі ветеринарної медицини, тваринництва і охорони здоров'я: проти членистоногих, які паразитують зовні або всередині хребетних, зокрема теплокровних хребетних, включаючи людину і свійських тварин, таких як собаки, коти, велика рогата худоба, вівці, кози, коні, свині, домашню птицю і рибу, наприклад Асаrіnа, включно з кліщами (наприклад Ixodes spp., Boophilus spp. e.g. Boophilus microplus, Amblyomma spp., Hyalomma spp., Rhipicephalus spp. e.g. Rhipicephalus appendiculatus, Haemaphysalis spp., Dermacentor spp., Ornithodorus spp. (наприклад Omithodorus moubata), кліщів (наприклад Damalinia spp., Dermanyssus gallinae, Sarcoptes spp. e.g. Sarcoptes scabiei, Psoroptes spp., Chorioptes spp., Demodex spp., Eutrombicula spp.); двокрилих Diptera (наприклад Aedes spp., Anopheles spp., Muscidae spp. e.g. Stomoxys calcitrans і Haematobia irritans, Hypoderma spp., Gastrophilus spp., Simulium spp.); справжніх напівжорсткокрилих клопів Hemiptera (наприклад Triatoma spp.); Phthiraptera (наприклад Damalinia spp., Linognathus spp.); бліх Siphonaptera (наприклад Ctenocephalides spp.); тарганів Dictyoptera (наприклад Periplaneta spp., Blatella spp.) і паразитичних перетинковокрилих Hymenoptera (наприклад Monomorium pharaonis). Для уникнення неоднозначності, посилання на "лікування" стосується лікувального, паліативного і профілактичного лікування, посилання на "боротьбу" (з паразитами і/або шкідниками і т.д.) включає знищення, вигнання, витіснення, ураження, відлякування, ліквідування, зменшення кількості, мінімізувався, винищення. Скринінг живлення бліх на мембрані використовували для визначення біологічної активності заявлених сполук. Дослідження включає in vitro тестування відносно Ctenocephalides feiis, яке проводили відповідно до наступної загальної методики. Бліх культивували in vitro застосовуючи кров собаки. 25-30 дорослих котячих бліх Ctenocephalides felis збирали і розміщували в тестовій камері (50мл полістиролова колба, закрита нейлоном із дрібними чарунками). Цитратну собачу кров готували шляхом додавання водного розчину цитрату натрію (10мл, 20%об./вага, 20г цитрату натрію в 100мл води) до собачої крові (250мл). Тестові сполуки розчиняли в диметилсульфоксиді з одержанням основного робочого розчину 4мг/мл. Основний розчин (12,5мкл) додавали до цитратної собачої крові (5мл) зодержанням початкової тестової концентрації 10мкг/мл. Для тестування при 30мкг/мл, готували основні робочі розчини із концентрацією 12мг/мл. Цитратну собачу кров, яка містила тестову сполуку (5мл, 10мкг/мл) розміщували у пластикову кришку чашки Петрі, яку тримали при 37°С на нагрітій подушці. Над відкритим верхом натягували парафільм для утворення щільно прилягаючої мембрани, через яку блохи могли живитись. Тестову камеру, в якій знаходились блохи, обережно розміщували на мембрані парафільму і блохи починали живитись. Бліх залишили харчуватись на 2 години, після чого тестові камери знімали і зберігали протягом ночі при кімнатній температурі. За блохами спостерігали і фіксували відсоток бліх, що загинули. Сполуки, активні при 10мкг/мл, тестували при нижчих дозах. Для активних молекул, 4 точки відповіді на дозу (10, 3, 1, 0,3, 0,1мкг/мл) повторювали n=5. На основі показників будували графік для одержання значень ED80. Всі ілюстративні сполуки за цим винаходом, які пройшли тестування, мали показник ED80 відносно бліх менше ніж, або тотожний 3, на противагу відповідним порівняльним сполукам рівня техніки, наприклад, сполукам 3-ціано-5-аміноарилпіразолу, в яких присутній галоген на 4-циклопропіловому кільці, описані в [публікації WO98/24767]. Наприклад, 5-аміно-3-ціано-4-(2,2-дибромциклопропіл)-1-(2,6-дихлорфеніл-4трифторметил-)піразол був неактивним у описаному вище скринінг бліх на ED80 при 30мкг/мл. У наступних описах експериментів, показники спектру ядерно-магнітного резонансу одержували за допомогою спектрометрів Varian Inova 300, Varian Inova 400, Varian Mercury 400, Varian Unityplus 400, Bruker AC 300МГц, Bruker AM 250МГц або Varian T60МГц, виявлені хімічні зсуви відповідали запропонованим структурам. Показники мас-спектру одержували на Finnigan Masslab Navigator, Fisons Instrument Trio 1000, або спектрометрі Hewlett Packard GCMS System Model 5971. Зазначені іони, розраховані і які спостерігали, відносяться до ізотопної композиції найнижчої маси. ВЕРХ означає високоефективну рідинну хроматографію. Кімнатна температура означає 20-25°С. Приклад 1 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Н-піразол-3карбонітрил До розчину Приготування 1 (62мг, 0,12ммоль) в метанолі (10мл) додавали п-толуольсульфонову кислоту (0,5г, 2,63ммоль) і реакційну суміш нагрівали при кипінні із зворотним холодильником протягом ночі. Реакційну суміш заливали на насичений розчин гідрокарбонату натрію (50мл) і одержану суміш екстрагували етилацетатом (2´20мл). Об'єднані екстракти сушили (MgSO4) і концентрували у вакуумі. Неочищений продукт розчиняли в ацетонітрилі (1,5мл) і воді (0,9мл) і розчин очищували автоматизованою препаративною рідинною хроматографією (Gilson system, 150мм´30мм Phenomenex LUNA C18(2) колонка) застосовуючи градієнт вода:ацетонітрил [45:55 до 5:95]. Придатні фракції об'єднували і концентрували у вакуумі з одержанням рацемічної вказаної в заголовку сполуки (22мг). МС (ES): M/Z [МН+] 523,2; очікувана маса для C14H6Cl2F10N4S+Η: 523,0 1 Н-ЯМР (CDCI 3): 2,05-2,20 (1Н), 2,42-2,53 (1Η), 3,83-3,99 (2Н), 7,87-7,93 (2Н) Рацемічну суміш Прикладу 1 розчиняли в суміші етанол/гексан (2:3) і енантіомери розділяли автоматизованою препаративною рідинною хроматографією (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка) із використанням суміші етанол/гексан [5:95] як рухомої фази. Придатні фракції об'єднували і концентрували з одержанням двох енантіомерно збагачених продуктів Прикладу 1а і Прикладу 1b. Приклад 1а: МС (ES): МН+ 523,0, C14H6Cl2F10N4S+Η вимагає 523,0 ВЕРХ: (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [5:95], час утримання 10,73хв., чистота енантіомерів 100% Приклад 1b: МС (ES): МН+ 523,0, C14H6Cl2F10N4S+Η вимагає 523,0 ВЕРХ: (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [5:95], час утримання 12,23хв., чистота енантіомерів 100% Приклад 2 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Hпіразол-3-карбонітрил До розчину Приготування 2 (234мг, 0,45ммоль) в метанолі (10мл) додавали п-толуольсульфонову кислоту (500мг, 2,63ммоль) і реакційну суміш нагрівали при кипінні із зворотним холодильником протягом ночі. До реакційної суміші додавали етил ацетат (100мл) і органічну фазу відділяли, промивали насиченим водним розчином гідрокарбонату натрію (2´100мл), сушили (MgSO4) і концентрували у вакуумі. Залишок очищували колонковою хроматографією (силікагель, 20г), елююючи сумішшю дихлорметан/пентан [2:1]. Придатні фракції об'єднували і концентрували з одержанням рацемічної суміші вказаної в заголовку сполуки (160мг) у вигляді блідо-жовтої твердої речовини. МС (ES): M/Z [MH+] 465.1; очікувана маса для C15H6CI 2F8N4+Η складає 465,0 1 Н-ЯМР (CDCI 3): 2,05-2,20 (1Η), 2,42-2,53 (1Η), 3,86-3,95 (2Н), 7,74-7,79 (2Н) Рацемічну суміш Прикладу 2 розчиняли в суміші етанол/гексан (1:1) і енантіомери розділяли автоматизованою препаративною рідинною хроматографією (Gilson system, 250´20мм ID Chiraicel OD, 10мкм колонка) із використанням суміші етанол/гексан [1:9] як рухомої фази. Придатні фракції об'єднували і концентрували з одержанням двох енантіомерно збагачених продуктів Прикладу 2а і Прикладу 2b. Приклад 2а: МС (ES): МН+ 464,8, C15H6Cl2F8N4+Η вимагає 465,0 ВЕРХ: (Gilson system, 250´20мм ID Chiraicel OD, 10мкм колонка), етанол/гексан [1:9], час утримання 12,09хв., чистота енантіомерів 99%, (-) ізомер. Приклад 2b: МС (ES): МН+ 464,8, C15H6CI 2F8N4+Η вимагає 465,0 ВЕРХ: (Gilson system, 250´20мм ID Chiraicel OD, 10мкм колонка), етанол/гексан [1:9], час утримання 14.63хв., чистота енантіомерів 100%, (+) ізомер. Наступні сполуки одержували подібно: Приклад 3 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(1,2,2-трифторциклопропіл)-1Н-піразол-3-карбонітрил; із сполуки Приготування 3 (22мг, 0,047ммоль) з одержанням вказаної в заголовку сполуки (9,4мг). МС (ES): M/Z [МН+] 415.1; очікувана маса для C14H6CI 2F6N4+Η складає 415,0 1 Н-ЯМР (CDCI 3): 2,16-2,27 (2Н), 4,02-4,12 (2Н), 7,76-7,80 (2Н) Приклад 4 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(пентафторциклопропіл)-1H-піразол-3-карбонітрил; із сполуки Приготування 4 (32 мг, 0,063ммоль) з одержанням вказаної в заголовку сполуки (10мг) МС (ES): Μ/Ζ [ΜΗ+] 451,1; очікувана маса для C14H4CI 2F8N4+Η складає 451,0 1 Н-ЯМР (CDCI 3): 4,16-4,24 (2Н), 7,77-7,81 (2Н) Приклад 5 5-аміно-4-(2,2-дихлор-1-фторциклопропіл)-1-[2,6-дихлор-4-(трифторметил)феніл]-1H-піразол-3карбонітрил; із сполуки Приготування 5 (29мг, 0,06ммоль) з одержанням вказаної в заголовку сполуки (5мг) у вигляді білої твердої речовини. МС (ES): M/Z [MH+] 446,8; очікувана маса для C14H6CI 4F4N4+Η складає 447,0 1 Н-ЯМР (CDCI 3): 2,25-2,34 (1Н), 2,41-2,47 (1Н), 4,09-4,18 (2Н), 7,75-7,80 (2Н) Приклад 6 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-(пентафторциклопропіл)-1Н-піразол-3-карбонітрил; із сполуки Приготування 6 (40мг, 0,07ммоль) з одержанням вказаної в заголовку сполуки (20мг) у вигляді білої твердої речовини. МС (ES): M/Z [MH+] 509,2; очікувана маса для C13H4CI 2F10N4S+Η складає 509,0 1 Н-ЯМР (CDCI 3): 4,16-4,22 (2Н), 7,91-7,93 (2Н) Приклад 7 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-(1,2,2-трифторциклопропіл)-1Н-піразол-3-карбонітрил; із сполуки Приготування 7 (92мг, 0,17ммоль) з одержанням вказаної в заголовку сполуки (46мг). МС (ES): M/Z [MH+] 472,9; очікувана маса для C13H6CI 2F8N4S+Η складає 473,0 1 Н-ЯМР (CDCI 3): 2,14-2,27 (2Н), 4,05-4,14 (2Н), 7,89-7,92 (2Н) Приклад 8 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Н-піразол3-карбонітрил До розчину Приготування 23 (4,0г, 8.0ммоль) в 1,4-діоксані (50мл) додавали метанол (5мл) і соляну кислоту (10% у воді, 5мл). Реакційну суміш потім нагрівали при кипінні із зворотним холодильником 4год. До реакційної суміші додавали насичений водний розчин гідрокарбонату натрію і водну фазу відділяли і екстрагували етилацетатом (3´20мл). Об'єднані органічні фази потім сушили (MgSO4) і концентрували у вакуумі. Залишок очищували колонковою хроматографією (силікагель, 70 г) з градієнтним елююванням, петролейний етер:діетиловий етер [1:0-0:1]. Придатні фракції об'єднували ι концентрували з одержанням рацемічної суміші Прикладу 8 (3,2г). МС (ES): Μ/Ζ [ΜΗ+] 448,9; очікувана маса для C15H7CI 2F7N4+Η складає 447,0 1 Н-ЯМР (CDCI 3): 2,04-2,11 (1Н), 2,13-2,20 (1Н), 3,82-3,90 (2Н), 5,63-5,89 (1Н), 7,73-7,79 (2Н) Рацемічну суміш Прикладу 8 (88мг) розчиняли в суміші етанол/гексан (1:1) і енантіомери розділяли автоматизованою препаративною рідинною хроматографією (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка) із використанням суміші етанол/гексан [2:8] як рухомої фази. Придатні фракції об'єднували і концентрували з одержанням Прикладу 8а (40мг) і Прикладу 8b (40мг). Приклад 8а: МС (ES): МН+ 446,8, C15H7CI 2F7N4+Η вимагає 447,0 ВЕРХ: (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [2:8], час утримання 7,3хв., чистота енантіомерів 100%. Приклад 8b: МС (ES): МН+ 446,8, C15H7CI 2F7N4+Η вимагає 447,0 ВЕРХ: (Giison system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [2:8], час утримання 17.4хв., чистота енантіомерів 100%. Приклад 9 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(2,2-дифторциклопропіл)-1Н-піразол-3-карбонітрил До розчину Приготування 31 (560мг, 1,40ммоль) і фториду натрію (4,0мг, 0,12ммоль) в толуолі (0,8мл), при 100°С, додавали триметилсиліл-2,2-дифтор-2-(фторсульфоніл)ацетат (700мг, 2,8ммоль) протягом 1год., використовуючи шприц. Реакційну суміш потім нагрівали при кипінні із зворотним холодильником 1год. До охолодженої реакційної суміші додавали силікагель і розчин концентрували у вакуумі. Суміш продукт/силікагель частково очищували колонковою хроматографією, елююючи сумішшю діетиловий етер/гексан [1:1], і фракції, що містили продукт, концентрували у вакуумі. До залишку додавали метанол (5мл) і соляну кислоту (2N, 5мл), реакційну суміш нагрівали при кипінні із зворотним холодильником 6год. Реакційну суміш концентрували у вакуумі і залишок розділяли між діетиловим етером і водою (20мл). Два шари розділяли і органічний шар сушили (MgSO4) і концентрували у вакуумі. Залишок очищували колонковою хроматографією з градієнтним елююванням, діетиловий етертексан [1:2 до 1:1]. Придатні фракції об'єднували і концентрували з одержанням Прикладу 9 (96мг) у вигляді білої твердої речовини. MC (ES): Μ/Ζ [ΜΗ+] 397.1, очікувана маса для C14H7CI 2F5N4+Η складає 397,0 1 Н-ЯМР (CDCI 3): 1,74-1,83 (1Η), 1,95-2,05 (1Η), 2,44-2,56 (1Η), 3,72-3,84 (2Η), 7,76-7,81 (2Η) Подібно до Прикладу 2 одержували: Приклад 10 5-аміно-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1-[2,6-дифтор-4-(трифторметил)феніл]-1Нпіразол-3-карбонітрил; із сполуки Приготування 10 (250мг, 0,51ммоль) з одержанням вказаної в заголовку сполуки (11мг). MC (ES): Μ/Ζ [МН+] 433.0; очікувана маса для C15H6F10N4+Η складає 433,1 1 Н-ЯМР (CDCI 3): 2,02-2,09 (2Н), 2,29-2,42 (1Н), 4,63-4,76 (1Н), 7,30-7,37 (2Н) Подібно до Прикладу 8 одержували: Приклад 11 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Н-піразол-3карбонітрил; із сполуки Приготування 11 (655мг, 1,17ммоль) з одержанням рацемічної суміші вказаної в заголовку сполуки (284мг). MC (ES): M/Z [MH+] 504,9; очікувана маса для C14H7CI 2F9N4S+Η складає 505,0 1 Н-ЯМР (CDCI 3): 2,00-2,09 (1Н), 2,12-2,20 (1Н), 3,87-3,96 (2Н), 5,61-5,90 (1Н), 7,88-7,91 (2Н) Рацемічну суміш Прикладу 11 розчиняли в суміші етанол/гексан (1:1) і енантіомери розділяли автоматизованою препаративною рідинною хроматографією (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка) із використанням суміші етанол/гексан [2:8] як рухомої фази. Придатні фракції об'єднували і концентрували з одержанням двох енантіомерно збагачених продуктів Прикладу 11а і Прикладу 11b. Приклад 11а: MC (ES): МН+ 504,9, C14H7CI 2F9N4S+Η вимагає 505,0 ВЕРХ: (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [2:8], час утримання 6,40хв., чистота енантіомерів 100% Приклад 11b: MC (ES): МН+ 504,9, C14H7CI 2F9N4S+Η вимагає 505,0 ВЕРХ: (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [2:8], час утримання 13,89хв., чистота енантіомерів 100% Приклад 12 5-аміно-4-{1-[хлор(фтор)метил]-2,2-дифторциклопропіл}-1-[2,6-дихлор-4-(трифторметил)феніл]-1Hпіразол-3-карбонггрил; із сполуки Приготування 12 (100мг, 0,19ммоль) з одержанням рацемічної суміші вказаної в заголовку сполуки (20мг). МС (ES): M/Z [МН+] 462,8; очікувана маса для C15H7CI 3F6N4+Η складає 463,0 1 Н-ЯМР (CDCI 3): 2,03-2,11 (1Н), 2,16-2,25 (1Н), 3,84-3,95 (2Н), 6,02-6,16 (1Н), 7,73-7,80 (2Н) Рацемічну суміш Прикладу 12 розчиняли в суміші етанол/гексан (1:1) і енантіомери розділяли автоматизованою препаративною рідинною хроматографією [Gilson system, 250´20мм ID Chiralcel OD, 10мм колонка) із використанням суміші етанол/гексан [2:8] як рухомої фази. Придатні фракції об'єднували і концентрували з одержанням двох енантіомерно збагачених продуктів Прикладу 12а і Прикладу 12b. Приклад 12а: МС (ES): МН+ 462,9, C15H7CI 3F6N4+Η вимагає 463,0 ВЕРХ: (Gilson system, 250x20 мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [2:8], час утримання 7,07хв., чистота енантіомерів 99% Приклад 12b: МС (ES): МН+ 462,9, C15H7CI 3F6N4+Η вимагає 463,0 ВЕРХ: (Gilson system, 250x20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [2:8], час утримання 21,44хв., чистота енантіомерів 100% Приклад 13 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Hпіразол-3-карбонітрил; із сполуки Приготування 13 (48мг, 0,09ммоль) з одержанням вказаної в заголовку сполуки (17мг). МС (ES): M/Z [МН+] 482,7; очікувана маса для C15H5CI 2F9N4+Η складає 483,0 1 Н-ЯМР (CDCI 3): 3,84-3,91 (2Н), 5,95-6,24 (1Н), 7,76-7,79 (2Н) Приклад 14 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрил; із сполуки Приготування 14 (7мг, 0,01ммоль) з одержанням вказаної в заголовку сполуки (4мг). МС (ES): M/Z [МН+] 500,9; очікувана маса для C15H4Cl2F10N4+Η складає 501,0 Приклад 15 1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-5-(метиламіно)-1Нпіразол-3-карбонітрил До розчину Прикладу 2 (500мг, 1,08ммоль) в триетилортоформаті (13,4мл) додавали концентровану соляну кислоту (декілька крапель). Реакційну суміш потім нагрівали при кипінні із зворотним холодильником 2,5год. Реакційну суміш концентрували у вакуумі і залишок повторно розчиняли в толуолі і повторно концентрували (´2). До розчину залишку в етанолі (10мл), при 0°С, додавали боргідрид натрію (90мг, 2,37ммоль). Реакційну суміш потім перемішували при кімнатній температурі протягом ночі. До реакційної суміші додавали оцтову кислоту (0,5мл) і воду (10мл) і суміш екстрагували етилацетатом (3´10мл). Об'єднані органічні фази сушили (MgSO4) і концентрували у вакуумі. Залишок очищували колонковою хроматографією (силікагель), закладаючи в толуол і елююючи толуолом. Придатні фракції об'єднували і концентрували з одержанням рацемічної суміші Прикладу 15 (323мг). МС (ES): M/Z [MH+] 478,8; очікувана маса для C16H8CI 2F8N4+Η складає 479,0 1 Н-ЯМР (CDCI 3): 2,07-2,23 (1Η), 2,42-2,58 (1Η), 2,71-2,76 (3H), 3,51-3,66 (1H), 7,73-7,77 (2Н) Рацемічну суміш Прикладу 15 розчиняли в суміші етанол/гексан (1:1) і енантіомери розділялиавтоматизованою препаративною рідинною хроматографією (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка) із використанням суміші етанол/гексан [1:9] як рухомої фази. Придатні фракції об'єднували і концентрували з одержанням двох енантіомерно збагачених продуктів Прикладу 15а і Прикладу 15b. Приклад 15а: МС (ES): МН+ 478,9, C16H8CI 2F8N4+Η вимагає 479,0 ВЕРХ: (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [1:9], час утримання 8,67хв., чистота енантіомерів 100% Приклад 15b: МС (ES): МН+ 478,9, C16H8CI 2F8N4+Η вимагає 479,0 ВЕРХ. (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [1:9], час утримання 11,26хв., чистота енантіомерів 100% Подібно до Прикладу 8 одержували: Приклад 16 5-аміно-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Hпіразол-3-карбонітрил; із сполуки Приготування 15 (1,0г, 1,86ммоль) з одержанням рацемічної суміші вказаної в заголовку сполуки (630мг). МС (ES): M/Z [МН+] 480,9; очікувана маса для C15H6Cl2F8N4O+Η складає 481,0 1 Н-ЯМР (CDCI 3): 2,05-2,18 (1H), 2,41-2,52 (1H), 3,87-3,95 (2Н), 7,37-7,40 (2Н) Рацемічну суміш Прикладу 16 розчиняли в суміші етанол/гексан (1:1) і енантіомери розділяли автоматизованою препаративною рідинною хроматографією (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка) із використанням суміші етанол/гексан [5:95] як рухомої фази. Придатні фракції об'єднували і концентрували з одержанням двох енантіомерно збагачених продуктів Прикладу 16а і Прикладу 16b. Приклад 16а: МС (ES): МН+ 480,9, C15H6CI2F8N4O+Η вимагає 481,0 ВЕРХ. (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [5:95], час утримання 8,86хв., чистота енантіомерів 99% Приклад 16b. МС (ES): MH+ 480,9, C15HeCl2F8N4O+Η вимагає 481,0 ВЕРХ (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [5:95], час утримання 9,91хв., чистота енантіомерів 100% Приклад 17 5-аміно-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Нпіразол-3-карбонітрил; із сполуки Приготування 16 (50мг, 0,09ммоль) з одержанням вказаної' в заголовку сполуки (10мг). МС (ES): M/Z [МН+] 498,9; очікувана маса для C15H5CI 2F9N4O+Η складає 499,0 1 Н-ЯМР (CDCI 3): 3,86-3,91 (2Н), 5,95-6,23 (1Н), 7,38-7,40 (2Н) Приклад 18 5-аміно-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Нпіразол-3-карбонприл; із сполуки Приготування 17 (3,6г, 7,0ммоль) з одержанням рацемічної суміші вказаної в заголовку сполуки (3,0г). МС (ES): M/Z [MH+] 463,0; очікувана маса для C15H7CI 2F7N4O+Η складає 463,0 1 Н-ЯМР (CDCI 3): 2,00-2,08 (1H), 2,10-2,19 (1Н), 3,82-4,00 (2Н), 5,60-5,90 (1Н), 7,35-7,40 (2Н) Рацемічну суміш Прикладу 18 розчиняли в суміші етанол/гексан (1:2) і енантіомери розділяли автоматизованою препаративною рідинною хроматографією (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка) із використанням суміші етанол/гексан [1:9] як рухомої фази. Придатні фракції об'єднували і концентрували з одержанням двох енантіомерно збагачених продуктів Прикладу 18а і Прикладу 18b. Приклад 18а: МС (ES): МН+ 463,0, C15H7CI 2F7N4O+Η вимагає 463,0 ВЕРХ: (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [1:9], час утримання 13,35хв., чистота енантіомерів 99% Приклад 18b: МС (ES): МН+ 463,0, C15H7Cl2F7N4O+Η вимагає 463,0 ВЕРХ: (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [1:9], час утримання 31,58хв., чистота енантіомерів 100% Приклад 19 5-аміно-1 -[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(фторметил)циклопропіл]-1Н-піразол-3карбонітрил; із сполуки Приготування 18 (100мг, 0.21ммоль) з одержанням рацемічної суміші вказаної в заголовку сполуки (17мг) МС (ES): M/Z [МН+] 428,9; очікувана маса для C15H8CI 2F6N4+Η складає 429,0 1 Н-ЯМР (CDCI 3): 1,84-1,93 (1H), 1,93-2,02 (1H), 3,68-4,06 (2Н), 4,42-4,82 (2Н), 7,73-7,78 (2Н) Рацемічну суміш Прикладу 19 розчиняли в суміші етанол/гексан (1.1) і енантіомери розділяли автоматизованою препаративною рідинною хроматографією (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка) із використанням суміші етанол/гексан [1:9] як рухомої фази. Придатні фракції об'єднували і концентрували з одержанням двох енантіомерно збагачених продуктів Прикладу 19а і Прикладу 19b. Приклад 19а: МС (ES): МН+ 429,0, C15H8CI 2F6N4+Η вимагає 429,0 ВЕРХ. (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [1:9], час утримання 14,99хв., чистота енантіомерів 100% Приклад 19b: МС (ES): МН+ 429,0, C15H8CI 2F6N4+Η вимагає 429,01 ВЕРХ: (Gilson system, 250´20мм ID Chiralcel OD, 10мкм колонка), етанол/гексан [1:9], час утримання 20,89хв., чистота енантіомерів 100% Приклад 20 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(2,2-дифтор-1-метилциклопропіл)-1Н-піразол-3карбонітрил; із сполуки Приготування 19 (80мг, 0,17ммоль) з одержанням вказаної в заголовку сполуки (56мг). МС (ES): M/Z [МН+] 411,0; очікувана маса для C15H9CI 2F5N4+Η складає 411,0 1 Н-ЯМР (CDCI 3): 1,46-1,50 (3H), 1,56-1,63 (1Н), 1,69-1,78 (1Н), 3,62-3,76 (2Н), 7,72-7,77 (2Н) Приклад 21 5-аміно-1-{2,6-дихлор-4-[(трифторметил)тіо]феніл}-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Hпіразол-3-карбонітрил; із сполуки Приготування 20 (1,8г, 3,3ммоль з одержанням вказаної в заголовку сполуки (1,1г). МС (ES): M/Z [MH+] 496,9; очікувана маса для C15H6Cl2F8N4S+Η складає 496,9 1 Н-ЯМР (CDCI 3): 2,05-2,18 (1Н), 2,42-2,52 (1Н), 3,86-3,97 (2Н), 7,75-7,80 (2Н) Приклад 22 етил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Hпіразол-5-ілкарбамат До розчину Прикладу 2а (100мг, 0,20ммоль) в N,N-диметилформаміді (3мл) додавали гідрид натрію (10мг, 0,20ммоль), з наступним додаванням 1-хлоретилетилкарбонату (37мг, 0,24ммоль). Реакційну суміш потім перемішували при кімнатній температурі протягом ночі. Реакційну суміш концентрували у вакуумі і залишок розчиняли в ацетонітрилі (2мл). Розчин очищували автоматизованою препаративною рідинною хроматографією (Gilson system, 150мм´30мм LUNA II C18 10мкм колонка) застосовуючи градієнт ацетонітрил:вода [60:40 до 95:5]. Придатні фракції об'єднували і концентрували з одержанням Прикладу 22 (50мг). МС (ES): M/Z [МН+] 536,9; очікувана маса для C18H10Cl2F8N4O2+Η складає 537,0 1 Н-ЯМР (CDCI 3): 1,07-1,14 (3H), 2,09-2,19 (1Н), 2,48-2,57 (1Н), 3,99-4,06 (2Н), 6,16-6,24 (1Н), 7,717,76(2Н) Одержували подібним чином: Приклад 23 1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-5-(2-оксо-1,3оксазолідин-3-іл)-1Н-піразол-3-карбонітрил; із сполуки Прикладу 2а (135мг, 0,30ммоль) і 2брометилхлорформат (60мг, 0,33ммоль) з одержанням вказаної в заголовку сполуки (47мг). МС (ES): M/Z [MH+] 534,9; очікувана маса для C18H8CI 2F8N4O2+Η складає 535,0 1 Н-ЯМР (CDCI 3): 2,31-2,39 (1Н), 2,54-2,64 (1Н), 4,00-4,10 (2Н), 4,43-4,50 (2Н), 7,75-7,78 (2Н) Подібно Прикладу 8 одержували: Приклад 24 5-аміно-1-[3-хлор-5-(трифторметил)піридин-2-іл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрил; із сполуки Приготування 22 (164мг, 0,34ммоль з одержанням вказаної в заголовку сполуки (60мг). МС (ES): M/Z [MH+] 432,0; очікувана маса для C14H6CIF8N5+Η складає 432,0 1 Н-ЯМР (CDCI 3): 2,02-2,19 (1Н), 2,40-2,54 (1Н), 5,13-5,22 (2Н), 8,19-8,23 (1Н), 8,63-8,67 (1Н) Приклад 25 Гідрохлорид 2-(диметиламіно)етил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату До розчину Прикладу 2а (100мг, 0,22ммоль) в суміші безводний дихлорметан/толуол (3:2, 2мл) додавали піридин (40мкл, 0,50ммоль) і молекулярні сита (4А). Цей розчин додавали до фосгену (20% в толуолі, 1,7N, 300мкл, 0,50ммоль) при 0°С і в атмосфері азоту, реакційну суміш залишали відстоюватись на 1год. Додавали 2-(диметиламіно)етанол (1мл) і реакційну суміш залишали відстоюватись на ніч перед концентрувнням у вакуумі. Залишок розчиняли в ацетонітрилі (1,8мл) і розчин очищували автоматизованою препаративною рідинною хроматографією (Gilson system, 150мм´30мм LUNA II С18 10мкм колонка) застосовуючи градієнт ацетонітрил:0,1% трифтороцтова кислота [35:65 до 95:5]. Придатні фракції об'єднували і концентрували, і до залишку додавали соляну кислоту з одержанням Прикладу 25 (100мг). МС (ES): M/Z [МН+] 580,0; очікувана маса для C20H15CI 2F8N5O2+Η складає 580,1 1 Н-ЯМР (CDCI 3): 2,21-2,30 (1Н), 2,47-2,56 (2Н), 2,84-2,88 (6Н), 3,19-3,24 (2Н), 4,27-4,39 (2Н), 7,71-7,74 (2Н) Одержували подібним чином: Приклад 26 2,2,2-трифторетил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамат; із сполуки Прикладу 2а (100мг, 0,22ммоль) і 2,2,2трифторетанолу з одержанням вказаної в заголовку сполуки (100мг). МС (ES): M/Z [MH+] 590,9; очікувана маса для C18H7CI 2F11N4O2+Η складає 591,0 1 Н-ЯМР (ДМСО): 2,61-2,71 (1Н), 2,89-2,99 (1Н), 4,62-4,73 (2Н), 8,26-8,29 (2Н), 10,89-10,97 (1Н) Приклад 27 5-аміно-1-{2,6-дихлор-4-[(трифторметил)сульфоніл]феніл}-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1Н-піразол-3-карбонітрил Суміш Прикладу 21 (600мг, 1,2ммоль) і 3-хлорпероксибензойної кислоти (929мг, 5,4ммоль) в дихлорметані (20мл) перемішували при кімнатній температурі 48год. Реакційну суміш промивали водним розчином гідроксиду натрію, з наступним промиванням водою і насиченим розчином солі. Органічну фазу потім сушили і концентрували у вакуумі. Залишок очищували флеш-хроматографією (силікагель) з градієнтним елююванням, толуол:дихлорметан [1:0-0:1]. Придатні фракції об'єднували і концентрували у вакуумі. Залишок розчиняли в суміші ацетонітрил/вода (1мл) і розчин очищували автоматизованою препаративною рідинною хроматографією (Gilson system, 150мм´30мм LUNA II С18 10мкм колонка) застосовуючи градієнт ацетонітрил:вода [60:40-95:5]. Придатні фракції об'єднували і концентрували з одержанням Прикладу 27 (27мг). МС (ES): M/Z [МН+] 529,0; очікувана маса для C15H6CI 2F8N4O2S+Η складає 529,0 1 Н-ЯМР (ДМСО): 2,11-2,22 (1Н), 2,59-2,70 (1Н), 6,68-6,73 (2Н), 8,55-8,59 (2Н) Приклад 28 1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-5-[(піридин-4ілметил)аміно]-1H-піразол-3-карбонітрил До розчину Приготування 25 (200мг, 0,36ммоль) в безводному метанолі (10мл), в атмосфері азоту і при 0°С додавали боргідрид натрію (34мг, 0,90ммоль). Реакційну суміш потім перемішували при кімнатній температурі 2год. До реакційної суміші додавали воду і суміш доводили до рівня рН 2 шляхом додання соляної кислоти (4N). Суміш потім нейтралізували шляхом додання насиченого водного розчину карбонату натрію, екстрагували етилацетатом (3´10мл) і об'єднані екстракти сушили (MgSO4) і концентрували у вакуумі. Залишок розчиняли в суміші ацетонітрил/вода (3,6мл) і розчин очищували автоматизованою препаративною рідинною хроматографією (Giison system, 150´30мм, LUNA II C18 10мкм колонка), застосовуючи градієент ацетонітрил:вода [55:45-95:5]. Придатні фракції концентрували з одержанням Прикладу 28 (34мг). МС (ES): M/Z [МН+] 556,0; очікувана маса для C21H11CI 2F8N5+Η складає 556,0 1 Н-ЯМР (CDCI 3): 2,20-2,34 (1Н), 2,53-2,67 (1Н), 4,10-4,17 (1Н), 4,18-4,28 (2Н), 7,01-7,05 (2Н), 7,60-7,63 (2Н), 8,44-8,48 (2Н) Подібно до Прикладу 2 одержували: Приклад 29 5-аміно-1-[2,6-дихлор-4-(дифторметокси)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-3-карбонітрил; із сполуки Приготування 26 (110мг, 0.21ммоль) з одержанням вказаної в заголовку сполуки (48мг). МС (ES): M/Z [МН+] 463,0; очікувана маса для C15H7CI 2F7N4O+Η складає 463,0 1 Н-ЯМР (CDCI 3): 2,01-2,19 (1Н), 2,38-2,51 (1Н), 3,83-3,98 (2Н), 6,38-6,77 (1Н), 7,27-7,32 (2Н) Приклад 30 5-аміно-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Нпіразол-3-карбонітрил; із сполуки Приготування 27 (138мг, 0.23ммоль) з одержанням вказаної в заголовку сполуки (100мг). МС (ES): M/Z [MH+] 541,0; очікувана маса для C14H5CI 2F11N4S+Η складає 541,0 1 Н-ЯМР (ДМСО): 6,51-6,71 (1Н), 6,73-6,76 (2Н), 8,43-8,46 (2Н) Подібно до Прикладу 25 одержували: Приклад 31 Ізопропіл 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]1Н-піразол-5-ілкарбамат; із сполуки Прикладу 2а (50мг, 0,11ммоль) і 2-пропанолу з одержанням вказаної в заголовку сполуки (44мг). МС (ES): Μ/Ζ [ΜΗ+] 551,0; очікувана маса для C19H12CI 2F8N4O2+Η складає 551,0 1 Н-ЯМР (ДМСО): 0,96-1,04 (6Н), 2,61-2,71 (1H), 2,87-2,99 (1H), 4,59-4,67 (1H), 8,28-8,32 (2Η), 10,15-10,22 (1Η) Приклад 32 Гідрохлорид піридин-4-ілметил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату; із сполуки Прикладу 2а (50мг, 0,11ммоль) і піридин4-метанолу з одержанням вказаної в заголовку сполуки (5мг) МС (ES): Μ/Ζ [МН+] 600,0; очікувана маса для C22H11CI 2F8N5O2+Η складає 600,0 1 Н-ЯМР (CD3OD): 2,24-2,35 (1Н), 2,55-2,65 (1Н), 5,21-5,23 (2Н), 7,65-7,68 (2Н), 7,92-7,94 (2Н), 8,64-8,68 (2Н) Приклад 33 Гідрохлорид піридин-3-ілметил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1Н-піразол-5-іл]-карбамату; із сполуки Прикладу 2а (50мг, 0,11ммоль) і піридин-3-метанолу з одержанням вказаної в заголовку сполуки (24мг). МС (ES): M/Z [МН+] 600,0; очікувана маса для C22H11CI 2F8N5O2+Η складає 600,0 1 Н-ЯМР (ДМСО): 2,63-2,73 (1Н), 2,84-2,95 (1Н), 5,11-5,16 (2Н), 7,68-7,74 (1Н), 7,95-8,01 (1Н), 8,20-8,26 (2Н), 8,61-8,64 (1Н), 8,68-8,73 (1Н), 10,55-10,68 (1Н) Приклад 34 Гідрохлорид піридин-2-ілметил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1H-піразол-5-ілкарбамату; із сполуки Прикладу 2а (50мг, 0,11ммоль) і піридин2-метанолу з одержанням вказаної в заголовку сполуки (31мг). МС (ES): Μ/Ζ [ΜΗ+] 600,0; очікувана маса для C22H11CI 2F8N5O2+Η складає 600,0 1 Н-ЯМР (ДМСО): 2,65-2,75 (1Н), 2,86-2,97 (1Н), 5,05-5,11 (2Н), 7,11-7,16(1Н), 7,31-7,37 (1Н), 7,77-7,82 (1Н), 8,21-8,28 (2Н), 8,46-8,51 (1Н), 10,56-10,70 (1Н) Приклад 35 Гідрохлорид 1Н-імідазол-5-ілметил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1Н-піразол-5-ілкарбамату; із сполуки Прикладу 2а (50мг, 0,11ммоль) і 5(гідроксиметил)імідазолу з одержанням вказаної в заголовку сполуки (2мг). МС (ES)· Μ/Ζ [ΜΗ+] 589,0; очікувана маса для C20H10CI 2F8N6O2+Η складає 589,0 Приклад 36 Гідрохлорид 2-піролідин-1-ілетил 3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1(трифторметил)циклопропіл]-1H-піразол-5-ілкарбамату; із сполуки Прикладу 2а (50мг, 0,11ммоль) і 1-(2гідроксиетил)піридину з одержанням вказаної в заголовку сполуки (10мг). МС (ES): Μ/Ζ [ΜΗ+] 606,1; очікувана маса для C22H17Cl2F8N5O2+Η складає 606,1 1 Н-ЯМР (CD3OD): 1,93-2,01 (4Н), 2,31-2,38 (1Н), 2,56-2,64 (1Н), 3,18-3,23 (4Н), 3,30-3,35 (2Н), 4,21-4,26 (2Н), 7,95-7,99 (2Н) Подібно до Прикладу 8 одержували: Приклад 37 5-аміно-4-{1-[хлор(дифтор)метил]-2,2-дифторциклопропіл}-1-[2,6-дихлор-4-(трифторметил)феніл]-1Hпіразол-3-карбонітрил; із сполуки Приготування 55 (124мг, 0,23ммоль) з одержанням вказаної в заголовку сполуки (17мг). МС (ES): M/Z [MH+] 480,9; очікувана маса для C15H6CI 3F7N4+Η складає 480,96 1 Н-ЯМР (CDCI 3): 2,08-2,24 (1Н), 2,46-2,61 (1Н), 3,87-4,00 (2Н), 7,75-7,79 (2Н) Рацемічну суміш Прикладу 37 розчиняли в суміші етанол/гексан (1:4) і енантіомери розділяли автоматизованою препаративною рідинною хроматографією (Gilson system, 250´20мм ID Chiraicel ΙΑ, 5мм колонка) із використанням суміші етанол/гексан [5:95] як рухомої фази. Придатні фракції об'єднували і концентрували з одержанням одного енантіомерно чистого продукту, Прикладу 37а, і декількох змішаних фракцій. Приклад 37а: МС (ES): МН+ 481,0, C15H6CI 3F7N4+Η вимагає 481,0 ВЕРХ: (Gilson system, 250´20мм ID Chiraicel OD, 10мм колонка), етанол/гексан [5:95], час утримання 10,55хв., чистота енантіомерів 98%. Наступні Приготування ілюструють синтез деяких проміжних сполук, які застосовувались при одержанні вищенаведених сполук в Прикладах. Приготування 1 N'-{3-ціано-1-[2,6-дихлор-4-(пентафтортіо)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-5-iл}-N,N-диметилімідоформамід Суміш Приготування 32 (264мг, 0,5ммоль), метилбензоату (100мл) і фториду натрію (6мг) нагрівали при 105°С в атмосфері азоту. Триметилсиліл-2,2-дифтор-2-(фторсульфоніл)ацетат (197мл, 1,0ммоль) додавали по краплях протягом 1год. і реакційну суміш перемішували при 105°С. Протягом 7год. додатково додавали триметилсиліл-2,2-дифтор-2-(фторсульфоніл)ацетат (700мл, 3.6ммоль), підтримуючи температуру реакційної суміші на 105°С. До реакційної суміші додавали дихлорметан (15мл) і розчин промивали насиченим водним розчином гідрокарбонату натрію. Органічну фазу відділяли, сушили (MgSO4) і концентрували у вакуумі. Залишок очищували застосовуючи картридж IsoluteÔ (силікагель, 20г) і елююючи толуолом Придатні фракції об'єднували і концентрували з одержанням Приготування 1 (62мг) у вигляді не зовсім білої твердої речовини. МС (ES): M/Z [MH+] 578,3; очікувана маса для C17H11CI 2F10N5S+Η складає 578,0 1 Н-ЯМР (CDCI 3): 2,15-2,20 (1H), 2,45-2,55 (1Н), 2,79-2,81 (3H), 3,01-3,03 (3H), 7,79-7,81 (2Н), 7,88-7,90 (1Н) Одержували подібним чином: Приготування 2 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 33 (160мг, 0,34ммоль) з одержанням вказаної в заголовку сполуки (94мг) у вигляді блідо-жовтої твердої речовини. МС (ES): Μ/Ζ [ΜΗ+] 520,2; очікувана маса для C18H11CI 2F8N5+Η складає 520,0 1 Н-ЯМР (CDCI 3): 1,99-2,31 (2Н), 2,74-2,80 (3H), 2,99-3,00 (3H), 7,64-7,69 (2Н), 7,82-8,02 (1Н) Приготування 3 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[(1R)-1,2,2-трифторциклопропіл]-1Н-піразол-5-іл}N,N-диметилімідоформамід До розчину Приготування 34 (11мг, 0,026ммоль) в толуолі (0,2мл), в атмосфері азоту, додавали феніл(трифторметил)-ртуть (45мг, 0,13ммоль) і йодид натрію (59мг, 0,39ммоль). Реакційну суміш потім нагрівали при 85°С 18год. До реакційної суміші додавали толуол (5мл) і розчин фільтрували через Аrbосеl для видалення залишків Нg. Фільтрат концентрували у вакуумі з одержанням Приготування 3 (22мг). МС (ES): M/Z [МН+] 470,2; очікувана маса для C17H11CI 2F6N5+Η складає 470,0 1 Н-ЯМР (CDCI 3): 2,08-2,31 (2Н), 2,81-2,84 (3H), 3,04-3,08 (3H), 7,65-7,69 (2Н), 7,85-7,88 (1Н) Подібно одержували: Приготування 4 N'-[3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(пентафторциклопропіл)-1H-піразол-5-іл]-N,Nдиметилімідоформамід; із сполуки Приготування 35 (46мг, 0,1ммоль) з одержанням вказаної в заголовку сполуки (35мг) у вигляді білої твердої речовини. МС (ES): Μ/Ζ [ΜΗ+] 506,2; очікувана маса для C17H9Cl2F8N5+Η складає 506,0 1 Н-ЯМР (CDCI 3): 2,85-2,87 (3H), 3,07-3,09 (3H), 7,67-7,69 (2Н), 7,69-7,71 (1Н) Приготування 5 N'-{3-ціано-4-(2,2-дихлор-1-фторциклопропіл)-1-[2,6-дихлор-4-(трифторметил)феніл]-1H-піразол-5-іл}N,N-диметилімідоформамід; із сполуки Приготування 34 (42мг, 0,1ммоль) і феніл(трихлорметил)ртуть (40мг, 0,1ммоль) з одержанням вказаної в заголовку сполуки (29мг) у вигляді білої твердої речовини. 1 Н-ЯМР (CDCI 3): 2,31-2,34(1H), 2,35-2,38 (1H), 2,82-2,86 (3H), 3,09-3,13 (3H), 7,66-7,69 (2Н), 7,99-8,03 (1Н) Приготування 6 N'-[3-ціано-1-[2,6-дихлор-4-(пентафтортіо)феніл]-4-(пентафторциклопропіл)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід До розчину Приготування 37 (102мг, 0,20ммоль) в метилбензоаті (4мл) додавали фторид натрію (3мг). Суміш нагрівали до 130°С і триметилсиліл-2,2-дифтор-2-(фторсульфоніл)ацетат (1мл, 0.33ммоль) додавали через 10год. Реакційну суміш концентрували у вакуумі і залишок очищували колонковою хроматографією (силікагель, 10г), елююючи толуолом. Придатні фракції об'єднували і концентрували з одержанням Приготування 6 (75мг) у вигляді блідо-жовтої твердої речовини. МС (ES): Μ/Ζ [МН+] 564,2; очікувана маса для C16H9CI 2F10N5S+Η складає 564,0 1 Н-ЯМР 2,86-2,90 (3H), 3,07-3,10 (3H), 7,69-7,72 (1Н), 7,80-7,85 (2Н) Подібно до Приготування 3 одержували: Приготування 7 N'-[3-ціано-1-[2,6-дихлор-4-(пентафтортіо)феніл]-4-(1,2,2-трифторциклопропіл)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід; із сполуки Приготування 38 (100мг, 0,21ммоль) з одержанням вказаної в заголовку сполуки (90мг) у вигляді білої твердої речовини. МС (ES): Μ/Ζ [ΜΗ+] 527,9; очікувана маса для C16H11CI 2F8N5S+Η складає 528,0 1 Н-ЯМР (CDCI 3): 2,09-2,29 (2Н), 2,82-2,86 (3H), 3,04-3,09 (3H), 7,79-7,83 (2Н), 7,85-7,88 (1Н) Приготування 8 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)вініл]-1Н-піразол-5-іл}-N,Nдиметилімідоформамід До суспензії броміду метилтрифенілфосфонію (8,9г, 25,0ммоль) в тетрагідрофурані (80мл) при -10°С додавали по краплях бутиллітій (1,6М в гексані, 16мл, 25,0ммоль). Суміш перемішували при кімнатній температурі 20хв., перед додаванням Приготування 39 (7,6г, 16,7ммоль) в тетрагідрофурані (16,5мл). Реакційну суміш потім перемішували при кімнатній температурі протягом ночі. До реакційної суміші додавали воду і суміш екстрагували етилацетатом (2´50мл). Об'єднані органічні фази розділяли і концентрували на силікагелі. Суміш силікагель/продукт очищували колонковою хроматографією, елююючи дихлорметаном. Придатні фракції потім об'єднували і концентрували з одержанням Приготування 8 (5,2г). МС (ES): Μ/Ζ [ΜΗ+] 454,0; очікувана маса для C14H12CI 2F5N5+Η складає 452,1 1 Н-ЯМР (CDCI 3): 2,74-2,76 (3H), 2,91-2,94 (3H), 5,77-5,79 (1Н), 5,91-5,94 (1Н), 6,16-6,45 (1Н), 7,62-7,64 (1Н), 7,65-7,68 (2Н) Приготування 9 Етиловий естер 3-ціано-2-оксо-пропіонової кислоти можна одержати відповідно до [Achmatowicz, О., Jr; Szymoniak, J. Tetrahedron (1982), 38(9), 1299-1302] Подібно до Приготування 1 одержували: Приготування 10 N'-{3-ціано-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1-[2,6-дифтор-4-(трифторметил)феніл]-1Нпіразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 40 (250мг, 0,57ммоль) з одержанням вказаної в заголовку сполуки (250мг). МС (ES): M/Z [MH+] 488,1; очікувана маса для C18H11F10N5+Η складає 488,1 Подібно до Приготування 3 одержували: Приготування 11 N'-{3-ціано-1-[2,6-дихлор-4-(пентафтортіофеніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Hпіразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 41 (820 мг, 1,61ммоль) з одержанням вказаної в заголовку сполуки (655мг). МС (ES): Μ/Ζ [ΜΗ+] 559,9; очікувана маса для C17H12Cl2F9N5S+Η складає 560,0 1 Н-ЯМР (CDCI 3): 1,81-1,90 (1Н), 2,03-2,12 (1Н), 2,76-2,79 (3H), 2,99-3,01 (3H), 5,64-5,93 (1Н), 7,78-7,81 (2Н), 7,87-7,89 (1Н) Приготування 12 N'-{4-{1-[хлор(фтор)метил]-2,2-дифторциклопропіл}-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-1Hпіразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 42 (150мг, 0,32ммоль) з одержанням вказаної в заголовку сполуки (100мг). МС (ES): Μ/Ζ [ΜΗ+] 517,9; очікувана маса для C18H12CI 3F6N5+Η складає 518,0 1 Н-ЯМР (CDCI 3): 1,86-1,97 (1Н), 2,05-2,15 (1Н), 2,73-2,80 (3H), 2,95-3,01 (3H), 6,06-6,22 (1Н), 7,63-7,71 (2Н), 7,88-7,94 (1Н) Приготування 13 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]1Н-піразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 43 (200мг, 0,41ммоль) з одержанням вказаної в заголовку сполуки (48мг). МС (ES): M/Z [MH+] 537,8; очікувана маса для C18H10CI 2F9N5+Η складає 538,0 Приготування 14 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропіл]1Н-піразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 44 (28мг, 0,06ммоль) з одержанням вказаної в заголовку сполуки (7мг). МС (ES): Μ/Ζ [ΜΗ+] 555,8; очікувана маса для C18H9CI 2F10N5+Η складає 556,0 1 Н-ЯМР (CDCI 3): 2,79-2,81 (3H), 2,99-3,00 (3H), 7,65-7,67 (1Н), 7,67-7,69 (2Н) Приготування 15 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-5-іл}-N,N-диметилімідоформамід Використовуючи набір DiazaldÒ, розчин DiazaldÒ в діетиловому етері (45мл) додавали по краплях до розчину гідроксиду калію (1М, 89мл) у воді і етанолі (10мл), при приблизно 50°С. Уловлювач охолоджували до -30°С і після додавання всього DiazldÒ, до суміші додавали діетиловий етер (10мл). Дистилювання продовжували до одержання безбарвного дистиляту, розчин діазометану додавали до Приготування 45 (1,0г, 1,92ммоль) в діетиловому етері (30мл). Реакційну суміш потім залишали відстоюватись при кімнатній температурі протягом ночі. Надлишковий діазометан розкладали шляхом додання оцтової кислоти, реакційну суміш залишали випарюватись з одержанням Приготування 15 (1,0г). МС (ES): M/Z [MH+] 536,0; очікувана маса для C18H11CI 2F8N5+Η складає 536,0 Подібно до Приготування 3 одержували: Приготування 16 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]1Н-піразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 47 (650мг, 1,3ммоль) в толуолі з одержанням вказаної в заголовку сполуки (50мг) як суміші продуктів. МС (ES): Μ/Ζ [ΜΗ+] 553,9; очікувана маса для C18H10CI 2F9N5O+Η складає 554,0 Приготування 17 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Hпіразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 48 (3,60г, 7,7ммоль) з одержанням вказаної в заголовку сполуки (3,6г). МС (ES): Μ/Ζ [ΜΗ+] 518,1; очікувана маса для C18H12CI 2F7N5O+Η складає 518,0 1 Н-ЯМР (CDCI 3): 1,82-1,91 (1Н), 2,02-2,11 (1Н), 2,74-2,79 (3H), 2,97-3,00 (3H), 5,64-5,93 (1Н), 7,26-7,31 (2Н), 7,83-7,87 (1Н) Приготування 18 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(фторметил)циклопропіл]-1H-піразол5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 49 (100мг, 0,23ммоль), з одержанням вказаної в заголовку сполуки (100мг). МС (ES): M/Z [MH+] 484,0; очікувана маса для C18H13Cl2F6N5+Η складає 484,1 Приготування 19 N'-[3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(2,2-дифтор-1-метилциклопропіл)-1H-піразол-5-іл]N,N-диметилімідоформамід; із сполуки Приготування 50 (137мг, 0,33ммоль) з одержанням вказаної в заголовку сполуки (80мг). МС (ES): Μ/Ζ [ΜΗ+] 466,0; очікувана маса для C18H14CI 2F5N5+Η складає 466,1 Подібно до Приготування 15 одержували: Приготування 20 N'-{3-ціано-1-{2,6-дихлор-4-[(трифторметил)тіо]феніл}-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 51 (2,50г, 4,6ммоль) з одержанням вказаної в заголовку сполуки (1,8г). МС (ES): Μ/Ζ [ΜΗ+] 552,9; очікувана маса для C18H11CI 2F8N5S+Η складає 552,0 Приготування 21 (2,6-Дифтор-4-трифторметил-феніл)-гідразин Суміш 1,2,3-трифтор-5-(трифторметил)бензолу (300г, 1,5ммоль) і моногідрату гідразину (300г, 6,0ммоль) в етанолі (1200мл) нагрівали при кипінні із зворотним холодильником протягом ночі. Реакційну суміш концентрували у вакуумі і залишок перекристалізовували з 2-пропанолу з одержанням Приготування 21 (194г). МС (ES): M/Z [МН+] 213,2; очікувана маса для C7H5F5N2+Η складає 213,1 1 Н-ЯМР (CDCI 3): 3,81-4,08 (2Н), 5,23-5,41 (1Н), 7,03-7,14 (2Н) Подібно до Приготування 3 одержували: Приготування 22 N'-{1-[3-хлор-5-(трифторметил)піридин-2-іл]-3-ціано-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Hпіразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 52 (800мг, 1,83ммоль) з одержанням вказаної в заголовку сполуки (260мг). МС (ES): M/Z [MH+] 487,2; очікувана маса для C17H11CIF8N6+Η складає 487,1 Приготування 23 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2-дифторциклопропіл]-1Нпіразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 8 (4,52г, 10,0ммоль), з одержанням вказаної в заголовку сполуки (4,0г). МС (ES): Μ/Ζ [ΜΗ+] 501,92; очікувана маса для C18H12CI 2F7N5+Η складає 502,04 1 Н-ЯМР (CDCI 3): 1,82-1,91 (1Н), 2,03-2,11 (1Н), 2,73-2,78 (3H), 2,97-3,01 (3H), 5,66-5,93 (1Н), 7,63-7,69 (2Н), 7,85-7,89 (1Н) Приготування 24 Етил 2,3-диціанопропаноат можна одержати відповідно до [Hainzl, D.; Cole, L. Μ.; Casida, J. E. Chemical Research in Toxicology (1998), 11(12), 1529-1535] Приготування 25 1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-5-{[(1Е)-піридин-4ілметилен]аміно}-1Н-піразол-3-карбонітрил До Прикладу 2а (120мг, 0,26ммоль) і 4А молекулярних сит в толуолі (10мл) додавали ізонікотинальдегід (550мл, 6,71ммоль) і л-толуольсульфонову кислоту (каталітична кількість, 5мг). Реакційну суміш потім нагрівали при кипінні із зворотним холодильником застосовуючи апарат Діна-Старка протягом 9 днів. До реакційної суміші додавали воду і суміш доводили до рівня рН 2 шляхом додання соляної кислоти (4N). Суміш потім нейтралізували шляхом додання насиченого водного розчину карбонату натрію, екстрагували етилацетатом (3´20мл) і об'єднані екстракти сушили (MgSO4) і концентрували у вакуумі з одержанням Приготування 25 (200мг). MC (ES): Μ/Ζ [ΜΗ+] 554,0; очікувана маса для C21H9CI2F8N5+Η складає 554,0 Подібно до Приготування 15 одержували: Приготування 26 N'-{3-ціано-1-[2,6-дихлор-4-(дифторметокси)феніл]-4-[2,2-дифтор-1-(трифторметил)циклопропіл]-1Нпіразол-5-іл}-N,N-диметилімідоформамід; з Приготування 53 (104мг, 0,21ммоль) з одержанням вказаної в заголовку сполуки (110мг). MC (ES): Μ/Ζ [ΜΗ+] 518,0; очікувана маса для C18H12CI 2F7N5O+Η складає 518,0 1 Н-ЯМР (CDCI 3): 2,05-2,21 (1Н), 2,41-2,55 (1Н), 2,77-2,81 (3H), 2,98-3,00 (3H), 6,36-6,72 (1Н), 7,18-7,21 (2Н), 7,22-7,24 (1Н) Подібно до Приготування 3 одержували: Приготування 27 N'-{3-ціано-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропіл]-1Нпіразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 54 (618мг, 1,13ммоль), з одержанням вказаної в заголовку сполуки (138мг). MC (ES): M/Z [МН+] 596,1; очікувана маса для C17H10CI 2F11N5S+Η складає 596,0 1 Н-ЯМР (CDCI 3): 2,78-2,81 (3H), 2,99-3,02 (3H), 5,95-6,24 (1Н), 7,76-7,79 (1Н), 7,79-7,82 (2Н) Приготування 28 2,6-Дихлор-4-дифторметокси-анілін До розчину 4-[(дифторметокси)метил]аніліну (15,0г, 94.3ммоль) в ацетонітрилі (150мл) додавали Nхлорсукцинімід (25,2г, 18,9ммоль) і реакційну суміш перемішували в атмосфері азоту 2год. Реакційну суміш концентрували у вакуумі і залишок розділяли між діетиловим етером (500мл) і водою (125мл). Органічний шар відділяли, промивали водним розчином тіосульфату натрію, водою і насиченим розчином солі, сушили (MgSO4) і оброблювали деревним вугіллям. Розчин потім фільтрували і концентрували у вакуумі. Залишок екстрагували гексаном (2´300мл) і об'єднані екстракти концентрували у вакуумі з одержанням Приготування 28 (13,8г). MC (ES): Μ/Ζ [ΜΗ+] 228, очікувана маса для C7H5CI 2F2NO+Η складає 227,98 Приготування 29 етил 5-аміно-1-[2,6-дифтор-4-(трифторметил)феніл]-1Н-піразол-3-карбоксилат До розчину Приготування 9 (92,6г, 0,66ммоль) в етанолі (2л) додавали Приготування 21 (95,0г, 0,45ммоль) і реакційну суміш нагрівали при кипінні із зворотним холодильником протягом ночі. Реакційну суміш охолоджували і додавали гідрокарбонат натрію (36,0г, 0,43ммоль). Суміш потім нагрівали при кипінні із зворотним холодильником протягом ночі. Реакційну суміш концентрували у вакуумі і до залишку додавали діетиловий етер (1л). Розчин фільтрували, промивали водою, соляною кислотою і ще раз водою, сушили і концентрували у вакуумі. Залишок очищували колонковою хроматографією (силікагель, 70г), елююючи толуолом. Придатні фракції об'єднували і концентрували з одержанням Приготування 29 (40г). МС (ES): M/Z [МН+] 336,1; очікувана маса для С13Н10F5N3О2+Η складає 336,1 Приготування 30 5-Аміно-1-(2,6-дихлор-4-дифторметокси-феніл)-1Н-піразол-3-карбонітрил До сірчаної кислоти (концентрована, 21мл) при 15°С додавали нітрит натрію (4,8г, 69,6ммоль). Після перемішування протягом 1год. додавали холодну оцтову кислоту (17,3мл) з наступним додаванням по краплях Приготування 28 (13,8г, 60,3ммоль) в оцтовій кислоті (33,8мл), підтримуючи температуру суміші нижче 25°С. Розчин нагрівали при 50°С 1год., охолоджували і додавали по краплях до суміші Приготування 24 (10,6г, 69,6ммоль), оцтової кислоти (42,8мл) і суміші лід/вода (55мл) при 0°С. Реакційну суміш потім перемішували при кімнатній температурі протягом ночі. До реакційної суміші додавали дихлорметан (300мл) і суміш перемішували. Два шари розділяли ι органічний шар промивали водою. До органічного шару додавали гідроксид амонію (концентрований, 125мл) і лід, суміш перемішували при 5°С 4год. Органічний шар знову відділяли і перемішували протягом ночі з активованим деревним вугіллям. Суміш фільтрували через CeliteÒ і фільтрат концентрували у вакуумі. Залишок очищували колонковою хроматографією (Biotage, силікагель, 90г), елююючи дихлорметаном. Придатні фракції об'єднували і концентрували з одержанням Приготування 30 (3,1г). МС (ES): M/Z [MH+] 319,0; очікувана маса для C11H6CI 2F2N4O+Η складає 319,0 Н-ЯМР (CDCI 3): 3,60-3,88 (2Н), 6,38-6,75 (1Н), 7,22-7,23 (1Н), 7,27-7,29 (2Н) Приготування 31 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-вініл-1H-піразол-5-іл}-N,N-диметилімідоформамід Розчин Приготування 57 (500мг, 1,44ммоль) в Ν,Ν-диметилформаміддиметилацеталі (6мл) нагрівали при кипінні із зворотним холодильником 1год. Реакційну суміш охолоджували і концентрували у вакуумі. До залишку додавали діетиловий етер (10мл), з наступним додаванням гексану до утворення осаду. Розчин потім концентрували під паром азоту з одержанням неочищеного продукту. Неочищений продукт промивали гексаном і сушили у вакуумі з одержанням Приготування 31 (560мг) у вигляді блідо-жовтої твердої речовини. МС (ES): M/Z [МН+] 402,2; очікувана маса для C16H12CI 2F3N5+Η складає 402,1 1 Н-ЯМР (CDCI 3): 2,81-2,87 (3H), 3,00-3,05 (3H), 5,29-5,36 (1Н), 5,91-6,00 (1Н), 6,35-6,46 (1Н), 7,64-7,67 (1Н), 7,68-7,72 (2Н) Приготування 32 N'-{3-ціано-1-[2,6-дихлор-4-(пентафтортіо)феніл]-4-[1-(трифторметил)вініл]-1Н-піразол-5-іл}-N,Nдиметилімідоформамід Суміш Приготування 58 (4,0г, 7,1ммоль), Приготування 59 (3,0г, 14,0ммоль), водного розчину гідрокарбонату натрію (1М, 40мл), толуолу (100мл) і метанолу (40мл) дегазували і розміщували в атмосферу азоту. До суміші додавали тетракіс(трифенілфосфін)паладій(0) (360мг), реакційну суміш дегазували і нагрівали при кипінні із зворотним холодильником 8год. Реакційну суміш розділяли між водою (50мл) і діетиловим етером (75мл). Два шари розділяли і водний шар повторно екстрагували діетиловим етером (3´50мл). Об'єднані органічні фази сушили (Na2SO4) і концентрували у вакуумі. Залишок очищували застосовуючи картридж lsoluteÔ (силікагель, 25 г) з градієнтним елююванням, етилацетатіциклогексан [1:3 до 1:1]. Придатні фракції об'єднували і концентрували і залишок повторно хроматографували застосовуючи картридж Isolute™ (силікагель, 70г) і елююючи толуолом. Фракції, що містили продукт, концентрували з одержанням Приготування 32 (1,34г) МС (ES) M/Z [MH+] 528,0; очікувана маса для C16H11CI 2F8N5S+Η складає 528,0 1 Н-ЯМР (CDCI 3): 2,74-2,78 (3H), 2,92-2,97 (3H), 5,85-5,89 (1Н), 6,20-6,24 (1Н), 7,63-7,66 (1Н), 7,79-7,82 (2Н) Подібно до Приготування 31 одержували: Приготування 33 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(трифторметил)вініл]-1Н-піразол-5-іл}-N,Nдиметилімідоформамід, із сполуки Приготування 60 (170мг, 0,41ммоль), з одержанням вказаної в заголовку сполуки (140 мг) у вигляді білої твердої речовини. МС (ES): M/Z [MH+] 470,2; очікувана маса для C14H11CI 2F6N5+Η складає 470,0 1 Н-ЯМР (CDCI 3): 2,76-2,80 (3H), 2,96-3,00 (3H), 5,90-5,92 (1Н), 6,23-6,26 (1Н), 7,66-7,68 (1Н), 7,69-7,72 (2Н) 54 Приготування 34 N'-[3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(1-фторвініл)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід До розчину Приготування 62 (2,9г, 5,7ммоль) і Приготування 61 (2,5г, 7,5ммоль) в N,Nдиметилформаміді (50мл), в атмосфері азоту, додавали тетракіс(трифенілфосфін)паладій(0) (330мг, 0,3ммоль). Реакційну суміш потім нагрівали при 80°С 4год. До реакційної суміші додавали воду (150мл) і суміш екстрагували етилацетатом (150мл). Об'єднані екстракти промивали водою (2´100мл) і насиченим розчином солі (100мл), сушили (MgSO4) і концентрували у вакуумі. Залишок розтирали з гексаном і осад збирали фільтрацією, сушили з одержанням Приготування 34 (2,35г) у вигляді коричневої твердої речовини. 1 Н-ЯМР (CDCI 3): 2,76-2,78 (3H), 2,99-3,01 (3H), 4,92-5,10 (2Н), 7,66-7,68 (2Н), 7,70-7,73 (1Н) Приготування 35 N'-[3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(трифторвініл)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід До суспензії дихлорбіс(трифенілфосфін)паладію II (70мг) в тетрагідрофурані (2мл) додавали гідрид диізобутилалюмінію (1,5М в толуолі, 133мл). До цього розчину додавали бромфторетилен (200ммоль) з наступним додаванням Приготування 64 (1.0ммоль), реакційну суміш нагрівали при кипінні із зворотним холодильником в атмосфері азоту протягом ночі. Реакційну суміш розділяли між етилацетатом (50мл) і водою, органічну фазу відділяли, промивали насиченим розчином солі, сушили (MgSO4) і концентрували у вакуумі. Залишок очищували із використанням колонки IsoluteÔ (силікагель, 20г), елююючи дихлорметаном. Придатні фракції об'єднували і концентрували, залишок розчиняли в гексані. Одержаний осад відділяли і сушили з одержанням Приготування 35 (200мг) у вигляді кристалічної твердої речовини. МС (ES): M/Z [MH+] 456,2; очікувана маса для C16H9CI 2F6N5+Η складає 456,0 1 Н-ЯМР (CDCI 3): 2,77-2,80 (3H), 3,02-3,05 (3H), 7,67-7,69 (2Н), 7,74-7,77 (1Н) Приготування 36 2,6-дихлор-4-трифторметилтіо-анілін До розчину Приготування 97 (4,8г, 25.0ммоль) в ацетонітрилі (50мл) при 50°С додавали Nхлорсукцинімід (6,7г, 50,0ммоль). Реакційну суміш потім перемішували при 50°С 1год. До реакційної суміші додавали воду (150мл) і суміш екстрагували дихлорметаном (100мл). Об'єднані екстракти сушили (MgSO4) і концентрували у вакуумі з одержанням Приготування 36 (1,0г). Приготування 37 N'-[3-ціано-1-[2,6-дихлор-4-(пентафтортіо)феніл]-4-(трифторвініл)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід Суспензію цинку RiekeÔ в тетрагідрофурані (5%, 26мл, 20ммоль) перемішували в атмосфері азоту. Атмосферу азоту заміщували бромтрифторетиленом (прибл 40ммоль) і розчин перемішували додаткові 1 3год. Азот пропускали через розчин і залишали відстоюватись надлишковий цинк, залишаючи розчин надосадової рідини бажаного цинкового реагенту. До розчину Приготування 58 (2,24г, 4,0ммоль) і тетракіс(трифенілфосфін)паладію(0) (231мг) в тетрагідрофурані (5мл) додавали розчин цинкового реагенту (12мл, прибл. 5,0ммоль). Реакційну суміш потім нагрівали при кипінні із зворотним холодильником в атмосфері азоту 5год. До реакційної суміші додавали надлишок водного розчину оцтової кислоти (розведеної) ι суміш екстрагували дихлорметаном (150мл). Екстракти промивали насиченим розчином солі, сушили (MgSO4) і концентрували у вакуумі. Залишок очищували із застосуванням колонки IsoluteÔ (силікагель, 50г), елююючи толуолом. Придатні фракції об'єднували і концентрували з одержанням Приготування 37 (913мг). МС (ES): M/Z [MH+] 514,2; очікувана маса для C15H9CI 2F8N5S+Η складає 514,0 1 Н-ЯМР (CDCI 3): 2,79-2,82 (3H), 3,03-3,06 (3H), 7,75-7,77 (1Н), 7,80-7,83 (2Н) Подібно до Приготування 34 одержували: Приготування 38 N'-[3-ціано-1-[2,6-дихлор-4-пентафтортіофеніл]-4-(1-фторвініл)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід; із сполук Приготування 58 (380мг, 0,68ммоль) і Приготування 61 (295мг, 0,88ммоль) з одержанням вказаної в заголовку сполуки (85мг). МС (ES): M/Z [MH+] 477,9; очікувана маса для C15H11CI 2F6N5S+Η складає 478,0 1 Н-ЯМР (CDCI 3). 2,77-2,81 (3H), 2,99-3,03 (3H), 4,92-5,09 (2Н), 7,70-7,73 (1Н), 7,79-7,82 (2Н) Приготування 39 N'-[3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(дифторацетил)-1H-піразол-5-іл]-N,Nдиметилімідоформамід До розчину Приготування 62 (12,5г, 25,0ммоль) в тетрагідрофурані (50мл) при -30°С додавали по краплях хлорид ізопропілмагнію (2М в тетрагідрофурані, 13,75мл, 27,5ммоль). Реакційну суміш перемішували при -30°С 30хв перед додаванням хлориду дифтороцтової кислоти (2М в тетрагідрофурані, 18,75, 37,5ммоль). Реакційну суміш залишали нагрітись до кімнатної температури. До реакційної суміші додавали насичений водний розчин гідрокарбонату натрію і суміш екстрагували етилацетатом (´3). Об'єднані органічні фази промивали насиченим розчином хлориду натрію, сушили (MgSO4) і концентрували у вакуумі. Залишок перекристалізовували з діетиловим етером шляхом додання петролейного етеру з одержанням Приготування 39 (7,6г). 1 Н-ЯМР (CDCI 3): 2,78-2,82 (3H), 3,08-3,12 (3H), 6,41-6,69 (1Н), 7,67-7,71 (2Н), 8,49-8,52 (1Н) Приготування 40 N'-{3-ціано-1-[2,6-дифтор-4-(трифторметил)феніл]-4-[1-(трифторметил)вініл]-1Н-піразол-5-іл}-N,Nдиметилімідоформамід До Приготування 66 (2,0г, 4,26ммоль) і тетракіс(трифенілфосфін)паладію(0) (246мг, 0,21ммоль) в N,Nдиметилформаміді (70мл) додавали розчин Приготування 65 в тетрагідрофурані (15,75мл, 6,3ммоль). Реакційну суміш потім нагрівали при 110°С протягом ночі в апараті, оснащеному уловлювачем Діна-Старка. Реакційну суміш концентрували у вакуумі і залишок очищували флеш-хроматографією (силікагель), елююючи толуолом. Придатні фракції об'єднували і концентрували з одержанням Приготування 40 (1,5г). МС (ES): M/Z [MH+] 438,0; очікувана маса для C17H11F8N5+Η складає 438,1 1 Н-ЯМР (CDCI 3): 2,78-2,81 (3H), 2,95-2,99 (3H), 5,84-5,87 (1Н), 6,20-6,23 (1Н), 7,28-7,33 (2Н), 7,64-7,68 (1Н) Приготування 41 N'-{3-ціано-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[1-(дифторметил)вініл]-1Н-піразол-5-іл}-N,Nдиметилімідоформамід До розчину броміду метилтрифенілфосфонію (1,80г, 5,05ммоль) в тетрагідрофурані (20мл) при 0°С додавали н-бутиллітій (1,6Ν в гексані, 3,2мл, 5,05ммоль) через шприц. Після перемішування 15хв. додавали Приготування 67 (1,72г, 3,37ммоль) в тетрагідрофурані (10мл) і реакційну суміш перемішували при кімнатній температурі 2,5год. До реакційної суміші додавали воду (50мл) і суміш екстрагували етилацетатом (3´30мл). Об'єднані органічні фази сушили (MgSO4) і концентрували у вакуумі. Залишок очищували колонковою хроматографією (силікагель) з градієнтним елююванням, етилацетат: гексан [1:4 до 1:2]. Придатні фракції об'єднували і концентрували з одержанням Приготування 41 (1,40г). МС (ES): M/Z [MH+] 509,9; очікувана маса для C16H12CI 2F7N5S+Η складає 510,0 1 Н-ЯМР (CDCI 3): 2,75-2,78 (3H), 2,91-2,95 (3H), 5,76-5,78 (1H), 5,91-5,94 (1H), 6,14-6,43 (1H), 7,63-7,65 (1H), 7,79-7,82 (2Η) Подібно до Приготування 41 одержували: Приготування 42 N'-{4-{1-[хлор(фтор)метил]вініл}-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-1H-піразол-5-іл}-N,Nдиметилімідоформамід; із сполуки Приготування 68 (800мг, 1,70ммоль) з одержанням вказаної в заголовку сполуки (800мг) МС (ES): Μ/Ζ [ΜΗ+] 468,1; очікувана маса для C17H12CI 3F4N5+Η складає 468,0 1 Н-ЯМР (CDCI 3): 2,75-2,78 (3H), 2,91-2,94 (3H), 5,67-5,70 (1Н), 5,91-5,95 (1Н), 6,72-6,86 (1Н), 7,65-7,68 (2Н), 7,70-7,73 (1Н) Приготування 43 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(дифторметил)-2,2-дифторвініл]-1H-піразол-5-іл}N,N-диметилімідоформамід До розчину трифенілфосфіну (524мг, 2,0ммоль) в N,N-диметилформаміді (5мл) в атмосфері азоту додавали дибромдифторметан (420мг, 2,0ммоль). Суміш перемішували при кімнатній температурі 30хв., перед додаванням Приготування 39 (454мг, 1,0ммоль) в N,N-диметилформаміді (1мл). До суміші додавали цинк RiekeÒ (130мг, 2,0ммоль) і реакційну суміш перемішували 1год. Реакційну суміш концентрували у вакуумі і залишок очищували флеш-хроматографією (силікагель), елююючи дихлорметаном. Придатні фракції об'єднували і концентрували з одержанням Приготування 43 (410мг). МС (ES): M/Z [МН+] 487,8; очікувана маса для C17H10CI 2F7N5+Η складає 488,0 1 Н-ЯМР (CDCI 3): 2,74-2,77 (3H), 2,95-2,98 (3H), 6,43-6,72 (1Н), 7,66-7,68 (2Н), 7,69-7,70 (1Н) Приготування 44 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[2,2-дифтор-1-(трифторметил)вініл]-1Н-піразол-5іл}-N,N-диметилімідоформамід Суспензію цинку RiekeÒ в тетрагідрофурані (15,6мл, 12.0ммоль) залишали відстоюватись і видаляли тетрагідрофуран настільки, накільки це було можливо До цинку RiekeÒ потім додавали сухий N,Nдиметилформамід (25мл) і розчин перемішували в атмосфері азоту. 2-Бромпентафторпропен (1,05г, 5,0ммоль) конденсували в охолоджений носій в атмосфері азоту, повільно додавали до розчину цинку через шприц Реакційну суміш потім перемішували при кімнатній температурі 12год. До Приготування 62 (1,04г, 2,0ммоль) і тетракіс(трифенілфосфін)паладію(0) (120мг) в атмосфері азоту додавали розчин цинкового реагенту в N,N-диметилформаміді (12мл, прибл. 4,0ммоль). Реакційну суміш перемішували при 90°С 3год. і потім при 100°С 6год. Реакційну суміш розділяли між етилацетатом і розведеною соляною кислотою. Органічний шар відділяли, сушили (MgSO4) і концентрували у вакуумі. Залишок очищували із застосуванням колонки IsoluteÔ (силікагель, 50г), елююючи толуолом. Фракції, що містили продукт, концентрували і залишок розчиняли в суміші ацетонітрил/вода/диметилсульфоксид (12:1:3, 1,6мл). Цей розчин додатково очищували автоматизованою препаративною рідинною хроматографією (Gilson system, 150´30мм Luna C18 5мк колонка) застосовуючи градієнт ацетонітрил:вода [65:35 до 95:5]. Придатні фракції концентрували у вакуумі з одержанням Приготування 44 (28мг). МС (ES): M/Z [МН+] 506,0; очікувана маса для C17H9CI 2F8N5+Η складає 506,0 1 Н-ЯМР (CDCI 3): 2,74-2,81 (3H), 2,96-3,02 (3H), 7,62-7,66 (1Н), 7,66-7,71 (2Н) Приготування 45 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[2,2-дифтор-1-(трифторметил)вініл]-1Н-піразол-5іл}-N,N-диметилімідоформамід До розчину Приготування 71 (6,7г, 13,7ммоль) в N,Ν-диметилформаміді (60мл) додавали трифенілфосфін (21,6г, 82,3ммоль) і дибромдифторметан (8,6г, 41,2ммоль). Реакційну суміш потім перемішували в атмосфері азоту при кімнатній температурі 5 днів. Реакційну суміш концентрували у вакуумі і залишок очищували флеш-хроматографією (силікагель), з градієнтним елююванням, толуол:дихлорметан [1:0 до 1:2]. Придатні фракції об'єднували і концентрували з одержанням Приготування 45 (2,8г). МС (ES): M/Z [MH+] 522,0; очікувана маса для C17H9CI 2F8N5O+Η складає 522,0 Приготування 46 Етил 2,3-диціанопропаноат До розчину етилціаноацетату (916,0г, 8,10 моль) в N,N-диметилформаміді (2,5л) повільно додавали гліконітрил (700,0г, 6,75 моль) у воді (55% розчин). До суміші додавали карбонат калію (932,7г, 6,75 моль) через 1,5год., слідкуючи, щоб температура реакції не перевищувала 30°С. Реакційну суміш потім перемішували при кімнатній температурі протягом ночі. Реакційну суміш фільтрували і фільтрат доводили до рівня рН 3 шляхом додання кислоти. Органічну фазу відділяли і частково концентрували у вакуумі. До концентрату додавали діетиловий етер (1л) і розчин промивали водою (5´1л), сушили (MgSO4) і концентрували увакуумі з одержанням Приготування 46 (803г). 1 Н-ЯМР (CDCI 3): 1,28-1,34 (3H), 2,95-3,01 (2Н), 3,84-3,89 (1Н), 4,27-4,33 (2Н) Подібно до Приготування 43 одержували Приготування 47 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[1-(дифторметил)-2,2-дифторвініл]-1H-піразол-5іл}-N,N-диметилімідоформамід; із сполуки Приготування 72 (1,1г, 2,3ммоль) з одержанням вказаної в заголовку сполуки (650мг). 1 Н-ЯМР (CDCI 3): 2,74-2,78 (3H), 2,93-2,98 (3H), 6,42-6,71 (1Н), 7,28-7,31 (2Н), 7,65-7,69 (1Н) Приготування 48 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-[1-(дифторметил)вініл]-1H-піразол-5-іл}-N,Nдиметилімідоформамід Суміш трет-бутоксид калію (1М розчин, 11,7мл, 11,7ммоль) і броміду метилтрифенілфосфонію (3,91г, 14,0ммоль) в циклогексані (50мл) перемішували при 50°С 45хв. і потім охолоджували до 10°С. Розчин Приготування 72 (4,40г, 9,36ммоль) в дихлорметані (20мл) додавали і реакційну суміш залишали нагрітись до кімнатної температури. Реакційну суміш концентрували у вакуумі і залишок очищували флешхроматографією (силікагель) з градієнтним елююванням, толуол:дихлорметан [1:0 до 0:1]. Придатні фракції об'єднували і концентрували з одержанням Приготування 48 (3,6г). МС (ES): M/Z [MH+] 468,0; очікувана маса для C17H12CI 2F5N5O+Η складає 468,0 1 Н-ЯМР (CDCI 3): 2,74-2,78 (3H), 2,90-2,95 (3H), 5,76-5,80 (1Н), 5,89-5,93 (1Н), 6,16-6,46 (1Н), 7,27-7,31 (2Н), 7,58-7,62 (1Н) Одержували подібним чином: Приготування 49 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(фторметил)вініл]-1H-піразол-5-іл}-N,Nдиметилімідоформамід; із сполуки Приготування 73 (370мг, 0,85ммоль) з одержанням вказаної в заголовку сполуки (242мг). МС (ES): M/Z [MH+] 434,0; очікувана маса для C17H13CI 2F4N5+Η складає 434,1 1 Н-ЯМР (CDCI 3): 2,78-2,81 (3H), 2,92-2,95 (3H), 4,95-4,98 (1Н), 5,07-5,10 (1Н), 5,61-5,64 (2Н), 7,61-7,64 (1Н), 7,65-7,68 (2Н) Приготування 50 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-ізопропеніл-1H-піразол-5-іл}-N,Nдиметилімідоформамід До розчину хлориду тетрабутиламонію (204мг, 0,69ммоль) в ацетонітрилі (7мл) додавали молекулярні сита (4Å, 3,0г). Через 30хв. розчин відфільтровували і додавали до Приготування 74 (100мг, 0,23ммоль). Цю суміш охолоджували до -10°С і тіонілхлорид (33,5мл, 0,46ммоль) додавали по краплях. Після перемішування 15хв. додавали метилмеркаптид натрію (32мг, 0,46ммоль) і реакційну суміш залишали нагрітись до кімнатної температури протягом ночі. Реакційну суміш концентрували у вакуумі і до залишку додавали дихлорметан (50мл). Розчин промивали водою (3´35мл), сушили (MgSO4) і концентрували у вакуумі. Залишок пропускали через прокладку з силікагелем, елююючи дихлорметаном. Фільтрат концентрували у вакуумі з одержанням Приготування 50 (137мг). МС (ES): M/Z [МН+] 416,0; очікувана маса для C17H14CI 2F3N5+Η складає 416,1 1 Н-ЯМР (CDCI 3): 2,01-2,03 (3H), 2,76-2,78 (3H), 2,93-2,97 (3H), 5,20-5,22 (1Н), 5,30-5,33 (1Н), 7,59-7,60 (1Н), 7,64-7,67 (2Н) Подібно до Приготування 43 одержували: Приготування 51 N'-{3-ціано-1-{2,6-дихлор-4-[(трифторметил)тіо]феніл}-4-[2,2-дифтор-1-(трифторметил)вініл]-1H-піразол5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 75 (6,50г, 12,9ммоль) з одержанням вказаної в заголовку сполуки (2,5г). МС (ES): M/Z [MH+] 537,9; очікувана маса для C17H9Cl2F8N5S+Η складає 538,0 1 Н-ЯМР (CDCI 3): 2,74-2,77 (3H), 2,96-2,99 (3H), 7,60-7,63 (1Н), 7,68-7,72 (2Н) Подібно до Приготування 48 одержували: Приготування 52 N'-{1-[3-хлор-5-(трифторметил)піридин-2-іл]-3-ціано-4-[1-(трифторметил)вініл]-1H-піразол-5-іл}-N,Nдиметилімідоформамід; із сполуки Приготування 76 (1,00г, 2.3ммоль) з одержанням вказаної в заголовку сполуки (820мг). МС (ES): M/Z [MH+] 437,0; очікувана маса для C16H11CIF6N6+Η складає 437,1 1 Н-ЯМР (CDCI 3): 2,89-2,91 (3H), 2,98-3,01 (3H), 5,96-5,98 (1Н), 6,26-6,28 (1Н), 7,65-7,68 (1Н), 8,14-8,16 (1Н), 8,69-8,71 (1Н) Подібно до Приготування 43 одержували: Приготування 53 N'-{3-ціано-1-[2,6-дихлор-4-(дифторметокси)феніл]-4-[2,2-дифтор-1-(трифторметил)вініл]-1Н-піразол-5іл}-N,N-диметилімідоформамід; із сполуки Приготування 77 (425мг, 0,9ммоль) з одержанням вказаної в заголовку сполуки (107мг). МС (ES): M/Z [MH+] 504,0; очікувана маса для C17H10CI 2F7N5O+Η складає 504,0 1 Н-ЯМР (CDCI 3): 2,77-2,80 (3H), 2,96-2,99 (3H), 6,36-6,72 (1Н), 7,20-7,22 (2Н), 7,58-7,60 (1H) Приготування 54 N'-{3-ціано-1-[2,6-дихлор-4-пентафтортіофеніл]-4-[1-(дифторметил)-2,2-дифторвініл]-1H-піразол-5-іл}N,N-диметилімідоформамід; із сполуки Приготування 67 (1,02г, 2,0ммоль) з одержанням вказаної в заголовку сполуки (612мг). МС (ES): Μ/Ζ [ΜΗ+] 546,1; очікувана маса для C16H10CI 2F9N5S+Η складає 546,0 Подібно до Приготування 3 одержували: Приготування 55 N'-{4-{1-[хлор(дифтор)метил]-2,2-дифторциклопропіл}-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]1Н-піразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 78 (100мг, 0,2ммоль) з одержанням вказаної в заголовку сполуки (124мг). МС (ES): Μ/Ζ [ΜΗ+] 535,9; очікувана маса для C18H11CI 3F7N5+Η складає 536,0 Приготування 56 5-аміно-1-[2,6-дифтор-4-(трифторметил)феніл]-1Н-піразол-3-карбоксамід Суміш Приготування 29 (600мг, 1,79ммоль), метанол (5мл) і гідроксид амонію (5мл) нагрівали при 50°С 5год. Реакційну суміш концентрували у вакуумі і залишок очищували колонковою хроматографією (силікагель), елююючи сумішшю дихлорметаном/етилацетат [1:1]. Придатні фракції об'єднували і концентрували з одержанням вказаної в заголовку сполуки (210мг). МС (ES): Μ/Ζ [МН+] 307,1; очікувана маса для C11H7F5N4O+Η складає 307,06 1 Н-ЯМР (CD3OD): 5,93-5,95 (1H), 7,58-7,64 (2Н) Приготування 57 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-вініл-1H-піразол-3-карбонітрил можна одержати відповідно до [ЕР933363 А1, WO9824767, або WO9804530 Подібно до Приготування 31 одержували: Приготування 58 N'-{3-ціано-1-[2,6-дихлор-4-(пентафтортіо)феніл]-4-йод-1Н-піразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 79 (52г, 103ммоль) з одержанням вказаної в заголовку сполуки (45г) у вигляді світлокоричневої твердої речовини. 1 Н-ЯМР (CDCI 3): 2,77-2,81 (3H), 3,02-3,05 (3H), 7,78-7,81 (2Н), 8,21-8,24 (1Н) Приготування 59 1-(трифторметил)вінілборна кислота До магнієвих стружок (5,83г, 0,24моль) в тетрагідрофурані (400мл) додавали по краплях триметилборат (68,13мл, 0,6моль). Реакційну суміш охолоджували до 0°С і 2-бром-3,3,3-трифторпропен (20,75мл, 0,2моль) додавали по краплях. Реакційну суміш залишали нагрітись до кімнатної температури і перемішували в атмосфері азоту протягом ночі. Реакційну суміш знову охолоджували до 0°С і соляну кислоту (5М, 200мл) додавали по краплях, слідкуючи за тим, щоб температура розчину залишалась нижче 10°С. Реакційну суміш потім перемішували в атмосфері азоту на 48год. До реакційної суміші додавали діетиловий етер (100мл) і воду (200мл) з одержанням двох фаз. Водний шар відділяли і екстрагували діетиловим етером (100мл). Об'єднані органічні фази промивали водою (100мл), сушили (MgSO4) і концентрували у вакуумі. До залишку додавали циклогексан (50мл), що викликало випадіння осаду. Осад відділяли фільтруванням розчину, промивали циклогексаном і сушили in vacuo з одержанням Приготування 59 (2,62г, 0,02моль) у вигляді білої твердої речовини. 1 Н-ЯМР (ДМСО): 5,50-5,57 (1Н), 5,80-5,88 (1Н), 6,22-6,36 (2Н) Приготування 60 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-[1-(трифторметил)вініл]-1Н-піразол-3-карбонітрил До суміші Приготування 82 (223мг, 0,5ммоль) і Приготування 59 (212мг, 1,0ммоль) в атмосфері азоту додавали дегазований розчин тетракіс(трифенілфосфін)паладію(0) (2 мольних %, 23мг) в толуолі (10мл) і метанолі (2мл). До цієї суміші додавали водний розчин карбонату натрію (1М, 2мл) і двофазну реакційну суміш нагрівали в атмосфері азоту при 85°С 22год. Реакційну суміш охолоджували, розводили діетиловим етером і органічний шар відділяли. Його потім промивали водою (2´5мл), сушили (MgSO4) і концентрували під паром азоту. Залишок очищували застосовуючи картридж IsoluteÔ (силікагель, 10г) з градієнтним елююванням, циклогексан:дихлорметан [3:2 до 1:1]. Придатні фракції об'єднували і концентрували з одержанням Приготування 60 (138мг). МС (ES): M/Z [MH+] 415,1; очікувана маса для C14H6CI 2F6N4+Η складає 415,0 1 Н-ЯМР (CDCI 3): 3,90-3,98 (2Н), 5,96-5,99 (1Н), 6,25-6,28 (1Н), 7,80-7,82 (2Н) Приготування 61 трибутил(1-фторвініл)станан До розчину Приготування 83 (4,7г, 19,4ммоль) в сухому N,N-диметилформаміді (50мл) в атмосфері азоту додавали біс(трибутилtin)оксид (6мл, 11,7ммоль) і фторид цезію (500мг, 1,94ммоль). Реакційну суміш потім перемішували протягом ночі при кімнатній температурі. Реакційну суміш розводили водою (100мл) і екстрагували сумішшю гексану і діетилового етеру (3:1, 150мл). Екстракти промивали водою (2´50мл) і насиченим розчином солі (50мл), сушили (MgSO4) і концентрували у вакуумі з одержанням Приготування 61 (5,1г) у вигляді безбарвного масла. 1 Н-ЯМР (CDCI 3): 0,85-0,89 (9Н), 0,91-1,06 (6Н), 1,27-1,35 (7Н), 1,40-1,63 (6Н), 4,41-4,64 (1Н), 5,14-5,43 (1Н) Подібно до Приготування 31 одержували: Приготування 62 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-йод-1H-піразол-5-іл}-N,N-диметилімідоформамід, із сполуки Приготування 82 (0,5г, 1,12ммоль з одержанням вказаної в заголовку сполуки у вигляді жовтої кристалічної твердої речовини. МС (ES): M/Z [MH+] 502,1; очікувана маса для C14H9CI 2F3IN5+Η складає 501,9 1 Н-ЯМР (CDCI 3): 2,78-2,82 (3H), 3,03-3,08 (3H), 7,67-7,71 (2Н), 8,23-8,27 (1Н) Приготування 63 N'-{3-ціано-1-[2,6-дихлор-4-(дифторметокси)феніл]-1H-піразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 30 (3,1г, 9,7ммоль) з одержанням вказаної в заголовку сполуки (3,5г) МС (ES): M/Z [MH+] 374,0; очікувана маса для C14H11CI 2F2N4O+Η складає 374,0 1 Н-ЯМР (CDCI 3): 2,76-2,80 (3H), 2,99-3,03 (3H), 6,14-6,17 (1Н), 6,35-6,72 (1Н), 7,11-7,15 (1Н), 7,21-7,24 (1Н), 7,70-7,73 (1Н) Приготування 64 (3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-5-{[(1E)-(диметиламіно)метилен]аміно}-1H-піразол-4іл)(йод)цинк До розчину Приготування 62 (5,02г, 10,0ммоль) в тетрагідрофурані (24мл) в атмосфері азоту додавали цинк RiekeÒ (1,31г, 20,0ммоль) у вигляді суспензії в тетрагідрофурані (26мл). Реакційну суміш потім перемішували протягом ночі при кімнатній температурі. Надлишок цинку залишали відстоюватись і розчин, який містив Приготування 64 (0,2моль на літр), застосовували безпосередньо у наступній стадії. Приготування 65 До розчину цинку RiekeÒ (5% в тетрагідрофурані, 7,8г, 157мл, 120,0ммоль) в тетрапдрофурані (43мл) в атмосфері азоту додавали 2-бром-3,3,3-трифторпроп-1-ен (14,0г, 80,0ммоль). Реакційну суміш перемішували протягом ночі і розчин Приготування 65 використовували без подальшого очищення. Подібно до Приготування 31 одержували: Приготування 66 N'-{3-ціано-1-[2,6-дифтор-4-(трифторметил)феніл]-4-йод-1H-піразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 84 (2,2г, 5,3ммоль) з одержанням вказаної в заголовку сполуки (2,3г). 1 Н-ЯМР (CDCI 3): 2,79-2,82 (3H), 3,03-3,06 (3H), 7,27-7,33 (2Н), 8,22-8,25 (1Н) Подібно до Приготування 39 одержували: Приготування 67 N'-[3-ціано-1-[2,6-дихлор-4-пентафтортіофеніл]-4-(дифторацетил)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід; із сполуки Приготування 58 (2,50г, 4,47ммоль) ізопропілмагній (1,72г). МС (ES): M/Z [MH+] 511,8; очікувана маса для С15Н10СІ 2F7N5О8+Η складає 512,0 1 Н-ЯМР (CDCI 3): 2,81-2,83 (3H), 3,09-3,13 (3H), 6,41-6,69 (1Н), 7,82-7,85 (2Н), 8,51-8,54 (1Н) Приготування 68 N'-{4-[хлор(фтор)ацетил]-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-1H-піразол-5-іл}-N,Nдиметилімідоформамід; із сполуки Приготування 62 (1,0г, 1,99ммоль) ізопропілмагній (800мг). МС (ES): M/Z [МН+] 470,0; очікувана маса для C16H10CI 3F4N5O+Η складає 470,0 1 Н-ЯМР (CDCI 3): 2,79-2,84 (3H), 3,07-3,12 (3H), 7,20-7,24 (1Н), 7,67-7,71 (2Н), 8,45-8,48 (1Н) Приготування 69 5-Аміно-1-(3-хлор-5-трифторметил-піридин-2-іл)-1Н-піразол-3-карбонітрил можна одержати відповідно до [ЕР 500209]. Приготування 70 5-аміно-1-{2,6-дихлор-4-[(трифторметил)тіо]феніл}-1H-піразол-3-карбонітрил Нітрит натрію (224мг, 3,25ммоль) обережно додавали сірчаної кислоти (концентрована, 1мл), спостерігаючи, щоб температура не перевищувала 30°С. Після перемішування при 15°С 1год., додавали оцтову кислоту (2мл) з наступним додаванням Приготування 36 (850мг, 3,24ммоль) в оцтовій кислоті (3мл). Реакційну суміш потім нагрівали при 50°С 1год. і охолоджували до кімнатної температури. До розчину Приготування 24 (500мг, 3,29ммоль) в оцтовій кислоті (5мл) додавали крижану воду (5мл) з наступним додаванням розчину солі діазонію, яку додавали по краплях при 0°С. Після завершення додавання, додавали гідроксид амонію (6мл) і реакційну суміш перемішували протягом ночі при кімнатній температурі. Реакційну суміш фільтрували через ArbocelÒ і фільтрат концентрували у вакуумі. Залишок розділяли між дихлорметаном і водою, органічну фазу відділяли, сушили (Na2SO4) і концентрували у вакуумі з одержанням Приготування 70 (1,0г). МС (ES): M/Z [MH+] 353,0; очікувана маса для C11H5CI 2F3N4S+Η складає 353,0 1 Н-ЯМР (CDCI 3): 6,01-6,03 (1H), 7,75-7,78 (2Н) Приготування 71 N'-[3-ціано-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-(трифторацетил)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід До розчину Приготування 87 (6,0г, 15,3ммоль) в піридині (75мл) додавали по краплях ангідрид трифтороцтової кислоти (4,32мл, 6,4г, 30,6ммоль). Реакційну суміш потім перемішували при кімнатній температурі в атмосфері азоту протягом ночі. Реакційну суміш концентрували у вакуумі і залишок очищували флеш-хроматографією (силікагель), елююючи толуолом. Придатні фракції об'єднували і концентрували з одержанням суміші продукту з захистом і без захисту. До залишку додавали дихлорметан з наступним додаванням N,N-диметилформаміддиметилацеталю (5мл). Суміш перемішували протягом ночі при кімнатній температурі і потім концентрували у вакуумі з одержанням Приготування 71 (6,7г). МС (ES): Μ/Ζ [МН+] 488,0; очікувана маса для C16H9CI 2F6N5O2+Η складає 488,0 1 Н-ЯМР (CDCI 3): 2,80-2,84 (3H), 3,09-3,13 (3H), 7,30-7,33 (2Н), 8,30-8,34 (1Н) Подібно до Приготування 39 одержували: Приготування 72 N'-[3-ціано-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-(дифторацетил)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід; із сполуки Приготування 89 (6,20г, 12,0ммоль) ізопропілмагній (4,4г). МС (ES): Μ/Ζ [ΜΗ+] 470,0; очікувана маса для C16H10Cl2F5N5O2+Η складає 470,0 1 Н-ЯМР (CDCI 3): 2,79-2,83 (3H), 3,08-3,12 (3H), 6,41-6,69 (1Н), 7,30-7,33 (2Н), 8,46-8,49 (1Н) Приготування 73 N'-[3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(фторацетил)-1H-піразол-5-іл]-N,Nдиметилімідоформамід До Приготування 91 (550мг, 1,44ммоль) в дихлорметані (10мл) додавали Ν,Νдиметилформаміддиметилацеталь (190мг, 1,59ммоль) і реакційну суміш перемішували при 35°С 1год. Реакційну суміш концентрували у вакуумі і залишок пропускали через прокладку з силікагелем, елююючи дихлорметаном. Фільтрат концентрували у вакуумі з одержанням Приготування 73 (370мг). 1 Н-ЯМР (CDCI 3): 2,77-2,79 (3H), 3,08-3,11 (3H), 5,43-5,46 (1Н), 5,55-5,57 (1Н), 7,67-7,70 (2Н), 8,63-8,66 (1Н) Приготування 74 N'-[3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-4-(1-гідрокси-1-метилетил)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід До розчину Приготування 62 (1,0г, 2,0ммоль) в тетрагідрофурані (15мл) при -30°С і в атмосфері азоту додавали по краплях хлорид ізопропілмагнію (2М в тетрагідрофурані, 1,2мл, 2,4ммоль). Після перемішування 1год. ацетон (5мл) додавали через шприц і реакційну суміш залишали нагрітись до кімнатної температури. До реакційної суміші додавали воду (7мл) і твердий карбонат натрію (приблизно 20г). Суміш перемішували 15хв., фільтрували і залишок промивали дихлорметаном. Органічну фазу потім відділяли, сушили і концентрували у вакуумі. Залишок пропускали через прокладку з силікагелем, елююючи дихлорметаном, потім діетиловим етером. Фільтрат концентрували у вакуумі з одержанням вказаної в заголовку сполуки (280мг). МС (ES): M/Z [МН+] 434,0; очікувана маса для C17H16CI 2F3N5O+Η складає 434,1 1 Н-ЯМР (CDCI 3): 1,65-1,69 (6Н), 2,79-2,82 (3H), 2,85-2,88 (3H), 3,36-3,41 (1Н), 7,40-7,42 (1Н), 7,65-7,69 (2Н) Приготування 75 N'-[3-ціано-1-{2,6-дихлор-4-[(трифторметил)тіо]феніл}-4-(трифторацетил)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід До розчину Приготування 92 (8,50г, 20,8ммоль) в безводному піридині (100мл) додавали по краплях ангідрид трифтороцтової кислоти (8,75г, 41,6ммоль). Реакційну суміш потім перемішували протягом ночі при кімнатній температурі. Реакційну суміш концентрували у вакуумі і залишок очищували флешхроматографією (силікагель) з градієнтним елююванням, толуол:дихлорметан [1:0 до 1:1]. Придатні фракції об'єднували і концентрували з одержанням Приготування 75 (7,1г). МС (ES): Μ/Ζ [ΜΗ+] 504,0; очікувана маса для C16H9Cl2F6N5OS+Η складає 504,0 1 Н-ЯМР (CDCI 3): 2,78-2,81 (3H), 3,09-3,12 (3H), 7,70-7,73 (2Н), 8,34-8,37 (1Н) Подібно до Приготування 31 одержували: Приготування 76 N'-[1-[3-хлор-5-(трифторметил)піридин-2-іл]-3-ціано-4-(трифторацетил)-1Н-піразол-5-іл]-N,Nдиметилімідоформамід; із сполуки Приготування 93 (5,98г, 15.6ммоль) з одержанням вказаної в заголовку сполуки (6,3г). МС (ES): M/Z [MH+] 439,0; очікувана маса для C15H9CIF6N6O+Η складає 439,1 1 Н-ЯМР (CDCI 3): 2,83-2,86 (3H), 3,11-3,14 (3H), 8,13-8,15 (1Н), 8,33-8,35 (1Н), 8,76-8,79 (1Н) Подібно до Приготування 39 одержували: Приготування 77 N'-[3-ціано-1-[2,6-дихлор-4-(дифторметокси)феніл]-4-(трифторацетил)-1H-піразол-5-іл]-N,Nдиметилімідоформамід; із сполуки Приготування 94 (0,50г, 1,0ммоль) з одержанням вказаної в заголовку сполуки (425мг). МС (ES): M/Z [MH+] 470,0; очікувана маса для C16H10CI 2F5N5O2+Η складає 470,0 Подібно до Приготування 48 одержували: Приготування 78 N'-{4-{1-[хлор(дифтор)метил]вініл}-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-5-іл}-N,Nдиметилімідоформамід; із сполуки Приготування 96 (1,20г, 2,5ммоль) з одержанням вказаної в заголовку сполуки (1,1г). МС (ES): Μ/Ζ [ΜΗ+] 485,9; очікувана маса для C17H11CI 3F5N5+Η складає 486,0 1 Н-ЯМР (CDCI 3): 2,72-2,75 (3H), 2,93-2,95 (3H), 5,76-5,78 (1Н), 6,18-6 20 (1Н), 7,66-7,68 (2Н), 7,74-7,77 (1Н) Приготування 79 5-аміно-1-[2,6-дихлор-4-(пентафтортіо)феніл]-4-йод-1Н-піразол-3-карбонітрил До розчину Приготування 95 (40,0г, 106ммоль) в ацетонітрилі (400мл) додавали N-йодсукцинімід (26,4г, 117ммоль) ι реакційну суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш розводили етилацетатом (1л) і промивали водним розчином тіосульфату натрію (10%, 3´500мл) і насиченим розчином солі (500мл). Органічну фазу сушили (MgSO4) і концентрували у вакуумі з одержанням Приготування 79 (53г) у вигляді коричневої твердої речовини. 1 Н-ЯМР (CDCI 3): 3,87-3,94 (2Н), 7,88-7,90 (2Н) Приготування 80 5-Аміно-4-(2-бром-ацетил)-1-(2,6-дихлор-4-трифторметил-феніл)-1Н-піразол-3-карбонітрил можна одержати відповідно до [US 6069157 або ЕР846686]. Подібно до Приготування 79 одержували: Приготування 81 5-Аміно-1-(2,6-дихлор-4-трифторметокси-феніл)-4-йод-1Н-піразол-3-карбонітрил; із сполуки Приготування 88 (5,0г, 14,8ммоль) з одержанням вказаної в заголовку сполуки (6,8г). МС (ES): M/Z [MH+] 462,8; очікувана маса для C11H4CI 2F3IN4O+Η складає 462,9 Приготування 82 5-аміно-1-[2,6-дихлор-4-(трифторметил)феніл]-4-йод-1Н-піразол-3-карбонітрил можна одержати відповідно до [US6069157, ЕР933363, WO9828278]. Приготування 83 (1-фторвініл)(метил)дифенілсилан До розчину літієвої проволоки (2,08г, 300ммоль) в сухому тетрагідрофурані (150мл) додавали хлорид метилдифенілсилілу (15,8мл, 75ммоль) і каталітичну кількість йоду. Реакційну суміш сонікували 40хв. і потім перемішували протягом ночі при кімнатній температурі. Реакційну суміш охолоджували до -78°С і 1,1дифторетилен (прибл. 225ммоль) пропускали через суміш протягом 30хв. Суміш перемішували при -78°С 2год. і потім нагрівали до кімнатної температури. Реакційну суміш гасили насиченим розчином хлориду амонію і екстрагували циклогексаном (´2). Об'єднані екстракти промивали насиченим розчином солі, сушили (MgSO4) і концентрували у вакуумі. Залишок очищували колонковою хроматографією (силікагель, 1кг) елююючи гексаном, потоім циклогексаном. Придатні фракції об'єднували і концентрували з одержанням Приготування 83 (7г) у вигляді безбарвного масла. 1 Н-ЯМР (CDCI 3): 0,76-0,81 (3H), 4,82-5,01 (1Н), 5,48-5,60 (1Н), 7,39-7,51 (6Н), 7,61-7,71 (4Н) Подібно до Приготування 79 одержували: Приготування 84 5-Аміно-1-(2,6-дифтор-4-трифторметил-феніл)-4-йод-1Н-піразол-3-карбонітрил; із сполуки Приготування 90 (2,00г, 6,9ммоль) з одержанням вказаної в заголовку сполуки (2,2г). 1 Н-ЯМР (CDCI 3): 3,89-4,04 (2Н), 7,39-7,45 (2Н) Приготування 85 Дифтор-ацетилхлорид До дифтороцтової кислоти (6,0г, 3,93мл, 62,5ммоль) при -10°С додавали пентахлорид фосфору (14,3г, 68,8ммоль). Реакційну суміш перемішували при 0°С 10хв. і потім нагрівали до 80°С. Реакційну суміш дистилювали і фракцію продукту збирали при -78°С з одержанням Приготування 85 (30г) [темп. кип. 25-30°С]. 1 Н-ЯМР (CDCI 3): 5,76-6,07 (1H) Приготування 86 Хлорфторацетилхлорид До пентахлориду фосфору (10,2г, 49,1ммоль) додавали по краплях хлорфтороцтову кислоту (5,0г, 44,6ммоль) при 0°С. Реакційну суміш залишали нагрітись до кімнатної температури і дистилювали при тиску оточуючого середовища (´2) з одержанням Приготування 86 (5,0г, темп. кип. 65°С). 1 Н-ЯМР (CDCI 3): 6,29-6,44 (1H) Подібно до Приготування 31 одержували: Приготування 87 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметокси)феніл]-1H-піразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 88 (7,0г, 20,8ммоль) з одержанням вказаної в заголовку сполуки (6,2г). МС (ES): Μ/Ζ [ΜΗ+] 392,0; очікувана маса для C14H10CI 2F3N5O+Η складає 392,0 1 Н-ЯМР (CDCI 3): 2,77-2,82 (3H), 3,00-3,04 (3H), 6,15-6,17 (1Н), 7,27-7,31 (2Н), 7,70-7,75 (1Н) Приготування 88 5-Аміно-1-(2,6-дихлор-4-трифторметокси-феніл)-1Н-піразол-3-карбонітрил До сірчаної кислоти (18М, 54мл) додавали нітрит натрію (13,9г, 201,2ммоль) і розчин перемішували при 15°С 1год. До розчину додавали оцтову кислоту (200мл), потім 2,6-дихлор-4-(трифторметокси)анілін (45,0г, 182,9ммоль) в оцтовій кислоті (90мл), спостерігаючи, щоб температура розчину не перевищувала 20°С. Після завершення додавання суміш нагрівали при 50°С 1год., охолоджували до кімнатної температури і додавали по краплях до розчину Приготування 46 (27,8г, 182,9ммоль) в оцтовій кислоті (115мл) і крижаній воді (145мл). Реакційну суміш потім перемішували протягом ночі при кімнатній температурі. До реакційної суміші додавали дихлорметан (500мл) і суміш перемішували 10хв. Дві фази розділяли і органічну фазу промивали водою (200мл) і аміак (0,88, 400мл) додавали по краплях, підтримуючи температуру суміші нижче 10°С. Цю суміш перемішували протягом ночі при кімнатній температурі і органічну фазу відділяли і концентрували у вакуумі. Залишок перекристалізовували з суміші толуол/пентан [2:1] з одержанням Приготування 88 (22,4г). МС (ES): M/Z [МН+] 337,0; очікувана маса для C11H5CI 2F3N4O+Η складає 337,0 1 Н-ЯМР (CDCI 3): 3,66-3,82 (2Н), 5,99-6,01 (1Н), 7,35-7,38 (2Н) Подібно до Приготування 31 одержували: Приготування 89 N'-{3-ціано-1-[2,6-дихлор-4-(трифторметокси)феніл]-4-йод-1H-піразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 81 (6,8г, 14.7ммоль) з одержанням вказаної в заголовку сполуки (6,2г). 1 Н-ЯМР (CDCI 3): 2,76-2,79 (3H), 3,01-3,04 (3H), 7,27-7,30 (2Н), 8,17-8,20 (1Н) Приготування 90 5-Аміно-1-(2,6-дифтор-4-трифторметил-феніл)-1Н-піразол-3-карбонітрил Розчин Приготування 56 (400мг, 1,19ммоль) в оксихлориді фосфору (20мл) нагрівали при кипінні із зворотним холодильником 1год. Реакційну суміш гасили шляхом додання до води і подальшу суміш екстрагували дихлорметаном. Об'єднані екстракти потім сушили (MgSO4) і концентрували у вакуумі. Залишок очищували колонковою хроматографією (силікагель), елююючи дихлорметаном. Придатні фракції об'єднували і концентрували з одержанням Приготування 90 (250мг). МС (ES): Μ/Ζ [ΜΗ+] 289,0; очікувана маса для C11H5F5N4+Η складає 289,1 1 Н-ЯМР (CDCI 3): 3,76-3,87 (2Н), 6,02-6,04 (1Н), 7,37-7,43 (2Н) Приготування 91 5-Аміно-1-(2,6-дихлор-4-трифторметил-феніл)-4-(2-фтор-ацетил)-1Н-піразол-3-карбонітрил До розчину Приготування 80 (800мг, 1,80ммоль) в толуолі (20мл) додавали 18-Crown-6 (85,6мг, 3,24ммоль) і фторид калію (безводний, 210мг, 3,60ммоль) в толуолі (20мл). Реакційну суміш потім нагрівали при 90°С 2 дні. Реакційну суміш концентрували у вакуумі і залишок пропускали через прокладку з силікагелем, елююючи діетиловий етер. Фільтрат концентрували у вакуумі з одержанням Приготування 91 (500мг). МС (ES): M/Z [MH+] 380,9; очікувана маса для C13H6CI 2F4N4O+Η складає 381,0 1 Н-ЯМР (CDCI 3): 5,38-5,40 (1Н), 5,50-5,52 (1Н), 5,84-5,90 (2Н), 7,79-7,81 (2Н) Подібно до Приготування 31 одержували: Приготування 92 N'-(3-ціано-1-{2,6-дихлор-4-[(трифторметил)тіо]феніл}-1H-піразол-5-іл)-N,N-диметилімідоформамід; із сполуки Приготування 70 (1,0г, 2,93ммоль) з одержанням вказаної в заголовку сполуки (720мг). МС (ES): M/Z [MH+] 408,0; очікувана маса для C14H10CI 2F3N5S+Η складає 408,0 1 Н-ЯМР (CDCI 3): 2,80-2,84 (3H), 3,01-3,06 (3H), 6,18-6,22 (1Н), 7,68-7,70 (2Н), 7,71-7,73 (1Н) Приготування 93 5-Аміно-1-(3-хлор-5-трифторметил-піридин-2-іл)-4-(2,2,2-трифтор-ацетил)-1Н-піразол-3-карбонітрил До розчину Приготування 69 (4,50г, 15,6ммоль) в піридині (45мл) при 0°С додавали по краплях ангідрид трифтороцтової кислоти (8,8мл, 62,6ммоль). Реакційну суміш потім перемішували при кімнатній температурі 3 год. Реакційну суміш концентрували у вакуумі і до залишку додавали тетрагідрофуран (20мл) і соляну кислоту (10%, 20мл). Реакційну суміш потім нагрівали при кипінні із зворотним холодильником 1,5год. До реакційної суміші додавали етилацетат і два шари розділяли. Водний шар екстрагували етилацетатом (3´30мл) і об'єднані органічні фази промивали соляною кислотою (10%, 2´30мл) і водним розчином гідрокарбонату натрію (3´30мл), сушили (MgSO4) і концентрували у вакуумі з одержанням Приготування 93 (6,1г). МС (ES): M/Z [МН+] 383,9; очікувана маса для C12H4CIF6N5O+Η складає 384,0 1 Н-ЯМР (CDCI 3): 7,54-7,64 (2Н), 8,24-8,27 (1Н), 8,67-8,69 (1Н) Подібно до Приготування 79 одержували: Приготування 94 N'-{3-ціано-1-[2,6-дихлор-4-(дифторметокси)феніл]-4-йод-1Н-піразол-5-іл}-N,N-диметилімідоформамід; із сполуки Приготування 63 (2,44г, 6,5ммоль) з одержанням вказаної в заголовку сполуки (3,1г). МС (ES): Μ/Ζ [ΜΗ+] 500,0; очікувана маса для C14H10Cl2F2IN5O+Η складає 499,9 Приготування 95 5-аміно-1-[2,6-дихлор-4-(пентафтортіо)феніл]-1H-піразол-3-карбонітрил можна одержати відповідно до [WO 9306089, ЕР605469]. Подібно до Приготування 39 одержували: Приготування 96 N'-{4-[хлор(дифтор)ацетил]-3-ціано-1-[2,6-дихлор-4-(трифторметил)феніл]-1Н-піразол-5-іл}-N,Nдиметилімідоформамід; із сполуки Приготування 62 (5,0г, 10.0ммоль) з одержанням вказаної в заголовку сполуки (2,9г). МС (ES): Μ/Ζ [ΜΗ+] 487,9; очікувана маса для C16H9CI 3F5N5O+Η складає 488,0 1 Н-ЯМР (CDCI 3): 2,80-2,83 (3H), 3,09-3,13 (3H), 7,68-7,71 (2Н), 8,28-8,31 (1Н) Приготування 97 4-Трифторметилтіо-анілін можна одержати відповідно до [ЕР 546391 А2].
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted 1-aryl-4-cyclopropylpyrazoles, antiparasitic pharmaceutic or veterinary composition
Автори англійськоюBillen Denis, Chubb Nathan Anthony Logan, Gethin David Morris, Hall Kim Thomas, Roberts Lee Richard, Walshe Nigel Derek Arthur
Назва патенту російськоюЗамещенные 1-арил-4-циклопропилпиразолы, противопаразитарная фармацевтическая или ветеринарная композиция
Автори російськоюБиллен Денис, Чабб Натан Энтони Логан, Гезин Девид Моррис, Холл Ким Томас, Робертс Ли Ричард, Уолш Найджел Дерек Артур
МПК / Мітки
МПК: C07D 231/38, A01P 7/04, A01N 43/56
Мітки: композиція, фармацевтична, протипаразитна, ветеринарна, 1-арил-4-циклопропілпіразоли, заміщені
Код посилання
<a href="https://ua.patents.su/29-83397-zamishheni-1-aril-4-ciklopropilpirazoli-protiparazitna-farmacevtichna-abo-veterinarna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Заміщені 1-арил-4-циклопропілпіразоли, протипаразитна фармацевтична або ветеринарна композиція</a>
Попередній патент: Пристрій для ручного прокручування ротора газотурбінного двигуна
Наступний патент: Антиокислювальна композиція на основі дифеніламіну та спосіб її одержання
Випадковий патент: Тепловий насос












