Спосіб одержання 13аlрhа-3-гідрокси-17-кетостероїдів андростанового ряду
Номер патенту: 23979
Опубліковано: 31.08.1998
Автори: Хват Олександр Вікторович, Орлов Валерій Дмитрійович, Натаров Валерій Володимирович, Яременко Федір Георгієвич
Формула / Реферат
1. Способ получения 13α-3-гидрокси-17-кетостероидов андростанового ряда общей формулы:
где R1 и R2 - водород; R1 и R2 могут совместно образовывать C5-C6 - связь, отличающийся тем, что соединение Формулы
где R1 и R2 - водород; R 1и R2 могут совместно образовывать C5-C6-связь; вводят в реакцию с соединением формулы
где R3 = Η, Me, СІ, Br, ОМе; R4 = Η, Me, СІ, в среде уксусной кислоты при кипячении в присутствии кислорода воздуха в течение 1-4 часов с последующим выделением целевых продуктов известными приемами.
2. Способ по п.1, отличающийся тем, что используют уксусную кислоту в концентрации 40-50%.
Текст
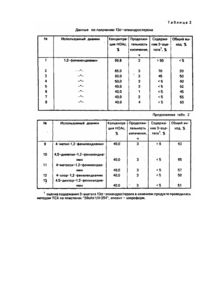
Изобретение относится к способу получения 13a-3-гидрокси-17-кетостероидов андростанового ряда формулы где R1 и R2 - водород; R1 и R2 могут совместно образовывать С 5-С6-связь, являющихся полупродуктами в синтезе активных 13 й стероидов, пригодных в качестве антигестагенов и посткоитальных контрацептивов [14]. Известен способ получения 13a-3-гид-рокси-17-кетостероидов андростанового ряда непосредственно из 13b -изомеров с выходами до 31%, заключающийся в облучении их эфирных или диоксановых растворов ртутной лампой с использованием излучения с длиной волны 313 нм в течение 28 дней с последующим разделением смеси 13a - и 13b - изомеров действием реактива Жерара [5]. К недостаткам указанного метода относятся нетехнологичность, низкий выход целевых продуктов и трудность их выделения. Известны также способы получения 13a -3-гидрокси-17-кетостероидов андростанового ряда в несколько стадий. Один из них заключается в изомеризации предварительно получаемого 17-оксима 3-ацетата 13a -Згидрокси-17-кетостероида при 12 часовом кипячении в смеси уксусного ангидрида и пиридина в инертной атмосфере с последующим гидролизом образовавшихся 17-моно- и диацетиламидопроизводных 13a -3гидрокси-17-кетостероида, которые выделяются хроматографически на силикагеле. Образовавшиеся 3ацетаты 13a-17-кетостероидов омыляют до целевых 3-гидроксипроизводных [6]. Выход 13a-3-гидрокси-17кетостероидов андростанового ряда составляет ~ 60%. Этот способ также имеет недостатки: необходимость получения и выделения промежуточных продуктов (оксима, моно- и диацетиламидо- производных, 3ацетилпроизводного), продолжительность и сложность синтетической процедуры. Другой способ состоит в изомеризации 17-оксима 3-гидрокси-17-кетостероида 13b -ряда (в свою очередь получаемого из исходного 17-кетона) действием порошка никеля в условиях кипячения в смеси уксусной кислоты и октана [7]. Выход 13a-3-гидрокси-17-кетостероида андростанового ряда составляет ~60% на исходный оксим. К недостаткам этого метода можно отнести необходимость введения дополнительной стадии получения промежуточного оксима и, как следствие, уменьшение выхода целевого продукта и усложнение синтетической процедуры. Третий способ получения 13a-3-гидрокси-17-кетостероидов андростанового ряда состоит в омылении их ацетатов, в свою очередь полученных изомеризацией 3-гидрокси- или 3-ацетоксипроизводных 13b-17кетостероидов андростанового ряда под воздействием 1,2-фенилендиамина при кипячении в концентрированной уксусной кислоте [8], К недостаткам данного метода следует отнести необходимость выделения промежуточных 3-ацетатов и введения дополнительной стадии омыления, что ведет к снижению выхода целевого продукта и усложнению синтетической процедуры. Целью изобретения является упрощение синтеза путем устранения промежуточных стадий при переходе от 3-гидрокси-17-кетоандростанов с природной 13b-конфигураций к изомерным соединениям 13a-ряда. Поставленная цель достигается тем, что в реакцию вводят в качестве реагентов 13b-3-гидрокси-17кетостероиды и 1-,2-фени-лендиамин или его 4-моно- и 4,5-дизаме-щенные при кипячении в 40-50% водной уксусной кислоте в течение 1-4 часов в присутствии кислорода воздуха. Синтез указанных соединений проводят в одну стадию, выход целевых продуктов составляет 60-65%. Способ получения предлагаемых соединений представлен следующей схемой реакции: где R1 и R2 - водород; R1 и R2 могут совместно образовывать С 5-С6-связь, R3= H, Me, CI, Br, OMe;R4 = H, Me, СІ. Химическая структура полученных соединений была доказана с использованием спектральных методов (ЯМР-1Н, -13С) и сравнением с литературными данными. Результаты опытов по получению 13a -дегидроэпиандростерона (II: 3β -гидрокси, R1+Rz = связь) и 13aэпиандростерона (II: Ζβ- гидрокси; R1 = 5а, R2 = Н) в различных условиях с использованием как 1,2-фенилендиамина, так и его замещенных приведены в табл. 1, 2. Как видно из табл.1 и 2, наиболее высокий выход указанных веществ, при незначительном содержании в качестве примесей 3-ацетатов, достигается при использовании 1,2-фенилендиамина, 4-метил-1,2-фенилендиамина и 4,5-диме-тил-1,2-фенилендиамина в 4050% водной уксусной кислоте. Аналогично получен 13a-андростерон (II, где R =5a-H, R2=H, 3a-гидрокси), выход 60%,т.пл. 144-145°С. Πример 1. Получение 1-За-дегидроэ-пиандростерона. В 70мл 45% водной уксусной кислоте при нагревании растворяют 5,80 г (~0,02 моль) дегидроэпиандростерона и 2,20 г (~0,02 моль) о-ФДА. Раствор кипятят 4 ч с обратным холодильником. Реакционную смесь охлаждают. Практически сразу выпадает темный маслянистый осадок. Прозрачный раствор сливают и оставляют на ночь в холодильнике. Затем фильтруют выпавший белый кристаллический осадок, получают 2,00 г 13а-дегидроэпиандростерона с т.пл. 189-191° С (из метанола). Фильтрат объединяют с первым осадком и экстрагируют хлороформом (100 мл). Экстракт тщательно промывают насыщенным раствором Nа2СО3 (100 мл), затем водой до нейтральной реакции промывных вод, 2% раствором HCI до прекращения окрашивания водного слоя и снова водой до нейтральной реакции промывных вод. Полученный раствор упаривают до 10 мл и смесь разделяют на колонке с силикагелем ("Chemapol L40-100m"). После хроматографирования получают 1,50 г 13a -дегидроэпиандростерона с т.пл. 189— 190,5°(изгексана) и 1,90 г исходного кетона. Кристаллизация объединенной порции 13a-стероида из гексана дает 3,45 г 13aдегидроэпиандростерона с т.пл. 190-191°С (лит. т.пл. 187-189° С [5]). Общий выход 13aдегидроэпиандростерона составил 60%. ЯМР-1Н (CDCI 3)d м.д.: 0,96 (18-СНз, 3Н), 0.83 (19-СН3, 3Н), 3,49 (3-Н, 1Н); ЯМР-1зС (СОСl3)d, м.д.: 214,2 (17-С), 25,0 (18-С), 19,0 (19-С), 71,5(3-С). Πример 2. Получение 13a-эпиандростерона. В 70 мл 40% водной уксусной кислоте при нагревании растворяют 5.80 г (~0,02 моль) эпиандростерона и 2,20 г (~0,02 моль) о-ФДА. Раствор кипятят 4 ч с обратным холодильником. Реакционную смесь охлаждают и выливают в воду (~100 мл). Выпавший осадок экстрагируют хлороформом (ТОО мл). Экстракт тщательно промывают насыщенным раствором Nа2СО3 (100 мл), затем водой до нейтральной реакции промывных вод, 2% раствором HCI до прекращения окрашивания водного слоя и снова водой до нейтральной реакции промывных вод. Полученный раствор упаривают до 10 мл и смесь разделяют на колонке с силикагелем ("Chemapol L40-100 μ"). После хроматографирования получают 3,75 г 13a-эпиандростерона с т.пл, 143-145°С (из гексана) и 1,90 г исходного кетона. Кристаллизация из гексана дает 3,65 г 13о-зпиандростерона с т.пл. 144,5-145,5°С (лит. т.пл. 143-145° С [5]). Общий выход составил 62%. ЯМР-1Н (CDCl3)d, м.д.: 0,95 (18-СН3, 3Н) 0,63 (19-СН3, 3Н), 3,58 (3-Н, 1Н); ЯМР-13С (СРСІ 3)d, м.д.: 216,1 (17-С), 25,2 (18-С), 12,0 (19-С), 73,5 (3-С). Таким образом, предлагаемый способ синтеза дает возможность получить указанные соединения в одну стадию с высоким выходом целевых продуктов.
ДивитисяДодаткова інформація
Назва патенту англійськоюThe process for preparation of 13-аlрhа-3-hydroxy-17-keto steroids of hydrosterone series
Автори англійськоюYaremenko Fedir Heorhiievych, Khvat Oleksandr Viktorovych, Orlov Valerii Dmytriovych, Natarov Valerii Volodymyrovych
Автори російськоюЯременко Федор Георгиевич, Хват Александр Викторович, Орлов Валерий Дмитриевич, Натаров Валерий Владимирович
МПК / Мітки
МПК: C07J 15/00, C07J 75/00
Мітки: андростанового, ряду, спосіб, одержання, 13аlрhа-3-гідрокси-17-кетостероїдів
Код посилання
<a href="https://ua.patents.su/3-23979-sposib-oderzhannya-13alrha-3-gidroksi-17-ketosterodiv-androstanovogo-ryadu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 13аlрhа-3-гідрокси-17-кетостероїдів андростанового ряду</a>
Попередній патент: Спосіб діагностики якості ремісії при шизофренії
Наступний патент: Спосіб фотометричного визначення хімічних забруднювачів води
Випадковий патент: Спосіб збагачення вершкового масла