Кристалічні трипептидні інгібітори епоксикетонпротеази
Формула / Реферат
1. Спосіб одержання кристалічної сполуки формули (II)
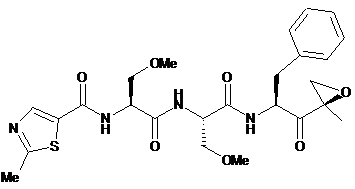 , (II)
, (II)
в якому здійснюють:
(і) одержання розчину сполуки формули (II) в органічному розчиннику;
(іі) доведення розчину до наднасичення, щоб викликати утворення кристалів; і
(ііі) виділення кристалів.
2. Спосіб за п. 1, де органічний розчинник вибирають з ацетонітрилу, етилацетату, гептанів, гексанів, ізопропілацетату, метанолу, метилетилкетону, тетрагідрофурану, толуолу і води або будь-якої їх комбінації.
3. Спосіб за п. 2, де органічний розчинник вибирають з ацетонітрилу, гептанів, гексанів, метанолу, тетрагідрофурану і толуолу.
4. Спосіб за п. 3, де органічний розчинник вибирають з гексанів, тетрагідрофурану і толуолу.
5. Спосіб за будь-яким з пп. 1-4, де доведення розчину до наднасичення здійснюють додаванням антирозчинника, наданням можливості розчину остудитися, зменшенням об'єму розчину або будь-якою їх комбінацію.
6. Спосіб за п. 5, де доведення розчину до наднасичення здійснюють додаванням антирозчинника, охолодженням розчину до температури навколишнього середовища і зменшенням об'єму розчину.
7. Спосіб за п. 5, де антирозчинник додають повільно.
8. Спосіб за п. 5, де антирозчинник вибирають з гексанів, толуолу і води.
9. Спосіб за п. 5, де зменшення об'єму здійснюють випарюванням.
10. Спосіб за будь-яким з пп. 1-9, який додатково включає внесення затравки в розчин.
11. Спосіб за п. 10, який додатково включає промивання кристалів.
12. Спосіб за п. 11, де промивання включає промивання рідиною, вибраною з антирозчинника, ацетонітрилу, гептанів, гексанів, метанолу, тетрагідрофурану, толуолу, води або їх комбінації.
13. Спосіб за п. 12, де промивання включає промивання комбінацією антирозчинника й органічного розчинника.
14. Спосіб за п. 13, де антирозчинник представляє гексани або гептани.
15. Спосіб за будь-яким з пп. 1-14, де виділення кристалів здійснюють фільтрацією кристалів.
16. Спосіб за будь-яким з пп. 1-15, в якому додатково здійснюють сушіння кристалів при зниженому тиску.
17. Кристалічна сполука, яка має структуру формули (II)
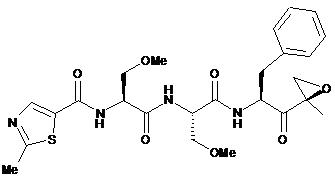 . (II)
. (II)
18. Кристалічна сполука за п. 17, яка має DSC термограм, по суті, як показано на фіг. 1.
19. Кристалічна сполука за п. 17, яка має точку плавлення від приблизно 140 до приблизно 155 °С.
20. Кристалічна сполука за п. 17, яка має точку плавлення від приблизно 145 до приблизно 150 °С.
21. Кристалічна сполука за п. 17, яка має тип XRPD, по суті, як показано на фіг. 2.
22. Кристалічна сполука за п. 17, яка має величини 2θ 8,94; 9,39; 9,76; 10,60; 11,09; 12,74; 15,27; 17,74; 18,96; 20,58; 20,88; 21,58; 21,78; 22,25; 22,80; 24,25; 24,66; 26,04; 26,44; 28,32; 28,96; 29,65; 30,22; 30,46; 30,78; 32,17; 33,65; 34,49; 35,08; 35,33; 37,85; 38,48.
23. Спосіб одержання кристалічної сполуки формули (II)
 , (II)
, (II)
в якому здійснюють
(і) взаємодію сполуки формули (III)
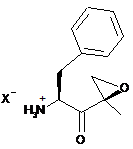 , (IIІ)
, (IIІ)
де X представляє будь-який придатний протиіон,
зі сполукою формули (IV) у другому органічному розчиннику
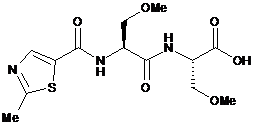 , (IV)
, (IV)
(іі) одержання розчину сполуки формули (II) у другому органічному розчиннику;
(ііі) доведення розчину до наднасичення для забезпечення можливості утворення кристалів; і (iv) відділення кристалів з одержанням кристалічної сполуки формули (II).
Текст
Реферат: Винахід стосується кристалічних трипептидних кетоепоксидних сполук, способів їх одержання і споріднених фармацевтичних композицій. UA 107569 C2 (12) UA 107569 C2 UA 107569 C2 5 10 15 20 25 30 35 40 45 Споріднені заявки Дана заявка вимагає пріоритет попередньої заявки на патент США під серійним № 61/162196, поданої 20 березня 2009 р., і попередньої заявки на патент США під серійним № 61/180561, поданої 22 травня 2009 р. Описи зазначених вище заявок повністю включені в дану заявку шляхом посилання. Передумови винаходу У еукаріотах, розпад білка переважно опосередковується по убіхітиновому шляху, у якому білки, що є мішенню для розпаду, легуються до поліпептиду з 76 амінокислот убіхітину. Після націлювання, убіхітиновані білки потім служать як субстрати для протеасоми 26S, мультикаталітичної протеази, що розщеплює білки на короткі пептиди за допомогою дії трьох основних протеолітичних активностей. Хоча опосередкований протеасомою розпад виконує загальну функцію у внутрішньоклітинному білковому обороті, він також відіграє ключову роль у багатьох процесах, таких як представлення антигенів класу I головного комплексу гістосумісності (MHC), апоптоз, регуляція росту клітин, активація NF-kB (транскрипційного фактора k), процесинг антигенів і трансдукція прозапальних сигналів. Протеасома 20S являє собою мультикаталітичний протеазний комплекс з молекулярною масою 700 кДа, що складається з 28 субодиниць, організованих у чотири кільця. У дріжджах і інших еукаріотах, 7 різних α-субодиниць утворюють зовнішні кільця, і 7 різних β-субодиниць містять внутрішні кільця. α-субодиниці служать як сайти зв'язування для регуляторних комплексів 19S (PA700) і 11IS (PA28), а також як фізичний бар'єр для внутрішньої протеолітичної камери, утвореної двома кільцями β-субодиниць. Таким чином, вважається, що протеасома існує у вигляді частинки 26S ("протеасоми 26S"). Експерименти in vivo показали, що інгібування форми 20S протеасоми може легко корелюватися з інгібуванням протеасоми 26S. Відщіплення амінокінцевих пропослідовностей β-субодиниць під час утворення частинки оголює амінокінцеві залишки треоніну, що служать як каталітичні нуклеофіли. Таким чином, субодиниці, відповідальні за каталітичну активність у протеасомах, мають аміноконцевий нуклеофільний залишок, і ці субодиниці належать до сімейства гідролаз N-кінцевого нуклеофілу (Ntn) (де нуклеофільний N-кінцевий залишок являє собою, наприклад, Cys, Ser, Thr і інші нуклеофільні частини). Це сімейство включає, наприклад, пеніцилін-G-ацилазу (PGA), пеніцилін-V-ацилазу (PVA), глутамін-PRPP-амідотрансферазу (GAT) і бактеріальну глікозиласпарагіназу. На доповнення до повсюдно експресованих β-субодиниць, вищі хребетні також мають три індуковані інтерфероном-γ β-субодиниці (LMP7, LMP2 і MECLl), що заміщають їх нормальні копії, відповідно β5, β1 і β7, таким чином, змінюючи каталітичну активність протеасоми. За допомогою використання різних пептидних субстратів, три основних види протеолітичної активності були визначені для 20S протеасоми еукаріота: активність, подібна хімотрипсину (CTL), яка відщеплює після великих гідрофобних залишків; подібна трипсину активність (T-L), яка відщеплює після основних залишків; і активність, гідролізуюча пептидилглутаміл-пептид (PGPH), яка відщеплює після кислотних залишків. Два додаткових менш охарактеризованих види активності також приписували протеасомі: активність BrAAP, яка відщеплює після розгалуженоланцюжкових амінокислот; і активність SNAAP, яка відщеплює після дрібних нейтральних амінокислот. Представляється, що різні каталітичні сайти додають внесок в основні види протеолітичної активності протеасоми, оскільки інгібітори, точкові мутації в βсубодиницях і обмін індукуючих інтерферон-γ β-субодиниць у різних ступенях змінюють зазначені види активності. Необхідні поліпшені композиції і способи одержання і складання інгібітору (інгібіторів) протеасом. Короткий виклад суті винаходу Один аспект винаходу стосується кристалічних сполук, які мають структуру формули (I), або їх фармацевтично прийнятних солей, 50 , 1 UA 107569 C2 5 10 15 20 25 де X представляє O, NH або N-алкіл, переважно O; 8 Y представляє N, S або C(R )2, переважно NH; 8 Z представляє NH, N-алкіл, O, S або C(R )2, переважно S; 1 2 3 R , R і R представляють водень; 4 5 6 7 8 кожна з груп R , R , R , R і R незалежно вибрана з водню, C1-6алкілу, C1-6гідроксіалкілу, C16алкоксіалкілу, арилу і C1-6аралкілу, кожний з яких необов'язково заміщений групою, вибраною з алкілу, аміду, аміну, карбонової кислоти або її фармацевтично прийнятної солі, складного ефіру 4 5 6 карбонової кислоти, тіолу і тіоефіру, переважно R , R і R незалежно вибрані з C1-6тіоефіру, C17 4 5 6гідроксіалкілу і C1-6аралкілу, і R представляє C1-6алкіл, переважніше R і R представляють C17 6тіоефір, і R представляє C1-6алкіл. Короткий опис креслень На фіг. 1 показана DSC (диференціальна скануюча калориметрична) термограма кристалічної сполуки 1. На фіг. 2 показаний тип XRPD (порошкової рентгенівської дифракції) кристалічної сполуки 1. На фіг. 3 показана TG (термограма) кристалічної сполуки 1. На фіг. 4 показані модульовані термограми аморфної сполуки 1, оберненого теплового потоку (нижня крива) і необерненого теплового потоку (верхня крива). На фіг. 5 показане порівняння DSC термограм кристалічної сполуки 1, одержаної відповідно до прикладу 2 (середня крива), прикладу 3 (верхня крива) і прикладу 4 (нижня крива). На фіг. 6 показаний тип XRPD аморфної сполуки 1, одержаної відповідно до прикладу 1 (верхня крива), у порівнянні з типами XRPD кристалічної сполуки 1, одержаної відповідно до прикладу 2 (верхня крива), прикладу 3 (2-а крива знизу) і прикладу 4 (2-а крива зверху). На фіг. 7 показана TG термограма аморфної сполуки 1. Докладний опис винаходу У визначених варіантах здійснення винахід стосується кристалічних сполук, які мають структуру формули (I), або їх фармацевтично прийнятних солей, , 30 35 40 де X представляє O, NH або N-алкіл, переважно O; 8 Y представляє N, S або C(R )2, переважно NH; 8 Z представляє NH, N-алкіл, O, S або C(R )2, переважно S; 1 2 3 R , R і R представляють водень; 4 5 6 7 8 кожна з груп R , R , R , R і R незалежно вибрана з водню, C1-6алкілу, C1-6гідроксіалкілу, C16алкоксіалкілу, арилу і C1-6аралкілу, кожний з яких необов'язково заміщений групою, вибраною з алкілу, аміду, аміну, карбонової кислоти або її фармацевтично прийнятної солі, складного ефіру 4 5 6 карбонової кислоти, тіолу і тіоефіру, переважно R , R і R незалежно вибрані з C1-6тіоефіру, C17 4 5 6гідроксіалкілу і C1-6аралкілу, і R представляє C1-6алкіл, переважніше R і R представляють C17 6тіоефір, і R представляє C1-6алкіл. У визначених варіантах здійснення винахід стосується кристалічної сполуки формули (II) 2 UA 107569 C2 . 5 10 15 20 25 30 35 40 45 У визначених варіантах здійснення винахід стосується способу одержання кристалічної сполуки формули (I) або (II), який включає: (і) одержання аморфної сполуки, наприклад, відповідно до заявки на патент США № 11/595804; (ii) розчинення аморфної сполуки в органічному розчиннику; (iii) доведення розчину до наднасичення; (iv) відділення кристалів, наприклад, фільтрацією кристалів, декантацією рідини з кристалів або іншою придатною методикою відділення; і (v) промивання кристалів. У визначених варіантах здійснення одержання, крім того, включає індукцію кристалізації. У визначених варіантах здійснення одержання, крім того, включає сушіння, переважно при зниженому тиску, наприклад в умовах вакууму. У визначених варіантах здійснення аморфна сполука може бути розчинена в розчиннику, вибраному з ацетонітрилу, етилацетату, гептанів, гексанів, ізопропілацетату, метанолу, метилетилкетону, тетрагідрофурану, толуолу і води або будь-якої їх комбінації. У визначених варіантах здійснення аморфна сполука формули (II) може бути розчинена в органічному розчиннику, вибраному з ацетонітрилу, гептанів, гексанів, метанолу, тетрагідрофурану і толуолу або будь-якої їх комбінації. У визначених переважних варіантах здійснення органічний розчинник являє собою толуол, гідрофуран або ацетонітрил, переважно ацетонітрил або толуол. У визначених варіантах здійснення доведення розчину до наднасичення включає повільне додавання антирозчинника, такого як вода, гептани, гексани або інша полярна або неполярна рідина, змішувана з органічним розчинником, надання можливості розчину остудитися (з осадженням або без осадження розчину), зменшення об'єму розчину або будь-яку їх комбінацію. У визначених варіантах здійснення доведення розчину до наднасичення включає додавання антирозчинника, охолодження розчину до навколишньої температури або нижче і зменшення об'єму розчину, наприклад, випарюванням розчинника з розчину. У визначених варіантах здійснення надання розчину можливості остудитися може бути пасивним (наприклад, надання розчину можливості відстоятися при навколишній температурі) або активним (наприклад, охолодженням розчину на льодяній бані або в морозильнику). У визначених варіантах здійснення спосіб, крім того, включає індукцію осадження або кристалізації. У визначених варіантах здійснення індукція осадження або кристалізації включає вторинну нуклеацію, де нуклеація відбувається в присутності кристалів затравки або при взаємодіях з навколишнім середовищем (стінками кристалізатора, перемішувальними імпелерами, обробкою ультразвуком і т. д.). У визначених варіантах здійснення промивання кристалів включає промивання рідиною, вибраною з антирозчинника, ацетонітрилу, гептанів, гексанів, метанолу, тетрагідрофурану, толуолу, води або їх комбінації. У визначених варіантах здійснення кристали промиваються комбінацією антирозчинника й органічного розчинника. У визначених варіантах здійснення антирозчинник являє собою воду, тоді як в інших варіантах здійснення він являє собою алкановий розчинник, такий як гексан або пентан, або ароматичний вуглеводневий розчинник, такий як бензол, толуол або ксилол. У визначених варіантах здійснення промивання кристалів включає промивання кристалічної сполуки формули (II) сумішшю тетрагідрофурану й алканового розчинника, такого як гексани або гептани, або сумішшю ацетонітрилу і води. У визначених варіантах здійснення промивання кристалів включає промивання кристалічної сполуки формули (II) толуолом. У переважних таких варіантах здійснення толуол охолоджується перед промиванням. У визначених варіантах здійснення кристалічна сполука формули (II) є по суті чистою. У визначених варіантах здійснення точка плавлення кристалічної сполуки формули (II) знаходиться в діапазоні від приблизно 135 до приблизно 160 °C, від приблизно 140 до 3 UA 107569 C2 5 10 15 приблизно 155 °C, від приблизно 145 до приблизно 150 °C або навіть від приблизно 147 до приблизно 149 °C, наприклад приблизно 149 °C. У визначених варіантах здійснення DSC кристалічної сполуки формули (II) має різкий ендотермічний максимум при температурі приблизно 147 °C, наприклад, у результаті плавлення і руйнування кристалічної форми, як показано на фіг. 1. У визначених варіантах здійснення тип порошкової рентгенівської дифракції кристалічної сполуки формули (II) являє собою (θ-2θ°): 8,94; 9,39; 9,76; 10,60; 11,09; 12,74; 15,27; 17,74; 18,96; 20,58; 20,88; 21,58; 21,78; 22,25; 22,80; 24,25; 24,66; 26,04; 26,44; 28,32; 28,96; 29,65; 30,22; 30,46; 30,78; 32,17; 33,65; 34,49; 35,08; 35,33; 37,85; 38,48, як показано на фіг. 2. У визначених варіантах здійснення TG термограма кристалічної сполуки формули (II) виявляє втрату маси від 0,0 до 0,3 % у температурному діапазоні від 25 до 125 °C, як показано на фіг. 3. У визначених варіантах здійснення кристалічна сполука формули (II) є несольватованою (наприклад, кристалічна решітка не містить молекул розчинника). У визначених варіантах здійснення кристалічна сполука формули (II) є сольватованою. У визначених варіантах здійснення винахід стосується способу одержання кристалічної сполуки формули (II) , 20 який включає (і) взаємодію сполуки формули (III) , 25 де X представляє будь-який придатний протиіон, зі сполукою формули (IV) в органічному розчиннику 30 (ii) одержання розчину сполуки формули (II) в органічному розчиннику; (iii) доведення розчину до наднасичення для забезпечення можливості утворення кристалів; і (iv) відділення 4 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 кристалів для одержання кристалічної сполуки формули (II), наприклад, фільтрацією кристалів, декантацією або будь-якою іншою придатною методикою відділення. У визначених варіантах здійснення сполука формули (II) не очищається хроматографією перед одержанням розчину в органічному розчиннику. У визначених варіантах здійснення одержання, крім того, включає індукцію кристалізації. У визначених варіантах здійснення одержання, крім того, включає промивання кристалів, наприклад, розчинником або рідиною, що не є розчинником. У визначених варіантах здійснення одержання, крім того, включає сушіння, переважно при зниженому тиску, наприклад у вакуумі. У визначених варіантах здійснення X представляє протиіон, вибраний з гідроброміду, гідрохлориду, сульфату, фосфату, нітрату, ацетату, трифторацетату, цитрату, метансульфонату, валерату, олеату, пальмітату, стеарату, лаурату, бензоату, лактату, сукцинату, тозилату, малонату, малеату, фумарату, тартрату, мезилату, 2гідроксіетансульфонату і тому подібних (див., наприклад, публікацію Berge et al. (1977) "Pharmaceutical Salts", J. Pharm. Sci. 66: 1-19). У визначених варіантах здійснення X вибраний із трифторацетату, метансульфонату, толуолсульфонату, ацетату, хлориду і броміду, переважно трифторацетату. У визначених варіантах здійснення органічний розчинник вибраний з ацетонітрилу, етилацетату, гептанів, гексанів, ізопропілацетату, метанолу, метилетилкетону, тетрагідрофурану, толуолу і води або будь-якої їх комбінації. У визначених варіантах здійснення аморфна сполука формули (II) може бути розчинена в органічному розчиннику, вибраному з ацетонітрилу, гептанів, гексанів, метанолу, тетрагідрофурану і толуолу або будь-якої їх комбінації. У визначених варіантах здійснення органічним розчинником є, переважно, ацетонітрил або толуол. У визначених варіантах здійснення одержання, крім того, включає промивання кристалів формули (II). У визначених варіантах здійснення промивання кристалів включає промивання рідиною, вибраною з антирозчинника, ацетонітрилу, гептанів, гексанів, метанолу, тетрагідрофурану, толуолу, води або їх комбінації. У визначених варіантах здійснення кристали промиваються комбінацією антирозчинника й органічного розчинника. У визначених варіантах здійснення антирозчинник являє собою воду, тоді як в інших варіантах здійснення він являє собою лужний розчинник, такий як гексан або пентан, або ароматичний вуглеводневий розчинник, такий як бензол, толуол або ксилол. У визначених варіантах здійснення одержання, крім того, включає сушіння кристалів обох сполук формули (II), переважно при зниженому тиску, наприклад у вакуумі. У визначених варіантах здійснення винахід стосується фармацевтичної композиції, яка містить кристалічну сполуку формули (II) і фармацевтично прийнятний носій. У визначених варіантах здійснення фармацевтична композиція вибрана з таблеток, капсул і розчинів для ін'єкцій. Види застосування кристалічних трипептидних епоксикетонів Організований розпад білка відіграє вирішальну роль у підтриманні нормальних клітинних функцій, і протеасома є невід'ємною частиною процесу розпаду білка. Протеасома регулює рівні білків, які важливі для розвитку клітинного циклу й апоптозу в нормальних і злоякісних клітинах, наприклад циклінів, каспаз, BCL2 і NF-kВ (Kumatori et al., Proc. Natl. Acad. Sci. USA (1990) 87:7071-7075; Almond et al., Leukemia (2002) 16: 433-443). Таким чином, не дивно, що інгібування активності протеасоми може включатися в терапевтичні способи для лікування різних патологічних станів, таких як злоякісні, незлоякісні й аутоімунні захворювання, залежно від залучених у процес клітин. Моделі і in vitro, і in vivo показали, що злоякісні клітини, у цілому, сприйнятливі до інгібування протеасоми. Дійсно, інгібування протеасоми також було обґрунтоване як терапевтична стратегія для лікування множинної меланоми. Це частково могло бути пов'язане з залежністю злоякісних клітин, що мають високу проліферативну здатність, від системи протеасоми для швидкого видалення білків (Rolfe et al., J. Mo. Med. (1997) 75:5-17; Adams, Nature (2004) 4: 349-360). Тому, визначені варіанти здійснення винаходу стосуються способу лікування онкологічних захворювань, який включає введення потребуючому такого лікування індивіду ефективної кількості описаної в даному винаході сполуки, інгібітору протеасоми. Використовуваний у даному описі термін "онкологічні захворювання" включає, без обмеження, гематологічні онкологічні захворювання і солідні пухлини. Онкологічні захворювання належать до захворювань крові, кісток, органів, шкірної тканини і судинної системи, включаючи, без обмеження, онкологічні захворювання сечового міхура, крові, кісток, мозку, молочних залоз, шийки матки, грудної клітки, ободової кишки, ендометрія, стравоходу, очей, голови, нирок, печінки, легень, лімфатичних вузлів, ротової порожнини, шиї, яєчників, підшлункової залози, 5 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 передміхурової залози, прямої кишки, ниркових структур, шкіри, шлунка, сім'яників, горла і матки. Визначені онкологічні захворювання включають, без обмеження, лейкоз (гострий лімфолейкоз (ALL), гострий мієлолейкоз (AML), хронічний лімфолейкоз (CLL), хронічний мієлолейкоз (CML), волосатоклітинний лейкоз), новоутворення зі зрілих B-клітин (дрібнолімфоцитарну лімфому, B-клітинний пролімфоцитарний лейкоз, лімфоплазмацитарну лімфому (таку як макроглобулінемія Вальденстрема), лімфому селезінкової крайової зони, плазмацитарну мієлому, плазмацитому, хвороби відкладення моноклонального імуноглобуліну, хвороби важкого ланцюга, B-клітинну лімфому позавузлової крайової зони (лімфому MALT), Bклітинну лімфому вузлової крайової зони (NMZL), фолікулярну лімфому, мантійноклітинну лімфому, дифузну B-клітинну лімфому, середостінну (тимічну) B-великоклітинну лімфому, внутрішньосудинну B-великоклітинну лімфому, первинну випітну лімфому і лімфому/лейкоз Беркітта), новоутворення зі зрілих T-клітин і природних кілерних (NK) клітин (T-клітинний пролімфоцитарний лейкоз, T-клітинний великий гранулярний лімфолейкоз, агресивний NKклітинний лейкоз, T-клітинний лейкоз/лімфому дорослих, позавузлову NK/T-клітинну лімфому, T-клітинну лімфому типу ентеропатії, печінково-селезінкову T-клітинну лімфому, бластну NKклітинну лімфому, фунгоїдний мікоз (синдром Сезарі), первинну шкірну анапластичну великоклітинну лімфому, лімфоматоїдний папульоз, ангіоімунобластну T-клітинну лімфому, неспецифіковану T-клітинну лімфому й анапластичну великоклітинну лімфому), лімфому Ходжкіна (вузликовий склероз, змішану целюлярність, збагачену лімфоцитами, з виснаженим або не виснаженим запасом лімфоцитів, вузликову з перевагою лімфоцитів), мієлому (множинну мієлому, безболісну мієлому, в'ялотекучу мієлому), хронічне мієлопроліферативне захворювання, мієлодиспластичне/мієлопроліферативне захворювання, мієлодиспластичні синдроми, лімфопроліферативні розлади, пов'язані з імунодефіцитом, гістіоцитарні новоутворення і новоутворення з дендритних клітин, мастоцитоз, хондросаркому, саркому Евінга, фібросаркому, злоякісну гігантоклітинну пухлину, мієломне захворювання кісток, остеосаркому, рак молочних залоз (гормонально залежний, гормонально незалежний), гінекологічні онкологічні захворювання (шийки матки, ендометрія, фаллопієвих труб, гестаційне трофобластичне захворювання, яєчників, очеревини, матки, піхви і вульви), базальноклітинну карциному (BCC), плоскоклітинну карциному (SCC), злоякісну меланому, виступаючу дерматофібросаркому, карциному з клітин Меркеля, саркому Капоші, астроцитому, пілоцитарну астроцитому, дизембріопластичну нейроепітеліальну пухлину, олігодендрогліоми, епіндимому, мультиформну гліобластому, змішані гліоми, олігоастроцитоми, медулобластому, ретинобластому, нейробластому, герміному, тератому, злоякісну мезотеліому (очеревинну мезотеліому, перикардіальну мезотеліому, плевральну мезотеліому), гастроентеропанкреатичну або гастроентеропанкреатичну нейроендокринну пухлину (GEPNET), карциноїд, панкреатичну ендокринну пухлину (PET), колоректальну аденокарциному, колоректальну карциному, агресивну нейроендокринну пухлину, лейоміосаркому, муцинозну аденокарциному, перстенеподібноклітинну аденкарциному, печінковоклітинну карциному, холангіокарциному, гепатобластому, гемангіому, печінкову аденому, осередкову вузликову гіперплазію (вузликову регенеративну гіперплазію, гамартому), недрібноклітинну легеневу карциному (NSCLC) (плоскоклітинну легеневу карциному, аденокарциному, великоклітинну легеневу карциному), дрібноклітинну легеневу карциному, карциному щитовидної залози, рак передміхурової залози (гормонально рефракторний, незалежний від андрогенів, залежний від андрогенів, гормонально нечутливий), нирковоклітинну карциному і саркоми м'яких тканин (фібросаркому, злоякісну фіброзну гістіоцитому, дерматофібросаркому, ліпосаркому, рабдоміосаркому, лейоміосаркому, гемангіосаркому, синовіальну саркому, злоякісну пухлину периневрія периферичних нервів/нейрофібросаркому, позаскелетну остеосаркому). Багато які пухлин гематопоетичних і лімфоїдних тканин характеризуються збільшенням клітинної проліферації або визначеним типом клітин. Хронічні мієлопроліферативні захворювання (CMPD) являють собою клональні розлади гематопоетичних стовбурових клітин, характеризовані проліферацією в кістковому мозку однієї або більше мієлоїдних ліній диференціації, що приводять до зрослого числа гранулоцитів, еритроцитів і/або тромбоцитів у периферичній крові. По суті, застосування інгібіторів протеасоми для лікування таких захворювань є привабливим і досліджується в даний час (Cilloni et al., Haematologica (2007) 92: 1124-1229). CMPD можуть включати хронічний мієлолейкоз, хронічний нейтрофільний лейкоз, хронічний еозинофільний лейкоз, істинну поліцитемію, хронічний ідіопатичний мієлофіброз, есенційну тромбоцитопенію і хронічне мієлопроліферативне захворювання, що не класифікується. Один аспект винаходу являє собою спосіб лікування CMPD, який включає введення потребуючому такого лікування індивіду ефективної кількості описаної в даній заявці сполуки, яка є інгібітором протеасоми. 6 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 Мієлодиспластичні/мієлопроліферативні захворювання, такі як хронічний мієлолейкоз, атиповий хронічний мієлолейкоз, ювенільний мієлолейкоз і мієлодиспластичне/мієлопроліферативне захворювання, що не класифікується, характеризуються гіперцелюлярністю кісткового мозку внаслідок проліферації в одній або більше з мієлоїдних ліній диференціювання. Інгібування протеасоми описаною в даній заявці сполукою або композицією може служити як лікування зазначених мієлодиспластичних/мієлопроліферативних захворювань шляхом введення потребуючому такого лікування індивіду ефективної кількості сполуки або композиції. Мієлодиспластичні синдроми (MDS) належать до групи розладів гематопоетичних стовбурових клітин, характеризованих дисплазією і неефективним гематопоезом в одній або більше з основних ліній мієлоїдних клітин. Вплив інгібітором протеасоми на NF-kВ як мішень при даних гематологічних злоякісних захворюваннях викликає апоптоз, за допомогою цього знищуючи злоякісні клітини (Braun et al. Cell Death and Differentiation (2006) 13:748-758). Ще один варіант здійснення винаходу являє собою спосіб лікування MDS, який включає введення потребуючому такого лікування індивіду ефективної кількості описаної в даному винаході сполуки. MDS включає рефракторну анемію з кільцеподібними сидеробластами, рефракторну цитопенію з дисплазією множини ліній диференціації, рефракторну анемію з надлишком бластів, мієлодиспластичний синдром, що не класифікується, і мієлодиспластичний синдром, пов'язаний з ізольованою аномалією хромосоми del(5q). Мастоцитоз являє собою проліферацію тучних клітин і їх подальше накопичення в одній або більше системах органів. Мастоцитоз включає без обмеження шкірний мастоцитоз, безболісний системний мастоцитоз (ISM), системний мастоцитоз з асоційованим клональним гематологічним, не пов'язаним з лінією диференціації тучних клітин захворюванням (SMAHNMD), агресивний системний мастоцитоз (ASM), тучноклітинний лейкоз (MCL), тучноклітинну саркому (MCS) і позашкірну мастоцитому. Інший варіант здійснення винаходу являє собою спосіб лікування мастоцитозу, який включає введення ефективної кількості описаної у даному винаході сполуки або композиції індивіду, у якого діагностований мастоцитоз. Протеасома регулює NF-kB, що у свою чергу регулює гени, які беруть участь в імунній і запальній реакції. Наприклад, NF-kВ потрібний для експресії гена k легкого ланцюга імуноглобуліну, гена α-ланцюга рецептора IL-2, гена класу I головного комплексу гістосумісності і ряду цитокінових генів, кодуючих, наприклад, IL-2, IL-6, фактор, стимулюючий колонії гранулоцитів, і IFN-β (Palombella et al., Cell (1994) 78:773-785). Таким чином, у визначених варіантах здійснення винахід стосується способів впливу на рівень експресії IL-2, MHC-I, IL-6, TNFα, IFN-β або будь-яких з раніше згаданих білків, причому кожен спосіб включає введення індивіду ефективної кількості описаної у даному винаході сполуки або композиції інгібітору протеасоми. У визначених варіантах здійснення винахід включає спосіб лікування аутоімунних захворювань у ссавця, який включає введення терапевтично ефективної кількості описаної у даній заявці сполуки або композиції. У даному описі "аутоімунне захворювання" являє собою захворювання або розлад, що виникає з власних тканин індивіда і спрямоване проти них. Приклади аутоімунних захворювань або розладів включають, без обмеження, запальні реакції, такі як запальні шкірні захворювання, включаючи псоріаз і дерматит (наприклад, атопічний дерматит); системну склеродермію і склероз; реакції, пов'язані з запальним кишковим захворюванням (таким як хвороба Крона і виразковий коліт); респіраторний дистрес-синдром (включаючи респіраторний дистрес-синдром дорослих; ARDS); дерматит; менінгіт; енцефаліт; увеїт; коліт; гломерулонефрит; алергічні стани, такі як екзема й астма, і інші стани, що включають інфільтрацію T-клітин, і хронічні запальні реакції; атеросклероз; недостатність адгезії лейкоцитів; ревматоїдний артрит; системний червоний вовчак (SLE); цукровий діабет (наприклад, цукровий діабет I типу або інсулінозалежний цукровий діабет); розсіяний склероз; синдром Рейно; аутоімунний тироїдит; алергічний енцефаломієліт; синдром Шегрена; ювенільний діабет; і імунні реакції, пов'язані з гострою і відстроченою гіперчутливістю, опосередкованою цитокінами і T-лімфоцитами, виявляються звичайно при туберкульозі, саркоїдозі, поліміозиті, гранулематозі і васкуліті; перніціозну анемію (хвороба Едіссона); захворювання, що залучають лейкоцитарний діапедез; запальний розлад центральної нервової системи (ЦНС); синдром пошкодження множини органів; гемолітичну анемію (включаючи без обмеження кріоглобулінемію або Кумбс-позитивну анемію); генералізовану міастенію; захворювання, опосередковані комплексом антиген-антитіло; захворювання, викликане антитілом проти основної мембрани клубочків; антифосфоліпідний синдром; алергічний неврит; хворобу Грейвса; міастенічний синдром Лемберта-Ітона; бульозну псевдопухирчатку; пухирчатку; аутоімунні поліендокринопатії; хворобу Рейтера; синдром м'язової скутості; хворобу Бехчета; гігантоклітинний артеріїт; нефрит, викликаний імунними комплексами; нефропатію, 7 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 викликану IgА; полінейропатії, викликані IgМ; імунну тромбоцитопенічну пурпуру (ITP) або аутоімунну тромбоцитопенію. Імунна система проводить скринінг для виявлення аутологічних клітин, що інфіковані вірусами, піддалися онкогенній трансформації або представляють незнайомі пептиди на їх поверхні. Внутрішньоклітинний протеоліз генерує дрібні пептиди для представлення Tлімфоцитам для викликання імунних реакцій, опосередкованих класом I MHC. Таким чином, у визначених варіантах здійснення винахід стосується способу застосування сполуки як імуномодулюючого засобу для інгібування зміни або представлення антигену в клітині, який включає вплив на клітину (або введення індивіду) сполуки, описаної в даному винаході. Визначені варіанти здійснення включають спосіб лікування захворювань трансплантата або пов'язаних з ним, таких як хвороба трансплантат проти хазяїна або хвороба хазяїн проти трансплантата, у ссавця, який включає введення терапевтично ефективної кількості сполуки, описаної в даному винаході. Використовуваний у даному описі термін "трансплантат" стосується біологічного матеріалу, одержаного у донора для трансплантації реципієнту. Трансплантати включають такі різноманітні матеріали як, наприклад, ізольовані клітини, такі як острівцеві клітини; тканину, таку як амніотична оболонка немовляти, кістковий мозок, гематопоетичні клітини-попередники й очну тканину, таку як тканина рогівки; і органи, такі як шкіра, серце, печінка, селезінка, підшлункова залоза, частка щитовидної залози, нирка, трубчасті органи (наприклад, кишечник, кровоносні судини або стравохід). Трубчасті органи можуть використовуватися для заміщення ушкоджених частин стравоходу, кровоносних судин або жовчної протоки. Шкірні трансплантати можуть використовуватися не тільки при опіках, але також як покриття ушкодженого кишечнику або для закриття визначених дефектів, таких як діафрагмальна грижа. Джерелом трансплантата може бути будь-який ссавець, включаючи людину, або трупи, або живі донори. У деяких випадках, донор і реципієнт являють собою одного й того ж ссавця. Переважно, трансплантат являє собою кістковий мозок або орган, такий як серце, і донор трансплантата і хазяїн збігаються по антигенах II класу HLA антигенів. Новоутворення з гістіоцитарних і дендритних клітин походять з фагоцитів і додаткових клітин, що грають основні ролі в процесингу і представленні антигенів лімфоцитам. Було показано, що виснаження запасу протеасоми в дендритних клітинах змінює їх викликані антигеном реакції (Chapatte et al., Cancer Res. (2006) 66:5461-5468). Таким чином, інший варіант здійснення винаходу включає введення ефективної кількості описаної в даному винаході сполуки або композиції індивіду з новоутворенням з гістіоцитів або дендритних клітин. Новоутворення з гістіоцитів або дендритних клітин включають гістіоцитарну саркому, гістіоцитоз клітин Лангерганса, саркому з клітин Лангерганса, саркому/пухлину з дендритних клітин, що змикаються, і неспецифіковану саркому з дендритних клітин. Було показано, що інгібування протеасоми сприятливе для лікування захворювань, при яких проліферує деякий тип клітин, і імунних розладів; таким чином, один варіант здійснення винаходу включає лікування лімфопроліферативних захворювань (LPD), пов'язаних з первинними імунними розладами (PID), яке полягає у веденні ефективної кількості описаної сполуки потребуючому цього індивіду. Найпоширенішими клінічними формами імунодефіциту, пов'язаного з підвищеною частотою лімфопроліферативних розладів, включаючи B-клітинні і Tклітинні новоутворення і лімфоми, є первинні синдроми імунодефіциту й інші первинні імунні розлади, інфекція людським вірусом імунодефіциту (HIV, ВІЛ), ятрогенне пригнічення імунітету у пацієнтів, що одержали алотрансплантати органа або кісткового мозку, і ятрогенне пригнічення імунітету, пов'язане з лікуванням метотрексатом. Інші PID, звичайно пов'язані з LPD, являють собою, без обмеження, атаксію-телангіектазію (AT), стиндром Віскотта-Олдріча (WAS), звичайний варіабельний імунодефіцит (CVID), важкий комбінований імунодефіцит (SCID), Xзчеплений лімфопроліферативний розлад (XLP), сидром хромосомних поломок Ніймегена (NBS), синдром гіпер-IgМ і аутоімунний лімфопроліферативний синдром (ALPS). Додаткові варіанти здійснення винаходу стосуються способів впливу на залежну від протеасоми регуляцію онкопротеїнів і способів лікування або інгібування росту злоякісного новоутворення, причому кожен спосіб включає вплив на клітину (in vivo, наприклад, у індивіда, або in vitro) описаною в даній заявці композицією інгібітору протеасоми. Протеїни, що походять з HPV-16 і HPV-18 E6, стимулюють АТІФ- і убіхітинзалежну кон'югацію і розпад p53 у неочищених ретикулоцитарних лізатах. Було показано, що рецесивний онкоген p53 накопичується при непермісивній температурі в лінії клітин з мутованим термолабільним E1. Підвищені рівні p53 можуть привести до апоптозу. Приклади протоонкопротеїнів, що розкладаються системою убіхітину, включають c-Mos, c-Fos і c-Jun. У визначених варіантах здійснення винахід стосується способу лікування пов'язаного з p53 апоптозу, який включає 8 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 введення індивіду ефективної кількості описаної в даному винаході композиції інгібітору протеасоми. Інший аспект винаходу стосується застосування описаних у даній заявці композицій інгібітору протеасоми для лікування нейродегенеративних захворювань і станів, включаючи без обмеження інсульт, ішемічне ушкодження нервової системи, травму нервів (наприклад, струс мозку, травму спинного мозку і травматичне ушкодження нервової системи), розсіяний склероз і інші імуноопосередковані нейропатії (наприклад, синдром Гієна-Барре і його варіанти, гостру рухову аксонну нейропатію, гостру запальну демієлінізуючу полінейропатію і синдром Фішера), комплекс деменції при ВІЛ-інфекції/СНІДі, аксономію, діабетичну нейропатію, хворобу Паркінсона, хворобу Хантінгтона, розсіяний склероз, бактеріальний, паразитарний, грибковий і вірусний менінгіт, енцефаліт, судинну деменцію, деменцію в результаті множинних інфарктів, деменцію з тільцями Леві, деменцію, пов'язану з ураженням лобної частки мозку, таку як хвороба Піка, субкортикальні деменції (такі як хвороба Хантінгтона або прогресуючий супрануклеарний параліч), синдроми осередкової атрофії кори (такі як первинна афазія), метаболічні-токсичні деменції (такі як хронічний гіпотиреоз або недостатність B12) і деменції, викликані інфекціями (такі як сифіліс або хронічний менінгіт). Хвороба Альцгеймера характеризується позаклітинними відкладеннями β-амілоїдного білка (β-AP) у сенільних бляшках і судинах мозку. β-AP являє собою пептидний фрагмент із 39-42 амінокислот, що походять з попередника амілоїдного білка (APP). Відомі щонайменше три ізоформи APP (695, 751 і 770 амінокислот). Альтернативний сплайсинг мРНК генерує ізоформи; нормальний процесинг впливає на частину послідовності β-AP, за допомогою цього запобігаючи генеруванню β-AP. Вважається, що аномальний процесинг білка протеасомою додає внесок у численність β-AP у мозку при хворобі Альцгеймера. Фермент процесингу APP у щурів містить приблизно 10 різних субодиниць (22-32 кДа). Субодиниця 25 кДа має N-кінцеву послідовність XGln-Asn-Pro-Met-X-Thr-Gly-Thr-Ser, яка ідентична β-субодиниці людської мультикаталітичної протеази (Kojima, S. et al., Fed. Eur. Biochem. Soc, (1992) 304:57-60). Фермент процесингу APP 15 16 розщеплює в зв'язку Gln -Lys ; у присутності іона кальцію, фермент також розщеплює в зв'язку '1 1 1 2 Met --Asp і зв'язку Asp --Ala для вивільнення позаклітинного домену β-AP. Тому, один аспект винаходу стосується способу лікування хвороби Альцгеймера, який включає введення індивіду ефективної кількості описаної в даній заявці сполуки або композиції інгібітору протеасоми. Таке лікування включає зниження швидкості процесингу β-AP, зниження швидкості утворення бляшки β-AP, зниження швидкості генерування β-AP і зменшення клінічних ознак хвороби Альцгеймера. Фіброз являє собою надлишкове і стійке утворення фіброзної сполучної тканини, що виникає в результаті гіперпроліферативного росту фібробластів і пов'язаний з активацією шляху передачі сигналів TGF-β. Фіброз включає екстенсивне відкладення позаклітинної матриці і може відбуватися по суті усередині будь-якої тканини або по декількох різних тканинах. Звичайно, рівень білка внутрішньоклітинної передачі сигналів (Smad), що активує транскрипцію генівмішеней після стимуляції TGF-β, регулюється активністю протеасоми (Xu et al., 2000). Однак прискорена деградація компонентів передачі сигналів TGF-β спостерігалася при фібротичних станах, таких як муковісцидоз, ін'єкційний фіброз, ендоміокардіальний фіброз, ідіопатичний легеневий фіброз, мієлофіброз, заочеревинний фіброз, прогресуючий масивний фіброз, нефрогенний системний фіброз. Інші стани, що часто пов'язані з фіброзом, включають цироз, дифузне паренхіматозне легеневе захворювання, синдром болю після вазектомії, туберкульоз, серпоподібноклітинну анемію і ревматоїдний артрит. Один варіант здійснення винаходу являє собою спосіб лікування фібротичного або пов'язаного з фібротичним стану, який включає введення ефективної кількості описаної в даному винаході композиції потребуючому такого лікування індивіду. Лікуванню постраждалих від опіків часто перешкоджає фіброз. Таким чином, у визначених варіантах здійснення винахід стосується місцевого або системного введення обговорюваного інгібітору для лікування опіків. Закриття ран після хірургічних втручань часто пов'язане з утворенням деформуючих рубців, яке може бути попереджене інгібуванням фіброзу. Таким чином, у визначених варіантах здійснення винахід стосується способу запобігання або зменшення деформуючого рубцювання. Вважається, що надлишкова продукція індукованих ліпополісахаридом (LPS) цитокінів, таких як TNFα є центральним механізмом у процесах, пов'язаних із септичним шоком. Крім того, у цілому прийнято вважати, що першою стадією в активації клітин LPS є зв'язування LPS зі специфічними рецепторами мембрани. α- і β-субодиниці комплексу протеасоми 20S були ідентифіковані як білки, що зв'язують LPS, свідчачи про те, що викликана LPS трансдукція сигналів може бути важливою терапевтичною мішенню при лікуванні або запобіганні сепсису 9 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 (Qureshi, N. et al., J. Immun. (2003) 171: 1515-1525). Тому, у визначених варіантах здійснення композиція інгібітору протеасоми може застосовуватися для інгібування TNFα для запобігання і/або лікування септичного шоку. Ішемія і реперфузійне ушкодження приводять до гіпоксії, стану, при якому є дефіцит кисню, що досягає тканин організму. Цей стан викликає збільшений розпад Ik-Bα, за допомогою цього, приводячи до активації NF-kB (Koong et al., 1994). Було продемонстровано, що тяжкість пошкодження в результаті гіпоксії може бути зменшена введенням інгібітору протеасоми (Gao et al., 2000; Bao et al., 2001; Pye et al., 2003). Тому, визначені варіанти здійснення винаходу стосуються способу лікування ішемічного стану або реперфузійного пошкодження, який включає введення потребуючому такого лікування індивіду ефективної кількості описаної в даному винаході сполуки інгібітору протеасоми. Приклади таких станів або пошкоджень включають, без обмеження, гострий коронарний синдром (уразливі бляшки), артеріальне оклюзійне захворювання (оклюзії серцевих, периферичних артерій і інших судин), атеросклероз (коронарний склероз, ураження коронарних артерій), інфаркти, серцеву недостатність, панкреатит, гіпертрофію міокарда, стеноз і рестеноз. NF-kВ також специфічно зв'язується з ВІЛ-енхансером/промотором. У порівнянні з Nef mac239, ВІЛ-регуляторний білок Nef pbj14 відрізняється двома амінокислотами в області, що регулює зв'язування протеїнкінази. Вважається, що протеїнкіназа передає сигнали фосфорилування IkВ, запускаючи розпад IkВ по шляху убіхітину-протеасоми. Після розпаду, NF-kB вивільняється в ядро, таким чином, підсилюючи транскрипцію ВІЛ (Cohen, J., Science, (1995) 267:960). У визначених варіантах здійснення винахід стосується способу інгібування або зменшення ВІЛ-інфекції у індивіда або способу зниження рівня експресії вірусного гена, причому кожен спосіб включає введення індивіду ефективної кількості описаної в даній заявці сполуки або композиції інгібітору протеасоми. Вірусні інфекції додають внесок у патологію багатьох захворювань. Серцеві стани, такі як поточний міокардит і дилатаційна кардіоміопатія, були пов'язані з коксаківірусом B3. У порівняльному цільногеномному мікрочиповому аналізі інфікованих мишачих сердець, специфічні протеасомні субодиниці були рівномірно стимульовані в серцях мишей, у яких розвився хронічний міокардит (Szalay et al, Am J Pathol 168:1542-52, 2006). Деякі віруси використовують убіхітин-протеасомну систему на стадії входження вірусу, де вірус вивільняється з ендосоми в цитозоль. Вірус гепатиту мишей (MHV) належить до сімейства Coronaviridae, що також включає коронавірус важкого гострого респіраторного синдрому (SARS). Yu і Lai (J Virol 79:644-648, 2005) продемонстрували, що обробка інфікованих MHV клітин інгібітором протеасоми привела до зменшення вірусної реплікації, що корелюється зі зниженим вірусним титром, у порівнянні з титром необроблених клітин. Вірус гепатиту B людини (HBV), член сімейства вірусів Hepadnaviridae, аналогічним чином для розмноження вимагає вірусно кодованих оболонкових білків. Інгібування шляху розпаду протеасоми викликає значне зниження кількості секретованих оболонкових білків (Simsek et al., J Virol 79:12914-12920, 2005). На доповнення до HBV, інші віруси гепатиту (A, C, D і E) можуть також використовувати шлях розпаду убіхіну-протеасоми для секреції, морфогенезу і патогенезу. Відповідно, у визначених варіантах здійснення винахід стосується способу лікування вірусної інфекції, такої як SARS або гепатит A, B, C, D і E, який включає контактування клітини з (або введення індивіду) ефективною кількістю описаної в даному винаході сполуки або композиції. У визначених варіантах здійснення описана композиція може застосовуватися для лікування паразитарної інфекції, такої як інфекції, викликаної протозойними паразитами. Вважається, що протеасома зазначених паразитів бере участь у першу чергу в таких видах клітинної активності як диференціація і реплікація (Paugam et al., Trends Parasitol. 2003, 19(2): 55-59). Крім того, було показано, що види ентамеби втрачають здатність інцистації при впливі інгібіторів протеасоми (Gonzales et al., Arch. Med. Res. 1997, 28, Spec № 139-140). У таких визначених варіантах здійснення протоколи введення для композицій інгібітору протеасоми використовуються для лікування паразитарних інфекцій у людей, викликаних протозойним паразитом, вибраним з видів Plasmodium (включаючи P. falciparum, P. vivax, P. Malariae і P. ovale, що викликають малярію), видів Trypanosoma (включаючи T. cruzi, що викликає хворобу Чагаса, і T. Brucei, що викликає африканську сонну хворобу), видів Leishmania (включаючи L. amazonesis, L. donovani, L. infantum, L. mexicana, і т. д.), Pneumocystis carinii (найпростіше, яке, як відомо, викликає пневмонію у пацієнтів зі СНІДом і іншими видами пригнічення імунітету), Toxoplasma gondii, Entamoeba histolytica, Entamoeba invadens і Giardia lamblia. У визначених варіантах здійснення описані композиції інгібітору протеасоми використовуються для лікування паразитарних інфекцій у тварин і худоби, викликаних найпростішими паразитами, вибраними з Plasmodium hermani, видів Cryptosporidium, Echinococcus granulosus, Eimeria tenella, Sarcocystis neurona і 10 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 Neurospora crassa. Інші сполуки, що діють як інгібітори протеасоми при лікуванні паразитарних захворювань, описані в документі WO 98/10779, який повністю включений у даний опис шляхом посилання. У визначених варіантах здійснення композиції інгібітору протеасоми інгібують активність протеасоми у паразита без витягання з еритроцитів і лейкоцитів. У таких визначених варіантах здійснення довгий період напіврозпаду в клітинах крові може забезпечити тривалий захист відносно терапії проти рецидивуючого впливу паразитів. У визначених варіантах здійснення композиції інгібітору протеасоми можуть забезпечити тривалий захист відносно хіміопрофілактики проти майбутньої інфекції. Прокаріоти мають еквівалент еукаріотній частинці протеасоми 20S. Хоча субодинична композиція частинки прокаріоту 20S простіше, ніж субодинична композиція еукаріотів, вона здатна гідролізувати пептидні зв'язки аналогічним чином. Наприклад, нуклеофільна атака на пептидний зв'язок відбувається через залишок треоніну на N-кінці β-субодиниць. Таким чином, один варіант здійснення даного винаходу стосується способу лікування прокаріотних інфекцій, який включає введення індивіду ефективної кількості описаної у даному винаході сполуки або композиції. Прокаріотні інфекції можуть включати захворювання, викликані або мікобактріями (такими як туберкульоз, проказа або виразка Бурулі), або архебактеріями. Було також продемонстровано, що інгібітори, які зв'язуються з протеасомою 20S, стимулюють формування кісткової тканини в органних культурах кісток. Крім того, коли такі інгібітори вводилися системно мишам, визначені інгібітори протеасоми збільшували об'єм кісток і швидкість утворення кісткової тканини більше ніж на 70 % (Garrett, I. R. et al., J. Clin. Invest. (2003) 111: 1771-1782), свідчачи про те, що убіхітин-протеасомний механізм регулює диференціацію остеобластів і формування кісткової тканини. Тому, описана сполука або композиція інгібітору протеасоми може використовуватися при лікуванні і/або профілактиці захворювань, пов'язаних із втратою кісткової тканини, таких як остеопороз. Таким чином, у визначених варіантах здійснення винахід стосується способу лікування захворювання або стану, вибраного з онкологічного захворювання, аутоімунного захворювання, стану, пов'язаного з трансплантатом, нейродегенеративного захворювання, стану, пов'язаного з фіброзом, станів, пов'язаних з ішемією, інфекції (вірусної, паразитарної або прокаріотичної) і захворювань, пов'язаних із втратою кісткової тканини, який включає введення описаної у даній заявці сполуки або композиції. Введення кристалічних трипептидних епоксикетонів Сполуки, одержані, як описано в даній заявці, можуть вводитися в різних формах, залежно від підлягаючого лікуванню розладу і віку, стану і маси тіла пацієнта, як добре відомо в даній галузі. Наприклад, коли сполуки буде потрібно вводити перорально, вони можуть знаходитися у вигляді таблетки, капсули, гранули, порошку або сиропу; або для парентерального введення,вони можуть знаходитися у вигляді розчинів для ін'єкцій (внутрішньовенних, внутрішньом'язових або підшкірних), препаратів для краплинної інфузії або супозиторіїв. Для введення через слизову оболонку очей, сполуки можуть знаходитися у вигляді очних крапель або очних мазей. Зазначені препаративні форми можуть бути одержані звичайними засобами і, при бажанні, активний інгредієнт може змішуватися з будь-якою звичайною добавкою або ексципієнтом, таким як зв'язувальний агент, розпушувач, мастильна речовина, коригент, солюбілізуючий агент, суспендуючий агент, емульгуючий агент, агент покриття, циклодекстрин і/або буфер. Хоча дозування буде варіюватися залежно від симптомів, віку і маси тіла пацієнта, природи і тяжкості розладу, що підлягає лікуванню або профілактиці, шляху введення і форми лікарського засобу; у цілому, рекомендована добова доза складає від 0,01 до 2000 мг сполуки для дорослого пацієнта-людини і її можна вводити однією дозою або дробовими дозами. Кількість активного інгредієнта, що може комбінуватися з матеріалом носія для одержання однієї лікарської форми, у цілому складає кількість сполуки, яка забезпечує терапевтичний ефект. Точний час введення і/або кількість композиції, що дасть найбільш ефективні результати з погляду ефективності лікування у даного пацієнта, буде залежати від активності, фармакокінетики і біодоступності конкретної сполуки, фізіологічного стану пацієнта (включаючи вік, стать, тип і стадію захворювання, загальний фізичний стан, реактивність на дане дозування і тип медикаментозної терапії), шляху введення і т. д. Однак зазначені вище рекомендації можуть використовуватися як основа для ретельного підбору лікування, наприклад, визначення оптимального часу введення і/або кількості, що вводиться, які будуть вимагати не більше ніж звичайного експериментування, що складається з моніторингу індивіда і підбору дозування і/або часу введення. Фраза "фармацевтично прийнятні" використовується в даному описі для позначення тих лігандів, матеріалів, композицій і/або лікарських форм, які, у межах обсягу здорового медичного 11 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 судження, придатні для застосування в контакті з тканинами людей і тварин без надлишкової токсичності, подразнення, алергічної реакції або іншої проблеми або ускладнення, відповідно до доцільного співвідношення користь/ризик. Використовувана в даному винаході фраза "фармацевтично прийнятний носій" означає фармацевтично прийнятний матеріал, композицію або наповнювач, такий як рідкий або твердий наповнювач, розріджувач, ексципієнт, розчинник або інкапсулюючий матеріал. Кожен носій повинний бути "прийнятним" у розумінні сумісності з іншими інгредієнтами препаративної форми і нешкідливим для пацієнта. Деякі приклади матеріалів, що можуть служити як фармацевтично прийнятні носії, включають: (1) цукри, такі як лактоза, глюкоза і сахароза; (2) крохмалі, такі як кукурудзяний крохмаль, картопляний крохмаль і заміщений і незаміщений βциклодекстрин; (3) целюлозу і її похідні, такі як карбоксиметилцелюлоза натрію, етилцелюлоза й ацетат целюлози; (4) порошкоподібний трагакант; (5) солод; (6) желатин; (7) тальк; (8) ексципієнти, такі як масло какао і воски для супозиторіїв; (9) олії, такі як арахісова олія, олія насіння бавовни, олія сафлору, кунжутна олія, маслинова олія, кукурудзяна олія й олія соєвих бобів; (10) гліколі, такі як пропіленгліколь; (11) поліоли, такі як гліцерин, сорбіт, маніт і поліетиленгліколь; (12) складні ефіри, такі як етилолеат і етиллаурат; (13) агар; (14) забуферювальні агенти, такі як гідроксид магнію і гідроксид алюмінію; (15) альгінову кислоту; (16) безпірогенну воду; (17) ізотонічний сольовий розчин; (18) розчин Рінгера; (19) етиловий спирт; (20) фосфатні буферні розчини; і (21) інші нетоксичні сумісні речовини, використовувані у фармацевтичних препаративних формах. У визначених варіантах здійснення фармацевтичні композиції за даним винаходом є не пірогенними, тобто не викликають значних підвищень температури при введенні пацієнту. Термін "фармацевтично прийнятна сіль" стосується відносно нетоксичних адитивних солей неорганічних і органічних кислот інгібітору(ів). Зазначені солі можуть бути одержані in situ під час кінцевого виділення й очищення інгібітору(ів) або окремою взаємодією очищеного інгібітору(ів) у його формі вільної основи з придатною органічною або неорганічною кислотою і виділенням утвореної таким чином солі. Репрезентативні солі включають гідроброміди, гідрохлориди, сульфати, бісульфати, фосфати, нітрати, ацетати, валерати, олеати, пальмітати, стеарати, лаурати, бензоати, лактати, фосфати, тозилати, цитрати, малеати, фумарати, сукцинати, тартрати, нафтилати, мезилати, глюкогептонати, лактобіонати, лаурилсульфонати і солі амінокислот, і тому подібні (див., наприклад, Berge et al. (1977) "Pharmaceutical Salts", J. Pharm. Sci. 66: 1-19). В інших випадках, інгібітори, що можуть використовуватися в способах за даним винаходом, можуть містити одну або більше кислотних функціональних груп і, таким чином, здатні утворювати фармацевтично прийнятні солі з фармацевтично прийнятними основами. Термін "фармацевтично прийнятні солі" у даних випадках стосується відносно нетоксичних адитивних солей неорганічних і органічних основ інгібітору(ів). Ці солі можуть бути аналогічним чином одержані in situ під час кінцевого виділення й очищення інгібітору(ів) або окремою взаємодією очищеного інгібітору(ів) у формі його вільної кислоти з придатним основою, такою як гідроксид, карбонат або бікарбонат фармацевтично прийнятного катіона металу з аміаком або з фармацевтично прийнятним органічним первинним, вторинним або третинним аміном. Репрезентативні лужні і лужноземельні солі включають солі літію, натрію, калію, кальцію, магнію й алюмінію і тому подібні. Репрезентативні органічні аміни, використовувані для утворення основних адитивних солей, включають етиламін, діетиламін, етилендіамін, етаноламін, діетаноламін, піперазин і тому подібні (див., наприклад, наведене вище посилання Berge et al.). Змочувальні агенти, емульгатори і мастильні речовини, такі як лаурилсульфат натрію і стеарат магнію, а також барвні агенти, речовини, що сприяють вивільненню, покривні речовини, підсолоджувачі, ароматизуючі й одоруючі речовини, консерванти й антиоксиданти можуть також бути присутніми у композиціях. Приклади фармацевтично прийнятних антиоксидантів включають: (1) розчинні у воді антиоксиданти, такі як аскорбінова кислота, цистеїн гідрохлорид, бісульфат натрію, метабісульфіт натрію, сульфіт натрію і тому подібні; (2) маслорозчинні антиоксиданти, такі як аскорбілпальмітат, бутильований гідроксіанізол (BHA), бутильований гідрокситолуол (BHT), лецитин, пропілгалат, альфа-токоферол і тому подібні; і (3) агенти, що утворюють хелати іонів металів, такі як лимонна кислота, етилендіамінтетраоцтова кислота (EDTA), сорбіт, винна кислота, фосфорна кислота і тому подібні. Препаративні форми, придатні для перорального введення, можуть бути представлені у вигляді капсул, облаток, пігулок, таблеток, коржів (з використанням ароматизованої основи, звичайно сахарози і акації або трагаканту), порошків, гранул або розчину або суспензії у водній або неводній рідині, або у вигляді емульсії масло-у-воді або вода-в-маслі, або у вигляді еліксиру 12 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 або сиропу, або у вигляді пастилок (з використанням інертної матриці, такої як желатин і гліцерин або сахароза й акація) і/або у вигляді полоскань для ротової порожнини і тому подібних, причому кожна форма містить задану кількість інгібітору (інгібіторів) як активного інгредієнта. Композиція може також вводитися у вигляді болюсу або пасти різної консистенції. У твердих лікарських формах для перорального введення (капсулах, таблетках, пігулках, драже, порошках, гранулах і тому подібних) активний інгредієнт може бути змішаний з одним або більше фармацевтично прийнятними носіями, такими як цитрат натрію або дикальційфосфат, і/або одним з наступних: (1) наповнювачів або збільшувачів об'єму, таких як крохмалі, циклодекстрини, лактоза, сахароза, глюкоза, маніт і/або кремнієва кислота; (2) зв'язувальних речовин, таких як, наприклад, карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідон, сахароза і/або акація; (3) зволожувачів, таких як гліцерин; (4) розпушувачів, таких як агар-агар, карбонат кальцію, крохмаль картоплі або тапіоки, альгінова кислота, певні саліцилати і карбонат натрію; (5) агентів, що затримують розчинення, такі як парафін; (6) прискорювачів всмоктування, таких як сполуки четвертинного амонію; (7) змочувальних агентів, таких як, наприклад, ацетиловий спирт і гліцеролу моностеарат; (8) абсорбентів, таких як каолінова і бентонітова глина; (9) мастильних речовин, таких як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію і їх суміші; і (10) барвних агентів. У випадку капсул, таблеток і пігулок, фармацевтичні композиції можуть також містити забуферювальні агенти. Тверді композиції аналогічного типу можуть також використовуватися як наповнювачі у м'яких і твердих заповнених желатинових капсулах з використанням таких ексципієнтів як лактоза або молочні цукри, а також поліетиленгліколі з високою молекулярною масою і тому подібні. У визначених варіантах здійснення кристалічний трипептидний епоксикетон вводиться ссавцю у вигляді капсули. В іншому варіанті здійснення кристалічний трипептидний епоксикетон являє собою сполуку формули (I). У більш переважному варіанті здійснення кристалічний трипептидний епоксикетон являє собою сполуку формули (II). Таблетка може бути одержана пресуванням або формуванням, можливо, з одним або більше додатковими інгредієнтами. Пресовані таблетки можуть бути одержані з використанням зв'язувальної речовини (наприклад, желатину або гідроксипропілметилцелюлози), мастильної речовини, інертного розріджувача, консерванту, розпушувача (наприклад, гліколяту крохмалю натрію або поперечнозшитої карбоксиметилцелюлози натрію), поверхнево-активного або диспергуючого агента. Формовані таблетки можуть бути одержані формуванням у придатній машині суміші порошкоподібного інгібітору (інгібіторів), змоченого інертним рідким розріджувачем. На таблетках і інших твердих лікарських формах, таких як драже, капсули, пігулки і гранули, можлива наявність насічки або вони можуть бути одержані з покриттями й оболонками, такими як ентеросолюбільні покриття і інші покриття, добре відомі в галузі одержання фармацевтичних препаративних форм. Вони можуть також складатися так, щоб забезпечити повільне або контрольоване вивільнення активного інгредієнта, що міститься в них, використовуючи, наприклад, гідроксипропілметилцелюлозу в різних пропорціях для забезпечення бажаного профілю вивільнення, інші полімерні матриці, ліпосоми і/або мікросфери. Вони можуть стерилізуватися, наприклад, фільтрацією через затримуючий бактерії фільтр або включенням стерилізуючих агентів у формі стерильного ін'єктованого середовища безпосередньо перед застосуванням. Можливий також вміст у зазначених композиціях контрастуючих агентів, і вони можуть також мати композицію, що вивільняє тільки активний інгредієнт (інгредієнти) або, переважно, у визначеній частині шлунково-кишкового тракту, можливо, відстроченим чином. Приклади композицій для заливання, що можуть використовуватися, включають полімерні речовини і воски. Активний інгредієнт може бути також представлений у мікроінкапсульованій формі, якщо доцільно, з одним або більше з описаних вище ексципієнтів. Рідкі лікарські форми для перорального введення включають фармацевтично прийнятні емульсії, мікроемульсії, розчини, суспензії, сиропи й еліксири. На доповнення до активного інгредієнта, рідкі лікарські форми можуть містити інертні розріджувачі, звичайно використовувані в даній галузі, такі як, наприклад, вода або інші розчинники, солюбілізуючі агенти і емульгатори, такі як етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, олії (зокрема, олію насіння бавовни, олію земляного горіха, кукурудзяну олію, зародкову олію, маслинову олію, касторову олію і кунжутну олію), гліцерол, тетрагідрофуриловий спирт, поліетиленгліколі і складні ефіри жирних кислот сорбітану і їх суміші. Крім інертних розріджувачів, пероральні композиції можуть також включати ад'юванти, такі як змочувальні агенти, емульгуючі і суспендуючі агенти, підсолоджувачі, ароматизатори, барвники, одоранти і консерванти. 13 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 Суспензії, на доповнення до активного інгредієнта (інгредієнтів), можуть містити суспендуючі агенти, такі як, наприклад, етоксиловані ізостеарилові спирти, поліоксіетиленсорбітол і складні ефіри сорбітану, мікрокристалічну целюлозу, метагідроксид алюмінію, бентоніт, агар-агар і трагакант і їх суміші. Препаративні форми для ректального або вагінального введення можуть бути представлені у вигляді супозиторія, який може бути одержаний змішуванням одного або більше інгібіторів з одним або більше придатними неподразнюючими ексципієнтами або носіями, що включають, наприклад, масло какао, поліетиленгліколь, віск для супозиторіїв або саліцилат, що є твердим при кімнатній температурі, але рідким при температурі тіла і, тому, розплавляється в прямій кишці або порожнині піхви і вивільняє активний агент. Препаративні форми, придатні для вагінального введення, також включають песарії, тампони, креми, гелі, пасти, піни або аерозольні препаративні форми, що містять такі носії, які доцільні, як відомо в даній галузі. Лікарські форми для місцевого або трансдермального введення інгібітору(ів) включають порошки, аерозолі, мазі, пасти, креми, лосьйони, гелі, розчини, накладки й інгаляційні засоби. Активний компонент може змішуватися в стерильних умовах з фармацевтично прийнятним носієм і з будь-якими консервантами, буферами або газами-витісниками, які можуть знадобитися. Мазі, пасти, креми і гелі можуть містити, на доповнення до інгібітору(ів), ексципієнти, такі як тваринні або рослинні жири, олії, воски, парафіни, крохмаль, трагакант, похідні целюлози, поліетиленгліколі, силікони, бентоніти, кремнієва кислота, тальк і оксид цинку або їх суміші. Порошки й аерозолі можуть містити, на доповнення до інгібітору(ів), ексципієнти, такі як лактоза, тальк, кремнієва кислота, гідроксид алюмінію, силікати кальцію і поліамідний порошок або суміші зазначених речовин. Аерозолі можуть додатково містити замовні гази-витісники, такі як хлорфторвуглеводні і леткі незаміщені вуглеводні, такі як бутан і пропан. Інгібітор(и) може альтернативно вводитися аерозолем. Це здійснюється одержанням водного аерозолю, ліпосомного препарату або твердих частинок, що містять композицію. Може використовуватися неводна суспензія (наприклад, фторвуглецевого газу-витісника). Переважні ультразвукові розпилювачі, оскільки вони мінімізують вплив на агент зсуву, що може привести до розпаду сполуки. Звичайно, водний аерозоль одержують включенням до складу водного розчину або суспензії агента разом зі звичайними фармацевтично прийнятними носіями і стабілізаторами. Носії і стабілізатори можуть варіюватися залежно від вимог до конкретної композиції, але звичайно включають неіонні поверхнево-активні речовини (Tweens, Pluronics, складні ефіри сорбітану, лецитин, Кремофори), фармацевтично прийнятні співрозчинники, такі як поліетиленгліколь, нешкідливі білки, подібні до сироваткового альбуміну, олеїнову кислоту, амінокислоти, такі як гліцин, буфери, солі, цукри або цукрові спирти. Аерозолі у цілому одержують з ізотонічних розчинів. Трансдермальні накладки або системи мають додаткову перевагу забезпечення контрольованої доставки інгібітору(ів) в організм. Такі лікарські форми можуть бути одержані розчиненням або диспергуванням агента у відповідному середовищі. Можуть бути також використані підсилювачі всмоктування для збільшення потоку інгібітору(ів) через шкіру. Швидкість такого потоку може контролюватися або забезпеченням регулюючої частоти мембрани, або диспергуванням інгібітору(ів) у полімерній матриці або гелі. Фармацевтичні композиції за даним винаходом, придатні для парентерального введення, містять один або більше інгібіторів у комбінації з одним або більше фармацевтично прийнятними стерильними водними або неводними розчинами, дисперсіями, суспензіями або емульсіями, або стерильні порошки, вологовміст у який може відновлюватися стерильними ін'єкційними розчинами або дисперсіями безпосередньо перед застосуванням, у яких можуть міститися антиоксиданти, буфери, бактеріостатичні агенти, розчинені речовини, що роблять препаративні форми ізотонічними з кров'ю передбачуваного реципієнта, або суспендуючі агенти або загусники. Приклади придатних водних і неводних носіїв, що можуть використовуватися у фармацевтичних композиціях за винаходом, включають воду, етанол, поліоли (такі як гліцерол, пропіленгліколь, поліетиленгліколь і тому подібні) і їх придатні суміші, рослинні олії, такі як маслинова олія, і ін'єктовані органічні складні ефіри, такі як етилацетат. Належна плинність може підтримуватися, наприклад, використанням покривних матеріалів, таких як лецитин, підтриманням необхідного розміру частинок у випадку дисперсій і використанням поверхневоактивних речовин. 14 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 Ці композиції можуть також містити ад'юванти, такі як консерванти, змочувальні агенти, емульгуючі агенти і диспергуючі агенти. Запобігання дії мікроорганізмів може бути забезпечене включенням різних антибактеріальних і протигрибкових агентів, наприклад парабену, хлорбутанолу, фенолсорбінової кислоти і тому подібних. Може також бути бажаним включення в композиції агентів, що регулюють тонічність, таких як цукри, хлорид натрію, і подібних сполук. Крім того, тривале всмоктування ін'єктованої фармацевтичної форми може бути забезпечене включенням агентів, що затримують усмоктування, таких як моностеарат алюмінію і желатин. У деяких випадках, для подовження ефекту лікарського засобу, бажане забезпечення можливості всмоктування лікарського засобу в результаті підшкірної або внутрішньом'язової ін'єкції. Наприклад, відстрочене всмоктування парентерально введеної лікарської форми здійснюється розчиненням або суспендуванням лікарського засобу в масляному носії. Ін'єктовані депо-форми одержують утворенням мікрокапсульних матриць інгібітору(ів) у біологічно розкладаних полімерах, таких як полілактид-поліглікозид. Залежно від відношення лікарського засобу до полімеру і природи конкретного використовуваного полімеру, можна регулювати швидкість вивільнення лікарського засобу. Приклади інших біологічно розкладаних полімерів включають полі(ортоефіри) і полі(ангідриди). Ін'єктовані препаративні депо-форми також одержують поміщенням лікарського засобу в ліпосоми або мікроемульсії, що сумісні з тканинами тіла. Препарати можуть вводитися перорально, парентерально, місцево або ректально. Вони, звичайно, вводяться у формах, придатних для кожного шляху введення. Наприклад, вони вводяться у формі таблеток або у формі капсул, ін'єкцій, інгаляцій, очного лосьйону, мазі, супозиторія, інфузії, місцево у формі лосьйону або мазі і ректально супозиторієм. Переважним є пероральне введення. Фрази "парентеральне введення" і "які вводяться парентерально", використовувані в даному описі, означають шлях введення, відмінний від ентерального і місцевого введення, звичайно ін'єкцією, і включає без обмеження внутрішньовенну, внутрішньом'язову, внутрішньоартеріальну, внутрішньотрахеальну, внутришньокапсулярну, внутрішньоорбітальну, внутрішньосерцеву, інтрадермальну, внутрішньоочеревинну, транстрахеальну, підшкірну, субкутикулярну, внутрішньосуглобову, субкапсулярну, субарахноїдальну, інтраспінальну і інтрастернальну ін'єкцію і інфузію. Використовувані в даному описі фрази "системне введення", "введені системно", "периферичне введення" і "введені периферично" означають введення ліганду, лікарського засобу або іншого матеріалу шляхом, відмінним від безпосереднього введення в центральну нервову систему, так, щоб він надходив у систему пацієнта і, таким чином, піддавався метаболізму й іншим подібним процесам, наприклад підшкірним введенням. Зазначені інгібітор(и) можуть вводитися для лікування людям і іншим тваринам будь-яким придатним шляхом введення, включаючи введення перорально, інтраназально, наприклад, у вигляді аерозолю, ректально, інтравагінально, парентерально, внутрішньоцистернально і місцево, наприклад, у вигляді порошків, мазей або крапель, включаючи введення букально і сублінгвально. Незалежно від вибраного шляху введення, інгібітор(и), що можуть застосовуватися в придатній гідрованій формі, і/або фармацевтичні композиції за даним винаходом складаються у фармацевтично прийнятні лікарські форми звичайними способами, відомими фахівцям у даній галузі. Дійсні рівні дозування активних інгредієнтів у фармацевтичних композиціях за даним винаходом можуть варіюватися для того, щоб одержати кількість активного інгредієнта, яка ефективна для досягнення бажаної терапевтичної реакції у конкретного пацієнта, композиції і шляху введення без токсичності для пацієнта. Концентрація описаної сполуки у фармацевтично прийнятній суміші буде варіюватися залежно від декількох факторів, включаючи дозування сполуки, що підлягає введенню, фармакокінетичних характеристик використовуваної сполуки і шляху введення. У цілому, композиції за даним винаходом можуть бути надані у водному розчині, що містить приблизно 0,1-10 % мас./об. описаної в даному винаході сполуки, серед інших речовин, для парентерального введення. Типові діапазони доз складають від приблизно 0,01 до приблизно 50 мг/кг маси тіла на день, введених 1-4 дробовими дозами. Кожна дробова доза може містити деякі або різні сполуки за винаходом. Дозування буде являти собою ефективну кількість, що залежить від декількох факторів, включаючи загальний стан здоров'я пацієнта, і препаративної форми і шляху введення вибраної сполуки. 15 UA 107569 C2 5 10 15 Визначення Термін "Cx-yалкіл" стосується заміщених або незаміщених насичених вуглеводневих груп, включаючи прямоланцюжкові алькільні і розгалуженоланцюжкові алкільні групи, що містять від x до y атомів вуглецю в ланцюзі, включаючи галогеналкільні групи, такі як трифторметил і 2,2,2трифторетил, і т. д. C0алкіл вказує вуглеводень, де група знаходиться в кінцевому положенні, зв'язок, якщо внутрішній. Терміни "C2-yалкеніл" і "C2-yалкініл" стосуються заміщених або незаміщених ненасичених аліфатичних груп, аналогічних по довжині, і можливого заміщення описаних вище алкілів, але які містять щонайменше відповідно один подвійний або потрійний зв'язок. Термін "алкокси" стосується алкільної групи, що має приєднаний до неї кисень. Репрезентативні алкоксигрупи включають метокси, етокси, пропокси, трет-бутокси і тому подібні. "Простий ефір" являє собою два вуглеводні, ковалентно зв'язані киснем. Відповідно, замісник алкілу, що робить зазначений алкіл простим ефіром, являє собою або нагадує алкокси. Термін "C1-6алкоксіалкіл" стосується C1-6алкільної групи, заміщеної алкоксигрупою, за допомогою цього, утворюючи простий ефір. Використовуваний у даному описі термін "C 1-6аралкіл" стосується C1-6алкільної групи, заміщеної арильною групою. Терміни "амін" і "аміно" визнані в даній галузі і стосуються і незаміщених, і заміщених амінів і їх солей, наприклад частини, що може бути представлена загальними формулами: 20 або 9 10 , 10' 8 де кожна з груп R , R і R незалежно представляє водень, алкіл, алкеніл, -(CH2)m-R , або 10 R і R , узяті разом з атомом N, до якого вони приєднані, завершують гетероцикл, що має від 4 8 до 8 атомів у кільцевій структурі; R представляє арил, циклоалкіл, циклоалкеніл, гетероцикліл або поліцикліл; і m дорівнює 0 або цілому числу від 1 до 8. У переважних варіантах здійснення 9 10 9 10 тільки одна з груп R або R може представляти карбоніл, наприклад R , R і азот разом не 9 10 10' утворюють імід. У ще більш переважних варіантах здійснення R і R (і, можливо, R ) кожна 8 незалежно представляє водень, алкіл, алкеніл або -(CH2)m-R . У визначених варіантах здійснення аміногрупа є основною, означаючи, що протонована форма має pKa>7,00. Терміни "амід" і "аміно" є визнаними в даній галузі як амінозаміщений карбоніл і включають частину, що може бути представлена загальною формулою: 9 25 30 , 35 40 45 50 9 10 де R , R є такими, як визначено вище. Переважні варіанти здійснення аміду не повинні включати іміди, що можуть бути нестабільними. Використовуваний у даному описі термін "арил" включає 5-, 6- і 7-членні заміщені або незаміщені однокільцеві ароматичні групи, у яких кожен атом кільця представляє вуглець. Термін "арил" також включає поліциклічні кільцеві системи, що мають два або більше циклічних кілець, у яких два або більше атомів вуглецю є загальними для двох суміжних кілець, де щонайменше одне з кілець є ароматичним, наприклад, інші циклічні кільця можуть представляти циклоалкіли, циклоалкеніли, циклоалкініли, арили, гетероарили і/або гетероцикліли. Арильні групи включають бензол, нафталін, фенантрен, фенол, анілін і тому подібні. Використовувані в даному описі терміни "карбоцикл" і "карбоцикліл" стосуються неароматичних заміщених або незаміщених кілець, у яких кожен атом кільця представляє вуглець. Терміни "карбоцикл" і "карбоцикліл" також включають поліциклічні кільцеві системи, що мають два або більше циклічних кілець, у яких два або більше атомів вуглецю є загальними для двох суміжних кілець, де щонайменше одне з кілець є карбоциклічним, наприклад, інші циклічні кільця можуть представляти циклоалкіли, циклоалкеніли, циклоалкініли, арили, гетероарили і/або гетероцикліли. 16 UA 107569 C2 Термін "карбоніл" визнаний у даній галузі і включає такі частини, які можуть бути представлені загальною формулою: або 5 10 15 20 25 30 35 40 45 50 55 , 11 де X представляє зв'язок або представляє кисень або сірку, і R представляє водень, алкіл, 8 11' алкеніл, -(CH2)m-R або фармацевтично прийнятну сіль, R представляє водень, алкіл, алкеніл 8 8 11 11' або -(CH2)m-R , де m і R є такими, як визначено вище. Коли X представляє кисень і R або R не представляє водень, то формула представляє "складний ефір". Коли X представляє кисень і 11 R представляє водень, то формула представляє "карбонову кислоту". Термін "гетероарил" включає заміщені або незаміщені ароматичні від 5- до 7-членних кільцеві структури, переважніше від 5- до 6-членних кільця, кільцеві структури яких включають від одного до чотирьох гетероатомів. Термін "гетероарил" також включає поліциклічні кільцеві системи, що мають два або більше циклічних кілець, у яких два або більше атомів вуглецю є загальними для двох суміжних кілець, де щонайменше одне з кілець є гетероароматичним, наприклад, інші циклічні кільця можуть представляти циклоалкіли, циклоалкеніли, циклоалкініли, арили, гетероарили і/або гетероцикліли. Гетероарильні групи включають, наприклад, пірол, фуран, тіофен, імідазол, ізоксазол, оксазол, тіазол, триазол, піразол, піридин, піразин, піридазин і піримідин, і тому подібні. Використовуваний у даному описі термін "гетероатом" означає атом будь-якого елемента, крім вуглецю або водню. Переважні гетероатоми являють собою азот, кисень, фосфор і сірку. Термін "гетероцикліл" або "гетероциклільна група" стосується заміщених або незаміщених неароматичних від 3- до 10-членних кільцевих структур, переважніше від 3- до 7-членних кілець, кільцеві структури яких включають від одного до чотирьох гетероатомів. Термін "гетероцикліл" або "гетероциклічна група" також включає поліциклічні кільцеві системи, що мають два або більше кілець, у яких два або більше атомів вуглецю є загальними для двох суміжних кілець, де щонайменше одне з кілець є гетероциклічним, наприклад, інші циклічні кільця можуть представляти циклоалкіли, циклоалкеніли, циклоалкініли, арили, гетероарили і/або гетероцикліли. Гетероциклільні групи включають, наприклад, тетрагідрофуран, піперидин, піперазин, піролідин, морфолін, лактони, лактами і тому подібні сполуки. Використовуваний у даному описі термін "C1-6гетероциклоалкіл" стосується C1-6алкільної групи, заміщеної гетероциклільною групою. Термін "C1-6гідроксіалкіл" стосується C1-6алкільної групи, заміщеної гідроксигрупою. Використовуваний у даному описі термін "інгібітор" призначений для опису сполуки, яка блокує або знижує активність ферменту (наприклад, інгібування протеолітичного розщеплення стандартних флуорогенних пептидних субстратів, таких як suc-LLVY-AMC, Box-LLR-AMC і ZLLE-AMC, інгібування різних видів каталітичної активності протеасоми 20S). Інгібітор може діяти конкурентним або неконкурентним інгібуванням. Інгібітор може зв'язуватися оборотно або необоротно, і, тому, термін включає сполуки, що є суїцидальними субстратами ферменту. Інгібітор може модифікувати один або більше сайтів на активному сайті ферменту або біля нього або він може викликати конформаційну зміну в інших ділянках ферменту. Використовуваний у даному описі термін "перорально біодоступна" призначений для опису сполуки, що вводиться миші в дозі 40 мг/кг або менше, 20 мг/кг або менше або навіть 10 мг/кг або менше, де через одну годину після перорального введення така сполука виявляє інгібування щонайменше приблизно на 50 %, щонайменше приблизно на 75 % або навіть щонайменше приблизно на 90 % активності протеасоми CT-L у крові. Використовуваний у даному описі термін "пептид" включає не тільки стандартний амідний зв'язок зі стандартними α-замісниками, але звичайно використовувані пептидоміметики, інші модифіковані зв'язки, бічні ланцюги, що не зустрічаються природно, і модифікації бічних ланцюгів, як детально описано нижче. Термін "поліцикліл" або "поліциклічні" стосується двох або більше кілець (наприклад, циклоалкілів, циклоалкенілів, циклоалкінілів, арилів, гетероарилів і/або гетероциклілів), у яких два або більше атомів вуглецю є загальними для двох суміжних кілець, наприклад, кільця являють собою "конденсовані кільця". Кожне з кілець поліциклу може бути заміщеним або незаміщеним. Використовуваний у даному описі термін "протеасома" призначений для включення імуно- і конститутивних протеасом. 17 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовуваний у даному описі термін "по суті чистий" стосується кристалічного поліморфу, чистота якого складає більше ніж 90 %, означаючи, що він містить менше ніж 10 % будь-якої іншої сполуки, включаючи відповідну аморфну сполуку. Переважно, кристалічний поліморф має чистоту більше ніж 95 % або навіть чистоту більше ніж 98 %. Термін "запобігання" визнаний у даній галузі і при використанні відносно стану, такого як місцевий рецидив (наприклад, болю), захворювання, такого як онкологічне захворювання, синдромокомплексу, такого як серцева недостатність або будь-який інший медичний стан, добре зрозумілий в даній галузі і може включати введення композиції, що знижує частоту або затримує початок симптомів медичного стану у індивіда відносно індивіда, що не одержує композицію. Таким чином, запобігання онкологічному захворюванню включає, наприклад, зниження числа випадків виявлюваного злоякісного росту у популяції пацієнтів, що одержують профілактичне лікування, відносно контрольної популяції, що не одержувала лікування, і/або затримку появи випадків виявлюваного злоякісного росту у популяції пацієнтів, що одержують лікування, у порівнянні з контрольною популяцією, що не одержувала лікування, наприклад, на статистично і/або клінічно значущу кількість. Запобігання інфекції включає, наприклад, зниження числа діагнозів інфекції в популяції, що одержувала лікування, у порівнянні з контрольною популяцією, що не одержувала лікування, і/або затримку початку симптомів інфекції в популяції, що одержувала лікування, у порівнянні з контрольною популяцією, що не одержувала лікування. Запобігання болю включає, наприклад, зниження виразності або затримку виникнення больового відчуття, якого зазнають індивіди, у популяції, що одержувала лікування, у порівнянні з контрольною популяцією, що не одержувала лікування. Термін "проліки" охоплює сполуки, які у фізіологічних умовах перетворюються в терапевтично активні засоби. Звичайний спосіб одержання проліків полягає у включенні вибраних частин, які гідролізуються у фізіологічних умовах, для виявлення бажаної молекули. В інших варіантах здійснення проліки перетворюються ферментативною активністю тваринихазяїна. Термін "профілактичне або терапевтичне" лікування визнане в даній галузі і включає введення в організм хазяїна однієї або більше описуваних композицій. Якщо композиція вводиться перед клінічним проявом небажаного стану (наприклад, захворювання або іншого небажаного стану тварини-хазяїна), то лікування є профілактичним (тобто воно захищає організм хазяїна від розвитку небажаного стану), а якщо вона вводиться після прояву небажаного стану, то лікування є терапевтичним (тобто призначене для зменшення, полегшення або стабілізації існуючого небажаного стану або його побічних ефектів). Використовуваний у даному описі термін "протеасома" призначений для включення імуно- і конститутивних протеасом. Термін "заміщені" стосується частин, які мають замісники, що заміщають водень, на одному або більше атомах вуглецю основного ланцюга. Варто розуміти, що "заміщення" або "заміщений чимось" включає припущення умови, що таке заміщення відбувається відповідно до валентності, що допускається, заміщеного атома і замісника, і що заміщення приводить до одержання стійкої сполуки, наприклад, яка спонтанно не піддається трансформації, наприклад, перебудовою, циклізацією, елімінацією і т. д. Використовуваний у даному описі термін "заміщений" передбачається для включення всіх допустимих замісників органічних сполук. У широкому аспекті, допустимі замісники включають ациклічні і циклічні, розгалужені і нерозгалужені, карбоциклічні і гетероциклічні, ароматичні і неароматичні замісники органічних сполук. Допустимі замісники можуть бути одиночними або множинними й однаковими або різними для відповідних органічних сполук. З метою даного винаходу гетероатоми, такі як азот, можуть мати замісники водню і/або будь-які допустимі замісники описаних у даному винаході органічних сполук, що відповідають величинам валентності гетероатомів. Замісники можуть включати, наприклад, галоген, гідроксил, карбоніл (такий як карбоксил, алкоксикарбоніл, форміл або ацил), тіокарбоніл (такий як складний тіоефір), алкоксил, фосфорил, фосфат, фосфонат, фосфінат, аміно, амідо, амідин, імін, ціано, нітро, азидо, сульфгідрил, алкілтіо, сульфат, сульфонат, сульфамоїл, сульфонамідо, сульфоніл, гетероцикліл, аралкіл або ароматичну або гетероароматичну частину. Фахівцю в даній галузі буде зрозуміло, що частини, заміщені на вуглеводневому ланцюгу, при доцільності самі можуть бути заміщені. "Терапевтично ефективна кількість" сполуки відносно обговорюваного способу лікування стосується кількості сполук(и) у препараті, що при введенні як частини бажаної схеми дозування (ссавцю, переважно людині) полегшує симптом, полегшує стан або уповільнює початок розвитку патологічних станів відповідно до клінічно прийнятних стандартів для підлягаючого лікуванню розладу або стану, або з косметичною метою, наприклад, при доцільному співвідношенні користі/ризику, що застосовується для будь-якого медичного лікування. 18 UA 107569 C2 5 Термін "простий тіоефір" стосується алкільної групи, як визначено вище, що має приєднану до неї сірчану частину. У переважному варіанті здійснення "простий тіоефір" представлений -Sалкілом. Репрезентативні прості тіоефірні групи включають метилтіо, етилтіо і тому подібні. Використовуваний у даному описі термін "лікування" включає викликання зворотного розвитку, зменшення або припинення симптомів, клінічних ознак і стану, що лежить в основі патології, для того, щоб поліпшити або стабілізувати стан індивіда. ПРИКЛАДИ Приклад 1 Синтез Сполуки 1 10 15 20 25 Синтез Сполуки (A) До розчину простого метилового ефіру N-Boc-серину (43,8 г, 200 ммоль), триетиламіну (26,5 г, 260 ммоль) і 4-(диметиламіно)піридину в дихлорметані (1,2 л) при 0 °C додавали розчин бензилхлорформіату (41 г, 240 ммоль) у дихлорметані (250 мл) протягом 30 хвилин. Одержану суміш перемішували при такій же температурі протягом ще 3 годин. Додавали насичений водний розчин бікарбонату натрію (200 мл), і органічний шар відділяли, залишкову суміш екстрагували дихлорметаном (2×400 мл). Комбіновані органічні шари промивали насиченим водним бікарбонатом натрію (200 мл) і розсолом (200 мл), сушили над сульфатом натрію і фільтрували через Целіт-545. Розчинники видаляли при зниженому тиску, і залишок очищали флеш-хроматографією (силікагель, гексан і етилацетат). Сполуку (A) (54 г) виділяли і характеризували LC/MS (рідинною хроматографією/мас-спектрометрією) (LRMS (MH) m/z: 310,16). Синтез Сполуки (B) До розчину Сполуки (A) (54 г) у дихлорметані (200 мл) при 0 °C додавали трифтороцтову кислоту (200 мл) протягом 10 хвилин, і одержану суміш перемішували при такій же температурі 19 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 ще протягом 3 годин. Розчинники видаляли при зниженому тиску, і залишок поміщали у високий вакуум на ніч, одержуючи сіль TFA (трифтороцтової кислоти) Сполуки (B), яку характеризували LC/MS (LRMS (MH) m/z: 210,11). Синтез Сполуки (C) До розчину Сполуки (B) (43,8 г, 200 ммоль), простого метилового ефіру N-Boc-серину (36,7 г, 167 ммоль), HOBT (гідроксибензотриазолу) (27 г, 200 ммоль) і HBTU (1H-бензотриазолію) (71,4 г, 200 ммоль) у тетрагідрофурані (1,2 л) при 0 °C додавали розчин N, N-діетилізопропіламіну (75 г, 600 ммоль) у тетрагідрофурані (250 мл) протягом 10 хвилин, і pН одержаної суміші склав ~8. Суміш перемішували при кімнатній температурі ще протягом 5 годин. Більшу частину розчинника видаляли при зниженому тиску при кімнатній температурі і розбавляли насиченим водним розчином бікарбонату натрію (400 мл). Потім його екстрагували етилацетатом (3×400 мл), промивали бікарбонатом натрію (100 мл) і розсолом (100 мл). Об'єднані органічні шари сушили над сульфатом натрію і фільтрували через Целіт-545. Розчинники видаляли при зниженому тиску. І залишок очищали флеш-хроматографією (силікагель, гексан і етилацетат). Сполуку (C) (65 г) виділяли і характеризували LC/MS (LRMS (MH) m/z: 411,21). Синтез Сполуки (D) До розчину Сполуки (C) (18 г) у дихлорметані (100 мл) при 0 °C додавали трифтороцтову кислоту (80 мл) протягом 5 хвилин, і одержану суміш перемішували при тій же температурі протягом ще 3 годин. Розчинники видаляли при зниженому тиску, і залишок поміщали у високий вакуум на ніч, одержуючи сіль TFA проміжної сполуки (D), яку характеризували LC/MS (LRMS (MH) m/z: 311,15). Синтез Сполуки (E) До розчину етил-2-метилтіазол-5-карбоксилату (15 г, 88 ммоль) у тетрагідрофурані (50 мл) при 0 °C додавали водний розчин гідроксиду натрію (5N, 50 мл) протягом 10 хвилин, і одержаний розчин перемішували при кімнатній температурі протягом ще 2 годин. Його потім підкисляли хлористоводневою кислотою (2N) до pН=1 і екстрагували тетрагідрофураном (3×100 мл). Об'єднані органічні шари промивали розсолом (30 мл) і сушили над сульфатом натрію. Більшу частину розчинників видаляли при зниженому тиску і залишок ліофілізували для одержання Сполуки (E) (14 г). Синтез Сполуки (F) До розчину Сполуки (D) (41 ммоль) і 2-метилтіазол-5-карбонової кислоти (E) (6,0 г, 42 ммоль), HOBT (7,9 г, 50 ммоль) і HBTU (18,0 г, 50 ммоль) у тетрагідрофурані (800 мл) при 0 °C додавали розчин N, N-діетилізопропіламіну (~50 г) у тетрагідрофурані (200 мл) протягом 5 хвилин доти, поки його pН не досягне рівня приблизно 8,5. Одержану суміш перемішували при такій же температурі протягом ночі. Потім її гасили насиченим водним розчином бікарбонату натрію (200 мл), і більшу частину розчинників видаляли при зниженому тиску. Залишкову суміш екстрагували етилацетатом (3×400 мл). Об'єднані органічні шари промивали насиченим водним розчином бікарбонату натрію (200 мл) і розсолом (100 мл), сушили над сульфатом натрію і фільтрували через Целіт-545. Розчинники видаляли при зниженому тиску, і залишок очищали флеш-хроматографією (силікагель, етилацетат з 2 % метанолом). Сполуку (F) (17,1 г) виділяли і характеризували LC/MS (LRMS (MH) m/z: 436,15). Синтез Сполуки (G) До розчину Сполуки (F) (17,1 г, 95 ммоль) у метанолі (300 мл) додавали 10 % Pd/C (3 г). Одержаній суміші давали можливість перемішуватися при тиску 1 атм. водню протягом 48 годин. Суміш фільтрували через Целіт-545, і фільтрувальний корж промивали метанолом (≈200 мл). Органічні шари концентрували при зниженому тиску, і залишок поміщали у високий вакуум для одержання Сполуки (G), яку характеризували LC/MS (LRMS (MH) m/z: 346,1). Синтез Сполуки (H) N-Boc-фенілаланінкетоепоксид (140 мг, 0,46 ммоль) розбавляли DCM (дихлорметаном) (2 мл) і охолоджували до 0 °C. До даного розчину додавали трифтороцтову кислоту (6 мл). Охолоджувальну баню видаляли і реакційну суміш перемішували протягом 1 години, і в цей час TLC (тонкошарова хроматографія) показала повну витрату вихідного матеріалу. Одержаний розчин концентрували при зниженому тиску і поміщали у високий вакуум для одержання солі TFA Сполуки (H). Синтез Сполуки 1 До розчину зазначеної вище Сполуки (H) (131 мг, 0,38 ммоль)і (J) (0,46 ммоль), HOBT (75 мг, 0,48 ммоль) і HBTU (171 мг, 0,48 ммоль) у тетрагідрофурані (20 мл) і N, N-диметилформаміді (10 мл) при 0 °C по краплях додавали N, N-діетилізопропіламін (1 мл). Суміш перемішували при такій же температурі ще протягом 5 годин. Потім її гасили насиченим водним розчином бікарбонату натрію (20 мл), і більшу частину розчинників видаляли при зниженому тиску. Потім 20 UA 107569 C2 5 10 15 20 25 30 35 40 45 50 55 60 залишкову суміш екстрагували етилацетатом (340 мл). Об'єднані органічні шари промивали насиченим водним розчином бікарбонату натрію (20 мл) і розсолом (10 мл), сушили над сульфатом натрію і фільтрували через Целіт-545. Розчинники видаляли при зниженому тиску, і залишок очищали HPLC (ВЕРХ) (0,02M водний ацетат амонію й ацетонітрил (66/34) для одержання Сполуки 1 (92 мг), яку ліофілізували і характеризували LC/MS (LRMS (MH) m/z: 533,2). Приклад 2 Аморфну Сполуку 1 (50 мг) розчиняли в ацетонітрилі (1 мл), потім додавали деіонізовану воду (2 мл), і розчин доводили до наднасичення повільним випарюванням 1 мл протягом приблизно 1-2 тижнів. Одержані кристали фільтрували, промивали 1 мл розчину ацетонітрилвода у співвідношенні 1:2 і сушили у вакуумі протягом 12 годин для одержання кристалічного поліморфу Сполуки 1 (25 мг) із точкою плавлення 148 °C. Характерна крива DSC зразка, зареєстрована диференціальним скануючим калориметром TA Instruments Differential Scanning Calorimeter 2920 при швидкості нагрівання 10 °C/хвилину, показана на фіг. 1. Приклад 3 Аморфну Сполуку 1 (611 мг) розчиняли в тетрагідрофурані (5 мл) з наступним додаванням гексанів (5 мл), і в розчин вносили затравку кристалічного поліморфу Сполуки 1, одержаного в прикладі 2, і розчин доводили до наднасичення повільним випарюванням 5 мл протягом приблизно 17 годин. Одержані кристали фільтрували, промивали 1 мл розчину тетрагідрофуран-гексани у співвідношенні 1:1 і сушили у вакуумі протягом 12 годин для одержання кристалічного поліморфу Сполуки 1 (150 мг) із точкою плавлення 147 °C. Приклад 4 Аморфну Сполуку 1 (176 мг) розчиняли в тетрагідрофурані (5 мл), потім додавали толуол (25 мл). У розчин вносили затравку кристалічного поліморфу Сполуки 1, одержаного в прикладі 2, і розчин доводили до наднасичення повільним випарюванням 20 мл протягом приблизно 2 днів. Одержані кристали фільтрували, промивали 15 мл толуолу і сушили у вакуумі протягом 12 годин для одержання кристалічного поліморфу Сполуки 1 (88 мг) із точкою плавлення 149 °C. Приклад 5 Аморфну Сполуку 1 (312 мг) розчиняли в толуолі (50 мл), нагрітому до приблизно 100ºC, для завершення розчинення, потім додавали гексани (50 мл), і в розчин вносили затравку кристалічного поліморфу Сполуки 1, одержаного в прикладі 2, і розчин доводили до наднасичення повільним випарюванням 60 мл протягом приблизно 2 днів. Одержані кристали фільтрували, промивали 10 мл толуолу і сушили у вакуумі протягом 12 годин для одержання кристалічного поліморфу Сполуки 1 (156 мг) із точкою плавлення 149 °C. Приклад 6 Аморфну Сполуку 1 (1,4 г) розчиняли в толуолі (25 мл), нагрітому до 50ºC, для завершення розчинення, потім розчин доводили до наднасичення охолодженням до 22ºC і наданням сполуці можливості кристалізуватися протягом 12 годин. Одержані кристали фільтрували, промивали 5 мл гексанів і сушили у вакуумі протягом 12 годин для одержання кристалічного поліморфу Сполуки 1 (0,94 г) із точкою плавлення 149 °C. Приклад 7 Синтез Сполуки 1 Синтез Сполуки (H) N-Boc-фенілаланінкетоепоксид (1,0 еквівалента) розчиняли в DCM (3 л/кг N-Bocфенілаланінкетоепоксиду) у 3-горлій колбі з круглим дном в інертній атмосфері, і розчин охолоджували на льодяній бані. Потім додавали TFA (5,0 еквівалента) зі швидкістю для підтримання внутрішньої температури нижче 10 °C. Потім реакційну суміш нагрівали приблизно до 20 °C і перемішували протягом 1-3 годин. Потім до реакційної суміші додавали MTBE (простий метил-трет-бутиловий ефір) (3,6 л/кг N-Boc-фенілаланінкетоепоксиду) при підтриманні температури суміші нижче 25 °C. Потім додавали гептан (26,4 л/кг N-Bocфенілаланінкетоепоксиду), реакційну суміш охолоджували до температури від -5 до 0 °C протягом 2-3 годин для забезпечення можливості кристалізації Сполуки (H). Білу тверду речовину фільтрували і промивали гептаном (3 л/кг N-Boc-фенілаланінкетоепоксиду). Білу тверду речовину потім сушили у вакуумі протягом 12 годин при 22 °C. Одержаний вихід склав 86 %, при ВЕРХ чистоті 99,4 %. Синтез Сполуки 1 Сполуку (H) (1,2 еквівалента), Сполуку (G) (1,0 еквівалента), HBTU (1,2 еквівалента), HOBT (1,2 еквівалента) і N-метилпіролідинон (8 л/кг Сполуки (G)) додавали в суху колбу при інертній температурі, і суміш перемішували при 23 °C для завершення розчинення. Потім реакційну суміш охолоджували до температури від -5 до 0 °C, і діізопропілетиламін (2,1 еквівалента) 21 UA 107569 C2 5 10 15 20 25 30 35 40 45 додавали протягом 15 хвилин, у той же час, підтримуючи внутрішню температуру менше ніж 0 °C. Реакційну суміш перемішували при 0 °C протягом 12 годин. Неочищену Сполуку 1 осаджували виливанням реакційної суміші на 8 % бікарбонат натрію (40 л/кг Сполуки (G)) і суспензію неочищеної Сполуки 1 перемішували протягом 12 годин при 2025 °C, з наступним перемішуванням при 0-5 °C протягом 1 години. Білу тверду речовину фільтрували і промивали водою (5 л/кг Сполуки (G)). Потім білу тверду речовину ресуспендували у воді (15 л/кг) протягом 3 годин при 20-25 °C, фільтрували і промивали водою (5 л/кг Сполуки (G)) і ізопропілацетатом (2×2 л/кг Сполуки (G)). Білу тверду речовину сушили у вакуумі при 45 °C до постійної маси. Вихід неочищеної Сполуки 1 склав 65 %, при ВЕРХ чистоті 97,2 %. Неочищену Сполуку 1 повністю розчиняли в ізопропілацетаті (20 л/кг неочищеної Сполуки 1) перемішуванням і нагріванням при 85 °C. Потім розчин у гарячому стані фільтрували для видалення будь-якого матеріалу у вигляді частинок, і розчин знову нагрівали до 85 °C з одержанням прозорого розчину. Прозорому розчину давали можливість остудитися зі швидкістю 10 °C на годину до 20 °C, коли відбувалася суттєва кристалізація Сполуки 1. Суспензію перемішували при 20 °C протягом 6 годин з наступним перемішуванням при 0-5 °C протягом мінімум 2 годин і фільтрацією і промиванням ізопропілацетатом (1 л/кг неочищеної Сполуки 1). Очищену Сполуку 1 сушили у вакуумі при 45 °C протягом мінімум 24 годин до постійної маси. Вихід Сполуки 1 склав 87 %, при ВЕРХ чистоті 97,2 %. Приклад 8 Синтез Сполуки 1 Сполуку (H) (1,1 еквівалента), Сполуку (G) (1,0 еквівалента), HBTU (1,5 еквівалента), HOBT (1,5 еквівалента) і DMF (8 л/кг Сполуки (G)) додавали в суху колбу в інертній атмосфері, і суміш перемішували при 23 °C для завершення розчинення. Потім реакційну суміш охолоджували до температури від -5 до 0 °C, і додавали діізопропілетиламін (2,1 еквівалента) протягом 15 хвилин, у той же час, підтримуючи внутрішню реакційну температуру менше ніж 0 °C. Потім реакційну суміш перемішували при 0 °C протягом 3 годин. Реакційну суміш гасили додаванням попередньо охолодженого насиченого розчину бікарбонату натрію (94 л/кг Сполуки (G)), у той же час, підтримуючи внутрішню температуру на рівні менше 10 °C. Вміст потім переносили в ділильну лійку. Суміш екстрагували етилацетатом (24 л/кг Сполуки (G)), і органічний шар промивали насиченим розчином бікарбонату натрію (12 л/кг Сполуки (G)) і насиченим розчином хлориду натрію (12 л/кг Сполуки (G)). Органічний шар концентрували при зниженому тиску при температурі бані менше ніж 30 °C до 15 л/кг Сполуки (G), з наступною спільною перегонкою з ізопропілацетатом (224 л/кг PR022). Кінцевий об'єм доводили до 82 л/кг Сполуки (G) ізопропілацетатом перед нагріванням до 60 °C з одержанням прозорого розчину. Суміші прозорого розчину давали можливість остудитися до 50 °C перед додаванням кристалів затравки. Розчину давали можливість остудитися до 20 °C, коли відбувалася суттєва кристалізація Сполуки 1. Суспензію перемішували при 0 °C протягом 12 годин перед фільтрацією і промиванням ізопропілацетатом (2 л/кг Сполуки 1). Сполуку 1 сушили у вакуумі при 20 °C протягом 12 годин до постійної маси. Вихід Сполуки 1 склав 48 %, при ВЕРХ чистоті 97,4 %. Еквіваленти Фахівцям у даній галузі буде зрозуміло або вони зможуть визначити не більше ніж звичайним експериментуванням численні еквіваленти сполук і способи їх застосування, описані в даній заявці. Вважається, що такі еквіваленти знаходяться в межах обсягу даного винаходу й охоплюються представленою нижче формулою винаходу. Усі наведені вище посилання і публікації включені в даний опис шляхом посилання. ФОРМУЛА ВИНАХОДУ 50 1. Спосіб одержання кристалічної сполуки формули (II) 22 UA 107569 C2 OMe O N H N S O O H N N H O O OMe Me 5 10 15 20 25 30 , (II) в якому здійснюють: (і) одержання розчину сполуки формули (II) в органічному розчиннику; (іі) доведення розчину до наднасичення, щоб викликати утворення кристалів; і (ііі) виділення кристалів. 2. Спосіб за п. 1, де органічний розчинник вибирають з ацетонітрилу, етилацетату, гептанів, гексанів, ізопропілацетату, метанолу, метилетилкетону, тетрагідрофурану, толуолу і води або будь-якої їх комбінації. 3. Спосіб за п. 2, де органічний розчинник вибирають з ацетонітрилу, гептанів, гексанів, метанолу, тетрагідрофурану і толуолу. 4. Спосіб за п. 3, де органічний розчинник вибирають з гексанів, тетрагідрофурану і толуолу. 5. Спосіб за будь-яким з пп. 1-4, де доведення розчину до наднасичення здійснюють додаванням антирозчинника, наданням можливості розчину остудитися, зменшенням об'єму розчину або будь-якою їх комбінацію. 6. Спосіб за п. 5, де доведення розчину до наднасичення здійснюють додаванням антирозчинника, охолодженням розчину до температури навколишнього середовища і зменшенням об'єму розчину. 7. Спосіб за п. 5, де антирозчинник додають повільно. 8. Спосіб за п. 5, де антирозчинник вибирають з гексанів, толуолу і води. 9. Спосіб за п. 5, де зменшення об'єму здійснюють випарюванням. 10. Спосіб за будь-яким з пп. 1-9, який додатково включає внесення затравки в розчин. 11. Спосіб за п. 10, який додатково включає промивання кристалів. 12. Спосіб за п. 11, де промивання включає промивання рідиною, вибраною з антирозчинника, ацетонітрилу, гептанів, гексанів, метанолу, тетрагідрофурану, толуолу, води або їх комбінації. 13. Спосіб за п. 12, де промивання включає промивання комбінацією антирозчинника й органічного розчинника. 14. Спосіб за п. 13, де антирозчинник представляє гексани або гептани. 15. Спосіб за будь-яким з пп. 1-14, де виділення кристалів здійснюють фільтрацією кристалів. 16. Спосіб за будь-яким з пп. 1-15, в якому додатково здійснюють сушіння кристалів при зниженому тиску. 17. Кристалічна сполука, яка має структуру формули (II) OMe O H N N H N S O O O N H OMe O Me 35 . (II) 18. Кристалічна сполука за п. 17, яка має DSC термограм, по суті, як показано на фіг. 1. 19. Кристалічна сполука за п. 17, яка має точку плавлення від приблизно 140 до приблизно 155 °С. 20. Кристалічна сполука за п. 17, яка має точку плавлення від приблизно 145 до приблизно 150 °С. 21. Кристалічна сполука за п. 17, яка має тип XRPD, по суті, як показано на фіг. 2. 23 UA 107569 C2 22. Кристалічна сполука за п. 17, яка має величини 2θ 8,94; 9,39; 9,76; 10,60; 11,09; 12,74; 15,27; 17,74; 18,96; 20,58; 20,88; 21,58; 21,78; 22,25; 22,80; 24,25; 24,66; 26,04; 26,44; 28,32; 28,96; 29,65; 30,22; 30,46; 30,78; 32,17; 33,65; 34,49; 35,08; 35,33; 37,85; 38,48. 23. Спосіб одержання кристалічної сполуки формули (II) OMe O N H N S 5 O O H N O N H OMe O Me , (II) в якому здійснюють (і) взаємодію сполуки формули (III) X O + H3N O 10 , (IIІ) де X представляє будь-який придатний протиіон, зі сполукою формули (IV) у другому органічному розчиннику OMe O H N N H N S O O OH OMe Me 15 , (IV) (іі) одержання розчину сполуки формули (II) у другому органічному розчиннику; (ііі) доведення розчину до наднасичення для забезпечення можливості утворення кристалів; і (iv) відділення кристалів з одержанням кристалічної сполуки формули (II). 24 UA 107569 C2 25 UA 107569 C2 26 UA 107569 C2 27 UA 107569 C2 Комп’ютерна верстка М. Шамоніна Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCrustalline tripeptide epoxy ketone protease inhibitors
Автори англійськоюPhiasivongsa, Pasit, Sehl, Louis, C.
Автори російськоюПхиасивонгса Пасит, Сехл Луис С.
МПК / Мітки
МПК: A61K 38/55, C07K 5/08, C07D 277/56
Мітки: інгібітори, епоксикетонпротеази, трипептидні, кристалічні
Код посилання
<a href="https://ua.patents.su/30-107569-kristalichni-tripeptidni-ingibitori-epoksiketonproteazi.html" target="_blank" rel="follow" title="База патентів України">Кристалічні трипептидні інгібітори епоксикетонпротеази</a>
Попередній патент: Спосіб і система для одержання горючого газу з палива
Наступний патент: Безспиртовий водний розчин, що містить пропранолол
Випадковий патент: Механічна блокувальна система для панелей підлоги












