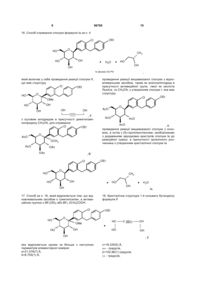
Кристалічні сольвати і комплекси похідних (is)-1,5-ангідро-l-c-(3-((феніл)метил)феніл)-d-глюцитолу з амінокислотами як інгібітори білка sglt2, придатні у лікуванні діабету
Номер патенту: 96765
Опубліковано: 12.12.2011
Автори: Дешпанде Прашант П., Рамакрішнан Шрівідья, Дімарко Джон Д., Гоугоутас Джек З., Рібель Петер, Бін Джеффрі Т., Ванг Ченчі, Ніршль Александра А., Лаі Чіаджен, Гроссо Джон Ентоні, Сінгх Джанак, Лобінгер Хільдегард
Формула / Реферат
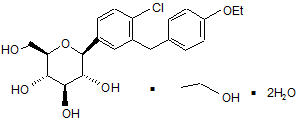
1. Кристалічна структура сполуки за формулою І
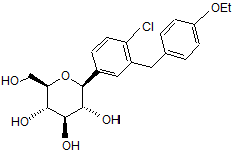 , І
, І
вибрана із сукупності, що складається із (S)-PG (форми SC-3), (R)-PG (форми SD-3), ЕtOН (форми SA-1), структури з етиленгліколем (EG) (форми SB-1) та структури з етиленгліколем (EG) (форми SB-2).
2. Кристалічна структура за п. 1, де кожна із зазначених структур є у практично чистій формі.
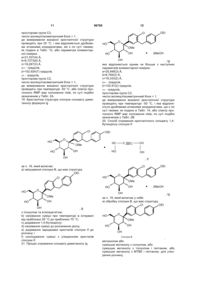
3. Кристалічна структура сполуки формули І
 І
І
у формі її сольвату пропіленгліколю.
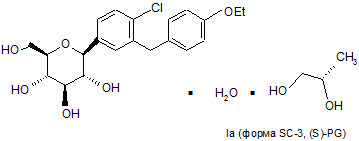
4. Кристалічна структура за п. 1, що має формулу Іа
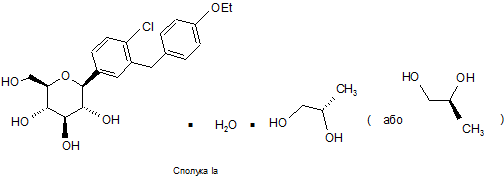 .
.
5. Кристалічна структура за п. 4, яка відрізняється одним чи більше із такого:
а) параметри елементарної комірки:
а=11,2688(8) Å,
b=4,8093(3) Å,
с=46,723(3) Å,
a=90 градусів,
b=90 градусів,
g=90 градусів,
просторова група: Р212121,
число молекул/асиметричний блок = 1,
де вимірювання зазначеної кристалічної структури проводять при кімнатній температурі і яка відрізняється дробовими атомними координатами, що є по суті такими, як подано в Табл. 4;
b) порошкова рентгенограма, що містить значення 2q (CuKa l=1,5418 Å), вибрані із сукупності, що складається із 3,8±0,1, 7,6±0,1,8,1±0,1, 8,7±0,1, 15,2±0,1, 15,7±0,1, 17,1±0,1, 18,9±0,1 і 20,1±0,1, при кімнатній температурі;
c) спектр ЯМР 13С у твердій фазі, який має по суті подібні положення піків на 16,2, 17,6, 39,3, 60,9, 63,3, 69,8, 76,9, 78,7, 79,4, 113,8, 123,6, 129,3, 130,5, 132,0, 135,7, 139,1 і 158,0 млн. ч., визначені на 400 МГц спектрометрі відносно TMS на нульовому рівні;
d) термограма диференціальної сканувальної калориметрії має ендотермічний провал на ділянці від приблизно 50 °C до приблизно 78 °C або як показано на Фіг. 7;
e) крива термогравіметричного аналізу показує приблизно 18,7 % втрату ваги в інтервалі від приблизно кімнатної температури до приблизно 240 °C або як показано на Фіг. 5; або
f) спектр протонного ЯМР, який має положення піків, по суті подібні зазначеним у Табл. 1А.
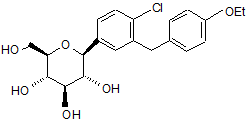
6. Кристалічна структура за п. 1, яка має формулу Іb
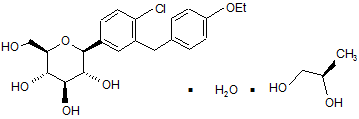 Ib.
Ib.
7. Кристалічна структура за п. 6, яка відрізняється одним чи більше із такого:
a) порошкова рентгенограма, що містить значення 2q (CuKa l=1,5418 Å), які вибрані із сукупності, що складається із 3,9±0,1, 8,0±0,1,8,7±0,1, 15,3±0,1, 15,6±0,1, 17,2±0,1, 19,2±0,1, 19,9±0,1 і 20,3±0,1, при кімнатній температурі;
b) спектр ЯМР 13С у твердій фазі, який має по суті подібні положення піків на 15,8, 17,6, 39,0, 60,9, 63,2, 67,4, 69,7, 77,3, 79,2, 79,8, 113,3, 123,6, 129,0, 130,4, 132,0, 135,6, 139,2 та 157,9 млн. ч., визначені на 400 МГц спектрометрі відносно TMS на нульовому рівні;
c) термограма диференціальної сканувальної калориметрії, що має ендотермічний провал на ділянці від приблизно 43 °C до приблизно 60 °C або як показано на Фіг. 8; або
d) крива термогравіметричного аналізу показує приблизно 18,7 % втрату ваги в інтервалі від приблизно кімнатної температури до приблизно 235 °C або як показано на Фіг. 6.
8. Кристалічна структура за п. 1, яка вибрана з групи, що включає:
(A) кристалічна структура EtOH (форма SA-1), яка відрізняється одним чи більше наступними параметрами елементарної комірки:
а=11,519(1) Å,
b=4,799(1) Å,
с=22,648(1) Å,
a= - градусів,
b=94,58(1) градусів,
g= - градусів,
просторова група: Р21,
число молекул/асиметричний блок = 1,
де вимірювання зазначеної кристалічної структури проводять при температурі -50 °C і яка відрізняється дробовими атомними координатами, що є по суті такими, як подано в Табл. 6;
(B) кристалічна структура EG (форма SB-1), яка відрізняється одним чи більше параметрами елементарної комірки, що по суті дорівнюють таким значенням: спектр ЯМР 13С у твердій фазі, яка має по суті подібні положення піків на 12,49, 59,16, 60,61, 60,69, 68,10, 72,51, 76,11, 78,51, 79,02, 112,09, 125,16, 126,47, 127,38, 128,61, 129,02, 129,73, 135,62, 137,48 і 154,70 млн. ч., визначені на 400 МГц спектрометрі відносно TMS на нульовому рівні;
параметри елементарної комірки:
а=11,593(8) Å,
b=4,766(5) Å,
с=22,78(3) Å
a= - градусів,
b=93,38(9) градусів,
g= - градусів,
просторова група Р21,
число молекул/асиметричний блок = 1,
де вимірювання зазначеної кристалічної структури проводять при -50 °C, і яка відрізняється дробовими атомними координатами, що є по суті такими, як подано в Табл. 8; та
(C) кристалічна структура EG (SB-2), яка відрізняється одним чи більше з наступних параметрів елементарної комірки:
а=11,4950(1) Å,
b=4,7443(1) Å,
с=44,4154(5) Å,
a= - градусів,
b= - градусів,
g= - градусів,
просторова група: Р212121,
число молекул/асиметричний блок = 1,
де вимірювання вказаної кристалічної структури проводять при кімнатній температурі, і яка відрізняється дробовими атомними координатами, що є по суті такими, як подано в Табл. 10.
9. Фармацевтична композиція, яка містить ефективну кількість кристалічної структури сполуки формули І за п. 1 і фармацевтично прийнятний носій або розріджувач.
10. Фармацевтична композиція за п. 9, яка містить терапевтично ефективну кількість кристалічної структури (S)-PG і фармацевтично прийнятний носій або розріджувач.
11. Фармацевтична композиція за п. 9, де зазначену кристалічну структуру вибирають із сукупності, що складається із:
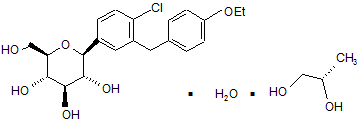 , Ia
, Ia
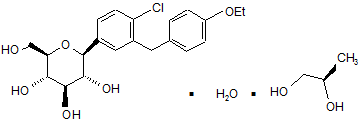 , Ib
, Ib
 Ic та
Ic та
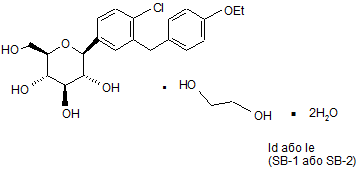 .
.
12. Спосіб лікування діабету, резистентності до інсуліну, гіперглікемії, гіперінсулінемії, підвищених рівнів жирних кислот або гліцерину в крові, гіперліпідемії, дисліпідемії, ожиріння, гіпертригліцеридемії або діабетичних ускладнень у ссавця, який включає введення ссавцю терапевтично ефективної кількості кристалічної структури за п. 4.
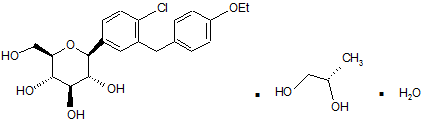
13. Спосіб отримання сполуки формули Іа за п. 4
 ,
,
який включає у себе:
проведення реакції сполуки формули А
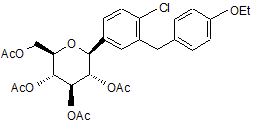 A
A
в органічному розчиннику з основою і (S)-пропіленгліколем, необов'язкове додавання зародкових кристалів (S)-PG сполуки Іа та отримання в результаті сполуки за формулою Іа.
14. Спосіб отримання кристалічної сполуки Іа за п. 4, який включає у себе проведення реакції сполуки В, що має структуру
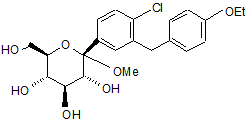 , В
, В
з відновлювальним засобом, таким як алкілсилілгідрид при наявності активаційної групи, такої як кислота Льюїса, в результаті чого утворюється сполука І, що має структуру
 , I
, I
проведення реакції сполуки І з (S)-пропіленгліколем, необов'язково з додаванням зародкових кристалів сполуки Іа до реакційної суміші в присутності органічного розчинника для отримання кристалічної сполуки Іа
 Ia.
Ia.
15. Спосіб за п. 14, який відрізняється тим, що відновлювальним засобом є триетилсилан, а активаційною групою є BF3OEt2 або BF3·2CH3COOH.
16. Спосіб отримання сполуки формули Іа за п. 4
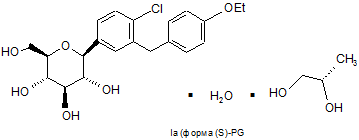 ,
,
який включає у себе проведення реакції сполуки If, що має структуру
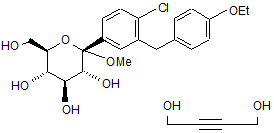 , If
, If
з оцтовим ангідридом в присутності диметиламінопіридину CH3CN, для отримання
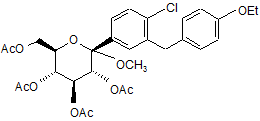 , B'
, B'
проведення реакції вищевказаної сполуки з відновлювальним засобом, таким як алкілсилілгідрид в присутності активаційної групи, такої як кислота Льюїса, та CH3CN, з утворенням сполуки І, яка має структуру
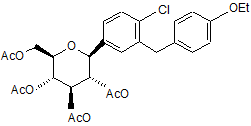 , А
, А
проведення реакції вищевказаної сполуки з основою, а потім з (S)-пропіленгліколем, необов'язково з додаванням зародкових кристалів сполуки Іа до реакційної суміші, в присутності органічного розчинника з утворенням кристалічної сполуки Іа
 Ia.
Ia.
17. Спосіб за п. 16, який відрізняється тим, що відновлювальним засобом є триетилсилан, а активаційною групою є BF3OEt2 або BF3·2CH3COOH.
18. Кристалічна структура 1,4-сольвату бутиндіолу формули If
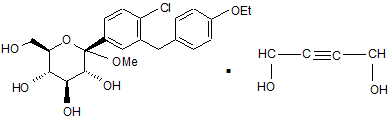 , If
, If
яка відрізняється одним чи більше з наступних параметрів елементарної комірки:
а=21,576(7) Å,
b=6,755(1) Å,
с=18,335(5) Å,
a= - градусів,
b=102,96(1) градусів,
g= - градусів,
просторова група С2,
число молекул/асиметричний блок = 1,
де вимірювання вказаної кристалічної структури проводять при 25 °C, і яка відрізняється дробовими атомними координатами, які є по суті такими, як подано в Табл. 12, або параметри елементарної комірки:
а=21,537(4) Å,
b=6,7273(6) Å,
с=18,267(3) Å,
a= - градусів,
b=102,924(7) градусів,
g= - градусів,
просторова група С2,
число молекул/асиметричний блок = 1,
де вимірювання вказаної кристалічної структури проводять при температурі -50 °C, або спектр протонного ЯМР має положення піків, по суті подібні зазначеним у Табл. 2А.
19. Кристалічна структура сполуки сольвату диметанолу формули Іg
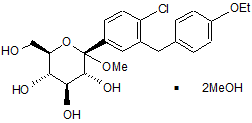 , Ig
, Ig
яка відрізняється одним чи більше з наступних параметрів елементарної комірки:
а=20,948(3) Å,
b=6,794(2) Å,
с=18,333(2) Å,
a= - градусів,
b=102,91(2) градусів,
g= - градусів,
просторова група С2,
число молекул/асиметричний блок = 1,
де вимірювання вказаної кристалічної структури проводять при температурі -50 °C, і яка відрізняється дробовими атомними координатами, що є по суті такими, як подано в Табл. 14, або спектр протонного ЯМР має положення піків, по суті подібні зазначеним у Табл. 2В.
20. Спосіб отримання кристалічного сольвату 1,4-бутиндіолу сполуки If
 If
If
за п. 18, який включає
a) змішування сполуки В, що має структуру
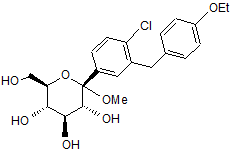 , B
, B
з толуолом та етилацетатом;
b) нагрівання суміші при температурі в інтервалі від приблизно 50 °C до приблизно 70 °C;
c) додавання 1,4-бутиндіолу;
d) нагрівання суміші до розчинення діолу;
e) додавання зародкових кристалів сполуки If до розчину; і
f) охолодження суміші з утворенням кристалів сполуки If.
21. Процес отримання сольвату диметанолу Іg
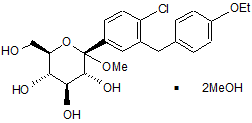 Ig
Ig
за п. 19, який включає у себе
a) обробку сполуки В, що має структуру
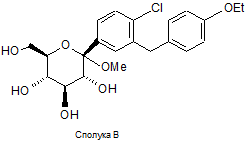 ,
,
метанолом або
сумішшю метанолу з толуолом, або
сумішшю метанолу з толуолом і гептаном, або сумішшю метанолу з МТВЕ і гептаном, для утворення розчину;
b) необов'язкове додавання зародкових кристалів сольвату диметанолу формули Іg до розчину; та
c) утворення кристалів сольвату диметанолу Іg.
22. Кристалічна структура сполуки за формулою II
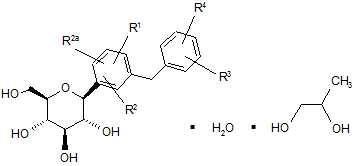 , II
, II
яка є сольватом (S)-пропіленгліколю або сольватом (R)-пропіленгліколю, або їх сумішшю, де
R1, R2 і R2a незалежно є воднем, ОН, OR5, алкілом, -OCHF2, -OCF3, -SR5a або галогеном;
R3 і R4 незалежно є воднем, ОН, OR5b, алкілом, алкеною, алкіном, циклоалкілом, CF3, -OCHF2, -OCF3, галогеном, -CONR6R6a, -CO2R5c, -CO2H, -COR6b, -CH(OH)R6c, -CH(OR5d)R6d, -CN, -NHCOR5e, -NHSO2R5f, -NНSO2арилом, -SR5g, -SOR5h, -SO2R5i, -SО2арилом або п'яти-, шести- чи семичленним гетероциклом, який може містити в кільці від 1 до 4 гетероатомів N, О, S, SO і/або SO2, або R3 і R4 разом з вуглецями, до яких вони приєднані, утворюють анельований п'яти-, шести- або семичленний карбоцикл або гетероцикл, який може містити в кільці від 1 до 4 гетероатомів N, О, S, SO і/або SO2;
R5, R5a, R5b, R5c, R5d, R5e, R5f, R5g, R5h і R5i незалежнo є алкілом, алкеною або алкіном; та
R6, R6a, R6b, R6c i R6d незалежно є воднем, алкілом, арилом, алкіларилом або циклоалкілом, або R6 і R6a разом з азотом, до якого вони приєднані, утворюють анельований п'яти-, шести- або семичленний гетероцикл, який може містити в кільці від 1 до 4 гетероатомів N, О, S, SO і/або SO2.
Текст
1. Кристалічна структура сполуки за формулою І 2 3 96765 4 OEt Cl HO O HO CH3 . OH HO H2O . OH ( або HO CH3 OH OH Сполука Ia . 5. Кристалічна структура за п. 4, яка відрізняється одним чи більше із такого: а) параметри елементарної комірки: а=11,2688(8) Å, b=4,8093(3) Å, с=46,723(3) Å, =90 градусів, =90 градусів, =90 градусів, просторова група: Р212121, число молекул/асиметричний блок = 1, де вимірювання зазначеної кристалічної структури проводять при кімнатній температурі, і яка відрізняється дробовими атомними координатами, що є по суті такими, як подано в Табл. 4; b) порошкова рентгенограма, що містить значення 2 (CuK =1,5418 Å), вибрані із сукупності, що складається із 3,8±0,1, 7,6±0,1,8,1±0,1, 8,7±0,1, 15,2±0,1, 15,7±0,1, 17,1±0,1, 18,9±0,1 і 20,1±0,1, при кімнатній температурі; 13 c) спектр ЯМР С у твердій фазі, який має по суті подібні положення піків на 16,2, 17,6, 39,3, 60,9, 63,3, 69,8, 76,9, 78,7, 79,4, 113,8, 123,6, 129,3, 130,5, 132,0, 135,7, 139,1 і 158,0 млн. ч., визначені на 400 МГц спектрометрі відносно TMS на нульовому рівні; d) термограма диференціальної сканувальної калориметрії має ендотермічний провал на ділянці від приблизно 50 °C до приблизно 78 °C або як показано на Фіг. 7; e) крива термогравіметричного аналізу показує приблизно 18,7 % втрату ваги в інтервалі від приблизно кімнатної температури до приблизно 240 °C або як показано на Фіг. 5; або f) спектр протонного ЯМР, який має положення піків, по суті подібні зазначеним у Табл. 1А. 6. Кристалічна структура за п. 1, яка має формулу Іb OEt Cl HO ). O CH3 OH HO OH 7. Кристалічна структура за п. 6, яка відрізняється одним чи більше із такого: a) порошкова рентгенограма, що містить значення 2 (CuK =1,5418 Å), які вибрані із сукупності, що складається із 3,9±0,1, 8,0±0,1,8,7±0,1, 15,3±0,1, 15,6±0,1, 17,2±0,1, 19,2±0,1, 19,9±0,1 і 20,3±0,1, при кімнатній температурі; 13 b) спектр ЯМР С у твердій фазі, який має по суті подібні положення піків на 15,8, 17,6, 39,0, 60,9, 63,2, 67,4, 69,7, 77,3, 79,2, 79,8, 113,3, 123,6, 129,0, 130,4, 132,0, 135,6, 139,2 та 157,9 млн. ч., визначені на 400 МГц спектрометрі відносно TMS на нульовому рівні; c) термограма диференціальної сканувальної калориметрії, що має ендотермічний провал на ділянці від приблизно 43 °C до приблизно 60 °C або як показано на Фіг. 8; або d) крива термогравіметричного аналізу показує приблизно 18,7 % втрату ваги в інтервалі від приблизно кімнатної температури до приблизно 235 °C або як показано на Фіг. 6. . H2O . HO OH Ib. 8. Кристалічна структура за п. 1, яка вибрана з групи, що включає: (A) кристалічна структура EtOH (форма SA-1), яка відрізняється одним чи більше наступними параметрами елементарної комірки: а=11,519(1) Å, b=4,799(1) Å, с=22,648(1) Å, = - градусів, =94,58(1) градусів, = - градусів, просторова група: Р21, число молекул/асиметричний блок = 1, де вимірювання зазначеної кристалічної структури проводять при температурі -50 °C, і яка відрізняється дробовими атомними координатами, що є по суті такими, як подано в Табл. 6; (B) кристалічна структура EG (форма SB-1), яка відрізняється одним чи більше параметрами елементарної комірки, що по суті дорівнюють таким 13 значенням: спектр ЯМР С у твердій фазі, яка має 5 96765 по суті подібні положення піків на 12,49, 59,16, 60,61, 60,69, 68,10, 72,51, 76,11, 78,51, 79,02, 112,09, 125,16, 126,47, 127,38, 128,61, 129,02, 129,73, 135,62, 137,48 і 154,70 млн. ч., визначені на 400 МГц спектрометрі відносно TMS на нульовому рівні; параметри елементарної комірки: а=11,593(8) Å, b=4,766(5) Å, с=22,78(3) Å = - градусів, =93,38(9) градусів, = - градусів, просторова група Р21, число молекул/асиметричний блок = 1, де вимірювання зазначеної кристалічної структури проводять при -50 °C, і яка відрізняється дробовими атомними координатами, що є по суті такими, як подано в Табл. 8; та (C) кристалічна структура EG (SB-2), яка відрізняється одним чи більше з наступних параметрів елементарної комірки: а=11,4950(1) Å, 6 b=4,7443(1) Å, с=44,4154(5) Å, = - градусів, = - градусів, = - градусів, просторова група: Р212121, число молекул/асиметричний блок = 1, де вимірювання вказаної кристалічної структури проводять при кімнатній температурі, і яка відрізняється дробовими атомними координатами, що є по суті такими, як подано в Табл. 10. 9. Фармацевтична композиція, яка містить ефективну кількість кристалічної структури сполуки формули І за п. 1 і фармацевтично прийнятний носій або розріджувач. 10. Фармацевтична композиція за п. 9, яка містить терапевтично ефективну кількість кристалічної структури (S)-PG і фармацевтично прийнятний носій або розріджувач. 11. Фармацевтична композиція за п. 9, де зазначену кристалічну структуру вибирають із сукупності, що складається із: Cl OEt O HO CH3 . OH HO H2O . HO OH OH , Ia Cl OEt O HO CH3 . OH HO H2O . HO OH OH , Ib Cl OEt O HO . OH HO OH . 2H2O OH Ic та Cl HO OEt O OH HO OH . HO OH . 2H2O Id або Іе (SB-1 або SB-2). . 7 96765 12. Спосіб лікування діабету, резистентності до інсуліну, гіперглікемії, гіперінсулінемії, підвищених рівнів жирних кислот або гліцерину в крові, гіперліпідемії, дисліпідемії, ожиріння, гіпертригліцериде 8 мії або діабетичних ускладнень у ссавця, який включає введення ссавцю терапевтично ефективної кількості кристалічної структури за п. 4. 13. Спосіб отримання сполуки формули Іа за п. 4 Cl OEt O HO CH3 . OH HO H2O . HO OH OH Ia (форма SC-3, (S)-PG) який включає у себе: проведення реакції сполуки формули А Cl OEt AcO O AcO OAc ,A в органічному розчиннику з основою і (S)пропіленгліколем, необов'язкове додавання зародкових кристалів (S)-PG сполуки Іа та отримання в результаті сполуки за формулою Іа. 14. Спосіб отримання кристалічної сполуки Іа за п. 4, який включає у себе проведення реакції сполуки В, що має структуру Cl OEt HO з відновлювальним засобом, таким як алкілсилілгідрид при наявності активаційної групи, такої як кислота Льюїса, в результаті чого утворюється сполука І, що має структуру Cl OEt O HO OAc , OH HO OH ,I проведення реакції сполуки І з (S)пропіленгліколем, необов'язково з додаванням зародкових кристалів сполуки Іа до реакційної суміші в присутності органічного розчинника для отримання кристалічної сполуки Іа O OMe OH HO OH ,В Cl OEt O HO CH3 OH HO OH 15. Спосіб за п. 14, який відрізняється тим, що відновлювальним засобом є триетилсилан, а активаційною групою є BF3OEt2 або BF3·2CH3COOH. . HO OH . H2O , Ia. 9 96765 10 16. Спосіб отримання сполуки формули Іа за п. 4 OEt Cl O HO CH3 . OH HO . H2O HO OH OH Ia (форма (S)-PG який включає у себе проведення реакції сполуки If, що має структуру Cl OEt HO O OMe OH OH O OCH3 AcO O AcO OH , If з оцтовим ангідридом в присутності диметиламінопіридину CH3CN, для отримання Cl OEt AcO проведення реакції вищевказаної сполуки з відновлювальним засобом, таким як алкілсилілгідрид в присутності активаційної групи, такої як кислота Льюїса, та CH3CN, з утворенням сполуки І, яка має структуру OEt Cl OH HO , AcO AcO AcO ,А проведення реакції вищевказаної сполуки з основою, а потім з (S)-пропіленгліколем, необов'язково з додаванням зародкових кристалів сполуки Іа до реакційної суміші, в присутності органічного розчинника з утворенням кристалічної сполуки Іа OAc OAc , B' OEt Cl O HO CH3 . OH HO HO OH OH 17. Спосіб за п. 16, який відрізняється тим, що відновлювальним засобом є триетилсилан, а активаційною групою є BF3OEt2 або BF3·2CH3COOH. Cl HO O OMe OH HO H2O Ia. 18. Кристалічна структура 1,4-сольвату бутиндіолу формули If OEt . HC C C HO OH яка відрізняється одним чи більше з наступних параметрів елементарної комірки: а=21,576(7) Å, b=6,755(1) Å, . CH OH , If с=18,335(5) Å, = - градусів, =102,96(1) градусів, = - градусів, 11 96765 просторова група С2, число молекул/асиметричний блок = 1, де вимірювання вказаної кристалічної структури проводять при 25 °C, і яка відрізняється дробовими атомними координатами, які є по суті такими, як подано в Табл. 12, або параметри елементарної комірки: а=21,537(4) Å, b=6,7273(6) Å, с=18,267(3) Å, = - градусів, =102,924(7) градусів, = - градусів, просторова група С2, число молекул/асиметричний блок = 1, де вимірювання вказаної кристалічної структури проводять при температурі -50 °C, або спектр протонного ЯМР має положення піків, по суті подібні зазначеним у Табл. 2А. 19. Кристалічна структура сполуки сольвату диметанолу формули Іg Cl HO O OMe OH HO 12 O HO . OMe OH HO OEt . HC C C HO CH OH , If HO O OH HO . 2MeOH O OH OMe HO OEt Cl OMe HO 2MeOH OH , Ig яка відрізняється одним чи більше з наступних параметрів елементарної комірки: а=20,948(3) Å, b=6,794(2) Å, с=18,333(2) Å, = - градусів, =102,91(2) градусів, = - градусів, просторова група С2, число молекул/асиметричний блок = 1, де вимірювання вказаної кристалічної структури проводять при температурі -50 °C, і яка відрізняється дробовими атомними координатами, що є по суті такими, як подано в Табл. 14, або спектр протонного ЯМР має положення піків, по суті подібні зазначеним у Табл. 2В. 20. Спосіб отримання кристалічного сольвату 1,4бутиндіолу сполуки If OH за п. 18, який включає: a) змішування сполуки В, що має структуру OEt Cl OEt Cl OH OH ,B з толуолом та етилацетатом; b) нагрівання суміші при температурі в інтервалі від приблизно 50 °C до приблизно 70 °C; c) додавання 1,4-бутиндіолу; d) нагрівання суміші до розчинення діолу; e) додавання зародкових кристалів сполуки If до розчину; і f) охолодження суміші з утворенням кристалів сполуки If. 21. Процес отримання сольвату диметанолу Іg , Ig за п. 19, який включає у себе: a) обробку сполуки В, що має структуру OEt Cl HO O OMe OH HO OH Сполука В , метанолом або сумішшю метанолу з толуолом, або сумішшю метанолу з толуолом і гептаном, або сумішшю метанолу з МТВЕ і гептаном, для утворення розчину; 13 96765 b) необов'язкове додавання зародкових кристалів сольвату диметанолу формули Іg до розчину; та 14 c) утворення кристалів сольвату диметанолу Іg. 22. Кристалічна структура сполуки за формулою II R4 R1 R2a R3 HO CH3 O R2 OH HO OH . H2O . HO OH , II яка є сольватом (S)-пропіленгліколю або сольватом (R)-пропіленгліколю, або їх сумішшю, де 1 2 2a 5 R , R і R незалежно є воднем, ОН, OR , алкілом, 5a -OCHF2, -OCF3, -SR або галогеном; 3 4 5b R і R незалежно є воднем, ОН, OR , алкілом, алкеною, алкіном, циклоалкілом, CF3, -OCHF2, 6 6a 5c OCF3, галогеном, -CONR R , -CO2R , -CO2H, 6b 6c 5d 6d 5e COR , -CH(OH)R , -CH(OR )R , -CN, -NHCOR , 5f 5g 5h 5i -NHSO2R , -NНSO2арилом, -SR , -SOR , -SO2R , -SО2арилом або п'яти-, шести- чи семичленним гетероциклом, який може містити в кільці від 1 до 4 3 4 гетероатомів N, О, S, SO і/або SO2, або R і R разом з вуглецями, до яких вони приєднані, утворю ють анельований п'яти-, шести- або семичленний карбоцикл або гетероцикл, який може містити в кільці від 1 до 4 гетероатомів N, О, S, SO і/або SO2; 5 5a 5b 5c 5d 5e 5f 5g 5h 5i R , R , R , R , R , R , R , R , R і R незалежнo є алкілом, алкеною або алкіном; та 6 6a 6b 6c 6d R , R , R , R i R незалежно є воднем, алкілом, 6 арилом, алкіларилом або циклоалкілом, або R і 6a R разом з азотом, до якого вони приєднані, утворюють анельований п'яти-, шести- або семичленний гетероцикл, який може містити в кільці від 1 до 4 гетероатомів N, О, S, SO і/або SO2. Галузь техніки, до якої належить винахід Даний винахід стосується вільнокислотних поліморфних кристалічних структур інгібіторів білка SGLT2, фармацевтичних композицій, що їх містять, процесу виготовлення таких кристалічних структур і методів лікування за їх допомогою таких хвороб, як діабет. Рівень техніки Приблизно 100 мільйонів людей в усьому світі хворіють на цукровий діабет II типу (NIDDM: noninsulin dependent diabetes melitus), для якого є характерною гіперглікемія внаслідок надмірного продукування глюкози печінкою і периферійної інсулінорезистентності, головні причини яких поки що є невідомими. Відповідне регулювання рівнів глюкози у плазмі хворих на діабет може компенсувати розвиток діабетичних ускладнень та пошкодження бета-клітин, що спостерігаються на розвинутих стадіях хвороби. Глюкоза плазми зазвичай фільтрується в клубочках нирок та активно реабсорбується у проксимальних канальцях. Дев'яносто відсотків зворотного всмоктування глюкози в нирках відбувається в епітеліальних клітинах раннього сегмента S1 ниркового кортикального проксимального канальця. Білок SGLT2, який складається із 672 амінокислот і містить 14 сегментів, що перекривають товщину мембрани, синтезується переважно в ранньому сегменті S1 ниркових проксимальних канальців та, очевидно, є головним транспортером, відповідальним за це зворотне всмоктування. Специфіч ність субстрату, натрієва залежність і локалізація білка SGLT2 відповідають великій потужності та низькій афінності натрій-залежного транспортера глюкози, охарактеризрованого у проведених раніше дослідженнях кортикальних проксимальних канальців нирок людини. Крім того, дослідження гібридного виснаження показали, що SGLT2 є го+ ловним Nа /глюкозним котранспортером в сегменті S1 проксимального канальця, оскільки фактично вся Na-залежна активність транспортування глюкози, кодована в мРНК із ниркової кірки щура, інгібується протисмисловим олігонуклеотидом, специфічним до SGLT2 щура. У людей мутації в SGLT2 пов'язувалися з сімейними формами ниркової глюкозурії, що послужило ще одним підтвердженням первинної ролі SGLT2 в нирковому зворотному всмоктуванні глюкози. У таких пацієнтів ниркова морфологія і ниркова функція в іншому є нормальною. Можна очікувати, що у хворих на діабет інгібування SGLT2 буде знижувати рівні глюкози в плазмі через збільшене виділення у них глюкози. Селективне інгібування SGLT2 у пацієнтів, хворих на діабет, могло б нормалізувати глюкозу плазми завдяки збільшенню рівня глюкози в сечі, і таким чином поліпшувати чутливість до інсуліну та затримувати розвиток ускладнень від діабету при відсутності значних шлунково-кишкових побічних ефектів. 15 Суть винаходу Один із варіантів здійснення даного винаходу стосується кристалічних структур сполуки за формулою І 96765 16 фармацевтичних композицій, що містять кристалічні структури сполуки І, включаючи структуру Іа (S)-пропіленгліколю ((S)-PG), яка є формою SC3 структуру Іb (r)-пропіленгліколю ((R)-PG), яка є формою SD-3 структуру Іс дигідрату етанолу або моноетанолу, яка є формою SA-1 структуру Іе етиленгліколю, яка є формою SB2 структуру Id етиленгліколю, яка є формою SB1 17 96765 18 структури Ik кристалічного комплексу з Lфенілаланіном 1:1, яка є формою 2 процесів для виготовлення таких кристалічних структур; структури Ih кристалічного комплексу з Lпроліном 1:2, яка є формою 3 методів лікування діабету і споріднених з ним хвороб за допомогою кристалічних структур сполуки І, сполукиІа, сполуки Іb, сполуки Ih, сполуки Іі, сполуки Ij, сполуки Ik і сполуки II згідно з визначеним у даному описі. Сполука за формулою 1 у формі некристалічного твердого тіла була описана в патенті США (U.S. Patent No. 6,515,117), уміст якого в усій його повноті включений тут шляхом посилання. Крім того, відповідно до іншого варіанта здійснення даного винаходу пропонується кристалічна сполука If, яка має структуру структури Іі кристалічного комплексу з Lпроліном 1:1, яка є формою 6 структури Ij напівгідрату кристалічного комплексу з L-проліном 1:1, яка є формою Н.5-2 і зветься тут також "сольватом 1,4-бутиндіолу" або "сольватом бутиндіолу", і процес виготовлення такої кристалічної структури, а також застосування такої кристалічної структури для виготовлення сполуки la (S)-PG. В одному із варіантів здійснення даного винаходу пропонуються: кристалічна сполука Іg, яка має структуру і зветься тут також "сольватом диметанолу", а також процес для виготовлення сольвату димета 19 нолу Іg, і застосування сполуки Іg для виготовлення кристалічної сполуки la (S)-PG. Сольват диметанолу Іg і сольват 1,4бутиндіолу If можуть використовуватися як проміжні продукти при виготовленні кристалічної сполуки за формулою 1 згідно з даним винаходом. Відповідно до одного із варіантів здійснення даного винаходу пропонується процес виготовлення кристалічної сполуки (S)-PG, що має структуру Іа (форму SC-3) який включає у себе стадії створення сполуки А (приготованої так, як описано в патентній заявці США № 10/745,075, поданій 23 грудня 2003 p., Приклади 17-20), що має структуру обробку сполуки А спиртовим розчинником, таким як метанол або етанол, і водним розчином основи, наприклад гідроксиду натрію, та в разі потреби - водою, в інертній атмосфері і, в разі потреби, при підвищеній температурі, додавання кислоти, наприклад соляної, для нейтралізації реакційної суміші, з одержанням у результаті сполуки І, що має структуру 96765 20 та обробку реакційної суміші, що містить сполуку І, органічним розчинником, наприклад метилt-бутиловим етером, алкілацетатом, наприклад етилацетатом, метилацетатом, ізопропілацетатом або бутилацетатом, та (S)-пропіленгліколем, у разі потреби - з додаванням до суміші зародків кристалів (S)-PG сполуки la (SC-3), для одержання в результаті (S)-PG сполуки Іа (форми SC-3). Відповідно до одного із варіантів здійснення даного винаходу пропонується процес виготовлення кристалічної сполуки (R)-PG, що має структуру Іb (форму SD-3) який є подібним описаному вище процесу виготовлення (S)-PG (форми SC-3) Іа за винятком того, що в ньому замість (S)-пропіленгліколю використовують (R)-пропіленгліколь. Відповідно до одного із варіантів здійснення даного винаходу пропонується новий процес виготовлення сполуки Іа який включає у себе стадію відновлення сполуки В, що має структуру в результаті чого видаляють метоксигрупу шляхом обробки сполуки В (приготованої так, як описано в патентній заявці США № 10/745,075, 21 96765 22 поданій 23 грудня 2003 p., Приклад 17) або кристалічного сольвату, наприклад сольвату диметанолу Ig або 1,4-сольвату бутиндіолу (If), відновлювальним засобом, таким як гідрид триетилсилілу, та активаційною групою, якою служить кислота Льюїса, така як BF3-Et2O або BF3-2CH3COOH, серед котрих кращою є BF3-2СН3СООН, органічним розчинником, таким яка CH3CN, і добавленою водою, відокремлення сполуки, що має структуру І під нагрівом до кипіння, для утворення масляного продукту, яким є сполука І. В іншому варіанті здійснення даного винаходу пропонується процес виготовлення структури дигідрату етиленгліколю, що описується формулою Id та обробки сполуки І (S)-пропіленгліколем при наявності розчинника, такого як t-бутилметиловий етер, необов'язково з зародками сполуки la ((S)PG), у результаті чого утворюється суспензія кристалів сполуки la ((S)-PG) і відокремлюється сполука la ((S)-PG). Описаний вище процес згідно з даним винаходом належить до типу операцій з одноразовим завантаженням сировини і зводить до мінімуму утворення проміжних продуктів, завдяки чому підвищується вихід кінцевого продукту і в ньому переважає кристалічна сполука Іа. Кристалічна сполука Іа, яка зветься також сольватом (S)-пропіленгліколю сполуки І, є новою кристалічною структурою і являє собою частину даного винаходу. Сполука за формулою В (аморфна форма) описана в (патентній заявці США № 10/745,075, поданій 23 грудня, 2003), вміст якої включений тут в усій його повноті шляхом посилання. Відповідно до іншого варіанта здійснення даного винаходу пропонується процес виготовлення моно-EtOH-дигідратної (зі структурою етанолу, EtOH) форми SA-1, що має структуру Іс який включає у себе стадії: розчиняння сполуки І у водному розчині етиленгліколю, бажано під нагрівом; необов'язково, після охолодження, додавання до утвореного розчину зародків кристалічної форми SC-3 (Іа) (S)-пропіленгліколю; і відновлення кристалів дигідратної форми етиленгліколю SB-1 (Id). У ще одному варіанті здійснення даного винаходу пропонується процес виготовлення структури дигідрату етиленгліколю, форми SB-2 який включає у себе стадії: розчиняння сполуки І у водному розчині етиленгліколю, бажано під нагрівом; необов'язково, після охолодження - додавання до утвореного розчину зародків кристалічної форми SA-1 (Іс) моно-EtOH-дигідрату; і відновлення кристалів дигідратної форми SB-2 (Іе) етиленгліколю. У ще одному варіанті здійснення даного винаходу пропонується процес виготовлення кристалу 1,4-сольвату бутиндіолу If який включає у себе стадії розчиняння сполуки І в етанолі та охолодження отриманого розчину до -20°С для утворення кристалів, що описуються формулою Іс, форма SA-1. Сполука І може бути виготовлена шляхом розчиняння сполуки А в етанолі, в кращому варіанті 23 який включає у себе стадії: розчиняння основної сполуки В в алкілацетаті, наприклад, в етилацетаті, пропілацетаті або бутилацетаті, або у спирті, наприклад, в ізопропанолі чи бутанолі, або у воді; додавання 2-бутин-1,4-діолу до розчину сполуки В; нагрівання утвореної таким чином суміші доти, поки не розчиниться діол; охолодження суміші, і видобування кристалів сольвату 1,4-бутиндіолу (If). У випадку кристалізації сольвату If в алкілацетаті як антирозчинник може використовуватися толуол або гептан. Сольват 1,4-бутиндіолу (If) можна відокремлювати і використовувати для одержання сполуки І або сполуки Іа у безперервному процесі або у періодичному процесі, як описано нижче. Крім того, відповідно до іншого варіанта здійснення даного винаходу пропонується а процес виготовлення кристалічного сольвату диметанолу Ig де основну сполуку В 96765 24 піддають обробці метанолом, одержуючи кристалічний сольват диметанолу (Ig). Відповідно до даного винаходу пропонується також процес виготовлення кристалічного сольвату диметанолу (Ig), де основну сполуку В розчиняють у суміші метанолу з толуолом або в суміші метанол/толуол/гептан, або в суміші метанол/толуол/етилацетат чи інший алкілацетат із засіванням зародками сольвату диметанолу Ig. Сольват диметанолу Ig і сольват 1,4бутиндіолу If можуть використовуватися у виготовленні кристалічної сполуки Іа, як описано нижче. Відповідно до одного із варіантів здійснення даного винаходу пропонується процес виготовлення кристалічного комплексу 1:2 з L-проліном, що має структуру Ih (форма 3) який включає у себе стадії створення сполуки І, що має структуру утворення розчину L-проліну у воді і спиртовому розчиннику, наприклад метанолі, етанолі чи ізопропанолі, нагрітого до температури в інтервалі приблизно від 70 до приблизно 95°С, обробку сполуки І у спиртовому розчиннику, такому як метанол, етанол чи ізопропанол, з нагрітим розчином L-проліну (що містить вдвічі більшу кількість Lпроліну в молях як сполуки І), та охолодження утвореного розчину до приблизно кімнатної температури, в результаті чого утворюється сполука Ih. Відповідно до одного із варіантів здійснення даного винаходу пропонується процес виготовлення комплексу кристалічної сполуки з L проліном 1:1, що має структуру Іі (форма 6) 25 який включає у себе стадії створення сполуки І, обробку розчину сполуки І спиртовим розчинником, таким як етанол або метанол, з киплячим розчином L-проліну у водно-спиртовому розчиннику, наприклад у суміші етанолу з водою (використовуючи сполуку І в п'ятикратно більшій кількості, ніж кількість L-проліну), та охолодження створеної суміші (наприклад, від приблизно -10 до приблизно -25°С), одержуючи в результаті сполуку Іі. Відповідно до одного із варіантів здійснення даного винаходу пропонується процес виготовлення напівгідрату кристалічного комплексу з Lпроліном у співвідношенні 1:1, що має структуру сполуки Ij (форми Н.5-2) згідно з формулою який включає у себе стадії створення зародкових кристалів комплексу з L-проліном у співвідношенні 1:1 (структура Іі, форма 6), змішування цих зародкових кристалів Іі, форма 6, з охолодженим (до -10 - -25°С) розчином L-проліну і сполуки І у водно-спиртовому розчиннику та охолодження отриманої суміші до температури приблизно від 10 до -25°С для утворення структури Ij напівгідрату (форма Н.5-2). Відповідно до одного із варіантів здійснення даного винаходу пропонується процес виготовлення структури Ik кристалічного комплексу з Lфенілаланіном 1:1 форми 2, 96765 26 який включає у себе стадії готування розчину L-фенілаланіну у воді, нагрітої приблизно до 75 85°С, змішування цього розчину L-фенілаланіну зі сполукою І, нагрівання утвореного розчину до приблизно 75-85°С і вільного його охолодження кімнатної температури для утворення сполуки Ik. Інший аспект даного винаходу стосується кристалічних структур сполуки згідно з формулою II яка в даному описі зветься кристалічною структурою (S)-пропіленгліколю ((S)-PG), де: 1 2 2a R , R і R незалежно один від одного є во5 5a день, ОН, OR , алкіл, -OCHF2, -OCF3, -SR або галоген; 3 4 R і R незалежно один від одного є водень, 5b ОН, OR , алкіл, алкеніл, алкініл, циклоалкіл, CF3, 6 6a 5c OCHF2, -OCF3, галоген, -CONR R , -CO2R , 6b 6c 5d 6d CO2H, -COR , -CH(OH)R , -CH(OR )R , -CN, 5c 5f NHCOR , -NHSO2R , 5g 5h 5i NHSO2арил, -SR , -SOR , -SO2R , -SO2арил або п'яти-, шести- чи семичленний гетероцикл, який може містити в кільці 1 або 4 гетероатоми N, 3 4 О, S, SO і/або SO2, або R і R разом з атомами вуглецю, до яких вони приєднані, утворюють анельований п'яти-, шести- або семичленний карбоцикл або гетероцикл, який може містити в кільці від 1 до 4 гетероатомів N, О, S, SO і/або SO2; 5 5a 5b 5c 5d 5e 5f 5g 5h 5i R , R , R , R , R , R , R , R , R і R незалежно один від одного є алкіл; а 6 6a 6b 6c 5d R , R , R , R і R незалежно один від одного є водень, алкіл, арил, алкіларил або циклоалкіл, 6 6a або R і R разом з атомом азоту, до якого вони приєднані, утворюють анельований п'яти, шести чи семичленний гетероцикл, який може містити в кільці від 1 до 4 гетероатомів N, О, S, SO і/або SO2. Крім того, згідно з даним винаходом пропонуються також фармацевтичні композиції, які містять 27 96765 28 кристалічну структуру сполуки II, і процеси для виготовлення кристалічної структури II. Один із аспектів даного винаходу стосується кристалічних структур сполуки за формулою III 1 яка в даному описі зветься також кристалічною структурою III (R)-пропіленгліколю ((R)-PG), де: 1 2 2a R , R і R незалежно один від одного є во5 5a день, ОН, OR , алкіл, -OCHF2, -OCF3, -SR або галоген; 3 4 R і R незалежно один від одного є водень, 5b ОН, OR , алкіл, алкеніл, алкініл, циклоалкіл, CF3, 6 6a 5c OCHF2, -OCF3, галоген, -CONR R , -CO2R , 6b 6c 5d 6d CO2H, -COR , -CH(OH)R , -CH(OR )R , -CN, 5c 5f 5g 5h NHCOR , -NHSO2R , -NHSO2арил, -SR , -SOR , 5 SO2R ', -SO2арил або п'яти-, шести- чи семичленний гетероцикл, який може містити в кільці від 1 до 3 4 4 гетероатомів N, О, S, SO і/або SO2, або R і R разом з атомами вуглецю, до яких вони приєднані, утворюють анельований п'яти-, шести- або семичленний карбоцикл або гетероцикл, який може містити в кільці від 1 до 4 гетероатомів N, О, S, SO і/або SO2; 5 5a 5b 5C 5d 5e 5f 5g 5h 5i R , R , R , R , R , R , R , R , R і R незалежно один від одного є алкіл; а 6 6a 6b 6c 5d R , R , R , R і R незалежно один від одного є водень, алкіл, арил, алкіларил або циклоалкіл, 6 6a або R і R разом з атомом азоту, до якого вони приєднані, утворюють анельований п'яти, шести чи семичленний гетероцикл який може містити в кільці від 1 до 4 гетероатомів N, О, S, SO і/або SO2. Крім того, відповідно до даного винаходу пропонуються також фармацевтичні композиції, що містять кристалічні структури сполуки III, і процеси для виготовлення таких кристалічних структур. Відповідно до одного із варіантів здійснення даного винаходу пропонується процес виготовлення кристалічної сполуки (S)-PG згідно з формулою II, який включає у себе стадії: створення сполуки С (включаючи варіанти, в 3 4 котрих R або R є алкеніл або алкініл, причому всі такі сполуки можуть виготовлятися відповідно до процесів, описаних у патентній заявці США № 10/745,075, поданій 23 грудня, 2003, Приклади 1720), що має структуру 2 2a 3 4 де R , R , R , R і R є такими, як визначено вище; обробки сполуки С спиртовим розчинником, наприклад метанолом, водним розчином основи, наприклад гідроксидом натрію, і, якщо потрібно, водою в інертній атмосфері, при підвищеній температурі, в результаті чого утворюється сполука D, що має структуру та змішування реакційної суміші, що містить сполуку D, з органічним розчинником, таким як метил-трет-бутиловий етер, алкілацетатом, таким як етилацетат, метилацетат, ізопропілацетат або бутилацетат, і (S)-пропіленгліколем, і, в разі потреби, додавання до утвореної суміші зародків (S)PG сполуки II, для створення (S)-PG сполуки II. Відповідно до одного із варіантів здійснення даного винаходу пропонується, процес виготовлення кристалічної сполуки (R)-PG, що має структуру III подібний описаному вище процесу для виготовлення сполуки (S)-PG II, за винятком того, що замість (S)-пропіленгліколю в ньому використовують (R)-пропіленгліколь. 29 Відповідно до одного із варіантів здійснення даного винаходу пропонується новий процес виготовлення сполуки II який включає у себе стадію відновлення сполуки Е, що має структуру (як описано в патентній заявці США № 10/745,075, поданій 23 грудня, 2003) для видалення метоксигрупи шляхом обробки сполуки Ε відновлювальним засобом, таким як гідрид триетилсилілу, та активаційною групою, якою служить кислота Льюїса, BF3.Et2O, в органічному розчиннику, наприклад CH3CN, і воді, відокремлення зазначеної сполуки зі структурою D та обробки сполуки D (S)-пропіленгліколем при наявності такого розчинника, як трет-бутилметиловий етер, у разі потреби - з кристалічними зародками сполуки II ((S)PG), з утворенням у результаті суспензії кристалів сполуки II ((S)-PG), і відокремлення сполуки II ((S)PG). Описаний вище процес згідно з даним винаходом здійснюється з одноразовим завантаженням сировини, що дозволяє зменшити до мінімуму утворення проміжних продуктів. Перелік фігур креслення Даний винахід ілюстрований на супровідних фігурах креслення, перелічених нижче. На Фіг. 1 показані розрахункова (модельована для 25°С) та емпірична (отримана експериментально при кімнатній температурі) порошкові рентгенограми кристалічної структури la (S)-PG форми SC-3. На Фіг. 2 показана емпірична (отримана експериментально при кімнатній температурі) порошкова рентгенограма кристалічної структури Ib (R)PG. 13 На Фіг. 3 показаний С ЯМР CPMAS спектр (отриманий при перехресній поляризації з обертанням під магічним кутом) кристалічної структури la (S)-PG форми SC-3. 13 На Фіг. 4 показаний С ЯМР CPMAS спектр кристалічної структури Ib (R)-PG. 96765 30 На Фіг. 5 показана крива термогравіметричного аналізу (TGA) кристалічної структури la (S)-PG форми SC-3. На Фіг. 6 показана крива термогравіметричного аналізу (TGA) кристалічної структури Ib (R)-PG форми SD-3. На Фіг. 7 показана термограма диференціальної сканувальної калориметрії (DSC) кристалічної структури сполуки la (S)-PG форми SC-3. На Фіг. 8 показана термограма диференціальної сканувальної калориметрії (DSC) кристалічної структури сполуки Ib (R)-PG. На Фіг. 9 показана емпірична (отримана експериментально при кімнатній температурі) порошкова рентгенограма кристалічної структури If сольвату 1,4-бутиндіолу. На Фіг. 10 показана емпірична (отримана експериментально при кімнатній температурі) порошкова рентгенограма кристалічної структури Ig сольвату диметанолу. На Фіг. 11 показана термограма диференціальної сканувальної калориметрії (DSC) кристалічної структури If сольвату 1,4-бутиндіолу. На Фіг. 12 показана термограма диференціальної сканувальної калориметрії (DSC) кристалічної структури Іb сольвату диметанолу. На Фіг. 13 показані розрахункова (модельована для -40°С), гібридна (при кімнатній температурі) та емпірична (отримана експериментально при кімнатній температурі) порошкові рентгенограми кристалічної структури Ih комплексу з L-проліном 1:2 форми 3, N-1. На Фіг. 14 показані розрахункова (модельована для -40°С), гібридна (при кімнатній температурі) та емпірична (отримана експериментально при кімнатній температурі) порошкові рентгенограми кристалічної структури Іі комплексу з L-проліном 1:1 форми 6, N-1. На Фіг. 15 показані розрахункова (модельована для -40°С), гібридна (при кімнатній температурі) та емпірична (отримана експериментально при кімнатній температурі) порошкові рентгенограми кристалічної структури Ij напівгідрату комплексу з L-проліном 1:1 форми Н.5-2. На Фіг. 16 показана крива термогравіметричного аналізу (TGA) кристалічної структури Ih комплексу з L-проліном 1:2 форми 3, N-1. На Фіг. 17 показана крива термогравіметричного аналізу (TGA) кристалічної структури Іі комплексу з L-проліном 1:1 форми 6, N-1. На Фіг. 18 показана крива термогравіметричного аналізу (TGA) кристалічної структури Ij напівгідрату комплексу з L-проліном 1:1 форми Н.5-2. На Фіг. 19 показана термограма диференціальної сканувальної калориметрії (DSC) кристалічної структури Ih комплексу з L-проліном 1:2 форми 3, N-1. На Фіг. 20 показана термограма диференціальної сканувальної калориметрії (DSC) кристалічної структури Іі комплексу з L-проліном 1:1 форми 6, N-1. На Фіг. 21 показана термограма диференціальної сканувальної калориметрії (DSC) кристалічної структури Ij напівгідрату комплексу з Lпроліном 1:1 форми Н.5-2. 31 На Фіг. 22 показана схема безперервного технологічного процесу. Докладний опис винаходу Даним винаходом пропонується новий матеріал, яким є принаймні частково кристалічні структури сполуки І. Термін "фармацевтично прийнятний" використовується в даному описі як ознака для тих сполук, матеріалів, композицій і/або лікарських форм, які в рамках загальноприйнятої медичної оцінки є підходящими для контактування з тканинами організмів людей і тварин і не завдають їм надмірного впливу з погляду токсичності, подразнення, алергічних реакцій та інших проблемних ускладнень, пропорційних прийнятному співвідношенню між корисним ефектом і ризиком від їх застосування. У деяких варіантах здійснення даного винаходу запропоновані кристалічні структури сполуки І згідно з даним винаходом є у практично чистій формі. Термін "практично чистий" використовується як ознака для сполук, хімічна чистота яких є більше 90% і складає, наприклад, приблизно 91%, приблизно 92%, приблизно 93%, приблизно 94%, приблизно 95%, приблизно 96%, приблизно 97%, приблизно 98%, приблизно 99% і приблизно 100%. Здатність сполуки існувати в різних кристалічних структурах є відомою під назвою поліморфізму. Використовуваний у зв'язку з цим термін "поліморфні модифікації" або "поліморфи" означає кристалічні форми, які мають один і той же хімічний склад, але відмінні просторові упорядкування молекул, атомів і/або іонів, що утворюють кристал. Отже, маючи однаковий хімічний склад, поліморфи відрізняються один від одного пакуванням і геометрією розподілу, і можуть мати різні фізичні властивості - температуру плавлення, форму, колір, густину, твердість, деформованість, стійкість, розчинність тощо. Залежно від їхньої температурної стабільності два поліморфи можуть бути монотропними або енантіотропними. У монотропної системи відносна стабільність двох твердих фаз при зміні температури залишається незмінною. На відміну від цього в енантіотропній системі існує температура переходу, при котрій стабільності двох фаз змінюються на протилежні. (Theory and Origin of polymorphism in "Polymorphism in Pharmaceutical Solids" (1999) ISBN: -8247-0237). Даний винахід дозволяє створювати кристалічні структури з практично чистою фазовою однорідністю, що свідчить про наявність у такому матеріалі переважаючої кількості домінантної монокристалічної структури та імовірно невеликих кількостей іншої чи інших кристалічних структур. Наявність у матеріалі згідно з даним винаходом однієї чи більше інших кристалічних структур може бути визначена за допомогою таких загальновідомих аналітичних методів, як порошковий рентгеноструктурний аналіз (PXRD: powder X-ray diffraction) та твердофазна ЯМР спектроскопія (SSNMR: solid state nuclear magnetic resonance spectroscopy). Так наприклад, поява додаткових піків на експериментальній (емпіричній) PXRD рентгенограмі у порівнянні з модельованою (розрахунковою) PXRD рентгенограмою може свідчити про наявність у піддослідному зразку більше однієї кристалічної 96765 32 структури. Модельована PXRD рентгенограма може обчислюватися за рентгеноструктурними даними для монокристалів (Smith, D.K., "A FORTRAN Program for Calculating X-Ray Powder Diffraction Patterns" Lawrence Radiation Laboratory, Livermore, California, UCRL-7196, Аpril, 1963; Yin. S., Scaringe, R.P., DiMarco, J., Galella, M. and Gougoutas, J.Z., American Pharmaceutical Review, 2003, 6, 2, 80). Як показують експериментальні дослідження, кристалічна структура згідно з винаходом має практично чисту фазову однорідність, тобто у кращому варіанті експериментальна рентгенограма має менше 10%, у ще кращому - менше 5%, а в ще кращому - менше 2% загальної площі піків, що припадають на додаткові піки, відсутні на модельованій PXRD рентгенограмі. У найкращому варіанті кристалічна структура згідно з даним винаходом має практично чисту фазову однорідність, що характеризується наявністю на експериментальній PXRD рентгенограмі 1% загальної площі піків, який належить до додаткових піків, відсутніх на модельованій PXRD рентгенограмі. Описані тут різноманітні кристалічні структури згідно з даним винаходом можуть відрізнятися одна від одної через застосування до них різних загальновідомих методів аналізу. Такими методами можуть бути, наприклад, твердофазна ЯМР спектроскопія (SSNMR), порошковий рентгеноструктурний аналіз (PXRD), диференціальна сканувальна калориметрія (DSC: differential scanning calorimetry), термогравіметричний аналіз (TGA: thermogravimetric analysis) тощо. Виготовлення кристалічних структур згідно з винаходом Кристалічні структури згідно з даним винаходом можуть одержуватися за допомогою різноманітних методів, включаючи, наприклад, кристалізацію і рекристалізацію із підходящого розчинника, сублімацію, вирощування із розплаву, твердофазне перетворення із іншої фази, кристалізацію із надкритичного флюїду і струминне розпорошування. Кристалізацію та рекристалізацію кристалічних структур із суміші з розчинником можна здійснювати, наприклад, шляхом випарювання розчинника, зниження температури суміші з розчинником, засівання центрами кристалізації перенасиченої суміші з розчинником молекули і/або солі, сублімаційної сушки суміші з розчинником, додавання антирозчинників до суміші з розчинником. Для одержання запропонованих кристалічних структур, включаючи поліморфи, можна застосовувати високопродуктивні методи кристалізації. Кристалічні лікарські речовини, включаючи поліморфи, методи виготовлення і характеризації лікарських кристалів детально розглянуті в книзі (Solid-Stale Chemistry of Drugs, S.R. Byrn, R.R. nd Pfeiffer, and J.G. Stowell, 2 Edition, SSCI, West Lafayette, Indiana, 1999). Для активації кристалізації до будь-якої кристалізаційної суміші можуть додаватися зародки кристалізації. Цілком зрозуміло, що додавання зародків кристалізації застосовують для керування процесом росту конкретної кристалічної структури або для регулювання гранулометричного складу кристалічного продукту. Відповідно до цього, пот 33 рібну кількість зародків кристалізації визначають у залежності від наявних у розпорядженні зародкових кристалів і потрібного середнього розміру часток продукту, як описано, наприклад, у публікації ("Programmed cooling of batch crystallizers," J.W. Mullin and J. Nyvlt, Chemical Engineering Science, 1971, 26, 369-377). У загальному випадку, для ефективного керування процесом росту кристалів певної партії продукту потребуються зародки малих розмірів. Дрібні зародки можуть одержуватися шляхом просіювання, помелу чи тонкого здрібнення більш грубих кристалів або шляхом мікрокристалізації розчинів. При цьому слід стежити за тим, щоб помел або тонке здрібнення кристалів не призводили до будь-яких відхилень кристалічності від Як показано на Схемі І, сполуку В, або If чи Ig (узагальнено - сполука В), яка є у формі аморфного або кристалічного твердого тіла (If або Ig), піддають обробці відновлювальним засобом, таким як гідрид силілу, краще - гідрид алкілсилілу, а ще краще - триетилсилан (або гідрид триетилсилілу), при наявності активаційної групи, наприклад кислоти Льюїса, такої як ВСІ3·Me2S, ВВr3, BF3OEt2, ВСІ3 або BF3·2СН3СООН, у кращому варіанті BF3OEt2 або BF3·2СН3СООН, та органічного розчинника, наприклад CH3CN, СН3СN/толуолу або СН3СN/дихлорметану, хлористого метилену або води, при температурі в інтервалі приблизно від 15 до приблизно 25°С, у кращому варіанті - від приблизно 5 до приблизно 10°С, в результаті чого сполука В відновлюється, і утворюється відповідна основна сполука І 96765 34 цільової кристалічної структури (тобто до змін на аморфний стан або на інший поліморф). Використовуваний у даному описі термін "кімнатна температура" означає навколишню температуру в інтервалі від 20 до 25°С (68-77°F). У загальному випадку при одержанні кристалічної сполуки Іа відповідно до описаного нижче використовуються розчинники, що дозволяють утворювати кристалічну сполуку Іа, яка у кращому варіанті має певну об'ємну вагу. Кристалічна сполука, що має структуру la (SPG) SC-3 згідно з даним винаходом, може бути одержана за допомогою скороченої реакції, показаної на Схемі І. яку відокремлюють від реакційної суміші і піддають обробці (S)-пропіленгліколем ((S)-PG) та органічним розчинником, наприклад алкілацетатом, як зазначалося вище, у кращому варіанті ізопропілацетатом або трет-бутилметиловим етером (МТВЕ), і в разі потреби додають зародки сполуки ((S)-PG) la (молярне відношення зародки Іа:сполука В в інтервалі приблизно від 0,1 до приблизно 10%, у кращому варіанті від приблизно 0,5% до приблизно 3%), у результаті чого утворю 35 96765 36 ється суспензія кристалів сполуки ((S)-PG) la і від цієї суспензії відокремлюється кристалічна сполука ((S)-PG) la. При проведенні описаної вище скороченої реакції згідно зі Схемою І, силіловий відновлювальний засіб використовують у молярному відношенні до сполуки В в інтервалі приблизно від 1,2:1 до приблизно 4,5:1, у кращому варіанті - від приблизно 2:1 до приблизно 4:1, у той час як активаційну групу (кислоту Льюїса) використовують у молярному відношенні до силілового відновлювального засобу в інтервалі приблизно від 1,2:1 до приблизно 4,5:1, у кращому варіанті - від приблизно 2:1 до приблизно 4:1. (S)-пропіленгліколь ((S)-PG) використовують у молярному відношенні до сполуки В в інтервалі приблизно від 0,9:1 до приблизно 1,5:1, у кращому варіанті - від приблизно 0,98:1 до приблизно 1,2:1; воду використовують у молярному відношенні до (S)-PG в інтервалі приблизно від 0,95:1 до приблизно 5:1, у кращому варіанті - від приблизно 0,99:1 до приблизно 2:1. Кристалічна сполука, що має структуру la ((S)PG) форми SC-3 згідно з даним винаходом може виготовлятися також згідно зі Схемою II, поданою нижче. де сполуку А піддають обробці спиртовим розчинником, таким як метанол, етанол або ізопропіловий спирт, у кращому варіанті - метанол, водою і водним розчином основи, наприклад гідроксиду лужного металу - NaOH, KОН або LiOH, у кращому варіанті NaOH, у кращому варіанті в інертній атмосфері, наприклад в азоті, при підвищеній температурі в інтервалі приблизно від 50 до приблизно 85°С, у кращому варіанті - від приблизно 60 до приблизно 80°С, у результаті чого одержують сполуку І. Водний розчин основи використовують у молярному відношенні до сполуки А в інтервалі приблизно від 3,5:1 до приблизно 5,5:1, у кращому варіанті - від приблизно 3:1 до приблизно 5:1. Реакційну суміш, що містить сполуку І, піддають обробці органічним розчинником, таким як метил-бутиловий етер (МТВЕ) або алкілацетат, як 37 96765 38 описано вище, у кращому варіанті - ізопропілацетатом або МТВЕ. Відокремлену таким чином сполуку І змішують з (S)-пропіленгліколем, утворюючи густу суспензію, що містить кристалічний продукт la (S)-PG, форму SC-3. У разі потреби до реакційної суміші додають зародки кристалізації сполуки ((S)-PG) Іа. Кристалічну сполуку Іа відокремлюють від суспензії за допомогою звичайних процедур. Для цього, наприклад, суспензію сполуки Іа змішують з органічним розчинником, таким як циклогексан, ізооктан або метилциклогексан, серед яких кращим є циклогексан, і кристалічну сполуку Іа видобувають. При утворенні сполуки Іа поліетиленгліколь (S)-PG використовують у молярному відношенні до сполуки І в інтервалі від приблизно 0,9:1 до приблизно 1,5:1, у кращому варіанті - від приблизно 0,98:1 до приблизно 1,2:1. Як зазначалося вище, сольват Іb (R)пропіленгліколю сполуки І може бути приготований способом, аналогічним способу одержання відповідного сольвату la (S)-пропіленгліколю, за винятком того, що замість (S)-пропіленгліколю при цьому використовують (R)-пропіленгліколь. Нижче на Схемі III ілюстрований процес згідно з даним винаходом для виготовлення моно-EtOHдигідрату (етанол або EtOH/структури) форми SA1 (сполуки Іс). де сполуку А розчиняють в етанолі шляхом нагріву до кипіння, а потім додавання води в об'ємному відношенні до етанолу в інтервалі приблизно від 1:1 до приблизно 3:1, у кращому варіанті - від приблизно 1,5:1 до приблизно 2,5:1. Додають етанол, і суміш охолоджують до температури в інтервалі від приблизно -10°С до приблизно -30°С, у кращому варіанті - від приблизно -15°С до приблизно -25°С. Сполуку Іс отримують у формі кристалів моно-EtOH-дигідрату. Процес згідно з даним винаходом для виготовлення структур дигідрату етиленгліколю, форми SB-1 і форми SB-2 (сполуки відповідно Id і Іе) здійснюють таким чином. Сполуку Id форми SB-1 одержують шляхом розчиняння сполуки А у водному розчині етиленгліколю (співвідношення вода:етиленгліколь від приблизно 1:1 до приблизно 0,4:1, у кращому варіанті - від приблизно 0,7:1 до приблизно 0,5:1) під нагрівом при температурі в інтервалі приблизно від 35 до приблизно 55°С, у кращому варіанті - від приблизно 40 до приблизно 50°С, протягом приблизно від 1,5 до приблизно 2 годин, у кращому варіанті - від приблизно 0,30 хв. до приблизно 1 год. Суміш охолоджують до температури в інтервалі приблизно від 10 до приблизно 22°С, у кращому варіанті - від приблизно 14 до приблизно 16°С, і до неї додають зародки моно-EtOHдигідратних кристалів Іс або кристалів дигідрату етиленгліколю Id форми SB-1 у молярному відношенні до сполуки А в інтервалі приблизно від 0,1 до приблизно 10%, у кращому варіанті - від приблизно 0,5 до приблизно 3%, у результаті чого утворюються кристали дигідрату етиленгліколю Id форми SB-1. Відповідно до даного винаходу кристал дигідрату етиленгліколю Іе форми SB-2 одержують шляхом розчиняння сполуки А у водному розчині етиленгліколю (у співвідношенні вода:етиленгліколь від приблизно 1:1 до приблизно 0.4:1, у кращому варіанті - від приблизно 0,7:1 до приблизно 0,5:1) під нагрівом при температурі в 39 96765 40 інтервалі приблизно від 35 до приблизно 55°С, у кращому варіанті - від приблизно 40 до приблизно 50°С, протягом від приблизно 1,5 до приблизно 2 годин, у кращому варіанті - від приблизно 0,30 хв. до приблизно 1 години. Суміш охолоджують до температури в інтервалі приблизно від 10 до приблизно 30°С, у кращому варіанті - від приблизно 20 до приблизно 25°С, і до неї додають зародки кристалів дигідрату етиленгліколю Іе форми SB-2 у молярному відношенні до сполуки А в інтервалі приблизно від 0,1 до приблизно 10%, у кращому варіанті - від приблизно 0,5 до приблизно 3%, у результаті чого утворюються кристали дигідрату етиленгліколю Іе форми SB-2. Процес згідно з даним винаходом для виготовлення кристалічної форми сполуки В, тобто If, здійснюють відповідно до Схеми IV, наведеної нижче. Кристалічний сольват 1,4-бутиндіолу If згідно з даним винаходом одержують так, як показано на наведеній нижче Схемі IV. де некристалічну сполуку В (котра може бути одержана так, як описано в патентній заявці США № 10/745,075, поданій 23 грудня, 2003, або в патенті США № 6,515,117), яка у кращому варіанті є у практично чистій формі (чистотою, наприклад, від 50 до 100%), змішують з толуол/алкілацетатом (наприклад, етилацетатом), до цієї суміші, нагрітої до температури в інтервалі приблизно від 50 до приблизно 70°С, у кращому варіанті - від приблизно 55 до приблизно 65°С, додають 2-бутин-1,4діол, і суміш гріють при зазначеній температурі доти, поки не розчиниться діол, і додають зародкові кристали сполуки If. Далі суміш охолоджують, у результаті чого утворюються кристали сполуки If. В альтернативному варіанті процесу для виготовлення кристалічної сполуки If сполуку В розчиняють в алкілацетаті (наприклад, у бутилацетаті) або в суміші алкілацетат/гептан (від 0,5:1 до 1,5:1) при підвищеній температурі в інтервалі приблизно від 50 до приблизно 70°С, у кращому варіанті - від приблизно 55 до приблизно 65°С, додають до неї 1,4-бутиндіол, і суміш охолоджують до кімнатної температури, внаслідок чого утворюються кристали сполуки If. У кращому варіанті цього процесу сполуку If кристалізують із суміші сполуки В з толуол/алкілацетатом (у кращому варіанті - етилацетатом), де об'ємне співвідношення між толуолом і алкілацетатом лежить в інтервалі приблизно від 1:1 до приблизно 19:1, у кращому варіанті - від приблизно 4:1 до приблизно 9:1. При цьому толуол/алкілацетатна суміш містить достатню кількість толуолу, що забезпечує молярне співвідношення зі сполукою В в інтервалі приблизно від 40:1 до приблизно 90:1, у кращому варіанті - від приблизно 60:1 до приблизно 80:1, потрібне для утворення сольвату 1,4-бутиндіолу If. Процес кристалізації з утворенням сольвату 1,4-бутиндіолу If може здійснюватися легше при використанні зародкових кристалів сполуки If у кількості від приблизно 0,1 до приблизно 10%, у кращому варіанті - від приблизно 0,5 до приблизно 3% від маси початкової сполуки В. В іншому кращому варіанті здійснення даного процесу сполуку If (котра в разі потреби може бути очищеною) кристалізують із суміші сполуки В з алкілацетат/гептановим (у кращому варіанті - бутилацетат/толуоловим) розчинником, у разі потреби з добавками зародків кристалічної сполуки If в кількості від приблизно 0,1 до приблизно 10%, у кращому варіанті - від приблизно 0,5 до приблизно 3% від маси початкової сполуки В. Алкіл ацетат при цьому використовують в об'ємному співвідношенні з гептаном в інтервалі приблизно від 0,5:1 до приблизно 2:1, у кращому варіанті - від приблизно 1:1 до приблизно 1:1,5. Кристалічний сольват 1,4-бутиндіолу If може виготовлятися також у безперервному процесі, як показано на Схемі IVA. Синтез сольвату If включає дві послідовні стадії зі сполукою Ε і сполука D: (1) літіювання сполуки Ε з утворенням літійованого проміжного продукту G, і (2) зв'язування літійованого проміжного продукту G зі сполукою D. 41 На Фіг. 22 показана схема технологічного процесу, аналогічна описаній в патенті США № 7,164,015, включеному тут шляхом посилання. Як показано на Схемі IVA, у цьому варіанті процес виготовлення сполуки If здійснюють у некріогенних умовах. Ароматичний реактив Е, який має групу, підходящу для Li - галогенового обміну, зберігають у першій посудині 1 при кімнатній температурі. Літієвий реактив Q подають у другу посудину 2 також при кімнатній температурі. Ароматичний реактив Ε і літієвий реактив Q передають відповідно із посудин 1 і 2 насосами 3 і 4 у закритий сорочкою перший статичний змішувач 5. Температуру реакції для одержання літійованого аніонного реактиву встановлюють у першому змішувачу 5 у межах від приблизно -30°С до приблизно 20°С охолоджувачем 6. Утворений таким чином літійований аніонний реактив G подають безпосередньо із першого змішувача 5 у другий статичний змішувач 22 по звичайній транспортній лінії 19. У третю посудину 20 при кімнатній температурі подають карбонілзаміщений реактив D за допомогою насоса 21 через охолоджувач 26, де він охолоджується до тем 96765 42 ператури в інтервалі приблизно від -10 до приблизно -30°С, а потім перепускають у закритий сорочкою другий статичний змішувач 22. Реакцією утворення глікозидного продукту Η керують у другому змішувачу 22 за допомогою другого змішувача 23. Подальший розвиток процесу в умовах глікозидування відбувається у звичайному реакторі 25, до якого подається Н, де він змішується у спиртовому розчиннику, у кращому варіанті MSA/MeOH або НСІ/МеОН, утворюючи Н' (десилільований напівкеталь), котрий далі перетворюється на глікозид В. У результаті подальшого додаткового змішування і зворотного екстрагування та кристалізації з 2-бутин-1,4-діолом (J) у суміші толуол/EtOAc утворюється кристалічний продукт If. У реакторі 25 протягом будь-яких наступних реакцій може підтримуватися кімнатна або інша некріогенна температура. Використовуваний у цьому процесі літієвмісний реактив у кращому варіанті є органічним. Серед підходящих літійорганічних реактивів можна назвати n-BuLi, s-BuLi і t-BuLi. Фахівцями в даній галузі можуть використовуватися також інші підходящі літійорганічні реактиви. 43 96765 44 По завершенні реакції цільовий продукт If може бути відокремлений та очищений за допомогою методів, широко відомих у галузі органічної хімії (це є, наприклад, методи осадження, екстрагування розчинником, рекристалізації та хроматографії). Позбавлена захисту сполука If може сама по собі використовуватися і як проміжний продукт, і як кінцевий продукт. У подальшому можна проводити реакції сполуки If з метою одержання її фармацевтично прийнятних адитивних солей кислот або солей основ за допомогою методів, широко розповсюджених і добре відомих фахівцям у даній галузі. Температура і тривалість реакції є двома важливими параметрами безперервного процесу, ілюстрованого на Схемі IVA. Так, літіювання може проводитися безперервно при температурах від 30°С (або нижче) до 20°С (або вище), у кращому варіанті - від приблизно -17° до приблизно -10°С, а тривалість реакції може складати від декількох хвилин до декількох секунд. Для проведення реакції послідовного зв'язування потік літійованої похідної G далі змішують з потоком сполуки D (третя лінія постачання сировини) у змішувачу. Після цього змішаний потік може подаватися у проточний реактор, якщо для завершення реакції потребується додатковий час. Реакція зв'язування може проводитися у безперервному режимі при більш високих температурах - від -30°С до - 10°С (і вище), у кращому варіанті - від приблизно -30° до приблизно -20°С, при тривалості реакції від декількох хвилин до декількох секунд. Після цього потік зв'язування спрямовують у реактор періодичної дії для проведення подальших реакцій згідно з даним описом. У безперервному процесі реакції як літіювання, так і зв'язування, можуть бути добре інтегровані і проводитися при більш високих температурах у проточних реакторах менших розмірів, але з більш ефективним контролем температури, ніж у великогабаритних кріогенних реакторах періодичної дії. Температура проведення безперервного літіювання у розглянутому вище процесі може досягати 20°С (без будь-якого обмеження) і в кращому варіанті лежати в інтервалі від -17 до -10°С, при створенні >95 RAP цільового літійованого проміжного продукту G. У реакції зв'язування продукт описаного вище процесу в діапазоні температур від -20°С до -30°С у кращому варіанті лежить в інтервалі 70-79 RAP. Сполука If може використовуватися для одержання проміжного кристалічного продукту А, як показано на Схемі IVB. У цьому процесі, як показано на Схемі IVB, тверду сполуку If, твердий диметиламінопіридин (DMAP), рідкий ацетонітрил і рідкий оцтовий ангідрид нагрівають до температури в інтервалі від приблизно 70 до приблизно 85°С і підтримують при цій температурі до завершення реакції. Реакційну суміш охолоджують (наприклад, до 5°С) і до неї додають триетилсилан і комплекс трифториду бору та оцтової кислоти або іншу кислоту Льюїса (як описано в тексті до Схеми І). По завершенні реакції до суміші додають ацетон або інший розчинник. Суміш нагрівають (наприклад від приблизно 20 до приблизно 30°С) та підтримують у нагрітому стані до повної витрати триетилсилану. До суміші додають водний розчин NH4Oac, суміш перемішують і залишають відстоюватися до утворення в ній верхньої і нижньої фаз. Загальний об'єм збагаченої на продукт верхньої фази зменшують шляхом відгонки ацетонітрилу до мінімальної рухливості. При підвищеній температурі (>60°С) додають SDA3A етанол. Продукт А викристалізовують шляхом охолодження без введення або з уведенням зародкових кристалів (5%(мас.) від маси сполуки If після мокрого помелу, помелу в струмені азоту або попередньої партії продукту). Отриманий продукт піддають рекристалізації у формі мокрого чи сухого осаду із SDA3A етанолу. Кристалічний сольват диметанолу Ig згідно з даним винаходом одержують так, як показано на наведеній нижче Схемі V. 45 96765 46 У цьому процесі некристалічну сполуку В (яка може бути одержана так, як описано в патентній заявці США № 10/745,075, поданій 23 грудня, 2003, або у патенті США № 6,515,117), у кращому варіанті у практично чистій формі (чистотою від 50 до 100%), розчиняють у метанолі, в суміші метанол/толуол або в суміші метанол/толуол/гептан, у суміші метанол/метил-t-бутиловий етер (МТВЕ)гептан, або в суміші метанол/толуол/етилацетат чи інший алкілацетат при перемішуванні, внаслідок чого утворюється біла суспензія, що містить кристалічний сольват диметанолу Ig. Кристалічний сольват диметанолу Igможе бути видобутий із суспензії за допомогою звичайних методів, наприклад фільтрації. Описаний процес може здійснюватися при кімнатній температурі, хоча для активації кристалізації можуть використовуватися і підвищені температури до приблизно 20-25°С. У кращому варіанті сполуку Ig кристалізують із суміші метанол/толуол, у котрій об'ємне співвідношення між метанолом і толуолом лежить в інтервалі приблизно від 6:1 до приблизно 1:1, а в ще кращому варіанті - від приблизно 3:1 до приблизно 5:1. Кількість метанолу в суміші метанол/толуол повинна бути достатньою для забезпечення молярного співвідношення зі сполукою В в інтервалі приблизно від 80:1 до приблизно 10:1, а в кращому варіанті - від приблизно 40:1 до приблизно 20:1, а разом з цим і утворення сольвату диметанолу Ig. Кристалізація для утворення сольвату диметанолу Ig здійснюється легше при використанні зародкових кристалів сполуки Ig у кількості від приблизно від 0,1 до приблизно 10%, а в кращому варіанті - від приблизно 0,5 до приблизно 3% від маси початкової сполуки В. В іншому кращому варіанті даного процесу сполуку Ig (яка необов'язково може бути очищеною) кристалізують із суміші метанол/толуол/гептан з використанням зародків кристалічної сполуки Ig у кількості від приблизно 0,1 до приблизно 10%, а в кращому варіанті від приблизно 0,5 до приблизно 3% відносно маси початкової сполуки В. Метанол використовують в об'ємному співвідношенні з толуолом в інтервалі приблизно від 1:0,5 до приблизно 1:6, у кращому варіанті - від приблизно 1:1,5 до приблизно 1:2,5, а об'ємне співвідношення гептан:толуол лежить в інтервалі приблизно від 2:1 до приблизно 0,5:1, у кращому варіанті - від приблизно 1,3:1 до приблизно 0,5:1. Кристалічний комплекс Ih з L-проліном 1:2 згідно з даним винаходом одержують так, як показано на наведеній нижче Схемі VI. У цьому процесі розчин L-проліну у воді нагрівають до температури в інтервалі приблизно від 70 до приблизно 90°С і до нього додають спиртовий розчинник, такий як метанол, етанол або ізопропіловий спирт, серед яких кращим є ізопропіловий спирт. До приготованого таким чином розчину L-проліну (при перемішуванні) додають розчин сполуки І, де сполуку І беруть у молярному відношенні до L-проліну приблизно 0,5:1. Цей розчин повільно охолоджують до кімнатної температури, протягом чого утворюються тверді тіла. Далі розчин фільтрують, видаляючи з нього утворені тверді тіла, котрі промивають спиртовим розчинником. Промиті тверді тіла висушують і отримують тверду речовину, котра являє собою кристалічний комплекс Ih з L-проліном 1:2, форму 3, N-1. Кристалічний комплекс Іі з L-проліном 1:1 згідно з даним винаходом одержують так, як показано на наведеній нижче Схемі VII. 47 96765 48 Розчин L-проліну в суміші етанол/вода нагрівають до кипіння і до нього додають розчин сполуки І в етанолі або іншому спиртовому розчиннику. Приготований таким чином розчин охолоджують від -10 до -25°С, протягом чого в ньому утворюються тверді тіла, які являють собою кристалічний комплекс Іі з L-проліном 1:1 і видобування яких із розчину здійснюють за допомогою звичайних ме тодів. При проведенні описаної вище процедури з виготовлення комплексу Іі з L-проліном 1:1 Lпроліновий компонент використовують у молярному співвідношенні зі сполукою І в інтервалі приблизно від 1:4 до приблизно 1:6. Напівгідрат кристалічного комплексу Ij з Lпроліном згідно з даним винаходом одержують так, як показано на наведеній нижче Схемі VIII. У цьому процесі розчин L-проліну і сполуки І (4,34 г, 10 ммоль) у суміші етанол/вода нагрівають до 70°С, отримуючи в результаті світлий розчин. Цей розчин охолоджують від -20 до -25°С і до нього додають зародки кристалів комплексу Іі з Lпроліном 1:1. За 3 дні витримування при температурі -20°С тверді тіла збирають шляхом фільтрації, і осад на фільтрі промивають холодним (-20°С) етанолом. Отримані тверді тіла за допомогою звичайних методів суспендують і видобувають із суспензії у формі кристалічних твердих тіл Ij, H0.5-2. Кристалічний комплекс Ik з L-фенілаланіном згідно з даним винаходом одержують так, як показано на наведеній нижче Схемі IX. У цьому процесі L-фенілаланін розчиняють у воді під нагрівом. Утворений розчин перепускають через фільтр і додають до етанолового (або в іншому спирті) розчину сполуки І. Цей розчин нагрівають до температури в інтервалі від 70 до 90°С і залишають повільно охолоджуватися до кімнатної температури (утворення кристалів спостерігається при 55°С). Після цього розчин піддають звичайним відновлювальним процедурам. Відновлений комплекс Ik з L-фенілаланіном має форму твердого тіла білого кольору та ідентифікується як такий, що являє собою комплекс сполуки І з L-Phe у співвідношенні 1:1. Нижче наведені приклади здійснення даного винаходу, які більш докладно висвітлюють його особливості та переваги. Ці приклади, в яких подаються кращі варіанти здійснення даного винаходу, мають виключно ілюстративне, а не обмежувальне спрямування. Загальні процеси виготовлення сполук за формулою І описані в патенті США (U.S. Patent 6,414,126), а конкретні їх варіанти описані на Схемі 1 і в Прикладі 1 патентів США (U.S. Patent 49 96765 50 5,515,117. U.S. Patent 6,414,126, U.S. Patent 5,515,117), включених тут в усій їхній повноті шляхом посилання. Підходящі сполуки за формулою (І) можуть кристалізуватися у формі сольватів (наприклад, гідратів). Приклади Виготовлення кристалічних структур Приклад 1 Виготовлення структури (S)-пропіленгліколю ((S)-PG) -Форма SC-3 - Формула Іа Сполука А може бути одержана так, як описано у Прикладі 1, Частина Е, патенту США (U.S. Patent 6,515,117). У скляний реактор ємністю 10 л, обладнаний термопарою і входом для подачі азоту, залили МеОН (1,25 л), деіонізовану воду (3,6 л), а після цього - 50% водний розчин NaOH (205,9 мл, 3,899 моль). Решту розчину NaOH, що залишилася в мірному циліндрі, перенесли до даної реакційної посудини з водою (94 мл). До суміші додали сполуку А (503,11 г, 0,872 моль), і суміш перемішували під нагрівом при ~68°С протягом 1,5 год. За 1 год. температуру циркуляційної бані знизили від 80 до 70°С, внаслідок чого внутрішня температура 1 знизилася до 65°С. Після загалом 3 год. НРLС 1 хроматографія ( НРLС. Колонка: YMC ODS-A (С18) S3, 4,6x50 мм. Розчинник А: 0,2% водний розчин Н3РО4. Розчинник В: 90% CH3CN/10%H2O початковий В=0%, кінцевий В=100%. Період градієнта: 8 хв.; час утримування 3 хв. Час припинення інтеграції: 11,0 хв. Витрата елюенту: 2,5 мл/хв. Довжина хвилі УФ детектування: 220 нм) показала завершення реакції; сполука І: АР ~99,5. Після охолодження суміші до 25°С, до неї додали ізопропілацетат (2,5 л). Суміш перемішували протягом 10 хвилин, після чого водний шар відокремили (рН=12,5), а органічний шар промили водою (1 л). Під час цього промивання величину рН даної двофазної системи відрегулювали на 6,0 концентрованою НСІ (5,0 мл), а потім водний шар відокре2 2 мили. ( Для запобігання забрудненню продукту гідроксидом натрію NaOH проводили розділяння фаз перед нейтралізацією. (S)-PG структура, що отримувалася без нейтралізації, мала невелику основність [рН 8,3 суспензії, опроміненої ультразвуком у воді (~20 мг/мл)]). Органічний шар зібрали в окремій посудині. Реактор промили водою (2 л), МеОН (2 л) і продули азотом. Мокрий розчин сполуки В знову залили в реактор і ввели у нього (S)пропіленгліколь ((S)-PG) (67,03 г, 0,872 моль). У разі потреби на цій стадії можна додавати зародкові кристали (S)-PG la. Внаслідок миттєвої кристалізації утворилася густа суспензія. Після перемішування протягом 1 год. до суспензії швидко, впродовж 10 хвилин додали циклогексан (2,5 л) і перемішування тривало ще протягом 21 год. Після цього продукт перепустили через фільтрувальний папір (ватман №5, лійка Бюхнера діаметром 24 дюйми). Фільтрація була швидкою і тривала приблизно 15 хвилин. Осад на фільтрі промили сумішшю МТВЕ/циклогексан 1:1 (2x1 л) і просушили в умовах відсмоктування впродовж 0,5 год. Твердий осад перенесли на лоток із пірексу і сушили під вакуумом (25 мм рт. ст.) у печі при температурі 2530°С протягом двох днів, поки аналіз води за допомогою KF не показав відповідність цього продукту моногідрату (3,6%(мас.)). Отриманий таким чином (S)-PG продукт Іа (0,425 кг, вихід 97%) мав 3 вигляд сніжно-білої твердої речовини, HPLC АР 3 99,7 ( Методика HPLC. Рухома фаза А: 0,05% TFA в Н2О. Рухома фаза В: 0,05% TFA в CAN. Колонка: YMC Hydrosphere 4,6x150 (3 мкм). Градієнт: 30 51 96765 52 90% В протягом 45 хвилин, утримування 5 хвилин; повернення до 30% В і відновлення рівноваги: 10 хв. Довжина хвилі: 220 нм. Об'єм інжекції: 10 мкл. Температура: навколишня). Зародкові кристали можуть виготовлятися шляхом розчиняння сполуки І, наприклад, у МТВЕ, змішування такого розчину з (S)-пропіленгліколем і проведення описаного вище процесу без застосування зародків кристалізації. Приклад ΘΑ Структура (S)-пропіленгліколю ((S)-PG), форма SC-3, формула Іа Технологічний процес До реактора при навколишніх температурі і тиску поміщали 20 г сполуки А. Після цього до реактора додавали 30 мл метанолу і 49,75 мл 3 н. розчину NaOH. Утворену таким чином реакційну суміш нагрівали до 80°С або кипіння зі зворотним холодильником і витримували при цій температурі приблизно 2-3 години до завершення реакції
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline solvates and complexes of (is) -1, 5-anhydro-l-c- (3- ((phenyl) methyl) phenyl) -d-glucitol derivatives with amino acids as sglt2 inhibitors for the treatment of diabetes
Автори англійськоюGougoutac, Jack Z., Lobinger Hildegard, Ramakrishnan Srividya, Deshpande Prashant P., Bien Jeffrey T., Lai Chiajen, Wang Chenchi, Riebel Peter, Grosso John Anthony, Nirschi Alexandra A., Singh Jakan, Dimarko, John D.
Назва патенту російськоюКристаллические сольваты и комплексы производных (is)-1,5-ангидро-l-c-(3-((фенил)метил)фенил)-d-глюцитола с аминокислотами как ингибиторы белка sglt2, пригодные в лечении диабета
Автори російськоюГоугоутас Джек З., Лобингер Хильдегард, Рамакришнан Шривидья, Дешпанде Прашант П., Бин Джеффри Т., Лаи Чиаджен, Ванг Ченчи, Рибель Петер, Гроссо Джон Энтони, Ниршль Александра А., Сингх Джанак, Димарко Джон Д.
МПК / Мітки
МПК: C07H 7/00, A61P 3/10, A61K 31/70
Мітки: амінокислотами, похідних, діабету, sglt2, комплекси, is)-1,5-ангідро-l-c-(3-((феніл)метил)феніл)-d-глюцитолу, придатні, сольвати, лікуванні, білка, інгібітори, кристалічні
Код посилання
<a href="https://ua.patents.su/74-96765-kristalichni-solvati-i-kompleksi-pokhidnikh-is-15-angidro-l-c-3-fenilmetilfenil-d-glyucitolu-z-aminokislotami-yak-ingibitori-bilka-sglt2-pridatni-u-likuvanni-diabetu.html" target="_blank" rel="follow" title="База патентів України">Кристалічні сольвати і комплекси похідних (is)-1,5-ангідро-l-c-(3-((феніл)метил)феніл)-d-глюцитолу з амінокислотами як інгібітори білка sglt2, придатні у лікуванні діабету</a>
Попередній патент: Похідні бензімідазолу, корисні у лікуванні розладів, пов’язаних з рецептором trpvl
Наступний патент: Гетероциклічні сполуки, придатні для лікування хвороб, що мають відношення до підвищеного рівня ліпідів
Випадковий патент: Суміш для тампонування