Агоністи рецептора mglu2
Номер патенту: 107684
Опубліковано: 10.02.2015
Автори: Табоада Мартінес Лорена, Монтеро Сальгадо Карлос, Шоу Брюс Уільям, Пр'єто Лоурдес, Монн Джеймс Аллен
Формула / Реферат
1. Сполука формули:
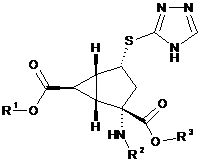 ,
,
де
R1 - водень, R2 - водень та R3 - водень;
R1 - водень, R2 - (2S)-2-амінопропаноїл та R3 - водень;
R1 - водень, R2 - (2S)-2-аміно-4-метилсульфанілбутаноїл та R3 - водень;
R1 - водень, R2 - (2S)-2-аміно-4-метилпентаноїл та R3 - водень;
R1 - водень, R2-2-аміноацетил та R3 - водень;
R1 - бензил, R2 - водень та R3 - бензил, або
R1 - (2-фторофеніл)метил, R2 - водень та R3 - (2-фторофеніл)метил;
або її фармацевтично прийнятна сіль, або сольват цієї солі.
2. Сполука за п. 1, яка являє собою (1R,2S,4R,5R,6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту, або її фармацевтично прийнятна сіль.
3. Сполука за п. 2, яка являє собою (1R,2S,4R,5R,6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту.
4. Сполука за п. 1, яка являє собою (1R,2S,4R,5R,6R)-2-[[(2S)-2-амінопропаноїл]аміно]-4-(1H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту, або її фармацевтично прийнятна сіль.
5. Сполука за п. 4, яка являє собою (1R,2S,4R,5R,6R)-2-[[(2S)-2-амінопропаноїл]аміно]-4-(1H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлорид.
6. Сполука за п. 1, яка являє собою (1R,2S,4R,5R,6R)-2-[[(2S)-2-аміно-4-метилсульфанілбутаноїл]аміно]-4-(4Н-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту, або її фармацевтично прийнятна сіль.
7. Сполука за п. 6, яка являє собою (1R,2S,4R,5R,6R)-2-[[(2S)-2-аміно-4-метилсульфанілбутаноїл]аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлорид.
8. Сполука за п. 1, яка являє собою (1R,2S,4R,5R,6R)-2-[[(2S)-2-аміно-4-метилпентаноїл]аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту, або її фармацевтично прийнятна сіль.
9. Сполука за п. 8, яка являє собою (1R,2S,4R,5R,6R)-2-[[(2S)-2-аміно-4-метилпентаноїл]аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлорид.
10. Сполука за п. 1, яка являє собою (1R,2S,4R,5R,6R)-2-[(2-аміноацетил)аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту, або її фармацевтично прийнятна сіль.
11. Сполука за п. 10, яка являє собою (1R,2S,4R,5R,6R)-2-[(2-аміноацетил)аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлорид.
12. Сполука за п. 1, яка являє собою дибензил(1R,2S,4R,5R,6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат, або її фармацевтично прийнятна сіль.
13. Сполука за п. 12, яка являє собою дибензил (1R,2S,4R,5R,6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат.
14. Сполука за п. 1, яка являє собою бiс[(2-фторофеніл)метил]-(1R,2S,4R,5R,6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат, або її фармацевтично прийнятна сіль.
15. Сполука за п. 14, яка являє собою бiс[(2-фторофеніл)метил]-(1R,2S,4R,5R,6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату гідрохлорид.
16. Сполука за п. 1, яка являє собою біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2-[[(2S)-2-аміно-1-оксопропіл]аміно]-4-(4Н-1,2,4-триазол-3-ілтіо)-, моноамонійної солі, (1R,2S,4R,5R,6R)-, моногідрат.
17. Сполука за п. 1, яка являє собою біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2-[[(2S)-2-аміно-1-оксопропіл]аміно]-4-(4Н-1,2,4-триазол-3-ілтіо)-, моноамонійної солі, (1R,2S,4R,5R,6R)-, моногідрат у кристалічній формі, який характеризується порошковою рентгенодифрактограмою, що має піки 18,61 та 21,07 при 2q±0,2.
18. Фармацевтична композиція, яка містить сполуку або сіль за будь-яким із пп. 1-17, а також фармацевтично прийнятний носій, розріджувач або наповнювач.
19. Сполука або сіль за будь-яким із пп. 1-17 для застосування у терапії.
20. Сполука або сіль за будь-яким із пп. 1-17 для застосування у лікуванні психічного розладу, який вибраний з групи, яка складається з біполярного розладу, шизофренії, депресії та генералізованого тривожного розладу.
21. Сполука або сіль для застосування за п. 20, причому психічний розлад являє собою біполярний розлад.
22. Сполука або сіль для застосування за п. 20, причому психічний розлад являє собою шизофренію.
23. Сполука або сіль для застосування за п. 20, причому психічний розлад являє собою депресію.
24. Сполука або сіль для застосування за п. 20, причому психічний розлад являє собою генералізований тривожний розлад.
25. Фармацевтична композиція, яка містить сполуку або сіль за будь-яким із пп. 1-17, разом із фармацевтично прийнятним носієм та, факультативно, іншими терапевтичними інгредієнтами.
Текст
Реферат: Пропонуються нові агоністи рецептора mGlu2, які можуть стати в нагоді при лікуванні біполярного розладу, шизофренії, депресії та генералізованого тривожного розладу. UA 107684 C2 (12) UA 107684 C2 UA 107684 C2 5 10 15 20 25 30 35 40 45 50 Цей винахід стосується сполук-агоністів метаботропного глютамату (mGlu), певних попередників лікарських засобів, що належать до цього ряду, солей та сольватів цих сполук; зокрема, він стосується нових сполук ряду 4-заміщеного біцикло[3.1.0]гексану, деяких попередників лікарських засобів, що належать до цього ряду, солей та сольватів цих сполук, а також фармацевтичних композицій і терапевтичного застосування таких сполук -зокрема, деяких попередників лікарських засобів, що належать до цього ряду, а також солей та сольватів цих сполук. L-Глютамат є одним з найважливіших збуджувальних нейромедіаторів у складі центральної нервової системи, і відомий як збуджувальна амінокислота. Рецептори метаботропного глютамату належать до спряжених з G-білком рецепторів, які модулюють збуджуваність нейронів. Успіх лікування неврологічних або психічних розладів пов'язували з селективною активацією рецепторів збуджувальної амінокислоти, а саме mGlu. Відомі численні дослідження, в яких підтримується активація рецептора mGlu Групи II (яка включає в себе mGlu2 та/або mGlu3) для лікування шизофренії. Зокрема, останні дані вказують на те, що агоніст рецептора mGlu2/3 має властивості антипсихотика, і може надати нову альтернативу при лікуванні шизофренії. Дослідження засвідчили, що антипсихотична активність агоністів mGlu2/3 опосередкована mGlu2. Дослідження також засвідчили, що агоністам mGlu2/3 притаманні властивості анксіолітиків, антидепресантів та нейропротекторів. Таким чином, агоністи mGlu2 можуть стати в нагоді при лікуванні психічних захворювань таких, як, так званий, біполярний розлад (відомий також як маніакально-депресивний психоз), шизофренії, депресії, а також генералізований тривожний розлад. У WO97/17952 описані певні 4-заміщені сполуки ряду біцикло[3.1.0]гексану, які, за твердженням, є антагоністами або агоністами рецепторів метаботропного глютамату. У WO03/104217 описані сполуки ряду біцикло[3.1.0]гексану та гетеробіцикло[3.1.0]гексану, які, за твердженням, є попередниками сполук-агоністів рецептора mGluR2. Виявилося, що багато хворобливих станів центральної нервової системи супроводжуються підвищеним тонусом системи обміну глютамату; втім, у клінічній практиці бракує ефективних препаратів, здатних коригувати такі патофізіологічні стани. Зокрема, клінічного застосування не вдалося реалізувати за браком агоністів рецептора mGlu2 із прийнятними терапевтичними властивостями. Отже, наразі існує потреба у потужних та ефективних агоністах mGlu2. У цьому винаході запропоновані нові 4-заміщені біцикло[3.1.0]гексани, в тому числі певні попередники лікарських засобів, що належать до цього ряду, які забезпечують підвищену біодосяжність, прийнятну для створення клінічного лікарського засобу, і є потужними та ефективними агоністами mGlu2. Такі нові сполуки за цим винаходом могли б задовольнити потребу у потужних, ефективних засобах лікування психічних захворювань, таких як біполярний розлад, шизофренія, депресія, а також генералізований тривожний розлад. Цим винаходом запропонована сполука за формулою де 1 2 3 R означає водень, R означає водень, R означає водень; 1 2 3 R означає водень, R означає (25)-2-амінопропаноїл, R означає водень; 1 2 3 R означає водень, R означає (25)-2-аміно-4-метилсульфанілбутаноїл, R означає водень; 1 2 3 R означає водень, R означає (25)-2-аміно-4-метилпентаноїл, R означає водень; 1 2 3 R означає водень, R означає 2-аміноацетил, R означає водень; 1 2 3 R означає бензил, R означає водень, R означає бензил, або 1 2 3 R означає (2-фторофеніл)метил, R означає водень, R означає (2-фторофеніл)метил; або її фармацевтично прийнятна сіль, або сольват цієї солі. Цим винаходом запропонована (1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль. 1 UA 107684 C2 5 10 15 20 25 30 35 40 45 50 55 60 У одному з конкретних варіантів здійснення цим винаходом запропонована (1R, 2S,4R,5R,6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота. Цим винаходом запропонована (1R,2S,4R,5R,6R)-2-[[(2S)-2-амінопропаноїл]аміно]-4-(1H1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль. У одному з конкретних варіантів здійснення, цим винаходом запропонований (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-амінопропаноїл]аміно]-4-(1H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан2,6-дикарбонової кислоти гідрохлорид. Цим винаходом запропонована (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4метилсульфанілбутаноїл]аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбонова кислота або її фармацевтично прийнятна сіль. У одному з конкретних варіантів здійснення, цим винаходом запропонований (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилсульфанілбутаноїл]аміно]-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлорид. Цим винаходом запропонована (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4метилпентаноїл]аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль. У одному з конкретних варіантів здійснення, цим винаходом запропонований (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилпентаноїл]аміно]-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлорид. Цим винаходом запропонована (1R, 2S, 4R, 5R, 6R)-2-[(2-аміноацетил)аміно]-4-(4H-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль. У одному з конкретних варіантів здійснення, цим винаходом запропонований (1R, 2S, 4R, 5R, 6R)-2-[(2-аміноацетил)аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбонової кислоти гідрохлорид. Цим винаходом запропонований дибензил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат або його фармацевтично прийнятна сіль. У одному з конкретних варіантів здійснення, цим винаходом запропонований дибензил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбоксилат. Цим винаходом запропонований біс[(2-фторофеніл)метил]-(1R, 2S, 4R, 5R, 6R)-2-аміно-4(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат або його фармацевтично прийнятна сіль. У одному з конкретних варіантів здійснення, цим винаходом запропонований біс[(2фторофеніл)метил]-(1R,2S,4R,5R,6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату гідрохлорид. Цим винаходом запропонована біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2-[[(2S)-2аміно-1-оксопропіл]аміно]-4-(4H-1,2,4-триазол-3-ілтіо)-, моноамонійна сіль, (1R, 2S, 4R, 5R, 6R)-, у вигляді моногідрату. Цим винаходом запропонована біцикло[3.1.0]гексан-2,6-дикарбонова кислота, 2-[[(2S)-2аміно-1-оксопропіл]аміно]-4-(4H-1,2,4-триазол-3-ілтіо)-, моноамонійна сіль, (1R, 2S, 4R, 5R, 6R)-, у вигляді кристалічного моногідрату. Цим винаходом запропонована біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2-[[(2S)-2аміно-1-оксопропіл]аміно]-4-(4H-1,2,4-триазол-3-ілтіо)-, моноамонійна сіль, (1R, 2S, 4R, 5R, 6R)-, у вигляді кристалічного моногідрату, який характеризується порошковою рентгенодифрактограмою, що має піки з інтенсивностями 18,61 та 21,07 при 2+0,2. Цим винаходом запропонована біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2-[[(2S)-2аміно-1-оксопропіл]аміно]-4-(4H-1,2,4-триазол-3-ілтіо)-, моноамонійна сіль, (1R, 2S, 4R, 5R, 6R)-, у вигляді кристалічного моногідрату, який характеризується порошковою рентгенодифрактограмою, яка має пік 18,61 при 2±0,2, а також один чи більшу кількість піків, що належать до групи, яка складається з піків при 21,07, 15,34, 14,7 та 19,20. Сполуками за цим винаходом є (1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2амінопропаноїл]аміно]-4-(1H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилсульфанілбутаноїл]аміно]-4-(4H-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота, (1R, 2S, 4R, 5R, 6R)-2[[(2S)-2-аміно-4-метилпентаноїл]аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан2,6-дикарбонова кислота, (1R, 2S, 4R, 5R, 6R)-2-[(2-аміноацетил)аміно]-4-(4H-1,2,4-триазол-3 2 UA 107684 C2 5 10 15 20 25 30 35 40 45 50 55 60 ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота, дибензил(1R, 2S, 4R, 5R, 6R)-2аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат та/або біс[(2фторофеніл)метил](1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат або їх фармацевтично прийнятна сіль цих сполук. Цим винаходом запропонована фармацевтична композиція, що містить (1R, 2S, 4R, 5R, 6R)2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту або її фармацевтично прийнятну сіль, (1R, 2S, 4R, 5R, 6R)-2- [[(2S)- 2-амінопропаноїл]аміно]-4-(1H1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту або її фармацевтично прийнятну сіль, (1R, 2S, 4R, 5R, 6R) - 2- [[(2S) - 2-аміно-4-метилсульфанілбутаноїл] аміно]-4-(4Н1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту або її фармацевтично прийнятну сіль, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилпентаноїл] аміно] -4-(4 Н-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту або її фармацевтично прийнятну сіль, (1R, 2S, 4R, 5R, 6R)-2- [(2-аміноацетил)аміно] -4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту або її фармацевтично прийнятну сіль, дибензил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан2,6-дикарбоксилат або його фармацевтично прийнятну сіль, біс[(2-фторофеніл)метил]-(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат або його фармацевтично прийнятну сіль, або біцикло[3.1.0]гексан-2,6- дикарбонової кислоти, 2[[(2S)-2-аміно-1-оксопропіл]аміно]-4-(4H-1,2,4-триазол-3-ілтіо)-, моноамонійної солі, (1R, 2S, 4R, 5R, 6R)-, моногідрат, разом із фармацевтично прийнятним носієм та, факультативно, іншими терапевтичними інгредієнтами. Цим винаходом запропонована фармацевтична композиція, що містить (1R, 2S, 4R, 5R, 6R)2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту або її фармацевтично прийнятну сіль, (1R, 2S, 4R, 5R, 6R)- 2- [[(2S)- 2-амінопропаноїл]аміно]-4-(1H1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту або її фармацевтично прийнятну сіль, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилсульфанілбутаноїл]аміно] -4-(4 Н1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту або її фармацевтично прийнятну сіль, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилпентаноїл]аміно]-4-(4H-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту або її фармацевтично прийнятну сіль, (1R, 2S, 4R, 5R, 6R)-2- [(2-аміноацетил)аміно] -4-(4 Н-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту або її фармацевтично прийнятну сіль, дибензил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан2,6-дикарбоксилат або його фармацевтично прийнятну сіль, біс[(2-фторофеніл)метил]- (1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат або його фармацевтично прийнятну сіль, або біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2[[(2S)-2-аміно-1-оксопропіл]аміно]-4-(4H-1,2,4-триазол-3-ілтіо)-, моноамонійної солі, (1R, 2S, 4R, 5R, 6R)-, моногідрат, та фармацевтично прийнятний носій, розріджувач або наповнювач. Цим винаходом запропонований спосіб лікування психічних розладів, що передбачає введення до організму пацієнта, який цього потребує, ефективної кількості (1R, 2S, 4R, 5R, 6R)2-аміно-4-(4H-1,2,4-триазол-З-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти або її фармацевтично прийнятної солі, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-амінопропаноїл]аміно]-4-(1H1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти або її фармацевтично прийнятної солі, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4метилсульфанілбутаноїл]аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбонової кислоти або її фармацевтично прийнятної солі, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2аміно-4-метилпентаноїл]аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбонової кислоти або її фармацевтично прийнятної солі, (1R, 2S, 4R, 5R, 6R)-2-[(2аміноацетил)аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти або її фармацевтично прийнятної солі, дибензил (1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату або його фармацевтично прийнятної солі, бic[(2-фторофеніл)метил]-(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату або його фармацевтично прийнятної солі, або біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2-[[(2S)-2-аміно-1-оксопропіл]аміно]-4-(4H1,2,4-триазол-3-ілтіо)-, моноамонійної солі, (1R, 2S, 4R, 5R, 6R)-, моногідрату. Цим винаходом запропоноване застосування (1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти або її фармацевтично прийнятної солі, (lR, 2S, 4R, 5R, 6R)-2-[[(2S)-2-амінопропаноїл]аміно]-4-(1 H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти або її фармацевтично прийнятної солі, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилсульфанілбутаноїл]аміно]-4-(4H-1,2,4-триазол 3 UA 107684 C2 5 10 15 20 25 30 35 40 45 50 55 60 3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти або її фармацевтично прийнятної солі, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилпентаноїл]аміно]-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти або її фармацевтично прийнятної солі, (1R, 2S, 4R, 5R, 6R)-2-[(2-аміноацетил)аміно]-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти або її фармацевтично прийнятної солі, дибензил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату або його фармацевтично прийнятної солі, біс[(2-фторофеніл)метил]-(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату або його фармацевтично прийнятної солі, або біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2-[[(2S)-2-аміно-1-оксопропіл]аміно]-4-(4H1,2,4-триазол-3-ілтіо)-, моноамонійної солі, (1R, 2S, 4R, 5R, 6R)-, моногідрату, для виготовлення лікарського засобу для лікування психічного розладу. Цим винаходом запропоновані (1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль, (1R, 2S, 4R, 5R, 6R) -2- [[(2S)-2-амінопропаноїл]аміно]-4-(1H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилсульфанілбутаноїл]аміно]-4-(4H-1,2,4-триазол3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилпентаноїл]аміно]-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль, (1R, 2S, 4R, 5R, 6R)-2-[(2-аміноацетил)аміно]-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль, дибензил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат або його фармацевтично прийнятна сіль, бic[(2-фторофеніл)метил]-(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат або її фармацевтично прийнятна сіль, або біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2-[[(2S)-2-аміно-1-оксопропіл]аміно]-4-(4H-1,2,4триазол-3-ілтіо)-, моноамонійної солі, (1R, 2S, 4R, 5R, 6R)-, моногідрат, для застосування у терапії. Цим винаходом також запропоновані (1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-амінопропаноїл]аміно]-4-(1H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилсульфанілбутаноїл]аміно]-4-(4H-1,2,4-триазол3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль, (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилпентаноїл]аміно]-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль, (1R, 2S, 4R, 5R, 6R)-2-[(2-аміноацетил)аміно]-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота або її фармацевтично прийнятна сіль, дибензил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат або її фармацевтично прийнятна сіль, біс[(2-фторофеніл)метил](1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат або її фармацевтично прийнятна сіль, або біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2-[[(2S)-2-аміно-1-оксопропіл]аміно]-4-(4H-1,2,4триазол-3-ілтіо)-, моноамонійної солі, (1R, 2S, 4R, 5R, 6R)-, моногідрат, для застосування у лікуванні психічного розладу. Крім того, цим винаходом запропоновані варіанти здійснення, яким віддається перевага, способів та варіантів застосування, викладених у описі винаходу, при цьому психічний розлад вибирають з групи, яка складається з біполярного розладу, шизофренії, депресії, а також генералізованого тривожного розладу. Зазначені нижче терміни, вжиті вище, а також на протязі всього опису цього винаходу, за відсутності інших вказівок, слід розуміти таким чином: Термін "фармацевтично прийнятні солі" стосується неорганічних та органічних солей сполук за цим винаходом із відносно низькою або відсутньою токсичністю. Термін "терапевтично ефективна кількість" або "ефективна кількість" означає кількість сполуки за цим винаходом або її фармацевтично прийнятної солі, або сольвату цієї солі або фармацевтичної композиції, що містить одну зі сполук за цим винаходом, або її фармацевтично прийнятну сіль, або сольват цієї солі, яка спричиняє біологічну або медичну реакцію, або справляє бажаний лікувальний вплив на тканину, систему організму, увесь організм тварини, ссавця або людини, яка назначається дослідником, ветеринаром, лікарем або іншим фахівцем медичної галузі. 4 UA 107684 C2 5 10 15 20 25 30 35 40 45 50 Терміни "лікувати", "лікування", "вилікування" тощо передбачають сповільнення або обернення (рецесія) перебігу захворювання. Цими термінами також охоплюються послаблення болю, поліпшення самопочуття, пом'якшення, часткове або повне усунення одного чи більшої кількості симптомів хвороби або хворобливого стану, навіть у випадку, якщо хвороба або хворобливий стан насправді не усунуті і навіть якщо хвороба або хворобливий стан як такі прогресують, тобто їхній перебіг не сповільнений і не обернений. За стандартною номенклатурою, вживаною у цьому описі, передусім описують найвіддаленішу (кінцеву) частину бокового ланцюга, а надалі перелічують розташовані поруч функціональні групи в напрямку до точки приєднання ланцюга. Наприклад, замісник метилсульфоніл є еквівалентом групи CH3-SO2-. Сполуки за цим винаходом здатні, зокрема, вступати у реакцію із численними неорганічними та органічними кислотами з утворенням фармацевтично прийнятних солей - продуктів приєднання кислоти або основи. Такі фармацевтично прийнятні солі і загальні способи їх приготування добре відомі фахівцям у відповідній галузі [див., наприклад, P. Stahl, et al., HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES, SELECTION AND USE, (VCHA/WileyVCH, 2002); S.M. Berge, et al, "Pharmaceutical Salts", Journal of Pharmaceutical Sciences, Vol 66, No. 1, January 1977]. За варіантом, якому віддається перевага, сполуки за цим винаходом включають до складу фармацевтичних композицій із застосуванням одного або більшої кількості фармацевтично прийнятних носіїв, розріджувачів або наповнювачів, і вводять до організму різноманітними шляхами. Перевага надається композиціям, призначеним для перорального або внутрішньовенного введення. Такі фармацевтичні композиції, способи і технологія їх приготування добре відомі фахівцям у відповідній галузі [див., наприклад, Remington: The Science and Practice of Pharmacy (A. Gennaro, et al., eds., 21st ed., Mack Publishing Co., 2005)]. Сполука або сполуки за цим винаходом на практиці вводять за визначенням лікаря з урахуванням відповідних обставин, в тому числі стану, який належить лікувати, обраного шляху введення, сполуки або сполук за цим винаходом, які фактично вводять в організм, віку, маси тіла, індивідуальної реакції конкретного пацієнта, та тяжкості симптомів захворювання, які спостерігаються у пацієнта. Добова доза зазвичай становить від приблизно 0,1 мг до приблизно 300 мг. У деяких випадках більш ніж достатньою може виявитися доза, нижча ніж нижня межа зазначеного діапазону, натомість у інших випадках цілком припустимим є застосування ще більших доз. Сполуки за цим винаходом можна готувати за різними методиками, відомими у галузі, а також тими, що описані нижче у препаративних методиках і прикладах. Для приготування сполук за цим винаходом конкретні стадії синтезу для кожного з описаних методів синтезу можна комбінувати по-різному. Замісники, за відсутності інших вказівок, відповідають наведеним вище визначенням. Реагенти та вихідні речовини можуть бути легко одержані фахівцем у галузі. Інші речовини можуть бути легко одержані за допомогою стандартних методик органічної хімії (зокрема, хімії гетероциклів), методик, які подібні до тих, що застосовуються у синтезі відомих структурно подібних сполук, методик, що описані у наведених далі препаративних методиках і прикладах, а також будь-якими новими методами. Пойменування препаративних методик і прикладів з 1 по 7 здійснювали за допомогою прикладного пакету Symyx Draw 3.1. Назву Прикладу 8 одержано за кодовою назвою CAS, отриманою від ACD Labs. У контексті цього опису наведені нижче терміни вжиті у таких значеннях: "HPLC" означає рідинну хроматографію високої ефективності, "LC" означає рідинну хроматографію, "MS" означає мас-спектроскопію, "ЯМР" означає ядерний магнітний резонанс, "TLC" означає хроматографію у тонкому шарі, "EDTA" означає етилендіамінтетраоцтову кислоту, "PBS" означає фосфатно-сольовий буфер, "PCR" означає полімеразну ланцюгову реакцію, "SCX" означає обмін сильними катіонами, "HLB" означає гідрофільно-ліпофільний баланс. Препаративна методика 1 Ди-трет-бутил(1S, 2S, 4S, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-(nтолілсульфонілокси)біцикло[3.1.0]гексан-2,6-дикарбоксилат 5 UA 107684 C2 5 10 15 20 25 30 35 У круглодонну колбу з 2 горловинами у атмосфері азоту вміщують ди-трет-бутил-(1S, 2S, 4S, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-гідрокси-біцикло[3.1.0]гексан-2,6-дикарбоксилат (20,7 г; 0,5 моль, деталі синтезу див. у WO03/104217/A2), 4-диметиламінопіридин (10,4 г; 0,85 моль), триетиламін (6,98 мл; 0,5 ммоль) та n-толуолсульфохлорид (10,6 г; 0,55 моль) у вигляді розчину у дихлорометані (200 мл), і перемішують реакційну масу протягом ночі при кімнатній температурі. Додають 1н розчин гідросульфату калію (200 мл), воду (100 мл), і екстрагують органічний шар. Промивають водою (200 мл), розсолом (200 мл), висушують сульфатом магнію, фільтрують, і згущують до сухого стану. До залишку додають тетрагідрофуран (30 мл), і потім суміш гептанів (90 мл). Прогрівають суміш при температурі 60 °C, і повільно додають решту суміші гептанів (200 мл). Охолоджують суміш до кімнатної температури. Відділяють твердий осад фільтруванням, і висушують у вакуумі, одержуючи сполуку, вказану у заголовку, у вигляді білої твердої речовини (24,6 г; 87 %). Мас-спектр (MS): m/z 590 (М+23). Препаративна методика 2 Ди-трет-бутил (1R, 2S, 4R, 5R, 6R)-2-(трет-бутоксикарбоніламшо)-4-(4Н-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат Спосіб 1: У круглодонну колбу у атмосфері азоту вміщують ди-трет-бутил(1S, 2S, 4S, 5R, 6R)-2-(третбутоксикарбоніламіно)-4-(n-толілсульфонілокси)біцикло[3.1.0]гексан-2,6-дикарбоксилат (462 г; 813,8 ммоль), 1H-1,2,4-триазол-3-тіол (88,2 г; 854,5 ммоль), карбонат калію (123,7 г; 895,2 ммоль) у вигляді розчину у N,N-диметилформаміді (2,3 л), і перемішують реакційну масу при температурі 80 °C протягом 2 год. Охолоджують суміш до кімнатної температури, після чого додають метил-трет-бутиловий простий ефір (2,3 л) і воду (4,6 л). Повільне додавання 1 Μ розчину гідросульфату калію (1,85 л) супроводжується виділенням газу. Екстрагують реакційну суміш метил-трет-бутиловим простим ефіром (2,3 л), та відкидають водну фазу. Послідовно промивають залишок водою (2,5 л) і розсолом (2 л), та відкидають водні фази. Згущують органічну фазу до сухого стану, одержуючи тверду речовину (440 г). Продукт очищують за допомогою флеш-хроматографії, використовуючи як елюент суміш етилацетат:гексан (від 20:80 до 70:30), та одержують сполуку, вказану у заголовку, у вигляді білої твердої речовини (305,6 г; 76 %). Мас-спектр (MS): m/z 497 (M+1). Спосіб 2: Розчиняють ди-трет-бутил(1S, 2S, 4S, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-(nтолілсульфонілокси)біцикло[3.1.0]гексан-2,6-дикарбоксилат (1,31 г; 2,31 ммоль) та 1H-1,2,4триазол-3-тіол (0,31 г; 3 ммоль) у N,N-диметилформаміді (7 мл); потім додають карбонат калію (639 мг; 4,62 ммоль), і перемішують реакційну масу протягом ночі при 80 °C. Згущують до сухого стану, залишок знов розчиняють у етилацетаті, промивають послідовно 10 % розчином лимонної кислоти та 10 % розсолом. Висушують сульфатом натрію, фільтрують, і згущують до сухого стану. Продукт очищують за допомогою флеш-хроматографії, використовуючи як елюент 6 UA 107684 C2 5 10 15 20 25 30 35 суміш етилацетаттексан (від 10:90 до 80:20), та одержують сполуку, вказану у заголовку (830 мг; 72 %). Мас-спектр (MS): m/z 497 (M+1) Препаративна методика 3 Діетил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан2,6-дикарбоксилату гідрохлорид. Спосіб 1: У круглодонну колбу вміщують ди-трет-бутил(1R, 2S, 4R, 5R, 6R)-2-(третбутоксикарбоніламіно)-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбоксилат (305,6 г; 0,61 моль) та етанол (1,53 л). Повільно додають тіонілхлорид (179,3 мл; 2,46 моль) (екзотермічна реакція із підвищенням температури до 45 °C), і перемішують реакційну масу протягом ночі при 80 °C. Видаляють розчинник у вакуумі, одержуючи білу піноподібну речовину. Додають метиловий-трет-бутиловий простий ефір (2,5 л), та видаляють розчинник у вакуумі. Додають метиловий-трет-бутиловий простий ефір (2,5 л), та перемішують протягом ночі. Відфільтровують осад, та промивають метил-трет-бутиловим простим ефіром. Висушують в атмосфері азоту, одержуючи сполуку, вказану у заголовку, у вигляді білої твердої речовини (264,6 г; 0,7 моль). Мас-спектр (MS): m/z 341 (M+1). Спосіб 2: Розчиняють ди-трет-бутил(1R, 2S, 4R, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-(4H-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат (830 г, 1,67 ммоль) у етанолі (6,7 мл), охолоджують суміш до 5 °C, і додають тіонілхлорид (487 мкл; 6,69 ммоль). Прогрівають суміш при 80 °C протягом ночі. Видаляють розчинник у вакуумі, одержуючи білу тверду речовину, потім додають діетиловий ефір, і згущують до сухого стану. Надалі висушують речовину протягом 48 год., одержуючи сполуку, вказану у заголовку (714 мг; 1,89 ммоль). Масспектр (MS): m/z (M+1). Препаративна методика 4 Діетил(1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-(трет-бутоксикарбоніламіно)пропаноїл]аміно]-4-(4Н1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат Спосіб 1: У реактор місткістю 5 л у атмосфері азоту вміщують діетил(1R, 2S, 4R, 5R, 6R)-2-аміно-4(4H, 1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату гідрохлорид (264 г, 0,7 моль) та тетрагідрофуран (1,32 л), і охолоджують суміш до 0-5 °C у водяній бані з льдом. Потім додають хлородиметокситриазин (125,5 г; 0,7 моль) та (2S)-2-(третбутоксикарбоніламіно)пропіонову кислоту (141,3 г; 0,73 моль). Повільно додають Nметилморфолін (231,8 мл; 2,1 моль), і перемішують протягом 3 год. Суміш фільтрують, і промивають білий осад тетрагідрофураном. Осад відкидають, а маточний розчин згущують до сухого залишку. Очищують за допомогою флеш-хроматографії, використовуючи як елюент 7 UA 107684 C2 5 10 15 20 суміш етилацетат:гексан (від 60:40 до 100:0), та одержують сполуку, вказану у заголовку (195 г; 54 %). Мас-спектр (MS): m/z 512 (M+1), 534 (М+23). Спосіб 2: Поєднують діетил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату гідрохлорид (354 мг; 0,94 ммоль), (2S)-2(трет-бутоксикарбоніламіно) пропіонову кислоту (271 мг; 1,41 ммоль), 4-диметиламінопіридин (11,5 мг; 94 мкмоль), 1-гідроскибензотриазолу гідрат (219 мг; 1,41 ммоль) та 1-(3диметиламінопропіл)-3-етилкарбодііміду гідрохлорид (274 мг; 1,41 ммоль) у дихлорометані (9,4 мл), потім додають триетиламін (393 мкл; 2,82 ммоль), та перемішують реакційну масу при кімнатній температурі протягом ночі в атмосфері азоту. Промивають 10 % розчином лимонної кислоти, насиченим розчином бікарбонату натрію та розсолом. Водні шари відкидають, органічний шар фільтрують крізь картридж з кізельгуром, і видаляють розчинник у вакуумі. Очищують за допомогою флеш-хроматографії, використовуючи як елюент суміш етилацетат:гексан (від 20:80 до 100:0), та одержують сполуку, вказану у заголовку (319 мг; 66 %). Мас-спектр (MS): m/z 512 (M+1), 534 (М+23). Наведені нижче сполуки одержані за методом 1 препаративної методики4. Препаративна методика 7 (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-(трет-бутоксикарбоніламіно)пропаноїл]аміно]-4-(4H-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота 8 UA 107684 C2 5 10 15 20 25 Спосіб 1: До круглодонної колби з 2 горловинами вміщують діетил(1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-(третбутоксикарбоніламіно)пропаноїл]аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан2,6-дикарбоксилат (195 г; 0,38 моль) та тетрагідрофуран (1,17 л), і охолоджують суміш до 4 °C у водяній бані з льодом. Повільно, протягом 30 хв, додають охолоджений до 4 °C 50 % розчин гідроксиду натрію (81 мл), розведений водою (1,17л) (спостерігається незначне підвищення температури до 8 °C). Прибирають водяну баню з льодом, та перемішують реакційну масу при температурі 15 °C. Через 3 години підкислюють суміш до рН 3 сумішшю концентрованої хлористоводневої кислоти та води (1:3, приблизно 500 мл), підтримуючи температуру нижче 20 °C. Екстрагують мутний розчин етилацетатом (600 мл, потім ще 2×100 мл). Органічні шари поєднують, промивають розсолом (100 мл), та відділяють водну фазу. Висушують сульфатом магнію, фільтрують, і згущують до сухого стану, одержуючи сполуку, вказану у заголовку, у вигляді білої твердої речовини (187 г; 0,41 моль). Мас-спектр (MS): m/z 456(M+1). Спосіб 2: Розчиняють діетил (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-(третбутоксикарбоніламіно)пропаноїл]аміно]-4-(4 Η-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан2,6-дикарбоксилат (319 мг; 0,62 ммоль) у тетрагідрофурані (4,2 мл), потім додають 2 моль/л гідроксид літію (2,5 мл; 5 ммоль). Перемішують розчин при кімнатній температурі протягом ночі. Розводять реакційну суміш водою, і промивають етилацетатом. Органічний шар відкидають. Доводять рН водної фази до рН 2 хлористоводневою кислотою, та екстрагують етилацетатом. Висушують органічну фазу, проганяючи крізь картридж з кізельгуром, і згущують до сухого стану, одержуючи сполуку, вказану у заголовку (244 мг; 86 % від теорії). Мас-спектр (MS): m/z 456 (M+1). Наведені нижче сполуки одержані по суті за методом 2 препаративної методики 7. 9 UA 107684 C2 5 10 15 20 25 30 Препаративна методика 10 Діетил(1R, 2S, 4R, 5R, 6R)-2-[[2-(трет-бутоксикарбоніламіно)ацетил]аміно]-4-(4H-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат До перемішуваного розчину ди-трет-бутил(1R, 2S, 4R, 5R, 6R)-2-(третбутоксикарбоніламіно)-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбоксилату (2,1 г, 4,23 ммоль) у етанолі (40 мл) при 0-5 °C краплями обережно (реакція екзотермічна) протягом 5 хв додають тіонілхлорид (2,5 мл; 34,32 ммоль). Прибирають охолоджувальну баню, і кип'ятять реакційну суміш зі зворотним холодильником протягом 16 год. Випаровують леткі сполуки, і висушують залишок у глибокому вакуумі протягом 7 год., отримуючи діетил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату гідрохлорид у вигляді безбарвної піни. Потім додають 2-(трет-бутоксикарбоніламіно)оцтову кислоту (0,89 г; 5,07 ммоль) та 0-(7азабензотриазол-1-іл)-N,N,N,N-тетраметилуронію гексафторофосфат (1,93 г; 5.07 ммоль) до розчину гідрохлориду діетил(1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату у безводному N,N-диметилформаміді (20 мл) при кімнатній температурі, після цього додають диізопропілетиламін (2 мл; 11,47 ммоль), та перемішують жовтий розчин, що утворився, у атмосфері азоту протягом 18 год. Випарюють розчинник, і залишок розділяють між етилацетатом (40 мл) та насиченим водним розчином бікарбонату натрію (40 мл). Перемішують суміш протягом 20 хв, ділять шари, та екстрагують водний шар надлишком етил ацетату (40 мл). Поєднують органічні шари, висушують над сульфатом натрію, і згущують до сухого стану. Залишок очищують за допомогою флешхроматографії, використовуючи як елюент суміш етилацетат:ізогексан (від 80:20 до 100:0), та одержують сполуку, вказану у заголовку, у вигляді безбарвної твердої речовини (2,42 г; 4,86 ммоль). Мас-спектр (MS): m/z 498 (M+1), 520 (М+23). Препаративна методика 11 (1R, 2S, 4R, 5R, 6R) -2- [[2- (трет-бутоксикарбоніламіно)ацетил] аміно] -4-(4H-1,2,4-триазол3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонова кислота 10 UA 107684 C2 5 10 15 20 25 30 До перемішуваного розчину діетил(1R, 2S, 4R, 5R, 6R)-2-[[2-(третбутоксикарбоніламіно)ацетил]аміно]-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбоксилату (1,4 г; 2,81 ммоль) у тетрагідрофурані (8 мл) при кімнатній температурі додають 2 Μ розчин гідроксиду натрію (4,5 мл; 9 ммоль). Перемішують двофазну суміш протягом 2 год., розводять реакційну суміш водою (50 мл), та промивають діетиловим ефіром (50 мл). Охолоджують водний шар до 0-5 °C, підкислюють до рН 2 за допомогою 2 Μ розчину хлористоводневої кислоти, та екстрагують етилацетатом (2×60 мл). Поєднують органічні шари, висушують сульфатом натрію, і згущують, одержуючи сполуку, вказану у заголовку, у вигляді 1 білої твердої речовини (0,75 г; 1,69 ммоль). ЯМР H (D2O): δ 1,18-1,27 (m, 1Н); 1,32 (s, 9H); 1,441,49 (m, 1H); 2,0-2,6 (m, 1H); 2,12-2,19 (m, 1H); 2,65-2,75 (m, 2H); 3,57-3,68 (m, 2H); 4,12-4,21 (m, 1H); 8,23 (s, 1H); крім того, певна кількість вказаної у заголовку сполуки (приблизно 1,12 ммоль) залишається у водному шарі. Мас-спектр (MS): m/z 442 (M+1), 464 (М+23). Препаративна методика 12 (1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбонової кислоти гідрохлорид До розчину ди-трет-бутил(1R, 2S, 4R, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-(4H-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату (1,97 г; 3,97 ммоль) у 1,4діоксані (10 мл) додають 4 Μ розчин хлороводню у 1,4-діоксані (10 мл, 40 ммоль). Нагрівають суміш до 50 °C, і перемішують при цій температурі протягом ночі (невдовзі після початку нагрівання з розчину починає випадати білий осад). До реакційної суміші додають етилацетат (50 мл) (при цьому утворюється мутний розчин білого кольору). Залишають суміш охолоджуватись до кімнатної температури, після чого відфільтровують осад, і висушують, одержуючи білу тверду речовину (1,97 г). Залишають твердий продукт сушитися протягом уїкенду при зниженому тиску при температурі 40 °C, одержуючи сполуку, вказану у заголовку, у вигляді білої твердої речовини, забрудненої невеликою кількістю 1,4-діоксану і слідами моно трет-бутилового складного ефіру вказаної в заголовку сполуки (1,936 г; вміст основної речовини 65 % мас; 3,95 ммоль). Мас-спектр (MS): m/z 285 (M+1). Препаративна методика 13 (1S, 2S, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-оксо-біцикло[3.1.0]гексан-2,6-дикарбонова кислота 11 UA 107684 C2 5 10 15 20 25 30 До перемішуваного розчину ди-трет-бутил(1S, 2S, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4оксо-біцикло[3.1.0]гексан-2,6-дикарбоксилату (2,0 г; 4,86 ммоль) у суміші тетрагідрофурану (24,3 мл) та етанолу (9,72 мл) додають 2,5 Μ розчин гідроксиду натрію (15,55 мл; 38,88 ммоль). Нагрівають реакційну суміш до 60 °C, і перемішують протягом ночі, підтримуючи цю температуру. Продовжують нагрівання ще протягом 4 год., після чого промивають етилацетатом. Водну фазу охолоджують у бані з льодом, і підкислюють до рН 2-3 за допомогою 1н розчину хлористоводневої кислоти. Екстрагують етилацетатом (тричі), висушують органічний шар сульфатом натрію, фільтрують, і згущують, одержуючи сполуку, вказану у заголовку, у вигляді помаранчевої твердої речовини (1,4 г; 96 %). Мас-спектр (MS): m/z 322 (М+23). Препаративна методика 14 Бic[(2-фτopoфeніл)мeτил]-(1S, 2S, 5R, 6R)-2-(трет-бутоксикарбоніламіно-4-оксобіцикло[3.1.0]гексан-2,6-дикарбоксилат До перемішуваної суспензії (1S, 2S, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-оксобіцикло[3.1.0]гексан-2,6-дикарбонової кислоти (0,17 г; 0,57 ммоль) та карбонату цезію (0,37 г; 1,14 ммоль) в безводному N,N-диметилформаміді (1,42 мл) краплями додають 2фторобензилбромід (0,21 мл; 1,7 ммоль). Перемішують цю суміш при кімнатній температурі протягом ночі у атмосфері азоту. Зупиняють перебіг реакції водою, і розводять суміш етилацетатом. Екстрагують водну фазу етилацетатом (тричі), і послідовно промивають органічний шар розсолом та водою. Висушують сульфатом натрію, фільтрують, і згущують, одержуючи неочищений продукт у вигляді світло-брунатного масла. Очищують за допомогою флеш-хроматографії, використовуючи як елюент суміш етилацетаттексан (від 20:80 до 30:70), та одержують сполуку, вказану у заголовку, у вигляді блідо-жовтого масла (229 мг; 79 %). Масспектр (MS): m/z 538 (М+23). Препаративна методика 15 Біс[(2-фторофеніл)метил] -(1S, 2S, 4S, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-гідроксибіцикло[3.1.0]гексан-2,6-дикарбоксилат До перемішуваного розчину біс[(2-фторофеніл)метил]-(1S, 2S, 5R, 6R)-2-(третбутоксикарбоніламіно)-4-оксо-біцикло[3.1.0]гексан-2,6-дикарбоксилату (2,33 г; 4,52 ммоль) у тетрагідрофурані (20,3 мл) при -78 °C краплями додають 1 Μ три(втор-бутил)борогідриду літію (L-selectride) у тетрагідрофурані (6,78 мл; 6,78 ммоль). Помаранчеву реакційну суміш перемішують у атмосфері азоту протягом 1 год. 45 хв. Зупиняють перебіг реакції, додаючи 12 UA 107684 C2 5 10 15 20 25 30 35 насичений розчин бікарбонату натрію при -78 °C. Розводять сумішшю води та етилацетату. Ділять шари, і послідовно промивають органічну фазу ропою та водою. Висушують сульфатом натрію, фільтрують, і згущують до сухого стану, одержуючи неочищений продукт у вигляді блідо-жовтого масла, забрудненого за даними мас-спектроскопії приблизно 6 % мінорного ізомера біс[(2-фторофеніл) метил]-(1S, 2S, 4R, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4гідрокси-біцикло[3.1.0]гексан-2,6-дикарбоксилату. Поєднують неочищений продукт із другою порцією, одержаною так само з біс[(2-фторофеніл)метил]- (1R, 2S, 5R, 6R)-2-(третбутоксикарбоніламіно)-4-оксо-біцикло[3.1.0]гексан-2,6-дикарбоксилату (0,23 г; 0,44 ммоль). Змішаний продукт очищують за допомогою флеш-хроматографії, використовуючи як елюент суміш етилацетат:гексан (від 20:80 до 50:50), одержуючи сполуку, вказану у заголовку, у вигляді чистого ізомера (2,49 г; 4,81 ммоль). Мас-спектр (MS): m/z 540 (M+23). Препаративна методика 16 Біс[(2-фторофеніл)метил] -(1S, 2S, 4S, 5R, 6R)-2-(трет-бутоксикарбоніламіно) -4-(nтолілсульфонілокси)біцикло[3.1.0]гексан-2,6-дикарбоксилат До розчину біс[(2-фторофеніл)метил]-(1S, 2S, 4S, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4гідрокси-біцикло[3.1.0]гексан-2,6-дикарбоксилату (2,5 г; 4,83 ммоль) у дихлорометані (19,32 мл) при кімнатній температурі додають n-толуолсульфохлорид (1,02 г; 5,31 ммоль). Охолоджують у водяній бані з льодом, після чого порціями додають триетиламін (0,74 мл; 5,31 ммоль) та N,Nдиметил-4-амінопіридин (1 г; 8,21 ммоль). Дозволяють нагрітися до кімнатної температури, та перемішують протягом ночі в атмосфері азоту. Зупиняють перебіг реакції водою, і розділяють шари. Органічні шари послідовно промивають 1 Μ розчином гідросульфату калію, ропою та водою. Висушують органічну фазу сульфатом натрію, фільтрують, згущують до сухого стану, і висушують у вакуумі, одержуючи блідо-жовту піну (2,72 г). Очищують за допомогою флешхроматографії, використовуючи як елюент суміш етилацетат:гексан (від 20:80 до 40:60); одержують сполуку, вказану у заголовку, у вигляді безбарвного масла (22,7 г; 4,02 ммоль). Масспектр (MS): m/z 672 (M+1). Препаративна методика 17 Біс[(2-фторофеніл)метил] -(1R, 2S, 4R, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-(4Η-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат До розчину біс[(2-фторофеніл)метил)- (1S, 2S, 4S, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4(n-толілсульфонілокси)біцикло[3.1.0]гексан-2,6-дикарбоксилату (2,63 г; 3,92 ммоль) у безводному N,N-диметилформаміді (15,66 мл) додають 4H-1,2,4-триазол-3-тіол (0,59 г; 5,87 ммоль) та карбонат калію (0,81 г; 5,87 ммоль). Суміш, що утворилася, прогрівають у загерметизованій пробірці в атмосфері азоту при температурі 70° С протягом ночі, не 13 UA 107684 C2 5 10 15 20 25 30 35 40 припиняючи перемішування. Зупиняють перебіг реакції водою, і розводять етилацетатом. Шар органічних продуктів послідовно промивають 10 %-ним водним розчином лимонної кислоти та розсолом. Висушують сульфатом натрію, фільтрують, і згущують, одержуючи неочищений продукт у вигляді світло-брунатного масла (2,3 г). Очищують за допомогою флешхроматографії, використовуючи як елюент суміш етилацетат:гексан (від 30:70 до 70:30); одержують сполуку, вказану у заголовку, у вигляді безбарвного масла (1,84 г; 3,06 ммоль). Масспектр (MS): m/z 601 (M+1), 623 (М+23). Приклад 1 (1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4H-1, 2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбонова кислота. Спосіб 1: До розчину] ди-трет-бутил(1R, 2S, 4R, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-(4H-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату (3,66 г; 7,37 ммоль) у 1,4діоксані, (17,69 мл) додають 4 Μ розчин хлороводню у 1,4-діоксані (18,42 мл; 7,37 ммоль), та перемішують розчин протягом уїк-енду при температурі 50 °C. Додають етилацетат, і охолоджують реакційну суміш на водяній бані з льодом. Відділяють білий осад декантацією, і декілька разів промивають етилацетатом. Висушують твердий продукт у вакуумі, та очищують за допомогою іонообмінної хроматографії. Приводять іонообмінну колонку (колонку SCX-2) до робочого стану за допомогою ацетонітрилу. Розчиняють речовину в мінімальній кількості води, і вносять у колонку. Послідовно елююють ацетонітрилом (2 об'єми колонки), сумішшю 2н розчин аміаку у метанолі:ацетонітрил (1:1) (2 об'єми колонки), розчином аміаку у метанолі та 7н розчином аміаку у метанолі. Згущують до сухого стану фракцію 2н розчину амонію в метанолі, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини (1,39 г). Висушують 1 твердий продукт впродовж 48 год. при 40 °C, одержуючи цільову сполуку (1,24 г; 66 %). ЯМР H (D2O): δ 1,41-1,55 (m, 2H); 2,02 (dd, J=3,1 Гц та 6,4 Гц, 1Н); 2,15-2,20 (m, 1Н); 2,40 (dd, J=8,1 Гц та 14,1 Гц, 1Н); 3,22 (s, 1H); 4,20-4,28 (m, 1H); 8,30 (s, 1H). Спосіб 2: Розчиняють ди-трет-бутил(1R, 2S, 4R, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4-(4Н-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат (433 мг; 0,87 ммоль) в 1,4діоксані (7 мл), і додають 4 Μ розчин хлороводню у 1,4-діоксані (7 мл; 2,8 ммоль). Струшують реакційну суміш протягом ночі при температурі 50 °C. Згущують до сухого стану. Очищують за + допомогою катіонного обміну (сильно кислий катіоніт Dowex Marathon С, у Na формі). Розчиняють залишок у мінімальній кількості води для переводу продукту в розчин, і одержаний розчин завантажують у колонку з катіонітом. Послідовно промивають колонку 2 об'ємами води, 2 об'ємами суміші вода:тетрагідрофуран (1:1) і знову 2 об'ємами води. Елююють цільовий продукт 10 %-вим розчином піридину у воді (2 об'єми колонки). Згущують до сухого стану, одержуючи сполуку, вказану у заголовку (202 мг; 82 % від теорії). Мас-спектр (MS): m/z 285 (M+1). Приклад 2 (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-амінопропаноїл]аміно]-4-(1H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлорид. 14 UA 107684 C2 5 10 15 20 25 30 35 40 Спосіб 1: У 5-літрову круглодонну колбу з трьома горловинами, споряджену механічною мішалкою, завантажують (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-(трет-бутоксикарбоніламіно)пропаноїл]аміно] -4(4Н-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту (186 г; 0,41 моль) у ацетоні (1,12 л). До отриманої густої суспензії краплями протягом 15 хв додають 37 % водний розчин хлористоводневої кислоти у воді (100 мл). Перемішують при 40 °C протягом 1 год. Охолоджують до кімнатної температури, і додають ацетон (3,72 л). Перемішують масу протягом 2 год. до завершення утворення білої смолоподібної речовини. Додають ще одну порцію ацетону (3 л); операцію повторюють, допоки не припиниться утворення білої смолоподібної речовини. Ацетон зливають, додають толуол, і згущують до стану масла. Знов розчиняють неочищений продукт у воді (400 мл), та виморожують розчин, одержуючи сполуку, вказану у заголовку, у вигляді білої твердої речовини (143 г; 89 % від теорії). Мас-спектр (MS): m/z 356 1 (M+1), 378 (М+23). ЯМР H (D2O): δ 1,37-1,43 (m, 4Н); 1,61 (t, J=3,2 Гц, 1Н); 2,31-2,34 (m, 1H); 2,44 (dd, J=2,9 Гц та 6,4 Гц, 1H); 2,77 (dd, J=8,1 Гц та 14,4 Гц, 1Н); 3,92 (q, J=7,1 Гц, 1H); 4,204,25 (m, 1H); 8,55 (s, 1H). Спосіб 2: Розчиняють (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-(трет-бутоксикарбоніламіно)пропаноїл]аміно]-4(4Н-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту (244 мг, 0,54 ммоль) у етилацетаті (24,5 мл), та барботують газоподібний хлороводень протягом 1-2 хв, при температурі 0 °C. Після 5-хвилинної витримки при 0 °C струшують суміш при кімнатній температурі протягом 90 хв. Видаляють розчинник у вакуумі, та знов розчиняють твердий продукт у воді. Виморожують розчин, одержуючи сполуку, вказану у заголовку (180 мг; 86 %), у вигляді білої твердої речовини. Мас-спектр (MS): m/z 356 (M+1), 378 (М+23). Приклад 3 (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилсульфанілбутаноїл]аміно]-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлорид. До розчину (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-(трет-бутоксикарбоніламіно)-4метилсульфанілбутаноїл]аміно]-4-(4Н-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6дикарбонової кислоти (2,66 г; 5,16 ммоль) у 1,4-діоксані (26,6 мл) при кімнатній температурі у водяній бані краплями додають 4 Μ розчин хлороводню у 1,4-діоксані (19,35 мл; 77,38 ммоль), і перемішують протягом ночі при кімнатній температурі. Додають метил-трет-бутиловий простий ефір, і перемішують впродовж 2 год. Відфільтровують твердий осад, і висушують у вакуумі протягом ночі. Знов розчиняють продукт у воді, і виморожують розчин протягом ночі. Розтирають продукт у ацетоні (10 об'ємів) при нагріванні зі зворотним холодильником, фільтрують, і висушують залишок у вакуумі в атмосфері азоту протягом 48 год., одержуючи сполуку, вказану у заголовку (2,33 г; 5,16 ммоль), у вигляді білої твердої речовини. Мас-спектр (MS): m/z 416 (M+1). Приклад 4 (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-аміно-4-метилпентаноїл]аміно]-4-(4H-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлорид. 15 UA 107684 C2 5 10 15 20 25 30 35 40 До розчину (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-(трет-бутоксикарбоніламіно)-4метилпентаноїл]аміно]-4-(4Н-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти (0,4 г; 0,8 ммоль) у 1,4-діоксані (4 мл) додають 4 Μ розчин хлороводню у 1,4-діоксані (3,01 мл; 12,06 ммоль). Одразу по додаванні реагенту випадає білий осад, який перемішують протягом ночі. Додають метил-трет-бутиловий простий ефір (16 мл), та відділяють білий осад декантацією, промиваючи кілька разів метил-трет-бутиловим простим ефіром; одержують 330 мг цільового продукту. Його поєднують із другою порцією продукту, одержаною так само з (1R, 2R, 4S, 5R, 6R)-4-[[(2S)-2-(трет-бутоксикарбоніламіно)-4-метилпентаноїл]аміно]-2-(4Н-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-4,6-дикарбонової кислоти (100 мг, 0,2 ммоль) та 4 Μ розчину хлороводню у 1,4-діоксані (0,75 мл; 3,01 ммоль); разом одержують 374 мг продукту. Половину продукту (190 мг) очищують, за допомогою картриджа OASIS® HLB, місткістю 1г. Елюент, що містить цільову сполуку, підкислюють до рН 2-3 хлористоводневою кислотою, та висушують у вакуумі протягом ночі при 45 °C, одержуючи 170 мг білої твердої речовини. Аналогічно очищують решту матеріалу, і змішують, одержуючи сполуку, вказану у заголовку (290 мг; 0,67 ммоль). Мас-спектр (MS): m/z 398 (M+1), 795 (2М+1). Приклад 5 (1R, 2S, 4R, 5R, 6R)-2-[(2-аміноацетил)аміно]-4-(4Н-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлорид До водного розчину ((1R, 2S, 4R, 5R, 6R)-2-[[2-(трет бутоксикарбоніламіно)ацетил]аміно]-4(4Н-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти (близько 1,12 ммоль) додають 5 Μ розчин хлористоводневої кислоти (10 мл; 50 ммоль), і перемішують при кімнатній температурі протягом 5 год. Згущують до сухого стану, і очищують залишок за допомогою хроматографії катіонного обміну (DOWEX® 50WX8-100). Розчиняють сполуку в воді, та доводять рН до 2. Дозволяють сполуці пройти крізь колонку з витратою елюенту приблизно 1 краплина на 1-2 секунди. Після того, як перший завантажений об'єм розчину спаде до поверхні катіоніту, промивають колонку водою (5-10 мл); операцію промивання повторюють тричі. Слідкують за рН елюату, і продовжують промивання водою доти, доки увесь продукт не буде введений у колонку (спостерігається циклічна зміна рН: спочатку елюат має рН 7, згодом рН спадає до рН 1, і насамкінець повертається до рН 7). Послідовно промивають колонку щонайменше одним об'ємом кожної з таких промивних рідин як вода, суміш вода:тетрагідрофуран (1:1) і знову вода. Змивають продукт з катіоніту 10 % водним розчином піридину. Елюювання 10 % водним розчином піридину продовжують до того моменту, коли методом TLC вже не визначатиметься цільова сполука. Згущують фракції, що містять продукт, до стану безбарвної твердої речовини (173 мг). Продукт розчиняють у воді (8 мл), додають 5 Μ розчин хлористоводневої кислоти (0,11 мл; 0,55 ммоль), і виморожують розчин впродовж 48 год., одержуючи сполуку, вказану у заголовку, у вигляді білої твердої речовини (195 мг; 0,52 ммоль). Мас-спектр (MS): m/z 342 (M+1). Приклад 6 16 UA 107684 C2 Дибензил (1R, 2S, 4R, 5R, ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилат 5 10 15 20 25 30 35 6R)-2-аміно-4-(4Н-1,2,4-триазол-3 До суміші бензилового спирту (18,18 мл; 175,68 ммоль) та (1R, 2S, 4R, 5R, 6R)-2-аміно-4(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонової кислоти гідрохлориду (1,61 г; 3,51 ммоль) при кімнатній температурі додають ацетилхлорид (2,5 мл; 35,14 ммоль). Мутну реакційну суміш, що утворилася, прогрівають при 60 °C у атмосфері азоту. Через 3 дні реакційну суміш охолоджують до кімнатної температури, обережно розводять ацетонітрилом (10 мл), та очищують на колонці SCX-2 (20 г сорбенту). Завантажують реакційну суміш у колонку, заздалегідь приведену у робочий стан ацетонітрилом, двічі промивають ацетонітрилом, та елюють 2 Μ розчином амоніаку у суміші метанол:ацетонітрил (1:1) (2 об'єми колонки); після цього випаровують розчинник у вакуумі, одержуючи білу смолоподібну речовину (576 мг), склад якої відповідає неочищеному цільовому продукту. Потім елююють 7 Μ розчином аміаку у метанолі (1 об'єм колонки), і випаровують розчинник у вакуумі, одержуючи білу тверду речовину, властивості якої відповідають (1R, 2S, 4R, 5R, 6R)-2-аміно-6-бензилоксикарбоніл-4(4H-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2-карбоновій кислоті (750 мг). Мас-спектр (MS): m/z 372 (М+1). Напівпродукт очищують за допомогою флеш-хроматографії, використовуючи як елюент суміш етилацетатщиклогексан (від 60:40 до 100:0); елюють двічі, одержуючи сполуку, вказану у заголовку, у вигляді білої твердої речовини (430 мг). Розчиняють в суміші дихлорометан:етилацетат:ацетонітрил, згущують до сухого стану, і висушують під високим вакуумом при кімнатній температурі протягом ночі (402 мг; 25 %). MS (m/z): 465 (М+1) Другу порцію сполуки, вказаної у заголовку, одержують так само шляхом додавання при кімнатній температурі ацетилхлориду (998 мкл; 14,02 ммоль) до суміші бензилового спирту (7,26 мл; 70,11 ммоль) та (1R, 2S, 4R, 5R, 6R)-2-аміно-6-бензилоксикарбоніл-4-(4H-1,2,4триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2-карбонової кислоти (0,75 г; 1,40 ммоль). Прогрівають реакційну суміш при 60 °C у атмосфері азоту. Через 3,5 дні до реакційної суміші обережно додають тіоніл хлорид (204,31 мкл; 2,8 ммоль), і продовжують прогрів протягом 24 год. Охолоджують реакційну суміш до кімнатної температури, і обережно розводять ацетонітрилом (10 мл). Очищують на колонці SCX-2 (20 г сорбенту), одержуючи білу тверду речовину (567 мг). Напівпродукт очищують за допомогою флеш-хроматографії, використовуючи як елюент суміш етилацетат:циклогексан (від 60:40 до 100:0). Ще раз очищують за допомогою флеш-хроматографії, використовуючи як елюент суміш етилацетат:циклогексан (від 60:40 до 80:20); після висушування одержують ще одну порцію сполуки, вказаної у заголовку (140 мг; 21 %). Мас-спектр (MS): m/z 465 (М+1). Приклад 7 Біс[(2-фторофеніл)метил](1R, 2S, 4R, 5R, 6R)-2-аміно-4-(4Н-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату гідрохлорид 17 UA 107684 C2 5 10 15 20 25 30 35 40 45 50 До розчину біс[(2-(фторфеніл)метил)-(1R, 2S, 4R, 5R, 6R)-2-(трет-бутоксикарбоніламіно)-4(4Н-1,2,4-триазол-3-ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбоксилату (0,48 г; 0,79 ммоль) у етилацетаті (7,91 мл) додають концентрований розчин хлороводню у етилацетаті (7,91 мл). Суміш, що утворилася, перемішують протягом ночі при кімнатній температурі. Видаляють з системи хлороводень, барботуючи азот крізь реакційну суміш. Згущують безбарвне масло, що залишилося, протягом ночі при 40 °C у вакуумній сушильній шафі. Знов розчиняють продукт у воді, ставлять у морозильну камеру на 48 год. та виморожують розчин, одержуючи сполуку, вказану у заголовку (379 мг; 89 %). Мас-спектр (MS): m/z 501 (M+1), 523 (М+23). Приклад 8 Біцикло[3.1.0]гексан-2,6-дикарбонова кислота, 2-[[(2S)-2-аміно-1-оксопропіл]аміно)-4-(4Н1,2,4-триазол-3-ілтіо)-, моноамонійна сіль, (1R, 2S, 4R, 5R, 6R)-, моногідрат До дистильованої або деіонізованої води (28,0 кг) при перемішуванні додають (1R, 2S, 4R, 5R, 6R)-2-[[(2S)-2-(трет-бутоксикарбоніламіно)пропаноїл]аміно]-4-(4Н-1,2,4-триазол-3ілсульфаніл)біцикло[3.1.0]гексан-2,6-дикарбонову кислоту (11,05 кг). При температурі нижче 50 °C додають до суміші соляну кислоту (5н; 8,5 кг). Нагрівають суміш при 50-55 °C протягом 1,5-2 год. Охолоджують суміш до 15-25 °C. Додаючи краплями водний розчин аміаку(25 %; 4,8 кг), доводять рН до 9, підтримуючи температуру 45-50 °C. Після цього додають етанол (34 кг), і охолоджують до 20-25 °C. У окрему посудину завантажують дистильовану або деіонізовану воду (6,5 кг), освітлений фільтрацією абсолютний етанол (45 кг), і вносять зародкові кристали біцикло[3.1.0]гексан-2,6-дикарбонової кислоти, 2-[[(2-5)-2-аміно-1-оксопропіл]аміно)-4-(4Н-1,2,4триазол-3-ілтіо)-, моноамонійної солі, (1R, 2S, 4R, 5R, 6R)-, моногідрату, які готували окремо (0,1 кг). Нагрівають цю суміш до 45-50 °C, потім краплями додають водний розчин амоніаку (освітлений фільтрацією). Прогрівають суміш протягом 2-3 год. при 50-55 °C, і краплями додають абсолютний етанол (72 кг), підтримуючи температуру 50-55 °C. Поступово, протягом 11,5 год., знижують температуру реакційної суміші до 40-45 °C у атмосфері азоту. Охолоджують суміш до 30-35 °C, та витримують при цій температурі протягом 1-1,5 год. Охолоджують суміш до 20-25 °C, та витримують при цій температурі впродовж 3-4 год., зберігаючи атмосферу азоту. Відділяють осад фільтруванням, і промивають шар осаду на фільтрі сумішшю дистильованої або деіонізованої води та етанолу (1:10). Висушують осад у вакуумі при 50-55 °C, одержуючи сполуку, вказану у заголовку, у вигляді білої твердої речовини (6,82 кг). Мас-спектр (MS): m/z 391(M+1) Рентгенограми кристалічного порошку (XRD) одержані на порошковому дифрактометрі Braker D4 Endeavor, оздобленому джерелом рентгенівського випромінення CuKα (= 1,54060 Å) і детектором Vantec, який живиться від джерела 35 кВ, 50 мА. Зразки сканували під кутом від 4° до 40° (2) із довжиною кроку у 0,009° (2). Сухий порошок щільно наносили на кварцовий утримувач зразку, а гладку поверхню одержували, накладаючи предметне скло. Рентгенограми кристалічної форми одержували при температурі та відносній вологості навколишнього середовища. У даному випадку коливання положення піка в межах ±0,2 (у одиницях 2) відповідають можливим варіаціям, і не призводять до невизначеності при ідентифікації вказаної кристалічної форми. На підтверждення тієї чи іншої кристалічної форми можна скористатись будь-якою унікальною комбінацією ясно розпізнаваних піків (у одиницях °2) - як правило, найбільш визначних піків. Для уточнення дифракційної картини кристалічного порошку за даними, одержаними при температурі та відносній вологості навколишнього середовища, застосовували добірку з 675 стандартних піків NIST під кутами 8,85 та 26,77° 2. Таким чином, кристалічна форма зразку сполуки характеризується наявністю рентгенограми від випромінення джерела CuKα із дифракційними піками (значення 2) відповідно до таблиці 1 (див. нижче) — зокрема, наявністю піків при 18,61 у поєднанні з одним або більшою кількістю піків вибраних з групи, яка складається з піків 21.07, 15.34, 14.74, and 19.20; при цьому припустима розбіжність для кутів дифракції становить 0,2 градуси. 18 UA 107684 C2 Таблиця 1: Дифракційні піки у рентгенограмі кристалічного порошку з Прикладу 8. 5 10 15 20 25 30 35 Рецептори mGlu належать до рецепторів, спряжених з G-білком, які модулюють збуджуваність нейронів. Зокрема, встановлено зв'язок між зміненою глютаматною нейротрансмісією і захворюванням на шизофренію; між тим, дія всіх застосовуваних на сьогодні лікарських засобів-антипсихотиків спрямована на рецептори допаміну. Відомі численні дослідження, які підтримують активацію рецептора mGlu групи II (яка включає в себе mGlu2 та/або mGlu3) з метою лікування шизофренії. Зокрема, останні дані вказують на те, що агоніст рецептора mGlu2/3 має властивості антипсихотика і може надати нову альтернативу при лікуванні шизофренії (див. Patil et al., Nature Medicine (2007) 13(3), 1102-1107). Дослідження засвідчили, що антипсихотична активність агоністів mGlu2/3 опосередкована mGlu2. Дослідження також засвідчили, що агоністам mGlu2/3 притаманні властивості анксіолітиків, антидепресантів та нейропротекторів. Таким чином, агоністи mGlu2 можуть стати в нагоді при лікуванні психічних захворювань, таких як біполярний розлад, шизофренії, депресії та генералізованого тривожного розладу. Оскільки сполуки-об'єкти цього винаходу є агоністами рецептора mGlu2, вони можуть знайти застосування у лікуванні вищезгаданих захворювань. Дослідження за методикою FLIPR агоніста людського mGlu2 Для цих досліджень використовували лінії клітин AV-12, що походять від фібробластів сирійського хом'ячка і виявляють стійку експресію людського mGlu2 людини; їх піддано котрансфекції з транспортером глютамату щура ЕААТ 1 (Excitatory Amino Acid Transporter 1 транспортер збуджувальної амінокислоти) і субодиниці Gα15. Експресія Gα15 дає змогу рецепторам, спряженим із Gi, надсилати сигнали провідним шляхом, який пролягає крізь фосфоліпазу С, внаслідок чого з'являється можливість кількісної оцінки активації рецептора за допомогою флуоресцентного тесту з визначення сигналу кальцію. Для підтримки лінії клітин її культивували у живильному середовищі Ігла, модифікованому за Дюльбекко (Dulbecco's Modified Eagle's Medium, DMEM), із високим вмістом глюкози та піридоксину гідрохлориду, з додаванням 5 % діалізованої плідної бичачої сироватки, 1мМ пірувату натрію, 10мМ HEPES (4(2-гидроксиетил)-1-піперазинетансульфонової кислоти), 1мМ L-глутаміну, та 5мкг/мл бластицидину (всі компоненти живильного середовища було замовлено в компанії Invitrogen). Культури для додавання пересівали раз на два тижні, застосовуючи розчин для дисоціації, що не містить ферментів (Chemicon S-004-B). Клітини вирощували протягом 24 год., перш ніж виконувати тест, після чого дозували за допомогою дозатора клітин Matrix Well-Mate у 96лункові мікропланшети із затемненими стінками, вкриті шаром полі-О-лізину (постачальник - BD 19 UA 107684 C2 5 10 15 20 25 30 35 40 45 50 55 60 BioCoat, №354640), у середовище, яке містило самий лише свіжо приготований L-глутамін (250 мкМ у випадку mGlu2 або 125 мкМ у випадку mGlu3), у кількості 85 000 клітин (mGlu2) або 115 000 клітин (mGlu3) на лунку. Рівень внутрішньоклітинного кальцію визначали до та після додавання сполук за допомогою пристрою Fluorometric Imaging Plate Reader (FLIPR; постачальник - Molecular Devices). Буферний розчин для виконання тесту складався зі збалансованого буферно-сольового розчину Хенка (Hank's Buffered Salt Solution, HBSS; постачальник - Sigma) із доданням 20 мМ HEPES. Живильне середовище видаляли, і піддавали клітини інкубації при 25 °C протягом 90 хв разом із 8 мкМ розчином барвника Fluo-ЗАМ (постачальник - Molecular Probes, F-1241; 50 мкл на лунку). Розчин барвника зливали, і натомість додавали свіжий тестовий буферний розчин (50 мкл на лунку). Перед кожним експериментом для підтвердження характерної залежності ЕС50 проводили контрольний однопорційний тест FLIPR, який надає 11 точок кривої залежності дозаефект (використовували розведення 3х, починаючи з концентрації 10 мкМ) для глютамату агоніста (Fisher A125-100). Результати піддавали аналізу за допомогою програмного пакету Prism v4.03 (розробник GraphPad Software). Сполуки за цим винаходом випробовували шляхом виконання однопорційного тесту FLIPR із використанням концентраційної кривої типу "доза-ефект" з 10 точок (використовували розведення 3х, при кінцевій концентрації 25 мкМ). Сполуки за цим винаходом переводили у розчин із одержанням 10мМ "концентратів" у 0,1 Μ розчині NaOH, і зберігали при температурі -20 °C. Ці концентрати розводили втричі серіями тестовим буферним розчином. Після зняття початкових показів сигналу флуоресценції впродовж 5 секунд за допомогою флуориметричного пристрою FLIPR, на мікро планшет із клітинами додавали сполуку за цим винаходом (50 мкл на лунку). Збір даних з метою визначення агоністичної активності проводили раз на секунду впродовж перших 30 секунд, а надалі раз на 3 секунди аж до спливання повного проміжку часу у 90 секунд. За максимальну реакцію вважали таку, що відповідає показнику ЕСmax (100 мкМ глютамату). Вплив сполуки визначали як різницю між максимальною та мінімальною висотами піків сигналу флуоресценції у відносних одиницях (ВОФ) із поправкою на фонову флуоресценцію за відсутності глютамату. Визначення проводили із застосуванням одного планшету. Вплив агоністів визначали як відсоток стимуляції, індукованої власне речовиною, відносно до максимального сигналу глютамату. Всі дані переводили у числову форму відносних показників ЕС 50, застосовуючи для цього програму підгонки чотирипараметрової логістичної кривої (ActivityBase v5.3.1.22). Сполуку з Прикладу 1 кількісно досліджували у тесті hmGlu2 FLIPR відповідно до наведеного вище опису; одержано ЕС 50=23,0±3,9 нмоль/л (n=5, наведено стандартну похибку середнього). Цей результат свідчить, що сполука з Прикладу 1, яка водночас є активною сполукою у прикладах 2-8, має властивості агоніста mGlu2. Для сполуки, описаної у WO97/17952, а саме 1SR, 2RS, 4SR, 5SR, 6SR)-2-аміно-4-(фенілтіо)-біцикло[3.1.0]гексан-2,6дикарбонової кислоти, в умовах тесту hmGlu2 FLIPR, виконаного за тією ж схемою, одержано ЕС50 >25 000 нМ. Обернення гіперлокомоторної активності у щурів, індуковане фенциклідином (РСР) Введення до організму людини антагоністів рецептора NMDA (кетаміну або фенциклідину (РСР)) супроводжується ефектами на зразок психотоміметичних, симптоми яких подібні до симптомів, які спостерігаються у хворих на шизофренію. Здатність певних сполук спричиняти обернення стимуляторної дії антагоністів NMDA на моторику нерідко використовують на тваринах як модель психозу; яка демонструє добру прогнозну валідність як засіб визначення клінічної ефективності лікарських засобів для лікування шизофренії та біполярного розладу. З метою здійснення поточного контролю моторики щурів-самців лінії Sprague-Dawley (постачальник - Harlan, Indianapolis, IN, USA) садовили поодинці у прозорі пластмасові клітки типу комірчин розміром 45×25×20 см із долівкою, вкритою шаром деревинної стружки завтовшки 1 см, і стелею з металевої решітки. Монітори для спостереження моторики (постачальник Kinder Scientific) складалися з рами прямокутної форми зі змонтованими на ній 12 фотосенсорами за схемою 8×4 (або ущільненої групи з 22 сенсорів за схемою 15×7) на висоті 5 см, а також другої рами (для підрахунку здіймань на задні лапи) на висоті 15 см. Клітку типу комірчини було розміщено всередині цих рам, при цьому самі рами встановлені на столі висотою 3 фути (0,91 м) у ізольованому приміщенні. Сполуку за цим винаходом вводили (внутрішньоочеревинним шляхом (в/ч), не попередник лікарського засобу) дозою 0,3-10 мг/кг, за 30 хв до введення стимулюючої дози (5 мг/кг) фенциклідину (РСР). Одну зі сполук за цим винаходом вводили (пероральним шляхом (п/о), попередник лікарського засобу) дозою 0,3-10 мг/кг щурам, яких тримали натщесерце протягом ночі, за 4 год. до введення стимулюючої дози (5 мг/кг) РСР. У день проведення тесту щурів садовили у дослідну клітку і давали їм 20 UA 107684 C2 5 10 15 20 25 30 35 40 45 50 55 60 адаптуватись протягом 30 хв, перш ніж застосовувати до них стимуляцію РСР; спостереження за щурами здійснювали ще впродовж 60 хв після введення РСР. Аналіз даних і обчислення ED50 здійснювали за допомогою програмного пакету GraphPad Prism (San Diego, CA, USA). Аналізом статистичної потужності з'ясовано, що для статистично значущого визначення різниці ефектів при лікуванні потрібні групи щурів з 8-10 особин (потужність=0,8). Дані, зібрані протягом всього 60-хвилинного відрізку проміжку часу спостереження моторики, піддавали однофакторному дисперсійному аналізу з апостеріорною оцінкою за множинно-порівняльним критерієм Даннетта. Задля Для обчислення ED5o застосовували апроксимацію кривою за допомогою нелінійної регресії до даних, трансформованих відповідно до відсотку обернення активності для кожної дози. Сполуку з Прикладу 1 кількісно досліджували у цьому тесті за наведеною вище схемою; одержано ED50=1,23 мг/кг (в/ч). Сполуки з Прикладу 2 та Прикладу 3 кількісно досліджували у цьому тесті за наведеною вище схемою; одержані відповідно ED50=2,94 мг/кг (п/о) та ED50=5,46 мг/кг (п/о). Ці результати свідчать, що сполуки, які розглядаються в межах цього винаходу, є корисними лікарськими засобами при лікуванні шизофренії та біполярного розладу. Обернення гіперлокомоторної активності ν мишей, індуковане фенциклідином (РСР) Цей тест на обернення гіперлокомоторної активності у мишей, індуковане фенциклідином (РСР), виконували так само, як і описаний вище тест на обернення гіперлокомоторної активності у щурів, індуковане фенциклідином (РСР), із використанням мишей замість щурів, і зі змінами, які викладено нижче. З метою здійснення поточного контролю моторики мишей-самців лінії ICR (CD-I) (постачальник - Harlan, Indianapolis, IN, USA) садовили поодинці у прозорі пластмасові клітки типу комірчин розміром 45×25×20 см, із долівкою, вкритою шаром деревинної стружки завтовшки 0,5 см, закриті пластиковою кришкою. Монітори для спостереження моторики (постачальник - Kinder Scientific) складалися з рами прямокутної форми зі змонтованими на ній 12 фотосенсорами за схемою 8×4 (або ущільненої групи з 22 сенсорів за схемою 15×7) на висоті 2,5 см. Клітки типу комірчини були розміщені всередині цих рам, при цьому самі рами були встановлені на столі висотою 3 фути (0,91 м) у ізольованому приміщенні. Сполуку за цим винаходом вводили (внутрішньоочеревинним шляхом (в/ч), не проліки) переважно дозою 0,3-30 мг/кг (хоча можливе застосування і вищих доз), за 30 хв до введення стимулюючої дози (7,5 мг/кг) фенциклідину (РСР). У день проведення тесту мишей садовили у дослідну клітку, і давали їм адаптуватись протягом 45 хв, перш ніж застосовувати до них стимуляцію РСР; спостереження за мишами здійснювали ще впродовж 60 хв після введення РСР. Аналізом статистичної потужності з'ясовано, що для статистично значущого визначення різниці впливу при лікуванні потрібні групи мишей з 7-8 тварин (потужність = 0,8). У експерименті з застосуванням одноразової дози у 10 мг/кг сполуку з Прикладу 1 кількісно досліджували у цьому тесті по суті так, як описано вище; одержаний відсоток пригнічення спричиненої введенням РСР здатності до руху становив 78±9 % (в/ч). У експерименті з застосуванням багаторазової дози у 10 мг/кг сполуку з Прикладу 1 кількісно досліджували по суті так, як описано вище; одержаний відсоток пригнічення спричиненою введенням РСР здатності до руху становить 81+5 % (в/ч). Ці результати свідчать, що сполуки, які розглядаються в межах цього винаходу, є корисними медичними засобами при лікуванні шизофренії та біполярного розладу. 1SR, 2RS, 4SR, 5SR, 6SR-2-аміно-4-(фенілтіо)-біцикло[3.1.0]гексан-2,6дикарбонову кислоту досліджували у цьому тесті за наведеною вище схемою; одержаний відсоток пригнічення спричиненої введенням РСР здатності до руху становив 18±11 % (в/ч) (у експерименті з застосуванням одноразової дози у 10 мг/кг), відсоток пригнічення спричиненої введенням РСР здатності до руху становив 5±10 % (в/ч) (у експерименті з застосуванням багаторазової дози у 10 мг/кг), а також відсоток пригнічення спричиненої введенням РСР здатності до руху становив 19+8 % (в/ч) (у експерименті з застосуванням багаторазової дози у 100 мг/кг). Послаблення стрес-індукованої гіпертермії у щурів Гіпертермія, тобто підвищення внутрішньої температури тіла у відповідь на стрес, є загальним явищем, існування якого було надійно доведено у багатьох видів ссавців, в тому числі у людини. У багатьох випадках психічних розладів із підвищенням тривожності гіпертермія виникає як одна з ознак патологічного стану, і вважається симптомом захворювання. За припущенням, сполуки, які послаблюють стрес-індуковану гіпертермію у тварин, можуть стати в нагоді при лікуванні психічних розладів із підвищенням тривожності у людини. Одним із прикладів таких розладів, які можна лікувати за допомогою цих сполук, є генералізований тривожний розлад. Традиційний метод дослідження стрес-індукованої гіпертермії із мінімальним втручанням полягає у вимірюванні за допомогою ректального термометра температури тіла, і її 21 UA 107684 C2 5 10 15 20 25 30 35 40 45 50 55 60 збільшення під впливом стресу. Тест виконували на самцях щурів лінії Fischer F-344 (постачальник - Harlan, Indianapolis, IN, USA) вагою 275-350 г. Всіх тварин тримали поодинці з вільним доступом до їжі і з автоматизованим подаванням води досхочу, витримуючи 12годинний цикл чергування світла і темряви (світло вмикали вранці о 06:00). Перед проведенням експерименту, який проводили під час світлого періоду доби, тварин тримали без їжі приблизно 12-18 год. За дві години до початку експерименту щурам вводили дозу засобу (1 мл/кг) або внутрішньоочеревинним (в/ч, не попередник лікарського засобу), або пероральним шляхом (п/о, попередник лікарського засобу). Доза сполук за цим винаходом становила 0,3 мг/кг, 1 мг/кг, 3 мг/кг та 10 мг/кг (в/ч) та 4,13 мг/кг, 13,78 мг/кг та 41,35 мг/кг (п/о). Зазначені пероральні дози відповідають дозам активної речовини попередника лікарського засобу відповідно у 3 мг/кг, 10 мг/кг та 30 мг/кг. Як носій застосовували фізіологічний розчин із доданням достатньої кількості NaOH для одержання рН 5-7. Для порівняння використовували відомий антагоніст mGluR5 сполуку МТЕР (3-[(2-метил-1,3-тіазол-4-іл)етиніл]піридин), для якої з доклінічних моделей було надійно встановлено активність на зразок анксіолітиків (5 мг/кг, в/ч шлях надходження, у вигляді водного розчину). Негайно після введення дози щурів повертали до рідної клітки, при цьому дослідник вимикав світло, і залишав кімнату. Кімнату для дозування засобу залишали затемненою протягом усього проміжку часу (1 год.) до початку лікування. По завершенні підготовчого проміжку часу щурів поодинці переводили до ясно освітленої кімнати, де вимірювали контрольну (відлікову) температуру тіла шляхом введення ректального зонда, змащеного мінеральним маслом. Для одержання температури тіла застосовували мікрозондувальний термометр PHYSITEMP ВАТ-12® Microprobe Thermometer у поєднанні з ректальним мікрозондом для щурів PHYSITEMP RET-2® (постачальник - Physitemp Instruments Inc., Clifton, NJ, USA). Зонд встромляли у пряму кишку приблизно на 2 см, щоб виміряти температуру центральної частини тіла (яка є не що інше, як контрольна температура тіла (Т1) у градусах Цельсія). Через десять хвилин здійснювали друге вимірювання температури центральної частини тіла (Т2). Різницю між двома відліками температури центральної частини тіла (Т2 - Т1) вважали за стрес-індуковану гіпертермічну реакцію. Дозу сполуки за цим винаходом, що забезпечує 35 % зменшення стрес-індукованої гіпертермічної реакції, порівняно з реакцією при введенні самого лише носія, позначено як дозу Т 35. Сполука з Прикладу 1, яку кількісно досліджували у цьому тесті по суті так, як описано вище, має Т35=1,27 мг/кг (в/ч). Сполука з Прикладу 2, яку кількісно досліджували у цьому тесті по суті = так, як описано вище, має Т35 16,2 мг/кг (п/о). Ці результати свідчать, що сполуки, які розглядаються в межах цього винаходу, є корисними лікарськими засобами при лікуванні психічних розладів із підвищенням тривожності. Зокрема, сполуки, які розглядаються в межах цього винаходу, можуть стати в нагоді як засоби лікування генералізованого тривожного розладу. Тест примусового плавання на гризунах Тест примусового плавання на гризунах добре описаний і виявляє добру прогнозну валідність при визначенні антидепресивної та подібної до неї активності наразі застосовуваних лікарських засобів для лікування тяжкого депресивного розладу. У цьому дослідженні механізми, які імовірно пов'язані із антидепресивною та подібною до неї активністю, зменшують нерухливість у короткому епізоді невідворотного примусового плавання. Тест примусового плавання виконували як на мишах (самцях лінії NIH-Swiss, вагою 20-25 г, постачальник - Harlan Sprague-Dawley, Indianapolis, IN, USA), так само й на щурах (самцях лінії Sprague-Dawley, вагою 250-350 г, постачальник - Harlan Sprague-Dawley, Indianapolis, IN, USA). Мишей садовили по прозорих пластмасових циліндричних посудинах (діаметром 10 см, висотою 25 см), наповнених до висоти 6 см водою температури 22-25 °C, і утримували в них 6 хв. Впродовж останніх 4 хв з 6 хв, відведених на тест, визначали тривалість періоду нерухомості. Зі щурами вчиняли так само, із тією різницею, що застосовували прозорі пластмасові циліндричні посудини більшого розміру (діаметром 18 см, висотою 40 см), наповнені до висоти 16 см водою температури 22-25 °C, а тест тривав 15 хв. Крім того, мишей змушували плавати один раз, натомість щурів змушували плавати двічі по 5 хв із перервою у 24 год. (дані реєстрували лише на 2 день). Сполуку з Прикладу 1 випробовували на мишах, вводячи її внутрішньоочеревинним шляхом (дозою 1 мг/кг, 3 мг/кг або 10 мг/кг) за 60 хв до початку тесту. Сполуку з Прикладу 2 випробовували на щурах після введення її пероральним шляхом (1,4мг/кг, 4,1 мг/кг або 13,8 мг/кг, що є еквівалентом відповідно 1 мг/кг, 3 мг/кг та 10 мг/кг активної сполуки). Сполуку з Прикладу 2 вводять, зачекавши 5 хв після першого сеансу примусового плавання, і за 120 хв. до початку сеансу на 2-й день. Як позитивний контроль у цих дослідженнях застосовували іміпрамін (імізин). Сполуки з Прикладу 1 та Прикладу 2 готували у вигляді розчину на основі водного носія з мінімальними домішками NaOH. Сполуки утворюють 22 UA 107684 C2 5 10 15 20 25 30 35 40 45 50 55 ясний розчин. Тривалість періоду нерухомості (визначають як рухи, що є лише необхідними для утримання голови певної особини над водою) є мірою, що залежить від низки факторів; і до її реєстрації залучали спостерігача, не обізнаного стосовно того, чи зазнавала певна особина лікування, і якого саме. При аналізі даних застосовували апостеріорне оцінювання за критерієм Даннетта із параметром «альфа»=0,05. Варіант примусового плавання за участю мишей належить до найуживаніших тестів. Для оцінювання сили дії досліджуваних сполук обчислюють величину ED60 (дози, що відповідає 60 % нерухомості порівняно з контрольною групою, де використовували самий лише носій). За цих умов експерименту реакція щурів не є такою ж статистично надійною, як реакція мишей; для оцінювання реакції на лікування використовують критерії статистичної значущості і максимальної ефективності відносно позитивного контролю, тобто іміпраміну. Сполука з Прикладу 1, яку кількісно досліджували у цьому тесті по суті так, як наведено вище, чинила помітну подібну до антидепресанту дію у тесті на мишах (F4,39=9,9; p
ДивитисяДодаткова інформація
Автори англійськоюMonn, James Allen, Prieto, Lourdes, Taboada Martinez, Lorena, Montero Salgado, Carlos, Shaw, Bruce William
Автори російськоюМонн Джеймс Аллен, Прьето Лоурдес, Табоада Мартинес Лорена, Монтеро Сальгадо Карлос, Шоу Брюс Уильям
МПК / Мітки
МПК: C07D 249/10, A61P 25/00, A61K 31/4196
Мітки: mglu2, рецептора, агоністи
Код посилання
<a href="https://ua.patents.su/30-107684-agonisti-receptora-mglu2.html" target="_blank" rel="follow" title="База патентів України">Агоністи рецептора mglu2</a>
Попередній патент: В’яжучі для будівельних матеріалів
Наступний патент: Друкарський станок глибокого друку та рухома каретка для такого станка
Випадковий патент: Спосіб прогнозування зрощення перелому












