Агоністи рецептора меланокортину
Номер патенту: 99555
Опубліковано: 27.08.2012
Автори: Чой Сунг Піл, Шім Донг Сап, Лі Хьюн Хо, Лі Хьюн Мін, Лі Коо, Моон Санг Піл, Чанг Соо Йонг, Ахн Ін Ае, Лі Санг Дае
Формула / Реферат
1.Сполука наступної формули 1
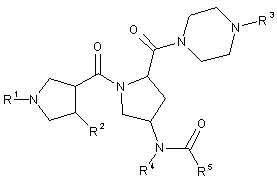 ,
,
де:
R1 являє собою водень або С1-С10-алкіл, С3-С7-циклоалкіл, С6-С10-арил, гетероцикл або гетероарил, кожний з яких є незаміщеним або заміщеним щонайменше одним замісником, вибраним з групи, що містить галоген, аміно, С1-С4алкіл, трифторметил, гідрокси, С1-С4-алкокси, ціано і оксо;
R2 являє собою феніл або шестичленний гетероарил, кожний з яких є незаміщеним або моно- або дизаміщеним замісниками, вибраними з групи, що містить галоген, гідрокси, С1-С4-алкіл, С1-С4-алкокси, ціано і аміно;
R3 являє собою водень або С1-С6-алкіл, або С3-С7-циклоалкіл, кожний з яких є незаміщеним або заміщеним замісниками, вибраними з групи, що містить галоген, метил, трифторметил, гідрокси і аміно;
R4 являє собою С4-С7-циклоалкіл або моноциклічний гетероцикл, кожний з яких є незаміщеним або моно- або полізаміщеним замісниками, вибраними з групи, що містить галоген, гідрокси, С1-С4-алкіл, трифторметил, С1-С4-алкокси і оксо; або являє собою феніл або шестичленний гетероарил, кожний з яких є незаміщеним або моно- або дизаміщеним замісниками, вибраними з групи, що містить галоген, гідрокси, С1-С4-алкіл, трифторметил, С1-С4-алкокси і аміно; і
R5 являє собою С1-С6-алкіл, дифторметил, трифторметил, С3-С8-циклоалкіл, аміно, С1-С4-алкіламіно, ді(С1-С4-алкіл)аміно, феніл, моноциклічний гетероарил або моноциклічний гетероцикл, де алкіл є незаміщеним або заміщеним щонайменше одним замісником, вибраним з групи, що містить фторо, гідрокси, меркапто, С1-С4-алкокси, ацетокси, аміно, ацетиламіно, ціано, карбамоїл, диметил карбамоїл і оксо, а феніл або гетероарил є незаміщеним або моно- або дизаміщеним замісниками, вибраними з групи, що містить галоген, гідрокси, метил, трифторметил, метокси і аміно, або її фармацевтично прийнятна сіль або ізомер.
2. Сполука формули 1 за п. 1, де R1 являє собою водень, метил, етил, трифторетил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, циклопропіл, циклобутил, циклопентил або циклогексил; або являє собою феніл, оксазолініл, імідазолініл, тіазолініл, тетрагідрофураніл, тетрагідротіопіраніл, імідазоліл, оксазоліл, тіазоліл, піразоліл, триазоліл, піридиніл, піримідиніл, піперидиніл або піридазиніл, кожний з яких є незаміщеним або заміщеним замісниками, вибраними з групи, що містить галоген, метил, ціано, оксо і гідрокси, або її фармацевтично прийнятна сіль або ізомер.
3. Сполука формули 1 за п. 2, де R1 являє собою ізопропіл, трет-бутил або циклопропіл; або являє собою феніл, тетрагідропіраніл, тіазоліл, піридиніл, піримідиніл або піридазиніл, кожний з яких є незаміщеним або заміщеним замісниками, вибраними з групи, що містить галоген, метил, ціано і гідрокси, або її фармацевтично прийнятна сіль або ізомер.
4. Сполука формули 1 за п. 1, де R2 являє собою феніл, що є незаміщеним або моно-або дизаміщеним замісниками, вибраними з групи, що містить фтор, хлор, бром, метокси і метил, або її фармацевтично прийнятна сіль або ізомер.
5. Сполука формули 1 за п. 4, де R2 являє собою 4-хлорфеніл або 2,4-дифторфеніл, або її фармацевтично прийнятна сіль або ізомер.
6. Сполука формули 1 за п. 1, де R3 являє собою водень, метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, циклопропіл, циклобутил або циклопентил, або її фармацевтично прийнятна сіль або ізомер.
7. Сполука формули 1 за п. 6, де R3 являє собою водень, метил, етил або ізопропіл, або її фармацевтично прийнятна сіль або ізомер.
8. Сполука формули 1 за п. 1, де R4 являє собою циклопентил, циклогексил, циклогептил, 4-метилциклогексил, 4,4-диметилциклогексил, 4-фторциклогексил, 4,4-дифторциклогексил або 4-трифторметилциклогексил; або являє собою феніл, що є незаміщеним або моно- або дизаміщеним замісниками, вибраними з групи, що містить фтор, хлор, метил і метокси, або її фармацевтично прийнятна сіль або ізомер.
9. Сполука формули 1 за п. 8, де R4 являє собою циклогексил, 4-метилциклогексил, 4,4-диметилциклогексил, 4,4-дифторциклогексил або 2,4-дифторфеніл, або її фармацевтично прийнятна сіль або ізомер.
10. Сполука формули 1 за п. 1, де R5 являє собою метил, трифторметил, гідроксиметил, метоксиметил, етоксиметил, пропіл, ізопропіл, ізобутил, трет-бутил, -СН2СН2ОН, -СН(СН3)СН2ОН, -С(СН3)2СН2ОН, -С(СН3)(СН2ОН)2, -С(СН3)2СН2ОМе, -C(CH3)2CH2OEt, феніл, оксазолініл, імідазолініл, тіазолініл, тетрагідропіраніл, імідазоліл, оксазоліл, тіазоліл, піразоліл, фураніл, тетрагідрофураніл, дигідрофураніл, тетрагідропіраніл, піридиніл або піперидиніл, або її фармацевтично прийнятна сіль або ізомер.
11. Сполука формули 1 за п. 10, де R5 являє собою ізопропіл, трет-бутил, -С(СН3)2СН2ОН, фураніл або тетрагідрофураніл, або її фармацевтично прийнятна сіль або ізомер.
12. Сполука формули 1 за п. 1, де:
R1 являє собою ізопропіл, трет-бутил або циклопропіл; або являє собою феніл, тетрагідропіраніл, тіазоліл, піридиніл, піримідиніл або піридазиніл, кожний з яких є незаміщеним або заміщеним замісниками, вибраними з групи, що містить галоген, метил, ціано і гідрокси,
R2 являє собою 4-хлорфеніл або 2,4-дифторфеніл,
R3 являє собою водень, метил, етил або ізопропіл,
R4 являє собою циклогексил, 4-метилциклогексил, 4,4-диметилциклогексил, 4,4-дифторциклогексил або 2,4-дифторфеніл, і
R5 являє собою ізопропіл, трет-бyтил, -C(CH3)2CH2OH, фураніл або тетрагідрофураніл, або її фармацевтично прийнятна сіль або ізомер.
13. Сполука формули 1 за п. 12, яку вибирають з групи, що містить:
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід;
N-[(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-(піперазин-1-ілкарбоніл)піролідин-3-іл]-N-(4,4-диметилциклогексил)ацетамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-3-гідрокси-2,2-диметилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-етилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-етилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2-диметилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2-диметилпропанамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-етилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-3-гідрокси-2,2-диметилпропанамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-2,2-диметил-N-(цис-4-метилциклогексил)пропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-2,2-диметил-N-(цис-4-метилциклогексил)пропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-3-гідрокси-2,2-диметил-N-(цис-4-метилциклогексил)пропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-3-гідрокси-2,2-диметил-N-(цис-4-метилциклогексил)пропанамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-етилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)-3-фурамід;
(2R)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)-2,2-диметилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)ацетамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-етилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)ацетамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)ацетамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)-2,2-диметилпропанамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5R)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5R)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-2,2-диметил-N-(цис-4-метилциклогексил)пропанамід;
(2S)-N-{(3S,5R)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5R)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5R)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-3-гідрокси-2,2-диметил-N-(цис-4-метилциклогексил)пропанамід;
N-{(3S,5R)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)ацетамід;
N-{(3S,5R)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)ацетамід;
N-{(3S,5R)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)ацетамід;
(2R)-N-{(3S,5R)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(тетрагідро-2Н-піран-4-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(6-метилпіридазин-3-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-(6-хлорпіридазин-3-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1,6-дигідропіридазин-3-ілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-фенілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-(тетрагідро-2Н-піран-4-іл)піролідин-3-іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-(тетрагідро-2Н-тіопіран-4-іл)піролідин-3-іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(тетрагідро-2Н-піран-4-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-3-гідрокси-2,2-диметилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(тетрагідро-2Н-піран-4-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)-2,2-диметилпропанамід;
(2S)-N-(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(тетрагідро-2H-піран-4-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5R)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-(тетрагідро-2Н-піран-4-іл)піролідин-3-іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-(тетрагідро-2H-піран-4-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-2,2-диметил-N-(цис-4-метилциклогексил)пропанамід;
N-{(3S,5R)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(тетрагідро-2H-піран-4-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4-метилциклогексил)ацетамід;
(2S)-N-{(3S,5R)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5R)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-3-гідрокси-2,2-диметилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)-3-гідрокси-2,2-диметилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-циклопропіл-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)-3-гідрокси-2,2-диметилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)-3-гідрокси-2,2-диметилпропанамід;
N-{(3S,5R)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-ізопропілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)ацетамід;
N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(6-метилпіридазин-3-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2-диметилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-піридин-2-ілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2-диметилпропанамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-піридин-2-ілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1,6-дигідропіридазин-3-ілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-піримідин-2-ілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2-диметилпропанамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-піридин-2-ілпіролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(5-ціанопіридин-2-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(1,3-тіазол-2-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2-диметилпропанамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(2-метилфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(6-оксо-1,6-дигідропіридазин-3-іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3R,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(цис-4-метилциклогексил)тетрагідрофуран-2-карбоксамід;
(2S)-N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)тетрагідрофуран-2-карбоксамід;
N-[(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-(піперазин-1-ілкарбоніл)піролідин-3-іл]-N-(2,4-дифторфеніл)-2-метилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)-2-метилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)-2,2-диметилпропанамід;
N-[(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-(піперазин-1-ілкарбоніл)піролідин-3-іл]-N-(2,4-дифторфеніл)-2,2-диметилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)-2,2-диметилпропанамід;
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)-2-фурамід і
N-{(3S,5S)-1-{[(3S,4R)-1-трет-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)-2-фурамід, або
фармацевтично прийнятна сіль або ізомер.
14. Агоністична до рецептора меланокортину композиція, яка містить сполуку формули 1, як її визначено в пункті 1, або її фармацевтично прийнятну сіль або ізомер як активний інгредієнт, разом з фармацевтично прийнятним носієм.
15. Композиція за п. 14 для профілактики і лікування ожиріння.
16. Композиція за п. 14 для профілактики і лікування діабету.
17. Композиція за п. 14 для профілактики і лікування запалення.
18. Композиція за п. 14 для профілактики і лікування еректильної дисфункції.
Текст
Реферат: Даний винахід стосується сполуки з високою агоністичною активністю до рецептора меланокортину або її фармацевтично прийнятної солі або ізомеру, а також агоністичної до рецептора меланокортину композиції, яка містить вказану сполуку або її фармацевтично прийнятну сіль або ізомер як активний інгредієнт. UA 99555 C2 (12) UA 99555 C2 UA 99555 C2 Даний винахід стосується сполуки наступної формули 1, яка володіє корисною агоністичною активністю до рецептора меланокортину; або її фармацевтично прийнятної солі або ізомеру: (1) 5 10 15 20 25 30 35 40 45 50 1 2 3 4 5 де R , R , R , R і R є такими, як визначено далі. Даний винахід стосується також процесу одержання сполуки вищенаведеної формули 1. Даний винахід стосується також агоністичної композиції для рецептора меланокортину, що містить сполуку вищенаведеної формули 1 в якості активного інгредієнту, зокрема композиції для профілактики і лікування ожиріння, діабету, запалення і еректильної дисфункції. Рівень техніки В родині меланокортину було клоновано і охарактеризовано п’ять підтипів рецепторів. Ці сполучені з G-білком рецептори (GPCR) стимулюють шлях проведення сигналів цАМФ в багатьох різних тканинах, опосередковуючи широке коло фізіологічних функцій. Рецептор 1 меланокортину (MC1R) експресується головним чином в меланоцитах, моноцитах і мастоцитах, опосередковуючи пігментацію волосся і шкіри і блокуючи запалення. MC2R експресується в адіпоцитах і в клітинах надниркової залози, опосередковуючи стероїдогенез в цій залозі. MC3R є присутнім у головному мозку, гіпоталамусі, серці, кишечнику та плаценті і асоціювався з гомеостазом енергії і запаленням. MC4R експресується виключно у головному мозку і контролює харчову поведінку, гомеостаз енергії та еректильну дисфункцію. Миші, нокаутні у відношенні MC4R, демонстрували фенотип гіперплазії і ожиріння. Рецептор MC5R виявляється в широкому колі тканин, і вважається, що він відіграє певну роль для системи екзокринних залоз. Велика кількість фізіологічних функцій рецепторів меланокортину спонукала до розробки і синтезування численних сполук в пошуку їх сильних агоністів та антагоністів. Ранніми прикладами можуть слугувати синтетичні пептиди і аналоги пептидів, що були ідентифіковані на основі ендогенного агоністу, такого як MSH (меланоцит-стимулюючий гормон). Такі пептидні агоністи використовувались для того, щоб охарактеризувати функцію цих рецепторів. NDP-MSH є дуже сильним і неселективним агоністом рецепторів MC1R, 3R, 4R і 5R, і повідомлялось, що він зменшує споживання корму і приріст ваги тіла в моделях на щурах. Циклічний гептапептид МТ-ІІ є агоністом з подібним неселективним профілем, і його терапевтичну корисність було доведено і клінічних дослідженнях, присвячених лікуванню еректильної дисфункції. Повідомлялось, що агоністи рецепторів меланокортину у вигляді малих молекул демонстрували сильну активність у випробуваннях лікарських препаратів для лікування ожиріння, статевої дисфункції або запалення. Наприклад, було ідентифіковано серію сильних і селективних агоністів MC4R, один з яких демонстрував достовірний вплив на посилення еректильної реакції у мишей (J. Med. Chem. 2002, 45, 4849). Було знайдено низку агоністів MC4R, які демонстрували гіпофазову активність і вплив на ожиріння в моделі на щурах (Bioorg. Med. Chem. Lett. 2005, 15, 171, Bioorg. Med. Chem. Lett. 2005, 15, 3430, Bioorg. Med. Chem. Lett. 2005, 15, 3501). Крім того, компанія Merck & Co. Inc. подала патентні заявки на різні сполуки в якості агоністів MC4R (WO 01/55109, WO 01/70337, WO 01/70708, WO 02/081443, WO 02/15909, WO 02/067869, WO 02/068387, WO 02/068388, WO 2004/087159, WO 2004/078716, WO 2004/078717, WO 2006/019787, WO 2006/020277, WO 2007/041052, WO 2007/041061, WO 2007/047496). Інші фармацевтичні компанії також подали патентні заявки на різні агоністи MCR у вигляді малих молекул (WO 02/059095, WO 02/059107, WO 02/059117, WO 02/059108, WO 02/085925, WO 03/009847, WO 03/009850, WO 02/018327, WO 2005/040109, WO 2005/047251, WO 2005/077935, WO 2005/077935, WO 2006/072393, WO 2007/015157, WO 2007/015162, JP 2007131570, WO 2007/096186, WO 2007/096763, WO 2007/141343, WO 2008/039418, WO 2008/007930). Повідомлялось також, що селективні агоністи MClR у вигляді малих молекул демонструють протизапальну ефективність в гострій моделі на мишах (J Med Chem 2003, 46, 1123). Через не усунуті недоліки різних фармацевтичних сполук, про які йшлося вище, в даній галузі відчувається гостра потреба в агоністах MCR у вигляді малих молекул і в 1 UA 99555 C2 5 10 15 20 25 фармацевтичних композиціях, що мають поліпшений фармакологічний профіль. Тому метою даного винаходу є запропонувати нові сполуки, що є корисними для лікування ожиріння, діабету, еректильної дисфункції і запалення. Суть винаходу Вищезгадані пептидні агоністи MCR мають суттєве обмеження для використання в якості препарату, що вводиться оральним шляхом, через свої молекулярні характеристики. Крім того, більшість непептидних агоністів MCR у вигляді малих молекул, про які повідомлялось до теперішнього часу, потребують вдосконалення у відношенні орального всмоктування, проникання через бар’єр кров-головний мозок і ефективності, щоб їх можна було використовувати в якості лікарських препаратів. Відповідно, метою даного винаходу було запропонувати непептидні агоністи MCR у вигляді малих молекул з новою структурою, які можна використовувати для профілактики і лікування ожиріння, діабету, еректильної дисфункції і запалення. Більш конкретно, метою даного винаходу було запропонувати непептидну сполуку формули 1, що чинить відмінний агоністичний вплив на рецептори MCR, зокрема селективно на MC4R, або її фармацевтично прийнятну сіль або ізомер. Іншою метою даного винаходу було запропонувати процес одержання сполуки формули 1. Іншою метою даного винаходу було запропонувати агоністичну до рецептора меланокортину композицію, що містить сполуку формули 1 або її фармацевтично прийнятну сіль або ізомер в якості активного інгредієнту, разом з фармацевтично прийнятним носієм. Зокрема, композиція за цим винаходом має сильний ефект у відношенні профілактики та лікування ожиріння, діабету, еректильної дисфункції і запалення. Кращий варіант здійснення винаходу Даний винахід пропонує сполуку формули 1 або її фармацевтично прийнятну сіль або ізомер: (1) 30 35 40 45 50 де: 1 R являє собою водень або C1-C10-алкіл, C3-C7-циклоалкіл, C6-C10-арил, гетероцикл або гетероарил, кожний з яких є незаміщеним або заміщеним щонайменше одним заміщенням, вибраним з групи, що містить галоген, аміно, C1-C4-алкіл, трифторметил, гідрокси, C1-C4алкокси, ціано і оксо; 2 R являє собою феніл або шестичленний гетероарил, кожний з яких є незаміщеним або моно- або дизаміщеним заміщеннями, вибраними з групи, що містить галоген, гідрокси, C 1-C4алкіл, C1-C4-алкокси, ціано і аміно; 3 R являє собою водень або C1-C10-алкіл або C3-C7-циклоалкіл, кожний з яких є незаміщеним або заміщеним заміщеннями, вибраними з групи, що містить галоген, метил, трифторметил, гідрокси і аміно; 4 R являє собою C4-C7-циклоалкіл або моноциклічний гетероцикл, кожний з яких є незаміщеним або моно- або полізаміщеним заміщеннями, вибраними з групи, що містить галоген, гідрокси, C1-C4-алкіл, трифторметил, C1-C4-алкокси і оксо; або являє собою феніл або шестичленний гетероарил, кожний з яких є незаміщеним або моно- або дизаміщеним заміщеннями, вибраними з групи, що містить галоген, гідрокси, C1-C4-алкіл, трифторметил, C1C4-алкокси і аміно; і 5 R являє собою C1-C6-алкіл, дифторметил, трифторметил, C3-C8-циклоалкіл, аміно, C1-C4алкіламіно, ди(C1-C4-алкіл)аміно, феніл, моноциклічний гетероарил або моноциклічний гетероцикл, де алкіл є незаміщеним або заміщеним щонайменше одним заміщенням, вибраним з групи, що містить фторо, гідрокси, меркапто, C 1-C4 алкокси, ацетокси, аміно, ацетиламіно, ціано, карбамоїл, диметил карбамоїл і оксо, а феніл або гетероарил є незаміщеним або моноабо дизаміщеним заміщеннями, вибраними з групи, що містить галоген, гідрокси, метил, трифторметил, метокси і аміно. В дефініціях заміщень для сполуки формули (1) за цим винаходом термін «алкіл», коли він використовується окремо або в комбінації, як «алкілокси», означає вуглеводневий радикал з 2 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 55 лінійним або розгалуженим ланцюгом. Термін «циклоалкіл» означає насичене аліфатичне кільце, включаючи циклогексил. Термін «арил» означає 6-10-членну ароматичну групу, включаючи феніл, нафтил і т.п. Термін «гетероарил» означає ароматичне 3-6-членне кільце, яке містить від 1 до 4 гетероатомів, вибраних з групи, що складається з атому азоту, атому кисню і атому сірки, яке може бути факультативно зрощеним з бензо або C3-C8-циклоалкілом. Прикладами моноциклічного гетероарилу можуть бути, не обмежуючись ними, тіазол, оксазол, тіофен, фуран, пірол, імідазол, ізоксазол, піразол, триазол, тіадиазол, тетразол, оксадиазол, піридин, піридазин, піримідин, піразин і подібні до них групи. Прикладами біциклічного гетероарилу можуть бути, не обмежуючись ними, індол, бензотіофен, бензофуран, бензімідазол, бензоксазол, бензізоксазол, бензотіазол, бензотіадиазол, бензотриазол, хінолін, ізохінолін, пурин, фуропіридин і подібні до них групи. Термін «гетероцикл» означає 4-8-членне кільце, яке містить від 1 до 2 гетероатомів, вибраних з групи, що складається з атому азоту, атому кисню і атому сірки, яке може бути факультативно зрощеним з бензо або C3-C8-циклоалкілом і є насиченим або ненасиченим 1 або 2 подвійними зв’язками. Прикладами можуть бути, не обмежуючись ними, піперидин, морфолін, тіаморфолін, піролідин, імідазолідин, тетрагідрофуран, піперазин і подібні до них групи. Кращими сполуками серед сполук формули (1) за цим винаходом є ті, в яких: 1 і) R являє собою водень, метил, етил, трифторетил, пропіл, ізопропіл, бутил, ізобутил, tertбутил, циклопропіл, циклобутил, циклопентил або циклогексил; або являє собою феніл, оксазолініл, імідазолініл, тіазолініл, тетрагідрофураніл, тетрагідротіопіраніл, імідазоліл, оксазоліл, тіазоліл, піразоліл, триазоліл, піридиніл, піримідиніл, піперидиніл або піридазиніл, кожний з яких є незаміщеним або заміщеним заміщеннями, вибраними з групи, що містить 1 галоген, метил, ціано, оксо і гідрокси, і краще, коли R являє собою ізопропіл, tert-бутил або циклопропіл; або являє собою феніл, тетрагідропіраніл, тіазоліл, піридиніл, піримідиніл або піридазиніл, кожний з яких є незаміщеним або заміщеним заміщеннями, вибраними з групи, що містить галоген, метил, ціано і гідрокси, 2 ii) R являє собою феніл, що є незаміщеним або моно- або дизаміщеним заміщеннями, 2 вибраними з групи, що містить фтор, хлор, бром, фенокси і метил, а ще краще, коли R являє собою 4-хлорфеніл або 2,4-дифторфеніл, 3 iii) R являє собою водень, метил, етил, пропіл, ізопропіл, бутил, ізобутил, tert-бутил, 3 циклопропіл, циклобутил або циклопентил, а ще краще, коли R являє собою водень, метил, етил або ізопропіл, 4 iv) R являє собою циклопентил, циклогексил, циклогептил, 4-метилциклогексил, 4,4диметилциклогексил, 4-фторциклогексил, 4,4-дифторциклогексил або 4трифторметилциклогексил; або являє собою феніл, що є незаміщеним або моно- або дизаміщеним заміщеннями, вибраними з групи, що містить фтор, хлор, метил і метокси, а ще 4 краще, коли R являє собою циклогексил, 4-метилциклогексил, 4,4-диметилциклогексил, 4,4дифторциклогексил або 2,4-дифторфеніл, 5 v) R являє собою метил, трифторметил, гідроксиметил, метоксиметил, етоксиметил, пропіл, ізопропіл, ізобутил, tert-бутил, -CH2CH2OH, -CH(CH3)CH2OH, -C(CH3)2CH2OH, -C(CH3)(CH2OH)2, C(CH3)2CH2OMe, -C(CH3)2CH2OEt, феніл, оксазолініл, імідазолініл, тіазолініл, тетрагідропіраніл, імідазоліл, оксазоліл, тіазоліл, піразоліл, тіазоліл, фураніл, тетрагідрофураніл, дигідрофураніл, 5 тетрагідропіраніл, піридиніл або піперидиніл, а ще краще, коли R являє собою ізопропіл, tertбутил, -C(CH3)2CH2OH, фураніл або тетрагідрофураніл. Найкращими сполуками серед сполук формули (1) за цим винаходом є ті, в яких: 1 R являє собою ізопропіл, tert-бутил або циклопропіл; або являє собою феніл, тетрагідропіраніл, тіазоліл, піридиніл, піримідиніл або піридазиніл, кожний з яких є незаміщеним або заміщеним заміщеннями, вибраними з групи, що містить галоген, метил, ціано і гідрокси, 2 R являє собою 4-хлорфеніл або 2,4-дифторфеніл, 3 R являє собою водень, метил, етил або ізопропіл, 4 R являє собою циклогексил, 4-метилциклогексил, 4,4-диметилциклогексил, 4,4дифторциклогексил або 2,4-дифторфеніл, і 5 R являє собою ізопропіл, tert-бутил, -C(CH3)2CH2OH, фураніл або тетрагідрофураніл. Показові сполуки формули 1 за даним винаходом включають перелічені далі сполуки: N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід; N-[(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-(піперазин1-ілкарбоніл)піролідин-3-іл]-N-(4,4-диметилциклогексил)ацетамід; 3 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил) тетрагідрофуран-2карбоксамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-3-гідрокси-2,2диметилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4етилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4етилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2диметилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2диметилпропанамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4етилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл] карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил) тетрагідрофуран-2карбоксамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-3-гідрокси-2,2диметилпропанамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-2,2-диметил-N-(cis-4-метилциклогексил) пропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-2,2-диметил-N-(cis-4-метилциклогексил) пропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-3-гідрокси-2,2-диметил-N-(cis-4метилциклогексил)пропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-3-гідрокси-2,2-диметил-N-(cis-4метилциклогексил)пропанамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert бутил-4-(2,4-дифторфеніл)піролідин-3-іл] карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4етилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил)-3-фурамід; 4 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2R)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)-2,2диметилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)ацетамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4етилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)ацетамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)ацетамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)-2,2диметилпропанамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5R)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл] карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил) тетрагідрофуран-2карбоксамід; N-{(3S,5R)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-2,2-диметил-N-(cis-4-метилциклогексил) пропанамід; (2S)-N-{(3S,5R)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5R)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; N-{(3S,5R)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-3-гідрокси-2,2-диметил-N-(cis-4метилциклогексил)пропанамід; N-{(3S,5R)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил)ацетамід; N-{(3S,5R)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил)ацетамід; N-{(3S,5R)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил)ацетамід; (2R)-N-{(3S,5R)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(тетрагідро-2H-піран-4-іл)піролідин-3іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4диметилциклогексил)тетрагідрофуран-2-карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(6-метилпіридазин-3-іл)піролідин-3іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4диметилциклогексил)тетрагідрофуран-2-карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-(6-хлорпіридазин-3-іл)піролідин-3іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4метилциклогексил)тетрагідрофуран-2-карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1,6-дигідропіридазин-3-ілпіролідин-3іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4диметилциклогексил)тетрагідрофуран-2-карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-фенілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2-карбоксамід; 5 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 55 (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-(тетрагідро-2H-піран-4-іл) піролідин-3іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4диметилциклогексил)тетрагідрофуран-2-карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-(тетрагідро-2H-тіопіран-4-іл) піролідин-3іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4диметилциклогексил)тетрагідрофуран-2-карбоксамід; N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(тетрагідро-2H-піран-4-іл)піролідин-3-іл] карбоніл}-5[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-3-гідрокси-2,2диметилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(тетрагідро-2H-піран-4-іл) піролідин-3-іл] карбоніл}5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)-2,2диметилпропанамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(тетрагідро-2H-піран-4-іл) піролідин-3іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4дифторциклогексил)тетрагідрофуран-2-карбоксамід; (2S)-N-{(3S,5R)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-(тетрагідро-2H-піран-4-іл) піролідин-3іл]карбоніл}-5-[(4-ізопропілпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4диметилциклогексил)тетрагідрофуран-2-карбоксамід; N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-(тетрагідро-2H-піран-4-іл)піролідин-3іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-2,2-диметил-N-(cis-4метилциклогексил)пропанамід; N-{(3S,5R)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(тетрагідро-2H-піран-4-іл)піролідин-3-іл]карбоніл}-5[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4-метилциклогексил) ацетамід; (2S)-N-{(3S,5R)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5R)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-3-гідрокси-2,2диметилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил)-3-гідрокси-2,2диметилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-циклопропіл-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил)-3-гідрокси-2,2диметилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-циклопропілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)-3-гідрокси-2,2диметилпропанамід; N-{(3S,5R)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-ізопропілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил)ацетамід; N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(6-метилпіридазин-3-іл)піролідин-3-іл] карбоніл}-5[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2диметилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-піридин-2-ілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2диметилпропанамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-піридин-2--ілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1,6-дигідропіридазин-3-ілпіролідин-3іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4метилциклогексил)тетрагідрофуран-2-карбоксамід; 6 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 55 N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-піримідин-2-ілпіролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2диметилпропанамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(2,4-дифторфеніл)-1-піридин-2-ілпіролідин-3-іл] карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(5-ціанопіридин-2-іл)піролідин-3-іл] карбоніл}-5[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(1,3-тіазол-2-іл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-2,2диметилпропанамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(2-метилфеніл)піролідин-3-іл] карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(1-метил-6-оксо-1,6-дигідропіридазин-3іл)піролідин-3-іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл] піролідин-3-іл}-N-(cis-4метилциклогексил)тетрагідрофуран-2-карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-4-(4-хлорфеніл)-1-(6-оксо-1,6-дигідропіридазин-3-іл) піролідин-3іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4метилциклогексил)тетрагідрофуран-2-карбоксамід; (2S)-N-{(3S,5S)-1-{[(3R,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4S)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3R,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід; (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)тетрагідрофуран-2карбоксамід; N-[(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-(піперазин-1ілкарбоніл)піролідин-3-іл]-N-(2,4-дифторфеніл)-2-метилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)-2-метилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)-2,2-диметилпропанамід; N-[(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-(піперазин-1ілкарбоніл)піролідин-3-іл]-N-(2,4-дифторфеніл)-2,2-диметилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)-2,2-диметилпропанамід; N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)-2-фурамід; і N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(2,4-дифторфеніл)-2-фурамід. Сполуки за даним винаходом можуть також утворювати фармацевтично прийнятні солі. Такі фармацевтично прийнятні солі включають солі приєднання кислоти, утворені кислотою, яка має фармацевтично прийнятний аніон, щоб утворити нетоксичну сіль приєднання кислоти, включаючи, наприклад, неорганічні кислоти, такі як соляна кислота, сірчана кислота, азотна кислота, фосфорна кислота, бромисто-воднева кислота, йодистоводнева кислота і т.п.; органічну карбонову кислоту, таку як винна кислота, мурашина кислота, лимонна кислота, оцтова кислота, трихлороцтова кислота, трифтороцтова кислота, глюконова кислота, бензойна кислота, молочна кислота, фумарола кислота, малеїнова кислота і т.п.; сульфонову кислоту, таку як метансульфонова кислота, бензолсульфокислота, р-толуолсульфокислота або нафталінсульфокислота і т.п.; а краще, щоб солі приєднання кислоти були утворені сірчаною кислотою, метансульфоновою кислотою або галогенводневою кислотою і т.п. Сполуки формули 1 за даним винаходом можуть бути перетворені на відповідні солі звичайними методами. 7 UA 99555 C2 5 Сполуки за даним винаходом можуть мати асиметричний вуглецевий центр, а відтак можуть бути представлені як R або S ізомерні форми, рацемати, діастереомерні суміші і окремі діастереомери. Даний винахід охоплює всі такі ізомерні форми і суміші. В іншому своєму аспекті даний винахід пропонує процес одержання сполуки формули 1, що включає етап амідного сполучення сполуки формули 2 зі сполукою формули 3: (2) (3) 10 (1), 1 15 2 3 4 5 де R , R , R , R і R є такими, як визначено вище. Додатково, даний винахід пропонує процес одержання сполуки формули 1, що включає етапи амідного сполучення сполуки формули 2’ зі сполукою формули 3 з утворенням сполуки формули 1’ і зняття захисту зі сполуки формули 1’: (2’) (1’) 20 (1), 25 де: 1 R являє собою водень, 8 UA 99555 C2 2 5 3 4 5 R , R , R і R є такими, як визначено вище, і Р являє собою захисну групу для аміно, переважно t-бутоксикарбоніл (Boc), бензилоксикарбоніл (Cbz) або фторенілметоксикарбоніл (Fmoc). Додатково, даний винахід пропонує процес одержання сполуки формули 1, що включає етапи зняття захисту зі сполуки формули 1’ або 2’ у вищеописаному процесі з наступним і) відновним амінуванням C1-C10-алкілом, C3-C7-циклоалкілом або гетероциклом, включаючи оксозаміщення або ii) сполученням з арилгалідом або гетероарилгалідом: (1’) 10 (1), 15 20 25 30 35 40 45 де: 1 R являє собою C1-C10-алкіл, C3-C7-циклоалкіл, C6-C10-арил, гетероцикл або гетероарил, який є незаміщеним або заміщеним щонайменше одним заміщенням, вибраним з групи, що містить галоген, аміно, C1-C4-алкіл, трифторметил, гідрокси, C1-C4-алкокси, ціано і оксо, а 2 3 4 5 R , R , R , R і Р є такими, як визначено вище. Краще, щоб вищеописані процеси за цим винаходом здійснювались у відповідному розчиннику, який не чинить несприятливого впливу на реакцію. Зокрема, краще використовувати один або більше розчинників, вибраних з групи, що містить, не обмежуючись ними, диметилформамід, диметилацетамід, тетрагідрофуран, метилен хлорид і хлороформ. Реакція зняття захисту з аміногруп може здійснюватись в присутності сильної кислоти, такої як соляна кислота (HCl), трифтороцтова кислота (TFA) і т.п., в присутності амінової основи, такої як триетиламін, диізопропілетиламін (DIPEA) і т.п., або шляхом дегідрогенізації. Конкретні умови реакції є описаними в книзі T.W. Green & G.M. Wuts, Protective Groups in Organic Synthesis, Chapter 7, pp 309-405. Крім того, відомими агентами сполучення, використовуваними в реакціях сполучення, є, без обмеження ними, карбодііміди, такі як дициклогексилкарбодіімід (DCC), 1-(3диметиламінопропіл)-3-етилкарбодіімід (EDC), 1,1’-дикарбонілдиімідазол (CDI) і т.п. в комбінації з 1-гідроксибензотриазолом (HOBT) або 1-гідрокси-7-азабензотриазолом (HOAT); або bis-(2оксо-3-оксазолідиніл)-фосфінової кислоти хлорид (BOP-Cl), дифенілфосфорилазид (DPPA), N[диметиламіно-1H-1,2,3-триазол[4,5-b]піридин-1-ілметилен]-N-метилметанаміній (HATU) і т.п. Сполуки формули 1, одержані за допомогою процесу за даним винаходом, можуть бути перетворені на відповідні солі звичайними методами. Після завершення вищенаведених реакцій у відповідності з процесом за цим винаходом продукти можуть бути відділені і очищені звичайними методами наступної обробки, наприклад хроматографією, рекристалізацією і т.п. Сполуки за даним винаходом чинять сильний агоністичний вплив проти рецепторів меланокортину, а відтак даний винахід пропонує агоністичну композицію для рецепторів меланокортину, що містить сполуку формули 1 або її фармацевтично прийнятну сіль або ізомер в якості активного інгредієнту, разом з фармацевтично прийнятним носієм. Зокрема, композиція у відповідності до даного винаходу має сильний ефект щодо профілактики і лікування, без обмеження ними, ожиріння, еректильної дисфункції, діабету і запалення. Коли сполуку за цим винаходом вводять з клінічною метою, доцільна добова доза може бути в межах від 0,01 до 10 мг/кг ваги тіла і може вводитись за один або кілька прийомів. Однак, рівень дози, який призначається для індивідуальних пацієнтів, може коливатись в залежності 9 UA 99555 C2 5 10 15 20 від конкретної використовуваної сполуки, ваги тіла, статі, стану здоров’я, раціону, часу і способу введення препарату, швидкості екскреції, змішування препаратів і тяжкості патологічного стану. Сполуки за цим винаходом можуть вводитись будь-яким шляхом в залежності від мети. Перевага віддається ін’єкції, а також оральному і назальному введенню, але для введення може використовуватись дермальний, інтраперитонеальний, ретроперитонеальний і ректальний шлях. Ін’єкційний препарат, наприклад водна або олійна суспензія для стерильної ін’єкції, можна приготувати відомим методом із застосуванням відповідних агентів для диспергування, зволоження або суспендування. Розчинниками, які використовуються з цією метою, є вода, розчин Рінгера та ізотонічний розчин NaCl. Стерилізована нелетуча олія також широко використовується в якості розчинника або середовища для суспендування. З цією метою може бути використана будь-яканеподразнююча нелетуча олія, включаючи моно- або тригліцерид; жирна кислота, така як олеїнова кислота, також може використовуватись для приготування ін’єкційних препаратів. Твердими лікарськими формами для орального введення є капсули, таблетки, пігулки, порошки і гранули; зокрема, використовуються капсули і таблетки. Таблетки і пігулки краще виготовляти з ентеросолюбільним покриттям. Тверді лікарські форми можуть готуватись шляхом змішування сполук формули 1 за цим винаходом з одним або більше інертними розріджувачами, такими як сахароза, лактоза, крохмаль і т.п., і носіями, наприклад лубрикантами, такими як магнію стеарат, агентами для дезінтеграції, зв’язування і т.п. Більш докладно даний винахід описується у розділах Методи приготування і Приклади, але об’єм даного винаходу не обмежується ними жодним чином. В наступних розділах Методи приготування і Приклади використовуються такі скорочення: 10 UA 99555 C2 11 UA 99555 C2 12 UA 99555 C2 Схема реакції А 5 13 UA 99555 C2 Схема реакції В 5 10 15 20 25 30 Методи приготування проміжних сполук А1 є наступними: Метод приготування 1: Метил (2S,4S)-1-Boc-4-амінопіролідин-2-карбоксилат Етап А: (4R)-1-Boc-4-гідрокси-L-пролін (4R)-гідрокси-L-пролін (5,08 г; 38,77 ммоль) розчинили в 1N NaOH (40 мл) і 1,4-діоксані (40 мл) і до одержаного розчину краплями додали ди-t-бутил дикарбонат (9,3 г; 42,6 ммоль) при 0 температурі 0 С. Реакційну суміш перемішували при кімнатній температурі впродовж 8 годин, концентрували in vacuo, підкислили за допомогою 1N HCl і екстрагували з використанням EtOAc. Органічні екстракти промили розсолом, висушили над MgSO4, профільтрували і концентрували in vacuo, щоб отримати титульну сполуку (8,84 г, 99%). MS[M+H] = 232 (M+1) Етап B: Метил (2S,4R)-1-Boc-4-гідроксипіролідин-2-карбоксилат (4R)-1-Boc-4-гідрокси-L-пролін (8 г; 34,63 ммоль), одержаний на Етапі A, розчинили в DMF (80 мл) і додали до цього K2CO3 (14 г; 101 ммоль) і краплями метил йодид (2,6 мл; 51,9 ммоль) 0 при температурі 0 С. Реакційну суміш перемішували при кімнатній температурі впродовж 5 годин, концентрували in vacuo і екстрагували з використанням EtOAc. Органічні екстракти промили водою і розсолом, висушили над MgSO 4, профільтрували і концентрували in vacuo, щоб отримати титульну сполуку (8,0 г, 95%). MS[M+H] = 246 (M+1) Етап C: Метил (2S,4R)-1-Boc-4-[(метилсульфоніл)окси]піролідин-2-карбоксилат Метил (2S,4R)-1-Boc-4-гідроксипіролідин-2-карбоксилат (8 г; 32,65 ммоль), одержаний на Етапі B, розчинили в DCM (80 мл) і додали до цього TEA (11,99 мл; 81,56 ммоль) і краплями 0 метансульфоніл хлорид (3,77 мл; 48,9 ммоль) при температурі 0 С. Реакційну суміш перемішували при кімнатній температурі впродовж 3 годин, органічні екстракти промили 1N HCl, насиченим водним розчином NaHCO3 і розсолом, висушили над MgSO4, профільтрували і концентрували in vacuo, щоб отримати титульну сполуку (9,4 г, 90%). MS[M+H] = 324 (M+1) Етап D: Метил (2S,4S)-1-Boc-4-азидопіролідин-2-карбоксилат 14 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 55 60 Метил (2S,4R)-1-Boc-4-[(метилсульфоніл)окси] піролідин-2-карбоксилат (9 г; 27,86 ммоль), одержаний на Етапі C, розчинили в DMF (80 мл), додали до цього NaN 3 (2,7 г; 41,79 ммоль) і 0 перемішували при 90 С впродовж 10 годин. Реакційну суміш концентрували in vacuo, екстрагували з використанням EtOAc. Органічні екстракти промили розсолом, висушили над MgSO4, профільтрували і концентрували in vacuo. Залишок очистили за допомогою колонкової хроматографії (елюент, EtOAc/Hex=1/4), щоб отримати титульну сполуку (6 г, 80%). MS[M+H] = 271 (M+1) Етап E: Метил (2S,4S)-1-Boc-4-амінопіролідин-2-карбоксилат Метил (2S,4S)-1-Boc-4-азидопіролідин-2-карбоксилат (6 г; 22,22 ммоль), одержаний на Етапі D, розчинили в THF (15 mL) і до цього краплями додали триметилфосфін (2,36 мл; 26,64 ммоль) 0 при температурі 0-5 С. Реакційну суміш перемішували при кімнатній температурі впродовж 2 годин, концентрували in vacuo, довели до лужної реакції насиченим NaHCO 3 і двічі екстрагували з використанням EtOAc. Органічні екстракти концентрували in vacuo, щоб отримати титульну сполуку у вигляді олії (5,34 г; 98,5%). MS[M+H] = 245 (M+1) Метод приготування 2: Метил (2R,4S)-1-Boc-4-амінопіролідин-2-карбоксилат Титульну сполуку було одержано з (4R)-гідрокси-D-проліну за тією ж методикою, яку було використано і Методі приготування 1. MS[M+H] = 245 (M+1) Метод приготування 3: Метил (2S,4R)-1-Boc-4-амінопіролідин-2-карбоксилат Титульну сполуку було одержано з (4S)-гідрокси-L-проліну за тією ж методикою, яку було використано і Методі приготування 1. MS[M+H] = 245 (M+1) Методи приготування проміжних сполук А2 є наступними: Метод приготування 4: 4,4-диметил-циклогексанон 4,4-диметил-циклогексен-1-он (5 г; 40,3 ммоль) помістили в реактор для синтезу на ізотопах водню і додали n-пентан (15 мл), після чого до цього додали Pd/C (500 мг). В реактор для синтезу на ізотопах водню ввели під тиском (172,4 кПа) водень, і проводили реакцію впродовж 30 хвилин. Після завершення реакції, твердий матеріал було відфільтровано на целіті, і фільтрат концентрували in vacuo, щоб отримати титульну сполуку (5 г, 98%). MS[M+H] = 127 (M+1) Метод приготування 5: 4,4-дифтор-циклогексанон Етап A: 8,8-дифтор-1,4-диоксоспіро[4.5]декан Придбаний 1,4-циклогександіон-моно-етилен кетал (25 г, 160 ммоль) розчинили в DCM (500 0 мл) і краплями додали DAST (52 г; 2,0 ммоль) при температурі 0 С. Реакційну суміш повільно нагріли при кімнатній температурі і перемішували до завершення реакції. Після підтвердження того, що всі реагенти зникли за допомогою ТШХ, реакційний розчин додали до насиченого водного розчину NaHCO3 (700 мл), щоб припинити реакцію, і екстрагували з використанням DCM. Органічні екстракти промили насиченим водним розчином NaHCO 3 і розсолом, висушили над MgSO4, профільтрували і концентрували in vacuo. Одержаний залишок було використано в наступній реакції без додаткової очистки. Етап B: 4,4-дифтор-циклогексанон 8,8-дифтор-1,4-диоксоспіро[4.5]декан, одержаний на Етапі A, розчинили в ацетоні (90 мл) і 3N HCl (900 мл) і перемішували до завершення реакції. Після цього, реакційну суміш екстрагували з використанням DCM, промили розсолом, висушили над MgSO 4, профільтрували і концентрували in vacuo. Одержаний залишок було використано в наступній реакції без додаткової очистки. MS[M+H] = 135 (M+1) Методи приготування проміжних сполук А3, які неможна придбати, є наступними: Метод приготування 6: (2S)-тетрагідрофуран-2-карбоніл хлорид (2S)-тетрагідрофуран-2-карбонову кислоту (25 г; 0,215 моль) розчинили в DCM (25 мл) і 0 охолодили розчин до 0 С, після чого краплями додали оксаліл хлорид (43,7 г; 0,344 моль). До реакційної суміші додали DMF (50 мкл) і перемішували її при кімнатній температурі впродовж 10 0 годин. Потім реакційну суміш концентрували in vacuo при 20-30 С, доки залишковий об’єм реакційної суміші дійшов приблизно до 30 мл. Реакційну суміш нагрівали при температурі біля 0 0 150-160 С і перегнали in vacuo при 80-100 С внутрішньої температури, щоб отримати титульну сполуку (24 г, 82,8%). Метод приготування 7: (2R)-тетрагідрофуран-2-карбоніл хлорид Титульну сполуку було одержано з (2R)-тетрагідрофуран-2-карбонової кислоти за тією ж методикою, яку було використано в Методі приготування 6. 15 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 55 60 Метод приготування 8: Тетрагідрофуран-2-карбоніл хлорид Тетрагідрофуран-3-карбонову кислоту (25 г; 0,215 моль) розчинили в DCM (25 мл) і 0 охолодили розчин до 0 С, після чого краплями додали оксаліл хлорид (43,7 г; 0,344 моль). До реакційної суміші додали DMF (50 мкл) і перемішували її при кімнатній температурі впродовж 10 0 годин. Потім реакційну суміш концентрували in vacuo при 20-30 С, доки залишковий об’єм реакційної суміші дійшов приблизно до 30 мл. Одержаний залишок було використано в наступній реакції без додаткової очистки. Метод приготування 9: 3-фуроїл хлорид 3-фуранкарбонову кислоту (25 г; 0,192 моль) розчинили в DCM (25 мл) і охолодили розчин 0 до 0 С, після чого краплями додали оксаліл хлорид (39,0 г; 0,307 моль). До реакційної суміші додали DMF (50 мкл) і перемішували її при кімнатній температурі впродовж 10 годин. Потім 0 реакційну суміш концентрували in vacuo при 20-30 С, доки залишковий об’єм реакційної суміші дійшов приблизно до 30 мл. Одрежаний залишок було використано в наступній реакції без додаткової очистки. Метод приготування 10: 2,2-диметил-3-ацетилоксипропіоніл хлорид Етап A: 2,2-диметил-3-ацетилоксипропіонова кислота 2,2-диметил-3-гідроксипропіонову кислоту (11,8 г; 100 ммоль) розчинили в піридині (30 мл), і 0 реакційний розчин охолодили до 0 С. Повільно краплями додали ацетил хлорид (11,8 г; 15,0 ммоль), після чого температуру підняли до кімнатної і перемішували реакційний розчин при кімнатній температурі впродовж 3 годин. Після завершення реакції додали 1N HCl (30 мл), щоб відрегулювати рН до 3-4, а потім реакційну суміш екстрагували з використанням EtOAc. Органічні екстракти промили 1N HCl, 4-5 разів, висушили над MgSO4 і концентрували in vacuo, щоб отримати титульну сполуку (15,2 г, 95,0%). MS[M+H] = 161 (M+1) Етап B: 2,2-диметил-3-ацетилоксипропіоніл хлорид Одержану на Етапі A 2,2-диметил-3-ацетилоксипропіонову кислоту (11,76 г; 80 ммоль) 0 розчинили в бензолі (100 мл), і охолодили реакційну суміш до 0 С, після чого краплями додали оксаліл хлорид (15,0 г; 120 ммоль). Через 3 години розчинник видалили in vacuo, а реакційну суміш перегнали in vacuo, щоб отримати титульну сполуку. MS[M+H] = 179 (M+1) Методи приготування проміжних сполук А4 є наступними: Метод приготування 11: (3S,4R)-1-t-бутил-4-(2,4-дифторфеніл)піролідин-3-карбонова кислота Титульну сполуку було одержано за методикою, описаною в публікації WO 2004/09126. Метод приготування 12: (3S,4R)-1-t-бутил-4-(4-хлорфеніл)піролідин-3-карбонова кислота Титульну сполуку було одержано з придбаного 2-бром-1-(4-хлорфеніл)етанону за тією ж методикою, яку було використано в Методі приготування 11. Метод приготування 13: (3S,4R)-1-Boc-4-(2,4-дифторфеніл)піролідин-3-карбонова кислота Етап A: (4R)-4-(2,4-дифторфеніл)піролідин-3-карбонітрил (4R)-1-t-бутил-4-(2,4-дифторфеніл)піролідин-3-карбонітрил (4 г, 15,15 ммоль), який було одержано за методикою, описаною в публікації WO 2004/09126, розчинили в DCE (10 мл) і до 0 цього краплями додали 1-хлоретил хлорформат (2,45 мл; 22,68 ммоль) при температурі 0 С. 0 Реакційний розчин нагріли до 70 С і, підтримуючи цю температуру, додали краплями впродовж 2 годин 1,8-bis(диметиламіно)нафталін (4,87 г; 22,72 ммоль), розчинений в DCE (10 мл). Після завершення реакції додали метиловий спирт (10 мл) і, підтримуючи цю температуру, перемішували реакційну суміш ще 1 годину, після чого концентрували in vacuo. Одержаний концентрат було використано в наступній реакції без додаткової очистки. MS[M+1] = 209 (M+1) Етап B: (4R)-1-BOC-4-(2,4-дифторфеніл)піролідин-3-карбонітрил (4R)-4-(2,4-дифторфеніл)піролідин-3-карбонітрил, одержаний на Етапі A, DMAP (1,8 г; 15,15 ммоль) і TEA (5,56 мл; 15,15 ммоль) розчинили в DCM (10 мл) і до цього краплями додали ди-t0 бутил дикарбонат (4,9 г; 22,7 ммоль) при температурі 0 С. реакційну суміш перемішували при кімнатній температурі впродовж 8 годин, концентрували in vacuo і екстрагували з використанням EtOAc. Органічні екстракти промили 1N HCl і розсолом, висушили над MgSO4, концентрували in vacuo і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/6), щоб отримати титульну сполуку (3,3 г, загальний вихід Етапів A і B: 72 %). MS[M+H] = 309 (M+1) Етап C: (3S,4R)-1-Boc-4-(2,4-дифторфеніл)піролідин-3-карбонова кислота (4R)-1-BOC-4-(2,4-дифторфеніл)піролідин-3-карбонітрил (3,3 г; 10,6 ммоль), одержаний на Етапі B, розчинили в етиловому спирті (10 мл), додали розчин 6N NaOH (5 мл) і перемішували 16 UA 99555 C2 0 5 10 15 20 25 30 35 40 45 50 55 при 70 С впродовж 4 годин. Після завершення реакції розчинник видалили, реакційну суміш розвели ефіром, органічний розчин достатньо підкислили і промили з використанням 6N HCl. Одержаний органічний розчин промили розсолом, висушили над MgSO 4 і концентрували in vacuo, щоб отримати титульну сполуку (3,43 г; 99,0%). MS[M+1] = 328 (M+1) Метод приготування 14: (3S,4R)-1-Boc-4-(4-хлорфеніл)піролідин-3-карбонова кислота Титульну сполуку було одержано з проміжного продукту 4-хлорфенілпіролідин-3карбонітрилу, одержаного в Методі приготування 12, за тією ж методикою, яку було використано в Методі приготування 13. MS[M+1] = 326 (M+1) Метод приготування 15: (3R,4R)-1-t-бутил-4-(4-хлорфеніл)піролідин-3-карбонова кислота Етап A: (3R ,4R)-1-t-бутил-4-(4-хлорфеніл)піролідин-3-карбонітрил 3-{t-Бутил[(2S)-2-(4-хлорфеніл)-2-гідроксиетил]-аміно}пропаннітрил (5 г; 17,80 ммоль), одержаний за методикою, описаною в публікації WO 2004/09126, розчинили в THF (27 мл). 0 Реакційну суміш охолодили до -20 С або нижче і додали до неї хлордиетилфосфат (2,69 мл; 0 18,70 ммоль). Температуру реакції підтримували на рівні 12-18 С, і під час реакції краплями додавали 1M LHMDS (37,4 мл; 37,38 ммоль) впродовж 2 годин. Після завершення реакції 0 додали воду (45 мл), підтримуючи температуру на рівні 15 С або нижче. Одержану суміш перемішували впродовж 30 хвилин, після чого екстрагували з використанням EtOAc. Екстрагований у такий спосіб органічний розчин концентрували in vacuo і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/3), щоб отримати титульну сполуку (0,5 г; 10,69%). MS[M+1] = 263 (M+1) Етап B: (3R,4R)-1-t-бутил-4-(4-хлорфеніл)піролідин-3-карбонова кислота До (3R,4R)-1-t-бутил-4-(4-хлорфеніл)піролідин-3-карбонітрилу (0,4 г; 1,52 ммоль), одержаного на Етапі A, додали концентровану HCl (10 мл), і суміш перемішували впродовж 5 0 0 годин при температурі 110 С. Після завершення реакції, суміш охолодили до 20-25 С і концентрували in vacuo. Суміш повторно концентрували in vacuo тричі з використанням EtOAc. До залишку додали EtOAc, і суміш перемішували впродовж 3-4 годин, після чого профільтрували, щоб отримати титульну сполуку (0,27 г; 62,95%). MS[M+1] = 282 (M+1) Метод приготування 16: (3S,4S)-1-t-бутил-4-(4-хлорфеніл)піролідин-3-карбонова кислота Етап A: (3S,4S)-1-t-бутил-4-(4-хлорфеніл)піролідин-3-карбонітрил 3-{t-Бутил[(2R)-2-(4-хлорфеніл)-2-гідроксиетил]-аміно}пропаннітрил (5 г; 17,80 ммоль), який було одержано з (R)-1-метил-3,3-дифенілтетрагідро-пірол[1,2-c][1,3,2]оксазаборолу за трьохетапною методикою, описаною в публікації WO 2004/09126, ввели в реакцію за тією ж методикою, яку було використано на Етапі А в Методі приготування 15, щоб отримати титульну сполуку (0,6 г; 12,82%). MS[M+1] = 263 (M+1) Етап B: (3S,4S)-1-t-бутил-4-(4-хлорфеніл)піролідин-3-карбонова кислота До (3S,4S)-1-t-бутил-4-(4-хлорфеніл)піролідин-3-карбонітрилу (0,4 г; 1,52 ммоль), одержаного на Етапі A, додали концентровану HCl (10 mL), і суміш перемішували впродовж 5 0 0 годин при температурі 110 С. Після завершення реакції, суміш охолодили до 20-25 С і концентрували in vacuo. Суміш повторно концентрували in vacuo двічі-тричі з використанням DCM. До залишку додали DCM, і суміш перемішували впродовж 3~4 годин, після чого профільтрували, щоб отримати титульну сполуку (0,19 г; 44,30%). MS[M+1] = 282 (M+1) Метод приготування 17: (3S,4R)-4-(4-хлорфеніл)-1-(6-метилпіридазин-3-іл)піролідин-3карбонова кислота Етап A: Метил (3S,4R)-4-(4-хлорфеніл)піролідин-3-карбоксилат (3S, 4R)-1-BOC-4-(4-хлорфеніл)піролідин-3-карбонову кислоту (0,70 г; 2,15 ммоль), одержану в Методі приготування 14, розчинили в DCE (3 мл), краплями додали 4N HCl (3 мл) і перемішували при кімнатній температурі впродовж 2 годин. До реакційної суміші додали MeOH (5 мл). Потім реакційну суміш перемішували при кімнатній температурі впродовж 3 годин і концентрували in vacuo. До одержаного залишку додали DCE (2 мл) і EtOAc (10 мл). Після цього, реакційну суміш перемішували при кімнатній температурі впродовж 1 години і профільтрували, щоб отримати титульну сполуку (0,46 г; 90,0%). MS[M+1] = 240 (M+1) Етап B: Метил (3S,4R)-4-(4-хлорфеніл)-1-(6-метилпіридазин-3-іл)піролідин-3-карбоксилат 17 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержаний на Етапі A метил (3S,4R)-4-(4-хлорфеніл)піролідин-3-карбоксилат (0,46 г; 1,92 ммоль) розчинили в діоксані (2 мл). Додали DIPEA (1,34 мл; 7,67 ммоль) і 3-хлор-60 метилпіридазин (0,74 г; 5,76 ммоль). Реакцію проводили при 180 С впродовж 5 хвилин з використанням мікрохвильового випромінювання. Потім реакційну суміш концентрували in vacuo. До одержаного залишку додали EtOAc. Цю суміш розвели EtOAc, промили водою і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/2), щоб отримати титульну сполуку (0,48 г; 75%). MS[M+H] = 332 (M+1) Етап C: (3S,4R)-4-(4-хлорфеніл)-1-(6-метилпіперазин-3-іл)піролідин-3-карбонова кислота Одержаний на Етапі B метил (3S,4R)-4-(4-хлорфеніл)-1-(6-метилпіридазин-3-іл)піролідин-3карбоксилат (0,48 г; 1,45 ммоль) розчинили в MeOH (4 мл) і воді (0,4 мл) і додали LiOH (0,1 г; 4,18 ммоль). Потім реакційну суміш перемішували при кімнатній температурі впродовж 3 годин і концентрували in vacuo. Одержаний залишок розвели водою. До розведеної суміші додали 1N HCl (4,18 мл). Після цього, реакційну суміш тричі екстрагували з використанням DCE/MeOH (10/1). Органічні екстракти висушили над MgSO 4 і концентрували під зниженим тиском, щоб отримати титульну сполуку (0,32 г; 70%). MS[M+H] = 318 (M+1) Метод приготування 18: (3S,4R)-4-(4-хлорфеніл)-1-(1,3-тіазол-2-іл)піролідин-3-карбонова кислота Етап A: Метил (3S,4R)-4-(4-хлорфеніл)-1-(1,3-тіазол-2-іл)піролідин-3-карбоксилат Одержаний на Етапі A в Методі приготування 17 метил (3S,4R)-4-(4-хлорфеніл)піролідин-3карбоксилат (0,46 г; 1,92 ммоль) розчинили в 1,4-діоксані (2 мл). Додали DIPEA (1,34 мл; 7,67 0 ммоль) і 2-бром-1,3-тіазол (1,57 г; 9,6 ммоль). Реакцію проводили при 180 С впродовж 20 хвилин з використанням мікрохвильового випромінювання. Потім реакційну суміш концентрували in vacuo. Одержаний залишок розвели EtOAc, промили водою і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/3), щоб отримати титульну сполуку (0.15 g, 25 %). MS[M+H] = 325 (M+1) Етап B: (3S,4R)-4-(4-хлорфеніл)-1-(1,3-тіазол-2-іл)піролідин-3-карбонова кислота Титульну сполуку (0,10 г; 70%) було одержано з продукту Етапу A, метил (3S,4R)-4-(4хлорфеніл)-1-(1,3-тіазол-2-іл)піролідин-3-карбоксилату (0,15 г; 0,46 ммоль) за тією ж методикою, яку було використано на Етапі C Методу приготування 17. MS[M+H] = 311 (M+1) Метод приготування 19: (3S,4R)-4-(2,4-дифторфеніл)-1-(6-хлорпіридазин-3-іл)піролідин-3карбонова кислота Етап A: Метил (3S,4R)-4-(2,4-дифторфеніл)піролідин-3-карбоксилат Титульну сполуку (0,46 г; 90%) було одержано з продукту Методу приготування 13, (3S,4R)1-Boc-4-(2,4-дифторфеніл)піролідин-3-карбонової кислоти (0,70 г; 2,15 ммоль) за тією ж методикою, яку було використано на Етапі A Методу приготування 17. MS[M+1] = 242 (M+1) Етап B: Метил (3S,4R)-4-(2,4-дифторфеніл)-1-(6-хлорпіридазин-3-іл)піролідин-3-карбоксилат Одержаний на Етапі A метил (3S,4R)-4-(2,4-дифторфеніл)піролідин-3-карбоксилат (0,46 г; 1,91 ммоль) розчинили в діоксані (2 мл). Додали DIPEA (1,33 мл; 7,64 ммоль) і 3,60 дихлорпіридазин (1,42 г; 9,55 ммоль). Реакцію проводили при температурі 120 С впродовж 5 0 хвилин і при 150 С впродовж 10 хвилин з використанням мікрохвильового випромінювання. Потім реакційну суміш концентрували in vacuo. Одержаний залишок розвели EtOAc, промили водою і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/5), щоб отримати титульну сполуку (0,44 г; 65%). MS[M+H] = 354 (M+1) Етап C: (3S,4R)-4-(2,4-дифторфеніл)-1-(6-хлорпіридазин-3-іл)піролідин-3-карбонова кислота Титульну сполуку (0,30 г, 70%) було одержано з продукту Етапу B, метил (3S,4R)-4-(2,4дифторфеніл)-1-(6-хлорпіридазин-3-іл)піролідин-3-карбоксилату, за тією ж методикою, яку було використано на Етапі С Методу приготування 17. MS[M+H] = 340 (M+1) Метод приготування 20: (3S,4R)-4-(4-хлорфеніл)-1-(6-хлорпіридазин-3-іл)піролідин-3карбонова кислота Титульну сполуку (0,30 г, 70%) було одержано з продукту Методу приготування 14, (3S,4R)1-Boc-4-(4-хлорфеніл)піролідин-3-карбонової кислоти, за тією ж методикою, яку було використано в Методі приготування 19. MS[M+1] = 242 (M+1) 18 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 Метод приготування 21: (3S,4R)-4-(4-хлорфеніл)-1-(1,6-дигідропіридазин-3-іл)піролідин-3карбонова кислота Етап A: Метил (3S,4R)-4-(4-хлорфеніл)-1-(1,6-дигідропіридазин-3-іл)піролідин-3-карбоксилат Проміжний продукт, одержаний при застосуванні Методу приготування 20, метил (3S,4R)-4(4-хлорфеніл)-1-(6-хлорпіридазин-3-іл)піролідин-3-карбоксилат (1,0 г; 2,84 ммоль) розчинили в MeOH (5 мл). Додали 1,4-циклогексадієн (2,27 г; 28,4 ммоль) і 10% Pd/C (1,0 г). Реакційну суміш перемішували при кімнатній температурі впродовж 10 годин і концентрували in vacuo. Одержаний залишок розвели EtOAc і профільтрували через целіт. Фільтрат концентрували in vacuo і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/2), щоб отримати титульну сполуку (0,72 г; 80%). Етап B: (3S,4R)-4-(4-хлорфеніл)-1-(1,6-дигідропіридазин-3-іл)піролідин-3-карбонова кислота Титульну сполуку (0,48 г; 70%) було одержано з продукту Етапу A, (3S,4R)-4-(4-хлорфеніл)1-(1,6-дигідропіридазин-3-іл)піролідин-3-карбоксилат (0,72 г; 2,27 ммоль) за тією ж методикою, яку було використано на Етапі С Методу приготування 17. MS[M+H] = 304 (M+1) Метод приготування 22: (3S,4R)-4-(4-хлорфеніл)-1-(6-оксо-1,6-дигідропіридазин-3іл)піролідин-3-карбонова кислота Етап A: Метил (3S,4R)-4-(4-хлорфеніл)-1-(6-оксо-1,6-дигідропіридазин-3-іл)піролідин-3карбоксилат До проміжного продукту, одержаного при застосуванні Методу приготування 20, метил (3S,4R)-4-(4-хлорфеніл)-1-(6-хлорпіридазин-3-іл)піролідин-3-карбоксилату (1,0 г; 2,84 ммоль) 0 додали AcOH (4 мл). Реакцію проводили при температурі 200 С впродовж 5 хвилин з використанням мікрохвильового випромінювання і концентрували in vacuo. Одержаний залишок розвели EtOAc і промили водою. Органічний розчин концентрували in vacuo і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/1), щоб отримати титульну сполуку (0,76 г; 80%). MS[M+H] = 334 (M+1) Етап B: (3S,4R)-4-(4-хлорфеніл)-1-(6-оксо-1,6-дигідропіридазин-3-іл)піролідин-3-карбонова кислота Титульну сполуку (0,51 г; 70%) було одержано з продукту Етапу A метил (3S,4R)-4-(4хлорфеніл)-1-(6-оксо-1,6-дигідропіридазин-3-іл)піролідин-3-карбоксилату (0,76 г; 2,28 ммоль) за тією ж методикою, яку було використано на Етапі С Методу приготування 17. MS[M+H] = 320 (M+1) Метод приготування 23: (3S,4R)-4-(4-хлорфеніл)-1-(1-метил-6-оксо-1,6-дигідропіридазин-3іл)піролідин-3-карбонова кислота Етап A: Метил (3S,4R)-4-(4-хлорфеніл)-1-(1-метил-6-оксо-1,6-дигідропіридазин-3іл)піролідин-3-карбоксилат Метил (3S,4R)-4-(4-хлорфеніл)-1-(6-оксо-1,6-дигідропіридазин-3-іл)піролідин-3-карбоксилат, одержаний на Етапі A Методу приготування 22, розчинили в DMF (5 мл). Додали краплями Cs2CO3 (1,11 г; 3,41 ммоль) і метил йодид (0,71 мл; 11,40 ммоль). Реакційну суміш 0 перемішували при 20-30 С впродовж 2 годин і концентрували in vacuo. Одержаний залишок розвели EtOAc, промили водою і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/1), щоб отримати титульну сполуку (0,55 г; 70%). MS[M+H] = 348 (M+1) Етап B: (3S,4R)-4-(4-хлорфеніл)-1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піролідин-3карбонова кислота Титульну сполуку (0,37 г; 70%) було одержано з продукту Етапу A, метил (3S,4R)-4-(4хлорфеніл)-1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл) піролідин-3-карбоксилату (0,55 г; 1,58 ммоль), за тією ж методикою, яку було використано на Етапі С Методу приготування 17. MS[M+H] = 334 (M+1) Сполуки з Прикладів, синтезовані за методикою Схеми реакції А, є наступними: Приклад 1: N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід, сіль TFA Сіль TFA (трифтороцтової кислоти) 55 19 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 Етап A: Метил (2S,4S)-1-BOC-4-[(4,4-диметилциклогексил)аміно]піролідин-2-карбоксилат Метил (2S,4S)-1-Boc-4-амінопіролідин-2-карбоксилат (1,07 г; 4,38 ммоль), одержаний за Методом приготування 1, і 4,4-диметилциклогексанон (0,66 г; 5,25 ммоль) розчинили в DCE (10 мл) і додали до цього NaBH(OAc)3 (1,39 г; 6,57 ммоль) при кімнатній температурі. Реакційну суміш перемішували при кімнатній температурі впродовж 4 годин, органічні екстракти екстрагували насиченим водним розчином NaHCO 3. Екстрагований водний розчин висушили над MgSO4, профільтрували і концентрували in vacuo. Одержаний залишок очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/2), щоб мати титульну сполуку (1,16 г; 75%). MS[M+H] = 355 (M+1) Етап B: Метил (2S,4S)-1-BOC-4-[ацетил(4,4-диметилциклогексил)аміно]піролідин-2карбоксилат Метил (2S,4S)-1-BOC-4-[(4,4-диметилциклогексил)аміно]піролідин-2-карбоксилат (1,01 г; 2,84 ммоль), одержаний на Етапі A, розчинили в піридині (5 мл) і додали до цього Ac 2O (1,34 мл; 0 14,20 ммоль) при кімнатній температурі. Реакційний розчин нагріли до 90 С і перемішували впродовж 2 годин. Після завершення реакції додали водний розчин CuSO4·5H2O і екстрагували з використанням EtOAc. Екстрагований органічний розчин висушили над MgSO 4 і концентрували in vacuo. Одержаний залишок очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/1), щоб мати титульну сполуку (0,98 г; 87%). MS[M+H] = 397 (M+1) Етап C: (4S)-1-BOC-4-[ацетил(4,4-диметилциклогексил)аміно]-L-пролін Метил (2S,4S)-1-BOC-4-[ацетил(4,4-диметилциклогексил)аміно]піролідин-2-карбоксилат (0,98 г; 2,47 ммоль), одержаний на Етапі B, розчинили в MeOH (8 мл) і воді (1,6 мл). До цього 0 додали LiOH (0,18 г; 7,52 ммоль) при температурі 0~5 С. Потім реакційну суміш перемішували при кімнатній температурі впродовж 3 годин і концентрували in vacuo. Одержаний залишок розвели водою і екстрагували з використанням EtOAc. Екстрагований органічний розчин промили розсолом, висушили над MgSO4 і концентрували in vacuo, щоб отримати титульну сполуку (0,92 г; 97%). MS[M+H] = 383 (M+1) Етап D: (2S,4S)-1-BOC-4-[ацетил(4,4-диметилциклогексил)аміно]-2-[(4-метилпіперазин-1іл)карбоніл]піролідин (4S)-1-BOC-4-[ацетил(4,4-диметилциклогексил)аміно]-L-пролін (0,92 г; 2,41 ммоль), одержаний на Етапі C, розчинили в DMF (10 мл) і додали до цього DIPEA (1,05 мл; 6,01 ммоль). По черзі додали 1-метилпіперазин (0,32 мл; 2,89 ммоль) і HBTU (0,91 г; 2,41 ммоль). Потім реакційний розчин перемішували при кімнатній температурі впродовж 2 годин, після чого концентрували in vacuo. Залишок розвели EtOAc і промили насиченим водним розчином NaHCO3. Екстрагований органічний розчин висушили над MgSO4, концентрували in vacuo і очистили за допомогою колонкової хроматографії (елюент: MC/MeOH = 10/1), щоб отримати титульну сполуку (1,06 г; 95%). MS[M+H] = 465 (M+1) Етап E: N-(4,4-диметилциклогексил)-N-{(3S,5S)-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин3-іл}ацетамід (2S,4S)-1-BOC-4-[ацетил(4,4-диметилциклогексил)аміно]-2-[(4-метилпіперазин-1іл)карбоніл]піролідин (1,06 г; 2,28 ммоль), одержаний на Етапі D, розчинили в DCM (1 мл) і до цього додали краплями 4M HCl (1 мл). Потім реакційний розчин перемішували при кімнатній температурі впродовж 1 години і концентрували in vacuo. Залишок концентрували in vacuo, щоб отримати титульну сполуку (830 мг, 99,8%). MS[M+H] = 365 (M+1) Етап F: N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)ацетамід, сіль TFA 20 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 N-(4,4-диметилциклогексил)-N-{(3S,5S)-5-[(4-метилпіперазин-1-іл)карбоніл] піролідин-3іл}ацетамід (0,83 г; 2,28 ммоль), одержаний на Етапі E, розчинили в DMF (5 мл) і до цього додали DIPEA (0,99 мл; 5,69 ммоль). Потім по черзі додали також (3S,4R)-1-t-бутил-4-(4хлорфеніл)піролідин-3-карбонову кислоту (0,64 г; 2,28 ммоль), одержану в Методі приготування 10, і HBTU (0,86 г; 2,28 ммоль). Після перемішування реакційного розчину при кімнатній температурі впродовж 2 годин, цей розчин концентрували in vacuo. Залишок розвели EtOAc і промили насиченим водним розчином NaHCO3. Екстрагований органічний розчин висушили над MgSO4, концентрували in vacuo і очистили за допомогою ВЕРХ, щоб отримати титульну сполуку як сіль TFA (1,22 г; 85%). MS[M+H] = 628 (M+1) 1 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,44-7,31 (m, 4H), 4,78-4,68 (br, 1H), 3,94-3,56 (m, 10H), 3,43-3,26 (m, 3H), 3,24-3,03 (m, 5H), 2,78 (s, 3H), 2,42-2,33 (m, 1H), 2,24-2,12 (br, 1H), 1,96 (s, 3H), 1,87-1,75 (m, 1H), 1,69-1,57 (br, 1H), 1,49-1,20 (m, 6H), 1,39 (s, 9H), 0,92-0,90 (2s, 6H). Приклад 2: N-[(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5(піперазин-1-ілкарбоніл)піролідин-3-іл]-N-(4,4-диметилциклогексил) ацетамід, сіль TFA Сіль TFA (трифтороцтової кислоти) Етап A: (2S,4S)-1-BOC-4-[ацетил(4,4-диметилциклогексил)аміно]-2-(піперазин-1ілкарбоніл)піролідин (4S)-1-BOC-4-[ацетил(4,4-диметилциклогексил)аміно]-L-пролін (0,92 г; 2,41 ммоль), одержаний на Етапі C Прикладу 1, розчинили в DMF (10 мл) і до цього додали DIPEA (1,05 мл; 6,01 ммоль). Далі по черзі додали також піперазин (0,25 г; 2,89 ммоль) і HBTU (0,91 г; 2,41 ммоль). Після перемішування реакційного розчину при кімнатній температурі впродовж 2 годин, цей розчин концентрували in vacuo. Залишок розвели EtOAc і промили насиченим водним розчином NaHCO3. Екстрагований органічний розчин висушили над MgSO4, концентрували in vacuo. Залишок очистили за допомогою колонкової хроматографії (елюент: MC/MeOH = 10/1), щоб отримати титульну сполуку (1,01 г; 93%). MS[M+H] = 451 (M+1) Етап B: N-(4,4-диметилциклогексил)-N-[(3S,5S)-5-(піперазин-1-ілкарбоніл) піролідин-3іл]ацетамід (2S,4S)-1-BOC-4-[ацетил(4,4-диметилциклогексил)аміно]-2-(піперазин-1-ілкарбоніл)піролідин (1,01 г; 2,24 ммоль), одержаний на Етапі A, ввели в реакцію за тією ж методикою, яку було використано на Етапі E Прикладу 1, щоб мати титульну сполуку (784 мг, 99,8%). MS[M+H] = 351 (M+1) Етап C: N-[(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-5(піперазин-1-ілкарбоніл)піролідин-3-іл]-N-(4,4-диметилциклогексил) ацетамід, сіль TFA N-(4,4-диметилциклогексил)-N-[(3S,5S)-5-(піперазин-1-ілкарбоніл)піролідин-3-іл] ацетамід (784 мг; 2,24 ммоль), одержаний на Етапі B, розчинили в DMF (5 мл) і до цього додали DIPEA (0,98 мл; 5,59 ммоль). Далі по черзі додали також (3S,4R)-1-t-бутил-4-(2,4дифторфеніл)піролідин-3-карбонову кислоту (0,63 г; 2,24 ммоль), одержану в Методі приготування 11, і HBTU (0,85 г; 2,24 ммоль). Після перемішування реакційного розчину при кімнатній температурі впродовж 2 годин, цей розчин концентрували in vacuo. Залишок розвели EtOAc і промили насиченим водним розчином NaHCO3. Екстрагований органічний розчин висушили над MgSO4, концентрували in vacuo. Залишок очистили за допомогою ВЕРХ, щоб отримати титульну сполуку як сіль TFA (1,20 г; 87%). MS[M+H] = 616 (M+1) 1 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,64-7,50 (m, 1H), 7,11-6,96 (m, 2H), 4,77-4,64 (br, 1H), 4,04-3,48 (m, 11H), 3,46-3,17 (m, 4H), 3,17-3,01 (m, 4H), 2,45-2,33 (m, 1H), 2,26-2,12 (br, 1H), 1,97 (s, 3H), 1,88-1,72 (m, 1H), 1,68-1,50 (br, 1H), 1,49-1,20 (m, 6H), 1,38 (s, 9H), 0,91 (s, 6H). 21 UA 99555 C2 Приклад 3: (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)тетрагідрофуран-2карбоксамід, сіль TFA Сіль TFA (трифтороцтової кислоти) 5 10 15 20 25 30 35 40 45 50 Етап A: Метил (2S,4S)-1-BOC-4-{(4,4-диметилциклогексил)[(2S)-тетрагідрофуран-2ілкарбоніл]аміно}піролідин-2-карбоксилат Метил (2S,4S)-1-BOC-4-[(4,4-диметилциклогексил)аміно]піролідин-2-карбоксилат, одержаний на Етапі A Прикладу 1, (1,01 г; 2,84 ммоль) розчинили в DCE (5 мл). До цього додали TEA (5 мл) і DMAP (0,34 г; 2,84 ммоль). Далі додали (2S)-тетрагідрофуран-2-карбоніл хлорид (1,14 г; 8,52 ммоль), одержаний в Методі приготування 6. Після перемішування реакційного розчину при кімнатній температурі впродовж 2 годин і завершення реакції, цей розчин концентрували in vacuo. До розчину, що залишився, додали насичений водний розчин NaHCO 3 і екстрагували з використанням EtOAc. Екстрагований органічний розчин промили 1N розчином HCl, висушили над MgSO4, концентрували in vacuo і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/4), щоб отримати титульну сполуку (1,05 г; 82%). MS[M+H] = 453 (M+1) Етап B: (4S)-1-BOC-4-{(4,4-диметилциклогексил)[(2S)-тетрагідрофуран-2-ілкарбоніл]аміно}-Lпролін Метил (2S,4S)-1-BOC-4-{(4,4-диметилциклогексил)[(2S)-тетрагідрофуран-2ілкарбоніл]аміно}піролідин-2-карбоксилат (1,05 г; 2,32 ммоль), одержаний на Етапі A, ввели в реакцію за тією ж методикою, яку було використано на Етапі С Прикладу 1, щоб мати титульну сполуку (0,99 г; 97%). MS[M+H] = 439 (M+1) Етап C: (2S,4S)-1-BOC-4-{(4,4-диметилциклогексил)[(2S)-тетрагідрофуран-2ілкарбоніл]аміно}-2-[(4-метилпіперазин-1-іл)карбоніл]піролідин (4S)-1-BOC-4-{(4,4-диметилциклогексил)[(2S)-тетрагідрофуран-2-ілкарбоніл] аміно}-L-пролін (0,99 г; 2,26 ммоль), одержаний на Етапі B, ввели в реакцію за тією ж методикою, яку було використано на Етапі D Прикладу 1, щоб мати титульну сполуку (1,12 г; 95%). MS[M+H] = 521 (M+1) Етап D: (2S)-N-(4,4-диметилциклогексил)-N-{(3S,5S)-5-[(4-метилпіперазин-1-іл) карбоніл]піролідин-3-іл}тетрагідрофуран-2-карбоксамід (2S,4S)-1-BOC-4-{(4,4-диметилциклогексил)[(2S)-тетрагідрофуран-2-ілкарбоніл] аміно}-2-[(4метилпіперазин-1-іл)карбоніл]піролідин (1,12 г; 2,15 ммоль), одержаний на Етапі C, ввели в реакцію за тією ж методикою, яку було використано на Етапі E Прикладу 1, щоб мати титульну сполуку (903 мг, 99,8%). MS[M+H] = 421 (M+1) Етап E: (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл] карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил) тетрагідрофуран-2карбоксамід, сіль TFA (2S)-N-(4,4-диметилциклогексил)-N-{(3S,5S)-5-[(4-метилпіперазин-1-іл)карбоніл] піролідин-3іл}тетрагідрофуран-2-карбоксамід (903 мг; 2,15 ммоль), одержаний на Етапі D, і (3S,4R)-1-tбутил-4-(4-хлорфеніл)піролідин-3-карбонову кислоту, одержану в Методі приготування 12, ввели в реакцію за тією ж методикою, яку було використано на Етапі F Прикладу 1, щоб мати титульну сполуку як сіль TFA (1,25 г; 85%). MS[M+H] = 684 (M+1) 1 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,43-7,31 (m, 4H), 4,80-4,68 (br, 1H), 4,49 (dd, J = 6,15; 6,1 Гц, 1H), 3,92-3,57 (m, 12H), 3,57-3,46 (m, 1H), 3,41-3,28 (m, 2H), 3,28-3,17 (m, 1H), 3,12-2,92 (m, 4H), 2,71 (s, 3H), 2,42-2,30 (m, 1H), 2,24-2,14 (br, 1H), 2,08-1,98 (m, 1H), 1,96-1,77 (m, 5H), 1,75-1,62 (m, 1H), 1,62-1,46 (m, 4H), 1,38 (s, 9H), 1,37-1,24 (m, 1H), 0,92-0,90 (2s, 6H). 22 UA 99555 C2 Приклад 4: N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперпзин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-3-гідрокси-2,2диметилпропанамід, сіль TFA Сіль TFA (трифтороцтової кислоти) 5 10 15 20 25 30 35 40 45 50 Етап A: Метил (2S,4S)-1-BOC-4-{[3-(ацетокси)-2,2-диметилпропаноїл](4,4диметилциклогексил)аміно}піролідин-2-карбоксилат Метил (2S,4S)-1-BOC-4-[(4,4-диметилциклогексил)аміно]піролідин-2-карбоксилат (1,01 г; 2,84 ммоль), одержаний на Етапі A Прикладу 1, розчинили в DCE (5 мл). До цього додали TEA (5 мл) і DMAP (0,34 г; 2,84 ммоль), а потім 2,2-диметил-3-ацетилоксипропіоніл хлорид (1,01 г; 0 5,68 ммоль), одержаний в Методі приготування 10. Реакційний розчин нагріли до 90 С і перемішували впродовж 48 годин. Після завершення реакції, розчинник видалили in vacuo. До розчину, що залишився, додали насичений водний розчин NaHCO 3 і екстрагували з використанням EtOAc. Екстрагований органічний розчин промили 1N розчином HCl, висушили над MgSO4, концентрували in vacuo і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/4), щоб мати титульну сполуку (0,88 г; 63%). MS[M+H] = 497 (M+1) Етап B: (4S)-1-BOC-4-[(4,4-диметилциклогексил)(3-гідрокси-2,2-диметилпропаноїл) аміно]-Lпролін Метил (2S,4S)-1-BOC-4-{[3-(ацетокси)-2,2-диметилпропаноїл](4,4-диметилциклогексил)аміно}піролідин-2-карбоксилат (0,88 г; 1,77 ммоль), одержаний на Етапі A, розчинили в MeOH (8 мл) і воді (1,6 мл). До цього додали NaOH (213 мг; 5,31 ммоль). Реакційний розчин перемішували впродовж 12 годин. Після завершення реакції, реакційний розчин концентрували in vacuo, підкислили 1N HCl і екстрагували з використанням EtOAc. Екстрагований органічний розчин промили 1N розчином HCl, висушили над MgSO4, концентрували in vacuo, щоб мати титульну сполуку (0,74 г; 95%). MS[M+H] = 441 (M+1) Етап C: (2S,4S)-1-BOC-4-[(4,4-диметилциклогексил)(3-гідрокси-2,2-диметилпропаноїл)аміно]2-[(4-метилпіперазин-1-іл)карбоніл]піролідин (4S)-1-BOC-4-[(4,4-диметилциклогексил)(3-гідрокси-2,2-диметилпропаноїл)аміно]-L-пролін (0,74 г; 1,68 ммоль), одержаний на Етапі B, ввели в реакцію за тією ж методикою, яку було використано на Етапі D Прикладу 1, щоб мати титульну сполуку (0,83 г; 95%). MS[M+H] = 523 (M+1) Етап D: N-(4,4-диметилциклогексил)-3-гідрокси-2,2-диметил-N-{(3S,5S)-5-[(4-метилпіперазин1-іл)карбоніл]піролідин-3-іл}пропіламід (2S,4S)-1-BOC-4-[(4,4-диметилциклогексил)(3-гідрокси-2,2-диметилпропаноїл) аміно]-2-[(4метилпіперазин-1-іл)карбоніл]піролідин (0,83 г; 1,59 ммоль), одержаний на Етапі C, ввели в реакцію за тією ж методикою, яку було використано на Етапі D Прикладу 1, щоб мати титульну сполуку (0,67 г; 99,8%). MS[M+H] = 423 (M+1) Етап E: N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-диметилциклогексил)-3-гідрокси-2,2диметилпропанамід, сіль TFA N-(4,4-диметилциклогексил)-3-гідрокси-2,2-диметил-N-{(3S,5S)-5-[(4-метилпіперазин-1іл)карбоніл]піролідин-3-іл}пропанамід (0,67 г; 1,59 ммоль), одержаний на Етапі D, і (3S,4R)-1-tбутил-4-(4-хлорфеніл)піролідин-3-карбонова кислота, одержана в Методі приготування 12, ввели в реакцію за тією ж методикою, яку було використано на Етапі F Прикладу 1, щоб мати титульну сполуку як сіль TFA (0,92 г; 85%). MS[M+H] = 686 (M+1) 23 UA 99555 C2 1 5 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,43-7,31 (m, 4H), 4,78-4,68 (br, 1H), 3,94-3,55 (m, 10H), 3,44-3,26 (m, 3H), 3,24-2,91 (m, 7H), 2,78 (s, 3H), 2,42-2,32 (m, 1H), 2,23-2,11 (br, 1H), 1,85-1,73 (m, 1H), 1,68-1,56 (br, 1H), 1,47-1,18 (m, 6H), 1,39 (s, 9H), 1,14 (s, 6H), 0,92, 0,90 (2s, 6H). Приклади 5-15 В методах приготування 1-23 сполуки вводились в реакцію за тією ж методикою, яка використовувалась в Прикладах 1~4, щоб отримали сполуки наступних Прикладів. O O N N R3 N N N O R5 R2' 2’ 3 Приклад 5 6 7 8 9 10 11 R 2,4-diF 2,4-diF 2,4-diF 4-Cl 4-Cl 4-Cl 2,4-diF R Me Et i-Pr Et i-Pr Me Me 12 4-Cl 5 Et R Me Me Me Me Me t-Bu t-Bu MS (M+1) 630 644 658 642 656 670 672 H 698 O H 13 4-Cl i-Pr 712 O H 14 2,4-diF Me 686 O 15 2,4-diF Me C(CH3)2CH2OH 688 10 15 20 25 30 Приклад 5 (сіль TFA) 1 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,66-7,53 (m, 1H), 7,12-6,97 (m, 2H), 4,76-4,64 (br, 1H), 4,04-3,80 (m, 3H), 3,80-3,56 (m, 7H), 3,45-3,27 (m, 3H), 3,27-3,17 (m, 1H), 3,17-3,02 (m, 4H), 2,77 (s, 3H), 2,46-2,35 (m, 1H), 2,23-2,12 (br, 1H), 1,97 (s, 3H), 1,85-1,73 (m, 1H), 1,64-1,50 (br, 1H), 1,47-1,20 (m, 6H), 1,38 (s, 9H), 0,91 (s, 6H). Приклад 7 (сіль TFA) 1 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,65-7,54 (m, 1H), 7,10-6,97 (m, 2H), 4,77-4,66 (br, 1H), 4,03-3,80 (m, 3H), 3,80-3,60 (m, 7H), 3,47-3,27 (m, 4H), 3,27-3,19 (m, 1H), 3,19-3,02 (m, 4H), 2,472,35 (m, 1H), 2,23-2,12 (br, 1H), 1,97 (s, 3H), 1,86-1,73 (m, 1H), 1,67-1,55 (br, 1H), 1,47-1,20 (m, 6H), 1,38 (s, 9H), 1,27, 1,25 (2s, 6H), 0,91 (s, 6H). Приклад (сіль TFA) 1 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,43-7,33 (m, 4H), 4,78-4,68 (br, 1H), 3,93-3,56 (m, 10H), 3,43-3,26 (m, 3H), 3,23-3,03 (m, 7H), 2,43-2,33 (m, 1H), 2,22-2,11 (br, 1H), 1,96 (s, 3H), 1,87-1,76 (m, 1H), 1,69-1,57 (br, 1H), 1,48-1,20 (m, 6H), 1,39 (s, 9H), 1,24 (t, 3H), 0,92, 0,90 (2s, 6H). Приклад 11 (сіль TFA) 1 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,66-7,56 (m, 1H), 7,10-6,98 (m, 2H), 4,77-4,67 (br, 1H), 4,07-3,91 (m, 2H), 3,89-3,57 (m, 8H), 3,57-3,46 (m, 1H), 3,44-3,28 (m, 2H), 3,20-3,04 (m, 5H), 2,78 (s, 3H), 2,52-2,40 (m, 1H), 2,17-2,06 (br, 1H), 1,92-1,79 (m, 1H), 1,66-1,54 (br, 1H), 1,49-1,18 (m, 6H), 1,39 (s, 9H), 1,16 (s, 9H), 0,92 (s, 6H). Приклад 16: (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил)тетрагідрофуран2-карбоксамід, сіль HCl Сіль HCl (соляної кислоти) 24 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 Етап A: Метил (2S,4S)-1-BOC-4-[(cis-4-метилциклогексил)аміно]піролідин-2-карбоксилат Метил (2S,4S)-1-Boc-4-амінопіролідин-2-карбоксилат (1,07 г; 4,38 ммоль), одержаний в Методі приготування 1, і 4-метилциклогексанон розчинили в DCE (30 мл) і до цього додали NaBH(OAc)3 (1,39 г; 6,57 ммоль) при кімнатній температурі. Після перемішування реакційного розчину впродовж 4 годин при кімнатній температурі, додали насичений водний розчин NaHCO 3 і екстрагували з використанням DCM (50 мл X 2) і EtOAc. Екстрагований органічний розчин промили розсолом, висушили над MgSO4, профільтрували і концентрували in vacuo. Cis- і transсполуки відділили від одержаного залишку за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/2), щоб мати титульну сполуку (0,84 г; 57%). MS[M+H] = 341 (M+1) Етап B: Метил (2S,4S)-1-BOC-4-{(cis-4-метилциклогексил)[(2S)-тетрагідрофуран-2ілкарбоніл]аміно}піролідин-2-карбоксилат Метил (2S,4S)-1-BOC-4-[(cis-4-метилциклогексил)аміно]піролідин-2-карбоксилат (0,84 г; 2,49 ммоль), одержаний на Етапі A, ввели в реакцію за тією ж методикою, яку було використано на Етапі A Прикладу 3, щоб мати титульну сполуку (0,92 г; 87%). MS[M+H] = 439 (M+1) Етап C: (4S)-1-BOC-4-{(cis-4-метилциклогексил)[(2S)-тетрагідрофуран-2-ілкарбоніл]аміно}-Lпролін Метил (2S,4S)-1-BOC-4-{(cis-4-метилциклогексил)[(2S)-тетрагідрофуран-2ілкарбоніл]аміно}піролідин-2-карбоксилат (0,92 г; 2,10 ммоль), одержаний на Етапі B, ввели в реакцію за тією ж методикою, яку було використано на Етапі C Прикладу 1, щоб мати титульну сполуку (0,85 г; 95%). MS[M+H] = 425 (M+1) Етап D: (2S,4S)-1-BOC-4-{(cis-4-метилциклогексил)[(2S)-тетрагідрофуран-2ілкарбоніл]аміно}-2-[(4-метилпіперазин-1-іл)карбоніл]піролідин (4S)-1-BOC-4-{(cis-4-метилциклогексил)[(2S)-тетрагідрофуран-2-ілкарбоніл]аміно}-L-пролін (0,85 г; 2,00 ммоль), одержаний на Етапі C, ввели в реакцію за тією ж методикою, яку було використано на Етапі D Прикладу 1, щоб мати титульну сполуку (0,95 г; 94%). MS[M+H] = 507 (M+1) Етап E: (2S)-N-(cis-4-метилциклогексил)-N-{(3S,5S)-5-[(4-метилпіперазин-1-іл) карбоніл]піролідин-3-іл}тетрагідрофуран-2-карбоксамід (2S,4S)-1-BOC-4-{(cis-4-метилциклогексил)[(2S)-тетрагідрофуран-2-ілкарбоніл] аміно}-2-[(4метилпіперазин-1-іл)карбоніл]піролідин (0,95 г; 1,87 ммоль), одержаний на Етапі D, ввели в реакцію за тією ж методикою, яку було використано на Етапі E Прикладу 1, щоб мати титульну сполуку (0,76 г; 99,8%). MS[M+H] = 407 (M+1) Етап F: (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл] карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід, сіль TFA (2S)-N-(cis-4-метилциклогексил)-N-{(3S,5S)-5-[(4-метилпіперазин-1-іл)карбоніл] піролідин-3іл}тетрагідрофуран-2-карбоксамід (0,76 г; 1,87 ммоль), одержаний на Етапі E, і (3S,4R)-1-tбутил-4-(4-хлорфеніл)піролідин-3-карбонову кислоту, одержану в Методі приготування 12, ввели в реакцію за тією ж методикою, яку було використано на Етапі F Прикладу 1, щоб мати титульну сполуку (1,10 г; 88%). MS[M+H] = 670 (M+1) Етап G: (2S)-N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл] карбоніл}-5[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(cis-4-метилциклогексил) тетрагідрофуран-2карбоксамід, сіль HCl 1 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,54-7,22 (m, 4H), 4,79-4,65 (br, 1H), 4,53-4,43 (m, 1H), 3,96-3,58 (m, 10H), 3,58-3,37 (m, 2H), 3,37-3,22 (m, 2H), 3,22-2,94 (m, 5H), 2,73 (s, 3H), 2,64-2,50 25 UA 99555 C2 5 (m, 1H), 2,43-2,27 (m, 1H), 2,20-2,09 (m, 1H), 2,09-1,97 (m, 1H), 1,97-1,74 (m, 5H), 1,61-1,44 (m, 4H), 1,40 (s, 9H), 1,37-1,22 (m, 3H), 0,95 (s, 3H). Приклади 17-25 Сполуки в Методах приготування 1-23 вводились в реакцію за тією ж методикою, що була використана в Прикладах 1-4, 16, щоб отримати сполуки наступних Прикладів. O O N N R3 N N N O R5 R2' 2’ 3 Приклад R 17 18 19 20 4-Cl 2,4-diF 4-Cl 2,4-diF Me Me Me Me 21 2,4-diF 5 Me R R t-Bu t-Bu C(CH3)2CH2OH C(CH3)2CH2OH MS (M+1) 656 658 672 674 H 672 O H 22 4-Cl Et 684 O H 23 4-Cl i-Pr 698 O 24 2,4-diF Me 25 4-Cl Me O 668 H 670 O 10 15 Приклад 17 (сіль TFA) 1 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,44-7,29 (m, 4H), 4,79-4,67 (br, 1H), 3,99-3,88 (m, 1H), 3,86-3,47 (m, 10H), 3,43-3,28 (m, 2H), 3,18-2,99 (m, 5H), 2,75 (s, 3H), 2,48-2,40 (m, 1H), 2,16-2,05 (m, 1H), 1,94-1,81 (m, 2H), 1,66-1,48 (m, 5H), 1,43-1,18 (m, 2H), 1,39 (s, 9H), 1,15 (s, 9H), 0,98 (d, 3H). Приклад 26: N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл] карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)-2,2диметилпропанамід, сіль TFA Сіль TFA (трифтороцтова кислота) 20 25 Етап A: Метил (2S,4S)-1-BOC-4-[(4,4-дифторциклогексил)аміно]піролідин-2-карбоксилат Метил (2S,4S)-1-Boc-4-амінопіролідин-2-карбоксилат (29 г, 120 ммоль), одержаний в Методі приготування 1, і 4,4-дифтор-циклогексанон (19,31 г; 144 ммоль), одержаний в Методі приготування 5, розчинили в DCE. До цього додали NaBH(OAc)3 (37 г, 180 ммоль). Реакційний 26 UA 99555 C2 5 10 15 20 25 30 35 40 45 50 розчин перемішували впродовж 6 годин при кімнатній температурі. Після завершення реакції, розчин концентрували in vacuo і додали до цього водний розчин NaHCO 3. Розчин екстрагували з використанням EtOAc, висушили над MgSO4, концентрували in vacuo і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/4), щоб мати титульну сполуку (23,66 г; 55%), відділену від метил (2S,4S)-1-BOC-4-[(4’-фторциклогекс-3-ен-1-іл)аміно]піролідин-2карбоксилату. MS[M+H] = 363 (M+1) Етап B: Метил (2S,4S)-1-BOC-4-[(4,4-дифторциклогексил)(2,2-диметилпропаноїл) аміно]піролідин-2-карбоксилат Метил (2S,4S)-1-BOC-4-[(4,4-дифторциклогексил)аміно]піролідин-2-карбоксилат (1,03 г; 2,84 ммоль), одержаний на Етапі A, розчинили в DCE (5 мл) і TEA (5 мл) і до цього додали DMAP (0,36 г; 2,84 ммоль). Додали також придбаний півалоїл хлорид (1,03 г; 8,52 ммоль). Реакційний 0 розчин нагріли до 90 С і перемішували впродовж 24 годин. Після завершення реакції, розчинник видалили in vacuo і додали насичений водний розчин NaHCO3. Реакційний розчин екстрагували з використанням EtOAc. Екстрагований органічний розчин промили 1N розчином HCl, висушили над MgSO4, концентрували in vacuo і очистили за допомогою колонкової хроматографії (елюент: EtOAc/Hex = 1/4), щоб мати титульну сполуку (1,04 г; 82 %). MS[M+H] = 447 (M+1) Етап C: (4S)-1-BOC-4-[(4,4- дифторциклогексил)(2,2- диметилпропаноїл) аміно]-L-proline Метил (2S,4S)-1-BOC-4-[(4,4-дифторциклогексил)(2,2-диметилпропаноїл)аміно] піролідин-2карбоксилат (1,02 г; 2,32 ммоль), одержаний на Етапі B, ввели в реакцію за тією ж методикою, яку було використано на Етапі C Прикладу 1, щоб мати титульну сполуку (0,95 г; 95%). MS[M+H] = 433 (M+1) Етап D: (2S,4S)-1-BOC-4-[(4,4-дифторциклогексил)(2,2-диметилпропаноїл)аміно]-2-[(4метилпіперазин-1-іл)карбоніл]піролідин (4S)-1-BOC-4-[(4,4-дифторциклогексил)(2,2-диметилпропаноїл)аміно]-L-пролін (0,95 г; 2,2 ммоль), одержаний на Етапі C, ввели в реакцію за тією ж методикою, яку було використано на Етапі D Прикладу 1, щоб мати титульну сполуку (1,05 г; 93%). MS[M+H] = 515 (M+1) Етап E: N-(4,4-дифторциклогексил)-2,2-диметил-N-{(3S,5S)-5-[(4-метилпіперазин-1іл)карбоніл]піролідин-3-іл}пропанамід (2S,4S)-1-BOC-4-[(4,4-дифторциклогексил)(2,2-диметилпропаноїл)аміно]-2-[(4метилпіперазин-1-іл)карбоніл]піролідин (1,05 г; 2,04 ммоль), одержаний на Етапі D, ввели в реакцію за тією ж методикою, яку було використано на Етапі E Прикладу 1, щоб мати титульну сполуку (845 мг, 99,9%). MS[M+H] = 415 (M+1) Етап F: N-{(3S,5S)-1-{[(3S,4R)-1-tert-бутил-4-(4-хлорфеніл)піролідин-3-іл]карбоніл}-5-[(4метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4-дифторциклогексил)-2,2диметилпропанамід, сіль TFA N-(4,4-дифторциклогексил)-2,2-диметил-N-{(3S,5S)-5-[(4-метилпіперазин-1-іл) карбоніл]піролідин-3-іл}пропанамід (845 мг; 2,04 ммоль), одержаний на Етапі E, і (3S,4R)-1-tбутил-4-(4-хлорфеніл)піролідин-3-карбонову кислоту, одержану в Методі приготування 12, ввели в реакцію за тією ж методикою, яку було використано на Етапі F Прикладу 1, щоб мати титульну сполуку як сіль TFA (1,18 г; 85%). MS[M+H] = 678 (M+1) 1 0 H ЯМР (500 МГц, ДМСО-d6, 140 С) δ 7,42-7,30 (m, 4H), 4,80-4,70 (br, 1H), 3,91-3,82 (m, 1H), 3,82-3,55 (m, 10H), 3,39-3,28 (m, 2H), 3,24-3,12 (m, 1H), 3,02-2,85 (m, 4H), 2,65 (s, 3H), 2,39-2,30 (m, 1H), 2,22-2,13 (br, 1H), 2,13-1,81 (m, 6H), 1,63-1,56 (m, 1H), 1,56-1,48 (m, 1H), 1,38 (s, 9H), 1,17 (s, 9H). Приклади 27-31 Сполуки в Методах приготування 1-23 вводились в реакцію за тією ж методикою, що була використана в Прикладах 1-4, 26, щоб отримати сполуки наступних Прикладів. 27 UA 99555 C2 O O N N R3 N N N O R5 R2' F F 2’ 3 Приклад R 27 28 29 30 4-Cl 4-Cl 4-Cl 2,4-diF Me Et i-Pr Me 31 4-Cl 5 Me R R Me Me Me t-Bu MS (M+1) 636 650 664 680 H 692 O 5 Приклад 32: (2S)-N-{(3S,5R)-1-{[(3S,4R)-1-tert-бутил-4-(2,4-дифторфеніл) іл]карбоніл}-5-[(4-метилпіперазин-1-іл)карбоніл]піролідин-3-іл}-N-(4,4диметилциклогексил)тетрагідрофуран-2-карбоксамід, сіль TFA Сіль TFA (трифтороцтової кислоти) піролідин-3 10 15 20 25 30 35 Етап A: Метил (2R,4S)-1-BOC-4-[(4,4-диметилциклогексил)аміно]піролідин-2-карбоксилат Метил (2R,4S)-1-Boc-4-амінопіролідин-2-карбокссилат (1,07 г; 4,38 ммоль), одержаний в Методі приготування 2, і 4,4-диметилциклогексанон (0,66 г; 5,25 ммоль) розчинили в DCE (20 мл) і до цього додали NaBH(OAc)3 (1,39 г; 6,57 ммоль) при кімнатній температурі. Реакційний розчин перемішували впродовж 4 годин при кімнатній температурі і екстрагували з використанням DCM (50 мл X 2) і EtOAc. Екстрагований органічний розчин промили розсолом, висушили над MgSO4, профільтрували і концентрували in vacuo. Одержаний залишок очистили за допомогою колонкової хроматографії (елюент, EtOAc/Hex = 1/2), щоб мати титульну сполуку (1,16 г; 75%). MS[M+H] = 355 (M+1) Етап B: Метил (2R,4S)-1-BOC-4-{(4,4-диметилциклогексил)[(2S)-тетрагідрофуран-2ілкарбоніл]аміно}піролідин-2-карбоксилат Метил (2R,4S)-1-BOC-4-[(4,4-диметилциклогексил)аміно]піролідин-2-карбоксилат (1,16 г; 3,27 ммоль), одержаний на Етапі A, ввели в реакцію за тією ж методикою, яку було використано на Етапі A Прикладу 3, щоб мати титульну сполуку (1,21 г; 82%). MS[M+H] = 453 (M+1) Етап C: (4S)-1-BOC-4-{(4,4-диметилциклогексил)[(2S)-тетрагідрофуран-2-ілкарбоніл]аміно}D-пролін Метил (2R,4S)-1-BOC-4-{(4,4-диметилциклогексил)[(2S)-тетрагідрофуран-2ілкарбоніл]аміно}піролідин-2-карбоксилат (1,21 г; 2,67 ммоль), одержаний на Етапі B, ввели в реакцію за тією ж методикою, яку було використано на Етапі C Прикладу 1, щоб мати титульну сполуку (1,14 г; 97%). MS[M+H] = 439 (M+1) Етап D: (2R,4S)-1-BOC-4-{(4,4-диметилциклогексил)[(2S)-тетрагідрофуран-2ілкарбоніл]аміно}-2-[(4-метилпіперазин-1-іл)карбоніл]піролідин 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMelanocortin receptor agonists
Автори англійськоюLee, Koo, Lee, Sang Dae, Moon, Sang Pil, Ahn, In Ae, Choi, Sung Pil, Lee, Hyun Ho, Shim, Dong Sup, Chung, Soo Yong, Lee, Hyun Min
Назва патенту російськоюАгонисты рецептора меланокортина
Автори російськоюЛи Коо, Ли Санг Дае, Моон Санг Пил, Ахн Ин Ае, Чой Сунг Пил, Ли Хьюн Хо, Шим Донг Сап, Чанг Соо Йонг, Ли Хьюн Мин
МПК / Мітки
МПК: C07D 403/14
Мітки: меланокортину, агоністи, рецептора
Код посилання
<a href="https://ua.patents.su/48-99555-agonisti-receptora-melanokortinu.html" target="_blank" rel="follow" title="База патентів України">Агоністи рецептора меланокортину</a>
Попередній патент: Ткана еластична стрічка
Наступний патент: Спіральне свердло
Випадковий патент: Механізм петлеутворення багатосистемної двофонтурної круглов'язальної машини












