Заміщені сполуки піразолу як антагоністи рецепторів лізофосфатидної кислоти (lpar)
Номер патенту: 109867
Опубліковано: 12.10.2015
Автори: Гамільтон Метью Майкл, Цянь Імінь, Сіддурі Ачютарао, Гебріель Стівен Дімс
Формула / Реферат
1. Сполука формули (І):
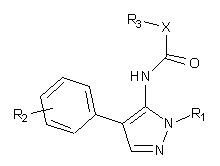 , (I)
, (I)
де:
X позначає атом кисню, азоту або вуглецю;
R1 позначає нижчий алкіл;
R2 позначає атом водню, атом галогену, -СН2С(О)ОН, алкокси, циклоалкілкарбонову кислоту, незаміщений феніл або феніл, заміщений атомом галогену, -СН2С(О)ОН, циклопропанкарбоновою кислотою, етиловим ефіром циклопропанкарбонової кислоти, метансульфоніламінокарбонілом або тетразолом; і
R3 позначає циклобутил, оксетаніл, незаміщений нижчий алкіл, нижчий алкіл, заміщений незаміщеним фенілом, або нижчий алкіл, заміщений фенілом, заміщеним атомом галогену або -CF3,
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, де X позначає атом кисню.
3. Сполука за п. 1, де R1 позначає метил.
4. Сполука за п. 1, де R2 позначає атом водню, F, Сl, -СН2С(О)ОН, метокси, етокси, циклопропанкарбонову кислоту, циклогексаноцтову кислоту або незаміщений феніл.
5. Сполука за п. 1, де R2 позначає феніл, заміщений -СН2С(О)ОН, циклопропанкарбоновою кислотою або етиловим ефіром циклопропанкарбонової кислоти.
6. Сполука за п. 1, де R3 позначає циклобутил, оксетаніл або незаміщений нижчий алкіл.
7. Сполука за п. 1, де R3 позначає нижчий алкіл, заміщений фенілом, заміщеним F, Сl або -CF3.
8. Сполука за п. 1, де сполука вибрана з групи, що включає:
2-метил-4-феніл-2Н-піразол-3-ілкарбамінової кислоти (R)-1-фенілетиловий ефір;
{4'-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1Н-піразол-4-іл]дифеніл-4-іл}оцтову кислоту;
(2-метил-4-феніл-2Н-піразол-3-іл)карбамінової кислоти 1-(2-хлорфеніл)етиловий ефір;
1-{4'-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонової кислоти етиловий ефір;
1-{4'-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонову кислоту;
1-(4'-{5-[1-(2-хлорфеніл)-етоксикарбоніламіно]-1-метил-1Н-піразол-4-іл}дифеніл-4-іл)циклопропанкарбонову кислоту;
(4-дифеніл-4-іл-2-метил-2Н-піразол-3-іл)карбамінової кислоти (R)-1-фенілетиловий ефір;
[4-(4-метоксифеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти (R)-1-фенілетиловий ефір;
1-{4-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1Н-піразол-4-іл]феніл}циклопропанкарбонову кислоту;
{4-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1Н-піразол-4-іл]феніл}оцтову кислоту;
[4-(4-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти 1-(2-хлорфеніл)етиловий ефір;
[4-(2-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти 1-(3-трифторметилфеніл)етиловий ефір;
[4-(2-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти 1-(2-хлорфеніл)етиловий ефір;
(R)-1-{4'-[5-(втор-бутоксикарбоніламіно)-1-метил-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонову кислоту;
(R)-1-{4'-[5-(1,2-диметилпропоксикарбоніламіно)-1-метил-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонову кислоту;
(R)-1-{4'-[5-((1-(2-фторфеніл)етокси)карбоніламіно)-1-метил-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонову кислоту;
(R)-1-{4'-[1-метил-5-((1-(3-(трифторметил)феніл)етокси)карбоніламіно)-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонову кислоту;
1-{4'-[5-((1-(4-фторфеніл)етокси)карбоніламіно)-1-метил-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонову кислоту;
1-{4'-[5-(циклобутоксикарбоніламіно)-1-метил-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонову кислоту;
1-{4'-[1-метил-5-((оксетан-3-ілокси)карбоніламіно)-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонову кислоту;
[4-(2-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти (R)-1-(2-хлорфеніл)етиловий ефір;
[4-(2-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти (S)-1-(2-хлорфеніл)етиловий ефір;
[4-(2-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти (R)-1-(3-трифторметилфеніл)етиловий ефір;
1-{4'-[5-(3-бензилуреїдо)-1-метил-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонову кислоту або
1-{4'-[1-метил-5-((S)-3-фенілбутириламіно)-1Н-піразол-4-іл]дифеніл-4-іл}-циклопропанкарбонову кислоту.
9. Сполука за будь-яким з пп. 1-8 для застосування як терапевтично активної речовини.
10. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-8 і терапевтично інертний носій.
11. Застосування сполуки за будь-яким з пп. 1-8 для лікування або профілактики фіброзу легенів.
12. Застосування сполуки за будь-яким з пп. 1-8 для одержання лікарського засобу для лікування або профілактики фіброзу легенів.
13. Сполука за будь-яким з пп. 1-8 для лікування або профілактики фіброзу легенів.
14. Спосіб лікування або профілактики фіброзу легенів, за яким пацієнту, що потребує цього, вводять ефективну кількість сполуки за будь-яким з пп. 1-8.
Текст
Реферат: У даному винаході запропоновано сполуку формули (І): , (I) UA 109867 C2 (12) UA 109867 C2 а також її фармацевтично прийнятні солі, де замісники є такими, як розкрито в описі. Дані сполуки та фармацевтичні композиції, що їх містять, корисні в лікуванні запальних захворювань та розладів, таких як, наприклад, фіброз легенів. R 3 X H R 2 O N N N R 1 UA 109867 C2 5 10 15 20 25 30 Даний винахід відноситься до органічних сполук, корисних для терапії та/або профілактики у ссавця запального захворювання або розладу, і, зокрема, до заміщених сполук, до їх одержання, до фармацевтичних композицій, що їх містять, і до їх застосування як антагоністів лізофосфатидної кислоти (LPA; від англ. “lysophosphatidic acid”). LPA є сімейством біоактивних фосфатних ліпідів, функція яких подібна медіатору фактора зростання за допомогою взаємодії рецепторів LPA, що відносяться до сімейства рецепторів, зв'язаних з G-білком (GPCR; від англ. “G-protein-coupled receptors”). Це сімейство ліпідів має довголанцюгові насичені (такі як C18:0 або C16:0) або ненасичені (C18:1 або C20:4) вуглецеві ланцюги, приєднані до гліцерину за допомогою складноефірного зв'язку. У біологічних системах LPA продукується багатоступінчастими ферментативними біохімічними шляхами за допомогою деетерифікації мембранних фосфоліпідів. Ферменти, що беруть участь в синтезі LPA, включають лізофосфоліпазу D (lysopld; від англ. “lysophospholipase D”), аутотаксин (ATX; від англ. “autotaxin”), фосфоліпазу A1 (PLA1; від англ. “phospholipase A1”), фосфоліпазу A2 (PLA2) і ацилгліцеринкіназу (AGK; від англ. “acylglycerol kinase”) (British J. of Pharmacology 2012, 165, 829-844). Ідентифіковано щонайменше шість рецепторів LPA (LPAR1-6). Передача сигналу LPA проявляє широкий ряд біологічних відповідей на багатьох різних типів клітин, які можуть привести до клітинного зростання, клітинної проліферації, міграції клітин і скорочення клітин. Підвищувальна регуляція біохімічного шляху LPA пов'язана з безліччю захворювань, що включають рак, алергічне запалення дихальних шляхів і фіброз нирки, легені і печінки. Отже, направлена дія на рецептори LPA або на метаболічні ферменти LPA могло б забезпечити нові підходи до лікування захворювань, значущих для медицини, що включають нейропсихіатричні розлади, невропатичний біль, безпліддя, серцево-судинне захворювання, запалення, фіброз і рак (Annu. Rev. Pharmacol. Toxicol. 2010, 50, 157-186; J. Biochem. 2011, 150, 223-232). Фіброз є результатом неконтрольованого процесу загоєння тканини, що приводить до надмірного накопичення позаклітинного матриксу (ПКМ). Нещодавно повідомлено, що рецептор LPA1 проявляє гіперекспресію у пацієнтів з ідіопатичним легеневим фіброзом (ІЛФ). Нокаутмиши за рецептором LPA1 були захищені від фіброзу легенів, індукованого блеоміцином (Nature Medicine 2008, 14, 45-54). Таким чином, антагонізация рецептора LPA1 може бути корисна для лікування фіброзу, такого як нирковий фіброз, легеневий фіброз, артеріальний фіброз і системний склероз. У втіленні даного винаходу запропоновані сполуки загальної формули (I): R3 X HN N N R2 35 40 45 50 O R1 (I), де: X позначає атом кисню, азоту або вуглецю; R1 позначає нижчий алкіл; R2 позначає атом водню, атом галогену, -CH2C(O)OH, алкокси, циклоалкілкарбонову кислоту, незаміщений феніл або феніл, заміщений атомом галогену, -CH2C(O)OH, циклопропанкарбоновою кислотою, циклопропанкарбонової кислоти етиловим ефіром, метансульфоніламінокарбонілом або тетразолом; і R3 позначає циклобутил, оксетаніл, незаміщений нижчий алкіл, нижчий алкіл, заміщений незаміщеним фенілом, або нижчий алкіл, заміщений фенілом, заміщеним атомом галогену або CF3, або їх фармацевтично прийнятна сіль. У наступному втіленні винаходу запропонована фармацевтична композиція, що містить терапевтично ефективну кількість сполуки формули (I) і терапевтично інертний носій. У наступному втіленні винаходу запропонований спосіб лікування або профілактики фіброзу легенів, що включає стадію введення терапевтично ефективної кількості сполуки формули (I) пацієнтові, що потребує цього. Всі документи, які цитуються і на які посилаються нижче, явним чином включені в даний винахід за допомогою посилання. Якщо не вказане інше, наступні конкретні терміни і вирази, використовувані в описі і у формулі винаходу, визначені, як описано нижче: 1 UA 109867 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як використовують в даному винаході, термін “алкіл”, окремо або в комбінації з іншими групами, відноситься до розгалуженого або прямоланцюгового одновалентного насиченого аліфатичного вуглеводневого радикала з атомів вуглецю в кількості від одного до двадцяти, переважно від одного до шістнадцяти атомів вуглецю, переважніше від одного до десяти атомів вуглецю. Термін “нижчий алкіл”, окремо або в комбінації з іншими групами, відноситься до розгалуженого або прямоланцюгового алкільного радикала з атомів вуглецю в кількості від одного до дев'яти, переважно від одного до шести атомів вуглецю, переважніше від одного до чотирьох атомів вуглецю. Даний термін додатково проілюстрований радикалами, такими як метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, ізобутил, трет-бутил, н-пентил, 3метилбутил, н-гексил, 2-етилбутил і тому подібне. Термін “циклоалкіл” відноситься до одновалентного моно- або полікарбоциклічного радикала з атомів вуглецю в кількості від трьох до десяти, переважно від трьох до шести атомів вуглецю. Даний термін додатково проілюстрований радикалами, такими як циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, норборніл, адамантил і тому подібне. У переважному втіленні винаходу “циклоалкільні” угрупування можуть бути необов'язково заміщені одним, двома, трьома або чотирма замісниками, розуміючи, що дані замісники, у свою чергу, не заміщені додатково. Кожен замісник може незалежно бути алкілом, алкокси, атомом галогену, аміно, гідроксилом або атомом кисню (O=), якщо конкретно не вказане інше. Приклади циклоалкільних угрупувань включають, але не обмежені ними, необов'язково заміщений циклопропіл, необов'язково заміщений циклобутил, необов'язково заміщений циклопентил, необов'язково заміщений циклопентеніл, необов'язково заміщений циклогексил, необов'язково заміщений циклогексилен, необов'язково заміщений циклогептил і тому подібне, або угрупування, конкретно проілюстровані в даному винаході. Термін “гетероциклоалкіл” означає моно- або поліциклічне алкільне кільце, де один, два або три з кільцевих атомів вуглецю заміщено гетероатомом, таким як N, O або S. Приклади гетероциклоалкільних груп включають, але не обмежені ними, морфолініл, тіоморфолініл, піперазиніл, піперидиніл, піролідиніл, тетрагідропіраніл, тетрагідрофураніл, 1,3-діоксаніл і тому подібне. Гетероциклоалкільні групи можуть бути незаміщеними або заміщеними, і приєднання може проходити через їх вуглецевий каркас або через їх гетероатом (гетероатоми), де це доцільно, розуміючи, що дані замісники, у свою чергу, не заміщені додатково. Термін “арил” відноситься до ароматичного моно- або полікарбоциклічного радикала з атомів вуглецю в кількості від 6 до 12, який має щонайменше одне ароматичне кільце. Приклади таких груп включають, але не обмежені ними, феніл, нафтил, 1,2,3,4тетрагідронафталін, 1,2-дигідронафталін, інданіл, 1H-інденіл і тому подібне. Термін "гетероарил" відноситься до ароматичного моно- або полікарбоциклічного радикала з атомів вуглецю в кількості від 5 до 12, який має щонайменше одне ароматичне кільце, що містить один, два або три кільцеві гетероатоми, вибраних з N, O і S, де решта кільцевих атомів є C. Приклади таких груп включають, але не обмежені ними, піридин, тіазол і піраніл. Алкільні, нижчі алкільні, арильні і гетероарильні групи, описані вище, можуть бути заміщені незалежно одним, двома або трьома замісниками, розуміючи, що дані замісники, у свою чергу, не заміщені додатково. Замісники можуть включати, наприклад, атом галогену, нижчий алкіл CF3, - SO2CH3, алкокси, -C(O)CH3, -OH, -SCH3 і -CH2CH2OH. Як використовують в даному винаході, термін “алкокси” означає алкіл-O-; і “алкоїл” означає алкіл-CO-. Групи замісників алкокси або групи замісників, що містять алкокси, можуть бути заміщені, наприклад, однією або більше алкільними групами, розуміючи, що дані замісники, у свою чергу, не заміщені додатково. Як використовують в даному винаході, термін “атом галогену” означає радикал фтору, хлору, брому або йоду, переважно радикал фтору, хлору або брому і переважніше радикал фтору або хлору. Сполуки формули I можуть мати один або більше асиметричних атомів вуглецю і можуть існувати у формі оптично чистих енантіомерів, сумішей енантіомерів, таких як, наприклад, рацемати, оптично чистих діастереоізомерів, сумішей діастереоізомерів, діастереоізомерних рацематів або сумішей діастереоізомерних рацематів. Оптично активні форми можуть бути одержані, наприклад, шляхом розділення рацематів, шляхом асиметричного синтезу або асиметричної хроматографії (хроматографії з хіральними адсорбентами або елюєнтами). У винахід включені всі ці форми. Як використовують в даному винаході, термін “фармацевтично прийнятна сіль” означає будь-яку фармацевтично прийнятну сіль сполуки формули (I). Солі можуть бути одержані з фармацевтично прийнятних нетоксичних кислот і основ, що включають неорганічні і органічні 2 UA 109867 C2 5 10 15 20 25 30 35 40 45 50 55 кислоти і основи. Такі кислоти включають, наприклад, наступні кислоти: оцтову, бензолсульфонову, бензойну, камфорсульфонову, лимонну, етенсульфонову, дихлороцтову, мурашину, фумарову, глюконову, глутамінову, гіпурову, бромисто-водневу, соляну, ізетіонову, молочну, малеїнову, яблучну, мигдальну, метансульфонову, муконову, азотну, щавлеву, памову, пантотенову, фосфорну, янтарну, сірчану, винну, пара-толуолсульфонову і тому подібне. Особливо переважні наступні кислоти: фумарова, соляна, бромисто-воднева, фосфорна, янтарна, сірчана і метансульфонова. Прийнятні солі основ включають солі лужних металів (наприклад, натрію, калію), лужноземельних металів (наприклад, кальцію, магнію) і алюмінію. На практиці способу за даним винаходом ефективна кількість будь-якї з сполук за даним винаходом або комбінації будь-яких із сполук за даним винаходом або їх фармацевтично прийнятних солей вводять за допомогою будь-якого із звичайних і прийнятних способів, відомих в даній області техніки, або окремо, або в комбінації. Сполуки або композиції можна, таким чином, вводити перорально (наприклад, в букальну порожнину), під'язиковим шляхом, парентерально (наприклад, внутрішньом'язово, внутрішньовенно або підшкірно), ректально (наприклад, за допомогою суппозіторіїв або промивань), черезшкірно (наприклад, шляхом електропорації шкіри) або шляхом інгаляції (наприклад, аерозолем) в твердих, рідких або газоподібних дозованих формах, включаючи пігулки і суспензії. Введення можна здійснювати в одноразовій стандартній дозованій формі у вигляді постійної терапії або у вигляді терапії одноразовою дозою за потребою. Терапевтична композиція може також знаходитися у формі масляної емульсії або дисперсії у поєднанні з ліпофільною сіллю, такою як памова кислота, або у формі біорозкладаної композиції пролонгованого вивільнення для підшкірного або внутрішньом'язового введення. Корисні фармацевтичні носії для одержання композицій за даним винаходом можуть бути твердими речовинами, рідинами або газами. Таким чином, композиції можуть приймати форму пігулок, пілюль, капсул, суппозіторіїв, порошків, препаратів з ентеросолюбільним покриттям або інших захищених препаратів (наприклад, зв'язаних на іонообмінних смолах або упакованих в ліпопротеїнові везикули), препаратів пролонгованого вивільнення, розчинів, суспензій, еліксирів, аерозолів і тому подібного. Носій може бути вибраний з різних масел, включаючи масла нафтового, тваринного, рослинного або синтетичного походження, наприклад, арахісового масла, соєвого масла, мінерального масла, кунжутного масла і тому подібного. Переважними рідкими носіями є наступні носії: вода, фізіологічний розчин, водний розчин декстрози та гліколі, зокрема (при ізотонічності з кров'ю) для ін'єкційних розчинів. Наприклад, препарати для внутрішньовенного введення включають стерильні водні розчини активного інгредієнта (інгредієнтів), одержані шляхом розчинення твердого активного інгредієнта (інгредієнтів) у воді з одержанням водного розчину і надання цьому розчину стерильності. Відповідні фармацевтичні ексципієнти включають крохмаль, целюлозу, тальк, глюкозу, лактозу, желатин, солод, рис, муку, крейду, кремнезем, стеарат магнію, стеарат натрію, гліцеринмоностеарат, хлорид натрію, сухе знежирене молоко, гліцерин, пропіленгліколь, воду, етанол і тому подібне. Композиції можуть включати традиційні фармацевтичні добавки, такі як консерванти, стабілізуючі агенти, зволожуючі або емульгуючі агенти, солі для регуляції осмотичного тиску, буфери і тому подібне. Відповідні фармацевтичні носії та їх одержання описані в кн. Remington's Pharmaceutical Sciences by E. W. Martin. Такі композиції у будь-якому випадку містять ефективну кількість активної сполуки разом з відповідним носієм, щоб одержати точну дозовану форму для точного введення реципієнтові. Доза сполуки за даним винаходом залежить від ряду факторів, таких як, наприклад, шлях введення, вік і маса тіла суб'єкта і стан суб'єкта, що підлягає лікуванню, і, зрештою, буде визначена лікарем-куратором або ветеринаром. Таку кількість активної сполуки, яка визначена лікарем-куратором або ветеринаром, в даному описі і у формулі винаходу називають “терапевтично ефективною кількістю". Наприклад, доза сполуки за даним винаходом в характерному випадку знаходиться в діапазоні від приблизно 1 до приблизно 1000 мг на добу. Переважно терапевтично ефективною кількістю є кількість, що становить від приблизно 1 мг до приблизно 500 мг на добу. В одному втіленні даного винаходу запропоновано сполуку формули (I), де X позначає атом кисню. В іншому втіленні винаходу запропоновано сполуку формули (I), де R1 позначає метил. В іншому втіленні винаходу запропоновано сполуку формули (I), де R2 позначає атом водню, -F, -Cl, -CH2C(O)OH, метокси, етокси, циклопропанкарбонову кислоту, незаміщений феніл або циклогексаноцтову кислоту. 3 UA 109867 C2 5 10 15 20 25 30 35 40 45 50 55 В іншому втіленні винаходу запропоновано сполуку формули (I), де R2 позначає феніл, заміщений -CH2C(O)OH, циклопропанкарбонову кислоту або циклопропанкарбонової кислоти етиловий ефір. В іншому втіленні винаходу запропоновано сполуку формули (I), де R3 позначає циклобутил, оксетаніл або незаміщений нижчий алкіл. В іншому втіленні винаходу запропоновано сполуку формули (I), де R3 позначає нижчий алкіл, заміщений фенілом, заміщеним -F, -Cl або -CF3. В іншому втіленні винаходу запропоновано сполуку формули (I), де X позначає атом кисню; R1 позначає нижчий алкіл; R2 позначає феніл, заміщений атомом галогену, -CH2C(O)OH, циклопропанкарбонову кислоту, циклопропанкарбонової кислоти етиловий ефір, метансульфоніламінокарбоніл або тетразол; і R3 позначає нижчий алкіл, заміщений фенілом, заміщеним атомом галогену або -CF3, або її фармацевтично прийнятна сіль. В іншому втіленні винаходу запропоновано сполуку формули (I), де X позначає атом кисню; R1 позначає метил; R2 позначає феніл, заміщений циклопропанкарбоновою кислотою; і R3 позначає нижчий алкіл, заміщений фенілом, заміщеним атомом галогену або -CF3, або її фармацевтично прийнятна сіль. Конкретні сполуки формули (I) включають наступні сполуки: 2-Метил-4-феніл-2H-піразол-3-іл-карбамінової кислоти (R)-1-феніл-етиловий ефір; {4'-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}-оцтову кислоту; (2-Метил-4-феніл-2H-піразол-3-іл)-карбамінової кислоти 1-(2-хлор-феніл)-етиловий ефір; 1-{4'-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонової кислоти етиловий ефір; 1-{4'-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонову кислоту; 1-(4'-{5-[1-(2-Хлор-феніл)-етоксикарбоніламіно]-1-метил-1H-піразол-4-іл}-дифеніл-4-іл)циклопропанкарбонову кислоту; (4-Дифеніл-4-іл-2-метил-2H-піразол-3-іл)-карбамінової кислоти (R)-1-феніл-етиловий ефір; [4-(4-Метокси-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти (R)-1-феніл-етиловий ефір; 1-{4-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-феніл}циклопропанкарбонову кислоту; {4-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-феніл}-оцтову кислоту; [4-(4-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти 1-(2-хлор-феніл)-етиловий ефір; [4-(2-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти 1-(3-трифторметил-феніл) етиловий ефір; [4-(2-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти 1-(2-хлор-феніл)-етиловий ефір; (R)-1-{4’-[5-(втор-Бутоксикарбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонову кислоту; (R)-1-{4’-[5-(1,2-Диметил-пропоксикарбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонову кислоту; (R)-1-{4’-[5-((1-(2-Фторфеніл)етокси)карбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонову кислоту; (R)-1-{4’-[1-Метил-5-((1-(3-(трифторметил)феніл)етокси)карбоніламіно)-1H-піразол-4-іл]дифеніл-4-іл}-циклопропанкарбонову кислоту; 1-{4’-[5-((1-(4-Фторфеніл)етокси)карбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонову кислоту; 1-{4’-[5-(Циклобутоксикарбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонову кислоту; 1-{4’-[1-Метил-5-((оксетан-3-ілокси)карбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонову кислоту; [4-(2-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти (R)-1-(2-хлор-феніл)етиловий ефір; [4-(2-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти (S)-1-(2-хлор-феніл)етиловий ефір; [4-(2-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти (R)-1-(3-трифторметилфеніл)-етиловий ефір; 4 UA 109867 C2 5 10 15 20 25 30 35 40 45 50 55 1-{4'-[5-(3-Бензил-уреїдо)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}-циклопропанкарбонову кислоту; і 1-{4'-[1-Метил-5-((S)-3-феніл-бутириламіно)-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонову кислоту. В іншому втіленні винаходу запропоновано сполуку формули (I), вживану як терапевтично активну речовину. В іншому втіленні винаходу запропонована фармацевтична композиція, що містить терапевтично ефективну кількість сполуки формули (I) і терапевтично інертний носій. В іншому втіленні винаходу запропоновано застосування сполуки формули (I) для лікування або профілактики фіброзу легенів. В іншому втіленні винаходу запропоновано застосування сполуки формули (I) для одержання лікарського засобу для лікування або профілактики фіброзу легенів. В іншому втіленні винаходу запропоновано сполуку формули (I) для лікування або профілактики фіброзу легенів. В іншому втіленні винаходу запропоновано сполуку формули (I), одержану способом, описаним нижче. В іншому втіленні винаходу запропонований спосіб лікування або профілактики фіброзу легенів, що включає стадію введення терапевтично ефективної кількості сполуки формули (I) пацієнтові, що потребує цього. В іншому втіленні винаходу запропонований винахід, як описано нижче. Зрозуміло, що сполуки загальної формули I за даним винаходом можуть бути дериватизовані на функціональних групах з одержанням похідних, здібних до зворотного перетворення в початкову сполуку in vivo. Фізіологічно прийнятні і метаболічно лабільні похідні, здібні до утворення початкових сполук загальної формули I in vivo, також знаходяться в межах об'єму даного винаходу. Сполуки за даним винаходом можуть бути одержані, починаючи з наявних в продажі початкових речовин, або використовуючи загальні методи і операції синтезу, відомі фахівцям в даній області техніки. Хімічні речовини можна придбати у фірм, таких як, наприклад, Aldrich, Argonaut Technologies, VWR, Lancaster, Princeton, Alfa, Oakwood, TCI, Fluorochem, Apollo, Matrix, Maybridge або Meinoah. Матеріали та устаткування для хроматографії можна придбати у таких фірм, як Analogix, Inc, Burlington, WI; Biotage AB, Charlottesville, VA; Analytical Sales and Services, Inc., Pompton Plains, NJ; Teledyne Isco, Lincoln, NE; VWR International, Bridgeport, NJ; Varian Inc., Palo Alto, CA і Multigram II Mettler Toledo Instrument Newark, DE. Колонки Biotage, ISCO і Analogix є колонками, попередньо набитими силікагелем, використовуваними в стандартній хроматографії. Кінцеві сполуки і проміжні сполуки були названі, використовуючи параметр AutoNom2000 в додатку MDL ISIS Draw. Даний винахід також направлений на введення терапевтично ефективної кількості сполуки формули I в комбінації або в асоціації з іншими лікарськими засобами або активними агентами для лікування запальних або алергічних захворювань і розладів. В одному втіленні даний винахід відноситься до способу лікування та/або попередження таких захворювань або розладів, що включає введення людині або тварині одночасно, послідовно або окремо терапевтично ефективної кількості сполуки формули I та іншого лікарського засобу або активного агента (такого як інший протизапальний або протиалергічний лікарський засіб або агент). Ці інші лікарські засоби або активні агенти можуть володіти однаковим, подібним або повністю різним механізмом дії. Відповідні інші лікарські засоби або активні агенти можуть включати, але не обмежені ними, наступні лікарські засоби або активні агенти: бета-2адренергічні агоністи, такі як альбутерол або салметерол; кортикостероїди, такі як дексаметазон або флутиказон; антигістамінні засоби, такі як лоратадин; антагоністи лейкотрієнів, такі як монтелукаст або зафірлукаст; терапії, направлені проти антитіла проти IgE, такі як омалізумаб; протиінфекційні засоби, такі як фузідова кислота (зокрема, для лікування атопічного дерматиту); протигрибкові засоби, такі як клотримазол (зокрема, для лікування атопічного дерматиту); імуносупресанти, такі як такролімус і пімекролімус; інші антагоністи простагландину D2 (PGD2), що діють при інших рецепторах, такі як антагоністи DP; інгібітори фосфодіестерази типу 4, такі як циломіласт; лікарські засоби, що модулюють продукування цитокінів, такі як інгібітори TNF-альфа-перетворюючого ферменту (TACE); лікарські засоби, що модулюють активність Th2-цитокінів та інтерлейкіну (ІЛ)-4 і ІЛ-5, такі як блокуючі моноклональні антитіла і розчинні рецептори; агоністи рецептора, що активується проліфератором пероксисом (PPAR; від англ. “peroxisome proliferator activated receptor”) гамма, такі як розіглітазон; та інгібітори 5-ліпоксигенази, такі як зілейтон. 5 UA 109867 C2 5 10 15 20 25 Сполуки за даним винаходу можуть бути одержані будь-якими традиційними способами. Відповідні способи синтезу цих сполук наведені в прикладах. В цілому сполуки формули I можуть бути одержані відповідно до схем, проілюстрованих нижче. Наприклад, певні сполуки за винаходом можуть бути одержані, використовуючи метод, зображений на схемі 1. Схема 1 Як описано на схемі 1, бром-заміщену N-алкілпіразолкарбонову кислоту (1), де R1 може позначати нижчу алкільну групу, можна етерифікувати в кислих умовах з одержанням відповідного метилового ефіру (2). Сполука (1) може бути 4-бром-2-метил-2H-піразол-3карбоновою кислотою. В умовах каталізованого паладієм поєднання Сузукі сполука (3) може бути утворена шляхом взаємодії сполуки (2) з бороновою кислотою, де R2 може позначати алкільні, арильні групи, атом галогену і алкоксигрупи. В результаті гідролізу сполуки (3) в основних умовах можна одержати відповідну карбонову кислоту (4), яку можна перетворити в карбамат (5) в умовах реакції перегрупування Курциуса, де R3 може позначати алкільні, циклоалкільні або арил-заміщені алкільні групи. Схема 2 Альтернативно, як описано на схемі 2, бром-заміщений N-алкіл-амінопіразол (6) можна піддавати поєднанню з арилбороновою кислотою в умовах паладієвого каталізу з одержанням сполуки (7), де R1 може позначати нижчі алкільні групи, такі як метил, а R2 може позначати алкільні, арильні групи, атом галогену і алкоксигрупи. Арил-заміщену амінопіразольну проміжну сполуку (7) можна піддавати взаємодії з трифосгеном і заміщеними спиртами в основних умовах з одержанням карбамату (5), де R3 може позначати алкільні, циклоалкільні або арилзаміщені алкільні групи. Схема 3 6 UA 109867 C2 5 10 15 20 25 Альтернативно, як описано на схемі 3, сполуку (1) можна піддавати взаємодії із заміщеними спиртами в умовах перегрупування Курциуса з одержанням проміжного карбамату (8), де R1 може позначати нижчі алкільні групи, такі як метильна група, а R3 може позначати алкільні, циклоалкільні або арил-заміщені алкільні групи. В результаті поєднання сполуки (8) з арилбороновою кислотою в умовах паладієвого каталізу можна одержати бажану сполуку (5). Схема 4 У разі, коли необхідної арилборонової кислоти немає у продажу, одержання бажаної арилборонової кислоти описане на схемі 4. Похідні 4-бромфенілоцтової кислоти (9) можна піддавати взаємодії з 4-гідроксибороновою кислотою (10) в умовах поєднання Сузукі, де R1 може позначати метильну або етильну групу, R2 і R3 можуть позначати атом водню, нижчі алкільні групи, або R2 і R3 можуть бути з’єднані з утворенням кільця, такого як 3-членні, 4членні або 5-членні карбоциклічні кільця, і R4 може позначати атом водню, алкокси або атом галогену, такий як атом фтору. Біарилфенол (11) можна перетворити у відповідний трифлат (12) шляхом взаємодії з трифторметансульфоновим ангідридом. Перетворення трифлата сполуки (12) в циклічний боронат (13) може бути виконане шляхом взаємодії з біспінаколатодибораном в умовах паладієвого каталізу. Схема 5 З метою одержання похідних біарил-заміщених карбонових кислот (16) на схемі 5 карбамат (14) можна піддавати поєднанню з пінаколатоборатом (13) з одержанням проміжної сполуки біарил-заміщеного N-алкілпіразолу (15), де сполука (14) може мати таку ж структуру, як сполука (8), описана на схемі 3. Паладієвий каталізатор може бути ацетатом паладію у присутності фосфінового ліганда, такого як X-Phos. В результаті гідролізу сполуки (15) в основних умовах може бути одержана бажана карбонова кислота (16), де R2, R3 і R4 є такими, як визначено на схемі 4, R5 може позначати нижчу алкільну групу, таку як метильна група, і R6 може позначати алкільні, циклоалкільні або арил-заміщені алкільні групи. Схема 6 7 UA 109867 C2 5 10 15 20 Альтернативно, як описано на схемі 6, бром-заміщений N-алкіл-амінопіразол (17) можна піддавати поєднанню з біарил-заміщеним пінаколатоборатом (13) в умовах паладієвого каталізу з одержанням біарил-заміщеного амінопіразолу (18), де структура (17) може бути такою ж, як структура (6) на схемі 2. Умови поєднання можуть бути ацетатом паладію у присутності фосфінового ліганда, такого як X-Phos. Біарил-заміщений амінопіразол (18) можна дериватизувати до відповідного карбамату (15) шляхом взаємодії із заміщеним спиртом у присутності трифосгену. В результаті гідролізу складного ефіру (15) може бути одержана бажана карбонова кислота (16). Схема 7 Для одержання складних ефірів циклогексил-заміщених арилборонових кислот реакція описана на схемі 7. Сполука (19) може бути одержана відповідно до літературного методу (WO 2009/016462). Сполука (20) може бути одержана з відповідного бромфенолу, де R1 може позначати атом водню або атом фтору. В результаті поєднання сполуки (19) із сполукою (20) в умовах паладієвого каталізу може бути одержана сполука (21). В результаті гідрогенізації сполуки (21) може бути одержаний бажаний фенол (22), який можна перетворити у відповідний пінаколатоборат (23). Сполуку (23) можна піддавати поєднанню з бром-заміщеним амінопіразолом, як описано на схемі 6, з одержанням бажаної циклогексил- заміщеної карбонової кислоти. Схема 8 8 UA 109867 C2 5 10 15 Для одержання заміщеної гетероциклом арилборонової кислоти реакція описана на схемі 8. Похідні піперидин-оцтової кислоти (24) можуть бути у продажу або одержані відповідно до літератури. Для початкової речовини (24), де R2 може позначати метил, етил або трет-бутил, R3 і R4 можуть позначати атом водню або алкіл, R3 і R4 можуть бути сполучені з утворенням кільця, такого як тричленне карбоциклічне кільце. Для сполуки (24), де R3 і R4 сполучені з утворенням циклопропанового кільця, одержання може бути виконане відповідно до літературного методу (WO2008/053194). В умовах амінування Бухвальда - Хартвіга в результаті взаємодії (24) з (20) може бути одержаний заміщений гетероциклом арилфеноловий ефір (25), де R1 може позначати атом водню або атом фтору. В результаті гідрогенізації (25) з подальшим перетворенням фенолу (26) в пінаколатоборонат може бути одержаний бажаний складний ефір арилборонової кислоти (27). Сполуку (27) можна піддавати поєднанню з бром-заміщеним амінопіразолом, як описано на схемі 6, з одержанням бажаної заміщеної гетероциклом карбонової кислоти. Схема 9 9 UA 109867 C2 5 10 15 Одержання карбонілсульфонамідної похідної (37) описано на схемі 9. Наявна в продажі карбонова кислота (28) може бути перетворена у відповідний хлорангідрид (29) шляхом взаємодії з тіонілхлоридом, де R3 в (28) може позначати атом водню або атом фтору, R4 і R5 можуть бути з’єднані з утворенням 3- або 4-членного карбоциклічного кільця. Сполука (29) може бути перетворена в карбонілсульфонамідну похідну (30) шляхом взаємодії з метансульфонамідом. Похідну бромпіразолу (2) можна піддавати взаємодії з 4бензилоксифенілбороновою кислотою (31) в умовах поєднання Сузукі з одержанням (32). Гідрогенізація (32), що каталізується паладієм, може привести до бажаної фенольної похідної (33), яка може бути перетворена у відповідний трифлат (34). В результаті подальшої взаємодії між трифлатом (34) і пінаколатодибораном в умовах паладієвого каталізу може бути одержана ключова проміжна боронатна похідна (35). В результаті поєднання між (35) і (30) в умовах поєднання Сузукі може бути одержана бажана дифенільна похідна (36), яку можна піддавати гідролізу в м'яких основних умовах, а потім перетворити у відповідний карбамат (37) в умовах перегрупування Курциуса. Схема 10 10 UA 109867 C2 5 10 15 20 25 Одержання тетразольної похідної (41) описано на схемі 10. В результаті взаємодії між боронатною проміжною сполукою (35) і наявним в продажі арилбромідом (38) в умовах поєднання Сузукі може бути одержана сполука (39). У м'яких основних умовах сполуку (39) можна піддавати гідролізу до відповідної карбонової кислоти, яку можна піддавати перегрупуванню Курциуса з одержанням сполуки (40). Обробка сполуки (40) азидотриметилсиланом і оксидом ди-н-бутилолова в нагрітому толуолі може привести до бажаного тетразолу (41). Схема 11 Нарешті, одержання сечовини (42) і карбоксаміду (43) описано на схемі 11. Проміжну сполуку (18) з схеми 6 можна піддавати взаємодії з трифосгеном і аміном з одержанням відповідної сечовини, яку можна піддавати гідролізу з одержанням бажаної сполуки (42). З тою же проміжною сполукою (18) карбоксамід (43) може бути одержаний за допомогою утворення аміду і гідролізу складного ефіру. ПРИКЛАДИ ЗДІЙСНЕННЯ ВИНАХОДУ Хоча в даному винаході зображені і описані певні ілюстративні втілення, сполуки за даним винаходом можуть бути одержані, використовуючи відповідні початкові речовини, згідно способам, в цілому описаним в даному винаході, та/або способами, доступними звичайному фахівцеві в даній області техніки. Визначення скорочень: DPPA: дифенілфосфорилазид (diphenylphosphorylazide); X-Phos: дициклогексил[2',4',6'-трис(1-метилетил)[1,1'-дифеніл]-2-іл]-фосфін; S-Phos: дициклогексил(2',6'диметокси[1,1'-дифеніл]-2-іл)-фосфін; ДМФ: диметилформамід; TEA: триетиламін (triethylamine); ТГФ: тетрагідрофуран; ТШХ: тонкошарова хроматографія; НРХ: надкритична рідинна хроматографія; ЕР+: електророзпилювання, позитивний заряд; EР-: електророзпилювання, негативний заряд. Приклад 1 2-Метил-4-феніл-2H-піразол-3-іл карбамінової кислоти (R)-1-феніл-етиловий ефір 11 UA 109867 C2 O O N N N 5 10 15 20 25 30 35 40 4-Бром-2-метил-2H-піразол-3-карбонову кислоту (6 г, 29,3 ммоль) додавали до 150 мл метанолу, обробленого тіонілхлоридом (3,5 г, 29,3 ммоль). Суміш кип'ятили із зворотним холодильником протягом 18 г. Розчинники випаровували, і залишок екстрагували дихлорметаном і 0,5 н. розчином гідроксиду натрію. Органічний шар промивали соляним розчином і висушували. Після випаровування розчинників було одержано білу тверду речовину (4,19 г, вихід 65,4%) було одержано як бажану сполуку 4-бром-2-метил-2H-піразол-3-карбонової 1 -1 кислоти метилового ефіру. H ЯМР (400 МГц, CDCl3) δ млн 3.97 (s, 3H), 4.19 (s, 3H), 7.51 (s, 1H).. Водний екстракт фільтрували і нейтралізували 1 н. соляною кислотою. Білу тверду речовину фільтрували і висушували з одержанням твердої непрореагованої речовини карбонової кислоти (1,51 г). Метил-4-бром-2-метил-2H-піразол-3-карбоксилат (438,1 мг, 2,0 ммоль), фенілборонову кислоту (244 мг, 2,0 ммоль) і карбонат цезію (1,3 г, 4,0 ммоль) розчиняли в ДМФ, і розчин дегазували аргоном. До цієї суміші додавали Pd(PPh3)4 (139 мг, 0,12 ммоль). Суміш перемішували при 80 °C протягом 12 г. Одержану в результаті суміш охолоджували до кімнатної температури і фільтрували. Тверду речовину промивали ТГФ. Фільтрат концентрували і очищали колоночною флеш-хроматографією ISCO (від 0% до 25% етилацетату в гексанах, 40 г силікагелю) з одержанням у вигляді маслянистої речовини метил-2-метил-4-феніл-2H-піразол1 -1 3-карбоксилату (388,6 мг, вихід 89,8%). H ЯМР (400 МГц, CDCl3) δ млн 3.77 (s, 3H), 4.21 (s, 3H), 7.31-7.36 (m, 1H), 7.37-7.42 (m, 4H), 7.52 (s, 1H); РХ/МС обчислене для C12H12N2O2 216,0, спостерігали 217,0 (M+H, ЕР+). Метил-2-метил-4-феніл-2H-піразол-3-карбоксилат (388,6 мг, 1,8 ммоль) розчиняли в ТГФ (8 мл) і додавали 0,5 н. розчин LiOH (4 мл). Суміш перемішували при 60 °C протягом 2 г, а потім концентрували. Залишок розчиняли у воді (30 мл) і фільтрували. Фільтрат нейтралізували 1 н. соляною кислотою, і білий осад фільтрували і висушували у вакуумній печі при 60 °C протягом 1 ночі з одержанням 2-метил-4-феніл-2H-піразол-3-карбонової кислоти (338,5 мг, вихід 93,1%). H -1 ЯМР (300 МГц, ДМСО-d6) δ млн 4.06 (s, 3H), 7.25-7.42 (m, 5H), 7.60 (s, 1H), 13.42 (s, 1H); РХ/МС обчислене для C11H10N2O2 202,0, спостерігали 201,0 (M-H, ЕР-). 2-Метил-4-феніл-2H-піразол-3-карбонову кислоту (100 мг, 0,495 ммоль) (R)-1-фенілетанол (60,4 мг, 0,495 ммоль), DPPA (136 мг, 0,495 ммоль) і TEA (100 мг, 0,989 ммоль) змішували з 3 мл толуолу. Суміш перемішували при 80 °C протягом 1 г. Розчинники випаровували, і залишок очищали колоночною флеш-хроматографією ISCO (40 г силікагелю, від 0% до 55% етилацетату в гексанах) з одержанням 2-метил-4-феніл-2H-піразол-3-іл карбамінової кислоти (R)-1-феніл1 етилового ефіру у вигляді білого порошку (106 мг, вихід 66,7%). H ЯМР (300 МГц, ДМСО-d6) δ -1 млн 1.13-1.29 (br, 0.7 H), 1.52 (d, J=5.8 Гц, 2.3 H), 3.60 (s, 3H), 5.58-5.82 (br m, 1H), 6.92-7.53 (m, 10H), 7.74 (s, 1H), 9.18 (br, 0.2H), 9.55 (s, 0.8H); РХ/МС обчислене для C19H19N3O2 321,0, спостерігали 320,0 (M-H, ЕР-). Приклад 2 {4'-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}-оцтова кислота O O N O N O N 45 4-Бром-2-метил-2H-піразол-3-карбонову кислоту (787,2 мг, 3,84 ммоль), DPPA (1,16 г, 4,22 ммоль) (R)-1-фенілетанол (491 мг, 4,02 ммоль) і TEA (1,10 мл, 7,68 ммоль) об'єднували в 15 мл толуолу з одержанням прозорого розчину. Суміш нагрівали до 80 °C і перемішували протягом 1 г. Розчинники випаровували, і залишок екстрагували етилацетатом і розчином бікарбонату натрію. Органічний шар висушували і випаровували з одержанням маслянистої речовини (1,38 12 UA 109867 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 г). ТШХ показала відсутність поглинання УФ. H-ЯМР неочищеної речовини показав 75% бажаної сполуки 4-бром-2-метил-2H-піразол-3-іл карбамінової кислоти (R)-1-феніл-етилового ефіру. РХ/МС обчислене для C13H14BrN3O2 (m/e) 324,0, спостерігали 323,0 (M-H, ЕР-). Етил-2-(4-бромфеніл)-ацетат (2,43 г, 10 ммоль), 4-гідроксифенілборонову кислоту (1,65 г, 1,20 екв.), Pd(PPh3)4 (693 мг, 0,06 екв.) і карбонат калію (2,76 г, 2,0 екв.) об'єднували в 14 мл безводного ДМФ. Суміш барботували азотом і запаювали. Суміш перемішували при 85 °C протягом 15 г. Розчинники випаровували, і залишок екстрагували етилацетатом і водою. Органічний шар промивали соляним розчином і висушували над сульфатом натрію. Розчинники випаровували, і залишок очищали колоночною флеш-хроматографією ISCO (від 5% до 50% етилацетату в гексанах). Чисті фракції об'єднували і концентрували. Залишок розчиняли в етилацетаті (4 мл) і додавали гарячі гексани. Білу тверду речовину фільтрували і висушували з одержанням 4’-гідрокси-дифеніл-4-іл оцтової кислоти етилового ефіру (1,68 г, вихід 65,6%). %). 1 -1 H ЯМР (400 МГц, CDCl3) δ млн 1.29 (t, J=7.1 Гц, 3H) 3.66 (s, 2H) 4.19 (q, J=7.1 Гц, 2H), 4.95 (br. s., 1 H), 6.87 (d, J=8.6 Гц, 2H), 7.33 (d, J=8.3 Гц, 2H) 7.47 (m, 4H); РХ/МС обчислене для C16H16O3 (m/e) 256,0, спостерігали 257,1 (M+H, ЕР+). Етил-2-(4'-гідроксидифеніл-4-іл)-ацетат (641 мг, 2,5 ммоль) розчиняли в дихлорметані (15 мл). До цього розчину додавали трифторметансульфоновий ангідрид (706 мг, 0,42 мл) при 78 °C. Додавали триетиламін (0,35 мл, 2,5 ммоль). Суміш перемішували при -78 °C протягом 10 хвилин і нагрівали до кімнатної температури. Через 30 хвилин ТШХ показала повну витрату початкової речовини. Суміш екстрагували водою і метиленхлоридом. Органічний шар промивали розбавленою соляною кислотою і концентрованим розчином бікарбонату натрію. Розчинники випаровували, і залишок обробляли гексанамі. Сіру кристалічну речовину фільтрували з одержанням 4’-трифторметансульфонілокси-дифеніл-4-іл оцтової кислоти 1 -1 етилового ефіру (812 мг, вихід 83,6%). H ЯМР (400 МГц, CDCl3) δ млн 1.29 (t, J=7.1 Гц, 3H), 3.68 (s, 2H), 4.19 (q, J=7.1 Гц, 2H), 7.35 (d, J=8.1 Гц, 2H), 7.39 (d, J=8.1 Гц, 2H), 7.53 (d, J=8.0 Гц, 2H), 7.64 (d, J=8.0 Гц, 2H). Етил-2-(4'-(трифторметилсульфонілокси)-дифеніл-4-іл)-ацетат (800 мг, 2,06 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі(1,3,2-діоксаборолан) (628 мг, 2,47 ммоль), ацетат калію (607 мг, 6,18 ммоль) і Pd(dppf)Cl2 (90,4 мг, 0,124 ммоль) об'єднували в безводному діоксані (15 мл). Суміш перемішували і барботували аргоном протягом 5 хвилин. Суміш нагрівали до 90 °C і перемішували протягом 4 г. ТШХ показала таке ж Rf, як початкова речовина. РХ/МС показала повну витрату початкової речовини і утворення бажаної сполуки. Суміш фільтрували через шар силікагелю і промивали етилацетатом. Розчинники випаровували, і залишок очищали колоночною флеш-хроматографією ISCO (40 г силікагелю, від 0% до 30% етилацетату в гексанах) з одержанням [4’-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-дифеніл-4-іл]-оцтової 1 кислоти етилового ефіру у вигляді білої твердої речовини (728 мг, вихід 96,5%). H ЯМР (400 -1 МГц, CDCl3) δ млн 1.28 (t, J=7.1 Гц, 3H), 1.37 (s, 12H), 3.67 (s, 2H), 4.18 (q, J=7.1 Гц, 2H), 7.37 (d, J=8.1 Гц, 2H), 7.60 (dd, J=8.0, 6.4 Гц, 4H), 7.88 (d, J=8.1 Гц, 2H). Ацетат паладію (12,5 мг, 0,055 ммоль), X-PHOS (CAS#564483-18-7, 52,9 мг, 0,11 ммоль) і триосновний фосфат калію (236 мг, 1,11 ммоль) змішували в 0,5 мл дегазованої води і 1 мл толуолу і перемішували протягом 1 хвилини. Потім додавали 4-бром-2-метил-2H-піразол-3-іл карбамінової кислоти (R)-1-феніл-етиловий ефір (180 мг, 0,55 ммоль) в 2 мл толуолу з подальшим додаванням [4’-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-дифеніл-4-іл]-оцтової кислоти етилового ефіру (203 мг, 0,55 ммоль) і 1 мл толуолу. Суміш дегазували аргоном і запаювали. Суміш перемішували при 95 °C протягом ночі. Одержану в результаті суміш екстрагували етилацетатом і водою. Органічний шар висушували і випаровували. Залишок очищали колоночною флеш-хроматографією ISCO (40 г силікагелю, етилацетат з 5% метанолом в гексанах) з одержанням (R)-етил-2-(4'-(1-метил-5-((1-фенілетокси)карбоніламіно)1H-піразол-4-іл)-дифеніл-4-іл)-ацетату (78,0 мг, вихід 29,1%) у вигляді аморфної речовини. РХ/МС обчислене для C29H29N3O4 (m/e) 483,0, спостерігали 484,1 (M+H, ЕР+). (R)-етил-2-(4'-(1-метил-5-((1-фенілетокси)карбоніламіно)-1H-піразол-4-іл)-дифеніл-4-іл)ацетат (78 мг, 0,161 ммоль) розчиняли в 6 мл ТГФ і додавали розчин гідроксиду літію (1 мл, 0,5 н.) з подальшим додаванням 0,2 мл метанолу. Суміш перемішували при кімнатній температурі протягом 4 г. ТШХ показала повну витрату початкової речовини. Суміш концентрували, а потім розчиняли в теплій воді (35 мл). Суміш перемішували і фільтрували. Фільтрат підкислювали 1 н. соляною кислотою (0,6 мл), і суміш фільтрували. Тверду речовину висушували у вакуумі протягом ночі з одержанням у вигляді блідо-жовтої твердої речовини {4'-[1-метил-5-((R)-1феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}-оцтової кислоти (30 мг, вихід 40,8%). 1 -1 H ЯМР (400 МГц, ДМСО-d6) δ млн 1.15-1.32 (br, 0.6H), 1.56 (d, J=5.8 Гц, 2.4H), 3.62 (s, 2H), 3.63 (s, 3H), 5.66-5.83 (br m, 1H), 7.03 (br, 0.5H), 7.18 (br, 0.5H), 7.28-7.38 (m, 3H), 7.38-7.48 (m, 3H), 13 UA 109867 C2 7.49-7.56 (m, 1H), 7.57-7.68 (m, 5H), 7.81 (s, 1H), 9.24 (br, 0.2H), 9.62 (s, 0.8H), 12.38 (s, 1H); РХ/МС обчислене для C27H25N3O4 (m/e) 455,0, спостерігали 456,0 (M+H, ЕР+). Приклад 3 (2-Метил-4-феніл-2H-піразол-3-іл)-карбамінової кислоти 1-(2-хлор-феніл)-етиловий ефір Cl O O N N 5 10 15 N 2-Метил-4-феніл-2H-піразол-3-карбонову кислоту (одержану як проміжну сполуку в Прикладі 1, 60 мг, 0,297 ммоль), 1-(2-хлорфеніл)етанол (46,5 мг, 0,297 ммоль), DPPA (81,7 мг, 0,297 ммоль) і триетиламін (0,09 мл) об'єднували в 2,5 мл толуолу. Суміш перемішували при 85 °C протягом 3 г. Розчинники випаровували, і залишок очищали колоночною флеш-хроматографією ISCO (від 0% до 50% етилацетату в гексанах) з одержанням (2-метил-4-феніл-2H-піразол-3-іл)карбамінової кислоти 1-(2-хлор-феніл)-етилового ефіру у вигляді білої пластівчастої твердої 1 -1 речовини (40 мг, вихід 38%). H ЯМР (400 МГц, ДМСО-d6) δ млн 1.15-1.28 (br, 0.6H), 1.55 (d, J=5.8 Гц, 2.4H), 3.54-3.78 (m, 3H), 5.82-6.10 (m, 1H), 7.23 (d, J=6.8 Гц, 1H), 7.28-7.54 (m, 7H), 7.59 (d, J=6.8 Гц, 1H), 7.76 (br s, 1H), 9.31 (br, 0.2H), 9.68 (s, 0.8H). РХ/МС обчислене для C19H18ClN3O2 (m/e) 355,0, спостерігали 356,0 (M+H, ЕР+). Приклад 4 1-{4'-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонової кислоти етиловий ефір O N O O 20 25 30 35 40 45 O N N Етил-1-(4-бромфеніл)циклопропанкарбоксилат (2,5 г, 9,29 ммоль), 4-гідроксифенілборонову кислоту (1,67 г, 12,1 ммоль), карбонат калію (2,57 г, 18,6 ммоль) і Pd(PPh3)4 (644 мг, 0,557 ммоль) об'єднували в ДМФ (15 мл). Суміш дегазували азотом і запаювали. Суміш перемішували при 85 °C протягом 15 г. Розчинники випаровували, і залишок екстрагували етилацетатом і водою. Органічний шар промивали розбавленою соляною кислотою і водою, висушували над сульфатом натрію і фільтрували. Розчинники випаровували, і залишок кристалізували з етилацетату і гексанів з одержанням першої партії свтло-жовтої твердої речовини (1,36 г) етил1-(4'-гідроксидифеніл-4-іл) циклопропанкарбоксилату. Матковий розчин концентрували і кристалізували з етилацетату і гексанів з одержанням другої партії кристалічної сполуки (330 1 1 мг). Обидві партії показали однаковий H-ЯМР (сумарний вихід 1,69 г, 64,4%). H-ЯМР (400 Мгц, -1 CDCl3) δ млн 1.15-1.32 (m, 5H), 1.60-1.71 (m, 2H), 4.14 (q, J=7.1 Гц, 2H), 5.15 (br s, 1H), 6.85 (d, J=8.6 Гц, 2H), 7.39 (d, J=8.1 Гц, 2H), 7.42-7.54 (m, 4H). Етил-1-(4'-гідроксидифеніл-4-іл)циклопропанкарбоксилат (1,41 г, 4,99 ммоль) і TEA (0,8 мл) розчиняли в метиленхлориді (80 мл). Розчин перемішували в умовах сухого льоду/ацетону і додавали трифторметансульфоновий ангідрид (1,48 г, 5,24 ммоль) в метиленхлориді (4 мл) через шприц. Розчин перемішували протягом 30 хвилин, і охолоджуючу баню видаляли. Суміш перемішували при кімнатній температурі протягом 1 г. Розчин екстрагували метиленхлоридом і водою. Органічний шар промивали розбавленою соляною кислотою, водою і розчином бікарбонату натрію, висушували над сульфатом натрію і фільтрували. Розчинники випаровували з одержанням у вигляді маслянистої речовини (1,98 г, вихід 95,7%) етил-1-(4'1 (трифторметилсульфонілокси)-дифеніл-4-іл)-циклопропанкарбоксилату. H-ЯМР (400 МГц, -1 CDCl3) δ млн 1.16-1.26 (m, 5H), 1.62-1.70 (m, 2H), 4.13 (q, J=7.1 Гц, 2H), 7.35 (d, J=8.6 Гц, 2H), 7.44 (d, J=8.1 Гц, 2H), 7.51 (d, J=8.3 Гц, 2H), 7.65 (d, J=8.8 Гц, 2H). Етил-1-(4'-(трифторметилсульфонілокси)-дифеніл-4-іл)-циклопропанкарбоксилат (1,98 г, 4,78 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі(1,3,2-діоксаборолан) (1,46 г, 5,73 ммоль) і ацетат калію (1,41 г, 14,3 ммоль) змішували в безводному діоксані (15 мл). До цієї суміші додавали Pd(dppf)Cl2 (280 мг, 0,38 ммоль), і суміш дегазували азотом протягом 2 хвилин. Суміш запаювали і перемішували в масляній бані, заздалегідь нагрітій до 90 °C. Після 4 г перемішування РХ/МС показала бажаний продукт і відсутність початкової речовини. Суміш охолоджували до кімнатної температури і розбавляли етилацетатом (40 мл). Суміш 14 UA 109867 C2 5 10 15 20 25 30 35 фільтрували через тонкий шар целіту. Фільтрат концентрували, і залишок обробляли етилацетатом (30 мл) і гексанами (90 мл). Суміш фільтрували. Фільтрат концентрували і очищали колоночною флеш-хроматографією ISCO (етилацетат в гексанах, від 0% до 20% протягом 20 хвилин, 120 г силікагелю) з одержанням у вигляді білої твердої речовини етил-1-(4'(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-дифеніл-4-іл)-циклопропанкарбоксилату (1,03 г, 1 -1 вихід 55%). %). H-ЯМР (400 МГц, CDCl3) δ млн 1.17-1.30 (m, 5H), 1.39 (s, 12H), 1.60-1.71 (m, 2H), 4.14 (q, J=7.1 Гц, 2H), 7.43 (d, J=8.1 Гц, 2H), 7.54-7.70 (m, 4H), 7.90 (d, J=8.0 Гц, 2H). Етил-1-(4'-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-дифеніл-4-іл)циклопропанкарбоксилат (100 мг, 0,255 ммоль), 4-бром-1-метил-1H-піразол-5-амін (67,3 мг, 1,50 екв.), X-PHOS (36,5 мг, 0,30 екв.), триосновний фосфат калію (162 мг, 3,0 екв.) і ацетат паладію (8,6 мг, 0,15 екв.) змішували в 4 мл толуолу. Суміш перемішували і додавали дегазовану воду (0,8 мл). Суміш дегазували азотом і запаювали. Суміш перемішували при 100 °C протягом ночі, а потім екстрагували етилацетатом і водою. Розчинники випаровували, і залишок очищали колоночною флеш-хроматографією ISCO (метанол в метиленхлориді від 0% до 10%, 12 г силікагелю) з одержанням у вигляді світло-сірої твердої речовини 1-[4'-(5-аміно-1-метил-1Hпіразол-4-іл)-дифеніл-4-іл]-циклопропанкарбонової кислоти етилового ефіру (48 мг, вихід 1 -1 52,1%). H-ЯМР (400 МГц, CDCl3) δ млн 1.19-1.25 (m, 5H), 1.64 (m, 2H), 3.77 (s, 3H), 3.81(br s, 2H), 4.13 (q, J=7.1 Гц, 2H), 7.44 (t, J=8.8 Гц, 4H), 7.53 (s, 1H), 7.56 (d, J=8.1 Гц, 2H), 7.64 (d, J=8.1 Гц, 2H); РХ/МС обчислене для C22H23N3O2 (m/e) 361,0, спостерігали 362,1 (M+H, ЕР+). Етил-1-(4'-(5-аміно-1-метил-1H-піразол-4-іл)-дифеніл-4-іл)-циклопропанкарбоксилат (100 мг, 0,277 ммоль) і трифосген (123 мги, 0,415 ммоль) розчиняли в метиленхлориді (2 мл) з одержанням розчину. Додавали толуол (6 мл), і суміш перемішували, після чого додавали TEA (0,16 мл). Суміш запаювали і перемішували при 90 °C протягом 10 хвилин. Додавали (R)-(+)-1фенілетанол (68 мг, 0,553 ммоль) у толуолі (2 мл). Суміш перемішували при 105 °C протягом 2 г. ТШХ показала одну основну пляму і повне зникнення початкової речовини. Суміш екстрагували етилацетатом і розчином хлориду амонію. Органічний шар висушували над сульфатом натрію і фільтрували. Розчинники випаровували, і залишок очищали колоночною флеш-хроматографією ISCO (12 г силікагелю, від 0% до 60% етилацетату в гексанах протягом 15 хвилин) з одержанням у вигляді сірого порошку 1-{4'-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}-циклопропанкарбонової кислоти етилового 1 -1 ефіру (101 мг, вихід 71,6%). %). H-ЯМР (400 МГц, CDCl3) δ млн 1.20-1.34 (m, 6H), 1.49-1.75 (m, 4H), 3.80 (s, 3H), 4.14 (q, J=7.1 Гц, 2H), 5.93 (m, 1H), 6.25 (br s, 1H), 7.35-7.48 (m, 9H), 7.53-7.64 (m, 4H), 7.72 (s, 1H); РХ/МС обчислене для C31H31N3O4 (m/e) 509,0, спостерігали 510,0 (M+H, ЕР+). Приклад 5 1-{4'-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонова кислота O O O N O 40 45 50 N N 1-{4'-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонової кислоти етиловий ефір (80 мг, 0,157 ммоль) розчиняли в 4 мл ТГФ і додавали розчин гідроксиду літію (0,5 н., 2 мл). Суміш перемішували при кімнатній температурі протягом 5 хвилин. Додавали метанол (1 мл) з одержанням прозорого розчину. Суміш перемішували при 65 °C протягом 5 г, а потім при 30 °C протягом ночі. Розчинники випаровували, і залишок розчиняли у воді (12 мл). Додавали соляну кислоту (1 н., 1,3 мл), і тверду речовину фільтрували з одержанням білої твердої речовини (65 мг). РХ/МС показала 85% чистоту і основну домішку у вигляді розщепленого карбамату. Це тверду речовину розчиняли в ацетонітрилі/метиленхлориді (що містить 5% метанолу) і очищали колоночною флеш-хроматографією ISCO (12 г силікагелю, метанол в дихлорметані від 0% до 5% протягом 15 хвилин) з одержанням у вигляді білої твердої речовини 1-{4'-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}-циклопропанкарбонової кислоти (45 мг, 1 -1 вихід 59,5%). H-ЯМР (400 МГц, ДМСО-d6) δ млн 1.19-1.25 (m, 2H), 1.49-1.57 (m, 5H), 3.64 (s, 3H), 5.65-5.83 (m, 1H), 6.95-7.25 (br m, 1H), 7.27-7.48 (m, 6H), 7.49-7.67 (m, 6H), 7.82 (br s, 1H), 15 UA 109867 C2 5 9.25 (br s, 0.2H), 9.57 (s, 0.8H), 12.35 (s, 1H); РХ/МС обчислене для C29H27N3O4 (m/e) 481,0, спостерігали 482,1 (M+H, ЕР+). Приклад 6 1-(4'-{5-[1-(2-Хлор-феніл)-етоксикарбоніламіно]-1-метил-1H-піразол-4-іл}-дифеніл-4-іл) циклопропанкарбонова кислота Cl O O N O N O 10 15 20 25 30 N Етил-1-(4'-(5-аміно-1-метил-1H-піразол-4-іл)-дифеніл-4-іл)-циклопропанкарбоксилат (проміжну сполуку з Прикладу 4, 133 мг, 0,368 ммоль) змішували з трифосгеном (164 мг, 0,552 ммоль) в дихлорметані (5 мл). Додавали толуол (5 мл), і суміш перемішували. До цієї суміші додавали TEA (0,5 мл), і реакційну трубку запаювали. Суміш перемішували при 90 °C протягом 10 хвилин і охолоджували до 40 °C. Додавали 1-(2-хлорфеніл)-етанол (115 мг, 0,736 ммоль) в толуолі (1 мл). Суміш перемішували при 105 °C протягом 1 г. Суміш охолоджували до кімнатної температури і випаровували при зниженому тиску. Залишок екстрагували етилацетатом і водою, висушували і випаровували. Залишок очищали колоночною флеш-хроматографією ISCO (40 г силікагелю, від 10% до 65% етилацетату в гексанах) з одержанням у вигляді білої пластівчастої твердої речовини 1-(4'-{5-[1-(2-хлор-феніл)-етоксикарбоніламіно]-1-метил-1Hпіразол-4-іл}-дифеніл-4-іл)-циклопропанкарбонової кислоти етилового ефіру (141 мг, вихід 70,4%). РХ/МС обчислене для C31H30ClN3O4 (m/e) 543, спостерігали 544,1 (M+H, ЕР+). 1-(4'-{5-[1-(2-Хлор-феніл)-етоксикарбоніламіно]-1-метил-1H-піразол-4-іл}-дифеніл-4-іл)циклопропанкарбонової кислоти етиловий ефір (140 мг, 0,257 ммоль) розчиняли в 4 мл ТГФ і додавали розчин LiOH (0,5 н., 2 мл). Суміш перемішували при 65 °C протягом ночі. РХ/МС показала значну кількість побічного продукту дез-карбамату. Суміш концентрували і обробляли 1 н. соляною кислотою. Білу тверду речовину фільтрували і висушували (75 мг). Цю речовину очищали, використовуючи ВЕРХ з оберненою фазою (ацетонітрил у воді) з одержанням 1-(4'-{5[1-(2-хлор-феніл)-етоксикарбоніламіно]-1-метил-1H-піразол-4-іл}-дифеніл-4-іл)циклопропанкарбонової кислоти у вигляді білої ліофілізованої аморфної речовини (20 мг, вихід 1 -1 15,1%). H-ЯМР (400 МГц, ДМСО-d6) δ млн 1.14-1.30 (m, 2.6H), 1.42-1.52 (m, 2H), 1.57 (d, J=5.8 Гц, 2.4H), 6.03 (d, J=6.1 Гц, 1H), 7.29-7.69 (m, 12H), 7.83 (s, 1H), 9.37 (br s, 0.2H), 9.74 (s, 0.8H), 12.35 (br s, 1H); РХ/МС обчислене для C29H26ClN3O4 (m/e) 515,0, спостерігали 516,0 (M+H, ЕР+). Приклад 7 (4-Дифеніл-4-іл-2-метил-2H-піразол-3-іл)-карбамінової кислоти (R)-1-феніл-етиловий ефір O O N N N 35 Цю сполуку було одержано таким же способом, як описано для одержання 2-метил-4-феніл2H-піразол-3-іл карбамінової кислоти (R)-1-феніл-етилового ефіру, шляхом використання дифеніл-4-іл-боронової кислоти і 4-бром-2-метил-2H-піразол-3-карбонової кислоти метилового ефіру. РХ/МС обчислене для C25H23N3O2 (m/e) 397, спостерігали 398,0 (M+H, ЕР+). Приклад 8 [4-(4-Метокси-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти (R)-1-феніл-етиловий ефір 16 UA 109867 C2 O O N N O N 5 10 Цю сполуку було одержано таким же способом, як описано для одержання 2-метил-4-феніл2H-піразол-3-іл карбамінової кислоти (R)-1-феніл-етилового ефіру, шляхом використання 4метоксифеніл-боронової кислоти і 4-бром-2-метил-2H-піразол-3-карбонової кислоти метилового 1 -1 ефіру. H-ЯМР (400 МГц, ДМСО-d6) δ млн 1.15-1.30 (br, 0.6H), 1.54 (d, J=5.8 Гц, 2.4 H), 3.60 (br s, 3H), 3.75 (s, 3H), 5.76 (d, J=6.1 Гц, 1H), 6.87 (d, J=7.6 Гц, 2H), 6.97-7.25 (m, 1H), 7.28-7.51 (m, 6H), 7.67 (s, 1H), 9.12 (br s, 0.2H), 9.48 (br s, 0.8H); РХ/МС обчислене для C25H23N3O2 (m/e) 397, спостерігали 398,0 (M+H, ЕР+); РХ/МС обчислене для C20H21N3O3 (m/e) 351, спостерігали 350,0 (M-H, ЕР-). Приклад 9 1-{4-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-феніл}циклопропанкарбонова кислота O O N N O N O 15 20 25 30 35 (R)-1-Фенілетил-4-бром-1-метил-1H-піразол-5-іл-карбамат (165 мг, 0,51 ммоль), метил-1-(4(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-феніл)-циклопропанкарбоксилат (154 мг, 0,51 ммоль), S-PHOS (CAS# 657408-07-6, 62,7 мг, 0,153 ммоль), ацетат паладію (17,1 мг, 0,076 ммоль) розчиняли в толуолі (4 мл) і додавали триосновний фосфат калію (324 мг, 1,53 ммоль) в дегазованій воді (1 мл). Суміш дегазували протягом 5 хвилин і запаювали. Суміш перемішували при 100 °C протягом ночі, а потім екстрагували етилацетатом і водою. Органічний шар промивали соляним розчином і висушували. Розчинники випаровували, і залишок очищали колоночною флеш-хроматографією ISCO, використовуючи етилацетат в гексанах (від 0% до 50%, 24 г силікагелю) з одержанням у вигляді воскової блідо-жовтої речовини 1-{4-[1-метил-5((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-феніл}-циклопропанкарбонової кислоти метилового ефіру (123 мг, вихід 57,6%). РХ/МС обчислене для C24H25N3O4 (m/e) 419,0, спостерігали 420,0 (M+H, ЕР+). (R)-метил 1-(4-(1-метил-5-((1-фенілетокси)карбоніламіно)-1H-піразол-4-іл)-феніл)циклопропанкарбоксилат (123 мг, 0,29 ммоль) розчиняли в ТГФ (4 мл) і додавали водний розчин гідроксиду літію (0,5 н., 1 мл). Реакційну суміш нагрівали до 65 °C і перемішували протягом 4 г. Розчинники випаровували, і залишок обробляли теплою водою (25 мл) і перемішували при кімнатній температурі протягом 1 г. Суміш фільтрували, і фільтрат обробляли 1 н. соляною кислотою (0,5 мл). Білу тверду речовину фільтрували і промивали водою і висушували на повітрі з одержанням 1-{4-[1-метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-феніл}циклопропанкарбонової кислоти (42 мг, вихід 35,4%). РХ/МС обчислене для C23H23N3O4 (m/e) 405, спостерігали 406 (M+H, ЕР+). Приклад 10 {4-[1-Метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-феніл}-оцтова кислота O N O O N O N 17 UA 109867 C2 5 Цю сполуку було одержано, використовуючи такий же спосіб, як описано для одержання 1{4-[1-метил-5-((R)-1-феніл-етоксикарбоніламіно)-1H-піразол-4-іл]-феніл}-циклопропанкарбонової кислоти шляхом використання етил-2-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-феніл)ацетату і (R)-1-фенілетил-4-бром-1-метил-1H-піразол-5-іл-карбамату. РХ/МС обчислене для C21H21N3O4 (m/e) 379,0, спостерігали 380,0 (M+H, ЕР+). Приклад 11 [4-(4-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти 1-(2-хлор-феніл)-етиловий ефір F O N O N N 10 15 20 25 30 35 Cl 4-Фторфенілборонову кислоту (211 мг, 1,51 ммоль), метил-4-бром-1-метил-1H-піразол-5карбоксилат (300 мг, 1,37 ммоль), карбонат цезію (893 мг, 2,74 ммоль) і Pd(PPh3)4 (95 мг, 0,082 ммоль) змішували в толуолі (12 мл). Суміш дегазували азотом і запаювали. Суміш перемішували при 90 °C протягом ночі, а потім концентрували. Залишок екстрагували етилацетатом і водою. Органічний шар висушували і випаровували. Залишок очищали колоночною флеш-хроматографією ISCO (40 г силікагелю, від 0% до 30% етилацетату в гексанах) з одержанням у вигляді маслянистої речовини 4-(4-фторфеніл)-2-метил-2H-піразол-31 -1 карбонової кислоти метилового ефіру (140 мг, вихід 43,6%). H-ЯМР (400 МГц, CDCl3) ) δ млн 3.78 (s, 3H), 4.21 (s, 3H), 7.08 (t, J=8.5 Гц, 2H), 7.35 (m, 2H), 7.49 (s, 1H). 4-(4-Фторфеніл)-2-метил-2H-піразол-3-карбонової кислоти метиловий ефір (140 мг, 0,60 ммоль) розчиняли в ТГФ (4 мл) і додавали розчин LiOH (0,5 н., 2 мл). Суміш перемішували при кімнатній температурі протягом 4 г. Суміш концентрували і розчиняли у воді. Розчин обробляли 1 н. соляною кислотою (1,10 мл). Суміш екстрагували етилацетатом. Органічний шар висушували і концентрували з одержанням у вигляді маслянистої речовини (115 мг, 87,4%) 4-(4фторфеніл)-2-метил-2H-піразол-3-карбонової кислоти. 4-(4-Фторфеніл)-2-метил-2H-піразол-3-карбонову кислоту (106 мг, 0,48 ммоль), DPPA (132 мг, 0,48 ммоль), 1-(2-хлорфеніл)етанол (76 мг, 0,48 ммоль) і TEA (0,2 мл) перемішували в 5 мл толуолу. Суміш нагрівали до 90 °C і перемішували протягом 1 г. Розчинники випаровували, і залишок екстрагували етилацетатом і водою. Органічний шар промивали розчином бікарбонату натрію і висушували. Розчинники випаровували, і залишок очищали колоночною флешхроматографією ISCO (етилацетат в гексанах від 0% до 60%) з одержанням [4-(4-фтор-феніл)2-метил-2H-піразол-3-іл]-карбамінової кислоти 1-(2-хлор-феніл)-етилового ефіру у вигляді білої 1 -1 твердої речовини (116 мг, вихід 64,5%). H-ЯМР (400 МГц, ДМСО-d6) δ млн 1.15-1.30 (br, 0.6H), 1.56 (br d, J=5.3 Гц, 2.4H), 3.62 (br s, 3H), 5.86-6.06 (m, 1H), 6.81-7.27 (m, 3H), 7.31-7.65 (m, 5H), 7.76 (br s, 1H), 9.32 (s, 0.2H), 9.65 (s, 0.8H); РХ/МС обчислене для C19H17ClFN3O2 (m/e) 373,0, спостерігали 374,0 (M+H, ЕР+). Приклад 12 [4-(2-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти 1-(3-трифторметил-феніл)етиловий ефір F F F F N N N 40 45 O O 4-Бром-1-метил-1H-піразол-5-амін (800 мг, 4,55 ммоль), 2-фторфенілборонову кислоту (890 мг, 6,36 ммоль), X-PHOS (217 мг, 0,45 ммоль), ацетат паладію (51 мг, 0,227 ммоль) і триосновний фосфат калію (1,93 г, 9,09 ммоль) об'єднували і додавали толуол (12 мл). До перемішаної суміші додавали дегазовану воду (4 мл), і суміш дегазували, а потім запаювали. Суміш перемішували при 95 °C протягом ночі. Розчинники випаровували, і залишок екстрагували етилацетатом і водою. Органічний шар промивали соляним розчином і висушували. Розчинники випаровували, і залишок очищали колоночною флеш-хроматографією ISCO (етилацетат, що містить 3% метанолу в гексанах від 10% до 80%, 40 г силікагелю) з одержанням 4-(2-фторфеніл)-2-метил-2H-піразол-3-аміну у вигляді коричневого масла (649 мг, 18 UA 109867 C2 1 5 10 15 -1 вихід 74,7%). H-ЯМР (400 МГц, ДМСО-d6) δ млн 3.60 (s, 3H), 5.30 (br s, 2H), 7.14-7.25 (m, 3H), 7.30 (d, J=2.5 Гц, 1H), 7.39-7.52 (m, 1H); РХ/МС обчислене для C10H10FN3 (m/e) 191,0, спостерігали 192,0 (M+H, ЕР+). 4-(2-Фторфеніл)-2-метил-2H-піразол-3-амін (150 мг, 0,78 ммоль) і трифосген (303 мг, 1,02 ммоль) розчиняли в дихлорметані (3 мл). Додавали толуол (8 мл), і суміш запаювали. Суміш перемішували в крижаній бані і додавали TEA (0,9 мл, 8,0 екв.). Суміш перемішували при 85 °C протягом 20 хвилин і додавали 1-(3-(трифторметил)-феніл)етанол (194 мг, 1,02 ммоль) в толуолі (2 мл). Суміш перемішували при 90 °C протягом 2 г. Розчинники випаровували, і залишок екстрагували етилацетатом і водою. Органічний шар промивали соляним розчином і висушували. Розчинники випаровували, і залишок очищали колоночною флеш-хроматографією ISCO (від 0% до 60% етилацетату в гексанах) з одержанням [4-(2-фтор-феніл)-2-метил-2Hпіразол-3-іл]-карбамінової кислоти 1-(3-трифторметил-феніл)-етилового ефіру у вигляді блідо1 -1 жовтої воскової твердої речовини (226 мг, вихід 70,7%). H-ЯМР (400 МГц, ДМСО-d6) δ млн 1.11-1.29 (m, 0.6H), 1.55 (br d, J=5.81 Гц, 2.4H), 3.65 (s, 3H), 5.73-5.85 (m, 1H), 7.06-7.24 (m, 2H), 7.25-7.52 (m, 3H), 7.56-7.82 (m, 4H), 9.29 (br s, 0.2H), 9.66 (s, 0.8H); РХ/МС обчислене для C20H17F4N3O2 (m/e) 407,0, спостерігали 408,0 (M+H, ЕР+). Приклад 13 [4-(2-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти 1-(2-хлор-феніл)-етиловий ефір O N F 20 25 30 35 N N O Cl 4-(2-Фторфеніл)-2-метил-2H-піразол-3-амін (110 мг, 0,575 ммоль) і трифосген (222 мг, 0,748 ммоль) змішували в дихлорметані (4 мл) і додавали толуол (6 мл), і трубку запаювали. Суміш перемішували в крижаній бані і додавали триетиламін (0,7 мл). Суміш перемішували при 85 °C протягом 20 хвилин і додавали 1-(2-хлорфеніл)етанол (117 мг, 0,748 ммоль) в 1 мл толуолу. Суміш перемішували при 90 °C протягом 1 г. Розчинники випаровували, і залишок екстрагували етилацетатом і водою. Органічний шар висушували і концентрували. Залишок очищали колоночною флеш-хроматографією ISCO (етилацетат в гексанах від 0% до 50%) з одержанням [4-(2-фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти 1-(2-хлор-феніл)-етилового 1 -1 ефіру у вигляді аморфного порошку (134 мги, вихід 62,3%). H-ЯМР (400 МГц, ДМСО-d6) δ млн 1.06-1.28 (m, 0.6H), 1.53 (br d, J=5.6 Гц, 2.4H), 3.65 (br s, 3H), 5.83-5.98 (m, 1H), 6.83-7.50 (m, 7H), 7.56 (d, J=6.8 Гц, 1H), 7.65 (br s, 1H), 9.31 (br, 0.2H), 9.66 (s, 0.8H); РХ/МС обчислене для C19H17ClFN3O2 (m/e) 373,0, спостерігали 372,0 (M-H, ЕР-). Приклад 14 (R)-1-{4’-[5-(втор-бутоксикарбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонова кислота N N O NH O O 40 45 OH У круглодонной колбі на 250 мл метил-1-(4-бромфеніл)-циклопропанкарбоксилат (9,4 г, 36,8 ммоль), 4-гідроксифенілборонову кислоту (6,61 г, 47,9 ммоль, 1,3 екв.) і карбонат калію (10,2 г, 73,7 ммоль, 2,0 екв.) поєднували з ДМФ (50 мл) з одержанням світло-коричневої суспензії. Pd(Ph3P)4 (2,55 г, 2,21 ммоль, 0,06 екв.), і з суміші відкачували повітря і продували її аргоном. Реакційну суміш нагрівали до 85 °C і перемішували протягом 17 г в атмосфері аргону. Неочищену реакційну суміш концентрували у вакуумі. Залишок розподіляли між H 2O і EtOAc і фільтрували. Фази розділяли, і органічний шар промивали 0,1 M HCl (15 мл), H 2O (15 мл) і насиченим розчином NaCl (15 мл). Органічний шар висушували над Na2SO4 і концентрували у вакуумі. Залишок розчиняли в гарячому EtOAc і гексані та декантували від нерозчинної червоної твердої речовини. Жовтий супернатант випарювали, і в результаті перекристалізації з EtOAc і гексанів одержали 4,49 г (46%)метил-1-(4'-гідроксидифеніл-4-іл)циклопропан-карбоксилату у вигляді білуватого твердої речовини. Фільтрат випарювали, і залишок перекристалізовували з 19 UA 109867 C2 5 10 15 20 25 30 35 40 45 50 55 60 EtOAc / гексану з одержанням додатково 1,64 г (17%) бажаного продукту у вигляді рожевого 1 -1 порошку. H ЯМР (ДМСО-d6) δ млн 9.53 (s, 1H), 7.45 - 7.55 (m, 4H), 7.29 - 7.38 (m, 2H), 6.82 6.86 (m, 2H), 3.59 (s, 3H),), 1.46 - 1.52 (m, 2H), 1.20 - 1.24 (m, 2H). У круглодонній колбі на 500 мл метил-1-(4'-гідроксидифеніл-4-іл)циклопропанкарбоксилат (3 г, 11,2 ммоль) і TEA (1,64 мл, 11,7 ммоль, 1,05 екв.) об'єднували з дихлорметаном (200 мл) з одержанням жовтої суспензії. Суміш охолоджували до -78 °C і додавали трифторметансульфоновий ангідрид (3,31 г, 11,7 ммоль, 1,05 екв.). Реакційну суміш перемішували при -78 °C протягом 30 хв, потім при 25 °C протягом 1 г. Реакційну суміш розбавляли H2O, і органічний шар промивали 0,5 M HCl (200 мл), H2O (200 мл) і насиченим розчином NaHCO3 (150 мл). Органічний шар висушували над Na2SO4 і фільтрували через шар силікагелю для видалення темно-червоної домішки. Фільтрат концентрували у вакуумі з одержанням 1-(4’-трифторметансульфонілокси-дифеніл-4-іл)циклопропанкарбонової кислоти метилового ефіру. Неочищену речовину використовували без додаткового очищення в подальшій реакції. У круглодонній колбі на 1 л метил-1-(4'-(трифторметилсульфонілокси)дифеніл-4-іл) циклопропанкарбоксилат (2,8 г, 6,99 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі(1,3,2діоксаборолан) (2,13 г, 8,39 ммоль, 1,2 екв.) і ацетат калію (2,06 г, 21,0 ммоль, 3,0 екв.) об'єднували з діоксаном (10 мл) з одержанням коричневої суспензії. Додавали PdCl2(dppf) (457 мг, 559 мкмоль, 0,08 екв.), і реакційну суміш нагрівали до 90 °C і перемішували протягом 4 г з подальшим перемішуванням при 25 °C протягом 12 г. Реакційну суміш розбавляли EtOAc, фільтрували через целіт і випаровували у вакуумі. Неочищену речовину очищали фільтруванням через силікагель у вакуумі, елююючи Hex/EtOAc 1:1. Фільтрат випаровували до білуватого порошку. Цю речовину повторно очищали флеш-хроматографією (силікагель, 300 г, від 0% до 20% EtOAc в гептані) з одержанням 2,11 г (78%) 1-[4’-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-дифеніл-4-іл]-циклопропанкарбонової кислоти метилового ефіру у + 1 вигляді білуватої кристалічної твердої речовини. (M+H) = 379,0 (m/e). H ЯМР (ДМСО-d6) δ млн 1 7.72 - 7.94 (m, 2H), 7.53 - 7.72 (m, 4H), 7.26 - 7.53 (m, J = 8.6 Гц, 2H), 3.65 (s, 3H), 1.40 - 1.64 (m, 2H), 1.27 - 1.40 (m, 12H), 1.21 - 1.27 (m, 2H). У трубку на 50 мл додавали метил-1-(4'-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл) дифеніл-4-іл)циклопропанкарбоксилат (2,033 г, 5,37 ммоль), 4-бром-1-метил-1H-піразол-5-амін (1,23 г, 6,99 ммоль, 1,3 екв.), X-Phos (769 мг, 1,61 ммоль, 0,30 екв.) і K3PO4 (3,42 г, 16,1 ммоль, 3,0 екв.) в толуолі (31 мл) і воді (6 мл). Pd(OAc)2 (181 мг, 806 мкмоль, 0,15 екв.), і трубку запаювали. Реакційну суміш продували аргоном і нагрівали при 100ºC протягом 21 г. Реакційну суміш охолоджували і розбавляли EtOAc і водою. Суспензію фільтрували, і фази розділяли. Органічні шари висушували над Na2SO4 і концентрували у вакуумі. Неочищену речовину очищали флеш-хроматографією (силікагель, 300 г, від 0% до 5% метанолу в дихлорметані). Продукт виділяли у вигляді неочищеної маслянистої червоної твердої речовини. Цю речовину розчиняли у мінімальній кількості теплого дихлорметану і осаджували гексанами. Суспензію фільтрували, і фільтрат випаровували у вакуумі. Залишок розчиняли у мінімальній кількості теплого дихлорметану і осаджували гексанами. Супернатант декантували від рудуватої твердої речовини, і тверду речовину промивали гексанами. Об'єднані тверді речовини висушували у вакуумі з одержанням 738 мг (39%) 1-[4’-(5-аміно-1-метил-1H-піразол-4-іл)-дифеніл-4-іл]+ 1 циклопропанкарбонової кислоти метилового ефіру. (M+H) = 348,2 (m/e); H ЯМР (ДМСО-d6) δ -1 млн 7.37 - 7.63 (m, 8H), 7.11 (s, 1H), 5.40 (s, 2H), 3.52 - 3.61 (m, 6H) 1.49 (d, J = 3.0 Гц, 2H), 1.22 (d, J = 3.0 Гц, 2H). У трубці на 25 мл метил-1-(4'-(5-аміно-1-метил-1H-піразол-4-іл)-дифеніл-4-іл)циклопропанкарбоксилат (94 мг, 271 мкмоль) об'єднували з 2 мл дихлорметану і 5 мл толуолу. До цієї суспензії додавали трифосген (120 мг, 406 мкмоль, 1,5 екв.), а потім TEA (151 мкл, 1,08 ммоль, 4 екв.). Трубку запаювали, і суміш перемішували при 90 °C протягом 30 хв. Суміш охолоджували і додавали (R)-бутан-2-ол (40,1 мг, 49,8 мкл, 541 мкмоль, 2 екв.). Реакційну суміш запаювали і нагрівали до 90 °C протягом 2 г. Реакційну суміш розподіляли між EtOAc і насиченим розчином NH4Cl. Органічний шар промивали H2O (25 мл), насиченим розчином NaCl (25 мл), висушували над Na2SO4 і концентрували у вакуумі. Неочищену речовину очищали флеш-хроматографією (силікагель, 40 г, 100% EtOAc) з одержанням 60 мг (50%) 1-{4’-[5-((R))втор-бутоксикарбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}-циклопропанкарбонової + кислоти метилового ефіру у вигляді білуватої твердої речовини. (M+ H) = 448,0 (m/e). У круглодонній колбі на 250 мл (R)-метил-1-(4'-(5-(втор-бутоксикарбоніламіно)-1-метил-1Hпіразол-4-іл)дифеніл-4-іл)циклопропанкарбоксилат (60 мг, 134 мкмоль) об'єднували з тетрагідрофураном (3 мл) і метанолом (3,00 мл) з одержанням світло-жовтого розчину. Додавали 1 M NaOH (1,34 мл, 1,34 ммоль, 10 екв.), і реакційну суміш перемішували при 45 °C 20 UA 109867 C2 5 10 протягом 4 г. Реакційну суміш концентрували і підкисляли 1 M HCl. Залишок розподіляли між дихлорметаном і водою. Водний шар назад екстрагували дихлорметаном (10 мл). Органічні шари об'єднували, промивали H2O (10 мл) і висушували у вакуумі з одержанням 54 мг (93%) (R)-1-{4’-[5-(втор-бутоксикарбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонову кислоту у вигляді білого порошку. РХ/МС обчислене для C25H27N3O4 1 -1 (m/e) 433,0, спостерігали 434,1 (M+H, ЕР+); H ЯМР (ДМСО-d6) δ млн 12.32 (br. s., 1H), 9.38 (br. s., 1H), 7.80 (s, 1H), 7.50 - 7.69 (m, 6H), 7.38 (d, J = 8.3 Гц, 2H), 4.69 (br. s., 1H), 3.65 (s, 3H), 1.58 (br. s., 2H), 1.33 - 1.52 (m, J = 2.6 Гц, 2H), 1.22 (br. s., 3H), 1.14 (m, J = 2.6 Гц, 2H), 0.91 (br. s., 3H). Приклад 15 (R)-1-{4’-[5-(1,2-Диметил-пропоксикарбоніламіно)-1-метил-1H-піразол4-іл]-дифеніл-4-іл}циклопропанкарбонова кислота N N NH O OH O O 15 20 Одержання методом, подібним до Прикладу 14, за винятком заміни (R)-3-метилбутан-2олом (R)-бутан-2-а, з одержанням (R)-1-{4’-[5-(1,2-диметил-пропоксикарбоніламіно)-1-метил-1Hпіразол-4-іл]-дифеніл-4-іл}-циклопропанкарбонову кислоту. РХ/МС обчислене для C26H29N3O4 1 -1 (m/e) 447,0, спостерігали 448,2 (M+H, ЕР+); H ЯМР (ДМСО-d6) δ млн 12.34 (br. s., 1H), 9.37 (br. s., 1H), 7.81 (s, 1H), 7.49 - 7.68 (m, 6H), 7.38 (d, J = 8.3 Гц, 2H), 4.58 (br. s., 1H), 3.65 (s, 3H), 1.82 (br. s., 1H), 1.44 (br. s., 2H), 1.03 - 1.30 (m, 5H), 0.92 (br. s., 6H). Приклад 16 (R)-1-{4’-[5-((1-(2-Фторфеніл)етокси)карбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонова кислота N N O NH O F O 25 30 OH Одержання методом, подібним до Прикладу 14, за винятком заміни (R)-1-(2фторфеніл)етанолом (R)-бутан-2-олу, з одержанням (R)-1-{4’-[5-((1-(2-фторфеніл) етокси)карбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}-циклопропанкарбонової кислоти. 1 РХ/МС обчислене для C29H26FN3O4 (m/e) 499,0, спостерігали 500,1 (M+H, ЕР+); H ЯМР (ДМСО-1 d6) δ млн 12.37 (br. s., 1H), 9.67 (s, 1H), 7.80 (s, 2H), 7.45 - 7.70 (m, 8H), 7.39 (d, 2H), 7.19 - 7.33 (m, 1H), 5.97 (d, J = 5.7 Гц, 1H), 3.62 (s, 3H), 1.57 (m, 2H), 1.38 - 1.52 (m, 2H), 1.22 (s, 1H), 1.15 (d, 2H). Приклад 17 (R)-1-{4’-[1-Метил-5-((1-(3-(трифторметил)феніл)етокси)карбоніламіно)-1H-піразол-4-іл]дифеніл-4-іл}-циклопропанкарбонова кислота N N O N H O F F O OH F 35 Одержання методом, подібним до Прикладу 14, за винятком заміни (R)-1-(3(трифторметил)-феніл)етанолом (R)-бутан-2-олу, з одержанням (R)-1-{4’-[1-метил-5-((1-(3(трифторметил)феніл)етокси)-карбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонової кислоти. РХ/МС обчислене для C30H26F3N3O4 (m/e) 549,0, спостерігали 21 UA 109867 C2 1 5 -1 550,1 (M+H, ЕР+); H ЯМР (ДМСО-d6) δ млн 12.34 (br. s., 1H), 9.71 (br. s., 1H), 7.45 - 7.85 (m, 10H), 7.39 (d, J = 8.3 Гц, 3H), 5.87 (d, J = 6.0 Гц, 1H), 3.65 (s, 3H), 1.57 (d, J = 6.0 Гц, 2H), 1.39 1.51 (m, 2H), 1.22 (br. s., 1H), 1.09 - 1.19 (m, 2H). Приклад 18 1-{4’-[5-((1-(4-фторфеніл)етокси)карбоніламіно)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонова кислота N N O N H O O F 10 15 20 25 OH У круглодонній колбі на 250 мл метил-1-(4'-(5-((1-(4-фторфеніл)етокси)карбоніламіно)-1метил-1H-піразол-4-іл)дифеніл-4-іл)циклопропанкарбоксилат (66 мг, 129 мкмоль) об'єднували з ТГФ (2 мл) і метанолом (2 мл) з одержанням жовтого розчину. Додавали NaOH (1,29 мл, 1,29 ммоль, 10 екв.), і реакційну суміш нагрівали при 45 °C і перемішували протягом 3,5 г. Реакційну суміш концентрували і підкисляли 1 M HCl. Реакційну суміш розподіляли між дихлорметаном і водою. Водний шар знову екстрагували дихлорметаном (10 мл). Органічні шари об'єднували, промивали H2O (10 мл), висушували над Na2SO4 і концентрували у вакуумі до білого порошку. Неочищену речовину очищали колоночною флеш-хроматографією (силікагель, 12 г, від 0% до 5% метанолу в дихлорметані) з одержанням 29 мг (46%) 1-(4'-(5-((1-(4-фторфеніл) етокси)карбоніламіно)-1-метил-1H-піразол-4-іл)дифеніл-4-іл)-циклопропанкарбонової кислоти у вигляді білуватого порошку. РХ/МС обчислене для C29H26FN3O4 (m/e) 499,0, спостерігали 498,0 1 -1 (M-H, ЕР-); H ЯМР (ДМСО-d6) δ млн 12.36 (br. s., 1H), 9.62 (br. s., 1H), 7.82 (s, 1H), 7.60 (d, J = 8.1 Гц, 4H), 7.51 (d, J = 7.8 Гц, 3H), 7.35 - 7.44 (m, 2H), 7.26 (t, J = 7.8 Гц, 2H), 6.94 - 7.18 (m, 1H), 5.79 (d, J = 5.8 Гц, 1H), 3.68 (br. s., 3H), 1.56 (d, J = 5.8 Гц, 2H), 1.42 - 1.51 (m, 2H), 1.21 - 1.33 (br.m, 1H), 1.11 - 1.21 (m, 2H). Приклад 19 Одержання 1-{4’-[5-(циклобутоксикарбоніламіно)-1-метил-1H-піразол- 4-іл]-дифеніл-4-іл}циклопропанкарбонової кислоти N N O NH O O 30 35 OH Одержання методом, подібним до Прикладу 18, за винятком заміни циклобутанолом 1-(4фторфеніл)етанолу, з одержанням 1-{4’-[5-(циклобутоксикарбоніламіно)-1-метил-1H-піразол-4іл]-дифеніл-4-іл}-циклопропанкарбонової кислоти. РХ/МС обчислене для C25H25N3O4 (m/e) 431,0, 1 -1 спостерігали 432,0 (M+H, ЕР+); H ЯМР (Метанол-d4) δ млн 7.77 (s, 1H), 7.52 - 7.72 (m, 5H), 7.44 (d, J = 8.3 Гц, 2H), 5.01 (br. s., 1H), 3.79 (s, 3H), 2.40 (br.s., 2H), 2.05 - 2.29 (m, 2H), 1.78 - 1.94 (m, 1H), 1.46 - 1.76 (m, 3H), 1.12 - 1.42 (m, 2H). Приклад 20 1-{4’-[1-Метил-5-((оксетан-3-ілокси)карбоніламіно)-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонова кислота N N O NH O O O OH Одержання методом, подібним до Прикладу 18, за винятком заміни оксетан-3-олом 1-(4фторфеніл)етанолу з одержанням 1-{4’-[1-метил-5-((оксетан-3-ілокси)карбоніламіно)-1H 22 UA 109867 C2 5 піразол-4-іл]-дифеніл-4-іл}-циклопропанкарбонової кислоти. РХ/МС обчислене для C24H23N3O5 1 -1 (m/e) 433,0, спостерігали 434,1 (M+H, ЕР+); H ЯМР (ДМСО-d6) δ млн 12.33 (br. s., 1H), 7.93 (s, 1H), 7.66 - 7.73 (m, J = 8.3 Гц, 2H), 7.61 (d, J = 8.3 Гц, 2H), 7.53 - 7.59 (m, J = 8.1 Гц, 2H), 7.42 (d, J = 8.1 Гц, 2H), 5.41 (br. s., 1H), 4.85 - 4.94 (m, 1H), 3.90 (t, 1H), 3.66 - 3.83 (m, 6H), 3.57 (br. d., 1H), 1.42 - 1.62 (m, 2H), 1.13 - 1.22 (m, 2H). Приклад 21 [4-(2-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти (R)-1-(2-хлор-феніл)етиловий ефір O N N 10 15 O N F Cl Цю сполуку було одержано шляхом розділення за допомогою хіральної НРХ відповідного рацемату в Прикладі 13. Умови розділення є наступними: хіральна колонка WHELKO, від 10% до 65% метанолу в CO2. Другу фракцію концентрували з одержанням бажаної сполуки. РХ/МС обчислене для C19H17ClFN3O2 (m/e) 373,0, спостерігали 374,0 (M+H, ЕР+). Приклад 22 [4-(2-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти (S)-1-(2-хлор-феніл)етиловий ефір F N N N 20 O Cl O Цю сполуку було одержано шляхом розділення за допомогою хіральної НРХ відповідного рацемату в Прикладі 13. Умови розділення є наступними: хіральна колонка WHELKO, від 10% до 65% метанолу в CO2. Першу фракцію концентрували з одержанням бажаної сполуки. РХ/МС обчислене для C19H17ClFN3O2 (m/e) 373,0, спостерігали 374,0 (M+H, ЕР+). Приклад 23 [4-(2-Фтор-феніл)-2-метил-2H-піразол-3-іл]-карбамінової кислоти (R)-1-(3-трифторметилфеніл)-етиловий ефір F F F F N N N 25 30 O O Цю сполуку було одержано шляхом розділення за допомогою хіральної НРХ відповідного рацемату в Прикладі 12. Умови розділення є наступними: хіральна колонка WHELKO, від 10% до 65% метанолу в CO2. Другу фракцію концентрували з одержанням бажаної сполуки. РХ/МС обчислене для C20H17F4N3O2 (m/e) 407,0, спостерігали 408,0 (M+H, ЕР+). Приклад 24 1-{4'-[5-(3-Бензил-уреїдо)-1-метил-1H-піразол-4-іл]-дифеніл-4-іл}-циклопропанкарбонова кислота O O N N O N N 35 Гідрид натрію (40,2 мг, 1,01 ммоль) в мінеральному маслі додавали до розчину 1-(4'-(5аміно-1-метил-1H-піразол-4-іл)дифеніл-4-іл)циклопропанкарбонової кислоти метилового ефіру (233 мг, 0,67 ммоль) в ДМФ (8 мл) при кімнатній температурі в атмосфері азоту, і суміш перемішували протягом 5 хвилин. Реакційна суміш перетворилася в червоно-коричневий 23 UA 109867 C2 5 10 15 20 25 розчин після додавання гідриду натрію. Потім додавали бензилізоціанат (89,2 мг, 0,67 ммоль), і реакційну суміш нагрівали до 80 °C і перемішували протягом 3 г, і в цей час аналіз РХ/МС показав присутність бажаного продукту. Суміш охолоджували до кімнатної температури і розбавляли водою, і органічну сполуку екстрагували в етилацетат (2 x 50 мл). Об'єднані екстракти промивали водою і соляним розчином і висушували над безводним MgSO4. В результаті фільтрування і концентрації одержали неочищений залишок, який очищали, використовуючи колоночну хроматографію ISCO (40 г), елююючи етилацетатом в гексанах (0100%). Бажані фракції об'єднували, і розчинник видаляли у вакуумі з одержанням 1-(4’-(5-(3бензилуреїдо)-1-метил-1H-піразол-4-іл)дифеніл-4-іл)циклопропанкарбонової кислоти метилового ефіру (105 мг, вихід 32%) у вигляді коричневого масла. РХ/МС обчислене для C29H28N4O3 (m/e) 480, спостерігали 481,1 (M+H, ЕР+). До розчину 1-(4'-(5-(3-бензилуреїдо)-1-метил-1H-піразол-4-іл)дифеніл-4іл)циклопропанкарбонової кислоти метилового ефіру (105 мг, 0,22 ммоль) в ТГФ (6 мл) і етанолі (6 мл) додавали надлишок 1,0 M розчину гідроксиду натрію (5,83 мл, 5,83 ммоль) при кімнатній температурі. Одержаний в результаті світло-жовтий розчин перемішували протягом 15 г при кімнатній температурі, і в цей час аналіз РХ/МС показав відсутність початкової речовини. Потім розчинник видаляли, і основний водний шар розбавляли водою, і нейтральні домішки екстрагували в етилацетат. Основний розчин нейтралізували 1,0 н. HCl. Одержані в результаті тверді речовини збирали фільтруванням і промивали водою і гексанами. Після висушування на повітрі 1-(4'-(5-(3-бензилуреїдо)-1-метил-1H-піразол-4-іл)дифеніл-4-іл)циклопропанкарбонову 1 кислоту (59 мг, вихід 57%) виділили у вигляді білуватої твердої речовини. . H ЯМР (ДМСО-d6) δ 12.34 (br. s., 1H), 8.27 (s, 1H), 7.81 (s, 1H), 7.36 - 7.73 (m, 9H), 7.19 - 7.36 (m, 4H), 7.03 (br. s., 1H), 4.31 (d, J = 5.8 Гц, 2H), 3.60 - 3.74 (m, 3H), 1.39 - 1.58 (m, 2H), 1.04 - 1.30 (m, 2H). РХ/МС обчислене для C28H26N4O3 (m/e) 466, спостерігали. 467,3 (M+H, ЕР+). Приклад 25 1-{4'-[1-Метил-5-((S)-3-феніл-бутириламіно)-1H-піразол-4-іл]-дифеніл-4-іл}циклопропанкарбонова кислота O O N O N N 30 35 40 45 50 До розчину (S)-3-фенілбутанової кислоти (181 мг, 1,1 ммоль) в толуолі (5 мл) додавали надлишок тіонілхлориду (2,62 г, 1,61 мл, 22,0 ммоль) при кімнатній температурі. Одержаний в результаті безбарвний розчин перемішували протягом 15 г при температурі утворення флегми. Потім реакційну суміш охолоджували до кімнатної температури, і розчинник видаляли у вакуумі. Одержаний в результаті залишок піддавали азеотропній перегонці один раз з толуолом і висушували у високому вакуумі. До суспензії 1-(4'-(5-аміно-1-метил-1H-піразол-4-іл)дифеніл-4-іл)циклопропанкарбонової кислоти метилового ефіру (174 мг, 0,5 ммоль) і диметиламінопіридину (ДМАП) (67,2 мг, 0,55 ммоль) в дихлорметані (5 мл) додавали розчин (S)-3-фенілбутаноїлхлориду (одержаний вище) (95,9 мг, 0,525 ммоль) у дихлорметані (5 мл). Одержану в результаті світло-коричневу суспензію перемішували протягом 2 діб при кімнатній температурі в атмосфері азоту, і в цей час аналіз ТШХ показав відсутність початкової речовини. Суміш розбавляли водою і дихлорметаном, і два шари розділяли, і водний шар екстрагували ще раз дихлорметаном. Об'єднані екстракти промивали соляним розчином і висушували над безводним MgSO4. В результаті фільтрування і концентрації одержали неочищений залишок, який очищали, використовуючи колоночну хроматографію ISCO (80 г), елююючи етилацетатом в гексанах (0-100%). Бажані фракції об'єднували, і розчинник видаляли у вакуумі з одержанням (S)-1-(4’-(1-метил-5-(3фенілбутанамідо)-1H-піразол-4-іл) дифеніл-4-іл)циклопропанкарбонової кислоти метилового ефіру (50 мг, вихід 20%) у вигляді білої твердої речовини. РХ/МС обчислене для C31H31N3O3 (m/e) 493, спостерігали 494,1 (M+H, ЕР+). До розчину (S)-1-(4'-(1-метил-5-(3-фенілбутанамідо)-1H-піразол-4-іл)дифеніл-4іл)циклопропанкарбонової кислоти метилового ефіру (43 мги, 0,087 ммоль) в ТГФ (5 мл) і EtOH (5 мл) додавали надлишок 1 M розчину гідроксиду натрію (1,74 мл, 1,74 ммоль) при кімнатній температурі. Одержаний в результаті розчин перемішували протягом 15 г при кімнатній температурі, і в цей час аналіз ТШХ і РХМС показав відсутність початкової речовини. Потім 24 UA 109867 C2 5 10 15 20 25 30 35 40 45 50 55 розчинник видаляли у вакуумі, і водний шар розбавляли водою і нейтралізували 1 N HCl. Одержані в результаті тверді речовини збирали фільтруванням і промивали водою і гексанами. Після висушування на повітрі (S)-1-(4'-(1-метил-5-(3-фенілбутанамідо)-1H-піразол-4-іл)дифеніл4-іл)циклопропанкарбонову кислоту (32 мг, вихід 76,6%) виділили у вигляді білуватої твердої 1 речовини. H ЯМР (ДМСО-d6) δ 12.35 (br. s., 1H), 9.95 (s, 1H), 7.79 (s, 1H), 7.53 - 7.71 (m, 4H), 7.47 (d, J = 8.3 Гц, 2H), 7.42 (d, J = 8.3 Гц, 2H), 7.30 - 7.38 (m, 4H), 7.25 (td, J = 6.0, 2.6 Гц, 1H), 3.27 - 3.43 (m, 4H), 2.63 - 2.86 (m, 2H), 1.41 - 1.58 (m, 2H), 1.30 (d, J = 7.0 Гц, 3H), 1.13 - 1.23 (m, 2H). РХ/МС обчислене для C30H29N3O3 (m/e) 479, спостерігали 480,3 (M+H, ЕР+). Приклад 26 Аналіз току кальцію з використанням зчитуючого пристрою для флуорометрічної візуалізації планшетів (FLIPR; від англ. “Fluorometric Imaging Plate Reader”) Умови культивування клітин: Стабільну лінію клітин ChemiScreen з оптимізованим вмістом кальцію, що містить рекомбінантний рецептор лізофосфоліпіду LPA1 людини, отримували у фірми Chemicon International, Inc./Millipore. Клітини культивували в середовищі Ігла, модифікованою Дульбекко (DMEM), з високим вмістом глюкози з додаванням 10% фетальної бичачої сироватки, 2 мм глутаміну, 100 од./мл пеніциліну/100мг/мл стрептоміцину, 1X замінних амінокислот, 10 мМ 4-(2-гідроксиетил)-1-піперазин етансульфонової кислоти (ГЕПЕС) і 0,25 мг/мл генетицину. Клітини збирали розчином трипсин/ЕДТА і підраховували, використовуючи реагент ViaCount. Об'єм клітинної суспензії доводили до 2,0 x 105 клітин/мл повним ростовим середовищем. Аліквоти по 50 мкл дозували в 384-лункові чорні планшети з прозорим дном, оброблені для клітинних культур (BD), і мікропланшети поміщали в термостат на 37 °C протягом ночі. Наступної доби планшети використовували в аналізі. Нанесення барвника і аналіз: Буфер для нанесення (набір FLIPR Calcium-4, Molecular Devices) готували шляхом розчинення вмісту однієї пляшки в 100 мл збалансованого сольового розчину Хенкса (HBSS; від англ. “Hank's balanced salt solution”), що містить 20 мМ ГЕПЕС і 2,5 мМ пробенецид. Планшети завантажували в пристрій для відмивання планшетів Biotek, і ростове середовище видаляли і замінювали 20 мкл збалансованого сольового розчину Хенкса, що містить 20 мМ ГЕПЕС і 2,5 мМ пробенецид, а потім 25 мкл буфера для нанесення. Потім планшети інкубували протягом 30 хвилин при 37 °C. Протягом інкубації готували тестовані сполуку шляхом додавання 90 мкл буфера HBSS/20 мМ ГЕПЕС/0,1% бичачого сироваткового альбуміну (БСА) до 2 мкл серійно розведених сполук. Для приготування серійних розведень готували 10 мМ початкові розчини сполук в 100% ДМСО. Планшет для розведення сполук збирали таким чином: у лунку № 1 поміщали 29 мкл початкового розчину сполуки і 31 мкл ДМСО; у лунки 2-10 поміщали 40 мкл ДМСО; перемішували і переносили 20 мкл розчину з лунки №1 у лунку №2; продовжували серійні розведення 1:3 до 10 стадій; переносили 2 мкл розведеної сполуки в дві повторювані лунки 384лункового “аналітичного планшета”, а потім додавали 90 мкл буфера. Після інкубації планшети з клітинами і “аналітичні” планшети переносили в FLIPR, і 20 мкл розведених сполук переносили в планшети з клітинами за допомогою FLIPR. Моніторинг додавання сполук проводили за допомогою FLIPR, щоб виявити яку-небудь агоністичну активність сполук. Потім планшети інкубували протягом 30 хвилин при кімнатній температурі в захищеному від світла місці. Після інкубації планшети повертали в FLIPR, і в планшети для клітин додавали 20 мкл 4,5X концентрованого агоніста. Протягом аналізу зчитування флуоресценції проводили одночасно зі всіх 384 лунок планшета для клітин кожні 1,5 секунд. П'ять зчитувань знімали, щоб встановити стабільний базовий рівень, потім 20 мкл зразка швидко (30 мкл/с) і одночасно додавали в кожну лунку планшета для клітин. Моніторинг флуоресценції проводили безперервно до, під час і після додавання зразка протягом сумарного періоду часу 100 секунд. Визначали відповіді (підвищення піку флуоресценції) в кожній лунці після додавання агоніста. Початкове зчитування флуоресценції з кожної лунки перед стимуляцією ліганда використовували як нульове базове значення для даних з кожної лунки. Відповіді виражали у вигляді % інгібування контрольного буфера. Значення IC50, визначене як концентрація сполуки, необхідна для 50% інгібування контрольного буфера, обчислювали шляхом приведення у відповідність даних відсотка інгібування 10 концентрацій з сигмоїдною (4параметричною логістичною) моделлю доза-відповідь, використовуючи програму Genedata Condoseo [модель 205, F(x) = (A+(B-A)/(1+((C/x)^D))))], і результати наведені нижче в таблиці 1: 25 UA 109867 C2 Таблиця 1 Антагоністичні активності у відношенні LPA1R і LPA3R Приклад № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 5 LPA1R IC50 (мкМ) або (%інгібування на мкМ) 17,50 (64,8% на 30) 0,035 3,59 1,59 (65,9% на 30) 0,02 0,112 >30 >30 >30 >30 3,93 24,65 (50,5% на 30) 1,4 0,038 0,107 0,024 0,042 0,057 0,176 >30 0,644 (97,2% на 30) >30 >30 0,58 (82,8% на 10) 0,88 (85,5% на 30) LPA3R IC50 (мкМ) >30 >30 >30 >30 8,35 2,47 >30 >30 >30 >30 >30 >30 >30 >30 >30 5,8 0,478 8,26 >30 >30 >30 >30 >30 >30 >30 Зрозуміло, що винахід не обмежений конкретними втіленнями винаходу, описаними вище, оскільки можуть бути проведені зміни цих конкретних втілень, і вони все ж таки знаходяться в межах об'єму формули винаходу, що додається. ФОРМУЛА ВИНАХОДУ 1. Сполука формули (І): 10 , (I) 15 де: X позначає атом кисню, азоту або вуглецю; R1 позначає нижчий алкіл; R2 позначає атом водню, атом галогену, -СН2С(О)ОН, алкокси, циклоалкілкарбонову кислоту, незаміщений феніл або феніл, заміщений атомом галогену, -СН2С(О)ОН, 26 UA 109867 C2 5 10 15 20 25 30 35 40 45 50 55 60 циклопропанкарбоновою кислотою, етиловим ефіром циклопропанкарбонової кислоти, метансульфоніламінокарбонілом або тетразолом; і R3 позначає циклобутил, оксетаніл, незаміщений нижчий алкіл, нижчий алкіл, заміщений незаміщеним фенілом, або нижчий алкіл, заміщений фенілом, заміщеним атомом галогену або CF3, або її фармацевтично прийнятна сіль. 2. Сполука за п. 1, де X позначає атом кисню. 3. Сполука за п. 1, де R1 позначає метил. 4. Сполука за п. 1, де R2 позначає атом водню, F, Сl, -СН2С(О)ОН, метокси, етокси, циклопропанкарбонову кислоту, циклогексаноцтову кислоту або незаміщений феніл. 5. Сполука за п. 1, де R2 позначає феніл, заміщений -СН2С(О)ОН, циклопропанкарбоновою кислотою або етиловим ефіром циклопропанкарбонової кислоти. 6. Сполука за п. 1, де R3 позначає циклобутил, оксетаніл або незаміщений нижчий алкіл. 7. Сполука за п. 1, де R3 позначає нижчий алкіл, заміщений фенілом, заміщеним F, Сl або -CF3. 8. Сполука за п. 1, де сполука вибрана з групи, що включає: 2-метил-4-феніл-2Н-піразол-3-ілкарбамінової кислоти (R)-1-фенілетиловий ефір; {4'-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1Н-піразол-4-іл]дифеніл-4-іл}оцтову кислоту; (2-метил-4-феніл-2Н-піразол-3-іл)карбамінової кислоти 1-(2-хлорфеніл)етиловий ефір; 1-{4'-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1Н-піразол-4-іл]дифеніл-4іл}циклопропанкарбонової кислоти етиловий ефір; 1-{4'-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1Н-піразол-4-іл]дифеніл-4іл}циклопропанкарбонову кислоту; 1-(4'-{5-[1-(2-хлорфеніл)-етоксикарбоніламіно]-1-метил-1Н-піразол-4-іл}дифеніл-4іл)циклопропанкарбонову кислоту; (4-дифеніл-4-іл-2-метил-2Н-піразол-3-іл)карбамінової кислоти (R)-1-фенілетиловий ефір; [4-(4-метоксифеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти (R)-1-фенілетиловий ефір; 1-{4-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1Н-піразол-4-іл]феніл}циклопропанкарбонову кислоту; {4-[1-метил-5-((R)-1-фенілетоксикарбоніламіно)-1Н-піразол-4-іл]феніл}оцтову кислоту; [4-(4-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти 1-(2-хлорфеніл)етиловий ефір; [4-(2-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти 1-(3трифторметилфеніл)етиловий ефір; [4-(2-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти 1-(2-хлорфеніл)етиловий ефір; (R)-1-{4'-[5-(втор-бутоксикарбоніламіно)-1-метил-1Н-піразол-4-іл]дифеніл-4іл}циклопропанкарбонову кислоту; (R)-1-{4'-[5-(1,2-диметилпропоксикарбоніламіно)-1-метил-1Н-піразол-4-іл]дифеніл-4іл}циклопропанкарбонову кислоту; (R)-1-{4'-[5-((1-(2-фторфеніл)етокси)карбоніламіно)-1-метил-1Н-піразол-4-іл]дифеніл-4іл}циклопропанкарбонову кислоту; (R)-1-{4'-[1-метил-5-((1-(3-(трифторметил)феніл)етокси)карбоніламіно)-1Н-піразол-4-іл]дифеніл4-іл}циклопропанкарбонову кислоту; 1-{4'-[5-((1-(4-фторфеніл)етокси)карбоніламіно)-1-метил-1Н-піразол-4-іл]дифеніл-4іл}циклопропанкарбонову кислоту; 1-{4'-[5-(циклобутоксикарбоніламіно)-1-метил-1Н-піразол-4-іл]дифеніл-4іл}циклопропанкарбонову кислоту; 1-{4'-[1-метил-5-((оксетан-3-ілокси)карбоніламіно)-1Н-піразол-4-іл]дифеніл-4іл}циклопропанкарбонову кислоту; [4-(2-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти (R)-1-(2-хлорфеніл)етиловий ефір; [4-(2-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти (S)-1-(2-хлорфеніл)етиловий ефір; [4-(2-фторфеніл)-2-метил-2Н-піразол-3-іл]карбамінової кислоти (R)-1-(3трифторметилфеніл)етиловий ефір; 1-{4'-[5-(3-бензилуреїдо)-1-метил-1Н-піразол-4-іл]дифеніл-4-іл}циклопропанкарбонову кислоту або 1-{4'-[1-метил-5-((S)-3-фенілбутириламіно)-1Н-піразол-4-іл]дифеніл-4-іл}-циклопропанкарбонову кислоту. 9. Сполука за будь-яким з пп. 1-8 для застосування як терапевтично активної речовини. 10. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будьяким з пп. 1-8 і терапевтично інертний носій. 27 UA 109867 C2 5 11. Застосування сполуки за будь-яким з пп. 1-8 для лікування або профілактики фіброзу легенів. 12. Застосування сполуки за будь-яким з пп. 1-8 для одержання лікарського засобу для лікування або профілактики фіброзу легенів. 13. Сполука за будь-яким з пп. 1-8 для лікування або профілактики фіброзу легенів. 14. Спосіб лікування або профілактики фіброзу легенів, за яким пацієнту, що потребує цього, вводять ефективну кількість сполуки за будь-яким з пп. 1-8. Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted pyrazole compounds as lpar antagonists
Автори англійськоюGabriel, Stephen Deems, Hamilton, Matthew Michael, Qian, Yimin, Sidduri, Achyutharao
Автори російськоюГэбриель Стивен Димс, Гамильтон Мэтью Майкл, Цянь Иминь, Сиддури Ачютарао
МПК / Мітки
МПК: A61K 31/192, C07D 231/40, A61P 19/04
Мітки: піразолу, антагоністи, lpar, лізофосфатидної, сполуки, кислоти, рецепторів, заміщені
Код посилання
<a href="https://ua.patents.su/30-109867-zamishheni-spoluki-pirazolu-yak-antagonisti-receptoriv-lizofosfatidno-kisloti-lpar.html" target="_blank" rel="follow" title="База патентів України">Заміщені сполуки піразолу як антагоністи рецепторів лізофосфатидної кислоти (lpar)</a>
Попередній патент: Спосіб автоматизованого контролю та розрахунку маси нафтопродуктів на паливних базах і в резервуарних парках при їх зберіганні в вертикальних резервуарах
Наступний патент: Сполуки n-алкілтриазолу як антагоністи лізофосфатидної кислоти (lpar)
Випадковий патент: Лігатура азотовмісна