2,6-заміщені-4-монозаміщені амінопіримідини як антагоністи рецепторів простагландину d2
Номер патенту: 95950
Опубліковано: 26.09.2011
Автори: Харріс Кіт Джон, Агіар Жуасі К., Гіллеспі Тімоті Алан, Стефані Девід, Гарднер Чарльз Дж.
Формула / Реферат
1. Сполука формули (І):
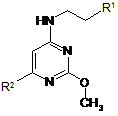 , (I)
, (I)
де
R1 являє собою 2,4-дихлорфеніл або 4-трифторметоксифеніл, і
коли R1 являє собою 2,4-дихлорфеніл, тоді R2 являє собою 3-карбоксипіролідиніл, 3,5-ди-(1-гідрокси-1-метилетил)феніл, 3-амінопіперидин-1-іл, 4-амінопіперидин-1-іл, 4-ацетамідпіперидин-1-іл, 1-метил-2-карбокси-2,3-дигідро-1H-індол-5-іл, 3-(1-трет-бутилсульфоніламінокарбоніл-1-метилетил)феніл, 3-(1-диметиламіносульфоніламінокарбоніл-1-метилетил)феніл, 3-(1-тіоморфолін-4-ілкарбоніл-1-метилетил)феніл, 3-(1-амінокарбоніл-1-метилетил)феніл, 3-(1-диметиламінокарбоніл-1-метилетил)феніл, 3-карбоксиметилпіперидин-1-іл, 3-метилсульфоніламінокарбонілпіперидин-1-іл, 3-етилсульфоніламінокарбонілпіперидин-1-іл, 3-трет-бутилсульфоніламінокарбонілпіперидин-1-іл, 3-трифторметилсульфоніламінокарбонілпіперидин-1-іл, 3-[(1Н-тетразол-5-іл)амінокарбоніл]піперидин-1-іл, 3-амінокарбонілпіперидин-1-іл, 3-диметиламінокарбонілпіперидин-1-іл, 3-диметиламіносульфоніламінокарбонілпіперидин-1-іл або 2-карбокси-2,3-дигідробензофуран-5-іл,
і, коли R1 являє собою 4-трифторметоксифеніл, тоді R2 являє собою 3-(1-метил-1-карбоксіетил)піперидиніл, 3-карбоксипіперидиніл, 3-метилсульфоніламінокарбонілпіперидин-1-іл, 5-карбокситіофен-2-іл,
або її фармацевтично прийнятна сіль, гідрат або сольват, її фармацевтично прийнятні проліки або фармацевтично прийнятна сіль, гідрат або сольват зазначених проліків.
2. Сполука за п. 1, вибрана з групи:
1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метилпіримідин-4-іл}піролідин-3-карбонова кислота,
2-(1-{2-метокси-6-[2-(4-трифторметоксифеніл)етиламіно]піримідин-4-іл}піперидин-3-іл)-2-метилпропіонова кислота,
2-[3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}-5-(1-гідрокси-1-метилетил)феніл]пропан-2-ол,
[6-(3-амінопіперидин-1-іл)-2-метоксипіримідин-4-іл]-[2-(2,4-дихлорфеніл)етил]амін,
[6-(4-амінопіперидин-1-іл)-2-метоксипіримідин-4-іл]-[2-(2,4-дихлорфеніл)етил]амін,
N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-4-іл)ацетамід,
5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}-1-метил-2,3-дигідро-1Н-індол-2-карбонова кислота,
[2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}феніл)-2-метилпропіоніл]амід 2-метилпропан-2-сульфонової кислоти,
[2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}феніл)-2-метилпропіоніл]амід N,N-диметиламід-2-сульфонової кислоти,
2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}феніл)-2-метил-1-тіоморфолін-4-ілпропан-1-он,
2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}феніл)ізобутирамід,
2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}феніл)-N,N-диметилізобутирамід,
(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-іл)оцтова кислота,
1-{2-метокси-6-[2-(4-трифторметоксифеніл)етиламіно]піримідин-4-іл}піперидин-3-карбонова кислота,
N-(1-{2-метокси-6-[2-(4-трифторметоксифеніл)етиламіно]піримідин-4-іл}піперидин-3-карбоніл)метансульфонамід,
N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбоніл)метансульфонамід,
(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбоніл)амід етансульфонової кислоти,
(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбоніл)амід 2-метилпропан-2-сульфонової кислоти,
N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбоніл)-С,С,С-трифторметансульфонамід,
(1H-тетразол-5-іл)амід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбонової кислоти,
амід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбонової кислоти,
диметиламід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбонової кислоти,
1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбоксамід N,N-диметиламід-2-сульфонової кислоти,
5-{2-метокси-6-[2-(4-трифторметоксифеніл)етиламіно]піримідин-4-іл}-тіофен-2-карбонова кислота чи
5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}-2,3-дигідробензофуран-2-карбонова кислота.
3. Сполука або складноефірні проліки за п. 1, що вибрана з групи:
1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метилпіримідин-4-іл}піролідин-3-карбонова кислота,
2-(1-{2-метокси-6-[2-(4-трифторметоксифеніл)етиламіно]піримідин-4-іл}піперидин-3-іл)-2-метилпропіонова кислота,
2-[3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}-5-(1-гідрокси-1-метилетил)феніл]пропан-2-ол,
[6-(3-амінопіперидин-1-іл)-2-метоксипіримідин-4-іл]-[2-(2,4-дихлорфеніл)етил]амін,
[6-(4-амінопіперидин-1-іл)-2-метоксипіримідин-4-іл]-[2-(2,4-дихлорфеніл)етил]амін,
N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-4-іл)ацетамід,
5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}-1-метил-2,3-дигідро-1Н-індол-2-карбонова кислота,
[2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}феніл)-2-метилпропіоніл]амід 2-метилпропан-2-сульфонової кислоти,
[2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}феніл)-2-метилпропіоніл]амід] N,N-диметиламід-2-сульфонової кислоти,
2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}феніл)-2-метил-1-тіоморфолін-4-ілпропан-1-он,
2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}феніл)ізобутирамід,
2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}феніл)-N,N-диметилізобутирамід,
(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-іл)оцтова кислота,
1-{2-метокси-6-[2-(4-трифторметоксифеніл)етиламіно]піримідин-4-іл}піперидин-3-карбонова кислота,
N-(1-{2-метокси-6-[2-(4-трифторметоксифеніл)етиламіно]піримідин-4-іл}піперидин-3-карбоніл)метансульфонамід,
етиловий ефір 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}-1-метил-2,3-дигідро-1Н-індол-2-карбонової кислоти,
етиловий ефір (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-іл)оцтової кислоти,
N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбоніл)метансульфонамід,
(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбоніл)амід етансульфонової кислоти,
(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбоніл)амід 2-метилпропан-2-сульфонової кислоти,
N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбоніл)-С,С,С-трифторметансульфонамід,
(1Н-тетразол-5-іл)амід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбонової кислоти,
амід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбонової кислоти,
диметиламід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбонової кислоти,
1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}піперидин-3-карбоксамід N,N-диметиламід-2-сульфонової кислоти,
5-{2-метокси-6-[2-(4-трифторметоксифеніл)етиламіно]піримідин-4-іл}-тіофен-2-карбонова кислота,
5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}-2,3-дигідробензофуран-2-карбонова кислота,
або її фармацевтично прийнятна сіль, гідрат або сольват.
4. Фармацевтична композиція, яка містить фармацевтично ефективну кількість сполуки за п. 1, або її фармацевтично прийнятної солі, гідрату або сольвату, її фармацевтично прийнятних проліків або фармацевтично прийнятної солі, гідрату або сольвату проліків, у суміші з фармацевтично прийнятним носієм.
5. Спосіб лікування алергійного захворювання, системного мастоцитозу, порушення, що супроводжується системною активацією мастоцитів, анафілактичного шоку, бронхоконстрикції, бронхіту, кропивниці, екземи, захворювань, що супроводжуються свербежем, захворювань, що виникають як вторинні захворювання в результаті поведінки, яка супроводжується свербежем, запалення, хронічних обструктивних захворювань легень, ішемічного реперфузійного ушкодження, розладу мозкового кровообігу, хронічного ревматоїдного артриту, плевриту або виразкового коліту в пацієнта, який потребує такого лікування, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за п. 1, або її фармацевтично прийнятної солі, гідрату або сольвату, її фармацевтично прийнятних проліків або фармацевтично прийнятної солі, гідрату або сольвату проліків.
6. Спосіб за п. 5, у якому захворюванням, що виникає як вторинне захворювання в результаті поведінки, яка супроводжується свербежем, є катаракта, відшарування сітківки, запалення, інфекція або порушення сну.
7. Спосіб за п. 5, у якому алергійним захворюванням є алергійний риніт, алергійний кон'юнктивіт, атопічний дерматит, бронхіальна астма або харчова алергія.
8. Спосіб за п. 5, у якому захворюванням, що супроводжується свербежем, є атопічний дерматит або кропивниця.
9. Спосіб за п. 5, у якому захворюванням, що виникає як вторинне захворювання в результаті поведінки, яка супроводжується свербежем, є катаракта, відшарування сітківки, запалення, інфекція або порушення сну.
10. Спосіб за п. 5, який призначений для лікування бронхіальної астми.
11. Спосіб за п. 5, який призначений для лікування алергійного риніту.
12. Спосіб за п. 5, який призначений для лікування алергійного дерматиту.
13. Спосіб за п. 5, який призначений для лікування алергійного кон'юнктивіту.
14. Спосіб за п. 5, який призначений для лікування хронічного обструктивного захворювання легень.
15. Фармацевтична композиція, яка містить фармацевтично ефективну кількість сполуки за п. 1, або її фармацевтично прийнятної солі, гідрату або сольвату, її фармацевтично прийнятних проліків або фармацевтично прийнятної солі, гідрату або сольвату проліків, і сполуки, яка вибирається з групи, що включає антигістамін, антагоніст лейкотриєну, бета-агоніст, інгібітор PDE4, антагоніст ТР і антагоніст CrTh2, у суміші з фармацевтично прийнятним носієм.
16. Фармацевтична композиція за п. 15, де антигістаміном є фексофенадин, лоратадин або цитиризин, антагоністом лейкотриєну є монтелукаст або зафірлукаст, бета-агоністом є альбутерол, сальбутерол або тербуталін, інгібітором PDE4 є рофлуміласт або циломіласт, антагоністом ТР є раматробан і антагоністом CrTh2 є раматробан.
Текст
1. Сполука формули (І): R1 HN 2 (19) 1 3 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-1-метил-2,3-дигідро-1Ніндол-2-карбонова кислота, [2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2метилпропіоніл]амід 2-метилпропан-2сульфонової кислоти, [2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2метилпропіоніл]амід N,N-диметиламід-2сульфонової кислоти, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2-метил-1тіоморфолін-4-ілпропан-1-он, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)ізобутирамід, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-N,Nдиметилізобутирамід, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-іл)оцтова кислота, 1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбонова кислота, N-(1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбоніл)метансульфонамід, N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3карбоніл)метансульфонамід, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)амід етансульфонової кислоти, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)амід 2-метилпропан-2-сульфонової кислоти, N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)С,С,С-трифторметансульфонамід, (1H-тетразол-5-іл)амід 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти, амід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбонової кислоти, диметиламід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]2-метоксипіримідин-4-іл}піперидин-3-карбонової кислоти, 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоксамід N,N-диметиламід-2-сульфонової кислоти, 5-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4-іл}тіофен-2-карбонова кислота чи 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-2,3-дигідробензофуран-2карбонова кислота. 3. Сполука або складноефірні проліки за п. 1, що вибрана з групи: 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метилпіримідин-4-іл}піролідин-3-карбонова кислота, 95950 4 2-(1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-іл)-2-метилпропіонова кислота, 2-[3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-5-(1-гідрокси-1метилетил)феніл]пропан-2-ол, [6-(3-амінопіперидин-1-іл)-2-метоксипіримідин-4іл]-[2-(2,4-дихлорфеніл)етил]амін, [6-(4-амінопіперидин-1-іл)-2-метоксипіримідин-4іл]-[2-(2,4-дихлорфеніл)етил]амін, N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-4-іл)ацетамід, 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-1-метил-2,3-дигідро-1Ніндол-2-карбонова кислота, [2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2метилпропіоніл]амід 2-метилпропан-2сульфонової кислоти, [2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2метилпропіоніл]амід] N,N-диметиламід-2сульфонової кислоти, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2-метил-1тіоморфолін-4-ілпропан-1-он, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)ізобутирамід, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-N,Nдиметилізобутирамід, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-іл)оцтова кислота, 1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбонова кислота, N-(1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбоніл)метансульфонамід, етиловий ефір 5-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}1-метил-2,3-дигідро-1Н-індол-2-карбонової кислоти, етиловий ефір (1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-іл)оцтової кислоти, N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3карбоніл)метансульфонамід, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)амід етансульфонової кислоти, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)амід 2-метилпропан-2-сульфонової кислоти, N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)С,С,С-трифторметансульфонамід, (1Н-тетразол-5-іл)амід 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти, амід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбонової кислоти, 5 95950 6 диметиламід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]2-метоксипіримідин-4-іл}піперидин-3-карбонової кислоти, 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоксамід N,N-диметиламід-2-сульфонової кислоти, 5-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4-іл}тіофен-2-карбонова кислота, 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-2,3-дигідробензофуран-2карбонова кислота, або її фармацевтично прийнятна сіль, гідрат або сольват. 4. Фармацевтична композиція, яка містить фармацевтично ефективну кількість сполуки за п. 1, або її фармацевтично прийнятної солі, гідрату або сольвату, її фармацевтично прийнятних проліків або фармацевтично прийнятної солі, гідрату або сольвату проліків, у суміші з фармацевтично прийнятним носієм. 5. Спосіб лікування алергійного захворювання, системного мастоцитозу, порушення, що супроводжується системною активацією мастоцитів, анафілактичного шоку, бронхоконстрикції, бронхіту, кропивниці, екземи, захворювань, що супроводжуються свербежем, захворювань, що виникають як вторинні захворювання в результаті поведінки, яка супроводжується свербежем, запалення, хронічних обструктивних захворювань легень, ішемічного реперфузійного ушкодження, розладу мозкового кровообігу, хронічного ревматоїдного артриту, плевриту або виразкового коліту в пацієнта, який потребує такого лікування, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за п. 1, або її фармацевтично прийнятної солі, гідрату або сольвату, її фармацевтично прийнятних проліків або фармацевтично прийнятної солі, гідрату або сольвату проліків. 6. Спосіб за п. 5, у якому захворюванням, що виникає як вторинне захворювання в результаті поведінки, яка супроводжується свербежем, є ката ракта, відшарування сітківки, запалення, інфекція або порушення сну. 7. Спосіб за п. 5, у якому алергійним захворюванням є алергійний риніт, алергійний кон'юнктивіт, атопічний дерматит, бронхіальна астма або харчова алергія. 8. Спосіб за п. 5, у якому захворюванням, що супроводжується свербежем, є атопічний дерматит або кропивниця. 9. Спосіб за п. 5, у якому захворюванням, що виникає як вторинне захворювання в результаті поведінки, яка супроводжується свербежем, є катаракта, відшарування сітківки, запалення, інфекція або порушення сну. 10. Спосіб за п. 5, який призначений для лікування бронхіальної астми. 11. Спосіб за п. 5, який призначений для лікування алергійного риніту. 12. Спосіб за п. 5, який призначений для лікування алергійного дерматиту. 13. Спосіб за п. 5, який призначений для лікування алергійного кон'юнктивіту. 14. Спосіб за п. 5, який призначений для лікування хронічного обструктивного захворювання легень. 15. Фармацевтична композиція, яка містить фармацевтично ефективну кількість сполуки за п. 1, або її фармацевтично прийнятної солі, гідрату або сольвату, її фармацевтично прийнятних проліків або фармацевтично прийнятної солі, гідрату або сольвату проліків, і сполуки, яка вибирається з групи, що включає антигістамін, антагоніст лейкотриєну, бета-агоніст, інгібітор PDE4, антагоніст ТР і антагоніст CrTh2, у суміші з фармацевтично прийнятним носієм. 16. Фармацевтична композиція за п. 15, де антигістаміном є фексофенадин, лоратадин або цитиризин, антагоністом лейкотриєну є монтелукаст або зафірлукаст, бета-агоністом є альбутерол, сальбутерол або тербуталін, інгібітором PDE4 є рофлуміласт або циломіласт, антагоністом ТР є раматробан і антагоністом CrTh2 є раматробан. Даний винахід належить до 2,6-заміщених-4монозаміщених сполук амінопіримідину, їхнього одержання, фармацевтичних композицій, що містить ці сполуки, і їх фармацевтичного застосування в лікуванні патологічних станів, які можна контролювати інгібуванням рецептора простагландину D2. Показано, що локальна стимуляція алергеном пацієнт, із з алергійним ринітом, бронхіальною астмою, алергійним кон'юнктивітом і атопічним дерматитом приводить до швидкого росту рівня простагландину D2 «(PGD2)» у назальній і бронхіальній змивній рідині, сльозах і рідині, зібраної зі шкірного міхура по методу «шкірної камери». PGD2 може робити ряд запальних впливів, наприклад, підвищувати проникність судин у кон'юнктиві і шкірі, підвищувати опір дихальних шляхів носа, викликати звуження дихальних шляхів і проникнення еозинофілів у кон'юнктиву і трахею. PGD2 - основний циклооксигеназний продукт арахідонової кислоти, продукований мастоцитами при імунологічному стимулюванні [Lewis, RА, Soter ΝΑ, Diamond PT, Austen KF, Oates JA, Roberts LJ II, prostaglandin D2 generation after activation of rat and human mast cells with anti-Ig, J. Immunol. 129, 16271631, 1982]. Активовані мастоцити, одне з головних джерел PGD2, відіграю!ь одну з ключових ролей у виникненні алергійної реакції при таких станах, як астма, алергійний риніт, алергійний кон'юнктивіт, алергійний дерматит і інші захворювання [Brightling СЕ, Bradding Ρ, Pavord ID, Wardlaw AJ, New Insights into the role of the mast cell in asthma, Clin Exp Allergy 33, 550-556, 2003]. Багато впливів PGD2 опосередковуються його діпо на рецептор простагландину D («DP») - реце 7 птор, зв'язаний з G-білком, який експресується на епітелії й у гладких м'язах. При астмі респіраторний епітелій уже давно вважається головним джерелом запальних цитокінів і хемокінів, що визначають розвиток захворювання [Holgate S, Lackie P, Wilson S, Roche W, Davies D, Bronchial Epithelium as a Key Regulator of Airway Allergen Sensitzation and Remodeling in Asthma, Am J Respir Crit Care Med. 162, 113-117, 2000]. В експериментальній моделі астми мишей при стимулюванні антигеном відбувається різка активація рецептора DP на епітелії дихальних шляхів [Matsuoka Τ, Hirata M, Tanaka II, Takahashi Y, Murata Τ, Kabashima К. Sugimoto Υ, Kobayashi Τ, Ushikubi F, Aze Y, Eguchi N, Urade Y, Yoshida N, Kimura K, Mizoguchi A, Honda Y, Nagai H, Narumiya S, prostaglandin D2 as a mediator of allergic asthma, Science 287, 2013-2017, 2000]. У нокаутних мишей з відсутнім рецептором DP помітно знижується гіперактивність дихальних шляхів і хронічне запалення [Matsuoka Τ, Hirata M, Tanaka Η, Takahashi Υ, Murata Τ, Kabashima Κ, Sugimoto Y, Kobayashi Τ, Ushikubi F, Aze Υ, Eguchi Ν, I Irade Y, Yoshida N, Kimura K, Mizoguchi A, Honda Y, Nagai H, Narumiya S, Prostaglandin D2 as a mediator of allergic asthma, Science 287, 2013-2017, 2000] - дві найважливіших ознаки астми людини. Вважається також, що рецептор DP задіяний в алергійному риніті людини, поширеному алергійному захворюванні, що характеризується такими симптомами, як чихання, свербіж, ринорея і закладеність носа. Місцеве застосування PGD2 у носовій порожнині викликає залежне від дози збільшення закладеності носа [Doyle WJ, Boehm S, Skoner DP, Physiologic responses to intranasal doseresponse challenges with histaMine, methacholine, bradykinin, and prostaglandin in adult volunteers with and without nasal allergy, J Allergy Clin Immunol. 86(6 Pt 1), 924-35, 1990]. Було показано, що антагоністи рецептора DP знижують запалення дихальних шляхів в експериментальній моделі астми морських свинок [Arimura A, Yasui K, Kishino J, Asanuma F, Hasegawa H, Kakudo S, Ohtani M, Arita H (2001), Prevention of allergic inflammation by a novel prostaglandin receptor antagonist, S-5751, J. Pharmacol. Exp. Ther. 298(2), 411-9, 2001]. Таким чином, PGD2, очевидно, діє на рецептор DP і відіграє важливу роль у виявленні деяких основних особливостей алергійної астми. Було показано, що антагоністи DP можуть ефективно послаблювати симптоми алергійного риніту в багатьох видів, зокрема, було показано, що вони можуть придушувати індуковану антигенами закладеність носа, найбільш явний симптом алергійного риніту [Jones, Т.K., Savoie. С, Robichaud, Α., Sturino, С. Scheigetz, J., Lachance, N., Roy, В., Boyd, M., Abraham, W., Studies with a DP receptor antagonist in sheep and guinea pig models of allergic rhinitis, Am. J. Resp. Crit. Care Med. 167, A218, 2003; and Arimura Α., Yasui K., Kishino J., Asanuma F., Hasegawa H., Kakudo S., Ohtani Μ., Arita Η., Prevention of allergic inflammation by a novel prostaglandin receptor 95950 8 antagonist, S-5751. J. Pharmacol. Exp. Ther. 298(2), 411-9, 2001]. Антагоністи DP також ефективні в експериментальних моделях алергійного кон'юнктивіту й алергійного дерматиту [Arimura Α., Yasui K., Kishino J., Asanuma F., Hasegawa H., Kakudo S., Ohtani M., Arita H., Prevention of allergic inflammation by a novel prostaglandin receptor antagonist, S-5751, J. Pharmacol. Exp. Ther. 298(2), 411-9, 2001; and Torisu K., Kobayashi K., Iwahashi M., Nakai Y., Onoda Т., Nagase Т., Sugimoto I., Okada Y., Matsumoto R., Nanbu F., Ohuchida S., Nakai H., Toda M., Discovery of a new class of potent, selective, and orally active prostaglandin D2 receptor antagonists, Bioorg. & Med. Chem. 12, 5361-5378, 2004]. Даний винахід належить до сполуки формули (І): (I) де 1 R являє собою 2,4-дихлорфеніл або 41 трифторметоксифеніл, і коли R являє собою 2,42 дихлорфеніл, тоді R являє собою 3карбоксиніролідиніл, 3,5-ди-(1-гідрокси-1метилетил)феніл, 3-амінопіперидин-1-іл, 4амінопіперидин-1-іл, 4-ацетамідпіперидин-1-іл, 1метил-2-карбокси-2,3-дигідро-1Н-індол-5-іл, 3-(1трет-бутилсульфоніламінокарбоніл-1метилетил)феніл, 3-(1диметиламіносульфоніламінокарбоніл-1метилетил)феніл, 3-(1-тіоморфолін-4-ілкарбоніл-1метилетил)феніл, 3-(1-амінокарбоніл-1метилетил)феніл, 3-(1-диметиламінокарбоніл-1метилетил)феніл, 3-карбоксиметилпіперидин-1-іл, 3-метилсульфоніламінокарбонілпіперидин-1-іл, 3етилсульфоніламінокарбонілпіперидин-1-іл, 3трет-бутилсульфоніламінокарбонілпіперидин-1-іл, 3трифторметилсульфоніламінокарбонілпіперидин1-іл, 3-[(1Н-тетразол-5-іл)амінокарбоніл]піперидин1-іл, 3-амінокарбонілпіперидин-1-іл, 3диметиламінокарбонілпіперидин-1-іл, 3диметиламіносульфоніламінокарбонілпіперидин-1іл, або 2-карбокси-2,3-дигідробензофуран-5-іл, і 1 коли R являє собою 4-трифторметоксифеніл, 2 тоді R являє собою 3-(1-метил-1карбоксіетил)піперидиніл, 3-карбоксипепіридиніл, 3-метилсульфоніламінокарбонілпіперидин-1-іл, 5карбокситіофен-2-іл, або її фармацевтично прийнятної солі, гідрату або сольвату, її фармацевтично прийнятних проліків або фармацевтично прийнятної солі, гідрату або сольвату проліків. Іншим аспектом даного винаходу є фармацевтична композиція, що включає фармацевтично ефективну кількість однієї або декількох сполук даного винаходу, або її фармацевтично прийнятної солі, гідрату або сольвату, її фармацевтично 9 прийнятних проліків або фармацевтично прийнятної солі, гідрату або сольвату проліків в суміші з фармацевтично прийнятним носієм. Ще один аспект даного винаходу являє собою спосіб лікування пацієнта, що страждає захворюванням, опосередкованим PGD2, у тому числі, не обмежуючи зазначеним, алергійним захворюванням (наприклад, алергійний риніт, алергійний кон'юнктивіт, атопічний дерматит, бронхіальна астма і харчова алергія), системним мастоцитозом, порушеннями, що супроводжуються системною активацією мастоцитів, анафілактичним шоком, бронхоконстрикцією, бронхітом, кропивницею, екземою, захворюваннями, що супроводжуються свербежем (наприклад, атопічний дерматит і кропивниця), захворюваннями (наприклад, катаракта, відшарування сітківки, запалення, інфекція і порушення сну), що виникають як вторинні захворювання в результаті поведінки, яка супроводжується свербежем (наприклад, розчісування і розтирання), запаленням, хронічним обструктивним захворюванням легень, ішемічним реперфузійним ушкодженням, розладом мозкового кровообігу, хронічним ревматоїдним артритом, плевритом, неспецифічним виразковим колітом і подібними захворюваннями, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки даного винаходу або її фармацевтично прийнятної солі, гідрату або сольвату, її фармацевтично прийнятних проліків або фармацевтично прийнятної солі, гідрату або сольвату проліків. Визначення термінів Використовувані вище і у всьому тексті опису винаходу наступні терміни, якщо не зазначено інакше, мають наступні прийняті значення: «Сполуки, які є об'єктом даного винаходу» і аналогічні вирази включають описані в даного документі сполуки формули (І), а також фармацевтично прийнятні солі, сольвати, наприклад, гідрати, проліки і фармацевтично прийнятні солі, сольвати і гідрати проліків, де це допускається контекстом. Точно так само посилання на проміжні сполуки, незалежно від того, чи включені вони самі у формулу винаходу чи ні, покликане включити їхні солі і сольвати у випадках, де це допускається контекстом. Термін «пацієнт» означає людину й інших ссавців. Термін «фармацевтично прийнятні солі» означає нетоксичні, неорганічні й органічні кислотноадитивні й основно-адитивні солі сполук, які є об'єктом даного винаходу. Ці солі можуть бути отримані in situ на кінцевій стадії виділення й очищення сполук. Термін «фармацевтично ефективна кількість» означає кількість сполуки або сполук, що згідно із даним винаходом ефективно для створення бажаного терапевтичного ефекту, описаного в даною документі, наприклад, зняття алергійної реакції або запалення. Використовуваний у даного документі термін «фармацевтично прийнятні проліки» означає проліки сполук, які є об'єктом даного винаходу, що у рамках здорового медичного судження є придатними для використання в контакті з тканинами 95950 10 пацієнта, при цьому небажана токсичність, подразнення або алергійна реакція знаходяться в межах розумного співвідношення користі і ризику, а також є ефективними для застосування по призначенню сполук, які є об'єктом даного винаходу. Термін «проліки» означає сполуки, що «in vivo» трансформуються з утворенням вихідної сполуки даного винаходу, наприклад, за допомогою гідролізу в крові. Функціональні групи, що можуть піддаватися швидким перетворенням за допомогою метаболічного розпаду in vivo, утворюють клас груп, здатних вступати в реакцію з карбоксильною групою сполук, які є об'єктом даного винаходу. До них належать, зокрема, такі групи, як алканоїл (наприклад, ацетил, пропаноїл, бутаноїл і їм подібні), незаміщений або заміщений ароїл (наприклад, бензоїл або заміщений бензоїл), алкоксикарбоніл (наприклад, етоксикарбоніл), триалкілсиліл (наприклад, триметил- або триетилсиліл) і моноефіри, утворені дикарбоновими кислотами (наприклад, сукциніл). Внаслідок легкості, з якою піддані метаболічному розпаду групи сполук, які є об'єктом даного винаходу, розщеплюються in vivo, сполуки з такими групами діють як проліки. Сполуки з підданими метаболічному розпаду групами мають ту перевагу, що вони можуть виявляти підвищену біодоступність у результаті більш високої розчинності і/або швидкості усмоктування вихідної сполуки, завдяки наявності підданої метаболічному розпаду групи. Докладне обговорення приводиться в роботах Design of Prodrugs, H. Bundgaard, ed,, Elsevier (1985); Methods in Enzymology; K. Widder et al., Ed., Academic Press, 42, 309-396 (1985); A Textbook of Drug Design and Development, Krogsgaard-Larsen and H. Bandaged, ed., Chapter 5; "Design and Applications of Prodrugs" 113-191 (1991); Advanced Drug Delivery Reviews, H. Bundgard, 8, 1-38, (1992); J. Pharm. Set., 77, 285 (1988), Chem. Pharm. Bull., N. Nakeya et al., 32, 692 (1984); Pro-drugs as Novel Delivery Systems, T. Higuchi and V. Stella, 14 A.C.S. Symposium Series, and Bioreversible Carriers in Drag Design, E.B. Roche, ed., American Pharmaceutical Association and Pergamon Press, 1987, що у силу посилання на них включаються в даний документ. «СкладноефірнІ проліки» означає сполуку, що може перетворюватися «in vivo» у ході метаболічних процесів (наприклад, за допомогою гідролізу) у сполуку даного винаходу. Наприклад, складний ефір сполуки даного винаходу, що містить гідроксигрупу, може перетворюватися за допомогою гідролізу «in vivo» у вихідну молекулу. Як альтернативу, складний ефір сполуки даного винаходу, що містить карбоксигрупу. може перетворюватися за допомогою гідролізу «in vivo» у вихідну молекулу. Прикладами ефірних проліків є: 11 етиловий ефір (1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-іл)оцтової кислоти; і етиловий ефір 5-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}1-метил-2,3-дигідро-1Н-індол-2-карбонової кислоти. Придатними складними ефірами сполук даного винаходу, що містять гідроксильну групу, є, наприклад, ацетати, цитрати, лактати, тартрати, малонати, оксалати, саліцилати, пропіонати, сукцинати, фумарати, малеати, метилен-біс-bгідроксинафтоати, гентизати, ізетіонати, ди-паратолуолтартрати, метансульфонати, етансульфонати, бензолсульфонати, пара-толуолсульфонати, циклогексилсульфамати і хінати. Придатними складними ефірами сполук даного винаходу, що містять карбоксильну групу, є, наприклад, ефіри, описані в F.J, Leinweber, Drug Metab. Res., 1987, 18, page 379. Особливо корисний клас складних ефірів сполук даного винаходу, що містять гідроксильну групу, може бути утворений з кислотних груп з числа описаних у роботі Bundgaard et al., J. Med. Chem., 1989, 32, page 2503-2507, і містити в собі заміщені (амінометил)бензоати, наприклад, діалкіламінометилбензоати, у яких дві алкільні групи можуть бути з'єднані і/або розділені атомом кисню або атомом азоту з можливим замісником, наприклад, алкілованим атомом азоту, а особливо (морфолінометил)бензоати, наприклад, 3або 4(морфолінометил)бензоати, і (4-алкілпіперазин-1іл)бензоати, наприклад, 3або 4-(4алкілпіперазин-1-іл)бензоати. «Сольват» означає сполуку, яка є об'єктом даного винаходу, фізично зв'язана з однією або декількома молекулами розчинника. До фізичного зв'язування належить, зокрема, утворення водневого зв'язку. У визначених випадках сольват можна буде виділити, наприклад, коли одна або декілька молекул розчинника включені в кристалічну решітку твердої кристалічної речовини. Термін «сольват» поширюється як на фазу розчину, так і на сольвати, які виділяються. Типовими сольватами є гідрати, етаноляти і метаноляти. Деякі зі сполук, які є об'єктом даного винаходу, є основними, і такі сполуки застосовні у формі вільних основ або у формі їхніх фармацевтично прийнятних кислотно-адитивних солей. Кислотно-адитивні солі можуть бути більш зручною формою для використання, і на практиці використання сольової форми власне кажучи означає застосування форми вільної основи. До кислот, що можуть використовуватися для приготування кислотно-адитивних солей, належать пе 95950 12 реважно такі, які при змішуванні з вільною основою приводять до фармацевтично прийнятних солей, тобто солей, аніони яких є нетоксичними для пацієнта у фармакологічних дозах солей, так що корисні ефекти інгібування, властиві вільній основі, не спотворюються побічними ефектами, приписуваними аніонам. Хоча фармацевтично прийнятні солі зазначених основних сполук є переважними, усі кислотно-адитивні солі, являють собою корисні джерела форми вільної основи, навіть якщо конкретна сіль, сама по собі, потрібна тільки лише як проміжний продукт, наприклад, якщо сіль виходить винятково з метою очищення й ідентифікації, або якщо вона використовується як проміжна сполука при одержанні фармацевтично прийнятної солі за допомогою іонообмінних процесів. Зокрема, кислотно-адитивні солі, можуть бути отримані незалежною реакцією очищеної сполуки у формі вільної основи з придатною органічною або неорганічною кислотою і виділенням отриманої в такий спосіб солі. Фармацевтично прийнятні солі, що належать до сфери даного винаходу, включають солі, отримані з мінеральних і органічних кислот. Приклади кислотно-адитивних солей включають гідроброміди, гідрохлориди, сульфати, бісульфати, фосфати, нітрати, ацетати, оксалати, валерати, олеати, пальмітати, хінати, стеарати, лаурати, борати, бензоати, лактати, фосфати, тозилати, цитрати, малеати, фумарати, сукцинати, тартрати, нафтилати, мезилати, глюкогептонати, лактіобіонати, сульфамати, малонати, саліцилати, пропіонати, метилен-біс-βгідроксинафтоати, гентизати, ізетіонати, ди-паратолуоїлтартрати, етансульфонати, бензолсульфонати, циклогексилсульфамати і лаурилсульфонати. Див., наприклад, роботу S.M. Berge, et al., "Pharmaceutical Salts," J. Pharm. Sci., 66, 1-19 (1977), що включена в даний документ у вигляді посилання. Якщо сполука, яка є об'єктом даного винаходу, заміщена кислотною групою, можуть виходити основно-адитивні солі, що є просто більш зручною формою застосування, і на практиці використання сольової форми по суті рівносильне її використанню у формі вільної кислоти. До основ, що можуть використовуватися для приготування основноадитивних солей, належать, переважно, такі, які при змішуванні з вільною кислотою приводять до фармацевтично прийнятних солей, тобто солей, катіони яких є нетоксичними для пацієнта у фармакологічних дозах солей, так що корисні ефекти інгібування, властиві вільній основі, не спотворюються побічними ефектами, приписуваними катіонам. Основно-адитивні солі можна також одержати незалежним чином у результаті реакції очищеної сполуки в її кислій формі з придатним органічною або неорганічною основою, що утворюється із солей лужних або лужноземельних металів, і виділенням отриманої в такий спосіб солі. До основноадитивних солей належать фармацевтично прийнятні солі металів і амінів. До придатних солей металів належать солі натрію, калію, кальцію, барію, цинку, магнію й алюмінію. У конкретному прикладі солями є натрієві і калієві солі. Придатні неорганічні основно-адитивні солі одержують з основ 13 металів, до яких належать гідрид натрію, гідроксид натрію, гідроксид калію, гідроксид кальцію, гідроксид алюмінію, гідроксид літію, гідроксид магнію, гідроксид цинку і їм подібні. Придатні амінні основно-адитивні солі одержують з амінів, основність яких достатня для утворення стабільної солі, і переважно з амінів, часто використовуваних у медичній хімії через їхню низьку токсичність і придатність для використання в медичних цілях, наприклад, аміак, етилендіамін, N-метилглюкамін, лізин, аргінін, орнітин, холін, N.N'дибензилетилендіамін, хлорпрокаїн, діетаноламін, прокаїн, N-бензилфенетиламін, діетиламін, піперазин, трис(гідроксиметил)амінометан, гідроксид тетраметиламонію, триетиламін, дибензиламін, ефенамін, дегідроабіетиламін. N-етилпіперидин, бензиламін, тетраметиламоній, тетраетиламоній, метиламін, диметиламін, триметиламін, етиламін, основні амінокислоти, наприклад, лізин і аргінін, і дициклогексиламін. Будучи корисними самі по собі як активні сполуки, солі сполук, що є об'єктом даного винаходу, корисні для цілей очищення сполук, наприклад, за рахунок використання різниці в розчинності солей і вихідних сполук, побічних продуктів і/або вихідних матеріалів за допомогою відомих фахівцям способів. Очевидно, що сполуки, які є об'єктом даного винаходу, можуть містити асиметричні центри. Ці асиметричні центри можуть незалежно один від одного бути в R- або в S-конфігурації. Для фахівця в даній галузі очевидно, що визначені сполуки, які є об'єктом даного винаходу, можуть також виявляти геометричну ізомерію. Варто розуміти, що даний винахід поширюється на окремі геометричні ізомери і стереоізомери і їхні суміші, у тому числі рацемічні суміші приведених вище сполук даного винаходу. Такі ізомери можна виділити з їхніх сумішей за допомогою відомих методів або їхніх модифікацій, наприклад, хроматографічних методів або методів перекристалізації, або одержати окремо з відповідних ізомерів проміжних сполук. Крім того, у ситуаціях, де можливі таутомери сполук даного винаходу, даний винахід включає всі таутомерні форми таких сполук. Конкретні здійснення даного винаходу Одним з конкретних здійснень даного винаходу є наступні сполуки формули (І): 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метилпіримідин-4-іл}піролідин-3-карбонова кислота, 2-(1-{2-мeтoкcи-6-[2-(4тpифтоpмeтoкcифeніл)eтилaмiнo]пipимiдин-4іл}піперидин-3-іл)-2-метилпропіонова кислота, 2-[3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-5-(1-гідрокси-1метилетил)феніл]пропан-2-ол, [6-(3-амінопіперидин-1-іл)-2-метоксипіримідин4-іл]-[2-(2,4-дихлорфеніл)етил]амін, [6-(4-амінопіперидин-1-іл)-2-метоксипіримідин4-іл]-[2-(2,4-дихлорфеніл)етил]амін, N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-4-іл)ацетамід, 95950 14 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-1-метил-2,3-дигідро-1Ніндол-2-карбонова кислота, [2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2метилпропіоніл]амід 2-метилпропан-2сульфонової кислоти, [2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2метилпропіоніл]амід N,N-диметиламід-2сульфонової кислоти, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2-метил-1тіоморфолін-4-ілпропан-1-он, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)ізобутирамід, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-Ν,Νдиметилізобутирамід, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-іл)оцтова кислота, 1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбонова кислота, N-(1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбоніл)метансульфонамід, N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3карбоніл)метансульфонамід, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)амід етансульфонової кислоти, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)амід 2-метилпропан-2-сульфонової кислоти, N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)С,С,С-трифторметансульфонамід, (1Н-тетразол-5-іл)амід 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти, амід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбонової кислоти, диметиламід 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти, 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоксамід N,N-диметиламід-2-сульфонової кислоти, 5-{2-метоксі-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4-іл}тіофен-2-карбонова кислота або 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-2,3-дигідробензофуран-2карбонова кислота, або її фармацевтично прийнятна сіль, гідрат або сольват, її фармацевтично прийнятні проліки або фармацевтично прийнятна сіль, гідрат або сольват проліків. Ще одним з конкретних здійснень даного винаходу є наступні сполуки формули (І) або її складноефірні проліки: 15 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метилпіримідин-4-іл}піролідин-3-карбонова кислота, 2-(1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-іл)-2-метилпропіонова кислота, 2-[3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-5-(1-гідрокси-1метилетил)феніл]пропан-2-ол, [6-(3-амінопіперидин-1-іл)-2-метоксипіримідин4-іл]-[2-(2,4-дихлорфеніл)етил]амін, [6-(4-амінопіперидин-1-іл)-2-метоксипіримідин4-іл]-[2-(2,4-дихлорфеніл)етил]амін. N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-4-іл)ацетамід, 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-1-метил-2,3-дигідро-1Ніндол-2-карбонова кислота, [2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2метилпропіоніл]амід 2-метилпропан-2сульфонової кислоти, [2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл)феніл)-2метилпропіоніл]амід N,N-диметиламід-2сульфоновоі кислоти, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2-метил-1тіоморфолін-4-ілпропан-1-он, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)ізобутирамід, 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-Ν,Νдиметилізобутирамід, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-іл)оцтова кислота, 1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбонова кислота, N-(1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбоніл)метансульфонамід, етиловий ефір 5-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}1-метил-2,3-дигідро-1Н-індол-2-карбонові кислоти, етиловий ефір (1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-іл)оцтові кислоти, N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3карбоніл)метансульфонамід, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин~3-карбоніл)амід етансульфонової кислоти, (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)амід 2-метилпропан-2-сульфонової кислоти, N-(1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)С,С,С-трифторметансульфонамід, (1Н-тетразол-5-іл)амід 1-{6-[2-(2,4дихлорфєніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти, 95950 16 амід 1-{б-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбонової кислоти, диметиламід 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти, 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоксамід N,N-диметиламід-2-сульфонової кислоти, 5-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4-іл}тіофен-2-карбонова кислота або 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-2,3-дигидрбензофуран-2карбонова кислота, або їх фармацевтично прийнятна сіль, гідрат або сольват. Сполуки, які є об'єктом даного винаходу, а також використовувані для їхнього одержання проміжні і вихідні речовини, називаються відповідно до номенклатури ІЮПАК, у якій характеристичні групи при найменуванні мають наступний пріоритет по убуванню важливості: кислоти, ефіри, аміди й ін. Проте, вважається, що якщо для якої-небудь зі сполук, представленої як структурною формулою, так і номенклатурною назвою, с невідповідність між структурною формулою і номенклатурною назвою, правильною необхідно вважати структурну формулу. Сполуки, які є об'єктом даного винаходу, виявляють активність як антагоністи рецептора простагландину D2 і можуть використовуватися як активні фармакологічні речовини. Відповідно, вони включаються у фармацевтичні композиції і використовуються в лікуванні пацієнтів, що страждають певними медичними порушеннями. Сполуки, на які поширюється даний винахід, є антагоністами рецептора простагландину D2 відповідно до тестів, описаних у літературі, а також у приведеному нижче розділі про фармакологічні тести, результати яких повинні корелювати з фармакологічною дією в організмі людини й інших ссавців. Таким чином, у ще одному варіанті здійснення даного винаходу представлені сполуки, яка є об'єктом даного винаходу і містять їхні композиції, що можуть використовуватися в лікуванні пацієнтів, що страждають захворюваннями, які можна полегшити введенням антагоніста PGD2, або підданих таким захворюванням. Наприклад, сполуки даного винаходу тому можуть використовуватися для лікування різних захворювань, опосередкованих PGD2, у тому числі, без обмеження зазначеними далі, алергійного захворювання (наприклад, алергійний риніт, алергійний кон'юнктивіт, атонічний дерматит, бронхіальна астма і харчова алергія), системного мастоцитозу. порушень, що супроводжуються системною активацією мастоцитів, анафілактичного шоку, бронхоконстрикції, бронхіту, кропивниці, екземи, захворювань, що супроводжуються свербежем (наприклад, атопічний дерматит і кропивниця), захворювань (наприклад, катаракта, відшарування сітківки, запалення, інфекція і порушення сну), що виникають як вторинні захворювання в результаті поведінки, яка супроводжується свербежем (наприклад, розчісування і 17 розтирання), запалення, хронічних обструктивних захворювань легень, ішемічного реперфузійного ушкодження, розладу мозкового кровообігу, хронічного ревматоїдного артриту, плевриту, неспецифічного виразкового коліту і подібних захворювань. Крім того, сполуки, які є об'єктом даного винаходу, можуть використовуватися для лікування в сполученні з: (і) антигістамінами, наприклад, фексофенадином, лоратадином і цитиризином, для лікування алергійного риніту; (іі) антагоністами лейкотриєнів, наприклад, монтелукастом і зафірлукастом, для лікування алергійного риніту, ХОЗЛ, алергійного дерматиту, алергійного кон'юнктивіту й ін. - точну інформацію див. у WO 01/78697 А2; (ііі) бета-агоністами, наприклад, альбутеролом, сальбутеролом і тербуталіном, для лікування астми, ХОЗЛ. алергійного дерматиту, алергійного кон'юнктивіту й ін.; (iv) антигістамінами, наприклад, фексофенадином, лоратадином і цитиризином, для лікування астми, ХОЗЛ, алергійного дерматиту, алергійного кон'юнктивіту й ін.; (ν) інгібіторами PDE4 (фосфодіестерази 4). наприклад, рофлуміластом і циломіластом, для лікування астми, ХОЗЛ, алергійного дерматиту, алергійного кон'юнктивіту й ін.; або (vi) з антагоністами ТР (рецептора тромбоксану А2) або антагоністами CrTh2 (молекули, гомологічної рецептору хемоаттрактанту, яка експресується на Th2 клітинах), наприклад, раматробраном (BAY-u3405), для лікування ХОЗЛ, алергійного дерматиту, алергійного кон'юнкгивігу і т. д. Конкретним варіантом здійснення терапевтичних способів, що є об'єктом даного винаходу, є лікування алергійного риніту. Ще одним конкретним варіантом здійснення терапевтичних способів, що є об'єктом даного винаходу, є лікування бронхіальної астми. Відповідно до ще одного аспекту винаходу пропонується спосіб лікування пацієнта (людини або тварини), що страждає захворюваннями, які можуть бути полегшені введенням антагоніста рецептора простагландину D2, або підданого таким захворюванням, як, наприклад, описаним вище, що включає введення пацієнту ефективної кількості сполуки, яка (об'єктом даного винаходу, або композиції, яка містить її. Під «ефективною кількістю» мається на увазі кількість сполуки, яка є об'єктом даного винаходу, що ефективна як антагоніст рецептора простагландину D2 і тому здатна дати бажаний терапевтичний ефект. Включені тут посилання на лікування поширюються як на профілактичну терапію, так і на лікування діагностованих захворювань. Даний винахід поширюється також на фармацевтичні композиції, що включають щонайменше одну сполуку, яка є об'єктом даного винаходу, у суміші з фармацевтично прийнятним носієм. На практиці сполуки, які є об'єктом даного винаходу, можуть вводитися у вигляді фармацевтично прийнятних лікарських форм людині й іншим іваринам за допомогою місцевого або системного 95950 18 застосування, у тому числі перорального, інгаляційного, ректального, назального, букального, сублінгвального, вагінального, кишкового, парентерального (у тому числі підшкірного, внутрішньом'яювого, внутрішньовенного, внутрішньошкірного, інтратекального і епідурального), інтрацистернального і внутрішньоочеревинного. Варто брати до уваги, що переважний спосіб уведення може варіюватися, наприклад, у залежності від стану пацієнта. «Фармацевтично прийнятними лікарськими формами» називаються лікарські форми сполуки, яка є об'єктом даного винаходу, що включають, наприклад, таблетки, драже, порошки, еліксири, сиропи, рідкі сполуки, у тому числі суспензії, спреї, інгалятори, таблетки, коржі, емульсії, розчини, гранули, капсули і супозиторії, а також рідкі сполуки для ін'єкцій, у тому числі ліпосомні препарати. Загальний опис методів і сполук можна знайти в останньому виданні ReMington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA. Особливим аспектом даного винаходу є сполука, яка є об'єктом даного винаходу, яка повинна вводитися у формі фармацевтичної композиції. Відповідно до даного винаходу, фармацевтичні композиції складаються зі сполук, що є об'єктом даного винаходу, і фармацевтично прийнятних носіїв. Фармацевтично прийнятні носії включають щонайменше один з компонентів, якими можуть бути фармацевтично прийнятні носії, розріджувачі, оболонки, ад'юванти, формотворні або середовища, такі як консерванти, наповнювачі, розпушувачі, змочувальні речовини, емульгатори, стабілізатори емульсій, суспендуючі речовини, ізотонічні речовини, підсолоджувачі, смакові добавки, ароматизатори, барвники, бактерицидні засоби, протигрибкові засоби, інші терапевтичні речовини, ковзні речовини, речовини, що сповільнюють або прискорюють усмоктування, і дозуючі речовини, у залежності від особливостей способу введення і лікарської форми. Прикладами суспендуючих речовин є етоксильовані ізостеарилові спирти, поліоксіетиленсорбіт і складні ефіри сорбітану, мікрокристалічна целюлоза, метагідроксид алюмінію, бентоніт, агар-агар і трагакант або суміші цих речовин. Прикладами бактерицидних і протигрибкових речовин, що запобігають дії мікроорганізмів, є парабени, хлорбутанол, фенол, сорбінова кислота і подібні до них. Прикладами ізотонічних речовин є цукри, хлорид натрію і подібні до них. Прикладами речовин, що сповільнюють і продовжують усмоктування, є моностеарат алюмінію і желатин. Прикладами речовин, що прискорюють і стимулюють абсорбцію, є диметилсульфоксид і його аналоги. Прикладами розріджувачів, розчинників, носіїв, солюбілізуючих добавок, емульгаторів і стабілізаторів емульсії є вода, хлороформ, сахароза, етанол, ізопропіловий спирт, етиловий ефір вугільної кислоти, етилацетат, бензиловий спирт, тетрагідрофурфуриловий спирт, бензилбензоат, по 19 ліоли, пропіленгліколь, 1,3-бутиленгліколь, гліцерин, поліетиленгліколі, диметилформамід, Tween® 60, Span® 60, цетосгеариловий спирт, міристиловий спирт, гліцерил моностеарат і лаурилсульфат натрію, складні ефіри сорбітану і жирних кислот, рослинні олії (такі як бавовняна олія, арахісове масло, кукурудзяна олія, маслинова олія, рицинова олія і кунжутна олія) і ін'єктовані органічні складні ефіри, такі як етил олеат і йому подібні, або придатні суміші цих сполук. Прикладами формотворних наповнювачів є лактоза, молочний цукор, цитрат натрію, карбонат кальцію і дикальційфосфат. Прикладами розпушувачів є крохмаль, альгінової кислоти і деякі складні силікати. Прикладами ковзних речовин є стеарат магнію, лаурилсульфат натрію, тальк, а також поліетиленгліколі з високою молекулярною вагою. Вибір фармацевтично прийнятного носія, у цілому, визначається відповідно до хімічних властивостей активної сполуки, такими як розчинність, метод застосування і норми, яким необхідно випливати у фармацевтичній практиці. Фармацевтичні композиції, які є об'єктом даного винаходу, придатні для перорального застосування, можуть являти собою окремі одиниці, такі як тверді лікарські форми, такі як капсули, облатки або таблетки, кожна з яких містить визначену кількість активного інгредієнта, або такі як порошки або гранули або рідкі лікарські форми, такі як розчини або суспензії у водному або неводному рідкому середовищі або рідкій емульсії масло в воді або вода в маслі. Активний інгредієнт також може бути у вигляді болюсу, електуарія або пасти. «Тверда лікарська форма» означає лікарську форму сполуки, яка с об'єктом даного винаходу, у вигляді твердої речовини, наприклад, капсул, таблеток, пігулок, порошку, драже або гранул. У таких лікарських формах сполука, що є об'єктом даного винаходу, додана в як мінімум один традиційно використовуваний інертний формотворний наповнювач (або носій), наприклад, цитрат натрію або дикальційфосфат або (а) наповнювачі або добавки, такі як. наприклад, крохмаль, лактоза, сахароза, глюкоза, маніт і кремнієва кислота, (b) зв'язувальні речовини, наприклад, карбоксиметилцелюлоза, альгінати, желатин, нолівінілпіролідон, сахароза і камедь, (с) зволожуючі речовини, такі як, наприклад, гліцерин, (d) розпушувачі, такі як, наприклад, агар-агар, карбонат кальцію, картопляний або маніоковий крохмаль, альгінова кислота, певні складні силікати і Na2CO3, (e) сповільнювачі утворення розчинів, такі як, наприклад, парафін, (f) прискорювачі абсорбції, такі як, наприклад, четвертинні амонієві сполуки, (g) зволожуючі речовини, такі як, наприклад, цетиловий спирт і гліцеринмоностеарат, (h) адсорбенти, такі як. наприклад, каолін або бентоніт, (і) ковзні речовини, такі як, наприклад, тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію, (j) замутнюючі компоненти, (k) буферні речовини і речовини, відстрочено вивільняючі сполуки або сполуки, які є об'єктом даного винаходу, у певній частині кишкового тракту. 95950 20 Таблетка може бути приготовлена пресуванням або формуванням і може мати один або декілька допоміжних компонентів. Пресовані таблетки можна одержувати пресуванням у придатному апараті активного інгредієнта в сипучій формі, такій як порошок або гранули, яка може бути змішана зі зв'язувальною речовиною, ковзною речовиною, інертним розріджувачем, консервантом, поверхнево-активною або диспергуючою речовиною. Можуть використовуватися такі інертні наповнювачі, як лактоза, цитрат натрію, карбонат кальцію, дикальційфосфат, і розпушувачі, такі як крохмаль, альгінової кислоти і певні складні силікати, змішані з ковзними речовинами, такими як стеарат магнію, лаурилсульфат натрію і тальк. Суміш порошкоподібних сполук, змочену інертним рідким розріджувачем, можна формувати на придатному автоматі для одержання формованих таблеток. Таблетки можуть мати покритгя або насічки, а також можуть мати сполуку, що забезпечує повільне або контрольоване вивільнення активного інгредієнта, що міститься в них. Тверді сполуки також можуть використовуватися як наповнювачів у желатинових капсулах з м'яким або твердим наповненням з використанням таких інертних наповнювачів, як лактоза або молочний цукор, а також поліетиленгліколей з великою молекулярною вагою і подібних до них речовин. У разі потреби, а також для більш ефективного поширення, сполуки можуть бути мікроінкапсульованими в системах повільного або спрямованого вивільнення або приєднані до них, такими системами є біосумісні, біорозкладані полімерні матриці (наприклад, співполімер (і,1-лактиду з гліколідом), ліпосоми і мікросфери для підшкірного і внутрішньом'язового ін'єктування методом, який називається підшкірною або внутрішньом'язовою ін'єкцією уповільненого усмоктування, що забезпечує повільне вивільнення сполуки або сполук протягом 2 тижнів або довше. Сполуки можуть бути стерилізовані, наприклад, фільтрацією через затримуючий бактерії фільтр або додаванням стерилізуючих речовин у формі стерильних твердих сполук, що можуть бути розчинені в стерильній воді або іншому стерильному ін'єктованому середовищі безпосередньо перед застосуванням. «Рідка лікарська форма» означає форму активної сполуки, що вводиться пацієнту в рідкій формі, наприклад, у вигляді фармацевтично прийнятних емульсій, розчинів, суспензій, сиропів або еліксирів. Крім активних сполук, рідкі лікарські форми можуть містити звичайно застосовувані в даній галузі інертні розріджувачі, такі як розчинники, солюбілізуючі речовини і емульгатори. Використовувані водні суспензії можуть містити емульгатори або речовини, що сприяють утворенню суспензій. Фармацевтичні композиції, придатні для місцевого застосування - це сполуки у формі, що допускає місцеве введення пацієнту. Сполуки можуть мати форму мазей місцевого застосування, бальзамів, порошків, спреїв і інгаляторів, гелів (на водній або спиртовій основі), кремів, звичайно використовуваних у даній сфері, або бути включени 21 ми в матричну основу для застосування як пластир, що забезпечує контрольоване вивільнення сполуки через шкірний бар'єр. У формі мазі активні інгредієнти можуть або використовуватися з парафіновими, або з водорозчинними основами. В альтернативному варіанті активні інгредієнти можуть мати форму крему з масляно-водною основою. Сполуки, призначені для місцевого застосування в очі, являють собою очні краплі, у яких активний інгредієнт розчинений або суспендований у придатному носії, як правило водному розчиннику. Сполуки, призначені для місцевого застосування через слизову рота, включають лікарські льодяники, що мають у своєму складі активний інгредієнт у смаковій добавці, як правило сахарозі і камеді або трагаканті; пастилки, що мають у своєму складі активний інгредієнт на інертній основі, такий як желатин і гліцерин або сахароза і камедь; і склади для полоскання рота, що мають у своєму складі активний інгредієнт у придатному рідкому носії. Масляна фаза емульсійних фармацевтичних композицій може бути отримана звичайним способом з відомих інгредієнтів. Ця фаза може мати у своєму складі тільки емульгатор (який також називається емульгуючою речовиною), однак бажано, щоб у неї також входив як мінімум один емульгатор, що містить жир або масло, або емульгатор, що містить і жир, і масло. В одному конкретному здійсненні винаходу до складу включений гідрофільний емульгатор поряд з ліпофільним емульгатором, що діє як стабілізатор. Емульгатор (емульгатори) разом зі стабілізатором (стабілізаторами) або без нього (них) утворюють віск, який емульгується, а разом з маслом або жиром утворюють основу мазі, яка емульгується, що є масляною диспергованою фазою кремових сполук. При необхідності водна фаза кремової основи може включати, наприклад, не менш 30% ваг. багатоатомного спирту, тобто спирту з двома або більше гідроксильними групами, наприклад, пропіленгліколь, бутан-1,3-діол, маніт, сорбіт, гліцерин або поліетиленгліколь (у тому числі PEG 400) і їхні суміші. Сполуки для місцевого застосування можуть, якщо потрібно, мати у своєму складі сполуку, що стимулює усмоктування або проникнення активного інгредієнта через шкіру або інші уражені зони. Вибір придатних масел або жирів для використання в складі залежить від властивостей, які необхідно одержати. Бажано, щоб крем був нежирним, що не залишає плям і змиваним продуктом придатної консистенції, що не допускає витоку з тюбиків і інших ємностей. Можуть використовуватися лінійні і розгалужені одно- і двоосновні алкілові ефіри, такі як діізопропілміристат, децилолеат, ізопропілпальмітат, бутилстеарат, 2етилгексилпальмітат або суміш ефірів з розгалуженим ланцюгом, відомим як Crodamol CAP. Вони можуть використовуватися окремо або в сумішах, у залежності від бажаних властивостей. Як альтернатива можуть використовуватися ліпіди з високою температурою плавлення, такі як білий м'який парафін і/або рідкий парафін і інші мінеральні масла. 95950 22 Фармацевтичними композиціями для ректального або вагінального застосування називаються сполуки, форма яких допускає ректальне або вагінальне введення пацієнту, і які містять як мінімум одну сполуку, що є об'єктом даного винаходу. Супозиторії являють собою одну з форм таких сполук, яку можна одержати змішуванням сполук, що є об'єктом даного винаходу, із придатними неподразнювальними інертними наповнювачами або носіями, як, наприклад, масло какао, поліетиленгліколь або воскова основа супозиторію, що знаходяться у твердому стані при звичайних температурах, але стають рідкими при температурі тіла, а тому плавляться при ректальному або вагінальному введенні і вивільняють активний інгредієнт. Фармацевтичні композиції, що вводяться за допомогою ін'єкції, можуть уводитися внутрішньом'язово, внутрішньовенно, внутрішньоочеревинно і/або підшкірно. Сполуки, які є об'єктом даного винаходу, готують у рідких розчинах, зокрема, у фізіологічно сумісних буферах, таких як розчин Хенка або розчин Рінгера. Крім того, сполуки можуть бути приготовлені у твердій формі і розчинені або суспендовані безпосередньо перед застосуванням. Можливі також ліофілізовані форми. Сполуки є стерильними і включають емульсії, суспензії, водні і неводні розчини для ін'єкцій, що можуть містити суспендуючі речовини, загусники й антиоксиданти, буфери, бактеріостати і добавки, що роблять сполуку ізотонічною, і мати правильно підібраний рівень рН, що відповідає показнику крові пацієнта, якому буде вводитися сполука. Фармацевтичними композиціями, що є об'єктом даного винаходу, придатними для назального або інгаляційного застосування, називаються сполуки, форма яких придатна для введення пацієнту назально або інгаляційно. Сполука може містити носій у формі порошку з розміром частинок, наприклад, у діапазоні від 1 до 500 мікронів (у тому числі з розмірами частинок у діапазоні від 20 до 500 мікронів із кроком 5 мікрон, тобто з розмірами 30 мікронів, 35 мікрон і т. д). До придатних сполук з рідким носієм для застосування, наприклад, як спрею або крапель для носа, належать водні або масляні розчини активного інгредієнта. Сполуки, придатні для аерозольного введення, можуть бути отримані відповідно до традиційних методів і вводитися з іншими терапевтичними речовинами. Для введення сполук, які є об'єктом даного винаходу, як інгаляційна терапія можуть використовуватися дозуючі інгалятори. Дане дозування активного інгредієнта (інгредієнтів) у сполуках, що є об'єктом даного винаходу, може варіюватися з метою одержання кількості активного інгредієнта (інгредієнтів), ефективного для одержання бажаного терапевтичного ефекту для визначеної сполуки і методу його введення пацієнту. Тому дозування, яке вибирається для кожного пацієнта, залежить від множини факторів, таких як бажаний терапевтичний ефект, спосіб уведення, бажана тривалість лікування, етіологія і тяжкість захворювання, стан пацієнта, вага, стать, дієта і вік, тип і активність кожного активного інгредієнта, швидкість абсорбції, метаболізму і/або виділення й інших факторів. 23 Повна денна доза сполук, які є об'єктом даного винаходу, що вводиться пацієнту у вигляді однієї або декількох доз, може складати, наприклад, приблизно від 0,001 до 100 мг/кг маси тіла на день, переважно від 0.01 до 10 мг/кг/день. Наприклад, для дорослого дози, як правило, складають приблизно від 0.01 до 100, переважно приблизно від 0,01 до 10 мг/кг маси тіла на день при інгаляції, приблизно від 0,01 до 100, переважно від 0,1 до 70, бажано від 0,5 до 10 мг/кг маси тіла на день при пероральному введенні, і приблизно від 0,01 до 50. переважно від 0,01 до 10 мг/кг маси тіла на день при внутрішньовенному введенні. Процентний вміст активного інгредієнта в композиції може бути різним, але він повинен забезпечувати одержання придатної дозування. Лікарські форми можуть містити часткові одиниці дози, що дозволяють одержати бажану денну дозу. Природно, що форми, які містять декілька одиниць дози, можуть уводитися приблизно одночасно. Введення доз може бути настільки частим, наскільки необхідно для досягнення бажаного терапевтичного ефекту. Деякі пацієнти можуть виявляти швидку відповідну реакцію на більш високу або більш низьку дозу, і для них можуть виявитися достатніми набагато більш слабкі підтримуючі дози. Для інших пацієнтів можуть знадобитися довгострокові курси лікування з частотою від 1 до 4 доз на день відповідно до фізіологічних потреб кожного конкретного пацієнта. Саме собою зрозуміло, для інших пацієнтів може знадобитися не більш однієї або двох доз у день. Стандартні дози сполук можуть бути отримані будь-яким із традиційно використовуваних у фармацевтиці способів. Такі способи включають стадію зв'язування активного інгредієнта з носієм, що складається з одного або декількох допоміжних інгредієнтів. Як правило, сполуки одержують однорідним і тісним зв'язуванням активного інгредієнта з рідкими носіями або дрібнозернистими твердими носіями, або і тими й іншими, з наступним формуванням продукту, якщо це необхідно. Сполуки можуть бути в упаковках по одній дозі або по декілька доз, наприклад, у запаяних ампулах і пляшечках з еластичними пробками, і можуть зберігатися в ліофілізованому стані, що вимагає тільки додавання стерильного рідкого носія, наприклад, води для ін'єкцій, безпосередньо перед застосуванням. Індивідуальні розчини для ін'єкцій і суспензії можуть бути приготовлені зі стерильних порошків, гранул або таблеток описаних вище типів. Сполуки, які є об'єктом даного винаходу, можуть бути отримані за допомогою застосування або адаптації відомих способів, під якими маються на увазі способи, що використовувалися колись або описані в літературі, наприклад, описані в роботі R.C. Larock in Comprehensive Organic Transformations, VCH publishers, 1989. Згідно з ще однією ознакою винаходу, утворені кислотно-адитивні солі сполук, що є об'єктом даного винаходу, можна одержати в результаті реакції вільної основи з відповідною кислотою за допомогою відомих способів або їхніх модифікацій. Наприклад, утворені кислотно-адитивні солі спо 95950 24 лук, які є об'єктом даного винаходу, можна одержати розчиненням вільної основи або в воді або водному розчині спирту або інших придатних розчинниках, що містять відповідну кислоту, і виділенням солі випарюванням розчину, або в результаті реакції вільної основи і кислоти в органічному розчиннику, де сіль випадає в осад або випарюється з розчину. Сполуки, які є об'єктом даного винаходу, можна регенерувати з їх кислотно-адитивних солей за допомогою відомих способів або їх модифікацій. Наприклад, вихідні сполуки, які є об'єктом даного винаходу, можна регенерувати з їх кислотноадитивних солей лугами, наприклад, водним розчином бікарбонату натрію або водним розчином аміаку. Сполуки, які є об'єктом даного винаходу, можна регенерувати з їхніх солей приєднання основи за допомогою відомих способів або їхніх модифікацій. Наприклад, вихідні сполуки, які є об'єктом даного винаходу, можна регенерувати з їхніх солей приєднання основи обробкою кислотою, наприклад, соляною кислотою. Сполуки, які є об'єктом даного винаходу, можна легко одержати або утворити в процесі, що є об'єктом даного винаходу, у вигляді сольватів (наприклад, гідратів). Гідрати сполук, що є об'єктом даного винаходу, можуть бути легко отримані шляхом перекристалізації із суміші водного/органічного розчинника за допомогою таких органічних розчинників, як діоксан. THF або МеОН. Згідно з ще однією ознакою винаходу, основно-адитивні солі сполук, які є об'єктом даного винаходу, можна одержати в результаті реакції вільної кислоти з відповідною основою за допомогою відомих способів або їх модифікацій. Наприклад, основно-адитивні солі сполук, які є об'єктом даного винаходу, можна одержати розчиненням вільної кислоти або в воді або водному розчині спирту, або інших придатних розчинниках, що містять відповідну основу, і виділенням солі випарюванням розчину, або в результаті реакції вільної кислоти і основи в органічному розчиннику, де сіль випадає в осад або випарюється з розчину. Вихідні або проміжні сполуки можна одержати за допомогою способів, описаних у даній заявці або адаптацією відомих способів. Сполуки винаходу, способи їхнього одержання, а також їхня біологічна активність будуть більш очевидні з аналізу наступних прикладів, що приводяться тільки як ілюстрація і не повинні розглядатися як обмежуючі об'єм винаходу. Сполуки даного винаходу ідентифікували, наприклад, за допомогою наступних аналітичних методів. Експерименти по рідинній хроматографії високого тиску і мас-спектрометрії (РХ-МС) для визначення часу утримування (Rt) і відповідних мас іонів проводилися з використанням одного з наступних методів. Мас-спектри (МС) записували на масспектрометрі Micromass LCT. Метод включає іонізацію позитивним електророзпиленням і сканування маси м/z від 100 до 1000. Рідинну хроматографію здійснювали за допомогою бінарного насоса і дегазатора Hewlett Packard 1100 Series; 25 нерухома фаза: колонка Phenomenex Synergi 2 μ Hydro-RP 20×4,0 мм, рухома фаза: А=0,1% мурашина кислота (FA) у воді, В=0,1% FA у MeCN. Об'єм уведення 5 мкл за допомогою системи СТС Analytical PAL. Швидкість потоку елюенту складає 1 мл/хв. Градієнт складає від 10% В до 90% В за 3 хвилини і від 90% В до 100% В за 2 хвилини. Допоміжні детектори: УФ-детектор Hewlett Packard 1100 Series, довжина хвилі = 220 нм, і випарний детектор світлорозсіювання (ELS) Sedere SEDEX 75, температура детектора = 46°С, тиск N2=4 бар. Спектри ядерного магнітного резонансу (ЯМР) 1 300 МГЦ Н записували при кімнатній температурі на спектрометрі Varian Mercury (300 МГц) з 5 мм датчиком ASW. У ЯМР величини хімічного зрушення (δ) зазначені в мільйонних частках (м. ч.) відносно тетраметилсилану (TMS) як внутрішньою стандарту. У приведених далі прикладах і описах синтезу, а також в іншій частині заявки, використовувані терміни мають наступні значення: «кг» - кілограми, «м» -грами, «мг» - міліграми, «мкг» - мікрограми, «моль» - молі, «ммоль» - мілімолі, «М» - молі на літр, «мм» - мілімолі на літр, «мкм» - мікромолі на літр, «нм» - наномолі на літр, «л» - літри, «мл» мілілітри, «мкл» - мікролітри, «°С» - градуси Цельсія, «т.пл.» - точка плавлення, «т.к.» - точка кипіння, «мм рт.ст.» - тиск у міліметрах ртутного стовпа, «см» - сантиметри, «нм» - нанометри, «абс.» абсолютний, «конц.» - концентрований, «с» - концентрація в г/мл, «к.т.» - кімнатна температура, «ТШХ» - тонкошарова хроматографія, «ВЕРХ» високоефективна рідинна хроматографія, «в/о» внутрішньоочеревинно, «в/в» - внутрішньовенно, «с» - синглет, «д» - дублет; «т» - триплет; «кв» квартет; «м» - мультинлет, «дд» -дублет дублетів; «уш.» - розширений, «РХ» - рідинний хроматограф, «МС» - мас-спектрограф, «ESI/MS» - іонізація електророзпиленням/мас-спектрограф, «Rt» - час утримування, «М» - молекулярний іон, «фунтів на кв. дюйм» - фунтів на квадратний дюйм, «ДМСО» диметилсульфоксид, «DMF» Ν,Νдиметилформамід, «CDI» - 1,Г-карбонілдіімідазол, «DCM» або «СН2СІ2» - дихлорметан, «НСI» - соляна кислота. «SPA» - SPA-аналіз, «АТТС» - Американська колекція типових культур, «FBS» - ембріональна бичача сироватка, «МПС» - мінімальне підтримуюче середовище, «імп./хв.» - кількість імпульсів на хвилину, «EtOAc» - етилацетат, «PBS» - фосфатний буферний фізіологічний розчин, «ТМД» - трансмембранний домен, «ІВМХ» - 3ізобутил-1-метилксантин, «сАМР» - циклічний аденозинмонофосфат. «ІЮПАК» - Міжнародний союз теоретичної і прикладної хімії. «МГц» - мегагерц, «ПЕГ» - иоліетиленгліколь, «МеОН» - метанол, «N» - нормальність, «TНF» - тетрагідрофуран, «год» - години, «хв» - хвилина(и), «MeNH2» - метиламін, «N2» - газоподібний азот, «O.D.» - зовнішній діаметр, «MeCN» або «СН3СN» - ацетонітрил, «Et2O» - етиловий ефір, «преп РХ» препаративна рідинна флеш-хроматографія, «ТФЕ» - твердофазна екстракція, «K2СО3» = карбонат калію. «Na2CO3» = карбонат натрію, «пмол» - пікомолярний, «гептан» - н-гепіан смола «HМВААМ» амінометильна смола 4 95950 26 гідроксиметилбензойної кислоти, «PdCl2(dppf)2» комплекс дихлориду 1,1'біс(дифенілфосфіно)фероценпаладію(ll) y DСМ, «~» - приблизно і «ІС50» - концентрація сполуки, що дає: 50% інгібування в SPA-аналізі цАМФ у Тклітинах LS174 людини. ПРИКЛАДИ Приклад 1 1-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метилпіримідин-4-іл}піролідин-3-карбонова кислота Стадія 1: Розчин 4,6-дихлор-2метоксипіримідину (0,7 г), 2-(2,4дихлорфеніл)етиламіну [0,74 г) і Na2CO3 (0,88 г) у EtOH (25 мл) нагрівають при 80°С протягом трьох годин і виливають у воду (400 мл). Отриману тверду речовину фільтрують і сушать повітрям, одержуючи (6-хлор-2-метоксипіримідин-4-іл)-[2-(2,4дихлорфеніл)етил]амін. Стадія 2: У пробірці змішують (6-хлор-2метоксипіримідин-4-іл)-[2-(2,4дихлорфеніл)етил]амін (300 мг), гідрохлорид 3піролідинкарбонової кислоти (341 мг), K2СО3 (373 мг) і 1-метил-2-піролідинон (5 мл). Пробірку запаюють, нагрівають до 140°С і перемішують протягом 16 годин. Суміш охолоджують до кімнатної температури, розбавляють водою (60 мл), підкислюють за допомогою 3М НСI і тричі екстрагують етилацетатом (60 мл). Органічні екстракти об'єднують, сушать над сульфатом магнію, концентрують і очищають хроматографією на силікагелі (40 г) з елююванням сумішшю від 0 до 20% МеОН у дихлорметані, одержуючи 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метилпіримідин-4іл}піролідин-3-карбонову кислоту (190 мг) у вигляді твердої речовини. РХ-МС Rt =2,22 хв, МС: 411 1 (М+Н). Н ЯМP [300 МГц, (CD3)2SO]: δ 7,57 (1H, с); 7,36 (2H, с), 6,77 (1H, с); 5,01 (1H, с); 3,72 (3Н, с); 3,5 (6Н, м); 3,12 (1Н, м); 2,91 (2Н, т); 2,09 (2Н. м). lС50=9 нМ. Приклад 2 2-(2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-іл)-2-метиллропіонова кислота Стадія 1: Суміш етилового ефіру пірид-3илоцтової кислоти (12,6 г) і родію на оксиді алюмі 27 нію (12,6 г) у етанолі (200 мл) вміщують в апарат Парра при 60°С і тиску 60 фунтів на кв. дюйм на 16 годин. Суспензію фільтрують через целіт. Фільтр промивають етанолом і фільтрат концентрують до об'єму приблизно 50 мл і додають воду (600 мл). Розчин екстрагують EtOAc (3×100 мл). Об'єднані органічні шари промивають сольовим розчином, сушать (Na2SO4), фільтрують і випарюють у вакуумі. Залишок розчиняють у THF (150 мл) з додаванням триетиламіну (10,7 мл). Розчин охолоджують до 0°С і додають по краплях бензилхлорформіат (11 мл). Розчин перемішують при 0°С протягом двох годин. Розчин концентрують до об'єму приблизно 50 мл і додають воду (600 мл). Розчин екстрагують ЕtOАс (2×150 мл). Об'єднаний органічний шар промивають сольовим розчином, сушать (Na2SO4), фільтрують і випарюють у вакуумі, одержуючи бензиловий ефір 3етоксикарбонілметилпіперидин-1-карбонової кислоти (21,5 г), що використовують на наступній ста1 дії без додаткового очищення. МС: 306 (М+Н); Н ЯМР (300 МГц, ДМСО-d6) δ 7,3 (м, 5Н); 5,05 (с, 2Н); 3,8-4,1 (м, 4Н); 2,5-2,6 (м, 1H); 1,5-1,7 (м, 4Н); 1-1,4 (м, 4Н). Стадія 2: До 1М суспензії трет-бутоксиду калію в THF (200 мл) при -78°С додають по краплях розчин бензилового ефіру 3еіоксикарбонілметилгііперидин-1-карбонової кислоти (21,5 г) у THF (25 мл) протягом десяти хвилин. Однією порцією додають метилйодид (6,85 мл). Суспензію перемішують при -78°С протягом однієї години, при -40°С протягом однієї години і доводять до кімнатної температури протягом ночі. Суспензію виливають у воду (800 мл) і екстрагують ЕtOАс (2×150 мл). Об'єднані органічні шари промивають сольовим розчином, сушать (Na2SO4), фільтрують і випарюють у вакуумі. Залишок очищають хроматографією на силікагелі з елююванням сумішшю 100% гептану до 30% ЕtOАс у гептані, одержуючи бензиловий ефір 3-(1етоксикарбоніл-1-метилетил)піперидин-11 карбонової кислоти (151,1 г). МС: 334 (М+Н); Н ЯМР (300 МГц, ДМСО-d6) δ 7,3 (м. 5Н); 5,05 (с, 2Н), 3,8-4,1 (кв, 2Н); 2,5-2,6 (м, 1H); 1,5-1,7 (м, 4Н); 11,4 (м, 4Н); 1 (с, 6H). Стадія 3: Суспензію бензилового ефіру 3-(1етоксикарбоніл-1-метилетил)піперидин-1карбонової кислоти (3,3 г) і 10% паладію на вуглеці (500 мг) у крижаній оцтовій кислоті (2 мл)/метанолі (200 мл) вміщують в апарат Парра при тиску 50 фунтів на кв. дюйм на 90 хвилин при кімнатній температурі. Суспензію фільтрують через целіт. Фільтр промивають метанолом, і фільтрат концентрують до об'єму приблизно 50 мл. Розчин метанолу розбавляють THF (50 мл) і водним розчином 2н гідроксиду калію (50 мл). Розчин перемішують при кімнатній температурі протягом 16 годин і концентрують до об'єму 70-80 мл у вакуумі. Розчин охолоджують до 5°С і повільно додають концентровану водну НСI (8,5 мл). Розчин екстрагують ЕtOАс (3×100 мл). Об'єднаний органічний шар промивають сольовим розчином, сушать (Na2SO4), фільтрують і випарюють у вакуумі, одержуючи 2метил-2-піперидин-3-ілпроиіонову кислоту (1,1 г), що використовують на наступній стадії без додат 95950 28 1 кового очищення. МС: 172 (М+Н); H ЯМР (300 МГц, ДМСО-d6) δ 2,5 (м, 1H); 1,5-1,7 (м, 4Н); 1-1,4 (м, 5Н); 1 (с, 6Н). Стадія 4: Метод А. Розчин (4трифторметоксифеніл)ацетонітрилу (5,05 г) у МеОН (75 мл) насичують газоподібним аміаком і обробляють нікелем Ренея у воді (2 мл, 50%). Суспензію вміщують в апарат Парра при тиску 50 фунтів на кв. дюйм і 50°С на 3 години і фільтрують через целіт. Фільтрат випарюють і залишкову маслянисту речовину розподіляють між водою і етилацетатом. Органічну фазу сушать над сульфатом натрію, фільтрують і випарюють. Залишок розчиняють у МеОН і додають розчин, оброблений концентрованою соляною кислотою (1 мл). Розчин випарюють у вакуумі до одержання твердої речовини, що розтирають у порошок в ефірі і сушать повітрям, одержуючи гідрохлорид 2-(4трифторметоксифеніл)етиламіну (5,15 г). МС: 206 1 (М+Н), H ЯМР (CDCI3): δ 8,2 (2Н, м); 7,4 (2Н, д, J=5 Гц); 7,3 (2Н, д, J=5 Гц); 3-3,1 (211, м): 2,9-3 (2Н, м). Метод В. Розчин 4трифторметоксибензальдегіду (1 г) і нітрометану (0,96 г) в оцтовій кислоті (10,6 мл) обробляють ацетатом амонію (1,01 г) і нагрівають у мікрохвильовій печі до 150°С протягом 15 хвилин. Реакційну суміш розбавляють водою і тричі екстрагують DCM (50 мл). Об'єднані екстракти послідовно промивають 2н гідроксидом натрію, водою і сольовим розчином, сушать над сульфатом натрію і концентрують. Залишок хроматографують на силікагелі й одержують 4-трифторметокси-(2-нітровініл)бензол (1,23 г) у вигляді твердої речовини. Частину 4трифторметокси-(2-нітровініл)бензолу (0,504 г) гідрують воднем з балона, 10% Pd/C (115 мг) у МеОН (22 мл), з вмістом концентрованої соляної кислоти (0,27 мл), при кімнатній температурі протягом 15 годин. Суміш фільтрують і фільтрат концентрують до твердої речовини, що промивають Et2O, одержуючи гідрохлорид 2-(4трифторметоксифеніл)етиламіну (0,3 г) у вигляді твердої речовини. РХ-МС: МС: 206 (М+Н). Стадія 5: Методом, аналогічним описаному у прикладі 1, стадія 1, але з використанням 4,6дихлор-2-метоксипіримідииу (0,39 г), гідрохлориду 2-(4-трифторметоксифеніл)етиламіну (0,38) і бікарбонату натрію (0,74 г) одержують (6-хлор-2метоксипіримідин-4-іл)-[2-(4трифторметоксифеніл)етил]амін (0,61 г). МС: 360 1 (М+Н), Н ЯМР (CDCI3): δ 7,4 (2Н, д, J=7 Гц), 7,3 (2Н, д, J=7 Гц); 6,2 (1Н, с); 3,8 (3Н, с); 3,5-3,6 (2Н, м); 2,8 (2Н, т). Стадія 6: Розчин 2-метил-2-піперидин-3ілпропіонової кислоти (0,6 г), (6-хлор-2метоксипіримідин-4-іл)-[2-(4трифторметоксифеніл)етил]аміну (0,46 г) і K2СО3 (0,46 г) у 1-метилпіролідин-2-оні (10 мл) нагрівають при 140°С протягом 16 годин. Розчин охолоджують і виливають у воду (200 мл). Водний розчин підкислюють до рН~6 крижаною оцтовою кислотою й екстрагують ЕtOАс (3×100 мл). Об'єднані органічні шари промивають сольовим розчином, сушать (Na2SO4), фільтрують і випарюють у вакуумі. За 29 лишок очищають хроматографією на силікагелі з елююванням 5% МеОН у ЕtOАс, одержуючи 2-(1{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-іл)-2-метилпропіонову кислоту (105 1 мг). МС: 483 (М+Н); H ЯМР (300 МГц. ДМСО-d6) δ 7,45 (д, J=3, 2Н); 7.3 (д, J=3, 2Н); 5,5 (с, 1H); 3,95 (с, 3Н); 3,6 (м, 2Н); 2,9 (т, 2H); 2,7 (м, 1H); 1,7-1,9 (м, 4Н); 1,3-1,4 (м, 3Н); 1,1 (д, J=3, 6H) ІС50=2 нМ. Приклад 3 2-[3-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-5-(1-гідрокси-1метилетил)феніл]пропан-2-ол Стадія 1: Розчин диметил-5-бромізофгалату (5 г) у THF (250 мл) охолоджують до -78°С, і додають по краплях розчин 3М метилмагнiйброміду в ефірі (36,6 мл), підтримуючи температуру нижче -70°С. Розчин перемішують при -78°С протягом 2 годин і доводять до кімнатної температури протягом ночі. Розчин розбавляють ефіром (300 мл) і охолоджують до 0°С. 1н водну НСI (100 мл) додають по краплях. Об'єднані органічні шари промивають сольовим розчином, сушать (Na2SO4), фільтрують і випарюють у вакуумі. Залишок очищають хроматографією на силікагелі з елююванням 60% ЕtOАс у гептані, одержуючи 2-[3-бром-5-(1-гідрокси-1метилетил)феніл]пропан-2-ол (4,1 г). МС: 272 1 (М+Н); H ЯМР (300 МГц, ДМСО-d6) δ 7,5 (с, 1Н); 7,4 (с, 2Н); 5,15 (с, 2H); 1,4 (с, 12Н). Стадія 2: 2-[3-бром-5-(1-гідрокси-1метилетил)феніл]пропан-2-ол (1,08 г), 4,4,5,5,4',4',5',5'-октаметил-[2,2']бі[[1,3,2]діоксабороланіл] (1,12 г), ацетат калію (0,78 г) і PdCl2(dppf)2 (42 мг) суспедують у ДМСО (20 мл) і дегазують протягом 20 хвилин. Суспензію нагрівають при 90°С протягом 16 годин. Розчин виливають у воду (300 мл) і екстрагують ЕtOАс (2×150 мл). Об'єднані органічні шари промивають сольовим розчином, сушать (Na2SO4), фільтрують і випарюють у вакуумі. Залишок очищають хроматографією на силікагелі з елююванням 50% ЕtOАс у гептані, одержуючи 2-[3-(1-гідрокси-1-метилетил)5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-21 ил)феніл]пропан-2-ол (0,9 г). МС: 285 (М+Н); H ЯМР (300 МГц, ДМСО-d6) δ 7,5 (с, 1H); 7,2 (с, 2Н); 5,15 (с, 2Н); 1,6 (с, 12Н); 1,4 (с, 12Н). Стадія 3: Розчин 2-[3-(1-гідрокси-1-метилетил)5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2іл)феніл]пропан-2-олу (0,35 г), (6-хлор-2метоксипіримідин-4-іл)-[2-(2,4 95950 30 дихлорфеніл)етил]аміну (0,2 г), карбонату цезію (0,58 г) і тетракис(трифенілфосфін)паладію(0) (41 мг) у 20 мл води/80 мл диметоксіетану дегазують протягом 20 хвилин і нагрівають при 90°С протягом 16 годин. Розчин випарюють у вакуумі. Залишок очищають хроматографією з елююванням 70% ЕtOАс у гептані, одержуючи 2-[3-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}5-(1-гідрокси-1-метилетил)феніл]пропан-2-ол (0,44 1 г). МС: 491 (М+Н); Н ЯМР (300 МГц, ДМСО-d6) δ 7,9 (с, 2Н), 7,8 (с, 1Н); 7,45 (с, 1H); 7,2-7,3 (м, 2H); 6,5 (с, 1H); 3,95 (с, 3Н); 3,85 (м, 2Н); 3,1 (т, 2Н); 1,6 (с, 12Н). lС50=730 нМ. Приклад 4 [6-(3-амінопіперидин-1-іл)-2-метоксипіримідин4-іл]-[2-(2,4-дихлорфеніл)етил]амін Стадія 1: Методом, аналогічним описаному у прикладі 1, стадія 2, але використовуючи 3-N-Восамінопіперидин (450 мг) замість гідрохлориду 3піролідинкарбонової кислоти й очищаючи продукт реакції флеш-хроматографією на колонці із силікагелем (40 г) з елююванням сумішшю від 20 до 50% ЕtOАс у гептані, одержують трет-бутиловий ефір (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-іл)карбамінової 1 кислоти (281 мг). Н ЯМР [300 МГц, (CD3)2SO]: δ 7,57 (1Н, с); 7,36 (2H, с); 6,9 (2Н, м); 5,29 (1Н, с); 4 (2Н, м); 3,71 (3Н, с); 3,41 (5Н, м); 2,91 (2Н, т); 2,65 (2Н, м); 1,82 (1Н, с); 1,63 (1Н, с); 1,39 (9Н, с). Стадія 2: Розчин трет-бутилового ефіру (1-{6[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-іл)карбамінової кислоти (234 мг) у дихлорметані (4 мл) обробляють трифтороцтовою кислотою (4 мл). Суміш перемішують при кімнатній температурі протягом 3 годин і концентрують у вакуумі. Залишок розчиняють у насиченому розчині бікарбонату натрію (25 мл) і двічі екстрагують етилацетатом (25 мл). Органічні екстракти об'єднують, промивають сольовим розчином (20 мл), сушать над сульфатом магнію, концентрують і очищають хроматографією на силікагелі (12 г) з елююванням сумішшю від 0 до 10% МеОН у дихлорметані, одержуючи [6-(3амінопіперидин-1-іл)-2-метоксипіримідин-4-іл]-[2(2,4-дихлорфеніл)етил]амін (157 мг) у вигляді твердої речовини. РХ-МС Rt=1,77 хв, МС: 396 (М+Н). 1 Н ЯМР [300 МГц, (CD3)2SO]: δ 7,59 (1H, с); 7,36 (2Н, с); 6,86 (2Н, м); 5,93 (1Н, уш.); 5,29 (1Н, с); 4,16 (2Н, д); 3,82 (2Н, д); 3,73 (3Н, с); 3,41 (4Н, м); 2,91 (4Н, м); 1,91 (1Ы, м); 1,69 (1Н, м); 1,41 (2Н, м); 1,23 (1H, с). ІС50=985 нМ. 31 Приклад 5 (а) [6-(4-амінопіперидин-1-іл)-2метоксипіримідин-4-іл]-[2-(2,4дихлорфеніл)етил]амін Стадія 1: Методом, аналогічним описаному у прикладі 1, стадія 2, але використовуючи 4-N-Восамінопіперидин (450 мг) замість гідрохлориду 3піролідинкарбонової кислоти й очищаючи продукт реакції флеш-хроматографією на колонці із силікагелем (40 г) з елююванням сумішшю від 0 до 40% EtOAc у гептані, одержують трет-бутиловий ефір (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-4-іл)карбамінової кислоти (320 мг). Стадія 2: Розчин трет-бутилового ефіру ((1-{6[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-4-іл)карбамінової кислоти (300 мг) у DCM (5 мл) обробляють триетилсиланом (194 мкл) з наступним додаванням трифтороцтової кислоти (106 мюі). Суміш перемішують при кімнатній температурі протягом 20 годин і концентрують у вакуумі. Залишок розчиняють у насиченому розчині бікарбонату натрію (30 мл) і двічі екстрагують етилацетатом (30 мл). Органічні екстракти об'єднують, промивають сольовим розчином (20 мл), сушать над сульфатом магнію і концентрують, одержуючи [6-(3-амінопіперидин-1іл)-2-метоксипіримідин-4-іл]-[2-(2,4дихлорфеніл)етил]амін (230 мг) у вигляді твердої речовини. (b) N-(1-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-4-іл)ацетамід До суміші [6-(3-амінопіперидин-1-іл)-2метоксипіримідин-4-іл]-[2-(2,4дихлорфеніл)етил]аміни (190 мг), триетиламіну (134 мкл, 0,96 ммоль) і Ν,Νдиметиламінопиридину (6 мг) у тетрагідрофурані (6 мл) додають ацетилхлорид (41 мкл, 0,58 ммоль). Реакційну суміш перемішують протягом 17 годин, гасять додаванням води (20 мл) і двічі екстрагують етилацетатом (25 мл). Органічні екстракти об'єднують, сушать над сульфатом магнію, концентрують і очищають хроматографією на силікагелі 95950 32 (12 г) з елююванням сумішшю від 0% до 12% МеОН у СН2Сl2, одержуючи N-(1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-4-іл)ацетамід (48 мг) у вигляді твер1 дої речовини. РХ-МС Rt=1,9 хв, МС: 438 (М+Н). Н ЯМР [300 МГц, (CDO2SO]: δ 7,81 (1Н, д); 7,59 (1H, с); 7,36 (2Н, с); 6,79 (2Н, м); 5,31 (1Н, с); 4,07 (2Н, м); 3,78 (1H, д); 3,71 (3Н, с); 3,41 (2Н, м); 2,91 (4Н, м); 1,78 (3Н, с); 1,73 (1Н, м); 1,25 (4Н м). lС50=26 нМ. Приклад 6 5-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-1-метил-2,3-дигідро-1Ніндол-2-карбонова кислота Стадія 1. До суміші етил-5-броміндол-2карбоксилату (2,5 г) у DMF (20 мл) додають розчин 60% Na (485 мг) у DMF (10 мл). Отриману суміш перемішують протягом 15 хвилин і додають через шприц йодметан (0,638 мл). Реакційну суміш перемішують при кімнатній температурі протягом 20 хвилин. Додають воду (200 мл) і суміш двічі екстрагують етилацетатом (100 мл). Органічні екстракти об'єднують, промивають водою (3×50 мл) і один раз сольовим розчином (50 мл), сушать над сульфатом магнію і концентрують, одержуючи етиловий ефір 5-бром-1-метил-1Н-індол-2-карбонової 1 кислоти (1,28 г) у вигляді твердої речовини. Н ЯМР [300 МГц, CDCI3]: δ 7,79 (1H, д), 7,41 (1H. дд); 7,27 (1H, т); 7,2 (1H, с); 4,39 (2Н, кв); 4,05 (3Н, с); 1,41 (3Н, т). Стадія 2. До розчину етилового ефіру 5-бром1-метил-1Н-індол-2-карбонової кислоти (1,28 г) у трифтороцтовій кислоті (10 мл) додають ціаноборгідрид натрію (680 мг) при 0°С. Реакційну суміш доводять до кімнатної температури, перемішують протягом 20 годин і гасять водою (100 мл). Підлуговують NaOH і екстрагують Et2O (3×50 мл). Органічні екстракти об'єднують, промивають сольовим розчином (30 мл), сушать над сульфатом магнію, концентрують і очищають хроматографією на силікагелі (34 г) з елююванням сумішшю від 0% до 25% етилацетату в гептані, одержуючи етиловий ефір 5-бром-1-метил-2,3-дигідро-1Н-індол-2карбонової кислоти (800 мг) у вигляді твердої ре1 човини. Н ЯМР [300 МГц, CDCI3]: δ 7,19 (1Н, д); 7,21 (1H, с); 6,34 (1Н, д); 4,25 (2Н, кв.д): 4,06 (1H, т); 3,21 (2Н, м); 2,82 (3Н, с); 1,30 (3Н, т). Стадія 3. Суміш етилового ефіру 5-бром-1метил-2,3-дигідро-1Н-індол-2-карбонової кислоти (800 мг), біс(пінаколато)дибору (1,5 г), ацетату калію (1,47 г) і PdCl2(dppf)2 (139 мг) у дим етил сульфоксиді (10 мл) дегазують продуванням азоту протягом 5 хвилин. Суміш нагрівають до 90°С протягом 4 годин. Реакційну суміш охолоджують, розбавляють водою (75 мл) і етилацетатом (100 мл) і 33 перемішують зі знебарвлюючим вугіллям. Двофазну суміш фільтрують через целіт і фільтрат двічі екстрагують ЕtOАс (50 мл). Органічні екстракти об'єднують, промивають тричі водою (50 мл), один раз сольовим розчином (30 мл), сушать над сульфатом магнію, концентрують і очищають хроматографією на силікагелі (34 г) з елююванням сумішшю від 0% до 20% етилацетату в гептані, одержуючи етиловий ефір 1-метил-5-(4,4,5,5тетраметил-[1,3,2]диоксаборолан-2-іл)-2,3-дигідро1Н-індол-2-карбонової кислоти (903 мг) у вигляді 1 твердої речовини. Н ЯМР [300 МГц, (CD3)2SO]: δ 7,39 (1H, д); 7,28 (1H, с); 6,46 (1Н. д); 4,18 (3Н, м); 3,3 (1Н, д); 2,97 (1Н, м); 2,79 (3Н, с); 1,24 (12Н, с); 1,22 (3Н, т). Стадія 4: Суміш (6-хлор-2-метоксипіримідин-4іл)-[2-(2,4-дихлорфеніл)етил]аміну (200 мг), етилового ефіру 1-метил-5-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-2,3-дигідро-1Н-індол-2карбонової кислоти (300 мг), Cs2CO3 (390 мг) і тетракис(трифенілфосфін)паладію (35 мг) у воді (0,4 мл) і диметилового ефіру етиленгліколю (1.6 мл) дегазують продуванням азоту протягом 5 хвилин і нагрівають при 90°С протягом 19 годин. Реакційну суміш охолоджують, розбавляють водою (50 мл) і двічі екстраіують етилацетатом (50 мл). Органічні екстракти об'єднують, сушать над сульфатом магнію, концентрують і очищають хроматографією на силікагелі (40 г) з елююванням сумішшю від 0% до 40% етилацетату в гептані, одержуючи етиловий ефір 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-]-метил-2,3-дигідро-1Ніндол-2-карбонової кислоти (110 мг) у вигляді твердої речовини. РХ-МС Rt = 5,57 хв, МС: 501 (М+Н). 1 Н ЯМР [300 МГц, (CD3)2SO]: δ 7,72 (2Н, м), 7,59 (1H, с); 7,37 (3Н, с); 6,54 (1H, д); 6,42 (1H, с); 4,30 (1Н, м): 4,17 (2Н, кв.д); 3,84 (3Н, с); 3,54 (2Н, уш.); 3,41 (1Н, м); 3.06 (1Н, м); 2,97 (2Н, т); 2,83 (3Н, с): 1,23 (3Н, т). Стадія 5: Моногідрат гідроксиду літію (1,28 ммоль) додають до переміщуваної суміші етилового ефіру 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-1-метил-2,3-дигідро-1Ніндол-2-карбонової кислоти (0,43 ммоль) у МеОН/Н2О (10 мл, 9:1). Реакційну суміш перемішують протягом ночі при кімнатній температурі. Реакційну суміш розбавляють водою і леткі речовини видаляють у вакуумі. Водну фазу однократно екстрагують Еt2О, підкислюють до рН 4 (1н, НСI) і двічі екстрагують етилацетатом. Об'єднаний органічний шар сушать (MgSO4) і концентрують у вакуумі, одержуючи 5-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}-1-метил-2,3-Дигідро-1Ніндол-2-карбонову кислоту. Приклад 7 (а) [2-(3-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2метилпропіоніл]амід 2-метилпропан-2сульфонової кислоти 95950 34 Стадія 1: До розчину діізопропіламіду літію в суміші ТHF/н-гептан/етилбензол (1,8 М, Г/ мл) при 0°С додають розчин 2-(3-бромфеніл)пропіонової кислоти (3 г) у THF (5 мл) по краплях протягом 15 хвилин. Розчин перемішують протягом 1 години з наступним додаванням по краплях метилйодиду (4,93 г) у THF (5 мл) протягом 10 хвилин. Реакційну суміш перемішують протягом 15 годин, гасять 2н соляною кислотою, концентрують у вакуумі і розчиняють в ефірі (150 мл). Шар ефіру промивають 2н соляною кислотою і тричі екстрагують 2н гідроксидом натрію (50 мл). Об'єднані шари гідроксиду натрію підкислюють 6н соляною кислотою до рН~1 і тричі екстрагують ефіром (75 мл). Об'єднані органічні шари промивають сольовим розчином, сушать над сульфатом натрію і концентрують, одержуючи 2-(3-бромфеніл)-2-метилпропіонову кислоту у вигляді твердої речовини (3,08 г), що використовують далі без додаткового очищення. РХ-МС: 243 (М+Н). Стадія 2: У розчин 2-(3-бромфеніл)-2метилпропіонової кислоти (2,18 ммоль) у безводному ефірі (20 мл) додають трет-бутиллітій (1,7М у пентані, 5,4 мл, 9,16 ммоль) по краплях при -78°С і цю суміш перемішують протягом 30 хвилин із трибутилборатом (2,34 мл, 8,72 ммоль). Реакційну суміш доводять до кімнатної температури, перемішують протягом 15 годин, розбавляють ефіром і гасять 1М Н3РО4. Після перемішування протягом 30 хвилин ефірний шар відділяють і екстрагують 2н водним гідроксидом натрію (3×20 мл). Об'єднані екстракти гідроксиду натрію підкислюють 6н соляною кислотою до рН~1 і тричі екстрагують ефіром (50 мл). Об'єднані органічні екстракти промивають сольовим розчином, сушать над сульфатом натрію і концентрують, одержуючи 3-(1-карбокси-1метилетил)фенілборонову кислоту, що далі використовують без додаткового очищення. Стадія 3: Розчин (6-хлор-2-метоксипіримідин4-іл)-[2-(2,4-дихлорфеніл)етил]аміну (0,51 ммоль) і 3-(1-карбокси-1-метилетил)фенілборонової кислоти (0,61 ммоль) у MeCN (2,5 мл) і водному розчині Na2CO3 (0,4M, 2,5 мл) дегазують азотом протягом 5 хвилин, а потім додають тетракис(трифенілфосфїн)палладій(0) (29,5 мг). Реакційну ємність герметизують і нагрівають у мікрохвильовій печі до 130°С протягом 30 хвилин. До реакційної суміші додають 2 ми води, рН доводять до ~7 за допомогою 2н водної соляної кислоти і цю суміш тричі екстрагують ЕtOАс (30 мл). Об'єднані екстракти промивають сольовим розчином, сушать над сульфатом натрію і концентрують. Отриману маслянисту речовину хроматографують на силікагелі з елююванням сумішшю від 0% до 7% МеОН у DCM, одержуючи 2-(3-{6-[2-(2,4 35 дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}феніл)-2-метилпрошонову кислоту (205 мг) у вигляді твердої речовини. РХ-МС: Rt=2,39 хв, МС: 1 460,2 (М+Н). Н ЯМР [300 МГц, (CD3)2SO]: δ 12,38 (1Н, с), 7,36-8 (7H, м), 6,58 (1H, с), 3,84 (3Н, с), 3,58 (2Н, м), 2,98 (2Н. м), 1,54 (6Н, с). Стадія 4: Гідрохлорид N-(3диметиламінопропіл)-N-етилкарбодііміду (0,23 ммоль) додають у перемішуваний крижаний розчин 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2-метилпропіонової кислоти (0,22 ммоль), трет-бутилсульфонаміду (0,23 ммоль) і 4-диметиламінопіридину (0,22 ммоль) у сухому DCM в атмосфері азоту. Крижану баню забирають, і реакційну суміш перемішують протягом ночі при 60°С. Леткі речовини видаляють при зниженому тиску, залишок розчиняють у етилацетаті, промивають 0,1н НСI, сольовим розчином і водою, сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску. Сирий залишок очищають хроматографією (колонка з Si2O) з елююванням EtOAc/DCM, одержуючи [2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2метилпропіоніл]амід 2-метилпропан-2сульфонової кислоти (25 мг). РХ-МС: Rt=2,67 хв, МС: 579, 581 (М+Н). ІС50=2 нМ. (b) [2-(3-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2метилпропіоніл]амід N,N-диметиламід-2сульфонової кислоти Методом, аналогічним описаному у прикладі 7(а), стадія 4, але використовуючи Ν,Νдиметилсульфамід замість третбутилсульфонаміду, одержують [2-(3-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}феніл)-2-метилпропіоніл]амід N,N-диметиламід2-cульфонової кислоти (185 мг). РХ-МС: Rt=2,26 хв, МС: 566, 568 (М+Н). (c) 2-(3-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-2-метил-1тіоморфолін-4-ілпропан-1-он Методом, аналогічним описаному у прикладі 7(а), стадія 4, але використовуючи тіоморфолін замість трет-бутилсульфонаміду, одержують 2-(3{6-[2-(2,4-дихлорфеніл)етиламіно]-2 95950 36 метоксипіримідин-4-іл}феніл)-2-метил-1тіоморфолін-4-ілпропан-1-он (120 мг). РХ-МС: Rt=2,68 хв, МС: 545, 547 (М+Н). ІС50=383 нМ (d) 2-(3-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)ізобутирамід Методом, аналогічним описаному у прикладі 7(а), стадія 4, але використовуючи бікарбонат амонію замість трет-бутилсульфонаміду, одержують 2-(3-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)ізобутирамід (120 мг). РХ-МС: Rt=2,01 хв, МС: 459, 461 (М+Н). (e) 2-(3-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-Ν,Νдиметилізобутирамід Методом, аналогічним описаному у прикладі 7(а), сгація 4, але використовуючи диметиламін замість трет-бутилсульфонаміду, одержують 2-(3{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}феніл)-N,Nдиметилізобутирамід (186 мг). РХ-МС: Rt=2,44 хв, МС: 487, 489 (M+H). Приклад 8 (1-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-іл)оцтова кислота Стадія 1: Розчин (6-хлор-2-метоксипіримідин4-іл)-[2-(2,4-дихлорфеніл)етил]аміни (3 ммоль), етилового ефіру піперидину оцтової кислоти (7,5 ммоль) і K2СО3 (9 ммоль) у 1-метил-2-піролідиноні (10 мл) перемішують протягом ночі при 145°С. Реакційну суміш охолоджують до кімнатної температури, розбавляють водою (60 мл) і двічі екстрагують DCM. Водний шар повільно підкислюють 1н соляною кислотою до рН 4, енергійно перемішуючи, і перемішування продовжується протягом 1,5 37 години. Осад, що утворився, фільтрують відсмоктуванням і сушать на повітрі, одержуючи етиловий ефір (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-іл)оцтової кислоти (1,42 г). РХ-МС: Rt=2,35 хв, МС: 467, 469 (М+Н). Стадія 2: Моногідрат гідроксиду літію (54 мг) додають до переміщуваного розчину етилового ефіру (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-іл)оцтової кислоти (0,2 г) у MeOH/H2O (10 мл, 9:1). Реакційну суміш перемішують протягом ночі при кімнатній температурі. Реакційну суміш розбавляють водою і леткі речовини видаляють у вакуумі. Водну фазу однократно екстрагують Et2O, підкислюють до рН 4 (1н, НСI) і двічі екстрагують етилацетатом. Об'єднаний органічний шар сушать (MgSО4) і концентрують у вакуумі, одержуючи (1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-іл)оцтову кислоту (180 мг). РХ-МС: Rt=2,08 хв, МС: 439, 441 (М+Н). ІС50=0,5 нМ. Приклад 9 1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбонова кислота Розчин (6-хлор-2-метоксипіримідин-4-іл)-[2-(4трифторметоксифеніл)етил]аміну (1 г), ніпекотинової кислоти (0,93 г) і K2СО3 (1,19 г) у 1-метил-2піролідиноні (10 мл) перемішують протягом ночі при 145°С. Реакційну суміш охолоджують до кімнатної температури, розбавляють водою (60 мл) і двічі екстрагують дихлорметаном. Водний шар повільно підкислюють 1н соляною кислотою до рН 4, енергійно перемішуючи, і перемішування продовжується протягом 1,5 години. Осад, що утворився, фільтрують відсмоктуванням і сушать на повітрі, одержуючи 1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбонову кислоту у вигляді порошку (0,99 г). РХ-МС: Rt=2,07 хв, МС: 441 (М+Н). ІС50=9 нМ. Приклад 10 N-(1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл)піперидин-3-карбоніл)метансульфонамід 95950 38 Гідрохлорид N-(3-диметиламінопропіл)-Nетилкарбодііміду (68 мг) додають у переміщуваний крижаний розчин 1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбонової кислоти (150 мг), метансульфонаміду (48,6 мг) і 4-диметиламінопіридину (50 мг) у сухому DCM в атмосфері N2. Крижану баню забирають, і реакційну суміш перемішують протягом ночі, доводячи до кімнатної температури. Суміш концентрують у вакуумі. Залишок розчиняють у етилацетаті, промивають 0,1н НСI, сольовим розчином і водою, сушать (Na2SO4), фільтрують і концентрують. Залишок очищають хроматографією (колонка з Si^O) з елююванням EtOAc/DCM, одержуючи N-(1-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4іл}піперидин-3-карбоніл)метансульфонамід (65 мг). РХ-МС: Rt=2,09 хв, МС: 518 (М+H). ІС50=22 нМ. Приклад 11 (а) N-(1-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3карбоніл)метансульфонамід Стадія 1: У пробірці змішують (6-хлор-2метоксипіримідин-4-іл)-[2-(2,4дихлорфеніл)етил]амін (200 мг), ніпекотинову кислоту (194 мг), K2СО3 (249 мг) і 1-метил-2піролідинон (2,5 мл). Пробірку запаюють, нагрівають до 140°С і перемішують протягом 5 годин. Суміш охолоджують до кімнатної температури, залишають на 12 годин, розбавляють водою (20 мл) і підкислюють за допомогою 3М водної НСI. Осад, що утвориться, збирають фільтрацією і сушать у високому вакуумі, одержуючи 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонову кислоту (121 мг) у вигляді твердої речовини. РХ-МС Rt=2,15 хв, МС: 425 (М+Н). Стадія 2: N-(3-Диметиламінопропіл)-Nетилкарбодіімідгідрохлорид (71 мг) додають у переміщуваний крижаний розчин 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти (150 мг), метансульфонаміду (43,6 мг) і 4-диметиламінопиридину (52 мг) у сухому дихлорметані в присутності N2. Крижану баню забирають і реакційну суміш перемішують протягом ночі при кімнатній температурі. Суміш концентрують у вакуумі. Залишок розчиняють у етилацетаті, промивають 0,1н НСI, сольовим розчином і водою, сушать (Na2SO4), фільтрують і концентрують. Залишок очищають хроматографією (колонка з Si2O) з елююванням ЕtOAc/DCM, одержуючи N-(1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбоніл)метансульфонамід (145 мг). РХ-МС: Rt=1,88 хв, МС: 502, 504 (М+Н). ІС50=1 нМ. 39 95950 40 (b) (1-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)амід етансульфонової кислоти Методом, аналогічним описаному у прикладі 11(а), стадія 2, але використовуючи етансульфонамід замість метансульфонаміду, одержують (1{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)амід етансульфонової кислоти (125 мг). РХ-МС: Rt=2,12 хв, МС: 516, 518 (M+H). (c) (1-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)амід 2-метилпропан-2-сульфонової кислоти Методом, аналогічним описаному у прикладі 11(а), стадія 2, але використовуючи третбутилсульфонамід замість метансульфонаміду, одержують (1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин~3-карбоніл)амід 2-метилпропан-2-сульфонової кислоти (132 мг). РХ-МС: Rt=2,2 хв, МС: 544, 546 (М+Н). (d) N-(1-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)С,С,С-трифтормeтансульфонамід Методом, аналогічним описаному у прикладі 11(а), стадія 2, але використовуючи ірифторметилсульфонамід замість метансульфонаміду, одержують N-(1-{6-[2-(2,4-дихлорфeніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоніл)С,С,С-трифторметансульфонамід (257 мг). РХ-МС: Rt=2,3 хв, МС: 556, 558 (М+H). ІС50=18 нМ (e) (1Н-тетразол-5-іл)амід і-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти Методом, аналогічним описаному у прикладі 11(а), стадія 2, але використовуючи 1H-тетразол5-іламін замість метансульфонаміду, одержують (1H-тетразол-5-іл)амід 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти (15 мг). РХ-МС: Rt=1,81 хв, МС: 492, 494 (М+Н). ІС50=4,4 нМ. (f) Амід 1- {6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбонової кислоти Гідрохлорид N-(3-диметиламінопротл)-Nетилкарбодiiмiду (0,23 ммоль) додають у перемішуваний крижаний розчин 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти (0,22 ммоль), етансульфонаміду (0,23 ммоль) і 4диметиламінопиридину (0,22 ммоль) у сухому дихлорметані в атмосфері N2. Крижану баню забирають, і реакційну суміш перемішують протягом ночі при 60°С. Суміш концентрують у вакуумі. Залишок розчиняють у етилацетаті, промивають 0,1н HСІ, сольовим розчином і водою, сушать (Na2SO4), фільтрують і концентрують при зниженому тиску. Залишок очищають хроматографією (колонка з Si2O) з елююванням EtOAc/DCM, одержуючи амід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбонової кислоти (75 мг) РХ-МС: Rt=1,77 хв, МС: 424, 426 (М+Н). (g) Диметиламід 1-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4іл}піперидин-3-карбонової кислоти Методом, аналогічним описаному у прикладі 11(а), стадія 2, але використовуючи диметиламін замість метансульфонаміду, одержують диметиламід 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2 41 метоксипіримідин-4-іл}піперидин-3-карбонової кислоти (65 мг). РХ-МС: Rt=1,88 хв, МС: 452, 454 (М+Н). (h) 1-{6-[2-(2,4-Дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоксамід N,N-диметиламід-2-сульфонової кислоти Методом, аналогічним описаному у прикладі 11(а), стадія 2, але використовуючи Ν,Νдиметилсульфамід замість метансульфонаміду, одержують 1-{6-[2-(2,4-дихлорфеніл)етиламіно]-2метоксипіримідин-4-іл}піперидин-3-карбоксамід N,N-диметиламід-2-сульфонової кислоти (241 мг). РХ-МС: Rt=2,5 хв, МС: 531, 533 (М+Н). ІС50=14 нМ. Приклад 12 5-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4-іл)тіофен-2-карбонова кислота Стадія 1: 5-(Дигідроксиборил)-2тіофенкарбонову кислоту (527 мг) і 2,2диметилпропан-1,3-діол (361 мг) перемішують при кімнатній температурі в THF (10 мл) протягом 19 годин і концентрують у вакуумі, одержуючи 5-(5,5диметил-[1,3,2]діоксаборинан-2-іл)-тіофен-2карбонову кислоту (748 мг) у вигляді твердої речо1 вини. РХ-МС: Rt=1,15 хв; H ЯМР [300 МГц, (CD3)2SO]: δ 13,15 (1H, с); 7,7 (1H, м); 7,45 (1H, м); 3,75 (4H, с); 0,95 (6Н, с). Стадія 2: Суміш (6-хлор-2-метоксипіримідин-4іл)-[2-(4-трифторметоксифеніл)етил]аміну (267 мг), 5-(5,5-диметил-[1,3,2]діоксаборинан-2-іл)-тіофен-2карбонової кислоти (277 мг), фториду цезію (351 мг) і тетракис(трифенілфосфін)паладію (71 мг) у воді (1,6 мл) і диметиловому ефірі етиленгліколю (6,4 мл) дегазують продуванням азоту протягом 5 хвилин і нагрівають до 85°С протягом 16 годин. Реакційну суміш охолоджують, розбавляють водою (150 мл) і сольовим розчином (25 мл), двічі екстрагують ЕtOАс (100 мл), і екстракти концентрують у вакуумі. Залишок очищають флешхроматографією на колонці із силікагелем (10 г) з елююванням сумішшю від 0 до 5% МеОН у ЕtOАс. Отриману тверду кристалічну речовину розтирають у порошок у DCM (5 мл) і ефірі (5 мл) і сушать, одержуючи 5-{2-метокси-6-[2-(4трифторметоксифеніл)етиламіно]піримідин-4-іл}тіофен-2-карбонову кислоту (42 мг) у вигляді твер 95950 42 1 дої речовини. МС: 440; РХ-МС: Rt=3,48 хв; H ЯМР [300 МГц, (CD3)2SO]: δ 7,7 (3Н, м); 7,35 (2H, м); 7,25 (2Н, м), 6,6 (1H, с); 3,85 (3Н, с); 2,55 (2Н; м); 1,9 (2Н, т, J=7 Гц). ІС50=2 нМ Приклад 13 Гідрохлорид 5-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}2,3-дигідробензофуран-2-карбонової кислоти Стадія 1: До розчину 2,3-дигіцробензофуран-2карбонової кислоти (510 мг) у крижаній оцтовій кислоті (4 мл) додають по краплях бромін (497 мг). Через 16 годин реакцію гасять водою (100 мл) і бісульфітом натрію (1 г) і двічі екстрагують ЕtOАс (100 мл). Екстракти концентрують) вакуумі і сушать у високому вакуумі, одержуючи 5-бром-2,3дигідробензофуран-2-карбонову кислоту (811 мг) у 1 вигляді твердої речовини. МС: 241 (М+Н), Н ЯМР [300 МГц, (CD3)2SO]: δ 13,05 (1Н, с); 7,4 (1H, с); 7,25 (1H, д); 6,8 (1H, м); 5,25 (1Н, кв), 3,55 (1Н, дд); 3,25 (1Н, м). Стадія 2: Суміш 5-бром~2,3дигідробензофуран-2-карбонової кислоти (0,74 г), біс(пінаколато)дибору (1,51 г), ацетату калію (1,47 м, 15 ммоль) і PdСІ2(dppf)2 (115 мг, 0,14 ммоль) у диметилсульфоксиді (10 мл) дегазують продуванням азоту протягом 5 хвилин. Суміш нагрівають до 90°С проіягом 16 годин. Реакційну суміш охолоджують, розбавляють водою (200 мл) і сольовим розчином (25 мл) і фільтрують через целіт, а потім додають воду (200 мл) і ЕtOАс (200 мл). Фільтрат двічі екстрагують ЕtOАс (200 мл), і екстракти концентрують у вакуумі. Залишок очищають флешхроматографією на колонці із силікагелем (4 г) з елююванням сумішшю від 80 до 100% ЕtOАс у гептані, одержуючи 5-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-2,3-дигідробензофуран2-карбонову кислоту (715 мг) у вигляді маслянис1 тої речовини. МС: 289 (М-Н), Н ЯМР [300 МГц, (CD3)2SO]: δ 13,05 (1Н, с); 7,5 (2H, м); 6,8 (1Н, м); 5,2 (1Н, м); 3,6 (1Н, м); 3,3 (1H, м); 1,05 (12Н, с). Стадія 3: Суміш (6-хлор-2-метоксипіримідин-4іл)-[2-(2,4-дихлорфеніл)етил]аміну (212 мг), 5(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-іл)-2,3дигідробензофуран-2-карбонової кислоти (124 мг), карбонату цезію (414 мг) і тетракис(трифенілфосфін)паладію (49 мг) у воді (1,2 мл) і диметиловому ефірі етиленгліколю (4,8 мл) дегазують продуванням азоту протягом 5 хвилин і нагрівають до 70°С протягом 64 годин. Реакційну суміш охолоджують, розбавляють водою (150 мл) і сольовим розчином (25 мл) і двічі екстрагують EtOAc (150 мл), і екстракти концентрують у вакуумі. Залишок очищають фпеш-хроматографією на колонці із силікагелем (4 г) з елююванням сумішшю від 0 до 25% МеОН у ЕtOАс, одержуючи 5-{6[2-(2,4-дихлорфеніл)етиламіно]-2 43 метоксипіримідин-4-іл}-2,3-дигідробензофурап-2карбонову кислоту (80 мг) у вигляді маслянистої речовини. МС: 460; РХ-МС: Rt=2,81 хв. Стадія 4: Частина 5-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}2,3-дигідробензофуран-2-карбонової кислоти обробляють флеш-хроматографією на колонці із силікагелем (5 г) з елююванням сумішшю від 0% до 25% МеОН у ЕtOАс. Продукт розчиняють у МеОН і обробляють 0.5М соляною кислотою в МеОН і концентрують у вакуумі. Продукт розчиняють у THF (3 мл) і ефірі (10 мл). Осад видаляють і сушать, одержуючи гідрохлорид 5-{6-[2-(2,4дихлорфеніл)етиламіно]-2-метоксипіримідин-4-іл}2,3-дигідробензофуран-2-карбонової кислоти (20 мг) у вигляді твердої речовини. РХ-МС: Rt=2,79 хв; МС: 460. ІС50=2 нМ. ФАРМАКОЛОГІЧНИЙ ТЕСТ Інгібіторну дію сполук, які є об'єктом даного винаходу, оцінюють за допомогою функціонального аналізу на простагландин D людини. Застосовується аналіз цАМФ із використанням лінії клітин людини LS174T, які експресують ендогенний рецептор простагландину D. Протокол аналогічний описаному раніше (Wright DH, Ford-Hutchinson AW, Chadee K, Metters KM, The human prostanoid DP receptor stimulates mucin secretion in LS174T cells, Br J Pharmacol. 131(8):1537-45 (2000)). Протокол SPA-аналізу цАМФ у клітинах LS174 Τ людини Матеріали - PGD2 (Cayman Chemical, кат. № 12010) - ІВМХ (Sigma кат. № 5879) - Система прямого скринінгового SPA-аналізу цАМФ (код Amersham RPA 559) - 96-ямкові планшети для клітинних культур (Wallac кат. № 1450-516) - Сцинтиляційний лічильник Wallac 1450 Microplate Trilux (РеrkinFlmer) - Пристосування для заклеювання планшетів - Центрифугальні пробірки Eppendorf - Фізіологічний розчин у фосфатному буфері (PBS) Дульбекко (Invitrogen кат. №14040-133) - Дистильована вода - Струшувач - Магнітна мішалка і набір якорів Підготовка реагентів Перед розведенням усі реагенти повинні бути доведені до кімнатної температури. Аналітичний буфер 1Х Переносять вміст пляшки в 500 мл мензурку багаторазовим промиванням дистильованою водою. Доводять повний об'єм до 500 мл, додавши дистильовану воду, і ретельно перемішують. Лізуючий реагент 1 і 2 Розчиняють кожний з лізуючих реагентів 1 і 2 у 200 мл аналітичного буфера, відповідно. Залишають на 20 хвилин при кімнатній температурі для розчинення. Гранули антитіл кролика для SPA-аналізу 95950 44 Додають у пляшку 30 мл лізуючого буфера 2. Обережно струшують пляшку протягом 5 хвилин. Імунна сироватка Додають 15 мл лізуючого буфера 2 у кожну посудину й обережно перемішують вміст до повного розчинення. 125 Маркер (І -цАМФ) Додають 14 мл лізуючого буфера 2 у кожну посудину й обережно перемішують вміст до повного розчинення. Підготовка імунореагенту 1) Додають рівні об'єми маркера, імунної сироватки і SPA-реагенту антитіл кролика в посудину, простеживши за тим, щоб був приготовлений достатній об'єм для потрібної кількості ямок (150 мкл на ямку). 2) Ретельно перемішують. 3) Необхідно готувати свіжий розчин імунореагенту перед кожним аналізом і не використовувати його повторно. Стандарт 1) Додають 1 мл лізуючого буфера 1 і обережно перемішують вміст до повного розчинення. 2) Кінцевий розчин містить цАМФ у концентрації 512 пмоль/мл. 3) Позначають 7 поліпропіленових або полісгирольних пробірок 0,2 пмоль, 0,4 пмоль, 0,8 пмоль, 1,6 пмоль, 3,2 пмоль, 6,4 пмоль і 12,8 пмоль. 4) Піпеткою додають 500 мкл лізуючою буфера 1 в усі пробірки. 5) У пробірку «12,8 пмоль» додають піпеткою 500 мкл стандартної суміші (512 пмоль/мл) і ретельно перемішують. Переносять 500 мкл із пробірки «12,8 пмоль» у пробірку «6,4 пмоль» і ретельно перемішують. Повторюють процедуру розведення вдвічі з іншими пробірками. 6) Порції по 50 мкл у двох екземплярах з кожного послідовного розведення і стандарт вихідного розчину дозволяють одержати 8 стандартних рівнів цАМФ у діапазоні від 0,2 до 25,6 пмоль. Буфер розведення сполуки Додають 50 мкл 1 мМ ІВМХ у 100 мл PBS, щоб одержати кінцеву концентрацію 100 мкМ, і обробляють ультразвуком при 30°С протягом 20 хвилин. Підготовка PGD2 Розчиняють 1 мг PGD2 (FW, 352,5) у 284 мкл ДМСО, щоб одержати вихідний розчин 10 мМ, і зберігають його при 20°С. Перед кожним аналізом необхідно готувати свіжий розчин. Додають 3 мкл 10 мм вихідного розчину в 20 мл ДМСО, ретельно перемішують і переносять 10 мл у 40 мл PBS. Розведення сполуки Розведення сполуки проводять у Віоmех 2000 (Beckman) за допомогою методу 11 точок 1_цАМФ DP. 5 мкл кожної сполуки з 10 мМ планшетів стандартних розчинів сполук переносять у ямки 96ямкового планшета, як зазначено нижче. 45 А В С D E F G H 1 1 2 3 4 5 6 95950 2 3 4 5 6 7 8 9 10 11 12 Контрольний Наповнюють планшет 45 мкл ДМСО, крім колонки 7, куди додають 28 мкл ДМСО. Ретельно відміряють піпеткою вміст колонки 1 i переносять 12 мкл паралельно в колонку 7. Виконують послідовне розведення 1:10 від колонки 1 до колонки 6 і від колонки 7 до колонки 11, переносячи від 5 мкл до 45 мкл ДМСО, щоб одержати наступні концентрації: Перший планшет Колонка 12 Колонка 11 Колонка 10 Колонка 9 Колонка 8 Колонка 7 Колонка 6 Колонка 5 Колонка 4 Колонка 3 Колонка 2 Колонка 1 Кінцева концентрація 0 0,03 мкМ 0,3 мкМ 3 мкМ 0,03 мМ 0,3 мМ 0,01 мкМ 0,1 мкМ 1 мкМ 0,01 мМ 0,1 мМ 1 мм Додають у новий 96-ямковий планшет 247,5 мкл буфера розведення сполуки. Переносять 2,5 мкл послідовно розведених сполук із приготовленого вище планшета в новий (розведення 1:100) у такий спосіб: Перший планшет Колонка 12 Колонка 6 Колонка 11 Колонка 5 Колонка 10 Колонка 4 Колонка 9 Колонка 3 Колонка 8 Колонка 2 Колонка 7 Колонка 1 Другий планшет Колонка 1 Колонка 2 Колонка 3 Колонка 4 Колонка 5 Колонка 6 Колонка 7 Колонка 8 Колонка 9 Колонка 10 Колонка 11 Колонка 12 Кінцева концентрація 0 0,1 нМ 0,3 нМ 1 нМ 3 нМ 0,01 мкМ 0,03 мкМ 0,1 мкМ 0,3 мкМ 1 мкМ 3 мкМ 10 мкМ Ріст клітин 1. LS174 Τ завжди вирощують у MEM (ATCC кат. № 30-2003), 10 % FBS (АТСС кат. № 30-2020) і додаткових 2 мМ L-глутаміну, при 37°C і 5% СО2. 2. Нагрівають 0,05 % трипсину і версину (Invitrogen кат. № 25300-054) при 37°C на водяній бані. 46 3. Видаляють середовище для росту з клітин. Клітини в колбі Τ165 двічі промивають 4 мл трипсину, а потім інкубують при 37°C і 5% СО2 протягом 3 хвилин. 4. Додають 10 мл середовища і піпеткою ретельно відділяють і перераховують клітини. 5 5. Доводять щільність клітин до 2,25×10 клітин на мл і висівають 200 мкл клітин на ямку (45000 клітин на ямку) у 96-ямковому планшеті за 1 день до аналізу. Порядок проведення аналізу День 1 Висівають 45000 клітин на ямку в 200 мкл середовища в 96-ямкових планшетах. Інкубують планшети з клітинами при 37°C, 5% СО2 і 95 % вологості протягом ночі. День 2 1. Виконують розведення сполук. 2. Готують аналітичний буфер, лізуючі буфери 1 і 2, PGD2 і стандарт. 3. Видаляють середовище з клітин відсмоктуванням і додають 100 мкл розчину сполуки, слідуючи протоколу цАМФ DP Zymark Sciclone-ALH/FD. 4. Інкубують клітини при 37°C, 5% СО2 і 95% вологості протягом 15 хвилин. 5. Додають 5 мкл 300 нМ PGD2 (20×15 нМ кінцевої концентрації) у кожну ямку за допомогою протоколу Zymark цАМФ DP PGD2 і інкубують клітини при 37°C, 5% СО2 і 95% вологості ще 15 хвилин. 6. Видаляють середовище з клітин відсмоктуванням і додають 50 мкл лізуючого буфера 1 за допомогою протоколу Zymark цАМФ DP лізису і інкубують при кімнатній температурі зі струшуванням протягом 30 хвилин. 7. Додають в усі ямки 150 мкл імунореагенту (повний об'єм 200 мкл на ямку). 8. Герметизують планшет, струшують протягом 2 хвилин і вміщують у камеру сцинтиляційного лічильника для мікротитрувальних планшетів Wallac на 16 годин. День 3 125 Проводять рахунок кількості [ l] цАМФ протягом 2 хвилин у сцинтиляційному лічильнику 1450 Trilux. Обробка даних Відкладають стандартну залежність цАМФ від кількості імпульсів на хвилину. Таблиця 1 Типові дані аналізу для стандарту цАМФ (пмоль/мл) 0,2 0,4 0,8 1,6 3,2 6,4 12,8 25,6 Імп/хв 5725 5367 4695 4251 3434 2758 2094 1531 5769 5259 4796 4178 3429 2716 2054 1573 Порівн. імп/хв 5530 6317 6507 6581 6601 6711 6680 6653 47 95950 Концентрації цАМФ (пмоль/мл) невідомих зразків обчислюються по стандартній залежності % інгібуванн я 48 цАМФ від кількості імпульсів на хвилину. Відсоток інгібування обчислюється по наступній формулі: (пмоль в контрольно зразку пмоль в зразку ) 100 му пмоль в контрольно зразку ( тількиклітин PGD2) му Здійснення даного винаходу можуть приймати інші конкретні форми, що не будуть торкатися суті винаходу або його основних положень. Комп’ютерна верстка Т. Чепелева Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською2,6-substituted-4-monosubstituted amino-pyrimidineasprostaglandin d2 receptor antagonists
Автори англійськоюStefany David, Harris Keith John, Gillespy Timothy Alan, Gardner Charles J., Aguiar Joacy C.
Назва патенту російською2,6-замещенные-4-монозамещенные аминопиримидины как антагонисты рецепторов простагландина d2
Автори російськоюСтефани Девид, Харрис Кит Джон, Гиллеспи Тимоти Алан, Гарднер Чарльз Дж., Агиар Жуаси К.
МПК / Мітки
МПК: C07D 409/04, A61P 11/00, C07D 403/04, A61K 31/505, C07D 239/46
Мітки: простагландину, амінопіримідини, антагоністи, 2,6-заміщені-4-монозаміщені, рецепторів
Код посилання
<a href="https://ua.patents.su/24-95950-26-zamishheni-4-monozamishheni-aminopirimidini-yak-antagonisti-receptoriv-prostaglandinu-d2.html" target="_blank" rel="follow" title="База патентів України">2,6-заміщені-4-монозаміщені амінопіримідини як антагоністи рецепторів простагландину d2</a>
Попередній патент: Бензоімідазол-2-ілпіримідини і піразини як модулятори рецептора гістаміну h4
Наступний патент: Рекомбінантний атенуйований організм clostridium perfringens
Випадковий патент: Комбінована деформуючо-різальна протяжка












