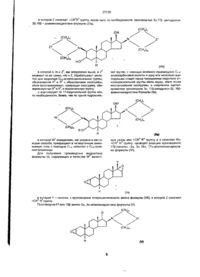
Похідні андростану, заміщені по 16-му положенню четвертинною амонієвою групою, для використання як нервово-м’язових блокаторів та фармацевтична композиція, що здатна викликати нервово-м’язову блокаду
Номер патенту: 27230
Опубліковано: 15.08.2000
Автори: Візі Е.Сільвестер, Тьюба Золтан, Махо Шандор, Фьолдіс Ф.Ференц
Текст
1. Производные андростана общей формулы (I): оя* (сн. (СН .X (I) замещенные по 16-му положению четвертичной аммониевой группой, где R1 означает атом водорода или Сі-4-алканоильную группу; R означает Сі-л-алканоильную группу; W1 и W 2 означают одинаковые или различные >CR 3 R 4 группы, или один из символов означает химическую связь, а другой - >CR3R4 группу, или W 1 означает >CR3R4 группу, a W2 означает >NER5 группу; один из R и R означает атом водорода, а другой -ORVpynny. или R3 и Rd вместе означают оксогруппу или С2-5-алкилендиоксильную группу; R означает d^-алкильную или Сз5- алкенильную группу; Е означает Сц-алкильную или С3-5-алкенильную группу, при условии, что в производных, содержащих циклическую структуру с двумя атомами азота, только тот заместитель Е означает данную группу, кото рый соединен химической связью с атомом азота, непосредственно не связанным со стероидным скелетом молекулы, в то время, как другой заместитель Е означает свободную пару электронов; Х~- анион, n=m=2 для использования в качестве нервно-мышечных блокаторов. 2. Производные по п 1, выбранные из группы соединений: 1- [17(3 -ацетокси-2р-(1,4-диокса -8 - азаспиро [4,5] - дец - 8 - ил) - За-гидрокси-5а-андростан-1бр-ил]1 -(2-пропенил)-пирролидиния бромид; 1-[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-азаспиро [4,5] дец-8-ил)-5а-андростан-16р-ил]-1 -метилпирролидиния бромид; 1-[Зос, 17^-бис (ацетокси)-2р-(1,4-диокса-8-азаспиро [4,5] дец-8-ил)-5а-андростан-16р-ил]-1-(2 пропенил) пирролидиния бромид; 1-[17р - ацетокси - За - гидрокси - 2р - (4-гидрокси1-пилеридинил)-5а-андростан-16р-ил]-1-метиллирролидиния бромид, О о со см см 27230 1-[17p - ацетокси - За - гидрокси -2р- (4-гидрокси1-пиперидинил)-5а-андростан-1бр-ил]-1-(2-пропенип) пирролидиния бромид, 1-[За, 17р-бис (ацетокси) - 2р - (4- гидрокси -1 - пиперидинил) -5а-андростан~1бр-ил]-1-(2 пропенил) пирролидиния бромид, 1 -[За, 17р-бис (ацетокси)-2р-(4-ацетокси-1 -пиперидинил)-5а-андростан-1бр-ил]-1 -метил пирролидиния бромид, 1-[17р- ацетокси - За - гидрокси -2{3- (4-гидроксипиперидинил)-5а-андростан-16р-ил]-1 -метилпиперидинил бромид, 1-[За, 17р - бис(ацетокси) - 2(3 - (4 - гидрокси - пиперидинил) -5а-андростан-16р-ил]-1-метилпиперидиния бромид; 4-[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-азаспиро [4,5] дец-8-ил)-5а-андростан-1бр-ил]-1,1диметилпиперазиния бромид; 4-[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-азаспиро [4,5] дец-8-ил)-5а-андростан-16р-ил]-1,1 -диметилпиперазиния бромид; 4-[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-азаспиро [4,5] дец-8-ил)-5а-андростан-16р-ил]-1-метил-1(2-пропенил) пиперазиния бромид, 4-[17р- ацетокси -За- гидрокси -2р- (4-гидрокси-!пиперидинил) -5а-андростан-16р ил]-1,1 -диметилпиперазиния бромид; 4-[17р-ацетокси-За-гидрокси -2р- (4- гидрокси - 1 пиперидинил) -5а-андростан-16р-ил]-1-метил-1-(2пропенил) пиперазиния бромид, 4-[За, 17р-бис(ацетокси) -2р-(4-оксо-1-пиперидинил) -5а- андростан-1бр-ил]- 1,1 -диметилпиперазиния бромид, 4-[За, 17р-бис(ацетокси) -2р- (4-оксо-1-пиперидинил) -5а-андростан-1бр-ил]-1-метил-1-(2-пропенил) пиперазиния бромид, 4-[Зсс, 17р - бис(ацетокси) - 2р - (4 - гидрокси - 1 - пи перидинил) -5а-андростан-16р-ил]-1,1 -диметилпиперазииия бромид, 4-[За, 17р - бис(ацетокси) - 2р - (4 - гидрокси - 1 пиперидинил) -ба-андростан-ібр-ил]^ 1 метил-1 (2-пропенил) пиперазиния бромид, 4-[3d, 17р - бис(ацетокси) - 2р - (4-ацетокси - 1 - пиперидинил) -5а-андростан-1бр-ил]-1,1 -диметилпиперазиния бромид, 4-[За, 17р(5 - бис(ацетокси) - 2р - (4 - ацетокси - 1 пиперидинил) -5а-андростан-16р-ил]-1 -метил-1 (2-пропенил) пиперазиния бромид; 8-[За, 17р-бис(ацетокси) -2р- (1-пиперидинил) -5аандростан -1 бр-ил]-8-метил-1,4-диокса-8-азониаспиро [4,5] декана бромид, 8-[За, 17р - бис(ацетокси) - 2р - (4-ацетокси - 1 пиперидинил) -5а-андростан-16р-ил]-8-метил-1,4диокса-8-азониаспиро [4,5] декана бромид, 4-ацетокси-1 -[За, 17р-бис(ацетокси)-2р-(4-ацетокси-1 -пиперидинил)-5а-андростан-16р-ил]-1 -метилпиперодиния бромид. 3 Фармацевтическая композиция, способная вызывать нервно-мышечную блокаду, содержащая активный ингредиент в смеси с обычно используемыми в фармацевтической промышленности добавками для наполнения и разбавления, отличающаяся тем, что в качестве активного ингредиента она содержит одно или несколько производных андростана формулы (I), замещенных по 16-му положению четвертичной аммониевой группой, взятых в терапевтически активном количестве, а в качестве обычно используемых ингредиентов композиция дополнительно содержит добавки для стабилизации, регулирования рН и осмотического давления и/или облегчения приготовления лекарственной формы Изобретение относится к области химии, в частности к нормальным стероидам, а также к области медицины, в частности к лекарственным препаратам, содержащим активные ингредиенты, и может быть использовано для релаксации во время эндотрахеальной анестезии, для поддержания миорелаксии при хирургических операциях или для профилактики больных, требующих миорелаксации, а также при проведении электрошоковой терапии и для лечения спастических заболеваний поперечно-полосатых мышц Известны синтезы производных 2р, 16 р-бис (амино)-З а, 17 р -диацетокси-5 а-андростана и их четвертичных солей Эти соединения содержат пиперидине-, морфолино- и алкиламиногруппы по 2-му и 16-му положению стероидного скелета Четвертичные центры в молекулах данных соединений могут быть образованы только по атомам азота, связанным с углеродными атомами С-2 и С-16 [1,2] Известны обобщения данных способов синтеза и результаты биологических исследований [3] Полученное соединение бромид панкурония (химическое название 1,1'-[За, 17 р-бис (ацеток си)-5 а- андростан-2 р, 16 р-диил] бис [1-метил-пиперидиния] дибромид), характеризующееся продолжительным периодом влияния и недополяризующим механизмом действия, используют в терапии в качестве нервно-мышечных блокаторов Поскольку бромид векурония (химическое название 1-[3 а, 17 р-бис (ацетокси)-2 р-(1-пиперидинил) андростан-1бр-ил] -1-метилпиперидиния дибромид гидрохлорид) - производное, близкое по структуре к бромиду панкурония, за исключением того, что его молекула содержит только одну четвертичную группу по атому азота, связанному с углеродным атомом С-16, он обладает более коротким периодом действия и не проявляет побочного влияния на сердечно-сосудистую систему, вследствие чего это соединение имеет больше преимуществ, чем панкуроний и другие бисчетвертичные производные Известно и приготовление панкурония [4,5] Кроме того, известны результаты исследований в области нервно-мышечных блокаторов [6] Из исследованных соединений бромид пипекурония (химическое название 4,4-[3 а, 17 р-бис (ацетокси) -5 а- андростан-2 р-диил] бис [1,1'-диметил 27230 липеразиния] дибромид по своей эффективности и стабилизирующему воздействию на сердечнососудистую систему превосходит бромид панкурония и бромид векурокия. Известны также синтезы четвертичных производных бис (амино) андростанов [7, 8, 9, 10, 11]. Однако эти соединения до сих пор не нашли применения в клинике Известны способы синтеза четвертичных производных, так называемых аза-аминостероидов, имеющих различную химическую структуру [12] Несмотря на то, что эти соединения характеризуются быстрым началом и короткой продолжительностью действия, они проявляют ряд побочных эффектов на сердечно-сосудистую систему и по этой причине не используются в клинике. Наиболее близким к изобретению являются недеполяризующие миорелаксанты, представляющие бисчетвертичные аммониевые соединения, в частности (d-турокуразин, диплацин, туркуроний, квалидил, ардуан, атракуртум, векуроний бромид, мелликтин [13] Данные соединения блокируют н-холинореактивные системы скелетной мускулатуры, а также вегетативных нервных узлов и применяются в хирургии, в том числе офтальмохирургии, в качестве миорелаксантов для облегчения эндотрахеальной интубации. Однако, хотя часть из них обладает относительно быстрым, легко обратимым мышечно-релаксирующим действием, они могут вызывать изменения в сердечно-сосудистой системе, например, тахикардию или замедление сердечных сокращений, понижать или повышать артериальное давление В основу изобретения поставлена задача получения соединений для использования их а качестве нервно-мышечных блокаторов, проявляющих стабилизирующее действие на сердечно-сосудистую систему и одновременно обладающих быстрым началом и короткой продолжительностью действия Поставленная задача достигается получением производных андростана общей формулы (I): X Ш замещенных [по 16-му положению четвертичной аммониевой группой, где R1 означает атом водорода или Cw-алканоильную группу; R2 означает Сі-4-алханоильную группу; W 1 и W2 означают одинаковые или различные >CR3R'J группы, или один из символов означает химическую связь, а другой ->CR3R4 группу, или W1 означает >CR3R4 группу, a W 2 - >NER^ группу; один из R3 и R4 означает атом водорода, а другой - -OR' группу, или R3 и R4 вместе означают оксогруплу или С2-5-алкилендиоксильную группу; R5 означает Сі-4-алкильную или Сз-5-алкенильную группу, Е означает Сі-4-алкильную или Сз-5-алкенильную группу, при условии, что в производных, содержащих циклическую структуру с двумя атомами азота, только тот заместитель Е означает данную группу, который соединен химической связью с атомом азота, непосредственно не связанным со стероидным скелетом молекулы, в то время как другой заместитель Е означает свободную пару электронов, X" - анион, n = m = 2 Производные андростана выбраны из группы соединений 1-[17 р-ацетокси-2р-(1,4-диокса-8 - азаспиро [4,5] — дец - 8 - ил) - За -гидрокси - 5а - андростан — 16р - ил] - 1 - (2-пропенил) - пирролидиния бромид, 1 -[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-аза спиро [4,5] дец-8-ил)-5 а-андростан-1бр-ил]-1-метилпирролидиния бромид, 1-[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-азаспиро [4,5] дец-8-ил)-5а-андростан-16р-ил]-1 - (2 пропенил) пирролидиния бромид; 1-[17р-ацетокси- За- гидрокси-2р- (4-гидрокси1-пиперидинил) - 5а-андростан-1бр-ил]-1 -метилпирролидиния бромид, 1-[17{3-ацетокси- За- гидрокси-2р- (4-гидрокси1-пиперидинил) - 5а-андростан-1бр-ил]-1 -(2-пропенил) пирролидиния бромид, 1-[За, 17р-бис (ацетокси) - 2(3 - (4-гидрокси- 1 - пиперидинил) -5а-андростан-1бр-ил]-1-(2 пропенил) пирролидиния бромид; 1 -[За, 17р-бис (ацетокси) -2(3- (4 - ацетокси - 1 пиперидинил )-5а-андростан-16р-ил1-1-метилпирролидиния бромид, 1-[17р- ацетокси - За- гидрокси -2р-(4-гидрокси-пиперидинил) - 5а-андростан-1бр-ил]-1-метилпиперидинил бромид, 1-[3а. 173-бис (ацетокси)- 2р -(4-гидрокси - пиперидинил) -ба-андростан-ібр-илі-і-метилпиперидиния бромид, 4-[За, 173-бис (ацетокси)-2р-(1,4-диокса-8-азаспиро [4,5] дец-8-ил)-5а-андростан-1бР-ил]-1,1диметилпиперазиния бромид, 4-[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-азаспиро [4,5] дец-8-ил}-5а-андростан-16р-ил]-1,1-диметилпилеразиния бромид; 4-[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-аза 27230 спиро [4,51 дец-8-ил)-5а-андростан-1бр-ил]-1 -метил-1 -(2-пропенил) пиперазиния бромид; 4-[17р-ацетокси -За- гидрокси -2р- (4-гидрокси -1-пиперидинил) -5а-андростан-16р-ил]-1,1-диметилпиперазиния бромид; 4-[17р-ацетокси-За- гидрокси -2р- (4-гидрокси 1- пиперидинил) -5а-андростан-1бр-ил]-1-метил-1(2-пропенил) пиперазиния бромид; 4-[За, 17р-бис(ацетокси)-2р- (4-оксо- 1-пиперидинил) -5а- андростан-16р-ил]-1,1-диметилпиперазиния бромид; 4-[За, 17р-бис(ацетакси) -2р- (4-оксо-1-пиперидинил) -5а-андростан-1бр-ил]-1 -метил-1 -(2 -пропенил) пиперазиния бромид; 4-[За, 17В-бис(ацетокси) - 2р - (4 - гидрокси - 1 - пиперидинил) -5а-андростан-16р-ил]-1,1-диметилпиперазиния бромид; 4-[За, 17р-бис(ацетокси) -2р- (4 - гидрокси - 1 пиперидинил) -5а-андростан-16р-ил]-1 -метил-1 (2-пропенил) пиперазиния бромид; 4-[За, 17р-бис(ацетокси) - 2р - (4 - ацетокси — 1 - пиперидинил) -5а андростан-16р-ил]-1,1-диметиллиперазиния бромид; 4-[Зсс, 17р-бис(ацетокси) - 2р - (4 - ацетокси — 1 - пиперидинил) -5а-андростан-16р-ил]-1 -метил-1 -(2-пропенил) пиперазиния бромид; 8-[За, 17р-бис(ацетокси)-2р-( 1 -пиперидинил) 5а-андростан-16р-ил]-8-метил-1,4-диокса-8-азониаспиро [4,5] декана бромид; 8-[За,17р-бис(ацетокси) - 2р - (4 - ацетокси - 1 пиперидинил) -5а-андростан-1бр-ил] - 8 - метил 1,4 - диокса - 8 - азониаспиро [4,5] декана бромид; 4-ацетокси-1-[За, 17р-бис(ацетокси)-2р-(4-ацетокси-1-пиперидинил)-5а-андростан-1бр-ил]-1-метилпиперодиния бромид. Указанная задача решается также тем, что фармацевтическая композиция, способная вызвать нервно-мышечную блокаду, содержащая активный ингредиент в смеси с обычно используемыми в фармацевтической промышленности добавками для наполнения и разбавления, согласно изобретению, в качестве активного ингредиента содержит одно или несколько производных андростана формулы ([), замещенных по 16-му положению четвертичной аммониевой группой, взятых в терапевтически активном количестве, а в качестве обычно используемых ингредиентов композиция дополнительно содержит добавки для стабилизации, регулирования рН и осмотического давления и/или облегчения приготовления лекарственной формы. Полученные производные андростана формулы (I), замещенные по 16-му положению четвертичной аммониевой группой, основным структурным отличием которых, приводящим к более благоприятной возможности использования их и фармацевтической композиции на их основе в качестве нервно-мышечных блокаторов, является то, что, по меньшей мере, один из заместителей у аминного атома азота содержит гидроксильную Сі-4-алканоилоксильную или Сз-5-алкилендиоксильную группу или оксогруппу, позволяют оказывать стабилизирующее действие на сердечно-сосудистую систему при одновременном обладании быстрым началом и короткой продолжительностью действия. Для получения производных андростана формулы (I), содержащих в качестве W 1 >CR 3 R 4 группу, а в качестве W "валентную связь или >NER5 группу, производят реакцию производного 17р-гидрокси-16-амино-2а, За-эпоксиандростана формулы (IV а), ОН Н (IVa) в которой Z1, означает валентную связь или >NR5 группу, с гетероциклическим амином формулы (VII), 27230 в которой Z означает >CR3R4 группу, после чего, по необходимости, производные Зсс,17р -дигидрокси2р,16р - диаминоандростана формулы (Ша), (СН2)П (Ша) 1 2 в которой n, m и 2 , как определено выше, и Z означает то же самое, что и Z, обрабатывают кислотой для гидролиза Сг 5-алкилендиоксильной группы, обозначенной R3 и R4 с образованием оксогруппы. и/или восстанавливают, превращая оксогруппу, обозначенную как R3 и R4, в гидроксилькую группу, и ацетилируют по 17-гидроксильной группе или, по необходимости, более, чем по одной гидроксиль НОЙ Группе, С ПОМОЩЬЮ аКТИВНОГО ПРОИЗВОДНОГО С-1-4 алканкарбоновой кислоты в одну или несколько ацилирующих стадий перед проведением гидролиза алкилендиоксильной группы и/или перед, и/или после восстановления оксогруппы, а полученное ацетилированное производное За, 17р-дигидрокси-2р, 16рдиаминоандростана Формулы (Па), (СН 2 ) П (СН2)П R'O Н в которой W 1 определено, как указано в настоящем способе, превращают в четвертичную аммониевую соль с помощью Сі_4 -алкилил и Сз-5-алкенилгалогенида Для получения производных андростана формулы (I), содержащих в качестве W 1 валент и ную связь или >CR 3 R4 группу и в качестве W2>CR 3 R4 группу, проводят реакцию производного 17р-гапоген -2а, За 16а, 17а-диэпоксиандростана формулы (VI), (VI) в которой Y - галоген, с производным гетероциклического амина формулы (VII), в которой Z означает >CR3 R4 группу Производное17-охо-16р-амино-2а, За-эпоксиандростана формулы (V), (СН 2 ) П н (V) 27230 в которой Z означает то же самое, что и Z, восстанавливают борогидридом щелочного металла; проводят реакцию полученного производного 17£-гидрокси-1б(}-амино-2а, За-эпоксиандростана формулы (1V6) ОН (СН 2 ) П 2/ш н (IV6) с производным гетероциклического амина формулы (VII), в которой Z означает валентную связь или >CR3 R4 группу. При необходимости, полученное производное За, 17р -дигидрокси-2р, 16(3-диаминоандростана формулы (III6) (CH: (СН 2 ) П (ПІ6) 2 в которой Z означает то же самое, что и Z в последнем случае, обрабатывают кислотой для гидролиза Сг-з-алкилендиоксильной группы, обозначенной R3 и R , и образования оксогруппы. и/или восстанавливают с превращением оксогруппы, обозначенной R3 и R4, в гидроксильную группу. и ацетилируют по гидроксильной группе в 17-м положении или, при необходимости, по одной или нескольким гидроксильным группам с помощью активного производного Ci-4-алканкарбоновой кислоты в одну или несколько ацилирующих стадий перед проведением гидролиза алкилендиоксильной группы, и/или перед, и/или после восстановления оксогруппы. В конечном итоге, полученное ацетилированное производное За,17р-дигидрокси-2р, 1бр-диаминоандростана формулы (Пб). (СН 2 ) П (СН 2 ) П (СН2) (Мб) 1 2 в которой W и W определены, как указано в данном способе, превращают в четвертичное аммониевое соединение с помощью Сі^-алкилгалогенида или Сз-5-алкенилгалогенида, а затем, при необходимости, полученное производное андростана формулы (I), замещенное по 16-му положению четвертичной аммониевой группой, превращают в соль кислого присоединения, обрабатывая его нетоксичной неорганической или органической кислотой. Соединения формул (II б) и (III б), являются симметричными или асимметричными диаминами в зависимости оттого, одинаковые ли аминные заместители связаны со стероидным скелетом по 2му и 16-му положениям. Согласно одному способу предпочтительно проводят реакцию соединений формулы (IV а) с 1,4-диокса-8-азаспиро [4,5] деканом или 4-гидроксипиперидином в присутствии воды или в смеси с инертным органическим растворителем, например, в смеси Н-пропанол и вода, при температуре кипения реакционной смеси. За протеканием реакции наблюдают с помощью тонкослойной хроматографии (ТСХ). По завершению реакции, для протекания которой требуется 70-100 часов, избыток используемого амина вместе с растворителем отгоняют осадок выпавший при добавлении воды, отфильтровывают, промывают водой для удаления маточного раствора и затем высушивают. 27230 В соответствии с другим вариантом очистки осадок перемешивают, например, с ацетонитрилом или ацетоном, и после осаждения маточного раствора высушивают и затем, при необходимости, перекристаллизовывают. Одну или несколько гидраксильных групп полученных производных За, 17Д -гидрохси-2р. 16)3диаминоандростана формулы (III а) предпочтительнее этерифируют следующим образом. После растворения соединений формулы (III а) в галогенированном углеводороде, предпочтительнее в метиленхлориде, и добавления основания - третичного амина, предпочтительнее триэтиламина, раствор охлаждают до 0-5°С и, в зависимости от количества ацетилируемых гидроксильных групп, больший или меньший избыток в сравнении с эквивалентным количеством ангидрида алканкарбоновой кислоты или хлорангидрида алканкарбоновой кислоты, предпочтительнее ацетилхлорида, по порциям добавляют к раствору таким образом, чтобы температура не превышала 10вС. Затем увеличивают температуру реакционной смеси до комнатной температуры и поддерживают ее на данном уровне до окончания реакции. Когда ацетилируют не все гидроксильные группы молекулы, за протеканием реакции предпочтительнее наблюдать с помощью ТСХ, чтобы предупредить протекание нежелательного ацетилирования. Затем избыток ацетилирующего агента разлагают добавлением воды, раствор промывают водой, а потом разбавленным водным раствором гидроксида натрия до нейтральной реакции. После отгона растворителя полученный продукт очищают с помощью хромотогрэфии или перекристаллизации, или с помощью и того, и другого метода. Соединения формулы (II а) также могут быть приготовлены и другим способом. Соединение формулы (III а), содержащее в качестве Z >CR3 R4 группу, в которой R и R4 означают С2-5-алкилендиоксильную группу, гидролизуют при кипячении в диоксане в присутствии кислоты для получения соответствующего производного формулы (III а), содержащего в качестве Z2>C = O группу, затем, по завершению реакции, раствор подщелачивают, диоксан отгоняют, после тщательного перемешивания с водой остаток отфильтровывают и промывают водой для удаления маточного раствора, затем высушивают и перекристаллизовывают. После этого полученное соединение формулы (III а) ацетилируют по одной или нескольким гидроксильным группам описанным способом. При необходимости, соединение формулы (III а), содержащее в качестве Z >С = О группу, также может быть восстановлено перед или после ацетилирования, предпочтительнее с помощью комплексного гидрида металла, лучше - борогидрида щелочного металла, в спирту, преимущественно - в метаноле, или в растворителе эфирного типа, предпочтительнее тетрагидрофуране, или гало геноугле водо роде, например, метиленхлориде, или в смеси указанных растворителей, лучше в метаноле при температуре от -10°С до +10°С При необходимости, образованная при восстановлении гидроксильная группа также может быть проацетилирована описанным способом. Четвертичные производные соединений формулы (II а), полученные при ацилировании, приготавливают следующим образом. Соединение фор мулы (На) растворяют в инертном растворителе. например, ацетонитриле, метиленхлориде или растворителе эфирного типа, таком как диэтиловый эфир, или в кетонном растворителе, предпочтительнее - в ацетоне, и затем проводят реакцию с алкилгалогенидом а том же растворителе, например, с раствором метилбромида или аллилбромида в ацетоне. Реакционную смесь выдерживают до завершения реакции, затем осадок отфильтровывают, промывают для удаления маточного раствора, после чего очищают Если полученная четвертичная соль не кристаллизуется из раствора, ее осаждают, добавляя диэтиловый эфир. В соответствии с изобретением проводят реакцию производного 17-галоген-2а, За :16а. 17адиэпокси-5а-андростана формулы (VI) с амином формулы (VII), например, 1,4-диокса-8-азаспиро [4,5)-деканом или 4-гидроксипиперидином, лучше в инертном растворителе, предпочтительнее в ацетонитриле, при комнатной температуре По завершении реакции реакционную смесь упаривают, а остаток разбавляют водой Выпавший осадок отфильтровывают, промывают водой для удаления маточного раствора, высушивают и очищают с помощью перекристаллизации Полученный продукт формулы (V). содержащий а-аминокетонную группу в кольце D-стероидного скелета, восстанавливают до соединения, имеющего 17-оксогруппу. с помощью борогидрида щелочного металла, лучше борогидрида натрия, в инертном растворителе, например, тетрагидрофуране, метиленхлориде, метаноле или в смеси данных растворителей, предпочтительнее - в метаноле. После разложения комплексного гидрида металла и отгона растворителя, например, метанола, продукт получают в виде осадка. После того, как осадок отфильтруют и промоют водой для удаления маточного раствора, продукт высушивают и затем перекристаллизовывают. Полученные таким способом соединения формулы (IV) превращают в соединения формулы (I) через вещества формул (III б) и (111 б) посредством химических реакций, приведенных для соединений формулы (IV а). Соли четвертичных производных с нетоксичными минеральными или органическими кислотами получают предпочтительно, растворяя четвертичное соединение в этаноле, добавляя к этому раствору любую из вышеуказанных кислот и высаживая соль добавлением эфира. Биологическую эффективность производных андростана формулы (I). замещенных по 16-му положению четвертичной аммониевой группой, изучали следующим образом. Опыты in vitro проводили на препаратах грудобрюшный нерв (nervus phrenicus) - купол диафрагмы крыс с массой тела 300-350 г или морских сеинок с массой тела 400-450 г. Грудобрюшный нерв стимулировали супрамаксимальными электрическими импульсами длительностью 0,2 мс (при частоте 0,1 Гц), при этом непрерывно регистрировали изометрические сокращения мускула. Препараты суспендировали (хранили) в ваннах на 50 мл в физиологическом растворе Кребса (Krebs) Состав раствора. 113 ммоль/л хлорида натрия, 4,7 ммоль/л хлорида калия, 1,5 ммоль/л хлорида кальция. 27230 1,2 ммоль/л сульфата магния, 25 ммоль/л гидрокарбоната натрия и 11 5 ммоль/л глюкозы Раствор Кребса насыщали газовой смесью 95% 0 - 5% СО Кумулятивно увеличивали концентрации испытуемых соединений и определяли значения ED и ED (т е концентраций, которые уменьшают силу /величину/ сокращения мускула купола диафрагмы - на 50% и 90% соответственно) Поскольку в предыдущих опытах было установлено, что воздействие миорепаксантов у морских свинок аналогично воздействию, наблюдаемому в клинике у людей, было проведено сравнение влияния, оказываемого полученными соединениями с влиянием других недепо ляризующих миорелаксантов на эти виды животных Во время опытов m vivo морских свинок подвергали анестезии с помощью смеси пентобарбитала [5-этил-5-(1-метилбутил)-2,4,6(1Н,ЗН,5Н)-пиримидинтрион] и уретана (этилкарбамата), дыхание подопытных животных поддерживали с помощью ап парата искусственной вентиляции легких Отделя ли (препарировали) переднюю большеберцовую мышцу, стимулировали седалищный нерв с помощью электричества (супрамаксимальные импульсы продолжительностью 0,2 мс с частотой 0,1 Гц), сок ращение мышцы регистрировали Ингибирующее действие соединений на блуждающий нерв изучали на кошках, подвергнутых анестезии с помощью смеси хлоралозы (продукта конденсации хлоральгидрата и глюкозы) и уретана Блуждающий нерв стимулировали с помощью электрического тока (супрамаксимальиые импульсы продолжительностью 0,3 мс с частотой 20 Гц), влияние на частоту сердечных сокращений и артериальное давление регистрировали с помощью регистрирующего устройства Геллига (Hellige) Все соединения вводили в организм через яремную вену Результаты опытов обобщены и представлены в таблицах (Таблицы 1 -4). Таблица 1 Влияние на миорелаксикацию, измеренное in vitro на изолированных препаратах грудобрюшный нервкупол диафрагмы крыс и морских свинок соответственно (0,1 Гц, 0,2 мс, супрамзксимальный импульс) Значение +СОС (п=4) ED 90 (ммоль/л) у крыс ED 90(ммоль/л) у морских свинок тубокурарина хлорид (с) - тубокурарин) 1,02 ±0,01 1.33 ±0,09 панкурония бромид 6,36 ±0,03 0,29 ±0,01 векурония бромид 8,72 ±0,38 0,25 ±0,01 пипекурония бромид 1,50 ±0,04 0 08 ± 0,003 соединение {пример 8) 8,37 ±0,26 0,90 ± 0,03 соединение (пример 5} 3,65 ±0,19 0,43 ± 0,04 соединение(пример 16 3,53 ± 0,05 0,59 ±0,004 соединение (пример 41) 2,79 ± 0,05 0,24 ±0,002 Соединение Химическое название тубокурарина {d - тубакурарин) - 7',12"-дигидрокси-6,6'-диметокси-2,2',2'триметилтубокурарания хлорид гндрохлорид (•) СОС - стандартная ошибка среднего Данные Таблицы 1 показывают, что нервно-мышечный блокирующий эффект бромида 1-[3a, 17JJбис(зцетокси-2р-(1,4-диокса-8-азаспиро [4 5] дец-8 ил)-5а-андростан-16р-ил]-1 -(2-проленил) пирролидиния (Пример 8) как у крыс, так и у морских свинок имеет по величине тот же эффект, что и эффект других известных, уже используемых в клинике миорелаксантов Это соединение характеризуется быстрым началом и легкой обратимостью действия с помощью промывания Воздействие соединения также может быть ингибировано с помощью антагонистов - неостигмин метилсупьфата [3-диметилкарбамоксифенил) триметиламмония метилсульфат] или хлорида эдрофония (этил-(З-гидроксифенил)диметиламмония хлорид Таблица 2 Определенное in vivo влияние на переднюю большеберцовую мышцу (musculus tibilis antentor) морских свинок Значение +СОС (п=4) Соединение ED50 (мг/кг) ED90 (мг/кг) ED50 (мг/кг) ED90 (мг/кг) у морских у морских у крыс у крыс свинок свинок Время начала действия (мин ) Продолжительность действия (мин.) Возвращение к норме 25-75% (мин.) Панкурония бромид 84 ±3,8 120 ±6,3 10±1,1 15 ± 1.9 1,1 ±031 45,6 ± 5,68 14.8 ±2,45 Верукония бромид 253 ±17,1 538 ± 58,9 7± 1,9 11 ±2,0 1,3 ±0,51 26,6 ±4,61 9,0 ±2,35 54 ±1,3 74 ±2,2 4 ±0,7 6 ±0,7 1,5 ±0,08 60,6 ± 9,28 24,6 ± 3,71 Пипекурония бромид 27230 Соединение ED50 (мг/кг) ED90 {мг/кг) у крыс у крыс ED50 (мг/кг) ED90 (мг/кг) у морских у морских СВИНОК свинок Время начала действия (мин.) Продолжительность действия (мин.) Возвращение к норме 25-75% (мин.) Соединение пример 5 120 ±15,5 186 ±7,1 16 ±0,8 29 ±1,2 1,2 ±0,15 10,5 ± 1,1 3,1 ±0,6 Соединение пример 8 286 ± 33,3 446 ±59,1 34 ± 2,0 48 ± 2,7 0,9 ±0,18 10,1 ± 1,32 2,4 ±0,3 Соединение пример 31 657 ±171,0 845 ± 231 Соединение пример 41 176±31,7 282 ± 52,7 14 ±1,3 20 ±1,3 Соединение пример 46 **** 587 ±163,0 795 ± 200,0 216 ±40 330±115 (*) - время, необходимое для наступления 95%-ной блокады при введении в организм двойной EDao дозы у морских свинок (•*) - уменьшение до 75% блокирующею эффекта соединения, введенного в организм в размере двух EDgo доз, у морских свинок. (*•*) _ время, необходимое для уменьшения блокирующего эффекта от 75% до 25%, у морских свинок. **•* - соединение 1 - [За, 17р-бис (ацетилокси)-2р-(4-ацетилокси-1-пиперидинил)-5а-андростан-16(3-ил]-1-(2пропенил) бромид пирролидина приготовлено путем реакции 2р-(4-акситилокси-1пиперидинил)-16)3-1-пирролидинил)-5а-андростанЗа,17р-диолдиоцетата (Пример 18) с бромидом аллила, как описано в Примере 5. Точка плавления 180-185"С. Данные Таблицы 2 показывают, что во время опытов in vivo на морских свинках начало действия соединения (Пример 8) было более быстрым, а продолжительность действия более короткой, чем соответствующие характеристики других известных веществ, имеющих подобную химическую структуру. Таким образом, например, после введения в организм подопытного двойной ED#> дозы нервно-мышечная блокада снижалась с 75% до 25% в течение 10,1 минуты. Для сравнения соответствующая характеристика для бромида панкурония и бромида. Таблица 3 Изучение антивагусного эффекта на подвергнутых анестезии кошках. Значение +СОС (п-4) Уменьшение частоты сердечных сокращений (%) Уменьшение артериального давления (мм рт. ст.) контроль 14 ±1,8 40,0 ±8,1 соединение (пример 8) 15 ±2,9 32,0 ± 6,6 Таблица 4 Сравнение воздействия двукратных ED90 доз на организм собак породы коротконогая гончая (в круглых скобках - количество животных). Значение +СОС Соединение пример 5 Время(с) до 80%-ной блокады (8 Соединение пример 8 Верукония бромид Р 48,4 ±2,9 62,8 ±4,5 CR3R4 группу, или W 1 означает >CR3R4 группу, a W 2 - >NER группу; один из R3 и R4 означает атом водорода, а другой - -OR1 группу, или R3 и R4 вместе означают оксогруппу или Сг-5-алкилендиоксильную группу, R5 означает Сі^-алкильную или Сэ-5-алкенильную группу, Е означает Сц-алкильную или Сз-5-алкенильную группу, при условии, что в производных, содержащих циклическую структуру с двумя атомами азота, только тот заместитель Е означает данную группу, который соединен химической связью с атомом азота, непосредственно не связанным со стероидным скелетом молекулы, в то время как другой заместитель Е означает свободную пару электронов, X - анион, n = m = 2 Производные андростана выбраны из группы соединений 1 -[17 [і-ацетокси-2(І-(1,4-диокса-8 - азаспиро [4,5] - дец - 8 - ил) - За -гидрокси - 5а - андростан - 1бр - ил] - 1 - (2-пропенил) - пирролидиния бромид, 1-[За, 17р-бис (ацетокси)-2Р-(1,4-диокса-8-аза спиро [4,5] дец-8-ил)-5 а-андростан-16р-ил]-1-метилпирролидиния бромид, 1-[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-азаспиро [4,5] дец-8-ил)-5а-андростан-16р-ил]-1 - (2 пропенил) пирролидиния бромид, 1-[17р-ацетокси- За- гидрокси-2р- (4-гидрокси1-пиперидинил) - 5а-андростан-16р-ил]-1 -метилпирролидиния бромид, 1-[17р-ацетокси- За- гидрокси-2р- (4-гидрокси1-пиперидинил) - 5а-андростан-1бр-ил]-1 -(2-пропенил) пирролидиния бромид, 1-[За, 17р-бис (ацетокси) - 2р - (4-гидрокси- 1 - пиперидинил) - 5а-андростан-1бр-ил]-1-(2 пропенил) пирролидиния бромид, 1 -[За, 17р-бис (ацетокси) -2р- (4 - ацетокси - 1 пиперидинил)-5а-андростан-16р-ил]-1-метилпирролидиния бромид, 1-[17р- ацетокси - За- гидрокси -2р-(4-гидрокси-пиперидинил) - 5а-андростан-16р-ил]-1-метилпиперидинил бромид, 1-[За, 17р-бис (ацетокси)- 2р -(4-гидрокси - пиперидинил) -5а-андростан-1бр-ил]-1 -метилпиперидиния бромид 4-[За, 17р-бис (ацетокси)-2р-(1.4-диокса-8-азэспиро [4,5] дец-8-ил)-5а-андростан-1бр-ил]-1,1дим етил пиперазиния бромид, 4-[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-азаспиро [4,5] дец-8-ил)-5а-андростан-16р-ил]-1,1-диметилпиперазиния бромид, 4-[За, 17р-бис (ацетокси)-2р-(1,4-диокса-8-аза 27230 спиро [4,5] дец-8-ил)-5а-андростан-16р-ил]-1 -метихИ -(2-пропенил) пиперазиния бромид, 4-[17р-ацетокси -За- гидрокси -2р- (4-гидрокси -1-пиперидинил) -5а-андростан-16р-ил]-1,1-диметилпиперазиния бромид; 4-[17(3-ацетокси-За- гидрокси -2р- (4-гидрокси 1- пиперидинил) -5а-андростан-1бр-ил]-1-метил-1(2-пропенил) пиперазиния бромид; 4-[За, 17р-бис(ацетокси)-2р- (4-оксо-1-пиперидинил) -5а- андростан-1бр-ил]-1,1-диметилпиперазиния бромид; 4-[За, 17р-бис(ацетокси) -2fi- (4-оксо-1-пиперидинил) -5а-андростан-16р-ил]-1 -метил-1 -(2 -пропенил) пиперазиния бромид; 4-[За, 17р-бис(ацетокси) - 2Р - (4 - гидрокси - 1 - пиперидинил) -5а-андростан-16р-ил)-1,1-диметилпиперазиния бромид; 4-[За, 17р-бис(ацетокси) -2р- (4 - гидрокси - 1 пиперидинил) -5а-андростан-16р-ил]-1 -метил-1 (2-пропенил) пиперазиния бромид; 4-[За, 17р-бис(ацетокси) - 2р - (4 - ацетокси — 1 - пиперидинил) -5а андростан-1бр-ил]-1,1-диметилпиперазиния бромид; 4-[За, 17р-бис(ацетокси) - 2fS - (4 - ацетокси — 1 - пиперидинил) -5а-андростан-16р-ил]-1 -метил-1 -(2-пропенил) пиперазиния бромид; 8-[За, 17р-бис(ацетокси)-2р-( 1 -пиперидинил) 5а-андростан-1бр-ил]-8-метил-1,4-диокса-8-азониаспиро [4,5] декана бромид; 8-[За,17р-бис(ацетокси) - 2р - (4 - ацетокси - 1 пиперидинил) -5а-андростан-16р-ил] - 8 - метил 1,4 - диокса - 8 - азониаспиро [4,5] декана бромид, 4-ацетокси-1-[За, 17р-бис(ацетокси)-2р-(4-ацетокси-1 -пиперидинил)-5а-андростан-1 бр-ил]-1 -метилпиперодиния бромид. Указанная задача решается также тем, что фармацевтическая композиция, способная вызвать нервно-мышечную блокаду, содержащая активный ингредиент в смеси с обычно используемыми в фармацевтической промышленности добавками для наполнения и разбавления, согласно изобретению, в качестве активного ингредиента содержит одно или несколько производных андростана формулы (I), замещенных по 16-му положению четвертичной аммониевой группой, взятых в терапевтически активном количестве, а в качестве обычно используемых ингредиентов композиция дополнительно содержит добавки для стабилизации, регулирования рН и осмотического давления и/или облегчения приготовления лекарственной формы. Полученные производные андростана формулы (I), замещенные по 16-му положению четвертичной аммониевой группой, основным структурным отличием которых, приводящим к более благоприятной возможности использования их и фармацевтической композиции на их основе в качестве нервно-мышечных блокаторов, является то, что, по меньшей мере, один из заместителей у аминного атома азота содержит гидроксильную Сі-4-алканоилоксильную или Сз-5-алкилендиоксильную группу или оксогруплу, позволяют оказывать стабилизирующее действие на сердечно-сосудистую систему при одновременном обладании быстрым началом и короткой продолжительностью действия. Для получения производных андростана формулы (I), содержащих в качестве W 1 >CR 3 R 4 группу, а в качестве W валентную связь или >NER5 группу, производят реакцию производного 17Р-ГИдрокси-16-амино-2а, За-эпоксиандростана формулы (IV а), ОН н (IVa) в которой Z1, означает валентную связь или >NR5 группу, с гетероциклическим амином формулы (VII), 27230 в которой Z означает >CR R группу; после чего, по необходимости, производные 3(3,170 -дигидрокси2р,1бр - диаминоандростана формулы (Ша), (СН2)П (СН2)П (Ша) 1 2 в которой n, m и Z , как определено выше, и Z означает то же самое, что и Z, обрабатывают кислотой для гидролиза Сг-Б-алкилендиоксильной группы, обозначенной R3 и R4 с образованием оксогруппы, и/или восстанавливают, превращая оксогруппу, обозначенную как R3 и R4, в гидроксильную фуппу, и ацетилируют по 17-гидроксильной фуппе или, по необходимости, более, чем по одной гидроксиль ной группе, с помощью активного производного Смалканкарбоновой кислоты в одну или несколько ацилирующих стадий перед проведением гидролиза алкилендиоксильной группы и/или перед, и/или после восстановления оксогруппы, а полученное ацетилированное производное За, 17р-дигидрокси-2р, 16(3диаминоандростана Формулы (На), (СН2)П (Иа) 1 в которой W определено, как указано в настоящем способе, превращают в четвертичную аммониевую соль с помощью C-I-4 -алкилил и Сз-5-алкенилгалогенида Для получения производных андростана формулы (1), содержащих в качестве W 1 валент 3 4 ную связь или >CR R группу и в качестве \Л/г>CR 3 R4 группу, проводят реакцию производного 17р-галоген -2а, За:1ба, 17а-диэпоксиандростана формулы (VI), в которой Y — галоген, с производным гетероциклического амина формулы (VII), в которой Z означает >CR 3 R 4 группу Производное17-охо-16р-амино-2а, За-эпоксиандростана формулы (V). О Н (V) 27230 2 в которой Z означает то же самое, что и Z, восстанавливают борогидридом щелочного металла; проводят реакцию полученного производного 17(ї-гидрокси-16р-амино-2а, За-эпоксиандростана формулы (IV6). ОН (СН 2 ) П 2/т н (IV6) с производным гетероциклического амина формулы (VII), в которой Z означает валентную связь или 3 4 >CR R группу. При необходимости, полученное производное За, 17р -дигидрокси-2р, 16р-диаминоандростана формулы (III6) (СН 2 ) П (ІІІб) 2 в которой Z означает то же самое, что и Z в последнем случае, обрабатывают кислотой для гидролиза Сг-5-алкилендиоксильной группы, обозначенной R3 и R , и образования оксогруппы и/или восстанавливают с превращением оксогруппы, обозначенной R3 и R4, в гидроксильную группу и ацетилируют по гидроксильной группе в 17-м положении или, при необходимости, по одной или нескольким гидроксильным группам с помощью активного производного С1-4 -алканкарбоновой кислоты в одну или несколько ацилирующих стадий перед проведением гидролиза алкилендиоксильной группы, и/или перед, и/или после восстановления оксогруппы В конечном итоге, полученное ацетилированное производное За,17р-дигидрокси-2р, 16р-диаминоандростана формулы (Иб) (СН 2 ) П (СН 2 ) R1O 1 Н 2 в которой W и W определены, как указано в данном способе, превращают в четвертичное аммониевое соединение с помощью С-м-алкилгалогенида или Сэ-5-алкенилгалогенида, а затем, при необходимости, полученное производное андростана формулы (I), замещенное по 16-му положению четвертичной аммониевой группой, превращают в соль кислого присоединения, обрабатывая его нетоксичной неорганической или органической кислотой Соединения формул (II б) и (III б) являются симметричными или асимметричными диаминами в зависимости от того, одинаковые ли аминные заместители связаны со стероидным скелетом по 2му и 16-му положениям (Иб) Согласно одному способу предпочтительно проводят реакцию соединений формулы (IV а) с 1,4-диокса-8-азаспиро [4,5] деканом или 4-гидроксипиперидином в присутствии воды или в смеси с инертным органическим растворителем, например, в смеси Н-пропанол и вода, при температуре кипения реакционной смеси. За протеканием реакции наблюдают с помощью тонкослойной хроматографии (ТСХ) По завершению реакции, для протекания которой требуется 70-100 часов, избыток используемого амина вместе с растворителем отгоняют осадок выпавший при добавлении воды, отфильтровывают, промывают водой для удаления маточного раствора и затем высушивают. 27230 В соответствии с другим вариантом очистки осадок перемешивают, например, с ацетонитрилом или ацетоном, и после осаждения маточного раствора высушивают и затем, при необходимости, перекристаллизовывают. Одну или несколько гидроксильных групп полученных производных За, 173 -гидрокси-2р, 1брдиаминоандростана формулы (111 а) предпочтительнее этерифируют следующим образом После растворения соединений формулы (III а) в галогенированном углеводороде, предпочтительнее в метиленхлориде, и добавления основания - третичного амина, предпочтительнее триэтиламина. раствор охлаждают до 0-5°С и, в зависимости от количества ацетилируемых гидроксильных групп, больший или меньший избыток в сравнении с эквивалентным количеством ангидрида алканкарбо новой кислоты или хлорангидрида алканкарбоновой кислоты, предпочтительнее ацетилхлорида, по порциям добавляют к раствору таким образом, чтобы температура не превышала 10пС. Затем увеличивают температуру реакционной смеси до комнатной температуры и поддерживают ее на данном уровне до окончания реакции Когда ацетилируют не все гидроксильные группы молекулы, за протеканием реакции предпочтительнее наблюдать с помощью ТСХ, чтобы предупредить протекание нежелательного ацетилирования Затем избыток ацетилирующего агента разлагают добавлением воды, раствор промывают водой, а потом разбавленным водным раствором гидроксида натрия до нейтральной реакции. После отгона растворителя полученный продукт очищают с помощью хромотофафии или перекристаллизации, или с помощью и того, и другого метода. Соединения формулы (II а) также могут быть приготовлены и другим способом. Соединение формулы (III а), содержащее в качестве 2 >CR3 RA группу, в которой R и R4 означают С2-5.алкилендиоксильную группу, гидролизуют при кипячении в диоксане в присутствии кислоты для получения соответствующего производного формулы (Ш а), содержащего в качестве Z2>C = О группу, затем. по завершению реакции, раствор подщелачивают, диоксан отгоняют, после тщательного перемешивания с водой остаток отфильтровывают и промывают водой для удаления маточного раствора, затем высушивают и перекристаллизовывают. После этого полученное соединение формулы (III а) ацетилируют по одной или нескольким гидроксильным группам описанным способом. При необходимости, соединение формулы (III а), содержащее в качестве Z >С = О группу, также может быть восстановлено перед или после ацетилирования, предпочтительнее с помощью комплексного гидрида металла, лучше - борогидрида щелочного металла, в спирту, преимущественно - в метаноле, или в растворителе эфирного типа, предпочтительнее тетрагидрофуране, или галогеноуглеводороде. например, метиленхлориде, или в смеси указанных растворителей, лучше в метаноле при температуре от-10"С до +10°С При необходимости, образованная при восстановлении гидроксильная группа также может быть проацетилирована описанным способом Четвертичные производные соединений формулы (II а), полученные при ацилировании, приготавливают следующим образом. Соединение фор мулы (I) а) растворяют в инертном растворителе, например, ацетонитриле, метиленхлориде или растворителе эфирного типа, таком как диэтиловый эфир, или в кетонном растворителе, предпочтительнее - в ацетоне, и затем проводят реакцию с алкилгалогенидом в том же растворителе, например, с раствором метилбромида или аллилбромида в ацетоне. Реакционную смесь выдерживают до завершения реакции, затем осадок отфильтровывают, промывают для удаления маточного раствора, после чего очищают Если полученная четвертичная соль не кристаллизуется из раствора, ее осаждают, добавляя диэтиловый эфир. В соответствии с изобретением проводят реакцию производного 17-галоген-2а, За :16а. 17адиэпокси-5а-андростана формулы (VI) с амином формулы (VII), например, 1,4-диокса-8-азаспиро [4,5]-деканом или 4-гидроксипиперидином, лучше в инертном растворителе, предпочтительнее в ацетонитриле, при комнатной температуре. По завершении реакции реакционную смесь упаривают, а остаток разбавляют водой. Выпавший осадок отфильтровывают, промывают водой для удаления маточного раствора, высушивают и очищают с помощью перекристаллизации Полученный продукт формулы (V), содержащий а-аминокетонную группу в кольце О-стероидного скелета, восстанавливают до соединения, имеющего 17-оксогруппу, с помощью борогидрида щелочного металла, лучше борогидрида натрия, в инертном растворителе, например, тетрагидрофуране, метиленхлориде, метаноле или в смеси данных растворителей, предпочтительнее - в метаноле. После разложения комплексного гидрида металла и отгона растворителя, например, метанола, продукт получают в виде осадка. После того, как осадок отфильтруют и промоют водой для удаления маточного раствора, продукт высушивают и затем лерекристаллизовывают. Полученные таким способом соединения формулы (IV) превращают в соединения формулы (I) через вещества формул (Ш б) и (III б) посредством химических реакций, приведенных для соединений формулы (IV а). Соли четвертичных производных с нетоксичными минеральными или органическими кислотами получают предпочтительно, растворяя четвертичное соединение в этаноле, добавляя к этому раствору любую из вышеуказанных кислот и высаживая соль добавлением эфира. Биологическую эффективность производных андростана формулы (I), замещенных по 16-му положению четвертичной аммониевой группой, изучали следующим образом. Опыты in vitro проводили на препаратах грудобрюшный нерв (nervus phremcus) - купол диафрагмы крыс с массой тела 300-350 г или морских свинок с массой тела 400-450 г. Грудобрюшный нерв стимулировали супрамаксимальными электрическими импульсами длительностью 0.2 мс (при частоте 0.1 Гц), при этом непрерывно регистрировали изометрические сокращения мускула. Препараты суспендировали (хранили) в ваннах на 50 мл в физиологическом растворе Кребса (Krebs) Состав раствора: 113 ммоль/л хлорида натрия. 4,7 ммоль/л хлорида калия, 1,5 ммоль/л хлорида кальция, 27230 1,2 ммолЫл сульфата магния, 25 ммоль/л гидрокарбоната натрия и 11 5 ммоль/л глюкозы Раствор Кребса насыщали газовой смесью 95% 0 - 5% СО Кумулятивно увеличивали концентрации испытуемых соединений и определяли значения E D и ED E (т е концентраций, которые уменьшают силу /величину/ сокращения мускула-купола диафрагмы - на 50% и 90% соответственно) Поскольку в предыдущих опытах было установлено, что воздействие миорелаксантов у морских свинок аналогично воздействию, наблюдаемому в клинике у людей, было проведено сравнение влияния, оказываемого полученными соединениями, с влиянием других недепо ляризующих миорелаксантов на эти виды животных Во время опытов in vivo морских свинок подвергали анестезии с помощью смеси пентобарбитала [5-этил-5-(1-метилбутил)-2,4,6 (1 Н,ЗН,5Н)-пиримидиитрион] и уретана (зтилкарбамата), дыхание подопытных животных поддерживали с помощью ап парата искусственной вентиляции легких Отделяли (препарировали) переднюю большеберцовую мышцу, стимулировали седалищный нерв с помощью электричества {супрамаксимальные импульсы продолжительностью 0,2 мс с частотой 0,1 Гц), сокращение мышцы регистрировали Ингибирующее действие соединений на блуждающий нерв изучали на кошках, подвергнутых анестезии с помощью смеси хлоралозы (продукта конденсации хлоральгидрзта и глюкозы) и уретана Блуждающий нерв стимулировали с помощью электрического тока (супрамаксимальиые импульсы продолжительностью 0,3 мс с частотой 20 Гц), влияние на частоту сердечных сокращений и артериальное давление регистрировали с помощью регистрирующего устройства Геллига (Hellige) Все соединения вводили в организм через яремную вену Результаты опытов обобщены и представлены в таблицах (Таблицы 1-4) Таблица 1 Влияние на миорелаксикацию, измеренное m vitro на изолированных препаратах грудобрюшный нервкупол диафрагмы крыс и морских свинок соответственно (0,1 Гц, 0,2 мс, супрамаксимальный импульс) Значение +СОС (п=4) ED 90 (ммоль/л) у крыс ED 90(ммоль/л) у морских свинок тубокурарина хлорид (d - тубокурарин) 1,02 ±0,01 1,33 ± 0 09 пзнкурония бромид 6,36 ±0,03 0.29 ±0,01 векурония бромид 8,72 ± 0,38 0,25 ±0,01 пипекурония бромид 1,50 ± 0,04 0,08 ±0,003 соединение (пример 8) 8,37 ±0,26 0 90 ± 0,03 соединение (пример 5) 3,65 ±0,19 0,43 ± 0,04 соединение{пример 16 3,53 ± 0,05 0,59 ±0,004 соединение (пример 41) 2,79 ±0,05 0,24 ± 0,002 Соединение Химическое название тубокурарина (d - тубакурарин) - 7' 12'-дигидрокси-6 6'-диметокси-2,2',2'триметилтубокурарания хлорид гндрохлорид (*) СОС - стандартная ошибка среднего Данные Таблицы 1 показывают, что нервно-мышечный блокирующий эффект бромида 1-[За, 17Вбис(ацетокси-2р-(1,4-диокса-8-аззспиро [4 5] дец-8 ил)-5а-андростан-1бр-ил]-1-(2-пропенил) пирролидиния (Пример 8) как у крыс, так и у морских свинок имеет по величине тот же эффект, что и эффект других известных, уже используемых в клинике миорелаксантов Это соединение характеризуется быстрым началом и легкой обратимостью действия с помощью промывания Воздействие соединения также может быть ингибировано с помощью антагонистов - неостигмин метилсульфата [3-диметилкарбамоксифенил) триметиламмония метилсульфат] или хлорида эдрофония [этил-(З-гидроксифенил)диметиламмония хлорид Таблица 2 Определенное in vivo влияние на переднюю большеберцовую мышцу (musculus tibilis antentor) морских свинок Значение +СОС (п=4) ... ._ _ Соединение ED50 (мг/кг) у крыс — • — — ED50 (мг/кг) ED90 {мг/кг) ED90 (мг/кг) у морских у морских у крыс свинок СВИНОК Время начала действия (мин ) Продолжительность действия (мин) Возвращение к норме 25-75% (мин.) Панкурония бромид 84 ±3,8 120 ±6,3 10 ±1,1 15 ± 1.9 1,1 ±0,31 45,6 ± 5,68 14,8 ±2,45 Верукония бромид 253 ±17,1 538 ± 58,9 7 ±1,9 11 ±2,0 1,3 ±0,51 26,6 ±4,61 9,0 ± 2,35 54 ±1,3 74 ± 2,2 4 ±0,7 6 ±0,7 1,5 ± 0 08 60,6 ±9,28 24,6 ±3,71 Пипекурония бромид 27230 Соединение Соединение пример 5 Соединение пример 8 Соединение пример 31 Соединение пример 41 Соединение пример 46 **** Время начала действия (мин.) EDS0 (мг/кг) ED90 (мг/кг) у морских у морских свинок СВИНОК ED50 (мг/кг) ED90 (мг/кг) у крыс у крыс Продолжительность действия (мин.) Возвращение к норме 25-75% (мин.) 120 ±15,5 186 ±7,1 16 ±0,8 29 ±1,2 1,2 ±0,15 10,5 ±1,1 3,1 ±0,6 286 ± 33,3 446 ±59,1 34 ± 2,0 48 ± 2,7 0,9 ±0,18 10,1 ±1,32 2,4 ± 0,3 657 ±171,0 845 ± 231 176±31,7 282 ±52,7 14 ±1,3 20 ±1,3 587 ±163,0 795 ± 200,0 216 ±40 330 ±115 (*) - время, необходимое для наступления 95%-ной блокады при введении в организм двойной EDgo дозы у морских свинок. (**) - уменьшение до 75% блокирующею эффекта соединения, введенного в организм в размере двух ЕОэо доз, у морских сеинок. (*•*) _ время, необходимое для уменьшения блокирующего эффекта от 75% до 25%, у морских свинок **•* - соединение 1 - [За, 17р-бис (ацетилокси)-2р-(4-ацетилокси-1-пиперидинил)-5а-андростан-16[1-ил]-1-(2пропенил) бромид пирролидина приготовлено путем реакции 2р-(4-акситилокси-1пиперидинил)-1бр-1-пирролидинил)-5а-андростанЗа,17В-диолдиоцетата (Пример 18) с бромидом аллила, как описано в Примере 5. Точка плавления 180-185°С. Данные Таблицы 2 показывают, что во время опытов in vivo на морских свинках начало действия соединения (Пример 8) было более быстрым, а продолжительность действия более короткой, чем соответствующие характеристики других известных веществ, имеющих подобную химическую структуру. Таким образом, например, после введения в организм подопытного двойной EDgo дозы нервно-мышечная блокада снижалась с 75% до 25% в течение 10,1 минуты. Для сравнения соответствующая характеристика для бромида панкурония и бромида. Таблица 3 Изучение антивагусного эффекта на подвергнутых анестезии кошках. Значение +СОС (п=4) Уменьшение частоты сердечных сокращений (%) контроль соединение (пример 8) Уменьшение артериального давления (мм рт. ст.) 14 ± 1,8 15 ±2,9 40,0 ±8,1 32,0 ±6,6 Таблица 4 Сравнение воздействия двукратных ED90 доз на организм собак породы коротконогая гончая (в круглых скобках - количество животных). Значение +СОС Соединение пример 5 Соединение пример 8 Верукония бромид Время начала действия (с) (8 63,3 + 7,5 48,4 ±2,9 75,3 ± 5,9 62,8 ±4,5 115,2 ±8,6
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of androstane substituted at 16-position with quaternary ammonium group, having neuromuscular blocking effect and pharmaceutical composition having neuromuscular blocking effect
Автори англійськоюTUBA ZOLTAN, VIZI E. SILVESTER, FOLDES F. FERENTS, MAKHO SHANDOR
Назва патенту російськоюПроизводные андростана, замещенные в 16-м положении четвертичной аммониевой группой, для использования как нервно-мышечных блокаторов и фармацевтическая композиция, способная вызывать нервно-мышечную блокаду
Автори російськоюТьюба Золтан, Визи Э.Сильвестер, Фелдис Ф.Ференц, Махо Шандор
МПК / Мітки
МПК: A61P 9/00, C07J 75/00, A61K 31/565, C07J 71/00, C07J 43/00, A61P 9/06
Мітки: нервово-м'язових, амонієвою, групою, положенню, здатна, андростану, блокаду, композиція, заміщені, 16-му, нервово-м'язову, викликати, похідні, блокаторів, використання, фармацевтична, четвертинною
Код посилання
<a href="https://ua.patents.su/30-27230-pokhidni-androstanu-zamishheni-po-16-mu-polozhennyu-chetvertinnoyu-amoniehvoyu-grupoyu-dlya-vikoristannya-yak-nervovo-myazovikh-blokatoriv-ta-farmacevtichna-kompoziciya-shho-zdatna.html" target="_blank" rel="follow" title="База патентів України">Похідні андростану, заміщені по 16-му положенню четвертинною амонієвою групою, для використання як нервово-м’язових блокаторів та фармацевтична композиція, що здатна викликати нервово-м’язову блокаду</a>
Попередній патент: Пристрій для підбирання, накопичення та розподілу щебеневого баласту залізничної колії
Наступний патент: Оральна лікарська форма з вивільненням у товстій кишці та її оболонка
Випадковий патент: Спосіб класифікації зернистих матеріалів та пристрій для його реалізації