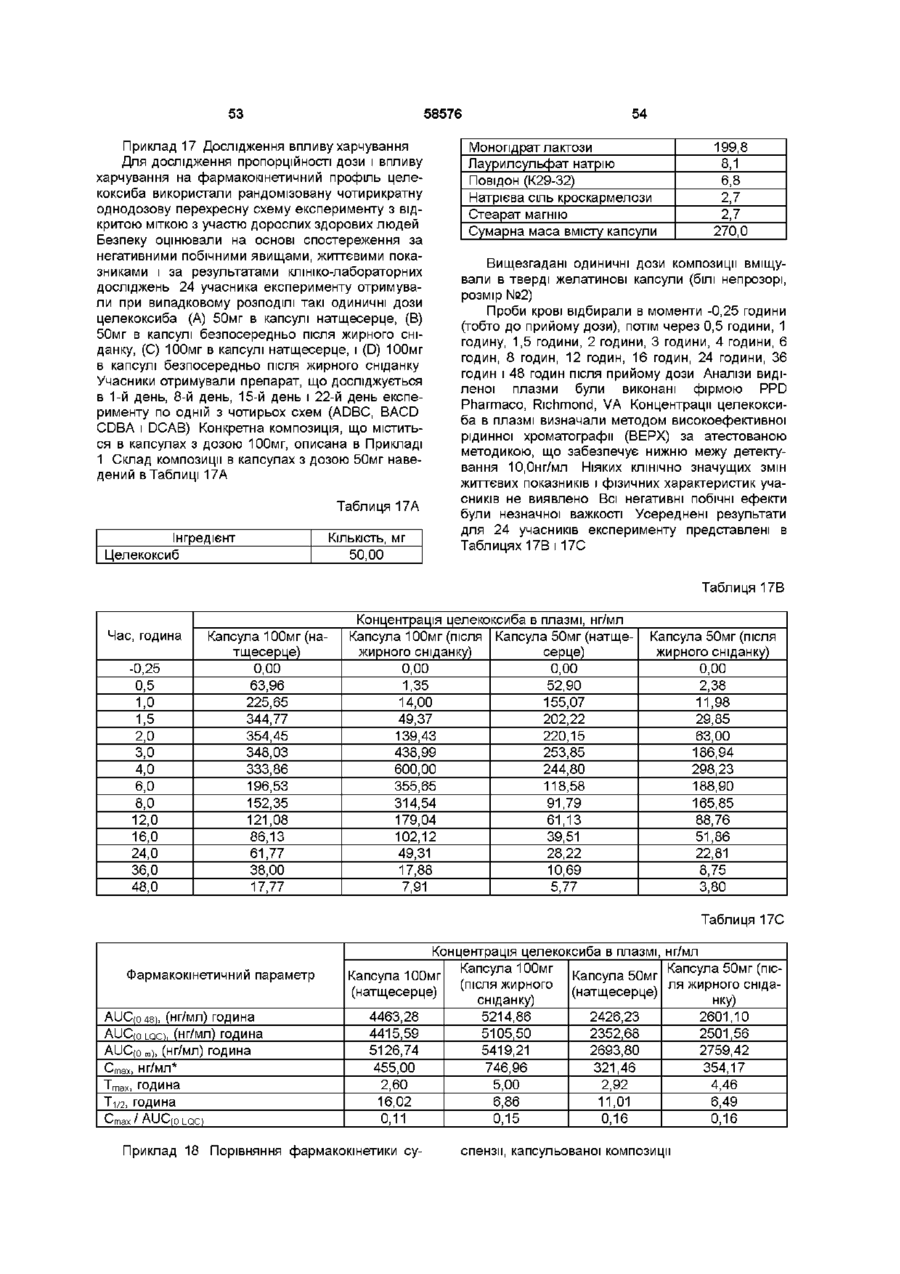
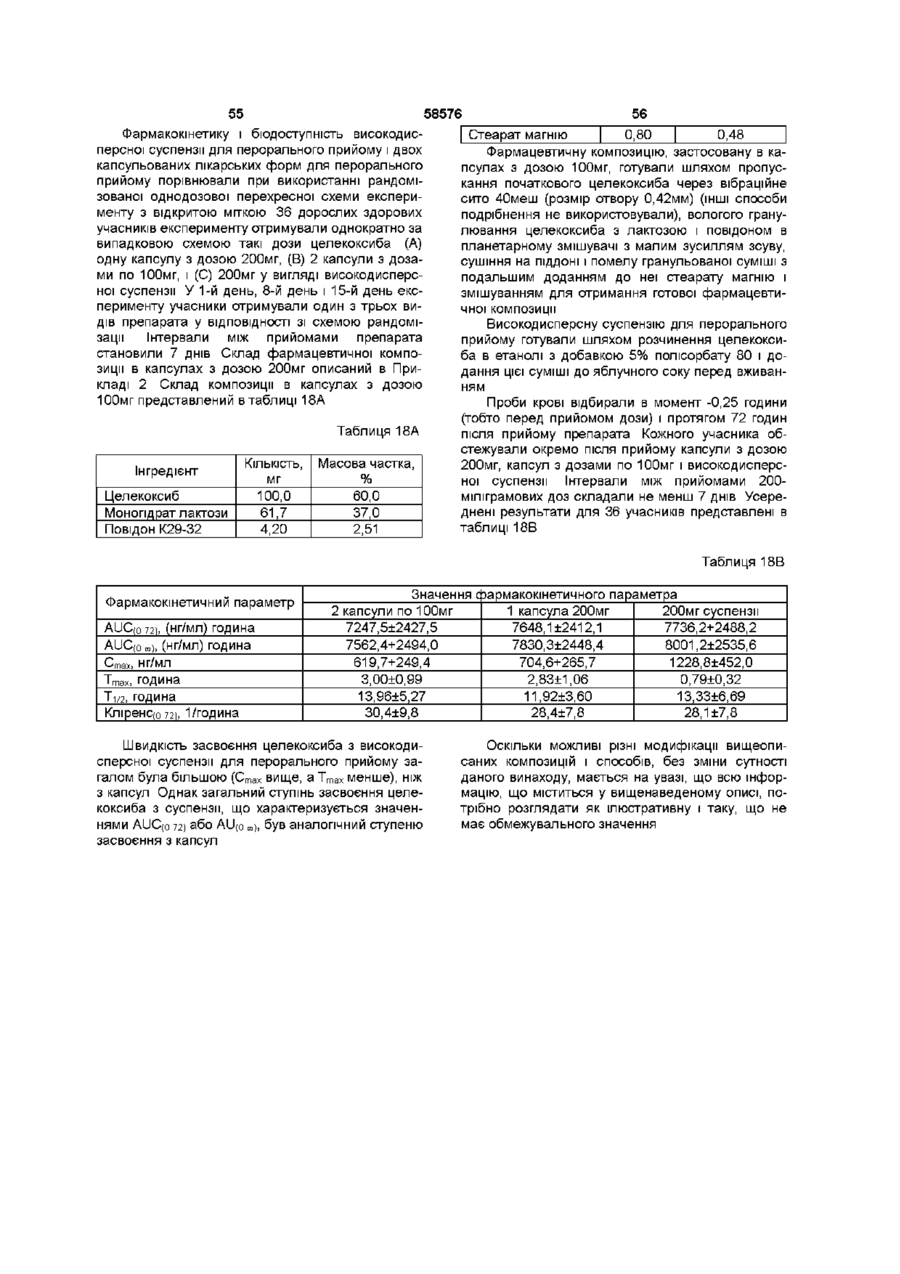
Фармацевтична композиція, що містить целекоксиб
Номер патенту: 58576
Опубліковано: 15.08.2003
Автори: Трулов Джеймз Е., Вон Маргарет Б. Вудхалл, Гао Данчен, Мажарі Ахмад М., Хлінак Антоні Дж.
Формула / Реферат
1. Фармацевтична композиція, що включає одну або декілька окремих твердих одиниць дозування для перорального застосування, кожна з яких містить целекоксиб у вигляді частинок в кількості від 10 мг до 1000 мг в однорідній суміші з однією або декількома фармацевтично прийнятними добавками, і що має такий розподіл частинок целекоксиба за розмірами, що D90 частинок за їх максимальним розміром має значення, менше, ніж 200 мкм, переважно - менше, ніж 100 мкм, більш переважно - менше, ніж 40 мкм, і найбільш переважно - менше, ніж 25 мкм.
2. Композиція за п. 1, яка відрізняється тим, що відносна біодоступність целекоксиба не менша, ніж приблизно 50%, переважно - не менша, ніж приблизно 70%, у порівнянні з розчином для перорального застосування, який містить таку ж дозу целекоксиба.
3. Композиція за будь-яким з пп. 1 і 2, яка відрізняється тим, що згадані одиниці дозування мають форму, вибрану із групи, яка включає таблетки, драже, тверді і м'які капсули, коржики, саше і пастилки.
4. Композиція за п. 3, яка відрізняється тим, що згадані одиниці дозування мають форму капсул або таблеток, причому зазначені добавки вибрано із групи, яка включає фармацевтично прийнятні розріджувачі, дезінтегратори, зв'язувальні агенти, змочувальні агенти і змащувальні агенти.
5. Композиція за п. 4, яка містить:
(a) один або декілька фармацевтично прийнятних розріджувачів в загальній кількості від 10% до 85% від маси композиції;
(b) один або декілька фармацевтично прийнятних дезінтеграторів в загальній кількості від 0,2% до 10% від маси композиції;
(c) один або декілька фармацевтично прийнятних зв'язувальних агентів в загальній кількості від 0,75% до 15%від маси композиції;
(d) необов'язково - один або декілька фармацевтично прийнятних змочувальних агентів, в загальній кількості від 0,4% до 10% від маси композиції; і
(e) необов'язково - один або декілька фармацевтично прийнятних змащувальних агентів, в загальній кількості від 0,2% до 8% від маси композиції.
6. Композиція за п. 5, яка відрізняється тим, що згаданим розріджувачем або одним із згаданих розріджувачів є лактоза, згаданим дезінтегратором або одним із згаданих дезінтеграторів є натрієва сіль кроскармелози, згаданим зв'язувальним агентом або одним із згаданих зв'язувальних агентів є полівінілпіролідон, згаданим змочувальним агентом або одним із згаданих змочувальних агентів, якщо вони наявні, є лаурилсульфат натрію, і згаданим змащувальним агентом або одним із згаданих змащувальних агентів, якщо вони наявні, є стеарат магнію.
7. Композиція за будь-яким з пп. 1-6 для лікування захворювання або розладу у пацієнта у випадку, якщо показано лікування інгібітором циклооксигенази-2, призначена для перорального введення в організм пацієнта, переважно - один або два рази на день.
8. Спосіб лікування захворювання або розладу у пацієнта у випадку, якщо показано лікування інгібітором циклооксигенази-2, який включає пероральне введення в організм пацієнта композиції за будь-яким із попередніх пунктів один або два рази на день.
9. Спосіб за п. 8, який відрізняється тим, що зазначеним захворюванням або розладом є ревматоїдний артрит.
10. Спосіб за п. 8, який відрізняється тим, що зазначеним захворюванням або розладом є остеоартрит.
11. Спосіб за п. 8, який відрізняється тим, що зазначеним захворюванням або розладом, або симптомом зазначеного захворювання або розладу, є біль.
Текст
1 Фармацевтична композиція, що включає одну або декілька окремих твердих одиниць дозування для перорального застосування, кожна з яких містить целекоксиб у вигляді частинок в КІЛЬКОСТІ від 10мг до 1000мг в однорідній суміші з однією або декількома фармацевтично прийнятними добавками, і що має такий розподіл частинок целекоксиба за розмірами, що Dgo частинок за їх максимальним розміром має значення, менше, ніж 200мкм, переважно - менше, ніж ЮОмкм, більш переважно - менше, ніж 40мкм, і найбільш переважно - менше, ніж 25мкм 2 Композиція за п 1, яка відрізняється тим, що відносна бюдоступність целекоксиба не менша, ніж приблизно 50%, переважно - не менша, ніж приблизно 70%, у порівнянні з розчином для перорального застосування, який містить таку ж дозу целекоксиба 3 Композиція за будь-яким з пп 1 і 2, яка відрізняється тим, що згадані одиниці дозування мають форму, вибрану із групи, яка включає таблетки, драже, тверді і м'які капсули, коржики, саше і пастилки 4 Композиція за п 3, яка відрізняється тим, що згадані одиниці дозування мають форму капсул або таблеток, причому зазначені добавки вибрано із групи, яка включає фармацевтично прийнятні розріджувачі, дезінтегратори, зв'язувальні агенти, змочувальні агенти і змащувальні агенти 5 Композиція за п 4, яка містить (а) один або декілька фармацевтично прийнятних розріджувачів в загальній КІЛЬКОСТІ ВІД 10% до 85% від маси композиції, (b) один або декілька фармацевтично прийнятних дезінтеграторів в загальній КІЛЬКОСТІ ВІД 0,2% до 10% від маси композиції, (c) один або декілька фармацевтично прийнятних зв'язувальних агентів в загальній КІЛЬКОСТІ ВІД 0,75% до 15% від маси композиції, (d) необов'язково - один або декілька фармацевтично прийнятних змочувальних агентів, в загальній КІЛЬКОСТІ від 0,4% до 10% від маси композиції, і (є) необов'язково - один або декілька фармацевтично прийнятних змащувальних агентів, в загальній КІЛЬКОСТІ від 0,2% до 8% від маси композиції 6 Композиція за п 5, яка відрізняється тим, що згаданим розріджувачем або одним із згаданих розріджувачів є лактоза, згаданим дезінтегратором або одним із згаданих дезінтеграторів є натрієва сіль кроскармелози, згаданим зв'язувальним агентом або одним із згаданих зв'язувальних агентів є полівшілпіролідон, згаданим змочувальним агентом або одним із згаданих змочувальних агентів, якщо вони наявні, є лаурилсульфат натрію, і згаданим змащувальним агентом або одним із згаданих змащувальних агентів, якщо вони наявні, є стеарат магнію 7 Композиція за будь-яким з пп 1-6 для лікування захворювання або розладу у пацієнта у випадку, якщо показано лікування інгібітором циклооксигенази-2, призначена для перорального введення в організм пацієнта, переважно - один або два рази на день 8 Спосіб лікування захворювання або розладу у пацієнта у випадку, якщо показано лікування інгібітором циклооксигенази-2, який включає пероральне введення в організм пацієнта композиції за будь-яким із попередніх пунктів один або два рази на день 9 Спосіб за п 8, який відрізняється тим, що зазначеним захворюванням або розладом є ревматоїдний артрит 10 Спосіб за п 8, який відрізняється тим, що зазначеним захворюванням або розладом є остеоартрит 11 Спосіб за п 8, який відрізняється тим, що зазначеним захворюванням або розладом, або симптомом зазначеного захворювання або розладу, є біль О (О ю 00 ю 58576 Даний винахід відноситься до фармацевтичних композицій для перорального вживання, що містять целекоксиб як активний інгредієнт, до способів приготування таких композицій, до способів лікування розладів, в яких медіатором є циклооксигеназа-2, що включає пероральне вживання пацієнтом таких композицій, і до застосування таких композицій у виробництві лікарських препаратів 4-[5-(4-метилфеніл)-3-(трифторметил)-1Нпіразол-1-іл]бензолсульфамід, що згадується в даному описі також під назвою "целекоксиб", був раніше описаний Теллі і іншими (Talley et аі) в патенті США №5,466,823, де описаний і заявлений як предмет винаходу клас 1,5-діарилпіразолів і їх солей, а також методики отримання таких сполук Целекоксиб має таку будову НаС ^ (І) Сполуки 1,5-діарилпіразолу описані в патенті США №5,466,823 як речовини, корисні при лікуванні запальних процесів і розладів, пов'язаних із запальними процесами Патент США №5,466,823 містить загальні вказівки, що стосуються лікарських форм для застосування цих 1,5-діарилпіразолів, в тому числі дозованих форм для перорального вживання, наприклад, таблеток і капсул У патенті США №5,760,068 Теллі і ІНШІ ПОВІДОМЛЯЮТЬ про клас сполук 1,5-діарилпіразолу, в тому числі про целекоксиб, які описані як селективні інгібітори циклооксигенази-2 і можуть бути застосовані для лікування, нарівні з іншими хворобливими станами і розладами, хворобливих станів, пов'язаних з ревматоїдними артритами і остеоартритами Пенінг і ІНШІ (Penning et al) в роботі під заголовком "Синтез і біологічна оцінка класу 1,5діарилпіразолів як інгібіторів циклооксигенази-2 ідентифікація 4-[5-(4-метилфеніл)-3-(трифторметил)-1 Н-піразол-1 -іл]бензолсульфаміду (SC-58635, целекоксиб)" (J Med Chem 40 (1997), 1347-1365) описують ряд похідних 1,5-діарилпіразолу, що містять сульфамідну групу, і оцінюють ці ПОХІДНІ ЯК інгібітори циклооксигенази-2 Симон і ІНШІ (Simon et al) в роботі "Попереднє дослідження безпеки і ефективності SC-58635 нового інгібітору циклооксигенази-2" (Arthritis & Rheumatism, Vol 41, No 9, September 1998, pp 1591-1602) описують дослідження ефективності і безпеки целекоксиба при лікуванні остеоартриту і ревматоїдного артриту ЛІПСКІ і ІНШІ (Lipsky et al) в роботі "Результати специфічного інгібування СОХ-2 при ревматоїдному артриті" (J Rheumatology, Vol 24, Suppl, 49, pp 9-14, 1997) повідомляють, що у пацієнтів, що страждають ревматоїдним артритом, специфічне інгібування циклооксигенази-2 достатнє для пригнічення ознак і симптомів запального захворювання У заявці на європейський патент №0863134 А1, опублікованій 9 вересня 1998р, описані композиції, що містять інгібітор циклооксигенази-2, конкретно, 2-(3,5-дифтор-феніл)-3-(4-метилсульфоніл)феніл)-2-циклопентен-1-он, в поєднанні з добавками, в тому числі з мікрокристалічною целюлозою, моногідратом лактози, пдроксипропілцелюлозою, натрієвою кроскармелозою і стеаратом магнію Отримання лікарських форм целекоксиба для ефективного перорального застосування до цього часу нелегке внаслідок специфічних фізичних і ХІМІЧНИХ властивостей цієї сполуки, зокрема, низької розчинності і чинників, пов'язаних з його кристалічною структурою, в тому числі схильності до злипання, низької насипної густини і поганої пресованості Целекоксиб надзвичайно слабко розчинний у воді У відсутності добавок целекоксиб важко розчиняється і диспергується, що утруднює його швидке засвоєння в травному тракті при пероральному прийомі, наприклад, у вигляді капсул Крім того, целекоксиб без додаткових інгредієнтів схильний по своїй кристалічній морфології до утворення довгих голчастих кристалів, що зчіплюються, при пресуванні на таблетковому пресі, як правило, сплавляється в монолітну масу Навіть будучи змішаними з іншими речовинами, кристали целекоксиба схильні до відділення від цих добавок і взаємної агломерації в процесі перемішування композиції, що приводить до нерівномірності її складу і наявності в ній понадміру великих агрегатів целекоксиба Тому приготування фармацевтичної композиції, що містить целекоксиб, бажаної міри однорідності нелегке Далі, в процесі приготування фармацевтичних композицій, що містять целекоксиб, виникає ряд технічних проблем Наприклад, низька об'ємна густина целекоксиба утруднює переробку малих його кількостей, необхідних при приготуванні фармацевтичних композицій ВІДПОВІДНО, існує потреба у вирішенні численних проблем, пов'язаних з приготуванням фармацевтичних композицій і дозованих лікарських форм, що містять целекоксиб, зокрема, дозованих форм для перорального вживання Зокрема, існує потреба в лікарських формах целекоксиба для перорального вживання, що мають одну або декілька з нижчеперерахованих характеристик в порівнянні з целекоксибом без добавок або з іншими композиціями целекоксиба (1) поліпшеною розчинністю, (2) скороченим часом дезінтеграції, (3) скороченим часом розчинності, (4) зниженою ламкістю таблетки, (5) підвищеною МІЦНІСТЮ таблетки, (6) підвищеною змочувальною здатністю, (7) поліпшеною пресованістю, (8) підвищеною текучістю рідких сумішей і тве 58576 розміру) рдих порошкових композицій, Одиниці дозування, що містять композицію, (9) підвищеною фізичною СТІЙКІСТЮ готової можуть мати форму окремих твердих виробів, накомпозиції, приклад, таблеток, драже, твердих або м'яких кап(10) зменшеними розмірами таблеток або капсул, саше або пастилок, альтернативними формасул, ми композиції можуть бути практично однорідна (11) підвищеною однорідністю складу суміші, сипуча або текуча маса, наприклад, порошкоподі(12) підвищеною однорідністю дози, бна або гранульована маса, або рідкі суспензії, з (13) можливістю більш точного регулювання яких шляхом відмірювання можна відбирати одимаси при таблетуванні або капсулюванні, ниці дозування (14) підвищеною густиною гранул для композицій, що гранулюються у вологому стані, Запропонований також спосіб лікування хво(15) зниженою потребою у воді для вологого робливого стану або розладу у пацієнта, при якогранулювання, му показано лікування інгібітором циклооксигенази-2, що включає пероральне вживання композиції (16) скороченим часом вологого гранулюванВІДПОВІДНО до даного винаходу один-два рази на ня, і день (17) скороченим часом сушіння сумішей, гранульованих у вологому стані Інші характерні особливості даного винаходу частково зрозумілі з нижченаведеного докладного Як зазначено нижче, застосування целекоксиопису, а частково прямо вказані в ньому ба показане або потенційно показане при лікуванні вельми широкої різноманітності хворобливих стаНа фіг 1 представлена принципова схема нанів і розладів, в яких медіатором є циклооксигенаведеного як приклад процесу приготування фарза-2 Тому вельми бажаним є створення ряду лімацевтичних композицій ВІДПОВІДНО до даного викарських форм, що мають характеристики бюдоснаходу в формі капсул тупності, ВІДПОВІДНІ різним показанням Особливо Фіг 2 являє собою принципову схему, що ілюсбажане створення лікарських форм, що мають трує інший спосіб приготування фармацевтичних фармакокшетичні характеристики, сумісні з прикомпозицій ВІДПОВІДНО до даного винаходу в формі скореним початковим ефектом в порівнянні з цекапсул лекоксибом, що не містить додаткових інгредієнНові фармацевтичні композиції ВІДПОВІДНО ДО тів даного винаходу містять одну або декілька одиниць дозування для перорального застосування, Такі лікарські форми здатні забезпечити значпричому кожна одиниця дозування містить целений прогрес в лікуванні хворобливих станів і розкоксиб у вигляді частинок в КІЛЬКОСТІ ВІД приблизно ладів, в яких медіатором є циклооксигеназа-2 Юмг до приблизно ЮООмг, і являють собою ефекДаний винахід пропонує фармацевтичну комтивні лікарські форми з безпосереднім виділенням позицію, що включає одну або декілька одиниць активного інгредієнта, здатні забезпечити швидке дозування для перорального вживання, кожна з ослаблення розладу, в якому медіатором є циклояких містить целекоксиб у вигляді частинок в КІЛЬоксигеназа-2, при пероральному прийомі пацієнКОСТІ від приблизно Юмг до приблизно ЮООмг в том, що страждає таким розладом однорідній суміші з однією або декількома фармацевтично прийнятними добавками Якщо залишити збоку теоретичні міркування, Згідно З ОДНИМ З варіантів здійснення винахото вважається, що висока клінічна ефективність, ду, одиниця дозування лікарської форми після що досягається за допомогою цих композицій, зуперорального вживання пацієнтом натщесерце мовлена підвищеною бюдоступністю целекоксиба, забезпечує тимчасову ПОСЛІДОВНІСТЬ ЗМІНИ концензокрема, несподіваним ефектом інтенсивного потрації целекоксиба в сироватці крові, що має приглинання целекоксиба в шлунково-кишковому транаймні одну з таких характеристик кті Таке ефективне поглинання може бути перевірене фахівцем шляхом моніторингу концентрації (a) час досягнення концентрації 100нг/мл не целекоксиба в сироватці крові пацієнта, що отрибільш 0,5 години з моменту прийому, мав дане лікування, протягом деякого періоду часу (b) час до досягнення максимальної концентпісля прийому препарату Бажано, щоб за можлирації (Т т а х ) НЄ біЛЬШ ПрибЛИЗНО З ГОДИН 3 МОМЄНТу во найкоротший час досягалася порогова конценприйому, трація целекоксиба в сироватці крові, відповідна (c) тривалість періоду, протягом якого конценефективному інгібуванню циклооксигенази-2 без трація перевищує ЮОнг/мл, не менш приблизно 12 подальшого дуже швидкого зниження цієї конценгодин, трації, так, щоб сприятливий ефект целекоксиба (d) кінцевий час напівжиття (Т1/2) не менш 10 зберігався протягом можливо більш тривалого ГОДИН, І часу (є) максимальна концентрація (С ) не менш тах приблизно 200нг/мл Згідно З ІНШИМ варіантом, композиція має відносну бюдоступність не менш приблизно 50% в порівнянні з перорально прийнятим розчином, що містить еквівалентну КІЛЬКІСТЬ целекоксиба Згідно З ще одним варіантом, композиція характеризується таким розподілом первинних частинок целекоксиба по величині, що Dgo не перевищує приблизно 200мкм (тобто 90% частинок в пробі мають величину менше Dgo по максимальному Тому, ВІДПОВІДНО до одного з варіантів здійснення винаходу, кожна одиниця дозування композиції після перорального введення забезпечує тимчасову ПОСЛІДОВНІСТЬ зміни концентрації целекоксиба в сироватці крові, що має принаймні одну з таких характеристик (a) час досягнення концентрації в сироватці крові ІООнг/мл не більш 0,5 години з моменту прийому, (b) час до досягнення максимальної концент 58576 8 (агрегати) Термін "величина частинок" в значенні, що вживається в даному описі, при відсутності спеціальних вказівок відноситься до максимального розміру первинних частинок Вважається, що величина частинок є важливим параметром, що впливає на клінічну ефективність целекоксиба Тому, згідно з іншим варіантом здійснення винаходу, композиції ВІДПОВІДНО до даного винаходу мають такий розподіл частинок целекоксиба по велиГОДИН, І чині, що Dgo частинок по їх максимальному розміру (є) максимальна концентрація в сироватці має значення менш приблизно 200мкм, переважно крові (Стах) не менш приблизно 200нг/мл, переваменш приблизно ЮОмкм, більш переважно менш жно не менш приблизно 300нг/мл, більш переважприблизно 75мкм, ще більш переважно менш прино не менш приблизно 400нг/мл близно 40мкм і найбільш переважно менш приПотрібно мати на увазі, що КІЛЬКІСТЬ целекокблизно 25мкм Зменшення величини частинок цесиба в одиниці дозування, що забезпечує досяглекоксиба ВІДПОВІДНО до даного варіанту здійсненнення концентрацій в сироватці крові, ВІДПОВІДНИХ ня винаходу, як правило, приводить до поліпшенбудь-якому з вищезгаданих критеріїв (а)-(е), заленя бюдоступності целекоксиба жить від маси тіла пацієнта, що приймає препарат Наприклад, якщо пацієнтом є дитина або тварина Крім того, або як альтернативний варіант, часневеликого розміру (наприклад, собака), то досягтки целекоксиба в композиції ВІДПОВІДНО ДО даного нення концентрацій в сироватці крові, ВІДПОВІДНИХ винаходу переважно мають середню величину від принаймні одному з вищезгаданих критеріїв (а)-(е), приблизно 1мкм до приблизно Юмкм, найбільш ймовірно, може бути забезпечено відносно невепереважно від приблизно 5мкм до приблизно ликою КІЛЬКІСТЮ целекоксиба в межах вищезгада7мкм ного діапазону від приблизно Юмг до приблизно Виявлено, що помел целекоксиба в ударному ЮООмг Якщо ж пацієнтом є доросла людина або млині, наприклад, в пальцьовому млині, перед велика тварина (наприклад, кінь), то для досягзмішуванням целекоксиба з добавками для пригонення вказаних концентрацій в сироватці крові, тування композиції ВІДПОВІДНО до даного винаходу ймовірно, буде потрібна порівняно велика КІЛЬКІСТЬ не тільки ефективний з точки зору забезпечення целекоксиба в одиниці дозування Для дорослих підвищеної бюдоступності, але також сприяє полюдей КІЛЬКІСТЬ целекоксиба в одиниці дозування доланню ускладнень, пов'язаних зі злипанням крикомпозиції ВІДПОВІДНО до даного винаходу, необсталів целекоксиба в процесі такого помелу або хідна для забезпечення вказаних концентрацій в змішування Целекоксиб, подрібнений із застосусироватці крові, складає, як правило, від приблизванням пальцьового млина, в процесі змішування но 75мг до приблизно 400мг менш схильний до злипання і в меншій мірі утворює повторні агрегати частинок целекоксиба в Бюдоступність целекоксиба при пероральному порівнянні з неподрібненим целекоксибом або з вживанні в суворому значенні слова важко піддацелекоксибом, подрібненим із застосуванням інється вимірюванню, оскільки внутрішньовенне ших типів млинів, наприклад, струминних млинів введення (як правило, випадок, що приймається Знижена злипальна здатність дозволяє отримати звичайно як стандарт, відносно якого визначають більш рівномірні за складом суміші, що має істотне бюдоступність) вельми нелегке у разі використанзначення при виготовленні одиниць дозування, ня лікарських речовин, дуже погано розчинних у наприклад, капсул і таблеток Цей результат є воді, до яких відноситься і целекоксиб Однак відособливо несподіваним, в зв'язку з високою корисносну бюдоступність можна визначити шляхом ністю струминних млинів, наприклад, повітрянопорівняння з випадком перорального вживання струминних млинів, при ПІДГОТОВЦІ компонентів целекоксиба у вигляді розчину у відповідному розінших фармацевтичних композицій Не беручи до чиннику Відносна бюдоступність целекоксиба при уваги теоретичних міркувань, можна передбачити, пероральному вживанні композицій ВІДПОВІДНО ДО що ударний помел приводить до зміни морфології даного винаходу виявилася несподівано високою кристалів целекоксиба з утворенням замість голТак, в одному з варіантів здійснення винаходу кочастих кристалів інших модифікацій, більш рівножна одиниця дозування для перорального вжимірних за формою і більш придатних для цілей вання після прийому показує відносну бюдоступзмішування, в той час як довгі голки менш схильні ність не менш приблизно 50%, переважно не мендо руйнування при струминному розмелюванні ше за 70%, в порівнянні з випадком перорального прийому розчину целекоксиба, що містить еквіваВиявлено також, що подальшому підвищенню лентну КІЛЬКІСТЬ активної речовини Як показано рівномірності складу суміші сприяє вологе гранунижче, бюдоступність визначають з результатів лювання целекоксиба з носіями і іншими добавкавимірювання інтегральної концентрації целекоксими, що застосовуються для приготування фармаба в сироватці крові протягом деякого періоду часу цевтичної композиції, особливо у випадку, коли після перорального прийому препарата початковий целекоксиб заздалегідь піддадуть подрібненню в ударному млині Особливо бажане Композиції ВІДПОВІДНО до даного винаходу місударне розмелювання початкового целекоксиба тять целекоксиб у вигляді дрібних частинок Пердо вищезгаданої величини частинок з подальшим винні частки целекоксиба, що отримуються, награнулюванням вологим способом приклад, шляхом помелу чи дроблення або шляхом осадження з розчину, можуть злипатися (агЗгідно З ще одним варіантом здійснення виналомерувати), утворюючи повторні частки ходу, нові фармацевтичні композиції містять целерації (Tmax) целекоксиба в сироватці крові не більш приблизно 3 години з моменту прийому, переважно не більш приблизно 2 години з моменту прийому, (c) тривалість періоду, протягом якого концентрація в сироватці крові перевищує приблизно 100нг/мл, не менш приблизно 12 годин, (d) кінцевий час напівжиття (Т1/2) не менш 10 58576 10 ного кишечника і виразкового коліту Композиції, що розглядаються, корисні при лікуванні запальних станів при таких захворюваннях, як мігрень, вузликовий періартермт, тироідит, апластична анемія, хвороба Ходжкіна, склеродома, ревматична лихоманка, діабет типу І, нервово-м'язові розлади, в тому числі важка міастенія, захворювання білої речовини мозку, в тому числі розсіяний склероз, саркоідоз, нефротичний синдром, синдром Бехчета, полімюзит, ГІНГІВІТ, нефрит, пперчутливість, набряки після травм, в тому числі набряк мозку, ішемія міокарда і ІНШІ КОМПОЗИЦІЇ, ЩО розглядаються, корисні при лікуванні офтальмологічних розладів, наприклад, ретиніту, кон'юнктивіту, ретинопатії, увеїту, світлобоязні і гострих пошкоджень тканин ока Композиції, що розглядаються, корисні при лікуванні запалення легень, наприклад, пов'язаного з вірусними інфекціями і кістозним фіброзом, і у разі резорбції кісток, пов'язаної, З композиції, що являє собою практично однонаприклад, з остеопорозом Композиції, що розрідну сипучу або текучу масу, окремі одиниці дозуглядаються, корисні при лікуванні деяких розладів вання можна відбирати шляхом відмірювання за центральної нервової системи, наприклад, кортидопомогою ВІДПОВІДНОГО пристрою для вимірюванкальних деменцій, в тому числі хвороби Альцгейня об'єму, наприклад, чашки або ложки До сипучої мера, не родегенерацм, і пошкоджень центральної маси відносяться порошки і грануляти, але не нервової системи, що виникають внаслідок інсультільки ці форми У інших випадках текуча маса ту, ішемії і травм Термін "лікування" в даному конможе являти собою суспензію, що містить целекотексті охоплює часткове або повне інгібування ксиб у вигляді твердої порошкоподібної фази, дисдеменції, в тому числі при хворобі Альцгеймера, пергованої в рідкій фазі, переважно у водній фазі судинній деменції, багатоінфарктній деменції, преПри приготуванні такої суспензії може виявитися сенільній деменції, алкогольній деменції і сенільдоцільним використання змочувального агента, ній деменції наприклад, полісорбату 80 і т ш Суспензію можна готувати шляхом диспергування розмолотого цеКомпозиції, що розглядаються, особливо колекоксиба в рідкій фазі, згідно з альтернативним рисні як протизапальні агенти, наприклад, для ліспособом, целекоксиб можна осаджувати з розчикування артриту, додатковою їх перевагою є значну в розчиннику, наприклад, в спирті, переважно в не зниження шкідливих побічних ефектів в поріветанолі Водна фаза переважно містить смакову нянні з композиціями на основі звичайних нестеродобавку, наприклад, сироп або фруктовий сік, наідних протизапальних засобів (НСПЗЗ) приклад, яблучний сік Композиції, що розглядаються, корисні при лікуванні алергічного риніту, синдрому розладу диКомпозиції ВІДПОВІДНО до даного винаходу кохання, синдрому ендотоксичного шоку і розладу рисні при лікуванні і профілактиці вельми широкофункцій печінки Композиції, що розглядаються, го діапазону розладів, в яких медіатором є циклоокорисні як болезаспокійливі засоби, в тому числі ксигеназа-2 Композиції, що розглядаються, корис(але не тільки) при післяопераційних болях, зуні при лікуванні, наприклад, запальних процесів, як бному болі, м'язових болях і болях, пов'язаних зі аналгетики для зняття болів і при головних болях, і злоякісними пухлинами як жарознижуючі засоби при лікуванні гарячкових станів, але не тільки вищезазначених розладів Композиції, що розглядаються, корисні при ліНаприклад, такі композиції корисні при лікуванні куванні і профілактиці розладів серцево-судинної розладів типу артритів, в тому числі (але не тільки) системи, пов'язаних із запальними процесами (але ревматоїдного артриту, спондилоартропатій, подане тільки) Такі композиції корисні при лікуванні і гричного артриту, остеоартриту, системної червопрофілактиці захворювань кровоносних судин, ної вовчанки і юнацького артриту Вони корисні захворювання коронарних артерій, аневризмі, відтакож при лікуванні астми, бронхіту, менструальторгненні трансплантатів судин, артеріосклерозу, них судом, при передчасних пологах, при лікуванні атеросклерозу, в тому числі атеросклерозу серцетендиніту, бурситу, алергічного невриту, цитомевих трансплантатів, інфарктів міокарда, емболій, галовірусної інфекції, апоптозу, включаючи апопінсультів, тромбозів, в тому числі венозного тромтоз, індукований ВІЛ, люмбаго, захворювань печінбозу, стенокардії, в тому числі нестійкої стенокарки, в тому числі гепатиту, хворобливих станів шкідії, осередкового запалення коронарних судин, ри, в тому числі псоріазу, екземи, вугрів, ОПІКІВ запалень бактерійної етіології, в тому числі запаультрафіолетовим випромінюванням, термічних лення, викликаного хламідіями, запалень вірусної ОПІКІВ і дерматитів, а також післяопераційних запаетіології і запалень, пов'язаних з хірургічними льних ускладнень, в тому числі після офтальмоловтручаннями, наприклад, з імплантацією судин, в гічних операцій, наприклад, зняття катаракти або тому числі з аорто-коронарним шунтуванням, корекції кришталика Композиції, що розглядаютьтрансплантацією судин, в тому числі з анпопласся, корисні при лікуванні захворювань шлунковотикою, установкою стента, ендартеректомією і кишкового тракту, наприклад, запалень кишечниіншими кардинальними операціями, що зачіпають ка, хвороби Крони, гастриту, синдрому подразнеартерії, вени і капіляри Такі композиції корисні при коксиб в поєднанні з однією або декількома добавками, вибраними з носив, розріджувачів, дезінтеграторів, зв'язуючих агентів, змочувальних агентів і змащувальних агентів Переважно, принаймні одна з добавок являє собою водорозчинний розріджувач або змочувальний агент Такий водорозчинний розріджувач або змочувальний агент сприяє диспергуванню і розчиненню целекоксиба в процесі засвоєння фармацевтичної композиції Переважно присутні як водорозчинний розріджувач, так і змочувальний агент Фармацевтична композиція ВІДПОВІДНО до винаходу може являти собою практично однорідну сипучу або текучу масу, наприклад, порошкоподібний або гранульований твердий матеріал або рідину, або ж виконана у вигляді дискретних виробів, наприклад, капсул або таблеток, кожна з яких містить одну одиницю дозування 12 11 58576 лікуванні розладів, пов'язаних з анпогенезом (але наприклад, в меншій мірі спричиняють ослаблення не тільки) КОМПОЗИЦІЇ ВІДПОВІДНО ДО даного винафункції нирок, що приводить до затримки рідини і ходу можна призначати пацієнтам, потребуючим посилення гіпертензії, слабше впливають на триінгібування анпогенезу Такі композиції корисні при валість кровотеч, в тому числі в меншій мірі інгілікуванні новоутворень, в тому числі метастазів, бують функції тромбоцитів, і, можливо, в меншій офтальмологічних захворювань, в тому числі відмірі провокують астматичні приступи у астматиків, торгання трансплантату рогівки, очної неоваскулячутливих до аспірину, в порівнянні із звичайними ризацм, ретинальної неоваскуляризацм, в тому НСПЗЗ числі пов'язаної з травмою або інфекцією, діабеКомпозиції, що розглядаються, корисні для тичної ретинопатії, осередкового виродження, реполегшення болів, зниження температури і зняття тролентальної фіброплазм і неоваскулярної глаузапалення при різноманітних хворобливих станах, коми, виразкових захворювань, наприклад, виразв тому числі при ревматичній лихоманці, симптоки шлунка, патологічних, але не злоякісних станів, мах, пов'язаних з грипом і іншими вірусними інфенаприклад, гемангіом, втому числі дитячих геманкціями, при звичайній простуді, болях в поперекогіом, анпофіброми носоглотки і аваскулярного нево-крижовій і шийній областях, дисменореї, голокрозу кістки, а також розладів жіночих репродуктивному болі, зубному болі, розтягненні зв'язок і ковних органів, наприклад, ендометриту руптурах, МІОЗИТІ, невралгії, СИНОВІТІ, артриті, в тому числі при ревматоїдному артриті, дегенераКомпозиції, що розглядаються, корисні для тивних захворюваннях суглобів (остеоартриті), профілактики або лікування доброякісних і злоякіподагрі і анкілозному СПОНДИЛІТІ, бурситі, при опісних пухлин і новоутворень, в тому числі ракових ках і травмах, пов'язаних з хірургічними і стоматопухлин, наприклад, рака прямої кишки, рака голологічними операціями Крім того, композиції, що вного мозку, рака кісток, неоплазми епітеліальних розглядаються, інгібують злоякісне переродження клітин (епітеліальної карциноми), наприклад, карклітин і зростання метастазів пухлин і, отже, моциноми базальних клітин, аденокарциноми, рака жуть бути застосовані при лікуванні ракових затравного тракту, наприклад, рака губи, рака порохворювань, зокрема, рака товстої кишки Композижнини рота, рака стравоходу, рака тонкої кишки і ції, що розглядаються, застосовні також для лікурака шлунку, рака товстої кишки, рака печінки, вання і/або профілактики проліферативних розларака сечового міхура, рака підшлункової залози, дів, в яких медіатором є циклооксигеназа-2, рака яєчників, рака шийки матки, рака легенів, наприклад, діабетичної ретинопатії і анпогенезу в рака молочної залози і рака шкіри, наприклад, рапухлинах ка плоских і базальних клітин, рака передміхурової залози, карциноми клітин нирок і інших відомих Композиції, що розглядаються, інгібують скоракових захворювань, що уражують епітеліальні рочення гладенької мускулатури, що провокується клітини різних органів До новоутворень, відносно простаноідами, внаслідок запобігання синтезу конборотьби з якими композиції ВІДПОВІДНО до даного тракційних простаноідів і, отже, можуть бути завинаходу можна вважати особливо корисними, стосовані при попередженні передчасних пологів, відносяться ракові пухлини травного тракту, страпри лікуванні дисменореї, астми і розладів, пов'явоходу Барета, рак печінки, рак сечового міхура, заних з функціями еозинофілів Вони можуть бути рак підшлункової залози, рак яєчників, рак передкорисні при лікуванні хвороби Альцгеймера, для міхурової залози, рак шийки матки, рак легенів, зниження втрати маси кісток, зокрема, у жінок в рак молочної залози і рак шкіри, наприклад, рак періоді менопаузи (тобто для лікування остеопоплоских і базальних клітин Композиції ВІДПОВІДНО розу) і при лікуванні глаукоми до даного винаходу можна застосовувати також Завдяки високій активності інгібування циклоодля лікування фіброзу, що виникає при променевій ксигенази-2 (СОХ-2) і специфічності інгібування терапії Такі композиції можна застосовувати для циклооксигенази-2 в порівнянні з циклооксигеналікування пацієнтів, страждаючих аденомними зою-1 (СОХ-1), композиції ВІДПОВІДНО ДО даного поліпами, в тому числі спадковим аденомним повинаходу корисні як альтернатива звичайним ліпозом (САП) Крім того, такі композиції можна НСПЗЗ, зокрема, у випадках, коли такі НСПЗЗ використати для профілактики виникнення ПОЛІПІВ протипоказані, наприклад, пацієнтам, що стражу пацієнтів групи ризику по САП дають пептичними виразками, гастритами, регіональними ентеритами, виразковим колітом, диверКомпозиції ВІДПОВІДНО до даного винаходу по тикулітом або таким, що неодноразово перенесли своїх протизапальних, жарознижуючих і болезасрозлади функцій травного тракту, пацієнтам з покійливих властивостях аналогічні звичайним шлунково-кишковими кровотечами, порушеннями нестероідним протизапальним лікарським засобам здатності крові зсідатися, в тому числі анемією, або перевершують їх Композиції, що розгляданаприклад, ппопротромбінемією, гемофілією або ються, також інгібують гормонально індуковані іншими порушеннями здатності зсідатися, ниркоскорочення матки і мають потенційний протираковими захворюваннями, або передопераційним вий ефект, однак виявляють меншу тенденцію до хворим або пацієнтам, що застосовують антикоадеяких зумовлених механізмом дії побічних ефекгулянти Короткий опис потенційної корисності інгітів в порівнянні із звичайними НСПЗЗ Зокрема, біторів циклооксигенази-2 наведений в статті Джокомпозиції ВІДПОВІДНО до даного винаходу мають на Вейна (John Vane, Nature, Vol 367, pp 215-216, знижену потенційну токсичність по відношенню до 1994) і в статті, опублікованій в журналі Drug News травного тракту і в меншій мірі спричиняють поand Perspectives Vol 7, pp 501-512, 1994 дразнення травного тракту, в тому числі покриття виразками і кровотечі у верхніх відділах травного Переважними областями застосування фартракту, надають знижену побічну дію на нирки, мацевтичних композицій ВІДПОВІДНО до даного ви 14 13 58576 находу є лікування ревматоїдних артритів і остеовант") в даному описі означає речовину, яка, будуартритів, полегшення і зняття болів різного похочи присутньою в фармацевтичній композиції, що дження (зокрема, болів після операцій в порожнині містить активний інгредієнт, або будучи доданою рота, після хірургічних операцій загального харакдо такої композиції, посилює або іншим чином потеру, після ортопедичних операцій і при гострих ліпшує дію активного інгредієнта приступах остеоартриту), лікування хвороби АльцТермін "одинична доза" в даному описі ознагеймера і хімічна профілактика рака товстої кишки чає КІЛЬКІСТЬ активного інгредієнта, призначену для однократного перорального прийому пацієнтом з Нарівні з корисністю при лікуванні людей, комметою лікування або профілактики хворобливого позиції ВІДПОВІДНО до даного винаходу корисні тастану або розладу, в якому медіатором є циклооккож при лікуванні домашніх тварин, екзотичних сигеназа-2 Лікування розладу, в якому медіатотварин, сільськогосподарських тварин і т ш , зокром є циклооксигеназа-2, може вимагати періодирема, ссавців, в тому числі гризунів Більш конкречного прийому одиничних доз целекоксиба, напритно, композиції ВІДПОВІДНО до даного винаходу коклад, однієї одиничної дози один або два рази на рисні при лікуванні розладів, в яких медіатором є день, однієї одиничної дози з кожним прийомом циклооксигеназа-2, у коней, собак і кішок їжі, однієї одиничної дози через кожні чотири годиКомпозиції, що розглядаються, можна викорини або через ІНШІ інтервали або лише однієї одистовувати в комбінованих схемах лікування в поничної дози на день єднанні з опюїдами і іншими аналгетиками, в тому числі з наркотичними аналгетиками, антагоністами Термін "одиниця дозування" в даному описі ц-рецепторів, антагоністами к-рецепторів, ненарозначає порцію фармацевтичної композиції, що котичними (тобто такими, що не спричиняють звимістить одну одиничну дозу активного інгредієнта кання) аналгетиками, інгібіторами засвоєння моДля цілей даного винаходу одиниця дозування наміну, регулювальниками аденозину, похідними може бути оформлена як окремий виріб, наприканабшолу, антагоністами речовини Р, антагонісклад, таблетка або капсула, або являти собою тами рецепторів нейрокшіну-1, блокаторами натрівідміряний об'єм розчину, суспензії і т ш , що місєвого каналу і іншими Переважні комбіновані схетить одиничну дозу активного інгредієнта ми терапії включають застосування композиції Термін "для перорального прийому" в даному ВІДПОВІДНО до даного винаходу разом із сполуками, описі означає, що лікарська форма призначена вибраними з групи, що включає морфін, меперидля введення в травний тракт пацієнта через рот дин, кодеїн, пентазопин, бупренорфін, буторфаТермін "практично однорідний", вжитий в данол, дезоцин, мептазинол, гідрокодон, оксикодон, ному описі застосовно до фармацевтичної компометадон, препарати, ВІДОМІ ПІД позначеннями DuPзиції, що містить поєднання компонентів, означає, 747, Dynorphine A, Enadolme, RP-60180, HN-11608, що ці компоненти повністю перемішані, так що E-2078, ICI-204448, ацетамшофен (парацетамол), окремі компоненти не розділені на окремі шари і пропоксифен, нальбуфін, препарат Е-4018, філене утворюють градієнтів концентрації в композиції надол, мірфентаніл, амітриптилін, препарати DuPТермін "бюдоступність" в даному описі відно631, GP-531, акадезин, препарати АКІ-1, АКІ-2, GPситься до частки КІЛЬКОСТІ активного інгредієнта, 1683, GP-3269, 4030W92, трамадол-рацемат і його що надійшла, через травний тракт в кровоток пацііндивідуальні (+)- і (-)-енантюмери, препарати єнта Більш конкретно, термін "бюдоступність" АХС-3742, SNX-111, ADL2-1294, СТ-3 і СР-99994 вживається в даному описі для позначення величини AUCJO ш) для конкретної перорально введеної Визначення термінів композиції, вираженої в процентах від величини Термін "активний інгредієнт" в даному описі AUCJO ш) для активного інгредієнта, введеного внупри відсутності спеціальних вказівок означає цетрішньовенно в тій же дозі лекоксиб Термін "добавка" в даному описі охоплює Термін "відносна бюдоступність" в даному будь-яку речовину, що використовується як носій описі означає величину AUC(Om) для конкретної для введення активного інгредієнту в організм паперорально введеної композиції, виражену в процієнта, і будь-яку речовину, додану до активного центах від величини AUCJO ш) для активного інгреінгредієнту, наприклад, для поліпшення його техдієнта, введеного перорально в тій же дозі нологічних властивостей або для забезпечення Терміни "AUCJO 24)", "AUC(0 48)" і "AUC(o-72)" в даможливості формування готової композиції в одиному описі означають площу під кривою залежносницю дозування для перорального вживання, що ті концентрації в сироватці крові від часу за період має бажану форму і консистенцію Як приклади від 0 годин до 24 годин, 48 годин і 72 годин, ВІДПОдобавок, що не мають обмежувального значення, ВІДНО, з моменту прийому, визначену методом можна згадати розріджувачі, дезінтегратори, зв'ялінійної трапецеїдальної апроксимації і виражену в зувальні агенти, клеї, змочувальні агенти, змащуодиницях (нг/мл) х година вальні агенти, поліпшувачі ковзання (глайдери), Т е р м і н " A U C J O LQC)" в д а н о м у о п и с і о з н а ч а є речовини, що додаються з метою маскування або площу під кривою залежності концентрації в сироусунення неприємного запаху і смаку, віддушки, ватці крові від часу за період від 0 годин з моменту барвники, речовини, що додаються з метою поприйому до моменту останнього можливого КІЛЬКІліпшення зовнішнього вигляду лікарської форми, а СНОГО визначення концентрації ("LQC"), визначену також будь-які ІНШІ речовини, крім активного інгреметодом лінійної трапецеїдальної апроксимації і дієнта, що звичайно використовуються при приговиражену в одиницях (нг/мл) х година туванні лікарських форм для перорального вжиВеличина AUCJO ш в даному описі визначаєть) вання Термін "допоміжна лікарська речовина" ("ад'ю ся як AUCJO LQC)+LQC/(-b), де LQC - остання концентрація, що КІЛЬКІСНО визначається в сироватці 15 58576 крові, а В - нахил графіка, визначений при розрахунку Т-і/2, і виражена в одиницях (нг/мл) х година Термін "Стах" в даному описі означає максимальну концентрацію в сироватці крові, що спостерігається безпосередньо або розраховану чи оцінену по кривій концентрація-час і виражену в одиницях (нг/мл) Термін "Т т а х " в даному описі означає час з моменту ВВедеННЯ, ВІДПОВІДНИЙ ДОСЯГНеННЮ Стах, виражений в годинах (година) Термін "Ті/211 в даному описі означає кінцевий час напівжитгя активного інгредієнта в кров'яному руслі, визначений методом простої лінійної регресії натурального логарифма (In) концентрації по часу для експериментальних даних, що відносяться до кінцевої ДІЛЬНИЦІ кривої концентрація-час Значення Т-і/2 розраховують як -ln(2)/(-b) і виражають в годинах (година) Термін "швидкість поглинання" в даному описі означає величину Cmax/AUC(o LQCJ Дозування целекоксиба що забезпечується композиціями ВІДПОВІДНО до даного винаходу Фармацевтичні композиції ВІДПОВІДНО ДО даного винаходу придатні для прийому целекоксиба в добових дозах від приблизно Юмг до приблизно ЮООмг Кожна одиниця дозування композиції ВІДПОВІДНО до даного винаходу містить КІЛЬКІСТЬ целекоксиба, відповідну від приблизно 1/10 добових дози до повної добової дози Композиції ВІДПОВІДНО до даного винаходу, як правило, містять целекоксиб в КІЛЬКОСТІ від приблизно Юмг до приблизно ЮООмг, переважно від приблизно 50мг до приблизно 800мг, більш переважно від приблизно 75мг до приблизно 400мг, найбільш переважно від приблизно ЮОмг до приблизно 200мг на одиницю дозування Якщо одиниці дозування виконані в формі дискретних виробів, придатних для перорального прийому, наприклад, капсул або таблеток, то кожний такий виріб містить від приблизно Юмг до приблизно ЮООмг целекоксиба, переважно від приблизно 50мг до приблизно 800мг, більш переважно від приблизно 75мг до приблизно 400мг і найбільш переважно від приблизно ЮОмг до приблизно 200мг Одиниці дозування композицій ВІДПОВІДНО ДО даного винаходу містять в типовому випадку, наприклад, Юмг, 20мг, 25мг, 37,5мг, 50мг, 75мг, ЮОмг, 125мг, 150мг, 175мг, 200мг, 250мг, ЗООмг, 350мг або 400мг целекоксиба Перевага віддається композиціям, що містять в одиниці дозування приблизно ЮОмг або приблизно 200мг целекоксиба Конкретний тип одиниці дозування можна вибрати з урахуванням бажаної періодичності прийому, виходячи з необхідності забезпечення необхідної добової дози Добова доза і періодичність прийому, отже, вибір відповідної одиниці дозування, залежить від множини чинників, в тому числі від віку, маси тіла, статі і медичного стану пацієнта і від природи і ступеня важкості захворювання або розладу і, таким чином, може варіювати в широких межах Однак виявлено, що при одноразовому або дворазовому щоденному прийомі в дозуванні, що забезпечує необхідну добову дозу, целекоксиб в композиціях, представлених в даному описі, виявляє підвищену ефективність в порівнянні з іншими 16 режимами прийому ВІДПОВІДНО, перевага віддається одноразовому або дворазовому щоденному пероральному прийому композиції ВІДПОВІДНО ДО даного винаходу з метою терапевтично або профілактично ефективного інгібування розладів, при яких медіатором є циклооксигеназа-2 Лікування конкретних захворювань і розладів Фармацевтичні композиції ВІДПОВІДНО ДО даного винаходу корисні у випадках, коли показано введення в організм пацієнта інгібітору циклооксигенази-2 Виявлено, що ці композиції особливо ефективні при лікуванні, наприклад, ревматоїдних артритів і остеоартритів, полегшенні і знятті болів різного походження (зокрема, болів після операцій в порожнині рота, після хірургічних операцій загального характеру, після ортопедичних операцій і при гострих приступах остеоартриту), лікуванні хвороби Альцгеймера і ХІМІЧНІЙ профілактиці раку товстої кишки Для лікування ревматоїдного артриту композиції ВІДПОВІДНО до даного винаходу можна застосовувати в кількостях, що забезпечують добову дозу целекоксиба від приблизно 50мг до приблизно 1000мг, переважно від приблизно 10Омг до приблизно 600мг, більш переважно від приблизно 150мг до приблизно 500мг і, ще більш переважно, від приблизно 175мг до приблизно 400мг, наприклад, приблизно 200мг Як правило, при введенні в формі композицій ВІДПОВІДНО до даного винаходу достатньою є добова доза целекоксиба від приблизно 0,67мг/кг до приблизно 13,3мг/кг маси тіла, переважно від приблизно 1,33мг/кг до приблизно 8,00мг/кг маси тіла, більш переважно від приблизно 2,00мг/кг до приблизно 6,67мг/кг маси тіла і, ще більш переважно, від приблизно 2,33мг/кг до приблизно 5,33мг/кг маси тіла, наприклад, приблизно 2,67мг/кг маси тіла Добову дозу можна вводити у вигляді від однієї до чотирьох доз на добу, переважно у вигляді однієї або двох доз на добу Для більшості пацієнтів переважним є прийом композиції ВІДПОВІДНО до даного винаходу у вигляді однієї дози в ЮОмг ДВІЧІ на день, однак для деяких пацієнтів може виявитися доцільним прийом однієї дози в 200мг або двох доз по ЮОмг ДВІЧІ на день Для лікування остеоартриту композиції ВІДПОВІДНО до даного винаходу можна застосовувати в кількостях, що забезпечують добову дозу целекоксиба від приблизно 50мг до приблизно ЮООмг, переважно від приблизно ЮОмг до приблизно 600мг, більш переважно від приблизно 150мг до приблизно 500мг і, ще більш переважно, від приблизно 175мг до приблизно 400мг, наприклад, приблизно 200мг Як правило, при введенні в формі композицій ВІДПОВІДНО до даного винаходу достатньою є добова доза целекоксиба від приблизно 0,67мг/кг до приблизно 13,3мг/кг маси тіла, переважно від приблизно 1,33мг/кг до приблизно 8,00мг/кг маси тіла, більш переважно від приблизно 2,00мг/кг до приблизно 6,67мг/кг маси тіла і, ще більш переважно, від приблизно 2,33мг/кг до приблизно 5,33мг/кг маси тіла, наприклад, приблизно 2,67мг/кг маси тіла Добову дозу можна вводити у вигляді від однієї до чотирьох доз на добу, переважно у вигляді однієї або двох доз на добу Переважним є прийом композиції ВІДПОВІДНО до даного винаходу у вигляді однієї дози в ЮОмг ДВІЧІ на 18 17 58576 день або однієї дози в 200мг або двох доз по лекоксиба, що виходить за межі вказаних діапазоЮОмг один раз на день нів дозування Для лікування хвороби Альцгеймера композиПриготування целекоксиба ції ВІДПОВІДНО до даного винаходу можна застосоЦелекоксиб, що застосовується в нових фарвувати в кількостях, що забезпечують добову дозу мацевтичних композиціях ВІДПОВІДНО до даного целекоксиба від приблизно 50мг до приблизно винаходу, можна приготувати за способом, описаЮООмг, переважно від приблизно ЮОмг до приному Теллі і іншими (патент США №5,466,823) або близно 800мг, більш переважно від приблизно Чжі і іншими (Zhi et al , WO 96/37476) 150мг до приблизно 600мг і, ще більш переважно, Форми композицій ВІДПОВІДНО до винаходу від приблизно 175мг до приблизно 400мг, наприФармацевтичні композиції ВІДПОВІДНО ДО даноклад, приблизно 400мг Як правило, при введенні в го винаходу містять целекоксиб в поєднанні з одформі композицій ВІДПОВІДНО до даного винаходу ним або декількома переважно нетоксичними, фадостатньою є добова доза целекоксиба від прирмацевтично прийнятними носіями, добавками і близно 0,67мг/кг до приблизно 13,3мг/кг маси тіла, допоміжними лікарськими речовинами (званими в переважно від приблизно 1,33мг/кг до приблизно даному описі в сукупності "носіями" або "добавка10,67мг/кг маси тіла, більш переважно від приблими"), придатними для перорального вживання зно 2,00мг/кг до приблизно 8,00мг/кг маси тіла і, Носи повинні бути прийнятними з точки зору суміще більш переважно, від приблизно 2,33мг/кг до сності з іншими інгредієнтами композиції і не повиприблизно 5,33мг/кг маси тіла, наприклад, приблинні негативно впливати на пацієнта, що приймає зно 5,33мг/кг маси тіла Добову дозу можна вводикомпозицію Композиції ВІДПОВІДНО до даного винати у вигляді однієї-чотирьох доз на добу, переважходу можуть бути пристосовані до будь-якого прино у вигляді однієї або двох доз на добу Для бідатного способу перорального вживання шляхом льшості пацієнтів переважним є прийом композиції підбору ВІДПОВІДНИХ носіїв і дозування целекоксиВІДПОВІДНО до даного винаходу у вигляді однієї ба, ефективного для призначеного лікування ВІДдози в 200мг або двох доз по ЮОмг ДВІЧІ на день ПОВІДНО, можуть бути застосовані будь-які носи, які можуть являти собою тверді або рідкі речовини, Для лікування раку композиції ВІДПОВІДНО ДО або і ті і ІНШІ, і композиція переважно містить від даного винаходу можна застосовувати в кількосприблизно 1% до приблизно 95% (мас) целекоктях, що забезпечують добову дозу целекоксиба від сиба, переважно від приблизно 10% до приблизно приблизно 50мг до приблизно ЮООмг, переважно 90% (мас), більш переважно від приблизно 25% від приблизно ЮОмг до приблизно 800мг, більш до приблизно 85% (мас) і, ще більш переважно, переважно від приблизно 150мг до приблизно від приблизно 30% до приблизно 80% (мас) Такі 600мг і ще більш переважно від приблизно 175мг фармацевтичні композиції ВІДПОВІДНО ДО даного до приблизно 400мг, наприклад, приблизно 400мг винаходу можуть бути приготовані будь-яким з Як правило, при введенні в формі композицій ВІДдобре відомих в фармацевтичній практиці спосоПОВІДНО до даного винаходу достатньою є добова бів, що включають змішування компонентів доза целекоксиба від приблизно 0,67мг/кг до при близно 13,3мг/кг маси тіла, переважно від приблизно 1,33мг/кг до приблизно 10,67мг/кг маси тіла, більш переважно від приблизно 2,00мг/кг до приблизно 8,00мг/кг маси тіла і ще більш переважно від приблизно 2,33мг/кг до приблизно 5,33мг/кг маси тіла, наприклад, приблизно 5,33мг/кг маси тіла Добову дозу можна вводити у вигляді від однієї до чотирьох доз на добу, переважно у вигляді двох доз на добу Для більшості пацієнтів переважним є прийом композиції ВІДПОВІДНО до даного винаходу у вигляді однієї дози в 200мг або двох доз по ЮОмг ДВІЧІ на день Як правило, композицію ВІДПОВІДНО ДО даного винаходу переважно призначають в дозі, що забезпечує середню концентрацію целекоксиба в сироватці крові пацієнта за період 24 години після прийому не менш приблизно ЮОнг/мл Виявлено, що фармацевтичні композиції ВІДПОВІДНО до даного винаходу забезпечують терапевтичний ефект інгібування циклооксигенази-2 протягом від приблизно 12 годин до приблизно 24 годин після перорального прийому Композиції, яким віддається перевага, дають такий терапевтичний ефект протягом приблизно 24 годин, забезпечуючи тим самим можливість перорального прийому препарату один раз на добу Хоч КІЛЬКІСТЬ целекоксиба в нових композиціях ВІДПОВІДНО до даного винаходу переважно лежить в межах, вказаних в даному описі, композиції можуть бути корисні також для прийому КІЛЬКОСТІ це Композиція ВІДПОВІДНО ДО даного винаходу містить бажану КІЛЬКІСТЬ целекоксиба в одиниці дозування і може бути приготована в формі, наприклад, таблетки, драже, твердої або м'якої капсули, пастилки, саше, дозованого порошку, гранул, суспензії, еліксиру, рідини або в ІНШІЙ формі, пристосованій для перорального прийому Таку композицію переважно готують у вигляді дискретних одиниць дозування, кожна з яких містить задану КІЛЬКІСТЬ целекоксиба, наприклад, у вигляді таблеток або капсул Ці дозовані форми для перорального прийому можуть додатково містити, наприклад, буферні сполуки Крім того, таблетки, драже і т ш можуть бути приготовані з покриттям (оболонкою) або без нього До композицій ВІДПОВІДНО до даного винаходу, придатних для розсмоктування у роті або під язиком, відносяться, наприклад, пастилки, що містять целекоксиб в основі, що має приємний смак, наприклад, в сахарозі, і гуміарабік або трагант, і пастилки, що містять целекоксиб в інертній основі, наприклад, в желатині, і гліцерин або сахарозу і гуміарабік РІДКІ дозовані форми для перорального застосування включають фармацевтично прийнятні суспензії, сиропи і еліксири, що містять інертні розріджувачі, що звичайно застосовуються в даній галузі, наприклад, воду Такі композиції можуть містити також, наприклад, змочувальні агенти, емульгатори і суспендуючі агенти, а також підсо 20 19 58576 лоджуючі добавки і ароматизатори джувачів До придатних розріджувачів відносяться застосовувані окремо або в поєднаннях лактоза Як вказано вище, композиції ВІДПОВІДНО ДО даUSP (за фармакопеєю США), лактоза USP безвоного винаходу можна готувати будь-яким з відомих дна, лактоза USP розпилювальної сушки, крохв фармацевтичній практиці способів, що включає маль USP, крохмаль, що безпосередньо пресуєтьстадію приведення целекоксиба в поєднання з ся, маніт USP, сорбіт, декстрози моногідрат, мікроносієм або носіями Як правило, композиції готукристалічна целюлоза NF (за стандартом Франції"), ють шляхом рівномірного і ретельного змішування повторний кислий фосфат кальцію, дипдрат, NF, целекоксиба з рідким або тонко подрібненим тверрозріджувачі на основі сахарози, цукрова пудра, дим носієм, або з носіями обох видів, з подальшим первинний кислий фосфат кальцію, моногідрат, розфасовуванням в капсули або формуванням сульфат кальцію, дипдрат, NF, лактат кальцію, продукту у разі необхідності Наприклад, таблетки трипдрат, гранульований, NF, декстрати, NF (наможна готувати шляхом пресування або відливанприклад, Emdex), Celutab, декстроза (наприклад, ня порошкоподібного або гранульованого матеріаCerelose), інозит, пдролізовані тверді продукти з лу в поєднанні з однією або декількома добавкадробленого зерна, наприклад, Maltrons і Mor-Rex, ми Пресовані таблетки можна приготувати шляамілоза, Rexcel, порошкоподібна целюлоза (нахом пресування сипучої композиції, наприклад, приклад, Elcema), карбонат кальцію, гліцин, бенпорошку або гранул, що містить целекоксиб, нетоніт, полівшілпіролідон і ІНШІ Такі розріджувачі у обов'язково змішаний з одним або декількома разі їх присутності складають в сумі від приблизно зв'язуючими агентами, змащувальними агентами, 5% до приблизно 99%, переважно від приблизно інертними розріджувачами, змочувальними аген10% до приблизно 85% і більш переважно від притами і/або диспергаторами, з використанням ВІДблизно 20% до приблизно 80% від загальної маси ПОВІДНОГО обладнання Литі таблетки можна отрикомпозиції Вибрані розріджувач або розріджувачі мати шляхом відливання в форми порошкоподібпереважно мають ВІДПОВІДНІ властивості текучості ної сполуки, зволоженої інертним рідким розріджуі, у разі приготування таблеток, пресованість вачем, із застосуванням ВІДПОВІДНОГО обладнання Носи або добавки Як вказано вище, фармацевтичні композиції ВІДПОВІДНО до даного винаходу містять в одиниці дозування целекоксиб в терапевтично або профілактично ефективній КІЛЬКОСТІ в поєднанні з однією або декількома фармацевтично прийнятними добавками, придатними для перорального вживання Композиції ВІДПОВІДНО до даного винаходу переважно містять целекоксиб в бажаній КІЛЬКОСТІ, змішаний з однією або декількома добавками, вибраними з групи, що включає фармацевтично прийнятні розріджувачі, дезінтегратори, зв'язувальні клеї, змочувальні агенти, змащувальні агенти і протиприхоплюючі добавки Більш переважно такі композиції приготовані в таблетованій або капсульованій формі, зручній для прийому як капсули або таблетки з негайним виділенням активного інгредієнта Шляхом підбору і поєднання добавок, що використовується в складі фармацевтичних композицій, ВІДПОВІДНО до даного винаходу можна отримати композиції, що мають поліпшену якість у відношенні, наприклад, ефективності, бюдоступності, запізнення дії, стабільності, сумісності целекоксиба з добавками, безпеки, профілю розчинення, профілю дезінтеграції і/або інших фармакокшетичних, ХІМІЧНИХ і/або фізичних характеристик, а також інших властивостей Носи або добавки переважно є водорозчинними або здатними диспергувати у воді і мають змочувальну здатність з метою компенсації низької розчинності целекоксиба у воді і його гідрофобності Якщо композиція виконана у виді таблетки, то поєднання вибраних добавок забезпечує отримання таблетки, що має поліпшені характеристики профілів розчинності і дезінтеграції, МІЦНОСТІ, МІЦНОСТІ на роздавлення і/або лам кість і т д Розріджувачі Фармацевтичні композиції ВІДПОВІДНО ДО даного винаходу містять як необов'язкові добавки один або декілька фармацевтично прийнятних розрі Переважними розріджувачами є лактоза і мікрокристалічна целюлоза в чистому вигляді або в поєднанні один з одним Обидва розріджувача ХІМІЧНО сумісні з целекоксибом 3 метою підвищення МІЦНОСТІ (для таблеток) і/або часу дезінтеграції можна використати постгрануляційне введення мікрокристалічної целюлози (тобто додання мікрокристалічної целюлози до гранульованої вологим способом композиції після м висушування) Особлива перевага віддається лактозі, особливо моногідрату лактози Лактоза, як правило, забезпечує отримання фармацевтичних композицій, що мають сприятливі характеристики швидкості виділення целекоксиба, стабільності, текучості до пресування і/або швидкості сушіння при відносно низькій вартості розріджувача Вона забезпечує отримання субстрату високої густини, що сприяє підвищенню густини в процесі гранулювання (у разі застосування вологого способу гранулювання) і, таким чином, поліпшення текучості суміші Дезінтегратори Фармацевтичні композиції ВІДПОВІДНО ДО даного винаходу, зокрема, для таблетованих лікарських форм, містять як необов'язкові добавки один або декілька фармацевтично прийнятних дезінтеграторів До придатних дезінтеграторів відносяться застосовувані окремо або в поєднаннях крохмаль, натрієва сіль гліколяту крохмалю, глини (наприклад, Veegum HV), целюлоза (наприклад, очищена целюлоза, метилцелюлоза, натрієва сіль карбоксиметилцелюлози, карбоксиметилцелюлоза), альгінати, заздалегідь желатинізовані кукурудзяні крохмалі (наприклад, National 1551 і National 1550), кросповідон USP, NF, і смоли (наприклад, агар, гуар, плоди ріжкового дерева, Кагауа, пектин і трагант) Дезінтегратори можна вводити на будь-якій ВІДПОВІДНІЙ стадії процесу приготування фармацевтичної композиції, особливо до гранулювання або на стадії введення змащувальних агентів перед пресуванням Такі дезінтегратори у разі їх присутності складають в сумі від приблизно 0,2% до при 22 21 58576 близно 30%, переважно від приблизно 0,2% до Змочувальні агенти приблизно 10% і більш переважно від приблизно Целекоксиб дуже погано розчиняється у вод0,2% до приблизно 5% від загальної маси компоних розчинах ВІДПОВІДНО, фармацевтичні композиції зиції ВІДПОВІДНО до даного винаходу містять як необов'язкові, але бажані добавки один або декілька Переважним дезінтегратором для руйнування фармацевтично прийнятних змочувальних агентів таблеток або капсул є натрієва сіль кроскармелоТакі змочувальні агенти переважно вибирають зи, яка у разі и використання складає переважно таким чином, щоб забезпечити тісний контакт цевід приблизно 0,2% до приблизно 10%, більш пелекоксиба з водою Вважається, що у цьому разі реважно від приблизно 0,2% до приблизно 6% і, відносна бюдоступність фармацевтичної композище більш переважно, від приблизно 0,2% до приції підвищується До придатних змочувальних агеблизно 5% від загальної маси композиції Натрієва нтів відносяться застосовувані окремо або в поєдсіль кроскармелози забезпечує високу здатність наннях олеїнова кислота, моностеарат гліцерину, до руйнування гранул композицій ВІДПОВІДНО ДО моноолеат сорбіту, монолаурат сорбіту, олеат даного винаходу триетаноламшу, полюксіетиленмоноолеат сорбіту, Зв'язувальні агенти і клеї полюксіетиленмонолаурат сорбіту, олеат натрію і Фармацевтичні композиції ВІДПОВІДНО ДО данолаурилсульфат натрію Перевага віддається змого винаходу, зокрема, для таблетованих лікарсьчувальним агентам, які являють собою аніонні ких форм, містять як необов'язкові добавки один поверхнево-активні речовини Такі змочувальні або декілька фармацевтично прийнятних зв'язуагенти у разі їх присутності складають в сумі від вальних агентів або клеїв Такі зв'язувальні агенти приблизно 0,25% до приблизно 15%, переважно і клеї переважно налають таблетованому порошку від приблизно 0,4% до приблизно 10% і, більш достатню міру когезії для забезпечення нормальпереважно, від приблизно 0,5% до приблизно 5% ного протікання операцій переробки, наприклад, від загальної маси композиції розсівання, змазування, пресування і упаковки, але при цьому ще не перешкоджають руйнуванню Переважним змочувальним агентом є лаурилтаблетки і всмоктуванню композиції в організмі До сульфат натрію У разі його застосування лаурилпридатних зв'язувальних агентів і клеїв відносятьсульфат натрію складає переважно від приблизно ся застосовувані окремо або в поєднаннях гуміа0,25% до приблизно 7%, більш переважно від прирабік, трагант, сахароза, желатин, глюкоза, крохблизно 0,4% до приблизно 6% і, ще більш перевамаль, ПОХІДНІ целюлози, наприклад (але не тільки), жно, від приблизно 0,5% до приблизно 5% від заметилцелюлоза і натрієва сіль карбоксиметилцегальної маси композиції люлози (наприклад, Tylose), альпнова кислота і її Змащувальні агенти солі, алюмосилікат магнію, поліетиленгліколь, гуФармацевтичні композиції ВІДПОВІДНО ДО даноар, кислоти - ПОХІДНІ полісахаридів, бентоніти, пого винаходу містять як необов'язкові добавки один лівшілпіролідон, поліметакрилати, пдроксипропілабо декілька фармацевтично прийнятних змащуметилцелюлоза (ГПМЦ), гідроксипропілцелюлоза вальних агентів і/або добавок, поліпшуючих ков(Klucel), етилцелюлоза (Ethocel), заздалегідь жезання ("глайдерів") До придатних змащувальних латинізовані крохмалі (наприклад, National 1511 і і/або поліпшуючих ковзання добавок відносяться Starch 1500) Такі зв'язувальні агенти і/або клеї у застосовувані окремо або в поєднаннях бегапат разі їх присутності складають в сумі від приблизно гліцерину (Compntol 888), стеарати (магнію, каль0,5% до приблизно 25%, переважно від приблизно цію і натрію), стеаринова кислота, пдрогенізовані 0,75% до приблизно 15% і, більш переважно, від рослинні масла (наприклад, Sterotex), тальк, віск, приблизно 1% до приблизно 10% від загальної препарат Stearowet, борна кислота, бензоат намаси композиції трію, ацетат натрію, фумарат натрію, хлорид натрію, DL-лейцин, поліетиленгліколі (наприклад, Переважним зв'язувальним агентом викорисCarbowax 4000 і Carbowax 6000), олеат натрію, товується для надання когезійних властивостей лаурилсульфат натрію, і лаурилсульфат магнію порошкоподібній суміші целекоксиба з іншими інгТакі змащувальні агенти у разі їх присутності редієнтами, призначеній для гранулювання лікарскладають в сумі від приблизно 0,1% до приблизської форми целекоксиба, є полівшілпіролідон У но 10%, переважно від приблизно 0,2% до приблиразі його присутності в композиції полівшілпіролізно 8% і, більш переважно, від приблизно 0,25% дон складає переважно від приблизно 0,5% до до приблизно 5% від загальної маси композиції приблизно 10%, більш переважно від приблизно 0,5% до приблизно 7% і, ще більш переважно, від Переважним змащувальним агентом є стеарат приблизно 0,5% до приблизно 5% від загальної магнію, що застосовується, наприклад, для знимаси композиції Можна використовувати ПОЛІВІНІження тертя між штампом і гранульованою сумішлпіролідон з в'язкістю ДО 20СПЗ, ХОЧ перевага відшю в процесі пресування таблетованих лікарських дається значенням в'язкості ВІД приблизно бсПз і форм менш, особливо від приблизно ЗсПз і менш ПоліУ фармацевтичній практиці ВІДОМІ ІНШІ добавки вшілпіролідон надає когезійні властивості порош(наприклад, протиприхоплюючі агенти, барвники, коподібній суміші і сприяє скріпленню частинок віддушки, підсолоджуючі добавки і консерванти), суміші в гранули в процесі вологого гранулювання які можна включати до складу композицій ВІДПОВІКрім того, виявлено, що композиції ВІДПОВІДНО до ДНО до даного винаходу Наприклад, для надання даного винаходу, що містять полівшілпіролідон, жовтого забарвлення в композицію можна ввести зокрема, композиції, отримані із застосуванням оксид заліза вологого гранулювання, мають підвищену бюдосКапсули і таблетки тупність в порівнянні з іншими композиціями Згідно З ОДНИМ З варіантів здійснення даного 24 23 58576 винаходу, фармацевтична композиція виготовлена (c) від приблизно 0,5 мг до приблизно 25 мг в формі капсул або таблеток, що містять одиничні натрієвої солі кроскармелози, і дози, і містить целекоксиб в бажаній КІЛЬКОСТІ І (d) від приблизно 0,5мг до приблизно 25мг позв'язувальні агенти Крім того, композиція перевалівшілпіролідону жно містить одну або декілька добавок, вибраних з Крім того, ця фармацевтична композиція місгрупи, що включає фармацевтично прийнятні розтить як необов'язкові добавки ріджувачі, дезінтегратори, зв'язувальні, змочува(є) від приблизно 0,5мг до приблизно 25мг лальні агенти і змащувальні агенти Більш переважурилсульфату натрію, но, композиція містить одну або декілька добавок, (f) від приблизно 0,2мг до приблизно Юмг стевибраних з групи, що містить лактозу, лаурилсуарату магнію, і/або льфат натрію, полівшілпіролідон, натрієву сіль (д) ВІД приблизно 1мг до приблизно 70мг міккроскармелози, стеарат магнію і мікрокристалічну рокристалічної целюлози целюлозу Ще більш переважно композиція місЗгідно З подальшим варіантом здійснення витить моногідрат лактози і натрієву сіль кроскарменаходу, фармацевтична композиція містить лози У ще більш переважному варіанті композиція (a) від приблизно 25% (мас) до приблизно містить, крім того, одну або декілька з таких доба85% (мас) целекоксиба, вок лаурилсульфат натрію, стеарат магнію і мік(b) від приблизно 5% (мас) до приблизно 70% рокристалічну целюлозу (мас) лактози, Згідно З ІНШИМ варіантом здійснення винаходу, (c) від приблизно 0,2% (мас) до приблизно 5% фармацевтична композиція містить (мас) натрієвої солі кроскармелози, і (a) від приблизно 1% (мас) до приблизно 95% (d) від приблизно 0,5% (мас ) до приблизно 7% (мас) целекоксиба, (мас) полівінілпіролідону (b) від приблизно 5% (мас) до приблизно 99% Крім того, ця фармацевтична композиція міс(мас ) фармацевтично прийнятного розріджувача, тить як необов'язкові добавки (c) від приблизно 0,5% (мас) до приблизно (є) від приблизно 0,4% (мас ) до приблизно 6% 30% (мас) фармацевтично прийнятного дезінтег(мас ) л аури л сульфату натрію, ратора, (f) від приблизно 0,2% (мас) до приблизно 8% (d) від приблизно 0,5% (мас) до приблизно (мас ) стеарату магнію, і/або 25% (мас) фармацевтично прийнятного зв'язува(д) ВІД приблизно 0,1% (мас) до приблизно льного агента 15% (мас) мікрокристалічної целюлози Крім того, ця фармацевтична композиція місКомпозицію ВІДПОВІДНО ДО ЦЬОГО варіанту петить, як необов'язкові добавки реважно готують в формі одиниць дозування у вигляді капсул (є) від приблизно 0,25% (мас) до приблизно 15% (мас) фармацевтично прийнятного змочуваЗгідно З нижчевказаним варіантом здійснення льного агента, і/або винаходу, фармацевтична композиція містить (f) від приблизно 0,1% (мас) до приблизно (a) від приблизно 27% (мас) до приблизно 10% (мас) фармацевтично прийнятного змащува47% (мас) целекоксиба, льного агента (b) від приблизно 45% (мас) до приблизно 65% (мас) лактози, Термін "% (мас )" в цьому випадку означає частку (в процентах) вказаного інгредієнта по відно(c) від приблизно 0,5% (мас) до приблизно 5% шенню до сумарної маси всіх інгредієнтів компо(мас) натрієвої солі кроскармелози, і зиції (d) від приблизно 0,5% (мас ) до приблизно 5% (мас) полівінілпіролідону Згідно З ще одним варіантом здійснення винаходу, фармацевтична композиція містить Крім того, ця фармацевтична композиція містить як необов'язкові добавки (a) від приблизно 1% (мас) до приблизно 95% (мас) целекоксиба, (є) від приблизно 0,25% (мас) до приблизно 7% (мас ) л аури л сульфату натрію, і/або (b) від приблизно 5% (мас) до приблизно 99% (мас) лактози, (f) від приблизно 0,25% (мас) до приблизно 5% (мас ) стеарату магнію (c) від приблизно 2% (мас) до приблизно 6% (мас) натрієвої солі кроскармелози, і Композицію ВІДПОВІДНО ДО ЦЬОГО варіанту переважно готують в формі одиниць дозування у (d) від приблизно 0,5% (мас) до приблизно вигляді капсул У цьому варіанті фармацевтична 10% (мас) полівінілпіролідону композиція переважно містить Крім того, ця фармацевтична композиція містить як необов'язкові добавки (a) від приблизно 32% (мас) до приблизно 42% (мас) целекоксиба, (є) від приблизно 0,25% (мас) до приблизно 7% (мас ) л аури л сульфату натрію, (b) від приблизно 50% (мас) до приблизно 60% (мас) лактози, (f) від приблизно 0,1% (мас) до приблизно 10% (мас ) стеарату магнію, і/або (c) від приблизно 0,5% (мас) до приблизно 3% (мас) натрієвої солі кроскармелози, і (д) ВІД приблизно 1% (мас) до приблизно 99% (мас) мікрокристалічної целюлози (d) від приблизно 1% (мас) до приблизно 5% (мас) полівінілпіролідону Згідно З ще одним варіантом здійснення винаходу, фармацевтична композиція містить Крім того, ця фармацевтична композиція містить як необов'язкові добавки (a) від приблизно 80мг до приблизно 220мг целекоксиба, (є) від приблизно 0,4% (мас ) до приблизно 6% (мас ) л аури л сульфату натрію, і/або (b) від приблизно ЗОмг до приблизно 225мг лактози, (f) від приблизно 0,5% (мас) до приблизно 3% 25 (мас) стеарату магнію У цьому варіанті фармацевтична композиція більш переважно містить (a) від приблизно 35% ( м а с ) до приблизно 39% ( м а с ) целекоксиба, (b) від приблизно 54% ( м а с ) до приблизно 57% (мас) лактози, (c) від приблизно 0,5% (мас) до приблизно 2% (мас) натрієвої солі кроскармелози, і (d) від приблизно 1,5% ( м а с ) до приблизно 4,5% ( м а с ) полівшілпіролідону Крім того, ця фармацевтична композиція містить як необов'язкові добавки (є) від приблизно 2% ( м а с ) до приблизно 4 % (мас ) л аури л сульфату натрію, і/або (f) від приблизно 0,5% ( м а с ) до приблизно 2% (мас) стеарату магнію Згідно З ще одним варіантом здійснення винаходу, фармацевтична композиція містить (a) від приблизно 65% ( м а с ) до приблизно 85% ( м а с ) целекоксиба, (b) від приблизно 8% ( м а с ) до приблизно 28% (мас) лактози, (c) від приблизно 0,5% (мас) до приблизно 5% (мас) натрієвої солі кроскармелози, і (d) від приблизно 0,5% (мас ) до приблизно 5% (мас) полівінілпіролідону Крім того, ця фармацевтична композиція містить як необов'язкові добавки (є) від приблизно 0,25% ( м а с ) до приблизно 7% (мас ) л аури л сульфату натрію, і/або (f) від приблизно 0,25% ( м а с ) до приблизно 5% (мас ) стеарату магнію Композицію ВІДПОВІДНО ДО ЦЬОГО варіанту пе реважно готують в формі одиниць дозування у вигляді капсул У цьому варіанті фармацевтична композиція переважно містить (a) від приблизно 69% ( м а с ) до приблизно 79% ( м а с ) целекоксиба, (b) від приблизно 13,5% ( м а с ) до приблизно 23,5% (мас) лактози, (c) від приблизно 0,5% (мас) до приблизно 3% (мас) натрієвої солі кроскармелози, і (d) від приблизно 1 % ( м а с ) до приблизно 5% (мас) полівінілпіролідону Крім того, ця фармацевтична композиція містить як необов'язкові добавки (є) від приблизно 0,4% (мас ) до приблизно 6% (мас ) л аури л сульфату натрію, і/або (f) від приблизно 0,5% ( м а с ) до приблизно 3% (мас) стеарату магнію У цьому варіанті фармацевтична композиція більш переважно містить (a) від приблизно 72% ( м а с ) до приблизно 76% ( м а с ) целекоксиба, (b) від приблизно 16,5% ( м а с ) до приблизно 20,5% (мас) лактози, (c) від приблизно 0,5% (мас) до приблизно 2% (мас) натрієвої солі кроскармелози, і (d) від приблизно 1,5% ( м а с ) до приблизно 4,5% ( м а с ) полівінілпіролідону Крім того, ця фармацевтична композиція містить як необов'язкові добавки (є) від приблизно 2% ( м а с ) до приблизно 4 % (мас ) л аури л сульфату натрію, і/або (f) від приблизно 0,5% ( м а с ) до приблизно 2% 58576 26 (мас) стеарату магнію Згідно З подальшим варіантом здійснення винаходу, фармацевтична композиція містить (a) від приблизно 30% ( м а с ) до приблизно 50% ( м а с ) целекоксиба, (b) від приблизно 30% ( м а с ) до приблизно 50% (мас) лактози, (c) від приблизно 0,5% (мас) до приблизно 6% (мас) натрієвої солі кроскармелози,і (d) від приблизно 0,5% (мас ) до приблизно 5% (мас) полівінілпіролідону Крім того, ця фармацевтична композиція містить як необов'язкові добавки (є) від приблизно 1 % ( м а с ) до приблизно 2 0 % (мас) мікрокристалічної целюлози, (f) від приблизно 0,25% ( м а с ) до приблизно 7% (мас ) л аури л сульфату натрію, і/або (д) ВІД приблизно 0,25% ( м а с ) до приблизно 5% (мас ) стеарату магнію Композицію ВІДПОВІДНО ДО ЦЬОГО варіанту пе реважно готують в формі одиниць дозування у вигляді таблеток У цьому варіанті фармацевтична композиція переважно містить (a) від приблизно 35% ( м а с ) до приблизно 45% ( м а с ) целекоксиба, (b) від приблизно 35% ( м а с ) до приблизно 45% (мас) лактози, (c) від приблизно 1 % ( м а с ) до приблизно 5% (мас) натрієвої солі кроскармелози, і (d) від приблизно 1 % ( м а с ) до приблизно 5% (мас) полівінілпіролідону Крім того, ця фармацевтична композиція містить як необов'язкові добавки (є) від приблизно 5% ( м а с ) до приблизно 15% (мас) мікрокристалічної целюлози, (f) від приблизно 0,4% ( м а с ) до приблизно 6% (мас ) л аури л сульфату натрію, і/або (д) ВІД приблизно 0,5% (мас ) до приблизно 3% (мас) стеарату магнію У цьому варіанті фармацевтична композиція більш переважно містить (a) від приблизно 38% ( м а с ) до приблизно 42% ( м а с ) целекоксиба, (b) від приблизно 38% ( м а с ) до приблизно 42% (мас) лактози, (c) від приблизно 1,5% ( м а с ) до приблизно 4,5% ( м а с ) натрієвої солі кроскармелози, і (d) від приблизно 1,5% ( м а с ) до приблизно 4,5% ( м а с ) полівінілпіролідону Крім того, ця фармацевтична композиція містить як необов'язкові добавки (є) від приблизно 8% ( м а с ) до приблизно 12% (мас) мікрокристалічної целюлози, (f) від приблизно 2% ( м а с ) до приблизно 4 % (мас ) л аури л сульфату натрію, і/або (д) ВІД приблизно 0,5% (мас ) до приблизно 2% (мас) стеарату магнію Згідно З нижченаведеним варіантом здійснення винаходу, фармацевтична композиція містить (a) від приблизно 95мг до приблизно 105мг целекоксиба, (b) від приблизно 145мг до приблизно 155мг моногідрату лактози, (c) від приблизно 0,5мг до приблизно 8мг натрієвої солі кроскармелози, і (d) від приблизно 2мг до приблизно 12мг полі 27 58576 28 вшілпіролідону трієвої солі кроскармелози, і Крім того, ця фармацевтична композиція міс(d) від приблизно 0,5мг до приблизно 11 мг потить як необов'язкові добавки лівшілпіролідону (є) від приблизно Змг до приблизно 13мг лауКрім того, ця фармацевтична композиція місрилсульфату натрію, і/або тить як необов'язкові добавки (f) від приблизно 0,5мг до приблизно 8мг стеа(є) від приблизно 20мг до приблизно ЗОмг мікрату магнію рокристалічної целюлози, Композицію ВІДПОВІДНО ДО ЦЬОГО варіанту пе(f) від приблизно Змг до приблизно 13мг лауреважно готують в форм, одиниць дозування у рилсульфату натрію, і/або вигляді капсул У цьому варіанті фармацевтична (д) ВІД приблизно 0,5мг до приблизно 7мг стекомпозиція переважно містить арату магнію (a) від приблизно 98мг до приблизно 102мг Композицію ВІДПОВІДНО ДО ЦЬОГО варіанту пецелекоксиба, реважно готують в формі одиниць дозування у вигляді таблеток У цьому варіанті фармацевтична (b) від приблизно 148мг до приблизно 152мг композиція переважно містить моногідрату лактози, (c) від приблизно 1,5мг до приблизно 4,5мг на(a) від приблизно 98мг до приблизно 102мг трієвої солі кроскармелози, і целекоксиба, (d) від приблизно 4,5мг до приблизно 8,5мг (b) від приблизно ЮОмг до приблизно 104мг полівшілпіролідону моногідрату лактози, Крім того, ця фармацевтична композиція міс(c) від приблизно 5мг до приблизно Юмг натить як необов'язкові добавки трієвої солі кроскармелози, і (є) від приблизно бмг до приблизно Юмг лау(d) від приблизно 4мгдо приблизно 8,5мг полірилсульфату натрію, і/або вшілпіролідону (f) від приблизно 1мг до приблизно 5мг стеаКрім того, ця фармацевтична композиція місрату магнію тить як необов'язкові добавки Згідно З нижчевказаним варіантом здійснення (є) від приблизно 23мг до приблизно 27мг міквинаходу, фармацевтична композиція містить рокристалічної целюлози, (a) від приблизно 195мг до приблизно 205мг (f) від приблизно 5мг до приблизно Юмг лауцелекоксиба, рилсульфату натрію, і/або (b) від приблизно 45мг до приблизно 55мг мо(д) ВІД приблизно 0,5мг до приблизно 4мг стеногідрату лактози, арату магнію (c) від приблизно 0,5мг до приблизно 8мг наЗгідно З подальшим варіантом здійснення витрієвої солі кроскармелози, і находу, фармацевтична композиція містить (d) від приблизно 2мг до приблизно 12мг полі(a) від приблизно 195мг до приблизно 205мг вшілпіролідону целекоксиба, Крім того, ця фармацевтична композиція міс(b) від приблизно 199мг до приблизно 209мг тить як необов'язкові добавки моногідрату лактози, (є) від приблизно Змг до приблизно 13мг лау(c) від приблизно Юмг до приблизно 20мг нарил сульфату натрію, і/або трієвої солі кроскармелози, і (f) від приблизно 0,5мг до приблизно 8мг стеа(d) від приблизно 7,5мг до приблизно 17,5мг рату магнію полівшілпіролідону Композицію ВІДПОВІДНО ДО ЦЬОГО варіанту пеКрім того, ця фармацевтична композиція місреважно готують в формі одиниць дозування у тить як необов'язкові добавки вигляді капсул У цьому варіанті фармацевтична (є) від приблизно 45мг до приблизно 55мг міккомпозиція переважно містить рокристалічної целюлози, (a) від приблизно 198мг до приблизно 202мг (f) від приблизно Юмг до приблизно 20мг лауцелекоксиба, рилсульфату натрію, і/або (b) від приблизно 48мг до приблизно 52мг мо(д) ВІД приблизно 0,5мг до приблизно 9мг стеногідрату лактози, арату магнію (c) від приблизно 1,5мг до приблизно 4,5мг наКомпозицію ВІДПОВІДНО ДО ЦЬОГО варіанту петрієвої солі кроскармелози, і реважно готують в формі одиниць дозування у вигляді таблеток У цьому варіанті фармацевтична (d) від приблизно 4,5мг до приблизно 8,5мг композиція переважно містить полівшілпіролідону Крім того, ця фармацевтична композиція міс(a) від приблизно 98мг до приблизно 102мг тить як необов'язкові добавки целекоксиба, (є) від приблизно бмг до приблизно Юмг лау(b) від приблизно 202мг до приблизно 206мг рилсульфату натрію, і/або моногідрату лактози, (f) від приблизно 1мг до приблизно 5мг стеа(c) від приблизно 13мг до приблизно 17мг нарату магнію Згідно з ще одним варіантом здійстрієвої солі кроскармелози, і нення винаходу, фармацевтична композиція міс(d) від приблизно 10,5мг до приблизно 14,5мг тить полівшілпіролідону (a) від приблизно 95мг до приблизно 105мг Крім того, ця фармацевтична композиція місцелекоксиба, тить як необов'язкові добавки (b) від приблизно 92мг до приблизно 112мг (є) від приблизно 48мг до приблизно 52мг мікмоногідрату лактози, рокристалічної целюлози, (c) від приблизно 2мг до приблизно 13мг на(f) від приблизно 1мг до приблизно 17мг лау ЗО 29 58576 рилсульфату натрію, і/або Профілі дезінтеграції капсул і таблеток (g) від приблизно 2мг до приблизно бмг стеаДобавки для приготування капсульованих і рату магнію таблетованих композицій негайного виділення ВІДПОВІДНО до даного винаходу переважно вибиВеличина частинок целекоксиба в капсулах і рають таким чином, щоб забезпечити час дезінтетаблетках грації менш приблизно ЗОхв , переважно менше за Виявлено, що зменшення величини частинок 25хв , більш переважно менш приблизно 20хв і, целекоксиба сприяє підвищенню бюдоступності ще більш переважно, менш приблизно 15хв целекоксиба при пероральному вживанні його в формі капсул або таблеток ВІДПОВІДНО, величина МІЦНІСТЬ частинок целекоксиба, виражена через Dgo, переДля приготування таблетованих лікарських важно не перевищує приблизно 200мкм, більш форм готову суміш в КІЛЬКОСТІ, достатній для припереважно вона не перевищує приблизно ЮОмкм, готування однорідної партії таблеток, піддають ще більш переважно не перевищує приблизно таблетуванню, використовуючи звичайний проми75мкм, ще більш переважно не перевищує присловий таблет-прес із звичайним тиском пресублизно 40мкм і найбільш переважно становить вання (наприклад, з прикладанням зусилля від менш приблизно 25мкм Наприклад, як вказано в приблизно 1кН до приблизно 50кН при застосуПрикладі 11, зменшуючи значення Dgo частинок ванні типових прес-форм для таблетування) Припочаткового целекоксиба з приблизно бОмкм до пустима будь-яка МІЦНІСТЬ таблеток, що не ускладприблизно ЗОмкм, можна істотно підвищити бюдоняє операції поводження з ними, приготування, ступність композиції Крім того, або як альтернатизберігання і прийому Для таблеток 100мг МІЦНІСТЬ ва, целекоксиб переважно має середню величину складає переважно не менше за 4кгс (40Н), більш частинок в межах від приблизно 1мкм до приблизпереважно не менш приблизно 5кгс (50Н) і ще но Юмкм, переважно від приблизно 5мкм до прибільш переважно не менш приблизно бкгс (60Н) близно 7мкм Для таблеток 200мг МІЦНІСТЬ складає переважно не менше за 7кгс (70Н), більш переважно не менш Величина вторинних частинок, що утворюютьприблизно 9кгс (90Н) і ще більш переважно не ся при гранулюванні, і характеристики сипучості менш приблизно 11кгс (110Н) Однак суміш не Хоч фармацевтичні композиції ВІДПОВІДНО ДО треба згущати до такої міри, яка надалі перешкоданого винаходу можна готувати, наприклад, шляджала б просоченню таблетки шлунковим соком хом прямого капсулювання або прямого пресування, переважно їх піддають вологому гранулюванЛамкість ню перед капсулюванням або пресуванням ВолоДля таблетованих лікарських форм ламкість ге гранулювання, нарівні з іншими ефектами, припри випробуваннях по стандартній методиці переводить до підвищення густини подрібнених комповажно не перевищує приблизно 1,0%, більш перезицій, внаслідок чого поліпшуються характеристиважно не перевищує приблизно 0,8% і ще більш ки сипучості, підвищується пресованість і спрощупереважно не перевищує приблизно 0,5% ється об'ємне або масове дозування композицій Спосіб лікування для капсулювання або пресування Величина поПредметом даного винаходу є також терапеввторних частинок, отриманих шляхом гранулютичний спосіб лікування захворювання або розлавання (тобто величина гранул), не має особливо ду, при якому показано лікування інгібітором цикважливого значення, важливо лише, щоб середня лооксигенази-2, спосіб включає пероральний привеличина гранул забезпечувала зручність повойом пацієнтом, що потребує такого лікування, фадження з композиціями і їх переробки, а також, у рмацевтичної композиції ВІДПОВІДНО до даного разі таблеток, можливість приготування суміші для винаходу Режими дозування, призначені для прямого пресування, утворюючої фармацевтично профілактики, полегшення або вилікування згадаприйнятні таблетки ного захворювання або розладу, переважно відповідають прийому композицій, розглянутих вище, Бажані значення насипної і об'ємної густини один або два рази на день, але можуть бути відкогранул лежать, як правило, в межах від приблизно риговані з урахуванням різних чинників До таких 0,Зг/мл до 1,0г/мл чинників відносяться тип, вік, маса тіла, стать, дієПрофілі виділення для капсул і таблеток та і загальний стан здоров'я пацієнта, а також приКапсульовані і таблетовані композиції ВІДПОВІрода і міра важкості розладу Таким чином, реальДНО до даного винаходу являють собою переважний режим дозування може змінюватися в широно композиції для негайного виділення активного ких межах і тому відхилятися від вищезгаданих інгредієнта, які, згідно з результатами вимірювань переважних режимів in vitro, виділяють не менш приблизно 50% целекоксиба протягом приблизно 45хв після прийому Лікування пацієнта, страждаючого захворюБільш переважно вони виділяють не менш приванням або розладом, при якому показано лікублизно 60% целекоксиба протягом приблизно вання інгібітором циклооксигенази-2, можна почи45хв після прийому Ще більш переважно вони нати з дозування, вказаного вище Як правило, у виділяють не менш приблизно 75% целекоксиба разі необхідності лікування продовжують протягом протягом приблизно 45хв після прийому періоду від декількох тижнів до декількох МІСЯЦІВ або років, до пригнічення або лікування захворюКапсульовані і таблетовані композиції, яким вання або розладу Стан пацієнтів, що піддаються віддається особлива перевага, виділяють не менш лікуванню композицією ВІДПОВІДНО ДО даного винаприблизно 50% целекоксиба протягом приблизно ходу, можна систематично контролювати будь15хв після прийому і/або не менш приблизно 60% яким відомим способом з метою визначення ефекцелекоксиба протягом приблизно ЗОхв після притивності терапії Безперервний аналіз отриманих йому 32 31 58576 даних дозволяє коректувати режим лікування з агентами, а також необов'язково з одним або декіметою забезпечення прийому оптимальних ефеклькома змочувальними агентами на цій стадії противних кількостей целекоксиба в будь-який момент цесу, хоч в альтернативних способах одну або часу, таким чином можна також визначити тривадекілька добавок можна вводити на більш ПІЗНІЙ лість лікування Таким способом можна раціонастадії Наприклад, при приготуванні композицій льно модифікувати режим лікування і дозування для таблетування, в яких як дезінтегратор застопротягом всього курсу лікування так, щоб забезпесована натрієва сіль кроскармелози, виявлено, що чити прийом мінімальної КІЛЬКОСТІ целекоксиба, що додання частини натрієвої солі кроскармелози на дає задовільну ефективність, і тривалість прийому стадії змішування (для введення "внутрішньогратільки протягом періоду, необхідного для успішнонульної" натрієвої солі кроскармелози) і іншої часго лікування захворювання або розладу тини після стадії сушіння, описаної нижче (для введення "позагранульної" натрієвої солі кроскарСпособи приготування композицій целекоксимелози), може сприяти поліпшенню характеристик ба дезінтеграції отриманих таблеток У цьому випадПредметом даного винаходу є також способи ку переважно від приблизно 60% до приблизно приготування фармацевтичних композицій, що 75% натрієвої солі кроскармелози вводять у вимістять целекоксиб Зокрема, предметом винаходу гляді "внутрішньогранульної" добавки, а від приє способи приготування фармацевтичних компоблизно 25% до приблизно 40% - у вигляді "позазицій, що містять целекоксиб в формі частинок гранульної" добавки Аналогічно, виявлено, що Більш конкретно, предметом винаходу є способи при приготуванні композицій для таблетування приготування композицій целекоксиба в формі додання мікрокристалічної целюлози після описадискретних одиничних доз, оформлених у вигляді ної нижче стадії сушіння (у вигляді позагранульної таблеток або капсул, причому кожна таблетка або мікрокристалічної целюлози) поліпшує пресовакапсула містить КІЛЬКІСТЬ целекоксиба, достатню ність гранул і МІЦНІСТЬ таблеток, приготованих з для забезпечення терапевтичного ефекту протяцих гранул гом від приблизно 12 годин до 24 годин Кожна одиниця дозування переважно містить, наприклад, На цій стадії змішування переважно змішують від приблизно ЮОмг до приблизно 200мг целекокцелекоксиб, лактозу, полівшілпіролідон і натрієву сиба ВІДПОВІДНО ДО даного винаходу, для приготусіль кроскармелози Виявлено, що суху суміш з вання таблетованих або капсульованих композидосить однорідним розподілом целекоксиба можна цій можна використовувати способи вологого граотримати при нетривалому змішуванні, наприклад, нулювання, сухого гранулювання або прямого при часі змішування 3 хвилини Наприклад, для пресування або капсулювання сухих порошкоподібних сумішей, що застосовуються для приготування капсул з дозою ЮОмг (суПереважним способом приготування фармамарна маса партії 1080кг) і 200мг (сумарна маса цевтичних композицій ВІДПОВІДНО до даного винапартії 918кг), виміряні значення відносного станходу є вологе гранулювання Згідно з способом дартного відхилення концентрації целекоксиба вологого гранулювання, целекоксиб (у разі необскладали ВІДПОВІДНО не більше за 3,6% 11,1% хідності в поєднанні з однією або декількома добавками) спочатку піддають помелу або подрібПотім ДО сухої порошкоподібної суміші доданенню до отримання частинок бажаної величини ють воду, переважно очищену, і перемішують масу Хоч при цьому можливе застосування різноманітпротягом деякого додаткового часу для отримання них відомих млинів або дробарок різних типів, при вологої гранульованої суміші При цьому переважударному розмелюванні, наприклад, на пальцьоно використовують змочувальний агент, який певих млинах, досягається підвищена однорідність реважно вводять шляхом додання його до води і готової композиції в порівнянні з іншими способаперемішування протягом не менше за 15хв , переми помелу У процесі розмелювання може виявиважно не менше за 20хв , після чого цю воду дотися необхідним охолоджування целекоксиба, надають до сухої порошкоподібної суміші Воду можприклад, рідким азотом, щоб уникнути розігрівання на додавати в один прийом, поступово протягом целекоксиба до небажаних підвищених темперадеякого часу або в декілька прийомів протягом тур Як вказано вище, зменшення величини Dgo на деякого часу Переважно воду додають поступово стадії помелу до значення не більш приблизно протягом деякого часу У альтернативному варіан200мкм, переважно не більш приблизно ЮОмкм, ті змочувальний агент можна додавати до сухої ще більш переважно не більш приблизно 75мкм, суміші, а потім до отриманої суміші додавативоду ще більш переважно не більш приблизно 40мкм і, При приготуванні вибраних як приклад капсул найбільш переважно, менш приблизно 25мкм доз дозою ЮОмг (маса партії 1080кг) прийнятні резволяє істотно підвищити бюдоступність целекокзультати досягаються при доданні води з швидкіссиба тю від приблизно 5кг/хв до приблизно 25кг/хв , переважно від приблизно 7кг/хв до приблизно Розмолотий або подрібнений целекоксиб потім 20кг/хв і ще більш переважно від приблизно змішують з однією або декількома добавками, в 8кг/хв до приблизно 18кг/хв Після додання води тому числі з добавками, розмолотими спільно з масу переважно перемішують протягом деякого целекоксибом, для отримання порошкоподібної додаткового часу для забезпечення рівномірного суміші, використовуючи для цієї мети, наприклад, розподілу води в суміші Для вищезазначеної як змішувач-гранулятор з високим зусиллям зсуву, приклад партії прийнятні результати досягаються планетарний змішувач, двобарабанний змішувач при додатковому часі перемішування від приблизабо змішувач типу "Сигма" Як правило, лікарську но 2хв до приблизно Юхв, переважно від приречовину змішують з одним або декількома розріблизно Зхв до приблизно 9хв , більш переважно джувачами, дезінтеграторами і/або зв'язуючими 34 33 58576 3 від приблизно Зхв до приблизно 7хв Волога гра7000куб футів в хвилину (56-200м /хв), ще більш нульована суміш цієї партії містить переважно від переважно від приблизно 4000куб футів в хвилину приблизно 2% (мас) до приблизно 15% (мас) водо приблизно 7000куб футів в хвилину (113ди, більш переважно від приблизно 4% (мас) до 200м /хв), при цьому міра відкриття заслінки приблизно 12% (мас) і ще більш переважно від складає від приблизно 10% до приблизно 90%, приблизно 6% (мас ) до приблизно 10% (мас ) переважно від приблизно 20% до приблизно 80% і ще більш переважно від приблизно 30% до приПри приготуванні вибраних як приклад капсул близно 70% Можна використовувати навантаженз дозою 200мг (маса партії 918кг) прийнятні реня сушарки в межах від приблизно 35% до призультати досягаються при доданні води з швидкісблизно 100%, переважно від приблизно 50% до тю від приблизно 5кг/хв до приблизно 25кг/хв , приблизно 100% і ще більш переважно від припереважно від приблизно 7кг/хв до приблизно близно 90% до приблизно 100% Середні втрати 23кг/хв і ще більш переважно від приблизно на сушіння в цих умовах складають, як правило, 8кг/хв до приблизно 21кг/хв Після додання води від приблизно 0,1% до 2,0% маси сухих гранул масу переважно перемішують протягом деякого додаткового часу для забезпечення рівномірного Потім сухі гранули у разі необхідності подріброзподілу води в суміші Для вищезазначеної як нюють з метою підготовки до пресування або капприклад партії прийнятні результати досягаються сулювання Для цієї мети можна застосовувати при додатковому часі перемішування від приблиззвичайне обладнання для подрібнення, наприно 2хв до приблизно 15хв, переважно від приклад, вібромлини або ударні млини (наприклад, близно Зхв до приблизно 12хв , більш переважно млини Fitz) При приготуванні вибраних як приклад від приблизно Зхв до приблизно Юхв Волога гракапсул з дозою ЮОмг (маса партії 1080кг) прийнянульована суміш цієї партії містить переважно від тний ступінь подрібнення досягається при викориприблизно 2% (мас) до приблизно 15% (мас) востанні швидкості подачі в межах від приблизно ди, більш переважно від приблизно 6% (мас) до 20% до приблизно 70%, переважно від приблизно приблизно 14% (мас) і ще більш переважно від 30% до приблизно 60%, швидкості млина від приприблизно 8% (мас ) до приблизно 13% (мас ) близно 20% до приблизно 70%, переважно від приблизно 40% до приблизно 60%, і розмірі отвоПотім вологу гранульовану суміш переважно рів сита від приблизно 0,020 дюйми (0,5мм) до піддають вологому помелу, наприклад, на розмеприблизно 0,070 дюйми (1,7мм), переважно від лювальній установці з просіюванням, для видаприблизно 0,028 дюйми (0,7мм) до приблизно лення великих агломератів матеріалу, які утворю0,040 дюйми (1,0мм) При приготуванні вибраних ються при вологому гранулюванні як побічний як приклад капсул з дозою 200мг (маса партії продукт Якщо ці агломерати не видалити, вони 918кг) прийнятна міра подрібнення досягається призводять до подовження подальшої стадії сушки при використанні швидкості подачі в межах від в псевдоскрапленому шарі і до збільшення розкиприблизно 10% до приблизно 70%, переважно від ду кінцевої вогкості суміші Для взятих як приклади приблизно 20% до приблизно 60%, швидкості капсул з дозою ЮОмг (маса партії 1080кг) і 200мг млина, від приблизно 20% до приблизно 60%, пе(маса партії 918кг) прийнятні характеристики грареважно від приблизно 30% до приблизно 50% і нулювання досягаються при використанні швидкорозмірі отворів сита від приблизно 0,020 дюйми сті подачі до 50% від максимального значення, (0,5мм) до приблизно 0,080 дюйми (1,9мм), перепереважно від приблизно 2% до приблизно 30% і важно від приблизно 0,028 дюйми (0,7мм) до прище більш переважно від приблизно 5% до приблиблизно 0,063 дюйми (1,6мм) Однак виявлено, що зно 20% застосування більш дрібних сит, наприклад, 0,028 Суміш після вологого гранулювання або володюйми (0,7мм), призводить до пониження продукгого помелу потім сушать, наприклад, в сушильтивності Застосування більш великих сит, наприному шафі або в сушарці з псевдоскрапленим шаклад, 0,063 дюйми (1,6мм), призводить до збільром, переважно в сушарці з псевдоскрапленим шення частки гранул, розмір яких перевищує шаром, для отримання сухих гранул При бажанні 850мкм Застосування сит з розміром отворів привологу гранульовану суміш можна перед сушінням близно 0,040 дюйми (1,0мм) виключає надмірне піддати екструзії або дражуванню Умови сушіння, збільшення частки гранул більших за 850мкм без наприклад, температуру повітря на вході і триваістотного зниження продуктивності лість сушіння, встановлюють з розрахунком досягнення бажаної вологості сухих гранул Може виВаріювання вищезгаданих параметрів вологоявитися доцільним об'єднання на цій стадії сушінго гранулювання і вологого помелу можна застоня і на подальших стадіях переробки двох або совувати для досягнення бажаного розподілу вебільш партій суміші, що отримуються на стадії личини гранул Наприклад, при збільшенні тривагранулювання лості змішування сумішей із зниженим змістом води спостерігається деяке зменшення величини Для взятих як приклади вищезазначених капгранул Передбачається, що у випадках, коли сул з дозою ЮОмг (маса партії 1080кг) або 200мг вміст води недостатній для активування всієї КІЛЬ(маса партії 918кг) температуру на вході сушарки КОСТІ застосованого змочувального агента, когеможна встановити 60°С, хоч можна використати і ЗІЙНІ сили, що діють між первинними частинками в ІНШІ значення температури, переважно в межах від гранулах, виявляються недостатніми для протиприблизно 50°С до приблизно 70°С Швидкість стояння зусиллям зсуву, що виникають під дією повітря можна варіювати в межах від приблизно лопатей змішувача, і відбувається не збільшення ЮООкуб футів в хвилину до приблизно 8000куб гранул, а, навпаки, їх стирання І навпаки, збільфутів в хвилину (28-226м /хв ), переважно від пришення вмісту води до КІЛЬКОСТІ, достатньої для близно 2000куб футів в хвилину до приблизно 36 35 58576 повного активування зв'язувального агента, забезрівні одиниці дозування, які легко піддаються дезпечує переважання когезійних сил, що діють між інтеграції, мають характеристики сипучості, достапервинними частинками в гранулах, над зусиллятні для ефективного регулювання маси в процесі ми зсуву, що виникають під дією лопатей змішувазаповнення капсули або таблетування і мають ча, і при збільшенні часу змішування і/або швидкодостатню насипну густину, так що партію можна сті додання води відбувається не стирання, а зропереробляти на вибраному обладнанні, і окремі стання гранул Зміна розміру отворів сита при водози вміщуються в капсули або прес-форми ВІДПОлогому помелі надає більший вплив на величину ВІДНОГО розміру гранул, ніж зміна швидкості подачі і/або швидкості Застосування при приготуванні лікарських замлина собів Потім сухі гранули завантажують в змішувач Предметом даного винаходу є також застосуВІДПОВІДНОГО типу, наприклад, двобарабанний змівання композицій ВІДПОВІДНО до винаходу при пришувач, і додають до них необов'язкові добавки, готуванні лікарських засобів, корисних при лікунаприклад, змащувальний агент (наприклад, стеаванні і/або профілактиці захворювань і розладів, в рат магнію) і ІНШІ необов'язкові добавки (наприяких медіатором є циклооксигеназа-2 клад, позагранульну мікрокристалічну целюлозу ПРИКЛАДИ і/або позагранульну натрієву сіль кроскармелози Нижченаведені приклади ілюструють аспекти для деяких таблетованих композицій) для отриданого винаходу, але не повинні розглядатися як мання готової суміші Тривалість змішування часттакі, що мають обмежувальне значення Методики ково залежить від технологічного обладнання, що експериментів, що використовуються для отризастосовується Для вищезгаданих капсул з дозамання представлених даних, детальніше викладеми ЮОмг і 200мг (маса партій ВІДПОВІДНО 1080КГ І ні нижче Символи і норми, використані в прикла918кг) тривалість змішування не менше за 5хв при дах, співпадають з тими, що застосовуються в суступені завантаження змішувача від приблизно часній фармацевтичній літературі При відсутності 15% до приблизно 60% і швидкості обертання спеціальних вказівок мається на увазі, що (і) всі змішувача не менше за 10об/хв гарантувала значення, вказані в цих прикладах в процентах, отримання змішаного матеріалу з вельми високою відносяться до масових процентів від загальної мірою однорідності розподілу концентрації целекомаси композиції, (м) сумарна маса композиції у разі ксиба Відносне стандартне відхилення, визначене капсул являє собою повну масу вмісту капсули і не на пробах суміші, ВІДПОВІДНИХ ОДИНИЧНИМ дозам, включає масу конкретної капсули, що застосовускладало не більше за 3,9% і не більше за 2,2% ється і (мі) у разі таблетки в оболонці остання виВІДПОВІДНО для доз ЮОмг і 200мг Для випадків, конана із звичайного матеріалу, наприклад, з коли до складу розріджувачів входить мікрокрисOpadry White YS-1-18027A, і масова частка оболоталічна целюлоза, виявлено, що введення частини нки становить приблизно 3% від загальної маси мікрокристалічної целюлози на цій стадії сприяє таблетки в оболонці істотному підвищенню пресованості гранул і МІЦПриклад 1 Капсули з дозою ЮОмг НОСТІ таблеток Крім того, збільшення КІЛЬКОСТІ Готують композицію такого складу з розрахунстеарату магнію до величин, що перевищують ку на 1 капсулу приблизно 1-2%, призводило до пониження МІЦНОСТІ таблеток і збільшення ламкості і часу розчиТаблиця 1 нення Потім готову суміш фасують в капсули (або, якщо необхідно таблетувати партію, пресують в таблетки бажаної маси і МІЦНОСТІ, використовуючи відповідне обладнання) При цьому можна застосовувати звичайні способи пресування і таблетування, ВІДОМІ фахівцям Для капсул прийнятні результати були отримані при використанні висоти шара в межах від приблизно 20мм до приблизно 60мм, заданої усадки від 0мм до приблизно 5мм і продуктивності від приблизно 60000 капсул в годину до приблизно 130000 капсул в годину Виявлено, що точність дозування знижується у разі (і) низької швидкості і високої усадки або (м) при високій швидкості і великій висоті шара ВІДПОВІДНО, необхідний ретельний підбір цих поєднань параметрів Виявлено також, що утворення агрегатів, що злежалися, можна повністю уникнути або звести його до мінімуму, використовуючи мінімальну задану міру усадки, що забезпечує необхідну однорідність маси капсул У випадках, коли необхідно виготовляти таблетки в оболонці, можна використовувати звичайні способи нанесення покриттів, ВІДОМІ фахівцям Таке поєднання операцій дозволяє отримувати гранули, однорідні за вмістом целекоксиба на Інгредієнт Целекоксиб Моногідрат лактози (NF, Ph Eur)* Лаурилсульфат натрію (NF, Ph Eur) Повідон (К29-32 USP) Натрієва сіль кроскармелози (NF, Ph Eur) Стеарат магнію (NF, Ph Eur) Загальна маса вмісту капсули Масова Маса, частка, % мг 37,04 100 5,46 149,75 3 8,1 2,5 6,75 1 2,7 1 100 2,7 270 *Тут і далі Ph Eur - Європейська фармакопея Одиничну дозу вищезгаданої композиції вміщують в тверду желатинову капсулу (білу непрозору, 2-го розміру), що містить дюксид титана (USP), желатин (NF) і синій барвник (SB-6018) Моногідрат лактози, що використовується в кожному з прикладів, постачається фірмою "Формост Фармз" (Formost Farms, Baraboo, Wiskonsm) Натрієва сіль кроскармелози марки Ac-Di-Sol, що використовується в кожному з прикладів, постача 37 58576 ється фірмою "ФМЦ" (FMC Corporation, Chicago, Illinois) Лаурилсульфат натрію, що використовується в кожному з прикладів, постачається фірмою "Хенкель" (Henkel Corporation, Cincinnati, Ohio) Повідон (полівшілпіролідон), що використовується в кожному з прикладів, постачається фірмою "Інтєрнейшнл Спешиалті Продактс" (International Specialty Products) Стеарат магнію, що використовується в кожному з прикладів, постачається фірмою "Малінкродт Інк" (Malhnckrodt Inc , St Louis, Missun) Склад Opadry White YS-1-18027A, що застосовується для приготування таблеток, покритих оболонкою, які описуються в цих прикладах, являє собою готову до вживання композицію, що поставляється фірмою "Колоркон" (Colorcon, West Point, Pennsylvania) Капсули з будь-якими бажаними дозами від 25мг до 225мг можна готувати шляхом варіювання маси целекоксиба і ВІДПОВІДНОГО збільшення або зменшення КІЛЬКОСТІ лактози так, щоб сумарна маса вмісту капсули становила 270мг Приклад 2 Капсули з дозою 200мг Готують композицію такого складу з розрахунку на 1 капсулу 38 Таблиця 2 Інгредієнт Целекоксиб Моногідрат лактози (NF, Ph Eur)* Лаурилсульфат натрію (NF, Ph Eur) Повідон (К29-32 USP) Натрієва сіль кроскармелози (NF, Ph Eur) Стеарат магнію (NF, Ph Eur) Загальна маса вмісту капсули Масова Маса, частка, % мг 74,07 200 18,43 49,75 3 8,10 2,5 6,75 1 2,7 1 100 2,7 270 Одиничну дозу вищезгаданої композиції вміщують в тверду желатинову капсулу (білу непрозору, 2-го розміру), що містить дюксид титана (USP), желатин (NF) і синій барвник (SB-6018) Приклад 3 Таблетки з дозою ЮОмг Готують таблетки такого складу Таблиця З Інгредієнт К-ть на таблетку, мг Масова частка, % К-ть на партію, кг Целекоксиб 100 40 6,40 Моногідрат лактози (NF) 101,8 40,75 6,52 Лаурилсульфат натрію (NF) 7,5 3 0,48 Повідон (К29/32, USP) 6,25 2,5 0,40 Натрієва сіль кроскармелози (тип A, NF) 7,5 3 0,48 Мікрокристалічна целюлоза (Avicel PH-102, 25 10 1,60 NF) Стеарат магнію (NF) 1,88 0,75 0,12 Усього 250,01 100 16 Opadry White YS-1 -18027А 7,50 Приготовані таблетки являють собою модифіковані таблетки овальної форми розміром 0,210x0,465 дюйми (5,0x11,2мм) Мікрокристалічна целюлоза сорту Avicel, використана при приготуванні таблеток за Прикладами З і 4, випускається фірмою "ФМЦ" (FMC Corporation, Philadelphia, Pennsylvania) Таблетки з дозами в межах від 25мг до 225мг можна готувати шляхом збільшення або зменшення кількостей целекоксиба і кожної з добавок, вказаних вище, так, щоб зберегти вказані в таблиці значення масових часток Приклад 4 Таблетки з дозою 200мг Готують таблетки такого складу Таблиця 4 Інгредієнт К-ть на таблетку, мг Масова частка, % К-ть на партію, кг Целекоксиб 200 40 6,40 Моногідрат лактози (NF) 203,75 40,75 6,52 Лаурилсульфат натрію (NF) 15 3 0,48 Повідон (К29/32, USP) 12,5 2,5 0,40 Натрієва сіль кроскармелози (тип A, NF) 15 3 0,48 Мікрокристалічна целюлоза (Avicel PH-102, 50 10 1,60 NF) Стеарат магнію (NF) 3,75 0,75 0,12 Усього 500 100 16 Opadry White YS-1 -18027А 15,0 Приготовані таблетки являють собою модифіковані таблетки в формі капсул розміром 0,275x0,496 дюйми (6,6x11,9мм) Приклад 5 Проба на дезінтеграцію Готували таблетки згідно з Прикладами 3 і 4, але без оболонки Шість однакових таблеток вмі 39 58576 40 Приклад 6 Проба на розчинення Для визначення швидкості розчинення капсул за Прикладами 1 і 2 і таблеток за Прикладами 3 і 4, які для мети цього випробування були виготовлені без оболонок, використали прилад ВІДПОВІДНО до Фармакопеї США, спосіб 2 (з лопатями) Як середовище для розчинення був використаний розчин 1% лаури л сульфату натрію і 0.04М фосфату натрію (рН=12) в КІЛЬКОСТІ ЮООмл Під час випробування температуру розчину підтримували на рівні 37±5°С і перемішували розчин (швидкість мішалки 50 обертів в хвилину) Випробуванню піддавали 12 однакових таблеток або капсул Кожну таблетку або капсулу вміщували в стандартну ємність для випробувань на розчинення, і з кожної посудини відбирали аліквотні об'єми розчину по 5мл через 15хв , ЗОхв , 45хв і бОхв з початку випробування Пробу з кожної ємності фільтрували і вимірювали поглинання розчину (УФспектрофотометр, кварцова кювета оптичною товщиною 2мм, довжина хвилі максимума поглинання 243нм, розчин порівняння - середовище для розчинення) 3 отриманих характеристик поглинання розраховували процент розчинення Середні результати проб на розчинення представлені в Таблиці 6 Потрібно мати на увазі, що показники розчинності, отримані в цих експериментах при підвищеному рН, не характеризують розчинність в травному тракті щували по одній в шість трубок, що мають поперечні перегородки з дротяної сітки, встановлених в кошику для випробувань на дезінтеграцію Нагрівали водяну баню до температури 37±2°С і підтримували цю температуру протягом випробування на дезінтеграцію У водяну баню вміщували склянку МІСТКІСТЮ 1000мл У склянку заливали воду в КІЛЬКОСТІ, достатній для того, щоб сітчасті перегородки трубок в процесі випробування знаходилися на глибині не менше за 2,5см нижче за рівень води Занурювали у воду кошик для випробувань на дезінтеграцію і навперемінно підводили і опускали її до закінчення випробування, при цьому дротяні перегородки трубок весь час знаходилися на глибині не менше за 2,5см нижче за рівень води За час дезінтеграції кожної таблетки приймали час, що вимірюється від моменту занурення кошика до моменту, коли матеріал таблетки, що розпадається, повністю проходить через сітку трубки Середні результати для таблеток за Прикладами 3 і 4 без оболонок представлені в таблиці 5 Таблиця 5 Таблетка За Прикладом 3 доза ЮОмг (без оболонки) За Прикладом 4 доза 200мг (без оболонки) Час дезінтеграції 4 хвилини 35 секунд 7 хвилин 40 секунд Таблиця 6 Композиція За За За За Прикладом Прикладом Прикладом Прикладом Приклад 7 У Таблиці лометричного композицій за 1 2 3 4 капсули, доза ЮОмг капсули, доза 200мг таблетки, доза ЮОмг таблетки, доза 200мг Аналіз величини частинок 7А представлені результати грануситового аналізу фармацевтичних Прикладами 1 і 2, гранульованих 15хв 89 55 81 60 % розчинення за час ЗОхв 45хв 99 100 82 89 93 94 96 98 бОхв 100 92 95 98 вологим способом, перед капсулюванням Термін "Залишок на ситі в %" означає масову частку партії композиції, що має величину частинок, що перевищує розмір отвору ВІДПОВІДНОГО сита Таблиця 7 А Розмір отвору сита, мкм 850 425 250 180 106 75 0 Залишок на ситі, % Приклад 1 капсули, ЮОмг Приклад 2 капсули, 200мг Нижня межа Верхня межа Нижня межа Верхня межа 0 1,3 1,1 10,7 2,8 14,9 4,3 25,4 10,0 25,5 10,8 35,4 15,3 39,0 17,3 39,2 32,5 64,5 35,2 58,2 37,1 77,5 39,5 71,8 100 100 100 100 У Таблиці 7В показані результати гранулометричного ситового аналізу фармацевтичних композицій за Прикладами 3 і 4, гранульованих вологим способом, перед пресуванням в таблетки Термін "Частка в партії в %" означає масову частку партії композиції, що має величину частинок в межах від розміру отвору ВІДПОВІДНОГО сита до розміру отвору наступного більш дрібного сита, вказаного в наступному рядку таблиці Термін "Накопичувальна частка в %" означає сумарну частку партії композиції, що має величину частинок, що перевищують розмір отвору ВІДПОВІДНОГО сита 41 42 58576 Таблиця 7В Розмір отвору сита, мкм 840 (20 меш) 420 (40 меш) 250 (60 меш) 177 (80 меш) 149 (100 меш) 105 (140 меш) 74 (200 меш) Дрібні Приклад 3 таблетки, ЮОмг Накопичувальна частка, Частка в парти, % % 1 1 24,6 25,6 18,4 44 9,6 53,6 6,6 60,2 11,6 71,8 8,8 80,6 19,4 100 Приклад 8 Аналіз об'ємної густини У таблиці 8 подані результати визначення об'ємної густини фармацевтичних композицій за При Приклад 4 таблетки, 200мг Частка в парти, Накопичувальна частка, % % 0,79 0,79 24,85 25,64 19,13 44,77 11,05 55,82 6,9 62,72 11,44 74,16 8,28 82,45 17,55 100 кладами 1 і 2, гранульованих вологим способом, перед капсулюванням або пресуванням в таблетки Таблиця 8 Приклад Приклад Приклад Приклад Композиція 1 капсули, ЮОмг 2 капсули, 200мг 3 таблетки, ЮОмг 4 таблетки, 200мг Об'ємна густина, г/мл Густина після згущення, г/мл Втрати при сушінні, % 0,77 1,02 0,6 0,61 0,96 0,5 0,73 0,87 1,37 0,72 0,86 1,4 Приклад 9 Статистичний аналіз таблеток У Таблиці 9 представлені результати статистичного аналізу таблеток по програмі "ТАР analysis" для вибірок об'ємом 10 таблеток композицій по Прикладах 3 і 4 Таблиця 9 Композиція Середня маса, мг Середня товщина, мм МІЦНІСТЬ, кгс Приклад 3 таб248 3,85 8,2 летки, ЮОмг Приклад 4 таб500 5,22 14,6 летки, 200мг Приклад 10 Випробування на ламкість Таблетки загальною масою 12г вміщували у барабан, що обертається Заздалегідь барабан і таблетки очищали від стороннього пилу Пускали барабан в хід і продовжували обертання протягом Юхв при швидкості мінімум 25 обертів в хвилину Потім зупиняли обертання і витягували таблетки Видаляли з таблеток пил і ВІДДІЛЯЛИ уламки зруйнованих таблеток, а непошкоджені таблетки зважували Розраховували процент спаду маси Результати для таблеток за Прикладами 3 і 4 представлені нижче в таблиці 10 Таблиця 10 Таблетки Приклад 3 таблетки з дозою ЮОмг Спад маси в % 0,33 Приклад 4 таблетки з дозою 200мг ках 0,16 Приклад 11-1 Бюдоступність - проба на соба Дорослим самицям коротконогих гончих з масою тіла від 9 фунтів до 13 фунтів (4,1-5,9кг) одноразово вводили целекоксиб в таких дозах (1) внутрішньовенно 0,5мг/кг маси тіла з подальшим повторним внутрішньовенним вливанням целекоксиба в дозі 5,0мг/кг маси тіла, (2) 5мг/кг маси тіла перорально у вигляді розчину, і (3) 5,0мг/кг маси тіла целекоксиба без добавок перорально в капсулі Носієм В розчинах для внутрішньовенного вливання і перорального прийому служила суміш поліетиленгліколю зі середньою молекулярною масою 400 (ПЕГ-400) і води в співвідношенні 2 1 (за об'ємом) Кожне внутрішньовенне вливання призначували протягом 15хв з перервою між двома вливаннями від 15хв до ЗОхв У кожної тварини відбирали декілька проб крові з вени за допомогою голки або катетера тривалого введення, проби вміщували в пробірки з гепарином Концентрацію целекоксиба в сироватці крові визначали методом високоефективної рідинної хроматографії і використовували отримані дані для розрахунку фармакокшетичних параметрів, представлених в таблиці 11-1 Таблиця 11-1 Фармакокшетичний параметр Стах, НГ/МЛ Ттах, ГОДИНа AUCo ш, нг/мл в годину Кліренс, мл/хв х кг Внутрішньовенне вливання 6950 Не використовується 31200 3,08 Пероральне введення Пероральний прийом в розчину капсулі 2190 517 0,5 3,0 16200 4800 5,14 17,4 43 44 58576 Продовження таблиці 11-1 Фармакокшетичний параметр Т-і/2, година Бюдоступність, % Пероральне введення Пероральний прийом в розчину капсулі 9,15 11,8 57,1 16,9 Внутрішньовенне вливання 8,84 Не використовується Приклад 11-2 Відносна бюдоступність лікарських форм - проба на собаках Вплив таких параметрів лікарських форм, як величина частинок целекоксиба, підвищена концентрація змочувального агента, рН і ступінь дисперсності целекоксиба в суспензіях, оцінювали по відношенню до перорального введення розчину на собаках Вплив тонкого подрібнення целекоксиба (до середньої величини частинок 10-20мкм) перед приготуванням лікарських форм випробовували на композиції А Сукупний вплив тонкого подрібнення, добавки змочувального агента (л аури л сульфату натрію) і підвищеного рН мікросередовища 12Н2О) випробовували на композиції В Вплив введення змочувального агента (Tween 80) в тісний контакт з целекоксибом (спільне осадження і звичайне змішування в сухому стані) випробовували на композиції С Вплив додаткового зменшення величини частинок суспензії (наближення до 1мкм) випробовували на композиції D Як основа для порівняння був застосований розчин целекоксиба (композиція Е), аналогічний використаному в Прикладі 11-1 Крім того, для порівняння використані дані для не подрібненого целекоксиба без добавок (композиція F), отримані в Прикладі 11-1 Конкретні склади композицій А, В, С, D, Е і F представлені в таблиці 11-2А Таблиця 11-2 А Інгредієнт Целекоксиб (тонкоподрібнений) Целекоксиб/Tween 80 і '' Целекоксиб (диспергований)1^' Целекоксиб (розчин)1^' Целекоксиб (неподрібнений) Лаурилсульфат натрію Avicel 101 Na3PO4 12Н2О Усього А 25 Масова частка в % (до сухої маси) В С D Е 25 25 100 100 F 100 2 73 100 25 25 25 100 75 100 100 100 100 (1) Осаджений з розчину в етанолі із застосуванням 5%-ного водного розчину полісорбату 80 як осаджувача (2) Приготований у вигляді суспензії шляхом помелу в кульовому млині лікарської речовини, суспендованого в полісорбаті 80 і полівшілпіролідоні, до діаметра частинок приблизно 1 мкм (оцінка методом мікроскоп 1 0 (3) Розчин в суміші ПЕГ-400 з водою (2 1 за об'ємом) Композиції вводили групам собак, що складаються з 3 самців і 3 самиць кожна Собакам групи 1 вводили целекоксиб у вигляді розчину Е і капсульованих композицій А і В в КІЛЬКОСТІ 5мг/кг маси тіла за нерандомізованою перехресною схемою Собакам групи 2 вводили за нерандомізованою перехресною схемою целекоксиб у вигляді капсульованої композиції С і суспензії D в КІЛЬКОСТІ 5мг/кг маси тіла Протягом 24 годин відбирали проби плазми і визначали концентрацію целекоксиба методом високоефективної рідинної хроматографії Результати дослідження (Таблиці 11-2В, 11-2С і 11-2D) показали, що зменшення величини частинок (композиція А) або спільне осадження целекоксиба зі змочувальним агентом (композиція С) підвищують бюдоступність (виражену через AUCo 24) целекоксиба в порівнянні з раніше отриманими результатами дослідження целекоксиба без добавок, представленого в Прикладі 11-1 Бюдоступність целекоксиба, введеного у вигляді розчину в ПЕГ-400 з водою (композиція Е) і суспензії (композиція D), підвищується Бюдоступність з суспензії частинок діаметром приблизно 1мкм аналогічна бюдоступності з розчину, що явно вказує нате, що доступність целекоксиба з твердих композицій, отриманих вологим гранулюванням, можна підвищити шляхом зменшення величини частинок целекоксиба (наприклад, подрібнення целекоксиба на пальцьовому млині до приготування композиції), підвищення змочувальної здатності целекоксиба (наприклад, введення л аури л сульфату натрію до складу рідини, що використовується при гранулюванні) і підвищення диспергованості (наприклад, шляхом введення натрієвої солі кроскармелози при гранулюванні) Дані по бюдоступності, наведені в Таблицях 11-2С і 11-2D для кожної композиції, дають уявлення про відносну бюдоступність для даної композиції, виражену в процентах по відношенню до бюдоступності, експериментально визначеної для випадку внутрішньовенного введення целекоксиба, дані для розчину (компо 45 зиція Е) забезпечують Час, ч 0 0,5 1,0 2,0 3,0 4,0 6,0 7,0 8,0 12,0 24,0 58576 можливість зіставлення 46 результатів, отриманих в Прикладах 11-1 і 11-2 Таблиця 11-2В Концентрація целекоксиба в плазмі крові, мкг/мл В С D Е 0 0 0 0 0,247 0,0635 0,453 0,824 0,228 0,443 0,826 0,820 0,138 0,717 0,865 0,604 0,0860 0,492 0,741 0,517 0,0707 0,384 0,576 0,413 0,0664 0,233 0,354 0,286 ~ ~ ~ ~ 0,0624 0,160 0,234 0,187 0,0431 0,0865 0,142 0,0802 0,0404 0,0408 0,0394 0,0159 А 0 0,0143 0,244 0,318 0,189 0,145 0,107 ~ 0,0828 0,0939 F 0 0,205 0,333 0,262 0,517 0,234 ~ 0,197 ~ ~ Таблиця 11-2С Фармакокшетичний параметр Стах, НГ/МЛ Ттах, ГОДИНа Бюдоступність, % А 360±60 1,3±0,2 31,2±2,9 Значення для самиць С D 790±190 1010±270 1,5±0,3 1,7±0,44 46,3+9,5 69,5±9,6 В 250±70 0,7+0,2 24,9±1,4 Е 840±240 0,67±0,18 62,4±9,4 F 500 3,0 16,9 Таблиця 11-2D Фармакокшетичний параметр Стах, НГ/МЛ Ттах, ГОДИНа Бюдоступність, % А 520±110 5,3±3,3 49,4±12,0 В 450±180 3,3±1,3 54,2±13,1 Приклад 11-3 РІЗНІ КОМПОЗИЦІЇ, ЩО МІСТЯТЬ лаурилсульфат натрію (від 0% до 5% (мас)) і натрієву сіль кроскармелози (від 0% до 5% (мас)), випробовували з метою оцінки відносної змочувальної здатності і схильності до дезінтеграції Відносну змочувальну здатність оцінювали шляхом вимірювання часу, необхідного для просочення води через шар гра Значення для самців С D 640±260 830±330 1,5±0,5 5,7±3,42 42,9±13,1 87,5±20,6 Е 1520±200 1,5 89,4±4,5 F 500 3,0 16,9 нульованого матеріалу, приготованого з кожної композиції Схильність ДО дезінтеграції визначали шляхом вимірювання маси гранульованого матеріалу, що залишається на ситі 20меш (850мкм) після витримування матеріалу у воді при температурі 37°С протягом 5хв Конкретні склади досліджених композицій А-Н представлені в Таблиці 11ЗА Таблиця 11-ЗА Склад Целекоксиб Лактоза Полівшілпіролідон Лаурилсульфат натрію Ac-Di-Sol Стеарат магнію А1" 74,7 15,8 2,5 3,0 3,0 1,0 В 74,7 15,8 2,5 3,0 3,0 1,0 С 74,7 21,8 2,5 0,0 0,0 1,0 Масова частка, % D Е 74,7 74,7 19,8 17,8 2,5 2,5 1,0 1,0 1,0 3,0 1,0 1,0 F 74,7 15,8 2,5 1,0 5,0 1,0 G 74,7 17,8 2,5 3,0 1,0 1,0 Н 74,7 11,8 2,5 5,0 5,0 1,0 (1) Лаурилсульфат натрію введений у вигляді сухого порошку Отримані результати представлені в Таблиці 11-ЗВ Експерименти по просоченню повторювалися тричі, а проби на дезінтеграцію - ДВІЧІ ДЛЯ кожної композиції Результати дослідження просочення показали, що нанесення лаурилсульфату натрію вологим способом (композиція В) дає кращі результати, ніж введення його у вигляді сухого порошку (композиція А) і що ті композиції, що містять від 3% до 5% лаурилсульфату натрію (компо зиції В, G і Н) перевершують композиції з меншим вмістом лаурилсульфату натрію (композиції C-F) Композиції із вмістом лаурилсульфату натрію 3% (композиції В і G) і 5% (композиція Н) мають аналогічні характеристики просочення Результати дослідження дезінтеграції показали, що повна дезінтеграція досяжна при таких низьких концентраціях натрієвої солі кроскармелози, як 1% (композиція G) і вмісту змочувального агента 3% При 47 більш високих вмістах дезінтегратора (композиції В, F і Н) повна дезінтеграція досягається незалежно від концентрації змочувального агента Компо 58576 48 зиція G має як високу змочувальну здатність, так і повну дезінтеграцію при мінімальному необхідному вмісту добавки Таблиця 11-ЗВ Композиція А В С D Е F G Н % л аури л сульфату натрію / % Ac-D і-So I З/З З/З 0/0 1/1 1/3 1/5 3/1 5/5 Час просочення Дезінтеграція >18 годин 5-60 хвилин >4 до >18 годин >4 до >18 годин від 2 до 4 годин від 1 до 4 годин від 10 до 40 хвилин від 10 до 55 хвилин 0,1-0,5% не відмічена 20-26% 10-13% 4-6% не відмічена не відмічена не відмічена Приклад 12 Композиції нижчевказаного складу випробовували на змочувальну здатність і рівномірність змішування Таблиця 12 Інгредієнт Целекоксиб Лактоза Мікрокристалічна целюлоза (МКЦ) Полісорбат80 (ПС-80) Полівшілпіролідон (ПВП) К29-32 Стеарат магнію Сухе змішування з лактозою 5 60 94,5 39,5 ~ ~ ~ ~ ~ ~ 0,5 0,5 Масова частка, % Сухе змішуван- Гранулювання з Гранулювання з ня з МКЦ ПВП11 ПС-8021 5 60 5 60 5 60 ~ ~ 92 37 93,5 38,5 ~ ~ ~ ~ 94,5 39,5 ~ ~ ~ ~ 1,0 1,0 ~ ~ ~ ~ 2,5 2,5 0,5 0,5 0,5 0,5 0,5 0,5 1) У цю композицію полівінілпіролідон вводили у вигляді сухого порошку перед вологим гранулюванням з водою 2) У цій композиції целекоксиб і лактозу гранулювали з водним розчином полісорбату-80 Суміші з 5% целекоксиба виявилися більш однорідними за складом, ніж суміші з 60% целекоксиба Виміряні значення відносного стандартного відхилення для сумішей з 5% целекоксиба лежали в межах від 0,4% до 3,5%, в той час як для сумішей з 60% целекоксиба цей показник варіював в межах від 4,7% до 6,3% Крім меншої однорідності складу, суміші з 60% целекоксиба містили відносно великі гранули (більше за 420мкм), які були понадконцентрованими (містили підвищені концентрації целекоксиба до 124-132% в порівнянні з іншими гранулами) Були приготовані чотири аналогічних композиції із вмістом целекоксиба 25% замість вищезгаданих 5% або 60% Бюдоступність цих композицій досліджували на собаках за методикою, аналогічною описаній в Прикладах 11-1 і 11-2 Найвищу бюдоступність (74%) мала композиція з ПОЛІВІНІЛпіролідоном, введеним на стадії вологого гранулювання Приклад 13 Готували і досліджували капсули з композиціями такого складу Таблиця13А КІЛЬКІСТЬ, МГ Інгредієнт Целекоксиб Капсула 5мг 5 Капсула 20мг 20 Капсула ЮОмг 100 Лактоза Повідон (К29-32) Стеарат магнію Усього Оболонка капсули Розмір капсули 92 2,5 0,5 100 1 №3 77 2,5 0,5 100 1 №3 61,9 4 0,8 166,7 1 №3 Целекоксиб подрібнювали шляхом багаторазового пропускання через вібромлин, який обладнували ситами з послідовно зменшуваними розмірами отворів (№14, №20, №40) Величина Dgo частинок целекоксиба, що вводиться в цю суміш, була менше приблизно 37мкм Целекоксиб, лактозу і полівінілпіролідон змішували в планетарному змішувачі і піддавали вологому гранулюванню з водою Гранульовану композицію сушили при 60°С, подрібнювали з пропусканням через сито 40меш (розмір отвору 0,42мм), додавали мастильний агент (стеарат магнію) в змішувачі типу V і капсулювали, використовуючи капсулятор типу дозатора Профіль розчинення капсул in vitro визначали по USP, спосіб 2, із застосуванням фосфатного буфера як розчинювального середовища (15мм) при рН=10 Приблизно через 15 хвилин досягалося приблизно 50%-не розчинення in vitro, а приблизно через ЗО хвилин ступінь розчинення in vitro перевищував 95% Профілі засвоєння, розподілу, метаболізму і виведення капсул вищезгаданого складу з дозою 49 58576 ЮОмг порівнювали з ВІДПОВІДНИМИ профілями для суспензії целекоксиба, міченим 14С Дослідження проводили за рандомізованою перехресною схемою з відкритою міткою на десяти здорових чоловіках Суспензію готували шляхом розчинення целекоксиба в етанолі, що містить 5% полісорбату 80, і додаванням цієї суміші до яблучного соку перед вживанням Учасники експерименту, що приймали суспензію, отримували з нею дозу ЗООмг целекоксиба Учасники, що приймали капсульований целекоксиб, отримували три капсули з дозою ЮОмг, тобто сумарна доза целекоксиба також становила ЗООмг Швидкість засвоєння з капсул була меншою, ніж з суспензії, однак характеристики засвоєння, виражені через AUCcus, були еквівалентними Усереднені результати представлені нижче в Таблиці 13В Целекоксиб зазнавав метаболізму значною мірою лише 2,56% радіоактивної дози виявлено в сечі або калі Таблиця 13В Фармакокшетичний параметр AUCo48 (нг/мл) в годину Суспензія 8706,7 1526,5 1,42 11,53 Стах, НГ/МЛ Ттах, ГОДИНа Т-і/2, година Капсули 8763,1 1076,5 1,94 15,57 Приклад 14 Готували і досліджували капсули з композиціями такого складу Таблиця 14 Інгредієнт Целекоксиб Лактоза Повідон (К29-32) Стеарат магнію Усього Розмір капсули КІЛЬКІСТЬ, МГ Капсула ЮОмг Капсула 200мг 100 200 223,4 120,1 8,3 1,7 8,3 5 333,4 333,4 №1 №1 Ці КОМПОЗИЦІЇ були приготовані за методикою, аналогічною описаній в Прикладі 13, з тією різницею, що замість вібромлина був використаний млин ударного типу (пальцьовий) Застосування пальцьового млина забезпечує подальше зменшення величини частинок Для капсули з дозою ЮОмг приблизно через 15 хвилин досягалося приблизно 30%-не розчинення in vitro, а приблизно через ЗО хвилин ступінь розчинення in vitro перевищував 85% Для капсули з дозою 200мг приблизно через 15 хвилин досягалося приблизно 50%не розчинення in vitro, а приблизно через ЗО хвилин ступінь розчинення in vitro перевищував 85% Приклад 15 Приготування капсул з дозою ЮОмг Капсули з дозою целекоксиба ЮОмг або 200мг, що мають склад вмісту, описаний ВІДПОВІДНО в Прикладах 1 і 2, можна приготувати ВІДПОВІДНО до прийнятої практики фармацевтичного виробництва за методиками, представленими на фіг 1 або фіг 2 Таблетки, що містять дозу целекоксиба 50 ЮОмг або 200мг і що мають склад, описаний ВІДПОВІДНО в Прикладах 3 і 4, можна приготувати, модифікувавши ВІДПОВІДНИМ образом технологічні процеси, представлені на фіг 1 або фіг 2, з урахуванням необхідності додання позагранульних добавок натрієвої солі кроскармелози і мікрокристалічної целюлози і використання таблетування замість капсулювання У процесі, що описується як приклад виробництва партії капсул з дозою ЮОмг з використанням нижчевказаних початкових матеріалів, типова партія складається з чотирьох однакових операцій гранулювання, хоч КІЛЬКІСТЬ операцій гранулювання не має істотного значення і значною мірою залежить від продуктивності обладнання, що застосовується, і необхідного об'єму партії Помел Целекоксиб розмелювали на млині ударного типу (пальцьовому) з дисками, що обертаються в протилежних напрямах При швидкостях обертання, що варіювалися в межах від приблизно 8960/5600 обертів в хвилину до приблизно 11200/5600 обертів в хвилину (швидкість обертання/швидкість протиобертання), величина частинок змінювалася у відносно вузьких межах (Dgo ЗОмкм або менш), з чого витікає, що швидкість млина не має істотного значення для крупномасштабного процесу подрібнення лікарської речовини Фіг 2 являє собою принципову схему переважного варіанту здійснення винаходу, в якому початковий целекоксиб піддають ударному подрібненню, переважно на пальцьовому млині, перед змішуванням з добавками Сухе змішування Целекоксиб, лактозу, ПОЛІВІнілпіролідон і натрієву сіль кроскармелози завантажували у високошвидкісний гранулятор типу Niro Fiedler PMA-1200 МІСТКІСТЮ 1200Л І перемішували протягом приблизно 3 хвилин при високих швидкостях ножа і крильчатки Така тривалість сухого змішування забезпечувала задовільне змішування целекоксиба з добавками перед початком стадії вологого гранулювання Вологе гранулювання Лаурилсульфат натрію (8,1кг) розчиняли в очищеній воді за USP (23,7кг) Отриманий розчин поступово додавали в гранулятор з швидкістю приблизно 14кг/хв Загальна тривалість гранулювання складала приблизно 6,5 хвилини Під час гранулювання основну лопать і ніжгранулятора встановлювали на високу швидкість Волога гранульована суміш містила приблизно 8,1% (мас) води У альтернативному варіанті лаурилсульфат натрію можна змішувати з целекоксибом, лактозою, полівінілпіролідоном і натрієвою сіллю кроскармелози на стадії сухого змішування і додавати очищену воду за USP до цієї сухої суміші, що містить лаурилсульфат натрію Сушіння Продукт зі стадії вологого гранулювання звільняли від великих грудок, використовуючи для цього млин з просіванням типу Quadro Сотії Model 198 S, обладнаний крильчаткою, що обертається, і крупночарунковим ситом Вологий помел використали для усунення великих грудок матеріалу, що утворюються як побічний продукт на стадії вологого гранулювання Залишаючись в матеріалі, ці грудки приводили б до збільшення тривалості подальшої стадії сушіння в псевдоскрапленому шарі і до підвищеної нерівномірності 52 51 58576 вологості матеріалу Гранульовану масу, що не трикратну однодозову перехресну схему експеримістить грудок, завантажували в сушарку типу менту з відкритою міткою Учасники експерименту Aeromatic Fluid Bed Dryer T-8 Встановлювали тетричі отримували дози целекоксиба по 200мг, примпературу повітря на вході і об'ємну швидкість йом здійснювався у вигляді (А) однієї капсули з ВІДПОВІДНО приблизно 60°С і приблизно 5000дозою 200мг, (В) двох капсул з дозами по ЮОмг і 3 бОООкуб футів в хвилину (140-170м /хв) Гранули (С) двох капсул з дозами по ЮОмг з іншої партії сушили в псевдоскрапленому шарі до вологості Прийом здійснювався з 7-денними інтервалами 0,5-2,5% Вологість контролювали за допомогою Конкретні фармацевтичні композиції, що містилися вологовимірювача Computrac Moisture Analyzer в капсулах з дозами ЮОмг і 200мг, описані ВІДПОСушіння продовжували до досягнення спаду ваги ВІДНО в Прикладах 1 і 2 Учасники приймали вказагранульованого матеріалу не більше за 1,0% На ні дози препаратів натщесерце в 08 00 і запивали стадії сушіння і подальших стадіях переробки моїх приблизно 180мл води Протягом 4 годин після же виявитися бажаним об'єднання двох або більш прийому дози учасники експерименту не приймали операцій гранулювання їжу і знаходилися весь час у вертикальному положенні Проби крові відбирали в моменти -0,25 гоСухий помел Висушений гранульований мадини (тобто до прийому дози), потім через 0,5 готеріал пропускали через ударний млин типу Fluid дини, 1 годину, 1,5 години, 2 години, 3 години, 4 Air Mill Model 007 (звичайний молотковий), обладгодини, 6 годин, 8 годин, 12 годин, 16 годин, 24 наний ситом з розміром отворів від 0,028 дюйма години, 36 годин і 48 годин після прийому дози до 0,063 дюйма (0,7-1,5мм), працюючий з швидкісАналізи виділеної плазми були виконані фірмою тю 2400 обертів в хвилину, з ножами в передньому PPD Pharmaco, Richmond, VA Концентрації целеположенні Сухий помел в поєднанні з вологим коксиба в плазмі визначали методом високоефекгранулюванням застосовують для регулювання тивної рідинної хроматографії (ВЕРХ) за атестовакінцевого розподілу гранул по величині ною методикою, що забезпечує нижню межу детеЗмішування і введення змащувального агента ктування 10,0нг/мл Кожний з учасників експериГранульований матеріал після помелу вміщували менту обстежувався окремо Між прийомами в дифузійний змішувач/змішувач V-типу, марки РК кожної з доз (200мг) витримувався 7-денний інтерCross-Flow Blender 75 Cubic Foot Додавали стеавал для виведення препарата з організму Усерерат магнію і перемішували суміш протягом приднені результати для 46 учасників наведені нижче близно 5 хвилин Така тривалість перемішування в таблицях 16А і 16В забезпечувала однорідність матеріалу з точки зору концентрації целекоксиба Швидкість обертання змішувача становила 10,6 обертів в хвилину ОсТаблиця 16А таточне змішування застосовували для об'єднання матеріалів декількох операцій гранулювання в Концентрація целекоксиба в плазмі, одну однорідну партію суміші і для рівномірного нг/мл Час, розподілу змащувального агента в матеріалі пе2 капсули по 2 капсули по година 1 капсула ред капсулюванням ЮОмг (пар- ЮОмг (пар200мг Капсулювання Готову гранульовану суміш катія 1) тія 2) псулювали, використовуючи капсулятор типу MG2 -0,25 0,22 0,00 0,00 G100a6oG120 Капсули полірували 0,5 103,74 117,89 212,61 Вищеописана ПОСЛІДОВНІСТЬ стадій дозволяє 1,0 418,24 446,39 647,00 отримати гранули з високою рівномірністю вмісту 575,68 606,97 826,90 1,5 целекоксиба на рівні одиниць дозування, які легко 2,0 646,83 656,98 862,23 розчиняються in vitro, мають достатню сипучість, 3,0 686,19 666,55 781,13 так що відтворюваність маси надійно забезпечу4,0 621,02 595,21 660,15 ється в процесі заповнення капсул, і мають доста6,0 389,00 387,41 383,81 тню об'ємну густину, так що партію можна переро8,0 322,24 332,51 323,59 бляти на вибраному обладнанні, і окремі дози вміщуються в капсули заданого розміру 12,0 214,63 208,06 209,96 16,0 149,11 146,40 144,23 Приклад 16 Дослідження бюеквівалентності 24,0 116,09 111,77 113,21 Бюеквівалентність і безпека 200-міліграмових доз целекоксиба визначали на групі із 46 здорових 36,0 52,76 48,27 46,98 дорослих людей, використовуючи рандомізовану 48,0 27,24 26,47 22,44 Таблиця 16В Фармакокшетичний параметр AUC(0 48), (нг/мл) година A U C J O LQC), ( н г / м л ) г о д и н а AUCJO ш), (нг/мл) година Стах, НГ/МЛ Ттах, ГОДИНа Т-і/2, година Стах/ A U C J O LQC) Значення фармакокінетичного параметра 1 капсула 200мг 2 капсули по ЮОмг (партія 1) 1 капсули по ЮОмг (партія 2) 8107,07 7976,56 8535,49 8063,17 7953,71 8501,94 8828,64 8640,46 9229,52 801,19 815,21 959,50 2,46 2,84 2,23 12,22 13,52 10,67 0,10 0,10 0,20 53 Приклад 17 Дослідження впливу харчування Для дослідження пропорційності дози і впливу харчування на фармакокшетичний профіль целекоксиба використали рандомізовану чотирикратну однодозову перехресну схему експерименту з відкритою міткою з участю дорослих здорових людей Безпеку оцінювали на основі спостереження за негативними побічними явищами, життєвими показниками і за результатами клініко-лабораторних досліджень 24 учасника експерименту отримували при випадковому розподілі такі одиничні дози целекоксиба (А) 50мг в капсулі натщесерце, (В) 50мг в капсулі безпосередньо після жирного сніданку, (С) ЮОмг в капсулі натщесерце, і (D) ЮОмг в капсулі безпосередньо після жирного сніданку Учасники отримували препарат, що досліджується в 1-й день, 8-й день, 15-й день і 22-й день експерименту по одній з чотирьох схем (ADBC, BACD CDBA і DCAB) Конкретна композиція, що міститься в капсулах з дозою ЮОмг, описана в Прикладі 1 Склад композиції в капсулах з дозою 50мг наведений в Таблиці 17А Моногідрат лактози Лаурилсульфат натрію Повідон (К29-32) Натрієва сіль кроскармелози Стеарат магнію Сумарна маса вмісту капсули 199,8 8,1 6,8 2,7 2,7 270,0 Вищезгадані одиничні дози композиції вміщували в тверді желатинові капсули (білі непрозорі, розмір №2) Проби крові відбирали в моменти -0,25 години (тобто до прийому дози), потім через 0,5 години, 1 годину, 1,5 години, 2 години, 3 години, 4 години, 6 годин, 8 годин, 12 годин, 16 годин, 24 години, 36 годин і 48 годин після прийому дози Аналізи виділеної плазми були виконані фірмою PPD Pharmaco, Richmond, VA Концентрації целекоксиба в плазмі визначали методом високоефективної рідинної хроматографії (ВЕРХ) за атестованою методикою, що забезпечує нижню межу детектування 10,0нг/мл Ніяких КЛІНІЧНО значущих змін життєвих показників і фізичних характеристик учасників не виявлено Всі негативні побічні ефекти були незначної важкості Усереднені результати для 24 учасників експерименту представлені в Таблицях 17В і 17С Таблиця 17А Інгредієнт Целекоксиб 54 58576 КІЛЬКІСТЬ, МГ 50,00 Таблиця 17В Час, година -0,25 0,5 1,0 1,5 2,0 3,0 4,0 6,0 8,0 12,0 16,0 24,0 36,0 48,0 Капсула ЮОмг (натщесерце) 0,00 63,96 225,65 344,77 354,45 348,03 333,86 196,53 152,35 121,08 86,13 61,77 38,00 17,77 Концентрація целекоксиба в плазмі, нг/мл Капсула ЮОмг (після Капсула 50мг (натщежирного сніданку) серце) 0,00 0,00 1,35 52,90 14,00 155,07 49,37 202,22 139,43 220,15 438,99 253,85 600,00 244,80 355,65 118,58 314,54 91,79 179,04 61,13 102,12 39,51 49,31 28,22 17,88 10,69 7,91 5,77 Капсула 50мг (після жирного сніданку) 0,00 2,38 11,98 29,85 63,00 186,94 298,23 188,90 165,85 88,76 51,86 22,81 8,75 3,80 Таблиця 17С Фармакокшетичний параметр Концентрація целекоксиба в плазмі, нг/мл Капсула ЮОмг Капсула 50мг Капсула 50мг (піс(після жирного (натщесерце) ля жирного снідасніданку) нку) 5214,86 2601,10 2426,23 5105,50 2501,56 2352,68 Капсула ЮОмг (натщесерце) AUC(Q48), (нг/мл) година юсі, (нг/мл) година 4463,28 4415,59 AUCJO m ), (нг/мл) година 5126,74 5419,21 2693,80 2759,42 455,00 746,96 321,46 354,17 Tmax, ГОДИНа 2,60 5,00 2,92 4,46 Т-і/2, година 16,02 6,86 11,01 6,49 0,11 0,15 0,16 0,16 НГ/МЛ' «-ТПЯХ ' A U O (0 LQC) Приклад 18 Порівняння фармакокінетики су спензії, капсульованої композиції 56 55 58576 Фармакокінетику і бюдоступність високодисСтеарат магнію 0,80 0,48 персної суспензії для перорального прийому і двох Фармацевтичну композицію, застосовану в какапсульованих лікарських форм для перорального псулах з дозою ЮОмг, готували шляхом пропусприйому порівнювали при використанні рандомікання початкового целекоксиба через вібраційне зованої однодозової перехресної схеми експерисито 40меш (розмір отвору 0,42мм) (ІНШІ способи менту з відкритою міткою 36 дорослих здорових подрібнення не використовували), вологого грануучасників експерименту отримували однократно за лювання целекоксиба з лактозою і повідоном в випадковою схемою такі дози целекоксиба (А) планетарному змішувачі з малим зусиллям зсуву, одну капсулу з дозою 200мг, (В) 2 капсули з дозасушіння на ПІДДОНІ і помелу гранульованої суміші з ми по ЮОмг, і (С) 200мг у вигляді високодисперсподальшим доданням до неї стеарату магнію і ної суспензії У 1-й день, 8-й день і 15-й день ексзмішуванням для отримання готової фармацевтиперименту учасники отримували один з трьох вичної композиції дів препарата у ВІДПОВІДНОСТІ ЗІ схемою рандоміВисокодисперсну суспензію для перорального зацм Інтервали між прийомами препарата прийому готували шляхом розчинення целекоксистановили 7 днів Склад фармацевтичної компоба в етанолі з добавкою 5% полісорбату 80 і дозиції в капсулах з дозою 200мг описаний в Придання цієї суміші до яблучного соку перед вживанкладі 2 Склад композиції в капсулах з дозою ням ЮОмг представлений в таблиці 18А Проби крові відбирали в момент -0,25 години (тобто перед прийомом дози) і протягом 72 годин Таблиця 18А після прийому препарата Кожного учасника обстежували окремо після прийому капсули з дозою КІЛЬКІСТЬ, Масова частка, 200мг, капсул з дозами по ЮОмг і високодисперсІнгредієнт ної суспензії Інтервали між прийомами 200мг % міліграмових доз складали не менш 7 днів УсереЦелекоксиб 100,0 60,0 днені результати для 36 учасників представлені в Моногідрат лактози 61,7 37,0 таблиці 18В Повідон К29-32 4,20 2,51 Таблиця 18В Фармакокшетичний параметр AUCJO 72), (нг/мл) година AUCJO ш), (нг/мл) година Стах, НГ/МЛ Ттах, ГОДИНа Т-і/2, година Кліренсю 72), 1/година Значення с зармакокінетичного параметра 2 капсули по ЮОмг 1 капсула 200мг 200мг суспензії 7247,5±2427,5 7648,1 ±2412,1 7736,2+2488,2 7562,4+2494,0 7830,3±2448,4 8001,2±2535,6 619,7+249,4 704,6+265,7 1228,8±452,0 3,00±0,99 2,83±1,06 0,79±0,32 13,96±5,27 11,92±3,60 13,33±6,69 30,4±9,8 28,4±7,8 28,1±7,8 Швидкість засвоєння целекоксиба з високодисперсної суспензії для перорального прийому загалом була більшою (Стах вище, а Т т а х менше), НІЖ з капсул Однак загальний ступінь засвоєння целекоксиба з суспензії, що характеризується значеннями AUCJO 72) або AUjo m), був аналогічний ступеню засвоєння з капсул Оскільки МОЖЛИВІ різні модифікації вищеописаних композицій і способів, без зміни сутності даного винаходу, мається на увазі, що всю інформацію, що міститься у вищенаведеному описі, потрібно розглядати як ілюстративну і таку, що не має обмежувального значення 57 58 58576 мокргідрат, лзь^ози, ПШШНІЛШрШЕДОН, mijasea иль хроскармелози Змішування (змішувач з високим зущллям зсуву) Ьгашге гранулювання Хзшжувачз Ху Змішування ВИСОКИМ зусиллям зсуву) Вологни помел: (млик) Сщиіння (сушарка з тюевдоекранленим жаром) • Сухий помел (шин) , Зщи[уврпсг забанний зміїщтвач) "Стеарат магшю Капсулювання ФІГ. 1 Целекоксиб Моногідрат лщтози, НОШЕІВЩЩИШДОН, натозева иль •Тоже подрібнення (!ШЛЬОД--ВИЙ мянн) ЗіМішрання (зшшувач з високим вач з високим Лауршкульфаг натрш, вода Подате гоануяювзння (змішувач а високим зусиддям ЗСУВУ) Змішування ВолвгаЙ помел • (ьопш) \ 2 59 Комп'ютерна верстка Е Гапоненко 58576 60 Підписано до друку 05 09 2003 Тираж 39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions of celecoxib
Назва патенту російськоюКомпозиции целекоксиба
МПК / Мітки
МПК: A61K 31/415, A61P 29/00, A61P 35/00, A61P 19/00
Мітки: містить, композиція, целекоксиб, фармацевтична
Код посилання
<a href="https://ua.patents.su/30-58576-farmacevtichna-kompoziciya-shho-mistit-celekoksib.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить целекоксиб</a>
Попередній патент: Спосіб обмеження водоприпливу у свердловину
Наступний патент: Теплозберігаюча витяжка для побутової плити
Випадковий патент: Спосіб прогнозування розвитку карієсу постійних зубів у дітей