Похідні фенілпіперидину, фармацевтична композиція на їх основі та їх застосування для приготування лікарського засобу для лікування афективних розладів
Номер патенту: 93857
Опубліковано: 25.03.2011
Автори: Пюшл Аск, Рухланд Томас, Банг-Андерсен Бенні, Андерсен Кім, Мольтсен Айнер Кнуд, Сміт Гаррік Пол
Формула / Реферат
1. Похідні фенілпіперидину загальної формули І
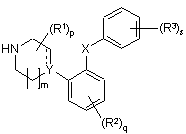 , I
, I
де
Y являє собою С або СН;
Х являє собою S;
m дорівнює 1 або 2;
р дорівнює 0, 1, 2, 3, 4, 5, 6, 7 або 8;
q дорівнює 0, 1, 2, 3 або 4;
s дорівнює 1 або 2;
пунктирна лінія являє собою необов'язковий зв'язок;
кожний R1 є незалежно вибраним з групи, представленої С1-6-алкілом, або два R1, приєднані до одного й того ж атома вуглецю, можуть утворювати 3-6-членний спіроприєднаний циклоалкіл;
кожний R2 є незалежно вибраним з груп, представлених галогеном, ціаногрупою, нітрогрупою, С1-6-алк(ен/ін)ілом, С1-6-алк(ен/ін)ілоксигрупою, С1-6-алк(ен/ін)ілсульфанілом, гідроксигрупою, гідроксі-С1-6-алк(ен/ін)ілом, галоген-С1-6-алк(ен/ін)ілом, галоген-С1-6-алк(ен/ін)ілоксигрупою, С3-8-циклоалк(ен)ілом, С3-8-циклоалк(ен)іл-С1-6-алк(ен/ін)ілом, ацилом, С1-6-алк(ен/ін)ілоксикарбонілом, С1-6-алк(ен/ін)ілсульфонілом або -NRxRy; -NRxCO-Cl-6-aлк(eн/iн)iлoм;
кожний R3 є незалежно вибраним з групи, що складається з галогену, С1-6-алкоксигрупи, С1-6-алкілсульфанілу, С1-6-алкілу, гідроксигрупи або трифторометилу;
де кожний Rx і Ry є незалежно вибраним з групи, представленої воднем, С1-6-алк(ен/ін)ілом, С3-8-циклоалк(ен)ілом, С3-8-циклоалк(ен)іл-С1-6-алк(ен/ін)ілом або арилом; або Rx і Ry разом з азотом, до якого вони приєднані, утворюють 3-7-членне кільце, яке необов'язково містить один додатковий гетероатом;
або їх фармацевтично прийнятні кислотно-адитивні солі.
2. Сполука за п. 1, де р дорівнює 0, 1 або 2.
3. Сполука за будь-яким з пп. 1-2, де R1 являє собою С1-6-алкіл.
4. Сполука за будь-яким з пп. 1-3, де m дорівнює 1 або 2.
5. Сполука за будь-яким з пп. 1-4, де q дорівнює 0, 1 або 2.
6. Сполука за будь-яким з пп. 1-5, де R2 являє собою трифторометил або С1-6-алкіл.
7. Сполука за п. 1, де згадана сполука вибрана з групи:
4-[2-(4-метилфенілсульфаніл)феніл]-3,6-дигідро-2Н-піридин,
4-[2-(4-метоксифенілсульфаніл)феніл]-3,6-дигідро-2Н-піридин або
4-[2-(4-метилфенілсульфаніл)феніл]піперидин;
або їх фармацевтично прийнятні кислотно-адитивні солі.
8. Сполука за п. 1, яка являє собою 4-[2-(4-метилфенілсульфаніл)феніл]-3,6-дигідро-2Н-піридин або його фармацевтично прийнятну кислотно-адитивну сіль.
9. Сполука за п. 1, яка являє собою 4-[2-(4-метоксифенілсульфаніл)феніл]-3,6-дигідро-2Н-піридин або його фармацевтично прийнятну кислотно-адитивну сіль.
10. Сполука за п. 1, яка являє собою 4-[2-(4-метилфенілсульфаніл)феніл]піперидин або його фармацевтично прийнятну кислотно-адитивну сіль.
11. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-10 або її фармацевтично прийнятну кислотно-адитивну сіль і принаймні один фармацевтично прийнятний носій або розріджувач.
12. Застосування сполуки за будь-яким з пп. 1-10 або її фармацевтично прийнятної кислотно-адитивної солі для приготування лікарського засобу для лікування афективних розладів, таких як депресія, тривожні розлади, включаючи генералізований тривожний розлад, панічний розлад і обсесивно-компульсивний розлад.
Текст
1. Похідні фенілпіперидину загальної формули І 2 (19) 1 3 93857 4 7. Сполука за п. 1, де згадана сполука вибрана з групи: 4-[2-(4-метилфенілсульфаніл)феніл]-3,6-дигідро2Н-піридин, 4-[2-(4-метоксифенілсульфаніл)феніл]-3,6-дигідро2Н-піридин або 4-[2-(4-метилфенілсульфаніл)феніл]піперидин; або їх фармацевтично прийнятні кислотноадитивні солі. 8. Сполука за п. 1, яка являє собою 4-[2-(4метилфенілсульфаніл)феніл]-3,6-дигідро-2Нпіридин або його фармацевтично прийнятну кислотно-адитивну сіль. 9. Сполука за п. 1, яка являє собою 4-[2-(4метоксифенілсульфаніл)феніл]-3,6-дигідро-2Нпіридин або його фармацевтично прийнятну кислотно-адитивну сіль. 10. Сполука за п. 1, яка являє собою 4-[2-(4метилфенілсульфаніл)феніл]піперидин або його фармацевтично прийнятну кислотно-адитивну сіль. 11. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-10 або її фармацевтично прийнятну кислотно-адитивну сіль і принаймні один фармацевтично прийнятний носій або розріджувач. 12. Застосування сполуки за будь-яким з пп. 1-10 або її фармацевтично прийнятної кислотноадитивної солі для приготування лікарського засобу для лікування афективних розладів, таких як депресія, тривожні розлади, включаючи генералізований тривожний розлад, панічний розлад і обсесивно-компульсивний розлад. Даний винахід стосується нових сполук, які є інгібіторами зворотного захоплення серотоніну і, таким чином, ефективні при лікуванні, наприклад, депресії і страху. Селективні інгібітори зворотного захоплення серотоніну (далі позначені як SSRI) стали першочерговими засобами для лікування депресії, різних форм страху і соціальних фобій, оскільки вони ефективні, добре переносяться пацієнтами і мають сприятливі показники безпеки в порівнянні з класичними трициклічними антидепресантами. Проте клінічні дослідження депресії показують, що нечутливість до SSRI значна, аж до 30 %. Іншим чинником при лікуванні антидепресантами, яким часто нехтують, є додержання пацієнтом режиму та схеми лікування, що має вельми глибокий вплив на мотивацію пацієнта стосовно продовжування фармакотерапії. Перш за все, існує запізнювання терапевтичного ефекту SSRI. Деякі симптоми навіть погіршуються під час перших тижнів лікування. По-друге, побічним ефектом усіх SSRI звичайно є сексуальна дисфункція. Без вирішення цих проблем не можна казати про досягнення реального прогресу у фармакотерапії депресії й тривожних розладів. Щоб справитися з нечутливістю, психіатри іноді використовують стратегію посилення дії. Терапія з посиленням дії антидепресантів може бути здійснена сумісним введенням стабілізаторів настрою, таких як карбонат літію або трийодотиронін, або шляхом застосування електрошоку. Ефект комбінованого введення сполуки, яка інгібує зворотне захоплення серотоніну, і антагоніста рецептора 5-НТ1A був оцінений в декількох дослідженнях (Innis et al. Eur. J. Pharmacol. 1987, 143, 1095-204 і Gartside Br. J. Pharmacol. 1995, 115, 1064-1070, Blier et al. Trends in Pharmacol. 1994, 75, 220). У вказаних дослідженнях було знайдено, що антагоністи рецептора 5-НТ1A можуть усувати гальмування нейротрансмісії 5-НТ, викликаної інгібіторами зворотного захоплення серотоніну, і таким чином забезпечувати негайне посилення трансмісії 5-НТ і швидкий початок терапевтичної дії. Були зареєстровані деякі патентні заявки, які охоплюють застосування комбінації антагоніста 5НТ1A та інгібітора зворотного захоплення серотоніну для лікування депресії (див., наприклад, патенти ЕР-А2-687472 і ЕР-А2-714663). Іншим підходом до збільшення кінцевого 5-НТ може бути блокування ауторецептора 5-НТ1B. Експерименти з мікродіалізу на щурах дійсно показують, що збільшення гіпокампального 5-НТ циталопрамом підсилюється GMC 2-29, експериментальним антагоністом рецептора 5НТ1B. Також зареєстровані різні патентні заявки, які відносяться до комбінації SSRI і антагоніста або часткового агоніста 5-НТ1B (WO 97/28141, WO 96/03400, ЕР-А-701819 і WO 99/13877). Раніше було знайдено, що комбінація інгібітора зворотного захоплення серотоніну із сполукою, що має антагоністичну або зворотну агоністичну дію на 5-НT2С (сполуками, що мають негативну ефективність по відношенню до рецептора 5НТ2C), дає значне підвищення рівня 5-НТ в кінцевих ділянках, як виміряно в дослідах з мікродіалізу (патент WO 01/41701). Це означатиме більш швидкий початок антидепресивної дії в клініці та наростання або потенціювання терапевтичного ефекту інгібітора зворотного захоплення серотоніну (SRI). Даним винаходом пропонуються сполуки, які є інгібіторами зворотного захоплення серотоніну, для лікування афективних розладів, таких як депресія, тривожні розлади, включаючи генералізований тривожний, панічний розлад і обсесивнокомпульсивний розлад. Деякі з вказаних сполук мають комбіновану дію інгібування зворотного захоплення серотоніну і модуляції рецептора 5НT2С, що згідно з WO 01/41701 означає більш швидкий початок антидепресивної дії. Деякі сполуки, охоплені даним винаходом, раніше були описані в патентах WO 01/49681 і WO 02/59108. Проте, ці сполуки за WO 01/49681 не описані як такі, що мають терапевтичну або біологічну активність. Сполуки за WO 02/59108 описані як проміжні продукти в синтезі сполук, відмінних від сполук даного винаходу, з терапевтичною активністю антагоністів рецептора меланокортину. 5 93857 Одну сполуку, 1-(2-феноксифеніл)піперазин, охоплену даним винаходом, описано в патенті US 4 064 245 як придатну для лікування метаболічних розладів. Суть винаходу Даний винахід пропонує сполуки загальної формули І до одного і того ж атома вуглецю, можуть утворювати 3-6-членний спіроприєднаний циклоалкіл; кожний R2 є незалежно вибраним з груп, представлених галогеном, ціаногрупою, нітрогрупою, С1-6-алк(ен/ін)ілом, С1-6-алк(ен/ін)ілоксигрупою, С16-алк(ен/ін)ілсульфанілом, гідроксигрупою, гідроксіС1-6-алк(ен/ін)ілом, галоген-С1-6-алк(ен/ін)ілом, галоген-С1-6-алк(ен/ін)ілоксигрупою, С3-8циклоалк(ен)ілом, С3-8-циклоалк(ен)іл-С1-6алк(ен/ін)ілом, ацилом, С1-6алк(ен/ін)ілоксикарбонілом, С1-6алк(ен/ін)ілсульфонілом або -NRxRy; кожний R3 є незалежно вибраним з групи, представленої галогеном, ціаногрупою, нітрогрупою, С1-6-алк(ен/ін)ілом, С1-6алк(ен/ін)ілоксигрупою, С1-6алк(ен/ін)ілсульфанілом, гідроксигрупою, гідроксіС1-6-алк(ен/ін)ілом, галоген-С1-6-алк(ен/ін)ілом, галоген-С1-6-алк(ен/ін)ілоксигрупою, С3-8циклоалк(ен)ілом, С3-8-циклоалк(ен)іл-С1-6алк(ен/ін)ілом, С1-6-алк(ен/ін)ілсульфонілом, арилом, С1-6-алк(ен/ін)ілоксикарбонілом, ацилом, НRxСО-С1-6-алк(ен/ін)ілом, СОНRxRy або NRxRy; або два суміжні замісники R3 разом утворюють гетероцикл, сконденсований з фенільним кільцем, вибраним з групи, що складається з (R3)s (R1)p X HN Y (I) m (R2)q , де Y являє собою N, С або СН; Х являє собою О або S; m дорівнює 1 або 2; р дорівнює 0, 1, 2, 3, 4, 5, 6, 7 або 8; q дорівнює 0, 1, 2, 3 або 4; s дорівнює 0, 1, 2, 3, 4 або 5; пунктирна лінія являє собою необов'язковий зв'язок; кожний R1 є незалежно вибраним з групи, представленої С1-6-алкілом, або два R1, приєднані R' W R'' , W 6 W R' R' R' R'' , R'' , R'' , R' R'' , де W являє собою О або S і R' і R'' означають водень або С1-6-алкіл; або два суміжні замісники R3 разом утворюють сконденсовану гетероароматичну систему, яка містить один, два або три гетероатоми; де кожний Rx і Ry є незалежно вибраним з групи, представленої воднем, С1-6-алк(ен/ін)ілом, С3-8циклоалк(ен)ілом, С3-8-циклоалк(ен)іл-С1-6алк(ен/ін)ілом або арилом; або Rx і Ry разом з азотом, до якого вони приєднані, утворюють 3-7членне кільце, яке необов'язково містить один додатковий гетероатом; або їх кислотно-адитивні солі. Винахід також пропонує сполуки, визначені вище, за умови, що сполука не є 1-(2феноксифеніл)піперазином. Винахід також пропонує сполуки, визначені вище, причому сполука не є 1-[2-(2метоксифенокси)феніл]піперазином, 1-[2-(2,6диметоксифенокси)феніл] [1,4]діазепаном, 1-{2-[3(диметиламіно)фенокси]феніл}піперазином, 1-[2(4-метилфенокси)феніл]піперазином, 1-[2-(3метилфенокси)феніл]піперазином, 1-[2-(3хлорофенокси)феніл]піперазином, 1-[2-(3метоксифенокси)феніл]піперазином і 1-(2феноксифеніл)піперазином. В переважному варіанті здійснення винахід також пропонує сполуки загальної формули І W (R3)s (R1)p X HN Y (I) m (R2)q , де Y являє собою С або СН; Х являє собою S; m дорівнює 1 або 2; р дорівнює 0, 1, 2, 3, 4, 5, 6, 7 або 8; q дорівнює 0, 1, 2, 3 або 4; s дорівнює 1 або 2; пунктирна лінія являє собою необов'язковий зв'язок; кожний R1 є незалежно вибраним з групи, представленої С1-6-алкілом, або два R1, приєднані до одного й того ж атома вуглецю, можуть утворювати 3-6-членний спіроприєднаний циклоалкіл; кожний R2 є незалежно вибраним з груп, представлених галогеном, ціаногрупою, нітрогрупою, С1-6-алк(ен/ін)ілом, С1-6-алк(ен/ін)ілоксигрупою, С16-алк(ен/ін)ілсульфанілом, гідроксигрупою, гідроксіС1-6-алк(ен/ін)ілом, галоген-С1-6-алк(ен/ін)ілом, галоген-С1-6-алк(ен/ін)ілоксигрупою, С3-8циклоалк(ен)ілом, С3-8-циклоалк(ен)іл-С1-6алк(ен/ін)ілом, ацилом, С1-6 7 алк(ен/ін)ілоксикарбонілом, С1-6алк(ен/ін)ілсульфонілом або -NRxRy; -NRxCO-C1-6aлк(eн/iн)iлoм; кожний R3 є незалежно вибраним з групи, що складається з галогену, С1-6-алкоксигрупи, С1-6алкілсульфанілу, С1-6-алкілу, гідроксигрупи або трифторометилу; де кожний Rx і Ry є незалежно вибраним з групи, представленої воднем, С1-6-алк(ен/ін)ілом, С3-8циклоалк(ен)ілом, С3-8-циклоалк(ен)іл-С1-6алк(ен/ін)ілом або арилом; або Rx і Ry разом з азотом, до якого вони приєднані, утворюють 3-7членне кільце, яке необов'язково містить один додатковий гетероатом; або їх фармацевтично прийнятні кислотноадитивні солі. Винахід передбачає сполуку згідно з вищезгаданому для застосування як лікарський засіб. Винахід передбачає фармацевтичну композицію, яка містить сполуку згідно вищезгаданому або її фармацевтично прийнятну кислотно-адитивну сіль і принаймні один фармацевтично прийнятний носій або розріджувач. Винахід передбачає застосування сполуки згідно вищезгаданому або її фармацевтично прийнятної кислотно-адитивної солі для приготування лікарського засобу для лікування афективних розладів, таких як депресія, тривожні розлади, включаючи генералізований тривожний розлад, панічний розлад і обсесивно-компульсивний розлад. Винахід передбачає спосіб лікування афективного розладу, включаючи депресію, тривожні розлади, включаючи генералізований тривожний розлад, панічний розлад і обсесивнокомпульсивний розлад, у вищих тварин, включаючи людину, який передбачає введення терапевтично ефективної кількості сполуки згідно з вищезгаданому або її фармацевтично прийнятної кислотно-адитивної солі. Докладний опис винаходу Переважними варіантами здійснення винаходу є такі, де р дорівнює 0; переважними варіантами здійснення винаходу є такі, де m дорівнює 1 або 2; переважними варіантами здійснення винаходу є такі, де R2 являє собою трифторометил або С1-6алкіл; переважними варіантами здійснення винаходу є такі, де R3 вибрані з групи, яка складається з галогену, С1-6-алкоксигрупи, С1-6-алкілсульфанілу, С1-6-алкілу, гідроксигрупи та трифторометилу; зокрема, переважними варіантами здійснення винаходу є такі, де сполука винаходу є будь-якою з наступних: 1-[2-(2трифторометилфенілсульфаніл)феніл]піперазин, 1-[2-(4-бромофенілсульфаніл)феніл]піперазин, 1-{2-[4-(метилсульфаніл)фенілсульфаніл] феніл} піперазин, 1-[2-(4-гідроксифенілсульфаніл)феніл] піперазин, 1-[2-(2,4-диметилфенілсульфаніл)феніл] піперазин, 1-[2-(3,5-диметилфенілсульфаніл)феніл] піперазин, 93857 8 1-[2-(2,6-диметилфенілсульфаніл)феніл] піперазин, 1-[2-(2,5-диметилфенілсульфаніл)феніл] піперазин, 1-[2-(2-трифторометилфенілсульфаніл) феніл][1,4]діазепан, 1-[2-(3-метилфенілсульфаніл)феніл] [1,4]діазепан, 1-[2-(4-бутилфенокси)феніл]піперазин, 1-[2-[(4-метоксифенокси)феніл]піперазин, 2-(4-метилфенілсульфаніл)феніл-1-піперазин, 1-[2-(4-хлорофенілсульфаніл)феніл]піперазин, 1-[2-(4-метоксифенілсульфаніл)-4хлорофеніл]піперазин, 1-[2-(4-метоксифенілсульфаніл)-4метилфеніл]піперазин, 1-[2-(4-метоксифенілсульфаніл)-5метилфеніл]піперазин, 1-[2-(4-фторофенілсульфаніл)-5метилфеніл]піперазин, 1-[2-(4-метоксифенілсульфаніл)-5трифторометилфеніл]піперазин, 1-[2-(4-хлорофенілсульфаніл)феніл]-3метилпіперазин, 1-[2-(4-хлорофенілсульфаніл)феніл]-3,5диметилпіперазин, 4-[2-(4-метилфенілсульфаніл)феніл]-3,6дигідро-2Н-піридин, 4-[2-(4-метоксифенілсульфаніл)феніл]-3,6дигідро-2Н-піридин або 4-[2-(4-метилфенілсульфаніл)феніл]піперидин, або її фармацевтично прийнятною кислотноадитивною сіллю. Переважними варіантами здійснення винаходу є такі, де р дорівнює 0,1 або 2. Переважними варіантами здійснення винаходу є такі, де q дорівнює 0, 1 або 2. Зокрема, переважними варіантами здійснення винаходу є такі, де сполука винаходу являє собою: 4-[2-(4-метилфенілсульфаніл)феніл]-3,6дигідро-2Н-піридин, 4-[2-(4-метоксифенілсульфаніл)феніл]-3,6дигідро-2Н-піридин або 4-[2-(4-метилфенілсульфаніл)феніл]піперидин; або їх фармацевтично прийнятні кислотноадитивні солі. Визначення замісників Галоген означає фтор, хлор, бром або йод. Вираз "С1-6-алк(ен/ін)іл" означає С1-6-алкільну, С2-6-алкенільну або С2-6-алкінільну групу. Вираз "С3-8-циклоалк(ен)іл" означає С3-8-циклоалкільну або циклоалкенільну групу. Термін "С1-6-алкіл" стосується розгалуженої або нерозгалуженої алкільної групи, що містить від одного до шести атомів вуглецю включно, включаючи без обмеження метил, етил, 1-пропіл, 2пропіл, 1-бутил, 2-бутил, 2-метил-2-пропіл і 2метил-1-пропіл. Аналогічно, С2-6-алкеніл і С2-6-алкініл, відповідно, означають такі групи, що містять від двох до шести атомів вуглецю, включаючи один подвійний зв'язок і один потрійний зв'язок, відповідно, включаючи без обмеження етеніл, пропеніл, бутеніл, етиніл, пропініл і бутиніл. 9 Термін "С3-8-циклоалкіл" означає моноциклічний або біциклічний карбоцикл, що містить від трьох до восьми С-атомів, включаючи без обмеження циклопропіл, циклопентил, циклогексил тощо. Термін "С3-8-циклоалкеніл" означає моноциклічний або біциклічний карбоцикл, що містить від трьох до восьми С-атомів і включає один подвійний зв'язок. В терміні "С3-8-циклоалк(ен)іл-С1-6-алк(ен/ін)іл" С3-8-циклоалк(ен)іл і С1-6-алк(ен/ін)іл є такими, як визначено вище. Терміни "С1-6-алк(ен/ін)ілоксигрупа", "С1-6алк(ен/ін)ілсульфаніл", "гідроксі-С1-6-алк(ен/ін)іл", "галоген-С1-6-алк(ен/ін)іл", "галоген-С1-6алк(ен/ін)ілоксигрупа", "С1-6-алк(ен/ін)ілсульфоніл" тощо означають такі групи, в яких С1-6-алк(ен/ін)іл є таким, як визначено вище. Як використано тут, термін "С1-6алк(ен/ін)ілоксикарбоніл" стосується груп формули С1-6-алк(ен/ін)іл-О-СО-, де С1-6-алк(ен/ін)іл є таким, як визначено вище. Як використано тут, термін "ацил" стосується формілу, С1-6-алк(ен/ін)ілкарбонілу, арилкарбонілу, арил-С1-6-алк(ен/ін)ілкарбонілу, С3-8циклоалк(ен)ілкарбонілу або С3-8-циклоалк(ен)ілС1-6-алк(ен/ін)іл-карбонільної групи. Термін "3-7-членне кільце", яке необов'язково містить один додатковий гетероатом, як використано тут, стосується кільцевих систем, таких як 1морфолініл, 1-піперидиніл, 1-азепініл, 1піперазиніл, 1-гомопіперазиніл, 1-імідазоліл, 1піроліл або піразоліл, усі з яких можуть бути заміщені С1-6-алкілом. Гетероцикли, утворені двома суміжними замісниками R3 і сконденсовані з родоначальним кільцем, можуть разом утворювати кільця, такі як 5членні моноциклічні кільця, такі як 3H-1,2,3оксатіазол, 1,3,2-оксатіазол, 1,3,2-діоксазол, 3H1,2,3-дитіазол, 1,3,2-дитіазол, 1,2,3-оксадіазол, 1,2,3-тіадіазол, 1H-1,2,3-триазол, ізоксазол, оксазол, ізотіазол, тіазол, 1H-імідазол, 1H-піразол, 1Hпірол, фуран або тіофен, і 6-членні моноциклічні кільця, такі як 1,2,3-оксатіазин, 1,2,4-оксатіазин, 1,2,5-оксатіазин, 1,4,2-оксатіазин, 1,4,3-оксатіазин, 1,2,3-діоксазин, 1,2,4-діоксазин, 4H-1,3,2діоксазин, 1,4,2-діоксазин, 2H-1,5,2-діоксазин, 1,2,3-дитіазин, 1,2,4-дитіазин, 4H-1,3,2-дитіазин, 1,4,2-дитіазин, 2H-1,5,2-дитіазин, 2H-1,2,3оксадіазин, 2H-1,2,4-оксадіазин, 2H-1,2,5оксадіазин, 2H-1,2,6-оксадіазин, 2H-1,3,4оксадіазин, 2H-1,2,3-тіадіазин, 2H-1,2,4-тіадіазин, 2H-1,2,5-тіадіазин, 2H-1,2,6-тіадіазин, 2H-1,3,4тіадіазин, 1,2,3-триазин, 1,2,4-триазин, 2H-1,2оксазин, 2H-1,3-оксазин, 2H-1,4-оксазин, 2H-1,2тіазин, 2H-1,3-тіазин, 2H-1,4-тіазин, піразин, піридазин, піримідин, 4H-1,3-оксатіїн, 1,4-оксатіїн, 4H1,3-діоксин, 1,4-діоксин, 4H-1,3-дитіїн, 1,4-дитіїн, піридин, 2H-піран або 2H-тіїн. Термін "арил" стосується карбоциклічних ароматичних систем, таких як феніл і нафтил. Кислотно-адитивними солями за цим винаходом є фармацевтично прийнятні солі сполук за винаходом, одержані при взаємодії з нетоксичними кислотами. Прикладами таких органічних солей 93857 10 є солі малеїнової, фумарової, бензойної, аскорбінової, бурштинової, щавлевої, бісметиленсаліцилової, метансульфонової, етандисульфонової, оцтової, пропіонової, винної, саліцилової, лимонної, глюконової, молочної, яблучної, мигдалевої, коричної, цитраконової, аспарагінової, стеаринової, пальмітинової, ітаконової, гліколевої, р-амінобензойної, глютамінової, бензолсульфонової та теофіліноцтової кислот, а також утворені з 8-галогентеофілінами, наприклад 8бромотеофіліном. Типовими прикладами таких неорганічних солей є солі хлористоводневої, бромистоводневої, сірчаної, сульфамінової, фосфорної та азотної кислот. Крім того, сполуки за цим винаходом можуть існувати в несольватованих і сольватованих формах, одержаних при використанні фармацевтично прийнятних розчинників, таких як вода, етанол тощо. Сольватовані форми звичайно еквівалентні несольватованим формам відповідно до задач цього винаходу. Деякі сполуки даного винаходу мають хіральні центри, і такі сполуки існують у формі ізомерів (тобто енантіомерів). Винахід охоплює всі такі ізомери і будь-які їх суміші, включаючи рацемічні суміші. Рацемічні форми можна розподілити на оптичні антиподи за відомими способами, наприклад, шляхом розподілу їх діастереомерних солей за допомогою оптично активної кислоти та наступного вивільнення оптично активної амінної сполуки шляхом обробки основою. Іншим способом розподілу рацематів на оптичні антиподи є хроматографія на оптично активній матриці. Рацемічні сполуки за цим винаходом можна також розподілити на оптичні антиподи, наприклад, фракційною кристалізацією d- або l-солей (тартратів, манделатів або камфорсульфонатів). Сполуки за цим винаходом можна розподілити шляхом утворення діастереомерних похідних. Можуть бути використані додаткові способи розподілу оптичних ізомерів, відомі фахівцям в даній галузі техніки. Такими способами є обговорені Jaques J., Collet A. and Wilen S. в "Enantiomers, Racemates, and Resolutions", John Wiley and Sons, New York (1981). Оптично активні сполуки також можуть бути одержані з оптично активних початкових речовин. Фармацевтичні композиції Фармацевтичні композиції винаходу можуть бути одержані за стандартними способами, відомими з рівня техніки. Наприклад, таблетки можуть бути одержані змішуванням активного інгредієнта із звичайними ад'ювантами та/або розріджувачами і подальшим пресуванням суміші на звичайній таблетувальній машині. Приклади ад'ювантів або розріджувачів включають: кукурудзяний крохмаль, картопляний крохмаль, тальк, стеарат магнію, желатин, лактозу, камеді і подібні. Для такої мети як фарбування, додання смаку, консервація тощо, можуть бути використані будь-які інші ад'юванти або добавки, які забезпечують сумісність з активними інгредієнтами. Розчини для ін'єкцій можуть бути одержані розчиненням активного інгредієнта і можливих доба 11 93857 вок в частині розчинника для ін'єкції, переважно - в стерильній воді, доведенням розчину до бажаного об'єму, стерилізацією розчину і заповненням ним відповідних ампул або пляшечок. Можуть бути додані будь-які відповідні добавки, які звичайно використовуються на практиці, такі як агенти ізотонічності, консерванти, антиоксиданти тощо. Фармацевтичні композиції даного винаходу або виготовлені відповідно до даного винаходу, можуть бути введені будь-яким звичайним шляхом, наприклад перорально у формі таблеток, капсул, порошків, сиропів тощо, або парентерально у формі розчинів для ін'єкцій. Для приготування вказаних композицій можуть бути використані способи, добре відомі на практиці, і можуть бути використані будь-які фармацевтично прийнятні носії, розріджувачі, ексципієнти або інші добавки, що звичайно використовуються на практиці. Зручно вводити сполуки винаходу у стандартній дозованій формі, яка містить вказані сполуки в кількості приблизно від 0,01 до 100 мг. Загальна денна доза звичайно знаходиться в інтервалі приблизно 0,05-500 мг і найбільш переважно приблизно від 0,1 до 50 мг активної сполуки винаходу. Сполуки винаходу одержують за наступними загальними способами. a) Видалення захисту або відщеплювання від полімерної підкладки сполуки формули II (R1)p O Z N (R3)s X (IV) H2N (R2)q , де R , R , X, s і q є такими, як визначено вище, з алкілувальним агентом формули (Сl(CH2)m+1)NH(CH2)2Cl або (Br-(CH2)m+1)NH(CH2)2Br, де m є таким, як визначено вище. d) Взаємодія сполуки формули V 2 3 (R3)s X (V) G (R2)q , де R2, R3, X, s і q є такими, як визначено вище, і G являє собою атом брому або йоду, із сполукою формули VI (R1)p HN X (VI) NH m (II) R'''O 12 Y (R2)q , , де R , m і р є такими, як визначено вище. e) Дегідратація і необов'язково одночасне видалення захисту сполуки формули VII 1 де Z являє собою (R3)s (R1)p , і R1, R2, R3, m, р, q, s, X, Y і пунктирна лінія є такими, як визначено вище, і R''' являє собою третбутильну, метильну, етильну, алільну або бензильну групу, або R'''OCO2 являє собою карбаматну групу твердої підкладки, такої як карбаматний лінкер на основі смоли Ванга. b) Хімічне перетворення сполуки формули III (R1)p H2N HN X OH (VII) HN (R2)q m , де R1, R2, R3, X, m, p, q і s є такими, як визначено вище, і R являє собою або атом водню, або групу ВОС. f) Гідрування подвійного зв'язку в сполуці формули VIII (ІІІ) Y (R2)q , де R , R , m, p, q, Y і пунктирна лінія є такими, як визначено вище, на відповідну діазосполуку і подальша взаємодія із сполукою HXZ, де Х і Z є такими, як визначено вище. c) Взаємодія сполуки формули IV 1 (R3)s (R1)p 2 (R3)s X (VIІI) HN m (R2)q , 1 2 3 де R , R , R , X, m, p, q і s є такими, як визначено вище. Видалення захисту в способі а) здійснюють за стандартною методикою, відомою фахівцям в даній галузі техніки та детально описаною в керівництві Protective Groups in Organic Synthesis Greene 13 93857 вуглеці в спиртовому розчиннику або відновлення з використанням хлориду металу, такого як хлорид цинку або хлорид олова. Отриманий анілін потім перетворювали на відповідно заміщений 3,5дикетопіперазин, модифікований за способом Kruse et al. Recl. Trav. Chim. Pays-Bas 1998, 707, 303, використовуючи N-бутилоксикарбонілімінодіоцтову кислоту. Похідне 3,5дикетопіперазину потім відновлювали, наприклад, бораном до відповідного ВОС-захищеного піперазину, з якого потім in situ видаляли захист з утворенням піперазину. T.W.and Wuts P.G.M., Wiley Interscience (1991) ISBN 0471623016. Початкові речовини формули II, де R''' - це трет-Вu, одержували згідно зі способом, описаним нижче. Похідні фторонітробензолу реагували з фенолами або тіофенолами згідно з описаним у Sawyer et al. J. Org. Chem. 1998, 63, 6338, з подальшим відновленням з використанням стандартної методики, відомої фахівцям в даній галузі. Вона передбачає відновлення до відповідного аніліну з використанням солі гідриду металу, такої як борогідрид натрію, разом з каталізатором паладій на Z Z X X X O2N O2N 14 O H2N R'''O (R2)q (R2)q (R1)p O X N Z (II) N (R2)q (R2)q O Сполуки, показані у формулі II, де Y - це СН і необов'язково подвійний зв'язок є відновленим, одержували з третинноспиртового попередника VII, де R являє собою групу ВОС, модифікованим відновленням за Бартоном аналогічно описаному у Hansen et al. Synthesis 1999, 1925-1930. Проміжні третинні спирти одержували з відповідних заміщених 1-бромофенілсульфанілбензолів або їх відповідних простих ефірів обміном метал-галоген з подальшим приєднанням відповідного електрофілу формули IX за способом, подібним описаному у Palmer et al. J. Med. Chem. 1997, 40, 1982-1989. Відповідно заміщені 1бромофенілсульфанілбензоли одержували за способом, подібним описаному в літературі: реакцією відповідно заміщених тіофенолів з відповідно заміщеними арилйодидами згідно з Schopfer and Schlapbach Tetrahedron 2001, 57, 3069-3073, Bates et al. Org. Lett. 2002, 4, 2803-2806 та Kwong et al. Org. Lett. 2002, 4 (у друку). Відповідні заміщені 1бромофеноксибензоли можуть бути одержані так, як описано у Buck et al. Org. Lett. 2002, 4, 16231626. FeCp+ (R1)p BOCN (IX) O m , Відщеплювання від полімерної підкладки, такої як карбаматний лінкер на основі смоли Ванга, згідно зі способом а), проводили за описаними в літературі методиками (Zaragoza Tetrahedron Lett. 1995, 36, 8677-8678 та Conti et al. Tetrahedron Lett. 1997, 38, 2915-2918). Початкова речовина формули II може бути також отримана згідно зі способом, описаним в патентній заявці WO 01/49681. Діаміни були або комерційно доступні, або синтезовані за способами, відомими фахівцям-хімікам. Комплекси заліза, подібні гексафторофосфату 6-1,2-дихлоробензол5-циклопентадієнілзаліза(II), і заміщені аналоги синтезували згідно зі способами, описаними в літературі (Pearson et al. J. Org. Chem. 1996, 61, 1297-1305), або синтезували за способами, відомими хімікам, фахівцям в даній галузі. (R2)q Cl O R'''O (R1)p O Cl N NH m R'''O (R1)p N FeCp+ HXZ N m O (R2)q Cl R'''O (R1)p N FeCp+ (R2)q (II) N m X Z Діазотування з подальшою взаємодією із сполукою HXZ за способом b) проводили додаванням солі діазонію відповідного аніліну до розчину натрієвої солі тіофенолу або фенолу у водній суспензії міді. Початкову речовину формули III одержували за наступною схемою. Похідне фторонітробензолу піддавали взаємодії з похідним піперазину в розчиннику, такому як ДМФА, NMP (Н-метил-2-піролідон) або інший диполярний апротонний розчинник, який містить органічну основу, таку як триетиламін, з утворенням похідного ортонітрофенілпіперазину. Проміжний ортонітрофенілпіперазин потім відновлювали, використовуючи стандартні методики, як вказано вище, з отриманням початкової речовини формули III. 15 Реакцію сполуки формули IV з алкілувальним агентом формули (Cl-(CH2)m+1)NH(CH2)2Cl або (Br(CH2)m+1)NH(CH2)2Br у вигляді його бромистоводневої або хлористоводневої солі, де m є таким, як визначено вище, проводили за способом, подібним описаному у Sircar et al. J. Med. Chem. 1992, 35, 4442-4449. Початкові речовини формули IV одержували так, як описано вище для початкових речовин формули II. Реакцію сполуки формули V з діаміном формули VI в способі d) проводили за способом, подібним описаному у Nishiyama et al. Tetrahedron Lett. 1998, 39, 617-620. Початкову речовину формули V одержували способом, подібним описаному у Schopfer et al. Tetrahedron 2001, 57, 3069-3073. Реакцію дегідратації та можливе одночасне видалення захисту сполуки формули VII в способі е) проводили за способом, подібним описаному у Palmer et al. J. Med. Chem. 1997, 40, 1982-1989. Початкову речовину формули VII, де R - це Н, одержували із сполуки формули VII, де R являє собою групу ВОС (див. вище), шляхом видалення захисту хлористоводневою кислотою в метанолі. Сполуки формули VII, де R - це ВОС, можуть бути одержані так, як описано у Palmer et al. J. Med. Chem. 1997, 40, 1982-1989. Відновлення подвійного зв'язку згідно зі способом f) звичайно проводили каталітичним гідруванням при низькому тиску (менше 3 атм) в апараті Пара або з використанням відновника, такого як диборан або бороводневе похідне, одержуваного in situ з NaBH4 в трифторооцтовій кислоті, в інертному розчиннику, такому як тетрагідрофуран (ТГФ), діоксан або діетиловий ефір. Початкову речовину формули VIII одержували з II, як описано в способі а). Приклади Дані аналізу РХ-МС одержували на приладі РЕ Sciex API 150EX, забезпеченому джерелом іонного розпилення ІonSpray і РХ-системою Shimadzu LC8A/SLC-10A. Колонка: колонка 30 Х 4,6 мм Waters Symmetry С 18 з розміром частинок 3,5 мкм. Система розчинників: А - це вода/трифторооцтова кислота (100:0,05), а В це вода/ацетонітрил/трифторооцтова кислота (5:95:0,03). Метод: елюювання з лінійним градієнтом від 90 % А до 100 % В за 4 хвилини і з об'ємною витратою 2 мл/хв. Чистоту визначали інтеграцією УФ-сліду (UV trace) (254 нм) і лінії ELSD. Час утримання (RT) виражали в хвилинах. Препаративну РХ-МС-очистку проводили на тому ж приладі. Колонка: 50 Х 20 мм YMC ODS-A з розміром частинок 5 мкм; метод: елюювання з лінійним градієнтом від 80 % А до 100 % В за 7 хвилин з об'ємною витратою 22,7 мл/хв. Фракційний збір проводили за допомогою МС-детектування розгалуженого потоку. Спектр 1Н-ЯМР реєстрували при 500,13 Мгц на приладі Bruker Avance DRX500 або при 250,13 Мгц на приладі Bruker AC 250. Як розчинники використовували дейтеровані метиленхлорид (99,8 % D), хлороформ (99,8 % D) або диметилсульфоксид (99,8 % D). Як внутрішній стандарт використовували TMS. Значення хімічних зсувів виражали в мільйонних частках (м. ч.). Для позначення муль 93857 16 типлетності сигналів ЯМР використовували наступні скорочення: с = синглет, д = дублет, т = триплет, к = квартет, кв = квінтет, г = гептет, дд = дублет дублетів, дт = дублет триплетів, дкв = дублет квартетів, тт = триплет триплетів, м = мультиплет і ш.с = широкий синглет. Для іонообмінної хроматографії використовували наступні матеріали: колонка SCX (1 г) від Varian Mega Bond Elut®, № 220776 за каталогом Chrompack. Перед застосуванням колонку SCX попередньо кондиціювали 10 % розчином оцтової кислоти в метанолі (3 мл). Для декомплексації шляхом опромінювання використовували джерело ультрафіолетового випромінювання (300 Вт) виробництва Philipps. Як початкову полімерну підкладку для твердофазного синтезу використовували смолу Ванга (1,03 ммоль/г, Rapp-Polymere, Tuebingen, Німеччина). Отримання проміжних продуктів Гексафторофосфат 6-1,2-дихлоробензол-5циклопентадієнілзаліза(ІІ) Фероцен (167 г), безводний трихлорид алюмінію (238 г) і порошкоподібний алюміній (24 г) суспендували в 1,2-дихлоробензолі (500 мл) і нагрівали при 90 °С в атмосфері азоту протягом 5 годин при інтенсивному перемішуванні. Суміш охолоджували до кімнатної температури і обережно маленькими порціями додавали воду (1000 мл) при охолоджуванні на льодяній бані. Додавали гептан (500 мл) і діетиловий ефір (500 мл) і суміш перемішували при кімнатній температурі протягом 30 хвилин. Суміш екстрагували діетиловим ефіром (3 х 300 мл). Водну фазу фільтрували і маленькими порціями додавали водний гексафторофосфат амонію (60 г в 50 мл води) при перемішуванні. Продукт залишали осаджуватися при кімнатній температурі. Через 3 години осад відфільтрували, інтенсивно промивали водою і сушили у вакуумі (50 °С), одержуючи 81 г (21 %) вказаної в заголовку сполуки у вигляді світло-жовтого порошку. 1НЯМР (D6-ДМСО): 5,29 (с, 5Н); 6,48 (м, 2Н); 7,07 (м, 2Н). Одержання амінів, зв'язаних з полістиролом 4-[(Піперазін-1-іл)карбонілоксиметил] феноксиметилполістирол 4-[(4-Нітрофенокси)карбонілоксиметил] феноксиметилполістирол (267 г, 235 ммоль) суспендували в безводному N,N-диметилформаміді (2 л). Додавали N-метилморфолін (238,0 г, 2,35 моль) і піперазин (102,0 г, 1,17 моль) і суміш перемішували при кімнатній температурі протягом 16 годин. Смолу відфільтрували і промивали N,Nдиметилформамідом (2 х 1 л), тетрагідрофураном (2 х 1 л), водою (1 х 500 мл), метанолом (2 х 1 л), тетрагідрофураном (2 х 1 л) і метанолом (1 х 1 л). Нарешті, смолу промивали дихлорометаном (3 х 500 мл) і сушили у вакуумі (25 °С, 36 годин), одержуючи майже безбарвну смолу (240,0 г). Аналогічно одержували наступний діамін, зв'язаний з полістиролом: 4-[(1,4-діазепан-1іл)карбонілоксиметил]феноксиметилполістирол Одержання зв'язаного із смолою гексафторофосфату 6-арил-5-циклопентадієнілзаліза(ІІ) 17 Гексафторофосфат 4-({4-[6(2-xлopoфeнiл)-5цuклoпентадiєнiлзалізо(II)] піперазин-1іл}карбонілоксиметил)феноксиметилполістиролу (проміжний продукт для Іа-Ih і Ik-Il) 4-[(Піперазін-1-іл)карбонілоксиметил] феноксиметилполістирол (115,1 г, 92 ммоль) суспендували в безводному тетрагідрофурані (1,6 л) і додавали гексафторофосфат 6-1,2-дихлоробензол5-циклопентадієнілзаліза(II) (76,0 г, 184 ммоль) і потім карбонат калію (50,9 г, 368 ммоль). Реакційну суміш перемішували при 60 °С протягом 16 годин. Після охолоджування до кімнатної температури смолу відфільтрували і промивали тетрагідрофураном (2 х 500 мл), водою (2 х 250мл), тетрагідрофураном (2 х 500 мл), водою (2 х 250 мл), метанолом (2 х 250 мл), дихлорометаном (2 х 250 мл) і метанолом (2 х 250 мл). Нарешті, смолу промивали дихлорометаном (3 х 500мл) і сушили у вакуумі (25 °С, 36 годин), одержуючи темно-оранжеву смолу (142 г). Аналогічно одержували наступний зв'язаний з полістиролом комплекс заліза: Гексафторофосфат 4-({4-[6(2-хлорофеніл)-5циклопентадієнілзалізо(ІІ)] [1,4]діазепан-1іл}карбонілоксиметил) феноксиметилполістиролу (проміжний продукт для Іі і Ij) Одержання інших проміжних продуктів 1-трет-Бутоксикарбоніл-4-[2-(4метилфенілсульфаніл)феніл]піперидин-4-ол Розчин BuLi (2,5 М в гексані, 12,0 мл, 30ммоль) повільно додавали до перемішуваного розчину 1-бромо-2-(4-метилфенілсульфаніл) бензолу (30 ммоль) в безводному ТГФ (75 мл) в атмосфері аргону при -78 °С. Розчин перемішували протягом 10 хвилин перед додаванням однією порцією трет-бутилового ефіру 4-оксопіперидин-1карбонової кислоти (5,98 г, 30 ммоль). Розчин залишали нагріватися до кімнатної температури і потім перемішували протягом 3 годин. Додавали насичений водний NH4Cl (150 мл) і розчин екстрагували етилацетатом (150 мл). Органічну фазу промивали насиченим розчином солі, сушили (MgSO4) і розчинник випаровували у вакуумі. Неочищену сполуку 1 очищали флешхроматографією на силікагелі (елюент:етилацетат/гептан, 20:80), одержуючи цільову сполуку у вигляді білої піни. РХ/МС (m/z) 399,3 (МH+); RT=3,82; чистота (УФ, ELSD): 98 %, 100 %; вихід: 5,02 г (42 %). 1-Трет-бутилоксикарбоніл-4-[2-(4метилфенілсульфаніл)феніл]-3,5-діоксопіперазин (проміжний продукт для 2а) 2-(4-Метилфенілсульфаніл)анілін (2,9 г, 13,5 ммоль) розчиняли в безводному ТГФ (200 мл) і поміщали в атмосферу азоту. До розчину додавали N-(трет-бутилоксикарбоніл)імінодіоцтову кислоту (4,7 г, 20,2 ммоль) і карбонілдіімідазол (4,2 г, 40,4 ммоль) і реакційну суміш кип'ятили із зворотним холодильником протягом 60 годин. Реакційну суміш охолоджували до кімнатної температури і додавали етилацетат (500 мл). Отриманий розчин потім промивали 2 н. NаНСО3 (2 х 200 мл), 2 н. НСl (2 х 200 мл) і насиченим розчином хлориду натрію (100 мл) і розчинники випаровували у вакуумі. Вихід 6,0 г, 107 %. 1Н-ЯМР (CDCl3) 1,5 (с, 9Н); 2,32 (с, 93857 18 3Н); 4,4-4,6 (м, 4Н); 7,02-7,18 (м, 3Н); 7,2-7,45 (м, 5Н). Аналогічним чином одержували наступні похідні 3,5-дикетопіперазину: 1-трет-бутилоксикарбоніл-4-[2-(4хлорофенілсульфаніл)феніл]-3,5-діоксопіперазин (проміжний продукт для 2b); 1-трет-бутилоксикарбоніл-4-[2-(4метоксифенілсульфаніл)-4-хлорофеніл]-3,5діоксопіперазин (проміжний продукт для 2с); 1-трет-бутилоксикарбоніл-4-[2-(4метоксифенілсульфаніл)-4-метилфеніл]-3,5діоксопіперазин (проміжний продукт для 2d); 1-трет-бутилоксикарбоніл-4-[2-(4метоксифенілсульфаніл)-5-метилфеніл]-3,5діоксопіперазин (проміжний продукт для 2е); 1-трет-бутилоксикарбоніл-4-[2-(4фторофенілсульфаніл)-5-метилфеніл]-3,5діоксопіперазин (проміжний продукт для 2f); 1-трет-бутилоксикарбоніл-4-[2-(4метоксифенілсульфаніл)-5-трифторометилфеніл]3,5-діоксопіперазин (проміжний продукт для 2g); 2-(3-метилпіперазин-1-іл)феніламін (проміжний продукт для 3а). Фторонітробензол (7,1 г, 50 ммоль) розчиняли в ДМФА (100 мл), який містив триетиламін (10г, 100 ммоль), і поміщали в атмосферу азоту. До розчину додавали 2-метилпіперазин (5,5 г, 55ммоль). Реакційну суміш нагрівали при 80 °С протягом 16 годин. Реакційну суміш залишали охолоджуватися до кімнатної температури перед зменшенням у вакуумі об'єму розчину наполовину. До розчину додавали етилацетат (200 мл) і льодяну воду (250 мл) і продукт екстрагували діетиловим ефіром (2 х 200 мл). Водну фазу насичували хлоридом натрію і екстрагували етилацетатом (2 х 200 мл). Органічні фази об'єднували, промивали насиченим розчином солі, сушили над сульфатом магнію, фільтрували і фільтрат концентрували у вакуумі. Продукт (10,5 г) розчиняли в етанолі (250мл). До розчину додавали каталізатор паладій на вуглеці (10 % мас./мас., 2,2 г) і розчин гідрували в апараті Пара при тиску 3 бар протягом 3 годин. Розчин фільтрували і розчинники випаровували у вакуумі, одержуючи аніліновий продукт. Вихід 8,0г, 83 %. Аналогічним чином одержували наступний проміжний продукт: 2-(3,5-диметилпіперазин-1-іл)феніламін (проміжний продукт для 3b) Сполуки винаходу: Приклад 1 1a) 1-[2-(2-трифторометилфенілсульфаніл) феніл]піперазин До розчину 2-трифторометилтіофенолу (1,75 г, 9,8 ммоль) в суміші 1:1 тетрагідрофуран/диметилформамід (30 мл) обережно при кімнатній температурі додавали гідрид натрію (7,4ммоль, 60 % в мінеральному маслі) (обережно: виділення водню). Суміш перемішували додатково 30 хвилин після припинення виділення водню. Потім додавали гексафторофосфат 4-({4-[6хлорофеніл)-5-циклопентадієнілзалізо(II)] піперазин-1-іл}карбонілоксиметил) феноксиметилполістиролу (3,5 г, 2,45 ммоль) і суміш перемішували 19 при 55 °С протягом 12 годин. Після охолоджування до кімнатної температури смолу відфільтрували і промивали тетрагідрофураном (2 х 50 мл), сумішшю тетрагідрофуран/вода (1:1) (2 х 50 мл), N,Nдиметилформамідом (2 х 50 мл), водою (2 х 50 мл), метанолом (3 х 50 мл), тетрагідрофураном (3 х 50 мл) і потім метанолом і тетрагідрофураном (по 50 мл, 5 циклів). Нарешті, смолу промивали дихлорометаном (3 х 50 мл) і сушили у вакуумі (25 °С, 12 годин), одержуючи темно-оранжеву смолу. Отриману смолу і 0,5 М розчин 1,10-фенантроліну в суміші 3:1 піридин/вода (20 мл) поміщали в світлопроникну реакційну пробірку. Суспензію перемішували шляхом обертання при опромінюванні видимим світлом протягом 12 годин. Смолу відфільтрували і промивали метанолом (2 х 25 мл), водою (2 х 25 мл) і тетрагідрофураном (3 х 25 мл) доти, поки промивні розчини не ставали безбарвними (приблизно 5 циклів), і процедуру опромінювання повторювали до завершення декомплексації (приблизно 5 циклів). Після завершення декомплексації смолу промивали дихлорометаном (3 х 25мл) і сушили у вакуумі (25 °С, 12 годин), одержуючи світло-коричневу смолу. 100 мг (77 мкмоль) одержаної смоли суспендували в суміші 1:1 трифторооцтової кислоти і дихлорометану (2 мл) і перемішували при кімнатній температурі протягом 2 годин. Смолу відфільтрували і промивали метанолом (1 х 0,5мл) і дихлорометаном (1 х 0,5 мл). Фільтрати об'єднували і леткі розчинники випаровували у вакуумі. Неочищений продукт очищали препаративною РХ-МС і потім іонообмінною хроматографією. РХ/МС (m/z) 339 (МH+); RT=2,39; чистота (УФ, ELSD): 92 %, 100 %; загальний вихід: 1 мг (4 %). Аналогічно одержували наступні арилпіперазини і арил[1,4]діазепани: 1b) 1-[2-(4-бромофенілсульфаніл) феніл]піперазин: РХ/МС (m/z) 350 (МН+); RT=2,46; чистота (УФ, ELSD): 75 %, 92 %; вихід: 2 мг (7 %); 1с) 1-{2-[4-(метилсульфаніл) фенілсульфаніл]феніл} піперазин: РХ/МС (m/z) 317 (МН+); RT2,39; чистота (УФ, ELSD): 91 %, 100 %; вихід: 2 мг (8 %); 1d) 1-[2-(4-гідроксифенілсульфаніл)феніл] піперазин: РХ/МС (m/z) 287 (МН+); RT=1,83; чистота (УФ, ELSD): 84 %, 100 %; вихід: 3 мг (13 %); 1е) 1-[2-(2,4-диметилфенілсульфаніл)феніл] піперазин: РХ/МС (m/z) 299 (МН+); RT=2,48; чистота (УФ, ELSD): 95 %, 100 %; вихід: 4 мг (17 %); 1f) 1-[2-(3,5-диметилфенілсульфаніл)феніл] піперазин: РХ/МС (m/z) 299 (МН+); RT=2,51; чистота (УФ, ELSD): 96 %, 100 %; вихід: 5 мг (21 %); 1g) 1-[2-(2,6-диметилфенілсульфаніл)феніл] піперазин: РХ/МС (m/z) 299 (МН+); RT=2,42; чистота (УФ, ELSD): 97 %, 100 %; вихід: 4 мг (17 %); 1h) 1-[2-(2,5-диметилфенілсульфаніл) феніл]піперазин: РХ/МС (m/z) 299 (МН+); RT=2,46; чистота (УФ, ELSD): 97 %, 100 %; вихід: 1 мг (4 %); 1і) 1-[2-(2-трифторометилфенілсульфаніл) феніл][1,4]діазепан: РХ/МС (m/z) 353 (МН+); RT=2,46; чистота (УФ, ELSD): 70 %, 96 %; вихід: 1 мг (4 %); 93857 20 lj) 1-[2-(3-метилфенілсульфаніл)феніл][1,4] діазепан: РХ/МС (m/z) 299 (МН+); RT=2,44; чистота (УФ, ELSD); 76 %, 93 %; вихід: 1 мг (4 %); 1k) 1-[2-(4-бутилфенокси)феніл]піперазин: + РХ/МС (m/z) 311 (МН ); RT=2,77; чистота (УФ, ELSD): 91 %, 100 %; вихід: 4 мг (17 %); 1l) 1-[2-(4-метоксифенокси)феніл]піперазин: РХ/МС (m/z) 285 (МН+); RT=2,08; чистота (УФ. ELSD): 93 %, 100 %; вихід: 4 мг (18 %). Приклад 2 2а) Гідрохлорид 2-(4метилфенілсульфаніл)феніл-1-піперазину 1-трет-Бутилоксикарбоніл-4-[2-(4метилфенілсульфаніл)феніл]-3,5-діоксопіперазин (5,5 г, 13 ммоль) розчиняли в безводному ТГФ (50мл) і поміщали в атмосферу азоту. Додавали комплекс борану з тетрагідрофураном (50 ммоль, 1,0 М) в тетрагідрофурані і реакційну суміш кип'ятили із зворотним холодильником десять хвилин. Надлишок борану гасили додаванням надлишку етилацетату і реакційну суміш кип'ятили із зворотним холодильником додатково 20 хвилин. Реакційну суміш залишали охолоджуватися до кімнатної температури перед додаванням хлористого водню, розчиненого в метанолі (50 мл, 4 М), і реакційну суміш кип'ятили із зворотним холодильником протягом 4,5 годин. Реакційну суміш залишали охолоджуватися до кімнатної температури і концентрували у вакуумі. Сполуки очищали від смолянистого залишку кристалізацією шляхом додаванням розчину ефір/метанол. Кристалічну тверду речовину відфільтрували і промивали сумішшю (1:1) ефір/метанол, одержуючи білу кристалічну тверду речовину. Вихід 2,0 г, 47 %. 1Н-ЯМР (D6DMCO) 2,35 (с, 3Н); 3,18 (ш.с, 8Н); 6,68 (д, 2Н); 7,02 (м, 1Н); 7,18 (м, 1Н); 7,3-7,5 (м, 4Н); МС (МН+) 285. Аналогічним чином одержували наступні сполуки: 2b) 1-[2-(4-хлорофенілсульфаніл)феніл] піпе+ разин: РХ-МС (m/z) 305,1 (МН ); RT=2,46; чистота (УФ, ELSD): 71 %, 91 %; вихід: 0,096 г, 100 %; 2с) 1-[2-(4-метоксифенілсульфаніл)-4хлорофеніл]піперазин: РХ-МС (m/z) (МН+) 335,2; RT=2,38; чистота (УФ, ELSD): 98 %, 100 %; вихід: 0,22 г, 62 %; 2d) 1-[2-(4-метоксифенілсульфаніл)-4метилфеніл]піперазин: РХ-МС (m/z) (МН+) 315,1; RT=2,33; чистота (УФ, ELSD): 97 %, 100 %; вихід: 0,21 г 56 %; 2е) 1-[2-(4-метоксифенілсульфаніл)-5метилфеніл]піперазин: РХ-МС (m/z) (МН+) 315,2; RT=2,38; чистота (УФ, ELSD): 98 %, 100 %; вихід: 2,3 г, 58 %; 2f) 1-[2-(4-фторофенілсульфаніл)-5метилфеніл]піперазин: РХ-МС (m/z) (МН+) 303,2; RT=2,46; чистота (УФ) 98 %; вихід: 2,1 г (62 %); 2g) 1-[2-(4-метоксифенілсульфаніл)-5трифторометилфеніл]піперазин: РХ-МС (m/z) (МН+) 369; RT=2,50; чистота (УФ, ELSD): 96 %, 100%; вихід: 0,54 г (31 %). Приклад 3 3а) 1-[2-(4-хлорофенілсульфаніл)феніл]-3метилпіперазин 21 2-(3-Метилпіперазин-1-іл)феніламін (0,96 г, 5ммоль) розчиняли в 30 мл води, яка містить сірчану кислоту (0,28 мл, 5,2 ммоль), розчин охолоджували до 0 °С і додавали нітрит натрію (0,36г, 5,2 ммоль). Реакційну суміш перемішували протягом 30 хвилин перед доведенням рН до 7 ацетатом натрію. Розчин солі діазонію потім додавали по краплях до розчину 4-хлоротіофенолу в суспензії міді (0,3 г, 5 ммоль) в 2 М NaOH (4 мл). Після додавання реакційну суміш нагрівали при 60°С протягом 30 хвилин перед тим, як залишити охолоджуватися до кімнатної температури, і додавали етилацетат (10 мл). Реакційну суміш фільтрували і шари розділяли. Водний шар екстрагували етилацетатом (2 х 10 мл). Об'єднані органічні фази сушили (MgSО4) і леткі розчинники випаровували у вакуумі. Неочищений продукт очищали флешхроматографією з використанням силікагелю, елююючи сумішшю 96:3:1 етилацетат/метанол/аміак. Чистий продукт виділяли у вигляді безбарвного масла. Вихід 0,18 г (11 %). 1НЯМР (CDCl3, 500 МГц) 1,12 (д, 3Н); 2,6-2,72 (ш.м, 2Н);3,0-3,15 (м, 5Н); 6,9 (м, 2Н); 7,08 (д, 1Н); 7,15 (м, 1Н); 7,25-7,35 (м, 4Н); МС (МН+) 319,1. Аналогічним чином одержували наступну сполуку: 3b) 1-[2-(4-хлорофенілсульфаніл)феніл]-3,5диметилпіперазин: РХ-МС (m/z) (МH+) 333,1; RT=2,29; чистота (УФ, ELSD): 83 %, 100 %; вихід: 0,54 г (31 %). Приклад 4 4а) 4-[2-(4-метилфенілсульфаніл)феніл]-3,6дигідро-2Н-піридин Концентровану водну хлористоводневу кислоту (10 мл) додавали до перемішуваного розчину 1трет-бутоксикарбоніл-4-[2-(4метилфенілсульфаніл)феніл]піперидин-4-олу (0,84г, 2,1 ммоль) в оцтовій кислоті (30 мл). Розчин кип'ятили із зворотним холодильником протягом ночі, охолоджували до кімнатної температури і потім перемішували на льодяній бані. Повільно додавали водний розчин NaOH (9,1 М, 40 мл) і непрозорий розчин екстрагували етилацетатом (2 х 40 мл). Об'єднані органічні фази сушили (MgSО4) і розчинники випаровували у вакуумі. Неочищену речовину (0,48 г) розчиняли в етилацетаті (3,2 мл) при 50 °С і поволі додавали розчин щавлевої кислоти (0,11 г) в EtOH (3,2 мл). Цільову сполуку виділяли у вигляді солі щавлевої кислоти. 1 Н-ЯМР (ДМСО-d6) 7,3-7,2 (м, 7Н); 7,15 (м, 1Н); 7,00 (м, 1Н); 5,6 (д, 1Н); 3,7 (д, 2Н); 3,25 (т, 2Н); 2,6 (м, 2Н); 2,3 (с, 3Н). РХ/МС (m/z) 282,2 (МН+); RT = 2,24; чистота (УФ, ELSD): 99 %, 100 %; вихід: 0,31 г (40 %). Аналогічно одержували наступне похідне: 4b) 4-[2-(4-метоксифенілсульфаніл)феніл]-3,6дигідро-2Н-піридин РХ/МС (m/z) 298 (МН+); RT=2,00; чистота (УФ, ELSD): 97 %, 100 %; вихід: 0,28 г (30%). Приклад 5 5а) 4-[2-(4метилфенілсульфаніл)феніл]піперидин Метиловий ефір хлорооксооцтової кислоти (1,37 г, 11,25 ммоль) додавали до переміщуваного розчину 1-трет-бутоксикарбоніл-4-[2-(4 93857 22 метилфенілсульфаніл)феніл]піперидин-4-олу (3,00г, 7,5 ммоль) і 4-(диметиламіно)піридину (1,65г, 13,5 ммоль) в суміші безводного СН3СН (24мл) і СНСl3 (12 мл) при 0 °С в атмосфері аргону. Реакційну суміш залишали до досягнення кімнатної температури та потім перемішували протягом 2 годин. Додавали етилацетат (140 мл) і деяку кількість солей видаляли фільтруванням крізь броунмілерит. Органічну фазу промивали насиченим NaHCO3 (140 мл), насиченим розчином солі (140 мл) і сушили (MgSO4). Розчинники випаровували у вакуумі та неочищену речовину сушили у вакуумі. Вказану речовину розчиняли в безводному толуолі (48 мл) в атмосфері аргону. Додавали Bu3SnH (3,27 г, 11,25 ммоль) і AIBN (0,31 г, 1,88ммоль). Розчин перемішували в атмосфері аргону при 90 °С протягом 2,5 годин. Розчинник випаровували у вакуумі та неочищену речовину очищали флеш-хроматографією на силікагелі (елюент: поетапний градієнт етилацетату в гептані від 10:90 до 20:80), одержуючи трет-бутиловий ефір 4-(2-(4-метилфенілсульфаніл)феніл) піперидин-1-карбонової кислоти у вигляді прозорого масла (1,94 г, 67 %). Це масло розчиняли в МеОН (9,2мл) і додавали НСl в діетиловому ефірі (2,0 М) при 0°С. Реакційну суміш залишали нагріватися до кімнатної температури і перемішували протягом ночі. Цільову сполуку виділяли у вигляді гідрохлориду. Т. пл. 229-231 °С. Обчислено для C18H21NS.HCl: С 67,58; Н 6,63; N 4,38. Знайдено: С 67,33; Н 6,97; N 4,31; РХ/МС (m/z) 284 (MH+); RT=2,12; чистота (УФ, ELSD): 96 %, 100 %; вихід: 0,26 г (46 %). Інгібування зворотного захоплення [3H]серотоніну синаптосомами інтактного головного мозку щура Сполуки випробували на предмет їх інігбуючого ефекту стосовно зворотного захоплення 5-НТ за допомогою вимірювання їх здатності інгібувати захоплення [3H]серотоніну синаптосомами інтактного головного мозку щура в умовах in vitro. Даний аналіз проводили так, як описано у Hyttel Psychopharmacology 1978, 60, 13. Ефективність у відношенні 5-НТ2C-рецепторів за результатами флюорометрії Сполуки вивчали на предмет їх ефективності у відношенні клітин СНО (яєчника китайського хом'ячка) (Euroscreen), експресуючих 5-НТ2Cрецептори, з використанням аналізу за допомогою планшетного зчитувального пристрою флюорометричного зображення (FLIPR). Це дослідження виконували згідно з інструкцією Molecular Devices Inc. для їх набору FLIPR Calcium Assay Kit та з модифікацією за Porter et al. British Journal of Pharmacology 1999, 128, 13. Кращі сполуки даного винаходу проявляють інгібування зворотного захоплення серотоніну до менше ніж 200 нМ (ІС50) У вищезгаданому аналізі. Більш кращі сполуки, які проявляють інгібування до менше ніж 100 нМ і найбільш кращі до менше ніж 50 нМ. Особливо цікаві сполуки, які проявляють інгібування зворотного захоплення серотоніну до менше ніж 10 нМ. 23 Комп’ютерна верстка Мацело В. 93857 Підписне 24 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenyl-piperazine derivatives, pharmaceutical composition based thereon and use thereof for the preparation of a medicament for the treatment of affective disorders
Автори англійськоюRuhland Thomas, Smith, Garrick, Paul, Bang-Andersen Benny, Pueschl Ask, Moltzen, Ejner, Knud, Andersen Kim
Назва патенту російськоюПроизводные фенилпиперидина, фармацевтическая композиция ha их ochobe и их применение для приготовления лекарственного средства для лечения аффективных расстройств
Автори російськоюРухланд Томас, Смит Гаррик Пол, Банг-Андерсен Бенни, Пюшл Аск, Мольтсен Айнер Кнуд, Андерсен Ким
МПК / Мітки
МПК: A61K 31/4965, C07D 211/20, C07D 243/08, A61K 31/4418, A61P 25/00, C07D 241/04, C07D 211/70, C07D 295/096
Мітки: засобу, лікарського, застосування, фармацевтична, основі, фенілпіперидину, лікування, приготування, афективних, похідні, розладів, композиція
Код посилання
<a href="https://ua.patents.su/12-93857-pokhidni-fenilpiperidinu-farmacevtichna-kompoziciya-na-kh-osnovi-ta-kh-zastosuvannya-dlya-prigotuvannya-likarskogo-zasobu-dlya-likuvannya-afektivnikh-rozladiv.html" target="_blank" rel="follow" title="База патентів України">Похідні фенілпіперидину, фармацевтична композиція на їх основі та їх застосування для приготування лікарського засобу для лікування афективних розладів</a>
Попередній патент: Пристрій та спосіб для пакування виробів з мінеральної вати
Наступний патент: Закупорювальний пристрій для пляшок, що містять дорогі напої, зі свідченням його порушення
Випадковий патент: Суміш для комплексного очищення води












