Інгібітори кінази та способи їх використання
Номер патенту: 94733
Опубліковано: 10.06.2011
Автори: Мансон Марк, Різзі Джеймс, Гронеберг Роберт, Ватсон Даніел, Харвей Даренн, Лерд Еллен, Ері Чарльз Тодд, Родрігес Марта, Бургесс Лоренс Е.
Формула / Реферат
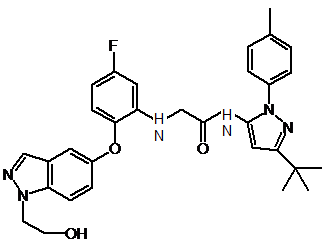
1. Сполука, що має формулу I:
 ,
,
I
або її фармацевтично прийнятна сіль.
2. Спосіб одержання сполуки за п. 1, який включає: (а) взаємодію сполуки формули II

II
або її солі, в якій Р1 представляє атом водню або гідроксильну захисну групу, зі сполукою формули III
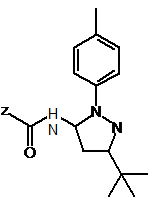 ,
,
III
в якій Z представляє відхідну групу або відповідний ізоціанат; або
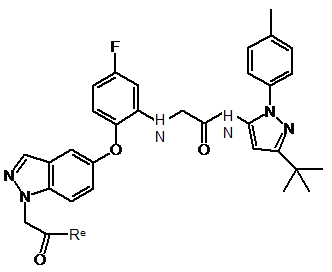
(b) відновлення сполуки формули IV
 ,
,
IV
де Re представляє атом водню або залишок спирту;
з наступним видаленням будь-якої захисної групи та, за бажанням, утворенням фармацевтично прийнятної солі.
3. Фармацевтична композиція, що містить сполуку за п. 1 та фармацевтично прийнятний носій або розріджувач.
4. Сполука за п. 1 для застосування як медикаменту.
5. Застосування сполуки за п. 1 у виробництві медикаменту для лікування кіназа-опосередкованого стану у ссавця.
6. Застосування за п. 5, де вказаний кіназа-опосередкований стан є запальним захворюванням, аутоімунним захворюванням, деструктивним кістковим розладом, проліферативним розладом, інфекційним захворюванням, вірусним захворюванням або нейродегенеративним захворюванням.
7. Сполука формули II

II
або її сіль, в якій Р1 представляє атом водню або гідроксильну захисну групу.
8. Сполука формули IV
 ,
,
IV
де Re представляє атом водню або залишок спирту.
9. Застосування проліків сполуки за п. 1 у виробництві медикаменту для лікування за допомогою сполуки за п. 1 кіназа-опосередкованого стану у ссавця, де проліками є 2-(5-(2-((3-(3-трет-бутил-1-р-толіл-IH-піразол-5-іл)уреїдо)метил)-4-фторфеноксі)-IH-індазол-1-іл)етилдигідрофосфат або його фармацевтично прийнятна сіль.
10. Застосування за п. 9, де вказаний кіназа-опосередкований стан є запальним захворюванням, аутоімунним захворюванням, деструктивним кістковим розладом, проліферативним розладом, інфекційним захворюванням, вірусним захворюванням або нейродегенеративним захворюванням.
11. 2-(5-(2-((3-(3-трет-бутил-1-p-толіл-1H-піразол-5-іл)уреїдо)метил)-4-фторфеноксі)-1H-індазол-1-іл)етилдигідрофосфат або його фармацевтично прийнятна сіль.
12. Фармацевтична композиція, що містить сполуку за п. 11 та фармацевтично прийнятний носій або розріджувач.
13. Спосіб за п. 2, де Z є арилоксигрупою, необов'язково заміщеною однією або більше групами, вибраними з F, Сl, Вr та NO2.
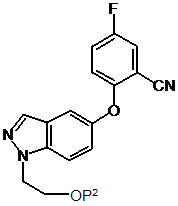
14. Спосіб за п. 2, де вказана сполука формули II одержана способом, що включає:
(і) відновлення сполуки формули V
 ,
,
V
в якій Р2 представляє водень або гідроксильну захисну групу, за умов каталітичної гідрогенації або у присутності бориду нікелю.
Текст
1. Сполука, що має формулу I: 3 94733 4 F O F H N H N N N O O N H N H N N N O N N N Re Re O , IV e де R представляє атом водню або залишок спирту; з наступним видаленням будь-якої захисної групи та, за бажанням, утворенням фармацевтично прийнятної солі. 3. Фармацевтична композиція, що містить сполуку за п. 1 та фармацевтично прийнятний носій або розріджувач. 4. Сполука за п. 1 для застосування як медикаменту. 5. Застосування сполуки за п. 1 у виробництві медикаменту для лікування кіназа-опосередкованого стану у ссавця. 6. Застосування за п. 5, де вказаний кіназаопосередкований стан є запальним захворюванням, аутоімунним захворюванням, деструктивним кістковим розладом, проліферативним розладом, інфекційним захворюванням, вірусним захворюванням або нейродегенеративним захворюванням. 7. Сполука формули II F NH2 O N N O , IV e де R представляє атом водню або залишок спирту. 9. Застосування проліків сполуки за п. 1 у виробництві медикаменту для лікування за допомогою сполуки за п. 1 кіназа-опосередкованого стану у ссавця, де проліками є 2-(5-(2-((3-(3-трет-бутил-1р-толіл-IH-піразол-5-іл)уреїдо)метил)-4фторфеноксі)-IH-індазол-1-іл)етилдигідрофосфат або його фармацевтично прийнятна сіль. 10. Застосування за п. 9, де вказаний кіназаопосередкований стан є запальним захворюванням, аутоімунним захворюванням, деструктивним кістковим розладом, проліферативним розладом, інфекційним захворюванням, вірусним захворюванням або нейродегенеративним захворюванням. 11. 2-(5-(2-((3-(3-трет-бутил-1-p-толіл-1H-піразол5-іл)уреїдо)метил)-4-фторфеноксі)-1H-індазол-1іл)етилдигідрофосфат або його фармацевтично прийнятна сіль. 12. Фармацевтична композиція, що містить сполуку за п. 11 та фармацевтично прийнятний носій або розріджувач. 13. Спосіб за п. 2, де Z є арилоксигрупою, необов'язково заміщеною однією або більше групами, вибраними з F, Сl, Вr та NO2. 14. Спосіб за п. 2, де вказана сполука формули II одержана способом, що включає: (і) відновлення сполуки формули V F OP1 II 1 або її сіль, в якій Р представляє атом водню або гідроксильну захисну групу. 8. Сполука формули IV CN O N N OP2 , V 2 в якій Р представляє водень або гідроксильну захисну групу, за умов каталітичної гідрогенації або у присутності бориду нікелю. 5 Ця заявка заявляє пріоритет попередньої заявки US із серійним No. 60/763,712, поданої 31 січня 2006, яка включена сюди шляхом посилання в її повному обсязі. Цей винахід стосується інгібіторів кінази, фармацевтичних композицій, що містять інгібітори, та методів одержання цих інгібіторів. Інгібітори кінази за цим винаходом є корисними для лікування запалення, остеоартриту, ревматоїдного артриту, раку, аутоімунних захворювань та інших цитокінопосередкованих захворювань. Множину хронічних та гострих запальних станів пов'язують із надлишковим продукуванням прозапальних цитокінів. Такі цитокіни включають, але не обмежуються, фактор некрозу пухлини альфа (TNF-), інтерлейкін 1 бета (IL-1), інтерлейкін 8 (IL-8) та інтерлейкін 6 (IL-6). Ревматоїдний артрит (RA) є хронічним захворюванням, де TNF- та IL1 залучені у початок хвороби та у прогресію кісткової й суглобної деструкції, яка спостерігається із цим станом, що ослаблює. Нещодавно схвалені терапевтичні способи лікування для RA включили розчинний TNF- рецептор (ENBREL™) та антагоніст IL-1 рецептора (ANAKINRA™). Ці способи лікування працюють шляхом блокування здатності їх відповідних цитокінів до зв'язування з їх природними рецепторами. Альтернативні методи лікування цитокін-опосередкованих захворювань на даний час досліджуються. Один з таких методів залучає інгібування сигнального шляху, що регулює синтез та виробляння про-запальних цитокінів, таких як р38. Р38 (також відомий як CSBP або RK) є серин/треонін мітоген активованою протеїн кіназою (МАРК), яка, як було показано, регулює прозапальні цитокіни. Р38 МАРК була вперше ідентифікована як кіназа, що стає тирозин фосфорильованою в мишачих моноцитах після обробки ліпополісахаридом (LPS). Зв'язок між р38 МАРК та відповіддю клітин на цитокіни вперше був встановлений Saklatvala et al., (Cell, 1994, 78:1039-1049), який показав, що IL-1 активує протеїн кіназний каскад, який результує у фосфориляцію малого білка теплового шоку, Hsp27, можливо за рахунок активованої мітоген-активованим білком протеїн кінази 2 (МАРКАР кіназа-2). Аналіз пептидних послідовностей, отриманих від очищеної кінази, вказав, що це пов'язано з р38 МАРК, активованою за допомогою LPS в мишачих моноцитах (Han, J., et al., Science, 1994, 265:808-811). У той самий час було показано, що р38 МАРК була сама активована попередньою кіназою у відповідь на різні клітинні стреси, включаючи вплив UV радіацією та осмотичнийшок, та ідентичність кінази, що безпосередньо фосфорилює Hsp27, була підтверджена як МАРКАР кіназа-2 (Rouse, J., et al., Cell, 1994, 78:1027-1037). Пізніше, було показано, що р38 МАРК була молекулярною мішенню серій піридинілімідазольних сполук, які інгібували продукцію TNF з LPS-уражених людських моноцитів (Lee, J., et al., Nature, 372:739-746). Це було ключовим відкриттям та призвело до розвитку множини селективних інгібіторів р38 МАРК та пояснення їх ролі у сигналізації цитокінів. 94733 6 Тепер відомо, що різноманітні форми р38 МАРК (, , , ), кожна з яких кодується окремим геном, утворюють частину кіназного каскаду, залученого у відповідь клітин на різні стимули, включаючи осмотичний стрес, UV світло та цитокін опосередковані події. Ці чотири ізоформи р38, як вважають, регулюють різні аспекти внутрішньоклітинної сигналізації. Активація р38 є частиною каскаду сигнальних подій, що ведуть до синтезу та продукування про-запальних цитокінів, таких як TNF-. P38 функціонує шляхом фосфориляції наступних субстратів, що включають інші кінази та транскрипційні фактори. Агенти, що інгібують р38 МАРК, як було показано, блокують продукування цитокінів, включаючи, але не обмежуючись, TNF-, IL-6, IL-8 та IL-1 in vitro та in vivo моделях (Adams, J. L., et al., Progress in Medicinal Chemistry, 2001, 38:1-60). Abl (також відома як Ableson) є тирозин кіназою, що експресується у гемопоетичних клітинах та залучена у прогресію різних рідких пухлин, включаючи хронічну мієлоїдну лейкемію (CML) та гостру лімфобластну лейкемію (ALL). Трансформація є результатом хромосомної транслокації, відомої як хромосома "Philadelphia". Це веде до конститутивно активованої химери між Ableson та ділянкою локалізації сайта ініціації реаранжировки (BCR) - Abl-BCR білка. GLEEVEC®, також відомий як іматиніб (Novartis) є сильним інгібітором Abl та натепер використовується в лікуванні СМЛ пацієнтів (N. Engl. J. Med., 2001, 344:1031-1037). Цей препарат став стандартом опікування за цією смертельною хворобою і також оцінюється щодо різноманіття інших локалізацій раку, включаючи шлунково-кишкові стромальні пухлини (GIST). Маються докази того, що фібробласти реагують на білок фактора росту TGF-, стимулюючи Abl шлях, та ведуть до морфологічних змін, що свідчать про фіброз; тому Abl може відігравати роль в патогенезі фіброзних захворювань, таких як ідіопатичний легеневий фіброз. Leof et al. (J. Clin. Invest., 2004, 114(9) 1308-1316) продемонстрували доклінічну ефективність GLEEVEC® у блеоміцинопосередкованій моделі фіброзу легенів у мишей. GLEEVEC® оцінюється у пацієнтів із легеневим фіброзом. ТЕК (також відомий як Тіе-2) є іншим рецептором тирозин кінази, що експресується лише на ендотеліальних клітинах, котрі, як було показано, відіграють роль в ангіогенезі. Зв'язування фактора ангіопоетин-1 результує у аутофосфориляцію ТЕКділянки кінази та результує у процес трансдукції сигналу, який проявляється в опосередкуванні взаємодії ендотеліальних клітин із періендотеліальними підтримувальними клітинами, полегшуючи таким чином розвиток нещодавно утворених кровоносних судин. Фактор ангіопоетин2, з іншого боку, проявляється у протидії дії ангіопоетину-1 на ТЕК та руйнує ангіогенез (Маіsоnріегге et al., Science, 1997, 277:55-60). Тіе2 є активованим у ангіогенних судинах пухлини (Trogan, E. Br. J. Cancer, 1998, 77:51-56) та маються докази того, що він може відігравати підтримувальну роль у гемопоетичних раках (L. Naldini et al., Cancer Cell, 2005, 8:211-226; Suda, T. et al., 7 Cell, 2004, 118:149-161). На додаток до цієї можливої ролі раку, ангіогенез може також мати наслідки в захворюваннях, таких як ревматоїдний артрит (RA), псоріаз та прогресія патологій, що викликаються запаленням. Формування панусу, деструктивної множини, що відповідає за артритну прогресію, частково викликається утворенням нових кровоносних судин та нещодавня робота Lin, С. et al. (Arthritis and Rheumatism, 2005, 52(5): 1585-1594) демонструє патологічну роль Тіе2 в мишачих моделях ревматоїдного артриту із колаген-індукованим артритом. Таким чином, інгібування Тіе2 можливо може забезпечити поліпшені ефекти проти проліферативних та запальних захворювань. Декілька інших кіназ залучені у прогресію проліферативних захворювань, таких як рак. Серед них, велика кількість білків, що є членами сімейства Src, як було показано, відіграють схожу із Src роль та можуть забезпечувати паралельні шляхи сигналізації під час неконтрольованої клітинної проліферації. Основні приклади включають тирозин кінази Lyn, Fyn, Lck та Hck. Lyn та Hck залучені у прогресію В-клітинної гострої лімфобластної лейкемії (B-ALL), гемопоетичний рак В клітин (Li, S. et al. Nat Genet., 2004 36(5):453-461). Eph (еритропоетин-продукуюча гематомна ампліфікована послідовність) сімейство тирозин кіназних рецепторів зв'язує ефрини, які керують багатьма клітинними процесами. Ephs, як це бачиться, відіграє роль, модулюючи адгезію пухлинних клітин та рухливість і інвазивність, та деякі експериментальні дані демонструють активну роль Ephs та ефринів у нео-васкуляризації під час патологічних процесів. Eph А рецептори надлишково експресуються у легеневій, нирковій та шлунковій пухлинній судинній сітці, а домінантно-негативні, розчинні EphA2 або A3 білки, як показано, модулюють пухлинний ангіогенез та прогресію in vivo (Lackmann M. et al., IUBMB Life, 2005, 57(6):42131). Васкулярні ендотеліальні фактори росту та їх споріднені рецептори, наприклад KDR (VEGFR2) та FLT1 (VEGFRR1) є ключовими регуляторами ангіогенезу. Терапевтичні ліки на основі протеїнів AVASTIN® демонструють перспективу у лікуванні раку кишечнику і працюють через VEGFR шлях. SUTENT/SU11248 (сунітиніб малат) (Pfizer) є сильним KDR інгібітором та демонструє перспективні результати проти GIST та ниркових клітинних карцином. Моноцити периферичної крові (PBMCs), як було показано, експресують та секретують прозапальні цитокіни, коли є стимульованими ліпополісахаридом (LPS) in vitro. P38 інгібітори ефективно блокують цей ефект, коли PBMCs попередньо оброблені такими сполуками перед стимуляцією із LPS (Lee, J.C., et al., Int. J. Immunopharmacol, 1988, 10:835-843). Ефективність р38 інгібіторів у тваринних моделях запального захворювання підштовхує до досліджень основного механізму(ів), що може пояснити ефект цих інгібіторів. Роль р38 у відповіді клітин на IL-1 та TNF була досліджена в багатьох 94733 8 клітинних системах, що стосуються запальної відповіді, при застосуванні піридиніл імідазольного інгібітора: ендотеліальні клітини та IL-8 (Hashimoto, S., et al., J. Pharmacol. Exp. Ther., 2001, 293:370-375), фібробласти та IL-6/GMCSF/PGE2 (Beyaert, R., et al., EMBO J., 1996, 15:1914-1923), нейтрофіли та IL-8 (Albanyan, E. A., et al., Infect. Immun., 2000, 68:2053-2060) макгофаги та IL-1 (Caivano, M. and Cohen, P., J. Immunol, 2000, 164:3018-3025), та клітини гладкої мускулатури та RANTES (Maruoka, S., et al., Am. J. Respir. Crit. Care Med., 1999, 161:659-668). Руйнівні ефекти багатьох хворобливих станів викликаються надлишковим продукуванням про-запальних цитокінів. Здатність р38 інгібіторів регулювати це надпродукування робить їх чудовими кандидатами у хворобомодифіуючі агенти. Відомі інгібітори щодо р38 МАРК активні у різноманітних широко визнаних моделях хвороб. Інгібітори щодо р38 МАРК демонструють позитивний ефект у множині стандартних тваринних моделей запалення, включаючи колаген-індукований артрит в щурів (Jackson, J.R., et al., J. Pharmacol. Exp. Ther., 1998, 284:687-692); адювант-індукований артрит в щурів (Badger, A. M., et al., Арmрum Rheum., 2000, 43:175-183; Badger, A. M., et al., J. Pharmacol. Exp. Ther., (1996) 279:1453-1461); та карагенан-індукований набряк лапи в миші (Nishikori, Т., et al., Eur. J. Pharm., 2002, 451:327333). Молекули, що блокують функцію р38, як було продемонстровано, є ефективними в інгібуванні кісткової резорбції, запалення, а також інших імунних та таких, що базуються на запаленні, патологій в цих тваринних моделях. Таким чином, безпечний та ефективний інгібітор кінази забезпечив би засіб для лікування захворювань, що послаблюють, які можуть регулюватися модулюванням однієї чи більше кіназ. Міжнародна патентна заявка із номером публікації WO 2004/078116 розкриває певні сполуки як інгібітори кінази. Серед цих сполук є певні N1заміщені індазол похідні, які мають замісник у 5положенні, що містить піразол-5-ілсечовинну групу. Приклади таких сполук включають сполуки Прикладів 94 та 138, в яких N1 замісник є відповідно метильною групою та 2-гідрокси-2метилпропільною групою. Як зараз було виявлено, сполуки, що мають особливо бажані властивості можуть бути одержані відбором первинної спиртової групи, СН2СН2ОН, як N1 замісника, та особливого замісника у 5-положенні, що містить 3-tert-бутил-1-ртоліл-1H-піразол-5-іл групу. Цей винахід охоплює сполуки, що інгібують одну чи більше кіназ та кіназ-опосередкованих подій, таких як інгібування продукції цитокінів, ангіогенезу або клітинної проліферації. Такі сполуки придатні як терапевтичні агенти при захворюваннях, що можуть лікуватися інгібуванням кіназ сигнальних шляхів. В одному з втілень, винахід охоплює сполуку, що має формулу І: 9 або її фармацевтично прийнятну сіль. Сполука може також бути описана за допомогою хімічної назви 1-(3-tert-бутил-1-р-толіл-1Hпіразол-5-іл)-3-(5-фтор-2-(1-(2-гідроксіетил)-1Hіндазол-5-ілокси)бензил)сечовина. Було виявлено, що сполука формули І має поліпшену ефективність проти певних кіназ. Окрім того, було помічено, що розчинність відповідної сполуки, в якої N1 замісник заміщений фосфат естерною групою формули -СН2СН2ОРО3Н, є на декілька порядків вище, ніж в сполуки формули І. Таким чином, сполука формули І володіє унікальним положенням для створення розчинних проліків. Більш конкретно, як демонструють нижче наведені дані дослідів, виявлено, що сполука формули І є значно більш ефективним інгібітором Abl та Тіе2, ніж сполуки за Прикладами 94 та 138 в WO 2004/078116. Окрім того, сполуки за Прикладами 94 та 138 в WO 2004/078116 не володіють первинною спиртовою групою, що може бути перетворена для одержання проліків. На додаток до сполуки Формули І, винахід також включає фармацевтично прийнятні солі сполуки, та сольвати сполуки та їх фармацевтично прийнятні солі. Вираз "фармацевтично прийнятний" вказує, що речовина або композиція є сумісною хімічно та/або токсикологічно з іншими інгредієнтами, що містять склади, та/або ссавець може лікуватися нею. "Сольват" стосується асоціації або комплексу однієї або більше молекул розчинника і сполуки за винаходом. Приклади розчинників, що утворюють сольвати включають, але не обмежуються, воду, ізопропанол, етанол, метанол, DMSO, етил ацетат, оцтову кислоту та етаноламін. Термін "гідрат" стосується комплексу, де молекула розчинника є водою. Відповідно до іншого втілення, даний винахід охоплює застосування сполуки Формули І у виробництві медикамента для лікування кіназопосередкованого стану у ссавців. В іншому втіленні, даний винахід охоплює спосіб лікування або попередження кіназопосередкованого стану, що включає введення сполуки Формули І у кількості, ефективній для лікування або попередження вказаного кіназопосередкованого стану. 94733 10 Також охопленими тут є проліки сполуки формули І. "Проліки" - це сполука, що може бути конвертована за фізіологічних умов або шляхом сольволізу у визначену сполуку або у сіль такої сполуки. Вільна гідрокси група сполуки за цим винаходом може бути перетворена при одержанні проліків шляхом конвертування гідрокси групи у групу, таку як, але не обмежуючись, фосфат естер, гемісукцинат, диметиламіноацетат або фосфорилоксиметилоксикарбоніл групу, як окреслено в Advanced Drug Delivery Reviews, 1996, 19, 115. Карбаматні проліки гідрокси груп також включають, як карбонатні проліки, сульфонат естери та сульфат естери гідрокси груп. Одержання похідних гідрокси груп у вигляді (ацилокси)метил та (ацилоксі)етил етерів, де ацильна група може бути алкіл естером, необов'язково заміщеним групами, що включають, але не обмежені, функціональні ділянки етеру, аміну та карбоксильної кислоти, або де ацильна група являє собою аміно кислий естер, як описано вище, є також охопленим. Проліки цього типу описані в J. Med. Chem., 1996, 39, 10. Більш специфічні приклади включають заміну атому водню спиртової групи групою, такою як (С1С6)алканоїлоксиметил, 1-((С1С6)алканоїлоксі)етил, 1-метил-1-((С1С6)алканоїлоксі)етил, (С1С6)алкоксикарбонілоксиметил, N-(С1С6)алкоксикарбоніламінометил, сукциноїл, (С1С6)алканоїл, -аміно(С1-С6)алканоїл, арилацил та -аміноацил, або -аміноацил--аміноацил, де кожна -аміноацил група є незалежно вибраною з L-амінокислот, що зустрічаються у природі, Р(О)(ОН)2, -Р(О)(О(С1-С6)алкіл)2 або глікозил (радикал, одержаний від видалення гідроксильної групи геміацетальної форми карбогідрату). Таким чином, відповідно до іншого втілення, даний винахід охоплює застосування проліків сполуки Формули І у виробництві медикамента для лікування за допомогою сполуки відповідно до пункту 1 кіназ-опосередкованого стану у ссавців. В одному втіленні, проліки являють собою фосфатні проліки. В іншому втіленні, даний винахід охоплює спосіб лікування або попередження кіназопосередкованого стану у ссавців за допомогою сполуки Формули І, що включає введення ссавцю проліків сполуки Формули І у кількості, ефективній для лікування або попередження вказаного кіназопосередкованого стану. В одному втіленні, проліки являють собою фосфатні проліки. Відповідно до іншого аспекта, таким чином, даний винахід охоплює 2-(5-(2-((3-(3-tert-бутил-1-ртоліл-1H-піразол-5-іл)уреїдо)-метил)-4-фторфенокси)-1H-індазол-1-іл)етил дигідрогенфосфат або його фармацевтично прийнятну сіль. Не бажаючи бути зв'язаними теорією, мається на увазі, що фосфат естерна сполука працює як проліки для відповідного первинного спирту. Як тут описано, було виявлено, що фосфат естер сполуки формули І володіє особливо гарною розчинністю. "Фармацевтично прийнятна сіль," якщо інше не зазначено, включає солі, що зберігають біологі 11 чну ефективність відповідних вільних кислот або основ визначених сполук та не є біологічно або іншим чином небажаними. Сполука за винаходом може мати доволі кислу групу, доволі основну групу, або обидві функціональні групи, та відповідно реагувати з будь-якою кількістю неорганічних або органічних основ або кислот для утворення фармацевтично прийнятної солі. Приклади фармацевтично прийнятних солей включають ті солі, що одержані реакцією сполуки за цим винаходом з мінеральною або органічною кислотою або неорганічною основою, такі солі включають, але не обмежені, сульфати, піросульфати, бісульфати, сульфіти, бісульфіти, фосфати, моногідрогенфосфати, дигідрогенфосфати, метафосфати, пірофосфати, хлориди, броміди, йодиди, ацетати, пропіонати, деканоати, каприлати, акрилати, формати, ізобутирати, капроати, гептаноати, пропіолати, оксалати, малонати, сукцинати, суберати, себакати, фумарати, малеати, бутин-1,4-діоати, гексин1,6-діоати, бензоати, хлорбензоати, метилбензоати, динітробензоати, гідроксибензоати, метоксибензоати, фталати, сульфонати, ксиленсульфонати, фенілацетати, фенілпропіонати, фенілбутирати, цитрати, лактати, -гідроксибутирати, гліколяти, тартрати, метансульфонати, пропансульфонати, нафтален-1-сульфонати, нафтален-2-сульфонати, та манделати. Оскільки одна сполука за цим винаходом може включати більш ніш одну кислотну або основну функціональну групи, сполуки за цим винаходом можуть включати моно, ди або три-солі в одній сполуці. Якщо винайдена сполука є основою, бажана фармацевтично прийнятна сіль може бути одержана будь-яким прийнятним методом, наявним в галузі, наприклад, шляхом обробки вільної основи кислотною сполукою, наприклад неорганічною кислотою, такою як соляна кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота та подібні, або органічною кислотою, такою як оцтова кислота, малеїнова кислота, бурштинова кислота, мигдальна кислота, фумарова кислота, малонова кислота, піровиноградна кислота, щавлева кислота, гліколева кислота, саліцилова кислота, піранозидильна кислота така як глюкуронова кислота або галактуронова кислота, альфа гідрокси кислота така як лимонна кислота або виннокам'яна кислота, аміно кислота така як аспарагінова кислота або глутамінова кислота, ароматична кислота така як бензойна кислота або корична кислота, сульфонова кислота така як р-толуєнсульфонова кислота або етансульфонова кислота, або подібні. Якщо винайдена сполука є кислотою, бажана фармацевтично прийнятна сіль може бути одержана будь-яким прийнятним методом, наприклад, шляхом обробки вільної кислоти неорганічною або органічною основою. Приклади придатних неорганічних солей включають ті, що утворені з лужними та лужноземельними металами такими як літій, натрій, калій, барій та кальцій. Приклади придатної органічної основної солі включають, наприклад, амоній, дибензиламоній, бензиламоній, 2гідроксіетиламоній, біс(2-гідроксіетил)амоній, фенілетилбензиламін, дибензилетилендіамін, та по 94733 12 дібні солі. Інші солі кислотних функціональних груп можуть включати, наприклад, ті солі, що утворені із прокаїном, хініном та N-метилглюкозаміном, плюс солі, утворені з основними аміно кислотами такими як гліцин, орнітин, гістидин, фенілгліцин, лізин та аргінін. Сполуки Формули І також включають інші солі таких сполук, що не є обов'язково фармацевтично прийнятними солями, та які можуть бути корисними як проміжні сполуки для одержання та/або очищення сполук Формули І та/або для відокремлення енантіомерів сполук Формули І. Цей винахід також охоплює ізотопно мічені сполуки за цим винаходом, які є ідентичними описаним тут, але для факту, що один або більше атомів заміщені атомом, що має атомну масу або масове число атому, відмінне від атомної маси або масового числа атому, що звичайно знаходиться у природі. Ізотопно мічені сполуки за цим винаходом можуть бути в цілому одержані за допомогою наступних процедур, аналогічних розкритим на Схемах та/або у Прикладах, що наведені тут нижче, шляхом заміни ізотопно міченим реагентом не-ізотопно міченого реагенту. Синтез сполук за винаходом Сполуки за цим винаходом можуть бути одержані шляхами синтезу, що включають процеси, аналогічні до тих, що добре знані у хімічній галузі, або як описані у міжнародній патентній заявці, номер публікації WO 2004/078116, особливо у світлі опису, що міститься тут. Вихідні матеріали в цілому доступні з комерційних джерел, таких як Aldrich Chemicals (Milwaukee, WI) або легко одержувані за допомогою методів, добре знаних фахівцю в галузі (наприклад, одержувані методами, загально описаними у Louis F. Fieser та Mary Fieser, Reagents for Organic Synthesis, v. 1-19, Wiley, N.Y. (19671999 ed.), або Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включаючи додатки (також доступні через Beilstein online базу даних). Відповідно до іншого втілення, даний винахід охоплює спосіб одержання сполуки Формули І або її фармацевтично прийнятної солі, який включає: (а) взаємодію сполуки Формули II 1 або її солі, в якої Р представляє атом водню або гідроксил захисну групу, із сполукою Формули III 13 в якій Z представляє групу, що йде, або відповідний ізоціанат; або (b) відновлення сполуки Формули IV e де R представляє атом водню або залишок спирту; з наступним видаленням будь-якої захисної групи, якщо бажано, утворюючи фармацевтично прийнятну сіль. Приклади придатних гідроксил захисних груп, 1 представлених Р , включають циклічні гемікеталі, такі як тетрагідро-2Н-піран-2-іл. Група, що йде, представлена Z, може бути, наприклад незаміщеною або заміщеною гідрокарбілокси групою, наприклад гало(1-6С)алкокси групою, такою як 2,2,2-трихлоретокси, алкенілокси група така як СН2=С(СН3)О-, або арилокси група, необов'язково заміщена, наприклад, однією або більше групами, вибраними з F, СІ, Вr, та NO2. Окремі значення необов'язково заміщеної арилокси групи включають фенокси, 4-хлорфенокси, 4бромфенокси, 4-фторфенокси, 4-нітрофенокси, та 2-нітрофенокси. В окремому втіленні, Z являє собою фенокси. 94733 14 Було виявлено, що сполуку IV можна вигідно ізолювати із гарним виходом та високою чистотою без кроку хроматографії, коли Z сполуки III є необов'язково заміщеною арилокси групою, такою як фенокси група. Взаємодія сполуки Формули (II) із сполукою Формули (III), коли Z є необов'язково заміщеною фенокси групою, може бути підходящим чином виконана при температурі між 0 та 100°С, та більш конкретно при температурі навколишнього середовища. Підходящі розчинники включають апротонні розчинники такі як етери (наприклад тетрагідрофуран або р-діоксан), DMF, DMSO або актеонітрил. Реакцію взаємодії підходящим чином проводять у присутності основи такої як третинний амін (наприклад, триетиламін або DMA). Окремі e значення R , коли він представлений залишком спирту, включають (1-6С)алкокси групи, таку як етокси. Сполуки формул (II) та (IV), як передбачають, є новими та охоплені як наступні аспекти винаходу. Сполуки Формули (III), де Z представлений необов'язково заміщеною арилокси групою, як також передбачають, є новими та охоплені як наступні аспекти винаходу. В іншому втіленні, даний винахід охоплює спосіб одержання фосфат проліків сполуки Формули І, що являє собою 2-(5-(2-((3-(3-tert-бутил-1-p-толіл1H-піразол-5-іл)уреїдо)метил)-4-фторфенокси)-1Hіндазол-1-іл)етил дигідрогенфосфат або його фармацевтично прийнятну сіль, який включає фосфорилювання 1-(3-tert-бутил-1-р-толіл-1H-піразол5-іл)-3-(5-фтор-2-(1 -(2-гідроксіетил)-1H-індазол-5ілокси)бензил)сечовини або її солі. Фосфориляцію відповідно підходящим чином здійснюють шляхом проведення реакції спирту із діалкіл або діарил діалкілфосфінамідитом, таким як ди-tert-бутил діізопропілфосфінамідит або дифеніл діізопропілфосфінамідит, з наступним видаленням алкіл або арил груп на фосфатному продукті шляхом гідролізу або каталітичної гідрогенації. З ілюстративною метою, Схеми 1 та 2 та Приклади ілюструють методи одержання сполук за цим винаходом, а також основних проміжних сполук. Обізнаний в галузі зрозуміє, що інші шляхи синтезу можуть бути використані для синтезування винайдених сполук. Хоча окремі вихідні матеріали та реагенти описані на Схемах та обговорені нижче, інші вихідні матеріали та реагенти можуть бути легко використані замість них для забезпечення різноманіття похідних та/або реакційних умов. На додаток, багато сполук, одержаних за способами, описаними нижче, можуть бути додатково модифіковані у світлі їх розкриття, використовуючи звичайні хімічні склади, добре знані фахівцями у галузі. 15 94733 16 17 Нітрил відновлення сполуки 77, як показано на 2, потребує високої концентрації кислоти (наприклад, НСl або оцтової кислоти) для мінімізації утворення димерів. Тим не менш, підвищені концентрації кислоти можуть також викликати гідроліз 94733 18 деяких представників естер сполуки 78 до відповідної кислоти. Схема 3 ілюструє покращений процес одержання сполуки Формули І, що знижує утворення димерних та кислотних домішок. 19 Схема 3 ілюструє спосіб відновлення естер групи сполуки 77 до відповідного спирту перед відновленням нітрил групи для забезпечення сполуки 79А, вільної від кислотних домішок та з мінімальним утворенням домішок димеру. Більш конкретно, сполука 77 може бути відновлена поетапно, в якій естер група відновлена за допомогою натрій борогідриду у прийнятному розчиннику для одержання відповідної спиртової сполуки 78А. Нітрил групу сполуки 78А потім відновлюють за умов стандартної каталітичної гідрогенації або із застосуванням нікель бориду у прийнятному органічному розчиннику для одержання відповідної метил амін сполуки 79А. Шлях, показаний на Схемі 3, пропонує декілька переваг перед шляхами, показаними на Схемі 2 для утворення сполуки Формули І. Використовуючи шляхи, показані на Схемі 3, відновлення нітрил групи може бути виконане за вищих концентрацій НСl, котрі вигідно знижують кількість залишку димерів, що утворюється. На додаток, шлях, показаний на Схемі 3, позбавлений від застосування натрій борогідриду на кінцевому кроці, позбавляючи таким чином від кроків додаткового очищення для видалення домішок бору, що залишилися, із кінцевого продукту. Таким чином, за рахунок включення кроку натрій борогідридного відновлення раніше у послідовність реакцій, бор, що залишився, може бути легко видалений під час проміжних кроків послідовності. На додаток, взаємодія аміно спиртової сполуки 79А із сполукою 69А може бути ви 94733 20 конана при знижений температурах, покращуючи у такий спосіб чистоту продукту 72. Відповідно, шлях, показаний на Схемі 3, робить можливою покращену продуктивність для синтезу сполуки Формули І, і таким чином забезпечує ефективний шлях синтезу для виробництва сполуки Формули І, що є більш податливою або прийнятною для великомасштабного виробництва. Відповідно, також охопленим є спосіб одержання сполуки Формули (II), що включає: (і) відновлення сполуки Формули (V) 2 в якій Р представляє водень або гідроксил захисну групу, за умов каталітичної гідрогенації або у присутності нікель бориду. Відносно кроку (і), каталізатори гідрогенації включають будь-який придатний паладієвий ката 21 94733 лізатор, такий як Pd(OH)2 або паладій, закріплений на вуглеці. Гідрогенація має місце за кислих умов (таких як при доданні кислоти, наприклад НСl або оцтової кислоти) або із доданням амонію. Каталітична гідрогенація може проводитися у будь-якій придатній системі розчинників, таких як спирт (наприклад, метанол, етанол, ізопропанол), естер (наприклад, етил ацетат) або етер (наприклад, THF). Змішані розчинники, наприклад спирт та THF, також придатні для кроку гідрогенації. Тиск водню може бути в інтервалі від 25 до 100 psi, наприклад 40 psi. Відновлення типово проводять при температурі 20-100°С. Відносно кроку (і), нікель борид може бути одержаний in situ при перетворенні металевої солі, переважно солі Ni(II), та натрій борогідриду. У переважному втіленні, нікель борид одержують з нікель (II) хлориду та натрій борогідриду. Рекцію підходящим чином проводять у прийнятному розчиннику такому як спирт (наприклад, метанол, етанол, ізопропанол). Відновлення типово виконують при температурі навколишнього середовища. Сполука Формули (V) може бути одержана шляхом відновлення сполуки Формули (VI) 3 2 де Р є таким, як визначено для Р , використовуючи будь-які підходящі умови естер відновлення (наприклад, натрій борогідрид), у прийнятному розчиннику такому як спирт (наприклад, метанол, етанол, ізопропанол). В одержанні сполуки за цим винаходом, захист віддалених функціональних ділянок (наприклад, первинних або вторинних амінів, спиртів і т.д.) проміжних сполук може бути необхідним. Потреба у такому захисті буде різнитися в залежності від природи віддаленої функціональної групи та умов методів одержання. Наприклад, придатні амінозахисні групи (NH-Pg) включають ацетил, трифторацетил, t-бутоксикарбоніл (ВОС), бензилоксикарбоніл (CBz) та 9-фторенілметиленоксикарбоніл (Fmoc). Підходящі гідроксил захисні групи включають тетрагідро-2Н-піран-2-іл, бензил, триалкілсиліл, та ацеталь. Потреба у такому захисті легко визначається фахівцем у галузі. Для загального опису захисних груп та їх використання, дивись Т. W.Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991. Способи лікування Сполуки за винаходом можуть бути використані для лікування захворювань, опосередкованих модуляцією або регуляцією протеїн кіназ. Відпові 22 дно, інший аспект винаходу охоплює способи лікування або профілактики захворювань або станів, описаних тут, шляхом введення ссавцю, такому як людина, терапевтично ефективної кількості сполуки за цим винаходом або її сольвату, метаболіту або фармацевтично прийнятної солі, у кількості, ефективній для лікування або попередження вказаного захворювання. В одному втіленні, спосіб включає введення ссавцю сполуки за цим винаходом у кількості, ефективній, щоб інгібувати одну чи більше кіназ. "Ефективна кількість" стосується кількості сполуки, що, коли вона вводиться ссавцю, що потребує такого лікування, є достатньою для ефективного лікування захворювання, опосередкованого активністю однієї або більше протеїн кіназ, таких як р38 МАРК, та пов'язаних кіназ-опосередкованих подій таких як продукування цитокінів. Таким чином, наприклад, терапевтично ефективна кількість сполуки за цим винаходом або її солі, активного метаболіту, - це кількість, достатня, щоб модулювати, регулювати або інгібувати активність однієї або більше протеїн кіназ, таких, що хворобливий стан, який опосередкований такою активністю, було б усунено або пом'якшено. Під "лікуванням" розуміють принаймні полегшення хворобливого стану у ссавців, таких як людина, що обумовлений, принаймні в частині, активністю однієї або більше протеїн кіназ. Терміни "лікувати" та "лікування" стосуються як до терапевтичного лікування, так і до профілактичних або превентивних заходів, де метою є попередити або сповільнити (зменшити) небажані фізіологічні зміни або захворювання. Для мети цього винаходу, корисні та бажані клінічні результати включають, але не обмежуються, пом'якшення симптомів, скорочення обсягу захворювання, стабілізацію (наприклад, не погіршення) стану захворювання, затримку або сповільнення прогресії захворювання, поліпшення або тимчасове полегшення стану захворювання, та ремісію (або часткову або повну), що є діагностованими або недіагностованими. "Лікування" може також означати продовження виживання у порівнянні із передбачуваним виживанням без проходження лікування. Ті, хто потребує лікування, включають тих, в кого вже наявний стан або захворювання, а також тих, хто схильні до набуття стану або захворювання, або тих, в яких стан або захворювання є попередженим. Кількість сполуки за цим винаходом, що вводять ссавцю, буде залежати від факторів, таких як конкретна сполука, хворобливий стан та його тяжкість, особливість (наприклад, вага) ссавця, який потребує лікування, але яка, тим не менш, може бути звичайним чином визначена обізнаним в галузі. Як використано тут, термін "ссавець" стосується теплокровної тварини, що має або в якої є ризик розвитку захворювання, описаного тут, та включає, але не обмежений, морських свинок, собак, котів, щурів, мишуй, хом'яків та приматів, включаючи людей. В одному з аспектів цього винаходу, сполуки за цим винаходом або її фармацевтичні солі можуть бути сформовані у фармацевтичні композиції 23 для введення тваринам або людям для лікування або попередження кіназ-опосередкованого стану. Термін "кіназ-опосередкований стан", як його використано тут, означає будь-яке захворювання або інший небезпечний стан, в якому, як відомо, р38 відіграє роль, та включає стани, щодо яких відомо, що вони викликаються IL-1, TNF, IL-6 або IL-8 надпродукуванням. Такі стани включають, але не обмежуються, запальні захворювання, аутоімунні захворювання, деструктивні захворювання кісток, проліферативні захворювання, інфекційні захворювання, вірусне захворювання, фіброзне захворювання та нейродегенеративні захворювання. Запальні захворювання, котрі можуть лікуватися або попереджатися, включають, але не обмежуються, гострий панкреатит, хронічний панкреатит, астму, алергії та синдром дихальної недостатності дорослих. Аутоімунні захворювання, котрі можуть лікуватися або попереджатися, включають, але не обмежуються, гломералонефрит, ревматоїдний артрит, системну червону вовчанку, склеродерму, хронічний тиреоїдит, базедову хвороба, аутоімунний гастрит, інсулінозалежний цукровий діабет (Тип І), аутоімунну гемолітичну анемію, аутоімунну нейропенію, тромбоцитопенію, атопічний дерматит, хронічний активний гепатит, астенічний бульбарний параліч, розсіяний склероз, запальне захворювання кишечнику, виразковий коліт, хворобу Крона, псоріаз, або реакцію "трансплантат проти хазяїна". Деструктивні захворювання кісток, котрі можуть лікуватися або попереджатися, включають, але не обмежуються, остеопороз, остеоартрит та захворювання кісток, пов'язане із множинною мієломою. Фіброзні захворювання, котрі можуть лікуватися або попереджатися, включають, але не обмежуються, ідіопатичний легеневий фіброз, фіброз нирок та печінки. Проліферативні захворювання, котрі можуть лікуватися або попереджатися, включають, але не обмежуються, гостру мієлогенну лейкемію, хронічну мієлогенну лейкемію, метастатичну меланому, Капоші саркому, мієлодиспластичний синдром, множинну мієлому, астроцитому, кістковий рак, рак мозку, рак грудей, колоректальний рак, гастральний рак, гліому, гліобластому, поліморфний рак голови та шиї, гематологічний рак, гематопоетичні захворювання, інтерстиціальні легеневі процеси, капоші саркому, лімфоцитарну лейкемію, меланому, мієлоїдну лейкемію, немілкоклітинний рак легенів, рак яєчника, рак простати, саркому, рак шкіри, мілкоклітинний рак легенів та рак шлунку. Інші пацієнти, яких можуть лікувати, включають тих, що піддані трансплантації кісткового мозку. Інфекційні захворювання, котрі можуть лікуватися або попереджатися, включають, але не обмежуються, сепсис, септичний шок та шигельоз. Вірусні захворювання, котрі можуть лікуватися або попереджатися, включають, але не обмежуються, гостру печінкову інфекцію (включаючи гепатит А, гепатит В та гепатит С), ВІЛ інфекцію та цитомегаловірусний ретиніт. 94733 24 Дегенеративні стани або захворювання, котрі можуть лікуватися або попереджатися, сполуками за цим винаходом включають, але не обмежуються, хворобу Альцгеймера, хворобу Паркінсона, церебральну ішемію та інші нейродегенеративні захворювання. Термін "кіназ-опосередковані стани" також включає ішемію/реперфузію при інсульті, серцеві атаки, міокардіальну ішемію, органну гіпоксію, васкулярну гіперплазію, серцеву гіпертрофію та тромбін-індуковану агрегацію тромбоцитів. На додаток, інгібітори кінази за цим винаходом також корисні для інгібування експресії прозапальних протеїнів, які індукуються, таких як простагландин ендопероксид синтаза-2 (PGHS-2), котрі також називаються циклооксигеназа-2 (СОХ2). Таким чином, інші "кіназ-опосередковані стани" включають, але не обмежуються, набряк, знеболювання, лихоманку та біль, такий як нейром'язовий біль, головний біль, біль при раці, зубний біль та біль при артриті. Стани та захворювання, що можуть лікуватися або попереджатися за допомогою інгібіторів кінази за цим винаходом, можуть також бути підходящим чином згруповані за цитокіном (наприклад, IL-1, TNF, IL-6, IL-8), котрий, як припускається, відповідає за захворювання. Таким чином, IL-1-опосередковане захворювання або стан включає ревматоїдний артрит, остеоартрит, інсульт, ендотоксемію та/або токсичний шок, запальну реакцію, викликану ендотоксином, запальне захворювання кишечнику, туберкульоз, атеросклероз, м'язову дегенерацію, кахексію, псоріатичний артрит, синдром Рейтера, подагру, травматичний артрит, краснушний артрит, гострий синовіт, діабети, -клітинне захворювання підшлункової залози та хворобу Альцгеймера. TNF-опосередковані захворювання або стани включають, але не обмежуються, ревматоїдний артрит, ревматоїдний спондиліт, остеоартрит, подагричний артрит та інші артритичні стани, сепсис, септичний шок, ендотоксичний шок, грамнегативний сепсис, токсичний шок, синдром дихальної недостатності дорослих, церебральна малярія, хронічне легеневе запальне захворювання, силікоз, легеневий саркоїдоз, захворювання резорбції кістки, реперфузійне пошкодження, реакцію «трансплантат проти хозяїна», відторгнення трансплантата, лихоманку та міальгію через інфекцію, вторинну до інфекції кахексію, СНІД, СНІДасоційований комплекс або злоякісність, колоїдні утворення, рубцеві тканинні утворення, хворобу Крона, виразковий коліт або пірексію. TNFопосередковані захворювання також включають вірусні інфекції, такі як ВІЛ, цитомегаловірусна, грип та герпес; та ветеринарні вірусні інфекції, такі як лентивірусні інфекції, що включають, але не обмежені, вірус кінської інфекційної анемії, вірус козлиного артриту, вісна або маєді вірус; або ретровірусні інфекції, включаючи вірус імунодефіциту кішок, вірус імунодефіциту корів або вірус імунодефіциту собак. IL-8 опосередковані захворювання або стани включають, але не обмежуються, захворювання, що характеризуються масивною нейтрофільною 25 інфільтрацією, такою як псоріаз, запальне захворювання кишечнику, астму, серцеве та ниркове реперфузійне пошкодження, синдром дихальної недостатності дорослих, тромбоз та гломуронефрит. На додаток, сполуки за цим винаходом можуть використовуватися місцево для лікування або попередження станів, що викликаються або загострюються через IL-1 або TNF. Такі стани включають, але не обмежуються, запалені суглоби, екзему, псоріаз, запальні стани шкіри такі як сонячний опік, запальні стани очей такі як кон'юктивіт, пірексію, біль та інші стани, асоційовані із запаленням. Хоча сполуки за цим винаходом перш за все мають цінність як терапевтичні агенти для застосування у теплокровних тварин (включаючи людей), вони також є корисними кожного разу, коли потрібно інгібувати ефекти цитокінів. Таким чином, вони корисні як фармакологічні стандарти для використання у розвитку нових біологічних тестів та у пошуці нових фармакологічних агентів. Розмір дози для терапевтичної та профілактичної мети сполуки за цим винаходом буде звичайно варіюватися в залежності від природи та тяжкості станів, віку та статі тварини або пацієнта та шляху введення, відповідно до добре знаних принципів медицини. Інший аспект цього винаходу охоплює сполуку за цим винаходом для використання як медикамента у лікуванні захворювань або станів, описаних тут, у ссавців, наприклад, людини, що потерпають від такого захворювання або стану. Також охопленим є застосування сполуки за цим винаходом у виготовленні медикамента для лікування захворювань або станів, описаних тут, у теплокровної тварини, такої як ссавець, наприклад людина, що потерпає від такого захворювання. Комбінована терапія Сполуки за цим винаходом можуть бути корисними в комбінації з іншими ліками та терапевтичними методами, використовуваними в лікуванні хворобливих станів, для яких може бути корисним інгібування кіназ та асоційованих цитокінів, таких як IL-1, TNF, IL-6 або IL-8. Доза других ліків може бути відповідно вибраною на основі клінічно застосовуваної дози. Пропорція сполуки за цим винаходом та других ліків може бути відповідно визначеною згідно із суб'єктом введення, шляхом введення, цільовою хворобою, клінічним станом, комбінацією та іншими станами. У випадку, коли суб'єктом введення є людина, наприклад, другі ліки можуть бути використані у кількості від 0,01 до 100 частин за вагою на частину за вагою сполуки за цим винаходом. Другі ліки фармацевтичної комбінації або режим дозування мають, наприклад, додаткові активності до сполуки за цим винаходом, такі, що вони не впливають несприятливо одні на одних. Такі ліки є відповідно присутніми у комбінації в кількостях, ефективних для поставленої мети. Відповідно, інший аспект цього винаходу охоплює композицію, що включає сполуку за цим винаходом в комбінації з другими ліками, такими як тут описано. 94733 26 Сполука за цим винаходом та додаткові фармацевтично активні ліки можуть вводитися разом або поокремо та, коли вводяться окремо, це може відбуватися одночасно або послідовно у будьякому порядку. Таке послідовне введення може бути близьким та віддаленим у часі. Кількості сполуки за цим винаходом та других ліків та відповідні проміжки часу введення будуть вибрані, щоб досягти бажаного комбінованого терапевтичного ефекту. Комбінована терапія може забезпечувати "синергію" та демонструвати "синергічний" ефект, тобто ефект, який досягається, коли активні інгредієнти використані разом, є більшим за суму ефектів, що виявляються при окремому використанні сполук. Синергічний ефект може бути досягнутий, коли сполука за цим винаходом та другі ліки є: (1) сумісно сформованими та введені або доставлені одночасно у комбінованому єдиному дозованому складі; (2) доставлені по черзі або паралельно як окремі склади; або (3) якимсь іншим режимом. Коли їх доставляють в альтернаційній терапії, синергічний ефект можу бути досягнутий, коли сполуку за цим винаходом та другі ліки вводять або доставляють послідовно, наприклад, різними ін'єкціями в окремих шприцях. Наприклад, під час альтернаційної терапії ефективна доза кожного активного інгредієнта може бути введена послідовно, тобто серіями, тоді як у комбінованій терапії ефективні дози двох або більше активних інгредієнтів вводять разом. Наприклад, через їх здатність інгібувати цитокіни, сполуки за цим винаходом корисні в лікуванні певних запальних та незапальних захворювань, які зараз лікують циклооксигеназа-інгібувальними нестероїдними протизапальними ліками (NSAID) такими як індометацин кеторолак, ацетилсаліцилова кислота, ібупрофен, суліндак, толметин та піроксикам. Спільне введення сполуки за цим винаходом із NSAID може привести до зниження кількості останнього агента, необхідної для створення терапевтичного ефекта, і таким чином ймовірність шкідливих побічних ефектів від NSAID, таких як шлунково-кишкові ефекти, є зниженою. Таким чином, відповідно до наступної характерної ознаки винаходу охопленою є фармацевтична композиція, яка включає сполуку за цим винаходом або її фармацевтично прийнятну сіль, у сполученні або суміші із циклооксигеназа інгібувальним нестероїдним протизапальним агентом, та фармацевтично-прийнятний розріджувач або носій. Сполуки за цим винаходом можуть також використовуватися у лікуванні станів, таких як ревматоїдний артрит, в комбінації із антиартритичними агентами, такими як золото, метотрексат, стероїди та пеніцилінамін, та в станах, таких як остеоартрит, в комбінації із стероїдами. Сполуки за цим винаходом можуть також бути використані у лікуванні деградативних захворювань, наприклад остеоартрит, в комбінації із хрондозахисними, анти-деградативними та/або репаративними агентами, такими як Diacerhein, склади із гіалуроновою кислотою, такі як Hyalan, Rumalon, Arteparon та солі глюкозаміну такі як Antril. 27 Сполуки за цим винаходом можуть також використовуватися у лікуванні астми в комбінації із протиастматичними агентами, такими як бронходилататори та лейкотриєн антагоністи. Введення сполуки за винаходом Сполуки за винаходом можуть вводитися будь-яким шляхом, що відповідає стану, який лікують. Придатні шляхи включають оральний, парентеральний (включаючи підшкірний, внутрішньом'язовий, внутрішньовенний, внутрішньоартеріальний, інтрадермальний, інтратекальний та епідуральний), трансдермальний, ректальний, назальний, зовнішній (включаючи букальний та сублінгвальний), вагінальний, внутрішньоочеревинний, внутрішньолегеневий та інтраназальний. Необхідно розуміти, що шлях введення може змінитися через, наприклад, стан реципієнта. Коли сполуку вводять орально, її може бути сформовано у вигляді пілюлі, капсули, таблетки і т.д. із фармацевтично прийнятним носієм або наповнювачем. Коли сполуку вводять парентерально, її може бути сформовано із фармацевтично прийнятною парентеральною основою та в єдиній дозованій ін'єкційній формі, як її докладно описано нижче. Фармацевтичні склади Щоб використовувати сполуку за цим винаходом для терапевтичного лікування (включаючи профілактичне лікування) ссавців, включаючи людей, її звичайно сформовано у відповідності із стандартною фармацевтичною практикою у вигляді фармацевтичної композиції. Відповідно до цього аспекту винаходу є охопленою фармацевтична композиція, що містить сполуку за цим винаходом у сполученні із фармацевтично прийнятним розріджувачем або носієм. Фармацевтичні композиції винаходу формують, дозують та вводять певним чином, тобто, кількості, концентрації, режими, курс, основи та шлях введення, є сумісними із доброю медичною практикою. Фактори, що приймаються до уваги в цьому контексті, включають окремий розлад, що лікують, окремого ссавця, що лікують, клінічний стан індивідуального пацієнта, причину розладу, місце доставки агента, спосіб введення, графік введення, та інші фактори, відомі медичним практикам. Терапевтично ефективна кількість сполуки, призначена для введення, буде обумовлена такими міркуваннями та є мінімальною кількістю, необхідною для попередження, поліпшення або лікування розладу. Сполуку за цим винаходом типово формують у фармацевтичні дозовані форми, щоб забезпечити легко контрольоване дозування ліків та отримати згоду пацієнта із призначеним режимом. Композиція для використання тут є переважно стерильною. Зокрема, склянки для використання in vivo введення мають бути стерильні. Така стерилізація може бути легко досягнута, наприклад, шляхом фільтрації через стерильні фільтраційні мембрани. Сполука звичайним чином може зберігатися як тверда композиція, ліофілізований склад або у вигляді водного розчину. Фармацевтичні склади сполук за цим винаходом можуть бути одержані для різних шляхів та 94733 28 типів введення. Наприклад, сполука за цим винаходом, що має бажаний ступінь чистоти, може бути необов'язково змішана з фармацевтично прийнятними розріджувачами, носіями, наповнювачами або стабілізаторами (Remington's Pharmaceutical Sciences (1980) 16th edition, Osol, A. Ed.), у формі ліофілізованого складу, помеленого порошку, або водного розчину. Склад може одержуватися шляхом змішування при температурі навколишнього середовища при придатному рН та при бажаному ступіні чистоти, із фізіологічно прийнятними носіями, тобто носіями, що є нетоксичними для реципієнта при застосовуваних дозуваннях та концентраціях. рН складу залежить головним чином від конкретного застосування та концентрації сполуки, але може змінюватися наприклад від приблизно 3 до приблизно 8. Склад у ацетатному буфері при рН 5 є придатним втілення. Склади можуть бути одержані, використовуючи звичайне розчинення та процедури змішування. Наприклад, неразфасовану лікарську речовину (тобто, сполуку за цим винаходом або стабілізовану форму сполуки (наприклад, комплекс із похідним циклодекстрину або іншим відомим комплексотвірним агентом) розчиняють у прийнятному розчиннику у присутності одного або більше наповнювачів. Окремий використовуваний носій, розріджувач або наповнювач буде залежати від засобів та мети, з якими використовують сполуку за цим винаходом. Розчинники, як правило, вибирають з розчинників, загальновизнаних фахівцями в галузі як безпечні (GRAS) для введення ссавцям. В загальних рисах, безпечні розчинники являють собою нетоксичні водні розчинники, такі як вода, та інші нетоксичні розчинники, що розчинні або змішувані з водою. Придатні водні розчинники включають воду, етанол, пропілен гліколь, поліетилен гліколі (наприклад, PEG 400, PEG 300), і т.д. та їх суміші. Прийнятні розріджувачі, носії, наповнювачі та стабілізатори нетоксичні до реципієнтів у застосовуваних дозуваннях та концентраціях, та включають буфери такі як фосфат, цитрат та інші органічні кислоти; антиоксиданти, включаючи аскорбінову кислоту та метіонін; консерванти (такі як октадецилдиметилбензил амоній хлорид; гексоній хлорид; бензалконій хлорид, бензетоній хлорид; фенол, бутил або бензиловий спирт; алкіл парабени такі як метил або пропіл парабен; пірокатехін; резорцин; циклогексанол; 3-пентанол; та m-крезол); низькомолекулярні (менш ніж приблизно 10 радикалів) поліпептиди; протеїни, такі як сироватковий альбумін, желатин, або імуноглобуліни; гідрофільні полімери такі як полівінілпіролідон; аміно кислоти такі як гліцин, глутамін, аспарагін, гістидин, аргінін або лізин; моносахариди, дисахариди та інші карбогідрати, включаючи глюкозу, манозу, або декстрини; хелатні агенти такі як EDTA; цукри такі як сахароза, манітол, трегалоза або сорбітол; солетвірні протиіони такі як натрій; металеві комплекси (наприклад, Zn-протеїн комплекси); та/або неіонні поверхнево-активні речовини такі як TWEEN™, PLURONICS™ або поліетилен гліколь (PEG). Склади можуть також включати один або більше стабілізуючих агентів, поверхнево-активні 29 речовини, зволожувальні агенти, змащувальні агенти, емульгатори, суспендуючі агенти, консерванти, антиоксиданти, світлонепроникні агенти, ковзні речовини, технологічні добавки, барвники, підсолоджувачі, ароматичні агенти, смакові агенти та інші відомі добавки для забезпечення гарного збереження ліків (тобто, сполука за цим винаходом або її фармацевтична композиція) або допоміжного засобу у виробництві фармацевтичного продукту (тобто, медикаменту). Активні фармацевтичні інгредієнти можуть також бути заключені у мікрокапсули, що одержуються, наприклад, методами коацервації або міжфазовою полімеризацією, наприклад, гідроксиметилцелюлозні або желатинові мікрокапсули та полі-(метилметакрилат) мікрокапсули, відповідно, в колоїдних системах доставки ліків (наприклад, ліпосоми, альбумін мікросфери, мікроемульсії, наночастинки та нанокапсули) або у макроемульсіях. Такі способи розкриті в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980). "Ліпосома" - це маленька везикула, складена із різних типів ліпідів, фосфоліпідів та/або поверхнево-активної речовини, що є корисними для доставки ліків ссавцю. Компоненти ліпосоми зазвичай розміщені у двошаровому утворенні, схожому до розташування ліпідів в біологічних мембранах. Препарати сповільненого вивільнення сполук за цим винаходом можуть бути одержані. Придатні приклади препаратів сповільненого вивільнення включають напівпроникні матрикси твердих гідрофобних полімерів, що містять сполуку за цим винаходом, де матрикси знаходяться у формі фасонних виробів, наприклад, плівок або мікрокапсул. Приклади матриксів сповільненого вивільнення включають поліестери, гідрогелі (наприклад, полі(2-гідроксіетил-метакрилат), або полі(вінілспирт)), полілактиди (U.S. Patent No. 3,773,919), сополімери L-глутамінової кислоти та гамма-етил-L-глутамату, етилен-вініл ацетат, який не розкладається, молочна кислота-гліколева кислота співполімери, що розкладаються, такі як LUPRON DEPOT™ (ін'єкційні мікросфери, складені молочна кислота-гліколева кислота співполімером та лейпролід ацетатом) та полі-D-(-)-3гідроксимасляна кислота. Фармацевтичні композиції за цим винаходом можуть бути у формі стерильного ін'єкційного препарату, такого як стерильна ін'єкційна водна або масляна суспензія. Цю суспензію може бути сформовано відповідно до відомих методів, використовуючи ті придатні диспергуючі або зволожувальні агенти та суспендуючі агенти, які було зазначено вище. Стерильний ін'єкційний препарат може також бути стерильним ін'єкційним розчином або суспензією в нетоксичному парентерально прийнятному розріджувачі або розчиннику, такому як розчин в 1,3-бутандіол або одержаний у вигляді ліофілізованого порошку. Серед прийнятних основ та розчинників, що можуть застосовуватися, є вода, розчин Рингера та ізотонічний розчин хлориду натрію. На додаток, стерильні нелеткі масла можуть традиційно застосовуватися як розчинник або суспендуюче середовище. Для цієї мети може застосовуватися будь-яке м'яке нелетке масло, 94733 30 включаючи синтетичні моно- або дигліцериди. На додаток, жирні кислоти, такі як олеїнова кислота, також можуть застосовуватися в препараті для ін'єктувань. Фармацевтичні композиції за цим винаходом, придатні для парентерального введення, включають водну та неводну стерильні ін'єкційні розчини, які можуть містити антиоксиданти, буфери, бактеріостати та розчинні речовини, які забезпечують склад, ізотонічний із кров'ю наміченого реципієнта; та водну та неводну стерильні суспензії, які можуть включати суспендуючі агенти та загусники. Композиції винаходу можуть також бути сформовані у формі, придатній для орального застосування (наприклад як таблетки, таблетки округлої форми, тверді або м'які капсули, водні або масляні суспензії, емульсії, дисперсні порошки або гранули, сиропи або еліксири), для топічного застосування (наприклад як креми, мазі, гелі, або водні чи масляні розчини або суспензії), для введення шляхом інгаляції (наприклад у вигляді тонкодиспергованого порошку або рідкого аерозолю), для введення шляхом вдування (наприклад у вигляді тонкодиспергованого порошку). Придатні фармацевтично-прийнятні наповнювачі складів для таблеток включають, наприклад, інертні розріджувачі такі як лактоза, натрій карбонат, кальцій фосфат або кальцій карбонат, гранулювальний та дезінтегрувальний агенти такі як кукурудзяний крохмаль або альгінова кислота; зв'язувальні агенти такі як крохмаль; змащувальні агенти такі як магній стеарат, стеаринова кислота або тальк; консервуючі агенти такі як етил або пропіл р-гідроксибензоат, та антиоксиданти такі як аскорбінова кислота. Таблетовані склади можуть бути невкриті або вкриті або для модифікування їх розкладу та наступної абсорбції активного інгредієнта у шлунково-кишковому тракті, або для покращення їхньої стабільності та/або зовнішнього вигляду, так чи інакше, застосовуючи традиційні покривні агенти та способи, добре знані в галузі. Композиції для орального застосування можуть бути сформовані у формі твердих желатинових капсул, в яких активний інгредієнт змішують з інертним твердим розріджувачем, наприклад, кальцій карбонатом, кальцій фосфатом або каоліном, або у вигляді м'яких желатинових капсул, в яких активний інгредієнт змішують із водою або маслом таким як арахісова олія, рідкий парафін або оливкова олія. Водні суспензії в цілому містять активний інгредієнт у тонко подрібненій порошковій формі разом із одним або більше суспендуючими агентами, такими як натрій карбоксиметилцелюлоза, метилцелюлоза, гідроксипропілметилцелюлоза, натрій альгінат, полівініл-піролідон, трагакантова камедь та аравійська камедь; диспергуючі або зволожувальні агенти такі як лецитин або продукти конденсації алкілен оксиду із жирними кислотами (наприклад поліоксіетилен стеарат), або продукти конденсації етилен оксиду із довголанцюговими аліфатичними спиртами, наприклад гептадекаетиленоксисетанол, або продукти конденсації етилен оксиду із неповними ефірами, похідними від жирних кислот та гекситу, такими як поліоксіетилен 31 сорбітол моноолеат, або продукти конденсації етилен оксиду із неповними ефірами, похідними від жирних кислот та гексит ангідридами, наприклад поліетилен сорбітан моноолеат. Водні суспензії можуть також містити один або більше консервантів (таких як етил або пропіл ргідроксибензоат, антиоксиданти (такі як аскорбінова кислота), барвні агенти, смакові агенти, та/або підсолоджувальні агенти (такі як сахароза, сахарин або аспартам). Жирні суспензії можуть бути сформовані шляхом суспендування активного інгредієнта у рослинній олії (такій як арахасова олія, оливкова олія, кунжутна олія або кокосава олія) або у мінеральному маслі (такому як рідкий парафін). Жирні суспензії можуть також містити загусник, такий як бджолиний віск, твердий парафін або цетиловий спирт. Підсолоджувальні агенти, такі як ті, що викладені вище, та смакові агенти можуть бути додані для забезпечення смачного орального препарату. Ці композиції можуть бути консервовані шляхом додавання антиоксиданта, такого як аскорбінова кислота. Дисперсні порошки та гранули, придатні для приготування водної суспензії шляхом додання води, як правило, містять активний інгредієнт разом із диспергуючим або зволожувальним агентом, суспендуючим агентом та одним або більше консервантами. Придатні диспергуючі або зволожувальні агенти та суспендуючі агенти проілюстровані тими, що вже зазначені вище. Додаткові наповнювачі такі як підсолоджувальні, ароматичні та барвні агенти, можуть такожбути присутніми. Фармацевтичні композиції за винаходом можуть також бути у формі емульсії масло-у-воді. Жирною фазою може бути рослинна олія, така як оливкова олія або арахасова олія, або мінеральне масло, таке як наприклад рідкий парафін або суміш будь-яких з них. Придатні емульгувальні агенти можуть бути, наприклад, смолами, що зустрічаються у природі, такими як аравійська камедь або трагакантова камедь, фосфатиди, що зустрічаються у природі, такі як соєві, лецитин, естери або неповні ефіри, похідні від жирних кислот та гексит ангідридів (наприклад сорбітан моноолеат) та продукти конденсації вказаних неповних ефірів із етилен оксидом, такі як поліоксіетилен сорбітан моноолеат. Емульсії можуть також містити підсолоджувальні, ароматичні та консервуючі агенти. Сиропи та еліксири можуть бути сформовані із підсолоджувальними агентами, такими як гліцерол, пропілен гліколь, сорбітол, аспартам або сахароза, та можуть також містити пом'якшувач, консервант, ароматичний та/або барвний агент. Супозиторні склади можуть бути одержані змішуванням активного інгредієнта із придатним не подразнюючим наповнювачем, що є твердим при звичайних температурах, рідкий при ректальній температурі і буде, таким чином, плавитися у прямій кишці для вивільнення ліків. Придатні наповнювачі включають, наприклад, масло какао та поліетилен гліколі. Склади, придатні для вагінального введення, можуть бути представлені у вигляді складів песаріїв, тампонів, кремів, гелей, паст, пін або спреїв, що містять на додаток до активного 94733 32 інгредієнта такі носії, що відомі в галузі для цього призначення. Склади для зовнішнього застосування, така як креми, мазі, гелі та водні або жирні розчини або суспензії, можуть, в цілому, бути одержані формуванням активного інгредієнта із традиційним прийнятним для зовнішнього застосування наповнювачем або розріджувачем. Використовуючи звичайні процедури, добре відомі в галузі. Композиції для трансдермального введення можуть бути у формі тих трансдермальних нашкірних пластирів, що добре знані середньому фахівцю в галузі. Композиції для введення шляхом вдування можуть бути у формі тонко диспергованого порошку, що містить частинки із середнім діаметром, наприклад, 30 мкм або значно меншим, порошок сам по собі містить або тільки активний інгредієнт або активний інгредієнт, розбавлений одним або більше фізіологічно прийнятними носіями, такими як лактоза. Порошок для вдування тоді зручно зберігати у капсулі, що містить, наприклад, від 1 до 50 мг активного інгредієнта для застосування у турбо-інгаляційному пристрої, такому, що використовується для вдування відомого агента натрій кромоглікату. Композиції для введення шляхом інгаляції можуть бути у формі звичайного аерозолю під тиском, пристосованого для диспергування активного інгредієнта або у вигляді аерозолю, що містить тонко дисперговані тверді або рідкі краплі. Можуть бути використані звичайні аерозольні пропеленти, такі як леткі фторовані вуглероди або вуглеводи, а аерозольний пристрій підходящим чином є пристосованим для диспергування дозованої кількості активного інгредієнта. Фармацевтична композиція (або склад) для застосування може бути упакована різними шляхами в залежності від методів, застосовуваних для введення ліків. Наприклад, виріб для розподілення може включати контейнер, що має розташований в ньому фармацевтичний склад у прийнятній формі. Придатні контейнери добре знані фахівцем в галузі та включають матеріали, такі як пляшки (пластикові та скляні), саше, ампули, пластикові резервуари, металеві балони і таке подібне. Контейнер може також включати захищене від невмілого використання з'єднання для попередження необачного доступу до вмісту упаковки. На додаток, контейнер має розташовану на ньому бірку, що описує вміст контейнера. Бірка може також включати відповідні попередження. Склади можуть також бути упаковані в однодозові або багатодозові контейнери, наприклад запаяні ампули та скляночки, та можуть зберігатися у сублімованому (ліофілізованому) стані, що необхідно виключно для додання стерильного рідкого носія, наприклад води, для ін'єктування безпосередньо перед використанням. Виготовлені для негайного використання ін'єкційні розчини та суспензії одержують із стерильних порошків, гранул та таблеток раніше описаних видів. Переважні одиничні дозовані склади ті, що містять денну дозу або одиничну денну субдозу, як цитовані тут вище, або їх прийнятну частину, активного інгредієнта. 33 Винахід також охоплює ветеринарні композиції, що містять принаймні один активний інгредієнт, як вище визначений, разом із веретинарним носієм відповідно. Ветеринарні носії - це речовини, корисні з метою введення композиції, та можуть бути твердими, рідкими або газоподібними речовинами, які є, якщо інше не оговорено, інертними або прийнятними у ветеринарії та сумісними із активним інгредієнтом. Ці ветеринарні композиції можуть вводитися парентерально, орально або будь-яким іншим бажаним шляхом. Кількість сполуки за цим винаходом, що може бути поєднана з одним або більше наповнювачами для одержання єдиної дозованої форми, буде обов'язково варіювати в залежності суб’єкта лікування, тяжкості розладу або стану, інтенсивності введення, розташування сполуки та від розсуду лікаря, що приписує. В одному втіленні, придатна кількість сполуки за цим винаходом, що вводять ссавцю, є та, що він потребує. Введення в одному втіленні відбувається у кількості від приблизно 0,001 мг/кг ваги тіла до приблизно 60 мг/кг ваги тіла на день. В іншому втіленні, введення відбувається у кількості від 0,5 мг/кг ваги тіла до приблизно 40 мг/кг ваги тіла на день. У деяких випадках, рівні дозувань нижче нижчої границі вищезгаданого діапазону можуть бути більш ніж адекватні, у той час як в інших випадках ще більші дози можуть бути застосовані без викликання шкідливого побічного ефекту за умови, що такі підвищені дози спершу розділені на декілька малих доз для введення протягом дня. Для додаткової інформації про шляхи введення та режими дозувань, дивись Chapter 25.3, Volume 5, Comprehensive Medicinal Chemistry (Corwin Hansch; Chairman of Editorial Board), Pergamon Press 1990, що спеціально включено тут шляхом посилання. Вироби В іншому втіленні винаходу, охопленим є виріб, або "набір", що містить матеріали, корисні для лікування описаних вище розладів. В одному втіленні, набір містить контейнер, що містить сполуку за цим винаходом. Придатні контейнери включають, наприклад, пляшки, пляшечки, шприці, блістерну упаковку і т.д. Контейнер може бути сформований із різних матеріалів, таких як скло або пластик. Контейнер може утримувати сполуку за цим винаходом або її склад, який є ефективним для лікування стану, та може мати стерильний вхідний отвір (наприклад, контейнер може бути пакет із внутрішньовенним розчином або пляшечка, що має пробку, яку може бути проколото голкою для підшкірної ін'єкції). Набір може окрім того включати бірку або вкладиш в упаковку на або приєднаний до контейнера. Термін "вкладиш в упаковку", що використовується, стосується інструкцій звичайно включених у комерційну упаковку терапевтичних продуктів, що містить інформацію про призначення, застосування, дозування, введення, протипоказання та/або попередження стосовно застосування таких терапевтичних продуктів. В одному втіленні, бірка або вкладиш в упаковки вказують, що композиція, що містить сполуку за цим винаходом, може бути застосована для лікування кіназ-опосередкованого 94733 34 захворювання або розладу. Бірка або вкладиш в упаковку можуть також вказувати, що композиція може використовуватися для лікування інших розладів. У певних втіленнях, набори є придатними для доставки твердих оральних форм сполуки за цим винаходом, таких як таблетки або капсули. Такий набір переважно включає множину одиничних доз. Такі набори можуть включати карту, що має дози, зорієнтовані у порядку їх передбаченого застосування. Прикладом такого набору є "блістерна упаковка". Блістерні упаковки добре відомі в галузі пакування та широко застосовуються для пакування фармацевтичних одиничних дозованих форм. Якщо бажано, може бути забезпечена допомога для пам'яті, наприклад у формі номерів, літер або іншого маркування, або за рахунок вкладишу із календарем, що зазначає дні в лікувальному плані, за яким має здійснюватися прийом. Відповідно до іншого втілення, набір може включати (а) перший контейнер із сполукою за цим винаходом, вміщеною в нього; та (b) другий контейнер із другим фармацевтичним складом, вміщеним в нього, де другий фармацевтичний склад містить другу сполуку, корисну для лікування кіназопосередкованого захворювання або розладу. Альтернативно, або додатково, набір може також включати третій контейнер, що містить фармацевтично-прийнятний буфер, такий як бактеріостатичну воду для ін'єкції (BWFI), фосфатно-сольовий буферний розчин, розчин Рингера та розчин декстрози. Набір може окрім того включати інші матеріали, бажані з комерційної та споживацької точок зору, включаючи інші буфери, розріджувачі, фільтри, голки та шприци. Набір може також містити інструкції із введення сполуки за цим винаходом та, якщо присутній, другого фармацевтичного складу. Наприклад, якщо набір включає першу композицію, що містить сполуку за цим винаходом та другий фармацевтичний склад, набір може додатково містити інструкції із одночасного, послідовного або окремого введення першої та другої фармацевтичних композицій пацієнту, який цього потребує. У певних інших втіленнях, де набір включає композицію за цим винаходом та другий фармацевтичний склад, набір може включати контейнер для вміщування окремих композицій таких як секційна пляшка або секційний пакет із фольги, тим не менш, окремі композиції можуть також утримуватися в окремому індивідуальному контейнері. У певних втіленнях, набір включає інструкції із введення окремих компонентів. Форма набору є особливо корисною, коли окремі компоненти переважно вводять у різних дозованих формах (наприклад, оральній та парентеральній), вводять при різних дозувальних інтервалах, або коли лікар, що прописує лікування, бажає титрування індивідуальних компонентів комбінації. Біологічна активність р38 МАРК інгібування Активність сполук за цим винаходом може бути оцінена на р38 МАРК інгібування in vitro, in vivo, або у клітинній лінії. In vitro дослідження включають дослідження, що визначають інгібування або 35 кіназної активності, або ATPase активності активованої р38 МАРК. Альтернативні in vitro дослідження передбачають кількісну оцінку здатності інгібітора до зв'язування із р38 МАРК та можуть вимірюватися або за допомогою введення радіоактивної мітки в інгібітор перед зв'язуванням, ізолювання інгібітор/р38 МАРК комплексу та визначення кількості зв'язаних радіоактивних міток, або керуючи конкурентним експериментом, де нові інгібітори інкубують із р38 МАРК, зв'язаною із відомими радіолігандами. Ті та інші, корисні в аналізах in vitro та у клітинних культурах, добре відомі тим, хто знається в галузі. Дослідження в клітинній культурі інгібувального ефекту сполук за цим винаходом можуть бути використані для визначення кількості TNF-, IL-1, IL-6 або IL-8, що продуковані у цільній крові або її клітинних фракціях в клітинах, оброблених інгібітором, порівняно із клітинами, обробленими згідно із негативним контролями. Рівень цих цитокінів може бути визначений за допомогою комерційно доступних ELISAs або як описано в розділі Біологічні приклади нижче. Приклади Щоб проілюструвати винахід, включені наступні приклади. Однак, слід розуміти, що ці приклади не обмежують винахід та призначені лише, щоб проілюструвати спосіб здійснення винаходу. Біологічні приклади Біологічні активності сполук за винаходом були продемонстровані шляхом наступних in vitro досліджень. Сполуки, використані в Прикладах СМ були: Сполука 72: 1-(3-tert-бутил-1-p-толіл-1Hпіразол-5-іл)-3-(5-фтор-2-(1-(2-гідроксіетил)-1Hіндазол-5-ілокси)бензил)сечовина (Приклади 1 та 3); та Сполука 74: 2-(5-(2-((3-(3-tert-бутил-1-ртоліл-1H-піразол-5-іл)уреїдо)метил)-4фторфенокси)-1H-індазол-1-іл)етил дигідрогенфосфат (Приклади 2 та 4). Приклад А р38 Біохімічне дослідження р38 активність визначали при кімнатній температурі в 100 мкл реакційної суміші, що містила 5 нМ активованого р38 ферменту та 1 мкМ ATF-2 (злитий білок активуючого транскрипційного фактора 2) як субстрат у 25 мМ HEPES (рН 7,4), 100 мкМ ванадату, 1 мМ DTT, 10 мМ MgCl2 та 10 мкМ 33 33 [- Р]-АТР (0.1Сі Р /реакційна суміш). Реакцію було завершено через 30-40 хвилин доданням 25% ТСА, дали постояти протягом 5 хвилин, та потім перенесли безпосередньо до GF-B мембранної фільтрувальної пластини. Фільтр було промито двічі протягом 30 секунд 0,5% фосфорною кислотою із застосуванням Tomtec Mach III автоматизованого харвестора. Після промивання, вакуум підтримували протягом 30 секунд для сушки фільтра. Приблизно 30 мкл сцинтилятора було додано в кожну лунку до фільтрувальної пластини та потім прочитано в рідинному сцинтиляційному лічильнику (Packard TopCount HTS). Приклад В РВМС дослідження Здатність сполук за цим винаходом інгібувати TNF- продукування визначали за допомогою мононуклеарів переферичної крові людини ("РВМС"), 94733 36 які синтезують та секретують TNF- при стимуляції ліпополісахаридом. Тестовані розчини сполук було виготовлено шляхом одержання 5-кратних серійних розведень у DMSO, котрі потім розбавляли до одержання 5 вихідних розчинів шляхом розбавляння із MEM, 2% інактивованої нагріванням фетальної бичачої сироватки ("FBS"), 20 мМ HEPES, 2 мМ Lглутаміну, та 1% пеніцилін/стрептоміцину. PBMC's були ізольовані від людської крові у такий спосіб. Зразки цільної крові були зібрані від людей-волонтерів в Vacutainer™ CPT від Becton Dickinson. Пробірки були перемішані та центрифуговані при кімнатній температурі (18-25°С) в горизонтальному роторі протягом принаймні 15 хвилин при 1500-1800 RCF (відноста відцентрова сила). Для кожного донора, світлі шари кров'яного зсідка були об'єднані в одній пробірці та промиті двічі фосфатно-сольовим буферним розчином ("PBS"). Клітинний залишок після центрифугування було ресуспендовано в MEM, 2% інактивованій нагріванням фетальній бичачій сироватці ("FBS"), 20 мМ HEPES, 2 мМ L-глутаміну, та 1% пеніцилін/стрептоміцину. Загальну кількість клітин було визначено за допомогою гемоцитометра та клітинна суспензія була доведена до 210 клітин/мл. До кожної лунки 96-лункового клітинного культурального планшета було додано 0,1 мл клітинної суспензії. Тестований розчин сполуки (30 мкл) було додано, та клітини було інкубовано в 37°С/5% СО2 інкубаторі протягом 1 години, та потім до кожної лунки було додано 20 мкл 7,5 нг/мл ліпополісахариду (LPS E. Coli K-235), та клітити повернули до 37°С/5% СО2 інкубатора на 16-20 годин. Клітини центрифугували протягом 15 хвилин при 1100 RCF. Приблизно 0,12 мл надосадової рідини було перенесено до чистого 96лункового поліпропіленового планшету. Зразки досліджувалися або одразу ж або зберігалися при -80°С до підготовки до дослідження. TNF- рівні визначали в кожному зразку, застосовуючи ELISA дослідження людського TNF- таке як те, що описане нижче. Рівні TNF- визначали, використовуючи таке дослідження. Вкриті TNF-альфа антитілами планшети були одержані доданням 150 мкл 2 мкг/мл очищеного від анти-TNF- мишачого моноклонального IgG в карбонат-бікарбонатому буфері (ВuрН™ пакет із карбонат-бікарбонатним буфером) до лунок 96-лункового Immulon 4 планшета (Immulon 4 ELISA плоскодонний планшет; Dynex, каталоговий номер 011-010-3855) та інкубовані протягом ночі при 2-8°С. Покривний розчин було видалено та додано 200 мкл блокуючого буфера (20 мМ HEPES рН 7,4, 150 мМ NaCl, 2% BSA) та планшети зберігалися при 2-8°С до приготовки до використання. Десятибальна стандартна крива рекомбінантного людського TNF- була одержана шляхом 1:2 серійних розведень в розріджувачі зразка (20 мМ HEPES, рН 7,4, 150 мМ NaCl, 2 мМ мг Сl2, 1% BSA) із максимальною концентрацією 6000 пг/мл. Блокуючий розчин було видалено з TNF- ELISA планшетів п'ятикратним промиванням 300 мкл "промивного буфера" (20 мМ HEPES, рН 7,4, 37 150 мМ NaCl, 2 мМ мгСl2, 0,02% Tween-20). 50 мкл розріджувача зразка було додано в кожну лунку, та потім до всіх лунок було додано або 50 мкл розчину TNF- стандартної кривої або надосадової рідини тестованої сполуки. Планшет інкубували при кімнатній температурі протягом однієї години при струшуванні (300 об./хв). Планшет було п'ятикратно промито водою за допомогою 300 мкл водного буфера. 100 мкл 0,2 мкг/мл біотинільований козлиний анти-TNF- людини в "розріджувачі антитіл" (20 мМ HEPES, рН 7,4, 150 мМ NaCl, 2 мМ мгСl2, 1% BSA, 0,02% Tween-20) було додано до кожної лунки, та планшет було інкубовано при кімнатній температурі протягом однієї години при струшуванні (300 об./хв). Планшет було п'ятикратно промито водою за допомогою 300 мкл водного буфера на кожну лунку. 100 мкл 0,02 мкг/мл стрептавідин лужної фосфатази в розріджувачі антитіл було додано в кожну лунку, та планшет було інкубовано при кімнатній температурі протягом однієї години при струшуванні (300 об./хв). Планшет було п'ятикратно промито водою за допомогою 300 мкл водного буфера на кожну лунку. 200 мкл 1 мг/мл pNPP (р-нітрофеніл фосфату) в діетаноламінному буфері із 0,5 мМ мгСl2 було додано в кожну лунку, і планшет було інкубовано протягом від 30 до 45 хвилин при кімнатній температурі при струшуванні (300 об./хв). Протікання реакції контролювали шляхом визначення оптичної щільності: коли верхній стандарт досягнув значення оптичної щільності між 2,0 та 3,0, в кожну лунку було додано 50 мкл 2N NaOH. Оптичну щільність кожної лунки було визначено не пізніше 30 хвилин, застосовуючи спектрофотометр для прочитування мікротитрувальних планшетів, встановлений на 405 нм. Дані було проаналізовано в дуже високій відповідності, застосовуючи 4-параметрову апроксимацію кривої. Наступні реагенти використовувалися у вищеописаних дослідженнях. Фосфатно-сольовий буферний розчин без кальцію або магнію Дулбекко (Gibco Catalog Number 14190); мінімально збагачене середовище Ерле (MEM; Gibco Catalog Number 11090); пеніцилін-стрептоміцин (Gibco Catalog Number 15140); L-глутамін, 200 мМ (Gibco Catalog Number 25030); HEPES, 1M (Gibco Catalog Number 15630); фетальна бичача сироватка ("FBS"; HyClone Catalog Number SH30070.03); ліпополісахариди з Escherichia coli K-235 ("LPS"; Sigma Catalog Number L2018); анти-TNF- очищений мишиний моноклональний IgG (R&D Systems Catalog Number MAB210); BupH™ пакет із карбонат-бікарбонатим буфером (Pierce Catalog Number 28382); HEPES (FW 238.3; Sigma Catalog Number H3575); NaCl (Sigma Catalog Number S7653); бичий сироватковий альбумін ("BSA"; Jackson ImmunoReseach Catalog Number 001-000-162); поліоксіетилен 20 сорбітан монолаурат (Sigma Catalog Number P2287); магній хлорид, гексагідрат (Sigma Catalog Number M2670); рекомбінантний людський TNF- (R&D Systems Catalog Number 94733 38 210TA010); біотинільований TNF- афінно очищений козлиний IgG, (R&D Systems Catalog Number BAF210); стрептавідин лужна фосфатаза (Jackson ImmunoResearch Catalog Number 016-050-084); діетаноламін субстрат буфер (Pierce Catalog Number 34064); р-нітрофеніл фосфат (Sigma Catalog Number N2765). Приклад С Активність Сполуки 72 проти різних кіназ Вивчали р38 активність Сполуки 72, використовуючи власне дослідження р38 радіоактивних кіназ, застосовуючи ATF-2 як субстрат. Селективність Сполуки 72 визначали шляхом дослідження активності 202 протеїн кіназ у присутності 1 мкМ Сполуки 72. ІС50 визначення потім контролювалися для тих кіназ, що інгібували >80% на першому екрані (АТР концентрація при Km) за встановленими протоколами. Як показано в Таблиці 1, Сполука 72 є сильним інгібітором р38 Абельсон цитоплазматичної тирозин кінази (Abl), Абельсон-пов'язаного гена (Arg) та Тіе-2 рецепторної тирозинкінази. На додаток до цих активностей, Сполука 72 є також помірно діючою проти іматиніб-резистентної форми BCR-Abl T315I, src-сімейства тирозинкінази Hck, Lyn та Fyn, і рецепторні тирозинкінази FGFR1 (рецептор 1 фактора росту фібробластів; FGFR1) та VEGFR2 (рецептор 2 васкулярного ендометріального фактора росту; KDR). Таблиця 1 Кіназа р38 Abl Arg Тіе2 Abl (T315l) Hck Lyn Fyn FGFR1 VEGFR IC50
ДивитисяДодаткова інформація
Назва патенту англійськоюKinase inhibitors and methods of use thereof
Автори англійськоюGroneberg Robert, Burges Laurence E., Harvey Darren, Laird Ellen, Munson Mark C., Rizzi James P., Rodriguez Martha, Eary Charles Todd, Watson Daniel
Назва патенту російськоюИнгибиторы киназы и способы их использования
Автори російськоюГронеберг Роберт, Бургесс Лоренс Э., Харвей Даренн, Лерд Эллен, Мансон Марк, Риззи Джеймс, Родригес Марта, Эри Чарльз Тодд, Ватсон Даниэл
МПК / Мітки
МПК: A61K 31/416, C07D 231/56, A61P 29/00, C07D 231/40
Мітки: використання, способи, інгібітори, кінази
Код посилання
<a href="https://ua.patents.su/30-94733-ingibitori-kinazi-ta-sposobi-kh-vikoristannya.html" target="_blank" rel="follow" title="База патентів України">Інгібітори кінази та способи їх використання</a>
Попередній патент: Сендвіч-елемент
Наступний патент: Терапевтичне антитіло, яке звязується з b-амілоїдним пептидом
Випадковий патент: Спосіб контролю технологічних параметрів