Піразоли як антагоністи crth2
Номер патенту: 109696
Опубліковано: 25.09.2015
Автори: Зайтер Петер, Ост Торстен, Мартірес Домнік, Андерскевіц Ральф, Ріст Вольфганг
Формула / Реферат
1. Піразол формули (Іа) або (Ib) або його фармацевтично прийнятна сіль:
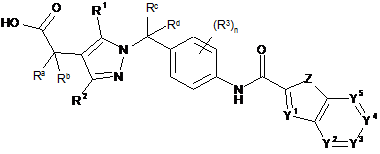 , (Ia)
, (Ia)
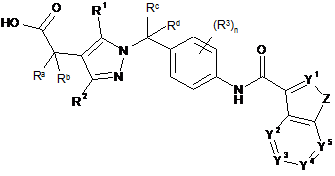 , (Ib)
, (Ib)
в якій
Ra і Rb незалежно вибрані з групи, що включає водень, гідроксигрупу, галоген, С1-С6-алкіл, С1-С6-галогеналкіл, С1-С6-алкоксигрупу, С1-С6-галогеналкоксигрупу і С3-С8-циклоалкіл, або Ra і Rb разом з атомом вуглецю, до якого вони приєднані, можуть утворити карбонільну групу, або Ra і Rb разом з атомом вуглецю, до якого вони приєднані, утворюють 3-8-членне кільце, де вказане кільце може містити як елементи кільця 1 або 2 гетероатоми, вибрані з О, N і S, і де елементи зазначеного кільця необов'язково можуть бути незалежно заміщені гідроксигрупою, галогеном, С1-С6-алкілом, С1-С6-галогеналкілом, С1-С6-алкоксигрупою, С1-С6-галогеналкоксигрупою і С3-С8-циклоалкілом;
Rc і Rd незалежно вибрані з групи, що включає водень, гідроксигрупу, галоген, С1-С6-алкіл, С1-С6-галогеналкіл, С1-С6-алкоксигрупу, С1-С6-галогеналкоксигрупу і С3-С8-циклоалкіл, або Rc і Rd разом з атомом вуглецю, до якого вони приєднані, можуть утворити карбонільну групу, або Rc і Rd разом з атомом вуглецю, до якого вони приєднані, утворюють 3-8-членне кільце, де вказане кільце може містити як елементи кільця 1 або 2 гетероатоми, вибрані з О, N і S, і де елементи зазначеного кільця необов'язково можуть бути незалежно заміщені гідроксигрупою, галогеном, С1-С6-алкілом, С1-С6-галогеналкілом, С1-С6-алкоксигрупою, С1-С6-галогеналкоксигрупою і С3-С8-циклоалкілом;
Y1, Y2, Y3, Y4 і Y5 незалежно вибрані із N і CRy, де кожен Ry незалежно вибраний із групи, що включає Н, гідроксигрупу, галоген, ціаногрупу, нітрогрупу, SF5, C(O)NRfRg, С1-С6-алкіл, гідроксі-С1-С6-алкіл, С1-С6-алкоксі-С1-С6-алкіл, С3-С8-циклоалкіл, С1-С6-галогеналкіл, С1-С6-алкоксигрупу, С1-С6-алкоксі-С1-С6-алкоксигрупу, С1-С6-галогеналкоксигрупу, С3-С8-циклоалкоксигрупу, С1-С6-алкіламіногрупу, ді-С1-С6-алкіламіногрупу, С1-С6-алкілсульфоніл, феніл, феноксигрупу, 5- або 6-членний гетероцикліл і 5- або 6-членну гетероциклілоксигрупу, де Rf і Rg незалежно один від одного вибрані з групи, що включає Н, С1-С6-алкіл, С1-С6-галогеналкіл, С3-С8-циклоалкіл, С3-С8-циклоалкеніл і 5- або 6-членний гетероцикліл, або Rf і Rg разом з атомом азоту, до якого вони приєднані, утворюють циклічний амін, який може містити як елемент кільця додатковий гетероатом, вибраний з О, N і S;
Z вибраний із О, S і NRz, де Rz означає Н, С1-С6-алкіл або бензил;
R1 і R2 незалежно один від одного вибрані з групи, що включає Н, галоген, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С1-С6-алкоксигрупу, С1-С6-алкілтіогрупу, -NRfRg, С3-С8-циклоалкіл, С3-С8-циклоалкіл-С1-С6-алкіл, С3-С8-циклоалкіл-С2-С6-алкеніл, С3-С8-циклоалкеніл, С3-С8-циклоалкеніл-С1-С6-алкіл, С3-С8-циклоалкеніл-С2-С6-алкеніл, феніл, феніл-С1-С6-алкіл, феніл-С2-С6-алкеніл, нафтил, нафтил-С1-С6-алкіл, нафтил-С2-С6-алкеніл, гетероцикліл, гетероцикліл-С1-С6-алкіл і гетероцикліл-С2-С6-алкеніл, де
С1-С6-алкільні, С2-С6-алкенільні і С2-С6-алкінільні фрагменти, що містяться у вказаних вище радикалах R1 і R2, є незаміщеними або містять щонайменше один замісник, вибраний з групи, що включає гідроксигрупу, галоген, ціаногрупу, нітрогрупу, С1-С6-алкоксигрупу, С1-С6-галогеналкоксигрупу, С1-С6-алкіламіногрупу, ді-С1-С6-алкіламіногрупу і С1-С6-алкілсульфоніл, і/або
де два радикали, зв'язані з одним і тим же атомом вуглецю зазначених С1-С6-алкільних, С2-С6-алкенільних і С2-С6-алкінільних фрагментів в зазначених вище радикалах R1 і R2, разом із зазначеним атомом вуглецю можуть утворити карбонільну групу, і де
С3-С8-циклоалкільні, циклоалкенільні, фенільні, нафтильні і гетероциклільні фрагменти в зазначених вище радикалах R1 і R2 є незаміщеними або містять щонайменше один замісник, вибраний з групи, що включає гідроксигрупу, галоген, ціаногрупу, нітрогрупу, С1-С6-алкіл, С3-С8-циклоалкіл, С1-С6-галогеналкіл, С1-С6-алкоксигрупу, С1-С6-галогеналкоксигрупу, С1-С6-алкіламіногрупу, ді-С1-С6-алкіламіногрупу, С1-С6-алкілсульфоніл, феніл і 5- або 6- членний гетероарил, і/або
де два радикали, зв'язані з одним і тим же атомом вуглецю зазначених С3-С8-циклоалкільних, С3-С8-циклоалкенільних і гетероциклільних фрагментів в радикалах R1 і R2, разом із зазначеним атомом вуглецю можуть утворити карбонільну групу, і де
Rf і Rg незалежно один від одного вибрані з групи, що включає Н, С1-С6-алкіл, С1-С6-галогеналкіл, С3-С8-циклоалкіл, С3-С8-циклоалкеніл і гетероцикліл, або
Rf і Rg разом з атомом азоту, до якого вони приєднані, утворюють циклічний амін, який може містити як елемент кільця додатковий гетероатом, вибраний з О, N і S;
n означає ціле число, вибране з 0, 1, 2 або 3; і
R3, якщо присутні, незалежно один від одного вибрані з групи, що включає галоген, С1-С6-алкіл, С1-С6-галогеналкіл, С1-С6-алкоксигрупу, С1-С6-галогеналкоксигрупу і С3-С8-циклоалкіл.
2. Піразол формули (Іа) або (Іb) за п. 1, де Ra і Rb обидва означають водень.
3. Піразол формули (Іа) або (Іb) за будь-яким з попередніх пунктів, де Rc і Rd обидва означають водень.
4. Піразол формули (Іа) або (Іb) за будь-яким з попередніх пунктів, де Y1 означає CRy1 або N, де Ry1 мають одне зі значень, зазначених для Ry в п. 1.
5. Піразол формули (Іа) або (Іb) за п. 4, де Y1 означає CRy1.
6. Піразол формули (Іа) або (Іb) за п. 5, де Ry1 вибраний із групи, що включає Н, С1-С6-алкіл, С1-С6-алкоксі-С1-С6-алкіл і С1-С6-галогеналкіл.
7. Піразол формули (Іа) або (Іb) за будь-яким з попередніх пунктів, де Y2 означає CRy2, Y3 означає CRy3, Y4 означає CRy4 і Y5 означає CRy5, де Ry2, Ry3, Ry4 і Ry5 незалежно один від одного мають одне зі значень, зазначених для Ry в п. 1.
8. Піразол формули (Іа) або (Іb) за п. 7, де Ry2, Ry3, Ry4 і Ry5 незалежно вибрані з групи, що включає Н, галоген, С1-С6-алкоксигрупу, С1-С6-алкоксі-С1-С6-алкоксигрупу і С1-С6-галогеналкоксигрупу.
9. Піразол формули (Іа) або (Іb) за будь-яким з попередніх пунктів, де Z означає О.
10. Піразол формули (Іа) або (Іb) за будь-яким з пп. 1-8, де Z означає S.
11. Піразол формули (Іа) або (Іb) за будь-яким з пп. 1-8, де Z означає NRZ.
12. Піразол формули (Іа) або (Іb) за будь-яким з попередніх пунктів, де R1 і R2 незалежно один від одного вибрані з групи, що включає Н, С1-С6-алкіл, С3-С8-циклоалкіл, феніл і нафтил.
13. Піразол формули (Іа) або (Іb) за п. 12, де R1 і R2 незалежно один від одного вибрані з групи, що включає Н, С1-С4-алкіл, С3-С6-циклоалкіл і феніл.
14. Піразол формули (Іа) або (Іb) за п. 13, де R1 і R2 вибрані із С1-С4-алкілу.
15. Піразол формули (Іа) або (Іb) за будь-яким з попередніх пунктів, де n дорівнює 0 або 1.
16. Піразол формули (Іа) або (Іb) за будь-яким з попередніх пунктів, де R3, якщо присутні, незалежно вибрані з галогену.
17. Піразол формули (Іа) за будь-яким з попередніх пунктів, який вибраний зі сполук формули (Іа'):
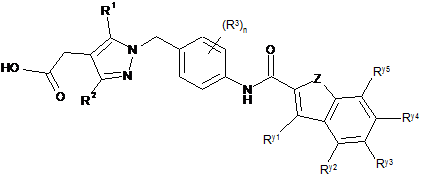 , (Іа')
, (Іа')
в якій Z, R1, R2, R3, Ry1, Ry2, Ry3, Ry4 і Ry5 мають одне зі значень, наведених в будь-якому з попередніх пунктів, і n дорівнює 0 або 1.
18. Піразол формули (Іb) за будь-яким з пп. 1-16, який вибраний зі сполук загальної формули (Іb'):
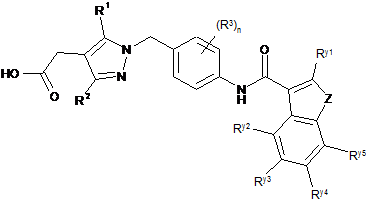 , (Іb')
, (Іb')
в якій Z, R1, R2, R3, Ry1, Ry2, Ry3, Ry4 і Ry5 мають одне зі значень, наведених в будь-якому з попередніх пунктів, і n дорівнює 0 або 1.
19. Застосування піразолу формули (Іа) або (Іb) за будь-яким з попередніх пунктів як лікарського засобу.
20. Застосування піразолу формули (Іа) або (Іb) за будь-яким з пп. 1-18 для приготування лікарського засобу, призначеного для лікування захворювань, пов'язаних з активністю CRTH2.
21. Застосування піразолу формули (Іа) або (Іb) за будь-яким з пп. 1-18 для приготування лікарського засобу, призначеного для попередження та/або лікування запальних, інфекційних та імунорегуляторних порушень, захворювань або патологічних станів дихальних шляхів або шлунково-кишкового тракту, запальних захворювань суглобів і алергічних захворювань носоглотки, очей і шкіри.
22. Фармацевтичний препарат, що містить один або більше піразолів формули (Іа) та/або (Іb) за будь-яким з пп. 1-18.
23. Фармацевтичний препарат, що містить один або більше піразолів формули (Іа) та/або (Іb) за будь-яким з пп. 1-18 в комбінації з однією або кількома активними речовинами, вибраними з групи, що включає бета-міметики, антихолінергетики, кортикостероїди, інгібітори PDE4, антагоністи LTD4, інгібітори EGFR, антагоністи CCR3, антагоністи CCR5, антагоністи CCR9, інгібітори 5-LO, антагоністи гістамінових рецепторів, інгібітори SYK і сульфонаміди.
Текст
Реферат: Даний винахід стосується піразолів формули (Іа) або (Іb) та їх фармацевтично прийнятних a b c d 1 2 3 4 5 1 2 3 солей, в яких R , R , R , R , Y , Y , Y , Y , Y , Z, R , R , n і R мають одне зі значень, наведених в описі і формулі винаходу, їх застосування як лікарських засобів, фармацевтичного препарату, який містить зазначені сполуки, і фармацевтичних препаратів, що містять зазначені сполуки в комбінації з одним або кількома активними речовинами. Ці сполуки мають антагоністичну активність по відношенню до CRTH2. UA 109696 C2 (12) UA 109696 C2 O R HO 1 Rc Rd (R3)n O N Ra Rb N R Z N H 2 Y Y 1 Y Y O R HO 1 N 2 Y O Y N H 1 Z Y 2 Y 3 Y Y 4 3 (R3)n N R 2 Rc Rd Ra Rb 5 5 4 . (Ib) , (Ia) UA 109696 C2 Даний винахід належить до піразолів формули (Ia) або (Ib) та їх фармацевтично прийнятних солей, які мають антагоністичну активність по відношенню до CRTH2, O HO R R c 1 R R d 3 (R )n O N a R b N R Z N H 2 5 Y 1 4 Y Y 2 O HO R R c 1 R R 3 d (R )n O N a R b 1 N R Y N H 2 Z 2 Y (Ib) 5 3 Y Y4 5 10 15 20 25 30 35 40 a b 3 Y Y (Ia) c d 1 2 3 4 5 1 Y 2 3 в яких R , R , R , R , Y , Y , Y , Y , Y , Z, R , R , n і R мають одне зі значень, наведених в описі і формулі винаходу, до застосування зазначених сполук в якості лікарських засобів, до фармацевтичних препаратів, що містять зазначені сполуки, і до фармацевтичних препаратів, що містять зазначені сполуки в комбінації з однією чи кількома активними речовинами. РІВЕНЬ ТЕХНІКИ Простагландин D2 (PGD2) являє собою ейкозаноїд, що утворюється в результаті метаболізму арахідонової кислоти при стимуляції запальних клітин алергенами, запальними факторами або при пошкодженні тканин. PGD2 в першу чергу вивільняється мастоцитами з клітинами Th2, дендритними клітинами, і його вторинним джерелом є макрофаги. PGD2 є головним метаболітом арахідонової кислоти, що продукуються мастоцитами при стимуляції алергеном (Lewis et al., J. Immunol. 1982, 129:1627-1631), і його виявили у високій концентрації в дихальних шляхах пацієнтів, які страждають на астму (Murray et al, N Engl J Med, 1986, 315:800804; Liu et al., Am Rev Respir Dis, 1990, 142 126-132; Zehr et al., Chest, 1989, 95:1059-63; Wenzel et al., J Allergy Clin Immunol, 1991, 87540-548). Продукування PGD2 посилюється також у пацієнтів, які страждають системним мастоцитозом (Roberts N. Engl. J. Med. 1980, 303, 14001404; Butterfield et al., Int Arch Allergy Immunol, 2008,147:338-343), алергічним ринітом (Naclerio et al., Am Rev Respir Dis, 1983, 128:597-602; Brown et al., Arch Otolaryngol Head Neck Surg, 1987, 113:179-183; Lebel et al., J Allergy Clin Immunol, 1988, 82:869-877), уртикарною висипкою (Heavy et al., J Allergy Clin Immunol, 1986, 78:458-461), хронічним риносинуситом (Yoshimura et al., Allergol Int, 2008, 57:429-436), хронічним обструктивним захворюванням легень (Csanky et al., Electrophoresis, 2009, 30:1228-1234), і під час анафілаксії (Ono et al., Clin Exp Allergy, 2009, 39:72-80). Введення PGD2 в дихальні шляхи може викликати реакцію, характерну для астматичної відповіді, включаючи бронхостеноз (Hardy et al., 1984, N Engl J. Med 311:209-213; Sampson et al 1997, Thorax 52: 513-518) і накопичення еозинофілів (Emery et al., 1989, J. Applied Physiol 67: 959-962). Здатність PGD2 ініціювати запальні відповіді підтверджена надекспресуванням PGD2 синтази людини у мишей, що приводить до посилення еозинофільного запалення легенів і продукуванню цитокінів Th2 у відповідь на алерген (Fujitani et al, 2002 J. Immunol. 168:443-449). PGD2 є агоністом двох типів містять 7 трансмембранних спіралей зшитих з білком G рецепторів, рецептора PGD2 DP1 (Boie et al., J Biol Chem, 1995, 270:18910-6) і недавно ідентифікованого рецептора CRTH2 (хемотаксичний рецептор-гомологічна молекула, експресується в клітинах Th2) (також називається рецептором DP2) (Nagata et al., J. Immunol., 1999, 162:1278-86). CRTH2 експресується в клітинах Th2, еозинофілах, базофілах і мастоцитах (Nagata et al., FEBS Lett, 1999, 459: 195-199; Nagata et al., J Immunol, 1999, 162: 1278-1286; Cosmi et al., Eur J Immunol, 2000, 30:2972-2979; Boehme et al., Int Immunol, 2009, 21: 621-32). З використанням агоністів CRTH2, таких як 13,14-дигідро-15-кето-PGD2 (DK-PGD2) і 15R-метил-PGD2, було встановлено, що активація CRTH2 ініціює клітинні процеси, що призводить до рекрутменту і 1 UA 109696 C2 5 10 15 20 активації запальних клітин (Spik et al., J. Immunol., 2005;174:3703-8; Shiraishi, J. Pharmacol. Exp. Ther., 2005, 312:954-60; Monneret et al., J. Pharmacol. Exp. Ther., 2003, 304:349-355). З використанням селективних антагоністів CRTH2 було встановлено, що можна послабити запальні відповіді і патофізіологічні зміни в експериментальних моделях на тварин таких захворювань, як астма, алергічний риніт, атопічний дерматит і ХОЗЛ (хронічне обструктивне захворювання легень) (Uller et al., Respir Res. 2007, 8:16; Lukacs et al., Am J Physiol Lung Cell Mol Physiol. 2008, 295:L767-79; Stearns, Bioorg. Med Chem Lett. 2009,19:4647-51; Nomiya, J Immunol, 2008, 180:5680-5688; Boehme et al., Int Immunol, 2009, 21:1-17; Boehme et al., Int Immunol, 2009, 21:81-93; Takeshita et al., Int Immunol, 2004, 16:947-59; Stebbins et al., J Pharmacol Exp Ther. 2009). Крім того, генетична делеція CRTH2 у мишей послаблює запальні відповіді в експериментальних моделях на тварин алергії (Shiraishi et al., J Immunol. 2008;180:541-549; Oiwa, Clin Exp Allergy, 2008, 38:1357-66; Satoh et al., J Immunol, 2006,177:2621-9). На відміну від цього, селективний стосовно DP1 агоніст BW245C не сприяє запальним відповідям, таким як міграція чи активація лімфоцитів Th2, базофілів або еозинофілів (Yoshimura-Uchiyama et al., Clin Exp Allergy, 2004, 34:1283-90; Xue et al., Immunol, 2005, 175:6531-6; Gervais et al., J Allergy Clin Immunol, 2001, 108:982-8). Тому, засоби, які протидіють впливу PGD2 на рецептор CRTH2, повинні бути придатні для лікування патологічних станів дихальних шляхів або шлунковокишкового тракту, а також запальних захворювань суглобів і алергічних захворювань носоглотки, очей і шкіри. В WO2004/096777 описані похідні піримідину формули (a) та їх солі, R R 6 4 R N 3 N (a) R 5 R 1 N R 2 6 25 в якій R означає карбоксигрупу, карбоксамід, нітрил або тетразоліл, зазначені похідні мають антагоністичну активність по відношенню до CRTH2 і їх можна використовувати для профілактики і лікування захворювань, пов'язаних з активністю CRTH2. В WO2009/042138 заявлені заміщені алкілтіогрупою піримідинів формули (b), R R 1 2 S(O)k R N R 3 N (b) 4a R 4b 5 (R )m W R 6 зазначені сполуки мають антагоністичну активність по відношенню до CRTH2. В WO2009/042139 заявлені 2-S-бензилпіримидини формули (c), 2 UA 109696 C2 R R 3 1 R N 4a R 4b 5 R 2 (R )m S(O)k N R (c) 8 зазначені сполуки мають антагоністичну активність по відношенню до CRTH2. У EP0480659 заявлені сполуки загальної формули (d), 1 2 Z Z 3 Z 1 X (d) Y 5 2 в якій Z , зокрема, може означати карбокси-C1-C10-алкіл-C= і Y може означати заміщений бензил, зазначені сполуки можуть бути придатні для лікування гіперурикемії. У WO2005/040128 заявлені сполуки загальної формули (e), 9 8 2b R R R W N 1 R X Z 2a R (e) Y x R 10 15 20 зазначені сполуки можуть бути придатні для лікування патологічних станів, таких як біль, або запальних, імунологічних, порушень кісток, нейродегенеративних або ниркових порушень. У WO01/38325 заявлені сполуки загальної формули (f), (f) у якій A означає ароматичне кільце і B означає азотовмісне 5-членне гетероциклічне кільце, яке може бути додатково заміщено, зазначені сполуки мають гіпоглікемічну і гіполіпідемічну активність. Завданням даного винаходу є отримання додаткових сполук, що мають антагоністичну активність по відношенню до CRTH2. Бажані сполуки, запропоновані в даному винаході, за даними дослідження з використанням цілих клітин мають покращену хімічну стабільність, поліпшені фармакокінетичні характеристики (PK) та/або поліпшену активність. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід належить до піразолів формули (Ia) або (Ib) та їх фармацевтично прийнятних солей, O HO R R c 1 R R d 3 (R )n O N a R b R N N H 2 Z 5 Y 1 4 Y Y 2 3 Y Y (Ia) 3 UA 109696 C2 O HO R R c 1 R R d 3 (R )n O N a R b R 1 N Y N H 2 (Ib) Z 2 Y 5 3 4 Y Y 5 10 15 20 25 30 35 40 45 50 Y в яких a b R і R незалежно вибрані з групи, що включає водень, гідроксигрупу, галоген, C 1-C6-алкіл, a C1-C6 галогеналкіл, C1-C6-алкоксигрупу, C1-C6-галогеналкоксигрупу і C3-C8-циклоалкіл, або R і b R разом з атомом вуглецю, до якого вони приєднані, можуть утворити карбонільну групу, або a b R і R разом з атомом вуглецю, до якого вони приєднані, утворюють 3-8-членне кільце, де вказане кільце може містити в якості елементів кільця 1 або 2 гетероатома, вибраних з O, N і S, і де елементи зазначеного кільця необов'язково можуть бути незалежно заміщені гідроксигрупою, галогеном, C1-C6-алкілом, C1-C6-галогеналкілом, C1-C6-алкоксигрупою, C1-C6галогеналкоксигрупою і C3-C8-циклоалкілом; c d R і R незалежно вибрані з групи, що включає водень, гідроксигрупу, галоген, C1-C6-алкіл, c C1-C6-галогеналкіл, C1-C6-алкоксигрупу, C1-C6-галогеналкоксигрупу і C3-C8-циклоалкіл, або R і d R разом з атомом вуглецю, до якого вони приєднані, можуть утворити карбонільну групу, або c d R і R разом з атомом вуглецю, до якого вони приєднані, утворюють 3-8-членне кільце, де вказане кільце може містити в якості елементів кільця 1 або 2 гетероатома, вибраних з O, N і S, і де елементи зазначеного кільця необов'язково можуть бути незалежно заміщені гідроксігрупою, галогеном, C1-C6-алкілом, C1-C6-галогеналкілом, C1-C6-алкоксигрупою, C1-C6галогеналкоксигрупою і C3-C8-циклоалкілом; 1 2 3 4 5 y Y , Y , Y , Y і Y незалежно вибрані із N і CR , де кожен Ry незалежно вибраний з групи, що f g включає H, гідроксигрупу, галоген, ціаногрупу, нітрогрупу, SF5, C(O)NR R , C1-C6-алкіл, гідроксиC1-C6-алкіл, C1-C6-алкокси-C1-C6-алкіл, C3-C8-циклоалкіл, C1-C6-галогеналкіл, C1-C6алкоксигрупу, C1-C6-алкокси-C1-C6-алкоксигрупу, C1-C6-галогеналкоксигрупу, C3-C8циклоалкоксигрупу, C1-C6-алкіламіногрупу, ди-C1-C6-алкіламіногрупу, C1-C6-алкілсульфоніл, феніл, феноксигрупу, 5- або 6-членний гетероцикліл і 5- або 6-членну гетероциклілоксигрупу, де f g R і R незалежно один від одного вибрані із групи, що включає H, C 1-C6-алкіл, C1-C6f g галогеналкіл, C3-C8-циклоалкіл, C3-C8-циклоалкеніл і 5- або 6-членний гетероцикліл, або R і R разом з атомом азоту, до якого вони приєднані, утворюють циклічний амін, який може містити в якості елемента кільця додатковий гетероатомом, вибраний з O, N і S; z z Z вибраний із O, S і NR , де R означає H, C1-C6-алкіл або бензил; 1 2 R і R незалежно один від одного вибрані з групи, що включає H, галоген, C 1-C6-алкіл, C2f g C6-алкеніл, C2-C6-алкініл, C1-C6-алкоксигрупу, C1-C6-алкілтиогрупу, -NR R , C3-C8-циклоалкіл, C3C8-циклоалкіл-C1-C6-алкіл, C3-C8-циклоалкіл-C2-C6-алкеніл, C3-C8-циклоалкеніл, C3-C8циклоалкеніл-C1-C6-алкіл, C3-C8-циклоалкеніл-C2-C6-алкеніл, феніл, феніл-C1-C6-алкіл, феніл-C2C6-алкеніл, нафтил, нафтил-C1-C6-алкіл, нафтил-C2-C6-алкеніл, гетероцикліл, гетероцикліл-C1C6-алкіл і гетероцикліл-C2-C6-алкеніл, де C1-C6-алкільні, C2-C6-алкенільні і C2-C6-алкінільні фрагменти, що містяться у вказаних вище 1 2 радикалах R и R , є незаміщеними або містять щонайменше один замісник, вибраний з групи, що включає гідроксігрупу, галоген, ціаногрупу, нітрогрупу, C1-C6-алкоксигрупу, C1-C6галогеналкоксигрупу, C1-C6-алкіламіногрупу, ди-C1-C6-алкіламіногрупу і C1-C6-алкілсульфоніл, і/або де два радикала, пов'язані з одним і тим же атомом вуглецю зазначених C 1-C6-алкільних, C21 2 C6-алкенільних и C2-C6-алкінільних фрагментів в зазначених вище радикалах R і R , разом із зазначеним атомом вуглецю можуть утворити карбонільну групу, і де C3-C8-циклоалкільні, циклоалкенільні, фенільні, нафтильні і гетероциклільні фрагменти в 1 2 зазначених вище радикалах R і R є незаміщеними або містять щонайменше один замісник, вибраний з групи, що включає гідроксигрупу, галоген, ціаногрупу, нітрогрупу, C 1-C6-алкіл, C3-C8циклоалкіл, C1-C6-галогеналкіл, C1-C6-алкоксигрупу, C1-C6-галогеналкоксигрупу, C1-C6алкіламіногрупу, ди-C1-C6-алкіламіногрупу, C1-C6-алкілсульфоніл, феніл і 5- або 6- членний гетероарил, і/або де два радикала, зв'язані з одним і тим же атомом вуглецю зазначених C 3-C81 2 циклоалкільних, C3-C8-циклоалкенільних і гетероциклільних фрагментів в радикалах R і R , 4 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 разом із зазначеним атомом вуглецю можуть утворити карбонільну групу, і де f g R і R незалежно один від одного вибрані з групи, що включає H, C 1-C6-алкіл, C1-C6галогеналкіл, C3-C8-циклоалкіл, C3-C8-циклоалкеніл і гетероцикліл, або f g R і R разом з атомом азоту, до якого вони приєднані, утворюють циклічний амін, який може містити в якості елемента кільця додатковий гетероатомом, вибраний з O, N і S; n означає ціле число, вибране з 0, 1, 2 або 3; і 3 R , якщо присутні, незалежно один від одного вибрані з групи, що включає галоген, C1-C6алкіл, C1-C6-галогеналкіл, C1-C6-алкоксигрупу, C1-C6-галогеналкоксигрупу і C3-C8-циклоалкіл. Згідно винаходу неочікувано було встановлено, що сполуки формули (Ia) або (Ib), запропоновані в даному винаході, мають значну антагоністичну активність по відношенню до CRTH2. Крім того, згідно винаходу було встановлено, що за даними дослідження з використанням цілих клітин зазначені сполуки зазвичай мають поліпшену хімічну стабільність, поліпшені фармакокінетичні характеристики (PK) та/або поліпшену активність. Таким чином, піразоли формули (Ia) або (Ib), запропоновані в даному винаході, є придатними для попередження та/або лікування захворювань, пов'язаних з активністю CRTH2. Відповідно до цього даний винахід також належить до застосування піразолів формули (Ia) або (Ib), пропонованих в даному винаході, в якості лікарських засобів. Крім того даний винахід належить до застосування сполук формули (Ia) або (Ib) для приготування лікарського засобу, призначеного для лікування захворювань, пов'язаних з активністю CRTH2. Точніше, даний винахід належить до застосування піразолів формули (Ia) або (Ib) для приготування лікарського засобу, призначеного для попередження та/або лікування запальних, інфекційних та імунорегуляторних порушень, захворювань або патологічних станів дихальних шляхів або шлунково-кишкового тракту, запальних захворювань суглобів і алергічних захворювань носоглотки, очей і шкіри. Даний винахід також належить до сполук формули (Ia) або (Ib), пропонованих у даному винаході, призначених для лікування та/або попередження захворювань, пов'язаних з активністю CRTH2. Точніше, даний винахід належить до сполук формули (Ia) або (Ib), призначених для застосування в якості лікарського засобу для лікування захворювань, пов'язаних з активністю CRTH2. Точніше, даний винахід відноситься до піразолів формули (Ia) або (Ib), призначених для застосування в якості лікарського засобу для попередження та/або лікування запальних, інфекційних та імунорегуляторних порушень, захворювань або патологічних станів дихальних шляхів або шлунково-кишкового тракту, запальних захворювань суглобів і алергічних захворювань носоглотки, очей і шкіри. Крім того даний винахід належить до фармацевтичних препаратів, що містять один або більше піразолів формули (Ia) або (Ib), пропонованих в даному винаході, у якості єдиної активної речовини або в комбінації з одним або кількома активними речовинами, вибраними з групи, що включає бета-міметики, антихолінергетики, кортикостероїди, інгібітори PDE4, антагоністи LTD4, інгібітори EGFR, антагоністи CCR3, антагоністи CCR5, антагоністи CCR9, інгібітори 5-LO, антагоністи гістамінового рецептора, інгібітори SYK і сульфонаміди. Активність сполук, пропонованих у даному винаході, у дослідженні зміни форми цільних клітин еозинофілів можна визначити, наприклад, за методиками, описаними в наступних публікаціях: (i) Mathiesen JM, Ulven T, Martini L, Gerlach LO, Heinemann A, Kostenis E. Identification of indol derivatives exclusively interfering with a G protein-independent signalling pathway of the prostaglandin D2 receptor CRTH2. Mol Pharmacol. 2005 Aug;68(2):393-402; (ii) Schuligoi R, Schmidt R, Geisslinger G, Kollroser M, Peskar BA, Heinemann A. PGD2 metabolism in plasma: kinetics and relationship with bioactivity on DP1 and CRTH2 receptors. Biochem Pharmacol. 2007 Jun 30;74(1):107-17; (iii) Royer JF, Schratl P, Carrillo JJ, Jupp R, Barker J, Weyman-Jones C, Beri R, Sargent C, Schmidt JA, Lang-Loidolt D, Heinemann A. A novel antagonist of prostaglandin D2 blocks the locomotion of eosinophils and basophils. Eur J Clin Invest. 2008 Sep;38(9):663-71. Хімічну стабільність сполук, запропонованих у даному винаході, можна визначити, наприклад, за таких умов: (i) інкубація в 0,1 н. розчині HCl при 60 ° C протягом 3 днів (стійкість до гідролізу в кислому середовищі); (ii) інкубація в буферному розчині, що має pH 4,0, при 60 °C протягом 3 днів (стійкість до гідролізу в слабокислому середовищі); (iii) інкубація в буферному розчині, що має pH 7,4, при 60 ° C протягом 3 днів (стійкість до гідролізу в середовищі, що має фізіологічне значення pH); (iv) інкубація в 0,3% розчині пероксиду водню при 20 °C протягом 3 днів (стійкість до впливу окислювальних реагентів); (v) інкубація у воді при обробці УФ2 випромінюванням (ультрафіолетове випромінювання) (лямбда = 300-800 нм, P = 250 Вт/м ) протягом 24 год (стійкість до впливу світла). Кінетику розкладання можна досліджувати, наприклад, з використанням аналізу за допомогою ВЕРХ (високоефективна рідинна хроматографія). 5 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармакокінетичні характеристики (PK) сполук, запропонованих в даному винаході, можна визначити з використанням доклінічних досліджень видів тварин, наприклад, мишей, щурів, собак, морських свинок, міні-свиней, макак-крабоїдів, макак-резусів. Фармакокінетичні характеристики сполуки можна описати, наприклад, за допомогою наступних параметрів: середній час утримування, період напіввиведення, об'єм розподілу, AUC (площа під кривою), кліренс, біологічна доступність після перорального введення. ТЕРМІНИ І ВИЗНАЧЕННЯ, ЩО ВИКОРИСТОВУЮТЬСЯ Термінам, спеціально не визначеним у цьому винаході, слід надавати значення, які їм надав би фахівець в даній галузі техніки з урахуванням опису та контексту. Однак, якщо не вказано інше, то при використанні в описі наведені нижче терміни мають вказані значення і використовуються вказані нижче позначення. У визначених нижче групах, радикалах або фрагментах, перед групою часто зазначена кількість атомів вуглецю. Наприклад, "C1-C6-алкіл" означає алкільну групу або алкільний радикал, що містить від 1 до 6 атомів вуглецю. Зазвичай в групах, які складаються з двох або більшої кількості підгруп, остання названа група є положенням приєднання радикала. Якщо не вказано інше, то для всіх формул і груп передбачаються звичайні значення термінів і звичайні валентності стабільних атомів. Зазвичай в обсяг даного винаходу входять всі таутомерні форми і ізомерні форми та суміші, а саме окремі геометричні ізомери або оптичні ізомери, або рацемічні або нерацемічні суміші ізомерів хімічної структури або сполуки, якщо у назві або структурі сполуки не вказана конкретна стереохімічна конфігурація або ізомерна форма. Термін "заміщений" при використанні в даному винаході означає, що у вказаного атома, фрагмента або радикала будь-який один або більша кількість атомів водню заміщені елементом із зазначеної групи радикалів за умови, що не перевищена нормальна валентність зазначеного атома і що заміщення призводить до стабільної сполуки. Сполуки, розкриті в даному винаході, можуть існувати у вигляді фармацевтично прийнятних солей. В обсяг даного винаходу входять сполуки у вигляді солей, включаючи солі приєднання з кислотами. Відповідні солі включають утворені і з органічними, і з неорганічними кислотами. Такі солі приєднання з кислотами зазвичай є фармацевтично прийнятними. Однак солі з фармацевтично неприйнятними кислотами можна використовувати для приготування і очищення використовуваної сполуки. Також можна отримати солі приєднання з основами і вони є фармацевтично прийнятними. Більш повне обговорення отримання і вибору солей наведено в публікації Pharmaceutical Salts: Properties, Selection, and Use (Stahl, P. Heinrich. Wiley-VCH, Zurich, Switzerland, 2002). Термін "фармацевтично прийнятна сіль" при використанні в даному винаході означає солі або цвіттерійні форми сполук, розкритих в даному винаході, які розчиняються або диспергуються у воді або маслі і є фармацевтично прийнятними, як це визначено в даному винаході. Солі можна отримати при остаточному виділенні і очищенні сполук або окремо по реакції відповідної сполуки у формі вільної основи з відповідною кислотою. Типові солі приєднання з кислотами включають ацетат, адипат, альгінат, L-аскорбат, аспартат, бензоат, бензолсульфонат (безилат), бісульфат, бутират, камфорат, камфорсульфонат, цитрат, диглюконат, форміат, фумарат, гентізат, глутарат, гліцерофосфат, гліколят, гемісульфат, гептаноат, гексаноат, гіпурат, гідрохлорид, гідробромід, гідройодид, 2-гідроксіетансульфонат (ізетіонат), лактат, малеат, малонат, DL-манделат, мезитіленсульфонат, метансульфонат, нафтіленсульфонат, нікотинат, 2-нафталінсульфонат, оксалат, памоат, пектинати, персульфат, 3-фенілпропионат, фосфонат, пікрати, півалат, пропіонат, піроглутамат, сукцинат, сульфонат, тартрат, L-тартрат, трихлорацетат, тріфторацетат, фосфат, глутамат, бікарбонат, паратолуолсульфонат (п-тозілат) і ундеканоат. Крім того, основні групи в сполуках, розкритих в даному винаході, можна кватернізований метил-, етил-, пропіл- і бутилхлоридами, -бромідами і -йодидами; диметил-, діетил-, дибутил- і діамілсульфатами; децил- , лаурил-, міристил- і стерилхлоридами, -бромідами і -йодидами; і бензил- і фенетилбромідами. Приклади кислот, які можна використовувати для отримання терапевтично прийнятних солей приєднання, включають неорганічні кислоти, такі як хлористоводнева кислота, бромістоводнева кислота, сірчана кислота та фосфорна кислота, і органічні кислоти, такі як щавлева кислота, малеїнова кислота, бурштинова кислота і лимонна кислота. Солі також можна отримати шляхом координації сполук з іоном лужного або лужноземельного металу. Таким чином, в обсяг даного винаходу входять солі натрію, калію, магнію і кальцію сполук, розкритих в даному винаході, і т.п. Солі приєднання з основами можна отримати при остаточному виділенні і очищенні сполук з реакції карбоксигрупи з відповідною основою, такою як гідроксид, карбонат або бікарбонат 6 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 катіона металу, або з аміаком або з органічним первинним, вторинним або третинним аміном. Катіони фармацевтично прийнятних солей включають катіони літію, натрію, калію, кальцію, магнію і алюмінію, а також катіони нетоксичних четвертинних амінів, такі як амоній, тетраметиламоній, тетраетиламмоній, метиламін, диметиламін, триметиламін, триетиламін, діетиламін, етиламін, трібутіламін, піридин, N,N-диметиланілін, N-метилпіперидин, Nметілморфолін, діхлоргексіламін, прокаїн, дібензіламін, N,N-дібензілфенетіламін, 1-ефенамін і N,N'-дибензілетілендіамін. Інші типові органічні аміни, застосовні для одержання солей приєднання з основами, включають етилендіамін, етаноламін, діетаноламін, піперидин і піперазин. Хоча сполуки, запропоновані в даному винаході, можна вводити у вигляді чистої речовини, їх також можна використовувати у вигляді фармацевтичного препарату. Відповідно до цього даний винахід належить до фармацевтичних препаратів, які містять одну або більша кількість деяких сполук, розкритих в даному винаході, або одну або більша кількість їх фармацевтично прийнятних солей, складних ефірів, проліків, амідів або сольватів разом з однією чи більшою кількістю фармацевтично прийнятних носіїв і необов'язково одним або більшою кількістю інших терапевтичних інгредієнтів. Носій (носії) повинен бути "прийнятним" в тому сенсі, що він повинен бути сумісний з іншими інгредієнтами препарату і не мати шкідливого впливу на його реципієнта. Те, який препарат використовується, залежить від вибраного шляху введення. Можна використовувати будь-які з добре відомих підходящих методик, носіїв та інертних наповнювачів, відомих в даній галузі техніки; наприклад, описаних у публікації Remington's Pharmaceutical Sciences. Фармацевтичні композиції, розкриті в даному винаході, можна приготувати за будь-якою методикою, відомою в даній галузі техніки, наприклад, за допомогою звичайних методик змішування, розчинення, гранулювання, приготування драже, розтирання в порошок, емульгування, капсулювання, включення або пресування. Термін "галоген" при використанні в даному винаході означає галогенідний замісник, вибраний з групи, що включає фтор, хлор, бром або йод. Термін "C1-C6-алкіл" при використанні в даному винаході (включаючи алкільні фрагменти C1C6-алкоксигрупи, C1-C6-алкіламиногрупи, ди-C1-C6-алкіламіногрупи, C1-C6-алкілтиогрупи і т.п.) означає розгалужені і нерозгалужені алкільні фрагменти, що містять від 1 до 6 атомів вуглецю, приєднаних до решти частини молекули сполуки в будь-якому положенні алкільного ланцюга. Термін "C1-C4-алкіл" відповідно означає розгалужений або нерозгалужений алкільний фрагмент, що містить від 1 до 4 атомів вуглецю. "C1-C4-Алкіл" зазвичай є кращим. Приклади "C1-C6-алкілу" включають: метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, нпентил, ізопентил, неопентил або гексил. Якщо не вказано інше, то визначення пропілу, бутилу, пентилу і гексилу включають всі можливі ізомерні форми зазначених груп. Так, наприклад, пропіл включає н-пропіл і ізопропіл, бутил включає ізобутил, втор-бутил і трет-бутил і т.п. Термін "C1-C6-галогеналкіл" при використанні в даному винаході (включаючи алкільні фрагменти C1-C6-галогеналкоксигрупи, C1-C6-галогеналкіламіногрупи, ди-C1-C6галогеналкіламіногрупи, C1-C6-галогеналкілтіогрупи і т.п.) означає розгалужені і нерозгалужені алкільні фрагменти, що містять від 1 до 6 атомів вуглецю, в яких один або більша кількість атомів водню замінені атомом галогену, вибраним з групи, що включає фтор, хлор або бром, переважно фтор і хлор, особливо переважно фтор. Термін "C1-C4-галогеналкіл" відповідно означає розгалужені і нерозгалужені алкільні фрагменти, що містять від 1 до 4 атомів вуглецю, в яких один або більша кількість атомів водню замінені аналогічно тому, як зазначено вище. C 1C4-Галогеналкіл зазвичай є кращим. Бажані приклади включають: CH 2F, CHF2, CF3. Термін "C2-C6-алкеніл" при використанні в даному винаході (включаючи алкенільні фрагменти інших радикалів) означає розгалужені і нерозгалужені алкенільні групи, що містять від 2 до 6 атомів вуглецю, приєднаних до решти частини молекули сполуки в будь-якому положенні алкенільного ланцюга, і містять щонайменше один подвійний зв'язок. Термін "C2-C4алкеніл" відповідно означає розгалужені і нерозгалужені алкенільні фрагменти, що містять від 2 до 4 атомів вуглецю. Кращими є алкенільні фрагменти, що містять від 2 до 4 атомів вуглецю. Приклади включають: етеніл або вініл, пропеніл, бутеніл, пентеніл або гексеніл. Якщо не вказано інше, то визначення пропенілу, бутенілу, пентенілу і гексенілу включають всі можливі ізомерні форми зазначених фрагментів. Так, наприклад, пропеніл включає 1-пропеніл і 2пропеніл, бутеніл включає 1-, 2- і 3-бутеніл, 1-метил-1-пропеніл, 1-метил-2-пропеніл і т.п. Термін "C2-C6-алкініл" при використанні в даному винаході (включаючи алкінільні фрагменти інших радикалів) означає розгалужені і нерозгалужені алкінільні групи, що містять від 2 до 6 атомів вуглецю, приєднаних до решти частини молекули сполуки в будь-якому положенні алкенільного ланцюга, і містять щонайменше один потрійний зв'язок. Термін "C2-C4-алкініл" відповідно означає розгалужені і нерозгалужені алкінільні фрагменти, що містять від 2 до 4 7 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 атомів вуглецю. Алкінільні фрагменти, що містять від 2 до 4 атомів вуглецю є кращими. Приклади включають етиніл, пропініл, бутиніл, пентиніл або гексиніл. Якщо не вказано інше, то визначення пропінілу, бутинілу, пентинілу і гексинілу включають всі можливі ізомерні форми відповідних фрагментів. Так, наприклад, пропініл включає 1-пропініл і 2-пропініл, бутиніл включає 1-, 2- і 3-бутиніл, 1-метил-1-пропініл, 1-метил-2-пропініл і т.п. Термін "C3-C8-циклоалкіл" при використанні в даному винаході (включаючи ціклоалкільні фрагменти інших радикалів) означає циклопропіл, циклобутил, циклопентил, циклогексил, ціклогептил і циклооктил. Кращими є циклічні алкільні групи, що містять від 3 до 6 атомів вуглецю, такі як циклопропіл, циклопентил і циклогексил. Термін "C3-C8-циклоалкеніл" при використанні в даному винаході (включаючи циклоалкенільні фрагменти інших радикалів) означає карбоциклічні радикали, що містять від 3 до 8 атомів вуглецю і містять щонайменше один, переважно один або два, неспряженні подвійні зв'язки. Прикладами є циклопентеніл, циклопентадієніл, циклогексеніл і циклогексадіеніл. Термін "гетероцикліл" при використанні в даному винаході (включаючи гетероциклільні фрагменти інших радикалів) означає 5-7-членні гетероциклічні радикали і 5-10-членні біцикличні гетероциклічні радикали, що містять в якості елементів кільця 1, 2 або 3 гетероатома, вибраних з O, N і S. Гетероцикліл може бути пов'язаний з молекулою через атом вуглецю або, якщо він є, через атом азоту. Термін "гетероцикліл" при використанні в даному винаході включає насичений або частково ненасичений гетероцикліл, а також гетероарил. Термін "насичений або частково ненасичений гетероцикліл" при використанні в даному винаході (включаючи гетероциклільні фрагменти інших радикалів) означає 5-7-членні моноциклічні гетероциклічні радикали, визначені вище, містять таку кількість подвійних зв'язків, що не утворюється ароматична система, а також 5-10-членні біцикличні гетероциклічні радикали, визначені вище, містять таку кількість подвійних зв'язків, що щонайменше в одному з циклів не утворюється ароматична система. Приклади моноциклічних насичених або частково ненасичених гетероциклілів включають піролідин, тетрагідрофуран, тетрагідротіофен, тіазолідин, діоксолан, піперидин, тетрагідропіран, тетрагідротіопіран, піперазин, морфолін, тіоморфолін, оксазепан і т.п. Приклади біциклічних насичених або частково ненасичених гетероциклілів включають дигідропірролізин, піролізин, тетрагідрохінолін, тетрагідроізохінолін, тетрагідроімідазопірідін, тетрагідропіразолопірідін, бензопіран, бензодіазепін і т.п. Термін "гетероарил" при використанні в даному винаході (включаючи гетероциклільні фрагменти інших радикалів) означає 5-7-членні моноциклічні гетероциклічні радикали, визначені вище, містять таку кількість подвійних зв'язків, що утворюється ароматична система, а також 5-10-членні біцикличні гетероциклічні радикали, визначені вище, містять таку кількість подвійних зв'язків, що в обох циклах утворюється ароматична система. Приклади моноциклічних ароматичних гетероциклілів включають фуран, тіазол, пірол, тіофен, піразол, імідазол, тіадіазол, 1,2,3-триазол, 1,2,4-триазол, тетразол, оксазол, оксадіазол, піридин, пірідазин, піримідин, піразин і т . п. Приклади біциклічних ароматичних гетероциклілів включають піролізин, індол, індолізін, ізоіндол, індазол, пурин, хінолін, ізохінолін, бензімідазол, бензофуран, бензотіазол, бензоізотіазол, пірідопірімідін, птеридин, пірімідопірімідін, імідазопіридин, піразолопірідін і т.п. Термін "конденсований карбоциклічний або гетероциклічний фрагмент" при використанні в даному винаході означає C3-C8-ціклоалкільні, C3-C8-циклоалкенильні, бензольні і гетероциклільні фрагменти, визначені вище, де вказані фрагменти містять щонайменше один загальний зв'язок з циклічним фрагментом, з яким вони пов'язані. Наприклад, бензол, сконденсований з бензолом, означає нафталін. Бажаними є конденсовані циклічні фрагменти, що містять один загальний зв'язок з циклічним фрагментом, з яким вони сконденсовані. Іншим переважним конденсованим фрагментом є бензол. Термін "3-8-членне кільце, утворене двома радикалами разом з атомом вуглецю, до якого вони приєднані, де вказане кільце може містити в якості елементів кільця 1 або 2 гетероатома, вибраних з O, N і S "при використанні в даному винаході означає C3-C8-циклоалкільні, C3-C8циклоалкенильні і гетероциклільні фрагменти, визначені вище. Термін "циклічний амін, утворений двома радикалами разом з атомом азоту, до якого вони приєднані, де вказане кільце може містити в якості елемента кільця додатковий гетероатомом, вибраний з O, N і S "при використанні в даному винаході означає циклічні аміни, що містять від 3 до 8, переважно 5 або 6 елементів кільця. Прикладами таких утворених амінів є пірролідін, піперидин, піперазин, морфолін, пірол, імідазол і т.п. Терміни "гетероцикліл-C1-C6-алкіл", "C3-C8-циклоалкіл-C1-C6-алкіл", "феніл-C1-C6-алкіл" і 8 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 "нафтил-C1-C6-алкіл" при використанні в даному винаході означають алкільні фрагменти, визначені вище, містять від 1 до 6 атомів вуглецю, в яких будь-який з атомів водню замінений циклічним фрагментом, визначеним вище. У цих термінах алкільний фрагмент переважно містить від 1 до 4 атомів вуглецю (C1-C4-алкіл). Більш кращим алкільним фрагментом є метил або етил, і найбільш кращим є метил. Кращими прикладами феніл -C1-C6-алкіла є бензил або фенетил. Терміни "гетероцикліл-C2-C6-алкеніл", "C3-C8-циклоалкіл-C2-C6-алкеніл", "феніл-C2-C6алкеніл" і "нафтил-C2-C6-алкеніл" при використанні в даному винаході означають алкенільні фрагменти, визначені вище, містять від 2 до 6 атомів вуглецю, в яких будь-який з атомів водню замінений циклічним фрагментом, визначеним вище. У цих термінах алкенільний фрагмент переважно містить від 2 до 4 атомів вуглецю (C 2-C4-алкеніл). Більш кращим алкенільним фрагментом є етеніл. Переважним прикладом феніл -C2-C6-алкенілу є фенетиніл. Конкретні і переважні визначення, наведені нижче в даному винаході для окремих радикалів a b c d 1 2 3 4 5 1 2 3 і фрагментів R , R , R , R , Y , Y , Y , Y , Y , Z, R , R , n і R , використовуються окремо, а також в комбінації. Слід розуміти, що переважними є сполуки формули (Ia) або (Ib), в яких один або a b c d 1 2 3 4 5 1 2 3 більша кількість окремих радикалів і фрагментів R , R , R , R , Y , Y , Y , Y , Y , Z, R , R , n і R мають одне зі значень, зазначених нижче в даному винаході в якості бажаних, і в якій інші радикали і фрагменти є такими, як зазначено вище в даному винаході. Найбільш бажаними є a b c d 1 2 3 сполуки формули (Ia) або (Ib), в яких всі окремі радикали і фрагменти R , R , R , R , Y , Y , Y , 4 5 1 2 3 Y , Y , Z, R , R , n і R мають одне зі значень, зазначених нижче в даному винаході в якості бажаних. В одному переважному варіанті здійснення даний винахід належить до піразолів формули (Ia), в якій окремі фрагменти мають одне зі значень, наведених в описі. Бажаними є сполуки формули (Ia), в якій окремі фрагменти мають одне з бажаних значень, наведених в описі. В іншому переважному варіанті здійснення даний винахід належить до піразолів формули (Ib), в якій окремі фрагменти мають одне зі значень, наведених в описі. Бажаними є сполуки формули (Ib), в яких окремі фрагменти мають одне з бажаних значень, наведених в описі. a b Бажаними є піразоли формули (Ia) або (Ib), в яких R і R незалежно вибрані із групи, що включає водень, C1-C6-алкіл, C1-C6 галогеналкіл і C3-C8-циклоалкіл. a b Особливо бажаними є піразоли формули (Ia) або (Ib), в яких R і R обидва означають водень. c d Бажаними також є піразоли формули (Ia) або (Ib), в яких R і R незалежно вибрані з групи, що включає водень, C1-C6-алкіл, C1-C6-галогеналкіл і C3-C8-циклоалкіл. c d Особливо бажаними є піразоли формули (Ia) або (Ib), в яких R и R оба означають водень. 1 y1 y1 Бажаними також є піразоли формули (Ia) або (Ib), в яких Y означає CR або N, в яких R y має одне із значень, зазначених для R . 1 y1 y1 Більш бажаними є піразоли формули (Ia) або (Ib), в яких Y означає CR , бажано в яких R вибраний із групи, що включає H, C1-C6-алкіл, C1-C6-алкокси-C1-C6-алкіл і C1-C6-галогеналкіл. 2 y2 3 y3 Бажаними також є піразоли формули (Ia) або (Ib), в яких Y означає CR , Y означає CR , 4 y4 5 y5 y2 y3 y4 y5 Y означає CR і/або Y означає CR , де R , R , R і R незалежно один від одного мають y одне із значень, зазначених для R . 2 y2 3 y3 Більш бажаними є піразоли формули (Ia) або (Ib), в яких Y означає CR , Y означає CR , 4 y4 5 y5 y2 y3 y4 y5 Y означає CR і Y означає CR , де R , R , R і R незалежно один від одного мають одне із y y2 y3 y4 y5 значень, зазначених для R , бажано в яких R , R , R і R незалежно вибрані із групи, що включає H, галоген, C1-C6-алкоксигрупу, C1-C6-алкокси-C1-C6-алкоксигрупу і C1-C6галогеналкоксигрупу. В одному переважному варіанті здійснення даний винахід належить до піразолів формули (Ia) або (Ib), в яких Z означає O і інші фрагменти мають одне зі значень, наведених в описі, переважно одним з бажаних значень, наведених в описі. В іншому переважному варіанті здійснення даний винахід належить до піразолів формули (Ia) або (Ib), в яких Z означає S і інші фрагменти мають одне зі значень, наведених в описі, переважно одним з бажаних значень, наведених в описі. В іншому переважному варіанті здійснення даний винахід належить до піразолів формули z z (Ia) або (Ib), в яких Z означає NR , де R означає H, C1-C6-алкіл або бензил, і інші фрагменти мають одне зі значень, наведених в описі, переважно одним з бажаних значень, наведених в описі. 1 2 Бажаними також є піразоли формули (Ia) або (Ib), в яких R і R незалежно один від одного вибрані з групи, що включає H, C1-C6-алкіл, C3-C8-циклоалкіл, феніл і нафтил. 1 2 Більш бажаними є піразоли формули (Ia) або (Ib), в яких R і R незалежно один від одного вибрані із групи, що включає H, C1-C4-алкіл, C3-C6-циклоалкіл і феніл. 9 UA 109696 C2 1 5 R 1 3 (R )n O N HO N O R N H 2 y5 R Z y4 R y1 R y3 y2 10 15 2 Особливо бажаними є піразоли формули (Ia) або (Ib), в яких R і R вибрані із C1-C4-алкілу. Бажаними також є піразоли формули (Ia) або (Ib), в яких n дорівнює 0, 1, 2 або 3, переважно в яких n дорівнює 0 або 1. 3 Бажаними також є піразоли формули (Ia) або (Ib), в яких R , якщо присутні, незалежно вибрані з групи, що включає галоген, C1-C6-алкоксигрупу і C1-C6-галогеналкоксигрупу. 3 Більш бажаними є піразоли формули (Ia) або (Ib), в яких R , якщо присутні, незалежно вибрані з галогену, переважно з F, Cl і Br. В одному переважному варіанті здійснення даний винахід належить до піразолів, вибраних із сполук формули (Ia’), 1 2 3 y1 y2 R R (Ia') y3 y4 y5 в якій Z, R , R , R , R , R , R , R і R мають одне з наведених вище значень, і n дорівнює 0 або 1. 1 2 3 y1 y2 y3 y4 y5 Більш бажаними є піразоли (Ia '), в яких один з фрагментів Z, R , R , R , R , R , R , R і R має наведені вище бажані значення. В іншому переважному варіанті здійснення даний винахід належить до піразолів, вибраних із сполук формули (Ib’), 1 R 3 (R )n HO N O y1 O N R N H 2 R Z y2 R y5 R (Ib') y3 R 1 20 25 30 2 3 y1 y2 y3 y4 y4 R y5 в якій Z, R , R , R , R , R , R , R і R мають одне з наведених вище значень. 1 2 3 y1 y2 y3 y4 y5 Більш бажаними є піразоли (Ib '), в яких один з фрагментів Z, R , R , R , R , R , R , R і R має наведені вище бажаними значення. В іншому варіанті здійснення даний винахід належить до сполук формули (Ia) або (Ib), і ці сполуки формули (Ia) або (Ib) містяться у вигляді окремих оптичних ізомерів, сумішей окремих енантіомерів або рацематів, переважно у вигляді енантіомерно чистих сполук. В іншому варіанті здійснення даний винахід належить до сполук формули (Ia) або (Ib), і ці сполуки формули (Ia) або (Ib) містяться у вигляді солей приєднання з фармакологічно прийнятними кислотами, а також необов'язково у вигляді сольватів і/або гідратів. ОДЕРЖАННЯ Сполуки, запропоновані в даному винаході, можна отримати за методиками синтезу, які відомі фахівцю в даній галузі техніки і описані в літературі з органічного синтезу. Ці сполуки переважно одержують за методиками, аналогічними методикам одержання, більш докладно описаними нижче в даному винаході, переважно описаними в експериментальному розділі. Сполуки формули (Ia), запропоновані в даному винаході, можна отримати у відповідності зі схемою 1. Схема 1 10 UA 109696 C2 5 10 15 20 25 30 У відповідності зі схемою 1, сполуки запропоновані в даному винаході, можна отримати з використанням в якості вихідних речовин I похідних (1H-піразол-4-іл) оцтової кислоти, які a b 1 2 містять в якості замісників R , R , R , R , а також містять захисну групу карбоксигрупи PG. У деяких випадках ці сполуки можна придбати у постачальників або їх можна отримати за методиками, описаними в літературі, наприклад, у WO2007/141267. Захисні групи описані в rd публікації T. W. Greene, Protective Groups in Organic Synthesis, Wiley, 3 edition, 1999. Бажаними захисними групами PG є метил, етил, трет-бутил. Проміжний продукт I можна отримати алкілуванням вихідної речовини I підходящими що містять 4-нітробензільну групу сполуками, що використовуються в якості вихідної речовини II, в яких LG означає відповідну відщеплвану групу, таку як галоген, переважно Br, або мезилат, у присутності основи. Відповідними основами є неорганічні основи, такі як карбонати, переважно карбонат калію. Реакцію переважно проводять в органічному розчиннику, такому як диметилформамід, диметилсульфоксид, ацетонітрил, тетрагідрофуран, дихлорметан, або в суміші розчинників. Реакцію зазвичай проводять протягом від 1 до 48 год. Бажана температура 1 проведення реакції становить від 0 °C до температури кипіння реакційної суміші. Якщо R 2 відрізняється від R , то реакція алкілування може призвести до отримання суміші регіоізомерів. Окремі ізомери можна виділити за методиками, які відомі фахівцю в даній галузі техніки, наприклад, за допомогою хроматографії на силікагелі з використанням відповідного розчинника або суміші розчинників або препаративної хроматографії з оберненою фазою з використанням відповідних розчинників в градієнтному режимі, або розтиранням або кристалізацією з відповідних розчинників або суміші розчинників. Проміжний амін II можна отримати з проміжного продукту I відновленням нітрогрупи, наприклад, шляхом гідрогенолізу в присутності каталізатора, такого як паладій на вугіллі або нікель Ренея. Реакцію переважно проводять в інертному органічному розчиннику, такому як метанол, етанол, оцтова кислота, етилацетат, або в суміші розчинників. Реакцію зазвичай проводять протягом від 1 до 48 год. Бажана температура проведення реакції становить від 0 до 50 ° C. Переважний тиск, при якому проводять реакцію, знаходиться в діапазоні від 11 UA 109696 C2 5 10 15 20 25 30 атмосферного тиску до 100 бар. Відновлення нітрогрупи проміжного продукту I також можна провести за альтернативними методиками, описаними у публікації J. March, Advanced Organic th Chemistry, Wiley, 4 edition, 1992, p. 1216-1217. Проміжний амід III можна отримати з проміжного аміну II з реакції поєднання з карбоновою кислотою (вихідна речовина III) у присутності реагенту поєднання, такого як (TBTU), і підстави, такого як діізопропілетиламін. Реакцію переважно проводять в інертному органічному розчиннику, такому як диметилформамід, тетрагідрофуран, дихлорметан, або в суміші розчинників. Реакцію зазвичай проводять протягом від 1 до 48 год. Бажана температура проведення реакції становить від 0 до 30 °C. Реакцію поєднання карбонової кислоти з що містить аміногрупу проміжним продуктом II також можна провести за альтернативними th методиками, описаними у публікації J. March, Advanced Organic Chemistry, Wiley, 4 edition, 1992, p. 419-421. Альтернативно, замість карбонової кислоти (вихідна речовина III) і реагенту поєднання, можна використовувати відповідний ацилхлорид або ангідрид кислоти. Сполуки формули (Ia) можна отримати з проміжного продукту III шляхом видалення захисної групи PG. У разі, якщо гідроксікарбонільна група захищена за допомогою CH 3 або C2H5, це перетворення можна провести у водному середовищі в присутності неорганічної основи, такої як NaOH або LiOH. Реакцію переважно проводять у воді чи у суміші води і CH 3OH, C2H5OH, тетрагідрофурану або діоксану. Реакцію зазвичай проводять протягом від 1 до 48 год. Бажана температура проведення реакції становить від 0 °C до температури кипіння реакційної суміші. У разі, якщо PG являє собою трет-бутил, видалення захисної групи можна провести в кислому середовищі, наприклад з використанням трифтороцтової кислоти, хлористоводневої кислоти або монтморілоніту. У разі використання трифтороцтової кислоти реакцію можна провести в нерозбавленій трифтороцтовій кислоті чи в інертному розчиннику, такому як дихлорметан. Реакцію зазвичай проводять протягом від 1 до 48 год. Бажана температура проведення реакції становить від 0 до 30 °C. Відщеплення захисної групи PG також можна провести за альтернативними методиками, описаними у публікації J. March, Advanced Organic Chemistry, th Wiley, 4 edition, 1992, p. 378-383, або у публікації T. W. Greene, Protective Groups in Organic rd Synthesis, Wiley, 3 edition, 1999. Сполуки формули (Ib) можна отримати за методикою, описаною на схемі I, з використанням замість вихідної речовини III вихідної речовини формули III ', в якій 1 35 40 45 50 2 3 4 5 Y , Y , Y , Y , Y і Z мають одне із зазначених вище значень. ПОКАЗАННЯ Сполуки формули (Ia) або (Ib), запропоновані в даному винаході, є особливо придатними для приготування лікарського засобу, призначеного для попередження та/або лікування захворювань, при яких грає роль активність рецептора CRTH2. Один варіант здійснення даного винаходу належить до приготування лікарського засобу, призначеного для попередження та/або лікування самих різних запальних, інфекційних та імунорегуляторних порушень, захворювань або патологічних станів дихальних шляхів або шлунково-кишкового тракту, запальних захворювань суглобів і алергічних захворювань носоглотки, очей і шкіри. Такі порушення, захворювання і патологічні стани включають астму та алергічні захворювання, еозинофільні захворювання, хронічне обструктивне захворювання легень, інфікування патогенними мікробами (які за визначенням включають віруси), а також аутоімунні патології, такі як ревматоїдний артрит і атеросклероз. Кращим є приготування лікарського засобу, призначеного для попередження та/або лікування запальних або алергічних захворювань і патологічних станів, включаючи алергічний, або Неалергійна риніт або синусит, хронічний синусит або риніт, назальний поліпоз, хронічний риносинусит, гострий риносинусит, астму, астму у дітей, алергічний бронхіт, альвеоліт, хвороба фермера, гіперреактивність дихальних шляхів, алергічний кон'юнктивіт, бронхіт або пневмоніт, викликаний інфекцією, наприклад, бактеріями або вірусами, або гельмінтами, або грибками, або найпростішими, або іншими патогенними мікроорганізмами, бронхоектаз, респіраторний дистрес-синдром у дорослих, набряк бронхів і легенів, бронхіт або пневмоніт, або інтерстиціальний пневмоніт різної етіології, наприклад, викликаний аспірацією, вдиханням токсичних газів, парів, бронхіт або пневмоніт, або інтерстиціальний пневмоніт, викликаний 12 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 серцевою недостатністю, рентгенівським випромінюванням, радіоактивним випромінюванням, хіміотерапією, бронхіт або пневмоніт, або інтерстиціальний пневмоніт, пов'язаний з колагенозом, наприклад, червоний вовчак, системну склеродермію, фіброз легенів, ідіопатичний фіброз легень (IPF), інтерстиціальні захворювання легенів або інтерстиціальний пневмоніт різної етіології, включаючи асбестоз, силікоз, хвороба Бека або саркоїдоз, гранулематоз, кістозний фіброз або муковісцидоз, або 1-антитрипсинову недостатність, еозинофільний целюліт (наприклад, синдром Велла), еозинофільні пневмонії (наприклад, синдром Леффлера, хронічна еозинофільна пневмонія), атонічний фасциит (наприклад, синдром Шульмана), гіперчутливість сповільненого типу, неалергічний астму; викликаний фізичним навантаженням бронхостеноз; хронічне обструктивне захворювання легень (ХОЗЛ), гострий бронхіт, хронічний бронхіт, кашель, емфізему легенів; загальну анафілактичну реакцію або реакції гіперчутливості, лікарські алергії (наприклад, на пеніцилін, цефалоспорин), еозинофільну міалгію, викликану споживанням забрудненого триптофану, алергічні реакції на укус комахи; аутоімунні захворювання, такі як ревматоїдний артрит, псоріатичний артрит, розсіяний склероз, системний червоний вовчак, злоякісна міастенія, імунна тромбоцитопенія (ITP дорослих, тромбоцитопенія новонароджених, ITP у дітей), імунна гемолітична анемія (аутоімунна і викликана лікарським засобом), синдром Еванса (тромбоцитарная і еритроцитарна імунні цитопенії), гемолітична анемія новонароджених з Rhg-фенотипом, синдром Гудпасчера (відкладення антитіл до базальної мембрани клубочків нирок), захворювання черевної порожнини, аутоімунна кардіоміопатія, юнацький діабет; гломерулонефрит, аутоімунний тиреоїдит, хвороба Бехчета; відторгнення трансплантата (наприклад, при трансплантації), включаючи відторгнення алотрансплантату або реакцію "трансплантат проти хазяїна"; запальні захворювання кишечника, такі як хвороба Крона і виразковий коліт; спондилоартропатію; склеродермію; псоріаз (включаючи опосредуемий Tклітинами псоріаз) і запальні дерматози, такі як дерматит, екзема, атопічний дерматит, алергічний контактний дерматит, уртікарія; васкуліт (наприклад, некротичний, шкірний і алергічний васкуліт); нодозну еритему; еозинофільний міозит, атонічний фасциит, ракові захворювання з інфільтрацією лейкоцитів у шкіру або органи. СПОСІБ ЛІКУВАННЯ Відповідно, сполуки формули (Ia) або (Ib), запропоновані в даному винаході, застосовні для попередження та/або лікування самих різних запальних, інфекційних та імунорегуляторних порушень і захворювань. Такі порушення і захворювання включають, але не обмежуються тільки ними, астму та алергічні захворювання, хронічне обструктивне захворювання легень, інфікування патогенними мікробами (які за визначенням включають, інфікування патогенними мікробами (які за визначенням включають віруси), аутоімунні патології, такі як ревматоїдний артрит і атеросклероз. Наприклад, сполука формули (Ia) або (Ib), пропонована в даному винаході, що інгібує одну або більшу кількість функцій рецептора CRTH2 ссавців (наприклад, рецептора CRTH2 людини), можна вводити для інгібування (тобто ослаблення або попередження) запалення і бронхостеноз. У результаті пригнічується один або більша кількість запальних процесів, таких як еміграція лейкоцитів, адгезія, хемотаксис, екзоцитоз (наприклад, ферментів, факторів росту, гістаміну, цитотоксичних білків), вивільнення запального медіатора, виживання чи проліферація експресуючих CRTH2 клітин. Наприклад, способом, запропонованим у даному винаході, можна придушити активацію або рекрутмент клітин Th2, мастоцитів, базофілів і еозинофілів в центрах запалення (наприклад, при астмі або алергічному риніті). Зокрема, за даними зазначених вище досліджень сполуки, вказані в наведених нижче прикладах мають активність, що забезпечує блокування активації і міграції клітин, що експресують рецептор CRTH2 з використанням відповідних агоністів CRTH2. Захворювання та патологічні стани у людей, які можна лікувати за допомогою інгібіторів функції рецептора CRTH2, включають, але не обмежуються тільки ними, запальні або алергічні захворювання і патологічні стани, включаючи алергічний, або неалергійний риніт або синусит, хронічний синусит або риніт, назальний поліпоз, хронічний риносинусит, гострий риносинусит, астму, астму у дітей, алергічний бронхіт, альвеоліт, хвороба фермера, гіперреактивність дихальних шляхів, алергічний кон'юнктивіт, бронхіт або пневмоніт, викликаний інфекцією, наприклад, бактеріями або вірусами, або гельмінтами, або грибками, або найпростішими, або іншими патогенними мікроорганізмами, бронхоектаз, респіраторний дистрес-синдром у дорослих, набряк бронхів і легенів, бронхіт або пневмоніт, або інтерстиціальний пневмоніт різної етіології, наприклад, викликаний аспірацією, вдиханням токсичних газів, парів, бронхіт або пневмоніт, або інтерстиціальний пневмоніт, викликаний серцевою недостатністю, рентгенівським випромінюванням, радіоактивним випромінюванням, хіміотерапією, бронхіт або 13 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 пневмоніт, або інтерстиціальний пневмоніт, пов'язаний з колагенозом, наприклад, червоний вовчак, системну склеродермію, фіброз легенів, ідіопатичний фіброз легень (IPF), інтерстиціальні захворювання легенів або інтерстиціальний пневмоніт різної етіології, включаючи асбестоз, силікоз, хвороба Бека або саркоїдоз, гранулематоз, кістозний фіброз або муковісцидоз, або 1-антитрипсиновая недостатність, еозинофільний целюліт (наприклад, синдром Велла), еозинофільні пневмонії (наприклад, синдром Леффлера, хронічна еозинофільна пневмонія), атонічний фасциит (наприклад, синдром Шульмана), гіперчутливість сповільненого типу, неаллергическую астму; викликаний фізичним навантаженням бронхостеноз; хронічне обструктивне захворювання легень (ХОЗЛ), гострий бронхіт, хронічний бронхіт, кашель, емфізему легенів; загальний анафілактичну реакцію або реакції гіперчутливості, лікарські алергії (наприклад, на пеніцилін, цефалоспорин), еозинофільну міалгію, викликану споживанням забрудненого триптофану, алергічні реакції на укус комахи; аутоімунні захворювання, такі як ревматоїдний артрит, псоріатичний артрит, розсіяний склероз, системний червоний вовчак, злоякісна міастенія, імунна тромбоцитопенія (ITP дорослих, тромбоцитопенія новонароджених, ITP у дітей), імунна гемолітична анемія (аутоімунна і викликана лікарським засобом), синдром Еванса (тромбоцитарная і еритроцитарна імунні цитопенії), гемолітична анемія новонароджених з Rhg-фенотипом, синдром Гудпасчера (відкладення антитіл до базальної мембрани клубочків нирок), захворювання черевної порожнини, аутоімунна кардіоміопатія, юнацький діабет; гломерулонефрит, аутоімунний тиреоїдит, хвороба Бехчета; відторгнення трансплантата (наприклад, при трансплантації), включаючи відторгнення алотрансплантату або реакцію "трансплантат проти хазяїна"; запальні захворювання кишечника, такі як хвороба Крона і виразковий коліт; спондилоартропатію; склеродермію; псоріаз (включаючи опосередковуваний T-клітинами псоріаз) і запальні дерматози, такі як дерматит, екзема, атопічний дерматит, алергічний контактний дерматит, уртикарія; васкуліт (наприклад, некротичний, шкірний і алергічний васкуліт); нодозну еритему; еозинофільний міозит, атонічний фасциит, ракові захворювання з інфільтрацією лейкоцитів у шкіру або органи. КОМБІНАЦІЇ Сполуки формули (Ia) або (Ib), запропоновані в даному винаході, можна використовувати окремо або в комбінації з іншими сполуками формули (Ia) або (Ib). Сполуки формули (Ia) або (Ib) також необов'язково можна об'єднувати з іншими фармакологічно активними речовинами. Такі фармакологічно активні речовини, що використовуються у фармацевтичній композиції, яка містить сполуки формули (Ia) або (Ib), запропоновані в даному винаході, можуть бути обрані з класів, що включають, але не обмежуються тільки ними, агоністи 2-адренорецептора (бетаміметики короткочасної і тривалої дії), антихолінергетиків (короткочасної і тривалої дії), протизапальні стероїди (кортикостероїди для перорального та місцевого введення), диссоційовані глюкокортікоідміметікі, інгібітори PDE3, інгібітори PDE4, інгібітори PDE7, антагоністи LTD4, інгібітори EGFR, антагоністи PAF , похідні ліпоксіна A4, модулятори FPRL1, антагоністи рецептора LTB4 (BLT1, BLT2), антагоністи гістамінового рецептора, інгібітори кінази PI3, інгібітори нерецепторних тирозинкіназ, таких як, наприклад, LYN, LCK, SYK, ZAP-70, FYN, BTK або ITK, інгібітори кіназ MAP, таких як, наприклад, p38, ERK1, ERK2, JNK1, JNK2, JNK3 або SAP, інгібітори сигнального шляху NF-kB, такі як, наприклад, інгібітори кінази IKK2, інгібітори iNOS, інгібітори MRP4, інгібітори біосинтезу лейкотрієну, такі як, наприклад, інгібітори 5ліпоксигенази (5-LO), інгібітори cPLA2 , інгібітори лейкотрієн-A4-гідролази або інгібітори FLAP, нестероїдні протизапальні засоби (НСПВС), модулятори рецептора DP1, антагоністи тромбоксанового рецептора, антагоністи CCR1, антагоністи CCR2, антагоністи CCR3, антагоністи CCR4, антагоністи CCR5, антагоністи CCR6, антагоністи CCR7, антагоністи CCR8, антагоністи CCR9, антагоністи CCR10, антагоністи CXCR1, антагоністи CXCR2 , антагоністи CXCR3, антагоністи CXCR4, антагоністи CXCR5, антагоністи CXCR6, антагоністи CX3CR1, антагоністи нейрокініна (NK1, NK2), модулятори сфингозин-1-фосфатного рецептора, інгібітори сфінгозин-1-фосфатліази, модулятори аденозинового рецептора, такі як, наприклад, агоністи A2a, модулятори пуринергічних рецепторів, такі як, наприклад, інгібітори P2X7, активатори гістондезацетілази (HDAC), антагоністи брадикініну (BK1, BK2), інгібітори TACE, модулятори PPAR-гамма, інгібітори кінази Rho, інгібітори інтерлейкін 1-бета-конвертуючого ферменту (ICE), модулятори Toll-подібного рецептора (TLR), інгібітори HMG-CoA редуктази, антагоністи VLA-4, інгібітори ICAM-1, агоністи SHIP, антагоніст рецептора GABAa, інгібітори ENaC, модулятори меланокортинового рецептора (MC1R, MC2R, MC3R, MC4R, MC5R), антагоністи CGRP, антагоністи ендотеліну, мукорегулятори, імунотерапевтичні кошти, сполуки, що перешкоджають набряку дихальних шляхів, протикашльові сполуки, агоністи CB2, ретиноїди, імуносупресивні засоби, стабілізатори мастоцитів, метилксантин, агоністи опіоїдних рецепторів, проносні засоби, 14 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 протиспінюючих агенти, протиспазматичні засоби, агоністи 5-HT4, а також комбінації двох або трьох активних речовин. Кращими є комбінації двох або трьох активних речовин, тобто антагоністи CRTH2, запропоновані в даному винаході, з бета-міметиками, антихолінергетиками, кортикостероїдами, інгібіторами PDE4, антагоністами LTD4, інгібіторами EGFR, антагоністами CCR3, антагоністами CCR5, антагоністами CCR9, інгібіторами 5-LO, антагоністами гістамінових рецепторів, інгібіторами SYK і сульфонамідами, а саме: • антагоністи CRTH2 з бета-міметиками і кортикостероїдами, інгібіторами PDE4, антагоністами CCR3 або антагоністами LTD4, • антагоністи CRTH2 з антихолінергетиками і бета-міметиками, кортикостероїдами, інгібіторами PDE4, антагоністами CCR3 або антагоністами LTD4, • антагоністи CRTH2 з кортикостероїдами та інгібіторами PDE4, антагоністами CCR3 або антагоністами LTD4 • антагоністи CRTH2 з інгібіторами PDE4 і антагоністами CCR3 або антагоністами LTD4. У фармацевтичних композиціях, пропонованих в даному винаході, залежно від конкретної сполуки антагоністи CRTH2 формули (Ia) або (Ib) можуть міститися у формі, вибраній з групи, що включає таутомери, оптичні ізомери, енантіомери, рацемати, діастереоізомери, фармакологічно прийнятні солі приєднання з кислотами, сольвати або гідрати, якщо такі форми існують. Фармацевтичні композиції, що включають одну або більшу кількість, переважно одну сполуку 1 у формі в основному чистого енантіомеру, є переважними. У фармацевтичних композиціях, пропонованих в даному винаході, може міститися більше одного антагоніста CRTH2 формули (Ia) або (Ib) і більше однієї додаткової фармакологічно активної сполуки. ФАРМАЦЕВТИЧНІ ФОРМИ Препарати, які підходять для введення сполук формули (Ia) або (Ib) включають наприклад, таблетки, капсули, супозиторії, розчини, порошки та т.п. Вміст фармацевтично активної сполуки (сполук) має перебувати в діапазоні від 0,05 до 90 мас.%, Переважно від 0,1 до 50 мас.% У перерахунку на композицію в цілому. Відповідні таблетки можна виготовити, наприклад, шляхом змішування активної речовини (речовин) з відомими інертними наповнювачами, наприклад, інертними розчинниками, такими як карбонат кальцію, фосфат кальцію або лактоза, розпушувачами, такими як кукурудзяний крохмаль або альгінова кислота, єднальними, такими як крохмаль або желатин, змащуючими речовинами, такими як стеарат магнію або тальк і/або агентами для уповільнення вивільнення, такими як карбоксиметилцелюлоза, ацетат-фталат целюлози або полівінілацетат. Таблетки також можуть містити кілька шарів. Пігулки з покриттям можна виготовити шляхом нанесення на ядра, отримані аналогічно таблеткам, покриття з речовин, зазвичай використовуються для нанесення на таблетки, наприклад, коллідон або шелаку, гуммиарабика, тальку, діоксиду титану або цукру. Для забезпечення уповільненого вивільнення або попередження несумісності ядро також може складатися з декількох шарів. Аналогічним чином, покриття таблетки також може складатися з ряду шарів, що забезпечують уповільнене вивільнення, можливо, з включенням інертних наповнювачів, зазначених вище для таблеток. Сиропи або еліксири, що містять активні речовини або їх комбінації, запропоновані в даному винаході, можуть додатково містити підсолоджувач, такий як сахарин, цикламат, гліцерин або цукор, і підсилювач смаку, наприклад, ароматизатор, такий як ванілін або апельсиновий екстракт. Вони також можуть містити суспендуючі допоміжні речовини або загусники, такі як натрієва сіль карбоксиметилцелюлози, змочуючі агенти, такі як, наприклад, продукти конденсації жирних спиртів з етиленоксидом, або консерванти, такі як п-гідроксибензоат. Розчини готують звичайним чином, наприклад, шляхом додавання ізотонічних агентів, консервантів, таких як п-гідроксибензоат, або стабілізаторів, таких як солі лужних металів етилендіамінтетраоцтової кислоти, необов'язково з використанням емульгаторів та/або диспергируючих агентів і при використанні води в якості розріджувача, наприклад, органічні розчинники необов'язково можна використовувати в якості солюбілізаторів або засобів, що сприяють розчиненню, і розчини можна поміщати у флакони або ампули для ін'єкцій або в бутлі для вливання. Капсули, що містять одну або більшу кількість активних речовин або комбінації активних речовин можна виготовити, наприклад, шляхом змішування активних речовин з інертними носіями, такими як лактоза або сорбіт, і їх приміщення в капсули з желатину. Відповідні супозиторії можна виготовити, наприклад, шляхом змішування з носіями, призначеним для цієї мети, такими як нейтральні жири або поліетиленгліколь або його похідні. 15 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інертні наповнювачі, які можна використовувати, включають, але не обмежуються тільки ними, воду, фармацевтично прийнятні органічні розчинники, такі як парафіни (наприклад, фракції нафти), рослинні масла (наприклад, арахісове або кунжутне масло), одно-або багатоатомні спирти (наприклад , етанол або гліцерин), носії, такі як, наприклад, порошкоподібні природні мінерали (наприклад, каоліни, глини, тальк, крейда), порошкоподібні синтетичні мінерали (наприклад, високодисперсна кремнієва кислота і силікати), цукру (наприклад, тростинний цукор, лактоза і глюкоза), емульгатори (наприклад, лігнін, відпрацьований сульфітний луг, метилцелюлоза, крохмаль і полівінілпіролідон) і змащувальні речовини (наприклад, стеарат магнію, тальк, стеаринова кислота і лаурилсульфат натрію). Зрозуміло, у разі перорального введення поряд із зазначеними вище носіями таблетки можуть містити добавки, такі як цитрат натрію, карбонат кальцію і дикальційфосфат спільно з різними добавками, такими як крохмаль, переважно картопляний крохмаль, желатин і т.п. Крім того, для виготовлення таблеток одночасно можна використовувати змащувальні речовини, такі як стеарат магнію, лаурилсульфат натрію і тальк. У разі водних суспензій на додаток до зазначених вище інертних наповнювачів активні речовини можна об'єднувати з різними підсилювачами смаку і барвниками. Сполуки формули (Ia) або (Ib) також можна вводити в якості препаратів або фармацевтичних композицій, придатних для інгаляції. Препарати для інгаляції включають порошки для інгаляції, що містять пропелент дозуючі аерозолі або розчини для інгаляції без палива. В обсязі даного винаходу термін "розчини для інгаляції без палива" також включає концентрати або стерильні, готові до застосування розчини для інгаляції. Препарати, які можна використовувати у контексті даного винаходу більш докладно описані в подальшій частині опису. Порошки для інгаляції, які можна використовувати в контексті даного винаходу, можуть містити сполуку формули (Ia) або (Ib) в чистому вигляді або в суміші з підходящими фізіологічно прийнятними інертними наповнювачами. Якщо активні сполуки (Ia) або (Ib) містяться в суміші з фізіологічно прийнятними інертними наповнювачами, то для приготування порошків для інгаляції, пропонованих в даному винаході, можна використовувати такі фізіологічно прийнятні інертні наповнювачі: моносахариди (наприклад, глюкоза або арабіноза), дисахариди (наприклад, лактоза, сахароза, мальтоза), оліго-і полісахариди (наприклад, декстрани), багатоатомні спирти (наприклад, сорбіт, маніт, ксиліт), солі (наприклад, хлорид натрію, карбонат кальцію) або суміші цих інертних наповнювачів. Бажано використовувати моно-або дисахариди, але особливо бажано використовувати лактозу або глюкозу, переважно, але не виключно, у вигляді їх гідратів. Для завдань даного винаходу особливо бажаним інертним наповнювачем є лактоза, і моногідрат лактози є найбільш бажаним. У порошках для інгаляції, пропонованих в даному винаході інертні наповнювачі з частками з максимальним розміром, рівним до 250 мкм, переважно від 10 до 150 мкм, найбільш переважно від 15 до 80 мкм. Іноді може виявитися доцільним додавати до зазначеного вище інертного наповнювача більш дрібнодисперсні фракції інертного наповнювача, з частками з середнім розміром, рівним від 1 до 9 мкм. Ці більш дрібнодисперсні інертні наповнювачі також обрані з групи можливих інертних наповнювачів, перерахованих вище в даному винаході. Крім того, для приготування порошків для інгаляції, пропонованих в даному винаході, до суміші інертних наповнювачів додають мікронізовану активну речовину 1, переважно з частками з середнім розміром, рівним від 0,5 до 10 мм, більш переважно від 1 до 5 мм. Методики приготування порошків для інгаляції, пропонованих в даному винаході, шляхом розмелювання і мікронізаціі із заключним змішуванням інгредієнтів відомі з попереднього рівня техніки. Порошки для інгаляції, запропоновані в даному винаході, можна вводити за допомогою інгаляторів, відомих з попереднього рівня техніки. Аерозолі для інгаляції, що містять газоподібний пропелент, запропоновані в даному винаході, можуть містити сполуки формули (Ia) або (Ib), розчинені в газоподібному пропеленті або в диспергованій формі. Сполуки формули (Ia) або (Ib) можуть міститися в окремих препаратах або в загальному препараті, в якому сполуки формули (Ia) або (Ib) обидва розчинені, обидва дисперговані або в кожному випадку тільки один компонент розчинений і інший диспергований. Газоподібні пропеленти, які можна використовувати для приготування аерозолів для інгаляції, відомі з попереднього рівня техніки. Відповідні газоподібні пропеленти обрані з групи, що включає вуглеводні, такі як н-пропан, н-бутан або ізобутан, і галогеновані вуглеводні, такі як фторовані похідні метану, етану, пропану, бутану, циклопропану або циклобутану. Зазначені вище газоподібні пропеленти можна використовувати в чистому вигляді або в сумішах один з одним. Особливо кращими газоподібними пропелентами є галогеновані 16 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 похідні алканів, вибрані з групи, що включає TG134a і TG227 та їх суміші. Приводимі в дію пропелентом аерозолі для інгаляції також можуть містити інші інгредієнти, такі як співрозчинники, стабілізатори, поверхнево-активні речовини, антиоксиданти, змащувальні речовини і регулятори pH. Всі ці інгредієнти відомі в даній галузі техніки. Приводимі в дію пропелентом аерозолі для інгаляції, запропоновані в даному винаході, вказані вище, можна вводити з використанням інгаляторів, відомих в даній галузі техніки (МДІ = мірні дозуючі інгалятори). Крім того, активні сполуки формули (Ia) або (Ib), запропоновані в даному винаході, можна вводити у формі розчинів і суспензій для інгаляції без палива. Використовуваний розчинник може бути водним або спиртовим, переважно використовувати етанольний розчин. Розчинником може бути чиста вода або суміш води і етанолу. Відносний вміст етанолу в порівнянні з вмістом води не обмежується, але максимальне переважно становить до 70 об.%, Більш переважно до 60 об.% І ще більш переважно до 30 об.%. Решту об'єму складає вода. Значення pH розчинів або суспензій, що містять сполуку формули (I), доводять до рівної від 2 до 7, переважно від 2 до 5 за допомогою відповідних кислот. Значення pH можна встановити з використанням кислот, обраних з числа неорганічних або органічних кислот. Приклади особливо підходящих неорганічних кислот включають хлористоводневу кислоту, бромістоводневу кислоту, азотну кислоту, сірчану кислоту і/або фосфорну кислоту. Приклади особливо підходящих органічних кислот включають аскорбінову кислоту, лимонну кислоту, яблучну кислоту, винну кислоту, малеїнову кислоту, янтарну кислоту, фумарову кислоту, оцтову кислоту, мурашину кислоту і/або пріпіонову кислоту і т.п. Бажаними неорганічними кислотами є хлористоводнева і сірчана кислоти. Також можна використовувати кислоти, які вже утворили сіль приєднання з кислотою одного із активних речовин. З органічних кислот бажаними є аскорбінова кислота, фумарова кислота і лимонна кислота. При необхідності можна використовувати суміші зазначених вище кислот, особливо у випадку кислот, які на додаток до здатності підкислювати з іншими характеристиками, наприклад, є смаковими добавками, антиоксидантами або комплексоутворюючими реагентами, такі як, наприклад, лимонна кислота або аскорбінова кислота. У контексті даного винаходу для регулювання pH особливо переважно використовувати хлористоводневу кислоту. При необхідності для цих препаратів можна виключити додавання етилендіамінтетраоцтової кислоти (ЕДТА) або однієї з її відомих солей, етилендіамінтетраацетату натрію як стабілізатора або комплексоутворюючого реагенту. Інші варіанти здійснення можуть містити цю сполуку або ці сполуки. У переважному варіанті здійснення вміст у перерахунку на етилендіамінтетраацетат натрію становить менше 100 мг/100 мл, переважно менше 50 мг/100 мл, більш переважно менше 20 мг/100 мл. Зазвичай розчини для інгаляції, в яких вміст етилендіамінтетраацетату натрію становить від 0 до 10 мг/100 мл, є кращим. У розчини для інгаляції без палива можна додати співрозчинники і/або інші інертні наповнювачі. Бажаними співрозчинники є такі, які містять гідроксигрупи або інші полярні групи, наприклад, спирти - переважно ізопропіловий спирт, гліколі - переважно пропіленгліколь, поліетиленгліколь, поліпропіленгліколь, простий ефір гліколю, гліцерин, поліоксиетиленові спирти і поліоксиетіленові ефіри жирних кислот. Терміни "інертні наповнювачі" і "добавки" в цьому контексті означають будь-яку фармакологічно прийнятну речовину, яка не є активною речовиною, але які можна приготувати разом з активною речовиною або речовинами у фізіологічно прийнятному розчиннику для поліпшення якісних характеристик композиції активної речовини. Переважно, якщо ці речовини не надають фармакологічного впливу або, у зв'язку з необхідним лікуванням не роблять істотного або щонайменше небажаного фармакологічного впливу. Інертні наповнювачі та добавки включають, наприклад, поверхнево-активні речовини, такі як лецитин сої, олеїнову кислоту, складні ефіри сорбіту, такі як полісорбати, полівінілпіролідон, інші стабілізатори, комплексоутворюючі реагенти, антиоксиданти і/або консерванти, які забезпечують або збільшують термін придатності готового фармацевтичного препарату, смакові добавки, вітаміни та/або інші добавки, відомі в даній галузі техніки. Добавки також включають фармакологічно прийнятні солі, такі як хлорид натрію, в якості ізотонічних реагентів. Бажані інертні наповнювачі включають антиоксиданти, такі як аскорбінова кислота, наприклад, за умови, що її вже не використовували для регулювання значення pH, вітамін A, вітамін E, токофероли та аналогічні вітаміни і провітаміни, що містяться в організмі людини. Консерванти можна використовувати для захисту композиції від зараження патогенами. Відповідними консервантами є відомі в даній галузі техніки, зокрема, цетилпіридинійхлорід, бензалконійхлорид або бензойна кислота або бензоати, такі як бензоат натрію в концентрації, відомою з попереднього рівня техніки. Зазначені вище консерванти переважно містяться в 17 UA 109696 C2 5 10 15 20 25 30 концентраціях, що становлять до 50 мг/100 мл, більш переважно від 5 до 20 мг/100 мл. Доза сполук, пропонованих у даному винаході, зрозуміло, сильно залежить від методики введення і піддається лікуванню захворювання. При введенні шляхом інгаляції сполуки формули (Ia) або (Ib) характеризуються високою активністю навіть при дозах, що знаходяться в мікрограммових діапазоні. Сполуки формули (Ia) або (Ib) також можна ефективно використовувати в кількостях, що перевищують знаходяться в мікрограммовому діапазоні. Крім того, доза може перебувати, наприклад, в грамовому діапазоні. Іншим об'єктом даного винаходу є зазначені вище фармацевтичні препарати самі по собі, які характеризуються тим, що вони містять сполуку формули (Ia) або (Ib), переважно зазначені вище фармацевтичні препарати, які можна вводити шляхом інгаляції. Наведені нижче приклади препаратів ілюструють даний винахід, не обмежуючи його обсяг: Приклади фармацевтичних препаратів: A)Таблетки в одній таблетці активна речовина (Ia) або (Ib) 100 мг лактоза 140 мг кукурудзяний крохмаль 240 мг полівінілпіролідон 15 мг стеарат магнію 5 мг ∑ 500 мг Змішують тонкоподрібнену активну речовину, лактозу й частину кукурудзяного крохмалю. Суміш просівають, потім зволожують розчином полівінілпіролідону у воді, замішують, піддають вологій грануляції і сушать. Гранули, решта кукурудзяного крохмалю і стеарат магнію просівають і змішують. Суміш пресують в таблетки підходящої форми і розміру. B) Таблетки в одній таблетці активна речовина (Ia) або (Ib) 80 мг лактоза 55 мг кукурудзяний крохмаль 190 мг мікрокристалічна целюлоза 35 мг полівінілпіролідон 15 мг натрієва сіль карбоксиметилкрохмалю 23 мг стеарат магнію 2 мг ∑ 400 мг Змішують тонкоподрібнену активну речовину, частину кукурудзяного крохмалю, лактозу, мікрокристалічну целюлозу і полівінілпіролідон, суміш просівають і обробляють рештою кукурудзяного крохмалю і водою з отриманням грануляту, який сушать і просівають. Додають натрієву сіль карбоксиметилкрохмалю і стеарат магнію і змішують і суміш пресують в таблетки відповідного розміру. C) Розчин для розфасовки в ампули активна речовина (Ia) або (Ib) 50 мг хлорид натрію 50 мг вода для ін'єкцій 5 мл Активну речовину розчиняють у воді при її власному pH або необов'язково при pH, рівному від 5,5 до 6,5, і додають хлорид натрію для одержання ізотонічного розчину. Одержаний розчин фільтрують для видалення пірогенів і фільтрат в асептичних умовах переносять в ампули, які потім стерилізують і термічно герметизують. Ампули містять 5 мг, 25 мг і 50 мг активної речовини. D) Дозований аерозоль активна речовина (Ia) або (Ib) 0,005 сорбітантриолеат 0,1 монофтортрихлорметан і TG134a:TG227 2:1 до 100 Суспензію переносять у звичайний контейнер для аерозолю з дозуючим клапаном. Переважно, щоб при кожному включенні подавалося 50 мкл суспензії. Активну речовину при 18 UA 109696 C2 5 10 15 20 25 30 35 бажанні також можна подавати в більш значних дозах (наприклад, 0,02 мас.%). E) Розчини (в мг/100 мл) активна речовина (Ia) або (Ib) 333,3 мг бензалконій хлорид 10,0 мг ЕДТК 50,0 мг HCl (1 н.) до pH 2,4 Це розчин можна приготувати звичайним чином. F) Порошок для інгаляції активна речовина (Ia) або (Ib) 12 мкг моногідрат лактозидо 25 мг Порошок для інгаляції готують звичайним чином шляхом змішування окремих інгредієнтів. Наведені нижче приклади призначені для додаткової ілюстрації даного винаходу, без обмеження його обсягу. ПРИКЛАДИ I. МЕТОДИКИ ВЕРХ Методика A: ВЕРХ-МС (високоефективна рідинна хроматографія - мас-спектрометрія): Agilent 1100 Рухлива фаза: A: вода з додаванням 0,032% NH4OH B: метанол час в хв %A %B швидкість потоку в мл/хв 0,00 95 5 1,50 2,00 0 100 1,50 2,50 0 100 1,50 2,60 95 5 1,50 2,90 95 5 1,50 Колонка: XBridge C18, 3,5 мкм, 4,650 мм (температура колонки: постійна, 40°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-500 нм. Методика B: ВЕРХ-МС: МС: Waters ZQ, ВЕРХ: Alliance 2790/2695, детектор з діодною матрицею 2996 Рухлива фаза: A: вода з додаванням 0,1% ТФК (трифтороцтова кислота) B: метанол час в хв %A %B швидкість потоку в мл/хв 0,00 95 5 4,0 0,20 95 5 4,0 1,60 0 100 4,0 2,160 0 100 4,0 Колонка: Waters XBridge C18, 4,620 мм, 3,5 мкм (температура колонки: постійна, 40°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика C: ВЕРХ: Waters Acquity з детектором ДМ (діодна матрица) і МС Рухлива фаза: A: вода з додаванням 0,1% ТФК B: метанол час в хв %A %B швидкість потоку в мл/хв 0,00 99 1 1,5 0,05 99 1 1,5 1,05 0 100 1,5 1,20 0 100 1,5 Колонка: Waters XBridge BEH C18, 2,130 мм, 1,7 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика D: ВЕРХ: Waters Acquity з детектором ДМ і МС Рухлива фаза: 19 UA 109696 C2 A: вода з додаванням 0,13% ТФК B: метанол з додаванням 0,05% ТФК час в хв %A 5 10 15 20 25 30 швидкість потоку в мл/хв 0,00 99 1 1,3 0,05 99 1 1,3 1,05 0 100 1,3 1,20 0 100 1,3 Колонка: Waters XBridge BEH C18, 2,130 мм, 1,7 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика E: ВЕРХ: Waters Acquity з детектором ДМ і МС Рухлива фаза: A: вода з додаванням 0,1% ТФК B: метанол час в хв %A %B швидкість потоку в мл/хв 0,00 95 5 1,4 0,05 95 5 1,4 1,00 0 100 1,4 1,10 0 100 1,4 Колонка: Waters XBridge C18, 2,130 мм, 2,5 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика F: ВЕРХ: Agilent 1200 з детектором ДМ і МС Рухлива фаза: A: вода з додаванням 0,1% ТФК B: метанол час в хв %A %B швидкість потоку в мл/хв 0,00 95 5 2,0 0,20 95 5 2,0 1,50 0 100 2,0 1,55 0 100 2,6 1,75 0 100 2,6 Колонка: Waters XBridge C18, 330 мм, 2,5 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика G: ВЕРХ-МС: Waters Alliance з детектором ДМ і МС Рухлива фаза: A: вода з додаванням 0,1% NH3 B: метанол з додаванням 0,1% NH3 час в хв %A %B швидкість потоку в мл/хв 0,00 95 5 4,0 0,20 95 5 4,0 1,50 0 100 4,0 1,75 0 100 4,0 Колонка: Waters XBridge C18, 4,630 мм, 3,5 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика H: ВЕРХ-МС: Waters Alliance з детектором ДМ і МС Рухлива фаза: A: вода з додаванням 0,1% ТФК B: метанол %B 35 20 UA 109696 C2 час в хв 5 10 15 20 25 30 швидкість потоку в мл/хв 0,00 95 5 4,8 1,60 0 100 4,8 1,85 0 100 4,8 1,90 95 5 4,8 Колонка: Waters SunFire C18, 4,630 мм, 3,5 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика J: ВЕРХ: Waters Acquity с детектором ДМ и МС Рухлива фаза: A: вода з додаванням 0,13 % ТФК B: метанол з додаванням 0,05 % ТФК час в хв %A %B швидкість потоку в мл/хв 0,00 99 1 1,2 0,15 99 1 1,2 1,10 0 100 1,2 1,25 0 100 1,2 Колонка: Waters Sunfire C18, 2,130 мм, 2,5 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика K: ВЕРХ-МС: Waters Alliance з детектором ДМ і МС Рухлива фаза: A: вода з додаванням 0,1% ТФК B: метанол з додаванням 0,1% ТФК час в хв %A %B швидкість потоку в мл/хв 0,00 95 5 4,0 0,20 95 5 4,0 1,50 0 100 4,0 1,75 0 100 4,0 1,85 95 5 4,0 Колонка: Waters XBridge C18, 4,630 мм, 3,5 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика L: ВЕРХ-МС: Waters Alliance з детектором ДМ і МС Рухлива фаза: A: вода з додаванням 0,1% ТФК B: метанол час в хв %A %B швидкість потоку в мл/хв 0,00 95 5 4,8 1,60 0 100 4,8 1,85 0 100 4,8 1,90 95 5 4,8 Колонка: Waters XBridge C18, 4,630 мм, 3,5 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика M: ВЕРХ-МС: ВЕРХ: Waters 2695, МС: ZQ, детектор з діодною матрицею 2996, автоматичний пробовідбірник 2695 Рухлива фаза: A: вода з додаванням 0,1% NH3 B: метанол з додаванням 0,1% NH3 %A %B 35 21 UA 109696 C2 час в хв 5 10 15 20 25 30 35 40 швидкість потоку в мл/хв 0,00 95 5 4,0 0,20 95 5 4,0 1,50 0 100 4,0 1,75 0 100 4,0 Колонка: Waters XBridge C18, 4,630 мм, 3,5 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика N: ВЕРХ: Waters Acquity з детектором ДМ і МС Рухлива фаза: A: вода з додаванням 0,13% ТФК B: метанол з додаванням 0,08% ТФК час в хв %A %B швидкість потоку в мл/хв 0,00 99 1 1,3 0,05 99 1 1,3 0,35 0 100 1,3 0,50 0 100 1,3 Колонка: Waters XBridge BEH C18, 2,130 мм, 1,7 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. Методика O: ВЕРХ: Agilent 1200 з детектором ДМ і МС Рухлива фаза: A: вода з додаванням 0,1% ТФК B: метанол час в хв %A %B швидкість потоку в мл/хв 0,00 95 5 1,9 0,20 95 5 1,9 1,55 0 100 1,9 1,60 0 100 2,4 1,80 0 100 2,4 Колонка: Waters XBridge C18, 330 мм, 2,5 мкм (температура колонки: постійна, 60°C). Детектування за допомогою детектора з діодною матрицею при довжині хвилі, що дорівнює 210-400 нм. II. СИНТЕЗ ВИХІДНИХ СПОЛУК A) Синтез амінів 1.) Метиловий ефір [1-(4-амінобензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти a) До розчину метилового ефіру (3,5-диметил-1H-піразол-4-іл)оцтової кислоти (3,90 г, 23 моля) і 4-нітробензилброміду (4,60 г, 20,7 моля) в ацетонітрилі додають K 2CO3 (2,76 г, 19,9 моля) і суміш перемішують при кімнатній температурі протягом 1 г. Реакційну суміш виливають у воду і двічі екстрагують етилацетатом. Органічну фазу сушать над MgSO 4 і випарюють при зниженому тиску. Отримують 7,50 г метилового ефіру [3,5-диметил-1-(4-нітробензил)-1H+ піразол-4-іл]-оцтової кислоти (мас-спектр ІЕР (іонізація електророзпиленням): [M+H] = 304). b) До розчину метилового ефіру [3,5-диметил-1-(4-нітробензил)-1H-піразол-4-іл]-оцтової кислоти (3,90 г, 10,3 моля) в метанолі (10 мл) додають 10% паладій на деревному вугіллі (500 мг) і суміш гідрують. Каталізатор відфільтровують і фільтрат концентрують при зниженому тиску. Суміш очищають за допомогою препаративної ВЕРХ з оберненою фазою (градієнтний + режим, метанол у воді + 0,1% NH3) і одержують 1,18 г шуканої сполуки (мас-спектр ІЕР: [M+H] = 274; час утримування ВЕРХ: 2,13 хв (методика A)). 2.) Етиловий ефір [1-(4-аміно-2-хлорбензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти a) До розчину етилового ефіру (3,5-диметил-1H-піразол-4-іл)оцтової кислоти (1,40 г, 7,7 моля) і 2-хлор-4-нітробензилброміду (4,60 г, 20,7 моля) в 20 мл ацетонітрилу додають K2CO3 (1,59 г, 11,5 моля) і суміш перемішують при кімнатній температурі протягом 48 г. Розчинник видаляють випарюванням і залишок розчиняють в суміші дихлорметан/вода. Після екстракції дихлорметаном органічний шар сушать над Na 2SO4 і випарюють при зниженому тиску і отримують 2,79 г етилового ефіру [3,5-диметил-1-(2-хлор-4-нітробензил)-1H-піразол-4-іл]%A %B 22 UA 109696 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 оцтової кислоти (мас-спектр ІЕР: [M+H] = 352; час утримування: 1,95 хв (методика A). b) До розчину етилового ефіру [3,5-диметил-1-(2-хлор-4-нітробензил)-1H-піразол-4іл]оцтової кислоти (2,39 г, 6,8 моля) в метанолі (40 мл) додають нікель Ренея (250 мг) і суміш гідрують. Каталізатор відфільтровують і фільтрат концентрують при зниженому тиску і + отримують 1,18 г шуканої сполуки (мас-спектр ІЕР: [M+H] = 322; час утримування ВЕРХ: 1,76 хв (методика A)). 3.) Етиловий ефір [1-(4-амінобензил)-3,5-діетил-1H-піразол-4-іл]-оцтової кислоти a) До розчину етилового ефіру (3,5-діетил-1H-піразол-4-іл)оцтової кислоти (10,95 г, 52,1 моля) і 4-нітробензилброміду (14,625 г, 68 молей) в ацетонітрилі (110 мл) додають K 2CO3 (10,80 г, 78,1 моля) і суміш перемішують при кімнатній температурі протягом 48 г. Реакційну суміш виливають у воду і двічі екстрагують етилацетатом. Органічну фазу сушать над MgSO 4 і випарюють при зниженому тиску. Залишок очищають за допомогою РХСТ (рідинна хроматографія середнього тиску) з використанням суміші етилацетат / циклогексан і отримують 12,50 г етилового ефіру [3,5-діетил-1-(4-нітробензил)-1H-піразол-4-іл]оцтової кислоти (мас+ спектр ІЕР: [M+H] = 346; час утримування ВЕРХ: 1,42 хв (методика B)). b) До розчину етилового ефіру [3,5-діетил-1-(4-нітробензил)-1H-піразол-4-іл]оцтової кислоти (6,66 г, 19,3 моля) в метанолі (500 мл) додають нікель Ренея (500 мг) і суміш гідрують при 2 кімнатній температурі і тиску, рівному 50 фунт-сила/дюйм . Каталізатор відфільтровують і фільтрат концентрують при зниженому тиску і отримують 4,38 г шуканої сполуки (мас-спектр + ІЕР: [M+H] = 316; час утримування ВЕРХ: 1,09 хв (методика B)). 4.) Метиловий ефір [1-(4-аміно-2-фторбензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти a) До розчину метилового ефіру (3,5-диметил-1H-піразол-4-іл)оцтової кислоти (10 г, 48,9 моля) і 2-фтор-4-нітробензилброміду (11,5 г, 49,1 моля) в ацетонітрилі (150 мл) додають K 2CO3 (10,1 г, 73,3 моля) і суміш перемішують при 60 ° C протягом 48 г. Розчинник видаляють випарюванням і залишок розчиняють в суміші дихлорметан/вода. Після екстракції дихлорметаном органічний шар сушать над Na2SO4 і випарюють при зниженому тиску. Залишок очищають за допомогою РХСТ (циклогексан / діетиловий ефір 7:3) і отримують 13 г метилового ефіру [3,5-диметил-1-(2-фтор-4-нітробензил)-1H-піразол-4-іл]оцтової кислоти (мас-спектр ІЕР: + [M+H] = 322; час утримування ВЕРХ: 0,85 хв (методика C)). b) До розчину метилового ефіру [3,5-диметил-1-(2-фтор-4-нітробензил)-1H-піразол-4іл]оцтової кислоти (13 г, 40,4 моля) в метанолі (250 мл) додають нікель Ренея (6 г) і суміш 2 гідрують при 50 ° C і тиску, рівному 50 фунт-сіла/дюйм . Каталізатор відфільтровують і фільтрат концентрують при зниженому тиску. Суміш очищають шляхом кристалізації з діізопропілового + ефіру і отримують 12,8 г шуканої сполуки (мас-спектр ІЕР: [M+H] = 292; час утримування ВЕРХ: 0,61 хв (методика C)). 5.) трет-Бутиловий ефір [1-(4-аміно-2-хлорбензил)-3,5-диметил-1H-піразол-4-іл]-оцтової кислоти a) До розчину трет-бутилового ефіру (3,5-диметил-1H-піразол-4-іл)оцтової кислоти (2,6 г, 12,4 моля, отримують відповідно до WO2007/141267 з використанням 2,4-пентандіону замість 3,5-гептандіону) і 2-хлор-4-нітробензилброміду (3,11 г, 12,4 моля) в ацетонітрилі (30 мл) додають K2CO3 (2,575 г, 18,6 моля) і суміш перемішують при кімнатній температурі протягом 48 год і потім при 60 ° C протягом 2 г. Тверду речовину відфільтровують і розчинник видаляють випарюванням. Залишок розчиняють в суміші дихлорметан / вода. Після екстракції дихлорметаном органічний шар сушать над MgSO 4 і випарюють при зниженому тиску і отримують 4,4 г трет-бутилового ефіру [3,5-диметил-1-(2-хлор-4-нітробензил)-1H-піразол-4+ іл]оцтової кислоти (мас-спектр ІЕР: [M+H] = 380). b) До розчину трет-бутилового ефіру [3,5-диметил-1-(2-хлор-4-нітробензил)-1H-піразол-4іл]оцтової кислоти (4,40 г, 11,6 моля) в метанолі (80 мл) додають нікель Ренея (440 мг) і суміш 2 гідрують при кімнатній температурі і тиску, рівному 50 фунт-сила/дюйм , протягом 12 г. Каталізатор відфільтровують і фільтрат концентрують при зниженому тиску і отримують 2,4 г + шуканої сполуки (мас-спектр ІЕР: [M+H] = 350; час утримування ВЕРХ: 0,76 хв (методика D)). 6.) трет-Бутиловий ефір [1-(4-амінобензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти + Шукану сполуку (мас-спектр ІЕР: [M+H] = 316; час утримування ВЕРХ: 0,65 хв (методика E)) синтезують за аналогією з методикою II.A.5 з використанням 4-нітробензілброміду замість 2фтор-4-нітробензилброміду. 7.) трет-Бутиловий ефір [1-(4-аміно-2-фторбензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти a) До розчину трет-бутилового ефіру (3,5-диметил-1H-піразол-4-іл)оцтової кислоти (10 г, 47,6 моля, отримують відповідно до WO2007/141267 з використанням 2,4-пентандіона замість 3,5-гептандіону) і 2-фтор-4-нітробензилброміду (11,2 г, 47,9 моля) в ацетонітрилі (150 мл) 23 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 додають K2CO3 (6,615 г, 47,9 моля) і суміш перемішують при кімнатній температурі протягом 24 год. Тверду речовину відфільтровують і розчинник видаляють випарюванням. Залишок розчиняють в суміші дихлорметан / вода. Після екстракції дихлорметаном органічний шар сушать над MgSO4 і випарюють при зниженому тиску. Залишок очищають за допомогою РХСТ (циклогексан / етилацетат 7:3, силікагель 60) та отримують 13,6 г трет-бутилового ефіру [3,5+ диметил-1-(2-фтор-4-нітробензил)-1H-піразол-4-іл]оцтової кислоти (мас-спектр ІЕР: [M+H] = 364 ТСХ (тонкошарова хроматографія): Rf = 0,23 (циклогексан/етилацетат 7:3, силікагель 60 F254)). b) До розчину трет-бутилового ефіру [3,5-диметил-1-(2-фтор-4-нітробензил)-1H-піразол-4іл]оцтової кислоти (13,6 г, 37,4 моля) в метанолі (250 мл) додають нікель Ренея (6 г) і суміш 2 гідрують при 50 ° C і тиску, рівному 50 фунт-сила/дюйм , протягом 12 г. Каталізатор відфільтровують і фільтрат концентрують при зниженому тиску і отримують 11,6 г шуканої + сполуки (мас-спектр ІЕР: [M+H] = 334; ТСХ: Rf = 0,53 (дихлорметан/метанол 95:5, силікагель 60 F254)). B) Синтез карбонових кислот 1.) 1-Етил-5-фтор-1H-індол-2-карбонова кислота a) До розчину 5-фторіндол-2-етилового ефіру (200 мг, 0,965 моля) в диметилсульфоксиді (6 мл) додають трет-бутилат калію (108 мг, 0,965 моля) і суміш перемішують при 50 ° C протягом 30 хв. Після охолодження до кімнатної температури додають брометан (0,081 мл, 1,06 моля) і суміш перемішують при кімнатній температурі протягом 2,5 г. При охолодженні додають воду і суміш екстрагують етилацетатом. Органічний шар промивають водою і насиченим водним розчином NaCl, сушать над MgSO4 і розчинник випарюють у вакуумі і отримують 200 мг + етилового ефіру 1-етил-5-фтор-1H-індол-2-карбонової кислоти (мас-спектр ІЕР: [M+H] = 236). b) До розчину етилового ефіру 1-етил-5-фтор-1H-індол-2-карбонової кислоти (200 мг, 0,85 моля) в діоксані (2 мл) додають водний розчин NaOH (1 M, 1,7 мл) і суміш перемішують при 60 °C протягом 1 г. Після випарювання розчинника залишок суспендують в невеликій кількості води і нейтралізують оцтовою кислотою (2 M розчин). Осад відфільтровують, промивають водою і + сушать і отримують 140 мг шуканої сполуки (мас-спектр ІЕР: [M+H] = 208; час утримування ВЕРХ: 1,21 хв (методика F)). Наступні індолкарбонові кислоти також отримують за аналогією з цією методикою: + 1-Бензил-1H-індол-2-карбонова кислота (мас-спектр ІЕР: [M+H] = 252 Час утримування ВЕРХ: 0,84 хв (методика E)); + 1-Бутил-1H-індол-2-карбонова кислота (мас-спектр ІЕР: [M+H] = 218); + 5-Фтор-1-пропіл-1H-індол-2-карбонова кислота (мас-спектр ІЕР: [M+H] = 222); + 1-Бутил-5-фтор-1H-індол-2-карбонова кислота (мас-спектр ІЕР: [M+H] = 236); + 1-Пропіл-1H-індол-2-карбонова кислота (мас-спектр ІЕР: [M+H] = 204); + 1-Етил-4-фтор-1H-індол-2-карбонова кислота (мас-спектр ІЕР: [M+H] = 208; час утримування ВЕРХ: 0,80 хв (методика E); 1-Етил-6-фтор-1H-індол-2-карбонова кислота (мас-спектр ІЕР: [M+H] =206; час утримування ВЕРХ: 0,71 хв (методика E)); 6-Фтор-1-пропіл-1H-індол-2-карбонова кислота (мас-спектр ІЕР: [M-H] = 220; час утримування ВЕРХ: 0,77 хв (методика E)). 2.) 3-Етил-5-фторбензофуран-2-карбонова кислота a) До розчину 5-фтор-2-гідроксипропіофенону (0,9 г, 5,2 моля) і трет-бутилбромацетату (0,9 мл, 6,1 моля) в ацетонітрилі (15 мл) додають K2CO3 (1,08 г, 7,8 моля) і суміш кип'ятять із зворотним холодильником протягом 3 г. Після охолодження до кімнатної температури суміш виливають у воду і екстрагують етилацетатом. Органічний шар двічі промивають водою, сушать над MgSO4 і розчинник випарюють у вакуумі і отримують 1,47 г трет-бутилового ефіру (4-фтор+ 2-пропіонілфеноксі) оцтової кислоти (мас-спектр ІЕР: [M+H] = 283; час утримування ВЕРХ: 0,88 хв (методика D)). b) До розчину трет-бутилового ефіру (4-фтор-2-пропіонілфенокси)оцтової кислоти (1,47 г, 5,2 моля) в сухому етанолі (20 мл) додають розчин метанолята натрію в метанолі (5,4 M, 20 мл) і суміш перемішують при 80 °C протягом 12 г. Після охолодження до кімнатної температури і випарювання розчинника залишок розчиняють у воді і підкислюють хлористоводневою кислотою (1 M розчин). Осад відфільтровують, промивають водою і сушать і отримують 440 мг шуканої сполуки (мас-спектр ІЕР: [M-H] = 207; час утримування ВЕРХ: 0,87 хв (методика G)). Наступні бензофуранкарбонові кислоти також отримують за аналогією з цією методикою: 7-Хлор-3-метилбензофуран-2-карбонова кислота (мас-спектр ІЕР: [M-H] = 209; час утримування ВЕРХ: 1,28 хв (методика H)); 5-Фтор-3-пропілбензофуран-2-карбонова кислота (мас-спектр ІЕР: [M-H] = 221; час 24 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 утримування ВЕРХ: 1,01 хв (методика G)); 3-Етил-7-фторбензофуран-2-карбонова кислота (мас-спектр ІЕР: [M-H] = 207; час утримування ВЕРХ: 0,77 хв (методика E)); 3-Етил-5,7-дифторбензофуран-2-карбонова кислота (мас-спектр ІЕР: [M-H] = 225; час утримування ВЕРХ: 1,32 хв (методика L)); 6-Хлорбензофуран-2-карбонова кислота (мас-спектр ІЕР: [M-H] = 195; час утримування ВЕРХ: 1,72 хв (методика H)). III) СИНТЕЗ СПОЛУК (Ia) и (Ib) Сполука 1: (1-(2-Фтор-4-[(1H-індол-2-карбоніл)аміно]бензил)-3,5-диметил-1H-піразол-4іл)оцтова кислота (методика сполучення C1): a) До розчину індол-2-карбонової кислоти (80 мг, 0,50 моля) в N,N-диметилформаміді (1,5 мл) додають TBTU (139 мг, 0,43 моля) і N,N-діізопропіламін (0,126 мл, 0,74 моля). Потім додають метиловий ефір [1-(4-аміно-2-фторбензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти (120 мг, 0,41 моля). Суміш перемішують при кімнатній температурі протягом 12 г. Потім додають водний розчин K2CO3 (2 M, 0,5 мл). Отриману суміш пропускають через Al2O3 з використанням суміші дихлорметан / метанол (9:1, 10 мл). Розчинник видаляють у вакуумі і отримують 82,3 мг метилового ефіру (1-(2-фтор-4-[(1H-індол-2-карбоніл)аміно]бензил)-3,5+ диметил-1H-піразол-4-іл)оцтової кислоти (мас-спектр ІЕР: [M+H] = 435; час утримування ВЕРХ: 0,41 хв (методика N). b) Метиловий ефір (1-(2-фтор-4-[(1H-індол-2-карбоніл)аміно]бензил)-3,5-диметил-1Hпіразол-4-іл)оцтової кислоти (82 мг, 0,19 моля) розчиняють у метанолі (0,5 мл). Додають водний розчин NaOH (4M, 0,3 мл) і суміш перемішують при кімнатній температурі протягом 2 г. Отриману суміш розбавляють сумішшю метанол/вода, тверду речовину відфільтровують і після випарювання залишок очищають за допомогою ВЕРХ (Gilson, XRS Pursuit, метанол/H 2O + 0,1% концентрованого NH3). Фракції, що містять шукану сполуку, концентрують і ліофілізують і + отримують 15 мг шуканої сполуки (мас-спектр ІЕР: [M+H] = 421; час утримування ВЕРХ: 1,04 хв (методика G)). 1 H-ЯМР 400 МГц (ДМСО-d6, ДМСО = диметилсульфоксид): [част./млн] = 2,03 (s, 3H), 2,14 (s, 3H), 2,52 (s, 3H), 3,21 (s, 2H), 5,16 (s, 2H), 6,99 (t, 1H), 7,08 (t, 1H), 7,23 (t, 1H), 7,39 (s, 1H), 7,48 (m, 2H), 7,66 (d, 1H), 7,79 (d, 1H), 10,45 (s, 1H), 11,79 (br., 1H). Сполуки 2 і 3, наведені в поданій нижче таблиці 1, також отримують за аналогією з методикою поєднання C1 з використанням відповідних вихідних амінів і карбонових кислот. Сполука 4: (1-{4-[(5-Фтор-3-метилбензофуран-2-карбоніл)аміно]бензил}-3,5-диметил-1Hпіразол-4-іл)оцтова кислота (методика сполучення C2): a) До розчину метилового ефіру [1-(4-амінобензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти (400 мг, 1,46 моля) в 5 мл дихлорметану додають діізопропілетиламін (1,5 мл, 8,8 моля) і 5-фтор-3-метил-1-бензофуран-2-карбонову кислоту (369 мг, 1,9 моля). Після перемішування при кімнатній температурі протягом 10 хв при охолодженні додають 50% розчин циклічного ангідриду 1-пропілфосфонової кислоти в етилацетаті (1,725 мл, 2,93 моля) і суміш перемішують при кімнатній температурі протягом 12 г. Розчинник випарюють у вакуумі і залишок очищають за допомогою РХСТ (дихлорметан/метанол 98:2) і отримують 410 мг метилового ефіру (1-{4-[(5фтор-3-метилбензофуран-2-карбоніл)аміно]бензил}-3,5-диметил-1H-піразол-4-іл)оцтової + кислоти (мас-спектр ІЕР: [M+H] = 450; ТШХ: Rf = 0,56 (дихлорметан/метанол 95:5, силікагель 60 F254)). b) До розчину метилового ефіру (1-{4-[(5-фтор-3-метилбензофуран-2карбоніл)аміно]бензил}-3,5-диметил-1H-піразол-4-іл)оцтової кислоти (410 мг, 0,91 моля) в суміші діоксан / вода (10 мл/10 мл) додають 1 M розчин NaOH (2,3 мл) і суміш перемішують при кімнатній температурі протягом 24 г. Суміш розбавляють водою і підкислюють хлористоводневою кислотою (1 M розчин, 3,25 мл). Осад відфільтровують, промивають водою і + сушать і отримують 338 мг шуканої сполуки (мас-спектр ІЕР: [M+H] = 436; час утримування ВЕРХ: 0,85 хв (методика D). 1 H-ЯМР 400 МГц (ДМСО-d6): [част./млн] = 2,05 (s, 3H), 2,10 (s, 3H), 2,52 (s, 3H), 3,24 (s, 2H), 5,16 (s, 2H), 7,10 (d, 2H), 7,37 (t, 1H), 7,66 (m, 2H), 7,75 (d, 2H), 10,40 (s, 1H), 12,05 (br., 1H). Сполуки 5-26 і 57-59, наведені у поданих нижче таблицях 1 і 2, також отримують за аналогією з методикою сполучення C2 з використанням відповідних вихідних амінів і карбонових кислот. Сполука 27: (1-{2-Фтор-4-[(5-фтор-3-метилбензофуран-2-карбоніл)аміно]бензил}-3,5диметил-1H-піразол-4-іл)оцтова кислота (методика сполучення C3): a) До розчину 5-фтор-3-метил-1-бензофуран-2-карбонової кислоти (194 мг, 1 моль) в 5 мл диметилформаміду додають діізопропілетиламін (0,516 мл, 3 моля) і ГАТУ (O-(7 25 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 азабензотриазол-1-іл)-N,N,N',N'-тетраметилуронійгексафторфосфат) (399 мг, 1,05 моля). Після перемішування при кімнатній температурі протягом 25 хв додають диметилформамід (1 мл) і потім проміжний метиловий ефір [1-(4-аміно-2-фторбензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти (291 мг, 1 моль). Потім додають діізопропілетиламін (0,344 мл, 2 моля) і диметилформамід (2 мл) і суміш перемішують при кімнатній температурі протягом 48 г. Потім додають етилацетат і воду і осад відфільтровують. Органічний шар двічі екстрагують оцтовою кислотою (1 н. Розчин), один раз водним розчином NaHCO3 (5 мас.%) і двічі водою, сушать над MgSO4. Розчинник видаляють випарюванням у вакуумі. Залишок очищають за допомогою РХСТ (дихлорметан / метанол 96:4) і одержують 120 мг метилового ефіру (1-(2-фтор-4-[(5-фтор-3метилбензофуран-2-карбоніл)аміно]-бензил)-3,5-диметил-1H-піразол-4-іл)оцтової кислоти (мас+ спектр ІЕР: [M+H] = 468; ТСХ: Rf = 0,72 (дихлорметан/метанол 9:1, силікагель 60 F254)). b) До розчину метилового ефіру (1-(2-фтор-4-[(5-фтор-3-метилбензофуран-2карбоніл)аміно]-бензил)-3,5-диметил-1H-піразол-4-іл)оцтової кислоти (119 мг, 0,26 моля) в суміші діоксан / вода (7 мл / 7 мл) додають водний розчин NaOH (1 M, 2,3 мл) і суміш перемішують при кімнатній температурі протягом 12 год і при 60 ° C протягом 2 г. Суміш розбавляють водою, підкислюють хлористоводневою кислотою (1 M розчин, 1 мл) і екстрагують етилацетатом. Органічний шар сушать над MgSO 4, розчинник випарюють у вакуумі, залишок кристалізують з діізопропілового ефіру і осад виділяють фільтруванням і одержують 69 мг + шуканої сполуки (мас-спектр ІЕР: [M+H] = 454; час утримування ВЕРХ: 0,90 хв (методика D)). 1 H-ЯМР 400 МГц (ДМСО-d6): [част./млн] = 2,03 (s, 3H), 2,14 (s, 3H), 2,57 (s, 3H), 3,28 (s, 2H), 5,18 (s, 2H), 6,96 (t, 1H), 7,37 (t, 1H), 7,54 (d, 1H), 7,66 (m, 2H), 7,79 (d, 1H), 10,60 (s, 1H), 12,07 (br., 1H). Сполуки 28-31, наведені в поданій нижче таблиці 1, також отримують за аналогією з методикою сполучення C3 з використанням відповідних вихідних амінів і карбонових кислот. Сполука 32: (1-(4-[(1-Етил-5-фтор-1H-індол-2-карбоніл)аміно]-2-фторбензил)-3,5-диметил1H-піразол-4-іл)оцтова кислота (методика сполучення C4): a) До розчину 1-етил-5-фтор-1H-індол-2-карбонової кислоти (140 мг, 0,68 моля) в 6 мл дихлорметану додають оксалілхлорид (0,094 мл, 0,68 моля) і краплю диметилформаміду. Після перемішування при кімнатній температурі протягом 1 год розчинник видаляють випарюванням у вакуумі. Залишок розчиняють у дихлорметані (5 мл) і по краплях додають до розчину метилового ефіру [1-(4-аміно-2-фторбензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти (177 мг, 0,61 моля) і діізопропілетиламіну (0,23 мл, 1,35 моля) в дихлорметані (5 мл). Після додавання 4-диметиламінопіридин (8,255 мг, 0,069 моля) розчин перемішують при кімнатній температурі протягом 12 г. Розчин двічі екстрагують хлористоводневою кислотою (1 M розчин), двічі водою, двічі водним розчином NaOH (1 M) і двічі водою. Органічний шар сушать над MgSO4, фільтрують і розчинник випарюють у вакуумі. Залишок очищають за допомогою РХСТ (дихлорметан/метанол 95:5) і одержують 160 мг метилового ефіру (1-(4-[(1-етил-5-фтор-1Hіндол-2-карбоніл)аміно]-2-фторбензил)-3,5-диметил-1H-піразол-4-іл)оцтової кислоти (мас-спектр + ІЕР: [M+H] = 481; час утримування ВЕРХ: 0,93 хв (методика D)). b) До розчину метилового ефіру (1-(4-[(1-етил-5-фтор-1H-індол-2-карбоніл)аміно]-2фторбензил)-3,5-диметил-1H-піразол-4-іл)оцтової кислоти (160 мг, 0,33 моля) в діоксані (2 мл) додають водний розчин NaOH (1 M, 0,66 мл) і суміш перемішують при 60 °C протягом 1 г. Розчинник випарюють у вакуумі і залишок суспендують у воді і обробляють оцтовою кислотою (2 M розчин). Осад сушать виморожуванням, розчиняють у метанолі і невеликій кількості диметилформаміду і продукт, осаджений при додаванні невеликої кількості води, фільтрують і + сушать і одержують 137 мг шуканої сполуки (мас-спектр ІЕР: [M+H] = 467; час утримування ВЕРХ: 0,89 хв (методика D)). 1 H-ЯМР 400 МГц (ДМСО-d6): [част./млн] = 1,30 (t, 6H), 2,04 (s, 3H), 2,13 (s, 3H), 3,25 (s, 2H), 4,55 (q, 4H), 5,16 (s, 2H), 6,97 (t, 1H), 7,17 (t, 1H), 7,29 (s, 1H), 7,47 (m, 1H), 7,62 (dd, 1H), 7,74 (d, 1H), 10,52 (s, 1H). Сполука 33: (1-(4-[(7-Хлор-3-метилбензофуран-2-карбоніл)аміно]бензил)-3,5-диметил-1Hпіразол-4-іл)оцтова кислота (методика сполучення C4): a) До розчину 7-хлор-3-метилбензофуран-2-карбонової кислоти (185 мг, 0,88 моля) в 6 мл дихлорметану додають оксалілхлорид (0,123 мл, 1,14 моля) і краплю диметилформаміду. Після перемішування при кімнатній температурі протягом 1 год розчинник видаляють випарюванням у вакуумі. Залишок розчиняють у дихлорметані (5 мл) і по краплях додають до розчину третбутилового ефіру [1-(4-амінобензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти (428 мг, 1 моль) у вигляді його толуолсульфонату і діізопропілетиламіну (0,39 мл, 2,27 моля) в дихлорметані (5 мл). Після додавання 4-диметиламінопіридину (11 мг, 0,09 моля) розчин перемішують при кімнатній температурі протягом 12 г. Розчин двічі екстрагують 26 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 хлористоводневою кислотою (1 M розчин), двічі водою, двічі водним розчином NaOH (1 M) і двічі водою. Органічний шар сушать над MgSO4, фільтрують і розчинник випарюють у вакуумі і отримують 426 мг трет-бутилового ефіру (1-(4-[(7-хлор-3-метилбензофуран-2+ карбоніл)аміно]бензил)-3,5-диметил-1H-піразол-4-іл)оцтової кислоти (мас-спектр ІЕР: [M+H] = 508; час утримування ВЕРХ: 1,60 хв (методика H)). b) До розчину трет-бутилового ефіру (1-(4-[(7-хлор-3-метилбензофуран-2карбоніл)аміно]бензил)-3,5-диметил-1H-піразол-4-іл)оцтової кислоти (426 мг, 0,84 моля) в дихлорметані (10 мл) додають трифтороцтову кислоту (400 мл, 5,2 благаючи) і суміш перемішують при кімнатній температурі протягом 3 днів. Розчинник випарюють у вакуумі і залишок суспендують у воді і обробляють діетіловим ефіром, і осаджений продукт фільтрують і + одержують 174 мг шуканої сполуки (мас-спектр ІЕР: [M+H] = 452; час утримування ВЕРХ: 1,39 хв (методика J)). 1 H-ЯМР 400 МГц (ДМСО-d6): [част./млн] = 2,07 (s, 3H), 2,14 (s, 3H), 2,57 (s, 3H), 3,29 (s, 2H), 5,17 (s, 2H), 7,12 (d, 2H), 7,38 (t, 1H), 7,62 (d, 1H), 7,74 (d, 2H), 7,76 (d, 1H), 10,33 (s, 1H). Сполука 48: (1-(4-[(3-Етил-5-фторбензофуран-2-карбоніл)аміно]бензил)-3,5-диметил-1Hпіразол-4-іл)оцтова кислота (методика сполучення C4) a) До розчину 3-етил-5-фторбензофуран-2-карбонової кислоти (450 мг, 2,16 моля) в 10 мл дихлорметану додають оксалілхлорид (0,335 мл, 3,1 благаючи) і краплю диметилформаміду. Після перемішування при кімнатній температурі протягом 1 год розчинник видаляють випарюванням у вакуумі. Залишок розчиняють у дихлорметані (10 мл) і по краплях додають до розчину трет-бутилового ефіру [1-(4-амінобензил)-3,5-диметил-1H-піразол-4-іл]оцтової кислоти (1,054 г, 2,16 моля) у вигляді його 4-толуолсульфонату і діізопропілетиламіну (1,3 мл, 7,57 моля) в дихлорметані (5 мл). Після додавання 4-диметиламінопіридину (26,4 мг, 0,216 моля) розчин перемішують при кімнатній температурі протягом 12 г. Розчинник випарюють у вакуумі, розчиняють в 100 мл етилацетату і розчин двічі екстрагують водою, один раз хлористоводневою кислотою (0,5 M розчин ), один раз водою, один раз водним розчином NaHCO3 (5 мас.%) і один раз водою. Органічний шар сушать над MgSO4, фільтрують і розчинник випарюють у вакуумі. Залишок очищають за допомогою РХСТ (дихлорметан/метанол 98:2) і одержують 150 мг трет-бутилового ефіру 1-(4-[(3-етил-5-фторбензофуран-2+ карбоніл)аміно]бензил)-3,5-диметил-1H-піразол-4-іл)оцтової кислоти (мас-спектр ІЕР: [M+H] = 506; час утримування ВЕРХ: 1,02 хв (методика D)). b) До розчину трет-бутилового ефіру 1-(4-[(3-етил-5-фторбензофуран-2карбоніл)аміно]бензил)-3,5-диметил-1H-піразол-4-іл)оцтової кислоти (150 мг, 0,30 моля) в ацетонітрилі (25 мл) додають монтморилоніт KSF (300 мг) і суміш кип'ятять із зворотним холодильником протягом 6 г. Суміш розбавляють ацетонітрилом до обсягу, що дорівнює 400 мл, кип'ятять із зворотним холодильником протягом 5 хв і фільтрують. Розчинник випарюють у вакуумі і залишок промивають диметилформамідом (300 мл). Після фільтрування розчинник видаляють випарюванням і залишок обробляють ацетоном (200 мл). Після розтирання осад + фільтрують і промивають ацетоном і отримують 112 мг шуканої сполуки (мас-спектр ІЕР: [M+H] = 450; час утримування ВЕРХ: 0,85 хв (методика E)). 1 H-ЯМР 400 МГц (ДМСО-d6): [част./млн] = 1,21 (t, 6H), 2,04 (s, 3H), 2,11 (s, 3H), 3,09 (q, 4H), 3,27 (s, 2H), 5,16 (s, 2H), 7,09 (d, 2H), 7,33 (t, 1H), 7,67 (m, 2H), 7,76 (d, 2H), 10,39 (s, 1H). Сполуки 34-47 і 49-56, наведені в поданій нижче таблиці 1, також отримують за аналогією з методикою сполучення C4 з використанням відповідних вихідних амінів і карбонових кислот. IV) БІОЛОГІЧНІ ДОСЛІДЖЕННЯ Сполуки формули (Ia) і (Ib), запропоновані в даному винаході, досліджували з використанням наведених нижче біологічних методик для визначення їх здатності витісняти PGD2 з рецептора CRTH2 і їх здатності протидіяти функціональному впливу PGD2 в рецепторі CRTH2 у всій системі. ПРИГОТУВАННЯ МЕМБРАН РЕЦЕПТОРА CRTH2 ЛЮДИНИ І АНАЛІЗ ЗВ'ЯЗУВАННЯ РАДИОЛІГАНДУ Зв'язування антагоністів CRTH2 визначають за допомогою мембран, приготовлених з клітин яєчника китайського хом'ячка (клітини CHO-K1), трансфікованих рецептором CRTH2 людини (клітини CHO-K1-hCRTH2, Perkin Elmer, Cat No ES-561-C). Для приготування клітинних мембран клітини CHO-K1-hCRTH2 вирощують в суспензії в середовищі CHO SFMII з додаванням 400 мкг / мл G418. Клітини збирають центрифугуванням при 300 g, при кімнатній температурі протягом 10 хв. Таблетку клітин повторно суспендують у забуференному фосфатом фізіологічному розчині (ЗФФ), що містить суміш інгібіторів протеази (Complete, Roche) і забезпечують концентрацію, рівну 10E7 клітин / мл. Клітини CHO-K1-hCRTH2 руйнують шляхом розкладання азотом і одержують препарат мембран. Залишки клітин видаляють центрифугуванням (при 500 27 UA 109696 C2 5 10 15 20 25 30 35 40 45 50 55 60 g при 4 ° C, 30 хв) і супернатант переносять у чисті пробірки і другий раз центрифугують при 40000 g, при 4 ° C протягом 1 год для осадження мембран. Мембрани суспендують в інкубаційному буфері для ПСА (проксимальний сцинтиляційний аналіз) (50 мM Tris-HCl (Tris трис (гідроксіметиламінометан)), 10 мM MgCl2, 150 мM NaCl, 1 мM ЕДТК (етилендіамінтетраоцтова кислота), pH 7,4), що не містить бичачий сироватковий альбумін, гомогенізують шляхом пропускання через одноразову голку (Terumo, 23Gx1 ") і зберігають у вигляді аліквот при -80°C. Дослідження зв'язування рецептора CRTH2 проводять за методикою проксимального сцинтиляційного аналізу (ПСА) з радіолігандом [3H]-PGD2 (Perkin Elmer, NET616000MC). Мембрани клітин CHO-K1-hCRTH2 повторно гомогенізують шляхом пропускання через одноразову голку (Terumo, 23Gx1 ") і розводять в інкубаційному буфері для ПСА до відповідних концентрацій (0,5-10 мкг білка / лунка). Дослідження за допомогою ПСА проводять в 96лункових мікропланшетах для титрування (Perkin Elmer, CatNo. 6005040) в інкубаційному буфері для ПСА при кінцевому об'ємі, дорівнює 200 мкл, і кінцевої концентрації, що становить 50 мM Tris-HCl, 10 мM MgCl2, 150 мM NaCl, 1 мM ЕДТА, pH 7,4, 0,1 % бичачого сироваткового альбуміну. Суміш для дослідження за допомогою ПСА містить 60 мкл суспензії мембран, 80 мкл гранул полівінілтолуола, на які нанесено агглютинин із зародків пшениці (GE Healthcare, RPNQ0001, 0,3 мг/лунка), 40 мкл [3H] - PGD2, розведеного в буфері для ПСА до кінцевої концентрації, що дорівнює 1 Нm ( 50000 розпадів/хв), і 20 мкл досліджуваної сполуки (розчиненого у диметилсульфоксиде). Суміш для дослідження за допомогою ПСА інкубують при кімнатній температурі протягом 3 год. Радіоактивність пов'язаної речовини визначають сцинтиляційним лічильником (Micro Beta Trilux, Wallac). 3 Зв’язування [ H]-PGD2 з клітинними мембранами CHO-K1-hCRTH2 визначають за відсутності (повне зв'язування, ПС) і в присутності (неспецифічне зв'язування, НСС) неміченого PGD2 (1 мкM, Cayman Chemical, Cat No 12010) або контрольного антагоніста CRTH2 (10 мкM CAY10471, Cayman Chemical, Cat No 10006735). Спорідненість досліджуваної сполуки розраховують, віднімаючи значення для неспецифічного зв'язування (НСС) із значення для повного зв'язування (ПС) або зв'язування в присутності досліджуваної сполуки (B) при даній концентрації сполуки. Значення НСС відповідає інгібуванню на 100%. Значення ПС-НСС відповідає інгібуванню на 0%. Виражені у відсотках значення інгібування одержують при певній концентрації сполуки, наприклад, при 1 мкМ, виражені у відсотках значення інгібування для досліджуваної сполуки розраховують за формулою 100 - ((B-НСС) * 100 / (ПС-НСС)). Значення інгібування, що перевищують 100%, отримані внаслідок мінливості аналізу. Константу дисоціації Ki розраховують шляхом ітеративної апроксимації експериментальних даних, отриманих при декількох концентраціях сполуки в діапазоні доз від 0,1 до 30000 нМ за допомогою програми "easy sys", яка заснована на законі дії мас (Schittkowski, Num Math 68, 129142 (1994)). МЕТОДИКА ФУНКЦІОНАЛЬНОГО ДОСЛІДЖЕННЯ ЗВЯЗУВАННЯ CRTH2 З CAMP Дослідження проводять з використанням клітин CHO-K1-hCRTH2. Внутрішньоклітинний cAMP (циклічний аденозинмонофосфат) генерують шляхом стимуляції клітин за допомогою 10 мкМ форсколіну, активатора аденілатциклази. Для активації рецептора CRTH2 додають PGD2, що призводить до зменшення індукованої форсколіном вироблення cAMP. Аналізують здатність досліджуваних сполук інгібувати опосередковуване за допомогою PGD2 зменшення індукованого форсколіном вироблення cAMP в клітинах CHO-K1-hCRTH2. Клітини CHO-K1-hCRTH2 вирощують в обертових флаконах у середовищі CHO SFMII з додаванням 400 мкг/мл G418. Клітини збирають центрифугуванням при 300 g, при кімнатній температурі протягом 10 хв. Таблетку клітин промивають і суспендують в ЗФФ. Кінцеву концентрацію клітин встановлюють рівною 410E6 клітин/мл. Досліджувані сполуки розводять у диметилсульфоксиді і досліджують при декількох концентраціях сполук, що знаходяться в діапазоні від 0,1 до 3000 нM. Вміст cAMP визначають за допомогою набору для дослідження cAMP AlphaScreen (Perkin Elmer CatNo. 6760625M) в 384-лункових планшетах Optiplates (PerkinElmer, CatNo. 6007290) при повному обсязі при дослідженні, що дорівнює 50 мкл. 10 мкл Клітин (40000 клітин / лунка) інкубують при 37 °C протягом 30 хв з 10 мкл суміші для стимулювання, яка містить при кінцевій концентрації 10 мкМ форсколіну, 30 нM PGD2, 0,5 мM ІБМК (ізобутилметилксантин), 5 мM HEPES (4-(2-гідроксиетил)-1-піперазинетансульфонова кислота), 1буфера ССРХ (збалансований сольовий розчин Хенкса), 0,1% БСА (бичачий сироватковий альбумін), зі значенням pH, доведеним до 7,4, і досліджуваною сполукою при різних концентраціях. Потім додають 30 мкл буфера для лізису та суміші для детектування, яка містить донорні гранули SA, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazole compounds as crth2 antagonists
Автори англійськоюAnderskewitz, Ralf, Martyres, Domnic, Oost, Thorsten, Rist, Wolfgang, Seither, Peter
Автори російськоюАндерскевиц Ральф, Мартирес Домник, Ост Торстен, Рист Вольфганг, Зайтер Петер
МПК / Мітки
МПК: A61K 31/4155, C07D 403/12, A61P 29/00, C07D 409/12, C07D 407/12
Мітки: антагоністи, crth2, піразоли
Код посилання
<a href="https://ua.patents.su/38-109696-pirazoli-yak-antagonisti-crth2.html" target="_blank" rel="follow" title="База патентів України">Піразоли як антагоністи crth2</a>
Попередній патент: Збиральний пристрій для збиральної машини (варіанти)
Наступний патент: Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщених)піколінатів
Випадковий патент: Спосіб підвищення захисних властивостей організму під впливом зовнішніх фізичних факторів