Похідні 6-дифторметил-5,6-дигідро-2н-[1,4]оксазин-3-аміну
Номер патенту: 111749
Опубліковано: 10.06.2016
Автори: Суркін Мішель, Трабанко-Суарес Андрес Авеліно, Гійсен Хенрікус Якобус Марія, Прокопцова Хана
Формула / Реферат
1. Сполука формули (І)
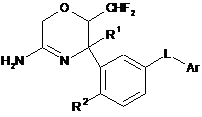
або її таутомерна або стереоізомерна форма, де
R1 являє собою С1-3алкіл;
R2 являє собою водень або фтор;
L являє собою зв'язок або -NHCO-;
Аr вибраний з групи, що складається з піридинілу, піримідинілу і піразинілу, кожний з яких необов'язково заміщений галогеном або С1-3алкокси;
або її фармацевтично прийнятна сіль приєднання.
2. Сполука за п. 1, де R1 являє собою метил або етил.
3. Сполука за п. 2, де Аr вибраний з 5-метоксипіридинілу, 5-піримідинілу і 5-фторпіразинілу.
4. Сполука за п. 1, де R2 являє собою водень або фтор.
5. Сполука за п. 1, де четвертинний атом вуглецю, заміщений R1, має R-конфігурацію.
6. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким із пп. 1-5 і фармацевтично прийнятний носій.
7. Спосіб отримання фармацевтичної композиції за п. 6, який відрізняється тим, що фармацевтично прийнятний носій рівномірно змішують з терапевтично ефективною кількістю сполуки за будь-яким із пп. 1-5.
8. Сполука за будь-яким із пп. 1-5 для застосування при лікуванні або попередженні хвороби Альцгеймера (AD), помірного когнітивного порушення, старіння, деменції, деменції з тільцями Леві, церебральної амілоїдної ангіопатії, слабоумства внаслідок множинних інфарктів, синдрому Дауна, деменції, асоційованої з інсультом, деменції, асоційованої із хворобою Паркінсона, або деменції, асоційованої з бета-амілоїдом.
9. Спосіб лікування розладу, вибраного з групи, що складається з хвороби Альцгеймера, помірного когнітивного порушення, старіння, деменції, деменції з тільцями Леві, церебральної амілоїдної ангіопатії, слабоумства внаслідок множинних інфарктів, синдрому Дауна, деменції, асоційованої з інсультом, деменції, асоційованої із хворобою Паркінсона, і деменції, асоційованої з бета-амілоїдом, у суб'єкта, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості сполуки за будь-яким із пп. 1-5 або фармацевтичної композиції за п. 6.
Текст
Реферат: Даний винахід стосується нових похідних 6-дифторметил-5,6-дигідро-2Н-[1,4]оксазин-3-аміну як інгібіторів бета-секретази, також відомої як фермент, що розщеплює попередник амілоїду по бета-сайту, ВАСЕ, ВАСЕ1, Asp2 або мемапсин 2. Даний винахід також стосується фармацевтичних композицій, що містять такі сполуки, способів отримання таких сполук і композицій і застосування таких сполук і композицій для попередження і лікування порушень, в які залучена бета-секретаза, таких як хвороба Альцгеймера (AD), помірне когнітивне порушення, старіння, деменція, деменція з тільцями Леві, церебральна амілоїдна ангіопатія, слабоумство внаслідок множинних інфарктів, синдром Дауна, деменція, асоційована з інсультом, деменція, асоційована із хворобою Паркінсона, та деменція, асоційована з бетаамілоїдом. UA 111749 C2 (12) UA 111749 C2 UA 111749 C2 5 10 15 20 25 30 35 40 45 50 55 ГАЛУЗЬ ВИНАХОДУ Даний винахід відноситься до нових похідних 6-дифторметил-5,6-дигідро-2H-[1,4]оксазин-3аміну в якості інгібіторів бета-секретази, також відомої як фермент, що розщеплює попередник амілоїду по бета-сайту, В АСЕ, ВАСЕ1, Asp2 або мемапсин 2. Даний винахід також відноситься до фармацевтичних композицій, що містять такі сполуки, до способів отримання таких сполук і композицій та до застосування таких сполук і композицій для попередження і лікування розладів, до яких залучена бета-секретаза, таких як хвороба Альцгеймера (AD), помірне когнітивне порушення, старіння, деменція, деменція з тільцями Леві, синдром Дауна, деменція, асоційована з інсультом, деменція, асоційована із хворобою Паркінсона, та деменція, асоційована з бета-амілоїдом. ПЕРЕДУМОВИ ВИНАХОДУ Хвороба Альцгеймера (AD) являє собою нейродегенеративне захворювання, асоційоване зі старінням. Пацієнти з AD страждають порушеннями пізнавальної здатності та втратою пам'яті, а також поведінковими проблемами, такими як тривожність. Понад 90 % уражених AD мають спорадичну форму розладу, тоді як менше 10 % випадків є сімейними або спадковими. В Сполучених Штатах у приблизно 1 з 10 людей у віці 65 років є AD, тоді як у віці 85 років 1 з кожних двох індивідуумів уражений AD. Середня передбачувана тривалість життя від початкового діагнозу становить 7-10 років, і пацієнти з AD потребують всебічного догляду, що здійснюється або у будинку престарілих, що є дуже дорогим, або членами родини. Через збільшення кількості літніх людей в популяції AD являє собою зростаючу медичну проблему. Наявні в даний час види терапії AD забезпечують лікування тільки симптомів захворювання та включають інгібітори ацетилхолінестерази для поліпшення когнітивних властивостей, а також анксіолітики та нейролептики для контролю поведінкових проблем, асоційованих з даною хворобою. Характерними патологічними ознаками в головному мозку пацієнтів з AD є нейрофібрилярні клубки, які виникають в результаті гіперфосфорилювання тау-білка, та амілоїдні бляшки, що утворюються в результаті агрегації пептиду бета-амілоїду 1-42 (Abeta 1-42). Abeta 1-42 утворює олігомери, а потім фібрили і, зрештою, амілоїдні бляшки. Олігомери та фібрили вважаються особливо нейротоксичними і можуть викликати більшу частину неврологічних ушкоджень, асоційованих з AD. Засоби, які попереджають утворення Abeta 1-42, мають потенціал, щоб стати засобами, що модифікують перебіг захворювання, для лікування AD. Abeta 1-42 утворюється з білка-попередника амілоїду (АРР), що складається із 770 амінокислот. N-кінець Abeta 1-42 відщеплюється бета-секретазою (ВАСЕ), а потім гамма-секретаза відщеплює Скінець. На додаток до Abeta 1-42 гамма-секретаза також вивільняє Abeta 1-40, який є переважним продуктом розщеплення, так само як Abeta 1-38 та Abeta 1-43. Ці форми Abeta також можуть агрегуватися з утворенням олігомерів і фібрил. Таким чином, передбачається, що інгібітори ВАСЕ будуть попереджати утворення Abeta 1-42, а також Abeta 1-40, Abeta 1-38 та Abeta 1-43 і будуть потенційними терапевтичними засобами для лікування AD. У WO-2011/009943 (Novartis) розкривають незаміщені та 2-заміщені похідні оксазину та їхнє застосування у якості інгібіторів ВАСЕ для лікування неврологічних розладів. У WO-2011/020806 (Hoffmann-LaRoche) розкривають 2,6-незаміщені похідні 3-аміно-5-феніл-5,6-дигідро-2Н[1,4]оксазину, які мають інгібуючі властивості по відношенню до ВАСЕ1 та/або ВАСЕ2. КОРОТКИЙ ОПИС ВИНАХОДУ Даний винахід відноситься до похідних 5,6-дигідро-2//-[1,4]оксазин-3амину формули (І), та їхніх таутомерних та стереоізомерних форм, де 1 R являє собою Сі-залкіл; 2 R являє собою водень або фтор; L являє собою зв'язок або -NHCO-; Аr обраний із групи, що складається з піридинілу, піримідинілу та піразинілу, кожен з яких необов'язково заміщений галогеном або С1-залкоксі; та їхніх фармацевтично прийнятних солей приєднання. Прикладом даного винаходу є фармацевтична композиція, що містить фармацевтично прийнятний носій і будь-яку зі сполук, описаних вище. Прикладом даного винаходу є 1 UA 111749 C2 5 10 15 20 25 30 35 40 45 50 55 фармацевтична композиція, отримана шляхом змішування будь-якої зі сполук, описаних вище, та фармацевтично прийнятного носія. Прикладом даного винаходу є спосіб отримання фармацевтичної композиції, який включає змішування будь-якої зі сполук, описаних вище, і фармацевтично прийнятного носія. Прикладом даного винаходу є способи лікування розладу, опосередкованого ферментом бета-секретазою, які включають введення суб'єкту, що потребує цього, терапевтично ефективної кількості будь-якої зі сполук або фармацевтичних композицій, описаних вище. Додатково ілюструють даний винахід способи інгібування ферменту бета-секретази, які включають введення суб'єкту, що потребує цього, терапевтично ефективної кількості будь-якої зі сполук або фармацевтичних композицій, описаних у даному документі. Прикладом даного винаходу є спосіб лікування розладу, обраного з групи, що складається із хвороби Альцгеймера, помірного когнітивного порушення, старіння, деменції, деменції з тільцями Леві, церебральної амілоїдної ангіопатії, слабоумства внаслідок множинних інфарктів, синдрому Дауна, деменції, асоційованої з інсультом, деменції, асоційованої із хворобою Паркінсона, і деменції, асоційованої з бета-амілоїдом, переважно хвороби Альцгеймера, який включає введення суб'єкту, що потребує цього, терапевтично ефективної кількості будь-якої зі сполук або фармацевтичних композицій, описаних у даному документі. Іншим прикладом даного винаходу є будь-яка зі сполук, описаних вище, для застосування при лікуванні: (а) хвороби Альцгеймера, (b) помірного когнітивного порушення, (с) старіння, (d) деменції, (є) деменції з тільцями Леві, (f) синдрому Дауна, (g) деменції, асоційованої з інсультом, (h) деменції, асоційованої із хворобою Паркінсона, та (і) деменції, асоційованої з бета-амілоїдом, у суб'єкта, що потребує цього. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Даний винахід відноситься до сполук формули (І), визначених вище у даному документі, та їхніх фармацевтично прийнятних солей і сольватів. Сполуки формули (І) є інгібіторами ферменту бета-секретази (також відомого як фермент, що розщеплює по бета-сайту, ВАСЕ, ВАСЕ1, Asp2 або мемапсин 2) та є придатними при лікуванні хвороби Альцгеймера, помірного когнітивного порушення, старіння, деменції, деменції, асоційованої з інсультом, деменції з тільцями Леві, синдрому Дауна, деменції, асоційованої із хворобою Паркінсона, і деменції, асоційованої з бета-амілоїдом, переважно хвороби Альцгеймера, помірного когнітивного порушення або деменції, більш переважно хвороби Альцгеймера. 1 У варіанті здійснення даного винаходу R являє собою метил або етил. У варіанті здійснення даного винаходу Аr обраний з 5-метоксипіридинілу, 5-піримідинілу та 5-фторпіразинілу. 2 В іншому варіанті здійснення даного винаходу R являє собою водень або фтор. В іншому варіанті здійснення четвертинний атом вуглецю, заміщений R, характеризується R-конфігурацією. ВИЗНАЧЕННЯ "Галоген" означає фтор, хлор і бром; "С1-залкілоксі" означає ефірний радикал, де С1-залкіл являє собою алкільну нерозгалужену групу або групу з розгалуженим ланцюгом, яка має 1, 2 або 3 атома вуглецю, наприклад, метил, етил, 1-пропіл і 2-пропіл. Вираз "суб'єкт", що використовується у даному документі, відноситься до тварини, переважно ссавця, найбільш переважно людини, яка є або була об'єктом лікування, спостереження або експерименту. Вираз "терапевтично ефективна кількість", що використовується у даному документі, означає таку кількість активної сполуки або фармацевтичного засобу, що викликає біологічний або медичний ефект у тканинній системі у тварини або людини, необхідний досліднику, ветеринару, лікарю або іншому клініцисту, який включає полегшення симптомів захворювання або розладу, лікування якого здійснюється. Вираз "композиція", що використовується у даному документі, призначений охоплювати продукт, що містить визначені інгредієнти у визначених кількостях, а також будь-який продукт, який отримують, прямо або опосередковано, в результаті комбінацій визначених інгредієнтів у визначених кількостях. Вище і нижче в даному документі вираз "сполука формули (І)" слід розуміти як такий, що включає солі приєднання, сольвати і стереоізомери. Вирази "стереоізомери" або "стереохімічно ізомерні форми"раніше і далі в даному документі використовують як взаємозамінні. Даний винахід включає всі стереоізомери сполуки формули (І) або у вигляді чистого стереоізомеру, або у вигляді суміші з двох або більше стереоізомерів. 2 UA 111749 C2 5 10 15 20 25 30 35 40 45 50 55 Енантіомери є стереоізомерами, які являють собою дзеркальні відображення один одного, що не збігаються при накладанні. Суміш 1:1 пари енантіомерів є рацематом або рацемічною сумішшю. Діастереомери (або діастереоізомери) є стереоізомерами, які не є енантіомерами, тобто вони не співвідносяться як дзеркальні зображення. Отже, даний винахід включає енантіомери, діастереомери, рацемати. Абсолютна конфігурація визначається згідно із системою Кана - Інгольда -Прелога. Конфігурація при асиметричному атомі визначається або як R, або як S. Аналізовувані сполуки, абсолютна конфігурація яких невідома, можуть бути позначені як (+) або (-) в залежності від напрямку, в якому вони обертають площину поляризованого світла. Якщо вказаний конкретний стереоізомер, це означає, що зазначений стереоізомер практично чистий, тобто пов'язаний з менше 50 %, переважно менше 20 %, більш переважно менше 10 %, ще більш переважно менше 5 %, зокрема, менше 2 % і найбільш переважно менше 1 % інших ізомерів. Таким чином, якщо сполука формули (І) зазначена, наприклад, як (R), це означає, що сполука практично не містить (8)-ізомер. Сполуки формули (І) співіснують у динамічній рівновазі з таутомерами формули (1-а). Крім того, деякі кристалічні форми сполук за даним винаходом можуть існувати у вигляді поліморфів, і в силу цього передбачається їх включення у даний винахід. Крім того, деякі зі сполук за даним винаходом можуть утворювати сольвати з водою (тобто гідрати) або звичайними органічними розчинниками, при цьому також передбачається, що такі сольвати охоплені обсягом даного винаходу. Що стосується застосування в медицині, солі сполук за даним винаходом відносяться до нетоксичних "фармацевтично прийнятних солей". Однак при отриманні сполук згідно з даним винаходом або їхніх фармацевтично прийнятних солей можуть бути використані інші солі. Придатні фармацевтично прийнятні солі сполук включають солі приєднання кислоти, які можна отримувати, наприклад, шляхом змішування розчину сполуки з розчином фармацевтично прийнятної кислоти, такої як соляна кислота, сірчана кислота, фумарова кислота, малеїнова кислота, янтарна кислота, оцтова кислота, бензойна кислота, лимонна кислота, винна кислота, вугільна кислота або фосфорна кислота. Більш того, якщо сполуки за даним винаходом несуть кислотний фрагмент, їхні придатні фармацевтично прийнятні солі можуть включати солі лужних металів, наприклад, солі натрію або калію; солі лужноземельних металів, наприклад, солі кальцію або магнію; та солі, утворені з придатними органічними лігандами, наприклад, солі четвертинного амонію. Типові кислоти, які можна використовувати в отриманні фармацевтично прийнятних солей, без обмеження включають наступні: оцтова кислота, 2,2-дихлороцтова кислота, ацильовані амінокислоти, адипінова кислота, альгінова кислота, аскорбінова кислота, L-аспарагінова кислота, бензолсульфонова кислота, бензойна кислота, 4-ацетамідобензойна кислота, (+)камфорна кислота, камфорсульфонова кислота, капронова кислота, капроєва кислота, каприлова кислота, корична кислота, лимонна кислота, цикламова кислота, етан-1,2дисульфонова кислота, етансульфонова кислота, 2-гідкроксіетансульфонова кислота, мурашина кислота, фумарова кислота, галактарова кислота, гентизинова кислота, глюкогептонова кислота, D-глюконова кислота, D-глюкуронова кислота, L-глутамінова кислота, бета-оксо-глутарова кислота, гліколева кислота, гіпурова кислота, бромистоводнева кислота, соляна кислота, (+)-L-молочна кислота, (±)-DL-молочна кислота, лактобіонова кислота, малеїнова кислота, (-)-L-оксіянтарна кислота, малонова кислота, (±)-DL-мигдальна кислота, метансульфонова кислота, нафталін-2-сульфонова кислота, нафталін-1,5-дисульфонова кислота, 1-гідрокси-2-нафтойна кислота, нікотинова кислота, азотна кислота, олеїнова кислота, оротова кислота, щавлева кислота, пальмітинова кислота, памова кислота, фосфорна кислота, L-піроглутамінова кислота, саліцилова кислота, 4-аміносаліцилова кислота, себацинова кислота, стеаринова кислота, янтарна кислота, сірчана кислота, дубильна кислота, (+)-b-винна кислота, тіоціанова кислота, птолуолсульфонова кислота, трифторметилсульфонова кислота та ундециленова кислота. Типові основи, які можна використовувати в отриманні фармацевтично прийнятних солей, без 3 UA 111749 C2 5 10 15 20 25 30 35 обмеження включають наступні: аміак, L-аргінін, бенетамін, бензатин, гідроксид кальцію, холін, диметилетаноламін, діетаноламін, діетиламін, 2-(діетиламіно)-етанол, етаноламін, етилендіамін, N-метилглюкамін, гідрабамін, ІЯ-імідазол, L-лізин, гідроксид магнію, 4-(2гідроксіетил)-морфолін, піперазин, гідроксид калію, 1 -(2-гідроксіетил)-піролідин, вторинний амін, гідроксид натрію, триетаноламін, трометамін та гідроксид цинку. Назви сполук за даним винаходом складені згідно з правилами номенклатури, узгодженими з Хімічною реферативною службою (CAS), з використанням програмного забезпечення Advanced Chemical Development, Inc., (ACD/назва продукту, версія 10.01; складання 15494, 1 грудня 2006 року) або згідно з правилами номенклатури, узгодженими з Міжнародним союзом теоретичної та прикладної хімії (ШРАС), з використанням програмного забезпечення Advanced Chemical Development, Inc., (ACD/назва продукту, версія 10.01.0.14105, жовтень 2006). У разі таутомерних форм складали назву представлених таутомерних форм структури. Інші не представлені таутомерні форми також включені в обсяг даного винаходу. Отримання сполук Методика експерименту 1 Кінцеві сполуки згідно з формулою (І) можуть бути отримані шляхом каталітичної гідрогенізації проміжної сполуки формули (ІІ-а) згідно зі схемою реакції (1). Зазначене перетворення можна виконати шляхом обробки проміжної сполуки формули (ІІ-а) воднем в присутності придатного каталізатора, такого як, наприклад, паладій на вугіллі, придатної каталітичної отрути, такої як, наприклад, тіофен, у придатному реакційно-інертному розчиннику, такому як, наприклад, етилацетат або метанол. Суміш перемішують в атмосфері водню при відповідній температурі, як правило, кімнатній температурі, при відповідному тиску, такому як, наприклад, атмосферний тиск, наприклад, протягом 16 годин. На схемі реакції (1) всі змінні величини визначені як у формулі (І). Методика експерименту 2 Проміжні сполуки формули (ІІ-c) можна, як правило, отримати шляхом приведення в реакцію проміжної сполуки формули (III) зі сполукою формули (IV) згідно зі схемою реакції (2), причому реакцію проводять у придатному реакційно-інертному розчиннику, такому як, наприклад, дихлорметан або метанол, в присутності придатної основи, такої як, наприклад, триетиламін, у присутності конденсуючого засобу, такого як, наприклад, 0-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронію гексафторофосфат [HATU, CAS 148893-10-1] або 4-(4,6-диметокси-1,3,5триазин-2-іл)-4-метилмофолінію хлорид [DMTMM, CAS 3945-69-5], за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 25 °C протягом часу, необхідного для завершення реакції, наприклад, 1-16 годин. На схемі реакції (2) всі змінні величини визначені як у формулі (І). Методика експерименту 3 4 UA 111749 C2 5 10 15 20 25 30 Загалом, проміжні сполуки формули (ll-с) можна отримати шляхом приведення в реакцію проміжних сполук формули (VI) з придатними арилборонатом або арилбороновою кислотою в реакції за типом Судзукі. Таким чином, проміжні сполуки формули (VI) можуть вступати в реакцію з арилборонатом або арилбороновою кислотою у придатному реакційно-інертному розчиннику, такому як, наприклад, 1,4-діоксан, етанол або суміші інертних розчинників, таких як, наприклад, 1,2-диметоксіетан/вода/етанол, в присутності придатної основи, такої як, наприклад, водний К3РО4, Na2СО3 або Cs2CO3, Pd-комплексного каталізатора, такого як, наприклад, [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладій (II) [CAS 72287-26-4] або трансбісдициклогексиламін)паладію діацетат [DAPCy, CAS 628339-96-8] або тетракіс(трифенілфосфін) паладій (0) [CAS14221-01-3], за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 80 °C, наприклад, протягом періоду часу 2-20 годин або, наприклад, нагрівання реакційної суміші при 130 °C, наприклад, протягом 10 хвилин в мікрохвильовому випромінюванні. На схемі реакції (3) усі змінні величини визначені як у 3 4 формулі (І), і W являє собою галоген. R та R можуть являти собою водень або алкіл або, взяті разом, можуть утворювати, наприклад, двовалентний радикал формули -СН2СН2-,СН2СН2СН2-або -С(СН3)2С(СН3)2-. Методика експерименту 4 Загалом, проміжні сполуки формули (III) можна отримати після етапів реакції, показаних на схемі реакції (4) нижче. А: перегрупування брому на амін В: перетворення тіоаміду в амідин С: перетворення аміду в тіоамід (тіонування) Проміжні сполуки формули (Пі) у наведеній вище схемі реакції (4) можна отримати з відповідних проміжних снолук формули (VI), дотримуючись відомого з рівня техніки типу методики поєднання, що каталізується міддю (етап реакції А). Зазначене поєднання можна здійснювати шляхом обробки проміжних сполук формули (VI) азидом натрію у придатному реакційно-інертному розчиннику, такому як, наприклад, DMSO, в присутності суміші придатних основ, таких як, наприклад, диметилетилендіамін, та Na2CO3, та мідного каталізатора, такого як, 5 UA 111749 C2 5 10 15 20 25 30 наприклад, Cul, за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 110 °C до завершення реакції, наприклад, протягом 1 години. Проміжні сполуки формули (VI) з вищевказаної схеми реакції (4) можна отримати з відповідних проміжних сполук формули (VII), дотримуючись відомих з рівня техніки методик перетворення тіоаміду в амідин (етап реакції В). Зазначене перетворення можна безперешкодно здійснювати шляхом обробки проміжних продуктів формули (VII) джерелом аміаку, таким як, наприклад, хлорид амонію або водний аміак, у придатному реакційноінертному розчиннику, такому як, наприклад, вода або метанол тощо, за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 60 °C, наприклад, протягом 6 годин. Проміжні сполуки формули (VII) з вищевказаної схеми реакції (4) можна отримати з відповідних проміжних сполук формули (VIII), дотримуючись відомих з рівня техніки методик тіонування (етап реакції С). Зазначене перетворення можна безперешкодно здійснювати шляхом обробки проміжних сполук формули (VIII) тіонуючим агентом, таким як, наприклад, пентасульфід фосфору або 2,4-біс-(4-метоксифеніл)-1,3-дитіа-2,4-дифосфетан-2,4-дисульфід [реагент Лавессона, CAS 19172-47-5], в реакційно-інертному розчиннику, такому як, наприклад, тетрагідрофуран або 1,4-діоксан і т.п., за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 50 °C, наприклад, протягом 50 хвилин. Методика експерименту 5 Як правило, проміжні сполуки формули (VIII) і (IX) можна отримати з проміжних сполук формули (X), дотримуючись відомих з рівня техніки методик (етап реакції D). Зазначене перетворення можна здійснити шляхом обробки проміжної сполуки формули (X) придатним цинковим реагентом, таким як, наприклад, цинковий пил або цинк-мідна пара, у придатному розчиннику, такому як оцтова кислота, при придатній температурі, як правило, від кімнатної температури до 80 °C протягом часу, необхідного для завершення реакції, наприклад, протягом 1-16 годин. Дане перетворення забезпечує суміш проміжних сполук формули (VIII) і (IX) у різному співвідношенні залежно від умов реакції та реактивів. Методика експерименту 6 Загалом, проміжні сполуки формули (X) можна отримати після етапів реакції, показаних на схемі реакції (6) нижче. 6 UA 111749 C2 5 10 15 20 25 30 35 40 45 50 55 Ε: хлорування F: трифторметилювання G: циклізація Проміжні сполуки формули (X) з вищевказаної схеми реакції (6) можна отримати з проміжних сполук формули (XI), дотримуючись відомих з рівня техніки методик хлорування (етап реакції Е). Зазначене перетворення можна здійснити шляхом обробки проміжної сполуки формули (XI) придатним хлорувальним засобом, таким як, наприклад, тіонілхлорид, в присутності основи, такої як, наприклад, піридин, у реакційно-інертному розчиннику, такому як, наприклад, дихлорметан. Реакційну суміш перемішують при придатній температурі, наприклад, 0 °C, протягом часу, необхідного для завершення реакції, наприклад, протягом 30-60 хвилин. Проміжні сполуки формули (XI) з вищевказаної схеми реакції (6) можна отримати з проміжних сполук формули (XII), дотримуючись відомих з рівня техніки методик трифторметилювання (етап реакції F). Зазначене перетворення можна здійснити шляхом обробки проміжної сполуки формули (XII) у присутності фториду тетрабутиламонію (TBAF) або трифенілдифтор-силікату тетрабутиламонію (ТВАТ) трифторметилюючим засобом, таким як, наприклад, (трифторметил)триметилсилан, у придатному реакційно-інертному розчиннику, такому як, наприклад, тетрагідрофуран. Реакційну суміш перемішують при придатній температурі, наприклад, при кімнатній температурі протягом часу, необхідного для завершення реакції, наприклад, протягом двох годин. Проміжні сполуки формули (XII) з вищевказаної схеми реакції (6) можна отримати з проміжних сполук формули (XIV), дотримуючись відомих з рівня техніки методик циклізації (етап реакції G). Перш за все, зазначене перетворення можна здійснити шляхом обробки проміжних сполук формули (XIV) проміжною сполукою формули (XIII), такою як, наприклад, хлорацетилхлорид, в присутності основи, такої як, наприклад, NaOH або DIPEA, у придатному реакційно-інертному розчиннику, такому як, наприклад, дихлорметан або суміші інертних розчинників, таких як, наприклад, вода і 1,4-діоксан або вода і THF. рН реакційної суміші можна довести до придатного значення рН, наприклад 10-11, шляхом додавання придатної основи, такої як, наприклад, NaOH. Реакційну суміш перемішують при придатній температурі, наприклад, від 0 °C до 25 °C протягом часу, необхідного для завершення реакції, наприклад, протягом 1-4 годин. Отриманий в результаті неочищений залишок в подальшому можна піддати циклізації з отриманням проміжної сполуки (XII) шляхом додавання придатної основи, такої як, наприклад, К2СО3, Cs2CO3, N,N-діізопропілетиламін або NаНСО3, у придатному реакційноінертному розчиннику, такому як, наприклад, ацетонітрил або DMF. Реакційну суміш перемішують за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 25 °C до 80 °C протягом 2-24 годин або, наприклад, нагрівання реакційної суміші при 140 °C протягом 15-30 хвилин в мікрохвильовому випромінюванні. Дане перетворення можна здійснити за відсутності основи у придатному реакційно-інертному розчиннику, такому як, наприклад, ацетонітрил або DMF, при придатній температурі, як правило, від 40 °C до 110 °C протягом періоду, наприклад, 24-48 годин. ФАРМАКОЛОГІЯ Сполуки за даним винаходом та їхні фармацевтично прийнятні композиції інгібують ВАСЕ та, отже, можуть бути придатними при лікуванні або попередженні хвороби Альцгеймера (AD), помірного когнітивного порушення (МСІ), старіння, деменції, деменції з тільцями Леві, церебральної амілоїдної ангіопатії, слабоумства внаслідок множинних інфарктів, синдрому Дауна, деменції, асоційованої з хворобою Паркінсона, та деменції, асоційованої з бетаамілоїдом. Даний винахід відноситься до сполуки згідно із загальною формулою (І), її стереоізомерної форми або її фармацевтично прийнятної солі приєднання кислоти або основи для застосування у якості лікарського препарату. Даний винахід також відноситься до сполуки згідно із загальною формулою (І), її стереоізомерної форми або її фармацевтично прийнятної солі приєднання кислоти або основи для застосування при лікуванні або попередженні захворювань або станів, вибраних з групи, що складається з AD, МСІ, старіння, деменції, деменції з тільцями Леві, церебральної амілоїдної ангіопатії, слабоумства внаслідок множинних інфарктів, синдрому Дауна, деменції, асоційованої з хворобою Паркінсона, та деменції, асоційованої з бета-амілоїдом. Даний винахід також відноситься до застосування сполуки згідно із загальною формулою (І), її стереоізомерної форми або її фармацевтично прийнятної солі приєднання кислоти або основи для отримання лікарського препарату для лікування або попередження будь-яких хворобливих станів, згаданих вище у даному документі. 7 UA 111749 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зважаючи на корисність сполуки формули (І) представлений спосіб лікування суб'єктів, таких як теплокровні тварини, у тому числі люди, які страждають будь-яким із захворювань, зазначених у даному документі, або спосіб попередження у суб'єктів, таких як теплокровні тварини, у тому числі люди, будь-якого із захворювань, зазначених вище у даному документі. Зазначені способи включають введення, тобто системне або місцеве введення, переважно пероральне введення, ефективної кількості сполуки формули (І), її стереоізомерної форми, її фармацевтично прийнятної солі приєднання або сольвату суб'єкту, такому як теплокровна тварина, у тому числі людина. Спосіб лікування може також включати введення активного інгредієнта за схемою від одного до чотирьох прийомів на день. У таких способах лікування сполуки згідно з даним винаходом переважно складені до введення. Як описано в даному документі нижче, придатні фармацевтичні склади отримують за допомогою відомих методик із застосуванням добре відомих та загальнодоступних інгредієнтів. Сполуки за даним винаходом, які можуть бути придатними для лікування або попередження хвороби Альцгеймера або її симптомів, можна вводити окремо або в комбінації з одним або декількома додатковими терапевтичними засобами. Комбінована терапія включає введення єдиного дозованого фармацевтичного складу, що містить сполуку формули (І) і один або декілька додаткових терапевтичних засобів, а також введення сполуки формули (І) і кожного додаткового терапевтичного засобу в своєму власному окремому дозованому фармацевтичному складі. Наприклад, сполука формули (І) і терапевтичний засіб можна вводити пацієнту разом в єдиній пероральній дозованій композиції, такій як пігулка або капсула, або кожний засіб можна вводити окремо в пероральних дозованих складах. ФАРМАЦЕВТИЧНІ КОМПОЗИЦІЇ У даному винаході також представлені композиції для попередження або лікування захворювань, при яких інгібування бета-секретази є сприятливим, таких як хвороба Альцгеймера (AD), помірне когнітивне порушення, старіння, деменція, деменція з тільцями Леві, синдром Дауна, деменція, асоційована з інсультом, деменція, асоційована з хворобою Паркінсона та деменція, асоційована з бета-амілоїдом. Зазначені композиції містять терапевтично ефективну кількість сполуки згідно з формулою (І) та фармацевтично прийнятний носій або розріджувач. Хоча активний інгредієнт можна вводити окремо, бажано надавати його у вигляді фармацевтичної композиції. Отже, у даному винаході додатково представлена фармацевтична композиція, що містить сполуку згідно з даним винаходом разом з фармацевтично прийнятним носієм або розріджувачем. Носій або розріджувач повинні бути "прийнятними" в тому сенсі, що вони повинні бути сумісними з іншими інгредієнтами композиції і повинні бути не шкідливі для пацієнтів, які їх отримують. Фармацевтичні композиції за даним винаходом можуть бути отримані будь-якими способами, добре відомими в галузі фармацевтики. Терапевтично ефективна кількість конкретної сполуки, у формі основи або у формі солі приєднання, у якості активного інгредієнта комбінують в однорідну суміш з фармацевтично прийнятним носієм, який може мати різноманітні форми в залежності від форми препарату, який необхідно ввести. Бажано, щоб дані фармацевтичні композиції були в одиничній лікарській формі, що підходить переважно для системного введення, такого як пероральне, черезшкірне або парентеральне введення; або для місцевого введення, такого як за допомогою інгаляції, назального спрею, очних крапель або за допомогою крему, гелю, шампуню і т. п. Наприклад, при отриманні композицій у вигляді пероральної лікарської форми можна використовувати будь-яке загальноприйняте фармацевтичне середовище, таке як, наприклад, вода, гліколі, масла, спирти тощо, у випадку пероральних рідких препаратів, таких як суспензії, сиропи, еліксири і розчини; або тверді носії, такі як крохмаль, цукри, каолін, мастильні речовини, зв'язувальні речовини, засоби для поліпшення розпадання тощо, у випадку порошків, пілюль, капсул та пігулок. Завдяки простоті їх введення пігулки і капсули являють собою найбільш переважні пероральні одиничні лікарські форми, у випадку яких безсумнівно використовують тверді фармацевтичні носії. Для парентеральних композицій носій буде, як правило, щонайменше, значною мірою містити стерильну воду, хоча може включати і інші інгредієнти, наприклад, для покращення розчинності. Наприклад, можуть бути отримані розчини для ін'єкцій, у яких носій містить фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину і розчину глюкози. Також можуть бути отримані суспензії для ін'єкцій, у випадку яких можуть бути використані придатні рідкі носії, суспендуючі засоби і т. п. В композиціях, придатних для черезшкірного введення, носій необов'язково містить засіб, що підсилює проникнення, та/або придатний змочуваний засіб, необов'язково в комбінації з придатними добавками будь-якої природи в мінімальних 8 UA 111749 C2 5 10 15 20 25 30 35 40 45 50 55 пропорціях, при цьому добавки не проявляють ніяких істотних шкідливих впливів на шкіру. Зазначені добавки можуть полегшувати нанесення на шкіру та/або можуть бути корисними при отриманні необхідних композицій. Дані композиції можна наносити різними шляхами, наприклад, у вигляді трансдермального пластиру, точково або у вигляді мазі. Для простоти введення і рівномірності дозування особливо переважним є складання вищезазначених фармацевтичних композицій в одиничній лікарській формі. Одинична лікарська форма, як використовується в описі та формулі винаходу в даному документі, відноситься до фізично дискретних одиниць, придатних у якості одиничних дозувань, причому кожна одиниця містить попередньо визначену кількість активного інгредієнта, розраховану так, щоб отримати необхідний терапевтичний ефект, спільно з необхідним фармацевтичним носієм. Прикладами таких одиничних лікарських форм є пігулки (у тому числі ділені або покриті пігулки), капсули, пілюлі, пакети з порошком, облатки, розчини або суспензії для ін'єкцій, чайні ложки, столові ложки тощо та їхні окремі безлічі. Точне дозування і частота введення залежать від конкретної застосовуваної сполуки формули (І), конкретного стану, лікування якого здійснюють, тяжкості стану, лікування якого здійснюють, віку, ваги, статі, ступеня тяжкості розладу і загального фізичного стану конкретного пацієнта, а також від іншої лікарської терапії, яку може отримувати індивідуум, як добре відомо фахівцю в даній галузі. Більш того, очевидно, що вказану ефективну добову кількість можна знижувати або збільшувати залежно від відповіді суб'єкта, що піддається лікуванню, та/або в залежності від оцінки лікаря, що призначає сполуки за даним винаходом. В залежності від способу введення фармацевтична композиція буде містити від 0,05 до 99 % за вагою, переважно від 0,1 до 70 % за вагою, більш переважно від 0,1 до 50 % за вагою активного інгредієнта та від 1 до 99,95 % за вагою, бажано від 30 до 99,9 % за вагою, більш переважно від 50 до 99,9 % за вагою фармацевтично прийнятного носія, при цьому всі відсоткові кількості ґрунтуються на загальній вазі композиції. Дані сполуки можна застосовувати для системного введення, такого як пероральне, черезшкірне або парентеральне введення; або для місцевого введення, такого як за допомогою інгаляції, назального спрею, очних крапель або за допомогою крему, гелю, шампуню тощо. Сполуки переважно вводяться перорально. Точне дозування і частота введення залежать від конкретної застосовуваної сполуки згідно з формулою (І), конкретного стану, лікування якого здійснюють, тяжкості стану, лікування якого здійснюють, віку, ваги, статі, ступеня тяжкості розладу і загального фізичного стану конкретного пацієнта, а також іншої лікарської терапії, яку може отримувати індивідуум, що добре відомо фахівцям в даній галузі. Більш того, очевидно, що вказану ефективну добову кількість можна знижувати або збільшувати залежно від відповіді суб'єкта, що піддається лікуванню, та/або в залежності від оцінки лікаря, що призначає сполуки за даним винаходом. Кількість сполуки формули (І), яку можна комбінувати з матеріалом-носієм для отримання разової лікарської форми, буде варіювати в залежності від захворювання, лікування якого здійснюють, виду ссавця і конкретного способу введення. Однак у якості загального керівництва придатні стандартні дози для сполук за даним винаходом можуть переважно містити, наприклад, від 0,1 мг до 1000 мг активної сполуки. Бажана стандартна доза становить від 1 мг до приблизно 500 мг. Більш бажана стандартна доза становить від 1 мг до приблизно 300 мг. Ще більш переважно стандартна доза становить від 1 мг до приблизно 100 мг. Такі стандартні дози можна вводити частіше одного разу на день, наприклад, 2, 3, 4, 5 або 6 разів на день, але переважно 1 або 2 рази в день, щоб загальна доза для дорослої людини вагою 70 кг знаходилася в діапазоні від 0,001 до приблизно 15 мг на кг ваги суб'єкта за введення. Бажана доза становить від 0,01 до приблизно 1,5 мг на кг ваги суб'єкта за введення, і така терапія може тривати протягом декількох тижнів або місяців, а в деяких випадках протягом декількох років. Проте слід розуміти, що певний рівень дози для будь-якого конкретного пацієнта буде залежати від ряду факторів, які включають активність визначеної використовуваної сполуки; вік, вага тіла, загальний стан здоров'я, стать та режим харчування індивідуума, що піддається лікуванню; час і шлях введення; швидкість виведення; інші лікарські засоби, які були введені раніше; і тяжкість конкретного захворювання, терапію якого здійснюють, що добре зрозуміло фахівцям в даній галузі. Типовим дозуванням може бути одна пігулка від 1 мг до приблизно 100 мг або від 1 мг до приблизно 300 мг, що приймається один раз на день або декілька разів на день, або одна капсула або пігулка пролонгованої дії, що приймається один раз на день і має пропорційно більш високий вміст активного інгредієнта. Ефект пролонгованої дії може бути забезпечений матеріалами капсули, які розчиняються при різних значеннях рН, за допомогою капсул, які 9 UA 111749 C2 5 10 15 20 25 30 35 повільно вивільняють лікарський засіб при осмотичному тиску, або за допомогою будь-яких інших відомих засобів з контрольованим вивільненням. У деяких випадках може знадобитися застосування дозувань поза цими діапазонами, що буде очевидно фахівцям в даній галузі. Крім того, слід зазначити, що клініцист або лікуючий лікар буде знати, як і коли починати, переривати, коригувати або завершувати терапію згідно з відповіддю окремого пацієнта. Щодо композицій і способів, представлених вище, фахівцю в даній галузі буде зрозуміло, що переважними сполуками для застосування в кожному є такі сполуки, що зазначені вище як переважні. Ще більш переважними сполуками для композицій і способів є сполуки, представлені у прикладах нижче. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Далі в даному документі термін "т. пл." означає точка плавлення, "водн." означає водний, "р. сум." означає реакційна суміш, "к. т." означає кімнатна температура, "DIPEA" означає N,N-діізопропілетиламін, "DIPE" означає діізопропіловий ефір, "THF" означає тетрагідрофуран, "DMF" означає диметилформамід, "DCM" означає дихлорметан, "EtOH" означає етанол, "ЕtOАс" означає етилацетат, "АсОН" означає оцтова кислота, "іРrOН" означає ізопропанол, "іРrNН2" означає ізопропіламін, "MeCN" означає ацетонітрил, "МеОН" означає метанол, "Pd(OAc)2" означає діацетат паладію (II), "рац." означає рацемічний, "насич." означає насичений, "SFC" означає надкритична рідинна хроматографія, "SFC-MS" означає надкритична рідинна хроматографія/мас-спектрометрія, "LC-MS" означає рідинна хроматографія/мас-спектрометрія, "GCMS" означає газова хроматографія/мас-спектрометрія, "HPLC" означає високоефективна рідинна хроматографія, "RP" означає обернено-фазова, "UPLC" означає надефективна рідинна хроматографія, "Rt" означає час утримування (у хвилинах), "[М+Н]+" означає протонована маса вільної основи сполуки, "DAST" означає трифторид діетиламіносірки, "DMTMM" означає 4-(4,6диметокси-1,3,5-триазин-2-іл)-4-метилморфолінію хлорид, "HATU" означає О-(1азабензотриазол-1-іл)-N,N,N',N'-тетраметилуронію гексафторофосфат, "Xantphos" означає (9,9диметил-9Н-ксантен-4,5-діїл)біс[дифенілфосфін], "ТВАТ" означає трифенілдифторсилікат тетрабутиламонію, "TFA" означає трифтороцтова кислота, "Et2O" діетиловий ефір, "DMSO" означає диметилсульфоксид, "MeCN" означає ацетонітрил. Для ключових проміжних сполук, як і для деяких кінцевих сполук, абсолютну конфігурацію хіральних центрів (позначена як R та/або S) встановлювали за допомогою порівняння із зразками з визначеною конфігурацією або шляхом використання аналітичних технік, придатних для визначення абсолютної конфігурації, таких як VCD (вібраційний круговий дихроїзм) або рентгеноструктурна кристалографія. Якщо абсолютна конфігурація хірального центру не відома, його довільно позначають R*. А. Отримання проміжних сполук Приклад А1 Отримання проміжної сполуки 1 40 45 Триметилсилілціанід (30,7 мл, 230 ммоль) додавали до перемішаного розчину 5-бром-2фторацетофенону (25 г, 115 ммоль) и NH4CI (18,5 г, 345 ммоль) в NН3/МеОН (150 мл). Суміш перемішували при кімнатній температурі протягом 3 днів. Потім розчинник випарювали in vacuo і залишок поглинали ЕtOАс (80 мл). Тверду речовину фільтрували і фільтрат випарювали in vacuo з отриманням проміжної сполуки 1 (кількісний вихід 27,9 г), яку використовували на наступному етапі без додаткового очищення. Приклад А2 Отримання проміжної сполуки 2 50 10 UA 111749 C2 5 Проміжну сполуку 1 (27 г, 111 ммоль) розчиняли в НСl (37 % в Н2О) (130 мл) і оцтовій кислоті (130 мл) і суміш нагрівали зі зворотним холодильником протягом 16 годин. Після охолодження до кімнатної температури суміш концентрували in vacua. Додавали воду і водний шар екстрагували за допомогою ЕtOАс. Водний шар олужнювали водн. розчином NaOH (25 %) до рН 7. Водний шар частково концентрували in vacuo. Суміш охолоджували в крижаній бані та осад відфільтровували, промивали водою, а потім Еt2О і висушували in vacuo з отриманням проміжної сполуки 2 (18 г, вихід 62 %) у вигляді білої твердої речовини. Приклад A3 Отримання проміжної сполуки 3 10 15 20 25 Проміжна сполука 2 (15 г, 57,2 ммоль) розчиняли в МеОН (300 мл). Додавали H2SO4 (330 мл) та реакційну суміш нагрівали зі зворотним холодильником протягом 48 год. Концентрували р. сум. in vacuo. Додавали воду і олужнювали розчин до рН 8 за допомогою насич. води, розчину NHCO3. Водний шар екстрагували за допомогою ЕtOАс. Відділяли органічний шар, сушили (MgSO4), фільтрували і концентрували in vacuo з отриманням проміжної сполуки 3 (15 г, вихід 95 %). Приклад А4 Отримання проміжної сполуки 4 Проміжну сполуку 3 (10 г) розділяли на відповідні енантіомери за допомогою препаративної SFC на (Chiralpak® Daicel AD 30 X 250 мм). Рухлива фаза (СО2, МеОН з 0,2 % іРrNН2) з отриманням проміжної сполуки 4 (4,2 г, вихід 42 %). aD: -10,1° (365 нм, з 0,762 ваг./об. %, МеОН, 20 °C). Приклад А5 Отримання проміжної сполуки 5 30 35 Додавали THF (150 мл) до розчину проміжної сполуки 4 (40 г, 145 ммоль) NaOH (1M в Н2О, 360 мл). Суміш перемішували при к. т. протягом 4 годин. Суміш концентрували in vacuo з отриманням проміжної сполуки 5 (42 г) у вигляді білої твердої речовини, яку використовували без додаткового очищення на наступному етапі реакції. Приклад А6 Отримання проміжної сполуки 6 40 11 UA 111749 C2 5 До охолодженого розчину проміжної сполуки 5 (41,3 г, 145 ммоль) в Н2О (150 мл), додавали по краплях розчин хлорацетилхлориду (24 мл, 304,5 ммоль) у 1,4-діоксані (75 мл). Одночасно додавали NaOH (5М в Н2О, 29 мл) для доведення рН до 10-11. Органічний шар відокремлювали і водний шар екстрагували за допомогою Еt2О. Далі водний шар підкислювали НС1 (6М в Н 2О) до рН 2. Осаджену білу тверду речовину збирали шляхом фільтрації, промивали Н2О і висушували з отриманням проміжної сполуки 6 (42 г, вихід 86 %). Приклад А7 Отримання проміжної сполуки 7 10 15 Проміжну сполуку 6 (42 г, 124 ммоль) і NаНСО3 (20,8 г, 248 ммоль) розчиняли в DMF (1000 мл) та реакційну суміш перемішували при 80 °C протягом 3 годин. Суміш частково концентрували при зниженому тиску, охолоджували до к. т. і потім фільтрували через діатомову землю. Фільтрат концентрували in vacuo і залишок очищали за допомогою колонкової флешхроматографії (силікагель; елюент: MeOH/DCM від 0/100 до 5/95). Необхідні фракції збирали і концентрували in vacuo з отриманням проміжної сполуки 7 (36 г, вихід 96 %). Приклад А8 Отримання проміжної сполуки 8 20 25 30 35 40 До розчину проміжної сполуки 7 (11,6 г, 38,5 ммоль) в THF (117 мл) додавали ТВАТ (2,08 г, 3,85 ммоль). Потім (трифторметил)триметилсилан (12,5 мл, 84,6 ммоль) додавали по краплях і р. сум. перемішували при к. т. протягом 20 хвилин. Суміш гасили водним NaCl та екстрагували за допомогою ЕtOАс. Об'єднані органічні шари сушили (MgSO4), фільтрували і концентрували in vacuo з отриманням проміжної сполуки 8 (14 г, вихід 98 %) у вигляді суміші цис- і транс-ізомерів, яку без додаткового очищення використовували на наступному етапі. Приклад А9 Отримання проміжної сполуки 9 Проміжну сполуку 8 (14 г, 37,6 ммоль) розчиняли в DCM (600 мл) і охолоджували до 0 °C. Потім по краплях додавали тіонілхлорид (11,2 мл, 150 ммоль). Реакційну суміш перемішували протягом 30 хв. при 0 °C і потім додавали піридин (18,2 мл, 225,7 ммоль). Через 30 хвилин реакційну суміш піддавали гідролізу водним розчином IN HC1 і потім екстрагували за допомогою DCM. Органічні шари розділяли, сушили (MgSO4), фільтрували і випарювали in vacuo. Неочищений продукт очищали за допомогою колонкової флеш-хроматографії (силікагель; елюент: 7М розчин аміаку у метанолі/DCM від 0/100 до 2/98). Необхідні фракції збирали і концентрували in vacuo з отриманням проміжної сполуки 9 (6 г, вихід 41 %, суміш діастереоізомерів). 12 UA 111749 C2 Приклад Α 10 Отримання проміжної сполуки 10 5 10 Проміжну сполуку 9 (7 г, 17,9 ммоль) і цинк-мідну пару (8,55 г, 66,3 ммоль) перемішували в оцтовій кислоті (420 мл) при к. т. протягом 16 годин. Реакційну суміш фільтрували, промивали DCM і концентрували in vacuo. Додавали розчин гідроксиду амонію (28 % у воді) і DCM і суміш перемішували при к. т. протягом 1 год. Органічний шар відокремлювали і водний шар екстрагували за допомогою DCM. Об'єднані органічні шари сушили (MgSO4), фільтрували і випарювали in vacuo з отриманням проміжної сполуки 10 (6 г, вихід 99 %) у вигляді білого порошку. Приклад А11 Отримання проміжної сполуки 11 15 20 Додавали P2S5 (5,95 г, 26,8 ммоль) до розчину проміжної сполуки 10 (6 г, 17,9 ммоль) в THF (145 мл) при кімнатній температурі. Реакційну суміш перемішували при 70 °C протягом 90 хвилин. Потім суміш охолоджували до к. т., відфільтровували та органічні розчинники випарювали in vacuo з отриманням проміжної сполуки 11 (5,9 г), яку використовували без додаткового очищення на наступному етапі. Приклад А12 Отримання проміжної сполуки 12 25 30 Проміжну сполуку 11 (5,9 г, 16,8 ммоль) розчиняли в 7N аміаку в МеОН (390 мл) та реакційну суміш перемішували при 80 °C протягом 2 годин. Розчинник випарювали і неочищений продукт очищали за допомогою колонкової хроматографії (силікагель; елюент: 7 Μ розчин аміаку у метанолі/DCM від 0/100 до 5/95). Необхідні фракції збирали і концентрували in vacuo з отриманням проміжної сполуки 12 (4,04 г, вихід 72 %). Приклад А13 Отримання проміжної сполуки 13 35 13 UA 111749 C2 5 10 Проміжну сполуку 12 (3,6 г, 10,7 ммоль) об'єднували з NaN3 (1,75 г, 26,9 ммоль), Cul (2,56 г, 13,4 ммоль) і Na2CO3 (2,28 г, 21,5 ммоль) в DMSO (153 мл) та реакційну суміш дегазували. Після цього додавали Ν,Ν'-диметилетилендіамін (2 мл, 18,8 ммоль) і суміш нагрівали при 110 °C приблизно протягом 3 годин до завершення реакції. Реакційну суміш концентрували in vacuo. Додавали 7N аміак у МеОН і суміш перемішували протягом ночі. Утворений осад відфільтровували і фільтрат концентрували in vacuo. Неочищений продукт очищали за допомогою колонкової хроматографії (силікагель; елюент: 7 Μ розчин аміаку у метанолі/DCM від 0/100 до 30/70). Необхідні фракції збирали і концентрували in vacuo з отриманням проміжної сполуки 13 (1,52 г, вихід 52 %). Приклад А14 Отримання проміжної сполуки 14 15 20 25 Розчиняли 5-метоксипіразин-2-карбонову кислоту (0,218 г, 1,42 ммоль) в МеОН (30 мл) і додавали DMTMM (0,456 г, 1,548 ммоль). Після перемішування суміші протягом 5 хвилин додавали розчин проміжної сполуки 13 (0,35 г, 1,29 ммоль) в МеОН (20 мл) при 0 °C, а потім перемішували суміш протягом 16 год. при кімнатній температурі. Розчинник випарювали in vacuo. Неочищений матеріал очищали за допомогою колонкової флеш-хроматографії (силікагель; елюент: 7М розчин аміаку у метанолі/DCM від 0/100 до 5/95). Необхідні фракції збирали і концентрували in vacuo. Залишок суспендували з DIPE/гептанів, фільтрували і висушували у високому вакуумі з отриманням проміжної сполуки 14 (0,266 г, вихід 51 %) у вигляді білої твердої речовини. Приклад А15 Отримання проміжної сполуки 15 30 35 Проміжну сполуку 15 синтезували згідно з тим же підходом, який описаний у прикладі А14. Починаючи з проміжної сполуки 13 (0,35 г, 1,29 ммоль), проміжну сполуку 15 отримували у вигляді білої твердої речовини (0,362 г, вихід 71 %). Приклад А16 Отримання проміжної сполуки 16 14 UA 111749 C2 5 10 15 20 25 30 1-(5-бром-2-фтор-феніл)етанон [(CAS 198477-89-3), 70 г, 322 ммоль) і оксид селену (71,6 г, 645 ммоль) розчиняли в піридині (520 мл). Реакційну суміш перемішували при 100 °C протягом 2 годин. Розчинник випарювали і додавали водний IN розчин НС1. Водний шар екстрагували за допомогою ЕtOАс. Об'єднані органічні шари сушили (Mg2SO4), фільтрували і концентрували in vacuo з отриманням проміжної сполуки 16 (62 г, вихід 78 %), яку використовували в неочищеному вигляді в наступній реакції. Приклад А17 Отримання проміжної сполуки 17 Хлорид тіонілу (37 мл, 510 ммоль) додавали по краплях до перемішаного розчину проміжної сполуки 16 (42 г, 170 ммоль) в МеОН (456 мл) при 0 °C. Суміш нагрівали зі зворотним холодильником протягом 18 годин. Розчинник випарювали in vacuo і залишок розділяли між насиченим Nа2СО3 і DCM. Органічний шар відокремлювали, сушили (Mg2SO4), фільтрували і концентрували in vacuo з отриманням проміжної сполуки 17 (30 г, вихід 68 %) у вигляді жовтого масла. Приклад А18 Отримання проміжної сполуки 18 Ізопропоксид титану(ІУ) (153 мл, 522 ммоль) додавали до перемішаної суміші проміжної сполуки 17 (68 г, 261 ммоль) та (5)-2-метил-2-пропансульфінаміду (37,9 г, 313 ммоль) в нгептані (1000 мл). Суміш перемішували при 80 °C протягом 1,5 години. Суміш охолоджували до к. т. і додавали крижану воду. Отриману в результаті суміш фільтрували через прокладку з діатомової землі і промивали н-гептаном. Водний шар екстрагували за допомогою EtOAc. Об'єднані органічні шари сушили (MgSO4), фільтрували і концентрували in vacuo з отриманням проміжної сполуки 18 (87,9 г, вихід 86 %), яку використовували без додаткового очищення в наступній реакції. Приклад А19 Отримання проміжної сполуки 19 35 15 UA 111749 C2 5 10 15 20 Бромід етилмагнію (ЗМ, 86 мл, 259 ммоль) по краплях додавали до перемішаного розчину проміжної сполуки 18 (72,6 г, 185 ммоль) в DCM (1154 мл) при -78 °C в атмосфері азоту. Суміш перемішували при даній температурі протягом 30 хв., а потім гасили реакцію шляхом додавання насич. водн. розчину NH4CI з подальшим додаванням води. Суміш екстрагували за допомогою DCM і промивали водою. Органічний шар відокремлювали, сушили (MgSU4), фільтрували і випарювали розчинники in vacuo. Неочищений продукт очищали за допомогою колонкової флеш-хроматографії (силікагель; елюент: гептани/EtOAc від 90/10 до 70/30). Необхідні фракції збирали і концентрували in vacuo з отриманням проміжної сполуки 19 (25,56 г, вихід 33 %) у вигляді жовтого масла. Приклад А20 Отримання проміжної сполуки 20 2М водн. розчин NaOH (91 мл, 181,8 ммоль) додавали до розчину неочищеної проміжної сполуки 19 (25,6 г, 60,6 ммоль) в МеОН (68 мл). Отриману в результаті суміш перемішували при нагріванні зі зворотним холодильником протягом 5 годин. Суміш охолоджували до к. т. і потім розділяли між водою і ЕЮ Ас. Водний шар відокремлювали і нейтралізували шляхом додавання 1М водн. розчину НС1, а потім екстрагували за допомогою DCM. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і випарювали розчинники in vacuo. Залишок суспендували з DIPE і осад відфільтровували і сушили in vacuo з отриманням проміжної сполуки 20 (17,5 г, вихід 76 %, суміш діастереомерів) у вигляді білої твердої речовини. Приклад А21 Отримання проміжної сполуки 21 25 30 Проміжну сполуку 20 (17,5 г, 46 ммоль) перемішували в 4М розчині НС1 в діоксані (46 мл) при кімнатній температурі протягом 15 хв. До отриманої в результаті суспензії додавали DIPE і осад відфільтровували і висушували in vacuo з отриманням проміжної сполуки 21 (15,1 г, кільк. вихід, рацемат) у вигляді білої твердої речовини. Приклад А22 Отримання проміжної сполуки 22 35 40 До охолодженого розчину проміжної сполуки 21 (15,1 г, 43,2 ммоль) і DIPEA (35 мл, 203,7 ммоль) в DCM (350 мл) додавали по краплях хлорацетилхлорид (5,6 мл, 70,6 ммоль) при 0 °C. Після перемішування при 0 °C протягом 15 хвилин реакційну суміш нагрівали до к. т. і підкислювали НС1 (2М в Н2О, 10 мл). Суміш екстрагували за допомогою ЕtOАс і промивали сольовим розчином. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і випарювали розчинники in vacuo. Неочищений продукт розтирали з DIPE і осад відфільтровували і висушували in vacuo з отриманням проміжної сполуки 22 (8,04 г, вихід 53 %) у вигляді коричневої твердої речовини. 16 UA 111749 C2 Приклад А23 Отримання проміжної сполуки 23 5 10 15 Проміжну сполуку 23 синтезували згідно з тим же підходом, який описаний у прикладі 7. Починаючи з проміжної сполуки 22 (8 г, 22,69 ммоль), проміжну сполуку 23 отримували у вигляді білої твердої речовини (4,5 г, вихід 63 %). Приклад А24 Отримання проміжної сполуки 24 Проміжну сполуку 24 синтезували згідно з тим же підходом, який описано в прикладі 8. Починаючи з проміжної сполуки 23 (2,34 г, 7,4 ммоль), проміжну сполуку 24 отримували у вигляді масла (1,9 г, вихід 66 %). Приклад А25 Отримання проміжної сполуки 25 20 25 Проміжну сполуку 25 синтезували згідно з тим же підходом, який описаний у прикладі 9. Починаючи з проміжної сполуки 24 (1,9 г, 4,92 ммоль), проміжну сполуку 25 отримували у вигляді блідо-жовтої твердої речовини (1,58 г, вихід 79 %). Приклад А26 Отримання проміжної сполуки 26 17 UA 111749 C2 5 10 Проміжну сполуку 25 (1,4 г, 3,46 ммоль) перемішували в оцтовій кислоті (42 мл) при 100 °C протягом 5 хвилин. Додавали цинк (0,91 г, 13,8 ммоль) і суміш перемішували при 100 °C протягом 1 год. Додатковий цинк (0,452 г, 6,9 ммоль) додавали і далі суміш перемішували при 100 °C. Через ще одну годину додавали нову порцію цинку (0,226 г, 3,46 ммоль) і суміш перемішували при 100 °C протягом 2 год. І нарешті, додатково додавали цинк (0,91 г, 13,8 ммоль) і суміш перемішували при 100 °C протягом 1 год. Після охолодження реакційну суміш фільтрували, промивали DCM і концентрували in vacuo. Додавали розчин гідроксиду амонію (28 % у воді), водн. насич. розчин NaHCO3 і воду. Водний шар екстрагували за допомогою DCM. Об'єднані органічні шари сушили (MgSO4), фільтрували і випарювали in vacuo з отриманням проміжної сполуки 26 (1,26 г, вихід 98 %) у вигляді твердої білої речовини. Приклад А27 Отримання проміжної сполуки 27 15 20 25 30 Проміжну сполуку 27 синтезували згідно з тим же підходом, який описаний у прикладі 11. Починаючи з проміжної сполуки 26 (1,26 г, 3,4 ммоль), проміжну сполуку 27 отримували у вигляді білої твердої речовини (1,09 г, вихід 83 %). Приклад А28 Отримання проміжної сполуки 28 і проміжної сполуки 29 Проміжну сполуку 27 (1 г, 2.59 ммоль) розчиняли в 7N аміаку в МеОН (60 мл) та реакційну суміш перемішували при 130 °C протягом 15 хвилин в мікрохвильовому випромінюванні. Реакційну суміш концентрували in vacua і додавали нову порцію 7N аміаку в МеОН (30 мл). Реакційну суміш перемішували при 130 °C протягом ще 15 хвилин під мікрохвильовим випромінюванням. Розчинник випарювали і неочищений продукт очищали за допомогою колонкової хроматографії (силікагель; елюент: 7М розчин аміаку у метанолі/DCM від 0/100 до 2/98). Необхідні фракції збирали і концентрували in vacuo з отриманням проміжної сполуки 28 (0,29 г. вихід 30 %, цис-рацемат) у вигляді білої твердої речовини і проміжної сполуки 29 (0,27 г, вихід 30 %) у вигляді масла. Приклад А29 Отримання проміжної сполуки 30 35 18 UA 111749 C2 5 Проміжну сполуку 30 синтезували згідно з тим же підходом, який описаний у прикладі 13. Починаючи з проміжної сполуки 29 (0,189 г, 0,542 ммоль), проміжну сполуку 30 отримували у вигляді масла (0,16 г), яку використовували без додаткового очищення в наступній реакції. Приклад А30 Отримання проміжної сполуки 31 10 15 20 25 30 35 Проміжну сполуку 31 синтезували згідно з тим же підходом, який описаний у прикладі А14. Починаючи з проміжної сполуки 30 (0,09 г, 0,315 ммоль), проміжну сполуку 31 отримували у вигляді брудно-білої твердої речовини (0,028 г, вихід 21 %). Приклад A31 Отримання проміжної сполуки 32 Проміжну сполуку 12 (0,4 г, 1,194 ммоль), 5-піримідинілборонову кислоту (0,296 г, 2,387 ммоль) і тетракіс(трифенілфосфін) паладій(0) (0,207 г, 0,179 ммоль) розчиняли в суміші 1,4діоксану (18 мл) і водного NaHCO3 (насич. розчин, 8,5 мл). Отриману в результаті суміш продували N2 і потім нагрівали при 70 °C протягом 2 годин. Далі реакційну суміш розбавляли водою і потім екстрагували за допомогою DCM (3х). Об'єднаний органічний шар промивали сольовим розчином, сушили (Na2SO4), фільтрували і випарювали розчинники in vacuo. Неочищений продукт очищали за допомогою колонкової флеш-хроматографії (силікагель, 7М розчин аміаку у метанолі/DCM від 0/100 до 5/95). Необхідні фракції збирали і концентрували in vacuo з отриманням проміжної сполуки 32 (0,3 г, вихід 75 %) у вигляді білої піни. Приклад A32 Отримання проміжної сполуки 33 Починаючи з 3-бромацетофенону (CAS 2142-63-4), проміжну сполуку 33 синтезували згідно з тими ж схемами реакції, які описані для проміжної сполуки 12 в прикладах А1-А12. Приклад A3З Отримання проміжної сполуки 34 19 UA 111749 C2 5 Проміжну сполуку 34 синтезували згідно з тим же підходом, який описаний у прикладі A31. Починаючи з проміжної сполуки 33 (0,31 г, 0,978 ммоль), проміжну сполуку 34 отримували у вигляді білої твердої речовини (0,21 г, вихід 68 %). Приклад A34 Отримання проміжної сполуки 35 10 15 20 25 30 35 Проміжну сполуку 13 (2,78 г, 10,25 ммоль) розчиняли в ЕtOАс (70 мл) і додавали паладій на вугіллі (10 %) (1,09 г) і тіофен (0,4 % розчин в THF, 14 мл). Суміш піддавали гідрогенізації при к. т. і атмосферному тиску протягом 16 годин. Каталізатор відфільтровували і розчинники випарювали in vacuo. Неочищений продукт очищали за допомогою колонкової флеш-хроматографії (силікагель; елюент: 7М розчин аміаку у метанолі/DCM від 0/100 до 10/90). Необхідні фракції збирали і концентрували in vacuo з отриманням проміжної сполуки 35 (0,478 г, вихід 17 %). В. Отримання кінцевих сполук Приклад В1 Отримання сполуки 1: N-{3-[(2R*,3R)-5-аміно-2-(дифторметил)-3-метил-3,6-дигідро-2Н-1,4оксазин-3-іл]-4-фторфеніл}-5-метоксипіразин-2-карбоксаміду Проміжну сполуку 14 (0,154 г, 0,378 ммоль) розчиняли в ЕtOАс (5 мл) і додавали паладій на вугіллі (10 %) (0,04 г, 0,038 ммоль) і тіофен (0,4 % розчин в THF, 0,5 мл, 0,026 ммоль). Суміш піддавали гідрогенізації при к. т. і атмосферному тиску протягом 16 годин. Каталізатор відфільтровували і розчинники випарювали in vacuo. Неочищений продукт очищали за допомогою колонкової флеш-хроматографії (силікагель; елюент: 7М розчин аміаку у метанолі/DCM від 0/100 до 2/98). Необхідні фракції збирали і концентрували in vacuo. Залишок суспендували з DIPE, фільтрували і висушували у високому вакуумі з отриманням сполуки 1 (0,067 г, вихід 43 %). Приклад В2 Отримання сполуки 2: N-{3-[(2R*,3R)-5-аміно-2-(дифторметил)-3-метил-3,6-дигідро-2Н-1,4оксазин-3-іл1-4-фторфеніл}-5-фторпіридин-2-карбоксаміду 20 UA 111749 C2 5 Сполуку 2 синтезували згідно з тим же підходом, який описаний у прикладі В Починаючи з проміжної сполуки 15 (0,251 г, 0,0637 ммоль), сполуку 2 отримували у вигляді білої твердої речовини (0,114 г, вихід 45 %). Приклад ВЗ Отримання сполуки 3: цис-рац-N-{3-[5-аміно-2-(дифторметил)-3-етил-3,6- дигідро-2Н-1,4оксазин-3-іл]-4-фторфеніл}-5-метоксипіразин-2-карбоксаміду 10 15 20 25 Проміжну сполуку 31 (0,028 г, 0,066 ммоль) розчиняли в МеОН (1,3 мл) і піддавали гідрогенізації в реакторі H-cube (1 мл/хв., 10 % Pd/C картридж, повний Н2 режим), спершу при 25 °C, потім при 50 °C і нарешті при 80 °C. Розчинник випарювали in vacuo. Неочищений продукт випарювали за допомогою препаративної HPLC (С18 XBridge 19 X 100 5 мкм), рухлива фаза (градієнт від 80 % 0,1 % NH4CO3H/NH4OH, рН 9, розчин у воді, 20 % CH3CN до 0 % 0,1 % NH4CO3H/NH4OH, рН 9, розчин у воді, 100 % CH3CN). Необхідні фракції збирали і концентрували in vacuo з отриманням сполуки 3 (0,0032 г, вихід 11 %). Приклад В4 Отримання сполуки 4: (5R, 6R*)-6-(дифторметил)-5-(2-фтор-5-піримідин-5- ілфеніл)-5 метил-5,6-дигідро-2Н-1,4-оксазин-3 –аміну Сполуку 4 синтезували згідно з тим же підходом, який описаний у прикладі В1. Починаючи з проміжної сполуки 32 (0,155 г, 0,464 ммоль), отримували сполуку 4 (0,018 г, вихід 12 %). Приклад В5 Отримання сполуки 5: (5R, 6R*)-6-(дифторметші)-5-метил-5-(3-піримідин-5- ілфеніл)-5.6дигідро-2Н-1,4-оксазин-3 –аміну 30 35 Сполуку 5 синтезували згідно з тим же підходом, який описаний у прикладі В1. Починаючи з проміжної сполуки 34 (0,124 г, 0,392 ммоль), сполуку 5 отримували у вигляді білої твердої речовини (0,04 г, вихід 32 %). Приклад В6 Отримання сполуки 6: N-{3-[(2R*,3R)-5-амщо-2-(дифторметил)-3-метил-3,6- дигідро-2Н-1,4оксазин-3-іл]-4-фторфеніл}-5-хлорпіридин-2-карбоксаміду 21 UA 111749 C2 5 10 5-хлорпіридин-2-карбонову кислоту (63 мг, 0,4 ммоль) розчиняли в МеОН (7 мл) і додавали DMTMM (129 мг, 0,44 ммоль). Після перемішування суміші протягом 5 хвилин додавали розчин проміжної сполуки 35 (100 мг, 0,366 ммоль) в МеОН (8 мл) при 0 °C і перемішували суміш протягом 16 год. при кімнатній температурі. Розчинник випарювали in vacuo. Неочищений матеріал очищали за допомогою колонкової флеш-хроматографії (силікагель; елюент: 7М розчин аміаку у метанолі/DCM від 0/100 до 5/95). Необхідні фракції збирали і концентрували in vacuo. Залишок розтирали з DIPE, фільтрували і висушували у високому вакуумі з отриманням сполуки 6 (0,116 г, вихід 74 %) у вигляді білої твердої речовини. Приклад В7 Отримання сполуки 7: N-{3-[(2R*,3R-5-аміно-2-(дифторметил)-3-метил-3,6- дигідро-2Н-1,4оксазин-3-іл]-4-фторфеніл}-5-ціанопіридин-2-карбоксаміду 15 20 Сполуку 7 синтезували згідно з тим же підходом, який описаний у прикладі В6. Прочинаючи з проміжної сполуки 35 (100 мг, 0,4 ммоль), отримували сполуку 7 (110 мг, вихід 75%). Сполуки 1-7 в таблиці 1 являють собою сполуки, отримані згідно з одним із перелічених вище прикладів. "Прикл. №" відноситься до номеру прикладу, згідно з протоколом якого синтезували сполуку. "№ спол." означає номер сполуки С 2(R*) позначає, що абсолютна конфігурація при С2 є або R, але поки невідома. 22 UA 111749 C2 5 10 15 20 25 С. Аналітична частина LCMS Для дослідження сполук за даним винаходом за допомогою (LC)MS застосовували наступні способи. Спосіб 1 Вимірювання за допомогою LC виконували з використанням системи Acquity UPLC (Waters), що включає насос для двокомпонентних сумішей, дозатор, нагрівач колонки (встановлений на 55 °C), діодно-матричний детектор (DAD) і колонку, як визначено у відповідних способах нижче. Потік з колонки розділявся для MS-спектрометра. MS-детектор був оснащений джерелом іонізації електророзпиленням. Мас-спектри отримували скануванням від 100 до 1000 за 0,18 секунди з використанням часу витримки 0,02 секунди. Напруга капілярної голки становила 3,5 кВ, і температуру джерела підтримували при 140 °C. В якості газа-розпилювача застосовували азот. Збір і обробку даних проводили за допомогою системи обробки даних Waters-Micromass MassLynx-Openlynx. Обернено-фазову UPLC (надпродуктивну рідинну хроматографію) проводили на колонці СІ8 з містковим гібридом етилсилоксан/діоксид кремнію (ВЕН) (1,7 мкм, 2,1 × 50 mm; Waters Acquity) зі швидкістю потоку 0,8 мл/хв. Дві рухливі фази (10 мМ ацетату амонію в Н 2О/ацетонітрилі 95/5; рухлива фаза В: ацетонітрил) застосовували для дотримання умови градієнта від 95 % А і 5 % В до 5 % А і 95 % В за 1,3 хвилини при утриманні протягом 0,7 хвилини. Використовуваний об'єм введеної проби становив 0,75 мкл. Напруга на конусі становила 10 В для способу позитивної іонізації і 20 В для способу негативної іонізації. Спосіб 2 23 UA 111749 C2 5 10 15 20 25 30 35 40 Вимірювання за допомогою UPLC (надефективної рідинної хроматографії) проводили із застосуванням системи Acquity UPLC (Waters), що включає дозатор, насос для двокомпонентних сумішей з дегазатором, чотирьохколонковий термостат, діодно-матричний детектор (DAD) і колонку, як визначено у відповідних способах. MS-детектор був оснащений подвійним джерелом іонізації ESCI (іонізація електророзпиленням в поєднанні з хімічною іонізацією при атмосферному тиску). В якості газа-розпилювача застосовували азот. Температуру джерела підтримували при 140 °C. Збір і обробку даних проводили за допомогою програмного забезпечення MassLynx-Openlynx. Обернено-фазову UPLC (надефективну рідинну хроматографію) проводили на RRHD Eclipse Plus-C18 (1,8 мкм, 2,1 × 50 мм) від Agilent зі швидкістю потоку 1.0 мл/хв.. при 50 °C без розподілу для MS-детектора. Застосовували наступні умови градієнта: від 95 % А (0,5 г/л розчину ацетату амонію + 5 % ацетонітрилу), 5 % В (ацетонітрилу) до 40 % А, 60 % В за 3,8 хвилини, до 5 % А, 95 % В за 4,6 хвилини, утримування 5,0 хвилин. Об'єм введеної проби 2 мкл. Мас-спектри низького розділення (одноквадрупольний SQD-детектор) отримували скануванням від 100 до 1000 за 0,1 секунди із застосуванням міжканальної затримки 0,08 секунди. Напруга капілярної голки становила 3 кВ. Напруга на конусі становила 25 В для режиму позитивної іонізації і 30 В для режиму негативної іонізації. Спосіб 3 Вимірювання за допомогою LC здійснювали із застосуванням системи Acquity UPLC (Waters), що включає насос для двокомпонентних сумішей, дозатор, нагрівач колонки (встановлений на 55 °C), діодно-матричний детектор (DAD) і колонку, як визначено у відповідних способах нижче. Потік з колонки розподілявся для MS-спектрометра. MS-детектор був оснащений джерелом іонізації електророзпиленням. Мас-спектри отримували скануванням від 100 до 1000 за 0,18 секунди з використанням часу витримки 0,02 секунди. Напруга капілярної голки становила 3,5 кВ, і температуру джерела підтримували при 140 °C. В якості газа-розпилювача застосовували азот. Збір і обробку даних проводили за допомогою системи обробки даних Waters-Micromass MassLynx-Openlynx. Обернено-фазову UPLC (надефективну рідинну хроматографію) проводили на колонці СІ8 з містковим гібридом етилсилоксан/діоксид кремнію (ВЕН) (1,7 мкм, 2.1 × 50 mm; Waters Acquity) зі швидкістю потоку 0,8 мл/хв. Дві рухливі фази (10 мМ ацетату амонію в Н 2О/ацетонітрилі 95/5; рухлива фаза В: ацетонітрил) застосовували для дотримання умови градієнта від 95 % А і 5 % В до 5 % А і 95 % В за 1,3 хвилини при утриманні протягом 0,3 хвилини. Використовуваний об'єм введеної проби становив 0,5 мкл. Напруга на конусі становила 10 В для режиму позитивної іонізації і 20 В для режиму негативної іонізації. Точки плавлення Значення являють собою або пікові значення, або діапазони плавлення, та їх отримували з погрішностями експерименту, які зазвичай пов'язані з цим аналітичним способом. DSC823e (зазначений DSC в таблиці 2) Для ряду сполук визначали точки плавлення за допомогою DSC823e (Mettler-Toledo). Точки плавлення вимірювали з градієнтом температури 30 °C/хвилину. Максимальна температура становила 400 °C. + Таблиця 2: дані аналізу - Rt означає час утримання (в хвилинах), [М+Н] означає протоновану масу сполуки, причому спосіб відноситься до способу, який застосовували для (LC)MS 45 Таблиця 2: № спол. 1 2 3 4 5 6 7 Rt 0,75 0,76 1,98 0,59 0,55 0,89 0,87 + [М+Н] 410 397 424 337 319 413 404 Спосіб 1 1 2 1 1 3 3 н. в. означає не визначали Оптичні обертання 24 Точка плавлення 227,3 °C 205,7 °C н.в. н.в. н.в. 203,9 °C 230,9 °C UA 111749 C2 Оптичні обертання вимірювали на поляриметрі Perkin-Elmer 341 з натрієвою лампою і t°С представляли наступним чином: [α]λ (с г/100 мл, розчинник). Таблиця 3: дані аналізу чистих сполук - значення оптичного обертання для енантіомерно № спол. 5 10 Довжина хвилі (нм) 365 589 Концентрація ваг./об. % 0,205 0,27 Розчин ник Темп. (°С) 2 +121,95 DMF 20 7 +11,85 DMF 20 ЯМР 1 Для ряду сполук спектри H ЯМР реєстрували на спектрометрі Bruker DPX-360, на спектрометрі Bruker DPX-400 або на спектрометрі Bruker Avance 600 зі стандартними послідовностями імпульсів, що діють при 360 МГц, 400 МГц і 600 МГц, відповідно, з використанням хлороформу-d (дейтерованого хлороформу, CDCb) або DMSO-d6 (дейтерованого DMSO, диметил-d6 сульфоксиду) в якості розчинників. Хімічні зрушення (δ) реєстрували в частинах на мільйон (ррm) щодо тетраметилсилану (TMS), який використовували в якості внутрішнього стандарту. 25 UA 111749 C2 5 10 15 D. Фармакологічні приклади Сполуки, представлені в даному винаході, є інгібіторами ферменту 1, що розщеплює АРР по бета-сайту (ВАСЕ1). Вважають, що інгібування ВАСЕ1, аспарагінової протеази, є суттєвим для лікування хвороби Альцгеймера (AD). Вважають, що продукування і накопичення бетаамілоїдних пептидів (Abeta) з білка-попередника бета-амілоїду (АРР) відіграє ключову роль у виникненні та прогресуванні AD. Abeta утворюється з білка-попередника амілоїду (АРР) шляхом послідовного розщеплення по N- і С-кінцям Abeta-домену за допомогою бета-секретази і гаммасекретази, відповідно. Передбачається, що сполуки формули (І) діють головним чином на ВАСЕ1 в силу своєї здатності інгібувати ферментативну активність. Поведінка таких інгібіторів, яких тестували за допомогою біохімічного аналізу на основі резонансного переносу енергії флуоресценції (FRET) і клітинного аналізу "aLisa" на клітинах SKNBE2, які описані нижче, і які є придатними для виявлення таких сполук і, зокрема, сполук згідно з формулою (І), показана у таблиці 5 та таблиці 6. 26 UA 111749 C2 5 10 15 20 25 30 Біохімічний аналіз на основі FRET Даний аналіз заснований на резонансному перенесенні енергії флуоресценції (FRET). Субстратом для цього аналізу є утворений з АРР 13-амінокислотний пептид, який містить "шведську" мутацію Lys-Met/Asn-Leu сайту розщеплення білка-попередника амілоїду (АРР) бета-секретазою. Цей субстрат також містить два флуорофори: (7-метоксикумарин-4-іл)оцтову кислоту (Мса), яка є донором флуоресценції з довжиною хвилі збудження 320 нм та випромінювання 405 нм, і 2,4-динітрофеніл (Dnp), який є відповідним акцептором-гасителем. Відстань між цими двома групами вибирали так, що при світловому збудженні енергія флуоресценції донора в значній мірі гасилася акцептором за допомогою резонансного перенесення енергії. При розщепленні за допомогою ВАСЕ1 флуорофор Мса відокремлюється від гасильної групи Dnp, відновлюючи повний вихід флуоресценції донора. Збільшення флуоресценції лінійно залежить від ступеня протеолізу. Коротко, в 384-лунковому форматі рекомбінантний білок ВАСЕ1 при кінцевій концентрації 1 мкг/мл інкубували протягом 120 хв. при кімнатній температурі з 10 мкМ субстрату в інкубаційному буфері (40мМ цитратного буферу, рН 5,0, 0,04 % PEG, 4 % DMSO) у відсутності або присутності сполуки. Далі величину протеолізу безпосередньо вимірювали шляхом вимірювання флуоресценції в момент Т=0 і Т=120 (збудження при 320 нм і випромінювання при 405 нм). Результати виражають у RFU (відносних одиницях флуоресценції) як різницю між Τ120 і Т0. Криву найкращого наближення підбирають за допомогою методики суми найменших квадратів для графіка залежності % хв. контролю від концентрації сполуки. З нього можна отримати значення ІС5о (інгібуюча концентрація, що викликає 50 % інгібування активності). LC = медіана значень низького контролю; = низький контроль: реакція без ферменту; НС = медіана значень високого контролю; = високий контроль: реакція з ферментом; % ефекту = 100-[(зразок-ІХ) / (HC-LC) *100]; % контролю = (зразок /НС)*100; % хв. контролю = (зразок-LC) / (HC-LC) *100. Здійснювали тестування наступних сполук, представлених в якості прикладу, головним чином, як описано вище, і вони показали наступну активність. Таблиця 5 № спол. 1 2 3 4 5 6 7 35 40 45 50 Біохімічний аналіз на основі FRET РІС50 7,45 7,45 7,2 6,37 6,34 7,39 7,27 Клітинний аналіз aLisa на клітинах SKNBE2 У двох аналізах aLisa кількісно визначали рівні загального Abeta і Abeta 1-42, продукованих і секретованих в середовище клітин SKNBE2 нейробластоми людини. Аналіз заснований на клітинах SKNBE2 нейробластоми людини, що експресують білок-попередник амілоїду дикого типу (hAPP695). Сполуки розводили і додавали до цих клітин, інкубували протягом 18 годин і потім здійснювали вимірювання кількості Abeta 1-42 і загального Abeta. Кількість загального Abeta і Abeta 1-42 вимірювали за допомогою сендвіч-otLisa. aLisa являє собою сендвіч-аналіз з використанням біотинільованого антитіла AbN/25, пов'язаного з покритими стрептавідином гранулами, або антитіла Ab4G8 або сАb42/26, кон'югованого з гранулами-акцепторами, для визначення загального Abeta і Abeta 1-42, відповідно. У присутності загального Abeta або Abeta 1-42 гранули наближаються одна до одної. Збудження гранул-донорів викликає вивільнення молекул синглетного кисню, що запускає каскад перенесення енергії на гранули-акцептори, що призводить до випромінювання світла. Випромінювання світла вимірювали через 1 годину після інкубування (збудження при 650 нм і випромінювання при 615 нм). Криву найкращого наближення підбирали за допомогою методики суми найменших квадратів для графіка залежності % хв. контролю від концентрації сполуки. З нього можна отримати значення ІС50 (інгібуюча концентрація, що викликає 50 % інгібування активності). 27 UA 111749 C2 5 LC = медіана значень низького контролю; = Низький контроль: клітини, попередньо інкубовані без сполуки, без біотинільованого Аb в αLisa; НС = медіана значень високого контролю; = високий контроль: клітини, попередньо інкубовані без сполуки; % ефекту = 100-[(зразок-ІХ) / (HC-LC) *100]; % контролю = (зразок /НС)*100; % хв. контролю - (зразок-LC) / (HC-LC) * 100. Здійснювали тестування наступних сполук, представлених в якості прикладу, головним чином, як описано вище, і вони показали наступну активність. 10 Таблиця 6 № спол. 1 2 3 4 5 6 7 15 20 25 30 35 40 45 Клітинний аналіз aLisa на клітинах SKNBE2 Abeta 42 рІС50 8,38 8,07 8,38 6,89 6,93 8,48 8,46 Клітинний аналіз aLisa на клітинах SKNBE2 Загальний Abeta pІС50 8,37 8,07 8,43 6,89 6,93 8,47 8,51 Демонстрація ефективності in vivo Засоби, що знижують рівень Αβ-пептиду, за даним винаходом можна застосовувати для лікування AD у ссавців, таких як люди, або, в альтернативному випадку, можуть виявляти ефективність на тваринних моделях, таких як без обмежень миша, щур або морська свинка. У ссавця може бути не виявлено AD, або він може не мати генетичної схильності до AD, але може бути трансгенним таким чином, що у нього надпродукується і в підсумку накопичується Αβ подібно до того, як це спостерігається у людей, уражених AD. Засоби, що знижують рівень Αβ-пептиду, можна вводити в будь-якій стандартній формі за допомогою будь-якого стандартного способу. Наприклад, але без обмежень, засоби, що знижують рівень Αβ-пептиду, можуть бути у формі розчину, пігулок або капсул, які можна приймати перорально або ін'єкційно. Засоби, що знижують рівень Αβ-пептиду, можна вводити в будь-якій дозі, достатній для того, щоб значно знизити рівні Αβ-пептидів у крові, плазмі крові, сироватці крові, цереброспінальній рідині (CSF) або головному мозку. Для того щоб визначити, чи одноразовий прийом засобу, знижуючий рівень Αβ42-пептиду, буде знижувати рівні Αβ-пептиду in vivo, використовували нетрансгенних гризунів, наприклад, мишей або щурів. Тварин, яких піддавали обробці засобом, що знижує рівень Αβ-пептиду, обстежили і порівнювали з тими, яких не піддавали обробці або піддавали обробці наповнювачем, і здійснювали кількісний аналіз рівнів розчинного Αβ42 і загального Αβ в головному мозку за допомогою стандартних методик, наприклад, з використанням ELISA. Періоди обробки варіювали від годин (год.) до днів, та їх коригували на основі результатів зниження рівня Αβ42, як тільки можна було встановити час виникнення ефекту. Представлений стандартний протокол для вимірювання зниження рівня Αβ42 in vivo, але він являє собою лише один з багатьох варіантів, які можна застосовувати для оптимізації рівнів виявленої Αβ. Наприклад, сполуки, що знижують рівень Αβ-пептиду, були складені в 20 % гідроксипропіл-β-циклодекстрині. Засоби, що знижують рівень Αβ-пептиду, вводили в одноразовій дозі перорально (п. о.) або в одноразовій дозі підшкірно (п. ш.) тваринам, яких не годували протягом ночі. Після закінчення певного часу, як правило, 2 або 4 год. (як показано в таблиці 7), тварин умертвляли і досліджували рівні Αβ42. Кров збирали за допомогою декапітації і знекровлення в пробірки для збору зразків, оброблені EDTA. Кров центрифугували при 1900 g протягом 10 хвилин (хв.) при 4 °C і відокремлювали плазму і піддавали швидкому заморожуванню для подальшого дослідження. Головний мозок відокремлювали від черепа і заднього мозку. Відділяли мозочок і розділяли ліву і праву півкулі. Ліву півкулю зберігали при -18 °C для кількісного аналізу рівнів досліджуваних сполук. Праву півкулю промивали буфером на основі забуференого фосфатом сольового розчину (PBS), і моментально заморожували на сухому льоду, і зберігали при -80 °C до гомогенізації для біохімічних аналізів. Головний мозок мишей від нетрансгенних тварин повторно суспендували у 8 обсягах 0,4 % DEA (діетиламіну)/50мМ NaCl, що містять інгібітори протеази (Roche-11873580001 або 28
ДивитисяДодаткова інформація
Назва патенту англійською6-difluoromethyl-5,6-dihydro-2h-[1,4]oxazin-3-amine derivatives
Автори англійськоюTrabanco-Suarez, Andres, Avelino, Gijsen, Henricus, Jacobus, Maria, Surkyn, Michel, Prokopcova, Hana
Автори російськоюТрабанко-Суарэс Андрэс Авэлино, Гийсэн Хэнрикус Якобус Мария, Суркин Мишель, Прокопцова Хана
МПК / Мітки
МПК: C07D 413/10, C07D 413/12, A61P 25/16, A61K 31/5377, A61P 25/28
Мітки: похідні, 6-дифторметил-5,6-дигідро-2н-[1,4]оксазин-3-аміну
Код посилання
<a href="https://ua.patents.su/32-111749-pokhidni-6-diftormetil-56-digidro-2n-14oksazin-3-aminu.html" target="_blank" rel="follow" title="База патентів України">Похідні 6-дифторметил-5,6-дигідро-2н-[1,4]оксазин-3-аміну</a>
Попередній патент: Кришка пластикова однокомпонентна для газованих напоїв
Наступний патент: Пристрій та спосіб нанесення покриття наливом на компоненти у формі панелі
Випадковий патент: Спосіб улаштування збірно-монолітного залізобетонного перекриття












