Похідні піридилу, їх енантіомери, цис- або транс-ізомери і їх солі
Номер патенту: 26976
Опубліковано: 28.02.2000
Автори: СОЙКА Райнер, МЮЛЛЕР Томас, ВЕЙСЕНВЕРГЕР Йоханес
Формула / Реферат
1. Производные пиридила общей формулы (І):
где А - углерод-азотная связь или неразветвленная алкиленовая группа с 1 - 4 атомами углерода,
X - нитрометиленовая группа, цианометиленовая группа, замещенная цианогруппой, аминокарбонилом или алкоксикарбонилом с 1 - 3 атомами углерода в алкоксильной группе, мли группа формулы =N-R7, где R7 означает цианогруппу, алкансульфонил с 1 - 3 атомами углерода, фенилсульфонил, аминосульфонил, аминокарбонил или фенилкарбонил,
Y - алкоксигруппа с 1 - 3 атомами углерода, феноксигруппа, или группа формулы NR8R9, где R8 означает атом водорода, неразветвленную или разветвленную алкильную группу с 1 - 8 атомами углерода, которая во 2-м, 3-м или 4-м положении может быть замещена гидроксигруппой или диалкиламиногруппой с 1 - 3 атомами углерода в каждой алкильной части, замещенную фенилом алкильную группу с 1 - 4 атомами углерода, которая может быть дополнительно замещена гидроксильной группой во 2-м, 3-м или 4-м положении, замещенную пиридилом алкильную группу с 1 - 4 атомами углерода, циклоалкильную группу с 3 - 8 атомами углерода, инданил, норборнил, адамантил, алкоксигруппу с 1 - 3 атомами углерода или триметилсилилалкил с 1 - 3 атомами углерода в алкильной части, a R9 - атом водорода или алкильная группа с 1 - 3 атомами углерода, или R8 и R9 вместе с находящимся между ними атомом азота образуют 1-пиперидинил, незамещенный или замещенный одной или двумя метальными группами или фенилом, морфолиногруппу, 1-пиперазинил, незамещенный или замещенный в 4-м положении фенилом или 1,2,3,4-тетрагидроизохинолин-2-ил,
R1 - атом водорода или алкил с 1 - 3 атомами углерода,
R2 и R3 - атом водорода или вместе образуют углерод-углеродную связь,
Руг - пиридильная группа,
R4 - тетразолил, аминокарбонил, алкиламинокарбонил и диалкиламинокарбонил, каждый с 1 - 3 атомами углерода в алкильных частях, сложноэфирная группа, переводимая in vivo метаболическим путем в карбоксильную группу, или же карбоксил, если Y означает группу NR8R9, где R8 и R9 имеют вышеуказанное значение,
R5 - атом водорода, алкил с 1 - 3 атомами углерода, алкоксил с 1 - 3 атомами углерода или трифторметил,
n - 2, 3, 4, 5,
их энантиомеры, цис- или транс-изомеры, если R2 и R3 вместе означают углерод-углеродную связь, и их фармацевтически приемлемые соли.
2. Производные пиридила общей формулы (I) по п.1, где n, А, X, R1-R5 и Pyr имеют указанные в п.1 значения, a Y означает группу формулы NR8R9 их энантиомеры, цис- или транс-изомеры, если R2 и R3 означают углерод-углеродную связь, и их фармацевтически приемлемые соли.
3. Производные пиридила общей формулы (I) по п.1, где n, А, X, R1-R5 и Pyr имеют указанные в п.1 значения, a Y означает алкоксигруппу с 1 - 3 атомами углерода или феноксигруппу, в качестве промежуточных продуктов для получения производных пиридила общей формулы (I) по п.1, где Y означает группу NR8R9.
4. Производные пиридила общей формулы (I) по п.1, где n, А, X, R1-R5 и Pyr имеют указанные в п.1 значения, a Y означает группу NR8R9, обладающие антитромботической антагонистической в отношении тромбоксана и тормозящей агрегацию тромбоцитов и синтез тромбоксана активностью.
5. Производное пиридила формулы (I) по п.1, представляющее собой 5Е-6-(3-(2-циано-3-трет.бутилгуанидино)фенил)-6-(3-пиридил)-гекс-5-еновую кислоту.
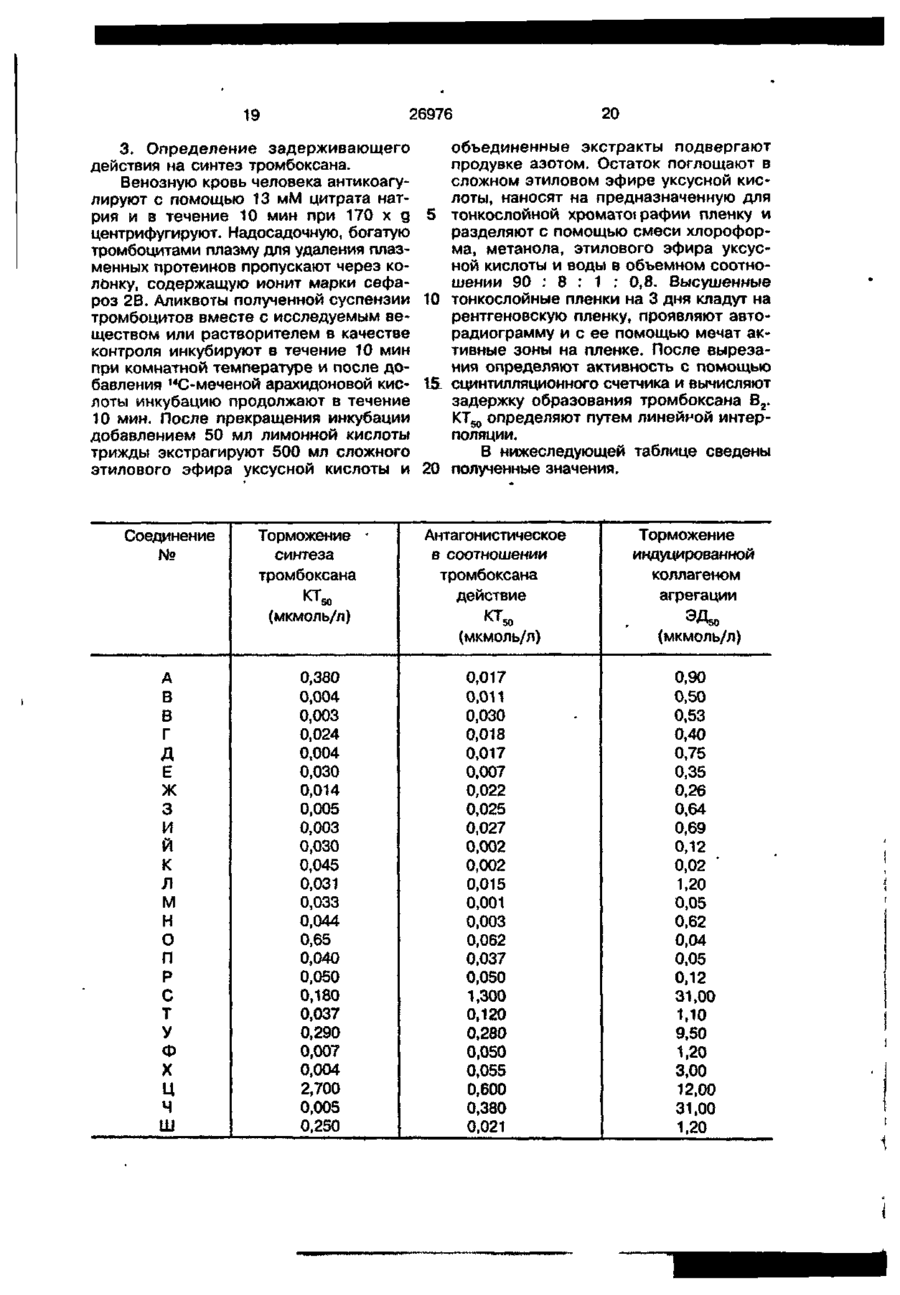
Текст
1. Производные пиридила общей формулы (I): где А - углерод-азотная связь или неразветвленная алкиленовая группа с 1 -4 атомами углерода, X - нитрометиленовая группа, цианометиленовая группа, замещенная цианогруппой, аминокарбонилом или алкоксикарбонилом с 1-3 атомами углерода в алкоксильной группе, мли группа формулы =N-R7, где R7 означает цианогруппу, алкансульфонил с 1 -3 атомами углерода, фенилсульфонил, аминосульфонил, аминокарбонил или фенилкарбонил, Y - алкоксигруппа с 1-3 атомами углерода, феноксигруппа, или группа формулы NReR9, где R8 означает атом водорода, неразветвленную или разветвленную алкильную группу с 1-8 атомами углерода, которая во 2-м, 3-м или 4-м положении может быть замещена гидроксигруппой или диалкиламиногруппой с 1 З атомами углерода в каждой апкильной части, замещенную фенилом алкильную группу с 1-4 атомами углерода, которая может быть дополнительно замещена гидроксильной группой во 2-м, 3-м или 4-м положении, замещенную пиридилом алкильную группу с 1-4 атомами углерода, циклоалкильную группу с 3-8 атомами углерода, инданил, норборнил, адамантил, алкоксигруппу с 1 -3 атомами углерода или триметилсилилалкил с 1-3 атомами углерода в алкильной части, a R9 - атом водорода или алкильная группа с 1 -3 атомами углерода, или R8 и R9 вместе с находящимся между ними атомом азота образуют 1-пиперидинил, незамещенный или замещенный одной или двумя метальными группами или фенилом, морфолиногруппу, 1-пиперазинил, незамещенный или замещенный в 4-м положении фенилом или 1,2,3,4-тетрагидроизохинолин-2-ил, R,- атом водорода или алкил с 1-3 атомами углерода, R2 и R3 - атом водорода или вместе образуют углерод-углеродную связь, Руг - пиридильная группа, R4 - тетразолил, аминокарбонил, алкиламинокарбонил и диалкиламинокарбонил, каждый с 1-3 атомами углерода в алкильных частях, сложноэфирная группа, переводимая in vivo метаболическим путем в карбоксильную группу, или же карбоксил, если Y означает группу NR8R9, где R8 и R9 имеют вышеуказанное значение, R5 - атом водорода, алкил с 1-3 атомами углерода, алкоксил с 1-3 атомами углерода или трифторметил, п - 2, 3, 4, 5, их энантиомеры, цис- или транс-изомеры, если R2 и R3 вместе означают углерод-углеродную связь, и их фармацевтически приемлемые соли. Q Os ON І О 26976 производных пиридила общей формулы 2. Производные пиридила общей фор0) по п. 1, где Y означает группу NR8R9. мулы (I) по п. 1, где п, А, X, R,-R5 и РУ 4. Производные пиридила общей форимеют указанные в п. 1 значения, a Y мулы (I) по п. 1, где п, А, X, R,-R5 и Руг означает группу формулы NR8R^ их энантиомеры, цис- или транс-изомеры, если 5 имеют указанные в п. 1 значения, a Y означает группу NR8R9, обладающие анR2 и R3 означают углерод-углеродную титромботической антагонистической в отсвязь, и их фармацевтически приемлемые ношении тромбоксана и тормозящей агсоли. регацию тромбоцитов и синтез тромбок3. Производные пиридила общей формулы (I) по п. 1, где п, А, X, Rt-R5 и Руг 10 сана активностью. 5. Производное пиридила формулы (I) имеют указанные в п. 1 значения, a Y по п. 1, представляющее собой 5Е-6-(3означает алкоксигруппу с 1-3 атомами (2-циано-3-трет.бутилгуанидино)фенил)-6углерода или феноксигруппу, в качестве (3-пиридил)-гекс-5-еновую кислоту. промежуточных продуктов для получения 15 Изобретение относится к химическим веществам, обладающим ценными свойствами, в частности к производным пиридила общей формулы (I) 25 -N—Aс=ЛІ—CH—(CH 2 X-R, 30 Pyt где п - число 2, 3, 4 или 5; А - углерод-азотная связь или неразеетвленная алкиленовая группа с 1-4 атомами углерода, незамещенная или замещенная одной или двумя апкильными группами; X - нитрометиленовая группа, цианометиленовая группа, незамещенная или замещенная остатком R6, имеющим указанные ниже для R4 значения за исклю* чением тетразола, или группа формулы =N-R7, где R7 - цианогрупла, алкансульфонильная группа, фенидсульфонильная группа, фенилалкансульфонильная группа, аминосульфонильная группа, алкиламиносульфонильная группа, диалкиламиносульфонильная группа, фенилкарбонильная группа, аминокарбонильная группа, алкиламинокарбонильная группа или диалкиламинокарбонильная группа; У - алкоксигруппа, феноксигруппа, алкилтиогруппа, фенилтиогруппа или группа формулы -RgNR9, где R8 означает атом водорода, неразветвленную или разветвленную алкильную группу с 1-10 атомами углерода, которая во 2-м, 3-м или 4-м положении может быть замещена гидроксифуппой, аминогруппой, алкиламиногруп 35 40 45 50 55 пой или диалкиламиногруппой, замещенная фенильной группой или пиридильной группой алкильная группа с 1 -4 атомами углерода, которая может быть дополнительно замещена гидроксильной группой во 2-м,3-м или 4-м положении, циклоалкильная группа с 3 или 4 атомами углерода, циклоалкильная группа с 5-8 атомами углерода, в которой один этиленовый мостик может быть заменен о-фениленовой группой, бициклоалкильная группа с 6-8 атомами углерода, незамещенная или замещенная 1, 2 или 3 алкильными группами, адамантильная группа, алкоксигруппа или триметилсилилалкильная группа, a R9 - атом водорода или неразветвленная алкильная группа или R8 и R9 вместе с находящимся между ними атомом азота образуют незамещенную или замещенную одной или двумя ал кильными группами или фенильной группой циклическую алкилениминогруппу с 4-6 атомами углерода, в которой один этиленовый мостик в положениях 3, 4 может быть заменен на о-фениленовую группу, морфолиногруппу или пиперазиногруппу, незамещенную или замещенную в 4-м положении алкильной группой с 1-3 атомами углерода или фенильной группой; R, - атом водорода или алкильная группа с 1-3 атомами углерода; R2 и R3 - атом водорода или вместе образуют углерод-углеродную связь; руг - пиридильная группа, незамещенная или замещенная в положениях 35 алкильной группой; R4 - цианогруппа, тетразолильная группа, аминокарбонильная группа, алкиламинокарбонильная группа, диапкиламино 26976 карбонильная группа, группа, переводимая in vivo метаболическим путем в карбоксигруппу, или карбонильная группа, если У означает группу R8NR9; R5 - атом водорода или галогена, алкильная группа, алкоксильная группа или трифторметильная группа, причем все упомянутые алкильные и алкоксильные остатки, если ничего другого не упомянуто, имеют 1-3 атомов углерода, а, если ничего другого не упомянуто, то все вышеупомянутые фенильные ядра могут быть моно- или дизамещены одинаковыми или различными заместителями из группы, включающей атом фтора, хлора, или брома, алкил, гидроксил, алкоксил, карбонил, фенил, нитро-, амино-, апкил-амино-, диалкиламино-, алканоиламино-, циано-, алкоксикарбонильной, аминокарбонильной, алкиламинокарбонильной, диакиламинокарбонильной.трифторметильной, алканоильной, аминосульфонильной, алкиламиносульфонильной или диалкиламиносульфонильной группами, их энантиомерам, цис- или транс-изомерам, если R2 и R3 вместе означают углерод-углеродную связь, и их солям. Под понятием "группа, переводимая метаболическим путем in vivo в карбоксильную группу", следует, например, понимать ее сложный эфир формул _ QQ _ OR' - СО - О -'{HCR") - О - СО - R'" и - СО - О - (HCR") - О - СО - OR"' где R' - неразветвленная или разветвленная алкильная группа с 1-6 атомами углерода, циклоалкильная группа с 5-7 атомами углерода, бензильная, 1-фенилэтильная, 2-фенилэтильная, 3-фенилпропильная, метоксиметильная или циннамильная группы, R"- атом водорода или метильная группа и R"' - неразветвленная или разветвленная алкильная группа с 1-6 атомами углерода, циклоалкильная группа с 5-7 атомами углерода, фонильная, бензильная, 1 -фенилэтильная, 2-фенилэтильная и 3-фенилпропильная группы. Соединения вышеприведенной общей формулы (I), где У означает алкокси-, фенокси-, алкилтио- и фенилтио-группы, представляют собой промежуточные продукты для получения соединений общей формулы I, где У означает группу R»NR9, а соединения вышеприведенной общей формулы (I), где R4 означает цианогруппу, представляют собой промежуточные продукты для получения соединений общей формулы (I), где R4 означает тетразолильную группу. 5 10 15 20 25 30 35 40 45 50 55 Соединения общей формулы (I), где У означает группу R8NR9, имеют, в частности, антитромботические действия. Кроме того, новые соединения одновременно представляют собой антагонисты тромбоксана и ингибиторы синтеза тромбоксана и таким образом они также ингибируют вызываемые тромбоксаном действия. Кроме того, они воздействуют также на производство PGE, в легких и на производство PGD2, PGE2 и PGF. в тромбоцитах человека. В качестве предпочтительных соединений вышеприведенной общей формулы (I) следует назвать такие, где п - число 2, 3, 4 или 5; А - связь или этиленовая группа, X - нитрометиленовая группа, цианометиленовая группа, незамещенная или замещенная остатком R6, имеющим указанные ниже для R4 значения за исключением тетразола, или группа формулы =N-R 7 , где R7 означает цианогруппу, фенилсульфонильную или алкансульфонильную группу, У - фенокси- или метилтиогруппа или группа R8NR9, где R8 - атом водорода, неразветвленная или разветвленная алкильная группа с 1-8 атомами углерода, незамещенная или замещенная во 2-м, 3 м или 4-м положении гидроксилом или диметилминогруппой, замещенная фенильной или пиридильной группой алкильная группа с 1-4 атомами углерода, которая может быть замещена гидроксилом в положении 2,3 или 4, циклоалкильная группа с 3-8 атомами углерода, метоксигруппа, триметилсилилметильная группа, индан-2ил или бициклогептильная группа, незамещенная или замещенная одной, двумя или тремя алкильными группами, R9 атом водорода или метильная группа или R8 и R9 вместе с расположенным между ними атомом азота означают пиперидино-группу, которая может быть замещена одной или двумя метильными группами или фенильной группой и в которой дополнительно один этиленовый мостик в положении 3, 4 может быть замещен на о-фениленовую группу, морфолино-группу или пиперазиногруппу, незамещенную или замещенную в 4-м положении фенильной группой, R, - атом водорода или метильная группа, •. R2 и R3 - атом водорода или вместе означают углерод-углеродную связь, Руг - 3-пиридильная или 4-пиридильная группа, R4 - цианогруппа, карбоксил, тетразолильная, агжоксикарбонильная, аминокар 26976 бонильная, алкиламинокарбонильная или диалкиламинокарбонильная группы, каждая с 1 - 3 атомами углерода в алкоксильной и алкильной частях, R5 - атом водорода, фтора, хлора 5 или брома, алкильная, алкоксильная или три-фторметильная группа, причем все вышеупомянутые апкильные и алкоксильные группы, если ничего другого не упомянуто, содержат 1-3 атомов углерода, 10 их энантиомеры, цис- и транс-изомеры, если R4 и Rb вместе представляют собой углерод-углеродную связь, и их соли. Особенно предпочтительными являют- 15 ся те соединения формулы (I), где п - число 3, А - связь или этиленовая группа, Х- группа формулы =N-R 7 , причем R7 - цианогруппа, фенилеульфонильная 20 группа, или дицианометиленовая группа, У - группа R8NRg, где R8 неразветвленная или разветвленная алкильная группа с 1-8 атомами углерода, циклоалкильная группа с 3-8 атомами углерода или эксо-норборнил-(2), a R9 атом водорода, R, - атом водорода, R2 и R3 - атом водорода или вместе 30 означают углерод-углеродную связь, Руг - 3-пиридильная группа, R4 - карбоксигруппа или алкоксикарбонильная группа с общим числом 2-4 атомов углерода, 35 R5 - атом водорода, хлора или брома, метильная или трифторметильная группа, их энантиомеры, цис- и транс-изомеры и их соли. Новые соединения вышеприведенной 40 формулы (I) можно получать следующими способами-аналогами. А. Для получения соединений общей формулы (I), где У означает алкокси-, фенокси-, алкилтио- и фенилтиогруплы: 45 Взаимодействие соединения общей формулы (II) (Y')3C=X где X имеет вышеуказанные значения, У - алкокси-, фенокси-, алкилтиоили фенилтио-группа. Реакцию предпочтительно проводят в среде растворителя, такого, как, например, метанол, этанол, иэопропанол, диоксан, тетрагидрофуран или хлороформ, в случае необходимости в присутствии связывающего кислоту агента, как карбоната калия, триэтиламина или пиридина, причем триэтиламин и пиридин можно также использовать в качестве растворителя. Реакцию целесообразно проводят при температуре 0-50'С, в частности при комнатной температуре. Б. Для получения соединения общей формулы (I), где У означает группу R.NR9: Взаимодействие соединения общей формулы (W) (IV) где А, X, п, R, - R5 и Руг имеют вышеуказанные значения и У означает алкокси-, фенокси-, алкилтио- или фенилтиогруппы, с амином общей формулы (V) Н - N. (V) где Re и R9 имеют вышеуказанные значения. Реакцию предпочтительно проводят Б среде растворителя, такого, как, например, этанол, изопропанол, тетрагидрофуран, диоксан или бензол, или в избытке используемого амина общей формулы (V), в случае необходимости в автоклаве и в случае необходимости в присутствии ос*® нования, такого, как, например, карбонат натрия и калия, триэтиламин или пиридин, при 0-125'С, предпочтительно 5 0 100'С. gg В. Для получения соединений общей формулы (I), где У означает группу ReMR9 и R4, означает карбоксильную группу: где А, л, R, - R5 и Руг имеют вышеукаОтщепление защитного радикала от занные значения, с соединением обшей соединения общей формулы (VI) формулы (III) 26976 (VI) где R,, R2, R3, R5, Pyr, A, X и п имеют вышеуказанные значения, У" означает группу R8NR9, где R8 и Rg имеют вышеуказанные значения, Z,- группа, переводимая посредством гидролиза, термолиза или гидрогенолиза в карбоксильную группу. В качестве гидролизуемых групп можно использовать, например, такие функциональные производные карбоксигруппы, как, например, незамещенные или замещенные амиды, сложные эфиры, сложные тиоэфиры, сложные ортоэфиры, простые иминоэфиры, амидины или ангидриды, нитрильную группу, эфирные группы, как, например, метокси-, этокси-, трет.бутокси- и бензилоксигруппы или лактоны, в качестве поддающихся термолизу групп - например, сложный эфир с третичными спиртами, как, например, сложный трет.бутиловый эфир, а в качестве отщепляемого гидрогенолизом остатка например, аралкильные группы, как, например, бензил. Гидролиз целесообразно проводят или в присутствии кислоты, как, например, соляной кислоты, серной кислоты, фосфорной кислоты или трихлоруксусной кислоты или в присутствии основания, как, например, гидроокиси натрия или калия, в среде пригодного растворителя, такого, как, например, вода, смесь воды и метанола, этанол, смесь воды и этанола, смесь воды и изопропанола или диоксана, при температуре от -10 до 120*С, например, при температуре от комнатной температуры до температуры кипения реакционной смеси. Если, например, соединение формулы (VI) содержит нитрильную или аминокарбонильную группу, то эту группу можно переводить в карбоксильную группу путем обработки 100%-ной фосфорной кислотой при 100-180*С, предпочтительно при 120-160*С, или же нитритом, например, нитритом натрия, в присутствии кислоты, как, например, серной кислоты, которую целесообразно одновременно использовать одновременно в качестве растворителя, при температуре 0-50'С. Если, например, соединение формулы (VI) содержит амидную группу, как, например, диэтиламинокарбонильную или 5 10 15 20 25 30 35 40 45 50 10 пиперидинокарбонильную группу, то эту группу можно переводить в карбоксильную группу гидролизом при температуре от -10% - +120*С, например, при температуре от комнатной до температуры кипения реакционной смеси, в присутствии кислоты, как, например, соляной кислоты, серной кислоты, фосфорной кислоты или трихлоруксусной кислоты, или же в присутствии основания, как, например, гидроокиси натрия или калия, в среде пригодного растворителя, как, например, воды, смеси воды и метанола, этанола, смеси воды и этанола или изопропанола или диоксана. Если, например, соединение общей формулы (VI) содержит трет.бутилоксикарбонильную группу, то трет.бутильную группу можно отщеплять путем термолиза при 40-100"С, в случае необходимости в среде инертного растворителя, такого, как, например, метиленхлорид, хлороформ, бензол, толуол, тетрагидрофуран или диоксан, и предпочтительно в присутствии каталитического количества кислоты, как, например, п-толуолсульфокислоты, серной кислоты, фосфорной и полифосфорной кислот. Термолиз предпочтительно проводят при температуре кипения используемого растворителя, например, при температуре 40-1ОО'С. В случае, если соединение формулы (VI) содержит бензилокси- или бензилокси-карбонилгруппу, то бензильную группу можно отщеплять путем гидрогенолиза, предпочтительно при температуре 0-50*С, например, при комнатной температуре, и давлении водорода 1 - 5 бар в среде пригодного растворителя, такого, как например, метанол, этанол, смесь метанола и воды, смесь этанола и воды, ледяная уксусная кислота, сложный этиловый эфир уксусной кислоты, диоксан или диметилформамид. В процессе гидрогенолиза галогенсодержащее соединение можно подвергать одновременному дегалогенированию и имеющуюся двойную связь можно подвергать гидрированию. Г. Для получения соединений общей формулы (I), где R, и R3 означают атом водорода: Гидрирование соединения общей формулы (VH) 55 к. (VII) 26976 11 где, А, X, Y, n, R,, R4, R5 и Руг имеют вышеуказанные значения. Гидрирование осуществляют каталитически возбужденным водородом, например, водородом в присутствии катализатора гидрирования, как, например, никеля Ренея, лалладия, палладия на угле, платины или платины^ на угле, при давлении водорода 1-5 бар, или водородом в моменте выделения, например, обработкой железом в присутствии соляной кислоты, цинком в присутствии ледяной уксусной кислоты, дихлоридом олова (И) в присутствии соляной кислоты или сульфатом железа (II) в присутствии серной кислоты, при температуре 0-50*С, предпочтительно при комнатной температуре, в среде пригодного растворителя, такого, как, например, метанол, этанол, диоксан, сложный, этиловый эфир уксусной кислоты или ледяная уксусная кислота. Однако каталитическое гидрирование можно также осуществлять стереоселективно в присутствии пригодного катализатора. Д. Для получения соединения общей формулы I, где X за исключением содержащих цианогруппу радикалов имеет вышеупомянутые значения, a R4 означает тетразолильную группу: Взаимодействие соединения общей формулы (VHI) (VIMJ Руг где А, п, Y, R p R2, R3, R5 и Руг имеют вышеуказанные значения, X' за исключением содержащих цианогруппу радикалов имеет вышеупомянутые для X значения, с азотистоводородной кислотой или ее солями. Реакцию предпочтительно проводят в среде растворителя, такого, как, например, бензол, толуол или диметилформамид, при температуре 80-150*С, предпочтительно при температуре 125*С. При этом целесообразно поступать так, что либо азотистоводородная кислота высвобождается во время реакции из азида щелочного металла, например, азида натрия, в присутствии слабой кислоты, как, например, хлорида аммония, либо получаемую 12 в реакционной смеси при реакции с солью азотистоводородной кислоты, предпочтительно азидом алюминия или трибутилолова (которую целесообразно получают 5 в реакционной смеси путем взаимодействия хлористого алюминия или хлористого трибутилолова с азидом щелочного металла, как, например, азидом натрия), тетразолильную соль затем высвобождают 10 путем подкисления разбавленной кислотой, как, например, 2Н соляной кислотой или 2Н серной кислотой. Если согласно изобретению получают соединение общей формулы I, где X оз15 начает группу формулы =N-CN, то ее можно перевести посредством омыления в соответствующее соединение фомулы (І), где X означает группу формулы =N-CONH 2 , или если получать соединение формулы 20 (I), где R4 означает карбоксильную группу, то ее можно перевести посредством омыления или амидирования в соответсвующее соединение формулы (I), где R4 означает группу, переводимую in vivo ме25 ^таболическим путем в карбоксильную группу, аминокарбонильную, алкиламинокарбонильную или диалкиламинокарбонильную группу, или если получать соединение формулы (I), где R4 означает амино30 карбонильную группу, то эту группу можно перевести посредством дегидратации в соответствующее соединение формулы (I), где R4 означает цианогруппу. Дополнительное омыление группы фор35 мулы =N-CN проводят путем гидролиза в присутствии кислоты или основания, например, серной кислоты, фосфорной кислоты, муравьиной кислоты, соляной кислоты, бромистоводородной кислоты, ук40 сусной кислоты, бортрифторида, четыреххлористого титана, или перекиси водорода и натрового щелока или едкого кали, при температуре 0-100°С, предпочтительно 2050'С. ^5 Последующую этярификацию или последующее амидирование целесообразно проводят в среде растворителя, например, в избытке используемого спирта, такого, как, например, метанол, этанол или изоп50 ропанол, или используемого амина, такого, как, например, аммиак, метиламин, нпропиламин или диметиламин, в присутствии активирующего кислоту средства, такого, как, например, тионилхлорид или хло55 ристый водород, карбонилдиимидазол или N, N'-дициклогексилкарбодиимид, при температуре 0-180*С, однако предпочтительно при комнатной температуре. Переведение карбоксильной группы в группу, которую переводят in vivo метабо 13 26976 лическим путем в карбоксильную группу, осуществляют целесообразно путем эте- рификации соответствующим спиртом или соответствующим реакционноспособным ацильным производным, целесообразно в 5 среде растворителя или смеси растворителя, как например, воды, метиленхлорида, хлороформа, простого диэтилового эфира, тетрагидрофурана, диоксана или диметилформамида или в избытке ацили- 10 рующего средства в качестве растворителя, в случае необходимости в присутствии активирующего кислоту или обезвоживающего средства, как, например, тионилхлорида, ангидридами, сложными эфира- 15 ми или галогенидами, в случае необходимости в присутствии неорганического или третичного органического основания, как, например, гидроокиси натрия, карбоната калия, триэтиламина или пиридина, при- 20 чем оба последних могут также служить в качестве растворителя, при температуре от -25 до + 100'С, однако предпочтительно при температуре от -10 до + 80"С. Дополнительную дегидратацию прово- 25 дят с использованием обезвоживающего средства, как, например, пятиокиси фосфора, серной кислоты или хлорангидрида п-толуолсульфокислоты, в случае необходимости в среде растворителя, как, нап- 30 ример, метиленхлорида или пиридина, при температуре 0-1ОСГС, предпочтительно при 20-80°С. Получаемые соединения формулы {{) можно также разделять на их энантиоме^ •35 ры. Так, например, получаемые соединения формулы (I), содержащие только один оптически активный центр, можно разделять известными приемами на их опти- 40 ческие антиподы, например, путем перекристаллизации из оптически активного растворителя или путем взаимодействия с образующим соль с рацемическим соединением оптически-активным веществом, 45 в частности основаниями, и разделения получаемых при этом смеси солей, например, на основе их различной растворимости, на диастереомерные соли, из которых можно получать свободные антипо- 50 ды путем воздействия пригодных средств. В качестве особенно пригодных оптически активных оснований можно назвать, например, D- и L-формы ос-фенил-этиламина или цинхонидина. 55 Кроме того, получаемые соединения формулы J, имеющие по меньшей мере два асимметричных атома углерода, можно разделять на их диастереомеры известными приемами, например, путем хро 14 матографии и/или фракционной кристаллизации, используя их физико-химические различия. Получаемую при этом энантиомерную пару можно затем разделять, как это описано выше, на оптические антиподы. В случае, если соединение общей формулы (I) содержит два оптически активных атома углерода, то получают соответствующие формы (R R\ S S' и R S', SR') Кроме того, получаемые соединения формулы (I), где R2 и R3 вместе означают углерод-углеродную связь, можно переводить в их цис- и транс-изомеры известными приемами, например, путем хроматографии на носителе, например, на силикагеле, или путем кристаллизации. Кроме того, если получаемые новые соединения формулы (I) содержат карбоксильную группу, то их можно переводить в аддитивные соли с неорганическими или органическими основаниями, или если они содержат основную группу, то в случае необходимости их можно переводить в соли с неорганическими или органическими кислотами, в частности в физиологически переносимые соли для фармацевтического использования. При этом в качестве оснований можно использовйть, например, гидроокись натрия, гидроокись калия, циклогексиламин, этаноламин, диэтаноламин и триэтаноламин, Nметилглюкозамин, аргинин и лизин, а в качестве кислот - например, соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, фумаровая кислота, янтарная кислота, молочная кислота, лимонная кислота, винная кислота или малеиновая кислота. Используемые в качестве исходных веществ соединения формул (II) - (VIII) получают известными из литературы способами или же они известны из литературы. Используемое в качестве исходного вещества соединение формулы (II) получают путем ацилирования по ФидельюКрафтсу соответствующего N-ациламиносоединения с последующим деацилированием и, в случае необходимости, восстановлением, гидролизом и/или этерификацией или же путем взаимодействия соответствующего магниевого или литиевого соединения с соответственно замещенным пиридином, как, например, 3-цианопиридином, пиридин-3-альдегидом или производным пиридин-3-карбоновой кислоты и последующего, в случае необходимости, окисления. Используемые в качесгве исходных веществ соединения формул (II), где R2 и Я^ вместе означают углерод-углеродную 15 26976 16 при температуре 0-100*Cf предпочтительно при 20-80'С. Используемые в качестве исходных соединений соединения формулы (III) по5 лучают известными приемами или путем взаимодействия дифеноксидихлорметана с соответственно замещенным амином, или путем взаимодействия сероуглерода с соответственно замещенным С-Н-ацидным 10 метильным или метиленовым компонентом метила или метилена с последующим метилированием. Используемые в качестве исходных где Rt, Pyr, R5 и А имеют вышеуказанные соединений соединения формул (VI), (VII) значения и U означает защитную группу для аминогруппы, с соединением общей 15 и {VIII) получают путем реакции соответствующего аминосоединения с соответстформулы (X) вующим производным угольной кислоты. R Используемые в качестве исходных (X), W - (снд. - « соединений соединения формулы IX погде R4 и п имеют вышеуказанные значе- 20 лучают путем ацилирования по ФиделюКрафтсу соответствующего амина. ния, Используемые в качестве исходных веW - радикал галогенида трифенилществ соединения формулы (X) получают фосфония, диалкилфосфоновой кислоты путем взаимодействия соответствующего или галогенида магния, с последующим отщеплением используемого защитного 25 галоидного соединения с трифенилфосрадикала и, в случае необходимости, дефаном или со сложным эфиром триалгидратацией. килфосфоновой кислоты. Как уже указывалось выше, новые соеРеакцию предпочтительно проводят в динения общей формулы (I), где У ознапригодном растворителе, таком, как, например, простой диэтиловый эфир, тетра- 30 чает группу R8NR9 и их физиологически гидрофуран, диоксан или диметилформапереносимые соли с неорганическими или мид при температуре - 30-100*С, предорганическими основаниями имеют ценпочтительно при температуре -20-25'С» в ные фармакологические свойства, в частслучае необходимости в присутствии осности, антитромботические действия и занования. 35 •держивающее агрегацию тромбоцитов действие. Кроме того, они представляют Реакцию с галогенидом трифенилфоссобой также антагонисты тромбоксана и фония формулы (X) особенно выгодно провоингибиторы синтеза тромбоксана, причем дят в присутствии основания, как, например, особенно следует обратить внимание на трет.бутилата калия или гидрида натрия. В случае, если во время реакции с 40 то, что соединения формулы (I) одноврегалогенидом магния формулы (X) от полуменно проявляют указанные действия. Начаемого в реакционной смеси карбинола ряду с указанными действиями они также гидроксильная группа не отщепляется, то оказывают влияние на производство PGEj она снимается в присутствии кислоты, как, в легких и на производство PGD2, PGE2 и например, соляной кислоты, серной кис- 46 PGF2a в тромбоцитах человека. лоты, фосфорной кислоты или трихлорукБиологические свойства соединений сусной кислоты, или в присутствии осноА - III исследовались нижеследующими вания, как, например, гидроокиси натрия методами. или калия, в среде пригодного раствориА = 5Е-6-[3-(2-циано-3-циклопропилтеля, как, например, этанола, изопропа- 50 гуанидино)фенил]-6-(3-пиридил)гекс-5нола или диоксана, при 0-120/С, наприеновая кислота, мер, при температуре от комнатной до Б = 5Е-6-[3-(2-циано-3-трет.бутил-гуатемпературы кипения реакционной смеси. нидино}фенил]-6-(3-пиридил)гекс-5-еновая Последующую дегидратацию осукислота, ществляют обезвоживающим средством, 55 В = 5£-6-[3-(2-циано-3-циклопентилкак, например, пятиокисью фосфора, сергуанидино)фенмл]-6-(3-пиридил)гекс-5ной кислотой или хлорангидридом п-тоеновая кислота, луолсульфокислоты, з случае необходиГ = 5Е-6-{3-(2-циано-3-изопролил-гуамости, в среде растворителя, такого, как, нидино)фенил]-6-(3-пиридил)гекс-5-еновая например, метиленхлорид или пиридин, кислота, связь, получают путем взаимодействия соединения общей формулы (IX) 17 26976 Д = 5Е-6-[3-(2-циано-3-ексо-норборн2-ил)гуанидино)фенил]-6-(3-пиридил)гекс5-еновая кислота, Е = 5Е-6-[3-(2-циано-3-(2-метилпропил)гуанидино)фенил]-6-(3-пиридил)гекс5-еновая кислота, Ж = 5Е-6-[3-{2-циано-3-неопентил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновая кислота, 3 = 5Е-6-[3-(2-циано-3-пентил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновая кислота, И = 5Е-6-[3-(2-циано-3-(3-метилбутил)гуанидино)фенил]-6-(3-пиридил)гекс-5еновая кислота, Й = 5Е-6-{3-[2,2-дициано-1-(2-метилпропиламино)-этиленамино]фенил}-6-(3-пиридил)гекс-5-еновая кислота» К = 5Е-6-[3-(2,2-дициано-1-изопропиламино-этиленамино)фенилЗ-6-(3-пиридил)гекс-5-еновая кислота, Л = 5Е-6-{3-[2,2-дициано-1-(3-метилбутиламино)-этиленамино]фенил}-6-(3-пиридил)гекс-5-еновая кислота, М = 5Е-6-[3-(2,2-дициано-1-цИклопентиламино-этиленамино)-фенил]-6-(3-пиридил)гекс-5-еновая кислота, Н = 5Е-6-[3-(2,2-дициано-1-неопентиламино-этиленамино)фенил}-6-(3-пиридил)гекс-5-еновая кислота, О = 5Е-6-[3-(2,2-дициано-1-циклопропиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновая кислота, П = 5Е-6-[3-(2,2-дициано-1-пропиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновая кислота, Р = 5Е-6-[3-(2,2-дициано-1-трет.бутиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновая кислота, С = 5Е-6-[4-(2-циано-3-циклогексилгуанидино)фенил]-6-(3-пиридил)гекс-5еновая кислота, Т = 6-[3-{2-циано-3-трет.бутил-гуанидино)фенил]-6-(3-пиридил)гексанкарбоновая кислота, У = 5Е-6-[3-(1-неочентиламино-2-нитро-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновая кислота, Ф = Е{г-6-[4-(2-циано-3-трет.бутилгуанидино)этил]-фенил }-6-(3-пиридил)гекс-5-еновая кислота, X = 5Е-6-[3-(3-трет.бугил-2-фенилсульфонил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновая кислота Ц = 5Е-6-{3-[2-амидосульфонил-3-(2метилпропил )гуанидино]фенил} -6-{3-пиридил)гекс-5-еновая кислота, 4 = 5Е-6-{3-[2-карбамоил-2-циано-1(2-метилпропиламино)этиленамино]фенил}-6-(3-пиридил)гекс-5-еновая кислота и 5 10 15 20 25 30 35 40 45 50 55 18 Щ = 4Е-1-{5-[3-(2-циано-3-циклопентил)-гуанидино]фенил}-5-(3-пиридил)-4пентенил )тетразол. 1. Антитромботическое действие. Методика. Методом Борна и Кросса (J. Physiol. 170, 397 (1964 г.)) в богатой кровяными пластинками плазме здоровых испытуемых измеряют агрегацию тромбоцитов. Для обеспечения антикоагуляционного действия к крови прибавляют цитрат натрия (3,14 %) в объемном соотношении 1:10. Индуцируемая коллагеном агрегация. Уменьшение оптической плотности суспензии тромбоцитов фотометрически измеряют и регистрируют после добавления вызывающего агрегацию вещества. По углу наклона кривой плотности делают вывод на скорость агрегации. Точка кривой, где установлено наибольшее пропускание света, служит для определения оптической плотности. Количество коллагена выбирают по возможности незначительно так, чтобы получать необратимо проходящую кривую. Используют торговый коллаген инофирмы Гормонхеми, Мюнхен, DE. Перед добавлением коллагена плазму вместе с веществом инкубируют при температуре 37*С в течение соответственно 10 мин. По полученным данным измерения графически определяют эффективную дозу ЭД50, относящуюся к 50%-ному изменению оптической плотности, то есть задержки агрегации. 2. Антагонистическое в отношении тромбоксана действие. Венозную кровь человека антикоагулируют с помощью 13 мМ цитрата натрия и в течение 10 мин при 170 х g центрифугируют. Надосадочную, богатую тромбоцитами плазму для удаления плазменных протеинов пропускают через колонку, содержащую ионит марки сефарозе 2Б. Аликвоты полученной суспензии тромбоцитов вместе с исследуемым веществом, 3 лигандом ( Н-меченым) и маркером (немеченым) в течение 60 мин при комнатной температуре инкубируют и затем в течение 20 с при 10 000 х g отделяют центрифугированием. Надосадочную жидкость отводят и остаток растворяют в гидроокиси натрия. 3Н-активность в надосадочной жидкости соответствует свободному лиганду, 14С указывает концентрацию маркера. 3Н в остатке соответствует связанному лиганду, 14С используют для коррекции лиганда во внеклеточном пространстве. По значениям связывания для различных концентраций исследуемого вещества определяют после повторения кривую вытеснения и 50%-ную концентрацию торможения 19 3. Определение задерживающего действия на синтез тромбоксана. Венозную кровь человека антикоагулируют с помощью 13 мМ цитрата натрия и в течение 10 мин при 170 х g центрифугируют. Надосадочную, богатую тромбоцитами плазму для удаления плазменных протеинов пропускают через колонку, содержащую ионит марки сефароз 2В. Аликвоты полученной суспензии тромбоцитов вместе с исследуемым веществом или растворителем в качестве контроля инкубируют в течение Ю мин при комнатной температуре и после добавления 14С-меченой арахидоновой кислоты инкубацию продолжают в течение 10 мин. После прекращения инкубации добавлением 50 мл лимонной кислоты трижды экстрагируют 500 мл сложного этилового эфира уксусной кислоты и Соединение № 20 26976 Торможение синтеза тромбоксана кт 5 0 5 10 Ш 20 объединенные экстракты подвергают продувке азотом. Остаток поглощают в сложном этиловом эфире уксусной кислоты, наносят на предназначенную для тонкослойной хроматої рафии пленку и разделяют с помощью смеси хлороформа, метанола, этилового эфира уксусной кислоты и воды в объемном соотношении 90 ; 8 : 1 : 0,8. Высушенные тонкослойные пленки на 3 дня кладут на рентгеновскую пленку, проявляют авторадиограмму и с ее помощью мечат активные зоны на пленке. После вырезания определяют активность с помощью сцинтилляционного счетчика и вычисляют задержку образования тромбоксана В2. КТ50 определяют путем линейной интерполяции. В нижеследующей таблице сведены полученные значения. Антагонистическое в соотношении тромбоксана действие Торможение индуцированной коллагеном агрегации (мкмоль/л) (мкмоль/л) А В В Г Д Е Ж 3 И й к л м н О п р с т У ф X ц ч ш 0,380 0,004 0,003 0,024 0,004 0,030 0,014 0,005 0,003 0,030 0,045 0,031 0,033 0,044 0,65 0,040 0.050 0.180 0.037 0,290 0,007 0.004 2,700 0,005 0,250 0,017 0,011 0,030 0,018 0,017 0,007 0,022 0,025 0,027 0,002 0,002 0,015 0,001 0,003 0,062 0,037 0,050 1,300 0,120 0.280 0,050 0,055 0.600 0,380 0.021 (мкмоль/л) 0,90 0,50 0,53 0,40 0,75 0.35 0,26 0,64 0,69 0,12 0,02 1,20 0,05 0,62 0,04 0,05 0,12 31,00 1,10 9,50 1,20 3,00 12,00 31.00 1.20 21 26976 4. Острая токсичность. Острая токсичность исследуемых веществ определялась на группах по 10 мышей в каждой группе после оральной дачи разовой дозы 250 мг/кг (время наблюдения: 14 дней). При этой дозе не умерло ни одно подопытное животное. По их фармакологическим свойствам новые соединения и их физиологически переносимые аддитивные соли пригодны для лечения и профилактики тромбо-эмболических заболеваний, таких как инфаркт миокарда, церебральный инфаркт, временной ишемический приступ, скоропреходящий амауроз, для профилактики артериосклероза и для профилактики от метастазирования, а также для лечения ишемии, астмы и аллергий. Необходимая для получения соответствующего действия дозировка целесообразно составляет 2-4 раза в день 0,3 - 4 мг/кг, предпочтительно 0,3 - 2 мг/кг веса тела. Для этого новые соединения формулы І, в случае необходимости в комбинации с другими активными началами, можно врабатывать вместе с одним или несколькими инертными обычными носителями и/или разбавителями, как, например, кукурузным крахмалом, молочным сахаром, сахаром-сырцом, микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, смесью воды и этанола, или глицерина, или сорбита, или полиэтиленгликоля, пропиленгликолем, цетилстеариловым спиртом, карбоксиметилцеллюлозой или содержащими жир веществами, как, например, отвержденным жиром или их пригодными смесями, в обычные галенические препараты, как, например, таблетки, драже, капсулы, порошки, суспензии или суппозитории. С учетом вышеизложенного дальнейшим объектом изобретения является фармацевтическая композиция с антитромботической антагонистической в отношении тромбоксана и тормозящей агрегацию тромбоцитов и синтез тромбоксана активностью, содержащая по меньшей мере один фармацевтически приемлемый носитель и активное начало, в качестве которого взято по меньшей мере одно производное пиридила вышеприведенной формулы (I) или его энантиомер, цис- или транс-изомер, если R2 и R3 вместе означают углерод-углеродную связь, или его фармацевтически приемлемую соль в эффективном количестве. Нижеследующие примеры иллюстрируют получение исходных соединений. 5 10 15 20 25 30 35 40 45 50 55 22 П р и м е р 1. Сложный метиловый эфир 6-(4-аминофенил)-6-(3-пиридил)гекс5-еновой кислоты. а) 4-Ацетиламинофенил-З-пиридил-кетон. 980 г трихпорида алюминия медленно смешивают с 155 мл диметилформамида. К этой смеси последовательно добавляют при температуре 90-110*С 342 г гидрохлорида хлорангидрида никотиновой кислоты и 206 г N-ацетиланилина. Затем реакционную смесь смешивают с 600 мл этиленхлорида, подают на лед и подвергают нейтрализации при охлаждении путем добавления 15N натрового щелока. Водную фазу экстрагируют метиленхлоридом. Объдиненные органические фазы сгущают и остаток перекристаллизовывают из метанола. ' Выход: 44% теории, т.пл.: 189-19ГС. C14H12N2O (240,26) Рассчитано: С 69,99 Н 5,03 N 11,66 Найдено: 69,87 5,14 11,58 б) 6-(4-Ацетиламинофенил)-6-(3-пиридил)гекс-5-еновая кислота. К суспензии 307 г бромида 4-карбоксибутил-трифенилфосфония и 233 г трет.бутилата калия в 2,8 л тетрагидрофурана добавляют при температуре - 40'С 140 г 4-ацетиламинофенил-3-пиридил-кетона и перемешивают в течение двух часов. Реакционную смесь разлагают путем добавления ледяной воды и сгущают. Остаток подают в воду и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до рН 5 - 6 и экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира и простого диизопропилового эфира. Выход: 86% теории, т.пл.: 155-156°С. C ^ N A (324,38) Рассчитано: С 70,35 Н 6,21 N 8,64 Найдено: 70,19 6,27 8,66 в) Сложный метиловый эфир 6-(4-аминофенил)-6-(3-пиридил)гекс-5-еновой кислоты. 65 г 6-(4-ацетиламинофенил)-6-(3пиридил)гекс-5-еновой кислоты в смеси 300 *мл метанола и 150 мл насыщенной метанольной соляной кислоты кипятят с обратным холодильником в течение двух часов. Реакционную смесь смешивают с 500 мл воды, нейтрализуют путем добавления карбоната натрия и экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу промывают, сушат и сгущают. Выход: 71% теории, масло; значение R,: 0,72 (силикагель; смесь дихлорметана и ацетона в объемном соотношении 9 : 1 ) 23 26976 C18H20N2O2 (296,37) Рассчитано: С 72,95 Н 6,80 N 9,45 Найдено: 72,83 6,85 9,23 Аналогично примеру 1 получают еще сложный метиловый эфир 6-(4-метиламинофенил)-6-(3-пиридил)гекс-5-еновой кислоты в виде масла. Значение R(: 0,56 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1) C19H22N2O2 (310,40) Рассчитано: С 73,52 Н 7,14 N 9,03 Найдено: 73,35 7,24 5,91 П р и м е р 2. Сложный метиловый эфир 6-(3-аминофенил)-6-(3-пиридил)гекс5-еновой кислоты, а) Ацетиламинофенил-3-пиридилкетон. 114 г З-нитрофенил-3-пиридилкетона в 1000 мл уксусной кислоты и 35 г никеля Ренея гидрируют при давлении 5 бар и температуре 50*С в течение двух часов. Катализатор отфильтровывают и фильтрат смешивают с 80 мл ангидрида уксусной кислоты. После истечения 30 мин сгущают при комнатной температуре и остаток поглощают в сложном этиловом эфи-, ре уксусной кислоты. Органическую фазу промывают водным раствором карбоната калия и сушат над сульфатом натрия. Растворитель отводят и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира. Выход: 69% теории, т.гш.: 116-117°С. C14Ht2N2O2 (240,26) Рассчитано: С 69,99 Н 5,03 N 11,66 Найдено: 70,01 5,11 11,81 б) 6-(3-Ацетиламинофенил)-6-(3-пиридил)гекс-5-еновая кислота. К смеси 217 г бромида 4-карбоксибутил-трифенилфосфония и 154 г трет.бутилата калия в 1,8 л тетрагидрофурана добавляют при температуре - 25*С 94 г 3-ацетил-аминофенил-3-пиридилкетона. После перемешивания при комнатной температуре в течение двух часов реакционую смесь смешивают с 200 мл воды и затем сгущают. Остаток поглощают в 500 мл воды и промывают сложным этиловым эфиром уксусной кислоты. Затем водную фазу нейтрализуют путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и ацетона. Выход: 85% теории, т.пл.: 86-89'С. C,9H20N2O2 (324,38) Рассчитано: С 70,35 Н 6,21 N 8,64 Найдено: 70,15 6,36 8,51 5 10 15 20 25 30 35 40 45 50 55 24 в) Сложный метиловый эфир 6-(3-аминофенил)-6-(3-пиридил)гекс-5-еновой кислоты. 65 г 6-(3-ацетиламинофенил)-6-(3пиридил)гекс-5-еновой кислоты кипятят с обратным холодильником в течение четырех часов в смеси 400 мл метанола и 200 мл метанольной соляной кислоты. Растворитель удаляют и остаток смешивают с водой. Водную фазу промывают сложным этиловым эфиром уксусной кислоты и путем добавления 4N натрового щелока доводят до значения рН 8 - 9. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу промывают, сушат и сгущают. Выход: 71% теории. Масло. Значение Rf: 0,55 (силикагель; смесь дихлорметана и этанола в объемном соотношении 9 : 1 ) . Ct8H20N2O2 (296,37) Рассчитано: С 72,95 Н 6,80 N 9,45 Найдено: 72,83 6,91 9,18 Аналогично примеру 2 получают следующие соединения: Сложный метиловый эфир 5-(3-аминофенил)-5-(3-пиридил)пент-4-еновой кислоты. Смола, значение Rf: 0,58 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 :1). C17H18N2O2 (282,34) Рассчитано: С 72,32 Н 6,43 N 9,92 Найдено: 72,29 6,55 9,70 Сложный метиловый эфир 7-(3-аминофенил)-7-(3-пиридил)гепт-7-еновой кислоты. Смола, значение R(: 0,63 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 :1) C19H22N2O2 (310,40) Рассчитано: С 73,52 Н 7,14 N 9,03 Найдено: 73,41 7,18 8,89 Сложный метиловый эфир 8-(3-аминофенил)-8-(3-пиридил)окт-7-еновой кислоты Смола, значение Rf: 0,66 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 :1) C20H24N2O2 (324,44) Рассчитано: С 74,05 Н 7,46 N 8,63 Найдено: 73,92 7,49 8,48 П р и м е р 3. Сложный метиловый эфир 6-метиламинофенил)-6-(3-пиридил)гекс-5-еновой кислоты. а) N-ацетил-З-метиламинофенил-З-пиридилкетон. К 84 г 3-ацетиламинофенил3-пиридиякетона в 600 мл диметилформамида проциями добавляют при охлаждении 17 г гидрида натрия и затем 22 мл метилйодида. Перемешивают при комнатной температуре в течение одного часа и 25 26976 реакционную смесь разлагают путем добавления 100 мл воды. Растворитель удаляют и остаток смешивают со сложным этиловым эфиром уксусной кислоты. Органическую фазу промывают, сушат и сгу- 5 щают. Остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 30 : 1. • Масло, значение Rf: 0,45 (силикагель; 10 смесь дихлорметана и этанола в объемном соотношении 30 : 1) C15H14N2O2 (254,29) Рассчитано: С 70,85 Н 5,55 N 11,02 Найдено: 70,96 5,65 10,92 15 б) Сложный метиловый эфир 6-(3-метиламинофенил)-6-(3-пиридил)гекс-5-еновой кислоты. Получают из N-ацетил-З-метиламинофенил-3-пиридилкетона и броми- да 4-карбоксибутил-трифенилфосфония 20 аналогично примеру 26 с последующей этерификацией аналогично примеру 2в. Масло, значение Rf: 0,56'(силикагель; смесь дихлорметана и этанола в объем25 ном соотношении 20 :1) C19H22N2O2 (310,40) Рассчитано: С 73,52 Н 7,14 N 9,03 * Найдено: 73,53 * 7,20 8,84 П р и м е р 4. Сложный метиловый эфир 6-(3-амино-4-метилфенил)-6-(3-пи- 30 ридил)гекс-5-еновой кислоты. а) 4-Метил-З-нитрофенил-З-пиридилкетон. К охлажденной до температуры 510вС смеси 22 мл концентрированной серной кислоты и 16 мл дымящей азотной 35 кислоты добавляют; порциями 16,4 г 4метилфенил-3-пиридилкетона. Затем перемешивают при комнатной температуре в течение двух часов, реакционную смесь подают на лед и подщелачивают путем 40 добавления концентрированного аммиака. Водную фазу экстрагируют сложным этиловым эфиром'уксусной кислоты. Органическую фазу сушат, сгущают и остаток очищают на силикагельсодержащей ко- 45 лонке с применением в качестве элюента смеси сложного этилового эфира уксусной кислоты и циклогексана в объемном соотношении 1 : 1 . Фракцию продукта сгущают и остаток перекристаллизовывают 50 из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира. Выход: 60 % теории. 55 C13H,0N2O2 (242,24) Рассчитано: С 64,46 Н 4,16 N 11,56 Найдено: 64,42 4,19 10,64 б) З-Ацетиламино-4-метилфенил-З-пиридилкетон. 12 г 4-метил-З-нитрофенил3-пиридилкетона растворяют в смеси 120 26 мл сложного этилового эфира уксусной кислоты и 15 мл метанола и после добавления 2 г никеля Ренея гидрируют при температуре 50*С под давлением водорода 3,5 бар в течение трех часов. Катализатор отфильтровывают, фильтрат сгущают и остаток смешивают с 30 мл ледяной уксусной кислоты. Раствор смешивают с 10 мл ангидрида уксусной кислоты и перемешивают при комнатной температуре в течение одного часа. Реакционную смесь сгущают, остаток смешивают со сложным этиловым эфиром уксусной кислоты и промывают 2N раствором карбоната натрия. Органический экстракт сушат, сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира. Выход: 77 % теории, т.пл.: 92-94*С C15H14N2O2 (254,29) Рассчитано: С 70,85 Н 5,55 N 11,02 Найдено: 70,77 5,64 10,96 Аналогично примеру 46 получают следующее соединение: З-ацетиламино-5-трифторметилфенил3-пиридилкетон, т.пл.: 128°С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C15HtlF3N2O2 (308,26) Рассчитано: С 58,45 Н 3,59 N 9,09 Найдено: 58,42 3,72 9,10 в) 6-(3-Ацетиламино-4-метилфенил)-6(3-пиридил)гекс-5-еновую кислоту Получают аналогично примеру 16. Вы-. ход: 70 % теории, т.пл: 177 - 179*С (смесь изопропанола и простого диизопропилового эфира) C20H22N2O3 (338,41) Рассчитано: С 70,99 Н 6,55 N 8,28 Найдено: 70,83 6,46 8,19 Аналогично примеру 4в получают следующее соединение: 6-(3-ацетиламино-5-трифторметилфенил)-6-(3-пиридил)гекс-5-еновую кислоту, т. пл.: 164*С (дихлорметан) C20H,9F3N2O3 (392,58) Рассчитано: С 61,22 Н 4,88 N 7,14 Найдено: 61,17 4,79 7,05 г) Сложный метиловый эфир 6-(3^-аммно-4-метилфенил)-6-(3-пиридил)гекс-5еновой кислоты Получают аналогично примеру 1в. Выход: 92 % теории, масло, значение Rf: 0,34 (силикагель; смесь дихлфметана v ацетона в объемном соотношении 9:1) C . 9 H 2 2 N A (310,40) Рассчитано: С 73,52 Н 7,14 N 9,03 Найдено: 73,35 7,28 8,86 Аналогично примеру 4г получают следующее соединение: 27 26976 Сложный метиловый эфир 6-(3-амино-5-трифторметилфенил)-6-(3-пиридил)гекс-5-еновой кислоты, масло, значение Rf: 0,46 (силикагель; смесь дихлорметана и ацетона в объемном соотношении 10 : 1) C,9H19N2O2 (364,37) Рассчитано: С 62,63 Н 5,26 N 7,69 Найдено: 62,55 5,24 7,72 П р и м е р 5. З-Нитро-5-трифторметил фенил-3-пиридилкетон. К 101 г 5-трифторметилфенил-З-пиридилкетона осторожно добавляют последовательно 400 мл концентрированной серной кислоты, 200 мл олеума и 140 мл дымящей азотной кислоты, причем внутренняя температура не должна превышать 35°С. Реакционную смесь перемешивают при комнатной температуре в течение 12 часов и затем подают на лед. Реакционный раствор нейтрализуют путем добавления 50 %-го натрового щелока, причем выпадает нитритная соль. Эту соль отсасывают и затем растворяют в 6N натровом щелоке. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сушат и сгущают, причем получаемое масло при стоянии выкристаллизовывает. Выход: 68 % теории, т.пл.: 182 - 184*С C13H7F3N2O3 (296,20) Рассчитано: С 52,71 Н 2,38 ,N 9,46 Найдено: 52,56 2,45 9,55 П р и м е р 6. 4Е-1-(5-(3-аминофенил)-5-(3-пиридил)пент-4-енил)тетразол. а) 4Е-5-(3-ацетиламинофенил)-5-(3-пиридил)пент-4-енкарбонитрил. К суспензии 25,5 г бромида 4-цианобутил-трифенилфосфония и 14 г трет.бутилата калия в 200 мл тетрагидрофурана добавляют при температуре - 40°С 12 г 3-ацетиламинофенил-3-пиридилкетона. Перемешивают при комнатной температуре в течение трех часов и реакционную смесь разлагают путем добавления 50 мл ледяной воды. Смесь сгущают, остаток смешивают с водой и экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дйхлорметана и этанола в объемном соотношении 40 : 1. Фракцию продукта сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира. Выход: 71 % теории, т.пл.: 144-146#С C19H19N3O (305,38) 5 10 15 20 25 30 35 40 45 50 55 28 Рассчитано: С 74,73 Н 6,27 N 13,76 Найдено: 74,57 6,14 13,59 б) 4Е-1 -[5-(3-ацетиламинофенил)-5-(3пиридил)пент-4-енил]тетразол 5,8 г 4Е-5-(3-ацетиламинофенил)-5-(3пиридил)пент-4-енкарбонитрила и 9,96 г азида трибутилолова в 300 мл толуола кипятят с обратным холодильником в течение 48 часов. Органическую фазу экстрагируют 100 мл 1N натрового щелока. Водную фазу промывают сложным этиловым эфиром уксусной кислоты и путем добавления лимонной кислоты доводят до рН 4 - 5. Выпавший осадок отсасывают, промывают водой и сушат. Выход: 83 % теории, т.пл.: 174-175'С C19H20N6O (348,41) Рассчитано: С 65,50 Н 5,79 N 24,12 Найдено: 65,39 5,86 23,96 в) 4Е-1-[5-(3-аминофенил)-5-(3-пиридил)пент-4-енил]тетразол 5,7 г 4Е-1-[5-(3-ацетиламинофенил)5-(3-пиридил)пент-4-енил]тетразола в 60 мл 4N соляной кислоты нагревают до температуры 60°С в течение 5 ч. Реакционный раствор нейтрализуют путем добавления бикарбоната натрия и затем доводят до значения рН 4 - 5 путем добавления лимонной кислоты. Водную фазу экстрагируют смесью дихлорметана и метанола в объемном соотношении 4 : 1 . Органическую фазу промывают насыщенным раствором хлорида натрия, сушат и сгущают. Выход: 91 % теории, масло, значение Rf: (силикагель марки RP8; смесь 5 %ного раствора хлорида натрия и метанола в объемном соотношении 4 : 6) C17H18N6 (306,37) Рассчитано: С 66,65 Н 5,92 N 27,43 Найдено: 66,53 6,04 27,21 Нижеследующие примеры иллюстрируют получение производных пиридила формулы (I). П р и м е р 7. 5Е-6-[4-(2-циано-3циклогексил-гуанидино)фенил]-6-(3-пиридил)-гекс-5-еновая кислота. а) Сложный метиловый эфир 5Е-6-[4(цианимидо-феноксиметиленамино)фенил] -6-(3-пиридил)гекс-5-еновой кислоты 11,4 г дифеноксиметилен-цианамида и 15 г сложного метилового эфира 5Е-6[4-(аминофенил)]-6-(3-пиридил)гекс-5-еновой кислоты растворяют в 250 мл изопропанола и перемешивают при комнатной температуре в течение шести часов. Образовавшийся осадок отсасывают и промывают простым диэтиловым эфиром. Выход: 87% теории, т.пл.: 163-165'С C26H24N4O3 (440,50) 29 26976 Рассчитано: С 70,89 Н 5,49 N 12,77 Найдено: 70,67 5,51 12,50 б) 5Е-6-[4-(2-циано-3-циклогексил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновая кислота 2,2 г сложного метилового эфира 5Е6-[4-(цианимидо-феноксиметиленамино)фенил]-6-(3-пиридил)гекс-5-еновой кислоты и 0,8 г циклогексиламина в 40 мл изопропанола нагревают с обратным холодильником в течение двух часов. Еще горячий реакционный раствор фильтруют, фильтрат смешивают с 6 мл 2N натрового щелока при температуре 40 - 50°С и затем перемешивают еще при температуре 40-50*С в течение двух часов. Реакционный раствор сгущают и остаток смешивают с водой. Водную фазу промывают сложным этиловым эфиром уксусной кислоты и путем добавления лимонной кислоты доводят до значения рН 4 5. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт промывают водой, сушат и сгущают. Остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и изопропанола. Выход: 40% теории, т.пл.: 145-147*С C25H29N5O2 (431,54) Рассчитано: С 69,58 Н 6,77 N 16,23 Найдено: 69,53 7,01 15,98 Аналогично примеру 7 получают следующие соединения: 1) 5Е-6-[4-(2-циано-3-циклопропил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту т.пл.: 118°С (смесь сложного этилового эфира уксусной кислоты и изопропанола) с Н 2 2 2 з * ф 2 (389,46) Рассчитано: С 67,86 Н 5,95 N 17,98 Найдено: 67,61 6,04 17,79 2) Е/г-6-[4-(2-циано-3-циклопропил-1 метил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту Исходя из сложного метилового эфира 6-(4-метиламинофенил)6-(3-пиридил)гекс-5-еновой кислоты; очистку целевого продукта проводят хроматографией на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 20:1. Пена, значение R(: 0,25 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1). C 2 3 H 2 5 N 5 O 2 (403,49) Рассчитано: С 68,47 Найдено: 68,24 Н 6,25 N 17,36 6,40 17,52 5 10 15 20 25 30 35 40 45 50 55 ЗО П р и м е р 8. 5Е-6-{3-[2-циано-3-(2окси-1,1 -диметилэтил)гуанидино]фенил} -6(3-пиридил)гекс-5-еновая кислота а) Сложный метиловый эфир 5Е-6-[3(цианимидо-феноксиметиленамино)фенил]-6-(3-пиридил)гекс-5-еновой кислоты 8,4 г цианамида дифенилоксиметилена и 10,5 г сложного метилового эфира 5Е-6-(3-аминофенил)-6-(3-пиридил)гекс-5еновой кислоты растворяют в 100 мл изопропанола и перемешивают при комнатной температуре в течение пяти часов. Затем реакционную смесь сгущают и остаток очищают на силикагельсодеращей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 40:1. Выход: 86% теории, смола, значение Rf: 0,61 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1). С2бН24М4О3 (440,50) Рассчитано: С 70,89 Н 5,94 N 12,72 Найдено: 70,68 5,60 12,79 Аналогично примеру 8а получают следующие соединения: 1) Сложный метиловый эфир 5Е-6-[3(цианимидо-фенокси-метиленамино)-4метилфенил]-6-(3-пиридил)гекс-5-еновой кислоты т.пл.: 147-149'С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C27H26N4O3 (454,53) Рассчитано: С 71,35 Н 5,77 N 12,33 Найдено: 71,19 5,92 12,26 2) Сложный метиловый эфир 5Е-6-[3(цианимидо-фенокси-метиленамино)-5трифторметилфенил]-6-(3-пиридил)гекс-5еновой кислоты т.пл.: 148-149*0 (простой диизопропиловый эфир) C27H23F3N4O3 (508,5) Рассчитано: С 63,78 Н 4,56 N11,02 Найдено: 63,67 4,61 11,11 б) 5Е-6-{3-[2-циано-3-(2-окси-1,1диметилэтил)гуанидино]фенил}-6-(3-лиридил)гекс-5-еновая кислота 2,2 г сложного метилового эфира 5Е6-[3-(цианимидо-феноксиметиленамино)фенил]-6-(3-пиридил)гекс-5-еновой кислоты и 2 мл 2-окси-1,1-диметилэтиламина нагревают в 22 мл изопропанола нагревают с обратным холодильником в течение шести часов. Еще горячую реакционную смесь фильтруют и при температуре 50'С смешивают с 15 мл 2N натрового щелока. Реакционный раствор перемешивают при температуре 50*С в течение одного часа, затем сгущают и остаток смеши 31 26976 32 Рассчитано: С 72,24 Н 5,85 N 15,04 вают с водой. Водную фазу промывают Найдено: 72,07 5,88 14,82 сложным этиловым эфиром уксусной кис6) 5Е-6-[3-(2-циано-3-циклопропил-гуалоты и затем путем добавления лимоннидин)фенил]-6-(3-пиридил)гекс-5-еновую ной кислоты доводят до значения рН 4~ 5. Водную фазу экстрагируют сложным 5 кислоту, т.пл.: 125'С (разложение) C22H23N5O2 (389,50) этиловым эфиром уксусной кислоты, орРассчитано: С 67,85 Н 5,95 N 17,98 ганический экстракт сушат и сгущают. ОсНайдено: 67,62 5,90 17,74 таток очищают на силикагельсодержащеи 7) 5Е-6-[3-(цианимидо-пипередин-1 -илколонке с примением в качестве элюента смеси дихлорметана и этанола в объем- 10 метиленамино)фенил]-6-(3-пиридил)-гекс5-еновую кислоту, т.пл.: 197'С (разложеном соотношении 19:1. Продукт фракции ние, смесь воды и изопропанола) сгущают и остаток перекристаллизовывают С 2 4 Н Д 0 2 х 0,5 Н2О (417,51) из смеси сложного этилового эфира укРассчитано: С 67,58 Н 6,61 N 16,42 сусной кислоты и простого диизопропиШ Найдено: 67,72 6,72 16,21 лового эфира. 8) 5Е-6-[3-2-циано-3-трет.бутил-гуаниВыход 13% теории, т.пл,: 155'С (раздино)фенил]-6-(3-пиридил}гекс-5-еновую ложение) кислоту, т.пл.: 150-15ГС (разложение, C 2 3 H 2 7 N 5 O 3 (421,50) смесь этанола и простого диизопропилоРассчитано: С 65,54 Н 6,46 N 16,62 20 вого эфира) Найдено: 65,57 6,36 16,41 C213H27N5O2 (405,50) Аналогично примеру 8 получают слеРассчитано: С 68,12 Н 6,71 N 17,27 дующие соединения: Найдено: 67,94 6,78 17,08 1) 5Е-6-[3-(2-циано-3-(2-фенилэтил) 9) 5Е-6-[3-(2-циано-3-циклогексил-гуагуанидино]фенил-6-(3-лиридил)гекс-5-ено- 25 нидино)фенил]-6-(3-пиридил)гекс-5-еновую вую кислоту, т,пл.: 164*С (разложение, кислоту, т.пл.: 156°С (разложение, смесь смесь воды и изопропанола) сложного этилового эфира уксусной кисC27H27N5O2 (454,50) лоты и простого диэтилового эфира) Рассчитано: С 71,50 Н 6,00 N 15,44 C 2 5 H 2 9 N 5 O 2 (431,54) Найдено: 71,34 6,13 15,26 30 Рассчитано: С 69,58 Н 6,77 N 16,23 2) 5Е-6- {3-[цианимидо~(4-фенилпипеНайдено: 69,38 6,80 16,06 разин-1 -ил)метиленамино]фенил} -6-(3-пи10) 5Е-6-ЇЗ-(2-циано-3-циклопентилгуанидино)фенил]-6-(3-пиридил)гекс-5ридил)гекс-5-еновую кислоту, т.пл.: 125*С еновую кислоту, т.пл.: 136°С (разложение, (разложение, смесь воды и изопропано35 смесь сложного этилового эфира уксусла) ной кислоты и простого диэтилового C29H30N6O2 (494,61) эфира) Рассчитано: С 70,42 Н 6,11 N 16,99 C24H27N5O2 (417,51) Найдено: 70,20 5,99 17,19 Рассчитано: С 69,04 Н 6,57 N 16,77 3) 5Е-6-{3-[цианимидо-(4-фенилпи68,96 6,48 16,61 перидин-1-ил)-метиленамино]фенил}-6-(3- 40 Найдено: 11) 5Е-6-[3-(2-циано-3-изопропил-гуапиридил)гекс-5-еновую кислоту, т.пл.: нущинр)фенил]-6-(3-пиридил)гекс-5-еновую 119°С (разложение, смесь воды и изопрокислотуї т.пл.: 186°С (разложение, смесь панола) сложного этилового эфира уксусной кисС 3 0 НзЛО 2 (493,60) 45 лоты и простого диэтилового эфира) Рассчитано: С 73,00 Н 6,33 N 14,19 C22H2SN5O2 (391,47) Найдено: 72,73 6,25 14,05 Рассчитано: С 67,50 Н 6,44 N 17,89 4) 5Е-6- {3-[цианимидо(1,2,3,4-тетрагидНайдено: 67,31 6,50 17,71 роизохинолин-2-ил)-метиленамино] 12) 5Е-6-{3-{2-циано-3-(эксо-норборнфенил}-6-(3-пиридил)гекс-5-еновую кисло50 2-ил)гуанидино]фенил} -6-(3-пиридил)гексту, т.пл.: 194*С (разложение, смесь воды 5-еновую кислоту, т.пл.: 172-173"С (рази изопропанола) ложение, смесь изопропанола и простого C 2 a H 2 7 N 5 O 2 (465,60) диизопропилового эфира) Рассчитано: С 72,24 Н 5,85 N 15,04 C26H29N5O (443,55) Найдено: 72,06 5,97 14,94 S5 Рассчитано: 2С 70,41 Н 6,60 N 15,79 5) 5Е-6- (3-[2~циано-3-(индан-2-ил)гуНайдено: 70,50 6,63 15,63 анидино)фенил}-6~(3-пиридил)гекс-5-ено13) 5Е-6-|3-1цианимидо-(3,3-диметилвую кислоту липеридин-1 -ил)метиленаминоЗФенил| -6т.пл.: 132*С (разложение, этилацетат) (3-пиридил)гекс-5-еновую кислоту, т.гої. C J W > a (465,60) 138*С (разложение, смесь сложного эти 33 26976 лового эфира уксусной кислоты и простого диизопропилового эфира) C26H31N5O2 (445,56) Рассчитано: С 70,09 Н 7,01 Н 15,72 5 Найдено: 69,98 7,10 15,59 14) 5Е-6-[3-(2-циано-3-триметилсилилметил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту, т-.пл.: 92*С (разложение, смесь сложного этилового эфира уксусной кислоты и простого диэти- 10 лового эфира) C23H23N5O2Si (435,60) Рассчитано: С 63,42 Н 6,71 N 16,08 Найдено: 63,23 6,80 15,87 15) 5Е-6- {3-[2-циано-3-(3-лиридилме- 15 тил)-гуанидино]фенил} -6-(3-пиридил)-гекс5-еновую кислоту, т.пл.: 125-126"С (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) 20 C25H24N6O2 (440,51) Рассчитано: С 68,17 Н 5,49 N 19,08 Найдено: 67,96 5,52 18,93 16) 5Е-6- {3~[2-циано-3-( 1,1,3,3-тетраметилбутил)гуанидино]фенил}-6-(3-пири- 25 дил)гекс-5-еновую кислоту, т.пл.: 170°С (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) 30 C27H35N5O2 (461,61) Рассчитано: С 70,25 Н 7,64 N 15,17 Найдено: 70,25 7,73 15,12 17) 5Е-6-{3-[2-циано-3-(2-окси-1-метил-2-фенилэтил)-гуанидино]фенил}-6-(3пиридил)гекс-5-еновую кислоту, т.пл.: 152- 35 153*С (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C28H29N5O3 (483,57) Рассчитано: С 69,55 Н 6,05 Ы 14,49 40 Найдено: 69,43 6,16 14,38 18) 5Е-6-{3-[2-циано-3-(2-окси-1фенилэтил)гуанидино}фенил}-6-(3-пиридил)гекс-5-еновую кислоту, пена, значение f?f: 0,33 (смесь дихлорметана и эта- 45 нола в объемном соотношении 19:1) C 2 rH 2 7 N 5 O 3 (469,54) Рассчитано: С 69,07 Н 5,80 N 14,92 Найдено: 68,98 5,87 ' 14,80 19) 5Е-6-[3-(2-циано-3-метил-3-изоп- 50 ропил-гуанидино)фенилЗ-б-(З-пиридил)гекс-5-еновую кислоту, т.тт.: 168*С (смесь сложного этилового эфира уксусной кислоты и изопрояанола) 55 £23H27N5O2 (405,50) Рассчитано: С 68,13 Н 6,71 N 17,27 Найдено: 68,03 6,74 17,33 20) 5Е-6-[3-С2-цмано-3-бензия-гуаникислоту, т.гш.:Л38-140*С (смесь сложно 34 го этилового эфира уксусной кислоты и простого трет.бутилметилового эфира) C26H25N5O2 (439,52) Рассчитано: С 71,05 Н 5,73 N 15,93 Найдено: 71,04 5,76 15,94 21) 5Е-6- {3-[2-циано-3-(2-метилпропил)гуанидино]фенил}-6-(3-пиридил)гекс~ 5-еновую кислоту, т.пл.: 129*С (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C23H27N5O2 (405,50) Рассчитано: С 68,13 Н 6,71 N 17,21 Найдено: 68,03 6,72 17,08 22) 5Е-6-[3-(2-циано-3-неопентил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 115-116°С (смесь сложного этилового эфира уксусной кислоты и" простого трет.бутилметилового эфира) C24H29N5O2 (419,53) Рассчитано: С 68,71 Н 6,974 N 16,69 Найдено: 68,53 7,07 16,53 23) 5Е-6-[3-(2-циано-3-пентил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 140-142*С (смесь сложного этилового эфира уксусной кислоты и изопропанола) C24H29N5O2 (419,53) Рассчитано: С 68,71 Н 6,97 N 16,69 Найдено: 68,57 7,11 16,63 24) 5Е-6-[3-(2-циано-3,3-диметил-гуанидано)фенилЗ-6-(3-пиридил)гекс-5-еновую кислоту Получают аналогично примеру 26 путем взаимодействия с диметиламином в тугоплавкой трубке. Т.пл.: 194°С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C 2 ,H 2 3 N 5 O 2 (377,45) Рассчитано: С 66,83 Н 6,14 N 18,55 Найдено: 66,63 6,25 18,38 25) 5Е-6-[3~(2-циано-3-метил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту Получают аналогично примеру 26 путем взаимодействия с метиламином в тугоплавкой трубке. Т.пл.: 120*С (смесь сложного этилового эфира уксусной кислоты и изопропанола) C20H2tN5O2 (363,42) Рассчитано: С 66,10 Н 5,82 N 19,27 Найдено: 66,00 5,98 19,35 26) 5Е-6-[3-(2-цианогуанидино)фенилЗ-, 6-(3-пиридил)гекс-5-еновую кислоту 2,2 г сложного метилового эфира 6-[3-(2-цианимидо-феноксиметиленаминс^фенилЗ-б(3-пиридил)гекс-5-еновой кислоты и 4 , 8 г карбоната аммония перемешивают в 40 мл метанола при комнатной температуре в течение 72 часов. 35 26976 36 пент-4-еновую кислоту, т.пл.: 189'С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C22H25N5O2 (391,47) Рассчитано: С 67,50 Н 6,44 N 17,89 Найдено: 67,31 6,48 17,79 C 1 9 H 1 9 N 5 O 2 (349,39) 34)Е/2-5-[3-(2-циано-3-трет.бутил-гуа* Рассчитано: С 65,32 Н 5,48 N 20,04 нидино)фенил]-5-(3-пиридил)пент-4-еноНайдено: 65,17 5,53 19,87 29) 5Е-6-[3-(цианимидо-морфолин-1 - 10 вую кислоту, т.пл.: 146-148°С (смесь сложного этилового эфира уксусной кислоты и ил-метиленамино)фенил]-6-(3-пиридил)изопропанола) гекс-5-еновую кислоту, т.пл.: 189*С (смесь C 2 2 H 2 5 N 5 O 2 (391,47) воды и изопропанола) Рассчитано: С 67,50 Н 6,44 N 17,89 C 2 3 H 2 5 N 5 O 3 (419,49) 67,32 6,50 17,68 Рассчитано: С 65,86 Н 6,01 N 16,70 15 Найдено: 35) 6Е-7-[3-(2-циано-3*циклопропил.Найдено: 65,88 5,96 16,53 гуанидино)фенил]-7-(3-пирилил)гепт-628)5Е-6-{3-[2-циано-3-(2-диметиленовую кислоту аминоэтил)-гуанидино]фенил}-6-(3-пириПена, значение R(: 0,24 (силикагель: дил)гекс-5-еновую кислоту Пена, значение R(: 0,28 (смесь дих- 20 смесь дихлорметана и этанола в объемном соотношении 20:1) лорметана и метанола в* объемном соотC23H25N5O2 (403,49) ношении 9:1) Рассчитано: С 68,47 Н 6,25 N 17,36 C23H28N6O2 (420,51) Найдено: 68,40 6,39 17,20 Рассчитано: С 62,94 Н 6,90 N 19,17 36) 6Е-7-[3-(2-циано-3-циклогексилНайдено: 62,74 6,76 18,96 25 29) 5Е-6- {3-[2-циано-3-циклогексилмегуанидино)фенил]-7-(3-пиридил)гепт-6тил)-гуанидино]фенил}-6-(3-пиридил)-гексеновую кислоту 5-еновую кислоту, т.пл.: 11VC (смесь Пена, значение Rt: 0,26 (силикагель: сложного этилового эфира уксусной киссмесь дихлорметана и этанола в объемлоты и изопропанола) 30 ном соотношении 20:1) C26H31N5O2 (445,56) C26H31N5O2 х 0,5 сложного этилового эфира уксусной кислоты (445,57) Рассчитано: С 70,09 Н 7,01 Т 15,72 Рассчитано: С 68,69 Н 7,20 N 14,30 Найдено: 70,17 7,05 15,52 Найдено: 68,55 7,28 14,41 37) 6Е-7-(3-(2-циано-3-трет.бутил-гуа30) 5Е-6-{3-[2-циано-3-(3-метилбутил)- 35 нидино)фенил)-7-(3-пиридил)гепт-6-еновую гуанидино}фенил}-6-(3-пиридил)-гекс-5-енокислоту, т.пл.: 96°С (смесь сложного этивую кислоту, т.пл.: 108*С (разложение: смесь лового эфира уксусной кислоты и проссложного этилового эфира уксусной кислотого диизопропилового эфира) C ты и простого трет, бутил метилового эфира) 2 4 H 2 9 N 5 ° 2 (419,53) C24H29N5O2 (419,56) 40 Рассчитано: С 68,71 Н 6,97 Т 16,69 Рассчитано: С 68,71 Н 6,97 N 16,69 Найдено: 68,54 7,08 16,44 Найдено: 68,67 7,09 16,73 38) 7Е-8-{3-[2-Циано-3-(2-метилпро31)*5Е-6-[3-(2-циано-3-метокси-гуанипил)-гуанидино]фенил}-8-(3-пиридил)октдино)фенил]-6-(3-пиридил)гекс-5-еновую 7-еновую кислоту кислоту, т.пл.: 118*С (разложение: смесь 4S Пена, значение Rf: 0,62 (силикагельг сложного этилового эфира уксусной киссмесь дихлорметана и этанола в объемлоты и изопропанола) ном соотношении 9:1) С C20H21N5O3 (379,42) 25 Н зЛО 2 (433,55) Рассчитано: С 63,31 Н 5,58 N 18,46 Рассчитано: С 69,26 Н 7,21 N 16,15 Найдено: 63,19 5,53 18,28 50 Найдено: 69,14 7,30 15,99 32) 5Е-6-[3-(2-циано-3-метокси-3-ме39) 7Е-8-[3-(2-циано-3-трет.бутил-гуатил-гуанидино)фенил]-6-(3-пиридил)-гекснидино)фенил]-8-(3-пиридил)окт-7-еновую 5-еновую кислоту, т.пл.: 116*С (смесь кислоту, т.пл.: 136-138'С (сложный этилосложного этилового эфира уксусной кисвый эфир уксусной кислоты) лоты и простого диизопропилового эфира) 5 5 C 2 5 H 3 1 N 5 O 2 (433,55) C 2 ,H 2 3 N 5 O 3 (393,45) Рассчитано: С 69,26 Н 7,21 N 16,15 Рассчитано: С 46,11 Н 5,89 N 17,80 Найдено: 69,04 7,15 16,17, Найдено: 64,21 5,85 17,62 40) Е/г-6-{3-[2-циано-3-циклопропил33) E/Z-5- {3-[2-циано-3-(2-метилпро1-метил)-гуанидино]фенил}-6-(3-пирипил)-гуанидино]фенил}-5-(3-пиридил)дил)гекс-5-еновую кислоту, т.пл.: 158Реакционную смесь сгущают и остаток подвергают омылению в среде изопропанола путем добавления натрового щелока аналогично примеру 26. Т.пл.: 174'С • (смесь сложного этилового эфира уксус- 5 ной кислоты и изопропанола) 37 26976 16О'С (смесь сложного этилового эфира уксусной кислоты и изопропанола) C 23H25N5O2 (403,49) Рассчитано: С 68,47 Н 6,25 N 17,36 Найдено: 68,34 6,25 17,26 41) 5Е-6-[3-(2-циано-3-циклолропилгуанидино)-4-метилфенил}-6-(3-лиридил)гекс-5-еновую кислоту, т.пл.: 156158°С (смесь этилового эфира уксусной кислоты и простого диизопролилового эфира) С 2 5 Н 2 Л О 2 (431,54) Рассчитано: С 69,58 Н 6,77 Ы 16,23 Найдено: 69,39 6,93 16,29 42) 5Е-6-[3-(2-циано-3-неопентил-гуанидино)-4-метилфенил]-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 148-149*С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C25H31N5O2 (433,55) Рассчитано: С 69,26 Н 7,21 N 16,15 Найдено: 69,08 7,33 16,24 43) 5Е-6-[3-(2-циано-3-пропил-гуанидино)-4-метилфенил]-6-(3-пиридил)гекс-5еновую кислоту, т.пл.: 196-17ГС (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C 23 H 27 N 5 O 2 (405,50) Рассчитано: С 68,13 Н 6,71 N 17,27 Найдено: 67,95 6,87 17,24 44) 5Е-6-[3-(3-трет.бутил-2-циано-гуанидино)-4-метилфенил]-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 127-129*С (смесь сложного этилового эфира уксус• ной кислоты и простого диизопропилового эфира) C24H29N5O2 (419,53) Рассчитано: С 68,71 Н 6,97 N 16,69 Найдено: 68,56 7,05 16,84 45) 5Е-6-[3-(2-циано-3-циклог\ентилгуанидино)-5-трифторметилфенил]-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 152'С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C25H26F3N5O2 (485,51) Рассчитано: С 61,85 Н 5,40 N 14,42 Найдено: 61,73 5,50 14,48 46) 5Е-6-[3~(2-циано-3-(2-метилпропил)-гуанидино]-трифторметилфенил)-6-(3пиридил)гекс-5-еновую кислоту, т.пл.: 164°С (сложный этиловый эфир уксусной кислоты) С 2 4 Н 2 б Ї ^ А (473,50) Рассчитано- С 60,88 Н 5,53 Ы 14,79 Найдено: 60,69 5,47 14,88 47) 5Е-6-[3-(2-циано-3-(эксо-норборн2-ил)гуанидино]-5-трифторметилфенил)-6 5 10 15 20 25 30 35 40 45 50 55 38 (3-пиридил)гекс-5-еновую кислоту, т.пл.: 144-145'С (сложный этиловый эфир уксусной кислоты) C27H28F3N5O2 (511,55) Рассчитано: С 63,39 Н 5,42 N 13,69 Найдено: 63,25 5,42 13,58 48) 5Е-6-[3-(2-циано-3-циклогептилгуанидино)фенил|-6-(3-лиридил)гекс-5еновую кислоту, т.пл.: 178#С (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) СаНзЛОї (445,57) Рассчитано: С 70,09 Н 7,01 Ы 15,72 Найдено: 69,96 7,08 15,52 49) 5Е-6-[3-(2-циано-3-циклооктил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 154*С (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C27H33N5O2 (459,59) Рассчитано: С 70,56 И 7,24 N 15,24 Найдено: 70,39 7,18 15,14 50) 5Е-6-[3-(3-адамант-1-ил)-2-цианогуанидино)фенил]-6-(3-пиридил)гекс-5еновую кислоту, т.пл.: 148*С (разложение, смесь изопропанола и воды) С„Н 3 ,М 5 О г (483,61) Рассчитано: С 72,02 Н 6,88 N 14,48 Найдено: 71,86 6,85 14,45 П р и м е р 9. 6.[3-(2-Циано-3изопропил-гуанидино)фенил]-6-(3-пиридил)-гексановая кислота. а) 6-(3-Ацетиламинофенил)-6-(3-пиридил)гексанкарбоновая кислота. 9,75 г 6-(3-ацетиламинофенил)-6-(3пиридил)-гекс-5-еновой кислоты растворяют в 33 мл 1N натрового щелока и после добавления 1 г 10%-го палладия на угле гидрируют при комнатной температуре и далении водорода 5 бар в течение одного часа. Затем отфильтровы-' вают от катализатора, фильтрат доводят до значения рН 4,5 путем добавления лимонной кислоты и сгущают. Остаток кипятят три раза путем варения смесью метанола и этанола в объемном соотношении 9:1. Объединенные органические экстракты сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и метанола в объемном соотношении 19:1. Выход: 73% теорий, пена, значение R,: 0,72 (силикагель; смесь дихлорметана и метанола в объемном соотношении 9:1) C,9H22N2Q3 (326,40) Рассчитано; С 69,92 Н 6,79 Ы 8,58 Найдено: 69,70' 6С72 8,43 39 26976 40 Выход: 64% теории, т.пл.: 168-169*С б) Сложный метиловый эфир 6-(3-амиC22H27N5O2 (393,49) нофенил)-6-(3-пиридил)гексанкарбоновой Рассчитано: С 67,15 Н 6,92 N 17,80 кислоты. Найдено: 67,12 6,95 17,87 6,9 г 6-(3-ацетиламинофенил)-6-(3-пиАналогично примеру 9 получают слеридил)гексанкарбоновой кислоты в 40 мл 5 дующее соединение: 6-[3-(2-циано-39N метанольной соляной кислоты перетрет. бутил гуанидино)фенил ]-6-(3-пиридил)мешивают при комнатной температуре в гексанкарбоновую кислоту с точкой плавтечение 24 часов. Реакционную смесь сгущают, остаток смешивают с водой и подления 142*С (смесь сложного этилового щелачивают путем добавления карбоната 10 эфира уксусной кислоты и изопропанола). натрия. Водную-фазу экстрагируют слож" ' C23H29N5O2 (407,51) ным этиловым эфиром уксусной кислоты.. Рассчитано: С 67,79 Н 7,17 N 17,19 Органический экстракт промывают водой, Найдено:67,62 7,25 17,07 сушат и сгущают. Пример 10. 5Е-6-[3-(1-неопенВыход: 81% теории, масло, значение 15 тиламино-2-нитро)-этиленамино]фенил-6Rf: 0,52 (силикагель; смесь дихлорметана (3-пиридил)гекс-5-еновая кислота и этанола в объемном соотношении 19:1) а) Сложный метиловый эфчр 5Е-6-[3C18H22N2O2 (298,38) (1 -метилтио-2-нитро-этиленамино)фенил]Рассчитано: С 72,46 Н 7,43 N 9,39 6-(3-пиридил)гекс-5-еновой кислоты Найдено: „ 72,28 7,58 9,23 20 3 г сложного метилового эфира 5Е-6в) Сложный метиловый эфир 6-(3-циа(3-аминофенил)-6-(3-пиридил)гекс-5-енонимидо-фенрксиметиленамино)фенил)-6вой кислоты и 1,65 г 1,1-бис-(метилтио)(З-пиридил)гексанкарбоновой кислоты 2-нитроэтена в 50 мл изопропанола наг5,1 г сложного метилового эфира 6ревают с обратным холодильником в те(3-аминофенил)-6-{3-пиридил)гексанкарбо- 25 чение 20 часов. Реакционную смесь новой кислоты и 4,1 г дифеноксиметиленфильтруют, фильтрат сгущают и остаток цианамида в 130 мл изопропанола переочищают на силикагельсодержащей комешивают при комнатной температуре в. лонке с применением в качестве элюента течение четырех дней. Реакционную смесь смеси дихлорметана и этанола в объемсгущают и остаток очищают на силика- 30 ном соотношении ЗОЛ. Фракцию продукта гельсодержащей колонке с применением сгущают и остаток перекристаплизовывают в качестве элюента смеси дихлорметана из простого трет.бутилметилового эфира. и этанола в объемном соотношении 19:1. Выход: 63% теории, т.пл.: 84'С Выход: 9 1 % теории, смола, значение C ^ H ^ O . S (423,50) Rf: 0,54#(силикагель; смесь дихлорметана 35 Рассчитано- С61,00 Н5.61 N 10,16 S 7,75 и этанола в объемном соотношении 19.1) Найдено: 60,99 5,52 10,23 7,62 б) 5Е-2-[3-( 1 -неопентиламино-2-нитроC26H26N4O3 (442,52) этиленамино)фенил]-6-(3-лиридил)гекс-5Рассчитано: С 70,57 Н 5,92 N 15,66 еновая кислота Найдено: 70,41 6,03 15,68 Z, 1 г сложного метилового эфира 5Е- • г) 6-[3-(2-циано-3-изопропил-гуаниди- 40 6-[3-( 1 -метилтио-2-нитро-этиленамино)фено)фенил]-6-(3-пиридил)гексанкарбоновая нил]-6-(3-пиридил)гекс-5-еновой кислоты кислота 3,1 *г сложного метилового эфира 6и 2,4 мл неопентиламина в 20 мл изоп(З-цианимидо-феноксимегиленамино)феропанола нагревают с обратным холодильнил)-6-(3-пиридил)гексанкарбоновой кис- 45 ником в течение 5 часов. Реакционную лоты и 5 мл изопропиламина в 50 мл смесь смешивают при температуре 60°С изопропанола нагревают с обратным хо- с 10 мл 2N натрового щелока и перемелодильником в течение трех часов. Затем • шивают при этой температуре в течение при температуре 50*С добавляют 10 мл 30 минут. Затем реакционный раствор сгу2N натрового щелока и реакционный раст- 50 ицают, остаток смешивают с водой и вод- ' вор перемешивают при этой температуре ную фазу промывают сложным этиловым в течение 30 минут. Затем сгущают, осэфиром уксусной кислоты. Водную фазу таток смешивают с водой и промывают доводят до значения рН 4-5 путем добавсложным этиловым эфиром уксусной кисления лимонной кислоты и экстрагируют лоты. Водную фазу доводят до значения 55 сложным этиловым эфиром уксусной кисрН 4-5 путем добавления лимонной кислоты. Органический экстракт сгущают и лоты, получаемый осадок отсасывают и остаток перекристаллизовывают из смеси перекристаллизовывают из смеси сложводы и изопропанола. ного этилового эфира уксусной кислоты и Выход: 70% теории, т.пл.: 190-19ГС изопропанола. C?4H30N4O4 (438,53) 41 26976 Рассчитано: С 65,73 Н 6,90 N 12,78 Найдено: 65,62 6,98 12,61 Аналогично примеру 10 получают следующее соединение: 5Е-6-[3-( 1 -циклогексиламино-2-нитро- 5 этиленамино)фенил]-6-(3-пиридил)гекс-5еновую кислоту с точкой плавления 155157*С (смесь сложного этилового эфира уксусной кислоты и изопропанола). 10 C25H30N4O4 (450,54) Рассчитано: С 66,65 Н 6,71 N 12,44 Найдено: 66,61 6,71 12,39 П р и м е р 11. 5Е-6-[3-(2,2-Дициано(2-метилпропиламино)этиленамино)фенил]15 6-(3-пиридил)гекс-5-еновая кислота. а) Сложный метиловый эфир 5Е-6-[3(2,2-дициано-1 -метилтио-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновой кислоты. 13,4 г сложного метилового эфира 5Е- 20 6-[3-(аминофенил)-6-(3-пиридил)]гекс-5еновой кислоты и 7,7 г 2,2-дициано-1,1бис(метилтио)этена в 130 мл изопропанола нагревают с обратным холодильником в течение 6 часов. Реакционную смесь 25 сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира. Выход: 45% теории, т.пл.: 125-127*С 30 C23H22N4O2S (418,51) Рассчитано: С 66,01 Н 5Д) N 13,39 S 7,66 Найдено: 65,97 5,27 13,49 7,66 б) 5Е-6-{3-[2,2~дициано- 1 -(2-метилпропиламино)этиленамино]фенил}-6-(3-пири- 35 дил)гекс-5-еновая кислота 4 г сложного метилового эфира 5Е-6[3-(2,2-дициано-1 -метилтио-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновой кислоты и 10 мл 2-метилпропиламина в 80 40 мл изопропанола нагревают с обратным холодильником в течение 4 часов. Реакционную смесь смешивают при температуре 40°С с 10 мл 2N натрового щелока и перемешивают при этой температуре в 45 течение одного часа. Затем сгущают, остаток смешивают с водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения рН 4-5 путем добавления лимонной кис- 50 лоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сгущают и остаток очищают на силикагельсодержащей колонке смесью дихлорметана и этанола в объемном соот- 55 ношении 29:1. Выход: 68% теории, пена, значение R(: 0,48 (силикагель; смесь дихлорметана и этанола в объемном соотношении 19:1). C25H27NSCV(429,52) 42 Рассчитано: С 69,91 Н 6,34 N 16,30 Найдено: 69,70 6,23 16,16 Аналогично примеру 11 получают следующие соединения: 1) 5Е-6-[3-(2,2-дициано-1-изопропиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 164165'С (смесь сложного этилового эфира уксусной кислоты и простого диэтилового эфира) C24H25N5O2 (415,49) Рассчитано: С 69,38 Н 6,06 N 16,86 Найдено: 69,22 6,11 16,68 2) 5Е-{3-[2,2-дициано-1 -(3-метилбутиламино)-этиленамино]фенил}-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 139°С (смесь сложного этилового эфира уксусной кислоты и простого диэтилового эфира) C26H29N5O2 (443,55) Рассчитано: С 70,41 Н 6,59 N 15,79 Найдено: 70,41 6,72 15,61 3) 5Е-6-[3-(2,2-дициано-1 -циклопентиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 150#С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C26H27N5O2 (441,53) Рассчитано: С 70,73 Н 6,16 N 15,86 Найдено: 70,55 6,27 15,90 4) 5Е-6-(3-(2,2-дициано-1 -неопентиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 116*С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C26H29N5O2 (443,55) Рассчитано: С 70,41 Н 6,59 N 15,79 Найдено: 70,29 6,63 15,65 5) 5Е-6-[3-(2,2-дициано-1 -циклопропиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновую кислотуї т.пл.: 173"С (смесь сложного этилового эфира уксусной кислоты и простого трет, -бутилметилового эфира) C24H23N5O2 (413,48) Рассчитано: С 69,72 Н 5,61 N 16,94 Найдено: 69,57 5,77 17,05 6) 5Е-6-[3-(2,2-дициано-1-бензиламино-этиленамино)фенил]-6-(3-пиридил)гекс5-еновую кислоту, т.пл.: 154*С (смесь изопропанола и воды) C28H25N5O2 (463,54) Рассчитано: С 72,55 Н 5,44 N 15,11 Найдено: 72,42 5,59 15,02 7) 5Е-6-[3-(2,2-дициано-1 -пропиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту, т.пл.: 116*С (смесь сложного этилового эфира уксусной кис 43 26976 44 2,1 г сложного метилового эфира 5Елоты и простого диизопропилового эфи6-(3-(2,2-дициано-1 -метилтио-этиленамира) CMH25N5O2 (415,49) но)фенил)-6-(3-пиридил)гекс-5-еновой кисРассчитано: С 69,38 Н 6,06 N 16,86 лоты растворяют в 100 мл дихлорметана, Найдено: 69,25 6,13 16,77 5 после чего добавляют 1,9 г 3-хлорпер8) 5Е-6-[3-(2,2-дициано-1 -метиламинобензойной кислоты и перемешивают при этиленамино)фенил]-6-(3-пиридил)-гекс-5комнатной температуре в течение одного еновую кислоту часа. Затем реакционную смесь смешиПолучают аналогично примеру 56 пувают с 10 мл трет, бутиламина и переметем взаимодействия с метиламином в ту- ^ шивают при комнатной температуре в те# гоплавкой трубке. Т.пл.: 178 С, (сложный чение 12 часов. Реакционную смесь проэтиловый эфир уксусной кислоты) мывают водой, сгущают, остаток смешиСаЛДЛ (387,44) вают с 20 мл этанола и 20 мл 1N натроРассчитано: С 68,20 Н 5,46 N 18,08 Найдено: 68,10 5,58 18,12 15 вого щелока и нагревают до температуры 50*С в течение трех часов. Реакционный 9) 5Е-6-[3-(2,2-дициано-1 -диметиламираствор сгущают, остаток'смешивают с но-этпенамино)фенил]-6-(3-пиридил)гексводой и промывают сложным этиловым 5-еновую кислоту эфиром уксусной кислоты. Водную фазу Получают аналогично примеру 56 путем взаимодействия с диметиламином в 20 доводят до значения рН 4 - 5 путем дотугоплавкой трубке. Т.пл.: 147*С (сложный бавления лимонной кислоты и экстрагиэтиловый эфир уксусной кислоты) руют сложным этиловым эфиром уксусC23H23N5O2 (401,47) - ной кислоты. Органическую фазу сгущают Рассчитано: С 68,81 Н 5,77 N 17,44 и остаток очищают на силикагельсодерНайдено: 68,75 5,83 17,28 25 жащей колонке с применением в качест10) 5Е-6-{3-[2,2-дициано-1 -(эксо-норве элюента смеси дихлорметана и этаноборн-2-иламино)-этиленамино]фенил}-6ла в объемном соотношении 20 :1. Фрак(3-лиридил)гекс-5-еновую кислоту, т.пл.: цию продукта сгущают и остаток перек154-156*С (простой трет.бутилметиловый ристаллизовывают из смеси сложного этиэфир) 30 лового эфира уксусной кислоты и просC28H29N5O2 (467,57) того диизопропилового эфира. Рассчитано: С 71,93 Н 6,25 N 14,98 Выход: 43 % теории, т.пл.: 188-189*С Найдено: 71,81 6,31 14,87 C 2 5 H 2 7 N 5 O 2 (429,52) 11) 5Е-6-[3-(2,2-дициано-1 -циклооктиРассчитано: С 69,91 Н 6,34 N 16,30 ламино-этиленамино)фенилЗ-6-(3-пири69,71 6,37 16,18 дил)гекс-5~еновую кислоту, т.пл.: 167- 35 Найдено: Аналогично примеру 12 получают сле169*С (сложный этиловый эфир уксусной кислоты) дующие соединения: 1) 5Е-6-[3-( 1 -адамант-1 -иламино-2,2C29H33N5O2 (483,61) Рассчитано: С 72,02 Н 6,88 N 14,48 дициано-етиленамино)-фенил]-6-(3-пириНайдено: 72,00 6,94 14,40 40 дил)гекс-5-еновую кислоту с точкой плав12) 5Е-6-[3-(2,2-дициано-1 -циклопенления 142°С (смесь изопропанола и простиламино-этиленамино)фенил]-6-(3-пиритого диизопропилового эфира). дил)гекс-5-еновую кислоту, т. пл.: 140G31H33N5O (507,64) 142*С (сложный этиловый эфир уксусной _ Рассчитано: 2С 73,35 Н 6,55 N 13,80 д 413 кислоты) Найдено: 73,22 6,61 13,71 CfcHaiNA (469,59) 2) 5Е-6-[3-(2,2-дициано-1 -диэтилаРассчитано: С 71,62 Н 7,07 N 14,91 мино-этиленамино)фенил]-6-(3-пиридил)Найдено: 71,49 7,16 14,84 гекс-5-еновую кислоту с точкой плавле13) 5Е-6-[3-(2,2-дициано-1-циклопен- 50 н и я 118'С (смесь сложного этилового эфитиламино-этиленамино)-5-трифторметил~ ра уксусной кислоты и простого диизопфенил]-6-(3-пиридил)гекс-5-еновую кислоропилового эфира). ту, т. пл.: 118*С (смесь сложного этилоC25H27N5O2 (429,52) вого эфира уксусной кислоты и простого Рассчитано: С 69,91 Н 6,34 N 16,30 диизопропилового эфира) 55 Найдено: 69,73 6,46 16,24 C27H28F3N5O2 (509,54) П р и м е р 13. Ег-6-{4-[2-(2-цианоРассчитано: С 63,65 Н 5,14 N 13,74 3-трет.бутил-гуанидино)этил]фенил}-6-(3Найдено: 63,50 5,25 13,57 пиридил)гекс-5-еновая кислота. П р и м е р 12. 5Е-6-(3-(2,2-дицианоа) Сложный метиловый эфир E/Z-61-трет.бутиламино-этиленамино)фенил)-6[4-(2-цианимидо-феноксиметиленамино(3-пиридил)гекс-5-еновая кислота. 45 46 26976 этил]фенил}-6-(3-пиридил)гекс-5-еновой кислоты 26,5 г Е/2-6-{4-[2-(ацетиламино)этил]фенил}-6-(3-пиридил)-гекс-5-еновой кислоты в 200 мл 6N соляной кисло- 5 ты нагревают с обратным холодильником в течение 12 часов. Реакционный раствор сгущают, остаток смешивают с 200 мл 2N метанольной соляной кислоты и пер*емешивают при комнатной температуре в те- 10 чение 12 часов. Реакционный раствор сгущают, остаток растворяют в воде и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу подщелачивают при температуре 0*С путем добав- 15 ления концентрированного аммиака и экстрагируют дихлорметаном. Органический экстракт промывают водой, сушат и сгущают. Остаток вместе с 14,9 г дифеноксиметиленцианамида в 300 мл изопропа- 20 нола перемешивают при комнатной температуре в течение 14 часов. Растворитель выделяют и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлор- 25 метана и этанола в объемном соотношении 30 : 1 . Выход: 80 % теории, масло, значение Rf: 0,72 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1) 30 C28H28N4O3 (468,56) Рассчитано: С 71,78 Н 6,02 N 11,96 Найдено: 71,64 6,08 11,85 б) Е/г-6-{4-[2-(2-циано-3-трет.бутилгуанидино)этил]фенил}-6-(3-пиридил)- 35 гекс-5-еновая кислота 2,35 г сложного метилового эфира Е/ 2-6-(4-(2-цианимидо-феноксиметиленамино)этил)фенил)-6-(3-пиридил)гекс-5-еновой кислоты и 3 мл трет, бутиламина в 40 40 мл изопропанола кипятят с обратным холодильником в течение трех часов. Затем реакционный раствор смешивают с 10 мл 2N натрового щелока при температуре 50*С и перемешивают при этой температуре в 45 течение 30 минут. Реакционный раствор сгущают, остаток смешивают с водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения рН 4 - 5 путем, добавления ли- 50 монной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт промывают водой, сгущают и остаток очищают на силикагельсодержащей колонке с применением в ка- 55 честве элюента смеси дихлорметана и этанола в объемном соотношении 20 : 1. Выход: 55 % теории, пена, значение Rf: 0,64 (смесь дихлорметана и этанола в объемном соотношении 9 : 1 ) C25H31N5O2 (433,55) Рассчитано: С 69,26 Н 7,21 N 16,15 Найдено: 69,27 7,29 15,95 Аналогично примеру 13 получают следующее соединение: Е/2-6-(4-(2-(2-циано~3-(2-метилпропил)гуанидино)этил)фенил)-б-(З-пиридил) гекс-5-еновую кислоту в виде смолы. Значение Rf: 0,48 (смесь дихлорметана и этапола в объемном соотношении 9 :1) * C25H31N5O2 (433,55) Рассчитано: С 69,26 Н 7,21 N 16,15 Найдено: 69,17 7,26 16,17 П р и м е р 14. Метиламид 5Е-6{3-[2,2-дициано-1 -(2-метилпропиламино)этиленамино]фенил}-6-(3-пиридил)гекс-5еновой кислоты 1,1 г 5Е-6-{3-[2,2-дициано-1-(2-ме~ тилпропиламино)-этиленамино]фенил}-6(3-пиридил)гекс-5-еновой кислоты растворяют в 20 мл абсолютного тетрагидрофурана. Затем добавляют 0,5 г карбонилдиимидазола, перемешивают до окончания выделения газа и добавляют 0,09 г метиламина. Реакционную смесь перемешивают при комнатной температуре в течение 12 часов, затем смешивают с 2 мл воды и сгущают. Остаток смешивают со сложным этиловым эфиром уксусной кислоты. Органический экстракт промывают водой, сушат, сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 14 : 1. Выход: 60 % теории, пена, значение Rf: 0,61 (силикагель; смесь дихлорметана и этанола в объемном соотношении 9 : 1 ) C 2 6 H 3 0 N 6 O (442,56) Рассчитано: С 70,56 Н 6,83 N 18,99 Найдено: 70,39 6,86 18,82 Аналогично примеру 14 получают следующие соединения: 1) Диметиламид 5Е-6-(3-(2,2-дициано1-(2-метилпропиламино)-этиленамино)-фенил)-6-(3-лиридил)гекс-5-еновой кислоты пена, значение Rf: 0,63 (силикагель; смесь дихлорметана и этанола в объемном соотношении 9 : 1 ) C 2 7 H 3 2 N 6 O (456,59) 2 7 3 2 6 Рассчитано: С 71,03 Н 7,06 Н 18,41 Найдено: 70,83 7,17 18,43 2) Сложный метиловый эфир 5Е-6(3-(2,2-дициано-1 -(2-метилпропиламино)этиленамино)фенил)-6-(3-пиридил)гекс-5еновой кислоты т.пл.: 127-129'С (простой трет.бутилметиловый эфир) C26H29N5O2 (443,55) Рассчитано: С 70,41 Н 6,59 Н 15,79 Найдено: 70,45 6,62 15,83 47 26976 48 10) Сложный циклогексиловый эфир 3) Сложный метиловый эфир 5Е-65Е-6-{3-[2-циано-3-(2-метилпропил)(3-(2,2-дициано-1-изопропиламино)-этилегуанидино]фенил}-6-(3-пиридил)гекс-5намино)фенил)-6-(3-пиридил)гекс-5-еновой еновой кислоты, масло, значение R{: 0,42 кислоты, т.пл.: 159°С (простой диизопропиловый эфир) 5 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1) C 2 5 H 2 7 N 5 O , (429,52) Рассчитано: С 69,91 Н 6,34 N 16,31 C 2 9 H 37 N A (487,65) Найдено: 69,87 6,41 16,48 Рассчитано: С 71,43 Н 7,65 N 14,36 4) Сложный 2-метилпропиловый эфир Найдено: 71,38 7,68 14,18 5Е-6- {3-[2-(2-дициано-1 -изопропиламино)- 10 П р и м е р 15. 5Е-6-[3-(3-неопенэтиленаминоЗфенил} -6-(3-пиридил)гекс-5тил-2-фенилсульфонил-гуанидино)фенил]еновой кислоты, масло, значение Rf: 0,53 6-(3-пиридил)гекс-5-еновая кислота. (силикагель; смесь дихлорметана и этаа) Дифеноксиметилен-фенилсульфонанола в объемном соотношении 20 : 1) мид С Л А А (471,61) . 15 13,5 г дихлор-дифеноксиметана и 17,3 Рассчитано: С 71,31 Н 7,05 N 14,85 г фенилсульфонамида в 16Q мл сложного Найдено. 71,10 7,16 15,09 этилового эфира уксусной кислоты наг5) Сложный изопропиловый эфир 5Еревают с обратным холодильником в те6- {3-[ 2-(2-дициано-1 -изопропиламино)чение 48 часов. Реакционную смесь cry* этиленамино]фенил}-6-(3-пиридил)гекс-5- 20 «дают, остаток смешивают с водой и пуеновой кислоты, т.пл/. 1 W C (смесь сложтем добавления бикарбоната натрия довоного этилового эфира уксусной кислоты и дят до значения рН 8. Водную фазу экстпростого диизопропилового эфира) рагируют сложным этиловым эфиром укC27H31N5O2 (457,58) сусной кислоты. Органический экстракт Рассчитано: С 70,87 Н 6,83 N 15,31 Найдено: 70,65 6,99 15,35 25 сгущают, остаток нагревают в дихлорметане и фильтруют. Фильтрат сгущают и 6) Сложный изопропиловый эфир 5Еостаток очищают на силикагельсодержа6-{3-[2-циано-3-(2-метилпропил)-гуанищей колонке с применением в качестве дино]фенил}6-(3-пиридил)гекс-5-еновой элюента дихлорметана. Фракцию продуккислоты, масло, значение R,: 0,35 (сили30 та сгущают и остаток перекристаллизокагель; смесь дихлорметана и этанола в вывают из смеси сложного этилового эфиобъемном соотношении 20 : 1) ра уксусной кислоты и простого диизопC 2 4 H 2 9 N 5 O 2 (419,53) ропилового эфира. Рассчитано: С 68,71 Н 6,97 N 16,69 Выход: 26 % теории, т.пл.: 121-122*С Найдено: 68,52 7,12 16,50 35 C19H15NO4S (353,40) 7) Сложный 2-метилпропиловый эфир Рассчитано: С 64,58 Н4.28 N 3,96 S 9,07 5Е-6-{3-[2-циано-3-(2-метилпропил)Найдено: 64,60 4,41 3,94 8,94 гуанидино]фенил}-6-(3-пиридил)гекс-5Аналогично примеру 15а получают слееновой кислоты, масло, значение Rf: 0,38 дующее соединение: (силикагель; смесь дихлорметана и эта/ 40 Дифеноксиметилен-метилсульфонанола в объемном соотношении 20 : 1) мид, т.пл.: 124*С (смесь сложного этилоC 2 7 H 35 N A (461,61) вого эфира уксусной кислоты и простого Рассчихано: С 70,25 Н 7,64 N 15,17 диизопропилового эфира). Найдено: 70,04 7,78 14,98 C14H13NO4S (291,33) 8) Сложный изопропиловый эфир 5Е45 Рассчитано: С 57,72 Н 4,50 N 4,81 S 11,01 6-{3-[2-циано-3-(2-метилпропил)Найдено: 57,62 4,58 4,87 11,10 гуанидино]фенил}-6-(3-пиридил)гекс-5б) Сложный метиловый эфир 5Е-6-[3еновой кислоты, масло, значение Rf: 0,37 (фенилсульфонимидо-феноксиметилена(силикагель; смесь дихлорметана и этамино)фенил]-6-(3-пиридил)гекс-5-еновой нола в объемном соотношении 20 : 1) 50 кислоты C 2 6 H 2 7 NA (447,58) 3,5 г дифенилоксиметилен-фенилсульРассчитано: С 69,77 Н 7,43 N 15,65 фонамида и 3 г сложного метилового эфиНайдено: 69,65 7,55 15,51 ра 5Е-6-(3-аминофенил)-6-(3-пири9) Амид 5Е-6-[3-(2,2-дициано-1-изопродил)гекс-5-еновой кислоты в 60 мл изоппиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновой кислоты, т.пл.: 123°С (смесь 55 ропанола перемешивают при комнатной сложного этилового эфира уксусной кислоты температуре в течение 48 часов. Реаки простого диизопропилового эфира) ционную смесь сгущают и остаток очиC24H26N6O (414,50) щают на силикагельсодержащей колонке Рассчитано: С 69,55 Н 6,32 N 20,28 с применением в качестве элюента дихНайдено: 69,46 6,43 20,42 лорметана. Фракцию продукта сгущают и 49 26976 остаток перекристаллизовывают из смеси простого диэтилового эфира и петролейного эфира. Выход: 86 % теории, т.пл.: 90-92'С C3,H29N3Q5S (555,65) Рассчитано: С 67,01 Н 5 3 N7,56 S 5,77 НЕЙРЄНО: 66,82 535 7,63 5,81 Аналогично примеру 156 получают следующее соединение: Сложный метиловый эфир 5Е-6-[Заметил сульфонимидо-феноксиметиленамино)фенилЗ-6-(3-пмридил)гекс-5-еновой кислоты, т.пл.: 101-102*С (смесь сложного этилового эфира уксусной кислоты и петролейного эфира) C26H27N3O5S (493,58) Рассчитано: С 63,27 Н 5,51 N 8,51 S 6,50 Найдено: 63,39 5,58 8,56 6,59 а) 5Е-6-[3-(3-неолентил-2-фенилсульфонил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновая кислота 2,4 г сложного метилового эфира 5Е6-(3-фенилсульфонимидо-феноксиметиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты и 2,4 мл неопентиламина в 40 мл изопропанола нагревают с обратным холодильником в течение одного часа. Затем охлаждают до температуры 50*С, реакционный раствор смешивают с 10 мл 2N натрового щелока и перемешивают при температуре 50°С в течение 30 мин. Реакционную смесь сгущают, остаток смешивают с водой и экстрагируют сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения рН 4 - 5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и изопропанола. Выход: 91 % теории, т.пл.: 159-160'С с Н (534,58) 29 здНА$ Рассчитано: С 65,15 Н 5,41 N 10,48 S 6,00 Найдено: 65,05 6,52 10,48 6,04 Аналогично примеру 15в получают следующие соединения: 1) 5Е-6-[3-(3-трет.бутил-2-фенилсульфонил-гуанидино)фенил}-6-(3-пиридил)гекс-5-еновую кислоту в виде пены. Значение R(: 0,20 (смесь дихлорметана и этанола в объемном соотношении 30 : 1) C 2 8 H 3 2 N 4 O 4 S (520,65) Рассчитано: С 64,59 Н 6,19 Н 10,76 S 6,16 Найдено: 65,39 6,27 10,61 6,13 2) 5Е-6- {3-[3-(2-метилпропил)-2-фенилсульфонил-гуанидиноЗфенил}-6-(3-пиридил)гекс-5-еновую кислоту с т.пл.: 124 5 10 15 20 25 30 35 40 45 50 55 50 125°С (сложный этиловый эфир уксусной кислоты). C28H32N4O4S (520,65) Раосниана С 64,59 Н 6,19 N 10,76 S 6,16 Найдено: 64,45 624 10,59 6,11 3) 5Е-6-[3-(3-неопентил-2-метилсульфонил-гуанидино)-фенил]-6-(3-пиридил)гекс-5-еновую кислоту с т.пл.: 143144*С (смесь сложного этилового эфира уксусной кислоты и изопропанола). C24H32N4O4S (472,61) Рассчитано: С 60,99 Н 6,83 N 11,86 S 6,78 Найдено: 80.S7 6,95 11,79 6,73 4) 5Е-б-{3-[3-(2-метилпропил)-2-фенилсульфонил-гуанидино]-фенил} -6-(3-пиридил)гекс-5-еновую кислоту с т.пл.: 158°С (смесь сложного этилового эфира уксус^ ной кислоты и изопропанола). C23H30N4O4S (458,58) Рассчитано: С 60,24 Н 6,59 N 12,22 S 6,99 Найдено; 60,15 6,65 12,08 6,92 5) 5Е-6-[3-(3-циклопентил-2-метилсульфонил-гуанидино)-фенил]-6-(3-пиридил)гекс-5-еновую кислоту с т.пл. 169170°С (смесь сложного этилового эфира уксусной кислоты и изопропанола). C24H30N4O4S (470,59) Рассчитано:С 61,26 Н 6,43 N 11,91 S 6,81 Найдено: 61,41 6,45 12,10 6,90 6) 5Е-6-[3-(3-трет.бутил-2-метилсульфонил-гуанидино)-фенил]-6-(3-пиридил)гекс-5-еновую кислоту с т.пл.: 15015 ГС (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира). C23H30N4O4S (458,58) Рассчитано: С 60,24 Н 6,59 N 12,22 S 6,99 Найдено: 60,33 6,62 12,35 7,04 7) 5Е-6-[3-(3-циклопентил-2-фенилсульфонил-гуанидино)-фенил]-6-(3-пиридил)гекс-5-еновую кислоту с т.пл.: 116117'С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира). C29H32N4O4S (532,66) Рассчитано: С 65,39 Н 6,06 N 10,52 5 6,02 Найдено: 65,20 6,08 10,39 6,19 П р и м е р 16. 5Е-6-{3-[2-амидосульфонил-3-(2-метиллропил)гуанидино]фенил}-6-(3-пиридил)гекс5-еновая кислота. а) Сложный метиловый эфир 5£-6-[3-, (сульфамоилимидо-феноксиметиленамино)-фенилЗ-6-(3-пиридил)гекс-5-еновой кислоты 2,4 г М-сульфамоид-дифения-имидокарбоната и 3 г сложного метилового эфира 5 Е - 6 - ( 3 - а м и н о ф е н и л ) - 6 - ( 3 - п и р и дил)гекс-5-еновой кмслоты растворяют в 60 мл изопропанола и* перемешивают при 51 26976 комнатной температуре в течение 36 часов. Растворитель удаляют и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 40 : 1. Выход: 89 % теории, масло, значение Rf: 0,59 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1) C25H26N4O4S (494,57) Рассчитано: С 60,-71 Н 5,30 N 11,33 S 6,48 Найдено: 60,55 5,43 11,18 6,39 б) 5Е-6- {3-(2-амидосульфонил-3-(2-метилпропил)гуанидино]фенил}-6-(3-пиридил)гекс-5-еновая кислота 2,2 г сложного метилового эфира 5Е6-[3-(сульфамоилимидо-феноксиметиленамино)фенил]-6-(3-пиридил)гекс-5-еновой кислоты и 5 мл метилпропиламина в 50 мл изопропанола кипятят с обратным холодильником в течение1четырех часов. Реакционной смеси дают охлаждаться до температуры 50*С, после чего ее смешивают с 10 мл 2N натрового щелока и перемешивают при температуре 50'С в течение 60 мин. Реакционную смесь сгущают, остаток смешивают с водой и экстрагируют сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения рН 4 - 5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 30 : 1. Фракциюпродукта сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира. Выход: 38 % теории, т.пл.: 98°С ZJ*2>"B°4 (459,57) Рассчитано:С 57,50 Н 6,36 N 15,24 S 6,98 Найдено: 57,62 6,51 15,38 6,05 Аналогично примеру 166 получают следующие соединения: 1) 5Е-6-(3-(2-амидосульфонил-3-неопентил-гуанидино)фенил)-6-(3-пиридил)гекс-5-еновую кислоту с т.пл.: 136140'С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) C23H31N5O4S (473,60) Рассчитано: С 58,33 Н6.60 N 14,79 S 6,77 Найдено: 58,28 6,73 14,53 6,50 2) 5Е-6-[3-(2-амидосульфонил-3-циклопентил-гуанидино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту с т.пл.: 95'С разложение; (смесь сложного этилового C 5 10 15 20 25 30 35 40 S 45 50 55 52 эфира уксусной кислоты и простого диизопропилового эфира). C23H2gN5O4S (471,58) Рассчитано: С 58,58 Н6,20 N 14,85 S 6,80 Найдено: 58,29 6,33 14,65 6,68 П р и м е р 17. 5Е-6-{3-[2-карбамоил-2-циано-1-(2-метилпропиламино)этиленамино]фенил} -6-(3-пиридил )гекс5-еновая кислота 1,5 г сложного метилового эфира 5Е6-(3-аминофенил)-6-(3-аминофенил)-6- (3пиридил)гекс-5-еновой кислоты и 0,95 г 1 -карбамоил-1 -циано-2,2-бис(метилтио)этена в 25 мл изопропанола кипятят с обратным холодильником в течение 20 ч. Реакционную смесь сгущают, маслянистый остаток смешивают с 40 мл изопропанола и подают в 5 мл 2-метилбутиламина. Реакционную смесь кипятят с обратным холодильником в течение четырех часов и затем смешивают при температуре 50*С с 10 мл 2N натрового щелока. Реакционный раствор перемешивают при температуре 50*С в течение 30 мин и затем его сгущают. Остаток смешивают с водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения рН 4 - 5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сушат, сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 30 : 1. Выход: 40 % теории, пена, значение Rf: 0,38 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1) C25H29N5O3 (447,54) Рассчитано: С 67,09 Н 6,53 N 15,65 Найдено: 66,94 6,63 15,69 Аналогично примеру 17 получают следующие соединения: 1) 5Е-6-[3-(2-карбамоил-2-циано-1 циклопентиламино-этиленамино)фенил]-6(3-пиридил)гекс-5-еновую кислоту в виде пены. Значение Rf: 0,35 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1) C26H29N5O3 (459,55) Рассчитано: С 67,95 Н 6,36 N 15,24 Найдено: 67,99 6,48 15,062) 5Е-6-[3-(2-карбамоил-2-циано-1пропиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту с т.пл.: 161163*С (смесь сложного этилового эфира уксусной кислоты и изопропанола). С24Н27М5О3 (433,51) Рассчитано: С 66,50 Н 6,28 N 16,16 Найдено: 66,37 6,42 16,05 53 26976 3) 5Е-6-[3-(2-карбамоил-2-циано-1 -диметиламино-этиленамино)фенил}-6-(3~нпиридил)гекс-5-еновую кислоту в виде пены. Значение Rf: 0,34 (силикагель; смесь дихлорметана и этанола в объемном соот- 5 ношении 10 : 1) C23H25N5O3 (419,50) Рассчитано: С 65,85 Н 6,01- N 16,69 Найдено: 65,69 6,10 16,54 4) 5Е-6-[3-{2-циано-2-метоксикарбо~ 10 нил-1 -(2-метилпропиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновую кислоту Получают аналогично примеру 17 путем взаимодействия сложного эфира с 15 1 -циано-1 -метоксикарбонил-2,2-бмс(метилтио)этеном. Точка плавления: 134-135*С (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) 20 C26H30N4O4 (462,55) Рассчитано: С 67,51 Н 6,54 Н 12,11 Найдено: 67,33 6,48 12,28 5) 5Е-6-[3-(2-циано-1 -циклопентиламино-2-метоксикарбонил-этиленамино)- 25 фенил]-6-(3-пиридил)гекс-5-еновую кислоту Получают аналогично примеру 17 путем взаимодействия сложного эфира с 1 -циано-1 -метоксикарбонил-2,2-бис(метил- 30 тио)этеном Точка плавления: 150-15ГС (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира) e27H30N4O4 (474,56) 35 Рассчитано: С 68,34 Н 6,37 N 11,81 Найдено: 68,31 6,46 11,88 П р и м е р t8. 4Е-1-{5~/3-[2~циано3-(2-метилпропил)гуанидино]фенил-/-5-(3пиридил )пент-4-енил} тетразол 40 2,25 г 4Е-1-[5-(3-аминофенил)-5-(3-пиридил)пент-4-енил}-тетразола и 2,4 г дифеноксиметилен-цианамида в 500 мл толуола перемешивают при комнатной температуре в течение 20 ч. Реакционную 45 смесь фильтруют, фильтрат смешивают с 5 мл 2-метилпропиламина и нагревают с обратным холодильником в течение 13 ч. Растворитель удаляют и остаток очищают на силикагельсодержащей колонке с при- 50 менением в качестве элюента смеси лорметана, метанола и уксусной кислоты в объемном соотношении 96 : 4 ; 3» Выход: 66 % теории, оена, значение Rf: 0,27 (силикагель; смесь дихлорметана, 55 метанола и уксусной кислоты в объемном соотношении 90 :10 : 3) C23H27NS х СН3СООН (459,56) Рассчитано: С 62,73 И 6,36 N 27,43 Найдено: . 62,61 6,52 27в64 54 Аналогично примеру 18 получают следующее соединение: 1) 4Е-1-{5-[3-(2-циано-3-циклопентилгуанидино)фенил]-5-(3-пиридил)пент-4енил}тетразол в видепены. Значение Rf: 0,07 (силикагель; смесь дихлорметана и этанола в объемном соотношении 10 : 1) « W ^ (441,54) Рассчитано: С 65,29 Н 6,16 N 28,55 Найдено: 65,03 6,28 28,42 П р и м е р 19. 4Е-1-{5-[3-(2,2дициано-1 -циклопентиламино-этиленамино)-фенил]-5-(3-пиридил)пент-4-енил)тетразол 2,25 г 4Е-1 ~[5-(3-аминофенилЬ5-(3-пиридил)пент-4-енил]тетразола и 2,15 г 2,2дициано-1,1'бис(метилтио)этена в 50 мл изопропанола нагревают с обратным холодильником е течение 48 ч. Реакционную смесь смешивают с 3 мл циклопентиламина и кипятят с обратным холодильником в течение дальнейших 26 часов. Растворитель удаляют vs остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана, метанола и уксусной кислоты в объемном соотношении 96 : 4 : 3. Выход: 58 % теории, пена, значение Rf: 0,35 (силикагель марки RP8; 5 %-ный раствор хлорида натрия и метанол в объемном соотношении 4 : 6) C26H27N9 х 0,5 СН3СООН (495,59) Рассчитано: С 65,44 Н 6,90 Н 25,44 Найдено: 65,26 6,07 25,35 П р и м е р 20. 5Е-6-{3-[2-бензоил3-(2-метилпропил)гуанидино]фенил}-6-(3пиридил)гекс-5-еновая кислота а) Сложный метиловый эфир 5Е-6-(3бензоилимино-фенокси-метиленамино)фе» нил)-6-(3-пирццші)гекс-5-еновой кислоты 5 г Н-бензоил-дифенилимущокарбаната и 4,14 г сложного метилового эфира 5Е-6-(3-аминофенил)-6-(3-пиридил)гекс-5еновой кислоты растворяют в 200 мл изопропанола и перемешивают при комнатной температуре в течение четырех часов. Получаемый осадок отсасывают, промывают изопропанолом и сушат. Выход: 79 % теории, т.пл.: 112'С C32H29N3O4 (519,60) Рассчитано: С 73,97 И 5,63 М 8,09 Найдено: 73,94 5,68 8,10 б) 5£-6ЧЗ-[2-бензоил-3-(2-метиллролил)гуанидино]фенил}-6-(3-пиридшї)гекс5-еновая кислота 2,6 г сложного метилового эфира 5Е6-(3-(бензоилммино-фенокси-метиленамино)фенил)-6-(3-пирцдші)гекс-5-еновой кислоты и 5 мл 2-метушг*ролш\амина в 50 мл изопропанола нагревают с обратным хо 55 26976 лодильником в течение одного часа. Реакционной смеси дают охлаждаться до температуры 50*С, смешивают с 15 мл 1 N натрового щелока и перемешивают при этой температуре в течение 30 мин. Раст- 5 воритель удаляют, остаток смешивают с водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения рН 4 - 5 путем добавления лимонной кислоты, получаемый 10 осадок отсасывают и промывают водой. Фильтровальный осадок перекристаллизовывают из сложного этилового эфира уксусной кислоты. Выход: 74 % теории, т.пл.: 159-160'С 15 C29H32N4O3 (484,60) Рассчитано: С 71,88 Н 6,66 N 11,56 Найдено: 71,92 6,70 11,73 Аналогично примеру 20 получают следующее соединение: 20 1) 5Е-6-[3-(2-бензоил-3-циклопентилгуанидино)фенил]-6-(3-пиридил)гекс-5еновую кислоту с точкой плавления 171'С (смесь изопропанола и сложного этилового эфира уксусной кислоты). 25 C 3oH32N403 (496,61) Рассчитано: С 72,56 Н 6,50 N 11,28 Найдено: 72,42 6,55 11,15 П р и м е р 21. 5Е-6-{3-[2-карбамоил-(2-метилпропил)гуанидиноЗфенил} -6- 30 (3-пиридил)гекс-5-еновая кислота 1,34 г 5Е-6-[3-(2-циано-3-(2-метилпропил)гуанидино)фенил]-6-(3-пиридил)гекс-5-еновой кислоты растворяют в 50 мл 4N соляной кислоты и затем 35 перемешивают при комнатной температуре в течение 48 ч. Раствор доводят до значения рН 5 - 6 путем добавления ацетата натрия и экстрагируют сложным этиловым эфиром уксусной кислоты. Ор- 40 ганический экстракт сгущают и остаток очищают на силикагельсодержащей колонке < применением в качестве элюен5 та смеси дихлорметана и этанола в объемном соотношении 19 : 1. 45 Выход: 54 % теории, пена, значение Rf: 0,20 (силикагель; смесь дихлорметана и этанола в объемном соотношении 19:1) C23H29N5O3 (423,52) Рассчитано: С 65,22 Н 6,90 N 16,54 50 Найдено: 65,30 6,05 16,37 Нижеследующие примеры иллюстрируют конкретные составы предлагаемой фармацевтической композиции. П р и м е р 22. Таблетки с 100 мг 5Е- 55 6-[3-(2,2-дициано-1-циклопентил-аминоэти-ленамино)фенил]-6-(3-пиридил)гекс-5еновой кислоты Состав: 1 таблетка содержит, мг: 56 Активное вещество Лактоза Кукурузный крахмал Поливинилпирролидон Стеарат магния 100,0 80,0 34,0 4,0 2,0 220,0 Приготовление: Активное вещество, лактозу и крахмал смешивают и равномерно увлажняют водным раствором поливинилпирролидона. Влажную массу пропускают через сито величиной ячеек 2,0 мм, сушат во многоступенчатом сушильном шкафу при температуре 50"С, а затем пропускают через сито величиной ячеек 1,5 мм. После этого добавляют стеарат магния и размешивают. Готовую массу прессуют в таблетки. Вес одной таблетки: 220 мг Диаметр: 9 мм, плоские с обеих сторон с двусторонним фасетом и односторонним надрезом. П р и м е р 23. Капсулы из твердой желатины, содержащие 150 мг 5Е-6-[3(2,2-дициано-1 -циклопентиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновой кислоты 1 капсула содержит, мг: Активное вещество 150,0 Сушеный кукурузный крахмал, примерно 180,0 Лактоза в виде порошка, примерно Стеарат магния Примерно Приготовление: Активное вещество смешивают со вспомогательными веществами, полученную массу пропускают через сито величиной ячеек 0,75 мм, и с помощью пригодного устройства размешивают до получения гомогенной массы. Готовую массу подают в капсулы из твердой желатины размером 1. Содержание одной капсулы: примерно 420 мг Оболочка капсулы: Капсула из твердой желатины, размер 1. П р и м е р 24. Суппозитории, содержащие 150 мг 5Е-6-[3-(2,2-дициано-1-циклопентиламино-этиленамино)фенил]-6-(3пиридил)гекс-5-еновой кислоты 1 суппозиторий содержит, мг: Активное вещество t50,0 Полиэтиленгликоль (молекулярный вес 1500) 550,0 .Полиэтиленгликоль (молекулярный вес 6000) 460,0 Моностеарат полиэтиленсорбината 840,0 2000,0 57 26976 Приготовление: Полиэтиленгликоль и моностеарат полизгтиленсорбитана расплавляют, активное вещество гомогенно распределяют в полученной массе, и готовую массу разливают 5 по предварительно охлаждаемым формам. П р и м е р 25. Суспензия, содержащая 50 мг 5Е-6-[3-{2,2-дициано-1-циклопентиламино-этиленамино)фенилЗ-6-(3пиридил)гекс-5-еновой кислоты 10 100 мл суспензии содержат, г: Активное вещество 1,0 Натриевую соль карбоксиметилцештюлозы 0,2 Сложный метиловый эфир 15 п-оксибензойной кислоты 0,05 Сложный пропиловый эфир п-оксибензойной кислоты 0,01 Глицерин 5,0 70%-ный раствор сорбита 50,0 20 Аромат 0,3 Дистиллированную воду ДИЭДОмп Приготовление: Дистиллированную воду нагревают до температуры 70"С. В ней при размеши- 25 вании растворяют сложные метиловый и пропиловый эфиры п-оксибензойной кислоты, глицерин и натриевую соль карбоксиметилцеллюлозы. Охлаждают до комнатной температуры, при размешивании 30 добавляют активное вещество и смешивают до получения гомогенной дисперсии. Затем добавляют раствор сорбита и аромат, и суспензию размешивают npw удалении воздуха. 35 5 мл суспензии содержат 50 мг активного вещества. П р и м е р 26. Таблетки, содержащие 150 мг 5Е-6-[3-(2,2-дициано-1-циклопентиламино-этиленамино)фенил]-6-(3- 40 пиридил)гекс-5-еновой кислоты Состав: 1 таблетка содержит, мг: Активное вещество 150,0 Лактоза в виде порошка 89,0 45 Кукурузный крахмал 40,0 Коллодиальная кремневая кислота 10,0 Пояивинилпирролидон 10,0 Стеарат магния 1,0 50 300,0 Приготовление: Активное вещество смешивают с лактозой, кукурузным крахмалом и кремневой кислотой. Полученную смесь увлаж- 55 няют 20 %-ныъя водным раствором поливинилпирролидона и пропускают через сито величиной ячеек 1,5 мм. Полученный гранулят сушат при температуре 45*С, и после этого его вновь 58 дробят путем пропускания через то же сито, добавляют стеарат магния и размешивают. Полученную массу прессуют в таблетки. Вес одной таблетки: 300 мг Диаметр пуансона: 10 мм, плоский П р и м е р 27. Таблетки с покрытием, содержащие 75 мг 5Е-б-[3-(2,2-дициано-1 -циклопентиламино-этиленами но)фенил)-6-(3-пиридил)гекс-5-еновой кислоты 1 таблетка содержит, мг: Активное вещество 75,0 Фосфат кальция 93,0 Кукурузный крахмал 35,5 Поливинилпирролидон 10,0 Оксипропилметилцеллюлоза 15,0 Стеарат магния 1,5 230,0 Приготовление: Активное вещество смешивают с фосфатом кальция, кукурузным крахмалом, поливинилпирролидоном, оксипропилметилцеллюлозой и половиной указанного количества стеарата магния. С помощью соответствующего аппарата изготавливают прессованные заготовки диаметром примерно 13 мм, которые с помощью другого пригодного устройства дробят путем пропускания через сито величиной ячеек 1,5 мм. Затем добавляют остаток стеарата магния. Из полученного гранулята с помощью соответствующего аппарата прессуют таблетки желаемой формы. Вес одной таблетки без покрытия: 230мг Диаметр пуансона: 9 мм, изогнутый Полученные таким образрм таблетки снабжают тонким покрытием, в основном состоящим из оксипропилметилцеллюлозы. Готовые таблетки, снабженные покрытием, полируют с использованием пчелиного воска. Вес одной таблетки с покрытием: 245 мг Само собой разумеется, что в вышеописанных препаратах в качестве активного вещества можно использовать и все остальные соединения общей формулы (I). П р и м е р 29. Капсулы из твердой желатины, содержащие 200 мг 5Е-6-[3(2,2-дициано-1 -циклопентиламино-этиленамино)фенилЗ-6-(3-пиридил)гекс-5-еноаой кислоты (соединение Б) и 50 мг ингибитора PDE 10 кг дипиридамола, 20 кг фумаровой кислоты, 11,5 кг поливинилпирролидона, 40 кг соединения Б, 1,5 кг двуокиси кремния и 0,8 кг стеарата'магния смешивают 59 26976 в соответствующем смесителе в течение 15 минут. Полученную смесь пропускают через валковое устройство, к которому подключено устройство для сухого гранулирования, снабженное просеивающим приспособлением. Для наполнения капсул используют фракции размером 0,251,0 мм. Устройство для наполнения капсул устанавливают так, что каждая капсула размером 0 содержит количество гранулята, соответствующее 50 мг ингибитора PDE и 200 мг соединения Б. П р и м е р 30. Капсулы из твердой желатины, содержащие 100 мг 5Е-6-{3(2,2-дициано-1 -циклопентиламино-этиленамино)фенил]-6-(3~пиридил)гекс-5-еновой кислоты (соединение Б) и 250 мг ингибитора PDE а) Гранулят 125 кг мопидамола, 50 кг фумаровой кислоты и 13,5 кг лактозы смешивают и увлажняют водным раствором полизтиленгликоля молекулярным весом 6000. Подвергают гранулированию путем пропускания через сито величиной ячеек 1,0 мм, сушат при температуре 45'С и добавляют 1,4 кг стеариновой кислоты. б) Драже 100 кг соединения Б, 7,5 кг оксипропилметилцеллюлозы, 2,5 кг двуокиси кремния и 15 кг карбоксицеллюлозы увлажняют этанолом и подвергают гранулированию путем пропускания через сито величиной ячеек 1,5 мм. Затем сушат, при размешивании добавляют 1 кг стеарата магния, и из полученного гранулята прессуют таблетки весом 126 мг и диаметром 5,5 мм, выпуклые с обеих сторон. Полученные таблетки в некоторые приемы снабжают покрытием из суспензии, соотоящей из 5,6 кг сахарозы, 0,5 кг гуммиарабика и 3,8 кг талька, в результате чего таблетки достигают веса, равного 135 мг. в) Наполнение капсулей С помощью специально предназначенного для этого устройства удлиненные капсулы из твердой желатины размером 0 наполняют количеством гранулята, соответствующим 250 мг ингибитора PDE, и сверху размещают драже, содержащее 100 мг соединения Б. П р и м е р 3 1 . Суспензия, содержащая 10 мг 5Е-6-[3-(2,2-дициано-1циклопентиламино-эгаленамино)фенил]6-(3-пиридил)гекс-5-еновой кислоты (соединения Б) и 100 мг дипиридамола на 5 г 5 10 15 20 25 30 35 40 45 50 55' 60 Суспензия имеет следующий состав, %: (1) Дипиридамол 2,0 (2) Соединение Б 0,2 (3) Сорбит 20,8 (4) Целлюлоза 7,5 (5) Карбоксиметилцеллюлоз натрия 2,5 (6) Вкусовые вещества и консерванты 1,8 (7) Вода 65,2 В горячую воду при интенсивном перемешивании подают указанные под (3) (6) вещества. По.сле охлаждения в полученную вязкую суспензию врабатывают указанные под (1) и (2) вещества. П р и м е р 32. Препарат продленного действия, содержащий 50 мг 5Е-6[3-(2,2-дициано-1-циклопентиламино-этиленамино)фенил]-6-(3-пиридил)гекс-5-еновой кислоты (соединения Б) и 200 мг дипиридамола а) Гранулят I Смесь содержит, кг: Соединение Б 50,0 Лизин 12,5 Высокополимерная оксипропилцеллюлоза 52,5 Триацетин 4,0 Этилцеллюлоза 2,5 Стеарат магния 3,5 вместе с этанолом месят в специально предназначенном для этого экструдера и экструдируют в виде длинных жгутов диаметром 1 мм, которым затем придается круглая форма. Полученный гранулят тщательно сушат. б) Гранулят II 300 кг частиц винной кислоты в специальном сосуде опрыскивают суспензией, состоящей из изопропанола, дипиридамола и поливинилпирролидона до достижения в получаемом грануляте содержания дипиридамола, составляющего примерно 45%. Получаемый гранулят опрыскивают лаком, содержащим сополимер метакриловой кислоты и метилметакрилята (торговое название: Ойдрагит С) и фталат оксипропилметилцеллюлозы (торговое название: ХИ 55) в весовом соотношении от 851765 до 50:50. Кроме того, органические растворы, используемые в качестве лака, содержат, еще пластификаторы и тальк. Опрыскивают два компонента гранулята с 5 и 7% покрытия, соответственно, и с разными соотношениями компонентов лака в указанных пределах. Оба компонента гранулята смешивают таким образом, что in vitro активное вещество высвобождается в следующих количествах:
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridyl derivatives, enantiomers thereof, cis- or trans-isomers and salts thereof
Назва патенту російськоюПроизводные пиридила, их энантиомеры, цис- либо транс-изомеры и их соли
МПК / Мітки
МПК: C07D 401/12, C07D 213/55, C07F 7/08, C07D 401/06
Мітки: похідні, цис, енантіомери, солі, піридилу, транс-ізомери
Код посилання
<a href="https://ua.patents.su/32-26976-pokhidni-piridilu-kh-enantiomeri-cis-abo-trans-izomeri-i-kh-soli.html" target="_blank" rel="follow" title="База патентів України">Похідні піридилу, їх енантіомери, цис- або транс-ізомери і їх солі</a>
Попередній патент: Похідні індолу
Наступний патент: Спосіб очищення e-капролактаму
Випадковий патент: Пристрій ударної дії