Похідні 1-(2-оксоацетил)-піперідин-2-карбонової кислоти, спосіб одержання, фармацевтична композиція та спосіб лікування
Номер патенту: 63874
Опубліковано: 16.02.2004
Автори: Саундерс Джеффрі О., Армістід Девід М., Богер Джошуа С.
Формула / Реферат
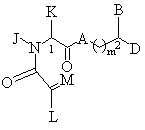
1. Соединение формулы (I)
 , (I)
, (I)
в которой А представляет собой CH2, кислород, NH или N-(С1-С4-алкил);
B и D независимо представляют собой:
(i) Ar, (С1-C10)-алкил нормального или разветвленного строения, (С2-С10)-алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкилзамещенный (С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкенилзамещенный (С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения или Ar-замещенный (С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения, причем в каждом случае любая одна из CH2-групп цепей этих алкилов, алкенилов или алкинилов необязательно может быть замещена на гетероатом, выбранный из группы, состоящей из S, О, SO, SO2, N и NR, где R выбран из группы, состоящей из водорода, (С1-С4)-алкила нормального или разветвленного строения, (С2-С4)-алкенила или алкинила нормального или разветвленного строения и мостикового (С1-С4)-алкила, причем мостик образован между атомом азота и атомом углерода, этой содержащей гетероатом, цепи с образованием ядра, которое необязательно конденсировано с группой Аr; или
(ii) группу формулы:
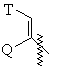 ,
,
в которой Q представляет собой водород, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил или алкинил нормального или разветвленного строения;
Т представляет собой Ar или замещенный 5-7-членный циклоалкил с заместителями в положениях 3 и 4, которые независимо выбраны из группы, состоящей из окcогруппы, водорода, гидроксигруппы, группы О-(С1-С4)-алкил и О-(С2-С4)-алкенил;
при условии, что по меньшей мере один из В и D независимо выбран из группы, состоящей из (С2-С10)-алкинила нормального или разветвленного строения, (С5-С7)-циклоалкилзамещенного (С2-С6)-алкинила нормального или разветвленного строения, (С5-С7)-циклоалкенилзамещенного (С2-С6)-алкинила нормального или разветвленного строения и Аr-замещенного (С2-С6)-алкинила нормального или разветвленного строения;
в которой Ar представляет собой карбоциклическую ароматическую группу, выбранную из группы, состоящей из фенила, 1-нафтила, 2-нафтила, инденила, азуленила, флуоренила и антраценила, или
гетероциклическую ароматическую группу, выбранную из группы, состоящей из 2-фурила, 3-фурила, 2-тиенила, 3-тиенила, 2-пиридила, 3-пиридила, 4-пиридила, пирролила, оксазолила, тиазолила, имидазолила, пиразолила, 2-пиразолинила, пиразолидинила, изоксазолила, изотиазолила, 1,2,3-оксадиазолила, 1,2,3-триазолила, 1,3,4-тиадиазолила, пиридазинила, пиримидинила, пиразинила, 1,3,5-триазинила, 1,3,5-тритианила, индолизинила, индолила, изоиндолила, 3Н-индолила, индолинила, бензо[b]фуранила, бензо[b]тиофенила, 1H-индазолила, бензимидазолила, бензтиазолила, пуринила, 4Н-хинолизинила, хинолинила, изохинолинила, циннолинила, фталазинила, хиназолинила, хиноксалинила, 1,8-нафтиридинила, птеридинила, карбазолила, акридинила, феназинила, фенотиазинила и феноксазинила;
в которой Ar может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленого строения, группы О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы, карбоксигруппы, N-(С1-С5-алкил или алкенил нормального или разветвленного строения)карбоксамидогрупп, N,N-ди-(С1-С5-алкил нормального или разветвленного строения или С2-С5-алкенил нормального или разветвленного строения)карбоксамидогрупп, N-морфолинокарбоксамидогруппы, N-бензилкарбоксамидогруппы, N-тиоморфолинокарбоксамидогруппы, N-пиколиноилкарбоксамидогруппы, группы О-Х, CH2-(СН2)q-X, O-(CH2)q-X, (CH2)q-О-X и CH=CH-X, где
Х представляет собой 4-метоксифенил, 2-пиридил, 3-пиридил, 4-пиридил, пиразил, хинолил, 3,5-диметилизоксазоил, изоксазоил, 2-метилтиазоил, тиазоил, 2-тиенил, 3-тиенил или пиримидил и q является числом 0-2;
в которой L представляет собой водород или U; M представляет собой кислород или СН-U, при условии, что, если L является водородом, то М представляет собой CH-U, если М является кислородом, то L представляет собой U;
в которой U представляет собой водород, О-(С1-С4)-алкил нормального или разветвленного строения или О-(С2-С4)-алкенил нормального или разветвленного строения, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил нормального или разветвленного строения, (С5-С7)-циклоалкил или (С5-С7)-циклоалкенил, замещенный (С1-С4)-алкилом нормального или разветвленного строения или (С2-С4)-алкенилом нормального или разветвленного строения, [(С1-С4)-алкил или (С2-С4)-алкенил]-Y или Y;
в которой Y представляет собой карбоциклическую ароматическую группу, выбранную из группы, состоящей из фенила, 1-нафтила, 2-нафтила, инденила, азуленила, флуоренила и антраценила, или
гетероциклическую ароматическую группу, как определено выше;
в которой Y может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы и карбоксигруппы;
в которой J представляет собой водород, (С1-С2)-алкил или бензил; K представляет собой (С1-С4)-алкил нормального или разветвленного строения, бензил или циклогексилметил или
J и К вместе образуют 5-7-членное гетероциклическое кольцо, которое может содержать гетероатом, выбранный из О, S, SO и SO2; и
в которой m является числом 0-3.
2. Соединение по п. 1, полезное для лечения или предупреждения устойчивости пациента ко многим лекарственным средствам.
3. Соединение формулы (I)
 , (I)
, (I)
в которой А представляет собой CH2, кислород, NН или N-(С1-С4-алкил);
В и D независимо представляют собой:
(i) Ar, (С1-С10)-алкил, алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкилзамещенный (С1-С6)-алкил, алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкенилзамещенный (С1-С6)-алкил, алкенил или алкинил нормального или разветвленного строения или Ar-замещенный (С1-С6)-алкил, алкенил или алкинил нормального или разветвленного строения, причем в каждом случае любая одна из CH2-групп цепей этих алкилов, алкенилов или алкинилов необязательно может быть замещена на гетероатом, выбранный из группы, состоящей из О, S, SO и SO2; или
(ii)
 ,
,
в которой Q представляет собой водород, (C1-C6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил нормального или разветвленного строения;
Т представляет собой Ar или замещенный 5-7-членный циклоалкил с заместителями в положениях 3 и 4, независимо выбранными из группы, состоящей из оксогруппы, водорода, гидроксигруппы, группы О-(С1-С4)-алкил и О-(С2-С4)-алкенил;
при условии, что по меньшей мере один из В и D независимо выбран из группы, состоящей из (С2-С10)-алкинила нормального или разветвленного строения, (С5-С7)-циклоалкилзамещенного (С2-С6)-алкинила нормального или разветвленного строения, (С5-С7)-циклоалкенилзамещенного (С2-С6)-алкинила нормального или разветвленного строения и Ar-замещенного (С2-С6)-алкинила нормального или разветвленного строения;
в которой Ar выбран из группы, состоящей из фенила, 1-нафтила, 2-нафтила, 2-фурила, 3-фурила, 2-тиенила, 3-тиенила, 2-пиридила, 3-пиридила, 4-пиридила и моно- и бициклических гетероциклических систем, у которых отдельные ядра 5- или 6-членные и одно или оба ядра содержат всего 1-4 гетероатома, независимо выбранных из атомов кислорода, азота и серы;
в которой Ar может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, группы О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы, карбоксигруппы, N-(С1-С5-алкил или алкенил нормального или разветвленного строения)карбоксамидогрупп, N,N-ди-(С1-С5-алкил или алкенил нормального или разветвленного строения)карбоксамидогрупп, N-морфолинокарбоксамидогруппы, N-бензилкарбокcамидогруппы, N-тиоморфолинокарбоксамидогруппы, N-пиколиноилкарбоксамидогруппы, группы О-Х, (CH2)-(CH2)q-X, O-(CH2)q-X, (CH2)q-O-X и CH=CH-X, где X представляет собой 4-метоксифенил, 2-пиридил, 3-пиридил, 4-пиридил, пиразил, хинолил, 3,5-диметилизоксазоил, изоксазоил, 2-метилтиазоил, тиазоил, 2-тиенил, 3-тиенил или пиримидил и q является числом 0-2;
в которой L представляет собой водород или U; M представляет собой кислород или CH-U, при условии, что, если L является водородом, то M представляет собой CH-U, если M является кислородом, то L представляет собой U;
в которой U представляет собой водород, О-(С1-С4)-алкил нормального или разветвленного строения или О-(С2-С4)-алкенил нормального или разветвленного строения, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил нормального или разветвленного строения, (С5-С7)-циклоалкил или (С5-С7)-циклоалкенил, замещенный (С1-С4)-алкилом нормального или разветвленного строения или (С2-С4)-алкенилом нормального или разветвленного строения, [(С1-С4)-алкил или (С2-С4)-алкенил]-Y или Y;
в которой Y выбран из группы, состоящей из фенила, 1-нафтила, 2-нафтила, 2-фурила, 3-фурила, 2-тиенила, 3-тиенила, 2-пиридила, 3-пиридила, 4-пиридила и моно- и бициклических гетероциклических систем, у которых отдельные ядра содержат 5 или 6 членов и которые могут содержать в одном или обоих ядрах 1-4 гетероатома, выбранных из атомов кислорода, азота и серы;
в которой Y может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы и карбоксигруппы;
в которой J представляет собой водород, (С1-С2)-алкил или бензил; К представляет собой (С1-С4)-алкил нормального или разветвленного строения, бензил или циклогексилметил или J и K вместе образуют 5-7-членное гетероциклическое ядро, которое может содержать в качестве заместителя в нем О, S, SO и SO2; и
в которой m является числом 0-3.
4. Соединение по п. 3, полезное для лечения или предупреждения устойчивости пациента ко многим лекарственным средствам.
5. Соединение формулы (I)
 , (I)
, (I)
в которой А представляет собой CH, кислород, NH или N-(С1-С4-алкил);
В и D независимо представляют собой:
(i) Ar, (C1-С10)-алкил нормального или разветвленного строения, (С2-С10)-алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкилзамещенный (С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкенилзамещенный (С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения или Ar-замещенный (С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения, причем в каждом случае любая одна из CH2-групп цепей этих алкилов, алкенилов или алкинилов необязательно может быть замещена на гетероатом, выбранный из группы, состоящей из О, S, SO, SO2, N и NR, где R выбран из группы, состоящей из водорода, (С1-С4)-алкила нормального или разветвленного строения, (С2-С4)-алкенила или алкинила нормального или разветвленного строения и мостикового (C1-С4)-алкила, причем мостик образован между атомом азота и атомом углерода этой, содержащей гетероатом, цепи и мостик образует кольцо, которое необязательно может быть сконденсировано с группой Ar; или
(ii)
 ,
,
в которой Q представляет собой водород, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил или алкинил нормального или разветвленного строения;
T представляет собой Ar или замещенный 5-7-членный циклоалкил с заместителями в положениях 3 и 4, независимо выбранными из группы, состоящей из оксогруппы, водорода, гидроксигруппы, группы О-(С1-С4)-алкил и О-(С2-С4)-алкенил;
при условии, что по меньшей мере один из B и D независимо выбран из группы, состоящей из Ar', Ar'-замещенного (С1-С6)-алкила нормального или разветвленного строения и Ar'-замещенного (С2-С6)-алкенила или алкинила нормального или разветвленного строения;
в которой Ar' представляет собой группу Ar, имеющую 1-3 заместителя, выбранных из группы, состоящей из (С1-С5-алкил или С2-С5-алкенил нормального или разветвленного строения)карбоксамидогрупп, N,N-ди-(C1-C5-алкил или С2-С5-алкенил нормального или разветвленного строения)карбоксамидогрупп, N-морфолинокарбоксамидогруппы, N-бензилкарбоксамидогруппы, N-тиоморфолинокарбоксамидогруппы, N-пиколиноилкарбоксамидогруппы, группы О-Х, (CH2)-(CH2)q-X, O-(CH2)q-X, (CH2)q-O-X и CH=CH-X, где X представляет собой 4-метоксифенил, 2-пиридил, 3-пиридил, 4-пиридил, пиразил, хинолил, 3,5-диметилизоксазоил, изоксазоил, 2-метилтиазоил, тиазоил, 2-тиенил, 3-тиенил или пиримидил и q является числом 0-2;
в которой Аr представляет собой карбоциклическую ароматическую группу, выбранную из группы, состоящей из фенила, 1-нафтила, 2-нафтила, инденила, азуленила, флуоренила и антраценила, или
гетероциклическую ароматическую группу, выбранную из группы, состоящей из 2-фурила, 3-фурила, 2-тиенила, 3-тиенила, 2-пиридила, 3-пиридила, 4-пиридила, пирролила, оксазолила, тиазолила, имидазолила, пиразолила, 2-пиразолинила, пиразолидинила, изоксазолила, изотиазолила, 1,2,3-оксадиазолила, 1,2,3-триазолила, 1,3,4-тиадиазолила, пиридазинила, пиримидинила, пиразинила, 1,3,5-триазинила, 1,3,5-тритианила, индолизинила, индолила, изоиндолила, 3Н-индолила, индолинила, бензо[b]фуранила, бензо[b]тиофенила, 1H-индазолила, бензимидазолила, бензтиазолила, пуринила, 4Н-хинолизинила, хинолинила, изохинолинила, циннолинила, фталазинила, хиназолинила, хиноксалинила, 1,8-нафтиридинила, птеридинила, карбазолила, акридинила, феназинила, фенотиазинила и феноксазинила;
в которой Ar может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, группы О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы, карбоксигруппы, N-(С1-С5-алкил или алкенил нормального или разветвленного строения)карбоксамидогрупп, N,N-ди-(С1-С5-алкил или С2-С5-алкенил нормального или разветвленного строения)карбоксамидогруппы, N-морфолинокарбоксамидогруппы, N-бензилкарбоксамидогруппы, N-тиоморфолинокарбоксамидогруппы, N-пиколиноилкарбоксамидогруппы, группы O-Х, (CH2)-(CH2)q-X, O-(CH2)q-X, (CH2)q-O-X и CH=CH-X, где X представляет собой 4-метоксифенил, 2-пиридил, 3-пиридил, 4-пиридил, пиразил, хинолил, 3,5-диметилизоксазоил, изоксазоил, 2-метилтиазоил, тиазоил, 2-тиенил, 3-тиенил или пиримидил и q является числом 0-2;
в которой L представляет собой водород или U; M представляет собой кислород или CH-U, при условии, что, если L является водородом, то M представляет собой CH-U, если M является кислородом, то L представляет собой U;
в которой U представляет собой водород, О-(С1-С4)-алкил нормального или разветвленного строения или О-(С2-С4)-алкенил нормального или разветвленного строения, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил нормального или разветвленного строения, (С5-С7)-циклоалкил или (С5-С7)-циклоалкенил, замещенный (С1-С4)-алкилом нормального или разветвленного строения или (С2-С4)-алкенилом нормального или разветвленного строения, [(С1-С4)-алкил или (С2-С4)-алкенил]-Y или Y;
в которой Y выбран из группы, состоящей из фенила, 1-нафтила, 2-нафтила, инденила, азуленила, флуоренила, антраценила и гетероциклических ароматических групп, как указано выше;
в которой Y может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы и карбоксигруппы;
в которой J представляет собой водород, (С1-С2)-алкил, бензил; К представляет собой (С1-С4)-алкил нормального или разветвленного строения, бензил, или циклогексилметил или J и К вместе образует 5-7-членное гетероциклическое ядро, которое может содержать гетероатом, выбранный из группы, состоящей из О, S, SO, SO2; и
в которой m является числом 0-3.
6. Соединение по п. 5, полезное для лечения или предупреждения устойчивости пациента ко многим лекарственным средствам.
7. Фармацевтическая композиция для лечения или предотвращения устойчивости ко многим лекарственным средствам, содержащая фармацевтически эффективное количество соединения по любому одному из пп. 1, 3 или 5 и фармацевтически приемлемый носитель, вспомогательный компонент или наполнитель.
8. Фармацевтическая композиция по п. 7, отличающаяся тем, что содержит также хемотерапевтическое средство.
9. Фармацевтическая композиция по п. 7 или 8, отличающаяся тем, что содержит также хемоcенсибилизатор, но другой, чем соединение по любому из пп. 1, 3 или 5.
10. Способ лечения или предотвращения устойчивости пациента ко многим лекарственным средствам, предусматривающий введение этому пациенту фармацевтической копозиции, содержащей фармацевтически эффективное количество соединения и фармацевтически приемлемый носитель, вспомогательный компонент или наполнитель, причем это соединение является соединением формулы (I)
 , (I)
, (I)
в которой А представляет собой CH2, кислород, NH или N-(С1-C4-алкил);
B и D независимо представляют собой:
(i) водород, Ar, (С1-С10)-алкил нормального или разветвленного строения, (С2-С10)-алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкилзамещенный (С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкенилзамещенный (С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения или Ar-замещенный (С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения, причем в каждом случае любая одна из CH2-групп цепей этих алкилов, алкенилов или алкинилов необязательно может быть замещена на гетероатом, выбранный из группы, состоящей из О, S, SO, SO2, N и NR, где R выбран из группы, состоящей из водорода, (С1-С4)-алкила нормального или разветвленного строения, (С2-С4)-алкенила или алкинила нормального или разветвленного строения и мостикового (С1-С4)-алкила, причем мостик образован между атомом азота и атомом углерода этой, содержащей гетероатом, цепи и мостик образует кольцо, которое необязательно может быть сконденсировано с группой Ar; или
(ii)
 ,
,
в которой Q представляет собой водород, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил или алкинил нормального или разветвленного строения;
T представляет собой Ar или замещенный 5-7-членный циклоалкил с заместителями в положениях 3 и 4, независимо выбранными из группы, состоящей из оксогруппы, водорода, гидроксигруппы, группы О-(С1-С4)-алкил и О-(С2-С4)-алкенил;
в которой Ar представляет собой карбоциклическую ароматическую группу, выбранную из группы, состоящей из фенила, 1-нафтила, 2-нафтила, инденила, азуленила, флуоренила и антраценила,
или гетероциклическую ароматическую группу, выбранную из группы, состоящей из 2-фурила, 3-фурила, 2-тиенила, 3-тиенила, 2-пиридила, 3-пиридила, 4-пиридила, пирролила, оксазолила, тиазолила, имидазолила, пиразолила, 2-пиразолинила, пиразолидинила, изоксазолила, изотиазолила, 1,2,3-оксадиазолила, 1,2,3-триазолила, 1,3,4-тиадиазолила, пиридазинила, пиримидинила, пиразинила, 1,3,5-триазинила, 1,3,5-тритианила, индолизинила, индолила, изоиндолила, 3Н-индолила, индолинила, бензо[b]фуранила, бензо[b]тиофенила, 1H-индазолила, бензимидазолила, бензтиазолила, пуринила, 4Н-хинолизинила, хинолинила, изохинолинила, циннолинила, фталазинила, хиназолинила, хиноксалинила, 1,8-нафтиридинила, птеридинила, карбазолила, акридинила, феназинила, фенотиазинила и феноксазинила;
в которой Ar может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидрокcигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, группы О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы, карбоксигруппы, N-(С1-С5-алкил или алкенил нормального или разветвленного строения)карбоксамидогрупп, N,N-ди-(С1-С5-алкил нормального или разветвленного строения или С2-С5-алкенил нормального или разветвленного строения)карбоксамидогрупп, N-морфолинокарбоксамидогруппы, N-бензилкарбоксамидогруппы, N-тиоморфолинокарбоксамидогруппы, N-пиколиноилкарбоксамидогруппы, группы O-Х, (CH2)-(CH2)q-X, O-(CH2)q-X, (CH2)q-O-X и CH=CH-X, где X представляет собой 4-метоксифенил, 2-пиридил, 3-пиридил, 4-пиридил, пиразил, хинолил, 3,5-диметилизоксазоил, изоксазоил, 2-метилтиазоил, тиазоил, 2-тиенил, 3-тиенил или пиримидил и q является числом 0-2;
в которой L представляет собой водород или U; M представляетсобой кислород или CH-U, при условии, что, если L является водородом, то M представляет собой CH-U, если M является кислородом, то L представляет собой U;
в которой U представляет собой водород, О-(С1-С4)-алкил нормального или разветвленного строения или О-(С2-С4)-алкенил нормального или разветвленного строения, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил нормального или разветвленного строения, (С5-С7)-циклоалкил или (С5-С7)-циклоалкенил, замещенный (С1-С4)-алкилом нормального или разветвленного строения или (С2-С4)-алкенилом нормального или разветвленного строения, [(С1-С4)-алкил или (С2-С4)-алкенил]-Y или Y;
в которой Y выбран из группы, состоящей из фенила, 1-нафтила, 2-нафтила, инденила, азуленила, флуоренила, антраценила, 2-пирролинила, 3-пирролинила, пирролидинила, 1,3-диоксолила, 2-имидазолинила, имидазолидинила, 2H-пиридила, 4H-пиранила, пиперидила, 1,4-диоксанила, морфолинила, 1,4-дитианила, тиоморфолинила, пиперазинила, хинуклидинила и гетероциклических ароматических групп, определение которых приведено выше;
в которой Y может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы и карбоксигруппы;
в которой J представляет собой водород, (С1-С2)-алкил или бензил; K представляет собой (С1-С4)-алкил нормального или разветвленного строения, бензил или циклогексилметил или J и K вместе образуют 5-7-членное гетероциклическое ядро, которое может содержать гетероатом, выбранный из группы, состоящей из О, S, SO или SO2; и
в которой m является числом 0-3.
11. Способ по п. 10, отличающийся тем, что в формуле (I), по меньшей мере, один из В и D независимо выбран из группы, состоящей из (С2-С10)-алкинила нормального или разветвленного строения; (С5-С7)-циклоалкилзамещенного (С2-С6)-алкинила нормального или разветвленного строения, (С5-С7)-циклоалкенилзамещенного (С2-С6)-алкинила нормального или разветвленного строения и Ar-замещенного (С2-С6)-алкинила нормального или разветвленного строения.
12. Способ по п. 10, отличающийся тем, что в формуле (I), по меньшей мере, один из B и D независимо выбран из группы, состоящей из Ar', Ar'-замещенного (С1-С6)-алкила нормального или разветвленного строения и Ar'-замещенного (С2-С6)-алкенила или алкинила нормального или разветвленного строения;
в которой Ar' представляет собой группу Ar, имеющую 1-3 заместителя, независимо выбранных из группы, состоящей из N-(С1-С5-алкил или С2-С5-алкенил нормального или разветвленного строения)карбоксамидогрупп, N,N-ди-(С1-С5-алкил или С2-С5-алкенил нормального или разветвленного строения)карбоксамидогрупп, N-морфолинокарбоксамидогруппы, N-бензилкарбоксамидогруппы, N-тиоморфолинокарбоксамидогруппы, N-пиколиноилкарбокcамидогруппы, группы O-Х, (CH2)-(CH2)q-X, O-(CH2)q-X, (CH2)q-O-X и CH=CH-X, где X представляет собой 4-метоксифенил, 2-пиридил, 3-пиридил, 4-пиридил, пиразил, хинолил, 3,5-диметилизоксазоил, изоксазоил, 2-метилтиазоил, тиазоил, 2-тиенил, 3-тиенил или пиримидил и q является числом 0-2.
13. Способ по любому одному из пп. от 10 до 12, отличающийся тем, что в формуле (I) J и K вместе образуют 5-7-членное ядро.
14. Способ по любому одному из пп. от 10 до 13, отличающийся тем, что в формуле (I), по меньшей мере, один из B и D независимо представляет собой группу формулы (CH2)r-(Х)-(CH2)s-Ar, в которой:
r является числом 0-4;
s является числом 0-1;
Ar имеет значения, указанные в п. 1, и
каждый из X независимо выбран из группы, состоящей из CH2, О, S, SO, SO2, N и NR, где R выбран из группы, состоящей из водорода, (С1-С4)-алкила нормального или разветвленного строения, (С2-С4)-алкенила или алкинила нормального или разветвленного строения и мостикового (С1-С4)-алкила, где мостик образован между атомом азота и группой Ar.
15. Способ по п. 10, отличающийся тем, что соединение формулы (I) выбрано из группы, состоящей из:
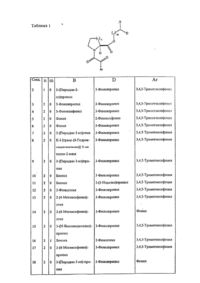
4-пиридин-3-ил-1-(3-пиридин-3-ил)пропил)бутилового эфиpa (S)-1-(2-окcо-2-(3,4,5-триметокcифенил)ацетил)пиперидин-2-карбоновой кислоты,
4-пиридин-3-ил-1-(3-пиридин-3-ил)пропил)бутилового эфиpa (R)-1-(2-окcо-2-(3,4,5-триметокcифенил)ацетил)пиперидин-2-карбоновой кислоты,
фармацевтически приемлемых производных их и их смесей.
16. Способ по любому одному из пп. от 10 до 15, отличающийся тем, что соединение вводят перорально.
17. Способ по любому одному из пп. от 10 до 16, отличающийся тем, что соединение не является значительно иммунодепрессивным при уровне дозы, необходимом для достижения хемосенсибилизации.
18. Способ лечения или предотвращения устойчивости пациента ко многим лекарственным средствам, предусматривающий введение этому пациенту фармацевтической композиции, содержащей фармацевтически эффективное количество соединения и фармацевтически приемлемый носитель, вспомогательный компонент или наполнитель, отличающийся тем, что это соединение является соединением формулы (I):
 , (I)
, (I)
в которой A представляет собой CH2, кислород, NH или N-(С1-С4-алкил);
B и D независимо представляют собой:
(i) Ar, (С1-С10)-алкил нормального или разветвленного строения, (С2-С10)-алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкилзамещенный (С1-С6)-алкил, алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкенилзамещенный (С1-С6)-алкил, алкенил или алкинил нормального или разветвленного строения или Ar-замещенный (С1-С6)-алкил, алкенил или алкинил нормального или разветвленного строения, причем в каждом случае любая одна из CH2-групп цепей этих алкилов, алкенилов или алкинилов необязательно может быть замещена на гетероатом, выбранный из группы, состоящей из О, S, SO или SO2;
или
(ii)
 ,
,
в которой Q представляет собой водород, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил нормального или разветвленного строения;
Т представляет собой Ar или замещенный 5-7-членный циклоалкил с заместителями в положениях 3 и 4, независимо выбранными из группы, состоящей из оксогруппы, водорода, гидроксигруппы, группы О-(С1-С4)-алкил и О-(С2-С4)-алкенил;
в которой Ar выбран из группы, состоящей из фенила, 1-нафтила, 2-нафтила, 2-фурила, 3-фурила, 2-тиенила, 3-тиенила, 2-пиридила, 3-пиридила, 4-пиридила и моно- и бициклических гетероциклических кольцевых систем, у которых отдельные ядра 5- или 6-членные и одно или оба ядра содержат всего 1-4 гетероатома, независимо выбранных из атомов кислорода, азота и серы;
в которой Ar может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, группы О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы, карбоксигруппы, N-(С1-С5-алкил или алкенил нормального или разветвленного строения)карбоксамидогрупп, N,N-ди-(С1-С5-алкил или алкенил нормального или разветвленного строения)карбоксамидогрупп, N-морфолинокарбокcамидогруппы, N-бензилкарбоксамидогруппы, N-тиоморфолинокарбоксамидогруппы, N-пиколиноилкарбоксамидогруппы, группы O-Х, CH2-(CH2)q-X, O-(CH2)q-X, -(CH2)q-O-X и CH=CH-X, где X представляет собой 4-метоксифенил, 2-пиридил, 3-пиридил, 4-пиридил, пиразил, хинолил, 3,5-диметилизоксазоил, изоксазоил, 2-метилтиазоил, тиазоил, 2-тиенил, 3-тиенил или пиримидил и q является числом 0-2;
в которой L представляет собой водород или U; M представляет собой кислород или CH-U, при условии, что, если L является водородом, то M представляет собой CH-U, если M является кислородом, то L представляет собой U;
в которой U представляет собой водород, О-(С1-С4)-алкил нормального или разветвленного строения или О-(С3-С4)-алкенил нормального или разветвленного строения, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил нормального или разветвленного строения, (С5-С7)-циклоалкил или (С5-С7)-циклоалкенил, замещенный (С1-С4)-алкилом нормального или разветвленного строения или (С2-С4)-алкенилом нормального или разветвленного строения, [(C1-C4)-алкил или (С2-С4)-алкенил]-Y или Y;
в которой Y выбран из группы, состоящей из фенила, 1-нафтила, 2-нафтила, 2-фурила, 3-фурила, 2-тиенила, 3-тиенила, 2-пиридила, 3-пиридила, 4-пиридила и моно- и бициклических гетероциклических систем, у которых отдельные кольца содержат 5 или 6 членов и которые могут содержать в одном или обоих кольцах 1-4 гетероатома, выбранных из атомов кислорода, азота и серы;
в которой Y может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы и карбоксигруппы;
в которой J представляет собой водород, (С1-С2)-алкил или бензил; К представляет собой (С1-С4)-алкил нормального или разветвленного строения, бензил или циклогексилметил или J и К вместе образуют 5-7-членное гетероциклическое кольцо, которое может содержать гетероатом, выбранный из группы, состоящей из О, S, SO или SO2; и
в которой m является числом 0-3.
19. Способ по п. 18, отличающийся тем, что в формуле (I) по меньшей мере один из В и D независимо выбран из группы, состоящей из (С2-С10)-алкинила нормального или разветвленного строения; (С5-С7)-циклоалкилзамещенного (С2-С6)-алкинила нормального или разветвленного строения, (С5-С7)-циклоалкенилзамещенного (С2-С6)-алкинила нормального или разветвленного строения и Ar-замещенного (С2-С6)-алкинила нормального или разветвленного строения.
20. Способ по п. 18, отличающийся тем, что в формуле (I), по меньшей мере, один из B и D независимо выбран из группы, состоящей из Ar', Ar'-замещенного (С1-С6)-алкила нормального или разветвленного строения и Ar'-замещенного (С2-С6)-алкенила или алкинила нормального или разветвленного строения;
в которой Ar' представляет собой группу Ar, имеющую 1-3 заместителя, независимо выбранных из группы, состоящей из N-(С1-С5-алкил или С2-С5-алкенил нормального или разветвленного строения)карбоксамидогрупп, N,N-ди-(С1-С5-алкил или С2-С5-алкенил нормального или разветвленного строения)карбоксамидогрупп, N-морфолинокарбоксамидогруппы, N-бензилкарбоксамидогруппы, N-тиоморфолинокарбоксамидогруппы, N-пиколиноилкарбокcамидогруппы, группы O-Х, (CH2)-(CH2)q-X, O-(CH2)q-X, (CH2)q-O-X и CH=CH-X, где X представляет собой 4-метоксифенил, 2-пиридил, 3-пиридил, 4-пиридил, пиразил, хинолил, 3,5-диметилизоксазоил, изоксазоил, 2-метилтиазоил, тиазоил, 2-тиенил, 3-тиенил или пиримидил и q является числом 0-2.
21. Способ по любому одному из пп. от 18 до 20, отличающийся тем, что в формуле (I) J и K вместе образуют 5-7-членное ядро.
22. Способ по любому одному из пп. от 18 до 21, отличающийся тем, что в формуле (I), по меньшей мере, один из B и D независимо представляет собой группу формулы (CH2)r-(Х)-(CH2)s-Ar, в которой:
r является числом 0-4;
s является числом 0-1;
Ar имеет значения, указанные в п. 1, и каждый из X независимо выбран из группы, состоящей из CH2, О, S, SO, SO2, N и NR, где R выбран из группы, состоящей из водорода, (С1-С4)-алкила нормального или разветвленного строения, (С2-С4)-алкенила или алкинила нормального или разветвленного строения и мостикового (С1-С4)-алкила, где мостик образован между атомом азота и группой Ar.
23. Способ по любому одному из пп. от 18 до 22, отличающийся тем, что соединение вводят перорально.
24. Способ по любому одному из пп. от 18 до 23, отличающийся тем, что соединение не является значительно иммунодепрессивным при уровне дозы, необходимом для достижения хемосенсибилизации.
25. Способ синтеза соединения формулы (I'):
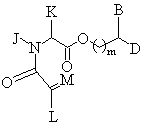 , (I')
, (I')
содержащий стадии:
(а) этерификации защищенной аминокислоты формулы (X) спиртом формулы (XI):
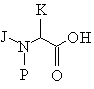 , (X)
, (X)
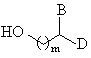 (XI)
(XI)
с образованием промежуточного продукта формулы (ХII):
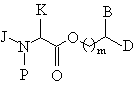 , (XII)
, (XII)
(b) удаления аминозащитной группы промежуточного продукта формулы (ХII) с получением аминоэфира формулы (ХIII):
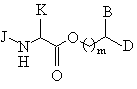 , (XIII)
, (XIII)
(c) ацилирования свободной аминогруппы соединения формулы (ХIII) соединением формулы (XIV):
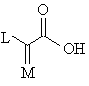 , (XIV)
, (XIV)
или его активированным производным,
в которой P представляет собой защитную группу и A, B, D, J, K, L и M имеют значения, указанные в п. 1.
26. Способ по п. 25, отличающийся тем, что защитная группа является алкоксикарбонильной группой.
Текст
Настоящее изобретение относится к новым соединениям, которые поддерживают, повышают или восстанавливают чувствительность клеток к терапевтическим или профилактическим средствам. Изобретение относится также к фармацевтическим композициям, содержащим эти соединения. Эти соединения и фармацевтические композиции настоящего изобретения, в частности, хорошо пригодны для лечения клеток, устойчивых к действию многих лекарственных средств, для предотвращения развития устойчивости ко многим лекарственным средствам и для терапии ракового заболевания, устойчивого ко многим лекарственным средствам. Основной проблемой в эффективности химиотерапии является развитие клеток, которые под действием химиотерапевтического лекарственного средства становятся устойчивыми ко многим структурно несвязанным лекарственным средствам и терапевтическим агентам. Появление такой устойчивости ко многим лекарственным средствам часто имеет место в присутствии избыточной экспрессии мембранного Ргликопротеина 170КDа (gр-170). Белок gр-170 кроме раковых клеточных линий присутствует в клеточных мембранах некоторых здоровых тканей. Он гомологичен бактериальным транспортным белкам (Hait et al., Cancer Communications, Vol 1(1), 35 (1989), West, TIBS, Vo1. 15, 42 (1990). Белок действует в качестве транспортного насоса, придащего устойчивость к лекарственным средствам путем активного вытеснения токсичных химикатов. Хотя механизм действия этого насоса неизвестен, предполагают, что белок gр-170 действует путем выталкивания веществ, которые обладают определенными общими химическими или физическими характеристиками, например, обладают гидрофобыостью, содержат карбонильные группы или конъюгат глутатиона (смотри West). Для подавления устойчивости ко многим лекарственным средствам и восстановления восприимчивости к лекарственным средствам вводили различные химические средства. Хотя некоторые лекарственные средства улучшают чувствительность MDR-клеток к химиотерапевтическим средствам, однако, лечение ими часто сопровождается нежелательными клиническими побочными действиями (смотри Hait et al.). Например, хотя циклоспорин A (СsA), широко признанный иммунодепрессант, может сенсибилизировать клетки некоторых карцином к химиотерапевтичвским средствам (Slater et аl., Br. J. Сanсеr, Yol. 54, 235 (1986)), концентрации его, необходимые для достижения этого действия, вызывают значительную иммунодепрессию у пациента, имеющего иммунную систему, ухе ослабленную химиотерапией (смотри Нaіt et al,). Аналогично блокаторы транспорта кальция и ингибиторы кадмодилина сенсибилизируют уотойчивые ко многим лекарственным средствам (МRD) клетки, но как те, так і другие, вызывают нежелательные физиологические эффекты (смотри Нaіt et al, Br. J. Сanсеr, Yol. 56. 55 (1987)). Недавние достижения привели к появлению средств, которые, как сообщается, имеют потенциально более высокую клиническую эффективность в сенсибилизации и МDR-клеток. Эти средства включают аналоги CsA, который не оказывают иммунодепресоивное действие, например, 11-метиллейцинциклоопорин (11-met-leu CsA) (смотри Нaіt et al, Twentymann et al.), или средства, которые могут быть эффективными при низких дозах, например, иммунодепрессант FК-506 (Epаnd аnd Epand, Anli-Cancer Drug Deseng 6, 189 (1991)). Несмотря на эти достижения, остается необходимость в эффективных средствах, которые можно применять для ресеноибилизации МDR -клеток к терапевтическим или профилактическим средствам или для предотвращения развития устойчивости ко многим лекарственным средствам. Настоящее изобретение предлагает новые соединения, которые полезны для поддержания, повышения или восстановления восприимчивости к лекарственному средству устойчивых к действию многих лекарственных средств (МDR) клеток, композиции, содержащие эти соединения, и способы применения их. Соединения настоящего изобретения можно применять отдельно или в комбинации о другими терапевтическими или профилактическими средствами для поддержания, повышения или восстановления терапевтического или профилактического действия лекарственных средств в клетках, особенно MDR-клетках, или для предупреждения развития MDR-клеток. В соответствии о одним примером осуществления настоящего изобретения эти новые соединения, композиция и способы преимущественно применяют для того, чтобы содействовать или усилить режим химиотерапии для лечения или профилактики рака и других заболеваний. Настоящее изобретение предлагает также способы получения соединений этого изобретения и промежуточные продукты, применяемые в этих способах. Настоящее изобретение относится к новому классу соединений, характеризующихся способностью предотвращать устойчивость ко многим лекарственным средствам или поддерживать, повышать или восстанавливать чувствительность к лекарственному средству в клетках, устойчивых ко многим лекарственным средствам ("MDR"). Более конкретно, эти соединения представлены формулой (I): в которой А представляет собой СН2, кислород, NH или N-(С1-С4-алкнл); в которой B и D независимо представляют собой: (і) водород, Аr, (С1-С10)-алкил нормального или разветвленного строения, (С2-С10)-алкенил или алкинил нормального или разветвленного строения, (С5-С7)-циклоалкилзамещенный(С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения, (С5-С7)циклоалкенилвамещенный(С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения или Ar-замещенный (С1-С6)-алкил нормального или разветвленного строения, (С2-С6)-алкенил или алкинил нормального или разветвленного строения, причем в каадом случае любая одна из СН2-групп цепей этих алкилов, алкенилов или алкинилов возможно может быть замещена на гетероатом, выбранный из группы, состоящей из O, S OS, ОS2, N и NR, где R выбран из группы, состоящей из водорода, (С1-С4)-алкила нормального или разветвленного строения, (С2-С4)-алкенида или алкинила нормального іди разветвленного строения и мостикового (С1-С4)-алкила, причем мостик образован между атомом азота и атомом углерода этой содержащей гетероатом цепи и сам образует ядро, которое возможно конденсировано с группой Ar; или (ii) группу формулы: в которой Q представляет собой водород, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил или алкинил нормального или разветвленного строения; в которой Т представляет собой Ar или замещенный 5-7-членный циклоалкил с заместителями в положениях 3 и 4, независимо выбранными из группы, состоящей из оксогруппы, водорода, гидрокоигруппы, группы О-(С1-С4)-алкил и О-(С2-С4)-алкенил; в которой Аr представляет собой карбоциклическую ароматическую группу, выбранную из группы, состоящей из фенила, 1-нафтила, 2-нафтила, инденила, азуленила, флуоренила, антраценила, или моно- и бицикличеокие гетероциклические сиcтемы, состоящие из 5- или 6-членных ядер, которые могут содержать в одном или обоих ядрах всего 1-4 гетероатома, независимо выбранных из атомов кислорода, азота и серы, прячем такие циклические системы включают гетероциклические ароматические группы, выбранные из группы, состоящей из 2-фурила, 3-фурила, 2-тиеяила, 3-тиеяида, 2-пнридила, 3-пиридала, 4-пиридила, пирролила, оксазолила, тиазолила, имндазо-лила, пирзолила, 2-пираволиняла, пиразолиданила, изоксазолила, изотиазолила, 1,2,3-оксадаазолила, 1,2,3-триазолила, 1,3,4-тиадиазолила, пирндазянила, пиришдинила, пиразиннла, 1,3,5-триазшшла, 1,3,5-тритианила, индолизинила, индолила, изоиндолила, 3Ниндолила, индолинила, бензо[b]фуранила, бензо[b]тиофенила, lH-индазолила, бензимидазолила, бвнзтиазолила, пуринила, 4Н-хинолизиннла, хинолинила, изохиноли-нила, циннолинила, фталазинила, хиназолинила, хиноксалинила, 1,8-нафтиридинила, птеридинила, карбазолила, акридинила, феназинила, фенотиазинила и феноксазинила; в которой Ar может содержать 1-3 заместителя, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы трифторметила, трифторметокоигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, группы О-(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы, карбокоигруппы, N(С1-С5)-алкил или алкенил нормального или разветвленного строения)карбокоамидогрупп, N,N-ди-(С1-С5алкил нормального или разветвленного строения или С2-C5-алкенил нормального или разветвленного строения)карбоксамидогрупп, N-морфолинокарбоксамидогруппы, N-бензилкарбоксамидогруппы, Nтиоморфолинокарбоксамадогруппы, -пиколиноилкарбоксамидогруппы, группы О-Х, СН2-(СН2)q-X, O-(CH2)q-X, (СН2)q-O-Х и СH=СН-Х, где X представляет собой 4-мвтоксяфенил, 2-пиридил, 3-пиридил, 4-пиридил, пиразил, хинолил, 3,5-диметилизоксазоил, изокоазоил, 2-метилтназоил, тиазоил, 2-тиенил, 3-тиенил или пиримидил и q является числом 0-2; в которой L представляет собой водород или U; M представляет собой кислород или CH-U, причем, если L является водородом, то М представляет собой CH-U, если M является кислородом, то L представляет собой U; в которой и представляет собой водород, О-(С1-С4)-алкил нормального или разветвленного строения или O-(С2-С4)-алкенил нормального или разветвленного cтроения, (С1-С6)-алкил нормального или разветвленного строения или (С2-С6)-алкенил нормального или разветвленного строения, (С5-С7)циклоалкил или (С5-СЗ)-циклоалкенил, замещенный (С1-С4)-алкилом нормального или разветвленного строения или (С2-С4)-алкенилом нормального или разветвленного строения, [(С1-С4)-алкил или (С2-С4)алкеяил]-Y или Y; в которой V выбран из группы, состоящей из фенила, 1-нафтила, 2-нафтила, инденила, азуленила, флуоренила, антраценила, 2-пирролинила, 3-пирролинила, пирролидинила, 1,3-диоксолила, 2имидазолинилй, имидазолидинила, 2Н-пиранила, 4-пиранила, пиперидила, 1,4-диоксанила, морфолинила, 1,4-дитианила, тиморфолинила, пиперазинила, хинуклидинила и указанных выше гетероциклических ароматических групп; где Y может содержать 1-3 заместителя, которые независимо выбраны ив группы, состоящей из водорода, галогена, гидроксигруппы, нитрогруппы, трифторметила, трифторметоксигруппы, (С1-С6)-алкила нормального или разветвленного строения, (С2-С6)-алкенила нормального или разветвленного строения, О(С1-С4)-алкил нормального или разветвленного строения, О-(С2-С4)-алкенил нормального или разветвленного строения, О-бензил, О-фенил, 1,2-метилендиоксигруппы, аминогруппы и карбоксигруппы; в которой J представляет собой водород, (С1-С2)-алкил или бензил; К представляет собой (С1-С4)-алкил нормального или разветвленного строения, бензил или циклогексилметил или J и К вместе образуют 5-7членнов гетероциклическое ядро, которое может содержать гетероатом, выбранный із О, S, SO и SO2 і и в которой m является числом 0-3. Стереохимия в положениях 1 и 2 (формула I) может быть независимо R или S. Предпочтительно, по меньшей мере, один из В и D не зависимо является нормальной цепью, имеющей на конце арил, т.е. группой, представленной формулой - (СН2)r-(X)-( СН2)S-Аr, в которой r является числом 0-4; S является числом 0-1; Ar имеет указанные выше значения и каждый X независимо выбран из группы, состоящей из СН2, О, S, SO, SO2, N и NR, где R выбран из группы, состоящей из водорода, (С1-С4)-алкила нормального или разветвленного строения, (С2-С4)-алкенила или алкинила нормального или разветвленного строения и мостикового алкила, причем мостик образован между атомом азота и группой Аr. В соответствии с одним примером осуществления настоящего изобретения гетероциклические ароматические группы выбраны из группы, состоящей из фурана, тиофена, пиррола, пиридина, индолизина, индола, изоиндола, бензо[b]фурала, бензо[b]тиофена, 4H-хинолизина, хинолина, изохинолина, 1,2,3,4тетрагидрохинолина, изоксазола и 1,2,3,4-тетрагидроизохинолина. В соответствии о другим примером осуществеиня настоящего изобретения, по меньшей мере, один из B и D выбран из группы, состоящей из (С2-С10)-алкинила нормального или разветвленного строения, (С5-С7)циклоалкилзамещенного (С2-С6)-алкинила нормального или разветвленного строения, (С5-С7)пиклоалкенилзамещенного (С2-С6)-алкинила нормального или разветвленного строения и Ar -замещенного (С2-С6)-алкинила нормального или разветвленного строения. В объеме настоящего изобретения находятся также соединения формулы (I), у которых, по меньшей мере, один из В и D выбран из группы, состоящей из Ar' Ar’ -замещенного (С1-С6)-алкила нормального или разветвленного строения и Ar'-замещенного (С2-С6)-алкенила или алкинила нормального или разветвленного строения, причем Ar'является группой Ar, имеющей 1-3 заместителя, которые независимо выбраны из группы, состоящей из N-(С1-С5-алкил или С2-С5-алкенил нормального или разветвленного строения)карбоксидов, N,N-да-(С1-С5-алкил или С2-С5-алкенил нормального или разветвленного строения)карбоксамидов, Nморфолинокарбоксамида, N-бензилкарбоксамида, N-тиоморфолинокарбоксамида, N-пиколиноилкарбокcида, группы O-Х, СН2-(СН2)q-X, O-(СН2)q-X, (СН2)q-O-X, СН=CH-X, в которой У представляет собой 4метокоифенил, 2-пиридил, 3-пиридил, 4-пиридил, пиразил, хинолил, 3,5-диметилизоксазоил, изоксазоил, 2метилтиазоил, тиазоил, 2-тиенил, 3-тиенил или пиримидил и q является числом 0-2. Примеры некоторых предпочтительных соединений формулы (I), у которых J и К, соединяясь, образуют 57-членное гетероциклическое ядро, приведены в таблице 1 и далее иллюстрируются в примерах.* *Должно быть понятно, что касается особенности настоящего изобретения по применению описанных в нем соединений в композициях или способах лечения или предотвращения устойчивости кo многим лекарственным средствам, то эти соединения представлены формулой (I), указанной вше. Что касается особенности настоящего изобретения по новым соединениям, описанным в нем, то эта соединения представлены формулой (I), приведенной вше, за исключением того, что В и D не могут быть водородом. Наиболее предпочтительными соединениями настоящего изобретения являются 4-пиридин-3-ил-1-(3пиридин-3-ил)пропил)-бутиловый эфир (S)-1-(2-оксо-2-(3,4,5-триметоксифеннл)ацетил )пиперидин-2карбоновой кислоты и 4-пиридин-3-ил-1-(3-(пиридин-3-ил)пропил)бутиловый эфир (R)-1-(2-оксо-2-(3,4,5триметоксифенил)ацетил)пиперидин-2-карбоновой кислоты, их фармацевтически пригодные производные и их смеси. В применяемом определении соединения настоящего изобретения, включающие соединения формулы (I), включают их фармацевтически пригодные производные, «Фармацевтически пригодное производное» обозначает любую фармацевтически пригодную соль, эфир или соль такого эфира соединения изобретения или любое другое соединение, которое при введении пациенту способно образовать (непосредственно или не непосредственно) соединение изобретения, или его метаболит или остаток, характеризующийся способностью поддерживать, повышать или восстанавливать чувствительность MDR-клеток к действию терапевтических или профилактических средств или предотвращать развитие устойчивости ко многим лекарственным средствам. Соединения настоящего изобретения, представленные формулой (I), можно получить любым обычным способом. Предпочтительно эти соединения химически синтезируют из легко доступных исходных соединений, например, альфа-аминокислот. Модулярные и конвергентные способы также предпочтительны для синтеза этих соединений. По способу конвергенции, например, большие части конечного продукта соединяют вместе в последних стадиях синтеза, что лучше, чем получать продукт постепенным присоединением небольших частей к растущей молекулярной цепи. Схема I иллюстрирует характерный пример конвергентного способа синтеза соединений формулы (l’), являющихся предпочтительной подгруппой соединений формулы (І), у которых А представляет собой кислород. Этот способ предусматривает этерификацню защищенной альфа-аминокислоты формулы (X), в которой Р является защитной группой, спиртом формулы (XI). Защищенные альфа-аминокислоты являются хорошо известными соединениями, многие из них коммерчески доступны. Например, обычные защитные группы и обычные способы защиты аминокислот описаны в Т W. Groups in Organic Chemistry, 2nd Ed., John Wiley and Sons, New York (1991). Для зашиты атома азота в соединениях формулы (X) предпочтительны алкокcикарбонильные группы, наиболее предпочтительны трет-бутоксикарбонил (Boс), бензилоксикарбонил (Сbz), аллилоксикарбонил (Аllос) и три-метилсилилэтоксикарбонил (Теос). После этерификации соединения формулы (Хll) освобождают от защитной группы в подходящих условиях удаления защитных групп (смотри Greent, Supra) и свободную аминогруппу соединения формулы (Хlll) затем ацилируют соединением формулы (XI) или активированным производным его для получения соединения формулы (Ґ). Способы активирования карбоксигрупп в карбонових кислотах, например, соединениях формулы (XIV), хорошо известны и многие активирующие средства коммерчески доступны. Спирты формулы (XI), у которых m является О (XI'), можно также получить стандартным способом, например, как показано на схемах 2 и 3. Реакцией металлорганического реагента формулы (XV) и альдегида формулы (XVl) получают спирты формулы (XI') (cхема 2). Альтернативно (cхема 3) 1,6-гептадиин-4-ол можно конденсировать путем катализируемой металлом реакции с ароматическими галогенидами формулы (XVll) для получения спирта формулы (XVll). Последующим гидрированием этого спирта можно получить спирт формулы (XI'’) из предпочтительного подкласса спиртов формулы (XI). Таким образом, настоящее изобретение предлагает способ получения соединений формулы (I), включающий стадии: (a) этерификации защищенной аминокислоты формулы (X) спиртом формулы (XI) для образования промежуточного продукта формулы (XII); (b) удаления аминозащитной группы у промежуточного продукта формулы (Хll) для получения аминоэфира формулы (Хlll); и (c) ацилирования свободной аминогруппы соединения формулы (Хlll) соединением формулы (XIV) или его активированным производным. Тем, кто работает в данной области, должно быть понятно, что способами, иллюстрированными синтетическими схемами 1, 2 и 3, можно легко получить большой ряд соединений формулы (I). Те же способы можно применять для синтеза многих других конечных продуктов путем изменения изменяемых групп в исходных соединениях. Например, соединения формулы (l") (не приведены), у которых А представляет собой NН или Н-(С1-C4алкил), можно синтезировать реакцией пептидного взаимодействия между карболовой кислотой формулы (X) и амином формулы (X”) (не приведена) для образования амида формулы (ХІl’). Эта стадия аналогична первой реакции этерификации схемы I. Стадии превращения (Xll’) в (І’’) также аналогичны cтадиям превращения (Xll) в (l’) схемы I. Оптически активные соединения формулы (I) можно также получить с применением оптически активных исходных соединений, благодаря чему отпадает необходимость в расщеплении энантиомеров и разделении диастереомеров на последней стадии синтеза. Работающим в данной области должно быть понятно также, что указанные выше синтетические схемы не предусматривают предоставление исчерпывающего перечня всех средств, при помощи которых можно синтезировать соединения или промежуточные продукты настоящего изобретения. Другие способы или модификации указанных выше общих схем должны быть ясны для специалистов данной области. Соединения настоящего изобретения можно модифицировать путем присоединения соответствующих функциональных групп с целью усиления селективных биологических свойств. Такие модификации известны в данной области и включают те модификации, которые повышают биологическое проникновение в данную биологическую систему (например, кровь, лимфатическую систему, центральную нервную систему), повышают пероральную доступность, повышают растворимость, чтобы соединение можно было вводить инъекцией, изменяют метаболизм и изменяют скорость экскреции соединения. Соединения настоящего изобретения характеризуются способностью повышать, восстанавливать или поддерживать восприимчивость МDR-клеток к действию цитотоксичних соединений, таких например, которые обычно применяют в химиотерапии. Благодаря этой способности соединения изобретения успешно применяют в качестве химиосенсибилизирующих средств, которые повышают эффективность химиотерапии у пациентов, которые поражены устойчивыми к лекарственным средствам раковыми заболеваниями, опухолями, метастазами или другими заболеваниями. Кроме того, соединения изобретения способны поддерживать восприимчивость к терапевтическим или профилактическим средствам в невосприимчивых клетках. Следовательно, соединения изобретения пригодны для лечения или профилактики устойчивости пациента ко многим лекарственным средствам. Применяемый в описании термин "пациент11 относится к животным, включая человека. Термин "клетка" относится к клеткам млекопитающих, включая клетки человека. Применяемые в описании термины "сенсибилизирующее средство", "сенсибилизатор", "химиосенсибилизирущее средство", "химиосеясибилизатор" и "МDR-модификатор" обозначают соединение, обладающее способностью повышать или восстанавливать восприимчивость МDR-клеток или поддергивать восприимчивость невосприимчивых клеток к одному или нескольким терапевтическим или профилактическим средствам. Термин "МDR-сенсибилизация" и "сенсибилизация" и "реоснсибилизация" относится к действие такого соединения в поддержании, повышении или восстановлении восприимчивости к лекарственным средствам. В соответствии с одним примером осуществления настоящего изобретения соединения настоящего изобретения полезны для повышения, восстановления или поддержания восприимчивости к лекарственным средствам и способны также связываться с белком FКВP-12 или другими, родственными FK-506 связывающими белками, например, FКВP-13, FKBP-26 и FKBP-52. В проводимых in vtro испытаниях (данные не приведены) эти соединения демонстрируют способность связываться с FKBP-12. Таким образом, это изобретение включает также класс химиосенсибилизирущих средств, не являющихся FK-506 и характеризующихся способностью связываться со связывающим белком FК-12 или родственными связывающими белками FК, фармацевтические композиции, включающие такие средства и физиологически пригодный вспомогательный компонент, носитель или наполнитель, и способы применения этих композиций для лечения или предупреждения устойчивости пациента ко многим лекарственным средствам. Предпочтительными соединениями, пригодными для применения щит предупреждения иди восстановлении устойчивости ко многим лекарственным средствам, являются те соединения, которые не проявляют заметной иммунодепрессивности при клинически пригодных или профилактически или терапевтически активных дозах, т.е. эффект, если он вообще имеется, иммунодепрессии такого соединения не превосходит величину активности его по сенсибилизации пациента. Такую иммунодепрессивную способность можно установить испытаниями in vitro, предложенными в заявках на патент США №07/547814 (теперь патент США 5192773), 07/704734, 07/697785 и 07/881152, которые включены сюда в качестве ссылок. Соединения настоящего изобретения дохло применять в форме фармацевтически пригодных солей, полученных из неорганических или органических кислот и оснований. Такие соли о кислотами включают: ацетат, адипат, альгинат, аспартат, бензоат, бензолоульфонат, бисульфат, оутират, цитрат, камфорат, камфораоульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, полусульфат, гептаноат, гекоаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиотансульфонат, лактат, малеат, метаноульфонат, 2-нафталиясульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, цропионат, оукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Соли с основаниями включают соли аммония, соли щелочных металлов, например, соли натрия и калия, соли щелочноземельные металлов, например, соли кальция и магния, соли с органическими основаниями, например, соли дициклогексиламина, N-метил-D-глюкамина, и соли с аминокислотами, например, аргинином, лизином и т.д. Азотсодержащие основные группы можно также кватернизовать такими агентами, как низшие алкилгалогениды, например, метил-, этил-, пропид- и бутилхлоридами, -бромидами и йодидами; диалкилсульфаты, например, диметил-, диэтил-, дибутил- и диамилсульфатами, высшие галогениды, например делил-, лаурил-, миристил- и стеарилхлоридами, бромидами и -йодидами; аралкилгалогенида, например, бензил- и фенотилбромидами и т.д. При этом получают растворимые или диспергируемые в воде или масле продукты. Соединения настоящего изобретения можно вводить перорально, парентерально, ингаляцией аэрозоля, местно, ректально, через нос, трансбуккально, вагинально или через имплантированный резервуар в дозированных формах, содержащих обычные нетоксичные фармацевтически пригодные носители, вспомогательные компоненты и наполнители. Применяемый термин "парентеральный” включает способы чрезкожной, внутривенной, внутримышечной, интраартикулярной, внутри су отавной, интрагрудинной, подоболочечной, внутрипочечной, внутрираневой и внутричерепной инъекции или инфузии. Фармацевтические композиции настоящего изобретения содержат любое не соединений изобретения или их фармацевтически пригодных содей с любым фармацевтическя пригодным носителем, вспомогательным компонентом или наполнителем. Фармацевтически пригодные носители, вспомогательные компоненты и наполнители, которые можно применять в фармацевтических препаратах настоящего изобретения, включают, но не ограничиваются ими, ионообменные смолы, оксид алюминия, стеарат алюминия, лецитин, белки сыворотки крови, например, альбумин сыворотки крови человека, буферные вещества, например, фосфаты, глицин, сорбиновую кислоту, сорбат калия, частично глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, например, сульфат протамина, вторичный кислый фосфат натрия, первичный кислый фосфат калия, хлористынй натрий, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натриевую соль карбокоиметилцеллюлозы, полиакридатн, воски, блокполимеры полиэтилена и полиоксипропилана, полиэтиленгликоль и ланолин. В соответствии с настоящим изобретением фармацевтические композиции могут быть в форме стерильного инъецируемого препарата, например, стерильной инъецируемой водной или маслянистой суспензии. Эту суспензию модно приготовлять по известным методикам с применением подходящих диспергирующих или смачивающих средств и суспендирующих средств. Стерильный инъецируемый препарат может быть также стерильным инъецируемым раствором иди суспензией в нетоксичном парентерально пригодном разбавителе или носителе, например, раствором в 1,3-бутандаоле. Среди пригодных наполнителей и растворителей, которые можно применять, указываются вода, раствор Рингера ж изотонический раствор хлористого натрия. Кроме того, в качестве растворителя или суспендирущей среды обычно применяют стерильные, нелетучие масла. Для этой поли можно применять любое мягкое нелетучее масло, включая синтетические моно- или диглицерида. Жирные кислоты, например, олеиновая кислота и ее глицеридные производные, пригодны для получения инъецируемых препаратов, для этого пригодны также природные фармацевтически пригодные масла, например, оливковое масло или касторовое масло, особенно их полиоксиэтилированные аналоги. Эти масляные растворы или суспензии могут содержать также в качестве разбавителя или диспергатора высший спирт, например Ph. Hclv. или аналогичный спирт. Фармацевтические препараты настоящего изобретения можно перорально вводить в любой перорально пригодной дозированной форме, включая, но не ограничиваясь ими, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального введения применяемые обычно носители включают лактозу и кукурузный крахмал. Обычно добавляют также смазывающие вещества, например, стеарат магния. Для получения перорального препарата в капоулированной форме пригодные разбавители включают лактозу и высушенный кукурузный крахмал. Когда для перорального применения нужны водные суспензии, активный компонент комбинируют с эмульгирущими и суспендирующими агентами. При желании, можно также добавить обычные подслащивающие вещества, корригены иди окрашивающие средства. Альтернативно фармацевтические препараты настоящего изобретения можно применять в форме суппозиториев для ректального введения. Их можно получать смешиванием активного компонента с подходящим, нераздражающим наполнителем, который является твердым при комнатной температуре, но гидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке, выовободдая лекарственное средство. Такие материалы включают какао-масло, пчелиный воск и полиэтилентгликоли. Фармацевтические препараты настоящего изобретения можно также вводить местно, особенно когда объект лечения включает участки или органы, легко доступные для местного применения, включая заболевания глаз, кожи или низшей части кишечника. Подходящие препараты для местного введения легко получают для каждого из этих участков или органов. Местное применение препарата для нижней части кишечника можно осуществить о использованием ректальных суппозиторий (смотри выше) или пригодной клизмы. Можно также применять местно-чрескожные пластыри. Для местного применения фармацевтические композиции можно приготовить в виде подходящей маги, содержащей активный компонент, суспендированный или растворенный в одном или нескольких носителях. Носители для местного введення соединений настоящего изобретения включают, но не ограничиваются ими, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиокоиэтилен, полиоксипропилен, эмульгируемый воск и воду. Альтернативно фармацевтические композиции можно приготовлять в форме пригодного лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или нескольких фармацевтически пригодных носителях. Пригодные носители включают, но не ограничиваются ими, минеральное масло, моноотеарат сорбитана, полисорбат 60, цетиловые эфиры воска, цетеариловый спирт, 2-октилдодеканол, бензиловий спирт и воду. Для офтальмологического применения фармацевтические композиции можно приготовлять в форме микронных суспензий в изотоническом стерильном солевом растворе с регулированным pH или, что предпочтительно, в форме растворов в изотоническом стерильном солевом растворе с установленным pH, возможно, с добавлением консерванта, например, хлористого бензилалкония. Альтернативно для офтальмологического применения фармацевтические композиции можно приготовить в виде мази, например, в вазелине. Фармацевтические композиции настоящего изобретения можно также вводить через нос распылением аэрозоля или ингаляцией. Такие композиции получают способами, хорошо известными для получения фармацевтических композиций, их можно получить в виде растворов в солевом растворе, применяя бензиловый спирт или другие пригодные консерванты, промоторы абсорбции для повышения биопригодности, фторкарбоны и/или другие обычные растворяющие или диспергирующие средства. Количество активного компонента, который можно комбинировать с носителями для получения композиции в виде разовых доз, будет изменяться в зависимости от пациента, которому вводят препарат, и способа введения препарата. Должно быть понятно, однако, что определенная доза и режим л вчення для конкретного пациента будут зависеть от различных факторов, включая активность применяемого специфического соединения, возраста, массы тела, общего здоровья, пола, диеты, времени введения, скорости экскреции, комбинации лекарственных средств, решения лечащего врача и остроты конкретного заболевания, которое лечат этим препаратом. Количество активного компонента может также зависеть от терапевтического или профилактического средства, если оно присутствует, с которым активный компонент вводят совместно. Применяемый термин "фармацевтически эффективное количество" относится к количеству, эффективному для предотвращения появления устойчивости ко многим лекарственным средствам или поддержания, повышения или восстановления восприимчивости MDR-клеток к лекарственному средству. Пригодны пределы доз активного компонента между около 0.01 и около 100мг/кг тела в день, предпочтительно между около 0.5н около 50мг/кг тела в день. Типичная когпгозяцая будет содержать между около 5% и около 95% активного соединения (масса/масса). Предпочтительно такие композиции содержат между около 20% и около 80% активного соединения. Когда соединения этого изобретения применяют в комбинационной терапии с другими средствами, юс можно вводить пациенту последовательно или одновременно. Альтернативно фармацевтические или профилактические композиции в соответствии о настоящим изобретением могут содержать комбинацию соединения настоящего изобретения и другого терапевтического или профилактического средства. Например, соединения можно вводить отдельно или в комбинации о одним или несколькими терапевтическими средствами, такими как химиотерапевтичеокие средства (например, актиномицином D, доксорубицином, винкристином, винбластином, этопозидом, амзакрином, митоксантроном, тениразидом, таксолом и колхицином) и/или химиосенсибилизирующие средства (например, циклоспорином А и его аналогами, фенотиазинами и тиоксантерами) для повышения восприимчивости MDR-клеток пациента к этому средству или средствам. Для того, чтобы настоящее изобретение можно было понять более полно, предложены следующие примеры. Эти примеры приведены только для целей иллюстрации и не должны рассматриваться ни коим образом как ограничение объема изобретения. Общие способы Спектры протонного ядерного магнитного резонанса (1Н ЯНР) регистрировали на спектрометре Вruker АМХ 500 при частоте 500МHz. Химические сдвиги представляли в частях на миллион (d) относительно Ме4Si (d 0,0). Аналитическую жидкостную хроматографию высокого разрешения проводили на жидкостном хроматографе Waters 600E или Нewlett Packard 1050. Пример 1 Синтез (S)-1,7-дифеяил-4-гептанил-N-(3,4,5-триме-токсифенилглиоксил)пипеколата (3) 4-фенил-1-масляный альдегид (119). В раствор 3.2мл (20.8ммоля) 4-фенил-1-Оутанола (Aid rich Chemical. Cа) в 20мл СН2Сl2 при 0°С добавляли 3.2г порошкообразных молекулярных сит 3A и затем 5.37г (24.9ммоля) хлорхромата пиридиния (РСС). Подученную суcпензию перемешивали при 0°С в течение 1 часа, в это время добавляли дополнительно 2,16г (10.0ммоля) РСС и реакционную смесь нагревали до комнатной температуры. После перемешивания при комнатной температуре 0.5ч реакционную смесь разбавляли простым эфиром и фильтровали через целит, получая 2.5г неочищенного продукта. Флаш-хроматографией (элюирование 5%-ным этилацетатом в гексане) выделили 700мг альдегида 119. 1Н ЯМВ-спектр его согласуется со структурой. Бромид 3-фендил-1-пропилмагния (120). В суспензию 736мг (30.3ммоля) магниевых стружек в 50мл ТГФ при комнатной температуре добавляли 50мкл 1,2-дибромэтана и затем по каплям 5.5г (25.1ммоля) 1-бром-3фенилпропана (Aldrich Chemicl Co.). После перемешивания при комнатной температуре 0.5ч супернатант переносили при помощи трубки в сосуд для хранения объемом 100мл и затем применяли в виде 0.5М раствора реактива Гриньяра 120 и ТГФ. 1,7-дифенид-4-гептнол: (121). В раствор 700мг (4.7ммоля) 4-феннл-1-бутаналя (119) в 5.0мл ТГФ при 0°С добавляли 10.0мл (5.0ммолей) бромистого 3-фонил-1-пропилмагния (120) и полученную смесь перемешивали при 0°С 0.5ч. В смесь затем добавляли по каплям насыщенный раствор NH4/Cl и разбавляли простым эфиром. Фазы разделяли и органический слой промывали водой и соляным раствором и затем сушили над MgSO4. После концентрирования получали 1.12г спирта 121 в виде масла. 1H ЯМР-спектр согласуется со структурой. (S)-Вос-1-Пипеколил-1.7-дифенил-4-гептаниловкй эфир. (122). В раствор 164мг (0.72ммоля) Вос-Lпипеколиновой кислоты в 5.0мл СН2Сl2 при комнатной температуре добавляли 174мг (0.65ммоля) спирта 121, 140мг (0.72ммоля) гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (ЕДС) и каталитическое количество N,N-диметиламинопиридина (DMAP). Реакционную смесь перемешивали при комнатной температуре 0.5ч и затем переносим непосредственно в колонку с силикагелем. Элюированием 10%-ным этилацетатом в гексане подучили 76,2мг эфира 122 в виде масла. 1Н ЯМР-спектр согласуется со структурой. (S)-1,7-Дифенил-4-гептанилпипеколат (1.23). В раствор 47мг (0.10ммоля) эфира 122 в 1.0мл CН2Cl2 при комнатной температуре добавляли 1.0мл трифторуксусной кислоты. После перемешивания при комнатной температуре 0.5ч полученный раствор нейтрализовали, добавлением по каплям насыщенного раствора КСO3. Слой разделяли и органическую фазу промывали водой, сушили над MgSO4 и концентрировали, получая 23мг амина 123 в виде масла. 1Н ЯМВ-спектр согласуется со структурой. 3,4,5-Триметоксибензоилмуравьиная киолота (124). В раствор 9.2г (43.4ммоля) 3,4,5триметокоиацетофенона (Aedrich Chemical Со.) в 35мл пиридина добавляли 6.3г (56.7ммоля) диоксида селена и полученный раствор нагревали о обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры, фильтровали через целит и концентрировали, получая темнокоричневое масло, которое раотворяли в этилацетате и промывали 1.0N НСl и затем насыщенным раствором NaHCO3. Щелочной водный слой разбавляли эфиром и подкисляли концентрированной НСІ. Слои разделяли и органическую фазу промывали соляным раствором и затем сушили над Na2SO4, получая 8.4г кислоты 124 в на де бледно-желтого твердого вещества. 1Н ЯНВ-спектр согласуется со структурой. (S)-1,7-Дифенил-4-гептанид-N-(3,4,5-триметоксифенил-глиоксил)пипеколат (3). В раствор 23мг (0.06ммоля) амина 123 в 1.0мл CН2Cl2 при комнатной температура добавляли 21,8мг (0.09ммоля) кислоты 124 и затем 17.9мг (0.09ммоля) EDС и полученный раствор перемешивали при комнатной температуре 0.5ч и затем непосредственно перенесли в колонку с силикагелем. Элюированием 15%-ным этилацетатом в гексане выделили 8.4мг амина 3 в виде смеси ротамеров (поворотным изомеров). 1Н ЯМР-спектр (500МГЦ, CDCl3) d 7.35-7.06 (м), 5.32 (ш.с), 5.00 (ш.c), 4.88 (ш.c), 4.58 (д), 4.31 (ш.с), 3.95 (c), 3.89 (с), 3.44 (д), 3.21 (m), 3.04 (m), 2.54 (ш.с), 2.51 (ш.c), 2.42 (ш.c), 2.30 (д), 2.15 (д), 1.83-1.21 (м). Пример 2 Синтез (R и S)-1-(3-фенокcифенил)-4-фенил-1-бутил-(S)--(3,4,5-триштоксифвнилглиоксил)пипеколата (4) 3-Феноксибензальдегид (125). В раствор 1.8мл (10.3ммоля) 3-феноксибензилового спирта (Aldrich Chemicol Co) в 20мл CН2Cl2 при комнатной температуре добавляли 1.5г порошкообразных молекулярных сит 4A и 2.5г активированного MnO2. Полученную суспензию перемешивали при комнатной температуре 0.5ч, в это время добавляли дополнительно 2.5г MnO2. После перемешивания 0.5ч при комнатной температуре реакционную смесь фильтровали через целит, получая 1.84г альдегида 125 в виде масла. 1Н ЯМР-спектр согласуется со структурой. (R и S)-1-(3-фенокcифенил)-4-фенил-1-бутил (126). Спирт 126 получали из 190мг (0.96ммоля) альдегида 125 и 2.0мл (1.0ммоля) реактива Гриньяра 120 в 2.0мл ТГФ, как описано вше для синтеза спирта 121 в примере 1. Флаш-хроматографией (элшрование 10%-ный етилацетатом в гексане) выделили 108мг рацемического спирта 126. 1Н ЯМР-спектр согласуется со структурой. (S)-(3.4.5-Триметоксифенил)гліоксилпипеколиновая кислота (127). Во взвесь 953.3мг (3.4ммоля) тартратной соли (S)-пипеколиновой кнслоты (Egbertson, M and Dfnishefsky., S.J. Org.Chem. 1989, 54, 11) в 7,0мл CН2Cl2 добавляли 3.9мл (22.39ммоля) диизопропилэтиламина и 2.4мл (18,9ммоля) хлортриметилсилана и полученный раствор перемешивали 0,5ч при 0°С. В другой реакционной кодов в раствор 820мг (3.4ммоля) кислоты 124 в 7.0мг добавляли 450мкл (5.2мм ммоля) хлористого оксалила и три капли ДМФ. После прекращения выделения газа все содержимое второй колбы добавляли в первую реакционную колбу и образованную смесь перемешивали 1ч при комнатной температуре. Реакционную смесь концентрировали, растворяли в эфире и промывали 0.5N НСl и затем насыщенным раствором NaHCO3. Щелочную водную фазу подкисляли концентрированной HCl и экстрагировали эфиром. Эфирные экстракты промывали водой, соляным раствором, сушили над MgSO4 и концентрировали, получая 490мг кислоты 127. 1 H ЯМР-cпектр согласуется со структурой. (R и S)-1-(3-фенокcифенил)-4-фенил-1-бутил-(S)-N-(3.4.5-триметокоифенилгдиоксид)пипеколат (4). В раотвор 29.4мг (0.08ммоля) кислоты 127 в 2.0мл CН2Cl2 при комнатной температуре добавляли 11мкл (0.13ммоля) хлористого оксалила и три капли ДМФ и реакционную смесь перемешивали 0.5ч при комнатной температуре и затем концентрировали и суспензировали в 1.0мл бензола. К этой суспензии добавляли 3220мг (0.1ммоля) спирта 126 и 13.4мг (0.1ммоля) цианида серебра. Полученную смесь нагревали о обратным холодильником в течение ночи, охлаждали до комнатной температуры и концентрировали. Флашхроматографией (элюирование 10%-ным етилацетатом в гексане) выделили 8.8мг эфира 4 в виде смеси диаотереомеров. 1H ЯМР-cпектр (500МГц, CDCl3) d 7.34-7.19 (м), 7.18-7.03 (м), 7.02-6.84 (м), 6.83-6.72 (м), 6.73 (к), 5.69-5.55 (м), 5.38 (m), 4.55 (ш.д), 4.35 (дд), 3.94 (с), 3.92 (с), 3.89 (с), 3,83 (с), 3.73 (с), 3.63 (с), 3.84-3.35 (м), 3.20 (m), 3.10 (m), 2.60 (к), 2.40 (дд), 1.95-1.91 (м), 1.90-1.45 (м). Пример 3 Синтез (R и S)-6-фвнил-1-(3-пиридил)-3-гексил-(S)-N-(3,4|5-тримвтоксифвнилглиоксил)пипеколата (7) 3-(3-Пиридил)-1-пропилальдегид (128). В раствор 2.3г (5.46ммоля) периодината Двсс-Мартина (Dess, D. B., Martin, J.C.J. Org. Chem. 1983, 48, 4155) в 10мл CН2Cl2 при 0°С добавляли 470мкл (3.65ммоля) 3-(3пиридил)-1-цропанола и полученную смесь оставляли для нагревания от 0°С до комнатной температуры в течение периода 1.5ч. В этот раствор добавляли 6.0г (38.22ммоля) Na2S2O3 в насыщенном растворе NaНСО3 и реакционную смесь перемешивали 15мин при комнатной температуре. Продукт экстрагировали CН2Cl2, сушили над МgSO4 и концентрировали. Флаш-хроматографией (элюирование смесью гексана и ацетона 3:1) выделили альдегид 128 в виде масла. 1H ЯМР-cпектр согласуется со структурой. (R и S)-6-Фенил-1'(3-пиридил)-3-гексанол (129). Спирт 129 получали из 125мг (0.92ммоля) альдегида 128 и 2.0мл (1.0ммоля) соединения 120 в 2.0мл ТГФ, как описано вше для синтеза спирта 121 в примере 1. Получили 221мг неочищенного спирта 129. 1H ЯМР-cпектр согласуется со структурой. (S)-Воc-Пипекоил-(R и S)-6-фенил-1-(3-пиридил)-3-гексидовый ЭФИР (130). Эфир 130 получали из 125мг (0.49ммоля) спирта 129, 93мг (0.41ммоля) Вос-пипеколиновой кислоты, 94мг (0.49ммоля) EDС и каталитического количества DMAP в 1.0мл CН2Cl2 и 1,0мл ДМФ, как описано выше для синтеза 122 в примере 1. Флаш-хроматографией (элюирование смесью гексана и этилацетата 2:1) выделили 105мг диастереомерного эфира 130 в виде масла. 1H ЯМР-cпектр согласуется со структурой. (R и S)-6-Фенил-1-(3-пиридил)-3-гексил-(S)-пипеколат (131). Амин 131 синтезировали обработкой 95мг (0.20ммоля) эфира 130 1.0мл трифторуксусной кислоты в 3.0мл CН2Cl2 как описано выше для получения амина 123 в примере 1. Получили 58мг диастереомерного амина 131 в виде масла. 1H ЯМР-cпектр согласуется со структурой. (R и S)-6-Фенил-1-(3-пиридил)-3-гексил-(S)-N-3,4,5-триметоксифенилглиоксид)пипеколат (7). Эфир 7 получали из долучала из 54мг (0.15ммоля) аминов 131, 50мг (0.22ммоля) кислоты 124 и 42мг (0.22ммоля) EDС в 3,0мл CН2Cl2, как описано выше в синтезе эфира 3 в примере 1. Флаш-хроматографией (элюирование смесью этилацетата и гексана 1:1) выделили 73мг диастереомерного эфира 7 в виде смеси ротамэров. 1H ЯМР-cпектр (500Гц, CDCl3) d 8.48-8.42 (м) 7.50-7.41 (м), 7.32 (д), 7.27-7.03 (м), 5.38 (д), 5.31 (д), 5.06-5.01 (м), 4.97-5.93 (м), 4.60 (ш.д), 3.92 (с), 3.88 (с), 3.86 (с), 3.84 (с), 3.82 (с), 3.79 (с), 3.46 (ш. д), 3.27 (ш. т), 2.73-2.68 (м), 2.38-2.29 (м), 1.98-1.76 (м), 1.75-1.60 (м), 1.56-1.51 (м), 1.38-1.20 (м). Пример 4 Синтез (R и S)-(Е)-1-[транс-(4-гидроксициклогексил)] -2-метил-6-фенил-3-гекс-1-енил-(S)-N-(3,4,5триметокоифенилглирксил)пипеколата (8) Цис и транс-4-(трет-Бутилдиметилсилилокси)циклогексан-1-ол (132) и (133). В раствор 3.43г (21.7ммоля) цис- и транс-метил-4-гадроксициклогексанкарбоксилата (Noyce, D. S., Denny, D.B.J. Am. Сhem. Soc. Vol. 74, 5912 (1952)) в 45мл хлористого метилена при 0°С добавляла 3.0мл (26.0ммоля) 2,6-лутидина и затем 5.5мл (23.0ммоля) трет-бутилдиметилсилилтрифторметансульфоната. Ледяную бани убирали и реакционную смесь перемешивали 2ч при 25°С, после чего раствор выливали в насыщенный раствор бикарбоната натрия. Слои разделяли и органический слой промывали насыщенным раствором сульфата меди и водой и затем сушили над МgSO4, получая 5.9г неочищенных кеталовых эфиров. Раствор 5.72г (21.0ммоля) этой смеси в 45мл безводного ТГФ обрабатывали 400мг (10.5ммоля) алюмогидрида лития. Реакционную смесь перемешивали 0.5ч при 25°С, в нее затем медленно добавляли насыщенный раствор соли Rochelles. Смесь разбавляли эфиром, слои разделяли и водный слой промывали 2 раза етилацетатом. Объединенный органический экстракт сушили над МgSO4 и концентрировали, получая 4.9г диастереомерных спиртов. Флашхроматографией (элюнрование смесью этилацетата и гексана 1:5) выделили 650мг изомера 132, 1.10г изомера 133 и 2.40г смеси обоих. Данные для 132: 1H ЯМР-cпектр (300МГц, СDСl3) d 3.99-3.92 (м), 3.46 (д), 1.72-1.58 (м), 1.57-1.36 (м), 0.86 (c), 0.08 (c). Данные для 133: 1H ЯМР-cпектр (300МГц, СDСl3) d 3.47 (дддд), 3.38 (д), 1.86-1.67 (м), 1.47-1.16 (м), 1.05-0.77 (м), 0.72 (с), 0.02 (с). (Е)- этил-3-[транс-(4-трет-Бутилдиметилсилилоксициклогексил)]-2-метилпрод-2-еноат (134). В раствор хлористого оксалина (785мкл, 9,0ммодя) в 10мл хлористого метилена при -78°С добавляли диметилсульфоксид (1.3мл, 18.0ммоля). Полученный раствор перемешивали 5мин и затем добавляли 1.1г (4.5ммоля) спирта 133 в 10мл хлористого метилена. Реакционную смесь перемешивали при -78°С 45мин и в это время добавляли 3.8мл (27,0ммоля) триэтиламина. Раствор оставляли для нагревания до комнатной температуры. Реакцию прекращали добавлением 1.0 N НСІ и водный слой экстрагировали тремя порциями хлористого метилена. Объединенный органический экстракт сушили над МgSO4 и выпаривали досуха, получая 1.0г промежуточного альдегида. Раствор этого альдегида обрабатывали непосредственно 710мг (1.95ммоля) (карбэтоксиэтилиден)трифенилфосфорана в 5.0мл хлористого метилена. Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи и затем выливали в воду. Слои разделяли и водный слой экстрагировав два раса хлористым метиленом. Объединенный органический сйой сушили над МgSO4 и концентрировали, получая енолят 134, содержащий небольшое количество Zизомера. 1H ЯМР-cпектр согласуется со структурой. (Е)- этил-3-[транс-(4-трет-Бутилдиметилсилилоксициклогексил)]-2-метилпрод-2--ен-1-ол (135). В раствор 860мг (2.6ммоля) енолята 134 в 5,0мл безводного тетрагадрофурана при 25°С добавляли 50мг (1.3ммоля) алюмогидрида лития и полученную смесь перемешивали 30мин. Реакцию прерывали медленным добавлением насыщенного раствора солі Rochelle's и разбавляли этилацетатом. Слои разделяли и водный слой экстрагировали двумя порциями этилацетата. Объединенный органический экстракт промывали водой и соляным раствором и сушилт над МgSO4. Выпариванием и флаш-хронатографией (элюирование 15%-ным этилацетатом в гексане) выделили 370мг аллилового спирта 135. 1H ЯМР-cпектр согласуется со структурой. (Е)- этил-3-[транс-(4-трет-Бутилдиметилсилилоксициклогексил)]-2-метилпрод-2-ен-1-адь (136). В раствор хлористого оксалала (105мкл, 1.2ммоля) в 1.0мл хлористого метилпроп при -78°С добавляли диметилсульфоксид (170мкл, 2.4ммоля). Полученный раствор перемешивали 5мин и затем добавляли 170мг (0.6ммоля) спирта 135 в 1.0мл хлористого метилена. Реакционную смесь перемешивали 45 мин при -78°С, в это время добавляли 500мкл (3.6ммоля) триэтиламина и раствор оставляли для нагревания до комнатной температуры. Реакцию прекращали 1.0N НСl и водный слой экстрагировали тремя порциями хлористого метилена. Объединенный органический екстракт сушили над МgSO4 и выпаривали досуха, получая неочищенный альдегид 136, который применяли непосредственно в следующей реакции. 1H ЯМР-cпектр согласуется со структурой. (R и S)-(Е)-1-[транс-(4-трет-Бутилдиметилсилилоксициклогексил)]-2-метил-6-фенилгекс-1-ен-3-ол (137). Спирт 137 получали из неочищенного адьдегида 136 и 1.5мл (0,75ммоля) соединения 120 в 2.0мл ТГФ, как описано выше для синтеза спирта 121 в примере 1. Получили 220мг неочищенного-диастереомерного спирта 137. Флаш-хроматографией (элюирование 20%-ным этилацетатом в гексане) выделили 146мг спирта 137 в виде мсла. 1H ЯМР-cпектр согласуется со структурой. (R и S) (Е)-1-[транс-(4-трет-Бутилдиметилсилилоксициклогексил)]-2-метил-6-фенил-3-гекс-1-енил-(S)-N3.4.6-триметоксифенилглиоксил)пипеколат (138). В раствор 75.7мг (0.22ммоля) кислоты 127 в 2.5мл хлористого метилена при комнатной температуре добавляли 30мкл (0.34ммоля) хлористого оксалила и три капли ДМФ и реакционную смесь перемешивали 0.5ч при комнатной температуре и затем концентрировали и суспензировали в 1.0мл бензола. В эту суспензию добавляли 43.4мг (0.11ммоля) спирта 137 и 28.8мг (0.22ммоля) цианида серебра. Полученную смесь нагревали с обратным холодильником в течение ночи, охлаждали до комнатной температуры и концентрировали. Флаш-хроматографией (элюирование 4% ацетона в гексане) выделили 17.5мг эфира 138 в виде смеси диастереомеров. 1H ЯМР-cпектр согласуется со структурой. (R и S) (Е)-1-[транс-(4-трет-4-Гидроксипиклогексил)]-2-метил-6-фенил-3-гекс-1-енил-(S)-N-3.4.6триметоксифенилглиоксил)пипеколат (8). В раствор 17.5мг (0.02ммоля) эфира 138 в 1.0мл CН3CN при комнатной температуре добавляли 10 капель раствора (95:5) CН3CN и полученную смесь перемешивали при комнатной температуре 0.5ч. Реакционную смесь нейтрализовали насыщенным раствором К2СО3 и экстрагировали эфиром. Эфирные слои промывали водой, сушили над МgSO4 концентрировали, получая 7.2мг неочищенного продукта. Флаш-хроматогрфей (элюировали 15% ацетона в гексане) выделили 4.9мг диастереомерного спирта 8 в виде смеси ротамеров. 1H ЯМР-cпектр (500МГц, СDСl3) d 7.38-7.02 (м), 5.35-5.01 (м), 4.62-4.53 (м), 4.28 (т), 3.95 (с), 3.89 (с), 3.87 (с), 3.86 (с), 3.85 (с), 3.81 (с), 3.55 (м), 3.45 (м), 3.20 (м), 3.102.90 (м), 2.60-2.45 (м), 2.32 (т), 2.10 (т), 1.95 (д), 1.85-1.40 (м), 1.39-1.02 (м). Пример 5 Синтез (R и S)-5-(3-индолил)-1-фенил-2-пентил-(S)-N-(3,4,5-триметоксифенилглиокоил)пипеколат (11) N-метил-N-метокси-4-(3-индолил)бутирамид (139). Во взвесь 1.75г (8.61ммоля) 3-индолмасляной кислоты (Aldrich Chemical Co.) в ацетонитриле при комнатной температуре доставляли 7.0мл (40.2ммоля) N,Nдиизопропилэтиламина, 3.8г (21,5ммоля) гидрохлорида N,N-диметилгидроксиламина и 4.19г (9.5ммоля) гексафторфосфата бензотриазол-1-илокситри(диеметиламино) фосфония (реaгент ВОР) и полученную смесь перемешивали при комнатной температуре в течение ночи и затем концентрировали досуха. Остаток растворяли в этилацетате и промывали водой, 0.5N НСІ, насыщенным раствором NaHCO3 соляным раствором и сушили над МgSO4 и концентрировали. Флаш-хроматографией (градиентное элюирование 2-10% эфира в хлористом метилене) выделили 2.0г амида 139. 1H ЯМР-cпектр согласуется со структурой. Бвнзил-3-(3-индолил) пропилкетон (140). В раотвор 147мг (0.60ммоля) амида 139 в 4.0мл ТГФ при -78°С добавляли 1.31мл (1.31ммоля) хлористого бензилмагния (1.0М в диэтиловом эфире) и реакционную смесь оставляли нагреваться до комнатнойтемпературы и перемешивали 3ч. Реакцию прерывали добавлением 5% KHSO4 и экстрагировали эфиром. Объединенный эфирный слой промывали соляным раствором и сушили над МgSO4. Флаш-хроматографией (элюирование 25% эфира в гексане) выделили 108мг кетона 140. 1H ЯМРcпектр согласуется со структурой. (R и S)-5-(3-индолил)-1-фенил-2-центанол (141). Во взвесь 105мг (0.38ммоля) кетона 140 в 3.0мл МеОН при 0°С добавляли 30мг (0.79ммоля) твердого NaBH4 и образованную суспензию перемешивали 3ч. В реакционную смесь добавляли 5% KHSO4 и экстрагировали атилацетатом. Объединенный органический экстракт промывали соляным раствором и сушили над МgSO4, Флаш-хроматографией (элюирование 4% эфира в хлористом метилене) выделили 81мг спирта 141 в виде белого твердого вещества. 1H ЯМР-cпектр согласуется со структурой, (S)-Воc-Пироколил-(R и S)-5-(3-индолил)-1-фенил-2-пентиловый эфир (142). Эфир 142 получали из 80мг (0,29 ммоля) спирта 141, 82мг (0,36ммоля) (S)-Вос-пипеколиновой кислоты, 66мг (0,34ммоля) ЕDС, и каталитического количества 4-пирролидинопиридина в 2.0мл хлористого метилена (смесь перемешивали в течение ночи при комнатной температуре), как описано выше для синтеза эфира 122 в примере 1. Флашхромотографией (элюирование смесью эфира, хлористого метилена, гексана, 4:10:26) выделили 108мг диастереомерного эфира 142 в виде белой пены. 1H ЯМР-cпектр согласуется со структурой. Гидрохлорид (R и S)-5-(3-индолил)-1-фенил-2-пентил-(S)-пипеколата (143). Безводный НСl барботировали в раствор 103мг (0.21ммоля) эфира 142 в 10мл этилацетата при -20°С в течение 10мин и затем реакционную смесь продували N2. Концентрированием выделяли 108мг неочищенного амина 143 в виде гидрохлорида. 1H ЯМР-cпектр согласуется со структурой. (R и S)-5-(3-Индолил)-1-фенил-2-пентил-(S)-N-(3.4.5- триметоксифенилглиоксил)пипеколат (11). Во взвесь 108мг неочищенного гидрохлорида амина 143 в CН3CN при комнатной температуре добавляли 91мкл (0.52ммоля) N,N-диизопропил-этиламина, 76мг (0.31ммоля) кислоты 124 и 111мг (0.25ммоля) реагента ВОР и полученную смесь перемешивала два дня при комнатной температуре и затем концентрировали досуха. Остаток растворяли в 75млэтилацетата и затем последовательно промывалт водой, 5% KHSO4, насыщенным раствором и соляным раствором и затем сушили над МgSO4 и концентрировали. Флаш-хроматографией (элюирование 4% эфира в хлористом метилене) выделили 56.7мг диастереомерного амида 11 в виде ротамерной смеси, 1H ЯМР-cпектр (500МГц, CDCI3 ) d 7,93 (д), 7.56 (т), 7.38-6.73 (м), 5.38-5.14 (м), 3.90 (м), 3.38 (ш. т), 3.10 (ш, т), 2.97-2.60 (м), 2.31 (д), 2.10 (д), 1.98-1.17 (м), 0.8 (м), 0.51 (10% эфира в хлористом метилене). Пример 6 Синтез (R и S)-2-бензил-4-фвнил-1-бутил-(S)-N-(3,4,5-триметоксифенилглиоксил)пипеколата (16) (R и S)-2-Бензил-4-фенил-1-масляная кислота (144). В раствор 1.06г (6.43ммоля) 4-фенилмасляной кислоты в 20мл ТГФ при 0°С добавляли 193мг (6,43ммоля) твердого NaH (80% в минеральном масле). После перемешивания при 0°С в течение 0.5ч добавляли 3,2мл (6.43ммоля) комплекса диизопропиламид лития-ТГФ (2.0М) и полученный красный раствор перемешивали при 0°С 45мин. В эту смесь добавляли 765мкл (6.43ммоля) бромистого бензила и раствор перемешивали в течение ночи при комнатной температуре. В реакционную смесь медленно добавляли насыщенный раствор NaHCO3 и затем промывали эфиром. Щелочные экстракты подкисляли твердым KHCO3 и экстрагировали этилацетатом. Объединенный органический экстракт промывали соляным раствором, сушили над МgSO4 и концентрировали, получая 484мг кислоты 144. 1H ЯМР-cпектр согласуется со структурой. (R и S)-2-Бензил-4-фенил-1-бутанол (145). В раствор 469мг (1.84ммоля) кислоты 144 в 3.0мл ТГФ при 78°С добавляли 2.03мл (2.03ммоля)алюмогидрида лития (1.0М в ТГФ) и полученный раствор оставляли для нагревания до комнатной температуры и перемешивали в течение ночи. В реакционную смесь медленно добавляли соль Rochelle’s и экстрагировали эфиром. Объединенный эфирный экстракт промывали водой и соляным раствором а сушили над МgSO4 и концентрировали. Флаш-хроматографией (элюирование 2% эфира в хлористом метилене) выделили 264мг спирта 145. 1H ЯМР-cпектр согласуется со струтурой. (S)-Воc-Пипеколил- (R и S)-2-бензил-4-бутиловый эфир (146). Эфир 146 получали из 264мг (1.10ммоля) спирта 145, 302мг (1.32ммоля) (S)-Вос-L-пипеколиновой кислоты, 235мг (1.32ммоля) ЕDС и каталитического количества 4-пирролидинопиридина в 2.0мл хлористого метилена (смесь перемешивали 3 дня при комнатной температуре), как описано вше для синтеза эфира 122 в примере 1. Флаш-хроматографией (элюирование смесью эфира, хлористого метилена и гексана, 1:5:14) выделила 375мг диастереомерного эфира 146. 1H ЯМР-cпектр согласуется со структурой. Гідрохлорид (R и S)-2-бензил-4-фенил-1-бутил-(S)-пипеколата (147). Безводный НСІ барботировали в раствор 375мг (0.83ммоля) эфира 146 в 10мл этилацетата при -20°С в течение 10мин и затем реакционную смесь продували N2. Концентрированием продукта получили неочищенный амин 147 в виде гидрохлорида. 1H ЯМР-cпектр согласуется со структурой. (R и S)-2-Бензил-4-фенил-1-бутил-(S)-N-(3.4.5-триметоксфенилглиоксил)пипеколат (16). Во взвесь 54мг (0.14ммоля) неочищенного гидрохлорида амина 147 в 2,0мл CН3CN при комнатной температуре добавляли 60мел (0.35ммоля) N,N-диизопропилэтиламина, 50мг (0,21ммоля) кислоты 124 и 73мг (0.16ммоля) реагента ВОР и полученную смесь перемешивали 3 дня при комнатной температуре и затем концентрировали досуха. Остаток растворили в 75мл этилацатата и затаи промыли последовательно водой, 5% раствором КНSO4, насыщенным раствором NaHCO3 и соляным раствором и затем сушили над МgSO4 и концентрировали. Флаш-хроматографией (элюирование 2% эфира в хлористом метилене) выделили 52.7мг диастереомерного амида 16 в виде ротамерной смеси. 1H ЯМР-cпектр (500МГц, СDСl3) d 7.21-7.01 (м), 5.41 (ш. с), 4.21 (дд), 4.08 (дд), 4.12 (д), 3.88 (д), 3.95 (с), 3.91 (с), 3.49 (д), 3.39 (дт), 2.80-2.62 (м), 2.38 (ш. т), 2.09 (ш. с), 1.87-1.20 (м). Rf 0.9 (метанол, эфир, хлористый метилен, 1:3:26). Пример 7 Синтез (R и S)-1-фенил-7-(2-пиридил)-4-гептил-(S)-N-(тpeтбyтилглиoкcил)пипeкoлaт (21) (Е и Z)-3-(1.3-Диоксан-2-ил)-1-(2-пиридил)-1-пропен (148 и 149). В суспензию 4,6г (10.2ммоля) бромистого [2-(1,3-диоксан-2-ил)этил]трифенифосфоная (Аldrich Chemical Со) в 50мл ТГФ при 0°С добавляли 6.4мл (10.2ммоля) н-бутиллития (1,6М в гексанах) и полученный красный раствор перемешивали при 0°С 0.5ч. В этот раствор добавляли 880мкл (9.3ммоля) 2-пиридинкарбоксальдегида (Aldrich Chemcal Co). Полученную смесь перемешивали 1ч при комнатной температуре и затем выливали в воду и экстрагировали эфиром. Объединенный эфирный экстракт сушиш над МgSO4 и концентрировали, Флаш-хромтографией (элюировние смеси гексана и этилацетата, 3:1) выделили 0.43г Е-3-(1,3-диоксан-2-ил)-1-(2-пиридил)-1-пропена (148) и 1,12г 1-3-(1,3-ди-оксан-3-ил)-1-(2-пиридил)-1-пропена (149). 1H ЯМР-cпектр согласуется со структурами. 1-(1.3-Диоксан-2-ил)-3-(2-пиридил)пропан (150). Через суспензию 800мг (4,2ммоля) олефина 149 и 100мг 10%, палладия на угле барботировали равномерный поток водорода в течение периода 10мин. Реакционную смесь затем фильтровали через целит и концентрировали, получая 805мг ацеталя 150 в виде бесцветного масла. 1H ЯМР-cпектр согласуется со структурой. 4-(2-Пиридил)-1-масляный альдегид (151). Раствор 420мг (2.2ммоля) ацеталя 150 в 4.0мл ТГФ и 3.0мл 4NНСl перемешивали при комнатной температуре 1.5ч и затем нейтрализовали медленным добавлением твердого NaHСО3. реакционную смесь экстрагировали етилацетатом, сушили над МgSO4 и концентрировала, получая 288мг альдегида 151. 1H ЯМР-cпектр согласуется со структурой. (R и S)-1фенил-7-(2-пиридил)-4гептанол. (152). Спирт 152 получали из 288г (1.93ммоля) альдегида 151 и 2,3мл (2.3ммоля) 120 в 3.0мл ТГФ, как описано выше для синтеза спирта 121 в примере 1. Получили 520мг неочищенного спирта 152. 1H ЯМР-cпектр согласуется со структурой. (S)-Вос-Пипеколил-(R и S)-1-фенил-7-(2-пиридил)-4-гептиловый эфир (153). Эфир 153 получали из 520мг (1.83ммоля) спирта 152, 442мг (1.93ммоля) (S)-Вос-L-пипеколиновой кислоты, 370мг (1.93ммоля) EDC и каталитического количества DМАР в 4.0мл хлористого метилена и 4.0мл ДМФ, как описано выше для синтеза 122 в примере 1. Флаш-хроматографией (элюирование смесью гексана и этилацетата, 3:1) выделили 740мг диастереомерного эфира 153 в виде масла. 1H ЯМР-cпектр согласуется со схруктурйй. (R и S)-1-Фенил-7-(2пиридил)-4-гептил-(S)-пипеколат (154). Амин 154 синтезировали обработкой 740мг (1.54ммоля) эфира 153 2.0мл трифторуксусной кислоты в 5.0мл хлористого метилена, как описано выше для получения 123 в примере 1. Получили 580мг диастереомерного амина 154 в виде масла. 1H ЯМР-cпектр согласуется со структурой. (R и S)-1-Фенил-7-(2-пиридил)-4-гепталол-(S)-N-метилоксалилпипеколат (155). В раствор 48мг (0.13ммоля) амина 154 в 1.0мл хлористого метилена, при 0°С добавляли 33мкл (0.19ммоля) N,Nдиизопропилэтиламина и 14мкл (0.15ммоля) хлористого метилоксалила и полученный раствор нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь разбавляла этилацетатом, промывали насыщенным раствором NН4Сl и соляным раствором, сушили над МgSO4 и затем концентрировали. Флаш-хроматографией (элюирование 25-30% этилацетата в гексане) выделили 49мг диастереомерного амида 155 в виде смеси ротамеров. 1H ЯМР-cпектр согласуется со структурой. (R и S)-1-Фенил-7-(2-пиридил)-4-гептанол-(S)-N-(трет-бутилглиоксил)пипеколат (21). В раствор амида 155 в 1.2мл ТГФ при -78°С дос5авляли по каплям трет-бутиллитий до полного расхода исходного соединения (определяли ТСХ). В реакционную смесь добавляли насыщенный раствор NН4Сl и экстрагировали этилацетатом. Объединенный органический экстракт промывали соляным раствором, сушили над МgSO4 а концентрировали. Флаш-хроматографией (элюирование 30% этил-ацетата в гексане) выделили диастереомерный амид 21 в виде смеси ротамеров. 1H ЯМР-cпектр (500МГц, СDСl3) d 8.50 (5), 7.57 (5), 7.207.05 (м), 5.23 (д), 5.18 (д), 4.56 (д), 4.44 (ш. д), 4.13 (д), 3.69 (ш. д), 3.37-3.28 (м), 3.13-3.00 (м), 2.85-2.70 (м), 2.65-2.54 (м), 2.38-2.15 (м), 1.82-1.65 (м), 1.56-1.44 (м), 1.55-1.30 (м), 1.27 (с), 1.21 (с). Пример 8 Синтез (R и S)-і-(3-фенилпропил)-4-пиридин-3-ил-бутилового эфира (S)-1-[3-Оксо-2-(3,4,5триметоксифенил)ацетил]пиперидин-2-карбоновой кислоты (9) (Е и Z)-3-(1,3-Диоксан-2-ил)-1-(3-пиридил)-1-пропен (156). В суспензию 9.9г (22.4ммоля) бромистого [2(1,3-даоксан-3-ил)этил]трифенилфосфония (Aldrich Chemical Со) в 50мл ТГФ при 0°С добавляла 14.0мл (22.4ммоля) бутиллития (1.6М в гексане) и полученный красный раствор перемешивали 0.5ч при 0°С. В этот раствор добавляли 1.8мл (18.7ммоля) 3-пиридинкарбоксальдегида (Aldrich Chemical Со.) и реакционную смесь перемешивали при комнатной температуре 1.5ч и затем выливали в воду и экстрагировали эфиром. Объединенный эфирный экстракт сушили над МgSO4 и концентрировали. Флаш-хроматографией (элюирование смесью гексана и этилацетата, 2:1) выделили 3.3г алкена 156 в виде смеси олефиновых изомеров. 1H ЯМР-cпектр согласуется со структурой. 1-(1.3-Диоксан-2-ил)-3-(3-пиридил)пропан (157). Через раствор 3.2г (16.7ммоля) олефина 156 и 300мг 10% палладия на угле барботировали равномерный поток водорода в течение 10мин. Реакционную смесь затем фильтровали через целит и концентрировали, получая 2.8г ацеталя 157 в виде бесцветного масла. 1H ЯМРcпектр согласуется со структурой. 4-(3-Пиридил)-1-масляный альдегид (158). Раствор 1.5г (7.8ммоля) ацеталя 157 в 10.0мл ТГФ и 10.0мл 4NНСl перемешивали в течение ночи при комнатной температуре и затем нейтрализовали медленным добавлением твердого NaHCO3. Реакционную смесь экстрагировали эитлацетатом, сушили над МgSO4 и концентрировали, получая 1.1г альдегида 158. 1H ЯМР-cпектр согласуется со структурой. (R и S) -1-Фенил-7-(3-пиридил)-4-гептанол (159). Спирт 159 получали из 1,1г (7.4ммоля) альдегида 158 и 8.1мл (8.1ммоля) соединения 120 в 30.0мл ТГО, как описано вше для синтеза 121 в примере 1. Получили 1.9г неочищенного спирта 159. 1H ЯМР-cпектр согласуется со структурой. (S)-Воc-пипеколил(R и S)-1-фенил-7-(3-пиридил)-4-гептиловнй эфир) (160). Эфер 160 получали из 1.65г (6.12ммоля) спирта 159, 1.54г (6.73ммоля) (S)-Вос-пипеколино-вой кислоты, 1.29г (6.73ммоля) EDС и каталитического количестве DMAР в 8.0мл хлористого метилена з 8.0мл ДМФ, как описано выше для синтеза 122 в примере 1. Флаш-хроматографией (элюирование смесью гексана и этилацетата, 2:1) выделили 1,42г диастереомерного эфира 160 в виде масла. 1H ЯМР-cпектр согласуется со структурой. (R и S)-1-фенил-7-(3-пиридил)-4-гептил-(S)-пипеколат (161). Амин 161 синтезировали обработкой 1,42г (2.95ммоля) эфира 160 2,0мл трифторуксусной кислоты в 8,0мл хлористого метилена, как описано выше для синтеза 123 в примере 1. Получали 1.02г диастереомерного амина 161 в виде масла, 1H ЯМР-cпектр согласуется со структурой. (R и S)-1-фенил-7-(3-пиридил)-4-гептил-(S)-N-(3,4,5-триметоксифенилглиоксил)пипеколат (9). Эфир 9 получал из 995мг (2.61ммоля) амина 161, 645мг (2.87ммоля) кислоты 124 а 551мг (2,87ммоля) EDC В 6,0мл хлористого метилена, как описано выше для синтеза эфира 3 в примере 1. Флащ-хроматографией (элюирование смесью ацетона и гексана, 3:1) выделили 976мг диастереомерного амида 9 в воде смеси ротамеров. 1H ЯМР-cпектр согласуется со структурой. Пример 9 Синтез N-оксида (R и S)-1-фенил-7-(3-пиридил)-4-гептил-(S)-N-(3,4,5-триметоксифениглиоксил)пипеколата (22) N-Оксид (R и S)-1-фенил-7-(3-пиридил)-4-гептид-(S)-N-(3.4.5-триметоксифенилглиоксил)пипеколата (22). В раствор 15мг (0.02ммоля) амида 9 в 2.0мл хлористого метилена при комнатной температуре добавляли 9.3мкл (0.03ммоля) 55% 3-хлорпероксибензойной кислоты и полученный раствор перемешивали в течение ночи при комнатной температуре. Флаш-хроматографией (элюирование 100%-ным ацетоном) выделили 12.6мг N-оксида 22 в виде смеси ротамеров. 1H ЯМР-cпектр (500МГцСDCl3) d 8.10 (м), 7.46-7.02 (м), 5.83 (д), 5.80 (д), 5.06-5.00 (м), 4.95-4.89 (м), 4.61 (м). 4.31 (дд), 3.87 (с), 3.84 (c), 3.83 (с), 3.81 (с), 3.78 (с), 3.50 (ш. д), 3.27 (ддд), 3.12 (ддд), 3.00 (ддд), 2.67-2.49 (м), 2.32 (ш. д), 1.86-1.78 (м), 1.55-1.50 (м), 1.39-1.22 (м). Пример 10 Синтез (R и S)-1-фенил-7-цуринил-4-гептил-(S)-N-(3,4,5-триметоксифенилглиоксил)пипеколата (25) 4-Хлорфенилмасляный альдегид (162). В раствор 19.1г (0.16ммоля) 4-хлор-1-бутанола (Aldrich Chemical Со.) в 50мл хлористого метилена при 0°С добавляли 1,0г порошкообразных молекулярных сит 4А и 38.7г (0.18ммоля) бихромата пиридиния и полученную суспензию перемешивали при 0°С 45мин. Реакционную смесь разбавляли эфиром, фильтровали через целит и концентрировали. Остаток перегоняли в вакууме (т.кип. 45-55°С), получая 5.0г альдегида 162 в виде масла. 1H ЯМР-cпектр согласуется со структурой. (R и S)-1-Хлор-7-фенил-4-гептанол (163). Спирт 163 получала из 182мг (1,7ммоля) альдегида 162 и 1.9мл (1.9ммоля) соединения 120 в 20.0мл ТГФ, как описано выше для синтеза 121 в примере 1. Получили 123мг спирта 163 (флаш-хроматографией в 100%-ном хлористом метилене). 1H ЯМР-cпектр согласуется со структурой. (S)-Вoc- пипеколил-(R и S)-1-хлор-7-фенил-4-гептиловый эфир (164). Эфир 164 получали из 128мг (0.56ммоля) спирта 163, 156мг (0.68ммоля) (S)-Вос-пипеколиновой кислоты, 1380мг (0.68ммоля) ЕDС и каталитического количества 4-пирролидинопиридина в 2.0мл хлористого метилена, как описано выше для синтеза 122 в примере 1. Флаш-хроматографией (элюирование смесью эфира, хлористого метилена и гексана, 1:5:14) выделили 159мг диастереомерного эфира 164. 1H ЯМР-cпектр согласуется со структурой. (S)-Вос-Пипеколил(R и S)-1-фенил-7-пуринил-4-гептиловий эфир (165). В раствор 34мг (0.28ммоля) пурина в 3.0мл ДМФ при комнатной температуре добавляли 8.4мг (0.28ммоля) твердого NаН (80% в мнеральной масле) и полученный раствор перемешивала при комнатной температуре 10мин. В эту реакционную смесь добавляли 62мг (0.14ммоля) эфира 164 и 10кг NaCl и перемешивали при комнатной температуре в течение ночи и затем концентрировала досуха. Остаток растворяли в этилацетате, промывали последовательно водой, насыщенным раствором NаHCO3 и соляный раствором и затем сушили над МgSO4 и концентрировали. Флаш-хроматографией (элюирование 15%-ным раствором смеси NH4OH MeОН и СН2Cl2 в соотношении 5:10:35 в СН2Cl2) выделили 56мг замещенного пурина 165 в виде масла. 1H ЯМР-cпектр согласуется со структурой. Гидрохлорид (R и S)-1-Фенил-7-пуринил-4-гептил-(S)-пипеколата (166). Безводный НСl. барботировали в раствор 53.7мг (0.10ммоля) эфира 165 в 10мл этилацетата при -20°С в течение 10мин и затем реакционную смесь продували N2. Концентрированием получили неочищенный амин 166 в виде гидрохлорида. 1H ЯМРcпектр согласуется со структурой. (R и S)-1-Фенил-7-пуринил-4-гептил-(S)-N-(3.4.5- триметоксифенилглиоксил)пипеколат (25). Bо взвесь неочищенного гидрохлорида амина 166 в СН3CN при комнатной температуре добавляли 45мкл (0,26ммоля) N,N-диизопропилэтиламина, 37мг (0.15ммоля) кислоты 124 и 54мг (0,12ммоля) реагента ВОР и полученную смесь перемешивали при комнатной температуре в течение двух дней а затем концентрировали досуха. Остаток растворяли в 75мл этилацетата и затем промывали последовательно водой, 5%-ным КНSO4, насыщеннм NaHСO3 и соляный раствором и затем сушили над МgSO4 и концентрировали, Флашхроматографией (элюирование смесью метанола, диэтилового эфира и хлористого метилена, 1:4:36) выделили 26.5мг диастереамерного амида 25 в виде ротамерной смеси. 1H ЯМР-cпектр (500МГц, СОСl3) d 9.11 (с), 8.95 (м), 8.09 (м), 7.36-7.05 (м), 5.31 (м), 4.28 (м), 3.90 (м), 3.46 (ш. т), 3.20 (м), 2.58 (м), 2.28 (ш. д), 2.17-1.18 (м), Rf 0.1 (30% эфира в хлористом метилене). Пример 11 Синтез (R и S)-4-[4-(морфолин-4-карбонил)фенил]-1-(3-фенилпропил)бутилового эфира (S)-1-[2-оксо-2(3,4,5-триметоксифенил)ацетил]пиперидин-2-карбоновой кислоты (44) Метиловый эфир 4-формилбензойной кислоты (167). В суспензию 9.6г (63,6ммоля) 4карбоксибензальдегида (Aldrich Chemical Со.) в 100мл хлористого метилена при 0°С добавляли избыток триметилсилилдиазометана и полученную смесь перемешиали при 0°С 1час. Смесь выливала в насыщенный водный раствор NaНСО3 и экстрагировали три раза этилацетатом. Объединенный органический экстракт сушили над МgSO4, фильтровали и концентрировали, получая 4.3г эфира 167 в виде масла. 1H ЯМР-cпектр согласуется со структурой. Метиловый эфир (Е и Z)-4-(3-(1.3-диоксолан-2-ил)пропенил)бензойной кислоты (168). Олефин получали из 4.3г (26.2ммоля) альдегида 167, 13.94г бромистого [1-(1,3-диоксан-2-ил)этил]трифенилфосфония и 12,6мл (32.0ммоля) н-бутиллития в 75мл ТГФ, как описано выше для синтеза 156 в примере 8. Флашхроматографией (элюрование 10% этилацетата в гексане) выделили 3.27г олефина 168. 1H ЯМР-cпектр согласуется со структурой. Метиловый эфир 4-[3-(1.3-диоксан-2-ил)пропил]бензойной кислоты (169). Олефин 169 (3,21г, 12.9ммоля) гидрировали над 328мг 10% Pd/C в 50мл этилового спирта, как описано для получения соединения 157 в примере 8. После фильтрования и выпаривания получила 2,85г соединения 169 в виде масла. 1H ЯМР-cпектр согласуется со структурой. [4-(3-(1.3-диоксанил-2)пропилфенил]метанол (170). В раствор 2.85г (11.4ммоля) эфира 169 в 25мл ТГФ при 0°С добавляли 4.4мл (24.7ммоля) гидрида диизобутилалюминия и полученную смесь перемешивали при 0°С 15мин. Реакцию прекращали насыщенным раствором смешанного тартрата калия и натрия и экстрагировали три раза этилацетатом. Объединенный органический слой сушили над МgSO4, фильтровали и концентрировали, получая 2,58г неочищенного спирта 170 в виде масла, 1H ЯМР-cпектр согласуется со структурой. 2-[3-(4-трет-Бутилдифенилсилилоксиметилфенил)пропил]-1.3-диоксолан (171). В раствор 2.58г (11.6ммоля) спирта 170 и 1.19г (17.5ммоля) имидазола в 50мл хлористого метилена добавляли 3,4мл (13.1ммоля) трет-бутилхлордифенилсилана и полученную смесь перемешивали 1 час при комнатной температуре. Смесь затем разбавляли этилацетатом и промывали 0.5N НСІ. Органический слой сушили над МgSO4, фильтровали и концентрировали, Флаш-хромтографией (элюирование 5% этилацетата в гексане) выделили 5.5г соединения 171. 1H ЯМР-cпектр согласуется со структурой. 4-(4-трет- Бутилдифенилсилилоксиметилфенил)масляный альдегид (172). В раствор 5.5г (11.9ммоля) диоксолана 171 в 40мл ТГФ при комнатной температуре добавляли 40 мол 4.0N HCl и полученный раствор перемешивали 1 час. Смесь затем нейтрализовали твердым К2СО3 экстрагировали этилацетатом и концентрировали. Неочищенную смесь растворяли в 25мл хлористого метилена, в который добавляли 600мг (8.8ммоля) имидазола и 1.9мл (7.3ммоля) трет-бутилхлордифенилсилана. Полученную смесь перемешивали при комнатной температуре в течение ночи и затем выливали в 0.5N НСІ и экстрагировали этилацетатом. Экстракт сушили над МgSO4, фильтровали и концентрировали. Флаш-хроматографией (элюирование 8% этилацетата в гексане) выделили 2.12г альдегида 172 в виде масла. 1H ЯМР-cпектр согласуется со структурой. 1-(4-трет-Бутилдифенилсилилоксиметилфенил)-7-фенилгептан-4-ол (173). Спирт 173 получали из 2.12г (5.0ммоля) соединения 172 и 9.0мл (9ммоля) соединения 120 в 50мл ТГФ, как описано выше для синтеза 121 в примере 1. Флаш-хроматографией (элюирование 10% этилацетата в гексане) выделили 3.3г спирта 173. 1H ЯМР-cпектр согласуется со структурой. (R и S)-2-[4-(4-трет-Бутилдифенилсилилоксиметилфенил)-1-(3-фенилпропил)бутиловый)]-1-третбутиловый эфир (S)-пи-перидин-1.2-дикарбоновой кислоты (174). Эфир 174 получали из 3.3г (6.15ммоля) спирта 173, 1.7г (7.4ммоля) (S)-Вос-пипеколиновой кислоты, 1.4г (7.3ммоля) EDC и каталитического количества DMAP в 35мл хлористого метилена, как описано выше для синтеза 122 в примере 1. Флашхроматографией (элюирование 10% этилацетата в гексане) выделили 2.4г эфира 174. 1H ЯМР-cпектр согласуется со структурой. 1-трет-Бтиловый-(R и S)-2-[4-(4-гидроксиметилфенил)-1-(3-фенилпропил) бутиловый]эфир (S)-пиперидин1.2-дикарбоновой кислоты (175). В раствор 750мг (1.0ммоля) зфира 174 в 10мл ТГФ добавляли 1.1мл (1.1ммоля) раствора фтористого тетрабутиламмония (1.0М в ТГФ) и полученную смесь перемешивали при комнатной температуре 15мин. Смесь разбавляли этилацетатом, промывали 5% КНSО4, сушили над МgSO4 и концентрировали. Флаш-хроматографией (элюирование 20% этилацетата в гексане) выделили 303мг спирта 175. 1H ЯМР-cпектр согласуется со структурой. 1-трет-Бутиловый-(R и S)-2-[4-(4-карбоксифенил)-1-(3-фенилпропил)бутиловнй]эфир (S)-пиперидин-1,2дикарбоновой кислоты (176). В раствор 326мг (0.64ммоля) спирта 175 и 3,0мл ацетона добавляли 0.5мл. (1.27ммоля) реагента Джонса к полученную смесь перемешивали при комнатной температуре 1 час и затем фильтровали через целит и концентрировали. Флаш-хроматографией (элюирование 2% МеОН в хлористом метилене) выделили 155мг кислоты 176. 1H ЯМР-cпектр согласуется со структурой. Трифторацетатная соль (R и S)-4-(4-карбоксифенил)-1-(3-фенилпропил)бутилового эфира, (S)пиперидин-2-карбоновой кислоты (117). В раствор 155мг (0,3ммоля) кислоты 176 в 3.0мл хлористого метилена добавляли 500мкл трифторуксусной кислоты а полученный раствор перемешивали при комнатной температуре 3 часа, в это время летучую часть удаляли в вакууме. Неочищенный остаток суспензировали в 5.0мл сухого бензола и летучую часть удаляли, получая безводную пробу кислоты 177. (R и S)-4-(4-карбоксифенил)-1-(3-фенилпропил) бутиловый эфир (S)-1-[2-оксо-2-(3,4,5триметоксифенил)ацетил]пиперидин-2-карбоновой кислоти (178). В суспензию 159мг (0.3ммоля) соли 177 в 2.5мл хлористого метилена при 0°С добавляли 110мкл (0.63ммоля) N,N-диизопропилэтиламина и затем 40мкл (0.31ммоля) хлортриметилсилана и полученную смесь перемешивали при 0°С в течение 30мин. В этот раствор добавляли 85мг (0.44ммоля) EDC и 106мг (0.44ммоля) кислоты 124 и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли етилацетатом и промывали 0.5N HCl, водой, соляным раствором, сушили над МgSO4 и концентрировали. Флаш-хроматографией (элюировали 30% МеОН в хлористом метилене) получили 97мг продукта 178 в виде смеси ротамеров. 1H ЯМР-cпектр согласуется со структурой. (R и S)-[4-(морфолин-4-карбонил)фенил]-1-(3-фенил-пропил)бутиловый эфир (S)-1-[2-оксо-2-(3.4.5триметоксифенил)ацетил]пиперидин-2-карбоновой кислоты (44). В раствор 11.2мг (17мкмоля) кислоты 178 в 1.0мл хлористого метилена добавляли 4,1мг (21.4мкмоля) EDC и 1.8мг (20,7мкмоля) морфолина и полученный раствор перемешивали при комнатной температуре в течение ночи. Флаш-хроматографией (элюирование 20% MеOH в хлористом метилене) выделили 7,6мг амида 44 в виде смеси ротамеров 1H ЯМРcпектр (500МГц CDCI3) d 7.32 (д), 7.30 (д), 7.26 (c), 7.21-7.03 (м), 5.33 (м), 5.01 (м), 4.92 (м), 3.92 (с), 3.89 (с), 3.88 (с), 3.87 (с), 3.86 (с), 3,85 (с), 3.81-3.53 (м), 3.42 (ш, д), 3.22-3.21 (м), 3.05 (м), 2.61 (м), 2.42 (дд), 2.31 (д), 2.12 (м), у1.83 (м), 1.73-1.42 (м), 2.42-1.20 (м). Пример 12. Данные ЯМР-спектров. Мы получили другие соединения формулы (I) способами, по существу аналогичными способам, описанным в указанных выше примерах 1-11 и иллюстрированных в схемах 1-3. Данные ЯМР-спектров этих соединений суммированы ниже. Соединения нумеровали соответственно нумерации соединений в таблице 1. В спектрах применяли следующие сокращения: с-синглет, d-дуплет, t-триплет, q-квартет, m-мультиплет, brширокий. Соединение 2: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров, т. е. поворотных изомеров). d 8.42-8.33 (m), 7.51(d), 7.42(d), 7.38(s), 7.31(d), 7.29-7.05(m), 5.01(s,br), 4.8(m), 4.71(m), 4.62(m), 3.92-3.83(m), 3.81(d), 3.60-3.51(m), 3.50-3.45(т), 2.65-2.51 (m), 2.50-2.39(m), 2.38-2.22(m), 2.05(m), 1.95 (m),. 1.81-1.68(m), 1.67-1.49(m), 1.48-1.31(m), 1.22(s). Соединение 5: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 7.39-6. 80 (m), 6.75(d), 5.47(m), 4.55(m), 4.45 (m), 3.953.78(m), 3.49-3.40(m), 3.22-3.11(m), 2.49-2.38(m), 1.88-1.67 (m), 1.61-1.42(m), 1.37-1.14(m). Соединение 6: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 7.36-7.19 (m), 7.18-7.02(m), 5.77(c), 5.65(m), 5.39(m), 4.604.52(m), 4.35(m), 3.93-3.82(m), 3.71-3.63(m), 3.48-3.42 (m), 3.41-3.34 (m), 3.28-3.19(m), 3.12-3.07 (m), 2 . 65-2.58 (m), 2.57-2.48(m), 2.42-2.31(m), 2.02-1.94 (m), 1.91-1.21 (m), 1.11-1.02(m). Соединение 10: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 7,35-6,98 (m) 5.35(d), 5.3-5.14 (m), 4.52(bd), 4.2-1 (bs), 3.973.87 (m), 3.49 (t) 3.12(q), 3.00-2.56(m), 2.46(t), 2.32(d), 2.18(d), 2.11(d), 1.93(d), 1. 83-1.56 (m), 1.55-1.38 (m), 1.321.18(m), 0.94-0.72(m). Соединение 12: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 7.37(s) 7.31-7.06(m), 6.98(d), 5.39(dd), 5.09-5.00(m), 4.994.93(m), 4.73(d), 4.38(m), 3.98-3.86(m), 3.91(s), 3.50(d), 3.34-3.24(m), 3.09(t), 2.73-2.16(m), 2.02-1.24(m). Соединение 131H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 7.38 (s), 7.29-7.21(m), 7.20-7.03(m), 6.99(d), 6.88(d), 6.826.73(m), 5.40-5.32(m), 5.04-4.98(m), 4.97-4.91(m), 4.61(d), 4.37(d), 3.93-3.83(m), 3.81-3.74(m), 3.53-3.47(d,br), 3.32-3.22(m), 3.11-3.04(m), 2.65-2.12(m), 1.97-1.21(m). Соединение 14: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 8.04(d), 7.97(t), 7.59-7.48(m), 7.47-7.41(m), 7.31-7.22(m), 7.217.02(m), 6.98-6.91(m), 6.82-6.76(m), 5.43-5.38(m), 5.12-5.03 (m), 4.93(m), 4.65-4.60 (m), 4.38(m), 3.79(m), 3.533.48(m), 3.23(q), 3.11-2.99(m), 2.68-2.29(m), 2.19(t), 1.98-1.31(m). Соединение 15: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.05-7.92 (m), 7.78(d), 7.47-7.03(m), 6.42(bs), 5.33(d), 5.01(m), 4.94(m), 4.59(bd), 4 .32-4.14 (m), 4.08-4.00 (m), 3.97-3.84(m), 3.77-3.68(m), 3.45(bd), 3.17-3.08(m), 2.97(t), 2.60(b), 2.48(t), 2.35-2.21(m), 2.11(d), 2.05-1.10 (m), 0.91-0.79(m). Соединение 17: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 7.38-6.92 (m), 6.82-6.71(m), 5.38-5.29(m), 5.06-4.85(m), 4.60(d), 4.31(d), 3.94-3.81(m), 3.79-3.70(m), 3.51-3.41(m), 3.23(t,br), 3.06(t), 2.62-2.22(m), 2.15(d), 1.82-1.29(m). Соединение 18: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь диастереомеров, смесь ротомеров). d 8.55-8.38 (m), 8.08-8.00(m), 7.98(d), 7.68(t), 7.59(t), 7.50-7.45 (m), 7.45-7.41(m), 7.29-7.25(m), 7.25-7.08 (m), 5.40(m), 5.11(m), 4.93 (m), 4.6l(brd), 4.38(m), 3.61(m), 3.51-3.46(m), 3.26-3.15(m), 3.08-2.96(m), 2,70-2.61 (m), 2.58-2.49(brd), 2.38(brd), 2.19(brd), 1.83-1.78(m), 1.78-1.59(m), 1.561.43(m), 1.41-1.24(m). Соединение 19: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.52-8.49(m), 8.04(d), 7.96(d), 7.64(t), 7.61-7.57(m), 7.52(t), 7.46-7.41(m), 7.26-7.22(m), 7.17(t), 7.12-77.08 (m), 5.41(d), 5.12(a), 4.93(m), 4.61(brd), 4.38(d), 3.89-3.83(m), 3. 673. 61 (m), 3.53-3.48(m), 3.28-3.19 (m), 3.06-3.00 (m), 2.83(brt), 2.72(brt), 2.65(brt), 2.52(brt), 2.48(brd), 2.21(brd), 1.89-1.73(m), 1.73-1.70(m), 1.70-1.48(m), 1.48-1.33(m). Соединение 20: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.50 (d), 7.61(dd), 7.28-7.25(m), 7.21-7.16(m), 7.12(dd), 5.38(brd), 5.09-5.02(m), 4.93-4.90(m), 4.62(brd), 4.34(m), 3.94(s), 3.92(s), 3.91(s), 3.90(s), 3.89(s), 3.49(brddd), 3.28(ddd), 3.09(dd), 2.83(t), 2.74(m), 2.63(brd), 2.49(dd), 2.36(brd), 2.19(brd), 1.86-1.70(m), 1.70-1.62(m), 1.591.52(m), 1.48-1.23(m). Соединение 23: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.30(d), 8.28(d), 7.79(d), 7.34(s), 7.31-7.00(m), 6.43(s), 5.33(d), 5.06(d), 4.94(m), 4.59(d), 4.42-4.10 (m), 4.04(s), 3.96(s), 3.94(s), 3.91(s), 3.81(s), 3.77(s), 3.48(d), 3.27(dt), 3.05(dt), 2.67-2.47(m), 2.32(d), 2.14(d), 2.03-1.22(m), 0.94-0.81(m). Соединение 26: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d7.32(d) 7.27-6.99(m), 5.34-5.28(m), 5.00(s,br), 4.61(d), 4.30(d), 3.92-3.81(m), 3.02(t), 2.54-2.48(m), 2.47-2.39(m), 2.34-2.22(m), 2.14(d), 1.82-1.14(m). Соединение 27: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь диастереомеров, смесь ротомсров). d 8.46-8.38(m), 7.68-7.50(m), 7.49-7.30(m), 7.29-7.08 (m), 5.48(m), 5.16-5.02(m), 4.98-4.90(m), 4.60(d), 4.32(d), 3.51-3.42(m), 3.26-3.12(m), 3.11-2.98(m), 2.65-2.42(m), 2.32(d,br), 2.14(d,br), 1.83-1.22 (m). Соединение 28: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.45-8.32 (m), 7.62-7.53(m), 7.52-7.43 (m), 7.42-7.05 (m) 6.095.98(m), 5.44-5.25(m), 5.09(s,br), 4.92(s,br), 4.64-4.51(m), 4.31(d), 3.50-3.41(m), 3.24-3.12(m), 3.07-2.94(m), 2.682.45(m), 2.32(d,br), 2.14(d,br), 1.83-1.26(m). Соединение 29: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь днастереомеров, смесь ротомеров). d 8.44-8.37 (m), 7.58-7.51(m), 7.50-7.08(m), 5.35(t,br), 5.10(s,br), 4.93(s,br), 4.68-4.54(m), 4.32(d), 3.51-3.42(m), 3.25-3.12(m), 3.00(q), 2.69-2.45(m), 2.38-2.29(m), 2.14(d,br), 1.821.20(m). Соединение 30: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.35(s), 7.29-7.20(m), 7.19-7.02(m), 6.89(m), 6.77(m), 5.34(d), 5.03 (m), 4.91(m), 4.61(d), 4.33(d), 3.95-3.88 (m), 3.48(d), 3.31-3.21(m), 3.05(t,br), 2.87-2.43(m), 2.32(d,br), 2.18(d,br), 1.87-1.21(m). Соединение 31: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.00 (s, br), 7.34(s,br), 7.31-7.02(m), 5.34(s,br), 5.31(6,br), 5.03(s,br), 4.92(d,br), 4.61(d,br), 4.33(s,br), 3.96-3.84(m), 3.48(d,br), 3.24(s,br), 2.76-2.42(m), 2.32(d,br), 2.15(m), 1.87-1.20 (m). Соединение 32: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 7.36(d), 7.30-7.08(m), 7.07-7.03(d), 5.35-5.31 (m), 4.98(m), 4.83 (m), 4.59(m), 4.31(m), 3.97-3.86(m), 3.46(d,br), 3.29-3.18(m), 3.04 (m), 2.65-2.42(m), 2.35-2.22(m), 1.63-1.14(m), 1.10 (m). Соединение 33: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.38(d), 7.32-7.24(m), 7.24(d), 7.21(d), 7.01(s), 7.00(s), 6.025.99(m), 5,92-5.88(m), 5.38(d), 5.36(d), 4.70(ABq), 4.69(ABq), 4.64(ABq), 4.32(brd), 3.91(s), 3.89(s), 3.88(s), 3.74(s), 3.73(s), 3.48(brddd), 3.36(brd), 3.20(ddd), 3.06-2.97(m), 2.62(t), 2.58(t), 2.38(brd), 2.21(brd), 2.08-2.04(m), 1.90-1.74 (m), 1.73-1.46(m), 1.38-1.33(m), 1.24(t). Соединение 34: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.33 (s), 7.30(d), 7.29(s), 7.28-7.20(m), 7.18-7.11(m), 6.956.90(m), 6.83(d), 6.82(d), 6.31-6.28(m), 6.02-5.91 (m), 5.43-5.40(m), 5.21(dd), 4.53(d), 3.91(s), 3.89(s), 3.86(s), 3.85(s), 3.84(s), 3.76(s), 3.71(s), 3.45(brddd), 3.40(brddd), 3.28(ddd), 3.15(ddd), 3.02(ddd), 2.62(dd), 2.40(brd), 1.941.89(m), 1.87-1.67(m), 1.65-1.50(m). Соединение 35: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.34-7.29(m), 7.28-7.11(m), 7.10-6.93(m), 5.35-5.28(m), 5.094.98(m), 4.90(m), 4.64-4.44(m), 4.30(m), 3.95-3.81(m), 3.46(t,br), 3.31-3.19(m), 3.03(m), 2.66-2.38(m), 2.34-2.25(m), 2.16(m), 1.85-1.19(m). Соединение 36: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.93-7.81 (m), 7.78(s), 7.41-7.01(m), 5.32(s,br), 5.02(s,br), 4.90(M), 4.58(d), 4.31(s,br), 3.95-3.80(m), 3.45(d), 3.22(t), 3.05(m), 2.72-2.48(m), 2.47(d), 1.83-1.43(m), 1.421.18(m). Соединение 37: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 7.38(s), 7.30(s), 7.30-7.02(m), 7.01(s), 5.80-5.83(m), 5.68(dd), 5.62(dd), 5.38(d), 5.36(d), 4.66(s), 4.65(ABq), 4.54(s), 4.32(brd), 4.28(brd), 3.90(s), 3.88(s), 3.86(s), 3.85(s), 3.84(s), 3.78(s), 3.76(s), 3.43(brddd), 3.39(brddd), 3.24(ddd), 3.12(ddd), 3.06(ddd), 2.97(ddd), 2.62(t), 2.57(t), 2.48(brd), 2.24(brd), 2.01-1.94(m), 1.89-1.73 (m), 1.72-1.65(m). 1.65-1.58(m), 1.52-1.49(m), 1.40-1.33(m), 1.12-1.08(m). Соединение 40: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 7.36 (s), 7.29-7.19(m), 7.18-7.06(m), 6.89(m), 6.75(s), 5.32(s,br), 4.94(t), 3.95-3.84(m), 3.46(d,br), 3.22(m), 2.82(t), 2.61(t), 2.30(m), 1.82-1.19(m). Соединение 41: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.37(d), 7.29-7.08(m), 7.04(d), 5.34(m), 4.97(m), 4.61(d), 4.33(m), 3.96-3.88(t), 3.86(d), 3.48(d), 3.25(m), 3.09(m), 2.65-2.52(m), 2.48 (m), 2.32(d), 2.18(d), 1.86-1.49 (m), 1.48-1.15(m). Соединение 42: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.34(d), 7.2(m), 7.13(m), 7.0-7.1(m), 5.87(m), 5.32 (m), 5.22(dd), 5.12(dd), 5.0(m), 4.89(bm), 4.57(bd), 4.30(bm), 3.80-3.95(m), 3.45(bd), 3.40(m), 3.32(m), 3.22(dt), 3.05(bm), 2.60(m), 2.52(bm), 2.44(m), 2.30(m), 2.15(bm), 1.75(m), 1.60(m), 1.54(m), 1.20-1.45(bm). Соединение 43: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.36-7.30(m), 7.29-7.20(m), 7.19-7.04(m), 5.34(m), 5.01(s,br), 4.91(m), 4.59(d), 4.31(s,br), 3.95-3.86 (m), 3.47(d,br), 3.25(t,br), 3.14-2.90(m), 2.68-2.52(m), 2.45(t), 2.32(d), 2.18(d), 1.85-1.46(m), 1.45-1.18 (m). Соединение 45: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь диастсреомеров, смесь рогомеров). d 7.35(d), 7.25(m), 7.15(m), 7.10(d), 7.05(d), 5.87(10), 5.38(bd), 5.34(m), 5.22(dd), 5.14(dd), 4.95(bm), 4.88(bm), 4.58(bd), 4.32(m), 3.82-3.95(m), 3.45(bd), 3.40(t), 3.25(m), 3.05(bm), 2.60(bm), 2.44(m), 2.34(bd), 2.18(bd), 1.78(m), 1.48-1.70(m), 1.20-1.45(m). Соединение 46: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.32(s), 7.25(m), 7.16(m), 7.10(t), 5.85(m), 5.50(dt), 5.38(dd), 5.25(dd), 5.18(d), 4.58(bm), 4.35(bm), 4.15(s), 4.06(d), 4.02(d), 3.85-3.95(m), 3.46(bd), 3.25(m), 3.08(bt), 2.98(bt). 2.65(t), 2.58(t), 2.53(t), 2.35(bt), 2.20(bd), 1.70-1.88(m), 1.50-1.70(m), 1.20-1.42(m). Соединение 47: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.44(d), 7.42-7.06(m), 5.45-5.30(m), 5.12-4.91(m), 4.03-3.83(m), 3.82-3.19(m), 2.72-2.26(m), 1.91-1.22(m) Соединение 48: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.34(d), 7.25(m). 7.20(d), 7.15(m), 7.10(d), 7.05(d), 5.88(m), 5.32(bt), 5.24(dd), 5.14(dd), 4.96(m), 4.86(m), 4.58(bd), 4.30(bm), 3.85-3.95(m), 3.45(bd), 3.38(t), 3.32(t), 3.25(m), 3.05(m), 2.60(m), 2.32(bd), 2.16(bd), 1.78(m), 1.48-1.72(m), 1.20-1.45(m). Соединение 49: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.28-7.42, 6.57-6.61(m), 6.45-6.5(m), 5.80-5.87 (dd), 5.705.77(dd), 5.37-5.41(brd), 5.34-5.37(brd), 4.94-5.07(dd), 4.53-4.60(brd), 4.35-4.38(m), 3.80-3.95(m), 3.74(s), 3.383.50(brdd), 3.22-3.31(ddd), 3.15-3.22(ddd), 2.96-3.08(m), 2.32-2.44(brdd), 1.73-1.85(m), 1.48-1.75(m), 1.54-1.56(d), 1.15-1.48(m). Соединение 50: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь диастереомеров, смесь ротомеров). d 7.34(d), 7.24 (m), 7.15(m), 7.10(d), 7.04(d), 5.85(m), 5.32 (m), 5.22(dd), 5.15(m), 5.00(m), 4.58(bd), 4.30(bs), 3.74-3.95(m), 3.44(m), 3.25(bt), 3.04 (bm), 2.62(m), 2.45(t), 2.30(bd), 2.18(bd), 1.88(m), 1.78(m), 1.46-1.72(m), 1.22-1.45(m). Соединение 51: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.34 (s), 7.25(m), 7.20(d), 7.14(m), 7.10(d), 7.06(d), 5.87(m), 5.78(dt), 5.68(m), 5.45-5.60(m), 5.35(d), 5.24(m), 5.15(d), 4.58(bd), 3.85-3.96(m), 3.45(m), 3.24 (m). 3.04(m), 2.62 (m), 2.56(t), 2.49(dt), 2.34(dt), 2.18(bm), 1.48-1.82 (m), 1.24-1.40(m). Соединение 52: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.40-7.03 (m), 5.38-5.28(m), 5.02(s,br), 4.90(m), 4.60(d), 4.32(s,br), 3.99-3.87(m), 3.86-3.31(m), 3.30-3.21(t.br), 3.11-3.02(q,br), 2.69-2.50(m), 2.47(m), 2.32(d), 2.14(d), 1.891.48(m), 1.47-1.21(m). Соединение 53: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.40 (d), 7.35(d), 7.30(d), 7.28(s), 6.60(d), 6.55(d), 6.52(t), 6.49(t), 5.86(q), 5.78(q), 5.42(d), 5.08(s), 4.64(bd), 4.35(m), 3.88-3.98(m), 3.46(bd), 3.21(dt), 3.05(dt), 2.36(bd), 2.18(bd), 1.80(m), 1.74(bd), 1.64(s), 1.56(d), 1.48-1.55(m), 1.40(d), 1.15-1.30(m). Соединение 54: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.52 (m), 7.82-7.71(m), 7.70-7.62(m), 7.55-7.42(m), 7.387.01(m), 5.36-5.29(m), 5.01(m), 4.90(m), 4.79-4.67(m), 4.59(d), 4.39-4.11(m), 3.96-3.73(m), 3.44(d), 3.22(t), 3.093.00(q,br), 2.72-2.41(m), 2.30(d), 2.14(d), 1.86-1.43(m), 1.42-1.02(m), 0.98-0.73(m). Соединение 55: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь диастереомеров, смесь ротомеров). d 7.36(d), 7.33(d), 7.29-7.02 (m), 5.32(m), 5.01(m), 4.90(m), 4.59(m), 4.30(m), 4.08-3.51(m), 3.46(d), 329-3.18(m), 3.11-2.98(q,br), 2.81-2.32(m), 2.30(d), 2.14(d), 1.84-1.19 (m). Соединение 56: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.39-7.30 (m), 7.27-7.20(brs), 7.20-7.15(brt), 7.14-7.06(brd), 5.81-5.78(brt), 5.77-5.72(brt), 5.34-5.30(brd), 5.28(s), 4.60-4.55(brd), 5.33(brs), 3.91(s), 3.88(s), 3.80(brs), 3.793.48(m), 3.47-3.30(brd), 3.28-3.20(brt), 3.01-2.94(brt), 2.66-2.60(t), 2.59-2.54(t), 2.42-2.35(brd), 2.25-2.19(brd), 2.041.93(m), 1.89-1.73(m), 1.72-1.65(m), 1.64-1.57(m), 1.54(brs), 1.39-1.25(m), 1.20(brs). Соединение 57: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.32(d), 7.31-7.01(m), 5.31(m), 5.00(m), 4.90(m), 4.59(m)f 4.30(m), 3.93-3.83(m), 3.82-3.63(m), 3 .49-3.38 (m), 3.22(t), 3.10-2.98(t), 2.68-2.21(m), 2.12 (m), 1.82-1.21 (m) . Соединение 58: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.33-7.01 (m), 5.31(m), 4.99(m), 4.89(m), 4.59(d), 4.29(m), 3.923.84(m), 3.83-3.64(m), 3.55-3.28(m), 3.22(t), 3.04(m), 2.63-2.22(m), 2.14(d), 1.81-1.21(m) . Соединение 59: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.71-7.52 (m), 7.42(m), 7.39-7.04(m), 6.72-6.59(m), 5.32(m), 5.22(m), 5.11(m), 5.01(m), 4.99-4.90(m), 4.69-4.52 (m), 4.39-. 4.26(m), 3.99-3.79(m), 3.46(t), 3.22(t), 3.11-2.94(m), 2.72-2.40(m), 2.29(t), 2.20-2.11(m), 1.88-1.19(m), 0.89(m). Соединение 60: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь дікісіереомеров. смесь [км омаров), d 8.53 (m) 7.801m), 7.72-7.53 (m), 7 .39-7.03 (m), 5.36 - 5.28(dd), 5.12-4.98(m), 4.92(m), 4 .79-4.52(m), 4.3l(m), 3.98-3.81(m), 3.45(m), 3.31-3.19(q,br), 3.11-3.00(m), 2.72-2.43(m), 2.31(d), 2.20-2.11(m), 1.88-1.22(m). Соединение 61: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь диастереомеров, смесь ротомеров). d 8.45(s,br), 7.60-7.49(m), 7.38-7.21(m), 5.38-5.31(m), 5.034.98(m), 3.99-3.88(m), 3.50(d,br), 3.29(q), 2.65(m), 2.38-2.31(m), 1.88-1.13(m), 0.92-0.74(m). Соединение 62: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.55-8.65 (m), 7.32-7.40(m), 6.80-7.00(m), 5.74-5.78(m), 5.625.71(m), 5.85-5.89(brd), 5.80-5.84(brd), 5.13-5.21(m), 5.03-5.10(m), 4.77-4.81(dd), 3.87-3.94(m), 3.80(s), 3.79 (s), 3.72(s), 3.38-3.46(brdd), 3.14-3.28 (m), 2.66-2.83 (m), 2.48-2.58(m), 2.28-2.48(m), 1.32-1.18(m). Соединение 63: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.62(d), 8.61-8.58(m), 7.64(dd), 7.59(dd), 7.32-7.24(m), 7.12(d), 6.92(dd), 6.89-6.83(m), 6.82(d), 6.79(d), 6.74(d), 5.48(d), 5.07(d), 4.60(m), 4.44(brdd), 3.91(s), 3.90(s), 3.86(s), 3.84(s), 3.83(s), 3.78(s), 3.44(brd), 3.18(ddd), 2.92(ddd), 2.40(brt), 2.32(brt), 1.89-1.70(m), 1.62-1.48(m). Соединение 64: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.59(d), 8.58(d), 7.32-7.04(m), 6.99-6.80 (m), 5.62(dd), 5.61(dd), 5.38(dd), 5.06(s), 5.02(d), 4.99(d), 4.53(m), 4.36(m), 3.91(s), 3.90(s), 3.89(s), 3.88(s), 3.84(s), 3.69(s), 3.61(s), 3.46(brd), 3.41(brd), 3.24(dd), 3.12(dd), 2.62(t), 2.58(t), 2.34(brt), 1.99-1.92(m), 1.86-1.42(m). Соединение 66: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.56-8.51(m), 7.35-7.28 (m 7.27-7.22 (m), 7.14(s), 7.07(S), 6.936.88(m), 6.87-6.80(m), 6.79-6.71(m), 6.65-6.62 (m), 5.81(q), 5.71(q), 5.32-5.27 (m), 5.20-4.98 (m), 4.57-4.47(m), 4.28-4.23 (m), 3.92-3.70 (m), 3.40(brd), 3.20(brd), 3.11(ddd), 3.00-2.89(m), 2.33(d), 2.26(d), 2.20(d), 2.07(d), 1.801.57(m), 1.56-1.25(m), 1.24-1.17(m), 1.13-1.00(m). Соединение 67: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.63-8.54 (m), 8.53-8.44(m), 7.38-7.11(m), 7.10-6.99 (m), 6.78 (d), 6.72(dd), 6.63(dd), 6.53(d), 6.44(d), 6.14(dd), 6.08(dd), 6.00(dd), 5.88(dd), 5.39(d), 5.31(d), 5.23-4.95(m), 4.614.50(m), 4.32-4.29(m), 3.91(s), 3.90(s), 3.88-3.74(m), 3.71(s), 3.64-3.58(m), 3.47-3.38 (m), 3.37-3.32(m), 3.24(ddd), 3.13(ddd), 3.07(ddd), 2.94(ddd), 2.62-2.45(m), 2.38-2.29(m), 2.20-2.11(m), 2.00-1.88(m), 1.87-1.40 (m), 1.39-1.08 (m). Соединение 68: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.61(d), 7.38 (d), 7.31(s), 7.28-7.22(m), 7.14(dd), 7.10(d), 7.04(d), 6.83(d), 5.23(dd), 5.14(dd), 5.36(d), 5.11(brs), 4.58(m), 4.31(m), 3.91(s), 3.90(s), 3.89(s), 3.88(s), 3.823.79(m), 3.78-3.64(m), 3.51-3.44(m), 3.40(brd), 3.26-3.10 (m), 2.63(dd), 2.32(brd), 2.00-1.92 (m), 1.88-1.40(m), 1.081.00(m). Соединение 69: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.60-8.57 (m), 8.56-8.53(m), 7.38-7.35(m), 7.32-7.17 (m), 6.53(s), 6.52(s), 5.83(q), 5.76(q), 5.38-5.32(m), 5.17-5.05 (m), 4.67-4.60(m), 4.30-4.28(m), 4.13-4.08(m), 3.963.82(m), 3.80(s), 3.45(brd), 3.28(ddd), 2.97(ddd), 2.77-2.72(m), 2.53-2.43(m), 2.36-2.22(m), 2.15-1.92(m), 1.860.79(m). Соединение 70: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.59-8.43 (m), 7.38-6.98(m), 6.65(s), 6.57(s), 6.53(m), 6.43(m), 5.88-5.84(m), 5.68-5.64(m), 5.63-5.59(m), 5.58-5.54(m), 5.35-5.28(14), 5.15-5.00(m), 4.99(d), 4.92(d), 4.58(d), 4.51(d), 4.33(d), 4.26(d), 3.89(s), 3.87(s), 3.83(s), 3.79(s), 3.72(s), 3.65(s), 3.45-3.37(m), 3.21(ddd), 3.10(ddd), 2.952.83(m), 2.62-2.42(m), 2.28(d), 2.21(d), 1.92-1.26(m), 1.17-1.12(m), 1.11-1.01(m). Соединение 71: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.64(d), 7.35(d), 7.28(s), 6.60(d), 6.55(d), 6.52(t), 6.49(t), 5.86(q), 5.78(q), 5.42(d), 5.08(s), 4.64(bd), 4.35(m), 3.88-3.98(m), 3.46(bd), 3.21(dt), 3.05(dt), 2.36(bd), 2.18(bd), 1.80(m), 1.74(bd), 1.64(s), 1.56(d), 1.48-1.55(m), 1.40(d), 1.15-1.30(m). Соединение 72: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.62(d), 7.35(d), 7.28(s), 6.60(d), 6.50(d), 6.45(t), 6.42(t), 5.85(q), 5.73(q), 5.40(d), 5.10(d), 5.04(d), 4.58(bd), 4.38(m), 3.92(s), 3.88(s), 3.82(s), 3.72(s), 3.50(bd), 3.30(dt), 3.0l(dt), 2.40(bd), 2.30(bd), 1.85(m), 1.64(bs), 1.56(d), 1.48(d), 1.35-1.45(m). Соединение 73: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.55-8.65(brd), 7.32-7.42(brdd), 7.28(s), 7.20(s), 6.50-6.55(m), 5.72-5.87(m), 5.32-5.39(m), 5.05-5.17(m), 4.58-4.64(brd), 4.53-4.58(brd), 4.34-4.36(brd), 4.25-4.29(brd), 3.713.96(ms), 3.40-3.48(m), 3.23-3.30(ddd), 3.13-3.22(ddd), 2.17-2.37(m), 1.10-1.86 (m), 1.48-1.52(d). Соединение 74: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.62-8.58(d), 8.57-8.51(d), 7.38-7.35(d), 7.33-7.28(m), 7.27(s), 7.18(s), 6.61(s), 6.59(s), 5.65-5.60(t), 5.55-5.50 (t), 5.40-5.36(d), 5.18-5.05(m), 4.67-4.63(brd), 4.33-4.30(d), 3.96(6), 3.93(s), 3.92(s), 3.87(s), 3.50-3.43(brd), 3.25-3.16(dt), 3.05-2.97(dt), 2.32-2.28(brd), 2.14-2.08(brd), 1.95-1.85(m), 1.84-1.64(m), 1.63-1.56(brd), 1.55-1.42(m), 1.35-1.23(m), 1.22-1.12(m), 0.92-0.83(t), 0.73-0.68(t). Соединение 75: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 8.62-8.58 (m) 8.57-8.53(d), 7.41-7.39(d), 7.38-7.35 (d), 7.27(s), 7.23(s), 7.13(s), 6.61(s), 6.51(s), 5.60-5.55 (t), 5.54-5.50(t), 5.39-5.35(d), 5.15(s), 5.14-5.10 (m), 5.09(s), 5.07(s), 5.01(s), 5.00(s), 4.60-4.55(brd), 4.51-4.49(t), 4.40-4.38(brd). 3.90(s), 3.85(s), 3.80(s), 3.73(s), 3.48-3.43(brd), 3.303.22(dt), 2.95-2.88(dt), 2.38-2.32(brd), 2.27-2.22(brd), 1.90-1.70(m), 1.69-1.62(brd), 1.59-1.50(m), 1.46-1.35(m), 1.26(s), 0.90-0.85(t), 0.82-0.78(t). Соединение 76: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь диастереомеров, смесь ротомеров). d 8.95 (s), 8.80(d), 8.55(m), 8.50(m), 7.34(s), 7.30(s), 7.28(s), і 6.76(s), 6.73(s), 5.8b(q), 5.77(q), 5.40(m), 5.20-5.35(m), 4.60(m), 4.35(m), 3.85-3.98 (m), 3.80(s), 3.48(bt), 3.183.30(m), 3.00(m). 2.40(bd), 2.32(bd), 2.26(bd), 1.65-1.90(m), 1.60(s), 1.55(dd), 1.48(d), 1.40(m), 1.12(m). Соединение 77: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.43-8.53 (m), 7.20-7.56(m), 7.04(s), 7.01(s), 6.75-6.92(m), 6.62(brs), 5.78-5.85(m), 5.68-5.77(m), 5.80-5.84(brd), 5.02-5.12(m), 3.76-4.00(m), 3.64-3.76(m), 3.49-3.60 (m), 3.383.49(m), 3.32-3.34(d), 3.21-3.27(m), 3.02-3.18(m) 2.73-2.82 (m), 2.37-2.53(m), 2.24-2.32(m), 2.20(s), 2.15(s), 1.271.72(m), 1.07-1.22(m), 0.92-0.97(dd), 0.82-0.86(dd). Соединение 78: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.65-8.56 (d), 8.55-8.51(d), 7.40-7.35(d), 7.34-7.20(m), 7.16(s), 6.70-6.60(m). 6.21-6.18(d), 6.15-6.11(d), 5.97-5.88(m), 5.83-5.75(m). 5.45-5.40(d), 5.32(s), 5.28 (s), 5.27(s), 5.215.18(m), 5.13(s), 5.11(s), 4.67-4.61(brd), 4.51-4.49(d), 4.35-4.33 (d), 4.05-4.00 (m), 3.95(s), 3.94(s), 3.90(s), 3.843.82(d), 3.81(s), 3.66-3.60(q), 2.50-3.45(brd), 3.40(s), 3.30(s), 3.23-3.17(dt), 3.03-2.97(brt), 3.86-3.80(brt), 2.602.55(brt), 2.50-2.40(d), 2.30-2.25(brd), 2.20(s), 2.15-2.10(brd), 1.90-1.65(d), 1.64-1.60(brd), 1.56-1.43(m), 1.361.27(m), 1.26-1.11(m). Соединение 79: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.65-8.59 (d), 8.58-8.52(d), 7.40-7.35(d), 7.32-7.28(d), 7.257.24(d), 7.13(s), 6.65(s), 6.60(s), 6.20-6.18(d), 6.12-6.10(d), 5.97-5.90(m), 5.89-5.75(m), 5.43-5.38(d), 5.З 3-5.20(m), 5.16(s), 5.15(s), 5.10(s), 4.60-4.58(brd), 4.51-4.49(d), 4.40-4.38(d), 4.05-4.00(m), 3.93-3.85(m), 3.83(s), 3.82(s), 3.79(s), 3.65-3.60(q), 3.50-3.45(brd), 3.39(s), 3.30-3.18(m), 2.95-2.80(m), 2.61-2.55(m), 2.39-2.32(brd), 2.20(s), 1.901.75(m), 1.74-1.66(m), 1.65-1.60(m), 1.59-1.48(m), 1.47-1.31(m), 1.27-1.22(m), 1. 20-1.18(d). Соединение 80: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.62-8.58 (d), 8.56-8.52(d), 7.40-7.35(d), 7.30(brs), 7.26(s), 7.18(s), 6.62(s), 6.60(s), 5.72-5.68(t), 5.62-5.58(t), 5.40-5.36(d), 5.30(s), 5.18(s), 5.17-5.13(d), 5.10(s), 4.664.61(brd), 4.60-4.58(m), 4.31-4.29(brd), 3.96(s), 3.95(s), 3.92(s), 3.87(s), 3.49-3.43(brd), 3.24-3.16(dt), 3.04-2.96(brt), 2.32-2.28(brd), 2.17(s), 2.13-2.06(m), 2.91-2.85(m), 2.81-1.64(m), 1.63-1.55(m), 1.54-1.40(m), 1.36-1.00(m), 0.930.87(t), 0.83-0.77(t). Соединение 81: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.62-8. 58 (d), 8.56-8.52(d), 7.41-7.39(d), 7.38-7.35(d), 7.337.28(d), 7.27(s), 7.23(s), 7.11(s), 6.60(s), 6.50(s), 5.65-5.61(t), 5.60-5.97(t), 5.38-5.35(d), 5.30(s), 5.15(s), 5.13 5.10(d), 5.08(s), 5.06(s), 5.01(8), 4.59-4.54(brd), 4.40-4.38(brd), 3.91(s), 3.85(s), 3.80(s), 3.74(s), 3.48-3.42(brd), 3.30-3.23(dt), 2.95-2.90(brt), 2.38-2.32(brd), 2.18(s), 1.90-1.75(m), 1.74-1.46(m), L Соединение 82: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь днастереомеров, смесь ротомеров). d 7.26-7.35(m), 7.26(s), 7.24(m), 7.14(d), 7.10(d), 6.65(s). 6.57(s), 5.85(q), 5.78(q), 5.40(d), 5.13(s), 5.07(q), 5.04(s), 4.60(bd), 4.38(d), 3.92(s), 3.88(s), 3.80(s). 3.48(bd), 3.26(dt), 2.95(dt), 2.40(bd), 2.25(bd), 1.82(m), 1.64(bd), 1.56(s), 1.54(d), 1.46(d), 1.38(m). Соединение 83: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.36 (s), 7.34 (m), 7.27(m), 7.22(d), 7.13(dd), 7.08(dd), 6.65(s), 5.85(q), 5.75(q), 5.40(d), 5.10(d), 5.04(s), 4.63(bd), 4.34(d), 3.95(s), 3.92(s), 3.88(s), 3.46(bd), 3.22(dt), 3.04(dt), 2.33(bd), 2.15(bd), 1.80(m), 1.70(dt), 1.55(d), 1.46-1.58(m), 1.36(d), 1.14(m). Соединение 84: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.53(d), 8.52(d), 7.42(d), 7.31(3), 7.27(d), 7.17(s), 6.52(ABg), 5.81(q), 5.74(q), 5.10(d), 5.04(s), 5.03(s), 4.58-4.50(m), 4.31(m), 3.91(s), 3.88(s), 3.87(s), 3.85(s), 3.41 (brd), 3.18(ddd), 3.00(ddd), 2.29(brd), 2.12(brd), 1.78-1.72(m), 1.68(brd), 1.52(d), 1.36(d), 1.32(d), 1.31(d), 1.11(m). Соединение 85: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.51(d), 7.42(d), 7.31(9), 7.28(d), 7.25(3), 7.13(s), 6.58(s), 5.80(q), 5.76(q), 5.33(d), 5.10(s), 5.02(s), 4.56-4.50(m), 4.31(brd), 3.90(s), 3.88(s), 3.81(s), 3.79(s), 3.46(brd), 3.24(ddd), 2.90(ddd), 2.33(brd), 2.21(brd), 1.85-1.74(m), 1.62(m), 1.51(d), 1.47(d), 1.31(d), 1.29(d). Соединение 86: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.61-8.45 (m), 7.38-7.28(m), 6.68(s), 6.49(s), 5.79(q), 5.61(q), 5.19-5.01(m), 4.72-4.63 (m), 3.89-3.67(m), 3.65-3.45(m), 2.85(t), 2.58(t), 2.39-2.23(m), 2.11-1.92 (m), 1.72-1.45(m), 1.39-1.16(m), 0.89(m). Соединение 87: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.60-8.46 (m), 7.38-7.15(m), 6.74-6.63 (m), 6.62(s), 6.526.47(m), 5.75(q), 5.61(m), 5.32-5.25(m), 5.15-5.01(m), 4.72-4.59(m), 3.93-3.80(m), 3.75(m), 3 . 62-3 . 43 (m), 2.391.55(m), 1.50(dd), 1.36-1.21(m). Соединение 88: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 9.16(d), 8.74(d), 8.70(d) 7.85(d), 7.50(t), 7.27(d), 6.68(s), 5.80(m), 5.70(m), 5.38(bd), 5.31(bd), 5.24(s), 5.20(d), 4.60(m), 4.34(dd), 3.88-3.95(m), 3.84(s), 3.75(s), 3.45(bd), 3.24(dt), 3.19(dt), 2.98(bt), 2.34(bd), 2.30(bd), 2.22(bd), 1.10-1.90(m), 1.52(d), 1.45(d). Соединение 89: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.36-7.22 (m), 5.43(d), 5.3 6(quintet), 5.25(quintet), 4.604.35(m), 3.95(s), 3.91(s), 3.88(s), 3.03(d), 3.67(d), 3.47-3.40(brd), 3.24(dt), 3.07(dt), 2.38(brd), 2.22(brd), 1.851.60(m), 1.58-1.25(m). Соединение 91: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 9.01-8.93 (m), 8.78(m), 8.06(m), 7.75(s), 7.68(t), 7.61(m), 7.57(d), 7.51-7.41(m), 7.28-7.19(m), 7.15(t), 7.12-7.05(m), 7.03(s), 5.82(q), 5.73(t), 5.33(d), 4.55(d), 4.33(d), 3.933.78(m), 3.73(s), 3.43(d,br), 3.21(dt), 3.01(t), 2.63(t), 2.58(t), 2.39(d,br), 2.22(d), 2.09-1.94(m), 1.92-1.43(m), 1.411.14(m). Соединение 92: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.94(d), 8.81 (m), 8.08(m), 7.75(s), 7.69(t), 7.55(d), 7.48(t), 7.42(m), 7.31(s), 7.29-7.07(m), 7.02(d), 5.81(t), 5.71(t), 3.11 (dt), 2.96(t), 2.61(t), 2.50 (m), 2.22-1.91(m), 1.901.35(m), 1.20(s), 1.02(m), 0.83(t). Соединение 93: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесьдиастереомеров, смесь ротомеров). d 8.62-8.55(m), 7.66-7.58(m), 7.57-7.56(m), 7.52-7.46(m), 7.407.30(m), 7.29-7.20(m), 7.19-7.04(m), 6.96-6.79(m), 6.77-6.69(m), 5.85-5.77(m), 5.70-5.62(m), 5.43-5.38(m), 5.104.98(m), 4.64-4.52(m), 4.39-4.35(m), 4.08-4.06(m), 4.02-3.99(m), 3.98-3.90(m), 3.89-3.84(m), 3.83-3.68(m), 3.483.40(m), 3.18(ddd), 3.14(ddd), 2.96(ddd), 2.92(ddd), 2.68-2.58(m), 2.57-2.51(m), 2.37(dd), 2.24-2.11(m), 2.051.94(m), 1.89-1.41(m), 1.40-1.23(m), 1.22-1.10(m). Соединение 94: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.61-8.55(m), 7.47-7.40(m), 7.38-7.02(m), 6.92-6.88(m), 6.876.82(m), 6.81-6.71(m), 6.68-6.64(m), 5.77-5.72(m), 5.65-5.59(m), 5.40-5.36(m), 5.11-5.04(m), 5.02(s), 4.97(s), 4.584.52(m), 4.36-4.33(m), 3.87(s), 3.83(s), 3.77(s), 3.70(s), 3.57-3.52(m), 3.48-3.36(m), 3.24(ddd), 3.12(ddd), 2.99(ddd), 2.81(ddd), 2.66-2.53(m), 2.41-2.31(m), 2.28-2.22(m), 2.02-1.92(m), 1.88-1.45(m), 1.44-1.21(m). Соединение 95: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.91-8.75 (m), 7.38-7.29(m), 7.28-7.02(m), 6.92-6.80(m), 6.796.76(m), 6.74-6.71(m), 6.69-6.64(m), 6.09-5.98(m), 5.78-5.70(m), 5.65-5.60(m), 5.40-5.34(m), 5.32-5.26(m), 5.195.13(m), 5.09-5.00(m), 4.63-4.52(m), 4.36-4.32 (m), 3.95-3.63 (m), 3.46(brd), 3.41(brd), 3.24(ddd), 3.12(ddd), 3.022.92(m), 2.67-2.45(m), 2.41-2.30(m), 2.27-2.21(m), 2.20-2.12(m), 2.01-1.90(m), 1.09-1.04(m). Соединение 96: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.59-8.54 (m), 7.67-7.57(m), 7.55-7.49(m), 7.47-7.38(m), 7.377.05(m), 6.95-6.71(m), 5.83(t), 5.78(t), 5.68(t), 5.65(t), 5.42-5.37(m), 5.28(s), 5.23-4.95 (m), 4.62-4.52 (m), 4.364.32(m), 3.93(s), 3.92(s), 3.88(s), 3.87(s), 3.47-3.38(d), 3.18-3.07(m), 2. 98-2.87 (m), 2.67-2.58 (m), 2.57-2.50(m), 2.41-2.30(m), 2.22-2.17 (m), 2.16-2.11 (m), 2.03-1.92(m), 1.89-1.21(m), 1.20-1.09(m). Соединение 97: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.62-8.52(m), 7.64-7.54(m), 7.52-7.46(m), 7.42-7.04(m), б.976.78(m), 6.77-6.70(m), 6.12-5.97(m), 5.85-5.76(m), 5.69-5.61(m), 5.46-5.35(m), 5.33-5.24(m), 5.10-5.01(m), 4.704.52(m), 4.39-4.33(m), 3.92(s), 3.91(s), 3.88(s), 3.87(s), 3.48-3.41(m), 3.18-3.10 (m), 2.97-.2.90(m), 2.67-2.57(m), 2.56-2.50 (m), 2.42-2.31(m), 2.23-2.10 (m), 2.04-1.93 (m), 1.89-1.10(m). Соединение 98: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.59-8.53(m), 7.67-7.44 (m), 7.39-7.03(m), 6.94-6.78 (m), 6.776.66 (m), 6.46-6.33(m), 6.03-5.93(m), 5.83(t), 5.78(t), 5.68(t), 5.64(t), 5.42-5.37(m), 5.08-4.97(m), 4.92-4.66(m), 4.644.52(m), 4.40-4.33(m), 3.94(s), 3.92(s), 3.90(s), 3.88(s), 3.87-3.84(m), 3.48-3.40(m), 3.20-3.08(m), 2.98-2.88(m), 2.64-2.57 (m), 2.56-2.50 (m), 2.41-2.31 (m), 2.23-2.17(m), 2.16-2.10(m), 2.03-1.92(m), 1.88-1.08(m). Соединение 99: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.67-8.58 (m), 8.54-8.48(m), 7.49-7.03(m), 6.95-6.87(m), 6.866.82(m), 6.72-6.68(m), 5.78-5.68(m), 5.63-5.57 (m), 5.40-5.31 (m), 5.14-4.93(m), 4.59-4.51(m), 4.35-4.30(m), 3.903.78(m), 3.73(s), 3.71(s), 3.45(brd), 3.38(brd), 3.22(ddd), 3.11(ddd), 2.99-2.91(m), 2.67-2.48 (m), 2.42-2.39 (m), 2.262.18 (m), 2.17-2.11(m), 2.05-1.92 (m), 1.89-1.18 (m), 1.09-0.98(d). Соединение 100: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.63-8.56(m), 7.68-7.59(m), 7.57-7.40(m), 7.39-7.20(m), 7.197.04(m), 7.03-6.98(m), 6.97-6.81(m), 6.78-6.71(m), 5.5.80(s), 5.77(s), 5.67(t), 5.62(t), 5.40-5.34(m), 5.27-4.94 (rn), 4.62-4.52(m), 4.38-4.32(m), 3.94(s), 3.S2(s). 3.91(s). 3.88(s), 3.87(s), 3.82(s), 3.81(S), 3.47-3.37(m), 3.18-3.05(m), 3.00-2.90(m), 2.68-2.50(m), 2.43-2.29(m), 2.22-2.09(m), 2.07-1.95(m), 1.90-1.63(m), 1.62-1.20(m), 1.14-1.02 (m). Соединение 101: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь диастереомеров, смесь ротомеров). d 8.64-8.58 (m), 7.43-7.30(m), 7.29-7.19(m), 7.18-7.02(m), 6.986.94(m), 6.93-6.87(m), 6.86-6.83(m), 6.77-6.73(m), 5.73(t), 5.71(t), 5.62(t), 5.60(t); 5-41-5.32(m), 5.10-5.05(m), 4.584.52 (m), 4.35-4.30(m), 3.94(s), 3.93(s), 3.91(s), 3.89(s), 3.88(s), 3.84(s), 3.83(s), 3.78(s), 3.76(s), 3.45(brd), 3.38(brd), 3.22(ddd), 3.10(ddd), 3.06-2.92(m), 2.67-2.53 (m), 2.52-2.48(m), 2.42-2.29(m), 2.28-2.11(m), 2.04-1.94 (m), 1.88-1.20(m), 1.08-0.98(m). Соединение 102: 1H ЯМР-cпектр (500Мгц, СDСl3) (смесь диастереомеров, смесь ротомеров). d 8.63 - 8.57 (m), 7.66-7.60(m), 7.58-7.54 (m), 7.53-7.47(m), 7.417.31(m), 7.27-7.20(m), 7.19-7.03(m), 6.92-6.70(m), 5.80(t), 5.77(t), 5.67(t), 5.61(t), 5.40-5.36(m), 5.09-5.02(m), 4.704.52(m), 4.37-4.33(m), 3.92(s), 3.91(s), 3.89(s), 3.88(s), 3.87(s), 3.86(s), 3.85(s), 3.82-3.77(m), 3.48-3.40(m), 3.183.09(m), 2.98-2.88(m), 2.66-2.42(m), 2.40-2.10(m), 2.04-1.94(m), 1.89-1.62(m), 1.61-1.18(m), 1.14-1.13(m). Соединение 103: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.76-7.59(m), 7.50-7.40(m), 7.38-7.18(m), 7.17-7.05 (m), 6.936.87 (m), 6.77-6.73(m), 6.18-6.15(m), 5.85(t), 5.79(t), 5.20(t), 5.16(t), 5.41-5.38(m), 5.21-5.08(m), 4.60-4.52(m), 4.374.32(m), 3.92(s), 3.91(s), 3.88(s), 3.87(s), 3.47-3.37(m), 3.17-3.03(m), 2.97-2.91(m), 2.64-2.58(m), 2.57-2.50(m), 2.42-2.33(m), 2.05-1.95(m), 1.90-1.80(m), 1.79-1.62(m), 1.61-1.31(m), 1.13-1.08(m). Соединение 104: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь диасгереомеров, смесь ротомерои). d 7.47-7.41 (m), 7.37-7.02(m), 5.78-5.72(m), 5.18(t), 5.12(t), 5.405.37(m), 5.10(s), 5.08(s), 5.07(s), 5.05(s), 4.59-4.51(m), 4.37-4.31(m), 3.87(s), 3.85(s), 3.77(s), 3.73(s), 3.45(brd), 3.37(brd), 3.24(ddd), 3.10(ddd), 3.02-2.94(m), 2.65-2.59 (m), 2.58-2.53(m), 2.52-2.46(m), 2.43-2.35(m), 2.27-2.22 (m), 2.21-2.15(m), 2.05-1.94(m), 1.89-1.30(m), 1.10-1.01(m). Соединение 105: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесьротомеров). d 8.39(d), 7.64(q), 7.52(q), 7.43(m), 7.29-7.03(m), 5.02-4.88(m), 4.60(q), 4.46(q), 3.62(m), 3.52-3.38 (m), 2.68-2.49 (m), 2.31-2.13(m), 2.09-1.75(m), 1.74-1.44(m), 1.29-1.16 (m). Соединение 106: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.43-8.34 (m), 7.46(ddt), 7.39(ddt), 7.32(s), 7.19-7.15(m), 5.32(br d), 5.28(s), 5.04-4.98(m), 4.92-4.88(m), 4.85(brd), 3.92(s), 3.90(s), 3.88(s), 3.87(s), 3.45(brd), 3.23(dt), 3.05(dt), 2.64-2.02(m), 2.29(brd), 2.13(br d), 1.82-1.48(m). Соединение 107: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 7.34-7.23 (m), 5.31(quintet), 5.12(quintet), 4.74(dd), 4.69(dd), 4.52(dq), 4.41(dq), 3.93(s), 3.90(s), 3.82(s), 3.70(m), 3.56-3.43(m), 2.34-1.88(m). Соединение 108: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.50-8.31 (m), 7.62(d), 7.57(d), 7.46(d), 7.44-7.31(m), 7.30(s), 7.19(q), 7.10(q), 5.00(m), 4.80(m), 4.69(m), 4.56(m), 3.97-3.71(m), 3.61-3.43(m), 2.68-2.41(m), 2.34-2.12(m), 2.081.84(m), 1.83-1.72(m), 1.71-1.42(m), 1.29-1.13(m). Соединение 109: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.48-8.32 (m), 7.53(dd), 7.47(m), 7.25-7.14(m), 5.02-4.89(m), 4.79 (m), 4.49(m), 3.73-3.55(m), 3.48 (quintet), 3.30 (quintet), 2.69-2.44(m), 2.32-1.41(m), 1.32-1.04(m), 1.01(m). Соединение 110: 1H ЯМР-cпектр (500Мгц, СDСl3). (смесь диастерсомеров, смесь роюмеров). d 8.63-8.51 (m), 8.50-0.31(m), 8.06(m), 7.93-7.85(m), 7.847.76(m), 7.69(d), 7.51-7.40(m), 7.23-7.11(m), 7.09(t), 5.32(d), 5.20(m), 5.08(m), 4.95(m), 4.61-4.52(m), 3.80(m), 3.61(m), 3.39(t), 3.21(dt), 2.94(dt), 2.74-2.44(m), 2.40(d), 2.31(m), 2.22-2.14(m), 2.13-1.91(m), 1.90-1.13(m). Соединение 111: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.46-8.36(m), 7.61(dd), 7.52(dd), 7.50-7.40(m), 7.22-7.15 (m), 6.87(dd), 6.83(dd), 6.07(s), 6.04(dd), 5.35(d), 5.10-5.06(m), 4.98-4.92(m), 4.6(brd), 4.34(d), 3.4(brd), 3.15(dt), 2.98(dt), 2.68-2.50(m), 2.24(brd), 1.8-1.46(m), 1.37-1.24(m). Соединение 112: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.7(d), 8.6(d), 7.7.-7.6(dd), 7.45(s), 7.3-7.2(m), 6.9(d), 6.1(d), 5.3(d), 4.6(d), 4.4(d), 3.45(dd), 3.4-3.3(m), 3.1-2.9(m), 2.85-2.8(m), 2.4(dd), 1.97-1.7(m), 1.6-1.35(m). Соединение 113: 1H ЯМР-cпектр (500Мгц, СDСl3), (смесь диастереомеров, смесь ротомеров). d 8.7(d), 8.6(d), 8.5(m), 7.7-7.6(dd), 7.3(s), 7.2(m), 5.4(d), 5.3(m), 4.6(brd), 4.4(brd), 3.95(s), 3.90(s), 3.85(s), 3.45(dd), 3.3-3.2(dd), 3.1-2.9(10), 2.4(dd), 1.95(s), 1.9-1.7(m), 1.61.35(m). Соединение 114: 1H ЯМР-cпектр (500Мгц, СDСl3),
ДивитисяДодаткова інформація
Назва патенту англійською1-(2-oxoacetyl)-piperidine-2-carboxylic acid derivatives, a method for the preparation, a pharmaceutical composition and a method for treatment
Назва патенту російськоюПроизводные 1-(2-оксоацетил)-пиперидин-2-карбоновой кислоты, способ получения, фармацевтическая композиция и способ лечения
МПК / Мітки
МПК: C07D 207/16, C07D 401/12, A61K 31/40, C07D 211/60, C07D 405/14, A61P 35/00, A61K 31/4427, A61K 31/445, C07D 473/00, A61K 31/4433, C07D 401/14, C07D 471/04, C07D 409/12, A61K 31/52, C07D 403/12
Мітки: спосіб, похідні, кислоти, одержання, 1-(2-оксоацетил)-піперідин-2-карбонової, композиція, лікування, фармацевтична
Код посилання
<a href="https://ua.patents.su/32-63874-pokhidni-1-2-oksoacetil-piperidin-2-karbonovo-kisloti-sposib-oderzhannya-farmacevtichna-kompoziciya-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-(2-оксоацетил)-піперідин-2-карбонової кислоти, спосіб одержання, фармацевтична композиція та спосіб лікування</a>
Попередній патент: Верстат для механічної обробки об’ємного виробу, зокрема елемента зубного протеза, за допомогою автоматичного копіювання
Наступний патент: Заміщені імідазоли, спосіб їх одержання, фармацевтична композиція на їх основі та спосіб лікування
Випадковий патент: Спосіб профілактики загострень бронхіальної астми