Інгібітори кінази
Номер патенту: 85505
Опубліковано: 26.01.2009
Автори: Бонжуклян Розанн, де Діос Альфонсо, Дель Прадо Міріам Філадельфа, Харамільо Агадо Карлос, Котіян Праміла, Ші Чан, Санчес-Мартінес Консепсьон, Сельгас Шейла Плейт, Хамдоучі Чафік Хамдоучі, Мадер Мері Маргарет
Формула / Реферат
1. Сполука Формули І:
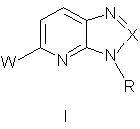 ,
,
де:
W є:
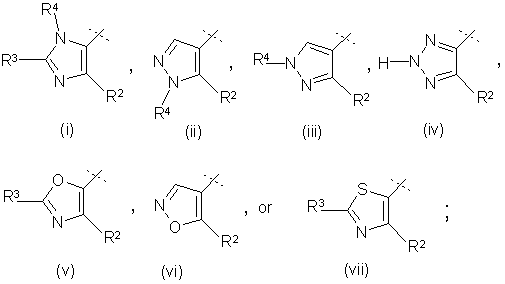
X є N або C-R1;
R є С1-С7-алкіл, С3-С7-циклоалкіл, (С1-С7-алкілен)-(С3-С7-циклоалкіл), -SO2-(С1-С7-алкіл) або -SO2-NR5R6;
R1 є водень, аміногрупа, метил або -N=CH(NMe)2;
R2 є феніл, факультативно заміщений одним або двома замісниками, незалежно один від одного вибраними з групи, яку складають галогени;
R3 є водень, С1-С7-алкіл, С3-С7-циклоалкіл або феніл, факультативно заміщений одним або двома замісниками, незалежно один від одного вибраними з групи, яку складають галогени та трифторметил;
R4 є водень або С1-С7-алкіл;
R5 та R6 незалежно один від одного вибрані з групи, яку складають С1-С7-алкіли;
або фармацевтично прийнятна сіль такої сполуки.
2. Сполука Формули I’:
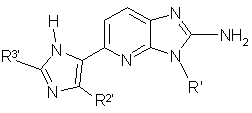 I’,
I’,
де:
R’ є 2,2-диметилпропіл або 1,2,2-триметилпропіл;
R2’ є феніл, 4-фторфеніл або 2,4-дифторфеніл;
R3’ є трет-бутил, 2-хлор-6-фторфеніл, 2-фтор-6-трифторметилфеніл, 2,6-дихлорфеніл або 2,6-дифторфеніл; або фармацевтично прийнятна сіль такої сполуки.
3. Сполука Формули I’:
 I’,
I’,
де:
a) R’ є 2,2-диметилпропіл, R2’ є 4-фторфеніл та R3’ є 2-фтор-6-трифторметилфеніл;
b) R’ є 2,2-диметилпропіл, R2’ є 4-фторфеніл та R3’ є 2,6-дихлорфеніл;
c) R’ є 2,2-диметилпропіл, R2’ є 4-фторфеніл та R3’ є трет-бутил;
d) R’ є 2,2-диметилпропіл, R2’ є феніл та R3’ є 2-хлор-6-фторфеніл;
e) R’ є 2,2-диметилпропіл, R2’ є 2,4-дифторфеніл та R3’ є трет-бутил;
f) R’ є 1,2,2-триметилпропіл, R2’ є 4-фторфеніл та R3 є трет-бутил; і
g) R’ є 1,2,2-триметилпропіл, R2’ є 4-фторфеніл та R3’ є 2,6-дифторфеніл;
або фармацевтично прийнятна сіль такої сполуки.
4. Сполука, яка являє собою 5-[2-трет-бутил-5-(4-фторфеніл)-1Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламін, або фармацевтично прийнятна сіль такої сполуки.
5. Сполука, яка являє собою 5-[2-трет-бутил-5-(4-фторфеніл)-1Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламін або його фумарат, диметансульфонат, сукцинат, дималеат або дигідрохлорид.
6. Сполука, яка являє собою 5-[2-трет-бутил-5-(4-фторфеніл)-1Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламін, диметансульфонат.
7. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-6 або фармацевтично прийнятну сіль такої сполуки у комбінації з фармацевтично прийнятним носієм, розріджувачем або наповнювачем.
8. Застосування сполуки за будь-яким із пп. 1-6 для виготовлення лікарського засобу для лікування захворювання або патологічного стану, який можна полегшити або відвернути шляхом інгібування кінази р38.
9. Застосування сполуки за будь-яким із пп. 1-6 для виготовлення лікарського засобу для лікування чутливих новоутворень.
10. Застосування за п. 9, яке відрізняється тим, що чутливим новоутворенням є множинна мієлома.
Текст
1. Сполука Формули І: 3 85505 4 g) R’ є 1,2,2-триметилпропіл, R2’ є 4-фторфеніл та R3’ є 2,6-дифтор феніл; або фармацевтично прийнятна сіль такої сполуки. 4. Сполука, яка являє собою 5-[2-трет-бутил-5-(4фтор феніл)-1Н-імідазол-4-іл]-3-(2,2диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламін, або фармацевтично прийнятна сіль такої сполуки. 5. Сполука, яка являє собою 5-[2-трет-бутил-5-(4фтор феніл)-1Н-імідазол-4-іл]-3-(2,2диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламін або його фумарат, диметансульфонат, сукцинат, дималеат або дигідрохлорид. 6. Сполука, яка являє собою 5-[2-трет-бутил-5-(4фтор феніл)-1Н-імідазол-4-іл]-3-(2,2диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламін, диметансульфонат. 7. Фармацевтична композиція, яка містить сполуку за будь-яким із пп.1-6 або фармацевтично прийнятну сіль такої сполуки у комбінації з фармацевтично прийнятним носієм, розріджувачем або наповнювачем. 8. Застосування сполуки за будь-яким із пп.1-6 для виготовлення лікарського засобу для лікування захворювання або патологічного стану, який можна полегшити або відвернути шля хом інгібування кінази р38. 9. Застосування сполуки за будь-яким із пп.1-6 для виготовлення лікарського засобу для лікування чутливи х новоутворень. 10. Застосування за п.9, яке відрізняється тим, що чутливим новоутворенням є множинна мієлома. Кіназа р38 є активована мітогеном протеїн(МАР)-кіназа, яка належить до надгрупи серин/треонін-кіназ. Ця кіназа активується позаклітинними чинниками, наприклад, теплом, УФ світлом та осмотичним напруженням, а також запальними подразниками, наприклад, ліпополісахаридами. Будучи активованою, кіназа р38 фосфорилує внутрішньоклітинні протеїнові субстрати, які регулюють біосинтез запальних цитокінів - αфактора некрозу пухлин (TNF-α) та інтерлейкіну1β (IL-1β). Ці цитокіни мають відношення до патології численних хронічних запальних розладів [Лі та ін. - Lee, et аі., Ann. Ν.Υ. Acad. Sci., 696, 149-170 (1993); Мюллер-Ладнер - Muller-Ladner, Curr. Opin. Rheumatol., 8, 210-220 (1996)), серцево-судинних розладів та розладів центральної нервової системи (Салітуро та ін. - Salituro, et al., Current Medicinal Chemistry. 6, 807-823 (1999)) та автоімунних розладів (Паргелліс та ін. - Pargellis, et al., Nature Structural Biology. 9(4), 268-272 (2002)]. Як інгібітори кінази р38 або як інгібітори цитокінів ідентифіковано численні сполуки, що належать до структурних гр уп піридинілімідазолу [заявки WO 96/21452, WO 97/25045, патенти США №5,656,644, №5,686,455, №5,717,100, заявки WO 9712876, WO 98/21957, WO 98/47892, WO 99/903837, WO 99/01449, WO 00/61576, WO 01/72737] та піримідинілімідазолу [заявки WO 97/25048, WO 99/01452, WO 97/25046, WO 9/932121, WO 99/01131, WO 99/01130, WO 99/01136, WO 98/07452, WO 97/47618, WO 98/56788, WO 98/57996]. Відомо, що селективні інгібітори кінази р38 пригнічують експресію TNF-α та IL-1β [Маккенна та ін. - McKenna, et al., J. Med. Chem.. 45(11), 2173-2184 (2002)]. Описано протизапальну дію сполук групи ігіримідинілімідазолу [Лантос та ін. - Lantos, et al., J. Med. Chem.. 27, 7275 (1984)], і на цей час досліджується придатність численних інгібіторів кінази р38 для лікування різноманітних розладів [Бем та Ддамс - Boehm and Adams, Exp. Opin. Ther. Patents. 10(1), 25-37 (2000)]. У галузі існує постійна потреба у сполуках, які є лікувальними засобами, що пригнічують цитокіни, тобто у сполуках, що здатні інгібувати кіназу р38. Цей винахід пропонує нові Інгібітори кінази р38, корисні для лікування патологічних станів, які є наслідками надмірного продукування цитокінів. Суть винаходу Цей винахід пропонує сполуки Формули І: I де: Wє X є N або C-R 1; R є С1-С7-алкіл, С3-С7-циклоалкіл, (C1-С7алкілен)-(С3-С7-циклоалкіл), -SO2-(C1-C7 алкіл) або -SO2-NR5R6; R1 є водень, аміногрупа, метил або N=CH(NMe)2; R2 є феніл, факультативно заміщений одним або двома замісниками, незалежно один від одного вибраними з групи, яку складають галогени; R3 є водень, С1-С7-алкіл, С3-С7-циклоалкіл або феніл, факультативно заміщений одним або двома замісниками, незалежно один від одного вибраними з групи, яку складають галогени та трифторметил; R4 є водень або C1-С7-алкіл; R5 та R6 незалежно один від одного вибрані з групи, яку складають C1-С7-алкіли; або фармацевтично прийнятні солі таких сполук. Цей винахід пропонує спосіб інгібування кінази р-38 у ссавців, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки Формули І або фармацевтично прийнятної солі такої сполуки. 5 85505 Цей винахід пропонує також спосіб пригнічення продукування α-фактора некрозу пухлин (TNFα) у ссавців, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки Формули І або фармацевтично прийнятної солі такої сполуки. Цей винахід пропонує також спосіб пригнічення продукування інтерлейкіну-1β (IL-1β) у ссавців, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки Формули І або фармацевтично прийнятної солі такої сполуки. Крім того, цей винахід пропонує спосіб лікування патологічних станів, що є наслідками надмірного продукування цитокінів, у ссавців, який включає введення в організм ссавця, який потребує такого лікування, сполуки Формули І або фармацевтично прийнятної солі такої сполуки у кількості, яка пригнічує цитокіни. Цей винахід пропонує також спосіб лікування чутливи х новоутворень у ссавців, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки Формули І або фармацевтично прийнятної солі такої сполуки. Цей винахід пропонує також спосіб інгібування метастазу у ссавців, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки Формули І або фармацевтично прийнятної солі такої сполуки. Цей винахід пропонує також спосіб лікування ревматоїдного артриту у ссавців, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки Формули І або фармацевтично прийнятної солі такої сполуки. Цей винахід пропонує також фармацевтичну композицію, яка включає сполуку Формули І або фармацевтично прийнятну сіль такої сполуки у комбінації з фармацевтично прийнятним носієм, розріджувачем або наповнювачем. Цей винахід пропонує також застосування сполуки Формули І або фармацевтично прийнятної солі такої сполуки для виготовлення лікарського засобу для інгібування кінази р38. Крім того, цей винахід пропонує сполуку Формули І або фармацевтично прийнятну сіль такої сполуки для застосування при інгібуванні кінази р38 у ссавців. Далі, цей винахід пропонує фармацевтичну композицію, пристосовану для інгібування кінази р38, яка включає сполуку Формули І або фармацевтично прийнятну сіль такої сполуки у комбінації з одним або кількома фармацевтично прийнятними носіями, розріджувачами або наповнювачами для неї. Цей винахід пропонує також застосування сполуки Формули І для виготовлення лікарського засобу для лікування захворювання або патологічного стану, який можна полегшити або відвернути шляхом інгібування кінази р38. Цей винахід пропонує також застосування сполуки Формули І або фармацевтично прийнятної солі такої сполуки для виготовлення лікарського засобу для пригнічення продукування α-фактора некрозу пухлин (TNF-α). Крім того, цей винахід пропонує сполуку Формули І або фармацевтично прийнятну сіль такої сполуки для застосування при пригніченні продукування α-фактора некрозу пух 6 лин (TNF-α) у ссавців. Далі, цей винахід пропонує фармацевтичну композицію, пристосовану для пригнічення продукування а-фактора некрозу пухлин (TNF-α), яка включає сполуку Формули І або фармацевтично прийнятну сіль такої сполуки у комбінації з одним або кількома фармацевтично прийнятними носіями, розріджувачами або наповнювачами для неї. Цей винахід пропонує також застосування сполуки Формули І для виготовлення лікарського засобу для лікування захворювання або патологічного стану, який можна полегшити або відвернути шля хом пригнічення продукування α-фактора некрозу пухлин (TNF-α). Цей винахід пропонує також застосування сполуки Формули І або фармацевтично прийнятної солі такої сполуки для виготовлення лікарського засобу для пригнічення продукування інтерлейкіну-1β (IL-1β). Крім того, цей винахід пропонує сполуку Формули І або фармацевтично прийнятну сіль такої сполуки для застосування при пригніченні продукування інтерлейкіну-1β (IL-1β) у ссавців. Далі, цей винахід пропонує фармацевтичну композицію, пристосовану для пригнічення продукування інтерлейкіну-1β (IL-1β), яка включає сполуку Формули І або фармацевтично прийнятну сіль такої сполуки у комбінації з одним або кількома фармацевтично прийнятними носіями, розріджувачами або наповнювачами для неї. Цей винахід пропонує також застосування сполуки Формули І для виготовлення лікарського засобу для лікування захворювання або патологічного стану, який можна полегшити або відвернути шляхом пригнічення продукування інтерлейкіну-1β (IL-1β). Цей винахід пропонує також застосування сполуки Формули І або фармацевтично прийнятної солі такої сполуки для виготовлення лікарського засобу для лікування патологічних станів, що є наслідками надмірного продукування цитокінів. Крім того, цей винахід пропонує сполуку Формули І або фармацевтично прийнятну сіль такої сполуки для застосування при лікуванні патологічних станів, що є наслідками надмірного продукування цитокінів у ссавців. Далі, цей винахід пропонує фармацевтичну композицію, пристосовану для лікування патологічних станів, що є наслідками надмірного продукування цитокінів, яка включає сполуку Формули І або фармацевтично прийнятну сіль такої сполуки у комбінації з одним або кількома фармацевтично прийнятними носіями, розріджувачами або наповнювачами для неї. Цей винахід пропонує також застосування сполуки Формули І для виготовлення лікарського засобу для лікування захворювання або патологічного стану, який можна полегшити або відвернути шляхом пригнічення надмірного продукування цитокінів. Цей винахід пропонує також застосування сполуки Формули І або фармацевтично прийнятної солі такої сполуки для виготовлення лікарського засобу для лікування чутливих ново утворень. Крім того, цей винахід пропонує сполуку Формули І або фармацевтично прийнятну сіль такої сполуки для застосування при лікуванні чутливи х новоутворень у ссавців. Далі, цей винахід пропонує фармацевтичну композицію, пристосовану для лікування чутливи х новоутворень яка включає сполуку Фор 7 85505 мули І або фармацевтично прийнятну ψ сіль такої сполуки у комбінації з одним або кількома фармацевтично прийнятними носіями, розріджувачами або наповнювачами. Цей винахід пропонує також застосування сполуки Формули І або фармацевтично прийнятної солі такої сполуки для виготовлення лікарського засобу для інгібування метастазу. Крім того, цей винахід пропонує сполуку Формули І або фармацевтично прийнятну сіль такої сполуки для застосування при інгібуванні метастазу у ссавців. Далі, цей винахід пропонує фармацевтичну композицію, пристосовану для інгібування метастазу, яка включає сполуку Формули І або фармацевтично прийнятну сіль такої сполуки у комбінації з одним або кількома фармацевтично прийнятними носіями, розріджувачами або наповнювачами. Цей винахід пропонує також застосування сполуки Формули І або фармацевтично прийнятної солі такої сполуки для виготовлення лікарського засобу для лікування ревматоїдного артриту. Крім того, цей винахід пропонує сполуку Формули І або фармацевтично прийнятну сіль такої сполуки для застосування при лікуванні ревматоїдного артриту у ссавців. Далі, цей винахід пропонує фармацевтичну композицію, пристосовану для лікування ревматоїдного артриту, яка включає сполуку Формули І або фармацевтично прийнятну сіль такої сполуки у комбінації з одним або кількома фармацевтично прийнятними носіями, розріджувачами або наповнювачами. Хімічні терміни загального характеру, вжиті у вищезазначених термінах, мають свої звичайні значення. Наприклад, термін "С1-С7-алкіл" охоплює метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил, гексил та гептил. Термін "С1-С7-алкілен" охоплює метилен, етилен, пропілен, ізопропілен, бутилен, ізобутилен, втор-бутилен, трет-бутилен, пентилен, гексилен та гептилен. Термін "С3-С7-циклоалкіл" охоплює циклопропіл, циклобутил, циклопентил, циклогексил та циклогептил. Термін "(С1-С7алкілен)-(С3-С7-циклоалкіл)" означає С 3-С7циклоалкіл, приєднаний до решти молекули через С1-С7-алкіленовий місточок. Термін "галоген" охоплює фтор, хлор, бром та йод. Термін "кіназа р-38" означає ізоформи кінази р-38α та/або р-38β. Термін " пригнічення продукування TNF-α (IL1β, цитокіну)" означає зниження надлишкових рівнів TNF-α, IL-1β або іншого цитокіну in vivo в організмах ссавців до нормальних або субнормальних рівнів. Такий ефект може бути досягнутий шляхом інгібування вивільнення TNF-α, IL-1β або іншого цитокіну in vivo усіма клітинами, в тому числі макрофагами; шляхом регулювання в напрямку зниження надлишкових рівнів TNF-α, IL-1β або іншого цитокіну in vi vo в організмах ссавців до нормальних або субнормальних рівнів на геномному рівні; шляхом інгібування синтезу TNF-α, IL-1β або іншого цитокіну як пост-трансляційного процесу; або шляхом регулювання в напрямку рівнів TNF-α, IL1β або іншого цитокіну на трансляційному рівні. Термін "мінімальна ефективна доза (МЕД, MED)" означає найменшу дозу, яка спричиняє 8 ефект, статистично значущо відмінний від ефекту, що спостерігається у контрольній групі піддослідних суб'єктів, які одержували носій. Термін "порогова ефективна доза (ПЕД, TED)" означає дозу, необхідну для досягнення заданого порогу активності. Наприклад, TED50 є доза, необхідна для досягнення 50% реакції. Термін "порогова мінімальна ефективна доза (ПМЕД, TMED)" означає найменшу доз у, яка гарантує ста тистично значущий ефект, який також досягає заданого порогового рівня активності. Наприклад, TMED50 є найменша доза, при якій досягається реакція у 50%, яка напевне статистично значущо відмінна від реакції, що спостерігається у контрольній групі піддослідних суб'єктів, які одержували носій. Термін "ефективна кількість" означає дозу сполуки Формули І, необхідну для досягнення бажаного фармакологічного ефекту. Для досвідченого фахівця зрозуміло, що деякі сполуки Формули І містять щонайменше один хіральний центр. Цей винахід охоплює усі індивідуальні енантіомери або діастереомери, а також суміші енантіомерів та діастереомерів згаданих сполук, в тому числі рацемати. Перевага віддається сполукам Формули І, що містять щонайменше один хіральний центр, у формах індивідуальних енантіомерів або діастереомерів. Індивідуальні енантіомери або діастереомери можна одержати, виходячи з хіральних реагентів, або шля хом застосування стереоселективних або стереоспецифічних методів синтезу. За альтернативними варіантами, індивідуальні енантіомери або діастереомери можна виділяти із сумішей стандартними методами хіральної хроматографії або кристалізації. Для досвідченого фахівця також зрозуміло, що якщо змінна група "W" є імідазол (і), a R4 є водень, то імідазольний цикл існує у таких дво х та утомерних формах: Хоча таутомери І та II є структурно відмінними, для досвідченого фахівця зрозуміло, що між ними існує рівновага, і за звичайних умов кожний з них легко та швидко перетворюється в інший. [Дивись: Марч, "С учасна органічна хімія" - March, Ad vanced Organic Chemistry. Third Edition, Wiley Interscience, New York, New York (1985), cтop.66-70; та Аллінджер, "Органічна хімія" - Allinger, Organic Chemistry. Second Edition, Worth Publishers, New York, New York, (1976), стор.173]. Отже, якщо сполука Формули І, де змінна група "W" є імідазол (і) та R є водень, зображена в одній таутомерній формі, то маються на увазі обидві таутомерні форми імідазольного циклу. Аналогічно, якщо сполука Формули І, де гр упа "W" є імідазол (і) та R є водень, згадується під назвою 1Н-імідазолу або 3Німідазолу, то маються на увазі обидві таутомерні 9 85505 форми імідазольного циклу. Конкретно, назва 5-[2трет-бутил-5-(4-фтор-феніл)-1Н-імідазол-4-іл]-3(2,2-диметил-пропіл)-3Н-імідазо[4,5-b]піридин-2іламін означає молекулу або у формі 1Н-імідазол4-ілу, або 3Н-імідазол-4-ілу. Аналогічно, якщо змінна група "W" є триазол (iv), то триазольна група існує у трьох та утомерних формах, і при зображенні або найменуванні однієї таутомерної форми маються на увазі усі три таутомерні форми триазольного циклу. Для читача-фахівця зрозуміло, що сполуки за цим винаходом здатні утворювати солі. У всіх випадках фармацевтично прийнятні солі усіх таких сполук охоплюються їхніми назвами. Сполуки за цим винаходом являють собою аміни і, відповідно, можуть реагувати з будь-якою з численних неорганічних та органічних кислот з утворенням фармацевтично прийнятних солей цих кислот. Перевага віддається фармацевтично прийнятним солям малеїнової, фумарової, бур штинової, хлористоводневої та метансульфонової кислот. Особлива перевага віддається диметансульфоновим солям сполук Формули І. Деякі класи сполук Формули І є інгібіторами кінази р-38, яким віддається перевага. Нижче описано такі класи, яким віддається перевага: a) W є: 10 , X є C-R1, R є С1-С7-алкіл, R2 є феніл, 4-фторфеніл або 2,4-дифторфеніл, R3 є C1-С7-алкіл або феніл, факультативно заміщений одним або двома замісниками, незалежно вибраними з групи, яку складають галогени та трифторметил, та R4 є водень; m) W є , X є C-NH2, R є С1-С7-алкіл, R2 є феніл, 4фтор феніл або 2,4-дифторфеніл, R3 є С1-С7-алкіл або феніл, факультативно заміщений одним або двома замісниками, незалежно вибраними з групи, яку складають галогени, та R4 є водень; n) сполука Формули І є вільна основа; о) сполука Формули І є сіль; р) сполука Формули І є метансульфонат; q) сполука Формули І є диметансульфонат. До варіантів здійснення цього винаходу, яким віддається перевага, належать усі комбінації пунктів а)-q). Підгрупою охоплюваних Формулою І сполук, якій віддається особлива перевага, є сполуки Формули l': I' b) W є: c) X є C-R1; d) X є C-NH 2; е) R2 є феніл, 4-фторфеніл дифторфеніл; f) R2 є феніл; g) R 2 є 4-фторфеніл; h) R 2 є 2,4-дифторфеніл; і) R4 є водень; j) W є або. 2,4 , X є C-R1, R2 є феніл, 4-фтор феніл або 2,4дифторфеніл, та R 4 є водень; k) W є , X є C-NH2, R2 є феніл, 4-фторфеніл або 2,4дифторфеніл, та R 4 є водень; 1) W є де: R' є 2,2-диметилпропіл або 1,2,2триметилпропіл; 2 R' є феніл, 4-фторфеніл або 2,4дифторфеніл; R3' є трет-бутил, 2-хлор-6-фторфеніл, 2-фтор6-трифторметилфеніл, 2,6-дихлорфеніл або 2,6дифторфеніл; або фармацевтично прийнятні солі таких сполук. Найбільша перевага серед сполук Формули l' віддається сполукам, де: 1. R' є 2,2-диметилпропіл, R2' є 4-фторфеніл та 3 R є 2-фтор-6-трифторметилфеніл; 2. R' є 2,2-диметилпропіл, R2' є 4-фторфеніл та 3 R ' є 2,6-ди хлорфеніл; 3. R' є 2,2-диметилпропіл, R2 є 4-фторфеніл та R3' є трет-бутил; 4. R' є 2,2-диметилпропіл, R2' є феніл та R3' є 2-хлор-6-фторфеніл; 5. R' є 2,2-диметилпропіл, R2' є 2,6дифторфеніл та R3 ' є трет-бутил; 6. R' є 1,2,2-триметилпропіл, R2' є 4-фтор феніл та R3 є трет-бутил; і 7. R' є 1,2,2-триметилпропіл, R2' є 4-фтор феніл та R3' є 2,6-дифтор феніл. 11 85505 Перевага віддається також кожній з цих сполук у формах метансульфонатів, сукцинатів, фумаратів, дималеатів, дигідрохлоридів та диметансульфонатів. Особлива перевага віддається кожній з цих сполук у формі диметансульфонатів. Сполуки Формули І є інгібіторами кінази р38. Отже, цей винахід пропонує також спосіб інгібування кінази р-38 у ссавців, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки Формули І. Серед ссавців, що підлягають лікуванню шляхом введення в організм сполук Формули І, перевага віддається людині. Як інгібітори кінази р38, сполуки за цим винаходом є корисними для пригнічення продукування запальних цитокінів - фактора некрозу пухлин (TNF-α) та інтерлейкіну-1β (IL-1β) і, отже, для лікування розладів, що є наслідками надмірного продукування цитокінів. Тому сполуки Формули І вважаються корисними при лікуванні запальних розладів, в тому числі екземи, атонічного дерматиту, ревматоїдного артриту, остеоартриту, запальних захворювань кишок та синдрому токсичного шоку. Сполуки за цим винаходом вважаються корисними також при лікуванні серцево-судинних розладів, наприклад, гострого інфаркту міокарда, хронічної серцевої недостатності, атеросклерозу, вірусного міокардиту, відторгнення серцевого аллотрансплантату та серцевої дисфункції, пов'язаної із сепсисом. Крім того, сполуки за цим винаходом вважаються корисними при лікуванні розладів центральної нервової системи, наприклад, менінгококового менінгіту, хвороби Альцгеймера, хвороби Паркінсона та розсіяного склерозу. Збільшення маси більшості твердих пухлин зумовлене проліферацією злоякісних клітин та клітин строми, в тому числі клітин ендотелію. Для розростання пухлини до розміру більше 2-3мМ у діаметрі вона має формувати систему судин; цей процес відомий під назвою ангіогенезу. Є відомості, що пригнічення індукованого пухлиною ангіогенезу під впливом ангіостатину та ендостатину спричиняє протипухлинний ефект [О'Рейлі та ін. O'Reilly, et al., Cell. 88, 277-285 (1997)]. Показано, що селективний інгібітор кінази р38 -SB22025 інгібує ангіогенез [Джексон та ін. - J.R. Jackson, et al., J. Pharmacol. Em Therapeutics. 284, 687 (1998)]. Оскільки ангіогенез є вирішальним чинником при збільшенні маси більшості твердих пухлин, розроблення нових інгібіторів кінази р38 для інгібування цього процесу є перспективним підходом до протипухлинної терапії. Цей підхід до протипухлинної терапії може бути позбавленим токсичних побічних ефектів або розвитку резистентності до лікарських засобів, які мають місце при звичайній хіміотерапії [Дж. Фолкмен - Judah Folkman, Endogenous Inhibitors of Aneiogenesis. The Harvey Lectures, Series 92, стор.65-82, Wiley-Liss Inc., (1998)]. Отже, як інгібітори кінази р38, сполуки за цим винаходом є корисними також при інгібуванні росту чутливих новоутворень. [Шульц. - Schultz R.M. Potential of p38 MAP kinase inhibitors in the treatment of cancer, у монографії під редакцією Юккера: Ε. Jucker (ed.), 12 Progress in Drug Research. 60, 59-92, (2003)]. Чутливе новоутворення визначається як новоутворення, виживання, ріст або метастаз якого залежать від кінази р38. До чутливи х новоутворень належать пухлини головного мозку, сечоста тевого тракту, лімфатичної системи, шлунку, гортані та легенів [патент США №5,717,100]. Термін "чутливі новоутворення" у цьому описі означає переважно людські ракові пухлини, в тому числі недрібноклітинну карциному [Грінберг та ін. - A. Greenberg, et al., Am. J. Respir. Cell Моl. Biol.. 26, 558 (2002)], карциному молочної залози [Чен та ін. - J. Chen, et al., J. Biol. Chem.. 276, 47901 (2001); Салх та ін. В. Salh, et al., Int. J. Cancer. 98,148 (2002); та Цзіонг та ін. - S. Xiong, et al., Cancer Res.. 61, 1727 (2001)], карциному шлунку [Юнг та ін. - Y.D. Jung, et al., Proc. Am. Assoc. Cancer Res.. 43, 9 (2002)], карциноми товстого кишечнику та прямої кишки [Цзіонг та ін. - S. Xiong, et al., Cancer Res.. 61, 1727 (2001)], карциноми простати [Парк та ін. - J.I. Park, et al., Oncogene. 22, 4314-4332 (2003); Чен та ін. L. Chen, et al., Cancer Lett.. 215, 239-247 (2004); та Узгара та ін. - AR. U zgara, et al., Prostate. 55, 128139 (2003)], злоякісну меланому [Денкерт та ін. - С. Denkert, et al., Clin. Exp. Metastasis. 19, 79 (2002)], та множинну мієлому [Хідесіма та ін. - Hideshima, et al., Oncogene advance online publication, 1-11, (11 October 2004); та Hideshima, et al., Blood. 101(2), 703 (2003)]. Сповіщається, що інгібування ангіогенезу шляхом пригнічення TNF-α є корисним також при інгібуванні або профілактиці метастазу [патенти США №6,414,150 та №6,335,336]. Крім того, пригнічення TNF-α показане при лікуванні та профілактиці кахексії - виснажливого синдрому, від якого страждає приблизно половина усіх хворих на рак [Йонеда та ін. - Т. Yoneda, et al., J. Clin. Invest., 87, 977 (1991)]. Крім того, інгібування кінази р38 може бути ефективним при лікуванні деяких патологічних станів, спричинених вірусами, наприклад, вірусом грипу [Кудзіме та ін. - К. Kujime, et al.. J. Immunology. 164, 3222-3228 (2000)], риновірусом [Грієго та ін. - S. Griego, et al.. J. Immunology. 165, 5211-5220 (2000)] та ВІЛ [Шапіро та ін. - L. Shapiro, et al. Proc. Natl. Acad. Sci. USA. 95, 7422-7426, (1998)]. Сполуки за цим винаходом можна одержати різноманітними способами; деякі з них ілюстровано поданими нижче схемами. Для фахівця у галузі зрозуміло, що для одержання сполук Формули І окремі стадії у поданих нижче схемах можна варіювати. Конкретна послідовність стадій, необхідних для одержання сполук Формули І, залежить від конкретної сполуки, яку слід синтезувати, вихідних реагентів та відносної лабільності груп-замісників. У поданих нижче схемах деякі замісники для ясності не вказано, і ця обставина не обмежує інформацію, представлену на схемах. Сполуки Формули І, де W - імідазол (і), можна одержати, як показано на представленій нижче схемі, де R, R1, R2 та R3 відповідають поданим вище визначенням. 13 85505 14 Дикетон (а) вводять у реакцію з ацетатом амонію та відповідним альдегідом у придатному розчиннику (перевага віддається оцтовій кислоті), і одержують відповідний нітропіридиніл-імідазол (b). Нітрогрупу відновлюють стандартним способом гідрування або хімічним способом, і одержують відповідний діамін (с). Цей діамін потім вводять у реакцію або з бромціаном, одержуючи 3заміщений 5-(імідазол-4-іл)-2-амінопіридиніл імідазол (1а), або з відповідним ортоформіатом, одержуючи 3-заміщений 5-(імідазол-4іл)піридинілімідазол (Іb), або з відповідним нітрилом, одержуючи 3-заміщений 5-(імідазол-4іл)піридинілтриазол (Іс). Необхідні дикетони (а) можна одержати, як показано на представленій нижче схемі, де R та R 2 відповідають поданим вище визначенням. 2,6-дихлорнітропіридин (d) та відповідний амін або похідну сполуку аміну нагрівають у придатному розчиннику, і одержують відповідний 2-аміно-6хлор-3-нітропіридин (е), який потім сполучають із відповідно заміщеним ацетиленом, і одержують відповідний 1,2-двозаміщений ацетилен (f). Цей ацетилен окиснюють, і одержують бажаний дикетон (а). Сполуки Формули І, де W - піразол (іі) або (ііі), можна одержати, як показано на поданій нижче схемі, де X, R, R1 та R2 відповідають поданим вище визначенням. 15 85505 16 Ацетилен (f) вводять у реакцію з оксидом ртуті (II) у водному розчині сірчаної кислоти, і одержують кетон (g). Цей кетон обробляють диметилацеталем диметилформаміду або трис(диметиламіно)метаном у придатному розчиннику, як правило, у диметилформаміді, і одержують єнамінокетон (h). Цей єнамінокетон потім обробляють гідразином у придатному розчиннику, як правило, у етанолі або метанолі, і одержують фенілпіразол (j). Вводять імідазоло- або триазолопіридинову груп у, як описано вище, і одержують сполуки Формули Id. Сполуки Формули І, де W - [1,2,3]триазол (iv), можна одержати, як показано на поданій нижче схемі, де змінні Y, R та R2 відповідають поданим вище визначенням. Ацетилен (f) вводять у реакцію з джерелом азиду, як правило, з азидом натрію, у придатному розчиннику, наприклад, у диметоксіетані, і одержують триазол (k). Вводять - імідазоло- або триазолопіридинову груп у, як описано вище, і одержують сполуки Формули Іе. Сполуки Формули І, де W - тіазол (ν) або оксазол (vii), можна одержати, як показано на представленій нижче схемі, де змінні X, R, R2 та R3 відповідають поданим вище визначенням, а Υ є О або S. α-бромкетон (1) вводять у реакцію з відповідним амідом (m, Y=O) або тіоамідом (m, Y=S) у придатному розчиннику, і одержують відповідний оксазол або тіазол (n). Оксазол (n, Υ=Ο) потім обробляють бромом у придатному розчиннику, і одержують відповідний бромзаміщений гетероцикл (о, Υ=Ο ). Тіазол (n, Y=S) обробляють н-бутиллітієм, і одержаний аніон вводять у реакцію з хлоридом трибутилолова, одержуючи відповідну похідну сполуку олова (о, Y=S). Відповідно заміщений гетероцикл (о) вводять у реакцію з відповідною борною кислотою (р) у присутності придатного каталізатора, як описано вище, і одержують сполуки If. Необхідні α-бромкетони або є наявними на ринку, або можуть бути одержані стандартними способами з відповідної карбонільної сполуки, наприклад, як описано Хаусом [Н.О. House, Modern Synthetic Reactions. W.A. Benjamin, Inc., Menlo Park, California (1972), cтop.459-478] та Лароком [Larock (R.C. Larock), Comprehensive Organic Transformations. VCH Publishers, Inc., New York, New York (1989), стор.369-471, 755]. Необхідні аміди та тіоаміди або є наявними на ринку, або можуть бути одержані стандартними способами, добре відомими досвідченому фахівцеві у галузі. Додаткові сполуки Формули І, де W - імідазол (і) або ізоксазол (vi), можна одержати стандартними способами сполучення із застосуванням сполук паладію, як показано на представленій нижче схемі, де W - імідазол (і) або ізоксазол (vi), а X та R відповідають поданим вище визначенням. Відповідно заміщений галогенгетероарил (q) сполучають із відповідно заміщеною борною кислотою (р) у присутності паладієвого каталізатора, 17 85505 як правило, хлориду біс(трифенілфосфін)паладію (II), у придатному розчиннику, і одержують бажану сполуку Формули Іе. Необхідні вихідні матеріали або є наявними на ринку, або можуть бути одержані способами, добре відомими досвідченому фа хівцеві у галузі. Численні сполуки за цим винаходом не тільки є корисними як інгібітори кінази р38, але також є корисними проміжними продуктами для одержання додаткових сполук за цим винаходом. Наприклад, первинні та вторинні аміни можна ацилювати, алкілувати або сполучати з карбоновими кислотами або амінокислотами у стандартних умовах пептидного сполучення. Далі, складно-ефірні групи можна відновлювати до відповідних спиртів або перетворювати в аміди стандартними способами. Спирти можна активува ти та заміщува ти численними нуклеофільними групами, одержуючи подальші сполуки за цим винаходом. Необмежувальні приклади таких відщеплюваних груп є галогени, оксонієві іони, алкілперхлорати, складні ефіри амоніоалкансульфонових кислот, алкілфторсульфонати, нонафлати, трезилати, трифлати та складні ефіри сульфонових кислот, причому перевага віддається мезилатам або тозилатам. Способи введення таких груп також добре відомі досвідченому фахівцеві; дивись, наприклад, монографії Марча [March, Ad vanced Organic Chemistry. 5 th Ed., John Wiley and Sons, New York, стор.445-449 (2001)]. Крім того, 2-аміногрупу бензимідазольного фрагменту можна діазотувати та замінювати стандартними способами, одержуючи додаткові сполуки за цим винаходом. Для досвідченого фахівця зрозуміло, що не всі замісники у сполуках Формули І є стійкими-у деяких умовах реакцій, що застосовуються для синтезу ци х сполук. Такі групи можна вводити у зручний момент у процесі синтезу або захищати з подальшим відщепленням груп захисту в разі необхідності або за бажанням. Для досвідченого фа хівця зрозуміло, що групи захисту можуть бути видалені у будь-який зручний момент у процесі синтезу сполук за цим винаходом. Способи введення та видалення груп захисту азоту та кисню добре відомі в галузі; дивись, наприклад, Гріні та Вутс [Greene and Wuts, Protective Groups in Organic Synthesis. 3rd Ed., John Wiley and Sons, New York, розділ 7 (1999)]. Крім того, для досвідченого фахівця зрозуміло, що у багатьох випадках послідовність введення груп не має суттєвого значення. Конкретна послідовність стадій, необхідних для одержання сполук Формули І, залежить від конкретної сполуки, яка синтезується, вихідних сполук та відносної лабільності груп-замісників. Абревіатури, символи та терміни, вжиті в описах прикладів та випробувань, мають такі значення: АсОН - оцтова кислота; DMF - Ν,Νдиметилформамід; DMSO - диметилсульфоксид; Et2O - діетиловий ефір; ЕtOАс - етилацетат; EtOH етанол;год - години; МеОН - метанол; хв - хвилини; МТВЕ - метил-трет-бутиловий простий ефір; Pd(OAc)2 - ацетат паладію; RT - кімнатна температура; THF - тетрагідрофуран; VO(acac)2 - ацетилацетонат ванадилу. Підготовчий синтез 1 18 [6-(2-трет-бутил-5-феніл-3Н-імідазол-4-іл)-3нітропіридин-2-іл]-(2,2-диметилпропіл)амін (6-хлор-3-нітропіридин-2-іл)-(2,2-диметилпропіл)амін До суспензії 2,6-дихлор-3-ниропіридину (20г, 103ммоль) та Na2CO3 (18,5г, 175ммоль) в EtOH (1,6мл/ммоль) додають при кімнатній температурі неопентиламін (18мл, 150ммоль) та перемішують протягом ночі. Концентрують, та розводять одержану суспензію водою (100мл) і повільно нейтралізують концентрованою НСI (приблизно 40мл) до рН=7. Охолоджують суспензію до 0°С, витримують 1год, і відділяють тверду речовину фільтруванням під вакуумом. Промивають цю тверду речовину льодяною водою (4´50мл) та сушать на повітрі протягом ночі. Перекристалізують продукт з EtOAc та гексану, і одержують вказану в заголовку сполуку у вигляді жовтої твердої речовини (21,23г, 84%). MS (ES): m/z=244 [М+Н]. (2,2-диметилпропіл)-(3-нітро-6фенілетинілпіридин-2-іл)амін У висушеній у шафі круглодонній колбі розчиняють (6-хлор-3-нітропіридин-2-іл)-(2,2диметилпропіл)амін (7,3г, 30,0ммоль), феніладетилен (5,0мл, 45ммоль) та трифенілфосфін (1,5ммоль, 0,39г) у триетиламіні (10мл/г). Розчин тричі почергово продувають азотом та вакуумують. Додають Pd(OAc)2 (0,10г, 0,45ммоль), і повторюють ще тричі почергову обробку азотом та вакуумування. Нагрівають при 70-80°С при перемішуванні в атмосфері азоту протягом 1-3год, потім охолоджують до кімнатної температури і витримують 2год. Концентрують, та розподіляють між водою (25мл) та EtOAc (150мл). Відділяють органічний шар і промивають водою (4´25мл), насиченим водним розчином NaCl (25мл), сушать над MgSO4 , фільтрують і концентрують. Очи щають неочищену тверду речовину шляхом перекристалізації із суміші EtOAc/гексан, і одержують вказану в заголовку сполуку у вигляді яскраво-оранжевої твердої речовини (6,5г, 21,2ммоль, 71%). MS (ES): m/z=310 [М+Н]; т.пл. 90-92°С. 1-[6-(2.2-диметилпропіламіно)-5-нітропіридин2-іл-2-фенілетан-1.2-діон Змішують (2,2-диметилпропіл)-(3-нітро-6фенілетинілпіридин-2-іл)амін (3,11г, 10ммоль), NaHCO3 (0,420г, 5,0ммоль), MgSO4 (2,40г, 20ммоль) в ацетоні (85мл) та воді (25мл) і охолоджують до 0°С. Додають до охолодженої суміші KМnО4 (3,16г, 20,0ммоль), і інтенсивно перемішують реакційну суміш при 0°С протягом приблизно 1-2год. Гасять суміш Na2SO3 (5,67г, 45ммоль). Відстороняють льодяну баню, і перемішують суміш при кімнатній температурі протягом 2год. Відфільтровують тверду речовину через шар фільтрувальної речовини. Промивають фільтр водою (2´50мл) та EtOAc (50мл). Розділяють фази і екстрагують водну фаз у EtOAc (3´50мл). Промивають об'єднані органічні фази насиченим водним розчином NaCl (25мл), суша ть над MgSO4, фільтрують і концентрують. Очищають неочищений продукт (хроматографія на силікагелі, елюювання сумішшю 1:1 гексан: СН2СІ2), і одержують вказану в заголовку сполуку (1,586г, 46%). MS (ES): m/z=342 [М+Н]; т.пл. 88-90°С. 19 85505 20 [6-(2-трет-бутил-5-Феніл-3Н-імідазол-4-іл)-3нітропіридин-2-іл]-(2,2-диметилпропіл)амін Нагрівають суміш 1-[6-(2,2диметилпропіламіно)-5-нітропірвдин-2-іл]-2фенілетан-1,2-діону (1,0241г, 3,0ммоль), триметилацетальдегіду (0,66мл, 6,0ммоль), ацетату амонію (3,47г, 45ммоль) у АсОН (5мл/ммоль) при 80°С, контролюючи появу продукту рідинною хроматографією з мас-спектроскопією. Охолоджують реакційну суміш до 0°С і нейтралізують до рН7 5,0н. NaOH. Екстрагують нейтралізовану водну фазу EtOAc (3´20мл), і промивають об'єднані органічні фази порціями по 20мл насиченого водного розчину NaHCO3 до припинення подальшої нейтралізації. Сушать органічну фаз у над MgSO 4, фільтрують і концентрують. Розтирають неочищену оранжеву тверду речовину з EtOAc, і одержують вказану в заголовку сполук у (0,7578г, 62%). MS (ES): m/z=408 [М+Н]; т.пл. 224-226°С. Сполуки Підготовчих синтезів 2-21 можна одержати по суті, як описано у Підготовчому синтезі 1. Підготовчий синтез 22 6-[2-(2,6-дихлорфеніл)-5-феніл-1Н-імідазол-4іл]-N2-ізобутилпіридин-2,3-діамін До розчину {6-[2-(2,6-дихлорфеніл)-5-феніл1Н-імідазол-4-іл]-3-нітропіридин-2-іл}ізобутиламіну (1,43г, 2,96ммоль) у 50мл суміші (1:1) ТИF:вода додають дитіоніт натрію (2,58г, 14,82ммоль), а потім 32% NH4OH (9мл). Перемішують суміш при кімнатній температурі протягом 2год. Розводять EtOAc. Промивають органічний шар насиченим водним розчином NaCl, і сушать органічну фазу над Na2SO4. Концентрують розчин, і одержують вказану в заголовку сполук у (1,32г, 98%). Підготовчий синтез 23 2-ізобутиламіно-3-нітро-6-[3-(4-фторфеніл)-1морфоліноетилпіразол-4-іл]піридин 21 85505 2-ізобутиламіно-3-нітро-6-(4фтор фенілетанон)три дин До розчину 2-ізобутиламіно-3-нітро-6-(4фтор феніл)етинілпіридину (3,99г, 12,7ммоль) у 100мл МеОН додають водну суспензію HgO (0,55г, 2,54ммоль) у 100мл 4% H2SO4. Перемішують при 95°С протягом 17год і охолоджують до кімнатної температури. Фільтрують суміш через шар фільтрувальної речовини, і промивають осад EtOAc (5´100мл). Концентрують фільтрат, і промивають залишок сумішшю (10:2:1) гексан:діетиловий ефір:МеОН (130мл), одержуючи вказану в заголовку сполуку (2,60г, 62%). MS (ES): m/z=332 [M+H]. 2-ізобутиламіно-3-нітро-6-{3-(4оторфеніл)піразол-4-ілпіридин До розчину 2-ізобутиламіно-3-нітро-6-(4фтор феніл-етанон)-піридину (5,63г, 16,1ммоль) у 15мл безводного DMF додають диметилацеталь диметилформаміду (4,50мл, 33,8ммоль). Нагрівають суміш при 80°С протягом 6год, охолоджують до кімнатної температури і концентрують. Розчиняють залишок у 100мл ЕtOН, додають 8,30мл гідразину (80% у Н2О), перемішують протягом 2год і концентрують. Очищають залишок (хроматографія на силікагелі, елюювання сумішшю гексан: EtOAc, 1:1) і одержують вказану в заголовку сполук у (4,51г, 75%). MS (ES): m/z=356 [М+Н]. 2-ізобутиламіно-3-нітро-6-[3-(4-фторфеніл)-1морфоліноетилтразол-4-іл]-піридин Обробляють розчин 2-ізобутиламіно-3-нітро-6[3-(4-фторфеніл)піразол-4-іл]піридину (1,25г, 3,52ммоль) у безводному DMF (15мл) 95% NaH (0,36г, 14,3ммоль) при 0°С протягом 15хв. Додають гідрохлорид морфолiноетилхлориду (0,983г, 5,28ммоль) і повільно нагрівають до кімнатної температури. Через 1год додають додаткову кількість NaH (0,36г, 14,3ммоль), і перемішують реакційну суміш протягом 24год. Гасять суміш МеОН (1мл) і розводять водою (30мл). Екстрагують EtOAc (100мл), сушать екстракт над MgSO4 і концентрують. Очи щають залишок (хроматографія на силікагелі, елюювання сумішшю гексан:ЕtOАс, 1:2), і одержують вказану в заголовку сполуку (1,35г, 81%). MS (ES): m/z=469 [М+Н]. Підготовчий синтез 24 (2,2-диметилпропіл)-[3-нітро-6-(5-феніл-3Н[1,2,3]триазол-4-іл)-піридин-2-іл]амін До розчину 2,2-диметилпропіл-(2-нітро-5фенілетинілфеніл)аміну (0,153г) у DMSO (2,5мл) додають азид натрію (0,065г). Нагрівають суміш при 80°С протягом 2год. Охолоджують до кімнатної температури. Додають 10мл 1-н. розчин НСl, екстрагують EtOAc (20мл) і промивають насиченим водним розчином NaCl (2´10мл). Суша ть залишкову органічну фазу над Na2SO4 і концентрують. Очищають залишок (хроматографія на силікагелі, елюювання сумішшю гексан:ЕtOАс, 1:2), і одержують вказану в заголовку сполуку у вигляді жовтої твердої речовини (0,176г, 100%). MS (ES): m/z=353 [М+Н]. Підготовчий синтез 25 22 2-аміно-5-(2-оксо-2-фенілацетил)імідазо[4,5b]піридин-3-сульфонова кислота, диметиламід N,N-диметил-N'-(6-хлор-3-нітропіpидин-2іл)сульфонова кислота Перемішують суміш 2,6-ди хлор-3нітропіридину (1г, 2,60ммоль) та Ν,Νдиметилсульфаміду (0,78г, 3,12ммоль) у безводному DMF (5мл). Додають гідрид літію (0,11г, 6,76ммоль) і перемішують при кімнатній температурі протягом ночі. Додають 10мл води і 3-н. НСI до рН=7. Відфільтровують жовту тверду речовину, і одержують вказану в заголовку сполук у (85%). MS(ES): m/z=279 [М+Н]. N,N-диметил-N'-(3-нітро-6-фенілетинілпіридин2-іл)сульфонова кислота Продувають азот через суміш N,N-диметил-N'(6-хлор-3-нітропіридин-2-іл)сульфонової кислоти (3,86г, 13,7ммоль), фенілацетилену (2,3мл, 20,67ммоль), трифенілфосфіну (0,09г, 0,68ммоль) та йодиду міді (І) (0,06г, 0,34ммоль) у триетиламіні (30мл) та THF (60мл) протягом 3хв. Додають до суміші хлорид біс(трифенілфосфін)паладію (II) (0,24г, 0,34ммоль) і нагрівають при 110°С протягом 4год. Фільтрують суміш через шар фільтрувальної речовини і концентрують. Очищають залишок (хроматографія на силікагелі, елюювання сумішшю гексан:ЕtOАс, 1:1), і одержують вказану в заголовку сполуку (80%). MS(ES): m/z=346[M+H]. N,N-диметил-N'-(3-аміно-6фенілетинілпіридин-2-іл)сульфонова кислота Перемішують суміш N,N-диметил-N'-(3-нітро-6фенілетинілпіридин-2-іл)сульфонової кислоти (0,09г, 0,26ммоль) та дигідрату хлориду олова (0,35г, 1,56ммоль) в EtOAc (5мл) та EtOH (2,5мл) при 70°С протягом 2год. Концентрують, очищають залишок (хроматографія на силікагелі, елюювання сумішшю гексан:ЕtOАс, 1:1), і одержують вказану в заголовку сполуку (65%). MS(ES): m/z=317[M+H]. Диметиламід 2-аміно-5фенілетинілімідазо[4,5-b]піридин-3-сульФонової кислоти Перемішують суміш N,N-диметил-N'-(3-аміно6-фенілетинілпіридин-2-іл)сульфонової кислоти (0,20г, 0,63ммоль), бромціану (0,07г, 0,69ммоль) та метилату літію (0,04г, 0,94ммоль) у 1,2дихлоретані (20мл) при 80°С протягом ночі. Концентрують, очищають залишок (хроматографія на силікагелі, елюювання сумішшю гексан:ЕtOАс, 1:1), і одержують вказану в заголовку сполуку (45%). MS(ES): m/z=342 [М+Н]. Диметиламід 2-аміно-(2-оксо-2фенілацетил)імдазо[4,5-b]піридин-3-сульфонової кислоти До розчину NaHCO3 (0,01г, 0,15ммоль) та MgSO4 (0,07г, 0,62ммоль) у воді (4мл) при 0°С додають при механічному перемішуванні розчин диметиламіду 2-аміно-5-фенілетинілімідазо[4,5b]піридин-3-сульфонової кислоти (0,10г, 0,31ммоль) в ацетоні (4мл). Додають KМnО4 (0,12г, 0,748ммоль), і перемішують при 0°С протягом ночі. Додають Na2SO3 (0,13г), і перемішують протягом 1год. Додають EtOAc, промивають наси 23 85505 ченим водним розчином NaCl і концентрують, одержуючи вказану в заголовку сполуку у вигляді оранжевої твердої речовини, яку використовують без додаткового очищення (вихід 68%). MS(ES): m/z=372 [M+H]. Підготовчий синтез 26 {3-аміно-6-[2-(2,6-дифторфеніл)-5-феніл-3Німідазол-4-іл]піридин-2-іл}амід пропан-2сульфонової кислоти (3-нітро-6-фенілетинілпіридин-2-іл)амід пропан-2-сульфонової кислоти До розчину триетиламіну (25мл, 178,5ммоль) у безводному THF (25мл) додають (5-хлор-2нітрофеніл)амід пропан-2-сульфонової кислоти (10г, 35,7ммоль), фенілацетилен (5,9мл, 53,6ммоль) та трифенілфосфін (0,46г, 1,78ммоль), та продувають систему азотом. Додають до цієї суміші при перемішуванні дихлорбіс(трифенілфосфін)паладій (II) (0,625г, 0,89ммоль) та йодид міді (І) (0,17г, 0,89ммоль). Нагрівають реакційну суміш зі зворотним холодильником протягом 4год. Охолоджують до кімнатної температури і концентрують, одержуючи суспензію. Фільтрують неочищений матеріал через шар силікагелю, застосовуючи EtOAc як елюювальний розчинник. Концентрують фільтрат і кристалізують вказану в заголовку сполуку із суміші ЕtOАс-гексан (7,9г, 64%). MS(ES): m/z=346 [М+Н]. [3-нітро-6-(2-оксо-2-фенілацетил)піридин-2іл]амід пропан-2-сульфонової кислоти Нагрівають суміш (3-нітро-6фенілетинілпіридин-2-іл)аміду пропан-2сульфонової кислоти (1,8г, 5,26ммоль) та хлориду паладію (II) (0,93г, 0,53ммоль) у безводному DMSO (20мл) при 120°С протягом 12год в атмосфері азоту. Охолоджують до кімнатної температури, концентрують, одержуючи суспензію, і очищають (хроматографія на силікагелі, елюювання градієнтом від 20:80 ЕtOАс:гексан до 30:70 ЕtOАстексан), одержуючи вказану в заголовку сполуку (1,07г, 54%). MS (ES): m/z=346 [M+H]. {6-[2-(2,6-дифторфеніл)-5-феніл-3Н-імдазол-4іл]-3-нітропіридин-2-іл}амід пропан-2-сульфонової кислоти Нагрівають суміш [3-нітро-6-(2-оксо-2фенілацетил)піридин-2-іл]аміду пропан-2сульфонової кислоти (0,25г, 0,67ммоль), 2,6дифторбензальдегіду (0,146мл, 1,35ммоль) та ацетату амонію (0,78г, 10,05ммоль) в АсОН (5мл) при 110°С протягом 2год. Охолоджують до кімнатної температури і концентрують. Розводять EtOAc (30мл), екстрагують послідовно насиченим розчином NaHCO3 та насиченим водним розчином NaCl. Сушать органічний шар над Na2SO4, концентрують і очищають (хроматографія на силікагелі, елюювання сумішшю 30:70 ЕtOАстексан), одержуючи вказану в заголовку сполук у (0,32г, 95%). MS(ES): m/z=500 [M+H]. {3-аміно-6-[2-(2,6-дифторфеніл)-5-феніл-3Німдазол-4-іл]-піридин-2-іл}амід пропан-2сульфонової кислоти До розчину {6-[2-(2,6-дифторфеніл)-5-феніл3Н-імідазол-4-іл]-3-нітропіридин-2-іл}аміду пропан 24 2-сульфонової кислоти (0,33г, 0,66ммоль) у МеОН (10мл) додають при перемішуванні 10% Pd/C (0,033г). Додають частинами протягом 15хв боргідрид натрію (0,124г, 3,3ммоль) при перемішуванні в атмосфері азоту. Відфільтровують каталізатор, і концентрують. Розводять EtOAc (20мл) і екстрагують послідовно насиченим розчином NaHCO3 та насиченим водним розчином NaCl. Сушать органічний шар над Na2SO4 і концентрують, одержуючи вказану в заголовку сполук у (0,3г, 98%). MS (ES): m/z=410 [M+H]. Підготовчий синтез 27 {3-аміно-6-[2-(2,6-дихлорфеніл)-5-феніл-3Німідазол-4-іл]-піридин-2-іл}амід пропан-2сульфонової кислоти Нагрівають суміш {6-[2-(2,6-дихлорфеніл)-5феніл-3Н-імідазол-4-іл]-3-нітропіридин-2-іл}аміду пропан-2-сульфонової кислоти (0,262г, 0,49ммоль) та дигідрату хлориду олова (II) (0,55г, 2,46ммоль) в EtOH (10мл) при 100°С протягом 1год. Охолоджують до кімнатної температури і концентрують, одержуючи суспензію. Виливають реакційну суміш у насичений розчин NаНСО3 (20мл), і додають фільтрувальну речовину. Фільтрують і промивають EtOAc. Розділяють шари, і екстрагують органічний шар послідовно насиченим розчином NaHCO3 та насиченим водним розчином Nad Сушать органічний шар над Na2SO4 і концентрують, одержуючи вказану в заголовку сполук у (0,21г, 85%). MS(ES): m/z=504 [M+H]. Підготовчий синтез 28 1-бензил-2-метил-4-бром-5-(2,4дифторфеніл)-1Н-імідазол 1-бензил-2-метил-5-бром-1Н-імідазол До розчину 1-бензил-2-метил-1Н-імідазолу (8,0г, 46ммоль) у хлороформі (200мл) додають Nбромсукцинімід (7,85г, 44ммоль), і перемішують протягом 6год. Промивають насиченим водним розчином бікарбонату натрію та насиченим водним розчином NaCl, сушать над MgSO4 і фільтрують через шар силікагелю. Концентрують фільтрат, і суспендують залишок у діетиловому ефірі (600мл), нагрівають до кипіння і фільтрують у гарячому стані. Концентрують ефірний фільтрат, і одержують вказану в заголовку сполуку у вигляді жовтувато-коричневої твердої речовини (9,3г). MS (ES): m/z=252 [M+H]. 1-бензил-2-метил-5-(2,4-дифторфеніл)-1Німідазол Нагрівають суміш 1-бензил-2-метил-5-бром1Н-імідазолу (4,71г, 18,7ммоль), 2,4-дифторфеніл борної кислоти (6,92г, 43,8ммоль), біс(ацетато)біс(трифенілфосфін)-паладію (II) (1,4г, 1,875ммоль), 2-н. розчин Nа2СО3 (19мл, 38ммоль), МеОН (19мл) та 1,2-диметоксіетану (120мл) зі зворотним холодильником протягом 18год. Охолоджують до кімнатної температури. Додають воду та EtOAc, і розділяють шари. Сушать органічний шар над MgSO4, фільтрують і концентрують. Очищають залишок (хроматографія на силікагелі, елюювання сумішами EtOAc:CH2Cl2), і одержують бажану сполуку (3,59г). MS (ES): m/z=285 [М+Н]. Бромування 25 85505 Перемішують суміш 1-бензил-2-метил-5-(2,4дифторфеніл)-1Н-імідазолу (3,58г, 12,6ммоль) та N-бромсукциніміду (2,24г, 12,6ммоль) у хлороформі (100мл) при кімнатній температурі протягом 18год. Завантажують реакційну суміш безпосередньо в колонку із силікагелем і елююють сумішами СН2Сl2:ЕtOАс, одержуючи вказану в заголовку сполуку (3,41г). MS(ES): m/z=364 [M+H]. Підготовчий синтез 29 2-трет-бутил-4-(4-фторфеніл)оксазол Розчин наявного на ринку 2-бром-4'фторацетофенону (100,00г, 460ммоль) та 2,2 26 диметил-пропіонаміду (93,06г, 20ммоль) в 1,4діоксані (600мл) нагрівають зі зворотним холодильником протягом 2 діб. Відділяють осад фільтруванням, фільтрат концентрують, і очищають залишок (хроматографія на силікагелі, елюювання сумішшю гексан:ЕtOАс, 60:1), одержуючи вказану в заголовку сполуку (55г, 55%). MS(ES): m/z=220 [М+Н]. Сполуки Підготовчих синтезів 30-31 можна одержати по суті, як описано у Підготовчому синтезі 29. 1 Підготовчий синтез 32 2-трет-бутил-4-(4-фторфеніл)-5триметилстананілоксазол Розчиняють 2-трет-бутил-4-(4фтор феніл)оксазол (0,61г, 2,77ммоль) у THF (15мл) і додають трет-бутиллітій (3,3мл, 1,7М) при -78°С. Перемішують суміш протягом 45хв. Додають триметилстананілхлорид (0,58г, 2,90ммоль), і дають температурі піднятися до кімнатної температури. Перемішують протягом 2год, додають розчин хлориду амонію (200мкл, рН=8, встановлено розчином аміаку) і концентрують. Н ЯМР (CDCІ3) δ 7,46 (m, 2H), 6,95 (m, 2H), 1,32 (s, 9H), 0,24 (s, 9H). Підготовчий синтез 33 4-(4-фторфеніл)-2-метилтіазол Розчин 2-бром-4'-фторацетофенону (10г, 46ммоль) та тіоацетамід (6,9г, 92ммоль) в 1,4діоксані (60мл) нагрівають зі зворотним холодильником протягом 3год. Відділяють осад фільтруванням і промивають EtOAc, одержуючи вказану в заголовку сполуку (6,5г, 73%). MS (ES): m/z=194 [М+Н]. Сполуку Підготовчого синтезу 34 можна одержати по суті, як описано у Πідготовчому синтезі 33. Підготовчий синтез 35 Диметиламід 2-аміно-5-бромімідазо[4,5b]піридин-3-сульфонової кислоти 2,6-дибром-3-нітропіридин Суміш 2,6-дихлор-3-нітропіридину (9г) та бромистоводневої кислоти (90мл) в АсОН (30%) нагрівають при 50°С протягом ночі. Охолоджують до кімнатної температури і виливають у воду (600мл). Відділяють тверду речовину фільтруванням, і одержують вказану в заголовку сполуку (87%). 1 Н ЯМР (CDCІ3) δ 7,93 (d, J=8,14Гц, 1H), 7,55 (d, J=8,14Гц, 1H). N,N-диметил-N'-(6-бром-3-нітропіридин-2іл)сульфонова кислота Перемішують суміш 2,6-дибром-3нітропіридину (11,3г, 39,25ммоль) та Ν,Νдиметилсульфаміду (0,006г, 47,10ммоль) у DMF (40мл). Додають гідрид літію (0,81г, 102,05ммоль), і перемішують при кімнатній температурі протягом ночі. Додають 100мл води та 3-н. НСI до рН=7. Відділяють фільтруванням жовту тверду речовину, і одержують вказану в заголовку сполук у (93%). 1 H ЯМР (DMSO-d6) δ 10,25 (br s, 1H), 8,41 (d, J=8,59Гц, 1H), 7,50 (d, J=8,59Гц, 1H), 2,95 (2, 6H). N,N-диметил-N'-(3-аміно-6-бром-піридин-2-іл)сульфонова кислота Нагрівають суміш N,N-диметил-N'-(6-бром-3нітропіридин-2-іл)сульфонової кислоти (11,6г, 35,69ммоль) та хлориду олова (40г, 178ммоль) у суміші EtOA:EtOH (500:250мл) протягом 4год. Концентрують і очищають залишок (хроматографія на силікагелі, елюювання сумішшю гексан:EtOAс, 1:1). Розчиняють із водою, і одержують вказану в заголовку сполуку (85%). MS (ES): m/z=297 [М+Н]. Диметиламід 2-аміно-5-бромімідазо[4,5b]піридин-3-сульфонової кислоти Перемішують суміш N,N-диметил-N'-(3-аміно6-бромпіридин-2-іл)сульфонової кислоти (0,40г, 1,35ммоль), бромціану (0,08г, 1,48ммоль) та метилату літію (0,08г, 2,02ммоль) у 1,2-дихлоретані (400мл). Перемішують при 80°С протягом 2год. Концентрують, і очи щають залишок (хроматографія на силікагелі, елюювання сумішшю гексан:EtOAc, 1:1), одержуючи вказану в заголовку сполуку (82%). MS(ES): m/z=322 [М+Н]. Підготовчий синтез 36 1-[2-аміно-3-(2,2-диметил-пропіл)-3Нгімідазо[4,5-b]піридин-5-іл]-2-(2,4-дифтор-феніл)етан-1,2-діон 5-(2,4-дифтор-фенілетиніл)-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]-піридин-2-іламін 27 85505 Змішують 5-бром-3-(2,2-диметил-пропіл)-3Німідазо[4,5-b]піридин-2-іламін (30,00г, 105,94ммоль), Et3N (60мл) та Pd(OAc)2[P(Ph) 3]2 (3,97г, 5,30ммоль) у толуолі (150мл), і нагрівають одержану суміш до приблизно 65°С в атмосфері азоту. Додають до цієї суміші краплями 1-етиніл2,4-дифторбейзол (21,95г, 158,92ммоль) у толуолі (30мл), а потім нагрівають одержану реакційну суміш при 80°С протягом 3год. Охолоджують реакційну суміш до 25°С і гасять насиченим водним розчином NH4CI (300мл). Перемішують одержану реакційну суміш при кімнатній температурі протягом 20хв, потім фільтрують, промивають тверду речовину Η2Ο і сушать на фільтрі в умовах вакуумфільтрування протягом 30хв. С успендують тверду речовину у МТВЕ (200мл), потім фільтрують і промивають МТВЕ (50мл). Сушать одержану тверду речовину в умовах вакуум-фільтрування, і одержують 14,47г вказаної в заголовку сполуки у вигляді світло-жовтої твердої речовини. MS(ES+): m/z=34l (M+1). Окиснення Додають до розчину 5-(2,4-дифторфенілетиніл)-3-(2,2-диметил-пропіл)-3Німідазо[4,5-b]піридин-2-іламіну (14,47г, 42,51ммоль) в ацетоні (350мл) розчин MgSO4 (10,23г, 85,00ммоль) та NaHCO3 (1,79г, 21,30ммоль) у воді (200мл). Занурюють колбу з одержаною реакційною сумішшю у водяну баню. Додають целіт (28,50г), а потім KМnО4 (14,11г, 89,28ммоль) протягом 10хв, при цьому температура підвищується приблизно до 30°С внаслідок екзотермічної реакції. Перемішують при кімнатній температурі протягом 3год, потім гасять 10% (мас.) водним розчином Na2SO3 (150мл). Перемішують протягом 30хв, потім фільтрують через шар целіту, промиваючи сумішшю 10% MeOH/EtOAc (2´700мл). Розділяють шари фільтрату, і екстрагують водний шар EtOAc (2x500мл). Промивають об'єднані органічні фази водою (500мл) і насиченим водним розчином хлориду натрію (500мл), сушать над Na2SO4, фільтрують і концентрують під зниженим тиском, одержуючи тверду речовину. Промивають фільтрувальний шар целіту сумішшю 10% MeOH/EtOAc, і концентрують фільтрат під зниженим тиском, одержуючи додаткову кількість твердого продукту. Об'єдн ують тверді продукти і очищають їх хроматографією на колонці, елююючи сумішшю 2% 2-н. NH4/MeOH в EtOAc, а потім 5% 2-н. NH4/MeOH в EtOAc, і одержують 13,08г (вихід 82%) вказаної в заголовку сполуки у вигляді оранжево-коричневої твердої речовини. MS(ES+): m/z=373(M+1). Підготовчий синтез 37 28 {6-[2-трет-бутил-5-(4-фтор-феніл)-3Н-імідазол4-іл]-3-нітро-піридин-2-іл}-(1(R),2,2-триметилпропіл)-амін 1-[6-(1(R'),2,2-триметилпропіламіно)-5нітропіридин-2-іл]-2-((4-фторфеніл)eтан-1,2-діон Розчиняють [6-(4-фтор-фенілетиніл)-3-нітропіридин-2-іл]-(1(R),2,2-триметил-пропіл)-амін (2,73г, 8,00ммоль) в ацетоні (60мл). Додають воду (20мл), потім NaHCO3 (336мг, 4ммоль, 0,5екв.) та MgSO4 (1,9г, 16ммоль, 2,0екв.), і охолоджують реакційну суміш приблизно до 3°С. Додають частинами KМnО4 (2,5г, 16ммоль, 2,0екв.) при інтенсивному перемішуванні, підтримуючи температуру нижче 3°С. Через 1-2год гасять реакцію шляхом додавання води (20мл) та Na2SO3 (4,5г, 36ммоль), і перемішують суміш при кімнатній температурі протягом 1год. Фільтрують суспензію через шар целіту, застосовуючи 600мл етилацетату та приблизно 300мл води. Розділяють шари, і промивають органічний шар чотири рази насиченим водним розчином NaHCO3 та двічі насиченим водним розчином NaCl. Сушать органічний шар над Na2SO4, відфільтровують тверду речовину, та концентрують надосадову рідину під зниженим тиском. Піддають залишок хроматографії на силікагелі під помірним тиском з градієнтним елююванням 50-70% СН2СІ2 у гексані, і одержують бажану сполуку у вигляді оранжевого масла (1,82г, вихід 61%). MS(ESI): m/z=374,1 (М+Н)+. Циклізація Розчиняють 1-[6-(1(R),2,2триметилпропіламіно)-5-нітропіридин-2-іл]-2-((4фтор феніл)етан-1,2-діон (747мг, 2,0ммоль) у льодяній оцтовій кислоті (10мл), додають ацетат амонію (2,3г, 30ммоль, 15екв.), а потім додають триметилацетальдегід (344мг, 4,0ммоль, 2екв.). Нагрівають реакційну суміш при 100°С протягом 1год і концентрують під зниженим тиском. Розподіляють одержану тверду речовину між етилацетатом та водою. Промивають органічний шар 5 разів насиченим водним розчином NaHCO3 та двічі насиченим водним розчином NaCl. Сушать органічний шар над Na2SO4, фільтрують і концентрують під зниженим тиском. Піддають залишок хроматографії на силікагелі під помірним тиском з ізократичним елююванням сумішшю 10% етилацетат/гексан, і одержують вказану в заголовку сполуку у вигляді оранжевої твердої речовини. (589мг, вихід 67%). MS(ESI): m/z=440,2 (M+H)+. Сполуки Підготовчих синтезів 38-40 можна одержати по суті, як описано у Підготовчому синтезі 37. 29 85505 Підготовчий синтез 41 {6-[2-тpет-бутил-5-(4-фтор-феніл)-3Н-імідазол4-іл]-3-нітро-піридин-2-іл}-(2,2-диметил-пропіл)амін Розчиняють 1-(4-фтор-феніл)-2-[5-нітро-6-(2,2диметилпропіламіно)-піридин-2-іл]-етан-1,2-діон (1,08г, 3,0ммоль) у льодяній оцтовій кислоті, додають ацетат амонію (3,47г, 45ммоль, 15екв.), а потім додають триметилацетальдегід (517мг, 6,0ммоль, 2екв.). Нагрівають реакційну суміш при 100°С протягом 1год і концентрують під зниженим тиском. Розподіляють одержану тверду речовину між етилацетатом та водою. Додають NаНСО3 до припинення вивільнення газу. Промивають органічний шар 5 разів насиченим водним розчином NaHCO3 та один раз насиченим водним розчином NaCl. Сушать органічний шар над Na2SO4, фільтрують і концентрують під зниженим тиском, одержуючи вказану в заголовку сполуку у вигляді оранжево-жовтої твердої речовини (1,25г, вихід 97%). Точна MS: обчислено: m/z=426,230 (М+Н)+; знайдено: m/z=426,2313 (М+Н)+. Приклад 1 5-(2-трет-бутил-5-феніл-3Н-імідазол-4-іл)-3(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2іламін, метансульфонат 30 Перемішують суспензію 6-(2-трет-бутил-5феніл-3Н-імідазол-4-іл)-3-нітропіридин-2-іл]-(2,2диметилпропіл)аміну (0,20г, 0,5ммоль) та 10% паладію на вугіллі (0,025г) в EtOH (10мл) в атмосфері водню (еластична камера) протягом ночі. Фільтрують суспензію через шар фільтрувальної речовини і промивають EtOH (2´5мл). Концентрують фільтрат до об'єму приблизно 5мл і обробляють при кімнатній температурі бромціаном (1,3ммоль). Гасять насиченим водним розчином бікарбонату натрію (2мл) і перемішують протягом 15-60хв. Розводять суміш водою (5мл), і екстрагують СН2СІ2 (2´10мл). Промивають об'єднані органічні фази насиченим водним розчином NaCl (5мл), сушать над MgSO4, фільтрують, концентрують, і очищають залишок (хроматографія на силікагелі, елюювання ступінчастим градієнтом від 100% СН2СІ2 до 5:95 розчину аміаку в МеОН:СН2СІ2), одержуючи бажану сполуку. Виділяють вільну основу, і потім перетворюють її у метансульфонат шля хом оброблення метансульфоновою кислотою у метанольноводному розчині з подальшою ліофілізацією з одержанням вказаної в заголовку сполуки. MS (ES): m/z=402 [M+H]. Сполуки Прикладів 2-14 можна одержати по суті, як описано у Прикладі 1. 31 85505 Приклад 15 3-циклопропілметил-5-[2-(2,6-дихлорфеніл)-5(4-фторфеніл)-3Н-імідазол-4-іл]-3Н-імідазо[4,5b]піридин-2-іламін, метансульфонат До суспензії (циклопропілметил{6-[2-(2,6дихлорфеніл)-5-(4-фторфеніл)-3Н-імідазол-4-іл]-3нітропіридин-2-іл}аміну (0,250г, 0,5ммоль) в EtOH (10мл) додають дигідрат дихлориду олова (0,5641г, 2,5ммоль), і нагрівають суміш зі зворотним холодильником в атмосфері азоту протягом 2,5год. Охолоджують до кімнатної температури і повільно гасять насиченим водним розчином NaHCO3 (5мл) та EtOAc (5мл). Додають до одержаної суспензії фільтрувальний агент, і додатково розводять суміш водним розчином NaHCО3 та EtOAc (по 5мл кожного). Фільтрують суміш через шар фільтрувальної речовини. Промивають тверду речовину водним розчином NaHCО3 та EtOAc (по 10мл кожного). Розділяють шари, і екстрагують водну фаз у EtOAc (10мл). Промивають об'єднані органічні фази насиченим водним розчином NaCl 32 (5мл), сушать над MgSO4 , фільтр ують і концентрують. Розчиняють неочищений фенілендіамін в EtOH (5мл) і обробляють бромціаном (1,0ммоль). Гасять насиченим водним розчином NаНСО3 (2мл) та перемішують протягом 15-60хв. Розводять суміш водою (5мл) і екстрагують СН 2Сl2 (2´10мл). Промивають об'єднані органічні фази насиченим водним розчином NaCl (5мл), сушать над MgSO4, фільтрують, концентрують, і очищають залишок (хроматографія на силікагелі, елюювання ступінчастим градієнтом від 100% СН2Сl2 до 5:95 розчину аміаку в МеОН:СН 2Сl2), одержуючи бажану сполуку. Виділяють вільну основу і потім перетворюють її у метансульфонат шляхом оброблення метансульфоновою кислотою у метанольноводному розчині з подальшою ліофілізацією. MS (ES): m/z=495,1 [М+Н]. Сполуки Прикладів 16-35 можна одержати по суті, як описано у Прикладі 15 33 85505 34 Приклад 36 5-[2-трет-бутил-5-(4-фторфеніл)-3Н-імідазол-4іл]-3-(2,2-диметилпропіл)-2-метил-3Н-імідазо[4,5b]піридин, метансульфонат Відновлюють та виділяють {6-[2-трет-бутил-5(4-фторфеніл)-3Н-імідазол-4-іл]-3-нітропіридин-2іл}-(2,2-диметилпропіл)амін (0,43г; 1,0ммоль), як описано у Прикладі 1. Проводять реакцію неочищеного діаміну з нерозбавленим триетилортоацетатом при 120°С протягом ночі. Концентрують суміш і розводять її 15мл 1-н. розчином НСl. Нейтралізують суміш насиченим водним розчином NaHCO3 і екстрагують СН2СІ2. Промивають органічний шар насиченим водним розчином NaCl, сушать над Na2SO4, концентрують, і очищають залишок (хроматографія на силікагелі, елюювання сумішшю EtOAc:CH 2Cl2, 50:50), одержуючи вказану в заголовку сполуку у вигляді жовтува токоричневої твердої речовини (0,11г; вихід 53%). Вільну основу перетворюють у метансульфонат, як описано у Прикладі 1. MS (ES): m/z=420 [М+Н]. Сполуки Прикладів 37-38 можна одержати по суті, як описано у Прикладі 36. Приклад 39 5-[2-(2,6-дифторфеніл)-5-феніл3Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-2-метил3Н-імідазо[4,5-b]піридин, метансульфонат Відновлюють {6-[2-(2,6-дифторфеніл)-5-феніл3Н-імідазол-4-іл]-3-нітропіридин-2-іл}-(2,2диметилпропіл)амін, як описано у Прикладі 15, а потім проводять реакцію цього діаміну у триметилортоацетаті, як описано у Прикладі 36, одержую чи вільну основу у вигляді жовтувато-коричневої твердої речовини (0,11г; ви хід 49%). Метансульфонат цієї вільної основи одержують, як описано у Прикладі 1. MS (ES): m/z=458 [M+H]. Сполуки Прикладів 40-45 можна одержати по суті, як описано у Прикладі 39 35 85505 36 Приклад 46 5-[2-(2-хлор-6-фторфеніл)-5феніл-3Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Німідазо[4,5-b]піридин метансульфонат Відновлюють {6-[2-(2-хлор-6-фторфеніл)-5феніл-3Н-імідазол-4-іл]-3-нітропіридин-2-іл}-(2,2диметилпропіл)амін, як описано у Прикладі 15. Проводять реакцію цього діаміну з нерозбавленим триетилортоформіатом при нагріванні зі зворот ним холодильником протягом 24год та при кімнатній температурі протягом ще 24год. Очищають, та виділяють вільну основу, як описано у Прикладі 36 (0,11г, вихід 49%). Перетворюють цю вільну основу у метансульфонат, як описано у Прикладі 1. MS(ES): m/z=460[M+H]. Сполуки Прикладів 47-48 можна одержати по суті, як описано у Прикладі 46. Приклад 49 5-[3-(4-фторфеніл)-1-ізопропілпіразол-4-іл]-3Н3-ізобутилімідазо-[4,5-b]піридин-2-іламін, диметансульфонат До розчину 2-ізобутиламіно-3-нітро-6-[3-(4фтор феніл)-1-ізопропілпіразол-4-іл]піридину (0,50г, 1,27ммоль) у 25мл суміші THF:H2O (1:1) додають у присутності NH4OH (8,70мл, 32% у H2О) гідросульфіт натрію (2,55г, 14,6ммоль). Через 2год розводять суміш водою (25мл). Екстрагують EtOAc (100мл), суша ть екстракт над MgSO4 і концентрують. Розчиняють залишок у суміші (1:1) CH2Cl2:EtOH (25мл), додають бромціан (0,16г, 1,51ммоль), і перемішують протягом приблизно 48год. Концентрують, і очищають залишок (хроматографія на силікагелі, елюювання сумішшю EtOAc:MeOH, 16:1). Перекристалізовують продукт із суміші діетилового ефіру з гексаном, і одержують вільну основу (0,44г, 88%). Вільну основу перетворюють у метансульфонат, як описано у Прикладі 1 (вихід 58%). MS (ES): m/z=W [M+H]. Сполуки Прикладів 50-62 можна одержати по суті, як описано у Прикладі 40 37 85505 38 Приклад 63 N'-{5-[2-(2,6-дифторфеніл)-5-феніл-3Німідазол-4-іл]-3-ізобутил-3Н-імідазо[4,5-b]піридин2-іл}-N,N-диметилформамідин Суміш N'-{5-[2,6-дифторфеніл)-5-феніл-3Німідазол-4-іл]-3-ізобутил-3Н-імідазо[4,5-b]піридин2-іламіну, одержаного, як описано у Прикладі 1 (0,10г, 0,225ммоль), та диметилацеталю Ν,Νдиметилформаміду (0,05мл, 0,4ммоль) у толуолі (1,5мл) нагрівають зі зворотним холодильником протягом 2год. Охолоджують до кімнатної температури і концентрують. Очи щають залишок (хроматографія на силікагелі, елюювання сумішшю СН2СІ2:ацетонітрил, 1:1), і одержують вказану в заголовку сполуку (0,11г). MS (ES): m/z=500 [M+H]. Сполуку Прикладу 64 можна одержати по суті, як описано у Прикладі 63. Приклад 65 N'-{5-[2-(2,6-дихлорфеніл)-3-метил-5-феніл3Н-імідазол-4-іл]-3-ізобутил-3Н-імідазо [4,5b]піридин-2-іл}-Ν,Ν-диметилформамідин Перемішують N'-{5-[2-(2,6-дихлорфеніл)-5феніл-3Н-імідазол-4-іл]-3-ізобугал-3Н-імідазо[4,5b]піридин-2-іл}-N,N-диметилформамідин, одержаний, як описано у Прикладі 63 (0,10г, 0,188ммоль), йодметан (0,040г, 0,282ммоль) та Cs 2CO3 (0,09г, 0,28ммоль) у DMF" (1,5мл) при кімнатній температурі протягом приблизно 24год. Екстрагують суміш EtOAc і промивають водою (тричі), насиченим водним розчином NaCl, після чого сушать над Na2SO4. Фільтрують і концентрують, одержуючи суміш ізомерних метилових похідних сполук. Очищають (хроматографія на силікагелі, елюювання сумішшю СН2Сl2:ацетонітрил:гексан, 1:1:0,4), і одержують вказану в заголовку сполук у (0,02г). MS(ES): m/z=54S [M+H]. Приклад 66 5-[2-(2,6-дифторфеніл)-3-метил-5-феніл-3Німідазол-4-іл]-3-ізобутил-3Н-імідазо[4,5-b]піридин2-іламін Нагрівають N’-{5-[2-(2,6-дифторфеніл)-3метил-5-феніл-3Н-імідазол-4-I іл]-34зобутил-3Німідазо[4,5-b]піридин-2-іл}-N,Nдиметилформамідин (0,02г, 0,04моль) у суміші (1:1) льодяної оцтової кислоти з концентрованою НСl (0,6мл) при 100°С протягом 30хв. Охолоджують до кімнатної температури. Додають СН2Сl2 та воду, нейтралізують 5-н. NaOH приблизно до рН=7 при інтенсивному перемішуванні. Екстрагують водну фазу тричі СН 2Сl2, об'єдн ують органічні шари, промивають насиченим водним розчином NaCl і сушать над Na2SO4. Фільтрують і концентрують, одержуючи вказану в заголовку сполуку (0,02г). MS (ES): m/z=459 [М+Н]. Сполуку Прикладу 67 можна одержати по суті, як описано у Прикладі 66. 39 85505 40 Приклад 68 3-(2,2-диметилпропіл)-5-(5-феніл-3Н[1,2,3]триазол-4-іл)-3Н-імідазо-[4,5-b]піридин-2іламін, метансульфонат Суспендують (2,2-диметил-пропіл)-[3-нітро-6(5-феніл-3Н-[1,2,3]-триазол-4-іл)піридин-2-іл]амін (0,180г, 0,51ммоль) та 10% Pd/C (0,025г) в EtOH (10мл) і перемішують при кімнатній температурі в атмосфері водню (застосовуючи еластичну камеру) протягом 5год. Фільтрують реакційну суміш із застосуванням фільтрувальної речовини і концентрують приблизно до половинного об'єму. Одержаний діамін (MS (ES): m/z 323 [М+Н]) одразу ж застосовують без додаткового виділення та очищення і обробляють його бромціаном (0,09г) в EtOH (5мл). Перемішують в атмосфері азоту протягом 3,5год, гасять насиченим водним розчином NaHCO3 (2,0мл), перемішують, розводять СН 2СІ2 (5мл) та Н2О (5мл), і розділяють фази. Водну фазу екстрагують СН 2СІ2 (2´5мл), промивають об'єднані органічні фази Н 2О та насиченим водним розчином NaCl (по 5мл кожного) і сушать над MgSO4. Фільтрують і концентрують. Очищають залишок (хроматографія на силікагелі, елюювання сумішшю 2,0-н. розчин аміаку у МеОН :СН 2СІ2, 4:96), і одержують вільну основу. Перетворюють її у метансульфонат шляхом оброблення метанольноводним розчином метансульфонової кислоти та подальшої ліофілізації, і одержують вказану в заголовку сполуку (0,07г, 39%). MS (ES): m/z=348 [М+Н]. Сполуки Прикладів 69-71 можна одержати по суті, як описано у Прикладі 68. Приклад 72 5-[2-(2-хлор-6-фторфеніл)-5-феніл-1Німідазол-4-іл]-3-ізобутил-3Н-[1,2,3]триазоло[4,5b]піридин, метансульфонат До розчину нітриту натрію у воді (0,1мл) (0,184г, 2,66ммоль) додають краплями розчин 6-[2(2-хлор-6-фторфеніл)-5-феніл-1Н-імідазол-4-іл]N2-ізобутилпіридин-2,3-діаміну (1,1г, 2,52ммоль) у СН2Сl2 (9мл) та 50% водному АсОН (9мл). Перемішують реакційну суміш протягом 15хв, додають додаткову кількість СН2СІ2, і промивають органічний шар насиченим водним розчином NaCl, водним розчином NaНСО3 (5%), сушать над MgSO 4 і концентрують. Очищають залишок (хроматографія на силікагелі, елюювання сумішами гексан:ЕtOАс, від 4:1 до 1:2), і одержують вільну основу (70%). MS (ES): m/z=447 [М+Н]. До розчину вільної основи (0,15г, 0,336ммоль) у 10мл суміші СН 2Сl2:МеOН (9:1) додають 0,34мл 1М розчину метансульфонової кислоти у суміші СН2СІ2:МеОН (9:1). Перемішують розчин протягом 5хв, концентрують, і розтирають одержану тверду речовину з діетиловим ефіром. Відділяють тверду речовину фільтруванням, і одержують вказану в заголовку сполуку (71%). MS (ES): m/z=447 [М+Н]. Сполуки Прикладів 73-75 можна одержати по суті, як описано у Прикладі 72. Приклад 76 Диметиламід 2-аміно-5-(2-трет-бутил-5-феніл3Н-імідазол-4-іл)імідазо-[4,5-b]піридин-3сульфонової кислоти, метансульфонат Нагрівають суміш диметиламіду 2-аміно-5-(2оксо-2-фенілацетил)-імідазо-[4,5-b]піридин-3сульфонової кислоти (0,07г, 0,20ммоль), триме тил-ацетальдегіду (65мкл, 0,6ммоль) та ацетату амонію (0,23г, 3ммоль) у АсОН (5мл) при 90°С протягом 4год. Охолоджують до кімнатної температури. Розводять насиченим водним розчином NaHCO3 та екстрагують EtOAc. Концентрують органічну фаз у, очи щають залишок (хроматографія на силікагелі, елюювання сумішшю СН 2Cl2:МеОН, 41 85505 42 15:1), і одержують вільну основу (35%). MS (ES): m/z=438 [М+Н]. До розчину вільної основи (0,02г, 0,054ммоль) у 5мл суміші СН 2Сl2:МеОН (95:5) додають 5,4мкл 1Μ розчину метансульфонової кислоти у суміші СН 2СІ2:МеОН (95:5) Перемішують розчин протягом 5хв, концентрують, і розтирають одержану тверду речовину з діетиловим ефіром. Відділяють тверду речовину фільтруванням, і одержують вказану в заголовку сполуку (71%). MS (ES): m/z=440 [М+Н]. Сполуки Прикладів 77-79 можна одержати по суті, як описано у Прикладі 76 Приклад 80 5-[2-(2,6-дифторфеніл)-5-феніл-3Н-імідазол-4іл]-3-(пропан-2-сульфоніл)-3Н-імідазо[4,5b]піридин-2-іламін, метансульфонат Перемішують суміш {3-аміно-6-[2-(2,6дифторфеніл)-5-феніл-3Н-імідазол-4-іл]-піридин-2іл}-аміду пропан-2-сульфонової кислоти (0,37г, 0,79ммоль), бромціану (0,104г, 0,99ммоль) та метилату лі тію (0,033г, 0,87ммоль) у дихлорметані (10мл) протягом 12год при кімнатній температурі. Додають насичений водний розчин NaHCO3 (10мл), і перемішують протягом 1год. Розділяють шари, і екстрагують органічний шар насиченим водним розчином NaCl. Сушать органічний шар над Na2SO4, концентрують, очищають залишок (хроматографія на силікагелі, градієнтне елюювання сумішами ЕtOАс:гексан, від 40:60 до 80:20), і одержують вільну основу (0,21г, 54%). MS (ES): m/z=495 [М+Н]. До розчину вільної основи в 1мл суміші метанол:дихлорметан (5:1) додають метансульфонову кислоту. Концентрують одержаний розчин, і додають діетиловий ефір. Відділяють тверду речовину фільтруванням і сушать, одержуючи вказану в заголовку сполуку. MS (ES): m/z=495 [M+H]. Сполуки Прикладів 81-91 можна одержати по суті, як описано у Приклад 80. 43 85505 44 Приклад 92 5-[2-трет-бутил-4-(4-фторфеніл)оксазол-5-іл]3-ізобутил-3Н-імідазо-[4,5-b]піридин-2-іламін Суспензію 2-трет-бутил-4-(4фтор феніл)оксазолу (0,145г, 0,66ммоль), 5-бром3-ізобутил-3Н-імідазо[4,5-b]піридин-2-іламіну (0,355г, 1,32ммоль), карбонату цезію (6,06г, 18,6ммоль), ацетату паладію (II) (0,201г, 10%) та трифенілфосфіну (0,14г, 0,07ммоль) у D MF (1,5мл) продувають азотом. Нагрівають реакційну суміш при 100°С протягом ночі, охолоджують до кімнатної температури і розподіляють між EtOAc та на сиченим водним розчином NaCl. Промивають органічний шар насиченим водним розчином NaCl. Сушать органічний шар над Na2SО4, фільтрують, концентрують, і очищають залишок (хроматографія на силікагелі, елюювання сумішшю 2% 2Μ розчин аміаку/МеОН у СН2СІ2), одержуючи вказану в заголовку сполуку (0,07г, 34%). MS(ES): m/z=408 [M+H]. Сполуки Прикладів 93-96 можна одержати по суті, як описано у Прикладі 92, з перетворенням вільних основ у метансульфонати, як описано ν Прикладі 1. Приклад 97 2-аміно-5-(2-трет-бутил-5-(4фтор феніл)оксазол-5-іл)імідазо[4,5-b]піридин-3сульфонова кислота, диметиламід Розчиняють диметиламід 2-аміно-5бромімідазо[4,5-b]піридин-3-сульфонової кислоти (0,05г, 0,156ммоль) у толуолі (3мл) в закритій трубці. Додають 2-трет-бутил-4-(4-фтор феніл)-5триметилстананілоксазол (0,07г, 0,17ммоль) та тетракіс(трифенілфосфін)паладій (0) (0,02г, 0,015ммоль). Нагрівають суміш при 110°С протягом 4год. Концентрують, і очищають залишок (хроматографія на силікагелі, елюювання сумішшю СН2СІ2:МеОН, 20:1), одержуючи вказану в заголовку сполуку. (14%). MS (ES): m/z=459 [M+H]. Сполуку Прикладу 98 можна одержати по суті, як описано у Прикладі 97, з перетворенням вільної основи у метансульфонат, як описано у Прикладі 1. Приклад 99 5-[2-(2,6-дихлор-феніл)-5-(4-фтор-феніл)-1Німідазол-4-іл]-3-(2,2-диметил-пропіл)-3Німідазо[4,5-b]піридин-2-іламін, метансульфонат Змішують 1-[2-аміно-3-(2,2-диметил-пропіл)3Н-імідазо[4,5-b]піридин-5-іл]-2-(4-фтор-феніл)етан-1,2-діон (19,58г, 55,24ммоль), 2,6-дихлорбензальдегід (15,47г, 88,39ммоль) та NH4OAc (42,58г, 552,41ммоль) у льодяній оцтовій кислоті (200мл), і перемішують при 85°С в атмосфері азоту протягом 5год. Концентрують одержану реакційну суміш під зниженим ψ тиском. Розчиняють залишок в етилацетаті (2000мл), і промивають одержаний розчин двічі насиченим водним розчином бікарбонату натрію (2´1000мл), водою (1000мл) та насиченим водним розчином хлориду натрію (1000мл). Сушать органічну фазу над MgSО4 , фільтрують і концентрують під зниженим тиском. Очищають одержаний продукт хроматографією на колонці, елююючи сумішшю етилацетат-гексан (1:1), потім сумішшю етилацетат-гексан (2:1), потім чистим етилацетатом, а потім 5% 2-н. розчину NH3/МеОН в етилацетаті, і одержують 11,70г (вихід 41,5%) 5-[2-(2,6-дихлор-феніл)-5-(4фтор-феніл)-1Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламіну у вигляді злегка забарвленої твердої речовини. MS (ES+): m/z=509 (M+1). Перемішують 5-[2-(2,6-дихлор-феніл)-5-(4фтор-феніл)-1Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламін (11,20г, 21,99ммоль) у метанолі (150мл), а потім додають краплями розчин метансульфонової кислоти (2,11г, 21,96ммоль) у метанолі (10мл). Перемішують при кімнатній температурі протягом 20хв і концентрують під зниженим тиском. Додають етилацетат (150мл), фільтрують одержану суспензію, і промивають осад на фільтрі діетиловим ефіром (200мл). Сушать одержану тверду речовину у сушильній шафі при 80°С під лабораторним вакуумом протягом 2год, і одержують 12,765г (вихід 45 85505 95%) вказаної в заголовку сполуки у вигляді світло-пурпурової твердої речовини. 1 H-ЯМР (400 МГц; CD3OD): δ 7,78-7,50 (m, 7H), 7,24-7,20 (m, 2H), 3,86 (s, 2H), 2,70 (s, ЗН), 0,85 (s, 9H). TOF-MS [ES+, M+H]. Знайдено: m/z 509,1412, обчислено: m/z 509,1423. Приклад 100 3-(2,2-диметил-пропіл)-5-[5-(4-фтор-феніл)-2(2-фтор-6-трифторметил-феніл)-1Н-імідазол-4-іл]3Н-імідазо[4,5-b]піридин-2-іламін, метансульфонат Змішують 1-[2-аміно-3-(2,2-диметил-пропіл)3Н-імідазо[4,5-b]піридин-5-іл]-2-(4-фтор-феніл)етан-1,2-діон (18,32г, 51,69ммоль), 2-фтор-6трифторметил-бензальдегід (15,00г, 78,08ммоль) та NH4OAс (39,84г, 516,90ммоль) у льодяній оцтовій кислоті (200мл) і перемішують при 85°С в атмосфері азоту протягом 4год. Концентрують одержану реакційну суміш під зниженим тиском. Розчиняють залишок в етилацетаті*(2000мл), і промивають одержаний розчин двічі насиченим водним розчином бікарбонату натрію (2´1000мл), водою (1000мл) та насиченим водним розчином хлориду натрію (1000мл). Сушать органічну фазу над MgSО4 , фільтрують і концентрують під зниженим тиском. Очищають одержаний продукт хроматографією на колонці, елююючи чистим етилацетатом, потім 2% 2-н. розчину NН3/МеОН в етилацетаті, а потім 5% 2-н. розчину NH 3/MeOH в етилацетаті, і одержують 7,38г 3-(2,2-диметилпропіл)-5-[5-(4-фтор-феніл)-2-(2-фтор-6трифторметил-феніл)-1Н-імідазол-4-іл]-3Німідазо[4,5-b]піридин-2-іламіну у вигляді злегка забарвленої твердої речовини. Очищають забруднені фракції хроматографією на колонці, елююючи чистим етилацетатом, потім 1% 2-н. розчину NH3/МеОН в етилацетаті, потім 2% 2-н. розчину NH3/МеОН в етилацетаті, а потім 3% 2-н. розчину NH3/МеОН в етилацетаті, і одержують додатково 4,68г бажаної сполуки. MS(ES+): m/z=527 (M+1). Перемішують 3-(2,2-диметил-пропіл)-5-[5-(4фтор-феніл)-2-(2-фтор-6-трифторметил-феніл)1Н-імідазол-4-іл]-3Н-імідазо[4,5-b]піридин-2-іламін (11,56г, 21,95ммоль) у метанолі (150мл), а потім додають краплями розчин метансульфонової кислоти (2,11г, 21,96ммоль) у метанолі (10мл). Залишають одержану реакційну суміш при перемішуванні при кімнатній температурі на 20хв, після чого концентрують під зниженим тиском. Суспендують залишок у діетиловому е фірі, фільтрують і промивають свіжим діетиловим ефіром. Сушать одержану тверду речовину у сушильній шафі при кімнатній температурі під лабораторним вакуумом протягом 48год, і одержують 12,015г (вихід 87,9%) вказаної в заголовку сполуки у ви гляді світлопурпурової твердої речовини. 1 H-ЯМР(400МГц; CD3OD): δ 7,84-7,60 (m, 7H), 7,24-7,20 (m, 2H), 3,86 (s, 2H), 2,70 (s, 3Н), 0,85 (s, 9H). TOF-MS [ES+, M+H] знайдено: m/z 527,1979, обчислено: m/z 527,1982. Приклад 101 46 5-[2-трет-бутил-5-(2,4-дифтор-феніл)-1Німідазол-4-іл]-3-(2,2-диметил-пропіл)-3Німідазо[4,5-b]піридин-2-іламін, метансульфонат Змішують 1-[2-аміно-3-(2,2-диметил-пропіл)3Н-імідазо[4,5-b]піридин-5-іл]-2-(2,4-дифторфеніл)-етан-2-діон (17,36г, 46,62ммоль) триметилацетальдегід (6,42г, 74,53ммоль) та NH4OAC (35,93г, 466,20ммоль) у льодяній оцтовій кислоті (200мл) і перемішують при 85°С в атмосфері азоту протягом 4,5год. Охолоджують до кімнатної температури протягом ночі. Нагрівають реакційну суміш при 85°С протягом 5год, потім при 100°С протягом 3год, після чого охолоджують до кімнатної температури протягом ночі. Концентрують одержану реакційну суміш під зниженим тиском. Розчиняють залишок у EtOAc (2л), і промивають одержаний розчин двічі насиченим водним розчином NaHCО3 (2´1л), Н2О (1л) та насиченим водним розчином хлориду натрію (1л). Сушать органічну фазу над Na2SO4, фільтрують і концентрують під зниженим тиском. Очищають одержаний продукт хроматографією на колонці, елююючи чистим етилацетатом, потім 1% 2-н. розчину NH3/MeOH в EtOAc, потім 2% 2-н. розчину NH3/MeOH в EtOAc, а потім 3% 2-н. розчину NH3/MeOH в EtOAc, і одержують 10,28г 5-[2-трет-бутил-5-(2,4-дифторфеніл)-1Н-імідазол-4-іл]-3-(2,2-диметил-пропіл)3Н-імідазо[4,5-b]піридин-2-іламіну у вигляді злегка забарвленої твердої речовини. MS (ES+): m/z=439 (M+1). Перемішують 5-[2-трет-бутил-5-(2,4-дифторфеніл)-1Н-імідазол-4-іл]-3-(2,2-диметил-пропіл)3Н-імідазо[4,5-b]піридин-2-іламін (11,55г, 26,33ммоль) у МеОН (150мл), а потім додають краплями розчин метансульфонової кислоти (2,53г, 26,33ммоль) у МеОН (10мл). Перемішують одержану реакційну суміш при кімнатній температурі протягом 20хв, після чого концентрують під зниженим тиском. Суспендують залишок у Et2О, фільтрують і промивають свіжим Et2O. Сушать одержану тверду речовину у сушильній шафі при кімнатній температурі під лабораторним вакуумом протягом ночі, а потім при 80°С протягом 1,5год. Розчиняють одержану сіль у МеОН та обробляють NaHCO3 до досягення лужної реакції. Екстрагують одержаний розчин EtOAc, сушать об'єднані органічні фази над Na2SO4, фільтрують і концентрують під зниженим тиском. Очищають одержаний продукт хроматографією на колонці, елююючи EtOAc, потім 1% 2-н. розчину NH3/MeOH в EtOAc, а потім 2% 2-н. розчину NH3/MeOH в EtOAc, і одержують 9,38г 5-[2-трет-бутил-5-(2,4-дифтор-феніл)-1Німідазол-4-іл]-3-(2,2-ддметил-пропіл)-3Німідазо[4,5-b]піридин-2-іламіну. Перемішують 5-[2трет-бутил-5-(2,4-дифтор-феніл)-1Н-імідазол-4-іл]3-(2,2-диметил-пропіл)-3Н-імідазо[4,5-b]піридин-2іламін (9,38г, 21,39ммоль) у безводному МеОН (150мл), а потім додають краплями розчин метансульфонової кислоти (2,06г, 21,43ммоль) у МеОН (10мл). Залишають одержану реакційну суміш при перемішуванні при кімнатній температурі на 30хв, після чого концентрують під зниженим тиском. Суспендують залишок у Еt2О, фільтрують і промивають свіжим Еt2О. Сушать одержану тверду речовину у сушильній шафі при кімнатній температу 47 85505 рі під лабораторним вакуумом протягом 48год, і одержують 10,695г (вихід 76%) вказаної в заголовку сполуки у вигляді жовтувато-коричневої твердої речовини. 1 H-ЯМР (400МГц; CD3OD): δ 7,74-7,66 (m, 2H), 7,60-7,54 (m, 1H), 7,15-7,08 (m, 2H), 3,70 (s, 2H), 2,70 (s, 3H), 1,51 (s, 9H), 0,81 (s, 9H). TOF-MS [ES+, M+H]: знайдено: m/z=439,2398; обчислено: m/z=439,2422. Приклад 102 5-[2-трет-бутил-5-(4-фтор-феніл)-1Н-імідазол4-іл]-3-(2,2-диметил-пропіл)-3Н-імідазо[4,5b]піридин-2-іламін, метансульфонат Перемішують суспензію {6-[2-трет-бутил-5-(4фтор-феніл)-3Н-імідазол-4-іл]-3-нітро-піридин-2іл}-(2,2-диметилпропіл)-аміну (426мг, 1,0ммоль) та 10% паладію на вугіллі (85мг) у 100% етанолі в атмосфері водню (із застосуванням еластичної камери) протягом ночі. Фільтрують суспензію через шприц-фільтр із розміром отворів 0,2мкМ і концентрують під зниженим тиском. Розчиняють залишок у 10% водному розчині етанолу і оброблюють при кімнатній температурі бромціаном (80мг, 0,75ммоль, 1,5екв.). Після завершення реакції гасять реакційну суміш насиченим водним розчином NаНСО3. Додають етилацетат та воду до повного розчинення твердих речовин. Промивають органічний шар один раз насиченим водним розчином NаНСО3, один раз насиченим водним розчином NaCl, суша ть над Na2SO4, фільтрують і концентрують під зниженим тиском. Піддають залишок хроматографії на силікагелі під помірним тиском з елююванням сумішшю 50% етилацетату з СН2СІ2, а потім градієнтом (1,5-3,5%) 2Μ розчин аміаку МеОН в СН2СІ2, і одержують 5-[2-третбутил-5-(4-фтор-феніл)-1Н-імідазол-4-іл]-3-(2,2диметил-пропіл)-3Н-імідазо[4,5-b]піридин-2-іламін у вигляді коричневої піни (156мг, вихід 74%). Оброблюють розчин 5-[2-трет-бутил-5-(4фтор-феніл)-1Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламіну у метанольно-водній суміші метансульфоновою кислотою з подальшою ліофізіацією, і одержують вказану в заголовку сполуку. Точна MS: обчислено: m/z=421,25l6 (M+H)+; знайдено: m/z=421,2523 (М+Н)+. 1 H-ЯМР (DMSO-d6): δ 7,85 (d, 1Н, J=7,9Гц), 7,85 (d, 1Н, J=7,9Гц), 7,72 (d, 1Н, J=8,4Гц), 7,62 (dd, 2H, J=8,8 Гц, 4,8Гц), 7,27 (t, 2H, J=8,8Гц), 3,90 (s, 2H), 2,70 (s, ЗН), 1,62 (s, 9H), 0,89 (s, 9H). Приклад 103 5-[2-трет-бутил-5-(4-фтор-феніл)1Н-імідазол-4-іл]-3-(2,2-диметил-пропіл)-3Німідазо[4,5-b]піридин-2-іламін, фумарат Розчиняють 126мг (0,3ммоль) 5-[2-трет-бутил5-(4-фтор-феніл)-1Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламіну у 1,0мл 88% ацетону (решта - вода за об'ємом). Додають частинами при струшуванні розчин 70мг фумарової кислоти у підігрітому 88% ацетоні (решта - вода за об'ємом). Додають затравочні кристали, і фільтрують одержаний осад. Сушать на повітрі, і одержують 145мг (74%) злегка пурпурових волосоподібних кристалів. Приклад 104 48 Кристалічний 5-[2-трет-бутил-5-(4-фторфеніл)-1Н-імідазол-4-іл]-3-(2,2-диметил-пропіл)3Н-імідазо[4,5-b]піридин-2-іламін, диметансульфонат Розчиняють 126мг (0,3ммоль) 5-[2-трет-бутил5-(4-фтор-феніл)-1Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламіну у 2,0мл ацетону. Додають частинами 58мг метансульфонової кислоти. Додають затравочні кристали, і фільтрують одержаний осад. Сушать на повітрі, і одержують 114мг (62%) злегка забарвлених кристалів неправильної форми. Т.пл. >250°С. Приклад 105 Аморфний 5-[2-трет-бутил-5-(4-фтор-феніл)1Н-імідазол-4-іл]-3-(2,2-диметил-пропіл)-3Німідазо[4,5-b]піридин-2-іламін, диметансульфонат Розчиняють диметансульфонат 5-[2-треотбутил-5-(4-фтор-феніл)-1Н-імідазол-4-іл]-3-(2,2диметил-пропіл)-3Н-імідазо[4,5-b]піридин-2-іламіну (300мг) у 5мл деіонізованої води. Фільтрують розчин через фільтр із розміром отворів 0,45мкМ у попередньо охолоджену мірну колбу місткістю 500мл. Швидко заморожують розчин на дні та стінках колби. Сушать сублімаційним способом протягом 24год, і одержують аморфний диметансульфонат 5-[2-трет-бутил-5-(4-фтор-феніл)-1Німідазол-4-іл]-3-(2,2-диметил-пропіл)-3Німідазо[4,5-b]піридин-2-іламіну. Приклад 106 5-[2-трет-бутил-5-(4-фтор-феніл)-1Н-імідазол4-іл]-3-(2,2-диметил-пропіл)-3Н-імідазо[4,5b]піридин-2-іламін, сукцинат Розчиняють 126мг (0,3ммоль) 5-[2-отретбутил-5-(4-фтор-феніл)-1Н-імідазол-4-іл]-3-(2,2диметил-пропіл)-3Н-імідазо[4,5-b]піридин-2-іламіну у 2,0мл 88% ацетону (решта - вода за об'ємом). Додають частинами розчин 71мг бурштинової кислоти у 1мл підігрітого 88% ацетону (решта - вода за об'ємом). Додають затравочні кристали, і фільтрують одержаний осад. Сушать на повітрі, і одержують 123мг (63%) дуже легких пурпурови х кристалів. Приклад 107 5-[2-трет-буінл-5-(4-фтор-феніл)-1Н-імідазол4-іл]-3-(2,2-диметил-пропіл)-3Н-імідазо[4,5b]піридин-2-іламін, дималеат Розчиняють 126мг (0,3ммоль) 5-[2-трет-бутил5-(4-фтор-феніл)-1Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламіну у 1,0мл ізопропанолу. Додають частинами розчин 69,6мг малеїнової кислоти у 1мл підігрітого ізопропанолу. Додають затравочні кристали, і фільтрують одержаний осад. Сушать на повітрі, і одержують 120мг (63%) дуже легких пурпурови х кристалів. Приклад 108 5-[2-трет-бутил-5-(4-фтор-феніл)-1Н-імідазол4-іл]-3-(2,2-диметил-пропіл)-3Н-імідазо[4,5b]піридин-2-іламін, дигідрохлорид Розчиняють 126мг (0,3ммоль) 5-[2-трет-бутил5-(4-фтор-феніл)-1Н-імідазол-4-іл]-3-(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламіну у 2,0мл ацетону. Додають частинами 120мкл 5-н. розчину хлористоводневої кислоти. Фільтрують одержаний осад. Сушать на повітрі, і одержують 140мг (93%) дуже легких рожевих кристалів. 49 85505 Приклад 109 5-[2-(2-хлор-6-фтор-феніл)-5-феніл-3Німідазол-4-іл]-3-(2,2-диметилпропіл)-3Німідазо[4,5-b]піридин-2-іламін, метансульфонат Розчиняють {6-[2-(2-хлор-6-фтор-феніл)-5феніл-3Н-імідазол-4-іл]-3-нітро-піридин-2-іл}-(2,2диметилпропіл)-аміну (240мг, 0,50ммоль) у 100% етанолі (10мл), і додають дигідрат дихлориду олова (II) (564мг, 2,50ммоль, 5,0екв.). Нагрівають реакційну суміш до вичерпання вихідного матеріалу. Охолоджують реакційну суміш до кімнатної температури і повільно гасять насиченим водним розчином NaHCO3. Після гасіння додають до реакційної суміші целіт, і фільтрують суспензію через шар целіту, промиваючи водою та етилацетатом. Розділяють шари, і промивають органічний шар насиченим водним розчином NaCl. Сушать органічний шар над Na2SO4, фільтрують і концентрують під зниженим тиском. Додають до одержаної твердої речовини 10% водний розчин етанолу та бромціан (106мг, 1,00ммоль, 2,0екв.) і перемішують протягом ночі. Гасять реакційну суміш насиченим водним розчином NaHCO3 (20мл). Додають етилацетат та воду до повного розчинення твердих речовин. Промивають органічний шар тричі насиченим водним розчином NaCl, сушать над Na2SO4, фільтрують і концентрують під зниженим тиском. Піддають залишок хроматографії на силікагелі під помірним тиском, елююючи градієнтом 1,5-3% (2Μ розчин аміаку в МеОН)/СН2Сl2, і одержують 5-[2-(2хлор-6-фтор-феніл)-5-феніл-3Н-імідазол-4-іл]-3(2,2-диметилпропіл)-3Н-імідазо[4,5-b]піридин-2іламін у вигляді жовто-зеленої твердої речовини (196мг, вихід 60%). Обробляють розчин 5-[2-(2-хлор-6-фторфеніл)-5-феніл-3Н-імідазол-4-іл]-3-(2,2диметилпропіл)-3Н-імідазо[4,5-b]піридин-2-іламіну у метанольно-водній суміші метансульфоновою кислотою з подальшою ліофілізацією, і одержують вказану в заголовку сполук у. MS (ESI): m/z=475,2 (М+Н)+. Приклад 110 5-[2-трет-бутил-5-(4-фтор-феніл)-3Н-імідазол4-іл]-3-(1(R),2,2-триметил-пропіл)-3Н-імідазо[4,5b]піридин-2-іламін, метансульфонат Розчиняють {6-[2-трет-бутил-5-(4-фтор-феніл)3Н-імідазол-4-іл]-3-нітро-піридин-2-іл}-(1(R),2,2триметил-пропіл)-амін (558мг, 1,27ммоль) у 100% етанолі (15мл), і додають дигідрат дихлориду олова (II) (1,4г, 6,3ммоль, 5екв.). Нагрівають реакційну суміш до вичерпання вихідного матеріалу. Охолоджують реакційну суміш до кімнатної температури і повільно гасять насиченим водним розчином NaНСО3. Додають целіт, і фільтрують суспензію через шар целіту, промиваючи водою та етилацетатом. Розділяють шари, і промивають органічний шар насиченим водним розчином NaCl. Сушать органічний шар над Na2SO4, фільтрують і концентрують під зниженим тиском. Додають до одержаної твердої речовини 10% водний розчин етанолу та бромціан (202мг, 1,99ммоль, 1,5екв.) і перемішують протягом ночі. Додають додатково 1,5екв. бромціану, перемішують 3год і гасять насиченим водним розчином NaHCO3 (20мл). Додають етилацетат та воду до повного розчинення 50 твердих речовин. Промивають органічний шар тричі насиченим водним розчином NaCl, сушать над Na2SO4, фільтрують і концентрують під зниженим тиском. Піддають залишок хроматографії на силікагелі під помірним тиском, елююючи градієнтом 1,5-4% (2Μ розчин аміаку в МеОН)/СН2Сl2, і одержують 5-[2-трет-бутил-5-(4-фтор-феніл)-3Німідазол-4-іл]-3-(1(R),2,2-триметил-пропіл)-3Німідазо[4,5-b]піридин-2-іламін у вигляді жовтува токоричневої склоподібної речовини (158мг, вихід 29%). Обробляють 5-[2-трет-бутил-5-(4-фтор-феніл)3Н-імідазол-4-іл]-3-(1(R),2,2-триметил-пропіл)-3Німідазо[4,5-b]піридин-2-іламін у метанольно-водній суміші метансульфоновою кислотою з подальшою ліофілізацією, і одержують вказану в заголовку сполуку. MS (ESI): m/z=435,2 (М+Н)+. Приклад 111 5-[2-(2,6-дифтор-феніл)-5-(4-фтор-феніл)-3Німідазол-4-іл]-3-(1(R),2,2-триметил-пропіл)-3Н-[4,5b]піридин-2-іламін, метансульфонат Розчиняють {6-[2-(2,6-дифтор-феніл)-5-(4фтор-феніл)-3Н-імідазол-4-іл]-3-нітро-піридин-2іл}-(1(R),2,2-триметил-пропіл)-амін (673мг, 1,4ммоль) у 100% етанолі (15мл), і додають дигідрат дихлориду олова (II) (1,5г, 6,8ммоль, 5екв.). Нагрівають реакційну суміш до вичерпання вихідного матеріалу. Охолоджують реакційну суміш до кімнатної температури і повільно гасять насиченим водним розчином NaНСО3. Після гасіння додають до реакційної суміші целіт, і фільтрують суспензію через шар целіту, промиваючи водою та етилацетатом. Розділяють шари, і промивають органічний шар насиченим водним розчином NaCl. Сушать органічний шар над Na2SO4, фільтрують і концентрують під зниженим тиском. Додають до залишку 10% водний розчин етанолу (14мл) та бромціан (216мг, 2,04ммоль, 1,5екв.) і перемішують протягом ночі. Гасять насиченим водним розчином NaНСО3 (20мл). Додають етилацетат та воду до повного розчинення твердих речовин. Промивають органічний шар тричі насиченим водним розчином NaCl, сушать над Na2SO4, фільтрують і концентрують під зниженим тиском. Піддають залишок хроматографії на силікагелі під помірним тиском, елююючи градієнтом 1,5-3% (2Μ розчин аміаку в МеОН)/СН2Сl2, і одержують 5-[2-(2,6дифтор-феніл)-5-(4-фтор-феніл)-3Н-імідазол-4-іл]3-(1(R),2,2-триметил-пропіл)-3Н-імідазо[4,5b]піридин-2-іламін у вигляді жовтувато-коричневої склоподібної речовини (289мг, вихід 43%). Обробляють розчин 5-[2-(2,6-дифтор-феніл)-5(4-фтор-феніл)-3Н-імідазол-4-іл]-3-(1(R),2,2триметил-пропіл)-3Н-імідазо[4,5-b]піридин-2іламіну у метанольно-водній суміші метансульфоновою кислотою з подальшою ліофілізацією, і одержують вказану в заголовку сполук у. MS (ESI): m/z=491,2 (M+H)+. Приклад 112 5-[2-трет-бутил-5-(4-фтор-феніл)-1Н-імідазол4-іл]-3-(2,2-диметил-пропіл)-3Н-імідазо[4,5b]піридин-2-іламін, диметансульфонат 5-бром-3-(2,2-диметил-пропіл)-3Н-імідазо[4,5b]піридин-2-іл-амоній-бромід 51 85505 Перемішують суміш гіпофосфористої кислоти (50% (мас.) водний розчин) (0,555г) та 5% Pt/C (2,5г) у Н2О (20мл, 0,4 об'єму) протягом 10хв. Додають твердий VO(acac)2 (0,420г, 1,20ммоль), і перемішують одержану темну суспензію додатково протягом 5хв. Завантажують цю суспензію разом із сумішшю 2-(2,2-диметилпропіламіно)-3нітро-6-бромпіридину (50,00г, 173,61ммоль) у толуолі (500,00мл) у автоклав місткістю 1л при кімнатній температурі. Нагрівають суміш в автоклаві при 75°С у присутності Н2 під тиском 35 фунтів на кв.дюйм (2,38 атмосфер) при перемішуванні зі швидкістю 100об/хв. Через 3год фільтрують суміш через шар матеріалу Hyflo Super Cel®, і концентрують фільтрат під зниженим тиском до половини загальної маси (273,0г) розчину. Перемішують розчин, і додають бромціан (18,4г, 173,70ммоль), а потім МеОН (250мл). Через 18год нагрівають до 40°С і концентрують під зниженим тиском до досягнення об'єму відділеного при молекулярній дистиляції розчинника 350мл. Розводять одержану суспензію (350мл, 7,0 об'ємів), охолоджують до 0°С і перемішують 1год. Відділяють фільтруванням твердий продукт, промивають МТВЕ (75мл, 1,5 об'єму) і сушать під зниженим тиском при 40°С протягом 24год, одержуючи 48,06г (76%) бажаної сполуки у вигляді білої твердої речовини. 1 H-ЯМР (300МГц, DMSO-d6): δ 0,96 (9Н, s), 3,91 (2Н, s), 7,45 (1H, d, J=8,1Гц), 7,64 (1H, d, J=8,1Гц), 8,73 (2H, bs). MS (ES-): m/z=282,0; (M-1)-. 3-(2,2-диметил-пропіл)-5-(4-фторфенілетиніл)-3Н-імдазо[4,5-b]піридин-2-іламін До суміші 5-бром-3-(2,2-диметал-пропіл)-3Німідазо[4,5-b]піридин-2-іл-амонійброміду (25,00г, 68,67ммоль) в етанолі (25мл) та толуолі (75мл) додають триетиламін (27,10г, 267,80ммоль). Нагрівають до 70-75°С, а потім додають Pd(OAc)2 (0,15г, 0,69ммоль), трифенілфосфін (0,72г, 2,75ммоль), та йодид міді (І) (0,13г, 0,69ммоль). Додають 2/3 розчину 4-фтор фенілацетилену (12,37г, 103,00ммоль) у толуолі (50мл, 2,0 об'єми) протягом 15хв. Через 1год додають залишок розчину 4-фторфенілацетилену. Через 3год додають додаткову кількість 4-фторфенілацетилену (1,5г, 12,86ммоль). Ще через 1 год видаляють EtOH дистиляцією. Охолоджують реакційну суміш до
ДивитисяДодаткова інформація
Назва патенту англійськоюKinase inhibitors
Автори англійськоюBonjouklian Rosanne, Hamdouchi Chafiq Hamdouchi, Shih Chuan, De Dios Alfonso, Del Prado Miriam Filadelfa, Jaramillo Aguado Carlos, Kotiyan Pramila, Mader Mary Margaret, Selgas Sheila Pleite, Sanchez-Martinez Concepcion
Назва патенту російськоюИнгибиторы киназы
Автори російськоюБонжуклян Розанн, Хамдоучи Чафик Хамдоучи, Ши Чан, де Диос Альфонсо, Дель Прадо Мириам Филадельфа, Харамильо Агадо Карлос, Котиян Прамила, Мадер Мери Маргарет, Сельгас Шейла Плейт, Санчес-Мартинес Консепсьон
МПК / Мітки
МПК: A61K 31/4188, C07D 471/04, A61P 29/00
Мітки: інгібітори, кінази
Код посилання
<a href="https://ua.patents.su/32-85505-ingibitori-kinazi.html" target="_blank" rel="follow" title="База патентів України">Інгібітори кінази</a>
Попередній патент: Багатопроменева дзеркальна антена
Наступний патент: Гідроакумулююча електростанція
Випадковий патент: Пристрій для обв'язування арматурних стрижнів, барабан для дроту і процес ідентифікації барабана для дроту