Похідні 4-феніл-піримідин-2-карбонітрилу
Номер патенту: 89633
Опубліковано: 25.02.2010
Автори: Цай Цзяцян, Ранковіч Зоран, Мойр Дженіфер Гелен
Формула / Реферат
1. Сполуки, які є похідними 4-фенілпіримідин-2-карбонітрилу загальної формули І
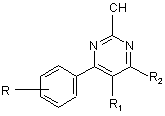 ,
,
або їх фармацевтично прийнятна сіль,
де R - 1-3 довільні замісники, незалежно вибрані з (С1-6)алкілу (як варіант, заміщеного одним або більше галогенами), (С1-6)алкілоксилу (як варіант, заміщеного одним або більше галогенами), ціано, галогену, гідрокси, нітро, (С3-6)циклоалкілу, СО(С1-6)алкілу, S(С1-6)алкілу, SО(С1-6)алкілу, SО2(С1-6)алкілу, SО2NH(С1-8)алкілу, SO2NH2, NHCO(С1-8)алкілу та СО2Н;
або 2 замісники R, розташовані у сусідніх позиціях, разом представляють ОСН2О, ОСН2СН2О або СН2СН2О;
R1 - Н або (С1-6)алкіл;
R2 - (С2-6)алкіл, як варіант, заміщений ОН, (С1-4)алкілоксилом, (С6-10)арилоксилом, (С6-10)арил(С1-4)алкілоксилом, одним або більше галогенами, NR3R4, СО2Н або CONR6R7;
R3 та R4, незалежно, - Н1 (С1-8)алкіл [як варіант, заміщений одним або більше галогенами, (С1-4)алкілоксилом або (С6-10)арилоксилом], (С3-8)циклоалкіл [як варіант, заміщений одним або більше галогенами], (С1-4)алкіл, заміщений 4-8-членним насиченим гетероциклічним кільцем, яке має гетероатом, вибраний з О, S та NR5, 4-8-членне насичене гетероциклічне кільце, яке має гетероатом, вибраний з О, S та NR5, (C6-10)арил, (С2-9)гетероарил [що, як варіант, заміщено 1-3 замісниками, вибраними з галогену, CF3, (С1-4алкілу та (С1-4)алкілоксилу], (С6-10)арил(С1-4)алкіл чи (С2-9)гетероарил(С1-4)алкіл; або
R3 та R4 разом з нітрогеном, з яким вони поєднані, утворюють 4-8-членне насичене гетероциклічне кільце, яке, як варіант, заміщене одним або більше галогенами або CONR8R9, а також, як варіант, має один або більше гетероатомів, вибраних з О, S та NR5; або
R3 - Н або (С1-4)алкіл; a R4 - (С1-4)алкіл, заміщений CONR8R9, COOR10, NR8, R9, NR8COR9 або NR8CONR9R10;
R5 - H, (С1-4)алкіл [як варіант, заміщений (С3-8)циклоалкілом, (С6-10)арилом або (С2-5)гетероарилом], (С3-8)циклоалкіл, (С6-10)арил або (С2-5)гетероарил;
R6 та R7, незалежно, - Н, (С1-4)алкіл або 4-8-членне насичене гетероциклічне кільце, яке має гетероатом, вибраний з О, S та NR5; або
R6 та R7 разом з нітрогеном, з яким вони поєднані, утворюють 4-8-членне насичене гетероциклічне кільце, яке, як варіант, заміщене одним або більше галогенами, а, крім того, як варіант, має один або більше гетероатомів, вибраних з О, S та NR5;
R8 та R9, незалежно, - Н або (С1-4)алкіл; або
R8 та R9 разом з атомами, з якими вони поєднані, утворюють 4-8-членне насичене гетероциклічне кільце, яке, як варіант, має один або більше гетероатомів, вибраних з О, S та NR5;
R10 - Н або (С1-4)алкіл;
або її фармацевтично прийнятна сіль.
2. Сполуки за п. 1, які відрізняються тим, що:
R - 1-3 довільні замісники, незалежно вибрані з (С1-6)алкілу (як варіант, заміщеного одним або більше галогенами), (С1-6)алкілоксилу (як варіант, заміщеного одним або більше галогенами), ціано та галогену;
R1 - Н або (С1-6)алкіл;
R2 - (С2-6)алкіл, як варіант, заміщений ОН, (С1-4)алкілоксилом, одним або більше галогенами або NR3R4;
R3 та R4, незалежно, - Н, (С1-8)алкіл [як варіант, заміщений одним або більше галогенами], (С3-8)циклоалкіл [як варіант, заміщений одним або більше галогенами], 4-8-членне насичене гетероциклічне кільце, яке має гетероатом, вибраний з О, S та NR5, (С6-10)арил, (С2-9)гетероарил, (С6-10)арил(С1-4)алкіл або (С2-9)гетероарил(С1-4)алкіл; або
R3 та R4 разом з нітрогеном, з яким вони поєднані, утворюють 4-8-членне насичене гетероциклічне кільце, яке, як варіант, заміщене одним або більше галогенами, і, крім того, як варіант, має один або більше гетероатомів, вибраних з О, S та NR5;
R5 - Н, (С1-4)алкіл [як варіант, заміщений (С3-8)циклоалкілом, (С6-10)арилом або (С2-5)гетероарилом], (С3-8)циклоалкіл, (С6-10)арил або (С2-5)гетероарил;
або їх фармацевтично придатна сіль.
3. Сполуки за п. 2, які відрізняються тим, що R2 - (С2-6)алкіл, заміщений ОН, (С1-4)алкілоксилом, одним або більше галогенами або NR3R4.
4. Сполуки за п. 2 або п. 3, які відрізняються тим, що R2 - пропіл, заміщений NR3R4 у позиції 3.
5. Сполуки за пп. 2-4, які відрізняються тим, що 4-феніл заміщено трифлуорметилом у мета-положенні.
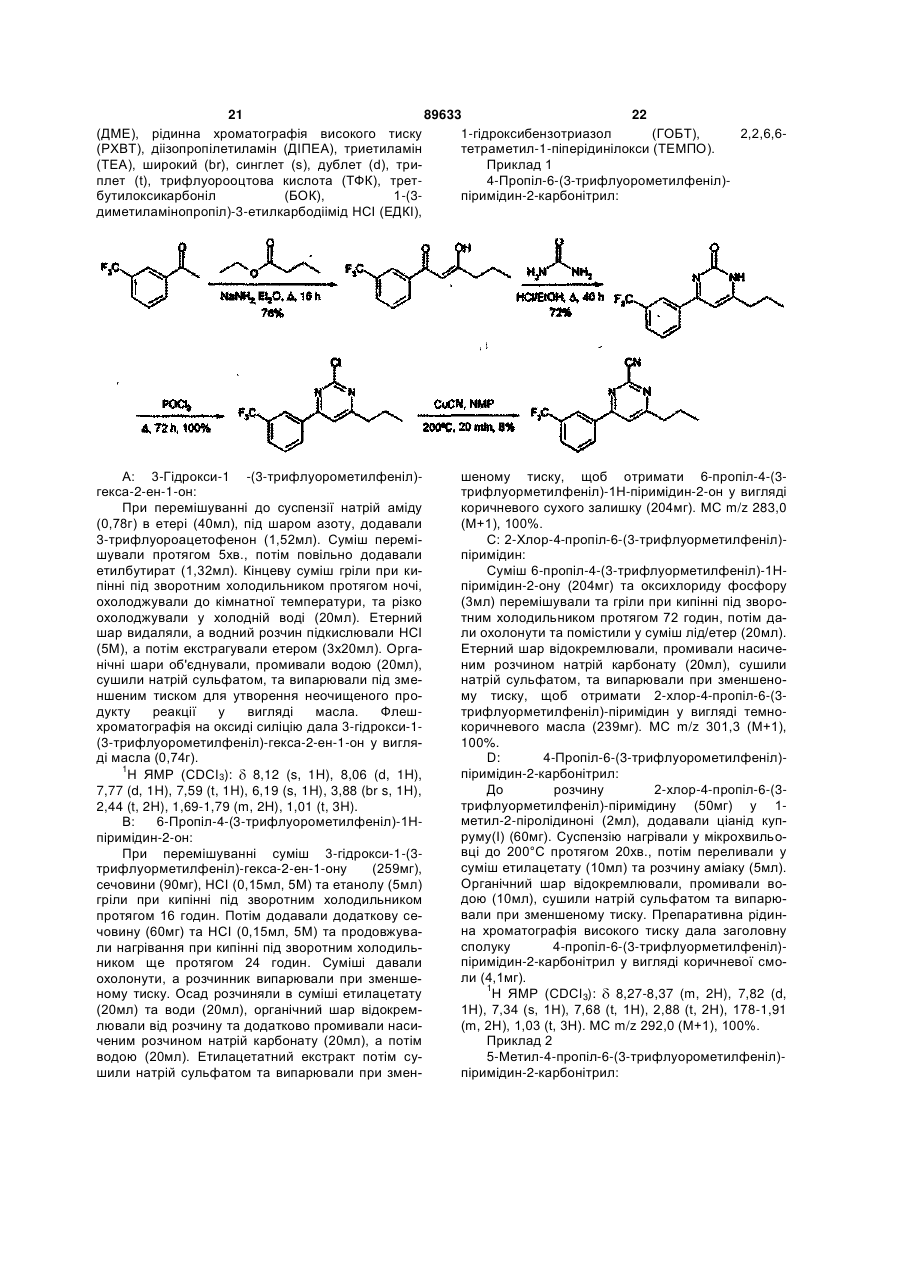
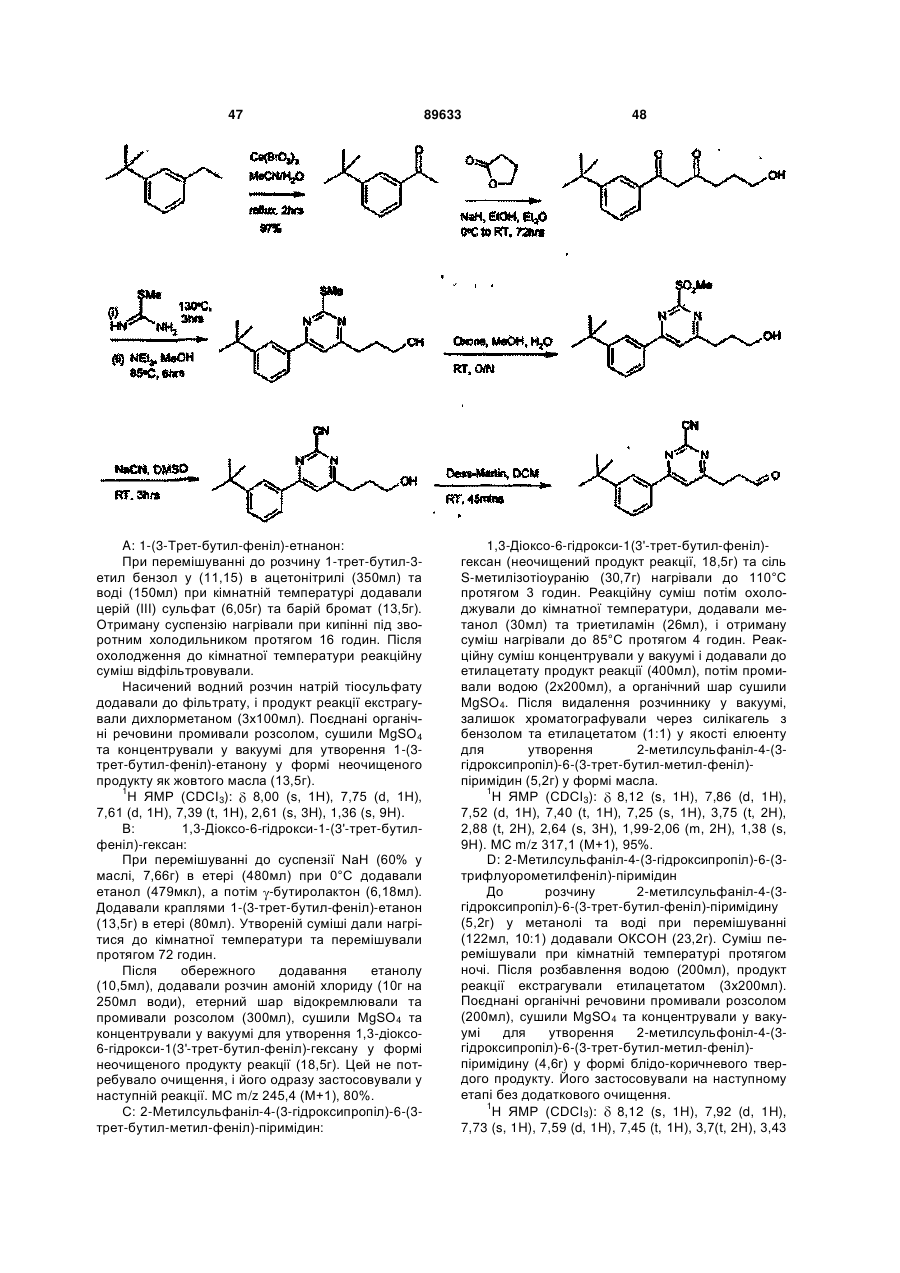
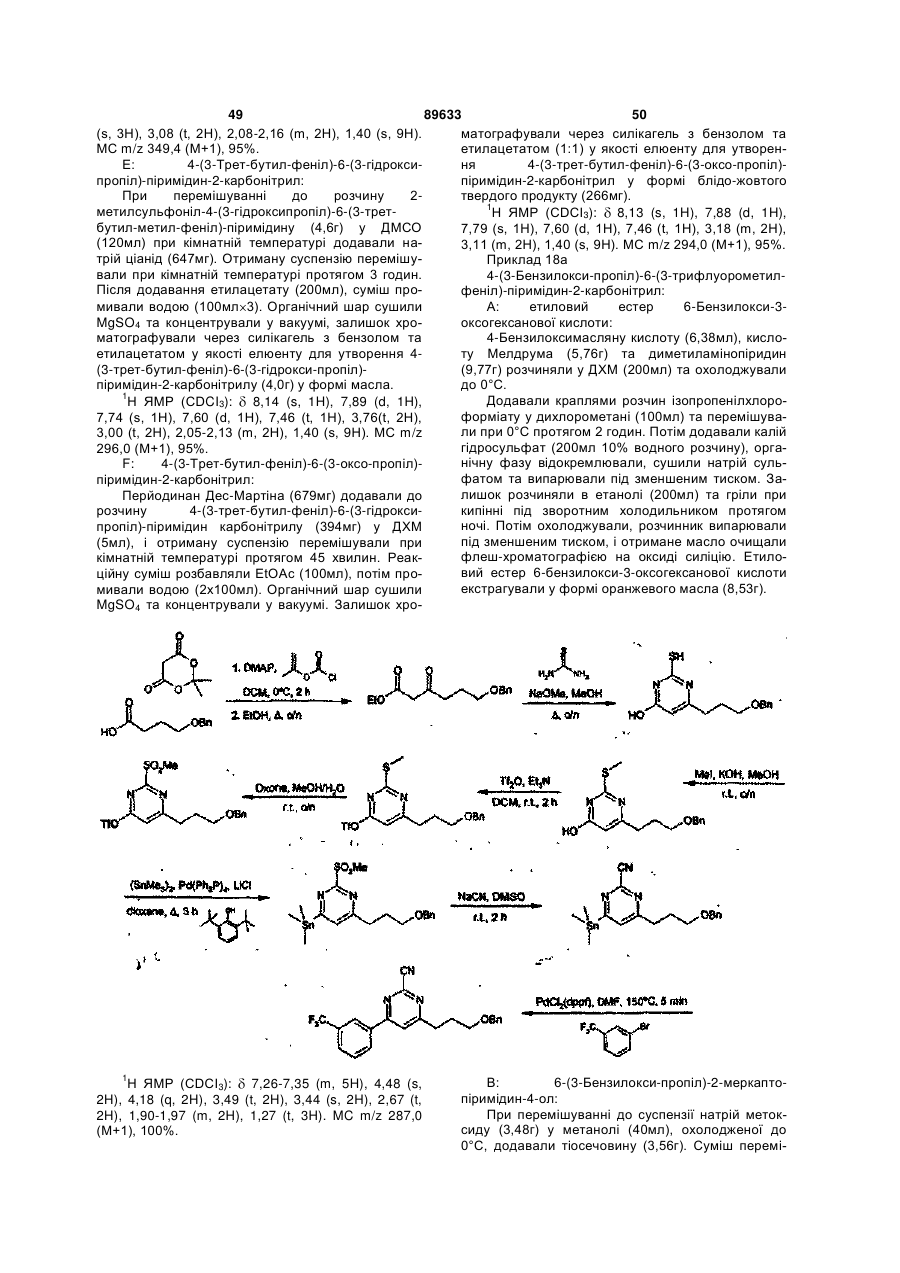
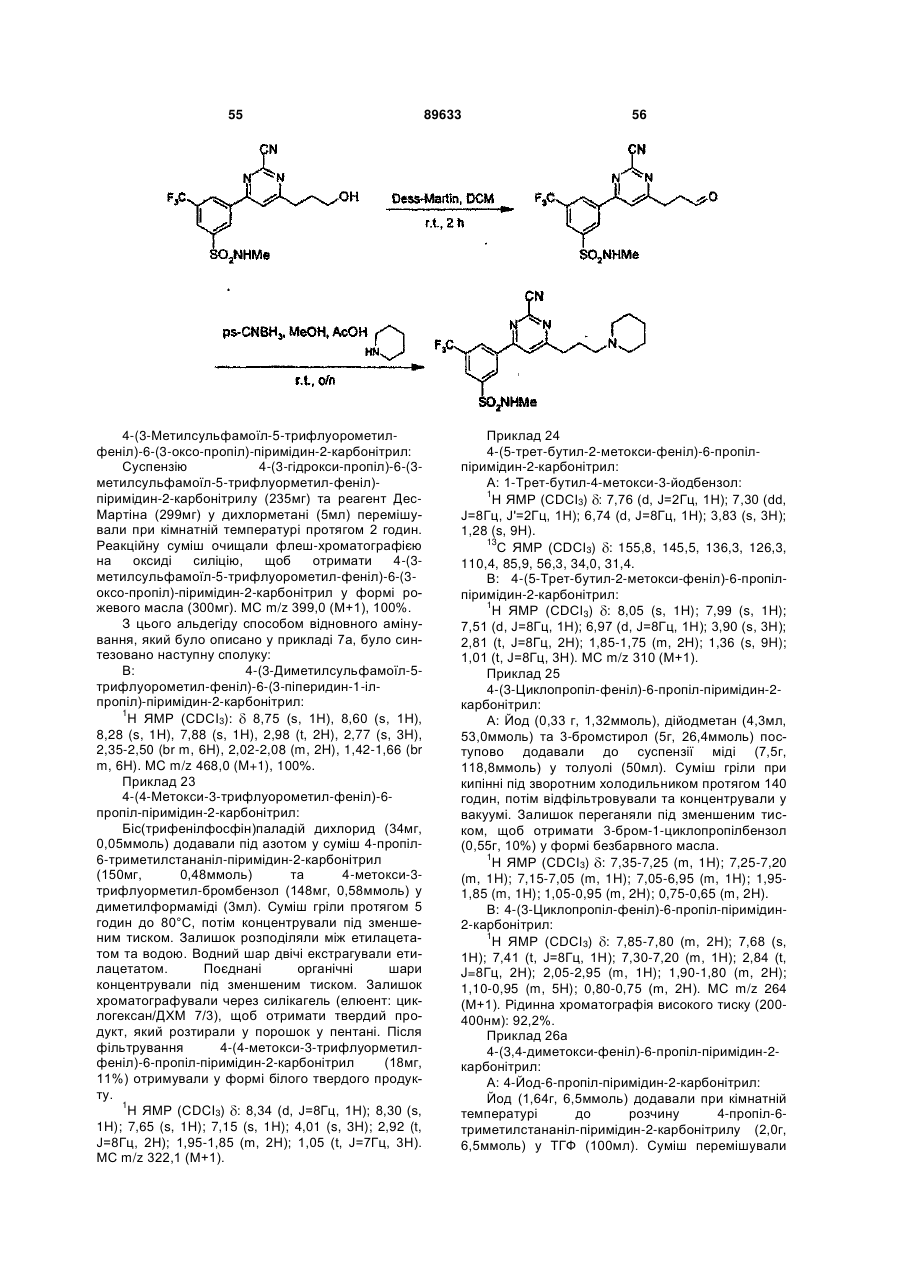
6. Сполуки, які є похідними 4-фенілпіримідин-2-карбонітрилу формули І, які вибрано з групи:
4-(3-гідрокси-1-пропіл)-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
-(3-(піперидин-1-іл)пропіл)-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
-[3-(1-етилпропіламіно)пропіл]-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-[3-(4-метил-[1,4]діазепан-1-іл)пропіл]-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-(3-циклогексиламінопропіл)-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-{3-[метил-(1-метилпіперидин-4-іл)аміно]пропіл}-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-[3-(4-метилпіперазин-1-іл)пропіл]-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-(3-ізопропіламінопропіл)-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-[3-(4-піридин-2-ілпіперазин-1-іл)пропіл]-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-[3-(карбамоїлметиламіно)пропіл]-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-[3-(карбоксиметиламіно)пропіл]-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-[3-(2-диметиламіноетиламіно)пропіл]-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-[3-(2-ацетиламіноетиламіно)пропіл]-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-{3-[2-(2-оксоімідазолідин-1-іл)етиламіно]пропіл}-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-(3,4-диметилфеніл)-6-[3-(метилкарбамоїлметиламіно)пропіл]-піримідин-2-карбонітрил;
4-[3-(2-ацетиламіноетиламіно)-пропіл]-6-(3,4-диметилфеніл)-піримідин-2-карбонітрил;
4-[3-(3-диметиламіно-пропіламіно)-пропіл]-6-(3,4-диметилфеніл)-піримідин-2-карбонітрил;
4-(3,4-диметилфеніл)-6-{3-[2-(1-метилпіролідин-2-іл)етиламіно]пропіл}-піримідин-2-карбонітрил;
4-(3-циклопропіламінопропіл)-6-(3-трифлуорметилфеніл)-піримідин-2-карбонітрил;
4-[3-(1-(S)-метил-2-метоксіетиламіно)пропіл]-6-(3-трифлуорометилфеніл)-піримідин-2-карбонітрил;
4-[3-(1-(S)-карбамоїлетиламіно)пропіл]-6-(3-трифлуорометилфеніл)-піримідин-2-карбонітрил;
4-[3-(1-(R)-карбамоїлетиламіно)пропіл]-6-(3-трифлуорометилфеніл)-піримідин-2-карбонітрил;
4-[3-(1-етил-1-метилпропіламіно)пропіл]-6-(3-трифлуорометилфеніл)-піримідин-2-карбонітрил;
4-[3-(1-метилциклопропіламіно)пропіл]-6-(3-трифлуорометилфеніл)-піримідин-2-карбонітрил;
4-[3-(2-гідроксіетиламіно)пропіл]-6-(3-трифлуорометилфеніл)-піримідин-2-карбонітрил;
4-[3-(1-карбамоїл-1-метилетиламіно)пропіл]-6-(3-трифлуорометилфеніл)-піримідин-2-карбонітрил;
4-[3-(2-оксопіролідин-3-(S)-іламіно)пропіл]-6-(3-трифлуорометилфеніл)-піримідин-2-карбонітрил; або
їх фармацевтично придатна сіль.
7. Сполуки за будь-яким з пунктів 1-6, які відрізняються тим, що призначені для застосування у терапії.
8. Застосування сполук за будь-яким з пунктів 1-6 для отримання медикаментів для лікування розладів, пов'язаних з катепсином К та катепсином S, як-то атеросклерозу, хвороб кісток, як-то остеопорозу; запальних та імунних розладів, як-то ревматоїдного артриту та розсіяного склерозу; і хронічного болю, як-то невропатичного болю.
9. Фармацевтична композиція, яка містить сполуки за будь-яким з пунктів 1-6 або їх фармацевтично прийнятну сіль з фармацевтично прийнятними добавками.
Текст
1. Сполуки, які є похідними 4-фенілпіримідин2-карбонітрилу загальної формули І CH 2 (19) 1 3 89633 4 заміщеного одним або більше галогенами), ціано 4-[3-(карбамоїлметиламіно)пропіл]-6-(3та галогену; трифлуорметилфеніл)-піримідин-2-карбонітрил; R1 - Н або (С1-6)алкіл; 4-[3-(карбоксиметиламіно)пропіл]-6-(3R2 - (С2-6)алкіл, як варіант, заміщений ОН, (С1трифлуорметилфеніл)-піримідин-2-карбонітрил; 4-[3-(2-диметиламіноетиламіно)пропіл]-6-(34)алкілоксилом, одним або більше галогенами або NR3R4; трифлуорметилфеніл)-піримідин-2-карбонітрил; R3 та R4, незалежно, - Н, (С1-8)алкіл [як варіант, 4-[3-(2-ацетиламіноетиламіно)пропіл]-6-(3заміщений одним або більше галогенами], (С3трифлуорметилфеніл)-піримідин-2-карбонітрил; 4-{3-[2-(2-оксоімідазолідин-1-іл)етиламіно]пропіл}8)циклоалкіл [як варіант, заміщений одним або більше галогенами], 4-8-членне насичене гетеро6-(3-трифлуорметилфеніл)-піримідин-2циклічне кільце, яке має гетероатом, вибраний з карбонітрил; О, S та NR5, (С6-10)арил, (С2-9)гетероарил, (С64-(3,4-диметилфеніл)-6-[3(метилкарбамоїлметиламіно)пропіл]-піримідин-210)арил(С1-4)алкіл або (С2-9)гетероарил(С1-4)алкіл; або карбонітрил; R3 та R4 разом з нітрогеном, з яким вони поєднані, 4-[3-(2-ацетиламіноетиламіно)-пропіл]-6-(3,4утворюють 4-8-членне насичене гетероциклічне диметилфеніл)-піримідин-2-карбонітрил; кільце, яке, як варіант, заміщене одним або більше 4-[3-(3-диметиламіно-пропіламіно)-пропіл]-6-(3,4галогенами, і, крім того, як варіант, має один або диметилфеніл)-піримідин-2-карбонітрил; більше гетероатомів, вибраних з О, S та NR5; 4-(3,4-диметилфеніл)-6-{3-[2-(1-метилпіролідин-2R5 - Н, (С1-4)алкіл [як варіант, заміщений (С3іл)етиламіно]пропіл}-піримідин-2-карбонітрил; (С6-10)арилом або (С24-(3-циклопропіламінопропіл)-6-(38)циклоалкілом, трифлуорметилфеніл)-піримідин-2-карбонітрил; 5)гетероарилом], (С3-8)циклоалкіл, (С6-10)арил або (С2-5)гетероарил; 4-[3-(1-(S)-метил-2-метоксіетиламіно)пропіл]-6-(3або їх фармацевтично придатна сіль. трифлуорометилфеніл)-піримідин-2-карбонітрил; 3. Сполуки за п. 2, які відрізняються тим, що R2 4-[3-(1-(S)-карбамоїлетиламіно)пропіл]-6-(3(С2-6)алкіл, заміщений ОН, (С1-4)алкілоксилом, одтрифлуорометилфеніл)-піримідин-2-карбонітрил; ним або більше галогенами або NR3R4. 4-[3-(1-(R)-карбамоїлетиламіно)пропіл]-6-(34. Сполуки за п. 2 або п. 3, які відрізняються тим, трифлуорометилфеніл)-піримідин-2-карбонітрил; що R2 - пропіл, заміщений NR3R4 у позиції 3. 4-[3-(1-етил-1-метилпропіламіно)пропіл]-6-(35. Сполуки за пп. 2-4, які відрізняються тим, що трифлуорометилфеніл)-піримідин-2-карбонітрил; 4-феніл заміщено трифлуорметилом у мета4-[3-(1-метилциклопропіламіно)пропіл]-6-(3положенні. трифлуорометилфеніл)-піримідин-2-карбонітрил; 6. Сполуки, які є похідними 4-фенілпіримідин-24-[3-(2-гідроксіетиламіно)пропіл]-6-(3карбонітрилу формули І, які вибрано з групи: трифлуорометилфеніл)-піримідин-2-карбонітрил; 4-(3-гідрокси-1-пропіл)-6-(3-трифлуорметилфеніл)4-[3-(1-карбамоїл-1-метилетиламіно)пропіл]-6-(3піримідин-2-карбонітрил; трифлуорометилфеніл)-піримідин-2-карбонітрил; -(3-(піперидин-1-іл)пропіл)-6-(34-[3-(2-оксопіролідин-3-(S)-іламіно)пропіл]-6-(3трифлуорметилфеніл)-піримідин-2-карбонітрил; трифлуорометилфеніл)-піримідин-2-карбонітрил; -[3-(1-етилпропіламіно)пропіл]-6-(3або трифлуорметилфеніл)-піримідин-2-карбонітрил; їх фармацевтично придатна сіль. 4-[3-(4-метил-[1,4]діазепан-1-іл)пропіл]-6-(37. Сполуки за будь-яким з пунктів 1-6, які відрізтрифлуорметилфеніл)-піримідин-2-карбонітрил; няються тим, що призначені для застосування у 4-(3-циклогексиламінопропіл)-6-(3терапії. трифлуорметилфеніл)-піримідин-2-карбонітрил; 8. Застосування сполук за будь-яким з пунктів 1-6 4-{3-[метил-(1-метилпіперидин-4-іл)аміно]пропіл}для отримання медикаментів для лікування роз6-(3-трифлуорметилфеніл)-піримідин-2ладів, пов'язаних з катепсином К та катепсином S, карбонітрил; як-то атеросклерозу, хвороб кісток, як-то остеопо4-[3-(4-метилпіперазин-1-іл)пропіл]-6-(3розу; запальних та імунних розладів, як-то ревматрифлуорметилфеніл)-піримідин-2-карбонітрил; тоїдного артриту та розсіяного склерозу; і хроніч4-(3-ізопропіламінопропіл)-6-(3ного болю, як-то невропатичного болю. трифлуорметилфеніл)-піримідин-2-карбонітрил; 9. Фармацевтична композиція, яка містить сполуки 4-[3-(4-піридин-2-ілпіперазин-1-іл)пропіл]-6-(3за будь-яким з пунктів 1-6 або їх фармацевтично трифлуорметилфеніл)-піримідин-2-карбонітрил; прийнятну сіль з фармацевтично прийнятними добавками. Винахід стосується 4-феніл-піримідин-2карбонітрильних похідних, фармацевтичних композицій, що їх містять, і застосування 4-фенілпіримідин-2-карбонітрильних похідних для виготовлення медикаментів, що лікують хвороби, пов'язані з катепсином К та катепсином S, наприклад, атеросклероз; хвороби кісток, як-то остеопороз; запальні та імунні розлади, як-то ревматоїдний артрит і розсіяний склероз; та хронічний біль, як-то невропатичний біль. Цистеїнові протеази представляють клас пептидаз, які характеризуються присутністю цистеїнового залишку у каталітичному сайті ферменту, і ці протеази пов'язані з нормальним процесингом та розкладанням білків. Багато патологічних розладів та хвороб є результатом відхилення від норми активності цистеїнових протеаз, наприклад, їх за 5 89633 6 надто вираженої або посиленої активації. Цистеїкатепсину S в організмі збільшує автоантигеннові катепсини, наприклад, катепсин В, К, L, S, V, представлення та розвиток органоспецифічного F, є класом лізосоматичних ферментів, які спричиавтоімунітету. няють різні розлади, включаючи запалення, ревТакож у міжнародній заявці на патент WO матоїдний артрит, остеоартрит, остеопороз, пух03/020287 було розкрито, що мРНК для катепсину лини, коронарну хворобу, атеросклероз, аутоімунні S є підвищено регульованою у тваринних моделях хвороби та інфекційні хвороби. хронічного болю, і що застосування інгібіторів каКатепсин К має сильну колагенічну, еластазну тепсину S призводить до усунення механічної гіта желатиназну активність (Bromme et al., J. Biol, пералгезії у цих тварин. Chem, 271, 2126-2132, 1996), і переважно є вираПохідні 4-аміно-піримідин-2-карбонітрилу було женим в остеокластах (Bromme and Okamoto, Biol. розкрито у міжнародній заявці на патент WO Chem. Hopp-Seyler, 376, 379-384, 1995). Він роз03/020278 (Novartis Pharma GMBH), як речовини, щеплює основні білки клітин кісток, включаючи що інгібують дію катепсинів К та/або S, тоді як колаген типів І та II (Kaffienah et al., Biochem. J. структурно пов'язані похідні 4-аміно-піримідин-2331, 727-732, 1998), желатин, остеопонтин і остеокарбонітрилу було нещодавно розкрито в WO нектин, та інші елементи, пов'язані з обміном ре04/000819 (ASTRAZENECA АВ), як речовини, що човин позаклітинного матриксу, необхідним для інгібують дію катепсину S. Подібним чином піролнормального росту та корекції кісток (Bossard et піримідини було розкрито в WO 03/020721 al., J. Biol. Chem. 271, 12517-12524, 1996). Інгібу(Novartis Pharma GMBH) та WO 04/000843 вання дії катепсину К призводить до зменшення (ASTRAZENECA AB), як речовини, що інгібують опосередкованої остеокластами ресорбції кісток. дію катепсинів К та/або S. Інгібітори катепсину К, можуть тому представляти Нещодавно було виявлено, що похідні 4нові терапевтичні засоби для лікування таких людфеніл-піримідин-2-карбонітрилу загальної формуських хвороб, як остеопороз. ли І. Sukhova et al (J. Clin. Invest. 1,02, 576-583, 1998) довели, що клітини (фагоцити), які мігрують у атеросклеротичні бляшки людини, що розвиваються, і накопичуються там, а також утворюють сильнодіючі еластази - катепсин К та S. Виродження метриксу, особливо у фіброзному кепі таких бляшок, є важливим процесом у дестабілізації атеросклеротичного ушкодження. Таким чином, обмін речовин компонентів позаклітинного матриксу - колагену та еластину, які надають структурну цілісність на фіброзному кепі ураження, можуть де: критично впливати на клінічні прояви атеросклеR - 1-3 довільні замісники, незалежно обрані з розу, як-то тромбоз коронарних артерій в резуль(С1-6)алкілу (як варіант, заміщеного одним або бітаті розриву атеросклеротичної бляшки. Інгібуванльше галогенами), (С1-6)алкілоксилу (як варіант, ня сайтів катепсинів К та/або S у бляшках, заміщеного одним або більше галогенами), ціано, схильних до розриву, може представляти ефектигалогену, гідрокси, нітро, (С3-6)цикло-алкілу, СО(С1вний шлях попередження таких наслідків. Подібно S(С1-6)алкілу, SО(С1-6)алкілу, SО2(С16)алкілу, катепсину К катепсин S також є дуже еластазно 6)алкілу, SO2NH(С1-8)алкілу, SO2NH2, NНСО(С1(Arch. Biochem. Biophys., 299, 334-339, 1992; J. 8)алкілу та СО2Н; або 2 замісники R у сусідніх поBiol. Chem., 267, 7258-7262, 1992) та колагенічно зиціях разом представляють ОСН2О, ОСН2СН2О активним (Biochem. J., 256, 433-440, 1998). Хворі або СН2СН2О; артерії людини надекспресують катепсин К та S і R1 - Η або (С1-6)алкіл; демонструють відповідний дефіцит цистеїну С, R2 - (С2-6)алкіл, як варіант, заміщений ОН, (С1найпоширеного ендогенного інгібітору цистеїнових 4)алкілоксилом, (С6-10)арилоксилом, (С6-10)арил(С1протеаз (J. Clin. Invest. 102, 576-583, 1998; J. Clin. 4)алкілоксилом, одним або більше галогенами, Invest. 104. 1191-1197, 1999). Sukhova et al. (J. Clin. NR3R4, СО2Н або CONR6R7; Invest. 111. 897-906, 2003) довели на мишах, що R3 та R4, незалежно, - Н1 (С1-8)алкіл [як варідефіцит катепсину S зменшує ступінь атеросклеант, заміщений одним або більше галогенами, (С1розу у LDL-рецептородефіцитних мишей. Bromme або (С6-10)арилоксилом], (С34)алкілоксилом et al (Biochem. Biophys. Research Comm. 312,10198)циклоалкіл [як варіант, заміщений одним або 1024, 2003) також довели, що катепсини К та S більше галогенами], (С1-4)алкіл заміщеним насичездатні розкладати in-vitro HDL3 та безліпідний ним гетероциклічним 4-8 членним кільцем, яке має ароА-І. Це крім того визначає катепсини К та S, як гетероатом, обраний з О, S та NR5, або насиченим терапевтичну мету для лікуванні атеросклерозу. гетероциклічним 4-8 членним кільцем, яке має Катепсин S показаний як ключовий фермент, гетероатом, обраний з О, S та NR5, (С6-10)арил, (С2залучений до процесингу інваріантного ланцюга у 9)гетероарил (як варіант, заміщений 1-3 замісниклітинах, що представляють антиген людей та ками, обраними з галогену, CF3, (С1-4)алкіл та (С1мишей (J. Clin. Invest. 110, 361-369, 2002). Цей 4)алкілоксил, (С6-10)арил(С1-4)алкіл; або процесинг інваріантного ланцюга регулює функцію R3 та R4 разом з нітрогеном, з яким вони поєдМНС класу II та пов'язаний із запаленнями та авнані, утворюють насичене гетероциклічне 4-8 тоімунними розладами. Saegusa et al. (J. Clin. членне кільце, що, як варіант, заміщене одним або Invest. 110, 361-369, 2002) довели, що інгібування 7 89633 8 більше галогенами, або CONR8R9, а також, як вабільше галогенами або CONR8R9, а також, як варіріант, має один або більше гетероатомів, обраних ант, має один або більше гетероатомів, обраних з з О, S та NR5; або О, S та NR5; R3 - Η або (С1-4)алкіл; a R4 - (С1-4)алкіл, заміR5 - Η, (С1-4)алкіл [як варіант, заміщений (С3щений CONR8R9, COOR10, NR8, R9, NR8COR9, або (С6-10)арилом або (С28)циклоалкілом, NR8CONR9R10; 5)гетероарилом], (С3-8)циклоалкіл, (С6-10)арил або R5 - Η, (С1-4)алкіл [як варіант, заміщений (С3(С2-5)гетероарил; або (С6-10)арилом або (С2їх фармацевтично прийнятних солей. 8)циклоалкілом, Термін (С1-6)алкіл, який застосовано при ви5)гетероарилом], (С3-8)циклоалкіл, (С6-10)арил або (С2-5)гетероарил; значенні формули І, означає розгалужений або R6 та R7, незалежно, - Н, (С1-4)алкіл або насинерозгалужений алкіл, який має 1-6 атомів карбочене гетероциклічне 4-8 членне кільце, яке має ну, як-то гексил, пентил, 3-метил-бутил, бутил, гетероатом, обраний з О, S та NR5; або ізобутил, третинний бутил, пропіл, ізопропіл, етил R6 та R7 разом з нітрогеном, з яким вони поєдта метил. нані, утворюють насичене гетероциклічне 4-8 Термін (С2-6)алкіл також означає розгалужений членне кільце, що, як варіант, заміщене одним або або нерозгалужений алкіл, який має 2-6 атомів більше галогенами, а також, як варіант, має один карбону, як-то гексил, пентил, 3-метил-бутил, буабо більше гетероатомів, обраних з О, S та NR5; тил, ізобутил, третинний бутил, пропіл, ізопропіл R8 та R9, незалежно, - Η або (С1-4)алкіл; або та етил. Бажаний (С2-6)алкіл, який застосовано при R8 та R9 разом з атомами, з якими вони поєдвизначенні R2 у формулі І, це н-пропіл. нані, утворюють насичене гетероциклічне 4-8 Термін (С1-4)алкіл означає розгалужений або членне кільце, що, як варіант, має один або більнерозгалужений алкіл, який має 1-4 атомів карбоше гетероатомів, обраних з О, S та NR5; ну, як-то бутил, ізобутил, третинний бутил, пропіл, або їх фармацевтично прийнятні солі, ізопропіл, етил та метил. Термін (С1-8)алкіл ознає інгібіторами катепсину К та катепсину S, які чає розгалужений або нерозгалужений алкіл, який можуть бути застосовані при приготуванні медимає 1-8 атомів карбону, як-то октил, гептан, геккаментів для лікування розладів, пов'язаних з касил, пентил, 3-метил-бутил, бутил, ізобутил, третепсином К та катепсином S, наприклад, атеротинний бутил, пропіл, ізопропіл, етил та метил. склерозу, хвороб кісток, наприклад остеопорозу; Термін (С3-6)циклоалкіл означає циклоалкіл, запалень та імунних розладів, наприклад, ревмаякий має 3-6 атомів карбону, як-то циклогексил, тоїдного артриту та розсіяного склерозу; і хронічциклопентил, циклобутил та циклопропіл. Термін ного болю, наприклад, невропатичного болю. (С3-8)циклоалкіл також означає циклоалкіл, який Інший аспект винаходу стосується похідних 4має 3-8 атомів карбону, як-то циклооктил, циклофеніл-піримідин-2-карбонітрилу загальної формугептан, циклогексил, циклопентил, циклобутил та ли І. циклопропіл. Термін (С6-10)арил означає радикал, похідний з ароматичної групи, яка має 6-10 атомів карбону, як-то феніл та нафтил. Термін (С6-10)арил(С1-4)алкіл означає (С14)алкіл, який заміщено (С6-10)арилом, наприклад, бензилом. Термін (С2-9)гетероарил означає циклічну ароматичну групу, яка має 1-3 гетероатомів, серед яких можуть бути нітроген, оксиген або сульфур, і яку може бути конденсовано з іншим 5-6-членним (гетеро)ароматичним кільцем. Прикладами таких де: гетероарильних груп є: піридил, імідазоліл, піразоR - 1-3 довільні замісники, незалежно обрані з ліл, піримідиніл, тіазоліл, ізотіазоліл, оксазоліл, (С1-6)алкілу (як варіант, заміщеного одним або біізооксазоліл, тіеніл, оксадіазоліл, хіноліл, ізохінольше галогенами), (С1-6)алкілоксилу (як варіант, ліл, бензотіазоліл, бензимідазоліл та інші. Бажазаміщеного одним або більше галогенами), ціано ними гетероарилами є 2-піридил та 3-піридил. та галогену; Термін (С2-5)гетероарил означає циклічну ароR1 - Η або (С1-6)алкіл; матичну 5-6 членну групу, яка має 1-3 гетероатоR2 - (С2-6)алкіл, як варіант, заміщений ОН, (С1мів, серед яких можуть бути нітроген, оксиген або 4)алкілоксилом, одним або більше галогенами, або сульфур. Прикладами таких гетероарилів є: піриNR3R4; дил, імідазоліл, піразоліл, піримідиніл, тіазоліл, R3 та R4, незалежно, - Н, (С1-8)алкіл [як варіізотіазоліл, оксазоліл, ізооксазоліл, тіеніл, оксадіаант, заміщений одним або більше галогенами], (С3золіл та інші. Бажаними гетероарилами є 28)циклоалкіл [як варіант, заміщений одним або піридил та 3-піридил. більше галогенами], насичене гетероциклічне 4-8 Термін (С2-9)гетероарил(С1-4)алкіл означає (С1членне кільце, яке має гетероатом, обраний з О, S 4)алкіл, який заміщено (С2-9)гетероарилом, наприта NR5, (С6-10)арил, (С2-9)гетероарил, (С6-10)арил клад, піридин-4-ілметилом. (С1-4)алкіл або (С2-9)гетероарил(С1-4)алкіл; або За формулою І R3 та R4, та/або R6 та R7, R3 та R4 разом з нітрогеном, з яким вони поєдта/або R8 та R9 разом з нітрогеном, з яким вони нані, утворюють насичене гетероциклічне 4-8 поєднані, можуть утворити насичене гетероцикліччленне кільце, що, як варіант, заміщене одним або не 4-8 членне кільце, наприклад, азетидинове, 9 89633 10 піролідинове, піперидинове або 1Н-азепінове кіль4-[3-(3-диметиламіно-пропіламіно)-пропіл]-6це. Такі кільця можуть містити один або більше (3,4-диметилфеніл)-піримідин-2-карбонітрил; додаткових гетероатомів, серед яких можуть бути 4-(3,4-диметилфеніл)-6-{3-[2-(1-метилО, S або NR5, і утворювати кільця, наприклад, піролідин-2-іл)-етиламіно]-пропіл}-піримідин-2морфолінове, тіоморфолінове, гексагідро-1,4карбонітрил; оксазепінове, піперазинове, гомопіперазинове, 4-(3-циклопропіламіно-пропіл)-6-(3імідазолідинове або тетрагідротіазолове кільце. трифлуорметилфеніл)-піримідин-2-карбонітрил; Термін галоген означає F, СІ, Br, або І. Бажаним 4-[3-(1-(S)-метил-2-метоксіетиламіно)-пропіл]заміщувальним атомом в алкілі є галоген F. Бажа6-(3-трифлуорометилфеніл)-піримідин-2ним алкілом, який заміщає галоген, є трифлуормекарбонітрил; тил. 4-[3-(1-(S)-карбамоіл-етиламіно)-пропіл]-6-(3У винаході бажаними є похідні 4-фенілтрифлуорометилфеніл)-піримідин-2-карбонітрил. піримідин-2-карбонітрилу згідно формули І, в яких 4-[3-(1-(R)-карбамоіл-етиламіно)-пропіл]-6-(3R2 - (С2-6)алкіл, заміщений ОН, (С1-4)алкілоксилом, трифлуорометилфеніл)-піримідин-2-карбонітрил; одним або більше галогенами, або NR3R4. 4-[3-(1-етил-1-метилпропіламіно)-пропіл]-6-(3Також бажаними є сполуки, в яких R2 - пропіл, трифлуорометил феніл )-піримідин-2-карбонітрил; заміщений у положенні 3 NR3R4. 4-[3-(1-метил-циклопропіламіно)-пропіл]-6-(3Більш бажаними є похідні формули І, в якій 4трифлуорометил феніл )-піримідин-2-карбонітрил; феніл включає трифлуорметил, заміщений у мета4-[3-(2-гідроксіетиламіно)-пропіл]-6-(3положенні. трифлуорометилфеніл}-піримідин-2-карбонітрил; Особливо бажаними похідними 4-феніл4-[3-(1-карбамоіл-1-метил-етиламіно)-пропіл]піримідин-2-карбонітрилу винаходу є: 6-(3-трифлуорометилфеніл)-піримідин-24-(3-гідрокси-1-пропіл)-6-(3карбонітрил; трифлуорметилфеніл)-піримідин-2-карбонітрил; 4-[3-(2-оксо-піролідин-3-(S)-іламіно)-пропіл]-64-(3-(піперидин-1-іл)пропіл)-6-(3(3-трифлуорометил феніл )-піримідин-2трифлуорметилфеніл)-піримідин-2-карбонітрил; карбонітрил; або їх фармацевтично прийнятна 4-[3-(1-етил-пропіламіно)-пропіл]-6-(3сіль. трифлуорметилфеніл)-піримідин-2-карбонітрил; В іншому аспекті винахід стосується фармаце4-[3-(4-метил-[1,4]діазепан-1-іл)-пропіл]-6-(3втичних композицій, які включають похідне 4трифлуорметилфеніл)-піримідин-2-карбонітрил; феніл-піримідин-2-карбонітрилу, яке має загальну 4-(3-циклогексиламіно-пропіл)-6-(3формулу І, або його фармацевтично прийнятну трифлуорметилфеніл)-піримідин-2-карбонітрил; сіль з фармацевтично прийнятними добавками. 4-{3-[метил-(1-метил-піперидин-4-іл)-аміно]Похідні 4-феніл-піримідин-2-карбонітрилу запропіл}-6-(3-трифлуорметил]феніл)-піримідин-2гальної Формули І можна отримувати, як зображекарбонітрил; но на схемі 1, конденсацією похідного ацетофено4-[3-(4-метил-піперазин-1-іл)-пропіл]-6-(3ну, формули (II), в якій R має те саме значення, як трифлуорметилфеніл)-піримідин-2-карбонітрил; і визначене раніше, з естером формули R'4-(3-ізопропіламіно-пропіл)-6-(3OC(O)R2, в якій R' означає (С1-6)алкіл, a R2 має те трифлуорметилфеніл)-піримідин-2-карбонітрил; саме значення, як і визначене раніше; з утворен4-[3-(4-піридин-2-іл-піперазин-1-іл)-пропіл]-6ням 1,3-діонового похідного формули (III). Як варі(3-трифлуорметил феніл )-піримідин-2ант, групу R1 можна уводити алкілуванням похідкарбонітрил; ного 1,3-діону у присутності основи, наприклад, 4-[3-(карбамоілметиламіно)-пропіл]-6-(3калій карбонату, та придатного розчиннику, напритрифлуорметилфеніл)-піримідин-2-карбонітрил; клад, ТГФ або ацетону при нагріванні, щоб забез4-[3-(карбоксиметиламіно)-пропіл]-6-(3печити похідне 2-алкіл-1,3-діону, формули (IV). трифлуорметилфеніл)-піримідин-2-карбонітрил; Циклізація 1,3-діону (IV) сечовиною у присутності 4-[3-(2-диметиламіноетиламіно)-пропіл]-6-(3кислоти, наприклад, концентрованого водного гідтрифлуорметилфеніл)-піримідин-2-карбонітрил; рохлориду у придатному розчиннику, наприклад, 4-[3-(2-ацетиламіноетиламіно)-пропіл]-6-(3етанолі при нагріванні, дає похідне 2-гідрокси-4трифлуорметилфеніл)-піримідин-2-карбонітрил; феніл-піримідину формули (V). Обробка сполуки 4-{3-[2-(2-оксо-імідазолідин-1-іл)-етиламіно]формули (V) РОСІ3 при нагріванні дає похідне 2пропіл}-6-(3-трифлуорметилфеніл)-піримідин-2хлоро-4-феніл-піримідину формули (VI), яке при карбонітрил; ціануванні ціанідом міді у розчиннику, наприклад, 4-(3,4-диметилфеніл)-6-[3диметилформаміді або N-метилпіролідиноні та з (метилкарбамоілметиламіно)-пропіл]-піримідин-2мікрохвильовим нагріванням дає 4-фенілкарбонітрил; піримідин-2-карбонітрильне похідне загальної фо4-[3-(2-ацетиламіноетиламіно)-пропіл]-6-(3,4рмули І. Етап ціанування також можна виконувати диметилфеніл)-піримідин-2-карбонітрил; з ціанідом цинку, який є реагентом, разом з каталі4-(3,4-диметил-феніл)-6-{3-[2-(2-оксозатором на основі перехідного металу, наприклад, імідазолідин-1-іл)-етиламіно]-пропіл}-піримідин-2тетракістрифенілфосфін паладієм у придатному карбонітрил; розчиннику, наприклад, диметилформаміді, диметоксіетані або N-метилпіролідиноні. 11 89633 12 В альтернативному способі, що зображено на схемі 2, похідне 1,3-діону формули (IV) обробляють S-метил-ізотіоуриній йодидом у придатному розчиннику, як-то ізопропанолі, та у придатній основі, як-то триетиламіні для утворення похідного 2-метилсульфаніл-4-феніл-піримідину формули (VII). Окиснення похідного формули VII калій моноперсульфатом (Оксон) або м хлоропербензойною кислотою (мХПБК) у придатному розчиннику, наприклад, метанолі, воді, хлороформі або їх суміші, дає похідне 2метансульфоніл-4-феніл-піримідину формули (VIII), яке при взаємодії з натрій ціанідом у придатному розчиннику, наприклад, диметилсульфоксиді дає похідні 4-феніл-піримідин-2-карбонітрилу загальної формули І. В іншому способі, що зображено на схемі 3, похідне естеру -кетону формули (IX), де R2 визначено раніше, конденсують з тіосечовиною у присутності натрій метоксиду для утворення похідного 2-меркапто-4-гідрокси-піримідину формули (X), яке знаходиться в умовах S-метилування з йодометаном у присутності основи, наприклад, калій гідроксиду, яка дає похідне 2метилсульфаніл-4-гідрокси-піримідину формули (XI). Обробка сполук формули XI РОСІ3 дає похідне 2-метилсульфаніл-4-хлоропіримідину формули (XII), окиснення мХПБК дає похідне 2метансульфоніл-4-хлоропіримідину формули (XIII). 13 89633 14 Сполучення XIII з фенілбороновими кислотами з застосуванням каталізатору на основі перехідного металу дає похідні 2-метансульфоніл-4-фенілпіримідину формули (VII), які пізніше можна перетворити у похідні 4-феніл-піримідин-2-карбонітрилу загальної формули І обробкою натрій ціанідом у придатному розчиннику, наприклад, диметилсульфоксиді. В альтернативному способі, зображеному на схемі 4, для уведення фенілу у позицію 4 піримідинової частини, сполука формули XIII (див. схему 3), може реагувати з гексаметилбісстананом для утворення похідного 2-метансульф-оніл-4триметилстаніл-піримідину формули (XIV), яке при реакції з натрій ціанідом у диметилсульфоксиді дає похідне 2-ціано-4-триметилстаніл-піримідину формули (XV). Крім того сполучення сполуки формули XV з арилгалогенідами з каталізатором на основі перехідного металу, як описано в основній літературі по даному предмету, дає похідне 4феніл-піримідин-2-карбонітрилу загальної формули 1. Похідні 4-феніл-піримідин-2-карбонітрилу загальної формули І, в яких R2 представляє (С26)алкіл, заміщений NR3R4, можна переважно отримувати, починаючи з відповідного похідного спирту, як зображено на схемі 5, для сполук винаходу, в яких R2 представляє 3-ОН-пропіл. Окислення підходящого похідного спирту формули (І) перйо динаном Дес-Мартіна, або альтернативним способом окиснення, дає підходяще похідне альдегіду, що відповідає формулі (XVI), яке потім конденсують з аміном формули HNR3R4 в умовах відновного амінування для утворення вищезгаданих похідних 4-феніл-піримідин-2-карбонітрилу винаходу. 15 89633 16 Похідні 4-феніл-піримідин-2-карбонітрилу загальної формули І, в якій R2 представляє (С26)алкілкарбоксильну або карбоксіамідну групу, можна отримувати переважно, починаючи з відповідного спирту, як зображено на схемі 6, для сполук винаходу, в яких R2 представляє 3-ОН-пропіл. Окиснення підходящого похідного спирту формули (І) натрій хлоритом та натрій гіпохлоритом у присутності ΤΕΜΠΟ у якості каталізатору дає відповідну кислоту (XVIII). Сполучення цієї кислоти з первинними або вторинними амінами з різними реагентами сполучення, наприклад, ЕДКІ 1-(3диметиламінопропіл)-3-етилкарбодіімід хлоридом, РуВОР (бензотриазол-1ілокси)трипіролідинофосфоній гексафлуорфосфатом, HBTU [Ν,Ν,Ν',Ν'-тетраметил-О-(бензотриазол1-іл)уроній гексафлуорфосфатом] та іншими, дає відповідний карбоксіамід (XIX), як продукт реакції. В іншому способі, який зображено на схемі 7, для введення фенілу в положення 4 піримідинової частини, сполуки формули XV (див. схема 4) обробляють йодом для утворення похідного 2-ціано4-йодо-піримідину формули (XX). Потім, сполучення типу Стила, Сузукі або Негіші сполуки формули XX з арилбороновими кислотами або іншими підходящими арилметалами з каталізатором на основі перехідного металу, як описано в загальній літературі по даному предмету, дає похідні 4феніл-піримідин-2-карбонітрилу загальної формули І. 17 89633 18 В іншому способі, який зображено на схемі 8, для введення R2 та фенілу у положення 6 та 4, відповідно, піримідинових частин, сполучення сполуки XXI з арилгалогенідами із перехідним металом у якості каталізатору, а потім зняття захисту бензиловою групою, дає сполуки характерної загальної формули І, в якій R2 - 3-гідроксипропіл, які можна додатково дериватизувати згідно схеми 5 для утворення сполук з різними R2 та фенілом у 6 та 4 позиціях піримідинового кільця. Сполуки XXI можна синтезувати згідно схеми 3 і схеми 4 з естером -кетону з R2, як 4бензоксипропілом (XXIV). який можна синтезувати, як зображено на схемі 9. Реакція 4бензоксимасляної кислоти з кислотою Мелдрума, у присутності ізопропенілхлороформіату з DMAP у якості основи, дає ациловане похідне кислоти Мелдрума, яке потім перетворюють у XXIV етанолізом за допомогою кислоти. Альтернативно, сполуку XXIV також можна синтезувати з етил- або метил-ацетоацетату (XXV) за допомогою добре відомої двоаніонної хімії, з 3 бензоксіетилбромідом (XXVI) як засобом алкілування. В отриманні похідних 4-феніл-піримідин-2карбонітрилу загальної формули І, в якій R2 включає основний атом нітрогену аміну (NR3R4 чи NR5), такий нітроген тимчасово захищено, наприклад, лабільною до кислоти t-бутилоксикарбонільною (БОК) захисною групою. Інші придатні захисні групи для функціональних груп, які тимчасово захищено підчас синтезу, добре відомі фахівцям, наприклад, за виданням Wuts, P.G.M. and Greene, T.W.: Protective Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999. 19 Сполуки винаходу, які можуть мати форму вільної основи, їх можна виділити з реакційної суміші у вигляді фармацевтично придатної солі. Фармацевтично придатні солі також можна отримувати реакцією вільної основи формули І та органічної або неорганічної кислоти, наприклад, хлоридної, бромідної, йодидної, сульфатної, фосфатної, оцтової, трифлуорооцтової, пропіонової, гліколевої, малеїнової, малонової, метансульфонової, фумарової, янтарної, винної, лимонної, бензойної та аскорбінової. Сполуки винаходу можуть існувати в сольватованій і в несольватованій формах, включаючи гідратовані форми. Взагалі, сольватовані форми є подібними до несольватованих і знаходяться в рамках даного винаходу. Сполуки винаходу можуть існувати в аморфній, а також в різних кристалічних формах. Взагалі, усі фізичні форми є подібними за застосуванням при розгляді у даному винаході, і охоплені рамками цього винаходу. Похідні 4-феніл-піримідин-2карбонітрилу та їх солі можуть містити хіральний центр в одному або в декількох бічних ланцюгах R, R1-R10, а тому можуть бути чистими енантіомерами, сумішами енантіомерів, або сумішами діастереомерів. Способи асиметричного синтезу, в яких отримують чисті стереоізомери, добре відомі фахівцям, як-то синтез з індукуванням хіральності або починаючи з хіральних проміжних сполук, енантіоселективні ферментні перетворення, розділення стереоізомерів або енантіомерів хроматографією у хіральних середовищах. Наприклад, такі способи описані в Chirality in Industry (edited by A.M. Collins, G.N. Sheldrake and J. Crosby, 1992; John Wiley). Було визначено, що сполуки винаходу є інгібіторами катепсину К та катепсину S людини, а тому в додатковому аспекті винаходу можуть бути застосовані у терапії, а особливо у виготовленні медикаментів для лікування остеопорозу, атеросклерозу і пов'язаних з катепсином К та катепсином S розладів, наприклад,: запалених та імунних розладів, як-то, ревматоїдний артрит, хронічний біль, наприклад, невропатичний біль та інші розлади, пов'язані з анормальною ресорбцією кісток, як-то 89633 20 хвороба Педжета, остеоартрит, остеолітичний рак кісток та метастатична хвороба кісток. Сполуки винаходу можна уводити ентерально або парентерально, для людей бажаною добовою дозою є 0,001-100мг на кг маси тіла, переважно 0,01-10мг на кг маси тіла. У суміші з фармацевтично придатними добавками, наприклад, як описано у стандартному довіднику, Gennaro et at., Remington's Pharmaceutical Sciences, (20th ed, Lippincott Williams & Wilkins, 2000, дивись особливо Part 5: Pharmaceutical Manufacturing) сполуки можна пресувати у тверді дозовані одиниці, наприклад пілюлі, таблетки або капсули чи свічки. З фармацевтично придатними рідинами сполуки також можна застосовувати у формі розчину, суспензії, емульсії, наприклад, для застосування як препарату для ін'єкцій, або як спрею, наприклад, для застосування як назального спрею. Для створення дозованих одиниць, наприклад, таблеток, передбачено застосування звичайних домішок, якто наповнювачі, барвники, полімерні зв'язуючі та інші. Взагалі, можна застосовувати будь-яку фармацевтично прийнятну добавку, яка не взаємодіє з функціональними групами активних сполук. Підходящі носії, з якими можна уводити сполуки, включають лактозу, крохмаль, похідні целюлози та інші, або їх суміші, застосовані в прийнятних кількостях. Винахід додатково ілюстровано наступними прикладами. Способи. Основні хімічні способи. Усі реагенти були узяті із загальних комерційних джерел або синтезовані літературними способами. Протонний ЯМР (1Н ЯМР) реєстрували на спектрометрі Bruker DPX 400, з триметилсиланом, як внутрішнім стандартом. Мас-спектри реєстрували на Shimadzu LC-8A ΡΕ Sciex API 150EX LCMS. Аналіз зворотнофазовою PX-MC проводили на колонці LUNA C18 (5мкм; 30x4,6мм) в умовах градієнту (від 90% води/0,1% мурашиної кислоти до 90% ацетонітрилу/0,1% мурашиної кислоти) при швидкості потоку 4мл/хв. Диметилформамід (ДМФ), N-метилпіролідинон (ΝΜΠ), дихлорометан (ДХМ), диметилсульфоксид (ДМСО), тетрагідрофуран (ТГФ), 1,2-диметоксіетан 21 89633 22 (ДМЕ), рідинна хроматографія високого тиску 1-гідроксибензотриазол (ГОБТ), 2,2,6,6(РХВТ), діізопропілетиламін (ДІПЕА), триетиламін тетраметил-1-піперідинілокси (ΤΕΜΠΟ). (TEA), широкий (br), синглет (s), дублет (d), триПриклад 1 плет (t), трифлуорооцтова кислота (ТФК), трет4-Пропіл-6-(3-трифлуорометилфеніл)бутилоксикарбоніл (БОК), 1-(3піримідин-2-карбонітрил: диметиламінопропіл)-3-етилкарбодіімід НСІ (ЕДКІ), А: 3-Гідрокси-1 -(3-трифлуорометилфеніл)гекса-2-ен-1-он: При перемішуванні до суспензії натрій аміду (0,78г) в етері (40мл), під шаром азоту, додавали 3-трифлуороацетофенон (1,52мл). Суміш перемішували протягом 5хв., потім повільно додавали етилбутират (1,32мл). Кінцеву суміш гріли при кипінні під зворотним холодильником протягом ночі, охолоджували до кімнатної температури, та різко охолоджували у холодній воді (20мл). Етерний шар видаляли, а водний розчин підкислювали НСІ (5М), а потім екстрагували етером (3x20мл). Органічні шари об'єднували, промивали водою (20мл), сушили натрій сульфатом, та випарювали під зменшеним тиском для утворення неочищеного продукту реакції у вигляді масла. Флешхроматографія на оксиді силіцію дала 3-гідрокси-1(3-трифлуорометилфеніл)-гекса-2-ен-1-он у вигляді масла (0,74г). 1 Н ЯМР (CDCI3): 8,12 (s, 1H), 8,06 (d, 1H), 7,77 (d, 1H), 7,59 (t, 1H), 6,19 (s, 1H), 3,88 (br s, 1H), 2,44 (t, 2H), 1,69-1,79 (m, 2H), 1,01 (t, 3H). В: 6-Пропіл-4-(3-трифлуорометилфеніл)-1Нпіримідин-2-он: При перемішуванні суміш 3-гідрокси-1-(3трифлуорметилфеніл)-гекса-2-ен-1-ону (259мг), сечовини (90мг), НСІ (0,15мл, 5М) та етанолу (5мл) гріли при кипінні під зворотним холодильником протягом 16 годин. Потім додавали додаткову сечовину (60мг) та НСІ (0,15мл, 5М) та продовжували нагрівання при кипінні під зворотним холодильником ще протягом 24 годин. Суміші давали охолонути, а розчинник випарювали при зменшеному тиску. Осад розчиняли в суміші етилацетату (20мл) та води (20мл), органічний шар відокремлювали від розчину та додатково промивали насиченим розчином натрій карбонату (20мл), а потім водою (20мл). Етилацетатний екстракт потім сушили натрій сульфатом та випарювали при змен шеному тиску, щоб отримати 6-пропіл-4-(3трифлуорметилфеніл)-1Н-піримідин-2-он у вигляді коричневого сухого залишку (204мг). МС m/z 283,0 (М+1), 100%. С: 2-Хлор-4-пропіл-6-(3-трифлуорметилфеніл)піримідин: Суміш 6-пропіл-4-(3-трифлуорметилфеніл)-1Нпіримідин-2-ону (204мг) та оксихлориду фосфору (3мл) перемішували та гріли при кипінні під зворотним холодильником протягом 72 годин, потім дали охолонути та помістили у суміш лід/етер (20мл). Етерний шар відокремлювали, промивали насиченим розчином натрій карбонату (20мл), сушили натрій сульфатом, та випарювали при зменшеному тиску, щоб отримати 2-хлор-4-пропіл-6-(3трифлуорметилфеніл)-піримідин у вигляді темнокоричневого масла (239мг). МС m/z 301,3 (М+1), 100%. D: 4-Пропіл-6-(3-трифлуорометилфеніл)піримідин-2-карбонітрил: До розчину 2-хлор-4-пропіл-6-(3трифлуорметилфеніл)-піримідину (50мг) у 1метил-2-піролідиноні (2мл), додавали ціанід купруму(І) (60мг). Суспензію нагрівали у мікрохвильовці до 200°С протягом 20хв., потім переливали у суміш етилацетату (10мл) та розчину аміаку (5мл). Органічний шар відокремлювали, промивали водою (10мл), сушили натрій сульфатом та випарювали при зменшеному тиску. Препаративна рідинна хроматографія високого тиску дала заголовну сполуку 4-пропіл-6-(3-трифлуорметилфеніл)піримідин-2-карбонітрил у вигляді коричневої смоли (4,1мг). 1 Н ЯМР (CDCI3): 8,27-8,37 (m, 2H), 7,82 (d, 1H), 7,34 (s, 1H), 7,68 (t, 1H), 2,88 (t, 2Н), 178-1,91 (m, 2Н), 1,03 (t, 3H). МС m/z 292,0 (М+1), 100%. Приклад 2 5-Метил-4-пропіл-6-(3-трифлуорометилфеніл)піримідин-2-карбонітрил: 23 А: 2-метил-1-(3-трифлуорометилфеніл)гексан-1,3-діон: При перемішуванні до суспензії калій карбонату (596мг) в ацетоні (7мл) додавали 3-гідрокси-1(3-трифлуорметилфеніл)-гекса-2-ен-1-он (190мг) з йодометаном (0,45мл). Суміш нагрівали при кипінні під зворотним холодильником протягом 6 годин, охолоджували до кімнатної температури та випарювали розчинник при зменшеному тиску. Утворене масло розчиняли в етилацетаті (20мл), промивали водою (3x20мл), сушили натрій сульфатом та випарювали при зменшеному тиску для утворення неочищеного продукту реакції у вигляді масла. Флеш-хроматографія на діоксиді силіцію дала 2метил-1-(3-трифлуорметилфеніл)-гексан-1,3-діон у вигляді масла (102мг). 1 Н ЯМР (CDCI3): 8,14 (s, 1Η), 8,06 (d, 1H), 7,77 (d, 1H), 7,56 (t, 1H), 4,41 (q, 1H), 2,29-2,48 (m, 2H), 1,46-1,55 (m, 2H), 1,40 (d, 3H), 0,78 (t, 3H). В: 5-метил-6-пропіл-4-(3трифлуорометилфеніл)-1Н-піримідин-2-он: При перемішуванні суміш 2-метил-1-(3трифлуорметилфеніл)-гексан-1,3-діону (102мг), сечовини (45мг), НСІ (0,10мл, 5М) та етанолу (4мл) нагрівали при кипінні під зворотним холодильником протягом 16 годин. Додатково додавали сечовину (30мг) та НСІ (0,10мл, 5М) та безперервно гріли при кипінні під зворотним холодильником протягом 24 годин. Суміш охолоджували, а розчинник випарювали при зменшеному тиску. Осад розчиняли у суміші етилацетату (10мл) та води (10мл), органічний шар відокремлювали та додатково промивали насиченим розчином натрій карбонату (10мл), а потім водою (10мл). Етилацетатний екстракт сушили натрій сульфатом та випарювали при зменшеному тиску, щоб отримати 5-метил-6-пропіл-4-(3-трифлуорметилфеніл)-1Нпіримідин-2-он у вигляді жовтого масла (64мг). МС m/z 297,4 (М+1), 100%. С: 2-хлор-5-метил-4-пропіл-6-(3трифлуорометилфеніл)-піримідин: Суміш 5-метил-6-пропіл-4-(3трифлуорметил!феніл)-1Н-піримідин-2-ону (64мг) та фосфор оксихлориду (3мл) перемішували та гріли при кипінні під зворотним холодильником протягом 24 годин, потім охолоджували та виливали у суміш лід/етер (20мл). Шар етеру відокремлювали, промивали насиченим розчином натрій карбонату (10мл) та водою (10мл), сушили натрій сульфатом та випарювали при зменшеному тиску, щоб отримати 2-хлор-5-метил-4-пропіл-6-(3 89633 24 трифлуорометилфеніл)-піримідин у вигляді масла (64мг). МС m/z 315,0 (М+1), 100%. D: 5-метил-4-пропіл-6-(3трифлуорметилфеніл)-піримідин-2-карбонітрил: До розчину 2-хлор-5-метил-4-пропіл-6-(3трифлуорметилфеніл)-піримідину (50мг) у диметилформаміді (1мл), додавали цинк(ІІ) ціанід (16мг) та тетракіс(трифенїлфосфін)-паладій(0) (16мг). Суспензію нагрівали у мікрохвильовці до 150°С протягом 5хв., потім виливали в етилацетат (50мл) та воду (2x10мл). Органічний шар відокремлювали, сушили натрій сульфатом та випарювали при зменшеному тиску. Препаративна рідинна хроматографія високого тиску дала 5-метил-4пропіл-6-(3-трифлуорметилфеніл)-піримідин-2карбонітрил у вигляді жовтої смоли (11мг). 1 Н ЯМР (CDCI3): 7,63-7,81 (m, 4Н), 2,87 (t, 2Н), 2,39 (s, 3H), 1,80-1,90 (m, 2H), 1,07 (t, 3H). МС m/z 306,4 (М+1), 100%. Приклад 3 4-(3-гідрокси-1-пропіл)-6-(3-трифлуорометил феніл )-піримідин-2-карбонітрил: А: 1. 3-діоксо-6-гідрокси-1-(3'трифлуорофеніл)-гексан: При перемішуванні до суспензії натрій гідриду (60% в парафіновому маслі, 20г) у діетиловому етері (1л) при 0°С додавали етанол (1мл). До вищезгаданої суміші додавали гама-бутиролактон (18г), а потім краплями розчин у діетиловому етері (100мл), 3'-трифлуорметилацетофенону (38г) протягом 30 хвилин. Суміш перемішували при кімнатній температурі протягом 72 годин. Потім для руйнування надлишку натрій гідриду додавали етанол (20мл), а потім водний розчин амоній хлориду (20г на 300мл води). Органічний шар відокремлювали та промивали розбавленою хлоридною кислотою (0,1N, 500мл), а потім водою (2x200мл). Етерний шар сушили натрій сульфатом, розчинник видаляли під зменшеним тиском. Залишок очищали на колонці з силікагелем з бензолом та етилацетатом (1:1) у якості елюенту для утворення 1, 3-діоксо-6гідрокси-1-(3'-трифлуорофеніл)-гексану (32г). 1 Н ЯМР (CDCI3): 8,1 (s, 1H), 8,04 (d, 1H), 7,76(d, 1H), 7,55 (dd, 1H), 6,2 (s, 1H), 3,74 (t, 2Н), 2,61 (t, 2Н), 1,97 (m, 2Н). МС m/z 275 (М+1), 100%. В: 2-метилсульфаніл-4-(3-гідроксипропіл)-6-(3трифлуорометилфеніл)піримідин: До розчину 1, 3-діоксо-6-гідрокси-1-(3'трифлуорофеніл)-гексану (32г) у ізопропанолі (30мл) додавали S-метил-ізотіоураній йодид (34г). Суміш нагрівали до 110°С протягом 4 годин. Після 25 89633 26 охолодження до кімнатної температури додавали 45 хвилин. Суміш промивали водою (3x10мл), сутриетиламін (45мл) та метанол (50мл), і суміш шили натрій сульфатом, та випарювали при змегріли при кипінні під зворотним холодильником у ншеному тиску, щоб отримати 4-(3-оксо-пропіл)-6масляній бані при 85°С протягом 6 годин. Після (3-трифлуорметил-феніл)-піримідин-2-карбонітрил видалення розчиннику та триетиламіну при змену вигляді коричневого сухого залишку (70мг). МС шеному тиску залишок переносили в етилацетат m/z 306,1 (М+1), 100%. (500мл) та воду (500мл). Потім відокремлювали В:4-(3-піперідин-1-іл-пропіл)-6-(3органічний шар, промивали розбавленою хлоридтрифлуорометилфеніл)-піримідин-2-карбонітрил: ною кислотою (0,1N, 500мл), а потім водою До суспензії макропористого ціаноборогідриду (2x300мл). Органічний шар висушували, розчинник (102мг, 2,35ммоль/г) в ацетонітрилі (0,5мл), додавидаляли під зменшеним тиском. Залишок очищавали піперидин (19мл), оцтову кислоту (0,1мл), та ли на колонці з силікагелем з бензолом та етиларозчин 4-(3-оксо-пропіл)-6-(3цетатом (1:1) у якості елюенту для утворення 2трифлуорметилфеніл)-піримідин-2-карбонітрилу метилсульфаніл-4-(3-гідроксипропіл)-6-(3(49мг) в ацетонітрилі (0,5мл). Суміш нагрівали у трифлуорметилфеніл)піримідину (18г). мікрохвильовці при 150°С протягом 10хв., профі1 льтровували через фрітовану трубку з допомогою Н ЯМР (CDCI3): 8,3 (s, 1H), 8,25 (d, 1H), мультифільтрувального пристрою Вакмастера, та 7,76(d, 1H), 7,58 (dd, 1H), 7,28 (s, 1H), 3,74 (t, 2Н), очищали препаративною рідинною хроматографі2,92 (t, 2Н), 2,65 (s, 3H), 2,03 (m, 2Н). МС m/z 329 єю високого тиску. 4-(3-Піперидин-1-іл-пропіл)-6(М+1), 100%. (3-трифлуорометилфеніл)-піримідин-2-карбонітрил С: 2-метансульфаніл-4-(3-гідроксипропіл)-6-(3виділяли, як чисту смолу (12мг). трифлуорометилфеніл)піримідин: 1 Н ЯМР (CDCI3): 8,34 (s, 1H), 8,32 (d, 1H), До розчину 2-метилсульфаніл-4-(3гідроксипропіл)-6-(3-трифлуорметил7,82 (d, 1H), 7,79 (s, 1H), 7,68 (t, 1H), 2,93 (t, 2H), феніл)піримідину (7,8г) у метанолі та воді (200мл, 2,32-2,44 (m, 5H), 1,97-2,05 (m, 2H), 1,49-1,60 (m, 10:1) при перемішуванні додавали ОКСОН (34г). 4H), 1,37-1,45 (m, 2H), 1,23-1,38 (m, 1Н). МС m/z Суміш перемішували при кімнатній температурі 375,3 (М+1), 85%. протягом 3 годин, потім, розбавляли етилацетатом Вищеописаний спосіб було також реалізовано (500мл). Суміш промивали водою (3x500мл). Оріз застосуванням підходящих амінопохідних, щоб ганічний шар сушили натрій сульфатом, розчинник отримати наступні сполуки: видаляли під зменшеним тиском для утворення 24b: 4-(3-Морфолін-4-іл-пропіл)-6-(3метансульфоніл-4-(3-гідроксипропіл)-6-(3трифлуорометилфеніл)-піримідин-2-карбонітрил: 1 трифлуорметилфеніл)-піримідину (8,9г) у вигляді Н ЯМР (CDCI3): 8,28-8,34 (m, 2H), 7,82 (d, неочищеного продукту, який застосовували на 1H), 7,78 (s, 1H), 7,69 (t, 1H), 3,68 (t, 4Н), 2,96 (t, наступному етапі без додаткового очищення. 2Н), 2,38-2,48 (m, 6Н), 1,98-2,07 (m, 2Н). МС m/z 1 Н ЯМР (CDCI3): 8,3-8,4 (m, 2H), 7,8-7,87 (m, 377,4 (М+1), 100%. 2H), 7,68 (dd, 1H), 3,77 (t, 2H), 3,43 (s, 3H), 3,10 (t, 4с: 4-[3-(4,4-Дифлуор-піперидин-1-іл)-пропіл]2H), 2,10 (m, 2H). 6-(3-трифлуорметилфеніл)-піримідин-2D: 4-(3-Гідрокси-пропіл)-6-(3карбонітрил: 1 трифлуорометилфеніл)-піримідин-2-карбонітрил: Н ЯМР (CDCI3): 8,3,-8,33 (m, 2H), 7,83 (d, При перемішуванні до розчину 21H), 7,76 (s, 1H), 7,69 (t, 1H), 2,95 (t, 2Н), 2,55 (brt, метилсульфоніл-4-(3-гідроксипропіл)-6-(34Н), 2,48 (t, 2Н), 1,92-2,05 (m, 6Н). МС m/z 411,3 трифлуор-метилфеніл)піримідину (200мг) у диме(М+1), 100%. тилсульфоксиді (5мл) додавали натрій ціанід 4d: 4-[3-(4-Метил-піперазин-1-іл)-пропіл]-6-(3(27мг). Суміш перемішували при кімнатній темпетрифлуорометилфеніл)-піримідин-2-карбонітрил: 1 ратурі протягом 45хв., потім виливали в етилацеН ЯМР (CDCI3): 8,31-8,33 (m, 2H), 7,82 (d, тат (50мл) та промивали водою (2x50мл). Органіч1H), 7,78 (s, 1H), 7,69 (t, 1H), 2,94 (t, 2Н), 2,30-2,60 ний шар сушили натрій сульфатом, випарювали (br m, 10H), 2,26 (s, 3H), 1,98-2,05 (m, 2H). МС m/z при зменшеному тиску, та очищали препаратив390,1 (М+1), 100%. ною рідинною хроматографією високого тиску. 44е: 4-(3-Циклогексаіламіно-пропіл)-6-(3(3-Гідрокси-пропіл)-6-(3-трифлуорметилфеніл)трифлуорометилфеніл)-піримідин-2-карбонітрил: піримідин-2-карбонітрил відокремлювали, як смолу 1Н ЯМР (CDCI3): 8,31-8,34 (m, 2H), 7,82 (d, (78мг). 1H), 7,78 (s, 1H), 7,68 (t, 1H), 2,97 (t, 2H), 2,71 (t, 1 Н ЯМР (CDCI3): 8,35 (s, 1H), 8,32 (d, 1H), 2H), 2,35-2,45 (m, 1H), 1,92-2,03 (m, 2H), 1,79-1,91 7,83 (d, 1H), 7,80 (s, 1H), 7,69 (t, 1H), 3,77 (t, 2Н), (m, 2H), 1,65-1,77 (m, 2H), 1,54-1,65 (m, 1H), 0,963,05 (t, 2Н), 2,07-2,13 (m, 2Н). МС m/z 308,3 (М+1), 1,32 (m, 5H). МС m/z 389,3 (М+1), 100%. 100%. 4f: 4-(3-Ізопропіламіно-пропіл)-6-(3Приклад 4а трифлуорметилфеніл)-піримідин-2-карбонітрил: 1 4-(3-Піперидин-1-іл-пропіл)-6-(3Н ЯМР (CDCI3): 8,31-8,35 (m, 2H), 7,82 (d, трифлуорометилфеніл)-піримідин-2-карбонітрил: 1H), 7,78 (s, 1H), 7,68 (t, 1H), 2,98 (t, 2Н), 2,80 (квінА: 4-(3-оксо-пропіл)-6-(3тет, 1Н), 2,69 (t, 2H), 1,95-2,02 (m, 2H), 1,05 (d, 6H). трифлуорометилфеніл)-піримідин-2-карбонітрил: МС m/z 349,5 (М+1), 83%. Перйодинан Дес-Мартіна (104мг) додавали до 4g: 4-[3-(Бензил-метил-аміно)-пропіл]-6-(3розчину 4-(3-гідрокси-пропіл)-6-(3трифлуорометилфеніл)-піримідин-2-карбонітрил: 1 трифлуорметилфеніл)-піримідин-2-карбонітрилу Н ЯМР (CDCI3): 8,33 (s, 1H), 8,28 (d, 1H), (50мг) у дихлорметані (5мл), і утворену суспензію 7,82 (d, 1H), 7,69 (s, 1H), 7,67 (t, 1H), 7,20-7,29 (m, перемішували при кімнатній температурі протягом 5Н), 3,49 (s, 2Н), 2,94 (t, 2Н), 2,40-2,50 (brt, 2Н), 27 89633 28 2,23 (s, 3H), 1,97-2,08 (m, 2Н). МС m/z 411,3 (М+1), 4r: 4-[3-(1-Етил-пропіламіно)-пропіл]-6-(3100%. трифлуорометилфеніл)-піримідин-2-карбонітрил: 1 4h: 4-(3-Ізобутиламіно-пропіл)-6-(3Н ЯМР (CDCI3): 8,35 (s, 1H), 8,32 (d, 1H), трифлуорметилфеніл)-піримідин-2-карбонітрил: 7,82 (d, 1H), 7,79 (s, 1H), 7,68 (t, 1H), 2,99 (t, 2Н), 1 Н ЯМР (CDCI3): 8,34 (s, 1H), 8,32 (d, 1H), 2,66 (t, 2Н), 2,33-2,39 (квінтет, 1Н), 1,95-2,02 (m, 7,82 (d, 1H), 7,78 (s, 1H), 7,68 (t, 1H), 2,98 (t, 2Н), 2Н), 1,35-1,47 (m, 4Н), 0,88 (t, 6H). МС m/z 377,5 2,69 (t, 2Н), 2,42 (d, 2Н), 1,95-2,05 (m, 2Н), 1,66(М+1), 100%: 1,78 (m, 1Н), 0,91 (d, 6Н). МС m/z 363,3 (М+1), 98%. 4s: 4-{3-[Метил-(1-метил-піперидин-4-іл)4i: 4-(3-Піролідин-4-ілметил)-аміно]-пропіл}-6аміно]-пропіл}-6-(3-трифлуорметилфеніл)(3-трифлуорометилфеніл)-піримідин-2піримідин-2-карбонітрил: 1 карбонітрил: Н ЯМР (CDCI3): 8,34 (s, 1H), 8,32 (d, 1H), 1 Н ЯМР (CDCI3): 8,54 (d, 2H), 8,34 (s, 1H), 7,82 (d, 1H), 7,77 (s, 1H), 7,68 (t, 1H), 2,87-2,95 (m, 8,30 (d, 1H), 7,83 (d, 1H), 7,75 (s, 1H), 7,68 (t, 1Н), 4H), 2,51 (t, 2H), 2,29-2,37 (m, 1H), 2,25 (s, 6H), 7,24-7,27 (m, 2Н), 3,82 (s, 2Н), 3,00 (t, 2Н), 2,73 (t, 1,88-2,01 (m, 4H), 1,53-1,70 (m, 4Н). МС m/z 418,3 2Н), 2,00-2,09 (m, 2Н). МС m/z 398,0 (М+1), 100%. (М+1), 58%. 4j: 4-(3-Піролідин-1-іл-пропіл)-6-(34t: 4-[3-(2,2,2-Трифлуор-етиламіно)-пропіл]-6трифлуорметилфеніл)-піримідин-2-карбонітрил: (3-трифлуорометилфеніл)-піримідин-21 карбонітрил: Н ЯМР (CDCI3): 8,35 (s, 1H), 8,32 (d, 1H), 1 Н ЯМР (MeOD): 8,51 (s, 1H), 8,48 (d, 1H), 7,82 (d, 1H), 7,79 (s, 1H), 7,68 (t, 1H), 2,97 (t, 2H), 2,44-2,56 (m, 6H), 2,00-2,07 (m, 2H), 1,74-1,79 (m, 8,24 (s, 1H), 7,91 (d, 1H), 7,79 (t, 1H), 3,92 (q, 2H), 4H). MC m/z 361,1 (М+1), 100%. 3,21 (t, 2H), 3,08 (t, 2H), 2,21-2,29 (m, 2H). МС m/z 4k: 4-(3-Азепан-1-іл-пропіл)-6-(3389,1 (М+1), 58%. трифлуорометилфеніл)-піримідин-2-карбонітрил: 4u: 4-[3-(4-Метил-[1,4]діазепан-1-іл)-пропіл]-61 (3-трифлуорометилфеніл)-піримідин-2Н ЯМР (CDCI3): 8,34 (s, 1H), 8,32 (d, 1H), карбонітрил: 7,82 (d, 1H), 7,78 (s, 1H), 7,68 (t, 1H), 2,94 (t, 2H), 1 Н ЯМР (CDCI3): 8,32-8,34 (m, 2H), 7,82 (d, 2,58-2,61 (m, 4H), 2,53 (t, 2H), 1,94-2,01 (m, 2H), 1,54-1,67 (m, 8H). MC m/z 389:3(M+1), 100%. 1H), 7,79 (s, 1H), 7,69 (t, 1H), 2,94 (t, 2Н), 2,68-2,71 4l: 4-[3-(Азациклоокт-1-ил)-пропіл]-6-(3(m, 4Н), 2,53-2,62 (m, 6Н), 2,34 (s, 3H), 1,94-2,02 трифлуорометилфеніл)-піримідин-2-карбонітрил: (m, 2H), 1,76-1,82 (m, 2H). МС m/z 404,5 (М+1), 1 100%. H ЯМР (CDCI3): 8,35 (s, 1H), 8,32 (d, 1H), 4v: 4-(3-[1,4]Оксазепан-4-іл-пропіл)-6-(37,82 (d, 1H), 7,77(s, 1H), 7,68 (t, 1H), 2,98 (t, 2H), трифлуорметилфеніл)-піримідин-2-карбонітрил: 2,48-2,58 (m, 6H), 1,91-2,00 (m, 2H), 1,51-1,72 (m, 1 Н ЯМР (CDCI3): 8,39 (s, 1H), 8,31 (d, 1H), 10H). MC m/z 403,5 (M+1), 100%. 4m: 4-(3-Циклопентиламіно-пропіл)-6-(37,86 (s, 1H), 7,83 (d, 1H), 7,68 (t, 1H), 3,97 (t, 2Н), трифлуорометилфеніл)-піримідин-2-карбонітрил: 3,87 (t, 2Н), 2,07-3,77 (m, 12Н). МС m/z 391,1 (М+1), 1 100%. H ЯМР (CDCI3): 8,36 (s, 1H), 8,30 (d, 1H), 4w: 4-(3-Феніламіно-пропіл)-6-(37,81-7,84 (m, 2H), 7,67 (t, 1H), 3,48 (brt, 1H), 3,08трифлуорометилфеніл-піримідин-2-карбонітрил: 3,20 (br m, 2H), 3,04 (t, 2H), 2,26-2,33 (m, 2H), 2,001 2,13 (m, 2H), 1,71-1,84 (m, 4H), 1,57-1,68 (m, 2H). Н ЯМР (CDCI3): 8,31 (s, 1H), 8,26 (d, 1H), MC m/z 375,3 (M+1), 100%. 7,81 (d, 1H), 7,72 (s, 1H), 7,66 (t, 1H), 7,16 (t, 2H), 4n: 4-(3-Циклогептиламіно-пропіл)-6-(36,70 (t, 1H), 6,60 (d, 2H), 3,72 (brs, 1H), 3,27 (t, 2H), трифлуорометилфеніл)-піримідин-2-карбонітрил: 3,03 (t, 2H), 2,15-2,19 (m, 2Н). МС m/z 383,1 (М+1), 1 58%. H ЯМР (CDCI3): 8,35 (s, 1H), 8,32 (d, 1H), 4х: 4-[3-(4-Піридин-2-іл-бензиламіно)-пропіл]-67,82 (d, 1H), 7,79 (s, 1H), 7,68 (t, 1H), 2,97 (t, 2H), (3-трифлуорометилфеніл)-піримідин-22,67 (t, 2H), 2,58-2,64 (m, 1H), 1,95-2,02 (m, 2H), карбонітрил: 1,24-1,84 (m, 12H). MC m/z 403,5 (M+1), 100%. 1 Н ЯМР (CDCI3): 8,68 (d, 1H), 8,34 (s, 1H), 4o: 4-[3-(Циклогексаілметил-аміно)-пропіл]-6(3-трифлуорметилфеніл)-піримідин-2-карбонітрил: 8,27 (d, 1H), 7,94 (d, 2H), 7,63-7,81 (m, 5Н), 7,41 (d, 1 2H), 7,21-7,23 (m, 1H), 3,86 (s, 2H), 2,99 (t, 2H), 2,74 H ЯМР (CDCI3): 8,35 (s, 1H), 8,32 (d, 1H), (t, 2H), 2,00-2,07 (m, 2H). МС m/z 474,1 (М+1), 42%. 7,82 (d, 1H), 7,78 (s, 1H), 7,68 (t, 1H), 2,97 (t, 2H), 4у: 4-[3-(4-Феніл-піперазин-1-іл)-пропіл]-6-(32,68 (t, 2H), 2,43 (d, 2H), 1,96-2,04 (m, 2H), 0,85трифлуорометилфеніл)-піримідин-2-карбонітрил: 1,77 (m, 11H). MC m/z 403,5 (M+1), 100%. 1 Н ЯМР (MeOD): 8,51 (s, 1H), 8,47 (d, 1H), 4p: 4-(3-Трет-бутиламіно-пропіл)-6-(3трифлуорометилфеніл)-піримідин-2-карбонітрил: 8,24 (s, 1H), 7,90 (d, 1H), 7,77 (t, 1H), 7,21 (t, 2H), 1 6,93 (d, 2H), 6,83 (t, 1H), 3,11-3,15 (m, 4H), 2,99 (t, H ЯМР (CDCI3): 8,35 (s, 1H), 8,32 (d, 1H), 2H), 2,63-2,68 (m, 4H), 2,53 (t, 2H), 2,05-2,13 (m, 7,82 (d, 1H), 7,79 (s, 1H), 7,68 (t, 1H), 2,99 (t, 2H), 2H). MC m/z 452,1 (М+1), 100%. 2,66 (t, 2H), 1,94-2,01 (m, 2H), 1,11 (s, 9H). MC m/z 4z: 4-[3-(4-Бензил-піперазин-1-іл)-пропіл]-6-(3363,3 (M+1), 100%. трифлуорометилфеніл)-піримідин-2-карбонітрил: 4q: 4-[3-(2,2-Диметил-пропіламіно)-пропіл]-61 (3-трифлуорометилфеніл)-піримідин-2Н ЯМР (CDCI3): 8,31-8,34 (m, 2H), 7,82 (d, карбонітрил: 1H), 7,78 (s, 1H), 7,67 (t, 1H), 7,25-7,32 (m, 5H), 3,48 1 (s, 2H), 2,93 (t, 2H), 2,38-2,55 (m, 10H), 1,97-2,05 H ЯМР (CDCI3): 8,34 (s, 1H), 8,32 (d, 1H), (m, 2H). MC m/z 466,0 (М+1), 100%. 7,82 (d, 1H), 7,78 (s, 1H), 7,68 (t, 1H), 2,99 (t, 2H), 2,69 (t, 2H), 2,34 (s, 2H), 1,97-2,04 (m, 2H), 0,90 (s, 9H). MC m/z 377,5 (M+1), 100%. 29 89633 30 4a': 4-[3-(4-Піридин-2-іл-піперазин-1-іл)метилсульфаніл-6-пропіл-піримідин (17,5г, 100%) у пропіл]-6-(3-трифлуорметилфеніл)-піримідин-2вигляді оранжевого масла. карбонітрил: 1Н ЯМР (CDCI3) : 6,85 (s, 1H); 2,7-2,6 (m, 2H); 1 Н ЯМР (CDCI3): 8,35 (s, 1H), 8,32 (d, 1H), 2,57 (s, 3H); 1,8-1,7 (m, 2H); 0,97 (t, J=7Гц, 3H). 8,18 (d, 1H), 7,82 (d, 1H), 7,80 (s, 1H), 7,68 (t, 1H), D: 4-хлор-2-метансульфоніл-6-пропіл7,47 (t, 1H), 6,60-6,65 (m, 2H), 3,51-3,53 (m, 4H), піримідин: 2,98 (t, 2H), 2,54-2,57 (m, 4Н), 2,48 (t, 2Н), 2,03-2,11 м-Хлоропербензойну кислоту (65,0г, (m, 2Н). MC m/z 453,0 (М+1), 100%. 378ммоль) додавали порціями протягом 15 хвилин Приклад 5а до розчину 4-хлор-2-метилсульфаніл-6-пропіл4-(3-Ізопропіл-феніл)-6-пропіл-піримідин-2піримідину (17,5г, 84ммоль) у ДХМ (350мл) при карбонітрил: 0°С. Суміш перемішували при кімнатній темпераА: 2-меркапто-6-пропіл-піримідин-4-ол: турі протягом 24 годин, потім профільтровували. Натрій (4,6г) порціями додавали до метанолу Залишок далі промивали незначною кількістю (150мл) при 0°С. Суміш перемішували при кімнатДХМ, водного розчину натрій метабісульфіту, води ній температурі до повного розчинення. Після охота розтирали у порошок у насиченому розчині налодження до 0°С додавали порціями тіосечовину трій гідрокарбонату, профільтровували і потім (11,0г), і суміш перемішували до повного розчипромивали водою, висушували під зменшеним нення. Етил бутирилацетат (15,8г) у метанолі тиском, щоб отримати 4-хлор-2-метансульфоніл-6(200мл) додавали краплями при 0°С протягом 30 пропіл-піримідин (18,3г, 93%) у вигляді білого твехвилин. Суміш гріли при кипінні під зворотним хордого продукту (т.пл.=73°С). 1 лодильником протягом 9 годин, потім концентруН ЯМР (CDCI3) : 7,43 (s, 1Н); 3,37 (s, 3H); вали під зменшеним тиском. Залишок розчиняли у 2,87 (t, J=1Гц, 2Н); 1,9-1,7 (m, 2H); 1,02 (t, J=7Гц, воді. Після підкислення оцтовою кислотою до 3H). рН=6 та збовтування протягом 1 години суміш віЕ: 4-(3-ізопропіл-феніл)-2-метансульфоніл-6дфільтровували. Залишок далі промивали водою пропіл-піримідин: та ізопропанолом, потім висушували під зменшеКалій карбонат (0,850г, 6ммоль), воду (1мл) та ним тиском, щоб отримати 2-меркапто-6-пропілтетракіс(трифенілфосфін)паладій (0,695г, піримідин-4-ол (14,1) у вигляді білих кристалів 0,6ммоль) поступово додавали під атмосферою (т.пл.=220°С). азоту у суміш 4-хлор-2-метансульфоніл-6-пропіл1 Н ЯМР (ДМСО-d6) : 12,2 (br. s, 2Н); 5,68 (s, піримідину (1,17г, 5ммоль) та 3-ізопропіл1Н); 2,32 (t, J=7Гц, 2Н); 1,60-1,50 (m, 2Н); 0,88 (t, фенілборонової кислоти (0,984г, ммоль) у димеJ=7Гц, 3H). токсіетані (40мл). Суміш гріли при кипінні під звоВ: 2-метилсульфаніл-6-пропіл-піримідин-4-ол: ротним холодильником протягом 18 годин, потім 1Η розчин калій гідроксиду у метанолі (110мл) концентрували під зменшеним тиском. Залишок додавали краплями при 0°С до суспензії 2розподіляли між етилацетатом та водою. Водний меркапто-6-пропіл-піримідин-4-олу (17,0г) у меташар двічі екстрагували етилацетатом. Поєднані нолі (220мл). Суміш перемішували при кімнатній органічні шари сушили натрій сульфатом, профітемпературі протягом 15 хвилин. Після охолольтровували та концентрували під зменшеним дження до 0°С, йодметан (6,8мл) додавали краптиском. Залишок хроматографували через силікалями протягом 15 хвилин. Суміш перемішували гель (елюент: циклогексан/етилацетат 7/3), щоб при кімнатній температурі протягом 6 годин, потім отримати жовте масло, яке кристалізували у пенпрофільтровували. Перший залишок далі промитані. Після фільтрування, 4-(3-ізопропіл-феніл)-2вали метанолом, водою, ізопропанолом, а потім метансульфоніл-6-пропіл-піримідин (0,380г) отривисушували під зменшеним тиском. Фільтрат конмували у вигляді білого твердого продукту центрували під зменшеним тиском, розтирали у (т.пл.=82°С). 1 порошок у воді, профільтровували. Другий залиН ЯМР (CDCI3) : 8,0-7,9 (m, 2Н); 7,71 (s, 1Н); шок далі промивали метанолом, водою, ізопропа7,5-7,4 (m, 2Н); 3,43 (s, 3H); 3,1-3,0 (m, 1Н); 2,95нолом, потім висушували під зменшеним тиском. 2,85 (m, 2Н); 1,95-1,85 (m, 2Н); 1,32 (d, J=7Гц, 6Н); Обидва залишки об'єднували, отримуючи 21,03 (t, J=7Гц, 3H). МС m/z 319,1 (М+1). Рідинна метилсульфаніл-6-пропіл-піримідин-4-ол (15,5г) у хроматофафія високого тиску (200-400нм): 99,3%. вигляді білих кристалів (т.пл.=158°С). F: 4-(3-ізопропіл-феніл)-6-пропіл-піримідин-21 Н ЯМР (ДМСО-d6) : 5,93 (s, 1Н); 2,47 (s, 3H); карбонітрил: 2,45-2,35 (m, 2H); 1,65-1,55 (m, 2H); 0,89 (t, J=7Гц, Натрій ціанід (65мг, 1,32ммоль) додавали при 3H). кімнатній температурі до 4-(3-25 ізопропіл-феніл)С: 4-хлор-2-метилсульфаніл-6-пропіл2-метансульфоніл-6-пропіл-піримідину (211мг) на піримідин: ДМСО (2мл). Суміш перемішували при кімнатній Суспензію 2-метилсульфаніл-6-пропілтемпературі протягом 2 годин, потім розподіляли піримідин-4-олу (15,5г) у фосфор оксихлориді між етилацетатом та водою. Водний шар двічі екс(160мл) гріли при кипінні під зворотним холодильтрагували етилацетатом. Поєднані органічні шари ником протягом 6 годин. Розчинник відганяли під промивали розсолом, сушили натрій сульфатом, зменшеним тиском. Залишок розбавляли дихлопрофільтровували та концентрували під зменшерометаном та виливали на лід. Шари відокремлюним тиском. Залишок хроматографували через вали, потім водний шар двічі екстрагували етиласилікагель (елюент: циклогексан/етилацетат 7/3), цетатом. Поєднані органічні шари сушили натрій щоб отримати рожеве масло, яке кристалізували у сульфатом, профільтровували та концентрували пентані. Після фільтрування 4-(3-ізопропіл-феніл)під зменшеним тиском, щоб отримати 4-хлор-2 31 89633 32 2-ціано-6-пропіл-піримідин (164мг) отримували у m/z 238,2 (М+1). Рідинна хроматографія високого вигляді білого твердого продукту (т.пл.=64°С). тиску (200-400нм): 99,1%. 1 Приклад 6а Н ЯМР (CDCI3) : 7,98 (s, 1H); 7,90-7,85 (m, 4-(3,5-Біс-трифлуорметил-феніл)-6-пропіл1H); 7,71 (s, 1H); 7,5-7,4 (m, 2H); 3,10-2,95 (m, 1Н); піримідин-2-карбонітрил: 2,85-2,75 (m, 2Н); 1,90-1,80 (m, 2Н); 1,32 (d, J=7Гц, А: 2-Метансульфоніл-4-пропіл-66Н); 1,02 (t, J=7Гц, 3H). МС m/z 266,1 (М+1). Рідинтриметилстананіл-піримідин: на хроматографія високого тиску (200-400нм): Тетракіс(трифенілфосфін)паладій (2,48г, 98,5%. 2,1ммоль) та гексаметил-дистанан (20г, Вищеописаний спосіб також реалізовували, з 61,4ммоль) поступово додавали під атмосферою допомогою похідних підходящої боронової кислоазоту у суміш 4-хлор-2-метансульфоніл-6-пропілти, щоб отримати наступні сполуки: піримідину (12,8г, 54,5ммоль), літій хлориду (2,8г, 5b: 4-Феніл-6-пропіл-піримідин-2-карбонітрил: 1 66ммоль) та 2,6-ди-трет-бутил-4-метилфенолу Н ЯМР (CDCI3) : 8,15-8,05 (m, 2Н); 7,71 (s, (0,18г, 0,82ммоль) у діоксані (240мл). Суміш гріли 1Н); 7,60-7,45 (m, 3H); 2,90-2,80 (m, 2Н); 1,90-1,80 при кипінні під зворотним холодильником протягом (m, 2Н); 1,03 (t, J=7Гц, 3H). МС m/z 224,1 (М+1). 3 годин, потім охолоджували до кімнатної темпеРідинна хроматографія високого тиску (200ратури та профільтровували. Фільтрат концентру400нм): 97,1%. вали під зменшеним тиском. Залишок хроматог5с: 4-(3-Ізопропіл-6-метокси-феніл)-6-пропілрафували через силікагель (елюент: піримідин-2-карбонітрил: 1 циклогексан/етилацетат 8/2), щоб отримати 2Н ЯМР (CDCI3) : 8,01 (s, 1H); 7,91 (s, 1H); метансульфоніл-4-пропіл-6-триметилстананіл7,35 (d, J=8Гц, 1Н); 6,97 (d, J=8Гц, 1Н); 3,90 (s, 3H); піримідин (9,5г, 48%) у формі жовтого масла. 3,1-2,9 (m, 1Н); 2,85-2,75 (m, 2Н); 1,85-1,75 (m, 2Н); 1 Н ЯМР (CDCI3) : 7,51 (s, 1Н); 3,39 (s, 3H); 1,28 (d, J=7Гц, 6Н); 1,01 (t, J=7Гц, 3H). МС m/z 2,81 (t, J=7Гц, 2Н); 1,9-1,8 (m, 2H); 1,02 (t, J=7Гц, 296,2 (М+1). Рідинна хроматографія високого тис3H); 0,44 (s, 9H). ку (200-400нм): 98,3%. В: 4-Пропіл-6-триметилстананіл-піримідин-25d: 4-(3-Трифлуорометокси-феніл)-6-пропілкарбонітрил: піримідин-2-карбонітрил: 1 Натрій ціанід (0,63г, 12,9ммоль) додавали при Н ЯМР (CDCI3) : 8,05 (d, J=8Гц, 1Н); 7,98 (s, кімнатній температурі до 2-метансульфоніл-41H); 7,71 (s, 1H); 7,58 (t, J=8Гц, 1Н); 7,42 (d, J=8Гц, пропіл-6-триметилстананіл-піримідину (2,34г, 1Н); 2,9-2,8 (m, 2H); 1,9-1,8 (m, 2H); 1,03 (t, J=7Гц, 6,5ммоль) у ДМСО (23мл). Суміш перемішували 3H). МС m/z 308,1 (М+1). Рідинна хроматографія при кімнатній температурі протягом 2 годин, потім високого тиску (200-400нм): 97,1%. розподіляли між етилацетатом та водою. Водний 5е: 4-(4-Флуор-3-метил-феніл)-6-пропілшар двічі екстрагували етилацетатом. піримідин-2-карбонітрил: 1 Поєднані органічні шари промивали розсолом, Н ЯМР (CDCI3) : 7,99 (d, J=8Гц, 1Н); 7,95сушили натрій сульфатом, профільтровували кон7,90 (m, 1H); 7,65(s, 1H); 7,15 (t, J=8Гц, 1H); 2,9-2,8 центрували під зменшеним тиском. Залишок хро(m, 2Н); 2,37 (s, 3H); 1,9-1,8 (m, 2H); 1,02 (t, J=7Гц, матографували через силікагель (елюент: цикло3H). МС m/z 256,1 (М+1). Рідинна хроматографія гексан/етилацетат 9/1) для утворення 4-пропіл-6високого тиску (200-400нм): 97,1%. триметилстананіл-піримідин-2-карбонітрилу (1,53г, 5f: 4-(2,3-Диметил-феніл)-6-пропіл-піримідин76%) у формі білого твердого продукту 2-карбонітрил: 1 (т.пл.=62°С). Н ЯМР (CDCI3) : 7,40-7,35 (m, 1Н); 7,3-7,1 (m, 1 Н ЯМР (CDCI3) : 7,47 (s, 1H); 2,80-2,65 (t, 3H); 2,85-2,75 (m, 2Н); 2,35 (s, 3H); 2,25 (s, 3H); J=7Гц, 2Н); 1,8-1,7 (m, 2H); 0,99 (t, J=7Гц, 3H); 0,41 1,85-1,75 (m, 2Н); 1,03 (t, J=7Гц, 3H). МС m/z 252,3 (s, 9H). (М+1). Рідинна хроматографія високого тиску (200С: 4-(3,5-біс-трифлуорометил-феніл)-6-пропіл400нм): 99,6%. піримідин-2-карбонітрил: 5g: 4-(3-хлор-4-флуор-феніл)-6-пропілБіс(трифенілфосфін)пападій дихлорид (34мг, піримідин-2-карбонітрил: 1 0,05ммоль) додавали під атмосферою азоту у суН ЯМР (CDCI3) : 8,21 (d, J=8Гц, 1H); 8,1-8,0 міш 4-пропіл-6-триметилстананіл-піримідин-2(m, 1H); 7,66 (s, 1H); 7,35-7,20 (m, 1H); 2,9-2,8 (m, карбонітрилу (155мг, 0,50ммоль) та 3,5-біс2H); 1,90-1,75 (m, 2H); 1,03 (t, J=7Гц, 3H). MC m/z трифлуорметил-бромбензолу (0,10мл, 0,58ммоль) 276/278 (М+1). Рідинна хроматографія високого у диметилформаміді (3мл). Суміш гріли при кипінні тиску (200-400нм): 93,3%. під зворотним холодильником протягом 4 годин, 5h: 4-(3,5-Дихлор-феніл)-6-пропіл-піримідин-2потім концентрували під зменшеним тиском. Закарбонітрил: 1 лишок розподіляли між етилацетатом та водою. Н ЯМР (CDCI3) : 8,00 (s, 2H); 7,68 (s, 1H); Водний шар двічі екстрагували етилацетатом. По7,55 (s, 1H); 2,9-2,8 (m, 2H); 1,9-1,8 (m, 2Н); 1,03 (t, єднані органічні шари концентрували під зменшеJ=7Гц, 3H). МС m/z 292/294 (М+1). Рідинна хроманим тиском. Залишок хроматографували через тографія високого тиску (200-400нм): 93,7%. силікагель (елюент: ДХМ), щоб отримати твердий 5і: 4-(3-Метил-феніл)-6-пропіл-піримідин-2продукт, розтертий у порошок у пентані. Після фікарбонітрил: 1 льтрування, 4-(3,5-біс-трифлуорметил-феніт)-6Н ЯМР (CDCI3) : 7,94 (s, 1Н); 7,88 (d, J=8Гц, пропіл-піримідин-2-карбонітрил (63мг, 35%) отри1Н); 7,71 (s, 1H); 7,45-7,35 (m, 2H); 2,9-2,8 (m, 2Н); мували у формі білого твердого продукту 2,47 (s, 3H); 1,9-1,8 (m, 2Н); 1,03 (t, J=7Гц, 3H). МС (т.пл.=112°С). 33 89633 34 6m: 4-(3-Флуор-4-метил-феніл)-6-пропілН ЯМР (CDCI3) : 8,56 (s, 2Н); 8,07 (s, 1Н); піримідин-2-карбонітрил: 7,80 (s, 1Н); 2,92 (t, J=8Гц, 2Н); 1,95-1,85 (m, 2H); 1 Н ЯМР (CDCI3) : 7,79 (d, 2Н), 7,65 (s, 1Н), 1,05 (t, J=7Гц, 3H). МС m/z 360,3 (М+1). Рідинна хроматографія високого тиску (200-400нм): 99,4%. 7,34 (t, J=7,8Гц, 1Н), 2,84 (t, J=7,6Гц, 2Н), 2,37 (s, Вищеописаний спосіб також реалізовували, 3H), 1,83 (m, 2H), 1,02 (t, J=7,2Гц, 3H). МС m/z 256 застосовуючи підходящі бром- або йодфенільні (М+1). Рідинна хроматографія високого тиску (200похідні, щоб отримати наступні-сполуки: 400нм): 98,9%. 6b: 4-(3-Хлор-феніл)-6-пропіл-піримідин-2Вищеописаний спосіб було модифіковано для карбонітрил: отримання наступних сполук, застосовуючи підхо1 дящі бром- або йодфенільні похідні у киплячому Н ЯМР (CDCI3) : 8,10 (s, 1Н); 7,99 (d, J=8Гц, під зворотним холодильником 1,2-дихлороетані як 1Н); 7,69 (s, 1H); 7,6-7,4 (m, 2H); 2,86 (t, J=7Гц, 2H); розчиннику замість ДМФ. 1,90-1,75 (m, 2Н); 1,03 (t, J=1Гц, 3H). МС m/z 6n: 4-(4-Хлор-3-флуор-феніл)-6-пропіл258/260 (М+1). Рідинна хроматографія високого піримідин-2-карбонітрил: тиску (200-400нм): 94,9%. 1 Н ЯМР (CDCI3) : 8,0-7,9 (m, 1Н); 7,86 (d, 6с: 4-(3,4-Дихлор-феніл)-6-пропіл-піримідин-2карбонітрил: J=8Гц, 1Н); 7,67 (s, 1H); 7,6-7,5 (m, 1H); 2,86 (t, 1 J=8Гц, 2Н); 1,95-1,80 (m, 2H); 1,03 (t, J=7Гц, 3H). Н ЯМР (CDCI3) : 8,23 (s, 1Н); 7,96 (d, J=8Гц, МС m/z 276/278 (М+1). Рідинна хроматографія 1Н); 7,67 (s, 1H); 7,62 (d, J=8Гц, 1Н); 2,86 (t, J=8Гц, високого тиску (200-400нм): 97,6%. 2Н); 1,9-1,8 (m, 2H); 1,03 (t, J=7Гц, 3H). МС m/z 6о: 4-(3-Хлор-4-ціано-феніл)-6-пропіл292/294 (М+1). Рідинна хроматографія високого піримідин-2-карбонітрил: тиску (200-400нм): 99,3%. 1 Н ЯМР(СОСІ3) : 8,28 (s, 1Н); 8,11 (d, J=8Гц, 6d: 4-(4-Хлор-3-трифлуорометил-феніл)-6пропіл-піримідин-2-карбонітрил: 1H);7,85(d, J=8Гц, 1H);7,73 (s, 1H); 2,89 (t, J=7Гц, 1 2H); 1,95-1,80 (m, 2H); 1,03 (t, J=7Гц, 3H). МС m/z Н ЯМР (CDCI3) : 8,42 (s, 1H); 8,26 (d, J=8Гц, 283/285 (М+1). Рідинна хроматографія високого 1Н); 7,75-7,65 (m, 2H); 2,87 (t, J=,8Гц, 2Н); 1,9-1,8 тиску (200-400нм): 98,1%. (m, 2H); 1,04 (t, J=7Гц, 3H). МС m/z 326/328 (М+1). 6r: 4-Пропіл-6-(3,4,5-трифлуор-феніл)Рідинна хроматографія високого тиску (200піримідин-2-карбонітрил: 400нм): 98,9%. 1 Н ЯМР (CDCI3) : 7,81 (m, 2H), 7,63 (s, 1H), 6е: 4-(4-Ціано-3-метил-феніл)-6-пропілпіримідин-2-карбонітрил: 2,87 (t, J=7,6Гц, 2Н), 1,85 (m, 2H), 1,03 (t, J=8Гц, 1 3H). МС m/z 278 (М+1). Рідинна хроматографія Н ЯМР (CDCI3) : 8,10 (s, 1H); 7,99 (d, J=8Гц, високого тиску (200-400нм): 98,6%. 1Н); 7,77 (d, J=8Гц, 1Н); 7,73 (s, 1H); 2,88 (t, J=8Гц, Приклад 7а 2H); 2,68 (s, 3H); 1,9-1,8 (m, 2H); 1,03 (t, J=7Гц, 3H). 4-[3-(Піридин-2-іл-аміно)-пропіл]-6-(3МС m/z 263,2 (М+1). Рідинна хроматографія висотрифлуорметиліфеніл)-піримідин-2-карбонітрил кого тиску (200-400нм): 99,5%. гідрохлорид: 6f: 4-(3-Хлор-4-метил-феніл)-6-пропілДо розчину 4-(3-оксопропіл)-6піримідин-2-карбонітрил: 1 (трифлуорметилфеніл)-піримідин-2-карбонітрилу Н ЯМР (CDCI3) : 8,11 (s, 1Н); 7,91 (d, J=8Гц, (91мг) у дихлорометані (6мл) додавали оцтову 1Н); 7,66 (s, 1Η); 7,39 (d, J=8Гц, 1Н); 2,84 (t, J=8Гц, кислоту (36мл, 2еквів.), а потім 2-амінопіридином 2H); 2,47 (s, 3H); 1,9-1,8 (m, 2Н); 1,03 (t, J=7Гц, 3H). (1,3еквів.). Розчин перемішували при кімнатній МС m/z 272/274 (М+1). Рідинна хроматографія температурі протягом 15 хвилин, потім додавали високого тиску (200-400нм): 99,3%. натрій триацетоксиборогідрид (2еквів.) та перемі6g: 4-(4-Метил-3-трифлуорметил-феніл)-6шували суміш протягом 18 годин при кімнатній пропіл-піримідин-2-карбонітрил: 1 температурі. Додавали холодний, розбавлений Н ЯМР (CDCI3) : 8,33 (s, 1H); 8,20 (d, J=8Гц, розчин натрій карбонату, суміш перемішували 1Н); 7,71 (s, 1H); 7,47 (d, J=8Гц, 1Η); 2,86 (t, J=7Гц, протягом 10хв., органічний шар відокремлювали. 2H); 2,59 (s, 3H); 1,90-1,75 (m, 2H); 1,03 (t, J=7Гц, Неочищений продукт хроматографували у 2г ко3H). МС m/z 306,1 (М+1). Рідинна хроматографія лонці з силікагелем, елюючи сумішшю дихлоромевисокого тиску (200-400нм): 97,8%. таном: етанол 99:1 для утворення 4-[3-(піридин-26h: 4-(4-Флуор-3-трифлуорометил-феніл)-6іл-аміно)-пропіл]-6-(3-трифлуорметилфеніл)пропіл-піримідин-2-карбонітрил: 1 піримідин-2-карбонітрилу у формі вільної основи. Н ЯМР (CDCI3) : 8,4-8,3 (m, 2Н); 7,71 (s, -1Н); Потім вільну основу розчиняли у ДХМ, і додавали 7,39 (t, J=9Гц, 1Н); 2,88 (t, J=7Гц, 2Н); 1,9-1,8 (m, НСІ (1М у етері). Розчинник видаляли під зменше2H); 1,03 (t, J=7Гц, 3H). МС m/z 310,1 (М+1). Рідинним тиском. Залишок ще раз розчиняли у ДХМ, і на хроматографія високого тиску (200-400нм): продукт реакції осаджували додаванням діетило94,0%. вого етеру, щоб отримати 4-[3-(піридин-2-іл-аміно)6і: 4-(3,4-Диметил-феніл)-6-пропіл-піримідин-2пропіл]-6-(3-трифлуорметилфеніл}-піримідин-2карбонітрил: 1 карбонітрил як хлорид. Н ЯМР (CDCI3) : 7,90 (s, 1H), 7,82 (d, J=7,6Гц, 1 Н ЯМР (CD3OD): 8,51 (s, 1H), 8,48 (d, 1H), 1Н), 7,66 (s, 1H), 7,27 (d, J=7,6Гц, 1H), 2,82 (t, 8,28 (s, 1H), 7,90 (s, 1H), 7,89 (t, 1H), 7,81 (d, 1H), J=7,8Гц, 2H), 2,37 (s, 3H), 2,35 (s, 3H), 1,84 (квінтет, 7,79 (t, 1H), 7,08 (d, 1H), 6,89 (t, 1H), 3,51 (t, 2H), 2Н), 1,01 (t, J=7,4Гц, 3H). МС m/z 252 (М+1). Рідин3,12 (t, 2H), 2,31-2,20 (m, 2Н). МС m/z 384,0 (М+1). на хроматографія високого тиску (200-400нм): Вищеописаний спосіб також реалізовували, 99,7%. застосовуючи підходящий амін, щоб отримати 1 35 89633 36 наступні сполуки у формі вільної основи або відгідрохлорид (виділений, як незначний продукт реаповідного хлориду: кції з 4s'): 1 7b: 4-[3-(5-Хлоропіридин-2-іл-аміно)-пропіл]-6Н ЯМР (CD3OD): 8,52 (s, 1Η), 8,49 (d, 1Η), (3-трифлуорометилфеніл)-піримідин-28,27 (s, 1Η), 7,91 (d, 1Η), 7,79 (t, 1H), 4,03 (s, 2Н), карбонітрил: 3,85 (s, 3H), 3,21 (t, 2Н), 3,09 (t, 2Н), 2,32-2,22 (m, 1 Н ЯМР (CDCI3): 8,33 (s, 1H), 8,28 (d, 1H), 2Н). MC m/z 379,1 (М+1) 7,99 (s, 1H), 7,84 (d, 1H), 7,76 (s, 1H), 7,68 (t, 1Н), 7k: 4-[3-(Піримідин-2-іл-аміно)-пропіл]-6-(37,33 (d, 1Н), 6,33 (d, 1Н), 4,47 (brs, 1H), 3,48-3,40 трифлуорметилфеніл)-піримідин-2-карбонітрил (m, 2H), 3,01 (t, 2H), 2,22-2,13 (m, 2H). МС m/z гідрохлорид: 1 418,1 (M+1) Н ЯМР (CD3OD): 8,50 (s, 1H), 8,47 (m, 2H), 7с: 4-[3-(4-Метилпіридин-2-іл-аміно)-пропіл]-68,24 (s, 1H), 7,90 (d, 1H), 7,78 (t, 1H), 6,85 (t, 1Н), (3-трифлуорометилфеніл)-піримідин-23,59 (t, 2Н), 3,06 (t, 2Н), 2,21 (p, 2Н). MC m/z 385,0 карбонітрил: (М+1). 1 Н ЯМР (CDCI3): 8,31 (s, 1H), 8,27 (d, 1H), 7i: 4-[3-(6-Метокси-піримідин-4-іл-аміно)7,91 {d, 1H), 7,82 (d, 1H), 7,75 (s, 1H), 7,66 (t, 1H), пропіл]-6-(3-трифлуорометилфеніл)-піримідин-26,38 (d, 1H), 6,15 (s, 1H), 4,42 (brs, 1H), 3,47-3,40 карбонітрил гідрохлорид: 1 (m, 2H), 3,03 (t, 2H), 2,20-2,13 (m, 2Н), 2,19 (s, 3H). Н ЯМР (CD3OD): 8,52 (s, 1Η), 8,48 (d, 1H), МС m/z 398,1 (М+1) 8,37 (s, 1H), 8,27 (s, 1H), 7,91 (d, 1 Η), 7,79 (t, 1Η), 7d: 4-[3-(1-Метилбензімідазол-2-іл-аміно)6,10 (brs, 1Η), 4,06 (s, 3H), 3,63 (brs, 2Н), 3,07 (brs, пропіл]-6-(3-трифлуорометилфеніл)-піримідин-22Н), 2,22 (brs, 2Н). МС m/z 415,0 (М+1). карбонітрил: Приклад 8а 1 Н ЯМР (CDCI3): 8,31 (s, 1H), 8,16 (d, 1H), 4-[3-(Метилкарбамоїлметил-аміно)-пропіл]-67,79 (d, 1H), 7,78 (s, 1H), 7,60 (t, 1H), 7,41 (d, 1H), (3-трифлуорометилфеніл-піримідин-2-карбонітрил 7,09-7,02 (m, 1H), 7,02-6,96 (m, 2H), 4,38 (brs, 1H), трифлуорацетат: 3,74-3-68 (m, 2H), 3,43 (s, 3H), 3,07 (t, 2H), 2,34При перемішуванні до розчину 4-(3-оксо2,26 (m, 2H). MC m/z 437,1 (М+1) пропіл)-6-(3-трифлуорметилфеніл)-піримідин-27е: 4-[3-(4-Трифлуорометилпіридин-2-ілкарбонітрилу (50мг) у метанолі (1мл) додавали аміно)-пропіл]-6-(3-трифлуорометилфенілгліцин-метил-амід гідрохлорид (41мг) та оцтову піримідин-2-карбонітрил: кислоту (12мл). Суміш перемішували протягом 5 1 хвилин, потім додавали натрій триацетокси бороН ЯМР (ДМСО-d6): 8,50 (d, 1H), 8,49 (s, 1H), гідрид (42мг), і ще перемішували при кімнатній 8,46 (s, 1H), 8,14 (d, 1H), 7,99 (d, 1Н), 7,84 (t, 1H), температурі протягом ночі. Метанол видаляли у 7,11 (t, 1H), 6,64 (d, 1H), 6,63 (s, 1H), 3,43-3,36 (m, вакуум, а утворений залишок розчиняли у ДХМ 2H), 2,97 (t, 2H), 2,12-2,04 (m, 2H). МС m/z 452,1 (20мл) та промивали насиченим натрій гідрокар(М+1) бонатом та водою (1:1, 2x20мл). Органічний шар 7f: 4-[3-(Ізохінолін-3-іл-аміно)-пропіл]-6-(3відокремлювали, сушили натрій сульфатом та трифлуорметилфеніл)-піримідин-2-карбонітрил: 1 випарювали, щоб отримати неочищений продукт Н ЯМР (CDCI3): 8,80 (s, 1H), 8,30 (s, 1H), реакції у формі масла. Очищення препаративною 8,20 (d, 1H), 7,79 (d, 1H), 7,72 (s, 1H), 7,71 (d, рідинною хроматографією високого тиску дало 1H),7,60 (t, 1H), 7,51 (d, 1H), 7,46 (t, 1H), 7,19 (t, трифлуорацетат 4-[3-(метилкарбамоїлметил1H), 6,49 (s, 1H),4,66 (brs, 1H), 3,48-3,42 (m, 2H), аміно)-пропіл]-6-(3-трифлуорметилфеніл)3,07 (t, 2H), 2,29-2,22 (m, 2H). MC m/z 434,3 (М+1) піримідин-2-карбонітрилу у формі білого твердого 7g: 4-[3-(3,5-Дифлуоропіридин-2-iл-аміно)продукту (13мг). пропіл]-6-(3-трифлуорометилфеніл)-піримідин-21 Н ЯМР (MeOD): 8,55 (s, 1H), 8,48 (d, 1H), карбонітрил: 1 8,24 (s, 1H), 7,88 (d, 1H), 7,80 (t, 1H), 3,80 (s, 2Н), Н ЯМР (CDCI3): 8,32 (s, 1H), 8,30 (d, 1H), 3,15 (t, 2Н), 3,08 (t, 2Н), 2,75 (s, 3H), 2,22 (m, 2Н). 7,83 (d, 1H), 7,79 (d, 1H), 7,77 (s, 1H), 7,68 (t, 1H), МС m/z 378,4. (М+1), 100%. 7,05-6,97 (m, 1H), 4,60 (brs, 1H), 3,58 (q, 2H), 3,02 Вищеописаний спосіб також реалізовували, (t, 2H), 2,24-2,16 (m, 2H). MC m/z 420,0 (М+1) застосовуючи підходяще похідне аміну, щоб отри7h: 4-[3-(1-Метил-трифлуороетиламіно)мати наступні сполуки: пропіл]-6-(3-трифлуорометилфеніл)-піримідин-28b: 4-[3-(2-Диметилкарбамоїл-піролідин-1-іл)карбонітрил гідрохлорид: 1 пропіл]-6-(3-трифлуорометилфеніл)-піримідин-2Н ЯМР (CD3OD): 8,52 (s, 1H), 8,50 (d, 1H), карбонітрил трифлуорацетат: 8,29 (s, 1H), 7,91 (d, 1H), 7,80 (t, 1H), 4,35-4,24 (m, 1 Н ЯМР (MeOD): 8,55 (s, 1H), 8,48 (d, 1H), 1Н), 3,42-3,26 (m, 2Н), 3,12 (t, 2Н), 2,40-2,22 (m, 8,28 (s, 1H), 7,91 (d, 1H), 7,80 (m, 1H), 4,65 (t, 1Н), 2Н), 1,59 (d, 3H). MC m/z 403,1 (М+1) 3,88 (m, 1Н), 3,31 (m, 2Н), 3,22 (m, 1Н), 3,08 (m, 7h: 4-[3-(2-Аміно-2-оксоетил-метиламіно)5Н), 3,01 (s, 3H), 2,68 (m, 1Н), 2,22 (m, 3H), 2,24 (m, пропіл]-6-(3-трифлуорметилфеніл)-піримідин-22Н). МС m/z 432,4 (М+1), 100%. карбонітрил гідрохлорид: 1 8с: 4-[3-(Карбамоїлметил-аміно)-пропіл]-6-(3Н ЯМР (CD3OD): 8,53 (s, 1H), 8,50 (d, 1H), трифлуорометилфеніл)-піримідин-2-карбонітрил 8,27 (s, 1H), 7,91 (d, 1H), 7,79 (t, 1H), 4,01 (s, 2Н), трифлуорацетат: 3,37-3,31 (m, 2Н), 3,08 (t, 2Н), 2,98 (s, 3H), 2,371 Н ЯМР (MeOD): 8,55(s, 1Н), 8,48 (d, 1Н), 8,28 2,27 (m, 2H). MC m/z 378,3 (М+1) (s, 1Н), 7,91 (d, 1Н), 7. BO (t, 1H), 3,85 (s, 2H), 3,18 7j: 4-[3-(2-Метокси-2-оксоетиламіно)-пропіл]-6(t, 2H), 3,08 (t, 2H), 2,26 (m, 2H). МС m/z 364,3 (3-трифлуорметилфеніл)-піримідин-2-карбонітрил (М+1), 100%. Приклад 9а 37 89633 38 4-(3-Піперазин-1-іл-пропіл)-6-(34-[3-(Карбоксиметил-аміно)-пропіл]-6-(3трифлуорметилфеніл)-піримідин-2-карбонітрил трифлуорометилфеніл)-піримідин-2-карбонітрил трифлуорацетат: трифлуорацетат: При перемішуванні до розчину 4-(3-оксоПри перемішуванні до розчину 4-(3-оксопропіл)-6-(3-трифлуорметилфеніл)-піримідин-2пропіл)-6-(3-трифлуорметилфеніл)-піримідин-2карбонітрилу (50мг) у дихлорометані (1мл) додакарбонітрилу (50мг) у метанолі (1мл) додавали вали трет-бутил 1-піперазин карбоксилат (61мг) та гліцин (25мг), а потім воду (100мкл) та оцтову кисоцтову кислоту (12мкл). Суміш перемішували при лота (12мкл). Суміш перемішували при кімнатній кімнатній температурі протягом 5 хвилин, потім температурі протягом 5 хвилин, потім додавали додавали натрій триацетоксиборогідрид (42мг), і ціаноборогідрид на твердій підкладці (77мг, перемішували протягом ночі. Реакційну суміш роз2,57ммоль/г), і перемішували протягом ночі. Реакбавляли дихлорометаном (20мл) та промивали ційну суміш профільтровували, а фільтрат конценнасиченим натрій гідрокарбонатом та водою (1:1, трували під зменшеним тиском, щоб отримати 2x20мл). Органічні речовини відокремлювали, сунеочищений продукт реакції. Очищення препарашили натрій сульфатом, профільтровували, і розтивною рідинною хроматографією високого тиску чинник видаляли під зменшеним тиском. Утворедало трифлуорацетат 4-[3-(карбоксиметил-аміно)ний залишок розчиняли у діетиловому етері (1мл), пропіл]-6-(3-трифлуорметилфеніл)-піримідин-2додавали НСІ в етері (2М, 72мкл), і реакційну сукарбонітрилу. 1 міш перемішували протягом ночі. Суміш розбавН ЯМР (MeOD): 8,55 (s, 1H), 8,48 (d, 1H), ляли етером (10мл), промивали насиченим натрій 8,25 (s, 1H), 7,91 (d, 1H), 7,80 (t, 1H), 3,91 (s, 2Н), гідрокарбонатом та водою (1:1, 2x10мл), сушили 3,17 (t, 2Н), 3,08 (t, 2Н), 2,28 (m, 2Н). МС m/z 365,0 натрій сульфатом, профільтровували, а розчинник (М+1), 100%. видаляли під зменшеним тиском, щоб отримати Вищеописаний спосіб також реалізовували, неочищений продукт реакції. Очищення препаразастосовуючи підходящі похідні аміну, щоб отритивною рідинною хроматографією високого тиску мати наступні сполуки: дало трифлуорацетат 4-(3-піперазин-1-іл-пропіл}10b: 4-[3-(2-Карбамоїл-етиламіно)-пропіл]-6-(36-(3-трифлуорметилфеніл)-піримідин-2трифлуорометилфеніл)-піримідин-2-карбонітрил карбонітрилу. трифлуорацетат: 1 1 Н ЯМР (MeOD): 8,51 (s, 1H), 8,48 (d, 1H), Н ЯМР (MeOD): 8,51 (s, 1H), 8,47 (d, 1H), 8,25 (s, 1H), 7,90 (d, 1H), 7,78 (d, 1H), 3,56 (m, 4Н), 8,25 (s, 1H), 7,90 (d, 1H), 7,78 (t, 1H), 3,32 (t, 2Н), 3,30 (m, 6Н), 3,08 (t, 2Н), 2,32 (m, 2Н). МС m/z 3,19 (t, 2Н), 3,09 (t, 2Н), 2,70 (t, 2Н), 2,27 (m, 2Н). 376,4 (М+1), 100%. МС m/z 378,3 (М+1), 100%. Наступну сполуку отримано тим самим спосо10с: 4-[3-Карбоксиметил-метил-аміно)-пропіл]бом: 6-(3-трифлуорометилфеніл)-піримідин-29b: 4-(3-[1,4]Діазепан-1-іл-пропіл)-6-(3карбонітрил трифлуорацетат: 1 трифлуорометилфеніл)-піримідин-2-карбонітрил Н ЯМР (MeOD): 8,55 (s, 1H), 8,48 (d, 1H), трифлуорацетат: 8,25 (s, 1H), 7,91 (d, 1H), 7,80 (t, 1H), 4,14 (s, 2Н), При перемішуванні до розчину 4-(3-оксо3,38 (t, 2Н), 3,08 (t, 2Н), 3,02 (s, 3H), 2,35 (m, 2Н). пропіл)-6-(3-трифлуорметилфеніл)-піримідин-2МС m/z 378,8 (М+1). карбонітрилу (50мг) у дихлорометані (1мл) додаПриклад 11а вали трет-бутил 1-гомопіперазин-карбоксилат 4-(3-[2-(1-Метил-піролідин-2-іл)-етиламіно](75мкл) та оцтову кислоту (12мкл). Суміш переміпропіл}-6-(3-трифлуорометилфеніл)-піримідин-2шували при кімнатній температурі протягом 5 хвикарбонітрил трифлуорацетат: лин, потім додавали натрій триацетоксиборогідрид При перемішуванні до розчину 4-(3-оксо(42мг), і перемішували протягом ночі. Реакційну пропіл)-6-(3-трифлуорметилфеніл)-піримідин-2суміш розбавляли дихлорометаном (20мл) та карбонітрилу (50мг) у метанолі (1мл) додавали 2промивали насиченим натрій гідрокарбонатом та (2-аіиіноетил)-1-метилпіролідин (48мкл) та оцтову водою (1:1, 2x20мл). Органічні речовини відокремкислоту (12мкл). Суміш перемішували при кімнатлювали, сушили натрій сульфатом, профільтровуній температурі протягом 5 хвилин, потім додававали, а розчинник видаляли під зменшеним тисли ціаноборогідрид на твердій підкладці (77мг, ком. Утворений залишок розчиняли у ТГФ 257ммоль/г), і перемішували протягом ночі. Реак(500мкл), і додавали трифлуороцтову кислоту ційну суміш профільтровували, та фільтрат конце(100мкл). Реакцію перемішували при кімнатній нтрували під зменшеним тиском, щоб отримати температурі протягом 2 годин, потім розчинник неочищений продукт реакції. Очищення препаравидаляли під зменшеним тиском, щоб отримати тивною рідинною хроматографією високого тиску неочищений продукт реакції. Очищення препарадало трифлуорацетат 4-{3-[2-(1-метил-піролідин-2тивною рідинною хроматографією високого тиску іл)-етиламіно]-пропіл}-6-(3-трифлуорметилфеніл)дало трифлуорацетат 4-(3-[1,4]діазепан-1-ілпіримідин-2-карбонітрилу. 1 пропіл)-6-(3-трифлуорметилфеніл)-піримідин-2Н ЯМР (MeOD): 8,52 (s, 1H), 8,48 (d, 1H), карбонітрилу. 8,25 (s, 1H), 7,90 (d, 1H), 7,79 (t, 1H), 3,75 (m, 1H), 1 Н ЯМР (MeOD): 8,52 (s, 1H), 8,48 (d, 1H), 3,38 (m, 1H), 3,19 (m, 5H), 3,12 (t, 2H), 2,96 (s, 3H), 8,25 (s, 1H), 7,91 (d, 1H), 7,79 (t, 1H), 3,78 (m, 2H), 2,40 (m, 2H), 2,27 (t, 2H), 2,15 (m, 2H), 2,05 (m, 1H), 3,70 (m, 2H), 3,59 (m, 2H), 3,45 (t, 2H), 3,38 (t, 2H), 1,82 (m, 1H). MC m/z 418,3 (М+1), 100%. 3,31 (t, 2H), 2,32 (m, 4H). МС m/z 390,3 (М+1), Вищеописаний спосіб також реалізовували, 100%. застосовуючи підходящі похідні аміну, щоб отриПриклад 10а мати наступні сполуки: 39 89633 40 11b: 4-[3-(2-Піролідин-1-іл-етиламіно)-пропіл]При перемішуванні до суспензії натрій гідриду 6-(3-трифлуорметилфеніл)-піримідин-2(60% у парафіновому маслі 20г), у діетиловому карбонітрил трифлуорацетат: етері (1л) при 0°С додавали етанол (1мл). Потім 1 до вищезгаданої суміші додавали гамаН ЯМР (MeOD): 8,51 (s, 1H), 8,48 (d, 1H), бутиролактон (18г), а потім краплями розчин 3',4'8,25 (s, 1H), 7,90 (d, 1H), 7,78 (t, 1H), 3,61 (t, 2Н), диметилацетофенону у діетиловому етері (100мл) 3,50 (m, 6Н), 3,24 (t, 2Н), 3,10 (t, 2Н), 3,29 (m, 2Н), (29,6г) протягом 30 хвилин. Суміш перемішували 2,13 (m, 4Н). MC m/z 404,5 (М+1), 100%. при кімнатній температурі протягом 72 годин. По11c: 4-{3-[(1-Етил-піролідин-2-іл-метил)тім для руйнування надлишку натрій гідриду додаамінол-пропіл)-6-(3-трифлуорометилфеніл)вали етанол (20мл), а потім водний розчин амоній піримідин-2-карбонітрил трифлуорацетат: 1 хлориду (20г на 300мл води). Органічний шар віН ЯМР (MeOD): 8,51 (s, 1H), 8,48 (d, 1H), докремлювали та промивали розбавленою хлори8,25 (s, 1H), 7,90 (d, 1H), 7,78 (t, 1H), 3,82(m, 1H), дною кислотою (0,1N, 500мл), а потім водою 3,78 (m, 1H), 3,68 (m, 1H), 3,55 (m, 1H), 3,45 (m, (2x200мл). Потім етерний шар сушили натрій су1H), 3,31 (m, 1H), 3,27 (t, 2Н), 3,20 (m, 1H), 3,11 (t, льфатом, розчинник видаляли під зменшеним тис2H), 2,50 (m, 1H), 2,31 (m, 2H), 2,19 (m, 2H), 2,05 ком. Залишок перемішували з S-метил-ізотіоураній (m, 1H), 1,38 (t, 3H). MC m/z 418,1 (М+1), 100%. йодидом (37г). Суміш нагрівали при 130°С протя11d: 4-[3-(1-Аза-біцикло[2,2,2]окт-3-ил-аміно)гом 4 годин. Після охолодження до кімнатної темпропіл]-6-(3-трифлуорометилфеніл)-піримідин-2ператури додавали триетиламін (45мл) та метакарбонітрил трифлуорацетат: 1 нол (50мл), і суміш нагрівали при кипінні під Н ЯМР (MeOD): 8,51 (s, 1Η), 8,48 (d, 1Η), зворотним холодильником у масляній бані при 8,25 (s, 1Η), 7,90 (d, 1Η), 7,78 (t, 1Η), 3,95 (m, 1H), 85°С протягом 6 годин. Після видалення розчин3,86 (m, 1H), 3,42 (m, 5H), 3,25 (t, 2H), 3,11 (t, 2H), нику та триетиламіну при зменшеному тиску, за2,57 (m, 1H), 2,32 (m, 2H), 2,20 (m, 2Н), 2,05 (m, лишок додавали до етилацетату (500мл) та води 2Н). MC m/z 416,1 (М+1), 100%. (500мл). Органічний шар відокремлювали, проми11e: 4-[3-[2-Морфолін-4-іл-етиламіно)-пропіл]вали розбавленою хлоридною кислотою (0,1Н, 6-(3-трифлуорометилфеніл)-піримідин-2500мл), а потім водою (2x300мл). Потім органічний карбонітрил трифлуорацетат: 1 шар висушували, розчинник видаляли під зменН ЯМР (MeOD): 8,52 (s, 1Н), 8,48 (d, 1H), шеним тиском. Залишок очищали на колонці з си8,25 (s, 1H), 7,90 (d, 1H), 7,80 (t, 1H), 3,87 (t, 4H), лікагелем з бензолом та етилацетатом (1:1) як 3,45 (t, 2H), 3,23 (m, 4H), 3,10 (t, 6H), 2,28 (m, 2H). елюентом для утворення 2-метилсульфаніл-4-(3MC m/z 420,1 (M+1), 100%. гідроксипропіл)-6-(3,4-диметилфеніл)піримідину 11f: 4-[3-(2-Метоксіетиламіно)-пропіл]-6-(3(17,5г). трифлуорометилфеніл)-піримідин-2-карбонітрил 1 Н ЯМР (CDCI3): 7,84 (s, 1H), 7,80 (d, 1H), трифлуорацетат: 1 7,15-7,25 (m, 2H), 3,72 (t, 2H), 2,87 (t, 2Н), 2,63 (s, H ЯМР (MeOD): 8,52 (s, 1H), 8,48 (d, 1H), 3H), 2,34 (s, 3H), 2,32 (s, 3H), 2,03 (m, 2H). 8,24 (s, 1H), 7,90 (d, 1H), 7,79 (t, 1H), 3,66 (t, 2H), В: 4-(3-гідроксипропіл)-6-(3,43,42 (s, 3H), 3,25 (t, 2H), 3,16 (t, 2H), 3,08 (t, 2H), диметилфеніл)піримідин-2-карбонітрил: 2,24 (m, 2H). MC m/z 365,0 (M+1), 100%. До розчину 2-метилсульфаніл-4-(311g: 4-(3-[2-(2-Оксо-імідазолідин-1-іл)гідроксипропіл)-6-(3,4-диметил-феніл)піримідину етиламіно]-пропіл)-6-(3-трифлуорометил-феніл)(5,8г) у метанолі та воді при перемішуванні піримідин-2-карбонітрил трифлуорацетат: 1 (110мл, 10:1) додавали ОКСОН (35г). Суміш переН ЯМР (MeOD): 8,52 (s, 1H), 8,48 (d, 1H), мішували при кімнатній температурі протягом 3 8,25 (s, 1H), 7,90 (d, 1H), 7,79 (t, 1H), 3,53 (m, 2H), годин, потім розбавляли етилацетатом (500мл). 3,46 (m, 4H), 3,24 (m, 2H), 3,19 (t, 2H), 3,08 (t, 2H), Суміш промивали водою (3x500мл). Органічний 2,25 (m, 2H). MC m/z 419,0 (M+1), 100%. шар сушили натрій сульфатом, розчинник видаля11h: 4-[3-(2-Диметиламіно-етиламіно)-пропіл]ли під зменшеним тиском для утворення 26-(3-трифлуорметилфеніл)-піримідин-2метансульфоніл-4-(3-гідроксипропіл)-6-(3,4карбонітрил трифлуорацетат: 1 диметилфеніл)-піримідину у формі неочищеного Н ЯМР (MeOD): 8,52 (s, 1H), 8,48 (d, 1H), продукту реакції. При перемішуванні до розчину 8,28 (s, 1H), 7,91 (d, 1H), 7,80 (t, 1H), 3,54 (s, 4H), вищезгаданого 2-метилсульфоніл-4-(33,28 (t, 2H), 3,12 (t, 2H), 2,98 (s, 6H), 2,30 (m, 2H). гідроксипропіл)-6-(3,4-диметилфеніл)піримідину у MC m/z 378,4 (М+1), 100%. диметилсульфоксиді (50мл) додавали натрій ціа11і: 4-[3-(2-аміно-етиламіно)-пропіл]-6-(3нід (2,9г). Суміш перемішували при кімнатній темтрифлуорметилфеніл)-піримідин-2-карбонітрил пературі протягом 4 годин, потім виливали в етитрифлуорацетат: 1 лацетат (300мл) та промивали водою (2x200мл). Н ЯМР (MeOD): 8,52 (s, 1H), 8,48 (d, 1H), Органічний шар сушили натрій сульфатом, роз8,25 (s, 1H), 7,90 (d, 1H), 7,79 (t, 1H), 3,51 (t, 2Н), чинник випарювали при зменшеному тиску, вище3,18 (m, 4Н), 3,08 (t, 2Н), 2,25 (m, 2Н), 1,99 (s, 3H). згаданий залишок флеш-хроматографували у сиMC m/z 392,1 (М+1), 100%. лікагелі з бензолом та етилацетатом (1:1) у якості Приклад 12 елюенту для утворення 4-(3-гідрокси-пропіл)-64-(3-Гідрокси-1-пропіл)-6-(3,4-диметилфеніл)(3,4-диметилфеніл)-піримідин-2-карбонітрилу як піримідин-2-карбонітрил: продукту реакції (4,8г). А: 2-метилсульфаніл-4-(3-гідроксипропіл)-61 Н ЯМР (CDCI3): 8,01 (s, 1H), 7,96 (s, 1H), (3,4-диметилфеніл)піримідин: 7,89 (d, 1H), 7,25 (d, 1H), 3,64 (t, 2H), 2,93 (t, 2H), 41 89633 42 2,36 (s, 3H), 2,34 (s, 3H), 2,0 (m, 2H). МС m/z 268 3,48 (m, 1Н), 3,25-3,15 (m, 2Н), 3,11-3,04 (m, 2Н), (М+1), 100%. 2,98 (s, 6Н), 2,37 (s, 3H), 2,35 (s, 3H), 2,32-2,26 (m, Приклад 13а 2Н), 1,50 (d, 3H). МС m/z 352,5 (М+1). 4-(3,4-Диметилфеніл)-6-[3-(піридин-2-іл-аміно)13d: 4-(3,4-Диметилфеніл)-6-[3-(1пропіл]-піримідин-2-карбонітрил гідрохлорид: етилпіролідин-2-метиламіно)-пропіл]-піримідин-2А: 4-(3-оксо-1-пропіл)-6-(3,4-диметилфеніл)карбонітрил дигідрохлорид: 1 піримідин-2-карбонітрил: Н ЯМР(CD3OD): 8,13 (s, 1H), 8,02(s, Перйодинан Дес-Мартіна (4,2г) додавали до 1H),7,95(d, 1H), 7,32 (d, 1H), 3,87-3,69 (m, 2Н), розчину 4-(3-гідрокси-пропіл)-6-(3,43,68-3,50 (m, 2H), 3,50-3,38 (m, 1H), 3,27-3,21 (m, диметилфеніл)-піримідин-2-карбонітрилу (2,0г) у 2H), 3,21-3,11 (m, 1H), 3,13 (t, 2H), 2,52-2,41 (m, дихлорометані (100мл), і утворену суспензію пе1Н), 2,38 (s, 3H), 2,35 (s, 3H), 2,35-2,26 (m, 2H), ремішували при кімнатній температурі протягом 45 2,24- 2,10 (m, 2H), 2,09-1,97 (m, 1Н), 1,41 (t, 3H). хвилин. Потім суміш промивали водою (3x100мл), МС m/z 378,5 (М+1). сушили натрій сульфатом, та випарювали при 13е: (S)-4-(3,4-Диметилфеніл)-6-[3зменшеному тиску. Залишок флеш(хінуклідиніл-3-аміно)-пропіл]-піримідин-2хроматографували у силікагелі з бензолом та етикарбонітрил гідрохлорид: 1 лацетатом (2:1), щоб отримати 4-(3-оксо-пропіл)-6Н ЯМР (CD3OD): 8,13 (s, 1Н), 8,02 (s, 1Н), (3,4-диметилфеніл)-піримідин-2-карбонітрил у фо7,95 (d, 1Н), 7,31 (d, 1Н), 3,94-3,85 (m, 1Н), 3,85 (t, рмі білого твердого продукту (1,9г). 1Н), 3,67-3,53 (m, 3H), 3,46-3,31 (m, 2Н), 3,22 (t, 1 Н ЯМР (CDCI3): 7,87 (s, 1H), 7,8 (d, 1H), 7,75 2Н), 3,07 (t, 2Н), 2,57 (brs, 1Н), 2,38 (s, 3H), 2,35 (s, (s, 1H), 7,25 (d, 1H), 3,16 (t, 2H), 3,09 (t, 2Н), 2,36 (s, 3H), 2,36-2,26 (m, 3H), 2,22-2,10 (m, 1Н), 2,10-1,99 3H), 2,34 (s, 3H). МС m/z 266 (М+1), 100%. (m, 2Н). МС m/z 376,4 (М+1). В: 4-(3,4-диметилфеніл)-6-[3-(піридин-2-іл13f: 4-(3,4-Диметилфеніл)-6-[3-(проп-2-іламіно)-пропіл]-піримідин-2-карбонітрил гідрохлоаміно)-пропіл]-піримідин-2-карбонітрил: 1 рид: Н ЯМР (CDCI3): 7,90 (s, 1H), 7,82 (d, 1H), До розчину 4-(3-оксо-пропіл)-6-(3,47,69 (s, 1H), 7,28 (d, 1H), 2,91 (t, 2H), 2,84-2,77 (m, диметилфеніл)-піримідин-2-карбонітрилу (91мг) у 1H), 2,68 (t, 2H), 2,37 (s, 3H), 2,35 (s, 3H), 2,02-1,93 дихлорометані (6мл) додавали оцтову кислоту (m, 2H), 1,06 (d, 3H). MC m/z 309,4 (М+1). (2еквів.), а потім 2-амінопіридином (1,3еквів.). Роз13g: 4-(3,4-Диметилфеніл)-6-[3-(1-метилчин перемішували при кімнатній температурі протрифлуороетиламіно)-пропіл]-піримідин-2тягом 15 хвилин, потім натрій триацетоксиборогідкарбонітрил гідрохлорид: 1 рид (2еквів.) додавали і суміш перемішували Н ЯМР (CD3OD): 8,10 (s, 1Н), 8,01 (s, 1Н), протягом 18 годин при кімнатній температурі. 7,94 (d, 1H), 7,32 (d, 1H), 4,32-4,21 (m, 1Н), 3,39Холодний, розбавлений розчин натрій карбо3,33 (m, 2Н), 3,05 (t, 2Н), 2,38 (s, 3H), 2,36 (s, 3H), нату додавали, суміш перемішували протягом 2,35-2,17 (m, 2H), 1,57 (d, 6H). MC m/z 363,1 (М+1). 10хв., органічний шар відокремлювали, а розчин13h: 4-(3,4-Диметилфеніл)-6-{3-[2-(морфолін-4ник видаляли під зменшеним тиском. Неочищений іл)-етиламіно]-пропіл}-піримідин-2-карбонітрил продукт реакції хроматографували у 2 г-колонці з дигідрохлорид: 1 силікагелем, елюючи сумішшю дихлорометан: Н ЯМР (CD3OD): 8,06 (s, 1H), 8,00 (s, 1H), етанол (99:1), щоб отримати продукт реакції у фо7,92 (d, 1H), 7,32 (d, 1H), 3,69 (t, 4H), 2,93 (t, 2Н), рмі вільної основи. Потім вільну основу розчиняли 2,75 (t, 2Н), 2,70 (t, 2Н), 2,52 (t, 2Н), 2,50-2,45 (m, у ДХМ, та додавали НСІ (1Μ у етері). Розчинник 4Н), 2,38 (s, 3H), 2,35 (s, 3H), 2,06-1,98 (m, 2Н). MC видаляли під зменшеним тиском. Залишок знов m/z 380,4 (М+1). розчиняли у ДХМ, продукт реакції осаджували до13і: 4-([3-(3-Діетилкарбамоїл)-піперидин-1-індаванням діетилового етеру, отримуючи 4-(3,4пропіл)-6-(3,4-диметилфеніл)-піримідин-2диметилфеніл)-6-[3-(піридин-2-іл-аміно)-пропіл]карбонітрил гідрохлорид: 1 піримідин-2-карбонітрил гідрохлорид (60мг). Н ЯМР (CD3OD): 8,11 (s, 1H), 8,01 (s, 1H), 1 Н ЯМР (CD3OD): 8,09 (s, 1H), 8,00 (s, 1H), 7,94 (d, 1H), 7,31 (d, 1H), 3,9-2,9 (m, 13Н), 2,38 (s, 7,95-7,86 (m, 2H), 7,83 (d, 1H), 7,32 (d, 1Н), 7,07 (d, 3H), 2,35 (s, 3H), 2,33 (m, 2H), 2,1-1,6 (m, 4H), 1,271Н), 6,88 (t, 1Н), 3,48 (t, 2Н), 3,05 (t, 2Н), 2,29-2,19 1,05 (m, 6H). MC m/z 434,4 (М+1). (m, 2Н). МС m/z 344,1 (М+1). 13j: 4-(3,4-Диметилфеніл)-6-[3-(4-піридин-2-ілЗастосовуючи підходящі аміни, наступні спопіперазин-1-іл)-пропіл]-піримідин-2-карбонітрил луки отримували у формі вільної основи або віддигідрохлорид: 1 повідного хлориду. Н ЯМР (CD3OD): 8,14 (d,d 1H), 8,12 (s, 1H), 13b: 4-(3,4-Диметилфеніл)-6-[3-(48,10 (d, 1H), 8,02 (s, 1H), 7,95 (d, 1H), 7,46 (d, 1Н), метилпіридин-2-іл-аміно)-пропіл]-піримідин-27,32 (d, 1Н), 7,14 (t, 1Н), 4,42 (brs, 2Н), 3,80 (brs, карбонітрил гідрохлорид: 4Н), 3,38 (d,d 2Н), 3,35 (brs, 2Н), 3,07 (t, 2Н), 2,40 1 Н ЯМР (CD3OD): 8,08 (s, 1H),7,98(s, 1H), (m, 2Н), 2,38 (s, 3H), 2,36 (s, 3H). MC m/z 413,3 7,92 (d, 1H),7,69(d, 1H), 7,31 (d, 1H), 6,82 (s, 1H), (М+1). 6,74 (d, 1H), 3,37 (t, 2H), 3,04 (t, 2H), 2,37 (s, 6H), Приклад 14а 2,35 (s, 3H), 2,28-2,18 (m, 2H). MC m/z 358,0 (M+1). 4-(3,4-Диметил-феніл)-6-[3-(2-гідрокси-1,113с: 4-[3-(2-Диметиламіно-1-метилетиламіно)диметил-етиламіно)-пропіл]-піримідин-2пропіл]-6-(3,4-диметилфеніл)-піримідин-2карбонітрил трифлуорацетат: карбонітрил дигідрохлорид: При перемішуванні до розчину 4-(3-оксо1 Н ЯМР (CD3OD): 8,13 (s, 1H), 8,02 (s, 1H), пропіл)-6-(3,4-диметилфеніл)-піримідин-27,95 (d, 1H), 7,31 (d, 1H), 3,95-3,80 (m, 1Н), 3,65карбонітрилу (50мг) в ацетонітрилі (1,5мл) дода 43 89633 44 1 вали 2-аміно-2-метил-1-пропанол (36мкл), макрооН ЯМР (CDCI3): 7,91 (s, 1H), 7,84 (d, 1H), пористий ціаноборогідрид (110мг, 2,57ммоль/г) та 7,81 (s, 1H), 7,27 (d, 1H), 3,47-3,50 (m, 4Н), 3,12 (m, оцтову кислоту (16мкл), і утворену суспензію пе2Н), 3,05 (t, 2Н), 2,98 (m, 2Н), 2,49 (t, 2Н), 2,36 (s, ремішували при кімнатній температурі протягом 16 3H), 2,34 (s, 3H), 2,29 (m, 2Н), 2,08-2,16 (m, 4Н). годин. Реакційну суміш профільтровували та очиМС m/z 392,3 (М+1), 100%. щали препаративною рідинною хроматографією 14g: 4-P-(1,1 -Диметил-2-морфолін-4-ілвисокого тиску для утворення 4-(3,4-диметилетиламіно)-пропіл]-6-(3,4-диметил-феніл)феніл)-6-[3-(2-гідрокси-1,1-диметил-етиламіно)піримідин-2-карбонітрил трифлуорацетат 1 пропіл]-піримідин-2-карбонітрил трифлуорацетат у Н ЯМР (CDCI3): 7,91 (s, 1Η), 7,86 (d, 1H), формі білого твердого продукту (10мг). 7,78 (s, 1H), 7,27 (d, 1H), 3,92 (m, 4H), 3,34 (s, 2H), 1 Н ЯМР (MeOD): 8,08 (s, 1H), 8,00 (s, 1H), 3,14-3,18 (m, 6H), 3,01 (t, 2H), 2,37 (s, 3H), 2,35 (s, 7,92 (d, 1H), 7,33 (d, 1H), 3,55 (s, 1H), 3,11 (t, 2H), 3H), 2,30-2,35 (m, 2H), 1,52 (s, 6H). MC m/z 408,1 3,02 (t, 2H), 2,38 (s, 1H), 2,36 (s, 1H), 2,16-2,25 (m, (М+1), 100%. 2H), 1,34 (s, 6H). MC m/z 339,1 (М+1), 100%. 14h: 4-(3,4-Диметил-феніл)-6-{3-[2-(1Н-індол-314b: 4-(3,4-Диметил-феніл)-6-[3,(2іл)-етиламіно]-пропіл}-піримідин-2-карбонітрил метоксіетиламіно)-пропіл]-піримідин-2-карбонітрил трифлуорацетат: 1 трифлуорацетат: Н ЯМР (MeOD): 8,03 (s, 1H), 7,99 (s, 1H), При перемішуванні до розчину 4-(3-оксо7,93 (d, 1H), 7,58 (d, 1H), 7,31-7,37 (m, 2Н), 7,19 (s, пропіл)-6-(3,4-диметилфеніл)-піримідин-2-карбо1H), 7,12 (t, 1H), 7,04 (t, 1H), 3,33-3,38 (m, 2H), нітрилу (50мг) у МеОН (1,5мл) додавали 23,14-3,21 (m, 4H), 2,99 (t, 2H), 2,38 (s, 3H), 2,35 (s, метоксіетиламін (26мкл). Потім додавали макроо3H), 2,14-2,21 (m, 2Н). MC m/z 411,0 (М+1), 100%. пористий ціаноборогідрид (110мг, 2,57ммоль/г) та 14i: 4-(3,4-Диметил-феніл)-6-[3оцтову кислоту (16мкл), і утворену суспензію пе(метилкарамоїлметил-аміно)-пропіл]-піримідин-2ремішували при кімнатній температурі протягом 16 карбонітрил трифлуорацетат: 1 годин. Н ЯМР (MeOD): 8,07 (s, 1Н), 8,00 (s, Реакційну суміш профільтровували та очища1H),7,94(d, 1H), 7,31 (d, 1H), 3,73 (s, 1H), 3,08 (t, ли препаративною РХ-МС для утворення 4-(3,42H), 3,01 (t, 2H), 2,79 (s, 3H), 2,38 (s, 3H), 2,36 (s, диметилфеніл)-6-[3,(2-метоксіетиламіно)-пропіл]3H), 2,19 (t, 2H). MC m/z 338,5 (M+1), 100%. піримідин-2-карбонітрил трифлуорацетат у формі 4-[3-(2-Ацетиламіно-етиламіно)-пропіл]-6-(3,4білого твердого продукту (8мг). диметил-феніл)-піримідин-2-карбонітрил трифлуо1 Н ЯМР (MeOD): 8,07 (s, 1Н), 8,00 (s, 1Н), рацетат: 1 7,94 (d, 1Н), 7,33 (d, 1Н), 3,64 (t, 2H), 3,42 (s, 3H), H ЯМР (MeOD): 8,08 (s, 1H), 8,00 (s, 1H), 3,24 (t, 2Н), 3,13 (t, 3H), 3,01 (t, 2Н), 2,38 (s, 3H), 7,94 (d, 1H), 7,31 (d, 1H), 3,50 (t, 2H), 3,15 (m, 4H), 2,36 (s, 3H), 2,16- 2,26 (m, 2Н). МС m/z 325,5 (М+1), 3,01 (t, 2H), 2,38 (s, 3H), 2,35 (s, 3H), 2,21 (m, 2H), 100%. 1,99 (s, 3H). MC m/z 352,4 (M+1), 100%. Вищеописаний спосіб також реалізовували, 14k: 4-(3,4-Диметил-феніл)-6-(3-[2-(1-метилзастосовуючи підходящі похідні аміну, щоб отрипіролідин-2-іл)-етиламіно]-пропіл-піримідин-2мати наступні сполуки: карбонітрил трифлуорацетат: 1 14с: 4-(3,4-Диметил-феніл)-6-{3-[(Піридин-2Н ЯМР (MeOD): 8,08 (s, 1H), 8,00 (s, 1H), ілметил)-аміно]пропіл}піримідин-2-карбонітрил 7,94 (d, 1H), 7,33 (d, 1H), 3,70-3,77 (m, 1Н), 3,33трифлуорацетат: 3,41 (m, 1Н), 3,12-3,21 (m, 5Н), 3,04 (t, 2Н), 2,94 (s, 1 Н ЯМР (CDCI3): 8,62 (d, 1H), 7,98 (t, 1H), 7,90 3H), 2,38-2,43 (m, 2H), 2,38 (s, 3H), 2,36 (s, 3H), (s, 1H), 7,84 (d, 1H), 7,75 (s, 1H), 7,60 (d, 1Н), 7,52 2,20-2,28 (m, 2H), 2,04-2,18 (m, 2H), 1,93-2,04 (m, (m, 1Н), 7,2,7 (d, 1Н), 4,48 (s, 2Н), 3,33 (t, 2Н), 3,07 1H), 1,75-1,86 (m, 1Н). MC m/z 378,5 (M+1), 100%. (t, 2Н), 2,36 (s, 3H), 2,35 (s, 3H), 2,23-2,35 (m, 2Н). 14l: 4-[3-(Карбамоїлметил-метил-аміно)МС m/z 358,0 (М+1), 100%. пропіл]-6-(3,4-диметил-феніл)-піримідин-214d: 4-(3,4-Диметил-феніл)-6-{3-[3-(1Hкарбонітрил трифлуорацетат:: 1 імідазол-4-іл)-пропіламіно]-пропіл}-піримідин-2Н ЯМР (MeOD): 8,08 (s, 1Н), 8,00 (s, 1Н), карбонітрил трифлуорацетат: 7,94 (d, 1Н), 7,32 (d, 1Н), 4,00 (br s, 2H), 3,24-3,30 1 Н ЯМР (MeOD): 8,81 (s, 1H), 8,08 (s, 1H), (m, 2H), 3,01 (t, 2H), 2,98 (t, 2H), 2,38 (s, 3H), 2,36 8,00 (s, 1H), 7,93 (d, 1H), 7,45 (s, 1H), 7,30 (d, 1H), (s, 3H), 2,23-2,30 (m, 2H). MC m/z 338,4 (M+1), 3,39 (t, 2H), 3,18-3,22 (m, 4H), 3,04 (t, 2H), 2,38 (s, 100%. 3H), 2,36 (s, 3H), 2,20-2,28 (m, 2Н). МС m/z 361,0 14m: 4-[3-(Диметилкарбамоїлметил-аміно)(М+1), 100%. пропіл]-6-(3,4-диметил-феніл)-піримідин-214е: 4-[3-(Біцикло[2,2,1]гепт-2-иламіно)карбонітрит, трифлуорацетат: 1 пропіл]-6-(3,4-диметил-феніл)-піримідин-2H ЯМР (CDCI3): 7,89 (s, 1H), 7,83 (d, 1H), карбонітрил трифлуорацетат: 7,76 (s, 1H), 7,27 (d, 1H), 4,00 (s, 2H), 3,24 (t, 2H), 1 Н ЯМР (CDCI3): 7,87 (s, 1H), 7,82 (d, 1H), 3,03 (m, 2H), 3,01 (s, 6H), 2,36 (s, 3H), 2,34 (s, 3H), 7,70 (s, 1H), 7,52 (m, 1H), 3,37-3,42 (m, 1Н), 3,012,23-2,35 (m, 2H). MC m/z 352,3 (M+1), 100%. 3,09 (m, 2Н), 2,96 (t, 2Н), 2,54 {s, 1Н), 2,35 (s, 3H), 14n: 4-(3,4-Диметил-феніл)-6-[3-[2-(2-оксо2,33 (s, 3H), 2,22-2,30 (m, 3H), 1,93-2,04 (m, 1H), імідазолідин-1-іл)-етиламіно]-пропіл}-піримідин-21,68-1,78 (m, 1H), 1,53-1,60 (m, 2H), 1,38-1,45 (m, карбонітрилтрифлуорацетат: 1 3H), 1,26(d, 1H). МС m/z 361,0 (М+1), 100%. Н ЯМР (MeOD): 8,08 (s, 1H), 8,00 (s, 1Η), 14f: 4-(3,4-Диметил-феніл)-6-{3-[3-(2-оксо7,94 (d, 1H), 7,33 (d, 1H), 3,51-3,55 (m, 2Н), 3,43піролідин-1-іл)-пропіламіно]-пропіл}-піримідин-23,48 (m, 4Н), 3,23 (t, 2Н), 3,17 (t, 2Н), 3,02 (t, 2Н), карбонітрил трифлуорацетат: 45 89633 46 2,38 (s, 3H), 2,36 (s, 3H), 2,17-2,27 (m, 2Н). МС m/z гідроксидбензотриазол (30мг) та 1-(3379,4 (М+1), 100%. диметиламінопропіл)-3-етил карбодіімід НСІ 14о: 4-[3-(3-Диметиламіно-пропіламіно)(38мг). Розчин перемішували при кімнатній темпепропіл]-6-(3,4-диметил-феніл)-піримідин-2ратурі протягом 15хв. та додавали піперидин карбонітрил трифлуорацетат: (22мг). Після перемішування протягом 18 годин, 1 реакційну суміш промивали НСІ (1М, 2x5мл), Н2О, Н ЯМР (MeOD): 8,07 (s, 1H), 7,99 (s, 1H), потім розсолом, і висушували натрій сульфатом. 7,93 (d, 1H), 7,31 (d, 1H), 3,24 (t, 2H), 3,13-3,20 (m, Після видалення розчиннику, кристалізація з не4Н), 3,03 (t, 2Н), 2,92 (s, 6Н), 2,37 (s, 3H), 2,35 (s, великої кількості суміші ацетон/етер дала 4-(33H), 2,20-2,28 (m, 2H), 2,12-2,19 (m, 2Н). МС m/z піперидин-1-іл-3-оксопропіл)-6-(3352,4 (М+1), 100%. трифлуорметилфеніл)-піримідин-2-карбонітрил у Приклад 15 формі білого твердого продукту, 35мг. 4-(3-Гідрокси-3-оксопропіл)-6-(31 Н ЯМР (CDCI3): 8,37(s, 1Н), 8,31 (d, 1Н), 7,91 трифлуорометилфеніл)-піримідин-2-карбонітрил: При перемішуванні до розчину 4-(3(s, 1H),7,80 (d, 1H), 7,66 (t, 1H), 3,51 (t, 2H), 3,46 (t, гідроксипропіл)-6-(3-трифлуорметилфеніл)2H), 3,23 (t, 2H), 2,95 (t, 2H), 1,70-1,58 (m, 4H), піримідин-2-карбонітрилу (1,54г) в ацетонітрилі 1,56-1,48 (m, 2H). MC m/z 389,1 (M+1). (15мл) додавали буфер 0,2М КН2РО4 з рН 6,5 Наступні сполуки отримували подібним чином (15мл), а потім TEMPO (120мг). Суміш гріли при сполученням кислоти з підходящим аміном у при45°С і одночасно додавали розчини NaCIO2 (1,26г сутності HOBt та EDCI. на 5мл Н2О) та 5% NaOCI (0,25мл на 5мл Н2О) 16b: 4-[3-(Гомопіперазин-1-іл)-3-оксопропіл]-6протягом 1 години (приблизно по 1,5мл кожного, як (3-трифлуорометилфеніл)-піримідин-2-карбонітрил початкові аліквоти). Через 5 годин суміш охологідрохлорид: 1 джували та доводили до рН приблизно 9,0 4Η Н ЯМР (CD3OD): 8,51 (s, 1H), 8,48 (d, 1H), NaOH, а потім додавали холодний розчин натрій 8,28 (s, 1H), 7,90 (d, 1H), 7,78 (t, 1H), 3,98-3,92 та сульфіту. Нейтральні речовини видаляли екстра3,84-3,78 (m, 2Н) (ротамери), 3,81-3,76 та 3,71-3,66 гуванням етилацетатом. Водну фазу підкислювали (m, 2Н) (ротамери), 3,50-3,45 та 3,33-3,27 (m, 2H) до рН -3,5 5Η НСІ і двічі екстрагували дихлорме(ротамери), 3,41-3,35 та 3,33-3,27 (m, 2H) (ротаметаном (нерозчинний матеріал у двофазній суміші ри), 3,29-3,23 (m, 2Н), 3,07 (t, 2Н), 2,26-2,16 та видаляли фільтруванням через целіт), а органіч2,10-2,02 (m, 2Н) (ротамери). MC m/z 404,4 (М+1). ний шар промивали водою і потім розсолом. Ви16с: 4-(3,4-Диметил-феніл)-6-[2-(2-піридин-2далення розчиннику, а потім розтирання в пороіл-етилкарбамоїл)-етил]-піримідин-2-карбонітрил шок в етері, дали білий осад, який містив залишки трифлуорметансульфонат: 1 TEMPO та трохи 2-карбоксамід-піримідинового Н ЯМР (CDCI3): 8,62 (d, 1H), 8,27 (t, 1H), 7,88 похідного, в якості побічного продукту реакції. (s, 1H), 7,81 (d, 1H), 7,62-7,78 (m, 4Н), 7,28 (s, 1H), Отримані маткові розчини містили потрібну кисло3,70-3,80 (m, 2H), 3,33 (t, 2H), 3,04 (t, 2H), 2,70 (t, ту, 4-(3-гідрокси-3-оксопропіл)-6-(32H), 2,34 (d, 6H). MC m/z 386,0 (M+1), 95%. трифлуорметилфеніл)-піримідин-2-карбонітрил, 16d: 4-(3,4-Диметил-феніл)-6-[2-(2-піперидин370мг. 1-іл-етилкарбамоїл)-етил]-піримідин-21 Н ЯМР (CDCI3): 8,35 (s, 1H), 8,31 (d, 1H), карбонітрил: 1 7,83 (s, 1H), 7,83 (d, 1H), 7,68 (t, 1H), 3,22 (t, 2Н), H ЯМР (CDCI3): 7,90 (s, 1H), 7,85 (d, 1H), 3,00 (t, 2Н) МС m/z 322,1 (М+1). 7,78 (s, 1H), 7,28 (s, 1H), 3,29 (t, 2H), 3,19 (t, 2H), Приклад 16а 2,75 (t, 2H), 2,30-2,40 (m, 12Н), 1,52-1,60 (m, 4H), 4-[3-(Піперидин-1-іл)-3-оксопропіл]-6-(31,41-1,47 (m, 2H). MC m/z 392,1 (M+1), 100%. трифлуорометилфеніл)-піримідин-2-карбонітрил: Приклад 17 До розчину 4-(3-гідрокси-3-оксопропіл)-6-(34-(3-Трет-бутил-феніл)-6-(3-оксо-пропіл)трифлуорметилфеніл)-піримідин-2-карбонітрилу піримідин-2-карбонітрил: (64мг) у ДХМ (6мл) додавали 1 47 A: 1-(3-Трет-бутил-феніл)-етнанон: При перемішуванні до розчину 1-трет-бутил-3етил бензол у (11,15) в ацетонітрилі (350мл) та воді (150мл) при кімнатній температурі додавали церій (III) сульфат (6,05г) та барій бромат (13,5г). Отриману суспензію нагрівали при кипінні під зворотним холодильником протягом 16 годин. Після охолодження до кімнатної температури реакційну суміш відфільтровували. Насичений водний розчин натрій тіосульфату додавали до фільтрату, і продукт реакції екстрагували дихлорметаном (3x100мл). Поєднані органічні речовини промивали розсолом, сушили MgSO4 та концентрували у вакуумі для утворення 1-(3трет-бутил-феніл)-етанону у формі неочищеного продукту як жовтого масла (13,5г). 1 Н ЯМР (CDCI3): 8,00 (s, 1Н), 7,75 (d, 1Н), 7,61 (d, 1Н), 7,39 (t, 1Н), 2,61 (s, 3H), 1,36 (s, 9H). В: 1,3-Діоксо-6-гідрокси-1-(3'-трет-бутилфеніл)-гексан: При перемішуванні до суспензії NaH (60% у маслі, 7,66г) в етері (480мл) при 0°С додавали етанол (479мкл), а потім -бутиролактон (6,18мл). Додавали краплями 1-(3-трет-бутил-феніл)-етанон (13,5г) в етері (80мл). Утвореній суміші дали нагрітися до кімнатної температури та перемішували протягом 72 годин. Після обережного додавання етанолу (10,5мл), додавали розчин амоній хлориду (10г на 250мл води), етерний шарвідокремлювали та промивали розсолом (300мл), сушили MgSO4 та концентрували у вакуумі для утворення 1,3-діоксо6-гідрокси-1(3'-трет-бутил-феніл)-гексану у формі неочищеного продукту реакції (18,5г). Цей не потребувало очищення, і його одразу застосовували у наступній реакції. МС m/z 245,4 (М+1), 80%. С: 2-Метилсульфаніл-4-(3-гідроксипропіл)-6-(3трет-бутил-метил-феніл)-піримідин: 89633 48 1,3-Діоксо-6-гідрокси-1(3'-трет-бутил-феніл)гексан (неочищений продукт реакції, 18,5г) та сіль S-метилізотіоуранію (30,7г) нагрівали до 110°С протягом 3 годин. Реакційну суміш потім охолоджували до кімнатної температури, додавали метанол (30мл) та триетиламін (26мл), і отриману суміш нагрівали до 85°С протягом 4 годин. Реакційну суміш концентрували у вакуумі і додавали до етилацетату продукт реакції (400мл), потім промивали водою (2x200мл), а органічний шар сушили MgSO4. Після видалення розчиннику у вакуумі, залишок хроматографували через силікагель з бензолом та етилацетатом (1:1) у якості елюенту для утворення 2-метилсульфаніл-4-(3гідроксипропіл)-6-(3-трет-бутил-метил-феніл)піримідин (5,2г) у формі масла. 1 Н ЯМР (CDCI3): 8,12 (s, 1H), 7,86 (d, 1H), 7,52 (d, 1H), 7,40 (t, 1H), 7,25 (s, 1H), 3,75 (t, 2Н), 2,88 (t, 2Н), 2,64 (s, 3H), 1,99-2,06 (m, 2Н), 1,38 (s, 9Н). МС m/z 317,1 (М+1), 95%. D: 2-Метилсульфаніл-4-(3-гідроксипропiл)-6-(3трифлуорометилфеніл)-піримідин До розчину 2-метилсульфаніл-4-(3гідроксипропіл)-6-(3-трет-бутил-феніл)-піримідину (5,2г) у метанолі та воді при перемішуванні (122мл, 10:1) додавали ОКСОН (23,2г). Суміш перемішували при кімнатній температурі протягом ночі. Після розбавлення водою (200мл), продукт реакції екстрагували етилацетатом (3x200мл). Поєднані органічні речовини промивали розсолом (200мл), сушили MgSO4 та концентрували у вакуумі для утворення 2-метилсульфоніл-4-(3гідроксипропіл)-6-(3-трет-бутил-метил-феніл)піримідину (4,6г) у формі блідо-коричневого твердого продукту. Його застосовували на наступному етапі без додаткового очищення. 1 Н ЯМР (CDCI3): 8,12 (s, 1H), 7,92 (d, 1H), 7,73 (s, 1H), 7,59 (d, 1H), 7,45 (t, 1H), 3,7(t, 2Н), 3,43 49 89633 50 (s, 3H), 3,08 (t, 2Н), 2,08-2,16 (m, 2Н), 1,40 (s, 9Н). матографували через силікагель з бензолом та МС m/z 349,4 (М+1), 95%. етилацетатом (1:1) у якості елюенту для утворенΕ: 4-(3-Трет-бутил-феніл)-6-(3-гідроксиня 4-(3-трет-бутил-феніл)-6-(3-оксо-пропіл)пропіл)-піримідин-2-карбонітрил: піримідин-2-карбонітрил у формі блідо-жовтого При перемішуванні до розчину 2твердого продукту (266мг). 1 метилсульфоніл-4-(3-гідроксипропіл)-6-(3-третН ЯМР (CDCI3): 8,13 (s, 1H), 7,88 (d, 1H), бутил-метил-феніл)-піримідину (4,6г) у ДМСО 7,79 (s, 1H), 7,60 (d, 1H), 7,46 (t, 1H), 3,18 (m, 2Н), (120мл) при кімнатній температурі додавали на3,11 (m, 2Н), 1,40 (s, 9Н). МС m/z 294,0 (М+1), 95%. трій ціанід (647мг). Отриману суспензію перемішуПриклад 18а вали при кімнатній температурі протягом 3 годин. 4-(3-Бензилокси-пропіл)-6-(3-трифлуорометилПісля додавання етилацетату (200мл), суміш профеніл)-піримідин-2-карбонітрил: мивали водою (100мл 3). Органічний шар сушили А: етиловий естер 6-Бензилокси-3MgSO4 та концентрували у вакуумі, залишок хрооксогексанової кислоти: матографували через силікагель з бензолом та 4-Бензилоксимасляну кислоту (6,38мл), кислоетилацетатом у якості елюенту для утворення 4ту Мелдрума (5,76г) та диметиламінопіридин (3-трет-бутил-феніл)-6-(3-гідрокси-пропіл)(9,77г) розчиняли у ДХМ (200мл) та охолоджували піримідин-2-карбонітрилу (4,0г) у формі масла. до 0°С. 1 Додавали краплями розчин ізопропенілхлороН ЯМР (CDCI3): 8,14 (s, 1H), 7,89 (d, 1H), форміату у дихлорометані (100мл) та перемішува7,74 (s, 1H), 7,60 (d, 1H), 7,46 (t, 1H), 3,76(t, 2Н), ли при 0°С протягом 2 годин. Потім додавали калій 3,00 (t, 2Н), 2,05-2,13 (m, 2Н), 1,40 (s, 9Н). МС m/z гідросульфат (200мл 10% водного розчину), орга296,0 (М+1), 95%. нічну фазу відокремлювали, сушили натрій сульF: 4-(3-Трет-бутил-феніл)-6-(3-оксо-пропіл)фатом та випарювали під зменшеним тиском. Запіримідин-2-карбонітрил: лишок розчиняли в етанолі (200мл) та гріли при Перйодинан Дес-Мартіна (679мг) додавали до кипінні під зворотним холодильником протягом розчину 4-(3-трет-бутил-феніл)-6-(3-гідроксиночі. Потім охолоджували, розчинник випарювали пропіл)-піримідин карбонітрилу (394мг) у ДХМ під зменшеним тиском, і отримане масло очищали (5мл), і отриману суспензію перемішували при флеш-хроматографією на оксиді силіцію. Етилокімнатній температурі протягом 45 хвилин. Реаквий естер 6-бензилокси-3-оксогексанової кислоти ційну суміш розбавляли EtOAc (100мл), потім проекстрагували у формі оранжевого масла (8,53г). мивали водою (2x100мл). Органічний шар сушили MgSO4 та концентрували у вакуумі. Залишок хро 1 Н ЯМР (CDCI3): 7,26-7,35 (m, 5H), 4,48 (s, 2H), 4,18 (q, 2H), 3,49 (t, 2H), 3,44 (s, 2H), 2,67 (t, 2H), 1,90-1,97 (m, 2H), 1,27 (t, 3H). MC m/z 287,0 (М+1), 100%. В: 6-(3-Бензилокси-пропіл)-2-меркаптопіримідин-4-ол: При перемішуванні до суспензії натрій метоксиду (3,48г) у метанолі (40мл), охолодженої до 0°С, додавали тіосечовину (3,56г). Суміш перемі 51 89633 52 шували до повного розчинення, потім повільно тетракіс(трифенілфосфін)-паладію(0) (1,4г), літій додавали етиловий естер 6-бензилокси-3хлориду (1,4г), та 2,6-ди-трет-бутилфенолу (150мг) оксогексанової кислоти (8,52г на 20мл метанолу). у діоксані (100мл) гріли при кипінні під зворотним Розчин гріли при кипінні під зворотним холодильхолодильником під азотом протягом 3 годин. Після ником протягом ночі, охолоджували до кімнатної охолодження суспензію профільтровували, і фільтемператури, та концентрували у вакуумі. Залитрат випарювали до сухого стану під зменшеним шок розчиняли у воді (50мл), підкислювали оцтотиском. Флеш-хроматографія на оксиді силіцію вою кислотою до рН 6, та перемішували протягом дала 4-(3-бензилокси-пропіл)-2-метансульфоніл-61 години. Залишок профільтровували, далі промитриметилстананіл-піримідин (8,0г) у формі блідовали водою (2x20мл) та ізопропанолом (2x20мл), жовтого масла. 1 потім висушували, щоб отримати 6-(3-бензилоксиН ЯМР (CDCI3): 7,47 (s, 1Н), 7,25-7,4 (m, 5Н), пропіл)-2-меркапто-піримідин-4-ол у формі білого 4,5 (s, 2Н), 3,55 (t, 2Н), 3,35 (s, 3H), 2,90 (t, 2H), порошку (7,94г). MC m/z 277M (М+1), 100%. 2,06 (m, 2H), 0,40 (s, 9H). С: 6-(3-Бензилокси-пропіл)-2-метилсульфанілG: 4-(3-Бензилокси-пропіл)-6піримідин-4-ол: триметилстананіл-піримідин-2-карбонітрил: Суміш 6-(3-бензилокси-пропіл)-2-меркаптоРозчин 4-(3-бензилокси-пропіл)-2піримідин-4-ол (7,94г), калій гідроксиду (32мл 1N метансульфоніл-6-триметилстананіл-піримідину розчину у метанолі) та метил йодиду (1,97мл) пе(200мг) та натрій ціаніду (42мг) у диметилсульфокремішували при кімнатній температурі протягом сиді (1мл) перемішували при кімнатній температуночі. Залишок профільтровували, далі промивали рі протягом 2 годин. Реакційну суміш розбавляли метанолом (2x20мл), ізопропанолом (2x20мл) та етилацетатом (10мл), промивали водою (2x10мл), водою (2x20мл), потім висушували, щоб отримати сушили натрій сульфатом та випарювали при зме6-(3-бензилокси-пропіл)-2-метилсульфанілншеному тиску. Флеш-хроматографія на оксиді піримідин-4-ол у формі білого порошку (7,0г). MC силіцію дала 4-(3-бензил-окси-пропіл)-6m/z 291,0 (М+1), 100%. триметилстананіл-піримідин-2-карбонітрил у форD: Трифлуороцтової кислоти 6-[3-бензилоксимі жовтого масла (111мг). 1 пропіл)-2-метилсульфаніл-піримідин-4-іловий есН ЯМР (CDCI3): 7,45 (s, 1H), 7,28-7,37 (m, тер: 5H), 4,50 (s, 2H), 3,54 (t, 2H), 2,84 (t, 2Н), 2,02-2,10 Розчин 6-(3-бензилокси-пропіл)-2(m, 2H), 0,39 (s, 9H). метилсульфаніл-піримідин-4-олу (200мг) та триеН: 4-(3-Бензилокси-пропіл)-6-(3тиламіну (0,2мл) у дихлорметані (5мл) охолоджутрифлуорметил-феніл)-піримідин-2-карбонітрил: вали до 0°С, в наслідок чого додавали трифлуоРозчин 4-(3-бензилокси-пропіл)-6роцтовий ангідрид (0,14мл), і отриману суміш триметилстананіл-піримідин-2-карбо-нітрилу нагріли до кімнатної температури. Після 2 годин, (100мг), трифлуорметилбромбензолу (36мл) та реакційну суміш промивали водою (2x20мл), су1,1'шили натрій сульфатом та випарювали під змен(бістрифенілфосфіно)фероценедихлорпаладію(ІІ) шеним тиском. Флеш-хроматографія на оксиді (16мг) у диметилформаміді (5мл) гріли у мікрохвисиліцію дала трифлуороцтової кислоти 6-(3льовці до 150°С протягом 5 хвилин. Отриману субензилокси-пропіл)-2-метилсульфаніл-піримідинспензію розбавляли етилацетатом та водою 4-іловий естер (160мг) у формі жовтого масла. (20мл), органічний шар відокремлювали, сушили 1 Н ЯМР (CDCI3): 7,30-7,40 (m, 5H), 6,58 (m, натрій сульфатом та випарювали при зменшеному 1H), 4,49 (s, 2H), 3,51 (t, 2H), 2,88 (t, 2Н), 2,54 (s, тиску. Флеш-хроматографія на оксиді силіцію дала 3H), 2,04-2,10 (m, 2H). 4-(3-бензилокси-пропіл)-6-(3-трифлуорметилΕ: Трифлуороцтової кислоти 6-(3-бензилоксифеніл)-піримідин-2-карбонітрил у формі жовтої пропіл)-2-метансульфоніл-піримідин-4-іловий ессмоли (47мг). 1 тер: Н ЯМР (CDCI3): 8,31 (s, 1H), 8,25 (d, 1H), Суспензію трифлуороцтової кислоти 6-(37,82 (d, 1H), 7,72 (s, 1H), 7,67 (t, 1H), 7,24-7,32 (m, бензилокси-пропіл)-2-метилсульфаніл-піримідин5H), 4,49 (s, 2H), 3,57 (t, 2H), 3,02 (t, 2H), 2,10-2,18 4-ілового естеру (494мг) та Оксону (419мг) у мета(m, 2H). МС m/z 398,1 (М+1), 100%. нол/воді (8/2мл) перемішували при кімнатній темВищеописаний спосіб також реалізовували, пературі протягом ночі. Метанол випарювали під застосовуючи підходящі похідні арилброміду, щоб зменшеним тиском, і отриману суспензію екстраотримати наступні сполуки: гували етилацетатом (2x20мл). 18b: 4-(3-Аміно-5-трифлуорметил-феніл)-6-(3Органічну фракцію сушили натрій сульфатом бензилокси:пропіл)-піримідин-2-карбонітрил: 1 та випарювали під зменшеним тиском, щоб отриН ЯМР (CDCI3): 7,67 (s, 1Н), 7,59 (s, 1Н), мати трифлуороцтової кислоти 6-(3-бензилокси7,56 (s, 1Н), 7,24-7,35 (m, 5Н), 7,05 (s, 1Н), 4,49 (s, пропіл)-2-метансульфоніл-піримідин-4-іловий ес2Н), 4,08 (br s, 2H), 3,56 (t, 2H), 3,00 (t, 2H), 2,10тер (135мг). 2,18 (m, 2H). MC m/z 413,3 (М+1), 100%. 1 Н ЯМР (CDCI3): 7,28-7,40 (m, 5Н), 7,15 (m, 18с: 4-(3-Бензилокси-пропіл]-6-(3-карбокси-51Н), 4,47 (s, 2Н), 3,54 (t, 2Н), 3,33 (s, 3H), 3,11 (t, трифлуорометил-феніл)-піримідин-2-карбонітрил: 1 2Н), 2,10-2,18 (m, 2Н). MCm/z 477,0 (М+1), 100%. Н ЯМР (CDCI3): 8,86 (s, 1H), 8,55 (s, 1H), F: 4-(3-Бензилокси-пропіл)-2-метансульфоніл8,47 (s, 1H), 7,76 (s, 1H), 7,24-7,35 (m, 5Н), 4,43 (s, 6-триметилстананіл-піримідин: 2Н), 3,53 (t, 2Н), 3,00 (t, 2Н), 2,09-2,15 (m, 2Н). МС Суміш трифлуороцтової кислоти 6-(3m/z 440,3 (Μ-Η), 100%. бензилокси-пропіл)-2-метансульфоніл-піримідин-4Приклад 19 ілового естеру (13,5г), гексаметилдитину (11,8г), 53 89633 54 4-(3-Бензилокси-пропіл)-6-(3ляли під зменшеним тиском, щоб отримати 3метансульфоніламіно-5-трифлуорометилфеніл)бром-N-метил-5-трифлуорметилпіримідин-2-карбонітрил: бензолсульфонамід (181мг) у формі твердого жовА: N-(3-Бром-5-трифлуорометил-фент)того продукту. 1 метансульфонамід: Н ЯМР (MeOD): 8,19 (s, 1Н), 8,05 (s, 1H), До розчину 3-аміно-5-бромбензотрифлуориду 7,98 (s, 1H), 4,58 (m, 1H), 2,74 (d, 3H). МС m/z (200мг) у піридині (2мл) додавали метан сульфо319,8 (М+1). нілхлорид (115мг) та один кристал 4-(диметилВ: 4-(3-Бензилокси-пропіл)-6-(3аміно)піридину. Суміш перемішували при кімнатній метилсульфамоїл-5-трифлуорометил-феніл)температурі протягом 4 годин, потім розбавляли піримідин-2-карбонітрил: етилацетатом (50мл), промили НСІ (2М, 50мл) та 3-Бром-N-метил-6-трифлуорметилнасиченим розчином натрій хлориду (50мл). Оргабензолсульфонамід (37мг), 4-(3-бензилоксинічні речовини відокремлювали, сушили натрій пропіл)-6-триметилстананіл-піримідин-2сульфатом, профільтровували, розчинник видалякарбонітрил (40мг) та дихлорли під зменшеним тиском, щоб отримати N-(3біс(трифенілфосфін)паладій(ІІ) (7мг) у ДМФ (1мл) бром-5-трифлуорметил-феніл)-метансульфонамід нагрівали у мікрохвильовці до 80°С протягом 5 (264мг). хвилин. Суміш розбавляли етилацетатом (20мл) 1 Н ЯМР (MeOD); 7,59 (s, 1Н), 7,58 (s, 1H), та промивали водою (3x20мл). Органічні речовини 7,40 (s, 1H), 7,00 (s, 1H), 3,11 (s, 3H). МС m/z 318,9 відокремлювали, сушили натрій сульфатом, про(М+1). фільтровували, а розчинник видаляли під зменВ: 4-(3-Бензилокси-пропіл)-6-(3шеним тиском, щоб отримати неочищений продукт метансульфоніламіно-5-трифлуорметилфеніл)реакції. Очищення препаративною рідинною хропіримідин-2-карбонітрил: матографією високого тиску дало 4-(3-бензилоксиN-(3-Бром-5-трифлуорометил-феніл)пропіл)-6-(3-метилсульфамоїл-5-трифлуорметилметансульфонамід (37мг), 4-(3-бензилоксифеніл)-піримідин-2-карбонітрил (16,5мг). 1 пропіл)-6-триметилстананіл-піримідин-2Н ЯМР (MeOD): 8,70 (s, 1H), 8,54 (s, 1H), карбонітрил (40мг) та дихлор8,27 (s, 1H), 7,82 (s, 1H), 7,27 (m, 5H), 4,78 (m, 1Н), біс(трифенілфосфін)паладій(ІІ) (7мг) у ДМФ (1мл) 4,48 (s, 2Н), 3,59 (t, 2Н), 3,06 (t, 2Н), 2,75 (d, 3H), нагрівали у мікрохвильовці до 180°С протягом 5 2,16 (m, 2Н). МС m/z 491,1 (М+1), 100%. хвилин. Суміш розбавляли етилацетатом (10мл) Приклад 21 та профільтровували через целіт. Фільтрат проми4-(3-Гідрокси-пропіл)-6-(3-метилсульфамоїл-5вали водою (10мл) та розчин насиченого натрій трифлуорметил-феніл)-піримідин-2-карбонітрил: хлориду (10мл). Органічні речовини відокремлюДо розчину 4-(3-бензилокси-пропіл)-6-(3вали, сушили натрій сульфатом, профільтровуваметилсульфамоїл-5-трифлуорметил-феніл)ли, а розчинник видаляли під зменшеним тиском, піримідин-2-карбонітрилу (14,4мг) в ацетонітрилі щоб отримати неочищений продукт реакції. Очи(700мкл) та воді (300мкл) додавали церій сульфат щення рідинною хроматографією високого тиску (3мг) та барій бромат (6мг). Суміш нагрівали при дало 4-(3-бензилокси-пропіл)-6-(3кипінні під зворотним холодильником протягом метансульфоніламіно-5-трифлуорметилфеніл)ночі, потім відфільтрували через лійку зі спеченого піримідин-2-карбонітрил. скла, залишок промили ДХМ (10мл). Фільтрат 1 Н ЯМР (MeOD): 8,10 (s, 1H), 8,09 (s, 1H), промивали насиченим натрій тіосульфатом 7,74 (s, 1H), 7,70 (s, 1H), 7,29 (m, 5H), 4,49 (s, 2Н), (10мл), органічні речовини відокремлювали, суши3,58 (t, 2Н), 3,12 (s, 3H), 3,06 (t, 2Н), 2,17 (m, 2Н). ли натрій сульфатом, профільтровували, а розМС m/z 491,1. чинник видаляли під зменшеним тиском, щоб Приклад 20 отримати неочищений продукт реакції. Очищення 4-(3-Бензилокси-пропіл)-6-(3препаративною рідинною хроматографією високометилсульфамоїл-5-трифлуорометил-феніл)го тиску дало 4-(3-гідрокси-пропіл)-6-(3піримідин-2-карбонітрил: метилсульфамоїл-5-трифлуорметил-феніл)А: 3-Бром-N-метил-6-трифлуорметилпіримідин-2-карбонітрил (3,2мг). 1 бензолсульфонамід: Н ЯМР (MeOD): 8,89 (s, 1H), 8,78 (s, 1H), До розчину 3-бром-5-(трифлуорометил)8,31 (s, 1H), 8,28 (s, 1H), 3,66 (t, 2H), 3,05 (t, 2Н), бензолсульфонілхлориду (200мг) у 1,4-діоксані 2,61 (s, 3H), 2,08 (m, 2Н). МС m/z 401,1 (М+1), (1мл) додавали метиламін (40% водний розчин, 100%. 96мг). Суміш перемішували при кімнатній темпеПриклад 22 ратурі протягом 3 годин, потім розбавляли етила4-(3-Диметилсульфамоїл-5-трифлуорометилцетатом (20мл) та промили НСІ (1М, 2x20мл). Орфеніл)-6-(3-піперидин-1-іл-пропіл)-піримідин-2ганічні речовини відокремлювали, сушили натрій карбонітрил сульфатом, профільтровували, а розчинник вида 55 4-(3-Метилсульфамоїл-5-трифлуорометилфеніл)-6-(3-оксо-пропіл)-піримідин-2-карбонітрил: Суспензію 4-(3-гідрокси-пропіл)-6-(3метилсульфамоїл-5-трифлуорметил-феніл)піримідин-2-карбонітрилу (235мг) та реагент ДесМартіна (299мг) у дихлорметані (5мл) перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш очищали флеш-хроматографією на оксиді силіцію, щоб отримати 4-(3метилсульфамоїл-5-трифлуорометил-феніл)-6-(3оксо-пропіл)-піримідин-2-карбонітрил у формі рожевого масла (300мг). МС m/z 399,0 (М+1), 100%. З цього альдегіду способом відновного амінування, який було описано у прикладі 7а, було синтезовано наступну сполуку: В: 4-(3-Диметилсульфамоїл-5трифлуорометил-феніл)-6-(3-піперидин-1-ілпропіл)-піримідин-2-карбонітрил: 1 Н ЯМР (CDCI3): 8,75 (s, 1Н), 8,60 (s, 1H), 8,28 (s, 1H), 7,88 (s, 1H), 2,98 (t, 2H), 2,77 (s, 3H), 2,35-2,50 (br m, 6H), 2,02-2,08 (m, 2H), 1,42-1,66 (br m, 6H). MC m/z 468,0 (M+1), 100%. Приклад 23 4-(4-Метокси-3-трифлуорометил-феніл)-6пропіл-піримідин-2-карбонітрил: Біс(трифенілфосфін)паладій дихлорид (34мг, 0,05ммоль) додавали під азотом у суміш 4-пропіл6-триметилстананіл-піримідин-2-карбонітрил (150мг, 0,48ммоль) та 4-метокси-3трифлуорметил-бромбензол (148мг, 0,58ммоль) у диметилформаміді (3мл). Суміш гріли протягом 5 годин до 80°С, потім концентрували під зменшеним тиском. Залишок розподіляли між етилацетатом та водою. Водний шар двічі екстрагували етилацетатом. Поєднані органічні шари концентрували під зменшеним тиском. Залишок хроматографували через силікагель (елюент: циклогексан/ДХМ 7/3), щоб отримати твердий продукт, який розтирали у порошок у пентані. Після фільтрування 4-(4-метокси-3-трифлуорметилфеніл)-6-пропіл-піримідин-2-карбонітрил (18мг, 11%) отримували у формі білого твердого продукту. 1 Н ЯМР (CDCI3) : 8,34 (d, J=8Гц, 1Н); 8,30 (s, 1H); 7,65 (s, 1H); 7,15 (s, 1H); 4,01 (s, 3H); 2,92 (t, J=8Гц, 2H); 1,95-1,85 (m, 2Н); 1,05 (t, J=7Гц, 3H). МС m/z 322,1 (М+1). 89633 56 Приклад 24 4-(5-трет-бутил-2-метокси-феніл)-6-пропілпіримідин-2-карбонітрил: А: 1-Трет-бутил-4-метокси-3-йодбензол: 1 Н ЯМР (CDCI3) : 7,76 (d, J=2Гц, 1Н); 7,30 (dd, J=8Гц, J'=2Гц, 1Н); 6,74 (d, J=8Гц, 1Н); 3,83 (s, 3H); 1,28 (s, 9H). 13 С ЯМР (CDCI3) : 155,8, 145,5, 136,3, 126,3, 110,4, 85,9, 56,3, 34,0, 31,4. В: 4-(5-Трет-бутил-2-метокси-феніл)-6-пропілпіримідин-2-карбонітрил: 1 Н ЯМР (CDCI3) : 8,05 (s, 1H); 7,99 (s, 1H); 7,51 (d, J=8Гц, 1Н); 6,97 (d, J=8Гц, 1H); 3,90 (s, 3H); 2,81 (t, J=8Гц, 2H); 1,85-1,75 (m, 2H); 1,36 (s, 9H); 1,01 (t, J=8Гц, 3H). MC m/z 310 (М+1). Приклад 25 4-(3-Циклопропіл-феніл)-6-пропіл-піримідин-2карбонітрил: А: Йод (0,33 г, 1,32ммоль), дійодметан (4,3мл, 53,0ммоль) та 3-бромстирол (5г, 26,4ммоль) поступово додавали до суспензії міді (7,5г, 118,8ммоль) у толуолі (50мл). Суміш гріли при кипінні під зворотним холодильником протягом 140 годин, потім відфільтровували та концентрували у вакуумі. Залишок переганяли під зменшеним тиском, щоб отримати 3-бром-1-циклопропілбензол (0,55г, 10%) у формі безбарвного масла. 1 Н ЯМР (CDCI3) : 7,35-7,25 (m, 1H); 7,25-7,20 (m, 1H); 7,15-7,05 (m, 1H); 7,05-6,95 (m, 1H); 1,951,85 (m, 1H); 1,05-0,95 (m, 2H); 0,75-0,65 (m, 2H). В: 4-(3-Циклопропіл-феніл)-6-пропіл-піримідин2-карбонітрил: 1 Н ЯМР (CDCI3) : 7,85-7,80 (m, 2Н); 7,68 (s, 1Н); 7,41 (t, J=8Гц, 1Н); 7,30-7,20 (m, 1Н); 2,84 (t, J=8Гц, 2Н); 2,05-2,95 (m, 1H); 1,90-1,80 (m, 2H); 1,10-0,95 (m, 5H); 0,80-0,75 (m, 2Н). МС m/z 264 (М+1). Рідинна хроматографія високого тиску (200400нм): 92,2%. Приклад 26а 4-(3,4-диметокси-феніл)-6-пропіл-піримідин-2карбонітрил: А: 4-Йод-6-пропіл-піримідин-2-карбонітрил: Йод (1,64г, 6,5ммоль) додавали при кімнатній температурі до розчину 4-пропіл-6триметилстананіл-піримідин-2-карбонітрилу (2,0г, 6,5ммоль) у ТГФ (100мл). Суміш перемішували 57 89633 58 1 при кімнатній температурі протягом 2 годин, потім Н ЯМР (CDCI3) : 7,7-7,6 (m, 2Н); 7,58 (s, 1Н); розбавляли насиченим розчином натрій тіосуль6,98 (d, J=8Гц, 1Н); 4,35-4,25 (m, 4Н); 2,80 (t, фату, і ТГФ видаляли під зменшеним тиском. ВодJ=8Гц, 2H); 1,85-1,75 (m, 2Н); 1,01 (t, J=8Гц, 3H). ний шар екстрагували етилацетатом (3x100мл). МС m/z 282 (М+1). Поєднані органічні шари промивали розсолом, 26g: 4-Пропіл-6-(4-трифлуорметил-феніл)сушили натрій сульфатом, профільтровували та піримідин-2-карбонітрил: 1 концентрували під зменшеним тиском. Залишок Н ЯМР (CDCI3) : 8,23 (d, J=8Гц, 2Н); 7,80 (d, хроматографували через силікагель (елюент: цикJ=8Гц, 2Н); 7,75 (s, 1H); 2,88 (t, J=8Гц, 2H); 1,9-1,8 логексан/етилацетат 5/5), щоб отримати 4-йод-6(m, 2Н); 1,04 (t, J=8Гц, 3H). МС m/z 292 (М+1). пропіл-піримідин-2-карбонітрил (1,28г, 72%) у фо26h: 4-(2-Метокси-феніл)-6-пропіл-піримідин-2рмі безбарвного масла. карбонітрил: 1 1 Н ЯМР (CDCI3) : 7,81 (s, 1H); 2,71 (t, J=8Гц, Н ЯМР (CDCI3) : 8,07 (d, J=8Гц, 1Н); 8,02 (s, 2Н); 1,8-1,7 (m, 2H); 0,99 (t, J=8Гц, 3H). 1H); 7,50-7,45 (m, 1H); 7,15-7,10 (m, 1Н); 7,04 (d, 13 С ЯМР (CDCI3) : 172,0, 143,7, 134,2, 129,2, J=8Гц, 1Н); 3,93 (s, 3H); 2,82 (t, J=8Гц, 2Н); 1,9-1,8 114,7, 38,8, 21,8, 13,7. МС m/z 274 (М+1). (m, 2H); 1,02 (t, J=8Гц, 3H). МС m/z 254 (М+1). В: 4-(3,4-диметокси-феніл)-6-пропіл-піримідин26і: 4-Пропіл-6-(2-трифлуорметил-феніл)2-карбонітрил: піримідин-2-карбонітрил: 1 Під азотом розчин (с=0,18М) 4-йод-6-пропілН ЯМР (CDCI3) : 7,83 (d, J=8Гц, 1Н); 7,75піримідин-2-карбонітрилу (1мл, 0,18ммоль) у дега7,50 (m, 2H); 7,54 (d, J=8ц, 1Н); 7,49 (s, 1Н); 2,87 (t, зованому толуолі, водний розчин калій карбонату J=8Гц, 2H); 1,9-1,8 (m, 2Н); 1,01 (t, J=8Гц, 3H). МС (с=2М) (0,225мл, 0,45ммоль) та тетракісm/z 292 (М+1). (трифенілфосфін)паладію (10мг, 0,09ммоль) пос26j: 4-(3-Ацетил-феніл)-6-пропіл-піримідин-2тупово додавали до розчину 3,4карбонітрил: 1 диметоксифенілборонової кислоти (с=0,216М) Н ЯМР (CDCI3) : 8,67 (s, 1H); 8,37 (d, J=8Гц, (1мл, 0,216ммоль) у дегазованому толуолі. Суміш 1Н); 8,14 (d, J=8Гц, 1Н); 7,80 (s, 1Н); 7,67 (t, J=8Гц, нагрівали до 105°С протягом 4 годин, потім охоло1H); 2,88 (t, J=8Гц, 2H); 2,72 (s, 3H); 1,9-1,8 (m, 2H); джували до кімнатної температури та перемішува1,03 (t, J=8Гц, 3H). МС m/z 266 (М+1). ли з водою (4мл). Органічний шар випарювали під 26k: 4-(4-Ізопропіл-феніл)-6-пропіл-піримідинзменшеним тиском. Залишок хроматографували 2-карбонітрил: 1 препаративною рідинною хроматографією високоН ЯМР (CDCI3) : 8,04 (d, J=8Гц, 2Н); 7,67 (s, го тиску. (Н2О+0,05% TFA/CH3CN+0,05% TFA), 1H); 7,39 (d, J=8Гц, 2Н); 3,05- 2,95 (m, 1Н); 2,83 (t, щоб отримати 4-(3,4-диметокси-феніл)-6-пропілJ=8Гц, 2H); 1,9-1,8 (m, 2Н); 1,30 (s, 3H); 1,29 (s, піримідин-2-карбонітрил (28мг). 3H); 1,02 (t, J=8Гц, 3H). МС m/z 266 (М+1). 1 Н ЯМР (CDCI3) : 7,75 (s, 1H); 7,66 (d, J=8Гц, 26І: 4-(Бензо[1,3]діоксол-5-іл)-6-пропіл1Н); 7,63 (s, 1H); 6,97 (d, J=8Гц, 1H) ; 4,02 (s, 3H); піримідин-2-карбонітрил: 1 3,97 (s, 3H); 2,82 (t, J=8Гц, 2Н) ; 1,85-1,75 (m, 2H) ; Н ЯМР (CDCI3) : 7,68 (d, J=8Гц, 1Н); 7,62 (s, 1,02 (t, J=7Гц, 3H). MC m/z 284 (М+1). 1H); 7,58 (s, 1H); 6,94 (d, J=8Гц, 1H); 6,08 (s, 2H); Вищеописаний спосіб реалізовували, застосо2,81 (t, J=8Гц, 2Н); 1,85-1,75 (m, 2H); 1,01 (t, J=8Гц, вуючи похідні підходящої боронової кислоти у син3H). МС m/z 268 (М+1). тезі наступних похідних: 26m: 4-(3-Нітро-феніл)-6-пропіл-піримідин-226b: 4-(2,3-Дигідро-бензофуран-5-іл)-6-пропілкарбонітрил: 1 піримідин-2-карбонітрил: Н ЯМР (CDCI3) : 8,92 (s, 1H); 8,53 (d, J=8Гц, 1 Н ЯМР (CDCI3) : 8,1-8,0 (m, 1H); 7,9-7,8 (m, 1Н); 8,43 (d, J=8Гц, 1Н); 7,81 (s, 1Н); 7,77 (t, J=8Гц, 1H); 7,58 (s, 1H); 6,9-6,8 (m, 1H); 4,7-4,6 (m, 2H); 1Н); 2,91 (t, J=8Гц, 2Н); 1,9-1,8 (m, 2H); 1,05 (t, 3,35-3,25 (m, 2H); 2,85-2,70 (m, 2H); 1,9-1,8 (m, 2H); J=8Гц, 3H). МС m/z 269 (М+1). 1,00 (t, J=8Гц, 3H). МС m/z 266 (М+1). 26n: 4-(3-Хлор-4-флуор-феніл)-6-пропіл26с: 4-(3-Ціано-феніл)-6-пропіл-піримідин-2піримідин-2-карбонітрил: 1 карбонітрил: Н ЯМР (CDCI3) : 8,21 (d, J=8Гц, 1Н); 8,1.8,0 1 Н ЯМР (CDCI3) : 8,4-8,3 (m, 2H); 7,86 (d, (m, 1H); 7,66 (s, 1H); 7,35-7,20 (m, 1Н); 2,9-2,8 (m, J=8Гц, 1Н); 7,73 (s, 1H); 7,69 (t, J=8Гц, 1H); 2,89 (t, 2Н); 1,90-1,75 (m, 2Н); 1,03 (t, J=7Гц, 3H). МС m/z J=8Гц, 2Н); 1,9-1,8 (m, 2H); 1,04 (t, J=8Гц, 3H). МС 266 (М+1). m/z 249 (М+1). 26о: 4-(2,5-Диметокси-феніл)-6-пропіл26d: 4-(3-Xлop-фeнiл)-6-пpoпiл-пipимiдин-2піримідин-2-карбонітрил: 1 кapбoнiтpил: Н ЯМР (CDCI3) : 8,07 (s, 1H); 7,66 (d, J=3Гц, 1 Н ЯМР (CDCI3) : 8,10 (s, 1H); 7,99 (d, J=8Гц, 1Н); 7,05 (dd, J=8Гц, J'=3Гц, 1Н); 6,97 (d, J=8Гц, 1Н); 7,67 (s, 1H); 7,55-7,45 (m, 2H); 2,86 (t, J=8Гц, 1H); 3,88 (s, 3H); 3,87 (s, 3H); 2,82 (t, J=8Гц, 2Н) ; 2Н); 1,9-1,8 (m, 2H); 1,03 (t, J=8Гц, 3H). МС m/z 1,85-1,75 (m, 2H); 1,02 (t, J=7Гц, 3H). МС m/z 284 258/260 (М+1). (М+1). 26е: 4-(4-Диметиламіно-феніл)-6-пропілПриклад 27а піримідин-2-карбонітрил: 4-(2-Хлор-5-трифлуорометил-феніл)-6-пропіл1 Н ЯМР (CDCI3) : 8,03 (d, J=8Гц, 2Н); 7,53 (s, піримідин-2-карбонітрил: 1H); 6,75 (d, J=8Гц, 2Н); 3,08 (s, 6Н); 2,76 (t, J=8Гц, Під азотом розчин (с=0,18М) 4-йод-6-пропіл2Н); 1,9-1,8 (m, 2H); 1,00 (t, J=8Гц, 3H). МС m/z 267 піримідин-2-карбонітрилу (1мл, 0,18ммоль) у дега(М+1). зованому толуолі, водний розчин (с=2М) калій ка26f: 4-(2,3-Дигідро-бензо[1,4]діоксин-6-іл)-6рбонату (0,225мл, 0,45ммоль) та тетрапропіл-піримідин-2-карбонітрил: 59 89633 60 кіс(трифенілфосфін)паладій (10мг, 0,09ммоль) N,N-Дибензил-S-циклопентил-анілін (6,07г, поступово додавали до розчину (с=0,216М) 217,03ммоль) гідрували з Pd(OH)2 (600мг) під тисхлор-5-(трифлуорметил)фенілборонової кислоти ком 10бар у суміші МеОН (80мл), метоксіетанолу (1мл, 0,216ммоль) у дегазованому толуолі. Суміш (20мл), СН2СІ2 (20мл) та концентрованої НСІ нагрівали до 105°С протягом 4 годин, потім охоло(1,63мл) протягом 20 годин. Каталізатор видаляли джували до кімнатної температури та перемішувафільтруванням, а розчинник видаляли під зменли з водою (4мл). Органічний шар випарювали під шеним тиском. Залишок розподіляли між CH2CI2 та зменшеним тиском. Залишок хроматографували водою. рН доводили приблизно до 10 додаванням препаративною рідинною хроматографією високоNaOH у гранулах. Органічний шар промивали розго тиску (Н2О+0,05% TFA/CH3CN+0,05% TFA), щоб солом, сушили MgSO4 та концентрували під зменотримати 4-(2-хлор-5-трифлуорметил-феніл)-6шеним тиском для утворення 2,65г очікуваного пропіл-піримідин-2-карбонітрил (34мг, 58%) у фоаніліну. Гідрохлорид отримували обробкою етеррмі твердого продукту. ним НСІ: 2,38г, вихід: 71%. Рідинна хроматографія 1 високого тиску: 100%. Н ЯМР (CDCI3) : 7,99 (s, 1Н); 7,78 (s, 1Н); 7,71 7,6 (m, 2Н); 2,89 (t, J=8Гц, 2Н); 1,90-1,80 (m, 2H); Н ЯМР (CD3OD) : 7,44 (1Н, t, J=8Гц), 7,38 (Η, 1,03 (t, J=8Гц, 3H). МС m/z 326/328 (М+1). d, J=8Гц), 7,29 (1H, s), 7,21 (1H, m), 3,08 (1H, квінВищеописаний спосіб реалізовували, застосотет), 2,09-2,13 (2Н, m), 1,83-1,86 (2Н, m), 1,73-1,76 вуючи підходящі похідні арилборонової кислоти у (2Н, m), 1,60-1,63 (2Н, m). синтезі наступних похідних. С: 1-циклопентил-3-йодбензол: 27b: 4-(3-Метансульфоніл-феніл)-6-пропілРозчин натрій нітриту (558мг, 8,1ммоль) у воді піримідин-2-карбонітрил: (10мл) додавали протягом 5 хвилин, щоб охолоди1 ти (5°С) розчин 3-циклопентил-анілін гідрохлориду Н ЯМР (CDCI3) : 8,63 (s, 1H); 8,48 (d, J=8Гц, (1г, 5,1ммоль) у 6N НСІ (25мл). Після 50 хвилин, 1Н); 8,14 (d, J=8Гц, 1Н); 7,80-7,75 (m, 2H); 3,15 (s, розчин калій йодиду (2,02г, 12,2ммоль) у воді 3H); 2,89 (t, J=8Гц, 2Н) ; 1,9-1,8 (m, 2H) ; 1,04 (t, (10мл) додавали протягом 5 хвилин. Суміш гріли J=8Гц; 3H). МС m/z 308 /310 (М+1). протягом 1 години до 70°С. Після охолодження до Приклад 28 кімнатної температури рН доводили 6Η NaOH до 4-(3-Циклопентил-феніл)-6-пропіл-піримідин-211, і суміш тричі екстрагували дихлорметаном карбонітрил: (3x100мл). Поєднані органічні шари промивали A: N,N-дибензил-3-циклопентил-анілін: натрій тіосульфатом (75мл), потім розсолом Розчин бромциклопентану (7,62г, 51,1ммоль) у (75мл) та сушили MgSO4. Розчинник видаляли під сухому ТГФ (25мл) додавали краплями до суспензменшеним тиском для утворення 1,23г неочищезії магнієвої стружки (1,24г, 51ммоль) в етері (3мл) ного матеріалу (рідинна хроматографія високого під таким струмом азоту, щоб була досягнута внутиску, вихід: 67%), який очищали хроматографією трішня температура від 45 до 50°С. (Після додачерез силікагель (елюент: циклогексан), щоб вання кількох крапель розчину суміш нагрівали до отримати раніше зазначену сполуку у формі мас50°С, щоб викликати утворення реагенту Гриньяла: 825мг, вихід: 60%. ра). Через 1,5 години реагент Гриньяра помістили 1 Н ЯМР (CDCI3) : 7,58 (1Н, m), 7,50 (1Н, d, у лійку, розбавляли сухим ТГФ (25мл), та протягом 30 хвилин додавали краплями до холодного (0°С) J=8Гц), 7,19 (1Н, br d), 7,00 (1Н, t, J=8Гц), 2,92 (1H, розчину сухого ZnBr2 (11,5г, 51ммоль) у сухому квінтет), 2,03-2,07 (2Н, m), 1,76-1,82 (2Н, m), 1,65ТГФ (90мл) під азотом. Через 15 хвилин реакційну 1,70 (2Н, m), 1,54-1,57 (2Н, m). суміш охолоджували до -60°С і додавали D: 4-(3-циклопентил-феніл)-6-пропілPdCI2(dppf)2 (249мг, 0,34ммоль) (розчин став черпіримідин-2-карбонітрил: воним). Розчин 3-бром-N,N-дибензил-аніліну (6г, Суміш 1-цикпопентил-3-йодбензолу (158мг, 17ммоль) у сухому ТГФ (50мл) додавали до цього 0,58ммоль), 4-пропіл-6-триметилстананілрозчину протягом 35 хвилин. Потім видаляли баню піримідин-2-карбонітрилу (150мг, 0,48ммоль) та з сухим льодом, і розчину дали нагрітися до кімнаPdCI2(PPh3)2 (34мг, 0,05ммоль) у сухому ДМФ тної температури протягом ночі. Після додавання (3мл) гріли при 80°С протягом 6 годин під азотом. 3Η НСІ (70мл), видаляли ТГФ під зменшеним тисДодавали більше каталізатору (40мг, 0,06ммоль), і ком. Водний залишок тричі екстрагували етилацесуміш гріли протягом 12 годин при 80°С. Розчинтатом (3x70мл). Поєднані органічні шари промиваник видаляли під зменшеним тиском, а залишок ли розсолом (50мл), потім насиченим розчином розподіляли між водою (5мл) та AcOEt (5мл). ВодNaHCO3 (50мл). Нерозчинний матеріал профільтний шар двічі екстрагували етилацетатом (2x5мл). ровували, а розчин знов промивали розсолом Поєднані органічні шари промивали розсолом, (50мл). Органічний шар сушили MgSO4 та конценсушили MgSO4 та концентрували під зменшеним трували під зменшеним тиском для утворення ратиском для утворення 272мг неочищеного продукніше зазначеної сполуки (5,8г) яку застосовували ту реакції, який потім очищали хроматографією на наступному етапі без будь-якого додатково через силікагель (елюент: циклогексан/AcOEt 95/5) очищення. для утворення раніше зазначеної сполуки: 51мг, 1 вихід: 36%, рідинна хроматографія високого тиску: Н ЯМР (CDCI3) : 7,28-7,32 (4Н, m), 7,21-7,25 98%. (6Н, m), 7,08 (1Н, t, J=8Гц), 6,60-6,64 (2Н, m), 6,55 1 Н ЯМР (CDCI3) : 7,99 (1Η, s), 7,87 (1H, dt, (1Н, dd, J1=8Гц, J2=2,4Гц), 4,62 (4Н, s), 2,85 (1Н, квінтет), 1,90-2,00 (2Н, m), 1,65-1,75 (2Н, m), 1,5J1=5Гц, J2=2Гц), 7,69 (1H, s), 7,44 (2H, d, J=5Гц), 1,65 (2Н, m), 1,45-1,5 (2Н, m). 3,10 (1H, квінтет), 2,84 (2Н, t, J=7,6Гц), 2,12-2,15 В: 3-циклопентил-анілін гідрохлорид: (2Н, m), 1,81-1,88 (4Н, m), 1,60-1,76 (4Н, m), 1,02 (3H, t, J=7,2Гц). MC m/z 292 (М+1).
ДивитисяДодаткова інформація
Назва патенту англійською4-phenyl-pyrimidine-2-carbonitrile derivatives
Автори англійськоюCai Jiaqiang, Rankovic Zoran, Moir Jennifer Helen
Назва патенту російськоюПроизводные 4-фенил-пиримидин-2-карбонитрила
Автори російськоюЦай Цзяцян, Ранкович Зоран, Мойр Дженифер Гелен
МПК / Мітки
МПК: A61P 19/10, A61K 31/505, C07D 239/28
Мітки: 4-феніл-піримідин-2-карбонітрилу, похідні
Код посилання
<a href="https://ua.patents.su/32-89633-pokhidni-4-fenil-pirimidin-2-karbonitrilu.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-феніл-піримідин-2-карбонітрилу</a>
Попередній патент: Рослина ячменю з повною втратою активності lox-1 ферменту
Наступний патент: Спосіб вимірювання похибок фазометрів та пристрій для його здійснення
Випадковий патент: Дисковий підгортач